Предпосылки создания изобретения
Данное изобретение относится к составам на основе паклитаксела и аналогов паклитаксела или их конъюгатов, а также других гидрофобных агентов.
Из-за нерастворимости в водном растворе гидрофобные агенты, такие как паклитаксел и аналоги паклитаксела, обычно или солюбилизируются в неводных буферах или в буферах с поверхностно-активными веществами или присоединяются к гидрофильным фрагментам для повышения растворимости в водном растворе до введения пациенту. Паклитаксел выпускается в продажу в виде состава, в котором каждый миллилитр содержит 6 мг паклитаксела, 527 мг очищенного Cremophor®′ a EL (полиоксиэтилированного касторового масла) и 49,7% (об/об) дегидратированного спирта, USP, и этанола. Перед введением состав на основе паклитаксела разбавляют смесью хлорид натрия / декстроза или декстрозой в растворе Рингера. Так как Cremophor® может вызывать гиперчувствительность (например, анафилактические реакции), пациентам, принимающим паклитаксел, предварительно вводят дексаметазон для уменьшения возникновения этих реакций. Из-за этих реакций паклитаксел вводят через 4 ч для того, чтобы свести к минимуму гиперчувствительность пациентов.
Из-за высокой вероятности возникновения побочных эффектов вследствие наличия Cremophor′a в стандартных составах на основе паклитаксела были разработаны альтернативные композиции. Abraxane представляет собой состав на основе паклитаксела, в котором паклитаксел связан с альбумином. Были также предложены липосомальные составы на основе паклитаксела.
Поскольку существующие составы на основе гидрофобных агентов, таких как паклитаксел, или содержат нежелательные эксципиенты, или их трудно изготавливать, существует необходимость в создании новых составов на основе этих агентов.
Сущность изобретения
Согласно первому аспекту данное изобретение относится к композиции, содержащей (a) гидрофобный агент, паклитаксел, аналог паклитаксела или конъюгат (например, ANG 1005), включающий (i) полипептидный вектор; и (ii) терапевтический агент, выбранный из группы, состоящей из паклитаксела и аналога паклитаксела, при этом терапевтический агент сопряжен с полипептидом, или другой гидрофобный агент, описанный в данной заявке; (b) необязательный агент, регулирующий тоничность (например, хлорид натрия или любой агент тоничности, описанный в данной заявке); (c) буферный агент (например, глицин, молочную кислоту или лимонную кислоту, или любой буферный агент, описанный в данной заявке); (d) наполнитель (например, маннит, сорбит или любой наполнитель, описанный в данной заявке); и (e) солюбилизирующий агент (например, полиоксиэтиленовый эфир жирной кислоты, такой как описанный в данной заявке Solutol HS 15, или любой солюбилизирующий агент, описанный в данной заявке), например, когда солюбилизирующим агентом не является Cremophor. Полипептидный вектор может включать аминокислотную последовательность, по существу идентичную (например, по меньшей мере, на 70%, 80%, 90%, 95% или 100% идентичную) аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NOS: 1-105 и 107-116 (например, AngioPep-1 (SEQ ID NO: 67); AngioPep-2 (SEQ ID NO: 97) или AngioPep- (SEQ ID NO: 112)). Согласно некоторым вариантам буферный агент поддерживает раствор при pH менее 6 (например, при pH равном 4-6).
Согласно некоторым вариантам композиция также включает 0,01-10% (например, Менее чем 8%, 6%, 5%, 4%, 3%, 2%, 1%, 0,75%, 0,5%, 0,2% или 0,1%) DMSO. Согласно некоторым вариантам композиция по существу не содержит Cremophor (то есть в ней нет Cremophor). Композиция может быть растворена в воде.
Согласно некоторым вариантам композиция включает агенты в количествах, указанных в любой из Таблиц 1-4.
В этих композициях агент, регулирующий тоничность, если он содержится, может представлять собой хлорид натрия, буферный агент может быть глицином, молочной кислотой или лимонной кислотой и/или наполнитель может быть маннитом. Композиция может содержать примерно 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,1%, 1,2%, 1,3%, 1.4%, 1,5%, 1,6%, 1,7%, 1,8%, 1,9%, 2,0%, 2,1%, 2,2%, 2,3%, 2,4%, 2,5%, 2,6%, 2,7%, 2,8%, 3,0%, 3,2%, 3,5%, 4,0% или 5,0% ANG 1005, или любой интервал между этими величинами. ANG 1005 может быть растворен в достаточном количестве Solutol′a HS 15 и/или DMSO, и этот состав может быть далее растворен в водном растворе.
Описанные выше композиции могут находиться в контейнере, который может быть герметичным. Контейнер может быть частью набора, который включает также инструкции по применению (например, при введении композиции для лечения любой болезни из числа описанных в данной заявке).
Согласно другому аспекту данное изобретение предусматривает способ введения композиции согласно аспектам, описанным выше, пациентам, страдающим от болезни, например, любой болезни, описанной в данной заявке, такой как рак (например, рак яичника, мозга, легкого, печени, селезенки или почки).
Способ включает введение пациенту композиции в количестве, которое достаточно для лечения или профилактики болезни.
Согласно некоторым вариантам рак представляет собой рак мозга, выбранный из группы, состоящей из глиобластомы, астроцитомы, глиомы, медулобластомы и олигодендромы, нейроглиомы, эпендимомы и менингиомы.
Согласно другому аспекту данное изобретение предусматривает способ приготовления фармацевтической композиции. Этот способ включает (а) растворение гидрофобного агента в первом солюбилизирующем агенте (например, DMSO или любом таком агенте, описанном в данной заявке) с образованием смеси; (б) добавление второго солюбилизирующего агента (например, полиоксиэтиленового эфира жирной кислоты, такого как Solutol HS 15, или любого солюбилизирующего агента, описанного в данной заявке) к смеси со стадии (а); (в) возможное добавление воды и буферного агента к этой смеси; (г) лиофилизацию смеси со стадии (в); при этом лиофилизация приводит к уменьшению по меньшей мере на 5% (например, на 10%, 20%, 30%, 50%, 75%, 90%, 95% или 99%) количества первого солюбилизируюшего агента (например, до конечного содержания менее, чем 0,2%, 0,4%, 0,6%, 0,8%, 1,0%, 1,5%, 2%, 3%, 4%, 5%, 8% от общего веса лиофилизированного продукта).
Согласно некоторым вариантам лиофилизация недостаточно снижает количество второго солюбилизирующего агента.
Согласно некоторым вариантам гидрофобный агент включает паклитаксел или аналог паклитаксела. Гидрофобный агент может включать или может представлять собой конъюгат, включающий (а) полипептидный вектор и (б) агент, описанный в данной заявке (например, паклитаксел и его аналоги), при этом этот агент сопряжен с вектором.
Полипептидный вектор может включать аминокислотную последовательность, по существу идентичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NOS: 1-105 и 107-116 (например, AngioPep-1 (SEQ ID NO: 67); AngioPep-2 (SEQ ID NO: 97) или AngioPep-7 (SEQ ID NO: 112)). Согласно конкретным вариантам конъюгат представляет собой ANG 1005. Согласно некоторым вариантам вода и буферный агент добавляются на стадии (в) и стадия (г) лиофилизации включает (i) замораживание смеси; (ii) сушку замороженного продукта при первой температуре и давлении, достаточных для удаления части (например, по меньшей мере 50%, 60%, 70%, 80%, 90%, 95%, 99%, 99,5%, 99,9% или 99,99%) воды; и (iii) сушку продукта при второй температуре и давлении, достаточных для удаления по меньшей мере части (например, 10%, 20%, 30%, 50%, 75%, 90%, 95% или 99%) первого растворителя.
Смесь со стадии (б) можно отфильтровать перед осуществлением стадии лиофилизации (в) или она может быть помещена в сосуд или контейнер перед осуществлением стадии лиофилизации (в). Способ может также включать ресуспендирование лиофилизированного продукта со стадии (в).
Согласно другому аспекту данное изобретение предусматривает способ получения фармацевтической композиции, включающий стадии: (а) растворения в DMSO конъюгата, включающего паклитаксел или аналог паклитаксела, сопряженного с полипептидным вектором, с образованием при этом смеси; (б) добавления к этой смеси Solutol′a HS 15; (в) добавления к смеси воды, буферного агента и необязательно соли или наполнителя; и (г) лиофилизации смеси при условиях, которые приводят к удалению воды и DMSO из смеси. Solutol HS 15 может быть смешан с водой, буферным агентом и, возможно, с агентом, регулирующим тоничность, или наполнителем до добавления к смеси, при этом вода, буферный агент и, возможно, агент, регулирующий тоничность, добавляются в количестве, которое поддерживает растворимость конъюгата в смеси. Буферный агент может поддерживать рН раствора равным величине, находящейся между 4 и 6. DMSO может быть подкислен до рН между 3,5 и 4,5 до проведения стадии растворения (а). Согласно некоторым вариантам лиофилизация не приводит к существенному снижению количества Solutol′a HS 15 в смеси. Конъюгат может включать любой из полипептидов (например, AngioPep-2), описанный в данной заявке. Согласно конкретным вариантам конъюгат политаксел - полипептид представляет собой ANG 1005.
Согласно другому аспекту настоящее изобретение охватывает фармацевтическую композицию, полученную любым из методов, описанных в данной заявке.
Под "буферным агентом" подразумевают любое соединение или группу соединений, способных поддерживать величину рН (например, любую величину из 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0, 10,5, 11,0, 11,5, 12,0, 12,5, 13,0 и 13,5) раствора в конкретном интервале после добавления агентов, которые могут изменять величину рН. Примеры буферных агентов описаны в данной заявке.
Под "агентом, регулирующим тоничность" подразумевают любой агент, который меняет осмолярность водного раствора (например, до любой величины в любом интервале между 10, 20, 50, 75, 100, 150, 200, 250, 300, 400, 500, 750, 1000, 1500 или 2000 мМ). Дополнительные агенты, регулирующие тоничность, описаны в данной заявке.
Под "наполнителем" подразумевают соединение, которое изменяет физическую форму химической композиции после дегидратации или стадии лиофилизации. Примеры наполнителей также описаны в данной заявке.
Под "солюбилизирующим агентом" подразумевают любой растворитель, способный растворять конкретное соединение (например, гидрофобное соединение, такое как соединение или конъюгат, содержащие паклитаксел или аналог паклитаксела). Примеры таких солюбилизирующих агентов также описаны в данной заявке.
Под "вектором" подразумевают соединение или молекулу, такую как полипептид, которые могут быть транспортированы в клетку конкретного типа (например, в печени, легких, почке, селезенке или мышце) или через ВВВ. Вектор может быть присоединен к агенту (ковалентно или нет) или сопряжен с агентом и, следовательно, может быть способен транспортировать этот агент в клетку конкретного типа или через ВВВ. Согласно некоторым вариантам вектор может быть связан с рецепторами, находящимися в раковых клетках или эндотелиальных клетках мозга и, следовательно, могут транспортироваться в раковые клетки или через ВВВ путем трансцитоза. Вектор может представлять собой молекулу, для которой могут быть достигнуты высокие уровни трансэндотелиального транспорта без влияния на целостность клеток или ВВВ. Вектор может быть полипептидом или пептидомиметиком и может быть природного происхождения или может быть получен методом химического синтеза, или при помощи рекомбинантной генетической технологии.
Под "конъюгатом" подразумевают вектор, связанный с агентом. Сопряжение может быть по природе химическим, например, с применением линкера, или может быть по природе генетическим, например, с использованием рекомбинантной генетической технологии, например, в белке слияния с, например, молекулой репортера (например, зеленого флуоресцентного белка, β-галактозидазы, Histag и т.д.).
Под вектором или конъюгатом, который "эффективно транспортирован в клетку конкретного типа" подразумевают вектор или конъюгат, который способен аккумулироваться (или благодаря увеличенному транспорту в клетку, уменьшенному выходу из клетки или их комбинации) в клетке такого типа по меньшей мере на 10% (например, на 25%, 50%, 100%, 200%, 500%, 1000%, 5000% или 10000%) больше, чем или в контрольном веществе, или, в случае конъюгата, по сравнению с несопряженным агентом.
Под "по существу чистым" или "выделенным" подразумевают соединение (например, полипептид или конъюгат), которое было отделено от других химических компонентов. Обычно соединение считается по существу чистым, когда оно, по меньшей мере на 30% по весу свободно от других компонентов. Согласно некоторым вариантам препарат по меньшей мере на 50%, 60%, 75%, 85%, 90%, 95%, 96%, 97%, 98% или 99% по весу свободен от других компонентов. Очищенный полипептид может быть получен, например, путем экспрессии рекомбинантного полипептида, кодирующего такой полипептид, или путем химического синтеза полипептида. Степень чистоты можно измерить соответствующим методом, например, методом хроматографии на колонке, методом электрофореза на полиакриламидном геле или методом HPLC.
Фармацевтическая композиция, которая "по существу свободна" от вещества является композицией, в которой количество вещества меньше, чем 5%, 4%, 3%, 2%, 1%, 0,5%, 0,3%, 0,2%, 0,1%, 0,05% или 0,01% от веса сухой композиции.
Под "по существу идентичным" подразумевают полипептид или нуклеиновую кислоту, характеризующуюся, по меньшей мере, 35%, 40%, 50%, 55%, 60%, 65%, 70%, 75%, 85%, 90%, 95% или даже 99% идентичности по отношению к последовательности аминокислоты или нуклеиновой кислоты. Для полипептидов длина последовательностей сравнения обычно составляет, по меньшей мере, 4 (например, по меньшей мере, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 50 или 100) аминокислот. Для нуклеиновых кислот длина последовательностей сравнения обычно составляет, по меньшей мере, 60 нуклеотидов, предпочтительно, по меньшей мере, 90 нуклеотидов и более предпочтительно 120 нуклеотидов или полную длину. Следует иметь в виду, что между аминокислотами аналогов, которые идентичны или сходны с аминокислотами первоначального полипетида, могут быть гэпы. Гэпы могут не содержать аминокислот, могут включать одну или более аминокислот, которые не являются идентичными или сходными с первоначальным полипептидом. Биологически активные аналоги векторов (полипептидов) по изобретению также охвачены данным изобретением. Процентное содержание идентичности может быть определено, например, при помощи n алгоритмов GAP, BESTFIT или FASTA в Wisconsin Genetics Software Package Release 7.0, с применением весов гэпов по умолчанию.
Под "фрагментом" подразумевают полипептид, происходящий из части первоначальной или родительской последовательности или из аналога указанной или родительской последовательности. Фрагменты охватывают полипептиды, содержащие усеченные части одной или более аминокислот, причем усечение может происходить из аминоконца (N-конца), карбоксильного конца (С-конца) или из внутренней части белка. Фрагмент может включать ту же самую последовательность, что и соответствующая часть первоначальной последовательности. Функциональные фрагменты вектора (полипептида), описанные в данном описании, также охватываются данным изобретением. Фрагменты могут представлять собой по меньшей мере 5 (например, по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 25, 28, 30, 35, 40, 45, 50, 60, 75, 100 или 150) аминокислот. Согласно изобретению фрагменты могут включать, например, полипептид из 7, 8, 9 или 10 аминокислот. Фрагменты могут содержать любую из модификаций, описанных в данном описании, (например, замещенные аминокислоты, полученные ацетилированием, амидированием).
Под "аминокислотой неприродного происхождения" подразумевают аминокислоту, которая не получена в природе или обнаружена у млекопитающего.
Под "агентом" подразумевают соединение, например, антитело или терапевтический агент, маркер, трейсер или соединение, дающее возможность получить изображение.
Под "терапевтическим агентом" подразумевают агент, обладающий биологической активностью. В некоторых случаях терапевтический агент применяют для лечения симптомов болезни, физического или умственного состояния, травмы, инфекции, он включает противораковые агенты, антибиотики, антиангиогенные агенты и молекулы, которые проявляют активность в отношении центральной нервной системы.
Под "лекарством с малой молекулой" подразумевают лекарство, имеющее молекулярный вес равный 1000 г/мол или менее (например, менее, чем 800, 600, 500, 400 или 200 г/мол).
Под "субъектом" подразумевают человека или животное (например, млекопитающее).
Под "лечением" болезни, расстройства или состояния у субъекта подразумевают уменьшение, по меньшей мере, одного симптома болезни, расстройства или состояния при введении терапевтического агента этому субъекту.
Под "профилактическим лечением" болезни, расстройства или состояния у субъекта подразумевают уменьшение частоты возникновения (например, предотвращение) болезни, расстройства или состояния при введении терапевтического агента этому субъекту.
Под "раковым заболеванием" подразумевают любую пролиферацию клеток, уникальной особенностью которой является потеря нормального контроля, которая может привести к нерегулируемому росту, отсутствию дифференциации или способности поражать ткани и метастазировать. Рак может развиться в любой ткани или любом органе. Раковые болезни включают, без ограничения, рак мозга, печени, легких, почки или селезенки. Другие виды рака также описаны в данной заявке.
Под "введением" подразумевают способ доставки, включающий, без ограничения, оральное, внутриартериальное, интраназальное, интраперитонеальное, внутривенное, внутримышечное, подкожное, трансдермальное введение или per os (пероральное). Дневная доза может быть разделена на одну, две или более доз в подходящей форме, которая вводится один, два или более раз в течение определенного периода.
Под "терапевтически эффективным" или "эффективным количеством" подразумевают количество терапевтического агента, достаточное для улучшения, уменьшения, профилактики, задержки, подавления или остановки любого симптома болезни или состояния, которое подвергается лечению. Терапевтически эффективное количество этого агента необязательно излечивает болезнь или состояние, но будет обеспечивать лечение болезни или состояния таким образом, что у пациента вспышка болезни или состояния задерживается, затрудняется или предотвращается или симптомы болезни или состояния ослабляются, или срок проявления болезни или состояния изменяется, или, например, они становятся менее серьезными, или выздоровление ускоряется.
Если "интервал" или "группа веществ" упоминаются по отношению к конкретной характеристике (например, температуре, концентрации, времени и т.п.), данное изобретение относится и явно подразумевает каждый и специфический член и комбинацию подгрупп или интервалов. Так, например, в отношении длины от 9 до 18 аминокислот следует понимать, что явно имеется в виду каждая и каждая индивидуальная величина длины, например, длина из 18, 17, 15, 10, 9 аминокислот и любого числа между ними. Следовательно, если не упомянуто иное, каждый интервал, упомянутый в данной заявке, охватывается данным изобретением. Например, в выражении длины от 5 до 19 аминокислот имеются в виду длины, включающие 5 и 19 аминокислот. Это так же применяется по отношению к другим параметрам, таким как последовательности, длина, концентрации, элементы и т.п.
Последовательности, участки, части, определенные в данной заявке, каждая(-ый) включает каждую и каждую индивидуальную последовательность, каждый участок и каждую часть, описанные при этом, а также каждую и каждую возможную подпоследовательность, подчасть и каждый подучасток, независимо от того, определены ли такие подпоследовательность, подчасть и каждый подучасток как положительно включающие конкретные возможности, как исключающие конкретные возможности или их комбинации. Например, исключительным определением участка может быть следующее: "при условии, что указанный полипептид не короче, чем 4, 5, 6, 7, 8 или 9 аминокислот". Другим примером отрицательного ограничения является следующий: последовательность, включающая SEQ ID NO: X с исключением полипептида SEQ ID NO: H; и т.д. Дополнительный пример отрицательного ограничения представляет собой следующее: при условии, что указанный полипепетид не является (не включает или не состоит из) SEQ ID NO: Z.
Другие примеры и преимущества данного изобретения будут очевидными из следующих подробного описания, рисунков и формулы изобретения.
Краткое описание рисунков
На Фигуре 1 представлено схематическое описание примера способа приготовления фармацевтической композиции, включающей ANG 1005.
На Фигуре 2 приведен график, показывающий профили HPLC для воссозданного ANG 1005 для инъекции, разбавленного в D5W до 1,0 мг/мл, в условиях клинического применения в зависимости от времени.
На Фигуре 3 приведен график, показывающий профили HPLC для центрифугированного осадка, собранного для образца с концентрацией 2,0 мг/мл при хранении в течение примерно 6 ч, и солюбилизированного в DMSO.
Подробное описание изобретения
Авторы разработали фармацевтические композиции, пригодные для гидрофобных терапевтических агентов, включая паклитаксел и аналоги паклитаксела или их конъюгаты (например, ANG 1005) и способы приготовления и введения фармацевтических композиций с указанным составом. Гидрофобные терапевтические агенты (например, паклитаксел) часто солюбилизируются (и в действительности это часто требуется) в гидрофобных растворителях. Растворители, обычно применяемые для паклитаксела, включают Cremophor и DMSO, которые могут плохо переноситься пациентами. В частности, Cremophor может вызывать анафилактические реакции, что требует предварительной обработки агентами, такими как кортикостероиды. Для того, чтобы избежать применения таких плохо переносимых растворителей, мы разработали новые составы, содержащие, например, конъюгат полипетид - паклитаксел, ANG 1005. Составы, описанные в данной заявке, обладают тем преимуществом, что они могут быть приготовлены без применения Cremophor′a, могут быть получены с содержанием минимальных концентраций DMSO, приводят к низкой степени разложения и обеспечивают высокую активность активного агента и могут быть изготовлены стандартными методами. Композиции, которые не содержат плохо переносимых растворителей, можно вводить пациентам в высоких дозах, их можно вводить более быстро (например, в случае внутривенного введения), их можно вводить более часто или можно избежать необходимости предварительной обработки агентами (например, кортикостероидами) для того, чтобы увеличить переносимость таких эксципиентов.
Разработка состава для ANG 1005
При разработке нового состава для гидрофобного агента ANG 1005 авторы вначале определяли его растворимость в различных растворителях и комбинациях растворителей. Как показано в Примере 1 и как в случае паклитаксела, ANG 1005 имеет низкую растворимость в водных растворах, но очень хорошо растворяется в DMSO (120 мг/мл). ANG 1005 также растворяется в Solutol HS 15 (BASF, Parsippany, N.J.) с этанолом при температуре 75°C (6 мг/мл). Из-за его низкой токсичности и совместимости с лекарством Solutol HS 15 был выбран в качестве солюбилизирующего агента. Однако растворение в Solutol HS 15 само по себе привело к значительному разложению ANG 1005. Для растворения ANG 1005 Solutol HS 15 нагревали до, по меньшей мере, 65°C. Кроме того, мы заметили, что нагревание не буферированного Solutol′а от 25°С до 50°C приводило к повышению его pH от 6,0 до 9,0. Таким образом, комбинация высокой температуры и высокого pH, по всей видимости, приводит к наблюдаемой нестабильности ANG 1005 в этих условиях.
Для того, чтобы избежать избыточного разложения, ANG 1005 вначале растворяли в подкисленном DMSO (pH 3,5-4,0) перед добавлением при 50°C Solutol′a (см пример 2). Для дополнительной стабилизации ANG 1005 мы подкисляли Solutol HS 15 путем предварительного смешения с глициновым буфером при pH равном 5,0, что позволило поддерживать растворимость ANG 1005. Этот прием позволяет свести к минимуму разложение ANG 1005. Можно добавлять до 20% (например, 1%, 5%, 10% или 15%) буфера к Solutol перед добавлением ANG 1005, что не влияет на растворимость ANG 1005, в то время, как добавление большего количества буфера с Solutol приводит к неполной солюбилизации.
Для обеспечения стабильности ANG 1005 состав разбавляли в водном растворе при pH равном 5,0 (добавление буфера, глицина), так как авторы заметили, что ANG 1005 становится гораздо более нестабильным при pH равном 6,0 и выше. Применяли и другие буферы в этом интервале pH, включая ацетат и фосфат, но они были менее совместимы с составом. Мы также пытались стабилизировать ANG 1005 путем уменьшения конечного значения pH до 4,0, но полученный лиофилизированный осадок не воссоздается до прозрачного раствора.
Пример состава на основе ANG 1005 приведен в Таблице 5 ниже.
Были также добавлены наполнители для облегчения воссоздания лиофилизированного продукта. Оценивали составы, содержащие и маннит, и сорбит. Маннит приводил к получению осадка с превосходными свойствами.
Лиофилизация
Так как препарат, содержащий DMSO/Solutol/буфер, включал нежелательно высокие количества DMSO и не был стабильным в достаточной степени, был разработан протокол лиофилизации для снижения количества DMSO и для повышения стабильности ANG 1005. Проводили серию альтернативных циклов лиофилизации для уменьшения содержания DMSO (то есть повышение температуры и увеличение времени повторной сушки; см. Пример 3). Условия лиофилизации описаны подробно ниже. Проводили первый протокол лиофилизации и эта процедура привела к концентрации DMSO, превышающей 1%. Подробности этой процедуры приведены в Таблице 6.
Авторы смогли снизить концентрацию DMSO еще больше, до величины менее 1%, путем применения оптимизированного двухстадийного способа сушки. Вкратце, после стадии замораживания продукта проводили лиофилизацию при температуре хранения и в течение времени достаточного для удаления большей части воды из продукта. Температуру хранения затем повышали и продукт сушили при температуре, пригодной для удаления DMSO. Точные условия будут зависеть от объема образца, который подвергается сушке, величины давления и применяемой температуры, а также используемых состава и буферов. На основании процедуры, описанной в данной заявке специалист в данной области способен определить соответствующие условия для получения композиций, описанных в данном описании. Согласно одной из процедур состав загружают при температуре между -70°C и +25°C (например, при -40°C). Температуру меняли до величин, достаточных для замораживания раствора (любая температура между 0°C и -70°C) и эту температуру выдерживали в течение времени, достаточного для замораживания продукта и, предпочтительно, в течение времени, достаточного для того, чтобы обеспечить получение неразрушающегося осадка. Мы определили, что при -40°C требовалось время замораживания, равное, по меньшей мере, 12 ч (например, по меньшей мере, 15, 18, 20, 24, 36 или 48 ч) для обеспечения получения осадка, который не разрушался. После замораживания создавали вакуум (например, 10-500 мТ, в том числе 20, 50, 100, 200 или 500 мТ) и устанавливали температуру (например, от -15°C до -35°C, в том числе -25°C), достаточную для удаления воды из продукта во время первого цикла. Были испытаны величины давления от 10 до 100 мТ, полученные при этом результаты варьировались незначительно. Время сушки должно быть достаточным (например, равным 6 ч, 12 ч, 1 дню, 2 дням, 4 дням, 6 дням, 8 дням, 10 дням или 14 дням) для удаления значительной части (например, по меньшей мере, 50%, 60%, 70%, 80%, 90%, 95%, 98%. 99%, 99,5%, 99,9%) воды, содержащейся в продукте. После проведения первой стадии сушки проводили вторую стадию сушки для удаления DMSO. Температуру линейно изменяли до более высокой, между 10-30°С, (например, равной 18, 19, 20, 21, 22, 23, 24, 25, 26 или 27°C) для удаления DMSO. Согласно предпочтительному варианту температуру хранения поддерживали равной 27°C в течение 2 ч, затем равной 27°C в течение 1 ч. Затем температуру хранения устанавливали (или поддерживали) равной между 23 и 27°C в течение 30 мин и затем продукт выдерживали при этой температуре в течение, по меньшей мере, еще 10 ч (например, по меньшей мере, в течение 15, 20, 25, 30, 40, 48, 60 или 72 ч). Для того, чтобы предотвратить плавление остаточного DMSO, продукт можно хранить при температуре менее 25°C. Примерный протокол этой процедуры показан в Таблице 7. Лиофилизацию осуществляли с применением сушилки Hull Freezer Dryer, Model 72 FS 100- SS20c.
Воссоздание продукта
Перед инъекцией пациенту или перед проведением лабораторного анализа продукт может быть воссоздан. Для воссоздания могут быть использованы любой буфер, растворители или комбинация буфера(-ов) и растворителя(-ей); вид буфера не является критическим. Однако часто является желательным, чтобы активный агент был достаточно стабильным в растворе и чтобы применяемые буфер(-ы) и растворитель(-и) в растворах хорошо переносились пациентами при их введении. В случае ANG 1005, поскольку продукт является менее стабильным при pH выше 6,0, обычно желательно применять систему для воссоздания растворитель/буфер, которая позволяет поддерживать величину pH ниже 6,0.
Для ANG 1005 одной из предпочтительных систем растворителей является система, представляющая собой комбинацию этанола и смеси лактатированный раствор Рингера/ 5% декстрозы. В случае этой системы этанол добавляют в сосуд, содержащий продукт, осторожно перемешивают и затем для растворения продукта добавляют смесь лактатированный раствор Рингера/ 5% декстрозы. Применение обычной воды для инъекции (WFI) или физиологического раствора в качестве растворителей привело к высоким значениям pH, что вызывало разложение продукта ANG 1005. После растворения смесь может быть далее разбавлена водой или другими буферными системами. Примерные условия для воссоздания лиофилизированного продукта описаны далее в Примере 4.
Композиции лекарственного средства
Как описано выше, мы разработали композиции на основе гидрофобного агента, ANG 1005, пригодные для введения пациентам. Перед лиофилизацией согласно некоторым вариантам состав содержит значительное количество DMSO. Такие композиции могут содержать следующие компоненты (например, в расчете на сухой вес), которые приведены в Таблицах 8А и 8В. В Таблице 8С приведены примерные концентрации различных компонентов в водном растворе перед лиофилизацией.
До лиофилизации композицию обычно разбавляют водой (см. ниже условия лиофилизации). Для большинства клинических назначений раствор делится на соответствующие количества для введения единичной дозы ANG 1005 (например, примерно 10, 20, 30, 60, 90, 120, 150, 200, 240, 300, 400 или 500 мг). После лиофилизации (например, при условиях, описанных в данной заявке) концентрация DMSO может быть значительно снижена. После лиофилизации состав на основе ANG 1005 по изобретению может иметь следующие показатели (например, в расчете на сухой вес), которые приведены в Таблице 9.
Гидрофобные агенты
В композициях и в способах согласно данному изобретению могут быть использованы любые гидрофобные агенты. Примеры этих соединений описаны ниже.
Паклитаксел и родственные соединения
Хотя в данной заявке в качестве примера применяли ANG 1005, конъюгат AngioPep-паклитаксел, описанные здесь составы могут содержать паклитаксел, аналоги паклитаксела или его конъюгаты. Паклитаксел имеет следующую формулу:
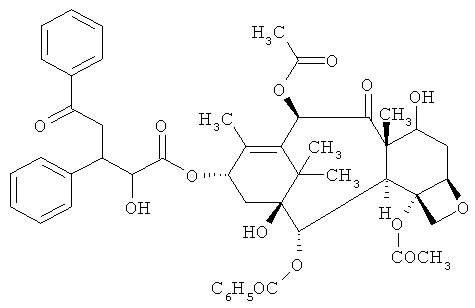
Структурные аналоги паклитаксела описаны в патенте США №6911549 и могут быть описаны формулой:
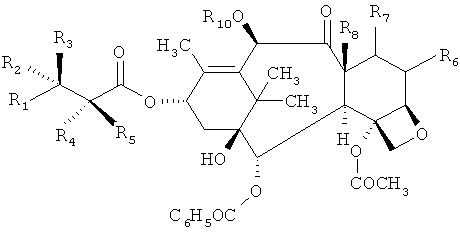
где R1 выбран из группы, состоящей из CH3, C6H5 или фенила, замещенного одним, двумя или тремя C1-C4алкилами, C1-C3алкокси, галоидами, C1-C3алкилтио, трифторметилами, C2-C6, диалкиламино, гидроксилами или нитрогруппами; и 2-фурила, 2-тиенила, 1-нафтила, 2-нафтила или 3,4-метилендиоксифенила; R2 выбран из группы, состоящей из H, NHC(O)H, NHC(O)C1-C10 алкила (предпочтительно, NHC(O)C4-C6алкила), -NHC(O)фенила, -NHC(O)фенила, замещенного 1, 2 или 3 C1-C4алкилами, C1-C3-алкокси, галоидами, C1-C3алкилтио, трифторметилами, C2-C6диалкиламино, гидрокси или нитрогруппами, -NHC(O)C(CH3)=CHCH3, -NHC(O)OC(CH3)3, -NHC(O)OCH2-фенилами, -NH2, -NHSO2-4-метилфенилами, -NHC(O)(CH2)3COOH, -NHC(O)-4-(SO3H) фенилами, -OH, -NHC(O)-1-адамантилами, -NHC(O)O-3-тетрагидрофуранилами, -NHC(O)O-4-тетрагидропиранилами, -NHC(O)СН2С(СН3)3, -NHC(O)С(СН3)3, -NHC(O)OC1-C10 алкилами, -NHC(O)NHC1-C10алкилами, -NHC(O)NHPh, -NHC(O)NHPh, замещенного 1, 2 или 3 C1-C4алкилами, C1-C3алкокси, галоидами, C1-C3алкилтио, трифторметилами, C2-C6диалкиламино или нитрогруппами, -NHC(O)C3-C8циклоалкилами, -NHC(O)C(CH2CH3)2CH3, -NHC(O)C(CH3)2CH2Cl, -NHC(O)С(СН3)2СН2СН3, фталимидо, -NHC(O)-1-фенил-1-циклопентилами, -NHC(O)-1-метил-1-циклогексилами, -NHC(S)NHC(СН3)3, -NHC(O)NHCC(СН3)3 или -NHC(O)NHPh; R3 выбран из группы, состоящей из -H, -NHC(O) фенила или -NHC(O)OC(CH3)3 при обязательном условии, что один из R2 and R3 обозначает -H, но R2 и R3 оба не являются -H; R4 обозначает -H или выбран из группы, состоящей из -OH, -OAc(-OC(O)CH3), -OC(O)OCH2C(Cl)3, -OCOCH2CH2NH3 +HCOO-, -NHC(O)фенила, -NHC(O)OC(CH3)3, -OCOCH2CH2COOH и их фармацевтически приемлемых солей, -OCO(CH2)3COOH и его фармацевтически приемлемых солей, и -OC(O)-Z-C(O)-R′ [где Z обозначает этилен (-CH2CH2-), пропилен (-CH2CH2CH2-), -CH=CH-, 1,2-циклогексан или 1,2-фенилен, R′ обозначает -OH, -OH основания, -NR′2R′3, -OR′3, SR′3, -OCH2C(O)NR′4R′5, где R′2 обозначает -H или -CH3, R′3 обозначает -(CH2)nNR′6R′7 или (CH2)nN+R′6R′7R′8X-, где n равен 1-3, R′4 обозначает -H или -C1-C4алкил, R′5 обозначает -H. -C1-C4алкил, бензил, гидроксиэтил, -CH2CO2H или диметиламиноэтил, R′6 и R′7 обозначают -CH3, -CH2CH3, бензил или R′6 и R′7 вместе с атомом азота группы NR′6R′7 образуют пирролидино, пиперидино, морфолино или N-метилпиперазино; R′8 обозначает -CH3, -CH2CH3 или бензил, X- обозначает галоид, и основани представляет собой NH3, (HOC2H4)3N, N(CH3)3, CH3N(C2H4)2NH, NH2(CH2)6NH2, N-метилглюкамин, NaOH или KOH], -OC(O)(CH2)nNR2R3 [где n равен 1-3, R2 обозначает -H или -C1-C3алкил и R3 обозначает -H или -C1-C3алкил], -OC(O)CH(R″)NH2 [где R″ выбран из группы, состоящей из -H, -CH3, -CH2CH(CH3)2, -CH(CH3)CH2CH3, -CH(CH3)2, -CH2фенила, -(CH2)4NH2, -CH2CH2COOH, -(CH2)3NHC(=NH)NH2], остатка аминокислоты пролина, -OC(O)CH=CH2, -C(O)CH2CH2C(O)NHCH2CH2SO3 -Y+, -OC(O)CH2CH2C(O)NHCH2CH2CH2SO3 -Y+, где Y+ обозначает Na+ или N+(Bu)4, -OC(O)CH2CH2C(O)OCH2CH2OH; R5 обозначает -H или -OH, при условии, что, когда R5 является -OH, R4 обозначает -H и еще при условии, что, когда R5 является -H, R4 не обозначает -H; R6 обозначает -H:-H, когда R7 обозначает α-R71:β-R72, где один из R71 и R72 обозначает -H и другой из R71 and R72 обозначает -X, где X обозначает галоид, и R8 обозначает -CH3; R6 обозначает -H:-H, когда R7 обозначает α-H:β-R74, где R74 and R8, взятые вместе, образуют циклопропильное кольцо; R10 is -H or -C(O)CH3; и их фармацевтически приемлемые соли, когда соединение содержит или кислотную, или основную функциональную группу.
Конкретные аналоги паклитаксела включают ((азидофенил)уреидо)таксоид, (2α,5α,7β,9α,10β,13α)-5,10,13,20-тетраацетокситакс-11-ен-2,7,9-триол, (2α,5α,9α,10β)-2,9,10-триацетокси-5-((β-D-глюкопиранозил)окси)-3,11-циклотакс-11-ен-13-он, 1β-гидроксибаккатин I, 1,7-дигидрокситаксанин, 1-ацет-5,7,10-деацетил-баккатин I, 1-дегидроксибаккатин VI, 1-гидрокси-2-деацетокси-5-дециннамоил-таксинин, 1-гидрокси-7,9-дидеацетилбаккатин I, 1-гидроксибаккатин I, 10-ацетил-4-деацетилтаксотер, 10-деацетоксипаклитаксел, 10-еацетилбаккатина III диметилсульфоксида дисольват, 10-деацетил-10-(3-аминобензоил) паклитаксел, 10-деацетил-10-(7-(диэтиламино)кумарин-3-карбонил)паклитаксел, 10-деацетил-9-дигидротаксол, 10-деацетилбаккатин III, 10-деацетилпаклитаксел, 10-деацетилтаксинин, 10-деацетилтаксол, 10-дезокси-10-C-морфолиноэтилдоцетаксел, 10-O-ацетил-2-O-(циклогексилкарбонил)-2-дебензоилтаксотер, 10-O-втор.-аминоэтилдоцетаксел, 11-десметиллауоималеимид, 13-дезоксо-13-ацетилокси-7,9-диацетил-1,2-дидеокситаксин, 13-дезоксибаккатин III, 14-гидрокси-10-деацетил-2-O-дебензоилбаккатин III, 14-гидрокси-10-деацетилбаккатин III, 14β-бензоилокси-13-деацетилбаккатин IV, 14β-бензоилокси-2-деацетилбаккатин VI, 14β-бензоилоксибаккатин IV, 19-гидроксибаккатин III, 2′,2″-метилендоцетаксел, 2′,2″-метиленпаклитаксел, 2′-(валил-лейцил-лизил-PABC)паклитаксел, 2′-ацетилтаксол, 2′-O-ацетил-7-O-(N-(4′-флуоресцеинкарбонил)-аланил)таксол, 2,10,13-триацетокси-такса-4(20), 11-диен-5,7,9-триол, 2,20-O-диацетилтаксумайрол N, 2-(4-азидобензоил)таксол, 2-деацетокситаксинин J, 2-дебензоил-2-м-метоксибензоил-7-триэтилсилил-13-оксо-14-гидроксибаккатин III 1,14-карбонат, 2-O-(циклогексилкарбонил)-2-дебензоилбаккатин III 13-O-(N-(циклогексилкарбонил)-3-циклогексилизосеринат), 2α,7β,9α,10β,13α-пентаацетоксилтакса-4(20), 11-диен-5-ол, 2α,5α,7β,9α,13α-пентагидрокси-10β-ацетокситакса-4(20),11-диен, 2α,7β,9α,10β,13-пентаацетокси-11β-гидрокси-5α-(3′-N,N-диметиламино-3′-фенил)-пропионилокситакса-4(20), 12-диен, 2α,7β-диацетокси-5α,10β,13β-тригидрокси-2(3-20)абеотакса-4(20), 11-диен-9-он, 2α,9α-дигидрокси-10β,13α-диацетокси-5α-(3′-метиламино-3′-фенил)-пропионилокситакса-4(20), 11-диен, 2α-гидрокси-7β,9α,10β,13α-тетраацетокси-5α-(2′-гидрокси-3′-N,N-диметиламино-3′-фенил)-пропионилокситакса-4(20), 11-диен, 3′-(4-азидобензамидо)таксол, 3′-N-(4-бензоилдигидроциннамоил)-3′-N-дебензоилпклитаксел, 3′-N-м-аминобензамидо-3′-дебензамидопаклитаксел, 3′-п-гидроксипаклитаксел, 3,11-циклотаксинин NN-2,4-деацетилтаксол, 5,13-диацетокси-такса-4(20), 11-диен-9,10-диол, 5-O-бензоилированный таксикинин K, 5-O-фенилпропионилокситаксинин A, 5α,13α-диацетокси-10β-циннамоилокси-4(20), 11-таксадиен-9α-ол, 6,3′-п-дигидроксипаклитаксел, 6-α-гидрокси-7-дезокси-10-деацетилбаккатин-III, 6-фтор-10-ацетилдоцетаксел, 6-гидрокситаксол, 7,13-диацетокси-5-циннамилокси-2(3-20)-абео-такса-4(20), 11-диен-2,10-диол, 7,9-дидеацетилбаккатин VI, 7-(5′-биотиниламидопропаноил)паклитаксел, 7-ацетилтаксол, 7-дезокси-10-деацетилбаккатин-III, 7-дезокси-9-дигидропаклитаксел, 7-эпипаклитаксел, 7-метилтиометилпаклитаксел, 7-O-(4-бензоилдигидроциннамоил)-паклитаксел, 7-O-(N-(4′-флуоресцеинкарбонил)аланил)таксол, 7-ксилозил-10-деацетилтаксол, 8,9-един.-эпоксибревифолин, 9-дигидробаккатин III, 9-дигидротаксол, 9α-гидрокси-2α,10β,13α-триацетокси-5α-(3′-N,N-диметиламино-3′-фенил)-пропионилокситакса-4(20), 11-диен, баккатин III, баккатин III 13-O-(N-бензоил-3-циклогексилизосеринат), BAY59, бензоилтаксол, BMS 181339, BMS 185660, BMS 188797, бревифолиол, бутитаксел, цефаломаннин, дантаксусин A, дантаксусин B, дантаксусин C, дантаксусин D, дибром-10-деацетилцефаломаннин, DJ927, доцетаксел, Flutax 2, глутарилпаклитаксел 6-аминогексанола глюкуронид, IDN 5109, IDN 5111, IDN 5127, IDN 5390, изолаулималид, лаумалид, MST 997, N-(паклитаксел-2′-O-(2-амино)-фенилпропионат)-O-(β-глюкуронил)карбамат, N-(паклитаксел-2′-O-3,3-диметил-бутаноат)-O-(β-глюкуронил)карбамат, N-дебензоил-N-(3-(диметиламино)бензоил)паклитаксел, нонатаксел, паклитаксел, сопряженный с паклитакселом, паклитаксел, паклитаксел-трансферрин, PNU 166945, паклитаксел, сопряженный с поли(этиленгликолем), паклитаксел-2′-глицинат, полиглутаминовая кислота-паклитаксел, протакс, протаксел, RPR 109881A, SB T - 101187, SB T - 1102, SB T - 1213, SB T - 1214, SB T - 1250, SB T - 12843, тасуматрол E, тасуматрол F, тасуматрол G, такса-4(20), 11(12)-диен-5-ил-ацетат, такса-4(20), 11(12)-диен-5-ол, таксан, таксхинин N, такскультин, таксезопидин M, таксезопидин N, таксин, таксинин, таксинин A, таксинин M, таксинин NN-1, таксинин NN-7, таксол C-7 - ксилозу, конъюгат таксол - сиалил, таксумайрол A, таксумайрол B, таксумайрол G, таксумайрол H, таксумайрол I, таксумайрол K, таксумайрол M, таксумайрол N, таксумайрол O, таксумайрол U, таксумайрол V, таксумайрол W, таксумайрол-X, таксумайрол-Y, таксумайрол-Z, таксусин, таксуспинанан A, таксуспинанан B, таксуспин C, таксуспин D, таксуспин F, таксуюннанин C, таксуюннанин S, таксуюннанин T, таксуюннанин U, таксуюннанин V, tRA-96023 и валлифолиол. Другие аналоги паклитаксела включают 1-дезоксипаклитаксел, 10-деацетокси-7-дезоксипаклитаксел, 10-O-деацетилпаклитаксела 10-моносукциниловый эфир, 10-сукцинилпаклитаксел, 12b-ацетилокси-2a,3,4,4a,5,6,9,10,11,12,12a,12b-додекагидро-4,11-дигидрокси-12-(2,5-диметоксибензилокси)-4а,8,13,13-тетраметил-5-оксо-7,11-метано-1H-циклодека(3,4)бенз(1,2-b)оксет-9-ил 3-(трет.бутил-оксикарбонил) амино-2-гидрокси-5-метил-4-гексаноат, 130-нм альбумин-связанный паклитаксел, 2′-паклитаксела метил-2-глюкопиранозилсукцинат, 3′-(4-азидофенил)-3′-дефенилпаклитаксел, 4-фторпаклитаксел, 6,6,8-триметил-4,4а,5,6,7,7а,8,9-октагидроциклопента(4,5)циклогепта(1,2-c)-фуран-4,8-диола 4-(N-ацетил-3-фенилизосеринат), 6,6,8-триметил-4,4а,5,6,7,7а,8,9-октагидроциклопента-(4,5)циклогепта(1,2-c)-фуран-4,8-диола 4-(N-трет.бутоксикарбонил-3-фенилизосеринат), 7-(3-метил-3-нитрозотиобутирил)паклитаксел, 7-дезоксипаклитаксел, 7-сукцинилпаклитаксел, A-Z - CINN 310, AI-850, альбумин-связанный паклитаксел, AZ 10992, изотаксел, MAC321, MBT-0206, NK105, паклиэкс, паклитаксел полиглумекс, конъюгат паклитаксел -EC-1, полилактофат и d TXD 258. Другие аналоги паклитаксела описаны в патентах США №№4814470, 4857653, 4942184, 4924011, 4924012, 4960790, 5015744, 5157049, 5059699, 5136060, 4876399 и 5227400.
Другие гидрофобные агенты
Другие гидрофобные агенты включают анальгетики и противовоспалительные агенты (например, алоксипирин, ауронафин, азапропазон, бенорилат, дифлунизал, этодолак, фенбуфен, кальциевую соль фенопрофена, флурбипрофен, ибупрофен, индометацин, кетопрофен, меклофенамовую кислоту, мефенамовую кислоту, набуметон, напроксен, оксифенбутазон, фенилбутазон, пироксикам, сулиндак), антигельминтики (например, албендазол, бефения гидроксинафтоат, камбендазол, дихлорофен, ивермектин, мебендазол, оксамниквин, оксфендазол, оксантела эмбонат, празиквантель, пирантела эмбонат, тиабендазол), антиаритмические агенты (например, амиодарона гидрохлорид, дисопиромид, флекаинида ацетат, хинидина сульфат), антибактериальные агенты (например, бенетамин, пенициллин, циноксацин, ципрофлоксацина гидрохлорид, кларитромицин, клофазимин, клоксациллин, демеклоциклин, доксициклин, эритромицин, этионамид, имипенем, налидиксовая кислота, нитрофурантоин, рифампицин, спирамицин, сульфабензамид, сульфадоксин, сульфамеразин, сульфацетамид, сульфадиазин, сульфафуразол, сульфаметоксазол, сульфапиридин, тетрациклин, триметоприм), антикоагулянты (например, дикумарол, дипиридамол, никумалон, фениндион), антидепрессанты (например, амоксапин, мапротилина гидрохлорид, миансерина гидрохлорид, нортриптилина гидрохлорид, тразодона гидрохлорид, тримипрамина малеат), антидиабетические агенты (например, ацетогексамид, хлорпропамид, глибенкламид, гликлазид, глипизид, толазамид, толбутамид), противоэпилептические агенты (например, бекламид, карбамазепин, клоназепам, этотоин, метоин, метсуксимид, метилфенобарбитон, окскарбазепин, параметадион, фенацемид, фенобарбитон, фенитоин, фенсуксимид, примидон, сультиам, вальпроевая кислота), противогрибковые агенты (например, амфотерицин, бутоконазола нитрат, клотримазол, эконазола нитрат, флуконазол, флуцитозин, гризеофульвин, итраконазол, кетоконазол, миконазол, натамицин, нистатин, сульконазола нитрат, тербинафена гидрохлорид, терконазол, тиоконазол, ундеценовая кислота), агенты против подагры (например, аллопуринол, пробенецид, сульфинпиразон), гипотензивные средства (например, амлодипин, бенидипин, дародипин, дилтиазема гидрохлорид, диазоксид, фелодипин, гуанобензацетат, исрадипин, миноксидил, никардипина гидрохлорид, нифедипин, нимодипин, феноксибензамина гидрохлорид, призозина гидрохлорид, резерпин, теразозина гидрохлорид), противомалярийные средства (например, амодиаквин, хлороквин, хлорпрогуанила гидрохлорид, галофантрина гидрохлорид, мефлоквина гидрохлорид, прогуанила гидрохлорид, пириметамин, хининсульфат), средства против мигрени (например, дигидроэрготамина мезилат, эрготамина тартрат, метилсергида малеат, пизотифена малеат, суматриптана сукцинат), антимускариновые агенты (например, атропин, бензгексола гидрохлорид, бипериден, этопропазина гидрохлорид, гиосциамин, мепензолата бромид, оксифенилцимина гидрохлорид, тропикамид), антинеопластические агенты и иммунодепрессанты (например, аминоглютемид, амсакрин, азатиоприн, бусульфан, хлорамбуцил, циклоспорин, дакарбазин, эстрамустин, этопозид, ломустин, мелфалан, меркаптопурин, метотрексат, митомицин, митотан, митозантрон, прокарбазина гидрохлорид, тамоксифена цитрат, тестолактон), антипротозойные агенты (например, бензнидазол, клиохинол, декохинат, дийодогидроксихинолин, дилоксанида фуроат, динитолмид, фурзолидон, метронидазол, ниморазол, нитрофуразон, орнидазол, тинидазол), антитиреоидные агенты (например, карбимазол, пропилтиоурацил), анксиолитики, седативные средства, гипнотические средства и нейролептики (например, алпразолам, амилобарбитон, барбитон, бентазепам, бромазепам, бромперидол, бротизолам, бутобарбитон, карбромал, хлордиазэпоксид, хлорметиазол, хлорпромазин, клобазам, клотиазепам, клозапин, диазепам, дроперидол, этинамат, флунанизон, флунитразепам, флуопромазин, флупентиксола деканоат, флуфеназина деканоат, флуразепам, галоперидол, лоразепам, лорметазепам, медазепам, мепробамат, метаквалон, мидазолам, нитразепам, оксазепам, пентобарбитон, перфеназина пимозид, прохлорперазин, сульпирид, темазепам, тиоридазин, триазолам, зопиклон), β-блокаторы (например, ацебутолол, алпренолол, атенолол, лабеталол, метопролол, надолол, окспренолол, пиндолол, пропранолол), сердечные инотропные агенты (например, амоинон, дигитоксин, дигоксин, эноксимон, ланатозид C, медигоксин), кортикостероиды (например, беклометазон, бетаметазон, будесонид, кортизонацетат, дезоксиметазон, дексаметазон, флудрокортизона ацетат, флунизолид, флукортолон, флутиказона пропионат, гидрокортизон, метилпреднизолон, преднизолон, преднизон, триамцинолон), диуретики : ацетазоламид, амилорид, бендрофлуазид, буметанид, хлортиазид, хлорталидон, этакриновая кислота, фрусемид, метолазон, спиронолактон, триамтерин), средства от паркинсонизма (например, бромокриптина мезилат, лизурида малеат), желудочно-кишечные средства (например, бисакодил, циметидин, цисаприд, дифеноксилата гидрохлорид, домперидон, фамотидин, лоперамид, мезалазин, низатидин, омепразол, ондансетрона гидрохлорид, ранитидина гидрохлорид, сульфалазин), гистамин Н, - рецептора антагонисты (например, акривастин, астемизол, циннаризин, циклизин, ципрогептадина гидрохлорид, дименгидринат, флунаризина гидрохлорид, лоратадин, меклозина гидрохлорид, оксатомид, терфенадин), агенты, регулирующие содержание липидов (например, безафибрат, клофибрат, фенофибоат, гемфиброзил, пробукол), нитраты и другие средства против ангины (например, амилнитрат, глицерилтринитрат, динитрат изосорбида, мононитрат изосорбида, пентаэритрита тетранитрат), опиоидные анальгетики (например, кодеин, декстропропиоксифен, диаморфин, дигидрокодеин, мептазинол, метадон, морфин, налбуфин, пентазоцин), половые гормоны (например, кломифена цитрат, даназол, этинилэстрадиол, медроксипрогестерона ацетат, местранол, метилтестостерон, норэтистерон, норгестрел, эстрадиол, сопряженные эстрогены, прогестерон, станозолол, стибестрол, тестостерон, тиболон) и стимулянты (например, амфетамин, дексамфетамин, дексфенфлурамин, фенфлурамин, мазиндол).
Конъюгаты полипептидов
В составе, описанном в данной заявке, могут быть использованы конъюгаты, включающие активный агент полипептид. Как описано в опубликованных патентных заявках США №№2006/0182684 и 2006/0189515, а также в предварительной заявке США на патент №61/008,880, поданной 20 декабря 2007 г., авторы разработали получение конъюгатов. Такие конъюгаты могут включать любой полипептид, описанный в данной заявке, гидрофобный агент, такой как паклитаксел или аналог паклитаксела (например, описанные в данной заявке) и линкер (например, такой, как описанные в данной заявке). Примером конъюгатов паклитаксела является ANG 1005, который включает пептид AngioPep-2 (SEQ ID NO: 97), сопряженный с тремя молекулами паклитаксела при помощи сложноэфирных связей на N-конце, лизинов в положениях 10 и 15. Структура ANG 1005 представлена ниже:
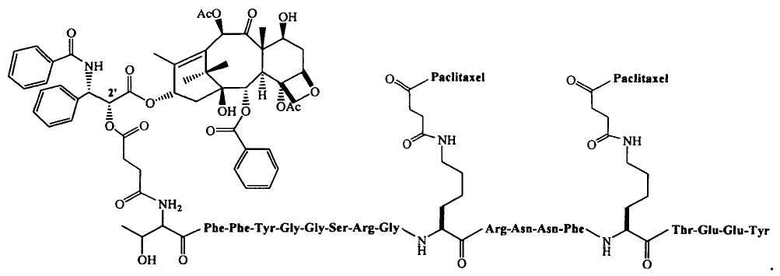
Согласно некоторым вариантам конъюгаты могут пересекать гемато-энцефалический барьер (ВВВ) или предпочтительно могут быть нацелены на клетки определенного типа, такие как клетки печени, легкого, почки, мышцы, или могут быть нацелены на клетки опухолей (или клетки любого типа, описанные в данной заявке). Такие агенты, сопряженные с указанными пептидами, могут характеризоваться повышенным поглощением клетками, на которые они нацелены, например, в случае опосредованного рецепторами эндоцитоза (например, рецептором LRP). Сопряженные агенты могут, или альтернативно, или в дополнение, проявлять повышенную стабильность или в меньшей степени удаляться из клетки (например, вследствие опосредствованного Р-гликопротеином оттока).
Полипептиды
Композиции и способы, описанные в данной заявке, могут включать любой полипептид по изобретению, например, полипептиды, указанные в Таблице 10 (например, полипептид, определенный в любой из последовательностей SEQ ID NOS: 1-105 и 107-112, такой как SEQ ID NOS: 1-97, 99, 100, 101 или 107-112), или его любой фрагмент, аналог, производное или вариант. Согласно некоторым вариантам такой полипептид может иметь по меньшей мере 35%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или даже 100%-ную идентичность полипептиду, описанному в данной заявке. Полипептид может содержать одно или более (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15) замещений по отношению к одной из последовательностей, указанных в данной заявке. Другие модификации описаны более подробно ниже.
Данное изобретение охватывает также фрагменты таких полипептидов (например, функциональный фрагмент). По некоторым вариантам фрагменты способны проникать или накапливаться в клетках определенного типа (например, в клетках печени, легкого, почки, селезенки или мышцы) или способны пересекать ВВВ. Усечениями полипептида могут быть 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более аминокислот или на N-конце полипептида, C-конце полипептида, или их комбинации. Другие фрагменты включают последовательности, в которых удалены внутренние участки полипептида.
Дополнительные полипептиды могут быть идентифицированы при помощи одного из методов анализа или методов, описанных в опубликованной заявке США на патент №2006/0189515, которая включена в данную заявку в качестве ссылки, или любого метода, известного из уровня техники. Например, вектор - кандидат может быть получен обычным методом синтеза полипептида, сопряженного с таксолом, и введен животному в лабораторных условиях. Биологически активный вектор может быть идентифицирован по его активности увеличивать выживаемость животного, которому введены методом инъекции опухолевые клетки и проведена обработка конъюгатом, по сравнению с контрольным животным, для которого не проводили обработку конъюгатом (например, его обрабатывали несопряженным агентом).
В другом примере биологически активный полипептид может быть идентифицирован по его положению в паренхиме при проведении in situ анализа церебральной перфузии. Для идентификации таких векторов могут быть применены in vitro методы анализа ВВВ, такие как модель, разработанная CELLIAL™ Technologies.
Можно также проводить анализы для определения накопления в других тканях. Меченые конъюгаты полипептида могут быть введены животному и затем измеряют его накопление в других органах. Например, полипептид, сопряженный с диагностической меткой (например, флуоресцентной меткой в области близкой к ИК, такой как Су5.5) позволяет осуществить in vivo визуализацию. Такой полипептид может быть введен животному и осуществлено обнаружение наличия полипептида в этом органе, что позволяет определить скорость и накопление в желательном органе. Согласно другим вариантам полипептид может быть мечен радиоактивным изотопом (например, 125I). Затем полипептид вводят животному. Через некоторое время животное умерщвляют и извлекают его органы. После этого можно измерить количество радиоизотопа в каждом органе с применением любых средств, известных из уровня техники. Путем сравнения количества меченого полипептида - кандидата в конкретном органе без знания количества меченого контрольного образца может быть установлена способность полипептида - кандидата обеспечивать скорость или количество накопленного полипептида - кандидата в конкретной ткани. Соответствующие отрицательные контрольные агенты включают любой полипептид, который, как известно, не транспортируется в клетки конкретного типа.
Пептид №5 включает последовательность SEQ ID NO: 5 и амидирован на C-конце (см., например, Фигуру 1).
Пептиде №67 включает последовательность SEQ ID NO: 67 и амидирован на C-конце (см., например, Фигуру 1).
Пептид №76 включает последовательность SEQ ID NO: 76 и амидирован на C-конце (см., например. Фигуру 1).
Пептид №91 включает последовательность SEQ ID NO: 91 и амидирован на C-конце (см., например, Фигуру 1).
Пептид №107 включает последовательность SEQ ID NO: 97 и ацетилирован на N-конце.
Пептид №109 включает последовательность SEQ ID NO: 109 и ацетилирован на N-конце.
Пептид №110 включает последовательность SEQ ID NO: 110 и ацетилирован на N-конце.
Аминогруппы Angiopep-1 (SEQ ID NO: 67) и Angiopep-2 (SEQ ID NO: 97) были использованы для сопряжения агентов. Для изучения роли аминогрупп в процессе сопряжения и их влияния на способность этих векторов к транспорту были созданы новые векторы, основанные на последовательности Angiopep-1 и Angiopep-2 с варьирующимися реакционноспособными группами и переменным общим зарядом. Эти полипептиды приведены в Таблице 11.
Модифицированные полипептиды
Композиции и способы по изобретению могут также предусматривать применение полипептида, содержащего модификацию аминокислотной последовательности, описанной в данной заявке (например, это полипептид, содержащий последовательность, описанную в любой из SEQ ID NOS: 1-105 и 107-116, такую как AngioPep-3, -4a, -4b, -5, -6 или -7). Согласно некоторым вариантам модификация не нарушает значительно описанную биологическую активность. Согласно некоторым вариантам модификация может уменьшать биологическую активность (например, по меньшей мере на 5%, 10%, 20%, 25%, 35%, 50%, 60%, 70%, 75%, 80%, 90% или 95%). Согласно другим вариантам модификация не оказывает влияния на биологическую активность или может повышать (например, по меньшей мере на 5%, 10%, 25%, 50%, 100%, 200%, 500% или 1000%) биологическую активность первоначального полипептида. Модифицированный полипептид может иметь или может оптимизировать одну или более характеристиик полипептида по изобретению, которые в некоторых случаях могут быть нужны или желательны. Такие характеристики включают in vivo стабильность, биодоступность, токсичность, иммунологическую активность или иммунологическую идентичность.
Полипептиды, применяемые по изобретению, могут включать аминокислоты или последовательности, модифицированные или в результате естественных процессов, таких как посттрансляционная обработка, или путем химической модификации, методы которой известны из уровня техники.
Модификации могут проводиться в любом месте полипептида, включая основную цепь полипептида, боковые цепи аминокислот и карбоксиконец, и аминоконец. Модификация того же типа в одной и той же и в разной степени может быть в нескольких местах данного полипептида, кроме того полипептид может содержать более одного типа модификаций. Полипептиды могут быть разветвленными в результате убиквитинирования, они могут быть циклическими с разветвлениями и без них. Циклические, разветвленные и разветвленные циклические полипептиды могут образовываться в результате естественных посттрансляционных процессов или могут получаться синтетическим методом. Другие методы модификации включают пэгилирование, ацетилирование, ацилирование, добавление ацетамидометильной (Аст) группы, ADP-рибозилирование, алкилирование, рибозилирование, алкилирование, амидирование, биотинилирование, карбамоилирование, карбоксиэтилирование, этерифицирование, ковалентное присоединение к флавину, ковалентное присоединение к фрагменту гема, ковалентное присоединение нуклеотида или производного нуклеотида, ковалентное присоединение лекарства, ковалентное присоединение маркера (например, флуоресцентного или радиоактивного), ковалентное присоединение липида или производного липида, ковалентное присоединение фосфатидилинозитола, сшивку, циклизацию, образование дисульфидной связи, деметилирование, образование ковалентных сшивок, образование цистина, образование пироглутамата, формилирование, гамма - карбоксилирование, гликозилирование, образование якоря GPI, гидроксилирование, иодирование, метилирование, миристоилирование, окисление, протеолитическую обработку, фосфорилирование, пренилирование, рацемизацию, селеноилирование, сульфирование, опосредованное передачей РНА присоединение аминокислот к белкам, такое как аргинилирование и убиквитинирование.
Модифицированный полипептид может включать вставку аминокислоты, делецию или замещение, или консервативное, или неконсервативное (например, D-аминокислот, десаминокислот) в полипептидной последовательности (например, когда такие изменения не изменяют в значительной степени биологическую активность полипептида).
Замещения могут быть консервативными (то есть, когда остаток замещается другим остатком того же общего типа или той же группы) или неконсервативным (то есть, когда остаток замещается аминокислотой другого типа). Кроме того, аминокислота неприродного происхождения может быть заменена аминокислотой природного происхождения (то есть, консервативное замещение неприродной аминокислоты или неконсервативное замещение неприродной аминокислоты).
Полипептиды, полученные методом синтеза, могут включать замещения аминокислот, кодированных ДНК неприродным образом (например, аминокислота неприродного происхождения или неприродная аминокислота). Примеры аминокислот неприродного происхождения включают D-аминокислоты, аминокислоту, содержащую ацетиламинометильную группу, присоединенную к атому серы цистеина, пэгилированную аминокислоту, омега-аминокислоты формулы NH2(CH2)nCOOH, где n равен 2-6, нейтральные неполярные аминокислоты, такие как саркозин, трет.-бутилаланин, трет.-бутилглицин, N-метилизолейцин и норлейцин. Фенилглицин может заменять Trp, Tyr или Phe; цитруллин и метионинсульфоксид являются нейтральными неполярными аминокислотами, цистеиновая кислота является кислой, а орнитин является основной кислотой. Пролин может быть заменен гидроксипролином и сохраняет конформационные свойства.
Аналоги могут быть получены методом субституционного мутагенеза и сохраняют биологическую активность исходного полипептида. Примеры замещений, называемых "консервативными замещениями", показаны в Таблице 12. Если такие замещения приводят к нежелательному изменению, тогда проводятся замещения другого типа, называемые "примерными замещениями" в Таблице 12, или описанные далее в отношении классов аминокислот, и полученные продукты подвергают скринингу.
Существенные модификации функции или иммунологической идентичности осуществляют путем выбора вида замещений, которые отличаются значительно по своему действию на поддержание (а) структуры основной цепи полипептида в области замещения, например, в виде складчатой или геликоидальной конформации, (б) заряда или гидрофобности молекулы в целевом сайте или (в) объема боковой цепи. Остатки природного происхождения делятся на группы, основанные на общих свойствах боковой цепи:
(1) гидрофобные: норлейцин, метионин (Met), аланин (Ala), валин (Val), лейцин (Leu), изолейцин (Ile), гистидин (His), триптофан (Trp), тирозин (Tyr), фенилаланин (Phe),
(2) нейтральные гидрофильные: цистеин (Cys), серии (Ser), треонин (Thr),
(3) кислые / отрицательно заряженные: аспартовая кислота (Asp), глутаминовая кислота (Glu),
(4) основные: аспарагин (Asn), глутамин (Gln), гистидин (His), лизин (Lys), аргинин (Arg),
(5) остатки, которые влияют на ориентацию цепей: глицин (Gly), пролин (Pro);
(6) ароматические: триптофан (Trp), тирозин (Tyr), фенилаланин (Phe), гистидин (His),
(7) полярные: Ser, Thr, Asn, Gln,
(8) основные положительно заряженные: Arg, Lys, His и
(9) заряженные: Asp, Glu, Arg, Lys, His.
Другие консервативные замещения аминокислот перечислены в Таблице 3.
Дополнительные аналоги
Полипептиды и конъюгаты, применяемые по изобретению, могут включать полипептидные аналоги апротинина, известные из уровня техники. Например, в патенте США №5807980 описан ингибитор трипсина из бычьей поджелудочной железы или ингибиторы, производные апротинина, а также способ их получения и терапевтическое применение, включая полипептид с SEQ ID NO: 102. Эти полипептиды были использованы для лечения состояния, характеризующегося аномальными появлением или количеством тканевого фактора и/или фактора VIIIa, такого как аномальный тромбоз. В патенте США №5780265 описаны ингибиторы серинпротеазы, способные ингибировать калликреин в плазме, включая SEQ ID NO: 103. В патенте США №5118668 описаны варианты ингибитора трипсина из бычьей поджелудочной железы, включая SEQ ID NO: 105. Последовательность аминокислоты апротинина (SEQ ID NO: 98), последовательность аминокислоты Angiopep-1 (SEQ ID NO: 67) и SEQ ID NO: 104, а также некоторые последовательности биологически активных аналогов можно найти в международной заявке № WO 2004/060403.
Ниже приведен пример нуклеотидной последовательности, кодирующей аналог апротинина в SEQ ID NO: 106 - (atgagaccag atttctgcct cgagccgccg tacactgggc cctgcaaagc tcgtatcatc cgttacttct acaatgcaaa ggcaggcctg tgtcagacct tcgtatacgg cggctgcaga gctaagcgta acaacttcaa atccgcggaa gactgcatgc gtacttgcgg tggtgcttag; номер доступа в Генбанке № X04666). Эта последовательность кодирует лизин в положении 16 вместо валина, как обнаружено в SEQ ID NO: 98. Мутацию в нуклеотидную последовательность SEQ ID NO: 106 можно ввести методами, известными из уровня техники для изменения образования полипептида SEQ ID NO: 98, содержащего валин в положении 16. Дополнительные мутации или фрагменты могут быть получены с применением методов, известных из уровня техники.
Другие примеры аналогов апротинина могут быть найдены с применением белка BLAST (Генбанк: www.ncbi.nlm.nih.gov/BLAST/) и с использованием последовательности синтетического апротинина (или ее части), описанных в международной заявке № PCT/CA 2004/000011. Примеры аналогов апротинина могут быть найдены под номерами доступа №№ CAA37967 (GI: 58005) и 1405218С (GI: 3604747).
Получение производных полипептидов и пептидомиметиков
Помимо полипептидов, состоящих только из аминокислот природного происхождения, согласно данному изобретению можно также использовать пептидомиметики или аналоги полипептидов. Аналоги полипептидов обычно применяют в фармацевтической промышленности как непептидные лекарства со свойствами, аналогичными свойствам темплатного полипептида. Не полипептидные соединения называют "полипептидными миметиками" или пептидомиметиками (Fauchere et al., Infect. Immun. 54: 283-287, 1986; Evans et al., J. Med. Chem. 30: 1229-1239, 1987). Полипептидные миметики, которые структурно связаны с терапевтически применяемыми полипептидами, могут быть использованы для получения эквивалентного или улучшенного терапевтического или профилактического эффекта. Обычно пептидомиметики структурно подобны модельному полипептиду (а именно, полипептиду, который обладает биологической или фармакологической активностью), такому как рецептор - связывающие полипептиды природного происхождения, но содержат одну или более пептидных связей, возможно замещенных такими связями, как -CH2NH-, -CH2S-, -CH2-CH2-, -CH=CH- (цис- и транс-), -CH2SO-, -CH(OH)CH2-, -COCH2- и т.д. при помощи методов, хорошо известных из уровня техники (Spatola, Peptide Backbone Modifications, Vega Data, 1(3): 267, 1983); Spatola et al. (Life Sci. 38: 1243-1249, 1986); Hudson et al. (Int. J. Pept. Res. 14: 177-185, 1979); и Weinstein. В., 1983, Chemistry and Biochemistry of Amino Acids, Peptides and Proteins, Weinstein eds, Marcel Dekker, New-York). Такие полипептидные миметики могут иметь значительные преимущества по сравнению с полипептидами природного происхождения, включая более экономичные способы их получения, более высокую химическую стабильность, улучшенные фармакологические свойства (например, полупериод существования, абсорбцию, активность, эффективность), сниженную антигенность и другие свойства.
В то время, как полипептиды, применяемые по изобретению, могут быть эффективными при попадании в клетки конкретного типа (например, те, которые описаны в данной заявке), их эффективность может уменьшаться в присутствии протеаз. Сывороточные протеазы имеют специфические требования к субстрату. Субстрат должен содержать и L-аминокислоты, и пептидные связи для расщепления. Кроме того, экзопептидазы, которые представляют наиболее важный компонент активности протеазы в сыворотке, обычно действуют на первую пептидную связь и требуют наличия свободного N-конца (Powell et al., Pharm. Res. 10: 1268-1273, 1993). В свете этого часто лучше применять модифицированные версии полипептидов. Модифицированные полипептиды сохраняют структурные характеристики исходных полипептидов с L-аминокислотами, которые придают биологическую активность в отношении IGF-1, но имеют то преимущество, что не легко восприимчивы к расщеплению протеазой и/или экзопептидазами.
Систематическая замена одной или более аминокислот консенсусной последовательности D-аминокислотой того же типа (например, D-лизин вместо L-лизина) может быть использована для получения более стабильных полипептидов. Таким образом, производное полипептида или пептидомиметик, применяемые по изобретению, могут быть все L-, все D- или смешанными D, L-полипептидами. Наличие N-конца или C-конца в D-аминокислоте повышает in vivo стабильность полипептида, так как пептидазы не могут использовать D-аминокислоту в качестве субстрата (Powell et al., Pharm. Res. 10: 1268-1273, 1993). Обратные D-полипептиды представляют собой полипептиды, содержащие D-аминокислоты, расположенные в обратной последовательности по отношению к полипептиду, содержащему L-аминокислоты. Таким образом, C-концевой остаток L аминокислотного полипептида становится N-концом для D-аминокислотного полипептида и т.д. Обратные D-полипептиды сохраняют ту же самую третичную конформацию и, следовательно, ту же самую активность, что и полипептиды с L-аминокислотами, но более стабильны к ферментному расщеплению in vitro и in vivo и поэтому имеют большую терапевтическую эффективность, чем исходный полипептид (Brady and Dodson, Nature 368: 692-693, 1994; Jameson et al., Nature 368: 744-746, 1994). В добавление к обратным D-полипептидам могут быть получены принужденные полипептиды, включающие консенсусную последовательность или вариацию практически идентичной консенсусной последовательности при помощи методов, хорошо известных из уровня техники (Rizo and Gierasch, Ann. Rev. Biochem. 61: 387-418, 1992). Например, принужденные полипептиды могут быть получены путем добавления цистеиновых остатков, способных к образованию дисульфидных мостиков и, следовательно, к получению циклического полипептида. Циклические полипептиды не имеют свободных N-концов или С-концов. Соответственно, они не восприимчивы к протеолизу под действием экзопептидаз, хотя они, конечно, восприимчивы к эндопептидазам, которые не расщепляют пептидов на концах. Аминокислотные последовательности полипептидов с N-концевыми или C-концевыми D-аминокислотами и последовательности циклических полипептидов обычно идентичны последовательностям полипептидов, которым они соответствуют, за исключением наличия N-концевого или С-концевого остатка или их кольцевой структуры, соответственно.
Циклическое производное, содержащее внутримолекулярную дисульфидную связь, может быть получено обычным методом синтеза в твердой фазе при введении подходящих остатков S-защищенного цистеина или гомоцистеина в положения, выбранные для циклизации, такие как аминоконец и карбоксильный конец (Sah et al., J. Pharm. Pharmacol. 48: 197, 1996). Вслед за завершением сборки цепи может быть проведена циклизация или (1) путем селективного удаления S-защищающей группы с последующим окислением на носителе соответствующих двух свободных SH-групп с образованием S-S связей и обычным удалением продукта с носителя и соответствующей очисткой или (2) путем удаления полипептида с носителя вместе с полным снятием защиты и последующим окислением свободных SH-групп в сильно разбавленном водном растворе.
Циклическое производное, содержащее внутримолекулярную дисульфидную связь, может быть получено обычным методом синтеза в твердой фазе при введении подходящих производных аминокислот с защищенными амино- и карбоксильными боковыми цепями в положение, выбранное для циклизации. Циклические производные, содержащие внутримолекулярные - S-алкильные связи, могут быть получены обычным химическим методом в твердой фазе при введении остатка аминокислоты с подходящей боковой цепью с защищенной аминогруппой и подходящего остатка S-защищенного цистеина или гомоцистеина в положение, выбранное для циклизации.
Другой эффективный подход для придания сопротивляемости к действию пептидаз, действующих на N-концевые или C-концевые остатки полипептида, состоит в добавлении химических групп в концевые положения полипептида, таким образом, что модифицированный полипептид не будет больше служить субстратом для пептидазы. Один из видов такой химической модификации заключается в гликозилировании полипептидов на одном или обоих концах. Некоторые виды химической модификации, в частности, N-концевое гликозилирование, как было показано, повышает стабильность полипептидов в сыворотке человека (Powell et al., Pharm. Res. 10: 1268-1273, 1993). Другой вид химической модификации, который повышает стабильность сыворотки, включает, но без ограничения, добавление N-концевой алкильной группы, представляющей собой низший алкил, содержащий от одного до двадцати атомов углерода, такой как ацетильная группа, и/или добавление C-концевой амидной или замещенной амидной группы. В частности, композиции и способы по изобретению могут включать применение модифицированных полипептидов, состоящих из полипептидов, имеющих N-концевую ацетильную группу и/или C-концевую амидную группу.
Данное изобретение охватывает также другие типы полипептидов, содержащие дополнительные химические фрагменты, обычно не являющиеся частью полипептида, при условии, что полученное производное сохраняет желательную функциональную активность полипептида. Примеры таких производных включают (1) N-ацильные производные с концевыми аминогруппами или другими свободными аминогруппами, в которых ацильная группа может быть алканоильной группой (например, ацетильной, гексаноильной, октаноильной), ароильной группой (например, бензоильной) или блокирующей группой, такой как F-moc (флуоренилметильной-O-CO-); (2) сложные эфиры соединений с концевыми карбоксильными группами или другими свободными карбоксильными или гидроксильными группами; (3) амиды с концевыми карбоксильными группами или другими свободными карбоксильными группами, полученными по реакции с аммиаком или с подходящим амином; (4) фосфорилированные производные; (5) производные, сопряженные с антителом или другим биологическим лигандом, и другие типы производных.
Полипептидные последовательности большей длины, которые получаются при добавлении дополнительных остатков аминокислот к полипептидам, применяемым по изобретению, также охвачены данным изобретением. Ожидалось, что такие полипептидные последовательности большей длины будут иметь ту же самую биологическую активность (например, попадать в клетки определенного типа), как и полипептиды, описанные выше. Хотя полипептиды, содержащие значительное количество дополнительных аминокислот, не исключаются, считается, что некоторые длинные полипептиды будут иметь конфигурацию, которая маскирует эффективную последовательность, тем самым предотвращая связывание с мишенью (например, член семейства рецепторов LRP, таких как LRP или LRP2). Эти производные могут действовать как конкурентные антагонисты. Таким образом, хотя данное изобретение охватывает полипептиды или производные полипептидов, описанные в данной заявке, имеющие удлинение, желательно, чтобы это удлинение не разрушало целевую активность полипептида или его производного по отношению к клеткам.
Другие производные, которые могут быть использованы по изобретению, являются двойными полипептидами, состоящими из двух одних и тех же или двух разных полипептидов, описанных в данной заявке, ковалентно связанных один с другим или непосредственно, или через спейсер, такой как короткий отрезок остатков аланина, или через путативный сайт для протеолиза (например, через катепсин, см., например, патент США №5126249 и патент EP №495049). Мультимеры полипептидов, применяемых по изобретению, состоят из полимера молекул, образованного из одних и тех же или разных полипептидов или их производных.
Данное изобретение охватывает также производные полипептидов, которые представляют собой химерные или слитые белки, содержащие полипептид, описанный в данной заявке, или его фрагмент, связанный по его аминоконцу или карбоксильному концу или по обоим концам с аминокислотной последовательностью другого белка. Такой химерный или слитый белок может быть получен путем рекомбинантной экспрессии нуклеиновой кислоты, кодирующей белок. Например, химерный или слитый белок может содержать, по меньшей мере, 6 аминокислот полипептида, используемого согласно данному изобретению, и желательно, если он имеет функциональную активность, эквивалентную или превышающую активность полипептида, используемого по изобретению.
Производные полипептидов, используемые согласно изобретению, могут быть получены путем изменения последовательностей аминокислот путем замещения, присоединения или делеции остатка аминокислоты с образованием функционально эквивалентной молекулы или функционально усиленной или ослабленной молекулы, как это желательно. Производные, применяемые согласно данному изобретению, включают, но без ограничения, такие соединения, которые содержат в качестве основной аминокислотной последовательности всю последовательность аминокислоты полипептидов, описанных в данной заявке (например, любую из SEQ ID NOS: 1-105 и 107-116) или ее часть, включая измененные последовательности, содержащие замещенные функционально эквивалентных остатков аминокислот. Например, один или более остатков аминокислот в последовательности могут быть замещены другой аминокислотой со сходной полярностью, которая действует как функциональный эквивалент, приводя к молчащему изменению. Замещение аминокислотой в последовательности может быть выбрано из других членов класса, к которому относится аминокислота. Например, положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин. Неполярные (гидрофобные) аминокислоты включают лейцин, изолейцин, аланин, фенилаланин, валин, пролин, триптофан и метионин. Незаряженные полярные аминокислоты включают серии, треонин, цистеин, тирозин, аспарагин и глутамин. Отрицательно заряженные (кислые) аминокислоты включают глутаминовую кислоту и аспартовую кислоту. Глицин аминокислоты может быть включен или в семейство незаряженных (нейтральных) полярных аминокислот. Замещения при помощи семейства аминокислот обычно рассматриваются как консервативные замещения.
Анализы для идентификации пептидомиметиков
Как описано выше, непептидильные соединения, полученные для репликации геометрии основной цепи и появления фармакофоров (пептидомиметики) полипептидов, идентифицируемые определенными методами, могут обладать свойствами большей метаболической стабильности, более высокой активности, большей продолжительностью действия и большей биодоступности.
Пептидомиметики, применяемые по данному изобретению, могут быть получены с применением любого из многочисленных подходов в комбинаторных методах библиотек, известных из уровня техники, включая биологические библиотеки; библиотеки с пространственно направленной параллельной твердой фазой или библиотеки с фазой растворения; синтетические методы библиотеки, требующие деконволюции; метод библиотек "одна гранула - одно соединение и синтетические методы библиотек, использующие выбор аффинной хроматографии. Биологический подход библиотек ограничен полипептидными библиотеками. В то время как другие четыре подхода применимы к полипептидным библиотекам, библиотекам непептидных олигомеров или к библиотекам соединений с малыми молекулами (Lam, Anticancer Drug Des. 12: 145, 1997). Примеры методов синтеза молекулярных библиотек можно найти в литературе, например, в DeWitt et al. (Proc. Natl. Acad. Sci. USA 90: 6909, 1993); Erb et al. (Proc. Natl. Acad. Sci. USA 91: 11422, 1994); Zuckermann et al., J. Med. Chem. 37: 2678, 1994); Cho et al. (Science 261: 1303, 1993); Carell et al. (Angew. Chem, Int. Ed. Engl. 33: 2059, 1994 and ibid 2061); и в Gallop et al. (Med. Chem. 37: 1233, 1994). Библиотеки соединений могут быть представлены в растворе (например, Houghten, Biotechniques 13: 412-421, 1992) или на гранулах (Lam, Nature 354: 82-84, 1991), чипах (Fodor, Nature 364: 555-556, 1993), в бактериях или спорах (патент США №5,223,409), плазмидах (Cull et al., Proc. Natl. Acad. Sci. USA 89: 1865-1869, 1992) или в фагах (Scott and Smith, Science 249: 386-390, 1990) или люциферазе и ферментной метке, обнаруживаемой путем определения конверсии соответствующего субстрата в продукт.
После идентификации полипептида, который может быть применен согласно данному изобретению, он может быть выделен и очищен любым стандартным методом, включая, но без ограничения, методы дифференциальной растворимости (например, осаждения), центрифугирования, хроматографии (например, аффинной, ионообменной, с исключением размера и т.п.) или любые стандартные методики, используемые для очистки полипептидов, пептидомиметиков или белков. Функциональные свойства идентифицированного полипептида, представляющего интерес, можно оценить с применением любого функционального анализа, известного из уровня техники. Предпочтительно применять методы анализа оценки функции рецептора в прямом направлении в процессе внутриклеточных сигналов (например, пролиферации клеток).
Например, пептидомиметики, применяемые по данному изобретению, могут быть получены с использованием следующего трехфазного процесса: (1) сканирования полипептидов, применяемых по данному изобретению для идентификации участков вторичной структуры, необходимой для таргетирования клеток конкретного типа, описанных в данной заявке; (2) использование конформационно ограниченных дипептидных суррогатов для очистки геометрии основной цепи и обеспечения органических платформ, соответствующих этим суррогатам; и (3) применение лучших органических платформ для проявления органических фармакофоров в библиотеках кандидатов, сконструированных для имитации желательной активности нативного полипептида. Более подробно эти три фазы представляют собой следующее. Во время фазы 1 ведущие кандидаты полипептидов подвергаются сканированию и их структура усекается для определения требований к их активности. Синтезируется серия полипептидных аналогов исходного полипептида. На фазе 2 изучаются лучшие полипептидные аналоги с применением конформационно ограниченных дипептидных суррогатов. В качестве платформ для изучения геометрии основной цепи лучших кандидатов полипептидов применяют индолизидин-2-он, индолизидин-9-он и хинолизидиноновые аминокислоты (I2aa, I9aa и Qaa, соответственно). Эти и родственные платформы (обзор см. в Halab et al., Biopolymers 55: 101-122, 2000; и в Hanessian et al. Tetrahedron 53: 12789-12854, 1997) могут быть введены на специфических участках полипептида для ориентации фармакофоров в различных направлениях. Биологическая оценка этих аналогов позволяет идентифицировать усовершенствованные ведущие полипептиды, которые имитируют геометрические требования к активности. Во время фазы 3 платформы из наиболее активных ведущих полипептидов применяют для проявления органических суррогатов фармакофоров, ответственных за активность нативного полипептида. Фармакофоры и каркасы комбинируются в параллельном формате синтеза. Дериватизация полипептидов и вышеуказанные фазы могут быть осуществлены другими средствами, известными из уровня техники.
Взаимосвязь структура - функция, определенная в случае полипептидов, производных полипептидов, пептидомиметиков или других малых молекул, используемых по данному изобретению, может быть применена для облагораживания и получения аналогичных молекулярных структур, обладающих сходными или лучшими свойствами. Соответственно, соединения, применяемые по данному изобретению, включают также молекулы, которые обладают структурой, полярностью, характеристикой заряда и свойствами боковой цепи полипептидов, описанных в данной заявке.
Следует указать, что на основании данного описания специалист в данной области может разработать методы анализа полипептидов и пептидомиметиков путем скрининга, которые пригодны для идентификации соединений для таргетирования агента в клетки конкретного типа (например, описанные в данной заявке). Методы анализа могут быть разработаны в форматах скрининга с низкой производительностью, высокой производительностью или сверхвысокой производительностью. Методы анализа согласно данному изобретению включают методики, которые можно автоматизировать.
Конъюгаты
Полипептиды, описанные в данной заявке, или их производные могут быть связаны с агентом. Например, полипептид (например, любой из описанных в данной заявке) может быть присоединен к терапевтическому агенту, диагностическому агенту или к метке. Согласно некоторым вариантам полипептид связан с обнаруживаемой меткой или мечен такой меткой, как радио агент, для диагностики болезни или состояния. Примеры этих агентов включают конъюгат радио- агент-антитело-вектор, когда антитело связывается с антигеном, специфичным для данной болезни или состояния (например, для диагностики или терапии). Другие молекулы для связывания также охватываются данным изобретением. В других случаях полипептид или его производное связаны с терапевтическим агентом для лечения болезни или состояния или могут быть связаны с их смесями или мечены их смесями. Болезнь или состояние можно подвергать лечению путем введения конъюгата вектор-агент пациенту при условиях, которые позволяют транспортировать агент через ВВВ или в клетки конкретного типа. Каждый полипептид может включать по меньшей мере 1, 2, 3, 4, 5, 6 или 7 агентов. Согласно другим вариантам каждый агент содержит по меньшей мере 1, 2, 3, 4, 5, 6, 7, 10, 15, 20 или более присоединенных к нему полипептидов. Конъюгаты по изобретению могут быть способны ускорять аккумулирование (например, благодаря увеличенному поглощению или уменьшенному удалению) агента в клетках конкретного типа или в ткани, например, в печени, легком, почке, селезенке или мышце субъекта.
Агент может высвобождаться из вектора после транспорта в клетки конкретного типа или через ВВВ. Такой агент может высвобождаться, например, в процессе ферментативного расщепления или другого разрушения химической связи между вектором и агентом. Высвободившийся агент затем может действовать в отсутствие вектора.
Терапевтические агенты. Терапевтический агент может быть любым биологически активным агентом. Например, терапевтическим агентом может быть лекарство, медикамент, агент выделяющий излучение, клеточный токсин (например, химиотерапевтический агент), его биологически активный фрагмент или их смесь для лечения болезни (например, для умерщвления раковых клеток) или может быть агент для лечения болезни или состояния у субъекта. Терапевтический агент может быть синтетическим продуктом или продуктом грибкового, бактериального или другого микроорганизма (например, микоплазмы или вируса), животного, такого как рептилия или же продуктом растительного происхождения. Терапевтический агент и/или его биологически активный фрагмент может быть ферментативно активным агентом и/или его фрагментом или может действовать путем ингибирования или блокирования важного и/или существенного клеточного прохода или путем конкурирования с важным и/или существенным клеточным компонентом природного происхождения. Другие терапевтические агенты включают антитела и фрагменты антител.
Противораковые агенты. Любой противораковый агент, известный из уровня техники, может быть частью конъюгата, применяемого по изобретению. Согласно некоторым вариантам агент представляет собой паклитаксел или анналы паклитаксела (например, аналоги, описанные в данной заявке). Раковые заболевания мозга можно лечить конъюгатом, содержащим вектор, который эффективно транспортируется через ВВВ (например, AngioPep-1, AngioPep-2, AngioPep-3, AngioPep-4a, AngioPep-4b, AngioPep-5, или AngioPep-6). Раковое заболевание печени, легкого, почти или селезенки можно подвергать лечению противораковым агентом, сопряженным с вектором, который эффективно транспортируется в клетки соответствующего типа (например, AngioPep-7). Примеры таких агентов включают абареликс, альдеслейкин, алемтузумаб, алитретиноин, аллопуринол, альтретамин, амифостин, анакинру, анастрозол, трехокись мышьяка, аспарагиназу, азацитидин, BCG Live, бевакузимаб, бексаротен, блеомицин, бортезомби, бортезомиб, бусульфан, бусульфон, калустерон, капецитабин, карбоплатин, кармустин, целекоксиб, цетуксимаб, хлорамбуцил, цисплатин, кладрибин, клофарабин, циклофосфамид, цитарабин, дакарбазин, дактиномицин, актиномицин D, далтепарин (например, его натриевую соль), дарбепоэтин альфа, дасатиниб, даунорубицин, дауномицин, децитабин, денилейкин, Денилейкин дифтитокс, дексразоксан, доцетаксел, доксорубицин, дромостанолона пропионат, экулизумаб, эпирубицин (например, в виде гидрохлорида), эпоэпин альфа, эрлотиниб, эстрамустин, этопозид (например, в виде фосфата), эксеместан, фентанил (например, в виде цитрата), филграстин, флоксуридин, флударабин, флуорурацил, 5-FU, фулвестрант, гефитиниб, гемцитабин (например, в виде гидрохлорида), гемтузумаб озогамицин, госерелин (например, в виде ацетата), гистрелин (например, в виде ацетата), гидроксимочевину, ибритумомаб тиуксетан, идарубицин, ифосфамид, иматиниб (например, в виде мезилата), интерферон-альфа-2b, иринотекан, лапатиниба дитозилат, леналидомид, лейтрозол, лейковорин, лейпролид (например, в виде ацетата), левамизол, ломустин, CCNU, меклоретамин (азотистый иприт), лигестрол, мелфалан (L-PAM), меркаптопурин (6-MP), месну, метотрексат, метоксален, митомицин C, митотан, митоксантрон, нандролона фенпропионат, неларабин, нофетумомаб, опрелвекин, оксалиплатин, паклитаксел, палифермин, памидронат, панитумумаб, пегадемас, пегаспаргас, печфилграстим, пэгинтерферон альфа-2b, пеметрексед (например, в виде натриевой соли), пентостатин, пипоброман, пликамицин (митрамицин), порфимер (например, в виде динатриевой соли, прокарбазин, хинакрин, расбуриказ, ритуксимаб, сарграмостим, зорафениб, стрептозоцин, сунитиниб (например, в виде малеата), тальк, тамоксифен, темозоломид, тенипозид (VM-26), тестолактон, талидомид, тиогуанин (6-TG), тиотепу, тиотепу, тиотепу, топотекан (например, в виде геля), торемифен, Тозитумомаб/I - 131 (тозитумомаб), трастузумаб, трастузумаб, третиноин (ATRA), урамустин, валрубицин, винбластин, винкристин, винорелбин, вориностат, золендронат и золендроновую кислоту.
Метки, поддающиеся обнаружению. С целью обнаружения или диагностики конъюгат, применяемый по данному изобретению, может быть меченым. Обнаруживаемые метки, или маркеры, могут быть радиометкой, флуоресцентной меткой, меткой, активной в случае ядерного магнитного резонанса, люминесцентной меткой, хромофорной меткой, изотопом, выделяющим позитроны для сканера PET, хемилюминесцентной меткой или ферментной меткой. Примеры радиодиагностических агентов, выделяющих излучение (детектируемых радиометок) включают индий-111, технеций-99 или йод-131 с низкой дозой. Радионуклиды, излучающие гамма- и бета-частицы, включают 67Cu, 67Ga, 90Y, 111In, 99mTc, и 201Tl). Радионуклиды, выделяющие позитроны, включают 18F, 55Co, 60Cu, 62Cu, 64Cu, 66Ga, 68Ga, 82Rb, и 86Y. Флуоресцентные метки включают Су 5.5, Alexa 488, зеленый флуоресцентный белок (GFP), флуоресцеин и родамин. Хемилюминесцентные метки включают люциферазу и β-галактозидазу. Ферментные метки включают пероксидазу и фосфатазу. Обнаруживаемой меткой может быть также Histag. Например, конъюгаты могут включать фрагмент вектора и фрагмент антитела (антитело или его фрагмент), которые также могут включать метку. В этом случае метка может быть присоединена или к вектору, или к антителу.
Антитела. Антитела могут быть частью конъюгата, применяемого по изобретению. Сопряжение осуществляется с применением любых средств, известных из уровня техники (например, с применением стратегии сопряжения, описанной в данной заявке). Любое диагностическое или терапевтическое антитело может быть сопряжено с одним или более (например, с 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) векторов согласно данному изобретению. Кроме того, фрагменты антител (например, способные к связыванию антигена) также могут быть сопряжены с векторами по изобретению. Фрагменты антител включают участки Fab и Fc, тяжелую цепь и легкую цепь антитела (например, любого антитела, описанного в данной заявке). Примеры антител для применения при диагностике и терапии рака включают АВХ - EGF (панитумумаб), OvaRex (ореговемаб), Theragyn (пемтумомаб - иттрий-90), Therex, биватузумаб, панорекс (Edrecolomab), ReoPro (абсиксимаб), Bexxar (тозитумомаб), MAb, идиотипичный 105AD7, Anti-EpCAM (катумаксомаб), MAb легочного рака (от Cytoclonal), Herceptin (трастузумаб), Rituxan (ритуксимаб), Avastin (бевасизумаб), AMD Fab (ранибизумаб), Е-26 (2 ген. IgE) (омализумаб), Zevalin (ритуксан + иттрий-90) (ибритумомаба тиуксетан), Cetuximab, BEC2 (митумомаб), IMC-1C11, nuC242-DM1, LymphoCide (эпратузумаб), LymphoCide Y-90, CEA-Cide (лабетузумаб), CEA-Cide Y-90, CEA-Scan (Тс-99m-меченый арцитумомаб), LeukoScan (Tc-99m-меченый сулесомаб), LymphoScan (Тс-99m-меченый бектумомаб), AFP-Scan (Тс-99m-меченый), HumaRAD-HN (+ иттрий-90), HumaSPECT (вотумумаб), MDX-101 (CTLA-4), MDX-210 (переэкспрессия her-2), MDX-210/MAK, витаксин, MAb 425, IS-IL-2, Campath (алентузумаб), CD20 стрептавидин, Avidicin, (альбумин + NRLU13), Oncolym (+ иод-131) Cotara (+ иод-131), С215 (+ энтеротоксин стафилококка), MAb рака легкого/почки (от Pharmacia Corp.), наколомаб тафенатокс (С242 энтеротоксин стафилококка), Nuvion (висилизумаб), SMART М195, SMART 1D10, CEAVac, TriGem, TriAb, NovoMAb-G2 радиомеченный, Monopharm C, GlioMAb-H (+ токсин гелонина), Rituxan (ритуксимаб), и ING-1. Дополнительные терапевтические антитела включают 5G1.1 (эклуизумаб), 5G1.1-SC (пекселизумаб), ABX-CBL (гавилимомаб), ABX-IL8, Antegren (натализумаб), Anti-CD11a (эфализумаб), Anti-CD18 (от Genetech), Anti-LFA1, Antova, BTI-322, CDP571, CDP850, Corsevin M, D2E7 (адалимумаб), Humira (адалимумаб), Hu23F2G (ровелизумаб), IC14, IDEC-114, IDEC-131, IDEC-151, IDEC-152, Infliximab (ремикад), LDP-01, LDP-02, MAK-195F (афелимомаб), MDX-33, MDX-CD4, MEDI-507 (сиплизумаб), OKT4A, OKT3 (муромонаб - CD3), и ReoPro (абсиксимаб).
Линкеры для сопряжения
Конъюгат (например, конъюгат полипептид - агент) может быть получен с применением любого реагента сшивания (сопряжения) или протокола, известного из уровня техники, многие из которых являются коммерчески доступными. Такие протоколы и реагенты включают кросс-линкеры, реагирующие с аминными, карбоксильными, сульфгидрильными, карбонильными, карбогидратными и/или фенольными группами. Количества, продолжительность и условия таких протоколов могут меняться с целью оптимизации сопряжения. Сшивающие реагенты содержат по меньшей мере две реакционноспособные группы и обычно делятся на гомофункциональные кросс-линкеры (содержащие идентичные реакционноспособные группы) и гетерофункциональные кросс-линкеры (содержащие неидентичные реакционноспособные группы). Кросс-линкеры по данному изобретению могут быть или гомобифункциональными и/или гетеробифункциональными. Далее, кросс-линкер может внедрять "спейсер" между реакционноспособными фрагментами или два реакционноспособных фрагмента в кросс-линкере могут быть связаны непосредственно. Связи могут включать сложноэфирные связи.
Примеры линкеров включают BS3 [бис-(сульфосукцинимидил)суберат], NHS/EDC (N-гидроксисукцинимид и N-этил-(диметиламинопропил)карбодиимид, Sulfo-EMCS [(N-e-мальимидокапроновой кислоты]гидразид), SATA (N-сукцинимидил-S-ацетилтиоацетат) и гидразид. BS3 представляет собой гомобифункциональный N-гидроксисукцинимидный эфир, который нацелен на доступные первые амины. Схема сопряжения показана на Фигуре 2. NHS/EDC позволяет осуществить сопряжение первичных аминогрупп с карбоксильными группами. Sulfo-EMCS является гетеробифункциональными реакционноспособными группами (малеимидный и NHS-эфир), которые могут реагировать с сульфгидрильными и аминными группами. Сочетание с аминами, использующее сульфо-NHS/EDC-активацию, можно применять для сшивания терапевтических антител с полипептидами по изобретению, как показано на Фигурах 3 и 4. Этот метод является быстрым, простым и воспроизводимым способом сочетания. Полученный конъюгат является стабильным и сохраняет биологическую активность антитела. Более того, он обладает способностью к сильному сопряжению, которая может надежно контролироваться, и не специфически взаимодействует во время сочетания. SATA реагирует с аминами и добавляет защищенные сульфгидрильные группы. NHS - эфир реагирует с первичными аминами с образованием стабильных амидных связей. С сульфгидрильных групп можно снять защиту, используя гидроксиламин. Этот метод сопряжения показан на Фигуре 5. Для связи карбоксильных групп с первичными аминами можно применять гидразид, как показано на Фигуре 6, и, следовательно, гидразид может быть пригоден для связывания гликопротеинов. Примеры дополнительных линкеров показаны на Фигуре 7.
Малые молекулы, такие как терапевтические агенты, могут быть сопряжены с полипептидами (например, описанными в данной заявке). Паклитаксел с малой молекулой имеет два стратегических положения (положение C2′ и C7), которые могут использоваться для сопряжения. Сопряжение вектора или вектора по изобретению с паклитакселом можно осуществить следующим образом (Фигура 8). Вкратце, паклитаксел реагирует с ангидридом сукцинпиридина в течение трех часов при комнатной температуре для присоединения сукцинильной группы в положении 2′. Паклитаксел с 2′-сукцинильной группой содержит расщепляемую эфирную связь в положении 2′, может легко высвобождать янтарную кислоту. Эта расщепляемая эфирная связь может быть затем применена для дальнейших модификаций с линкерами, если это желательно. Полученный 2′-O-сукцинил-паклитаксел затем взаимодействует с EDC/NHS в DMSO в течение 9 ч при комнатной температуре с последующим добавлением вектора или вектора в смеси раствор Рингера / DMSO в течение дополнительных 4 ч при комнатной температуре. Мониторинг реакции сопряжения, показанной на Фигуре 8, осуществляют методом HPLC. Каждое промежуточное соединение, такое как паклитаксел, 2′-O-сукцинил-паклитаксел и 2′-O-NHS-сукцинил - паклитаксел, подвергают очистке и идентификации при помощи различных методов, таких как HPLC, жидкостная тонкослойная хроматография, ЯМР (13C или 1H), определение температуры плавления, масс-спектрометрия. Конечный конъюгат анализируют методом масс-спектрометрии и методом электрофореза на SDS-полиакриламидном геле. Это позволяет определить количество молекул паклитаксела, сопряженных с каждым вектором.
Фармацевтические композиции
Поскольку гидрофобные агенты часто проявляют ограниченную растворимость в водных растворах, фармацевтические композиции по изобретению могут включать солюбилизирующие агенты. Наш состав на основе ANG 1005 включает DMSO и Solutol HS 15; однако, в композициях по изобретению могут содержаться другие солюбилизирующие агенты или вместо указанных агентов, или в добавление к ним. Кроме того, композиции могут также включать буферные агенты, агенты, изменяющие тоничность, и агенты для лиофилизации (например, наполнители или криозащитные агенты).
Солюбилизирующие агенты
Композиции и способ по изобретению могут включать любой солюбилизирующий агент, известный из уровня техники. Такие агенты могут содержаться в количестве по меньшей мере 1%, 2%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 50%, 60%, или 70% от массы композиции. Примеры солюбилизирующих агентов включают растворимые в воде органические растворители (например, полиэтиленгликоль 300, полиэтиленгликоль 400, этанол, пропиленгликоль, глицерин, N-метил-2-пирролидон, диметилацетамид и диметилсульфоксид), неионные поверхностно-активные вещества (например, Cremophor EL, Cremophor RH 40, Cremophor RH 60, d-α-токоферол, полиэтиленгликоль-1000-сукцинат, полисорбат 20, полисорбат 80, Solutol HS 15 (Макрогол 15 гидроксистеарат), моноолеат сорбитана, полоксамер 407, Labrafil M-1944CS, Labrafil M-2125 CS, Labrasol, Gellucire 44/14, Softigen 767 и моно- и диэфиры жирных кислот и PEG 300, 400 или 1750), не растворимые в воде липиды (например, касторовое масло, кукурузное масло, хлопковое масло, оливковое масло, арахисовое масло, масло перечной мяты, сафлоровое масло, кунжутное масло, соевое масло, гидрированное соевое масло и триглицериды с цепями средней длины кокосового масла и пальмового масла), органические жидкости/полутвердые вещества (пчелиный воск, d-α-токоферол, олеиновая кислота, моно- и диглицериды с цепями средней длины), циклодекстрины (например, α-циклодекстрин, β-циклодекстрин, гидроксипропил-β-циклодекстрин и сульфобутиловый эфир-β-циклодекстрин) и фосфолипиды (например, гидрированный фосфатидилхолин на основе соевого масла, дистеароилфосфатидилглицерат, 1-α-димиристоилфосфатидилхолин, 1-α-димиристоилфосфатидилглицерин).
Буферные агенты
Композиции и способы по изобретению могут включать применение одного или более буферных агентов. В зависимости от гидрофобного агента может быть желательно поддерживать величину pH или тоничность фармацевтической композиции (например, чтобы свести к минимуму разложение активного агента или обеспечить максимальные безопасность или эффективность агента, когда он применяется для лечения). Буферирование до любой конкретной величины pH или любого интервала pH можно осуществить, используя подходящий буфер (например, до величины pH равной 2.0, 2.5, 3.0, 3.5, 4.0, 4.5, 5.0, 5.5, 6.0, 6.5, 7.0, 7.5, 8.0, 8.5, 9.0, 9.5, 10.0, 10.5, 11.0, 11.5, 12.0, 12.5, 13.0, или до любого интервала между этими величинами). Буфер может содержаться в любой концентрации, необходимой для достижения желаемого эффекта (например, концентрация может быть равна 1 мМ, 10 мМ, 20 мМ, 50 мМ, 100 мМ, 200 мМ, 500 мМ, 1.0 М, 1.5 М, или находиться в любом интервале между этими величинами). Примеры буферных агентов включают лимонную кислоту/фосфат, ацетат, барбитал, борат, раствор Бриттона-Робинсона, какодилат, цитрат, коллидин, формиат, малеат, Mcllvaine, фосфат, раствор Придо-Уорда, сукцинат, цитрат-фосфат-борат (Teorell-Stanhagen), ацетат веронала, MES (2-(N-морфолин)этансульфоновую кислоту), BIS-TRIS (бис-(2-гидроксиэтил)имино-трис-(гидроксиметил)метан, ADA(N-(2-ацетамидо)-2-иминодиуксусную кислоту), ACES (N-(карбамоилметил)-2-аминоэтансульфоновую кислоту), PIPES (пиперазин-N,N′-бис-(2-этансульфоновую кислоту), MOPSO (3-(N-морфолино-2-гидроксипропансульфоновую кислоту), BIS-TRIS PROPANE (1,3-бис-(трис-(гидроксиметил)метиламино)пропан), BES (N,N-бис-(2-гидроксиэтил)-2-аминометил)этансульфоновую кислоту), MOPS (3-(N-морфолино)пропансульфоновую кислоту), TES (N-трис-(гидроксиметил)метил-2-аминоэтансульфоновую кислоту, HEPES (N-(2-гидроксиэтил)пиперазин-N′-(2-этансульфоновую кислоту), DIPSO (3-(N,N-бис-(2-гидроксиэтил)амино)-2-гидроксипропансульфоновую кислоту), MOBS (4-(N-морфолино)бутансульфоновую кислоту, TAOSO (3-(N-трис-(гидроксиметил)метиламино)-2-гидроксипропансульфоновую кислоту), TRIZMA (трис-(гидроксиметил аминометан), HEPPSO (N-(2-гидроксиэтил)пиперазин-N′-(2-гидроксипропан сульфоновую кислоту), POPSO (пиперазин-N,N'-бис-(2-гидроксипропан сульфоновую кислоту), TEA (триэтаноламин), EPPS (N-(2-гидроксиэтил)пиперазин-N′-(3-пропансульфоновую кислоту), TRICINE (N-трис-(гидроксиметил)-метилглицин), GLY-GLY (глицил-глицин), BICINE (N,N-бис-2-(гидроксиэтил)глицин), HEBS (N-(2-гидроксиэтил)пиперазин-N′-(4-бутансульфоновую кислоту), TAPS (N-трис-(гидроксиметил)метил-3-аминопропансульфоновую кислоту), AMPD (2-амино-2-метил-1,3-пропандиол) и/или любой другой буфер, известный из уровня техники.
Тоничность, в добавление к применению буферного агента или вместо него, можно поддерживать путем применения любой фармацевтически приемлемой соли, известной из уровня техники. Примеры солей включают ацетат натрия, лактат натрия, хлорид натрия, хлорид калия и хлорид кальция. Такие соли, сами по себе или в комбинации с буферными агентами, могут содержаться в количестве, которое является достаточным для поддержания желаемой тоничности (например 1 мМ, 10 мМ, 20 мМ, 50 мМ, 100 мМ, 200 мМ, 500 мМ, 1.0 М, 1.5 М или в любом интервале между этими величинами).
Другие эксципиенты
Согласно некоторым вариантам композиции и способы по данному изобретению предусматривают применение другого эксципиента, такого как наполнитель или криозащитный агент. Наполнители особенно желательны, если фармацевтическая композиция получается в дегидратированной (например, лиофилизированной) форме. Лиофилизированные композиции могут содержать менее 10% (например, менее 8%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,1%, 0,05%) воды или другого растворителя (по весу). Поскольку дегидратированные композиции, вводимые парентеральным методом, обычно растворяются в водном растворе до введения пациенту, может быть важно, чтобы процесс дегидратации осуществлялся методом, позволяющим ресолюбилизацию. Наполнители можно добавлять для того, чтобы обеспечить более легкую ресолюбилизацию лиофилизированного продукта. Такие агенты известны из уровня техники и включают полиэтиленгликоль, поливиниловый спирт, поливинилпирролидон, декстран; сахара, такие как декстроза, маннит, сахароза, лактоза, трегалоза и сорбит; аминокислоты, такие как глицин, аргинин, аспартовая кислота; и растворимые белки, такие как коллаген, желатин или сывороточный альбумин.
Композиции могут также содержать консерванты (например, тимеросал, бензиловый спирт, парабены), ковалентно присоединенные полимеры, такие как полиэтиленгликоль, присоединенный к белку, комплексы с ионами металлов, или же они могут быть введены в какой-либо материал или на поверхность частиц препаратов полимерных соединений, таких как полимолочная кислота, полигликолевая кислота, гидрогели и т.н. или в липосомы, микроэмульсии, мицеллы, униламеллярные или мультиламеллярные пузырьки или сферопласты. Такие композиции будут влиять на физическое состояние, растворимость, стабильность, скорость высвобождения in vivo и скорость клиренса in vivo. Композиции с контролируемым или пролонгированным высвобождение включают состав в лиофильных депо (например, жирных кислотах, восках, маслах). Данное изобретение охватывает также композиции, состоящие из частиц с покрытием на основе полимеров (например, полоксамеров или полоксаминов). Другие варианты композиций по изобретению предусматривают конкретные формы, защитные покрытия, применение ингибиторов протеазы или усилителей проницаемости для различных методов введения, включая парентеральное, легочное, назальное, оральное, вагинальное, ректальное. По одному из вариантов фармацевтическая композиция вводится парентерально, направленно против раковых клеток, через мукозу, трансдермально, внутримышечно, внутривенно, интрадермально, подкожно, интраперитонеально, интравентрикулярно, интракраниально и в опухоли.
Твердые лекарственные формы для орального применения
Лекарственные вещества для орального применения включают таблетки, содержащие активный(-ые) ингредиент(-ы) в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, такие вещества известны специалисту в данной области (например, описанные в патентах США №№5,817,307, 5,824,300, 5,830,456, 5,846,526, 5,882,640, 5,910,304, 6,036,949, 6,036,949, 6,372,218, включенных в данную заявку в качестве ссылок. Такие эксципиенты могут представлять собой, например, инертные разбавители или наполнители (например, сахарозу, сорбит, сахар, манит, микрокристаллическую целлюлозу, крахмалы, включая картофельный крахмал, карбонат кальция, хлорид натрия, лактозу, фосфат кальция, сульфат кальция или фосфат натрия); гранулирующие и дезинтегрирующие агенты (например, производные целлюлозы, включая микрокристаллическую целлюлозу, крахмалы, включая картофельный крахмал, натриевую соль кроскармеллозы, альгинаты или альгиновую кислоту); связующие (например, сахарозу, глюкозу, сорбит, смолу акации, альгиновую кислоту, альгинат натрия, желатин, крахмал, предварительно желатинизированный крахмал, микрокристаллическую целлюлозу, смешанный силикат магния - алюминия, натриевую соль карбоксиметилцеллюлозы, метилцеллюлозу, гидроксипропилметилцеллюлозу, этилцеллюлозу, поливинилпирролидон или полиэтиленгликоль); и смазывающие агенты, добавки, способствующие скольжению и антиадгезионные добавки (например, стеарат магния, стеарат цинка, стеариновую кислоту, двуокись кремния, гидрированные растительные масла или тальк). Другими фармацевтически приемлемыми эксципиентами могут быть красители, ароматизаторы, пластификаторы, смягчители, буферные агенты и т.п. Таблетки могут быть без покрытия или они могут содержать покрытие, полученное известными методами, возможно, для задержки распада и абсорбции в желудочно-кишечном тракте, обеспечивая пролонгированное действие в течение более длинного периода времени. Покрытие может быть адаптировано для высвобождения агента по заранее заданному образцу (например, чтобы достичь контролируемого высвобождения из состава) или может быть адаптировано не для высвобождения агента(-ов) до прохождения через желудок (энтеропокрытие). Покрытие может быть получено на основе сахара, в виде пленки (например, на основе гидроксипропилметилцеллюлозы, метилцеллюлозы, метилгидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, карбоксиметилцеллюлозы, сополимеров акрилатов, полиэтиленгликолей и/или поливинилпирролидона), это может быть энтеропокрытие (например, на основе сополимера метакриловой кислоты, ацетатфталата целлюлозы, гидроксипропилфталата метилцеллюлозы, гидроксипропилацетатсукцината метилцеллюлозы, поливинилацетатфталата, шеллака и/или этилцеллюлозы). Кроме того, может быть применен материал, задерживающий выделение, такой как, например, глицерилмоностеарат или глицерилдистеарат.
Твердые композиции для таблеток могут включать покрытие, которое адаптировано для защиты композиции от нежелательных химических изменений (например, химического разложения до высвобождения активных веществ). Покрытие может быть нанесено на твердую лекарственную форму способом, похожим на описанный в Encyclopedia of Pharmaceutical Technology, Supra.
Лекарственные вещества для орального применения могут быть представлены в виде таблеток для разжевывания или твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем (например, картофельным крахмалом, лактозой, микрокристаллической целлюлозой, карбонатом кальция, фосфатом кальция или каолином), или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой, например, арахисовым маслом, жидким парафином или оливковым маслом. Порошки и грануляты могут быть приготовлены с применением ингредиентов, упомянутых выше, для таблеток и капсул обычным методом с использованием, например, микросеры, аппарата с псевдоожиженным слоем или оборудования для сушки распылением.
Способы лечения
Данное изобретение предусматривает также способы лечения с применением агентов, описанных в данной заявке. Противораковые агенты и конъюгаты, описанные в данной заявке (например, ANG 1005) могут быть применены для лечения любого вида рака, известного из уровня техники. Конъюгаты по изобретению, включая пептиды, описанные в данной заявке, могут быть способны к сшиванию ВВВ (например, AngioPep-1 при помощи AngioPep-6) и, таким образом, могут быть применены для лечения любого заболевания мозга или центральной нервной системы (например, рака мозга, такого как глиобластома, астроцитома, глиома, медулобластома и олигодендрома, нейроглиома, эпендимома и менингиома). Такие конъюгаты могут также легко транспортироваться в печень, легкие, почку, селезенку или мышцу (например, AngioPep-1 при помощи AngioPep-6) и поэтому могут быть использованы в сочетании с соответствующим терапевтическим агентом для лечения болезни, ассоциируемой с этими тканями (например, рака, такого как печеночно-клеточная карцинома, рак печени, мелкоклеточная карцинома (например, овсяно-клеточный рак), смешанная карцинома мелких и крупных клеток, комбинированная мелкоклеточная карцинома и метастазирующие опухоли. Метастазирующие опухоли могут возникать при раке любой ткани, включая рак груди, рак прямой кишки, рак простаты, саркому, рак мочевого пузыря, нейробластому, опухоль Вильма, лимфому, лимфому не-Ходжкина и некоторые лимфомы Т-клеток). Другие примеры раковых заболеваний, которые можно лечить с применением композиции по изобретению, включают гепатоклеточную карциному, рак груди, раки головы и шеи, включая различные лимфомы, такие как лимфома клеток мантийной зоны, лимфома не-Ходжкина, аденому, карциному сквамозных клеток, ларингеальную карциному, раковые заболевания сетчатки, рак пищевода, множественную миелому, рак яичника, рак матки, меланому, колоректальный рак, рак мочевого пузыря, рак простаты, рак легкого (включая немелкоклеточный рак легких), рак поджелудочной железы, цервикальный рак, рак головы и шеи, раковые заболевания кожи, назофарингеальную карциному, липосаркому, эпителиальную карциному, карциному почечных клеток, аденокарциному желчного пузыря, аденокарциному, околоушную аденокарциному, эндометриальную саркому, раки, резистентные ко многим лекарствам, и пролиферативные болезни и состояния, такие как неоваскуляризация, связанная с ангиогенезом опухолей, макулярная дегенерация (например, сухая/мокрая AMD), неоваскуляризацию роговицы, диабетическая ретинопатия, неоваскулярная глаукома, миопатическая дегенерация и другие пролиферативные болезни и состояния, такие как рестеноз и поликистозное заболевание почек. Раковые заболевания мозга, которые можно лечить при помощи вектора, который транспортируется эффективно через ВВВ, включают астроцитому, астроцитому пиноцитозных пузырьков, дисэмбриоплатическую нейроэпителиальную опухоль, олигодендроглиомы, эпендимому, многоформенную глиобластому, смешанные глиомы, олигоастроцитомы, медуллобластому, ретинобластому, нейробластому, герминому и тератому.
Конъюгат или композиция по изобретению могут быть введены субъекту любым известным из уровня техники методом, например, орально, интраартериально, интраназально, интраперитонеально, внутривенно, внутримышечно, подкожно, трансдермально или per os. Например, агент может быть антиангиогенным соединением.
Дозы
Дозы любого конъюгата или композиции, описанных в данной заявке или идентифицированных описанными в ней методами, зависит от нескольких факторов, включая метод введения, вид болезни (например, рака), которая подвергается лечению, степени серьезности заболевания, если лечению подвергается рак или предотвращается развитие рака, и возраста, веса, состояния субъекта, который проходит лечение.
Что касается способов лечения по изобретению, то следует иметь в виду, что данное изобретение не предусматривает, что введение вектора, конъюгата или композиции субъекту ограничивается конкретными методом лечения, дозами или частотой дозирования; настоящее изобретение охватывает все методы введения. Конъюгат или композиция могут быть введены субъекту в виде одноразовой дозы или в виде многоразовых доз. Например, соединение, описанное в данной заявке или идентифицированное при помощи методов скрининга по изобретению, может вводиться один раз в неделю в течение, например, 2, 3, 4, 5, 6, 7, 8, 10, 15, 20 или более недель. Следует иметь в виду, что для любого конкретного субъекта с течением времени следует регулировать специфические схемы приема в соответствии с необходимостью для пациента и профессиональным суждением человека, осуществляющего введение композиции или наблюдающего за ее введением. Например, доза композиции может быть увеличена, если меньшая доза не обеспечивает достаточной активности при лечении болезни или состояния, описанных в данной заявке (например, рака). И наоборот доза композиции может быть уменьшена, если болезнь (например, рак) ослабляется или исчезает.
Хотя соответствующее количество и схема приема в конечном счете будет определяться практикующим врачом, терапевтически эффективное количество вектора, конъюгата или композиции, описанных в данной заявке, может составлять, например, величину, находящуюся в интервале от 0,0035 мкг до 20 мкг/кг веса пациента/день или 0,010 мкг - 140 мкг/кг веса пациента/нед. Желательно, чтобы терапевтически эффективное количество находилось в интервале от 0,025 мкг до 10 мкг/кг, например, было равно, по меньшей мере, 0,025, 0,035, 0,05, 0,075, 0,1, 0,25, 0,5, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 5,0, 6,0, 7,0, 8,0, или 9,0 мкг/кг веса пациента и вводилось ежедневно, каждый второй день или дважды в неделю. Кроме того, терапевтически эффективное количество может находиться в пределах от 0,05 мкг до 20 мкг/кг, например, равнялось, по меньшей мере, 0,05, 0,7, 0,15, 0,2, 1,0, 2,0, 3,0, 4,0, 5,0, 6,0, 7,0, 8,0, 10,0, 12,0, 14,0, 16,0, или 18,0 мкг/кг веса пациента и вводилось ежедневно, каждый второй день, каждые три недели или один раз в месяц. Далее, терапевтически эффективное количество соединения может, например, быть в интервале от 0,1 мг/м2 до 2000 мг/м2 и вводиться каждый второй день, один раз в неделю, каждую вторую неделю или каждые три недели. Например ANG 1005 можно вводить с дозой равной 50, 100, 200, 300, 400, 420, 500, 600, 700, 800, или 1,000 мг/м2 каждую неделю, каждые две, три, четыре недели или каждый месяц или раз в два месяца. Согласно одному из примеров ANG 1005 вводят в дозе равной 300 мг/м2 или 420 мг/м2 каждые три недели. По другому варианту терапевтически эффективное количество соединения находится в интервале от 1000 мкг/м2 до 20000 мкг/м2, равняется, например, по меньшей мере, 1000, 1500, 4000 или 14000 мкг/м2, оно вводится ежедневно, каждый второй день, два раза в неделю, еженедельно и каждую вторую неделю.
Следующие ниже примеры предназначены для иллюстрации, но не для ограничения данного изобретения.
Пример 1
Растворимость ANG 1005
Испытывали растворимость ANG 1005 в ряде растворителей и поверхностно-активных веществ. Результаты, полученные при применении отдельных растворителей, показаны ниже в Таблице 13.
Растворимость ANG 1005 была также испытана с применением комбинаций растворитель/поверхностно-активное вещество. Эти результаты показаны в Таблице 14.
Пример 2
Условия солюбилизации ANG 1005
Для ANG 1005 применяли различные условия солюбилизации при подготовке к лиофилизации. Результаты этих испытаний показаны ниже. Как описано выше, вначале ANG 1005 растворяли в DMSO. К этой смеси добавляли нагретый Solutol или комбинацию Solutol с буфером. Наконец, к смеси ANG 1005/DMSO/Solutol добавляли глициновый буфер. Условия солюбилизации приведены в Таблице 15.
Результаты этих экспериментов показаны в Таблице 16 ниже.
На основе этих результатов мы определили, что состав можно обрабатывать при температурах между 40 и 50°C. Величина pH раствора должна быть выше 4,5 для обеспечения образования мицелл в присутствии Solutol HS 15, так как воссоздание раствора при pH равном 4,5 может привести к помутнению растворов. Подкисление Solutol HS 15 перед добавлением ANG 1005 приводит к его минимальному разложению.
Пример 3
Условия лиофилизации
После растворения смесь ANG 1005 разбавляли водным буфером (например, глициновым буфером, pH доводили до величины равной 5,0 при помощи HCl, маннита и хлорида натрия), замораживали и подвергали лиофилизации. Примерные условия приведены в Таблице 4 выше.
Величина температуры загрузки составляла от -70°C до 25°C при испытании для сегмента один. Время выдержки для сегмента 2 варьировалось в соответствии с разницей между температурами в сегментах 1 и 3 и могло составлять до 6 ч. Мы установили, что сегмент 3 может быть осуществлен в течение, по меньшей мере, 12 ч, так как более короткий промежуток времени приводил к разрушению лиофилизированного продукта. Сегменты 8 и 9 можно осуществлять при температурах, показанных выше, для обеспечения температуры продукта, равной величине между 18°C и 21°C во время второй стадии сушки. Продукт должен выдерживаться при температуре ниже 25°C, чтобы избежать плавления. Применяя протоколы солюбилизации/лиофилизации. Описанные в данной заявке, мы смогли, в некоторых случаях, получить продукт со степенью чистоты более 96%, содержащий менее 1% остаточного DMSO, как показано в Таблице 17.
Таблица 17
Другие характеристики партии 1007135 и других партий показаны в Таблице 18 ниже.
Пример 4
Повторное суспендирование лиофилюированного ANG 1005
Для растворения и суспендирования лиофилизированного состава на основе ANG 1005 в водном растворе была разработана следующая процедура. Эта процедура касается одного сосуда, содержащего 120 мг ANG 1005.
Сосуд с ANG 1005 выдерживали при комнатной температуре. Затем сосуд продували воздухом. При помощи шприца объемом 20 см3, снабженного иглой ½ дюйма, 18G 1, медленно вводили 4 мл безводного этанола в нижнюю часть сосуда. Затем этот сосуд помещали на 10 мин в конический миксер, что привело к медленному увлажнению продукта и получению молочной суспензии.
Затем сосуд удаляли из миксера и при помощи шприца из пластика объемом 20 см3, снабженного иглой 18G диаметром 1,5 дюйма вводили в нижнюю часть сосуда 12 мл раствора Рингера (содержащего лактат) с 5% декстрозы. Затем сосуд помещали на 5 мин в конический миксер. В этот момент суспензия была прозрачной и содержала минимальное количество пены. Затем сосуд оставляли стоять на полке в течение 5 мин перед осуществлением следующей стадии (например, разбавления для инъекции, анализа).
Были также испытаны альтернативные растворители (Таблица 19). Хотя применение этих растворителей привело к образованию прозрачного раствора в результате полного растворения, происходило большее разложение ANG 1005, чем при использовании смеси лактатированного раствора Рингера с 5% декстрозы и этанола при комнатной температуре.
Пример 5
Испытание других буферов и наполнителей
Были предприняты дальнейшие усилия с целью уменьшения количества остаточного DMSO (0,5%) и сокращения цикла лиофилизации (5 дн.).
Мы считаем, что различные эксципиенты состава (особенно глицин и хлорид натрия) приводили к пониженной эффективности удаления DMSO во время второй стадии цикла. Составы, приготовленные без NaCl, глицина, маннита и воды, обеспечивали гораздо меньшее содержание DMSO (порядка 0,01%). Однако без маннита продукт был воскоподобным (в основном состоящим из Solutol′а). Эти составы с низким содержанием DMSO не обеспечивали воссоздания с применением этанола и смеси D5W / лактатированный раствор Рингера. Кроме того, когда в составе не было глицина, величину pH не контролировали. Это приводило к разложению ANG 1005.
Далее, в качестве наполнителя применяли манит, глицин заменяли буферными растворами, включающими лимонную кислоту и молочную кислоту, и удаляли хлорид натрия. Эти составы, в случае менее продолжительного цикла лиофилизации, приводили к получению продуктов, все еще содержащих 0,05% остаточного DMSO. С этим количеством DMSO продуктом был не растворимым. В другом составе вместо маннита использовали лецитин соевых бобов. Это обеспечило 0,2%-ное содержание остаточного DMSO. В случае наличия 0,2% DMSO продукт был растворимым в этаноле и смеси D5W/LR. Таким образом, мы полагаем, что величина, равная минимум 0,2-0,4% DMSO должна быть необходима для воссоздания содержимого сосудов и дальнейшего разбавления в пакете для инфузии. Время лиофилизации можно регулировать соответственно, чтобы получить величину концентрации DMSO в указанном интервале.
В этих опытах использовали композиции следующего состава (Таблицы 20-22).
Отношение Solutol/API то же самое, что и в партии ANG.
Отношение DMSO/HCl то же самое, что и в партии ANG.
Концентрация лимонной кислоты выбрана для обеспечения величины pH равной 5 (F-34).
Концентрация молочной кислоты рассчитана для обеспечения величины pH равной 5 (F-38) и ниже (F-39).
Концентрация маннита в воде та же самая, что и в партии ANG.
Лецитин представляет собой "солюбилизирующий" наполнитель вместо маннита.
Композиции готовили следующим образом. Исходный раствор DMSO/HCl готовили путем взвешивания 0,5 г стандартного раствора 1N HCl в трубке Falcon объемом 50 мл. Добавляли 21,5 г DMSO и хорошо перемешивали смесь с получением раствора DMSO + 1N HCl.
Для каждой композиции взвешивали маннит, Solutol, лимонную или молочную кислоту, WFI и все это помещали в трубку Falcon объемом 50 мл. Содержимое трубок тщательно перемешивали для растворения. Трубки закрывали пробками и нагревали до температуры 51°C ("буферная смесь"). Другая трубка объемом 50 мл использовалась для ANG 1005. Затем туда добавляли смесь DMSO/HCl и всю смесь перемешивали, создавая завихрение до тех пор, пока раствор не становился прозрачным. Нагретую буферную смесь медленно добавляли к смеси DMSO/ANG 1005 при наличии завихрения. Затем смеси охлаждали до комнатной температуры. Затем в каждый сосуд помещали 1700-1730 мг раствора. Раствор подвергали лиофилизации, как описано выше. Соединение хранили при -20°C.
Затем растворы испытывают на их способность к воссозданию. Для воссоздания растворов добавляли этанол и смесь перемешивали. Затем добавляли раствор Рингера с лактатом. Количества компонентов показаны в Таблице 23.
Если воссоздание проходит успешно, записывают внешний вид образца (цвет, кристаллы или наличие твердых частиц РРТ под микроскопом и т.д.). Затем анализируют аликвоту методом HPLC (например, количественный состав и степень чистоты). Измеряют также величину pH.
Пример 6
Определение стабильности лиофилизированного продукта ANG 1005
Проводили определение стабильности продукта ANG 1005 со временем. Осуществляли мониторинг лиофилизированного продукта, который хранили при температуре около -15°C, определяли активность, степень чистоты, внешний вид, величину pH и степень разложения. Результаты этих испытаний приведены в Таблице 24 ниже.
Пример 7
Стабильность продукта ANG 1005 после воссоздания
Было проведено несколько экспериментов для определения стабильности ANG 1005 после воссоздания раствора, результаты описаны ниже.
Опыт 1
Продукт ANG 1005 партии № C0108002, предназначенный для инъекции, был воссоздан, как описано в данной заявке, с концентрацией в пределах от 1,0 до 2,0 мг/мл. Предварительно определили, что концентрация ANG 1005 равная 2,0 мг/мл являлась наиболее подходящей дозой для клинического променения, как ранее было указано в IND. Эти предварительные опыты проводили с маленькими объемами в стеклянных сосудах. Образцы выдерживали при комнатной температуре и визуально осматривали в различные моменты времени. Отобранные образцы отфильтровывали до проведения анализа методом HPLC.
В Таблице 25 показано, что растворы были прозрачными при испытанных концентрациях и времени. Появление мутности коррелирует с возрастанием концентрации и увеличением времени. Анализ отобранных образцов методом HPLC показал наличие единственного пика ANG 1005, что свидетельствует о том, что степень чистоты меняется незначительно в различные моменты времени. Не наблюдались также изменения профиля родственных веществ (Таблица 26). Были отмечены два пика для родственных веществ, они были идентифицированы как 2:1 конъюгат (RRT 0,88) и несопряженный паклитаксел (RRT 0,95). Наблюдался пик для RRT 1,15 (8,1 мин); этот пик показывает примесь из колонки HPLC, что было видно и на контрольных хроматограммах.
Опыт 2
Для проверки результатов стабильности при концентрации 1,0 мг/мл, полученных при проведении опыта 1, проводили дополнительное исследование в условиях клинического применения. ANG 1005 для инъекции, партия № С0108002, применяли для воссоздания раствора, как описано выше, с получением конечной концентрации равной 1,0 мг/мл в D5W в пакете для инфузии объемом 500 мл. Раствор оставался визуально прозрачным в течение 6-часового наблюдения при комнатной температуре с незначительными изменениями степени чистоты или профилей наличия родственных веществ (см. Таблицу 27 и Фигуру 2).
Опыт 3
Состав ANG 1005 для инъекции, партия № C0108002, был воссоздан и разбавлен D5W до конечной концентрации равной 2,0 мг/мл в стеклянном сосуде. Образец выдерживали при комнатной температуре в течение ~6 ч. Раствор становился мутным и его центрифугировали. Полученный осадок собирали путем декантации надосадочной жидкости, солюбилизировали в DMSO и анализировали методом HPLC. Основной пик ресолюбилизированного осадка был идентифицирован как ANG 1005 со степенью чистоты равной 97,2%. Никакого изменения профиля родственных веществ не наблюдалось, были только два ожидаемых дополнительных пика (1,3% для RRT 0,88 и 1,5% для RRT 0,95). Хроматограмма HPLC этого образца показана на Фигуре 3. Пик наблюдался для RRT 1,15 (8,1 мин); этот пик представляет собой примесь из колонки HPLC и был также на контрольных хроматограммах. Полученные данные показывают, что наблюдаемая мутность / непрозрачность является результатом наличия интактного ANG 1005, выпадающего из раствора без всякого разложения, вероятно, благодаря взаимодействию между компонентами лекарственного продукта и D5W. Оказалось, что это явление зависит от концентрации и времени.
Для уменьшения мутности было предложено снизить конечную концентрацию до ≤1 мг/мл для всех пациентов, получающих дозы ANG 1005 более 300 мг/м2.
Есть некоторые данные, позволяющие предположить, что это явление в основном обусловлено уменьшением количества остаточного DMSO в лекарственном продукте. Первая партия лекарственного продукта, партия № C0807121, имеет содержание остаточного DMSO равное 8,2%, в то время, как последняя партия продукта № C0108002, имеет содержание остаточного DMSO равное 0,54%. Оказалось, что это изменение могло влиять на растворимость вещества.
Дополнительные опыты предпринимались для модификации процедуры разбавления для увеличения стабильности воссозданного лекарственного продукта. Испытывались растворы, полученные с лактатированным раствором Рингера вместо 5% декстрозы для инъекции в качестве разбавителя на последней стадии процедуры воссоздания: каждый сосуд с ANG 1005 для инъекции вначале воссоздавали при помощи 4 мл безводного этанола и 12 мл смеси лактатированного раствора Рингера с 5% декстрозы для инъекции, как ранее, для достижения концентрации равной 6 мг/мл, и затем разбавляли лактатированным раствором Рингера для инъекции. Предварительные данные, показанные в Таблице 28, позволяют предположить, что замена D5W лактатированным раствором Рингера с той же концентрацией (до 2,0 мг/мл) может предотвратить наблюдаемое помутнение растворов доя инфузии. Все оставшиеся растворы оставались прозрачными в течение всего периода наблюдения без изменения степени чистоты ANG 1005.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТЫ ЭТОПОЗИДА И ДОКСОРУБИЦИНА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2009 |
|
RU2531591C2 |
| ПОЛИПЕПТИД, СПОСОБНЫЙ ПРЕОДОЛЕВАТЬ ГЕМАТОЭНЦЕФАЛИЧЕСКИЙ БАРЬЕР, И ЕГО КОНЪЮГАТ | 2005 |
|
RU2408605C2 |
| ПОЛИПЕПТИДЫ АПРОТИНИНА ДЛЯ ТРАНСПОРТА СОЕДИНЕНИЯ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИЧЕСКИЙ БАРЬЕР | 2010 |
|
RU2611193C2 |
| АНТИ-АНГИОГЕННЫЕ СОЕДИНЕНИЯ | 2009 |
|
RU2511420C2 |
| МОДУЛЯЦИЯ АКТИВНОСТИ КОМПЛЕМЕНТА | 2015 |
|
RU2670988C2 |
| НОВЫЕ ПОЛИПЕПТИДЫ | 2014 |
|
RU2674604C2 |
| ИНГИБИТОРЫ РЕЦЕПТОРОВ ФАКТОРА РОСТА ЭНДОТЕЛИЯ СОСУДОВ ТИПА 2 | 2004 |
|
RU2402567C2 |
| МОДУЛЯЦИЯ АКТИВНОСТИ КОМПЛЕМЕНТА | 2015 |
|
RU2778514C2 |
| ВАРИАНТЫ АЛЬБУМИНА | 2010 |
|
RU2607374C2 |
| ПОЛИПЕПТИДЫ АНТИТЕЛ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2753677C2 |


































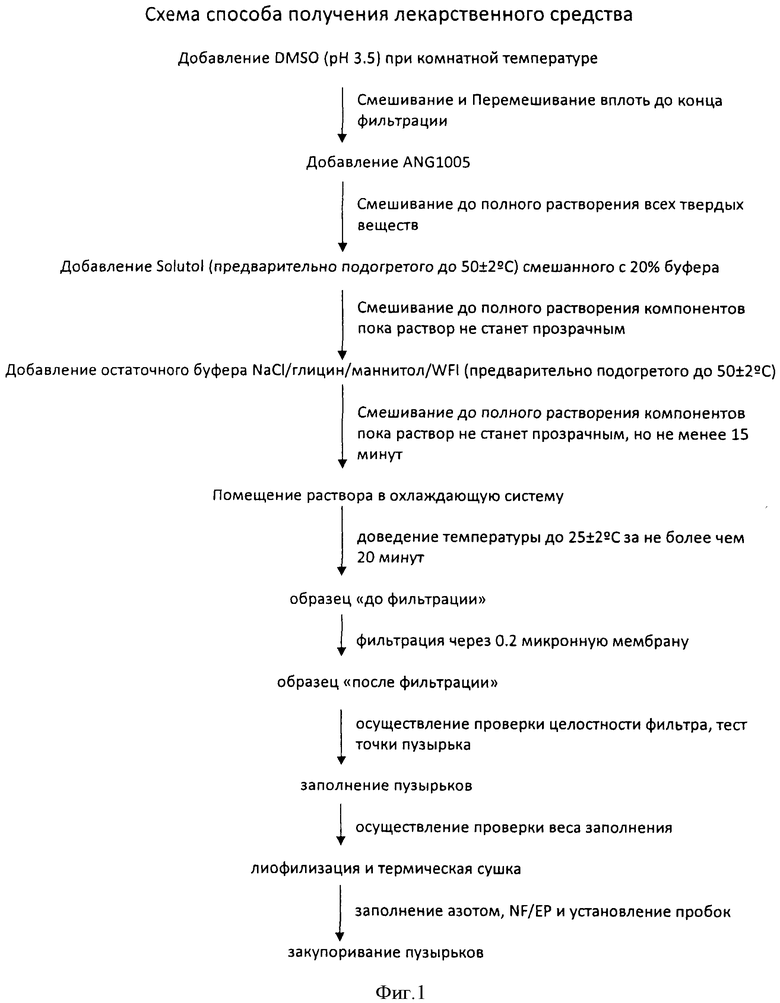
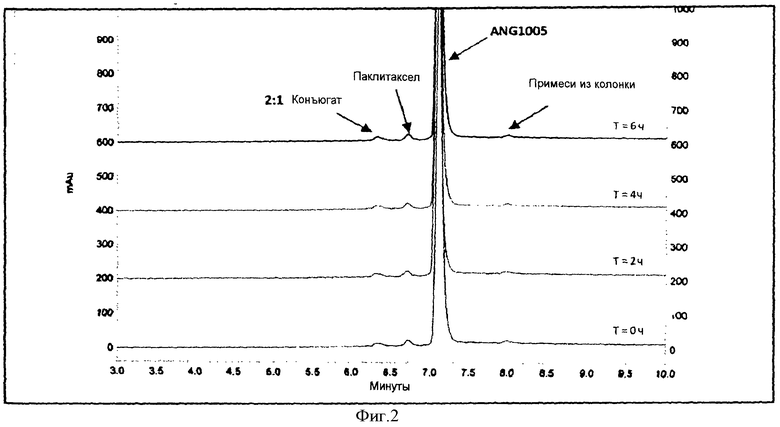
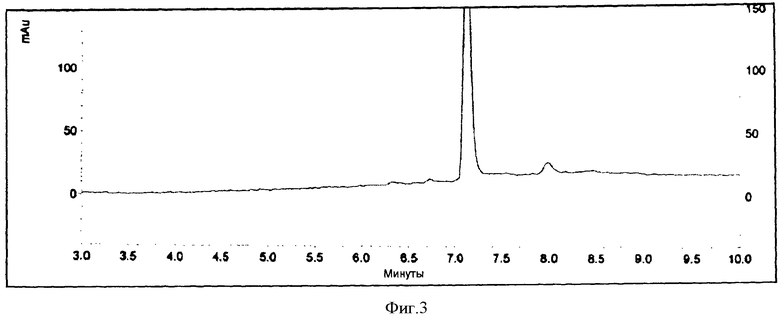
Предложены: композиция для лечения рака, включающая (а) конъюгат, содержащий (i) полипетидный вектор, содержащий аминокислотную последовательность, имеющую по меньшей мере 70%-ную идентичность по отношению к AngioPep-2 (SEQ ID NO: 97); и (ii) паклитаксел или аналог паклитаксела, конъюгированные с указанным полипетидом; (б) необязательный агент, регулирующий тоничность; (в) буферный агент; (г) наполнитель; (д) полиоксиэтиленовый эфир жирной кислоты; и (е) 0,01-8% DMSO (варианты), способы ее получения (варианты), способ лечения рака, контейнер, содержащий указанную композицию и набор, включающий контейнер с данной композицией. Изобретение отличается тем, что заявленные конъюгаты (например, ANG 1005), могут пересекать гемато-энцефалический барьер, характеризоваться повышенным поглощением клетками, на которые они нацелены, проявлять повышенную стабильность или в меньшей степени удаляться из клетки, а композиции на их основе могут растворяться в водном растворе, отличаются стабильностью с минимальным разложением при температурах между 40°C и 50°C. 10 н. и 43 з.п. ф-лы, 3 ил., 28 табл.
1. Композиция для применения для лечения рака, включающая:
(а) конъюгат, содержащий (i) полипетидный вектор, содержащий аминокислотную последовательность, имеющую по меньшей мере 70%-ную идентичность по отношению к AngioPep-2 (SEQ ID NO: 97); и (ii) паклитаксел или аналог паклитаксела, где паклитаксел или аналог паклитаксела конъюгированы с указанным полипетидом;
(б) необязательный агент, регулирующий тоничность;
(в) буферный агент;
(г) наполнитель; и
(д) полиоксиэтиленовый эфир жирной кислоты; и
(е) 0,01-8% DMSO.
2. Композиция по п.1, отличающаяся тем, что идентичность составляет 90%.
3. Композиция по п.1 или 2, отличающаяся тем, что терапевтический агент представляет собой паклитаксел.
4. Композиция по п.3, отличающаяся тем, что конъюгат представляет собой ANG 1005, где структура ANG 1005 представляет собой:

5. Композиция по любому из пп.1-4, отличающаяся тем, что агент, регулирующий тоничность, представляет собой хлорид натрия.
6. Композиция по любому из пп.1-5, отличающаяся тем, что буферный агент поддерживает величину pH раствора менее 6.
7. Композиция по п.6, отличающаяся тем, что величина pH составляет 4-6.
8. Композиция по любому из пп.1-7, отличающаяся тем, что буферный агент представляет собой глицин.
9. Композиция по любому из пп.1-7, отличающаяся тем, что буферный агент представляет собой лимонную кислоту.
10. Композиция по любому из пп.1-7, отличающаяся тем, что буферный агент представляет собой молочную кислоту.
11. Композиция по любому из пп.1-10, отличающаяся тем, что полиоксиэтиленовый эфир жирной кислоты представляет собой Solutol HS 15.
12. Композиция по любому из пп.1-11, отличающаяся тем, что наполнитель представляет собой маннит или сорбит.
13. Композиция по п.1, отличающаяся тем, что она содержит:
(e) 0,1-5% DMSO.
14. Композиция по любому из пп.1-13, отличающаяся тем, что количество DMSO меньше 2%.
15. Композиция по п.14, отличающаяся тем, что количество DMSO меньше 1%.
16. Композиция по п.15, отличающаяся тем, что количество DMSO находится в пределах от 0,2% до 1,0%.
17. Композиция по любому из пп.1-16, отличающаяся тем, что композиция практически не содержит Cremophor.
18. Композиция по п.17, отличающаяся тем, что композиция практически не содержит Cremophor.
19. Композиция по любому из пп.1-18, отличающаяся тем, что композиция растворена в воде.
20. Композиция для применения для лечения рака, содержащая:
где структура ANG 1005 представляет собой:
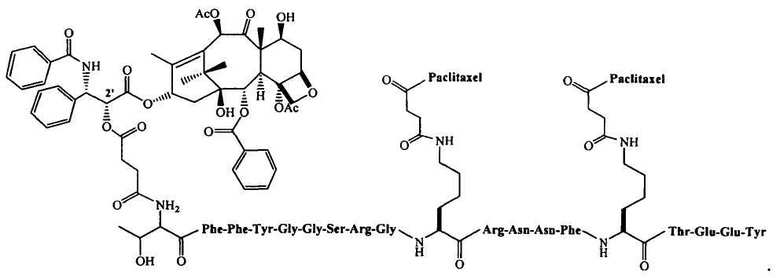
21. Композиция по п.20, отличающаяся тем, что агент, регулирующий тоничность, представляет собой хлорид натрия, буферный агент представляет собой глицин и наполнитель представляет собой маннит.
22. Композиция по п.20, отличающаяся тем, что она содержит:
23. Композиция по п.22, отличающаяся тем, что агент, регулирующий тоничность, представляет собой хлорид натрия, буферный агент представляет собой глицин и наполнитель представляет собой маннит.
24. Композиция для применения для лечения рака, содержащая:
25. Композиция по п.24, отличающаяся тем, что буферный агент представляет собой лимонную кислоту или молочную кислоту и наполнитель представляет собой маннит.
26. Композиция по п.24, отличающаяся тем, что она содержит следующие компоненты:
27. Композиция по п.26, отличающаяся тем, что буферный агент представляет собой молочную кислоту или лимонную кислоту и наполнитель представляет собой маннит.
28. Способ лечения рака, включающий введение пациенту эффективного количества композиции по любому из пп.1-27.
29. Способ по п.28, отличающийся тем, что раковое заболевание представляет собой рак мозга, яичника, легкого, печени, селезенки или почки.
30. Способ по п.29, отличающийся тем, что рак мозга выбран из группы, состоящей из глиобластомы, астроцитомы, глиомы, медулобластомы и олигодендромы, нейроглиомы, эпендимомы и менингиомы.
31. Герметичный контейнер, содержащий композицию по п.26.
32. Набор для применения для лечения рака, включающий:
(а) герметичный контейнер по п.31 и
(б) инструкции по применению.
33. Способ приготовления фармацевтической композиции, включающий:
(а) растворение конъюгата, содержащего (i) полипетидный вектор, который содержит аминокислотную последовательность, имеющую по меньшей мере 70%-ную идентичность по отношению к AngioPep-2 (SEQ ID NO: 97); и (ii) паклитаксел или аналог паклитаксела, где паклитаксел или аналог паклитаксела конъюгированы с указанным полипетидом, в первом солюбилизирующем агенте с образованием смеси;
(б) добавление второго солюбилизирующего агента к смеси со стадии (а);
(в) возможное добавление воды и буферного агента к указанной смеси;
(г) лиофилизацию смеси со стадии (в); при этом лиофилизация приводит к уменьшению по меньшей мере на 20% количества первого солюбилизирующего агента, но несущественно снижает количество второго солюбилизирующего агента.
34. Способ по п.33, отличающийся тем, что первый солюбилизирующий агент представляет собой DMSO.
35. Способ по п.33 или 34, отличающийся тем, что второй солюбилизирующий агент представляет собой полиоксиэтиленовый эфир жирной кислоты.
36. Способ по п.35, отличающийся тем, что полиоксиэтиленовый эфир жирной кислоты представляет собой Solutol HS 15.
37. Способ по любому из пп.33-36, отличающийся тем, что идентичность равна по меньшей мере 90%.
38. Способ по п.37, отличающийся тем, что полипептид включает аминокислотную последовательность AngioPep-2 (SEQ ID NO: 97).
39. Способ по п.38, отличающийся тем, что конъюгат представляет собой ANG 1005, где структура ANG 1005 представляет собой:
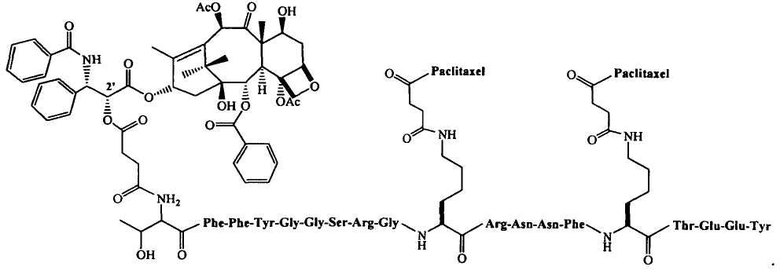
40. Способ по любому из пп.33-39, отличающийся тем, что воду и буферный агент добавляют на стадии (в) и стадия лиофилизации (г) включает:
(i) замораживание указанной смеси;
(ii) сушку замороженного продукта при первом значении температуры и давления, достаточных для удаления по меньшей мере части воды и
(iii) сушку продукта при втором значении температуры и давления, достаточных для удаления по меньшей мере части первого растворителя.
41. Способ по п.40, отличающийся тем, что первый растворитель представляет собой DMSO и второй солюбилизирующий агент представляет собой Solutol HS 15.
42. Способ по любому из пп.33-41, отличающийся тем, что смесь со стадии (б) подвергают фильтрованию перед проведением стадии (в) лиофилизации.
43. Способ по любому из пп.33-42, отличающийся тем, что указанную смесь помещают в сосуд перед проведением стадии (в) лиофилизации.
44. Способ по любому из пп.33-43, отличающийся тем, что он дополнительно включает стадию:
(д) повторного суспендирования лиофилизированного продукта.
45. Фармацевтическая композиция для применения для лечения рака, полученная любым из способов по пп.33-44.
46. Способ приготовления фармацевтической композиции, включающий стадии:
(а) растворения в DMSO конъюгата, содержащего паклитаксел или аналог паклитаксела, конъюгированных с полипептидным вектором, который содержит аминокислотную последовательность, имеющую по меньшей мере 70%-ную идентичность по отношению к AngioPep-2 (SEQ ID NO: 97) с образованием смеси;
(б) добавления Solutol HS 15 к указанной смеси;
(в) добавления к указанной смеси воды, буферного агента и возможно агент, регулирующий тоничность или наполнителя; и
(г) лиофилизации указанной смеси при условиях, которые приводят к удалению воды и DMSO из смеси.
47. Способ по п.46, отличающийся тем, что Solutol HS 15 смешивают с водой, буферным агентом и возможно с агентом, регулирующим тоничность, или наполнителем до добавления к указанной смеси, при этом воду, буферный агент и возможно агент, регулирующий тоничность, добавляют в количестве, которое поддерживает растворимость конъюгата в смеси.
48. Способ по п.46 или 47, отличающийся тем, что буферный агент поддерживает величину pH раствора 4-6.
49. Способ по любому из пп.46-48, отличающийся тем, что DMSO подкисляют до величины pH 3,5-4,5 перед стадией (а) растворения.
50. Способ по любому из пп.46-49, отличающийся тем, что указанная лиофилизация снижает количество Solutol HS 15 в смеси несущественно.
51. Способ по любому из пп.46-50, отличающийся тем, что конъюгат включает AngioPep-2 (SEQ ID NO: 97).
52. Способ по п.51, отличающийся тем, что конъюгат паклитаксел - полипептид представляет собой ANG 1005, где структура ANG 1005 представляет собой:
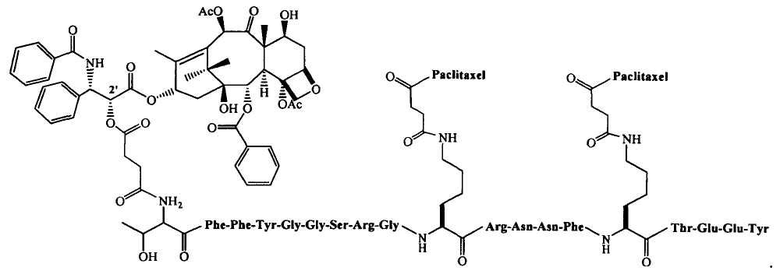
53. Фармацевтическая композиция для применения для лечения рака, полученная способом по любому из пп.46-52.
| БЫТОВОЙ ПРИБОР ДЛЯ УХОДА ЗА БЕЛЬЕМ | 2014 |
|
RU2637893C2 |
| ВРАЩАЮЩИЙСЯ ТРЕХФАЗНЫЙ/ДВУХФАЗНЫЙ ТРАНСФОРМАТОР, СОДЕРЖАЩИЙ СХЕМУ СКОТТА | 2013 |
|
RU2638034C2 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Р | |||
| ДОСОН и др | |||
| Справочник биохимика М., Мир 1991 с.352 | |||
| HANDBOOK OF PHARMACEUTICAL EXCIPIENTS | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| REGINA A | |||
| et al | |||
| ЦЕНТРОБЕЖНЫЙ ВЕНТИЛЯТОР | 1922 |
|
SU1005A1 |
Авторы
Даты
2014-06-10—Публикация
2009-04-20—Подача