Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет предварительной заявки США № 60/921141, поданной 30 марта 2007 года.
Предпосылки к созданию изобретения
Имеется целый ряд систем, в которых векторные молекулы нуклеиновой кислоты используют для экспрессии рекомбинантных белков в разнообразном и широком спектре эукариотических или прокариотических клеток-хозяев. Решение, какую пару вектор/клетка-хозяин использовать, обычно зависит от того, какая система обеспечивает наиболее высокий выход желаемого рекомбинантного генного продукта в форме, наиболее подходящей для его намеченного использования. Например, если посттрансляционная модификация, такая как гликозилирование, является решающим требованием к желаемому рекомбинантному белку (например, для антигенности, активности, конформации), то потребуется система эукариотической клетки-хозяина, поскольку для прокариотических клеток характерно отсутствие пост-трансляционной гликозилирующей активности. Также важно, что пара вектор/клетка-хозяин не только продуцирует экспрессированный генный продукт в желаемой форме, а также то, что молекулы желаемого экспрессированного генного продукта могут быть легко выделены из клеток, которые их продуцируют.
Вследствие возрастающих затрат, вовлеченных в развитие рекомбинантных белков, предназначенных для лечения людей, продолжаются усилия увеличить уровень экспрессии таких рекомбинантных белков, особенно в системах, в которых используют эукариотические клетки-хозяева. Различные охарактеризованные цис- и трансдействующие регуляторные элементы имеют нуклеотидные последовательности (ДНК или РНК), которые могут улучшать эффективность экспрессии и/или суммарный выход желаемого рекомбинантного генного продукта. Такие регуляторные элементы включают, но не только, высокоэффективные промоторы, трансляционные энхансерные последовательности (смотрите, например, обзор Dillon and Grosveld, Trends Genet., 9: 134 (1993), контрольные области локуса (LCR; смотрите, например, Grosveld et al., Cell, 51: 975 (1987)), области прикрепления матрикса или остова (MAR, SAR; смотрите, например, патент США № 7129062; Bode et al., Int. Rev. Cytol, 162A: 389-454 (1995); Bode et al., Crit. Rev. Eukaryotic Gene Expression, 6: 115-138 (1996)); изоляционные элементы (смотрите, например, Kellum et al., Cell, 64: 941 (1991)); и участки внутренней посадки рибосомы (IRES; смотрите, например, обзор McBratney et al., Curr. Opin. Cell Biol, 5: 961 (1993)). Впоследствии было обнаружено, что некоторые из последовательностей нуклеиновой кислоты таких элементов обладают особыми подпоследовательностями, которые могут влиять на экспрессию.
Несмотря на достижения в понимании различных последовательностей и других факторов, которые могут влиять на экспрессию рекомбинантных белков в различных типах клеток-хозяев, остается необходимость в улучшении выходов рекомбинантных белков, особенно когда такие рекомбинантные белки предназначены для терапевтических или других специализированных применений.
Краткое изложение сущности изобретения
Настоящее изобретение относится к выделенным молекулам нуклеиновой кислоты (полинуклеотидным молекулам), содержащим последовательности нуклеотидных оснований, которые усиливают экспрессию рекомбинантных белков. В настоящем описании такие молекулы нуклеиновой кислоты называются элементами рекомбинантного вектора экспрессии (rEVE). Присутствие rEVE в векторе экспрессии усиливает уровень экспрессии одного или нескольких рекомбинантных белков, кодируемых одним или несколькими функциональными генами, которые находятся в векторе экспрессии по сравнению с уровнем экспрессии в отсутствие этого rEVE. Такие rEVE-опосредованные усиления уровня экспрессии рекомбинантного белка возможны при расположении rEVE 5' к, 3' к, или как 5', так и 3' к (например, фланкируя) гену, кодирующему представляющий интерес рекомбинантный белок (белки). rEVE, находящийся в векторе экспрессии, может усиливать экспрессию одного или нескольких рекомбинантных белков либо кодируемых отдельными соответствующими генами, либо кодируемых одним полицистронным геном, находящимся в векторе экспрессии. REVE могут быть использованы для увеличения уровня экспрессии рекомбинантного белка, используя как стабильно экспрессирующие системы, так и транзиторно экспрессирующие системы.
В одном варианте осуществления изобретение относится к выделенной полинуклеотидной молекуле rEVE, которая содержит последовательность нуклеотидных оснований, выбранную из группы, состоящей из последовательности оснований SEQ ID NO:1 («ARM1»), последовательности оснований SEQ ID NO:2 («ARM2»), и усиливающей экспрессию части любой из представленных выше последовательностей, где в случае присутствия rEVE полинуклеотида в одном и том же векторе экспрессии в качестве рекомбинантного гена, кодирующего рекомбинантный белок, представляющий интерес, уровень экспрессии рекомбинантного белка будет увеличен по сравнению с уровнем экспрессии в отсутствие rEVE.
Предпочтительные молекулы rEVE по настоящему изобретению включают молекулу нуклеиновой кислоты rEVE из 2329 пар оснований (п.о.), которая имеет последовательность нуклеотидных оснований SEQ ID NO:1 и молекулу нуклеиновой кислоты rEVE из 2422 п.о., которая имеет последовательность нуклеотидных оснований SEQ ID NO:2.
3' концевая область последовательности SEQ ID NO:2 содержит последовательности, которые являются основными для rEVE-опосредованного усиления экспрессии белка. Такие предпочтительные последовательности 3' концевой области последовательности SEQ ID NO:2 включают последовательность оснований 462-2422 последовательности SEQ ID NO:2 и последовательность оснований 1087-2422 последовательности SEQ ID NO:2.
Выделенная молекула нуклеиновой кислоты rEVE, содержащая одну или несколько последовательностей нуклеотидных оснований, описанных в настоящей заявке, может иметь любое разнообразие форм, в том числе, без ограничения, линейной молекулы нуклеиновой кислоты, плазмиды, эукариотической вирусной молекулы, прокариотической вирусной (бактериофагальной) молекулы, искусственной хромосомы и рекомбинантной хромосомы.
В предпочтительном варианте осуществления настоящее изобретение относится к вектору экспрессии, содержащему по меньшей мере один rEVE, описанный в настоящей заявке. Такой rEVE-содержащий вектор экспрессии обеспечивает увеличенные (повышенные) уровни экспрессии в подходящей клетке-хозяине по меньшей мере одного рекомбинантного белка, кодируемого в векторе экспрессии, по сравнению с уровнем экспрессии в клетке-хозяине, несущей тот же вектор экспрессии, лишенный rEVE. Векторы экспрессии, применяемые в настоящем изобретении, включают любую векторную молекулу нуклеиновой кислоты, которая может быть создана для кодирования и экспрессии одного или нескольких рекомбинантных белков в подходящей (гомологичной) клетке-хозяине. Такие векторы экспрессии включают, без ограничения, эукариотические плазмидные векторы, эукариотические вирусные векторы, прокариотические плазмиды, бактериофагальные векторы, шаттл-векторы (например, вектор, который может реплицироваться в эукариотических и прокариотических клетках), мини-хромосомы и различные искусственные хромосомы. Предпочтительно, вектор экспрессии представляет собой плазмидный вектор экспрессии, более предпочтительно, плазмидный вектор экспрессии, который стабильно интегрируется в геном эукариотической клетки-хозяина, и еще более предпочтительно, плазмидный вектор экспрессии, который стабильно интегрируется в геном клетки-хозяина путем негомологичной рекомбинации.
В другом варианте осуществления настоящее изобретение относится к клетке-хозяину, которая содержит вектор экспрессии, содержащий rEVE, описанный в настоящей заявке, и рекомбинантный ген, который направляет экспрессию по меньшей мере одного рекомбинантного белка в клетке-хозяине. Клеткой-хозяином может быть эукариотическая или прокариотическая клетка-хозяин. Предпочтительные эукариотические клетки-хозяева для применения в настоящем изобретении включают, без ограничения, клетки-хозяева млекопитающих, клетки-хозяева растений, клетки-хозяева грибов, клетки-хозяева эукариотических водорослей, клетки-хозяева простейших, клетки-хозяева насекомых и клетки-хозяева рыб. Более предпочтительно, клетка-хозяин, используемая в настоящем описании, представляет собой клетку-хозяина млекопитающего, в том числе, но без ограничения, ооцит китайского хомяка (CHO), клетку COS, клетку Vero, клетку SP2/0, клетку миеломы NS/0, клетку зародышевой почки человека (HEK 293), клетку почки детеныша хомяка (BHK), клетку HeLa, B-клетку человека, клетку CV-1/EBNA, клетку L, клетку 3T3, клетку HEPG2, клетку PerC6 и клетку MDCK. Особенно предпочтительной является клетка CHO, которую можно обрабатывать в соответствии со стандартным протоколом обработки метотрексатом для амплификации числа копий рекомбинантных генов в векторе экспрессии, вставленном в клетку-хозяин. Клетки грибов, которые могут служить в качестве клеток-хозяев в настоящем изобретении, включают, без ограничения, клетки аскомицитов, таких как Aspergillus, Neurospora, и клетки дрожжей, в частности, дрожжей рода, выбранного из группы, состоящей из Saccharomyces, Pichia, Hansenula, Schizosaccharomyces, Kluyveromyces, Yarrowia и Candida. Предпочтительные виды дрожжей, которые могут служить в качестве клеток-хозяев для экспрессии рекомбинантных белков в соответствии с настоящим изобретением, включают, но не ограничиваются, Saccharomyces cerevisiae, Hansenula polymorpha, Kluyveromyces lactis, Pichia pastoris, Schizosaccharomyces pombe и Yarrowia lipolytica. Прокариотические клетки-хозяева, которые могут быть использованы для экспрессии рекомбинантных белков в соответствии с настоящим изобретением, включают, без ограничения, Escherichia coli, серовары Salmonella enterica, Shigella species, Wollinella succinogenes, Proteus vulgaris, Proteus mirabilis, Edwardsiella tarda, Citrobacter freundii, Pasteurella species, Haemophilus species, Pseudomonas species, Bacillus species, Staphyloccocus species и Streptococcus species. Другие клетки, которые могут быть использованы в качестве клеток-хозяев для экспрессии рекомбинантных белков по настоящему изобретению, включают клетки простейших, например, трипаносомный хозяин Leishmania tarentolae, и клетки нематоды Caenorhaditis elegans.
Полинуклеотиды rEVE, описанные в настоящей заявке, векторы, содержащие один или несколько rEVE, описанных в настоящей заявке, и клетки-хозяева, содержащие такие векторы, содержащие один или несколько rEVE, описанных в настоящей заявке, могут быть использованы в целом ряде способов, относящихся к экспрессии рекомбинантных белков, представляющих интерес.
В одном варианте осуществления настоящее изобретение относится к способу усиления экспрессии рекомбинантного белка, представляющего интерес, в клетке-хозяине, предусматривающему стадию вставки в клетку-хозяина рекомбинантного вектора экспрессии, который содержит rEVE, описанный в настоящей заявке, и рекомбинантный ген, который кодирует и направляет синтез рекомбинантного белка, представляющего интерес, в клетке-хозяине, и культивирование клетки-хозяина в условиях, способствующих экспрессии рекомбинантного белка.
В другом варианте осуществления, настоящее изобретение относится к способу получения метотрексат-резистентных клеток-хозяев, которые стабильно (в отличие от транзиторной) экспрессируют рекомбинантный белок на повышенном уровне в отсутствие метотрексата («MTX»), т.е. в отсутствие селективного давления для повышенной экспрессии рекомбинантного белка, обеспечиваемой присутствием метотрексата. Такой способ включает стадию вставки в клетки-хозяева вектора экспрессии, который содержит рекомбинантный ген, кодирующий интересующий рекомбинантный белок, rEVE, описанный в настоящей заявке, и ген, кодирующий дигидрофолатредуктазу («DHFR»); выращивания клеток-хозяев в присутствии метотрекстата для отбора клеток-хозяев, резистентных к метотрексату, которые экспрессируют интересующий рекомбинантный белок; и выделения резистентных к метотрексату клеток-хозяев, где резистентные к метотрексату клетки-хозяева экспрессируют интересующий рекомбинантный белок на уровне, который выше уровня чувствительных к метотрексату клеток-хозяев, и где резистентные к метотрексату клетки-хозяева стабильно экспрессируют повышенный уровень интересующего рекомбинантного белка при выращивании в присутствии или отсутствие метотрексата. В особенно предпочтительном варианте осуществления, rEVE, используемый в этот способе, содержит последовательность SEQ ID NO:2 или его часть, усиливающую экспрессию, при нахождении в том же векторе экспрессии, что и ген, кодирующий интересующий рекомбинантный белок, повышает уровень экспрессии рекомбинантного белка в клетке-хозяине.
В другом варианте осуществления настоящее изобретение относится к способу получения популяции клеток-хозяев с повышенной или улучшенной адаптацией к присутствию метотрексата в способе DHFR-метотрексат для усиления экспрессии рекомбинантного белка, предусматривающему стадию вставки в клетки-хозяева вектора экспрессии, содержащего ген, кодирующий интересующий рекомбинантный белок, rEVE, описанный в настоящей заявке, и ген DHFR, где популяция клеток-хозяев, содержащих вектор экспрессии, лучше адаптируется, т.е. имеет более высокую выживаемость и/или более высокую скорость роста, в присутствии метотрексата, по сравнению с популяцией клеток-хозяев, несущих вектор экспрессии, лишенный последовательности rEVE.
Еще в одном варианте осуществления настоящее изобретение относится к способу усиления амплификации (повышения) экспрессии рекомбинантного белка в клетках-хозяевах, полученных с помощью способа DHFR-метотрексат, предусматривающему стадию вставки в клетки-хозяева вектора экспрессии, содержащего рекомбинантный ген, кодирующий интересующий рекомбинантный белок, rEVE, описанный в настоящей заявке, и ген DHFR; выращивания клеток-хозяев в присутствии метотрексата для отбора метотрексат-резистентной клетки-хозяина, которая экспрессирует интересующий рекомбинантный белок; и выделения метотрексат-резистентной клетки-хозяина, где выделенная метотрексат-резистентная клетка-хозяин экспрессирует интересующий рекомбинантный белок в присутствии метотрексата на уровне, который выше уровня метотрексат-резистентной клетки-хозяина, содержащей тот же вектор экспрессии, лишенный rEVE.
Метотрексат можно удобно использовать в способах, описанных в настоящей заявке, в диапазоне от 20 нМ до 500 нМ, хотя более низкие и более высокие концентрации, такие как от 5 нМ до 10 мкМ, также могут быть с успехом использованы в таких способах для отбора на усиленную экспрессию интересующих рекомбинантных белков.
Еще в одном варианте осуществления настоящее изобретение относится к способу снижения, в основном подавления или по существу заглушения экспрессии рекомбинантного белка из вектора экспрессии. В таких способах используют векторы экспрессии, которые содержат один или несколько фрагментов rEVE, которые обеспечивают более низкие уровни экспрессии конкретного рекомбинантного генного продукта, чем обеспечивается использованием rEVE, содержащего последовательность SEQ ID NO:1 или SEQ ID NO:2. Такие фрагменты имеют особый усеченный вариант SEQ ID NO:2, включающий последовательность нуклеотидных оснований 1-1086 последовательности SEQ ID NO:2 или основания 1-461 последовательности SEQ ID NO:2. Молекула нуклеиновой кислоты, имеющая усеченную последовательность ARM2, состоящую из оснований 1-461 последовательности SEQ ID NO:2, особенно подходит для подавления или в основном заглушения экспрессии рекомбинантного белка из векторной молекулы в клетке-хозяине. Эти сведения также указывают на то, что последовательность нуклеотидных оснований 462-2422 последовательности SEQ ID NO:2 и последовательность нуклеотидных оснований 1087-2422 последовательности SEQ ID NO:2 являются наиболее предпочтительными для максимального rEVE-опосредованного повышения экспрессии рекомбинантных белков.
Рекомбинатный белок, экспрессия которого может быть усилена одной или несколькими молекулами rEVE, описанными в настоящей заявке, может представлять собой любой белок (в том числе пептиды, полипептиды и олигомерные белки), для которого функциональный ген(ы) может быть встроен методами генной инженерии в векторную молекулу нуклеиновой кислоты для экспрессии в подходящей клетке-хозяине. Такие белки включают, без ограничения, растворимые белки, мембранные белки, структурные белки (т.е. белки, которые обеспечивают клеткам, тканям или органам структуру или опору), рибосомные белки, ферменты, зимогены, молекулы антител, рецепторные белки клеточной поверхности, регуляторные белки транскрипции, регуляторные белки трансляции, белки хроматина (например, гистоны), гормоны, регуляторные белки клеточного цикла, G белки, нейроактивные пептиды, иммунорегуляторные белки (например, интерлейкины, цитокины), белки компоненты крови, белки ионных каналов, белки теплового шока, дигидрофолатредуктаза, белок устойчивости к антибиотикам, их функциональные фрагменты, их эпитоп-содержащие фрагменты и их сочетания.
Молекулы нуклеиновой кислоты, содержащие последовательность rEVE, описанного в настоящей заявке, или ее часть, также могут быть использованы в качестве зондов нуклеиновой кислоты для идентификации наличия последовательностей rEVE в других молекулах нуклеиновой кислоты посредством гибридизации нуклеиновых кислот, или в качестве источники праймеров для использования в различных методиках полимеразной цепной реакции (ПЦР), например, как могут быть использованы для манипуляций, идентификации, получения или амплификации описанных в настоящей заявке последовательностей rEVE.
Последовательности rEVE, например, описанные для ARM1 (SEQ ID NO:1) и для ARM2 (SEQ ID NO:2), могут содержать одну или несколько последовательностей участка присоединения матрикса (MAR). Последовательности MAR могут встречаться в кластерах в пределах последовательности rEVE, в том числе в кластерах в 5' и/или 3' концевых областях последовательности rEVE. Полинуклеотиды rEVE, описанные в настоящей заявке, являются подходящим источником последовательностей MAR. В соответствии с этим, настоящее изобретение относится к композициям и способам, которые подходят для увеличения последовательностей MAR в молекуле нуклеиновой кислоты, включающим вставку в молекулу нуклеиновой кислоты rEVE, описанного в настоящей заявке или части rEVE, описанного в настоящей заявке, содержащего одну или несколько последовательностей MAR.
Последовательности нуклеотидных оснований, описанные в настоящей заявке, также служат для обеспечения комплементарности их последовательностей. Молекулы ДНК и последовательности нуклеотидных оснований, описанные в настоящей заявке, также предоставляют соответствующие молекулы РНК и последовательности оснований, в которых тимин (T) заменен на урацил (U), и последовательности нуклеиновой кислоты, комплементарные им.
Краткое описание чертежей
На фиг.1 показана схематическая диаграмма плазмидного вектора экспрессии pA205, используемого для экспрессии тяжелой и каппа легкой цепей иммуноглобулина, которые образуют активную молекулу IgG1 человека против TNF-α («адалимумаб») в стабильных трансфектантах ооцитов китайского хомяка (CHO). Сокращения: «ЭНХАНСЕР» относится к промежуточному раннему энхансеру гена цитомегаловируса (CMV); «АДЕНОПРОМОТОР» относится к главному позднему промотору аденовируса; «ТЯЖЕЛАЯ ЦЕПЬ АДАЛИМУМАБА» относится к кодирующей области тяжелой цепи IgG1 адалимумаба; «SV40 Поли A» относится к сайту полиаденилирования обезьяньего вируса 40; «ТЕРМИНАТОР ГАСТРИНА» относится к сигналу терминации транскрипции гена гастрина человека; «ПРОМОТОР SV40» представляет собой промотор обезьяньего вируса 40; «DHFR» относится к мышиному гену дигидрофолатредуктазы; «TK Поли A» относится к сайту полиаденилирования гена тимидинкиназы вируса простого герпеса; «ЛЕГКАЯ ЦЕПЬ АДАЛИМУМАБА» относится к кодирующей области каппа легкой цепи адалимумаба; «ORI» относится к плазмидной ColE1 прокариотической точке начала репликации, которая функционирует в Escherichia coli; «P(BLA)» относится к прокариотическому промотору гена β-лактамазы (ген устойчивости к ампициллину) и маленькие стрелки указывают направление транскрипции; «APr» («резистентность к ампициллину») относится к кодирующей области β-лактамазы. Стрелки указыват направление транскрипции (от 5' к 3').
На фиг.2 представлена схематическая диаграмма плазмидного вектора экспрессии pA205Genomic, в котором нуклеиновая кислота ARM1 («A1»), которая имеет последовательность нуклеотидных оснований SEQ ID NO:1, вставлена в вектор экспрессии pA205 (фиг.1) выше основного позднего аденовирусного промотора и области, кодирующей тяжелую цепь IgG1 адалимумаба, и нуклеиновая кислота ARM2 («A2»), которая имеет последовательность нуклеотидных оснований SEQ ID NO:2 вставлена ниже области, кодирующей каппа легкую цепь адалимумаба. Для других сокращений смотрите описание фиг.1, приведенное выше.
На фиг.3 представлена схематическая диаграмма плазмидного вектора экспрессии pA205A1, в котором нуклеиновая кислота ARM1 («A1»), имеющая последовательность SEQ ID NO:1, вставлена в вектор экспрессии pA205 (фиг.1) выше аденопромотора и области, кодирующей тяжелую цепь IgG1 адалимумаба. Для других сокращений смотрите описание фиг.1, приведенное выше.
На фиг.4 представлена схематическая диаграмма плазмидного вектора экспрессии pA205A2, в котором нуклеиновая кислота ARM2 («A2»), имеющая последовательность нуклеотидных оснований SEQ ID NO:2, вставлена ниже области, кодирующей каппа легкую цепь адалимумаба. Для других сокращений смотрите описание фиг.1, приведенное выше.
На фиг.5 представлена схематическая диаграмма плазмидного вектора экспрессии pCHOEL246GGhum, используемого для экспрессии тяжелой и каппа легкой цепи иммуноглобулина, которые образуют активную молекулу IgG1 против EL-селектина в стабильных трансфектантах ооцитов китайского хомяка (CHO). «ТЯЖЕЛАЯ ЦЕПЬ ПРОТИВ EL-СЕЛЕКТИНА» относится к области, кодирующей тяжелую цепь IgG1 антитела человека против EL-селектина; «ЛЕГКАЯ ЦЕПЬ ПРОТИВ EL-СЕЛЕКТИНА» относится к области, кодирующей каппа легкую цепь IgG1 антитела человека против EL-селектина. Для других сокращений смотрите описание фиг.1, приведенное выше.
На фиг.6 представлена схематическая диаграмма плазмидного вектора экспрессии pA-Gen-EL-Selectin, в котором нуклеиновая кислота ARM1 («A1»), имеющая последовательность нуклеотидных оснований SEQ ID NO:1, вставлена в вектор экспрессии pCHOEL246GGhum (фиг.5) выше области, кодирующей тяжелую цепь IgG1 против EL-селектина, и нуклеиновая кислота ARM2 («A2»), имеющая последовательность нуклеотидных оснований SEQ ID NO:2, вставлена ниже области, кодирующей каппа легкую цепь против EL-селектина. Для других сокращений смотрите описание фиг.1, приведенное выше.
На фиг.7 представлена схематическая диаграмма плазмидного вектора экспрессии pA205-eGFP, используемого для экспрессии усиленного зеленого флуоресцентного белка (eGFP) в стабильных трансфектантах клеток CHO. Область, кодирующая eGFP («EGFP»), вставлена ниже основного позднего аденовирусного промотора («АДЕНОПРОМОТОР») в pA205 (фиг.1), из которого область, кодирующая легкую цепь, проксимальный промотор, и проксимальный энхансер, и область, кодирующая тяжелую цепь, были удалены. Для других сокращений смотрите описание фиг.1, приведенное выше.
На фиг.8 представлена схематическая диаграмма плазмидного вектора экспрессии pA205G-eGFP, в котором нуклеиновая кислота ARM1 («A1»), имеющая последовательность нуклеотидных оснований SEQ ID NO:1 вставлена в вектор экспрессии pA205-eGFP (фиг.7) выше области, кодирующей eGFP («EGFP»), и нуклеиновая кислота ARM2 («A2»), имеющая последовательность нуклеотидных оснований SEQ ID NO:2, вставлена ниже последовательности, кодирующей eGFP. Для других сокращений смотрите описание фиг.1, приведенное выше.
На фиг.9 представлена схематическая диаграмма плазмидного вектора экспрессии pA205A2-Spe-trunc, который по существу идентичен вектору экспрессии, pA205A2, изображенному на фиг.4, за исключением того, что ARM2 (SEQ ID NO:2) была заменена усеченным вариантом ARM2, «A2 (п.о. 1-1086)», который имеет последовательнось нуклеотидных оснований 1-1086 SEQ ID NO:2 как результат расщепления нуклеиновой кислоты ARM2 эндонуклеазой рестрикции SpeI. Для других сокращений смотрите описание фиг.1, приведенное выше.
На фиг.10 представлена схематическая диаграмма плазмидного вектора экспрессии pA205A2-Swa-trunc, который по существу идентичен вектору экспрессии pA205A2, изображенному на фиг.4, за исключением того, что ARM2 (SEQ ID NO:2) была заменена усеченным вариантом ARM2, «A2 (п.о. 1-461)», который имеет последовательность нуклеотидных оснований 1-461 последовательности SEQ ID NO:2 как результат расщепления нуклеиновой кислоты ARM2 эндонуклеазой рестрикции SwaI. Для других сокращений смотрите описание фиг.1, приведенное выше.
Подробное описание изобретения
Настоящее изобретение основано на открытии того, что одна или несколько выделенных молекул нуклеиновой кислоты (полинуклеотидных молекул), содержащих нуклеотидную последовательность SEQ ID NO:1:
aattgaattcgttccctttagtgagggttaattccgcggccgcgtcgacagctctagagggagtgccaggataggctccaaagctacacagagaatccctgtttcaaaaaaccaaaaaaaaaaaaataaaaaataaaaaataaaaagtagggtacagatctaaatagacaattctcaatagaggaatctaaaatgcctgaaagacaaataagaaagtgttcaacatccttagccatcagggaaatgcaaatcaaaacaactctgagatactatcttactcctgtcataatggccaaattcaaaaacactaatgacagttcatgttggagagaatgtggagaaagaggagcacttctccactgctggtgggagtgccaacttggacagccactttggaaatcagtatggctactcctcaagaaaatggaaatcagtttaccacaagatccagcaattccactcaggcatatacccaaaagaaccgcattcatacaagcaatatctgttcaacgatgttcatagcagctctatttgtaacagccagaaactggaagcagcctagttgcacctcaaccaaagaaatggatagagaaaatatggtacatttatgcaatggagtactactcagcggaaaagtacaatggaatcttgaaatttgcaagaaaatggatggaactagaagaaacctttctgagcaaggtaactcaatcacaaaaagacaaacatgatatgtaatcactcatatgtggattttagacacagtgtaaaggattaccagcctacaatccacactgccaaagaacctaataaacaaggaggaccctaagggagacatacatggtcccctggagatggggaatgggtcaagatatgctgagcaaagtgggaacatgggaagaggggggaaggagctaggaaattgagaaagggagaaaaggagggatgcagaggacataagggagcagaaacattgactcagggaatgaatcgaagataacaagccatggagatatcataatagagggagacattttgggtatacagagaaatcaggcacttgggaaatgtctggaaatctacaaagtataacaccaggtaacaatctaagcaacagaggagaggctaccttaaatgtcctaccctgatagtgagattgatgactaacttatatgccatgttatagccttcatccagcagctggtggaagtagaagcagacacccataactaatcacggaactgaactggaacccagattcagagaaggatgagtgaagggcacagaggtccagaccaggctggtgaaacccacaaaaacagttgaactgaatatcggtgaactcttgctccccagactgatagctggaataccagcatgggactgatccagactccaggaacatgagttcctgtgaggaaacctcggaaatctaagggacctcctgtagaagttcagtacttatccctagcataggtgtggactgagggagcccattccatatagaggaatactctctggagccaacacacatgggggtgggcataggccctttcccaaagcatacaatagactcggatgacaccctatggaaggcctcatcatccagggggagcagaaaggatatgtgatagacagggtttcagttgggagccgggtagtgggaggggagaattggtggaagaaggaaaccgggattgtcatgtaaatcaatgctgtttctaattcaaataagaaagttgaaaaaaaagaaaactgatacttattgcaccatgtaatgttatgaaatggcatttgctgttaagatgagcagtctatctgctaatctccctagctggcttgtgaacttgttatatggacaaagctggtctcaaattcaaagatatttgcgtatgtctgtctcctgagtgttgagagtacaagtatgtaccaccaatccctttgattatacaattacatttgaaaacagtttgagatttaattataactatgcaatcaattcaaaataataaatttaaatctcatatttgtctttaggtggaaatctgttaatatacatcatgattatatattttaatttattatatgttttctaggacaaaatatactaaaatgaaatctaaggctctaaacatacaaaactgtatgcatagatacatcacgatcatataatttccatgacatgctattcgggaatataatgatctacctgcagtaatgattaatttggaaatgctgaatacaactgcttctcttttgaaaatacaaattccttacatttgtaatctatttaattttaaaggttgtaccccagaaagtagtgaattcttaa
или нуклеотидную последовательность SEQ ID NO:2:
aagaatatgctcaatgtaatacccatggcaggcattcaatgtttgtctgtcttcatattgaagataaacagatgtatatcatatacaaaaatatttaatgtgaagttgtccatgtgttcaggatctatatactttcaaaaatctttttccatattcttttcttaatcctcctgaagtgtagaccattatactggaaaaccgtcactattgtacaggataggagcctttgactctgagaggatcccatacattgattgtattttcaaatatattttggctgcttttctccatgtgatatttggcaatctggagaggcatttgctcctggaaatttatcaatgttgacaatgttgtttacatgttttaagtaactattttgctaccaaggaaactgcttcactccctttcacatataaaactcataaaatattgaaaggctccaataagtttaaatcattctgtattgctcatggagatttaaatttcagtgctaattttttattagcactttaatttagaaggcaccaggtttctacaagatttaaaattattggagcatttcaaaattttataagctttccagtaaggttgtggctatgattctttgcttgtaaagtaaagtgcaatttaaagttaatttaaataatttaactgctgcagacattttaggagaattgtttgtatttcaaactgaaattcagggtagacaattagaataattttacaaagaggaaatatttttctaataataaattagtaactctaacttatattaaaatttaagtcctcattgctttcaatattttaacaaccctattgtattatttttcttataaatatttgaatttataatgatcaaagaatttctttgatacaagtgtctaaatgattaccatcaaactgttggtaggagcttgttatatatgtgttttaccttatgttttttgatacttcatttgttactgtactgtgatcgagttaattccctactgaaactaaaaatgctatcacatagttttagcatcatctgttggggaaatggctattttaactactctgagatgagaaattcaacaccattcactaacaatatagggaaactagtgttggtagattgttgagtgcttatacatatatcttgtcccatggttaactataagttggtgtctgttgctgccacccagtatggaaacacattatgttttttctttttttttttttatagccatgagaaagaccaaaattctatacttgaaaaaccgtttatattgaatgtgtattcctttcacgtccaccttagattcaactcctaagtcaatttatggtaaagcatagatcatctgcttgacaacagtttggatgatgatcttggaaaaaatgccttattatatgatacaatggaattaatgatatgagctgaataaatatatcaatattcaaatgacatactaatatttatgtctaagagaatgtgttcaaagtagatgaaagtgccttcacttgaaaattcatctgagttaaaacagatagttgcttcggttttagttatttcagaggtattcaagttgacaactaagaatagccgtcacagatacatatcaattatggacccaaattctattgaatgtcagctacatattcttatagaaaataggaacctagatgaggccgtgttcttggaatgaattttcaacacattgtatgagggttttattgtggttttggttgttgttttactttcctttttttccatagacaaatttgtcccatgtacccacaaggtgaccagtggtgacaagcctactccaggagtcctggtgaataaagattatacaagatagtagagactcatcaaaacaataagaaaaagagaatacatagggcagaaatttctcattttctcagctatggtatcctatttcactcttgtactattctactcactagaagtcagtgactaccataactcagtggctgtgccctagatcaaaggaaacattatttcaaggcatgaatgtcagccacaccttcatagtgggttacttttaatttgtttagtaagaatagacaccctactttggttaggaaacataaacttacaagacattcattggtttttctttactaaattaaatcattaagaaaatcgtaattatcagagtttaaatggcatgaaacatagaaatactcatttgctgccctgatttattttcccaagaatattttcaatgtcttctttggaagctccttggtaaatgcactttctttcactcatttatgaggtctgtgcacatcacagtcaataaaggcctgcagtattgaatcagccatacagacataattcataacatttttctatttctcatgaatcaaatattgttattgctgtacataaaataatgaatcaaagtataggtctaga
может быть вставлена методами генной инженерии в молекулы вектора экспрессии для усиления экспрессии одного или нескольких рекомбинантных белков из одного или нескольких генов, находящихся в молекулах вектора экспрессии.
Выделенная полинуклеотидная молекула, которая содержит нуклеотидную последовательность SEQ ID NO:1 или SEQ ID NO:2, в настоящем описании называется элементом рекомбинантного вектора экспрессии (rEVE). REVE по изобретению также включают, но не ограничиваются, полинуклеотидную молекулу, которая содержит усиливающую экспрессию часть последовательности, представленной в SEQ ID NO:1 («ARM1») или SEQ ID NO:2 («ARM2»). Последовательности из 3' концевой области ARM2 SEQ ID NO:2, такие как последовательности, имеющие последовательность оснований 462-2422 последовательности SEQ ID NO:2 и основания 1087-2422 последовательности SEQ ID NO:2, особенно применимы для обеспечения повышенной экспрессии рекомбинантного белка, представляющего интерес. REVE, описанный в настоящей заявке, может быть использован в сочетании с другими контрольными последовательностями, регуляторами, и процедурами, доступными в настоящее время для повышения продукции рекомбинантных белков в клетках-хозяевах.
Для более точного описания изобретения приведены определения следующих терминов:
Термин «антитело» или «молекула антитела», используемый и понимаемый в настоящем описании, в широком смысле относится к любой молекуле иммуноглобулина (Ig), состоящей из четырех полипептидных цепей, двух тяжелый (H) цепей и двух легких (L) цепей, или любого ее функционального фрагмента, мутанта, варианта или производного, которые сохраняют необходимые эпитоп-связывающие особенности молекулы Ig. Такие мутантные, вариантные или производные антитела известны из уровня техники и включают неограничивающие варианты осуществления, рассмотренные ниже.
В полноразмерном антителе каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена (CL). Области VH и VL дополнительно можно подразделить на области гипервариабельности, называемые областями, определяющими комплементарность (CDR), вперемежку с областями, которые являются более консервативными, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от аминоконца к карбоксильному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Молекулы иммуноглобулина могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2), или подкласса.
Термины «антитело» и «молекула антитела» также охватывает один или несколько фрагментов антитела, которые сохраняют способность специфически связываться с антигеном. Было показано, что антиген-связывающая функция антитела может выполняться фрагментами полноразмерного антитела. Такие антительные конструкции также могут представлять собой биспецифичные, с двойственной специфичностью, или мультиспецифичные форматы; специфически связывающиеся с двумя или несколькими различными антигенами. Примеры связывающих фрагментов, которые охватывает термин «антитело», включают фрагмент Fab, т.е. моновалентный (один связывающий сайт) фрагмент, состоящий из VL, VH, CL и CH1 доменов; фрагмент F(ab')2, т.е. бивалентный фрагмент (два связывающих сайта), содержащий два фрагмента Fab, связанных дисульфидным мостиком в шарнирной области; и фрагмент Fd, состоящий из VH и CH1 доменов; фрагмент Fv, состоящий из доменов VL и VH одиночного плеча антитела; одиночный домен антитела (dAb) (Ward et al., Nature, 341: 544-546 (1989); Winter et al., публикация PCT WO 90/05144 A1, включена в настоящее описание в качестве ссылки), который содержит одиночный вариабельный домен; двойной вариабельный домен антител (DVD) (смотрите, например, публикацию PCT WO 2007/024715); и выделенные области, определяющие комплементарность (CDR). Более того, хотя два домена фрагмента Fv, VL и VH, кодируются отдельными генами, они могут быть объединены, с помощью рекомбинантных способов, посредством синтетического линкера, который позволяет получить их в виде одной белковой цепи, в которой области VL и VH объединяются в пару с образованием моновалентных молекул (известных как одноцепочечные Fv (scFv), смотрите, например, Bird et al. Science, 242: 423-426 (1988); Huston et al., Proc. Natl. Acad. Sci. USA, 85: 5879-5883 (1988)). Такие одноцепочечные антитела охватываются терминами «антитело» и «молекула антитела». Диатела также охватываются терминами «антитело» и «молекула антитела». Диатела представляют собой бивалентные, биспецифичные антитела, в которых домены VH и VL экспрессируются на одной полипептидной цепи, но используя линкер, который является слишком коротким, чтобы была возможность образования пары между двумя доменами на одной и той же цепи, тем самым заставляя домены образовывать пары с комплементарными доменами другой цепи и создавая два антиген-связывающих сайта (смотрите, например, Holliger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993); Poljak et al., Structure, 2: 1121-1123 (1994)). Термины «антитело» и «молекула антитела» также охватывает двойной вариабельный домен молекул иммуноглобулинов, например, DVD-IG™ (Abbott Laboratories) двойной вариабельный домен молекул иммуноглобулинов (смотрите, например, публикацию PCT WO 2007/024715).
Используемый в настоящем описании «вектор» относится к любому генетическому элементу, способному служить в качестве носителя генетического переноса, экспрессии или репликации для чужеродного полинуклеотида в клетку-хозяина. Например, вектор может представлять собой искусственную хромосому или плазмиду и может быть способен к стабильной интеграции в геном клетки-хозяина, или он может существовать в виде независимого генного элемента (например, эписомы, плазмиды). Вектор может существовать в виде одиночного полинуклеотида или в виде двух или нескольких отдельных полинуклеотидов. Векторы в клетке-хозяине могут быть однокопийными векторами или мультикопийными векторами. Предпочтительные векторы для использования в настоящем изобретении представляют собой молекулы векторов экспрессии, в которых один или несколько функциональных генов могут быть вставлены в молекулу вектора, в соответствующей ориентации и близости к контрольным элементам экспрессии, находящимся в молекуле вектора экспрессии, таким образом, чтобы направлять экспрессию одного или нескольких белков, когда молекула вектора находится в соответствующей (гомологичной) клетке-хозяине.
Векторы экспрессии могут включать, без ограничения, эукариотические плазмидные векторы, эукариотические вирусные векторы, прокариотические плазмиды, бактериофагальные векторы, шаттл-векторы (например, вектор, который может реплицироваться в эукариотических и прокариотических клетках), мини-хромосомы, и различные искусственные хромосомы (например, бактериальные искусственные хромосомы (BAC), искусственные хромосомы дрожжей (YAC)). Предпочтительно, вектор экспрессии, используемый в настоящем изобретении, представляет собой плазмиду, более предпочтительно, плазмидный вектор экспрессии, который стабильно интегрируется в геном клетки-хозяина, и, еще более предпочтительно, плазмидный вектор экспрессии, который стабильно экспрессируется в геном клетки-хозяина посредством негомологичной рекомбинации. «Шаттл-вектор» (или бифункциональный вектор) относится к любому вектору, который может реплицироваться в более чем одном типе организмов. Например, шаттл-вектор, который может реплицироваться как в Escherichia coli (E. coli), так и Saccharomyces cerevisiae (S. cerevisiae) может быть сконструирован путем связывания последовательностей из плазмиды E. coli с последовательностями из дрожжевой плазмиды 2 мкм.
Системы экспрессии включают вектор экспрессии и подходящую (гомологичную) клетку-хозяина, которая будет экспрессировать рекобинантный белок (белки), кодируемый в векторе экспрессии. Система экспрессии может представлять собой систему стабильной экспрессии или систему транзиторной экспрессии. В системе стабильной экспрессии, вектор экспрессии стабильно интегрируется в геном клетки-хозяина или непрерывно реплицируется, и успешно переходя в обе дочерние клетки, таким образом, что клетки-хозяева способны продолжать экспрессировать рекомбинантный белок (белки) при культивировании в соответствующих условиях. В транзиторной системе экспрессии, молекулы вектора экспрессии не остаются в обеих дочерних клетках и со временем утрачиваются или так уменьшаются в растущей клеточной культуре, что экспрессия рекомбинантного белка (белков) из культуры в конечном счете прекратится или будет такой низкой, что будет неприменима в для большинства целей получения. Векторы экспрессии, используемые в примерах, приведенных ниже, представляют собой типы шаттл-векторов, которые могут реплицироваться до сравнительно высокого числа копий, когда вставлены (например, путем трансформации) в клетки E. coli и которые также могут быть встроены (например, путем трансфекции) в стабильные ооциты китайского хомячка (CHO) для получения стабильной экспрессии кодируемого ими генного продукта (продуктов), представляющего интерес (Kaufman et al., Molec. Cell. Biol, 5: 1750-1759 (1980)) или которые могут быть транзиторными в клетках HEK 293 (Durocher et al., Nucleic Acids Res., 30: E9). Таким образом, полинуклеотидная молекула rEVE, описанная в настоящей заявке, может быть использована для усиления экспрессии рекомбинантного белка (белков), представляющих интерес, как в стабильной, так и в транзиторной системах экспрессии.
Приводимые в качестве примера эукариотические векторы, которые могут быть использованы в настоящем изобретении, включают, но не ограничиваются, вирусные и невирусные векторы. Вирусные векторы включают, без ограничения, ретровирусные векторы (в том числе лентивирусные векторы); аденовирусные векторы, в том числе способные к репликации, неспособные к репликации и «gutless» их формы; адено-ассоциированные вирусные векторы (AAV); векторы обезьяньего вируса 40 (SV-40); векторы вируса папилломы крупного рогатого скота; векторы вируса Эпштейна-Барра; векторы вируса герпеса, векторы вируса оспы; векторы вируса мышиного лейкоза Молони; векторы вируса саркомы мышей Харви, векторы вируса опухоли молочных желез мышей, и векторы вируса саркомы Рауса. Бакуловирусные векторы также хорошо известны и подходят для экспрессии в клетках насекомых.
Целый ряд векторов, подходящих для экспрессии в эукариотических или прокариотических клетках, хорошо известны из уровня техники, и многие коммерчески доступны. Коммерческие источники включают, без ограничения, Stratagene (La Jolla, California), Invitrogen (Carlsbad, California), Promega (Madison, Wisconsin) и Sigma-Aldrich (St. Louis, Missouri). Многие векторные последовательности доступны через GenBank, и дополнительная информация, касающаяся векторов, доступна в интернете через Riken BioSource Center.
Молекула вектора обычно содержит одну точку начала репликации и также может содержать ген «маркера» или «селектируемого маркера», по которому вектор может быть идентифицирован или выбран при включении в клетку-хозяина. Такие подходящие маркеры могут, без ограничения, придавать резистентность к антибиотикам, обеспечивать функции, которые дают преимущества селективного роста по сравнению с клетками, которые лишены таких функций, или обеспечивают средства для простой идентификации клеток, которые обладают вектором (например, система Colorigenic). Такие маркеры хорошо известны из уровня техники и выбор соответствующего селектируемого марекра (маркеров) для использования в молекуле вектора будет зависеть от используемой клетки-хозяина и какие свойства желательны для клетки-хозяина, содержащей вектор.
Термины «функциональная генная конструкция», «функциональный ген» и «ген» относятся к полинуклеотиду, который содержит кодирующую последовательность для одного или нескольких белков, которая оперативно связана с промоторной последовательностью и возможно другими транскрипционными регуляторными последовательностями для направления правильной транскрипции кодирующей последовательности в матричную РНК (мРНК) и которая также содержит любую из целого ряда трансляционных регуляторных последовательностей, которые могут быть необходимы или желательны для направления правильной трансляции мРНК в желаемый белок в заданной клетке-хозяине. Трансляционный старт-кодон (например, ATG) и сайт связывания с рибосомой обычно требуются в мРНК для трансляции, происходящей в прокариотических и эукариотических клетках. Также могут быть использованы трансляционные регуляторные последовательности, в зависимости от клетки-хозяина, в том числе, но не только, сайт сплайсинга РНК и сайт полиаденилирования.
Термин «рекомбинантный» используется в настоящей заявке для описания измененных нуклеиновых кислот или нуклеиновых кислот, подвергавшихся манипуляциям, нуклеиновых кислот, выделенных из окружения, в котором они находятся в природе, клеток-хозяев, трансфицированных или иным образом подвергавшихся манипуляциям для содержания экзогенных нуклеиновых кислот, или белков, экспрессированных синтетически посредством манипуляции с выделенной ДНК или трансформации клеток-хозяев. «Рекомбинатный» является термином, который особенно охватывает молекулы ДНК, которые были сконструированы in vitro, используя способы генной инженерии, и применение термина «рекомбинантный» как прилагательного для описания молекулы, конструкции, вектора, клетки, белка, полипептида или полинуклеотида, особо исключает такие природные молекулы, конструкции, векторы, клетки, белки, полипептиды или полинуклеотиды. В частности, «рекомбинантный белок» для целей настоящего изобретения представляет собой белок, который экспрессируется клеткой-хозяином, с которой были произведены манипуляции путем включения по меньшей мере одного генетического элемента, который не встречался в природе в клетке-хозяине до экспрессии этого белка. Белок, кодирующая последовательность для которого была искусственным путем вставлена в клетку-хозяина, ставшую способной экспрессировать этот белок, например, трансфицированную вектором экспрессии, содержащим последовательность, кодирующую белок, является «рекомбинантным белком», экспрессированным клеткой-хозяином.
«Клетка-хозяин» относится к любой клетке, т.е. любой эукариотической или прокариотической клетке, в которую может быть вставлена молекула вектора. В соответствии с настоящим изобретением, предпочтительными клетками-хозяевами являются эукариотические или прокариотические клетки, в том числе, но не только, клетки животных (например, клетки-хозяева млекопитающих, птиц и рыб), клетки растений (в том числе эукариотические клетки водорослей), клетки грибов, клетки бактерий и клетки простейших. Клетки-хозяева, используемые в настоящем изобретении, могут быть любой генетической конструкции, но предпочтительно являются гаплоидными или диплоидными клетками. Предпочтительные клетки-хозяева млекопитающих, используемые в настоящем изобретении, включают, без ограничения, ооциты китайского хомяка (CHO), клетки COS, клетки Vero, клетки SP2/0, клетки миеломы NS/0, клетки эмбриональных почек человека (HEK 293), клетки детеныша хомяка (BHK), клетки HeLa, В-клетки человека, клетки CV-1/EBNA, L клетки, клетки 3T3, клетки HEPG2, клетки PerC6 и клетки MDCK. Предпочтительными клетками насекомых являются Sf9. Клетки грибов, которые могут служить в качестве клеток-хозяев в этом изобретении включают, без ограничения, клетки аскомицетов, таких как Aspergillus, Neurospora, и клетки дрожжей, в частности дрожжей родов Saccharomyces, Pichia, Hansenula, Schizosaccharomyces, Kluyveromyces, Yarrowia и Candida. Особенно предпочтительные дрожжевые грибковые виды, которые могут служить в качестве клеток-хозяев для экспрессии рекомбинантных белков представляют собой Saccharomyces cerevisiae, Hansenula polymorpha, Kluyveromyces lactis, Pichia pastoris, Schizosaccharomyces pombe и Yarrowia lipolytica. Предпочтительные прокариотические клетки, которые могут служить в качестве клеток-хозяев в настоящем изобретении, включают, без ограничения, Escherichia coli, серовары Salmonella enterica, Shigella species, Wollinella succinogenes, Proteus vulgaris, Proteus mirabilis, Edwardsiella tarda, Citrobacter freundii, Pasteurella species, Haemophilus species, Pseudomonas species, Bacillus species, Staphyloccocus species и Streptococcus species. Другие клетки, которые могут быть подходящими клетками-хозяевами для экспрессии рекомбинантных белков в соответствии с настоящим изобретением, включают простейших, таких как трипаносомный хозяин Leishmania tarentolae, и клетки нематоды Caenorhaditis elegans. Различные векторы экспрессии доступны для использования в упомянутых выше клетках.
Существует целый ряд способов и протоколов для вставки молекул вектора в клетки, в том числе, но без ограничения, трансформация, трансфекция, слияние клеток или протопластов, применение химической обработки (например, обработка протопластов полиэтиленгликолем, обработка кальцием, трансфектирующими агентами, такими как трансфекционные реагенты LIPOFECTIN® и LIPOFECTAMINE® доступные от фирмы Invitrogen (Carlsbad, California), применение различных типов липосом, применение механического устройства (например, микробусы, покрытые нуклеиновой кислотой), применение электрического заряда (например, электропорации), и их сочетания. Определение конкретного протокола и/или способов, используемых для вставки конкретной молекулы вектора, описанной в настоящей заявке в желаемую клетку-хозяина, находится в компетенции практикующего специалиста.
Способы «переноса информации последовательности нуклеиновой кислоты» из одного вектора или других молекул нуклеиновой кислоты в другую не ограничиваются в настоящем изобретении и включают любую из целого ряда технологию генной инженерии или рекомбинантных нуклеиновых кислот, известных из уровня техники. Особенно предпочтительные технологии переноса включают, но не ограничиваются, технологии рестрикционного расщепления и лигирования, протоколы полимеразной цепной реакции (ПЦР) (используя специфические или произвольные последовательности праймеров), технологии гомологичной рекомбинации (используя полинуклеотидные области гомологии) и негомологичной рекомбинации (например, случайную вставку). Молекулы нуклеиновой кислоты, содержащие специфическую последовательность, также могут быть синтезированы, например, используя автоматизированный синтезатор нуклеиновых кислот, и полученный в результате продукт, нуклеиновую кислоту, затем включают в другую молекулу нуклеиновой кислоты любой из упомянутых выше методик.
Применение технологии генной инженерии обязательно требует выращивания рекомбинантных клеток-хозяев (например, трансфектантов, трансформантов) в различных специализированных условиях, определенных требованиями клеток и конкретным состоянием клеток, по желанию практикующего специалиста. Например, клетка-хозяин может обладать (как определено ее генетическим расположением) определенными пищевыми требованиями, или конкретной резистентностью или чувствительностью к физическим (например, температуре) и/или химическим (например, антибиотикам) условиям. Кроме того, особые условия культивирования могут быть необходимы для регуляции экспрессии желаемого гена (например, применение индуцибельные промоторов), или для инициации конкретного состояния клетки (например, спаривающаяся или спорулирующая дрожжевая клетка). Эти различные условия и требования, удовлетворяющие таким условиям, понятны специалистам, практикующим в этой области.
В контексте увеличения (повышения) экспрессии рекомбинантных белков в клетке-хозяине, используя стандартную процедуру амплификации дигидрофолатредуктаза (DHFR)-метотрексат (MTX), термины «стабильность» и «стабильная экспрессия» относятся к способности культуры клеток продолжать экспрессировать рекомбинантный белок на увеличенном (повышенном) уровне при выращивании в отсутствие метотрексата, т.е. в отсутствие селективного давления для повышенной экспрессии, обеспечиваемого наличием метотрексата, используемого в процедуре амплификации. Таким образом, после выделения, стабильно трансфицированная клетка-хозяин может экспрессировать рекомбинантный белок, представляющий интерес, в присутствии или отсутствии метотрексата.
В контексте амплификации экспрессии рекомбинантного белка в клетке-хозяине, используя стандартную процедуру амплификации дигидрофолатредуктаза (DHFR)-метотрексат (MTX), «повышенная адаптация» или «улучшенная адаптация» к присутствию метотрексата относится к более высокой выживаемости и/или более высокой скорости роста в присутствии метотрексата культуры клеток-хозяев, несущих векторы экспрессии, содержащие rEVE, описанный в настоящей заявке, по сравнению с выживаемостью и/или скоростью роста в присутствии метотрексата культуры клеток-хозяев, несущих векторы экспрессии, которые лишены rEVE. «Выживаемость» популяции клеток-хозяев относится к способности популяции клеток-хозяев к росту и репродукции в присутствии селективного давления (например, метотрексата).
«Гомология последовательностей» является знакомой концепцией для практикующих специалистов в этой области. Для определения процента гомологии двух аминокислотных последовательностей или двух нуклеиновых кислот, последовательности выравнивают для целей оптимального сравнения (например, разрывы могут быть введены в последовательность первой аминокислотной последовательности или нуклеиновой кислоты для оптимального выравнивания со второй сравниваемой аминокислотной последовательностью или последовательностью нуклеиновой кислоты). Затем сравнивают аминокислотные остатки или нуклеотиды в соответствующих положениях аминокислот или нуклеотидов. В тех случаях, когда положение в первой последовательности занято тем же аминокислотным остатком или нуклеотидом, что и соответствующее положение во второй последовательности, тогда молекулы являются гомологичными в этом положении (например, как используется в настоящем описании «гомология» аминокислот или нуклеиновых кислот эквивалентна «идентичности» аминокислот или нуклеиновых кислота). Гомология последовательностей нуклеиновой кислоты может быть определена как степень идентичности между двумя последовательностями. Гомология может быть определена с помощью компьютерных программ, известных в этой области, таких как программное обеспечение GAP, поставляемое в пакете программ GCG. Смотрите, Needleman and Wunsch, J. Mol. Biol, 48: 443-453 (1970).
Композиция или способ, описанный в настоящей заявке как «содержащий» один или несколько названных элементов или стадий, представляет собой открытый формат, что обозначает, что названные элементы или стадии являются обязательными, но другие элементы или стадии могут быть добавлены в объеме этой композиции или способа. Во избежание многословности, также понятно, что любая композиция или способ, описанный как «содержащий» (или «содержит») один или несколько названных элементов или стадий, также описывает соответствующую, более ограниченную, композицию или способ, «состоящую по существу из (или «состоит по существу из») тех же названных элементов или стадий, означая, что эта композиция или способ включает названные обязательные элементы или стадии и также может включать дополнительные элементы или стадии, которые по существу не влияют на основную и новую характеристику(и) композиции или способа. Также понятно, что любая композиция или способ, описанные в настоящей заявке как «содержащие» или «состоящие по существу из» одного или нескольких названных элементов или стадий также описывают соответствующую, более ограниченную и «закрытого» формата композицию или способ, «состоящий из» (или «состоит из») названных элементов или стадий, чтобы исключить любой другой неназванный элемент или стадию. В любой описанной в настоящей заявке композиции или способе, известные или описанные эквиваленты любого названного обязательного элемента или стадии могут быть заменены таким элементом или стадией.
Также понятно, что элемент или стадия «выбранная из группы, состоящей из» относится к одному или нескольким элементам или стадиям в последующем перечне, в том числе сочетания любых двух или нескольких из перечисленных элементов или стадий.
Если не указано иное, значение других терминов будет ясно из контекста или будет понятно, что являются теми же, как принято, и используется специалистами в данной области.
Специалистам в данной области понятно, что последовательность нуклеиновой кислоты (последовательность нуклеотидных оснований), описанная в настоящей заявке, относится к ДНК, РНК и последовательностям, комплементарным им.
Элементы рекомбинантного вектора экспрессии (rEVE) по настоящему изобретению были сначала выделены из областей геномной ДНК, фланкирующих любую сторону сайта интеграции вектора экспрессии, находящегося в клетках трансфицированной DUXB11 CHO клеточной линии, которая экспрессировала исключительно высокие уровни молекул антитела против IL-12 из генов, находящихся в векторе экспрессии. Клонирование и секвенирование этих фланкирующих областей DUXB11 CHO геномной ДНК выявило последовательность SEQ ID NO:1 и SEQ ID NO:2. Последовательность 2329 оснований SEQ ID NO:1 также называется в настоящей заявке «ARM1», а последовательность 2422 основания SEQ ID NO:2 называется «ARM2». Было показано, что фланкирующая ARM1 последовательность ДНК расположена выше направления транскрипции гена тяжелой цепи интегрированного вектора экспрессии, а фланкирующая ARM2 последовательность ДНК расположена ниже направления транскрипции гена легкой цепи интегрированного вектора экспрессии (смотрите раздел примеры, приведенный ниже).
Молекулы ДНК, содержащие ARM1 и ARM2, были вставлены отдельно или в сочетании с векторами экспрессии для определения, могло ли их присутствие влиять на уровень экспрессии различных рекомбинантных белков в клетках-хозяевах, содержащих векторы экспрессии. ДНК, содержащие как ARM1, так и ARM2, обеспечивают повышенные уровни экспрессии рекомбинантных белков в клетках-хозяевах по сравнению с уровнями продукции, полученными в отсутствие этих последовательностей (смотрите приведенные ниже примеры). Соответственно, молекулы нуклеиновой кислоты, содержащие ARM1 и ARM2, являются примерами элементов рекомбинантного вектора экспрессии (rEVE). Обычно, повышенный уровень продукции, получаемый с полинуклеотидом ARM1 несколько ниже уровня, получаемого с полинуклеотидом ARM2, или с сочетанием полинуклеотидов ARM1 и ARM2.
Во всех случаях, когда одна или обе ARM1 и ARM2 были использованы в конструировании векторов экспрессии для продукции рекомбинантного белка, представляющего интерес, в соответствии с настоящим изобретением, уровень экспрессии белка был больше при использовании элементов усиления экспрессии ARM1 и/или ARM2. Непосредственно наблюдались повышенные сравнительные уровни экспрессии рекомбинантного белкового продукта более чем в 2 раза, более чем в 3 раза, более чем в 4 раза, более чем в 5 раз, более чем в 6 раз, более чем в 9 раз, более чем в 10 раз, более чем в 13 раз, более чем в 16 раз и более чем в 18 раз по сравнению с системами контрольной экспрессии, не имеющими энхансеров ARM. (Смотрите приведенные ниже примеры). Более того, высокий уровень экспрессии, полученный с использованием векторов экспрессии, несущих ARM1 или ARM2, или и ARM1, и ARM2, стабильно поддерживается на протяжении периода времени в трансфицированных клетках-хозяевах.
Последовательности ARM1 и ARM2 имеют области, которые относительно богаты последовательностями для областей присоединения матрикса/остова (MAR/SAR; смотрите, например, Michalowski et al., Biochemistry, 38: 12795-12804 (1999); Tikhonov et al., The Plant Cell, 12: 2490-264 (2000) патент США № 7129062; Bode et al., Int. Rev. Cytol, 162A: 389-454 (1995); Bode et al., Crit. Rev. Eukaryotic Gene Expression, 6: 115-138 (1996)). В случае ARM1, мотивы последовательности MAR в основном сконцентрированы в 3' концевой области последовательности, тогда как в случае ARM2, кластеры мотивов MAR появляются как в 5', так и в 3' концевых областях последовательности с меньшим количеством мотивов MAR, расположенных в области середины последовательности. Делеционный анализ указывает на то, что приблизительно 3' концевая область нуклеиновой кислоты ARM2 из 1260 пар оснований содержит последовательности, которые являются главными для усиленной ARM2 активности экспрессии белка (смотрите пример 6, приведенный ниже).
Молекулы rEVE по настоящему изобретению включают те молекулы нуклеиновой кислоты, которые содержат усиливающие экспрессию части или фрагменты последовательностей ARM1 и ARM2. Такими частями последовательностей ARM1 и ARM2, усиливающими экспрессию, являются те, которые при нахождении в том же векторе экспрессии в качестве гена, кодирующего интересующий рекомбинантный белок, усиливают уровень экспрессии рекомбинантного белка в клетке-хозяине, содержащей вектор экспрессии по сравнению с уровнем экспрессии, полученном в отсутствие таких частей или фрагментов последовательностей ARM1 или ARM2.
REVE, описанный в настоящей заявке, может быть использован отдельно или в сочетании с любым другим регуляторным элементом или системой усиления экспрессии для повышения уровня продукции желаемого рекомбинантного белка (белков) в клетке-хозяине. Другие такие последовательности и системы могут включать, без ограничения, применение регуляторных промоторов для контроля или оптимизации транскрипции гена (генов), кодирующих интересующий рекомбинантный белок (белки), применение сигнальной последовательности, которая направляет секрецию рекомбинантного белка (белков) из клетки-хозяина, и применение способов амплификации генов, такие как протокол амплификации дигидрофолатредуктаза (DHFR)-метотрекса (MTX) или протокол глутаминсинтетазы. В процедуре амплификации DHFR-MTX, клетки-хозяева, несущие вектор экспрессии, который содержит ген для DHFR, отбирают по резистентности к повышающимся концентрациям метотрексата (смотрите, например, Kaufman, R.J., In Genetic Engineering: Principles and methods (ed. J.K. Setlow), volume 9, page 155 (Plenum Publishing, New York, 1987)). Обычно, при повышении уровня резистентности к метотрексату, существует сопровождающая амплификация числа копий рекомбинантного гена (генов) наряду с соответствующей амплификацией (повышением) уровня экспрессии рекомбинантного белка из такого амплифицированного гена(ов).
Последовательности нуклеиновой кислоты SEQ ID NO:1 и SEQ ID NO:2 были идентифицированы из молекул ДНК, полученных из клеточной линии DUXB11 CHO. Любой из целого ряда способов может быть использован для получения молекул нуклеиновой кислоты, содержащих нуклеотидную последовательность SEQ ID NO:1, SEQ ID NO:2, или частей любой из этих последовательностей. Такие способы включают в себя, без ограничения, клонирование одной или нескольких ДНК молекул rEVE, содержащих такие последовательности вне геномной ДНК клеток DUXB11 CHO, протоколы твердофазного синтеза нуклеиновых кислот для получения полинуклеотида, содержащего такие последовательности, технологии рекомбинантных нуклеиновых кислот, протоколы полимеразной цепной рекации (ПЦР), автоматизированные синтезаторы нуклеиновых кислот, и их сочетания. Полинуклеотидную молекулу rEVE, описанную в настоящей заявке, также можно приобрести у коммерческих поставщиков молекулы нуклеиновой кислоты в соответствии с пожеланиями заказчика. Способ, которым получен или синтезирован rEVE, не ограничен, и практикующий специалист может решить, какой способ или сочетание способов является наиболее подходящим для получения конкретного rEVE, описанного в настоящей заявке.
REVE, описанный в настоящей заявке, может быть вставлен в вектор экспрессии для усиления экспрессии любого из целого ряда белков (включая пептиды, полипептиды, и олигомерные белки) из вектора экспрессии в клетке-хозяине. Если нуклеотидная кодирующая последовательность(и) известна или доступна на молекуле нуклеиновой кислоты (ДНК или РНК), кодирующая последовательность(и) или целый функциональный ген для интересующего белка может быть вставлен в вектор экспрессии, используя любой из целого ряда способов, доступных в этой области. Кодирующие последовательности оперативно связаны с промотором, который будет функционировать в этом типе клетки-хозяина, для которой желательна экспрессия. Дополнительные транскрипционные и трансляционные последовательности также могут быть встроены методами генной инженерии в вектор для соответствующей экспрессии желаемого белка (белков) в клетке-хозяине.
Экспрессия любого из целого ряда белков (в том числе пептидов, полипептидов, олигомерных белков) из вектора экспрессии в соответствующей клетке-хозяине может быть усилена одним или несколькими описанными в настоящей заявке rEVE, включая, но не ограничиваясь, растворимые белки, мембранные белки, структурные белки (т.е. белки, которые обеспечивают структуру или поддержку клеткам, тканям или органам), рибосомальные белки, ферменты, зимогены, различные молекулы антител (в том числе, но не только, антитела к TNF-α, например, адалимумаб; антитела к селектинам; антитела к иммунорегуляторным белкам, например, антитела к IL-13; двойной вариабельный домен молекул иммуноглобулинов, например, DVD-IG™ двойной вариабельный домен молекул иммуноглобулинов; антитела к рецепторам клеточной поверхности), рецепторные белки клеточной поверхности, транскрипционные регуляторные белки, трансляционные регуляторные белки, белки хроматина, гормоны, регуляторные белки клеточного цикла, G белки, нейроактивные пептиды, иммунорегуляторные белки (например, интерлейкины, цитокины, лимфокины), белковые компоненты крови, белки ионных каналов, белки теплового шока, дигидрофолатредуктаза, белок резистентности к антибиотикам, функциональный фрагмент любого из предыдущих белков, эпитоп-содержащий фрагмент любого из предыдущих белков, и их сочетания.
Рекомбинантный белок, представляющий интерес, может быть получен посредством транскрипции и трансляции гена или генов, которые кодируют рекомбинантный белок и находятся в молекуле вектора экспрессии, описанной в настоящей заявке. Такая транскрипция и трансляция гена или генов на векторе экспрессии, в том числе, описанных в настоящем описании, может осуществляться с помощью системы бесклеточной транскрипции/трансляции или используя подходящую клетку-хозяина, которая содержит молекулу вектора экспрессии и которая имеет соответствующий механизм клеточной транскрипции и трансляции, необходимый для получения интересующего рекомбинантного белка из гена или генов, находящихся на молекуле вектора экспрессии.
Области присоединения матрикса (MAR), также называемые областями присоединения остова (SAR), были первоначально идентифицированы как фрагменты хромосомной ДНК, которые связываются с препаратами ядерных белков, которые, по-видимому, образуют остов или матрикс в эукариотических ядрах. Считается, что MAR находятся в петлях хроматина, которые присоединяются к ядерному матриксу и определяют или разграничивают отдельные структурные единицы хроматина. MAR были связаны с некоторыми энхансерными последовательностями и/или связаны с рядом процессов, которые могут происходить в хроматине, включая транскрипцию, трансгенную экспрессию, трансгенную пересборку, рекомбинацию, репликацию и стабилизацию трансфекций (смотрите, например, Michalowski et al., Biochemistry, 38: 12795-12804 (1999); Zhong et al., Proc. Natl. Acad. Sci. USA, 96(21): 11970-11975 (1999); Tikhonov et al., The Plant Cell. 12: 249-264 (2000); Zhou et al., Gene, 277: 139-144 (2001); Sumer et al., Genome Research, 13: 1737-1743 (2003); патент США № 7129062; Bode et al., Int. Rev. Cytol, 162A: 389-454 (1995); Bode et al., Crit. Rev. Eukaryotic Gene Expression, 6: 115-138 (1996)). ARM1 (SEQ ID NO:1) и ARM2 (SEQ ID NO:2) имеют целый ряд элементов MAR, которые, по-видимому, расположены преимущественно в кластерах в 3' и/или 5' концевых областях. ARM1 содержит кластер элементов MAR в 3' концевой области. В случае ARM2, элементы MAR могут быть найдены по всей длине этой последовательности rEVE с кластерами мотивов MAR, расположенных, как в 5', так и в 3' концевых областях. Очевидно, векторы и другие молекулы нуклеиновой кислоты, несущие последовательности ARM1 и ARM2, являются удобными источниками элементов MAR и кластеров элементов MAR. Соответственно, ARM1, ARM2 и их MAR-содержащие части могут быть использованы для увеличения количества элементов MAR в интересующей молекуле нуклеиновой кислоты, используя любой из различных способов, доступных в этой области для рекомбинации или иного переноса информации последовательности нуклеиновой в молекулу нуклеиновой кислоты.
Молекулы нуклеиновой кислоты, содержащие последовательность rEVE, описанного в настоящей заявке, или его часть, также могут быть использованы в различных процедурах, известных в этой области для манипуляции, идентификации, получения или амплификации последовательностей rEVE в других молекулах нуклеиновой кислоты. Такие процедуры могут включать, без ограничения, применение rEVE или его части в качестве зонда в любом из различных способов гибридизации нуклеиновых кислот, известных в этой области или в качестве праймера в любой из различных процедур полимеразной цепной реакции (ПЦР), известных в этой области.
Полинуклеотидная молекула rEVE, описанная в настоящей заявке, может быть использована в способах получения интересующего рекомбинантного белка. Предпочтительно, такой способ получения рекомбинантного белка, представляющего интрес, включает рекомбинантный вектор экспрессии, описанный в настоящей заявке, который содержит один или несколько рекомбинантных генов, кодирующих интересующий рекомбинантный белок, и по меньшей мере одну полинуклеотидную молекулу rEVE, описанную в настоящей заявке, и транскрипцию и трансляцию одного или нескольких рекомбинантных генов, находящихся в рекомбинантном векторе экспрессии для получения интересующих рекомбинантных белков. Транскрипция и трансляция одного или нескольких рекомбинантных генов из вектора экспрессии предпочтительно осуществляется в клетке-хозяине, которая содержит вектор экспрессии и культивируется в условиях, способствующих экспрессии интересующего рекомбинантного белка. Полинуклеотидная молекула rEVE может быть использована для повышения уровня экспрессии одного или нескольких рекомбинантных белков, представляющих интерес, из вектора экспрессии в клетке-хозяине, экспрессированных транзиторно (например, в трансфицированных клетках-хозяевах COS или HEK 293), или экспрессированных стабильно (например, в трансфицированной клетке-хозяине CHO). Транскрипция и трансляция одного или нескольких рекомбинантных генов из вектора экспрессии, который несет rEVE, описанный в настоящей заявке, также может осуществляться с использованием бесклеточной системы транскрипции/трансляции in vitro, доступной в этой области.
Полинуклеотидная молекула rEVE, описанная в настоящей заявке, может быть использована в получении клетки-хозяина, которая стабильно (в отличие от транзиторно) экспрессирует повышенные уровни рекомбинантного белка, в тех случаях, когда уровень экспрессии был амплифицирован (повышен) с использованием процедуры амплификации DHFR-метотрексат. Такие клетки-хозяева являются метотрексат-резистентными (MTX-резистентными) клетками, которые будут продолжать экспрессировать повышенные уровни рекомбинантного белка не только при выращивании в присутствии метотрексата, а также при выращивании в отсутствие метотрексата, т.е. при выращивании в отсутствие селективного давления для повышенной экспрессии, обеспечиваемой присутствием метотрексата. В предпочтительном варианте осуществления, такой способ получения метотрексат-резистентной клетки-хозяина включает стадии:
вставки в клетки-хозяева вектора экспрессии, содержащего:
рекомбинантный ген, кодирующий интересующий рекомбинантный белок,
rEVE или его часть, усиливающую экспрессию, и
ген дигидрофолатредуктазы (DHFR),
выращивания клеток-хозяев в присутствии метотрексата для отбора метотрексат-резистентной клетки-хозяина, которая экспрессирует интересующий рекомбинантный белок, и
выделение метотрексат-резистентной клетки-хозяина;
где выделенная метотрексат-резистентная клетка-хозяин экспрессирует интересующий рекомбинантный белок на уровне, который выше уровня чувствительной к метотрексату клетки-хозяина, и где указанная метотрексат-резистентная клетка-хозяин стабильно экспрессирует повышенный уровень рекомбинантного белка при выращивании в присутствии или отсутствие метотрексата. Предпочтительно, rEVE содержит SEQ ID NO:1, SEQ ID NO:2 или их часть, усиливающую экспрессию. Более предпочтительно, rEVE содержит SEQ ID NO:2.
Полинуклеотидные молекулы rEVE, описанные в настоящей заявке, также могут быть использованы в способе улучшения способности популяции клеток-хозяев, которые экспрессируют рекомбинантный белок, адаптироваться к росту в присутствии метотрексата. В предпочтительном варианте осуществления этот способ включает:
вставку в клетки-хозяева вектора экспрессии, содержащего:
рекомбинантный ген, кодирующий интересующий белок,
полинуклеотидную молекулу элемента рекомбинантного вектора экспрессии (rEVE), содержащую последовательность, выбранную из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, части SEQ ID NO:1, части SEQ ID NO:2, и их сочетаний, и
ген дигидрофолатредуктазы (DHFR);
где популяция клеток-хозяев, содержащих вектор экспрессии, имеет более высокую выживаемость и/или более высокую скорость роста при выращивании в присутствии метотрексата по сравнению с популяцией клеток-хозяев, несущих вектор экспрессии, лишенный указанной полинуклеотидной молекулы rEVE.
Полинуклеотидная молекула rEVE, описанная в настоящей заявке, также может быть использована для усиления амплификации (повышения) экспрессии рекомбинантного белка в клетках-хозяевах, используя процедуру амплификации DHFR-метотрексат. В предпочтительном варианте осуществления, такой способ включает:
вставку в клетки-хозяева вектора экспрессии, содержащего:
рекомбинантный ген, кодирующий интересующий рекомбинантный белок
полинуклеотидную молекулу rEVE, содержащую последовательность, выбранную из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, части SEQ ID NO:1, части SEQ ID NO:2, и их сочетаний, и
гена дигидрофолатредуктазы (DHFR)
выращивание клеток-хозяев в присутствии метотрексата для отбора метотрексат-резистентной клетки, которая экспрессирует интересующий рекомбинантный белок, и
выделение метотрексат-резистентной клетки-хозяина,
где выделенная метотрексат-резистентная клетка-хозяин экспрессирует интересующий рекомбинантный белок в присутствии метотрексата на уровне, который выше уровня метотрексат-резистентной клетки-хозяина, содержащей вектор экспрессии, лишенный полинуклеотидной молекулы rEVE.
В способах, описанных в настоящей заявке, в которых применяется селекция метотрексатом для амплифицированной экспрессии желаемого рекомбинантного белка (белков), метотрексат может быть использован в диапазоне от 20 нМ до 500 нМ. Однако, предпочтительно, специалистам в данной области понятно, что более низкие и более высокие концентрации метотрексата, например, от 5 нМ до 10 мкМ также могут быть с успехом использованы в селекциях метотрексатом для амплификации экспрессии. (смотрите, например, Kaufman, R.J., Methods in Enzvmology. Vol. 185: 537-566 (1990)).
Настоящее изобретение также относится к способу снижения, в основном подавления или по существу заглушения экспрессии рекомбинантного белка из вектора экспрессии. В таком способе может быть использован вектор экспрессии, который содержит один или несколько фрагментов последовательности rEVE, описанной в настоящей заявке, обеспечивающих более низкие уровни экспрессии конкретного продукта рекомбинантного гена, чем при использовании полноразмерной последовательности rEVE. Такие снижающие экспрессию или подавляющие экспрессию последовательности. Происходящие из rEVE, включают усеченный вариант последовательности ARM2, имеющий последовательность оснований 1-1086 последовательности SEQ ID NO:2 или оснований 1-461 последовательности SEQ ID NO:2. Очевидно, наличие 3' концевого участка последовательности, удаленного из этих двух вариантов является крайне желательным для rEVE-опосредованного усиления экспрессии рекомбинантных белков. Молекула нуклеиновой кислоты, имеющая ARM2 усеченную последовательность оснований 1-461 последовательности SEQ ID NO:2, особенно подходит для подавления или по существу заглушения экспрессии рекомбинантного белка из молекулы вектора экспрессии в клетке-хозяине. Такие способы могут найти применение в ряде ситуаций, в том числе, без ограничения, в тех случаях, когда существуют сомнения, что экспрессия рекомбинантного белка может быть токсичной для клетки-хозяина, или когда некоторый уровень экспрессии может создавать проблемы для очистки или выделения желаемого белка, например, агрегация белка.
Таким образом, последовательность оснований 462-2422 последовательности SEQ ID NO:2 и последовательность оснований 1087-2422 последовательности SEQ ID NO:2 являются наиболее предпочтительными для максимального ARM2 rEVE-опосредованного усиления экспрессии рекомбинантных белков. В соответствии с этим полинуклеотиды rEVE, которые в основном используются для усиления экспрессии рекомбинантных белков, содержат последовательность оснований 462-2422 последовательности SEQ ID NO:2 и/или последовательность оснований 1087-2422 последовательности SEQ ID NO:2.
Дополнительные варианты осуществления и особенности настоящего изобретения будут очевидны из следующих неограничивающих примеров.
ПРИМЕРЫ
Пример 1. Клонирование и анализ последовательности элементов рекомбинантного вектора экспрессии (rEVE) ARM1 и ARM2
Продукцию DUX B11 CHO клеточной линии, несущей стабильно интегрированный вектор экспрессии, изучали для определения возможного основания для исключительно высокого уровня экспрессии рекомбинантного антитела к IL-12, кодируемого в векторе экспрессии, которым были трансфицированы клетки-хозяева CHO. В этом исследовании области геномной ДНК, фланкирующие интегрированный вектор экспрессии, были клонированы и секвенированы. Вкратце, геномную ДНК из клетки-хозяина расщепляли XbaI, и фрагменты среднего размера приблизительно 5 тысяч оснований (тыс. осн.) очищали, используя колонку BioGel A-50, в основном как описано у Reynaud et al. (J. Mol. Biol, 140: 481-504 (1980)). Библиотеку очищенных геномных фрагментов получали клонированием этих фрагментов в клонирующий вектор лямбда (λ) DASH® (Stratagene, La Jolla, California). Библиотеку амплифицировали и упаковывали, используя упаковывающий экстракт GIGAPACK® (Stratagene), и трансдуцировали в клетки Escherichia coli XL1-Blue MRA или XL1-Blue MRA(P2) в соответствии с протоколами производителя. Затем библиотеку подвергали скринингу с зондами для кодирующей последовательности вариабельной области тяжелой цепи (VH) антитела к IL-12 в соответствии с протоколами Stratagene. Фрагмент 14,5 тыс. осн. Xbal в клоне № 21 λDASH содержал сайт для встраивания вектора экспрессии антитела наряду с фланкирующими геномными последовательностями. Эти фланкирующие геномные области были обозначены ARM1 и ARM2. Было определено, что последовательности областей ARM1 и ARM2 являются таковыми последовательностей SEQ ID NO:1 и SEQ ID NO:2, соответственно. В отношении сайта встраивания вектора экспрессии антитела в геноме клеток CHO, ARM1 расположена выше сайта встраивания и 5' к направлению транскрипции векторного гена для тяжелой цепи антитела, а ARM2 расположена ниже сайта встраивания и 3' к направлению транскрипции векторного гена для легкой цепи антитела.
Анализ BLAST последовательностей SEQ ID NO:1 и SEQ ID NO:2 в отношении экспрессируемой CHO последовательности tag (EST) в базе данных не удалось раскрыть каких-либо родственных кодирующих последовательностей, что дает возможность предположить, что последовательности rEVE ARM1 и ARM2 не содержат каких-либо кодирующих последовательностей CHO. Анализ BLAST последовательностей rEVE также проводился в отношении геномной последовательности мыши. Никакой геномной последовательности мыши не было идентифицировано, которая была гомологична последовательности ARM1. Однако, по-видимому, последовательность ARM2 является родственной высоко консервативной области на мышиной хромосоме 14, которая содержит неизвестные кодирующие последовательности.
Используя программу анализа последовательностей Vector NTI (Invitrogen), последовательности ARM1 (SEQ ID NO:1) и ARM2 (SEQ ID NO:2) также подвергали скринингу на наличие образцов различных репрезентативных (т.е. не всех) мотивов нуклеотидной последовательности для элементов области присоединения матрикса (MAR) (смотрите, например, Michalowski et al., Biochemistry, 38: 12795-12804 (1999)). Специфические мотивы ДНК последовательности MAR скринировали с помощью компьютерной программы, показаны в таблице 1 (последовательности комплементарных цепей не перечислены).
Мотивы нуклеотидной последовательности для репрезентативных элементов области присоединения матрикса (MAR)
Как показано в таблице 2, приведенной ниже, по меньшей мере 41 последовательность элемента MAR была идентифицирована в ДНК последовательности ARM1 (SEQ ID NO:1) или в последовательности ее комплементарной цепи, и по меньшей мере 114 последовательностей элемента MAR было идентифицировано в ДНК последовательности ARM2 (SEQ ID NO:2) или в последовательности ее комплементарной цепи.
Расположение последовательностей MAR в ДНК последовательностях ARM1 и ARM2
Результаты анализа последовательности MAR (который включал анализ комплементарной цепи) ARM1 и ARM2 в таблице 2 указывают на то, что различные MAR образуют кластеры преимущественно в 3' концевой части ARM1 (SEQ ID NO:1) и как в 5' части, так и в 3' части ARM2 (SEQ ID NO:2). ARM1 имеет меньшее число таких участков MAR, чем ARM2. Более того, большинство последовательностей MAR в ARM1 находятся в 3' области этой последовательности, тогда как и 5', и 3' области ARM2 содержат последовательности MAR.
Пример 2. Основные протоколы для исследований влияния ARM1 и ARM2 rEVE на уровни экспрессии рекомбинантных белков
Клетки для исследований экспрессии
Клеточная линия DUXB11 CHO представляет собой линию клеток CHO, с недостаточной экспрессией дигидрофолатредуктазы (DHFR-) (смотрите, Urlaub, G. and Chasin, L.A., Proc. Natl. Acad. Sci. U.S.A., 77:4216-4220 (1980)). Фенотип DHFR- этой клеточной линии позволяет применять стандартный протокол системы дигидрофолатредуктаза-метотрексат (DHFR-MTX) для амплификации числа копий вектора экспрессии, который был трансфицирован в эти клетки (смотрите, например, Kaufman, R.J., In Genetic Engineering: Principles and Methods (ed. J.K. Setlow), volume 9, page 155 (Plenum Publishing, New York, 1987)).
Векторы экспрессии, содержащие последовательности rEVE ARM1 и ARM2
На фиг.1 представлена схематическая диаграмма плазмидного вектора экспрессии pA205. На фиг.2 представлена схематическая диаграмма плазмидного вектора экспрессии pA205Genomic, в котором гены, кодирующие тяжелую и легкую цепи адалимумаба, фланкированы ARM1 и ARM2, таким образом, что последовательность ARM1 расположена выше гена тяжелой цепи адалимумаба и последовательность ARM2 расположена ниже гена легкой цепи адалимумаба. На фиг.3 представлена схематическая диаграмма плазмидного вектора экспрессии pA205A1, в котором последовательность ARM1 расположена выше гена тяжелой цепи адалимумаба. На фиг.4 представлена схематическая диаграмма плазмидного вектора экспрессии pA205A2, в котором последовательность ARM2 расположена ниже гена легкой цепи адалимумаба.
На фиг.5 представлена схематическая диаграмма плазмидного вектора экспрессии pCHOEL246GGhum, который содержит гены тяжелой и легкой цепей антитела человека против EL-селектина. На фиг.6 представлена схематическая диаграмма плазмидного вектора экспрессии pA-Gen-EL-Selectin, в котором гены, кодирующие тяжелую и легкую цепи антитела против EL-селектина, фланкированы последовательностями ARM1 и ARM2, таким образом, что последовательность ARM1 расположена выше гена тяжелой цепи этого антитела и последовательность ARM2 расположена ниже гена легкой цепи этого антитела.
На фиг.7 представлена схематическая диаграмма плазмидного вектора экспрессии pA205-eGFP, который содержит ген усиленного зеленого флуоресцентного белка (eGFP). На фиг.8 представлена схематическая диаграмма плазмидного вектора экспрессии pA205G-eGFP, в котором ген, кодирующий усиленный зеленый флуоресцентный белок, фланкирован последовательностями ARM1 и ARM2, таким образом, что последовательность ARM1 расположена выше гена eGFP, последовательность ARM2 расположена ниже гена eGFP.
На фиг.9 представлена схематическая диаграмма плазмидного вектора экспрессии pA205A2-Spe-trunc, который по существу идентичен вектору экспрессии pA205A2, представленному на фиг.4, за исключением того, что последовательность ARM2 была заменена усеченным вариантом ARM2, «A2 (п.о. 1-1086)», который имеет последовательность оснований нуклеиновой кислоты 1-1086 последовательности SEQ ID NO:2 как результат расщепления ДНК ARM2 эндонуклеазой рестрикции SpeI. На фиг.10 представлена схематическая диаграмма плазмидного вектора экспрессии pA205A2-Swa-trunc, который по существу идентичен вектору экспрессии pA205A2, показанному на фиг.4, за исключением того, что последовательность ARM2 была заменена усеченным вариантом ARM2, «A2 (п.о. 1-461)», который имеет последовательность оснований нуклеиновой кислоты 1-461 последовательности SEQ ID NO:2 как результат расщепления ДНК ARM2 эндонуклеазой рестрикции SwaI.
Культуральная среда
αMEM представляет собой минимальную среду, среда α (GIBCO®, Invitrogen, Carlsbad, California).
Выращивание клеток и трансфекции
Три 10-см чашки для культивирования тканей для трансфекции засеивали 1×106 B3.2 родительскими клетками DUXB11 CHO, каждая в 10 мл αMEM, дополненной 5% диализированным FBS и H/T (GIBCO). Эти клетки трансфицировали через восемнадцать часов (18 ч) в соответствии с протоколом трансфекции с использованием фосфата кальция, описанным в Current Protocols in Molecular Biology. (Ausubel, F.V., Brent, R., Moore, D.M., Kingston, R.E., Seidman, J.G., Smith, J.A., и K. Struhl eds), (Wiley Interscience, New York, 1990)) с некоторыми модификациями, как указано ниже. Ростовую среду удаляли из культуральных планшетов аспирацией и 9 мл среды Ham F12 (Invitrogen) добавляли в каждый планшет. Планшеты инкубировали при 37°C в течение двух часов до трансфекции.
Протокол трансфекции с использованием фосфата кальция
Семьдесят пять микрограмм (75 мкг) ДНК растворяли в 1,35 мл воды в 50-мл конической пробирке. Добавляли сто пятьдесят микролитров (150 мкл) 2,5 M CaCl2, и эту смесь ДНК-кальций добавляли по каплям к 1,5 мл 2×HeBES (солевой раствор, забуференный HEPES) в 50 мл конической пробирке. HeBES барботировали пипеткой, добавляя смесь ДНК-кальций с помощью пастеровской пипетки. Смесь перемешивали встряхиванием в течение 5 секунд и инкубировали при комнатной температуре в течение 20 минут. Один миллилитр (1 мл) смеси ДНК-кальций равномерно распределяли на каждой культуральной чашке адгезивных клеток, выращивали и готовили для трансфекции в среде F12, описанной выше, и затем культуры инкубировали при 37°C в течение четырех часов. После инкубирования планшеты аспирировали, и 2 мл 10% диметилсульфоксида (ДМСО) в среде F12 добавляли в каждый планшет (шоковая обработка ДМСО). ДМСО шок продолжался в течение одной минуты, после чего ДМСО разбавляли добавлением 5 мл PBS (забуференного фосфатного солевого раствора) в каждый планшет. Планшеты аспирировали и промывали еще два раза в PBS. Добавляли десять (10) мл αMEM/5% FBS/HT, и планшеты инкубировали при 37°C в течение ночи.
Посев трансфицированных клеток в 96-луночные планшеты и амплификация метотрексатом (MTX)
На следующий день клетки высевали в 96-луночные планшеты следующим образом: клетки со всех 10-см планшетов собирали посредством расщепления трипсином и ресуспендировали при плотности 2000 клеток/мл в αMEM/5%FBS. 96-луночные планшеты засевали при 10 мл/планшет, 100 мк/лунку. Среду в 96-луночных планшетах меняли через одну неделю, через две недели, и еще раз через пять дней после этого. Используемая среда αMEM/5%FBS была селективной для клеток, экспрессирующих DHFR.
Через два дня после последней замены среды, культуральные супернатанты разводили 1:40 и тестировали, используя ELISA, специфичный в отношении гамма цепи IgG человека для направления экспрессии адалимумаба или антитела к EL-селектину. Клоны, которые давали наиболее высокий сигнал ELISA, переносили из 96-луночных планшетов в 12-луночные планшеты в 2,0 мл/лунку αMEM/5%FBS. При конфлюэнтности (приблизительно через 2-5 дней), их снова анализировали, и клоны разделяли в той же среде + 20 нМ MTX для амплификации. Клетки исходно отбирали в αMEM/5%FBS и 20 нМ MTX в 12-луночном планшете для культивирования тканей. Эти клетки, после первоначальной селекции на этом уровне MTX, пассировали минимум еще два раза в ростовой среде, содержащей 20 нМ MTX, на протяжении периода времени в среднем восемнадцать дней. Клеточные линии затем амплифицировали до 100 нМ MTX. Во время этого периода культивирования, возросла продуктивность культур в отношении адалимумаба (антитело человека против TNF-α) или анти-EL-селектина. После селекции на уровне 100 нМ MTX, линии пересевали минимум еще два раза в ростовой среде, содержащей 100 нМ MTX на протяжении периода времени в среднем восемнадцать (18) дней. Где указано, клеточные линии были дополнительно амплифицированы до 500 нМ MTX. После селекции на уровне 500 нМ MTX, линии пересевали минимум еще два раза в ростовой среде, содержащей 500 нМ MTX, на протяжении периода времени в среднем восемнадцать (18) дней.
Культуры трансфицированных клеток CHO, несущих векторы экспрессии, содержащие последовательность нуклеиновой кислоты ARM1 (SEQ ID NO:1), последовательность нуклеиновой кислоты ARM2 (SEQ ID NO:2), или сочетание последовательностей ARM1 и ARM2, адаптируются лучше, т.е. имеют более высокую выживаемость и/или более высокие скорости роста в присутствии метотрексата по сравнению с клетками CHO, трансфицированными теми же векторами экспрессии, лишенными этих последовательностей rEVE.
Пример 3. Влияние последовательностей ARM1 и ARM2 на уровни экспрессии анти-TNF-α в трансфицированных клетках CHO
В этом исследовании изучали действие последовательностей ARM1 и ARM2 на экспрессию антитела человека против TNF-α (адалимумаба) в стабильно трансфицированных клетках CHO. Уровни экспрессии адалимумаба сравнивали в клетках CHO, стабильно трансфицированных вектором экспрессии pA205 (нет последовательностей ARM), pA205Genomic (содержащим и ARM1, и ARM2), pA205A1 (содержащим ARM1) или pA205A2 (содержащим ARM2). В таблице 3 показан средний уровень продукции адалимумаба в адгезивных культурах верхних трех продуцирующих клонов из каждого вектора трансфекции при указанном уровне амплификации (концентрация метотрексата, «MTX»).
Уровень экспрессии адалимумаба
в стабильно трансфицированных клетках СНО
Данные в таблице 3 указывают на то, что последовательности ARM1 и ARM2, по отдельности или в сочетании, повышали уровень экспрессии адалимумаба по сравнению с уровнем, наблюдаемым в клетках, трансфицированных вектором, лишенным последовательностей ARM (pA205). В целом, только ARM2 (p205A2) обеспечивала наиболее высокий уровень повышенной экспрессии относительно всех других трансфектантов, тогда как только ARM1 (p205A1) обеспечивала наиболее низкие уровни повышенной экспрессии. Эти данные показывают, что выделенная молекула нулеиновой кислоты, которая имеет последовательность ARM1 (SEQ ID NO:1) или последовательность ARM2 (SEQ ID NO:2) представляет собой характерный элемент рекомбинантного вектора экспрессии (rEVE), который при включении в вектор экспрессии может усиливать экспрессию рекомбинантного белка, кодируемого этим вектором экспрессии и экспрессируемого из него.
Уровни экспрессии адалимумаба под действием отдельных клонов упомянутых выше векторных трансфекций также сравнивали через 1 неделю и через 4 недели в суспензионных культурах в отсутствие амплификации метотрексатом. Результаты показаны в таблице 4.
Уровень экспрессии адалимумаба в суспензионных культурах индивидуальных клонов стабильно трансфицированных клеток CHO через 1 неделю и 4 недели в отсутствие метотрексата
Данные в таблице 4 показывают, что включение ARM2 в pA205 без ARM1 (pA205A2) увеличивает стабильность повышенных уровней экспрессии адалимумаба с течением времени. В частности, при наличии и ARM1, и ARM2 (pA205Genomic) или только ARM1 (pA205A1), повышенный уровень экспрессии адалимумаба первоначально наблюдался в культурах, но этот уровень мог быстро упасть в течение недель до значительно более низких уровней (смотрите таблицу 4). В отличие от этого, в культурах клеток, экспрессирующих адалимумаб в присутствии только ARM2 (pA205A2), повышенный уровень экспрессии адалимумаба стабильно поддерживался в трех из четырех культур на протяжении период 4 недели. Таким образом, ARM2 может стабильно поддерживать значительное повышение уровня экспрессии адалимумаба в суспензионных культурах трансфицированных клеток CHO.
Пример 4. Влияние последовательностей ARM1 и ARM2 на уровень экспрессии антитела к EL-селектину в трансфицированных клетках CHO
В этом исследовании изучали влияние последовательностей ARM1 и ARM2 на экспрессию антитела человека против EL-селектина (которое связывается с E- и L-селектинами) в стабильно трансфицированных клетках CHO. Уровни экспрессии этого антитела против селектина сравнивали в клетках CHO, стабильно трансфицированных вектором экспрессии pCHOEL246GGhum (без последовательностей ARM) или вектором экспрессии pA-Gen-EL-Selectin (содержащим и ARM1, и ARM2). В таблице 5 показан средний уровень продукции антитела против селектина в адгезивных культурах верхних трех продуцирующих клонов из каждого вектора трансфекции при указанном уровне амплификации (концентрации метотрексата, «MTX»).
Уровень экспрессии антитела против EL-селектина
в стабильно трансфицированных клетках CHO
Данные в таблице 5 показывают, что последовательности ARM1 и ARM2 (pAGen-EL-Selectin) были эффективными в повышении уровня экспрессии антитела против EL-селектина в амплифицированных метотрексатом культурах стабильно трансфицированных клеток CHO.
Пример 5. Влияние последовательностей ARM1 и ARM2 на уровни экспрессии усиленного зеленого флуоресцентного белка (eGFP) в трансфицированных клетках CHO
Конструкции, содержащие ген, кодирующий усиленный зеленый флуоресцентный белок (eGFP), трансфицировали в клетки CHO, как описано выше, за исключением того, что клетки были ко-трансфицированы pcDNA3.1-hygro для обеспечения селективного маркера, т.е. резистентности к гидромицину для стабильных трансфектантов. Вектор экспрессии peGFP обеспечивает позитивный контроль для экспрессии eGFP под транскрипционным контролем CMV промотора. Плазмида pA205-eGFP содержит ген eGFP в векторе экспрессии pA205 без последовательностей ARM1 или ARM2 (фиг.7). Плазмида pA205Gen-eGFP (фиг.8) содержит и ARM1, и ARM2 фланкирующие ген, кодирующий eGFP. Ни в одной из этих плазмид нет гена селекции DHFR. Соответственно, стадии амплификации DHFR-метотрексат не требовались. Трансфектанты отбирали с использованием гидромицина в концентрации 400 мкг/мл в течение 2 недель, разделяя при необходимости, а затем сортировали с помощью FACS для определения уровней экспрессии. Клетки первоначально сортировали на пулы по каждому типу вектора и экспрессирующие клетки выращивали в течение еще двух недель, затем сортировали снова.
Уровень экспрессии eGFP
в стабильно трансфицированных клетках CHO
Данные в таблице 6 указывают на то, что последовательности ARM1 и ARM2 были эффективными в значительном повышении уровня экспрессии eGFP в трансфицированных клетках CHO по сравнению с уровнем экспрессии в клетках, трансфицированных тем же вектором экспрессии eGFP, но лишенным последовательностей ARM (pA205-eGFP).
Пример 6. Влияние делеционных мутантов ARM2 на уровни экспрессии адалимумаба в трансфицированных клетках CHO
3' концевая область последовательности ARM2 (SEQ ID NO:2) была усечена в векторе pA205A2 либо до сайта расщепления SpeI (основание 1086 последовательности SEQ ID NO:2) или сайта расщепления SwaI (основание 461 последовательности SEQ ID NO:2) для создания, соответственно, pA205A2-Spe-trunc (содержащего последовательность оснований 1-1086 последовательности SEQ ID NO:2) и pA205A2-Swa-trunc (содержащего последовательность оснований 1-461 последовательности SEQ ID NO:2). Полученные в результате плазмиды трансфицировали в клетки CHO, как описано выше, и амплифицировали до 20 нМ MTX. В таблице 7 показан средний уровень экспрессии в адгезивных культурах верхних трех продуцирующих клонов из каждой трансфекции на каждом уровне амплификации.
Уровень экспрессии адалимумаба в стабильно трансфицированных клетка СНО
Данные в таблице 7 показывают, что клетки CHO, трансфицированные вектором экспрессии pA205A2-Spe-trunc, который содержит 5' концевые 1086 пар оснований ДНК ARM2, продуцировали адалимумаб с более низким уровнем повышенной экспрессии по сравнению с клетками CHO, трансфицированными вектором pA205A2. Неожиданно, клетки, трансфицированные вектором экспрессии pA205A2-Swa-trunc, который содержит на 5' конце 461 пару оснований ДНК ARM2, продуцировали адалимумаб с еще более низкими уровнями экспрессии, чем клетки, трансфицированные pA205, который не содержит последовательности ARM. Данные, представленные в таблице 7, указывают на то, что области, удаленные с 3' конца ДНК ARM2, представляют особый интерес для повышенной экспрессии рекомбинантных белков в клетках-хозяевах. Кроме того, присутствие сравнительно небольшого, т.е. 461 пара оснований 5' концевого фрагмента ДНК ARM2, отдельно, по-видимому, фактически снижает экспрессию продукта рекомбинантного гена в трансфицированных клетках-хозяевах и может быть особенно применим в существенном снижении или заглушения экспрессии продукта рекомбинантного гена. Такое применение может быть желательным в тех случаях, когда экспрессия продукта гена была бы токсичной или иначе нежелательной в клетке-хозяине, например, в определенных условиях культивирования.
Пример 7. Уровни экспрессии отдельных трансфектантов из предшествующих исследований
В приведенных ниже таблицах представлен уровень экспрессии рекомбинантных белков, продуцируемых отдельными трансфицированными клонами, полученными в предыдущих исследованиях.
Уровни экспрессии адалимумаба в клетках CHO, трансфицированных pA205
Уровни экспрессии адалимумаба в клетках CHO, трансфицированных pA205Genomic
Уровни экспрессии адалимумаба в клетках CHO, трансфицированных pA205A1
Уровни экспрессии адалимумаба в клетках CHO, трансфицированных pA205A2
Уровни экспрессии адалимумаба в клетках CHO, трансфицированных pA205A2-Spe-trunc
Уровни экспрессии адалимумаба в клетках CHO, трансфицированных pA205A2-Swa-trunc
Уровни экспрессии антитела против EL-Selection в клетках CHO, трансфицированных pCHOEL246GGhum
Уровни экспрессии антитела против EL-селектина в клетках CHO, трансфицированных pA-Gen-EL-Selectin
Пример 8. Усиление экспрессии антитела против IL-13
Это исследование показывает rEVE-опосредованное усиление экспрессии гуманизированного антитела против IL-13 в стабильно трансфицированных клетках млекопитающего в культуре по сравнению с клетками, трансфицированными экспрессией, лишенной rEVE.
Молекулы ДНК, кодирующие тяжелую и легкую цепи гуманизированного моноклонального антитела против IL-13, которое имеет изотип IgGγ1 человека (смотрите США серийный № 11/899819, включено в настоящую заявку в качестве ссылки), вставляли в экспрессионную векторную плазмиду pBJ, DHFR-MTX амплифицируемую экспрессионную плазмиду, используя стандартные способы для получения экспрессионной плазмиды pBJ-13C5.5 (родительской экспрессионной плазмиды). Полинуклеотид rEVE, содержащий последовательность ARM2 (SEQ ID NO:2), затем вставляли в плазмиду pBJ-13C5.5 с получением rEVE-содержащей экспрессионной плазмиды pA2-13C5.5 (ARM2 rEVE экспрессионной плазмиды).
Клетки CHO трансфицировали либо родительской экспрессионной плазмидой pBJ-13C5.5, либо ARM2-содержащей rEVE экспрессионной плазмидой pA2-13C5.5 в соответствии с общим протоколом трансфекции, описанным в предыдущих примерах для получения стабильных трансфектантов клеток CHO. Через 24 часа после трансфекции, клетки с каждой трансфекции высевали в сорок восемь (48) 96-луночных культуральных планшетов (200 клеток/лунку). Культуральную среду отдельных лунок подвергали скринингу с помощью ELISA на экспрессию IgG человека. Оптические плотности были несколько выше в культурах (лунках) клеток, трансфицированных ARM2 rEVE экспрессионной плазмидой, чем для клеток, трансфицированных родительской экспрессионной плазмидой. Средние из 74 колоний (лунок) на культуральный планшет, перенесшие процесс селекции, когда клетки были трансфицированы плазмидой ARM2 rEVE pA2-13C5.5 по сравнению со средними из 68 колоний на планшет для клеток, трансфицированных родительской плазмидой pBJ-13C5.5. Пятнадцать (15) стабильно трансфицированных клонов от каждой трансфекции затем подвергали амплификации с использованием DHFR-метотрексата (MTX).
До амплификации средний уровень экспрессии антитела против IL-13, полученного из клонов, трасфицированных плазмидой ARM2-содержащей rEVE, был в два раза выше, чем средний уровень экспрессии из родительских клонов, трансфицированных плазмидой. Экспрессию антитела затем амплифицировали по одному из двух протоколов. Используя основной протокол для DHFR-MTX амплификации, как описано в примере 2, выше, клоны сначала подвергали селекции при концентрации 20 нМ MTX, затем дополнительной селекции при 100 нМ MTX. В другом протоколе амплификации, клоны отбирали непосредственно при 100 нМ MTX без промежуточного отбора при промежуточной концентрации MTX. Таблица 16, приведенная ниже, демонстрирует средний уровень продукции антитела против IL-13 в культурах трех верхних продуцирующих клонов с каждой трансфекции после двух пассажей в среде, содержащей указанный уровень амплификации (концентрации метотрексата, «MTX»).
Уровень гуманизированного антитела против IL-13 в трансфицированных клетках CHO
Данные в таблице 16 ясно показывают, что ARM2 rEVE усиливал экспрессию гуманизированного антитела против IL-13 приблизительно в 3-5 раз по сравнению с уровнем экспрессии, полученном из трансфектантов, несущих родительскую экспрессионной плазмидой лишенного ДНК ARM2 rEVE. Кроме того, один субклон ARM2 rEVE экспрессионная плазмида трансфектанта экспрессировал гуманизированное антитело против IL-13 на уровне 95 мкг/мл и специфичной продуктивностью 21,74 пг/клетку/день при выращивании на уровне амплификации 100 нМ MTX.
Амплифицированные уровни экспрессии антитела против IL-13 клонами, трансфицированными ARM2 rEVE экспрессионной плазмидой, легко сохранялись по меньшей мере в течение трех недель при выращивании в условиях MTX селекции.
Пример 9. Влияние полинуклеотидных молекул ARM1 и ARM2 rEVE на экспрессию адалимумаба в системе транзиторной экспрессии
Это исследование было создано для определения, будут ли полинуклеотидные молекулы rEVE увеличивать уровни экспрессии рекомбинантных белков в системе транзиторной экспрессии.
Клетки HEK 293 трансфицировали экспрессионными плазмидными векторами pA205, pA205Genomic, pA205A1, pA205A2, pA205A2-Spec-trunc и pA205A2-Swa-trunc. Клетки HEK293, культивированные в среде Freestyle 293 Expression Medium (GIBCO®, Invitrogen, Carlsbad, CA) трансфицировали плазмидными ДНК, в комплексе с полиэтиленамином в соответствии с опубликованными условиями (Durocher et al., Nucleic Acids Res., 30: E9). Селекции по интеграции вектора не проводили. Клетки культивировали в течение семи дней после трансфекции, и аликвоты культурального супернатанта тестировали на концентрацию адалимумаба, как описано выше. Результаты трех трансфекций представлены в таблице 17. Уровни экспрессии определяли в трех повторах для третьей трансфекции.
Уровень* экспрессии адалимумаба в трансфицированных клетках HEK 293
Результаты в таблице 17 показывают, что последовательности ARM1 и ARM2 могут повышать уровень экспрессии адалимумаба в клетках HEK 293, в тех случаях, когда присутствуют по отдельности в экспрессионных плазмидных векторах (pA205A1, pA205A2) или в сочетании (pA205Genomic). ARM1 придавала более высокий уровень усиления экспрессии адалимумаба, чем ARM2 в этой системе транзиторной экспрессии HEK 293. В отличие от этого, ARM2 придавала более высокий уровень усиления экспрессии адалимумаба, чем ARM1 в системе стабильной экспрессии CHO (смотрите пример 3, выше). Как видно в системе стабильной экспрессии CHO (пример 6, выше), усиливающее действие ARM2 также было явно снижено в клетках HEK 293, трансфицированных эксперссионным плазмидным вектором, несущим либо SpeI-, либо SwaI-усеченную последовательность ARM2, включая снижение экспрессии ниже, чем отмечено в клетках, трансфицированных контрольным плазмидным вектором экспрессии pA205 (без последовательности ARM).
Все патенты, заявки и публикации, процитированные в приведенном выше тексте, включены в настоящее описание в качестве ссылки.
Другие разновидности и варианты осуществления описанного здесь изобретения теперь будут очевидны для специалистов в этой области, и все эти варианты и альтернативные варианты осуществления этого изобретения охватываются изложенным выше описанием и формулой изобретения, представленной ниже.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ПОЛИПЕПТИДА | 2012 |
|
RU2628310C2 |
| УЛУЧШЕННЫЕ ЭКСПРЕССИЯ И ПРОЦЕССИНГ ТРАНСГЕНА | 2014 |
|
RU2808756C1 |
| НОВЫЕ ЭУКАРИОТИЧЕСКИЕ КЛЕТКИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ ДЛЯ РЕКОМБИНАНТНОЙ ЭКСПРЕССИИ ПРЕДСТАВЛЯЮЩЕГО ИНТЕРЕС ПРОДУКТА | 2014 |
|
RU2712507C2 |
| НОВЫЕ КЛЕТКИ ПОЗВОНОЧНЫХ И СПОСОБЫ РЕКОМБИНАНТНОЙ ЭКСПРЕССИИ ИНТЕРЕСУЮЩЕГО ПОЛИПЕПТИДА | 2015 |
|
RU2710726C2 |
| УСОВЕРШЕНСТВОВАННЫЕ ВЕКТОРЫ ЭКСПРЕССИИ МЛЕКОПИТАЮЩИХ И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2502800C2 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТКИ, СПОСОБНОЙ ПРОДУЦИРОВАТЬ ГЕТЕРОПРОТЕИНЫ С ВЫСОКИМ ВЫХОДОМ | 2008 |
|
RU2486245C2 |
| ЭКСПРЕССИЯ МНОЖЕСТВА ГЕНОВ, ВКЛЮЧАЯ sORF-КОНСТРУКЦИИ, И СПОСОБЫ ЭКСПРЕССИРОВАНИЯ ИММУНОГЛОБУЛИНА | 2006 |
|
RU2478709C2 |
| РЕКОМБИНАНТНЫЕ IL4-АНТИТЕЛА, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ, СВЯЗАННЫХ С ДЕЙСТВИЕМ IL4 | 1994 |
|
RU2162711C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ РЕКОМБИНАНТНЫХ ГЛИКОПРОТЕИНОВ С МОДИФИЦИРОВАННЫМ ГЛИКОЗИЛИРОВАНИЕМ | 2015 |
|
RU2704830C2 |
| СПОСОБ ЭКСПРЕССИИ | 2014 |
|
RU2731717C2 |








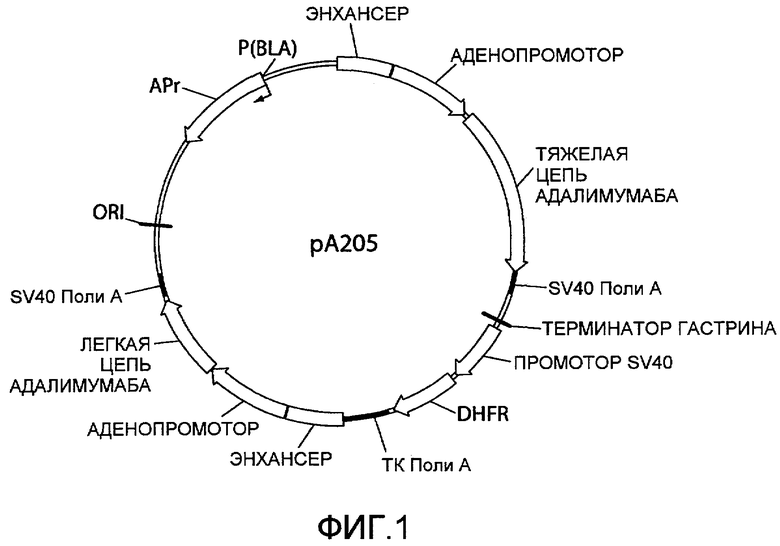



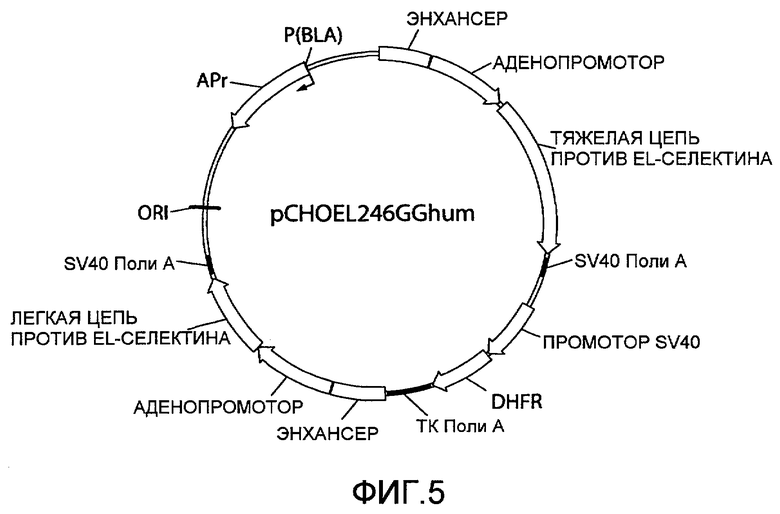
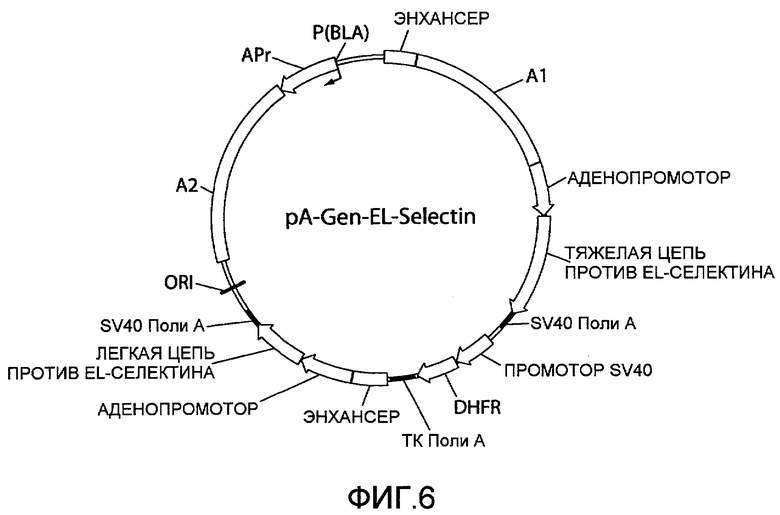
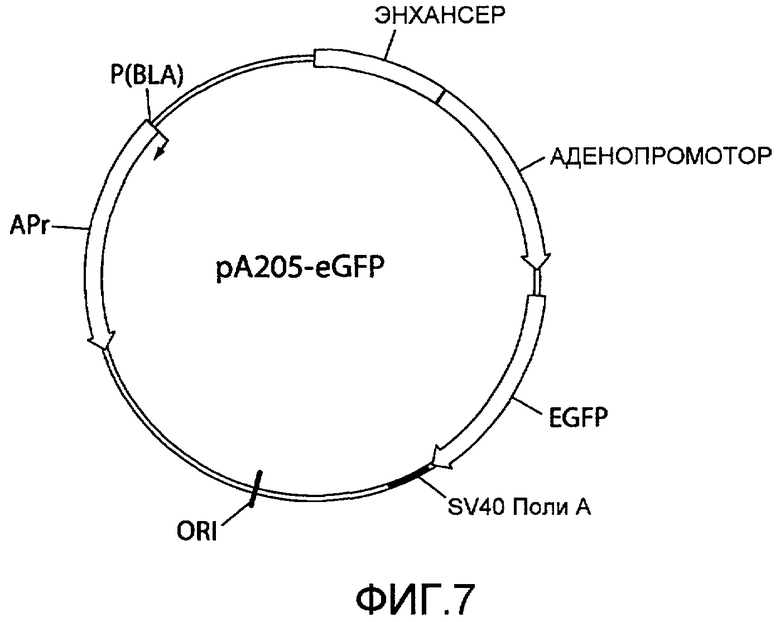

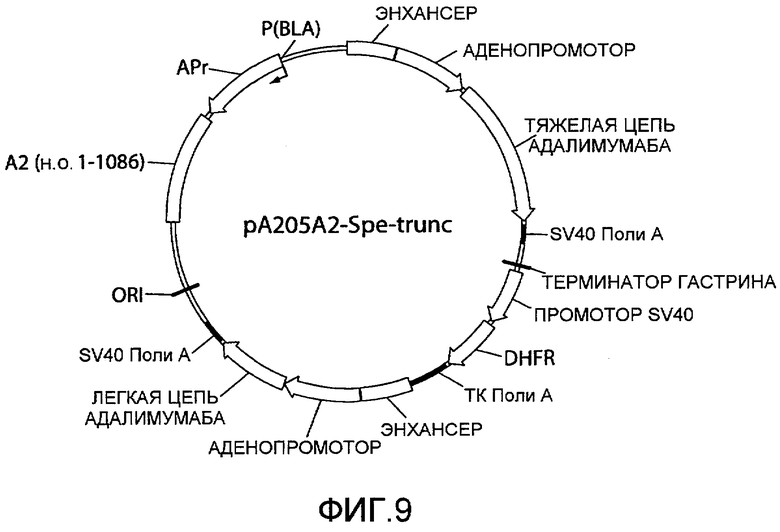
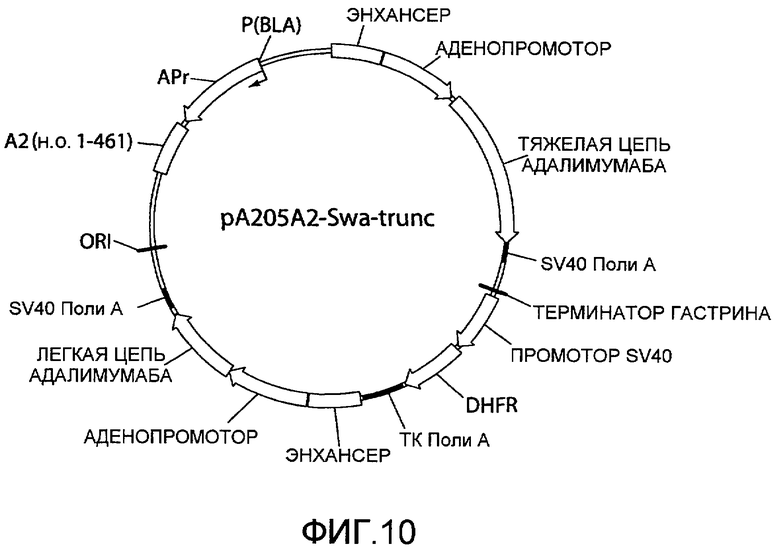
Изобретение относится к биотехнологии и представляет собой выделенную полинуклеотидную молекулу с функцией rEVE, рекомбинантный вектор экспрессии, экспрессионный шаттл-вектор, клетку-хозяина, а также способы с использованием вышеуказанной выделенной полинуклеотидной молекулы. Данная полинуклеотидная молекула с функцией rEVE может быть использована для получения рекомбинантных белков. Данная полинуклеотидная молекула с функцией rEVE содержит рекомбинантный экспрессионный векторный элемент (rEVE), содержащий последовательность нуклеотидных оснований, выбранную из группы, состоящей из последовательности нуклеотидных оснований SEQ ID NO:1, последовательности нуклеотидных оснований SEQ ID NO:2, фрагмента, усиливающего экспрессию, последовательности SEQ ID NO:1, фрагмента, усиливающего экспрессию, последовательности SEQ ID NO:2, последовательности, комплементарной любой последовательности, указанной выше, или их сочетания. Предложенное изобретение позволяет увеличить уровень экспрессии одного или нескольких белков. 8 н. и 26 з.п. ф-лы, 10 ил., 17 табл., 9 пр.
1. Выделенная полинуклеотидная молекула с функцией rEVE, содержащая:
рекомбинантный экспрессионный векторный элемент (rEVE), содержащий последовательность нуклеотидных оснований, выбранную из группы, состоящей из последовательности нуклеотидных оснований SEQ ID NO:1, последовательности нуклеотидных оснований SEQ ID NO:2, фрагмента, усиливающего экспрессию, последовательности SEQ ID NO:1 и фрагмента, усиливающего экспрессию, последовательности SEQ ID NO:2;
последовательности, комплементарной любой последовательности, указанной выше, или их сочетания.
2. Выделенная полинуклеотидная молекула rEVE по п.1, где полинуклеотидная молекула rEVE содержит часть, усиливающую экспрессию, последовательности SEQ ID NO:2, выбранную из группы, состоящей из последовательности оснований 462-2422 последовательности SEQ ID NO:2 и последовательности оснований 1087-2422 последовательности SEQ ID NO:2.
3. Рекомбинантный вектор экспрессии, содержащий полинуклеотидную молекулу rEVE по п.1 или 2.
4. Экспрессионный шаттл-вектор, содержащий полинуклеотидную молекулу rEVE по п.1 или 2.
5. Рекомбинантный вектор экспрессии по п.3, выбранный из группы, состоящей из рекомбинантного плазмидного вектора экспрессии, рекомбинантного эукариотического вирусного вектора экспрессии, рекомбинантного бактериофагального вектора экспрессии, рекомбинантной дрожжевой минихромосомы, рекомбинантной бактериальной искусственной хромосомы и рекомбинантного дрожжевого экспрессионного плазмидного вектора.
6. Рекомбинантный вектор экспрессии по п.3, где рекомбинантный вектор экспрессии содержит один или несколько функциональных рекомбинантных генов, кодирующих один или несколько рекомбинантных белков.
7. Рекомбинантный вектор экспрессии по п.6, где указанные один или несколько рекомбинантных белков выбраны из группы, состоящей из растворимого белка, мембранного белка, структурного белка, рибосомального белка, фермента, зимогена, молекулы антитела, рецепторного белка клеточной поверхности, регуляторного белка транскрипции, белка хроматина, гормона, регуляторного белка клеточного цикла, G белка, нейроактивных пептидов, иммунорегуляторного белка, белкового компонента крови, белка ионного канала, белка теплового шока, дигидрофолатредуктазы (DHFR), белок резистентности к антибиотикам, функционального фрагмента, любого из указанных выше белков, эпитоп-содержащего фрагмента, любого из указанных выше белков, и их сочетаний.
8. Рекомбинантный вектор экспрессии по п.7, где молекула антитела выбрана из группы, состоящей из антитела против TNF-α, антитела против EL-селектина, антитела против IL-13 и двойного вариабельного домена молекулы иммуноглобулина.
9. Рекомбинантный вектор экспрессии по п.8, где антителом против TNF-α является адалимумаб.
10. Рекомбинантный вектор экспрессии по любому из пп.3 или 5-9, где указанный рекомбинантный вектор экспрессии содержит по меньшей мере одну копию гена, кодирующего дигидрофолатредуктазу.
11. Клетка-хозяин, содержащая вектор экспрессии по любому из пп.3 или 5-10, для повышенной экспрессии представляющего интерес полипептида.
12. Клетка-хозяин по п.11, где клетка-хозяин представляет собой эукариотическую клетку-хозяин или прокариотическую клетку-хозяин.
13. Клетка-хозяин по п.12, где клетка-хозяин представляет собой эукариотическую клетку-хозяин, выбранную из группы, состоящей из клетки-хозяина млекопитающего, клетки-хозяина насекомого, растительной клетки-хозяина, клетки-хозяина гриба, клетки-хозяина эукариотической водоросли, клетки-хозяина нематоды, клетки-хозяина простейшего и клетки-хозяина рыбы.
14. Эукариотическая клетка-хозяин по п.13, где указанная эукариотическая клетка-хозяин представляет собой клетку-хозяина млекопитающего.
15. Клетка-хозяин млекопитающего по п.14, где клетка-хозяин млекопитающего выбрана из группы, состоящей из ооцита китайского хомячка (CHO), клетки COS, клетки Vero, клетки SP2/0, клетки миеломы NS/0, НЕК 293, клетки почки детеныша хомяка (ВНК), клетки HeLa, B-клетки человека, клетки CV-1/EBNA, L-клетки, клетки 3T3, клетки HEPG2, клетки PerC6 и клетки MDCK.
16. Клетка-хозяин млекопитающего по п.15, где клетка-хозяин млекопитающего представляет собой клетку СНО.
17. Эукариотическая клетка-хозяин по п.13, где эукариотическая клетка-хозяин представляет собой клетку-хозяина гриба.
18. Клетка-хозяин гриба по п.17, где клетка-хозяин гриба выбрана из группы, состоящей из Aspergillus, Neurospora, Saccharomyces, Pichia, Hansenula, Schizosaccharomyces, Kluyveromyces, Yarrowia и Candida.
19. Клетка-хозяин Saccharomyces no п.18, которая представляет собой клетку-хозяина S. cerevisiae.
20. Эукариотическая клетка-хозяин по п.13, где эукариотическая клетка-хозяин представляет собой клетку-хозяин простейшего.
21. Клетка-хозяин простейшего по п.20, где клетка-хозяин простейшего представляет собой клетку-хозяина Leishmania tarentolae.
22. Способ получения рекомбинантного белка, представляющего интерес, включающий индукцию транскрипции и трансляции одного или нескольких генов, кодирующих рекомбинантный белок, представляющих интерес, находящихся в рекомбинантном векторе экспрессии по любому из пп.6-10.
23. Способ по п.22, где указанная транскрипция и трансляция происходит в бесклеточной системе транскрипции/трансляции или в клетке-хозяине.
24. Способ по п.23, где указанная транскрипция и трансляция происходит в клетке-хозяине.
25. Способ по п.24, где указанной клеткой-хозяином является клетка-хозяин СНО.
26. Способ получения клетки-хозяина, которая стабильно экспрессирует повышенные уровни рекомбинантного белка, представляющего интерес, включающий:
введение в клетки-хозяева рекомбинантного вектора экспрессии по п.10,
рост указанных клеток-хозяев в присутствии метотрексата для отбора клетки-хозяина, резистентного к метотрексату, которая экспрессирует рекомбинантный белок, представляющий интерес, и
выделение указанной клетки-хозяина, резистентной к метотрексату,
где указанная выделенная клетка-хозяин, резистентная к метотрексату, экспрессирует рекомбинантный белок, представляющий интерес, на уровне, который выше уровня чувствительной к метотрексату клетки-хозяина, и где указанная клетка-хозяин, резистентная к метотрексату, стабильно экспрессирует повышенный уровень рекомбинантного белка, представляющего интерес, при росте в присутствии или в отсутствие метотрексата.
27. Способ по п.26, где концентрация указанного метотрексата находится в диапазоне от 5 нМ до 10 мкМ.
28. Способ по п.26, где указанной клеткой-хозяином является клетка-хозяин СНО.
29. Способ улучшения или повышения способности популяции клеток-хозяев, которые экспрессируют рекомбинантный белок, адаптироваться к росту в присутствии метотрексата, включающий стадию:
трансфекции клеток-хозяев рекомбинантным вектором экспрессии, содержащим:
рекомбинантный ген, кодирующий рекомбинантный белок, представляющий интерес,
полинуклеотид рекомбинантного экспрессирующего векторного элемента (rEVE), содержащий последовательность нуклеотидных оснований, выбранную из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, фрагмента, усиливающего экспрессию, последовательности SEQ ID NO:1, и фрагмента, усиливающего экспрессию, последовательности SEQ ID NO:2, и их сочетания, и
ген дигидрофолатредуктазы (DHFR);
культивирования трансфецированных клеток-хозяев в присутствии метотрексата; и
отбора популяция трансфецированных клеток-хозяев с высокой жизнеспособностью и/или более высокой скоростью роста при росте в присутствии метотрексата по сравнению с популяцией клеток-хозяев, несущих тот же рекомбинантный вектор экспрессии, лишенный полинуклеотидной молекулы rEVE.
30. Способ по п.29, где концентрация указанного метотрексата находится в диапазоне от 5 нМ до 10 мкМ.
31. Способ по п.29, где указанной клеткой-хозяином является клетка-хозяин СНО.
32. Способ получения клетки-хозяина, резистентной к метотрексату, которая экспрессирует повышенные уровни рекомбинантного белка, включающий:
трансфекцию клетки-хозяина рекомбинантным вектором экспрессии, содержащим:
рекомбинантный ген, кодирующий рекомбинантный белок, представляющий интерес, содержащий последовательность нуклеотидных оснований, выбранную из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, фрагмента, усиливающего экспрессию, последовательности SEQ ID NO:1, и фрагмента, усиливающего экспрессию, последовательности SEQ ID NO:2, и их сочетаний, и
ген дигидрофолатредуктазы (DHFR);
рост клеток-хозяев в присутствии метотрексата для отбора клетки-хозяина, резистентной к метотрексату, которая экспрессирует рекомбинантный белок, представляющий интерес; и
выделение указанной клетки-хозяина, резистентной к метотрексату;
где указанная клетка-хозяин, резистентная к метотрексату, экспрессирует рекомбинантный белок, представляющий интерес, в присутствии метотрексата на уровне, который выше уровня клетки-хозяина, резистентной к метотрексату, содержащей вектор экспрессии без последовательности rEVE.
33. Способ по п.32, где концентрация указанного метотрексата находится в диапазоне от 5 нМ до 10 мкМ.
34. Способ по п.32, где указанной клеткой-хозяином является клетка-хозяин СНО.
| KIM JONG-MOOK ET AL., "Improved recombinant gene expression in CHO cells using matrix attachment regions" JOURNAL OF BIOTECHNOLOGY, 2004, v | |||
| Счетный сектор | 1919 |
|
SU107A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| WO2004033693 A1 , 22.04.2004 | |||
| ZAHN-ZABAL M ET AL., "Development of stable cell lines for production or regulated expression using matrix attachment regions", JOURNAL OF BIOTECHNOLOGY, | |||
Авторы
Даты
2014-06-10—Публикация
2008-03-28—Подача