Настоящее изобретение относится к способу экспрессии рекомбинантных полипептидов и конкретно к секреции рекомбинантных полипептидов.
При получении рекомбинантного полипептида бывает очень полезно, если полипептид, представляющий интерес, может экспортироваться из клетки, в которой он экспрессируется. Поэтому предпочтительно разрабатывать экспрессирующие системы, в которых есть возможность такого экспорта или секреции. Секреция рекомбинантного полипептида из клетки-хозяина обычно включает использование сигнальных пептидов, которые обнаружены на большинстве эукариотических и прокариотических белков, которые предназначены для экспорта из цитоплазмы. Лидеры секреции, применяемые в таких экспрессирующих системах, как правило, являются нативными по отношению к экспрессирующему хозяину, например, сигнальные пептиды PhoA, MalB и OmpA Escherichia coli широко использовались для секреции полипептидов в периплазматическое пространство этого организма.
US7071172 описывает применение лидеров секреции фибронектина в векторах для доставки на основе AAV для применения в генной терапии.
Согласно первому аспекту настоящего изобретения предлагается способ получения целевого полипептида, где способ включает:
a) экспрессию экспрессирующего вектора для экспрессии целевого полипептида в клетке-хозяине, причем экспрессирующий вектор содержит экспрессирующую кассету, содержащую полинуклеотид, кодирующий рекомбинантный полипептид, функционально связанный с лидерной последовательностью секреции фибронектина или с его функциональным эквивалентом; и
b) извлечение целевого полипептида.
Лидеры секреции фибронектина, которые могут применяться в настоящем изобретении, включают лидеры секреции фибронектина млекопитающих и рептилий. Примеры лидеров секреции фибронектина рептилий включают лидеры секреции фибронектина Xenopus laevis. Примеры лидеров секреции фибронектина млекопитающих включают человеческий, крысиный, мышиный, бычий, свиной, собачий, кошачий лидер секреции фибронектина, а также лидер секреции фибронектина китайского хомяка, и их функциональные эквиваленты, такие как лидер секреции фибронектина человека, имеющий последовательность MLRGPGPGLLLLAVQCLGTAVPSTGA (SEQ ID No. 1). В некоторых воплощениях, лидер секреции фибронектина китайского хомяка, имеющий аминокислотную последовательность MLRGPGPGLLLAVLCLGTAVRCTEA (SEQ ID No. 2) и ее функциональные эквиваленты, является предпочтительным.
Функциональный эквивалент лидеру секреции представляет собой последовательность, которая имеет 70% идентичности или выше с аминокислотной последовательностью, 75% идентичности или выше, более предпочтительно, 80% идентичности или выше и наиболее предпочтительно, 90% идентичности или выше, как например, 95% идентичности или выше, и который сохраняет способность секретировать рекомбинантный полипептид. В некоторых воплощениях функциональный эквивалент лидера секреции отличается единственной аминокислотой, полученной любым способом, выбранным из вставки, делеции или замены.
Во множестве воплощений полинуклеотидные последовательности, которые функционально связаны, располагаются последовательно и, в случае лидера секреции, последовательно и в той же рамке считывания.
Предпочтительно, связь между полинуклеотидом, кодирующим лидерную последовательность секреции фибронектина, и полинуклеотидом, кодирующим целевой полипептид, такая что лидер секреции присоединен к N-концу рекомбинантного полипептида. В некоторых воплощениях рекомбинантный полипептид включает N-концевую метку, причем связь между лидерной последовательностью секреции и полинуклеотидом, кодирующим рекомбинантный полипептид, такая что лидер секреции присоединен к метке, предпочтительно к N-концу метки.
Полинуклеотид, кодирующий лидерную последовательность секреции фибронектина, предпочтительно присоединен к 5’-концу полинуклеотида, кодирующего целевой полипептид, и предпочтительно имеет последовательность ATGCTGAGAGGCCCTGGACCTGGACTGCTGCTGCTGGCTGTGCAGTGTCTGGGAACCGCCGTGCCTTCTACCGGCGCC (SEQ ID No. 3) или ATGCTCAGGGGTCCGGGACCCGGGCTGCTGCTGGCCGTCCTGTGCCTGGGGACAGCGGTGCGCTGTACCGAAGCC (SEQ ID No. 4).
Векторы по настоящему изобретению сдержат промотор, функционально связанный с экспрессирующей кассетой для лидера секреции и рекомбинантного полипептида.
Промоторы, которые могут применяться в векторах согласно настоящему изобретению, выбирают соответственно клетке-хозяину, в которой экспрессируется экспрессирующая кассета.
Промоторы, которые могут применяться в прокариотических клетках-хозяевах, включают промоторы фаговых полимераз, такие как одиночные участки промотора T7, включая те, что описаны в Studier and Moffat, J. Mol. Biol. 189:113-130 (1986), которая включена в данный документ ссылкой, особенно участок промотора гена 10 T7 и промоторы полимераз хозяина, особенно промоторы полимераз E coli, такие как T7A1, T7A2, T7A3, λpL, λpR, lac, lacUV5, trp, tac, trc, phoA и rrnB.
Когда применяется T7 РНК-полимераза-зависимый участок промотора, то следует понимать, что потребуется источник T7 РНК-полимеразы, которую получают методами, известными в данной области, и, как правило, путем вставки λDE3 профага, экспрессирующего требуемую фаговую полимеразу, в штамм-хозяин для создания лизогенных штаммов-хозяев. T7 РНК-полимераза также может доставляться в клетку с помощью инфекции с использованием специализированного трансдуцирующего фага λ, который несет ген T7 РНК-полимеразы.
Промоторы, которые могут применяться в дрожжевых клетках-хозяевах, включают gal-промоторы и AOX-промоторы, такие как AOX1 и AOX2, GAP (глицеральдегид 3-фосфат дегидрогеназа), FLP (формальдегид дегидрогеназа) и GAL1, и GAL10.
Промоторы, которые могут применяться в клетках-хозяевах млекопитающих, могут быть эндогенными или экзогенными по отношению к клеткам-хозяевам. Подходящие промоторы включают вирусные промоторы, такие как CMV, SV40-промотор и RSR-LTR. Также могут использоваться промоторы из генов домашнего хозяйства, таких как hEF1a и мышиная фосфоглицераткиназа (mPGK). В некоторых воплощениях, предпочтительные промоторы представляют собой человеческий CMV и крысиный CMV. Промоторы могут быть одинаковыми или различными, если экспрессируется более чем один полипептид (например, полипептиды MAb HC и LC). Промотор может применяться в комбинации с энхансерной последовательностью, такой как главный немедленно-ранний энхансер цитомегаловируса, особенно человеческого цитомегаловируса.
Экспрессирующий вектор может интегрироваться в геном клетки-хозяина или может содержаться внутри экстрахромосомного элемента, такого как плазмида.
Экспрессирующий вектор, как правило, также включает селектируемый маркер, подходящий для клетки-хозяина, в которой вектор будет экспрессироваться. Селектируемые маркеры для применения в прокариотических клетках-хозяевах включают маркеры устойчивости к антибиотикам, такие как маркеры устойчивости к тетрациклину или к канамицину. Селектируемые маркеры для применения в дрожжевых клетках включают маркеры устойчивости к антибиотикам, таким как Зеоцин, пуромицин, неоцин и гигромицин. Селектируемые маркеры для клеток млекопитающих и особенно для клеток яичника китайского хомяка включают маркерные системы глутамин-синтетазы и дигидрофолатредуктазы.
Применяемые векторы включают признаки, стандартные в данной области для экспрессии в подходящей клетке-хозяине. Прокариотические экспрессирующие векторы, как правило, включают последовательность начала репликации, сайты ферментов рестрикции, терминатор транскрипции и локус стабильности плазмиды, такой как последовательность стабильности cer. Дрожжевые экспрессирующие векторы, как правило, включают промотор, терминатор транскрипции, маркер селекции и для репликации последовательность начала репликации. Экспрессирующие векторы млекопитающих, как правило, включают последовательность полиаденилирования, такую как последовательность поли-А человеческого бетаглобина, последовательность поли-А бычьего гормона роста и раннюю и позднюю последовательности поли-А SV40.
Экспрессирующий вектор по настоящему изобретению может применяться для экспрессии рекомбинантных полипептидов, особенно белков в клетках-хозяевах. Могут применяться прокариотические и особенно эукариотические клетки-хозяева. Примеры прокариотических клеток включают бактериальные клетки, например, грам-отрицательные бактериальные клетки, включающие E. coli, Salmonella typhimurium, Serratia marsescens, Pseudomonas putida и Pseudomonas aeruginosa, и грам-положительные бактериальные клетки, включающие Bacillus subtilis. Предпочтительные прокариотические клетки-хозяева представляют собой бактерии, конкретно, энтеробактерии, предпочтительно E coli, и особенно их B или K12 штаммы.
Примеры эукариотических клеток-хозяев, которые могут применяться, включают дрожжевые клетки, клетки млекопитающих и клетки насекомых. Дрожжевые клетки-хозяева включают, конкретно, Saccharomyces cerevisiae, Pichia pastoris и Hansenula polymorpha.
Предпочтительные клетки-хозяева представляют собой клетки млекопитающих, такие как клетки почек новорожденного хомяка, человеческие эмбриональные почечные клеточные линии, например, клетки HEK 293, человеческие клеточные линии, выделенные из сетчатки, например, клетки PER.C6, и мышиные лимфоидные клеточные линии, например, клетки NS0 и SP2, и наиболее предпочтительно, клетки яичника китайского хомяка, и конкретно клетки CHOK1, DG44, DUXKB11 и CHO pro3-клетки.
Экспрессирующий вектор по настоящему изобретению стандартно применяется в форме плазмиды. Плазмиды могут представлять собой автономно реплицирующиеся плазмиды или интегративные плазмиды.
В некоторых высоко предпочтительных воплощениях настоящего изобретения лидер секреции фибронектина выбирают так, чтобы он соответствовал применяемой клетке-хозяину. Например, человеческий фибронектин применяется в клетках, выделенных из человека, крысиный фибронектин применяется в крысиных клетках, и конкретно фибронектин китайского хомяка применяется в клетках яичника китайского хомяка.
Полипептиды, которые могут экспрессироваться с помощью способа по настоящему изобретению, включают терапевтические белки и пептиды, включающие цитокины, факторы роста, антитела, антительные фрагменты, иммуноглобулино-подобные полипептиды, ферменты, вакцины, пептидные гормоны, хемокины, рецепторы, фрагменты рецепторов, киназы, фосфатазы, изомеразы, гидролазы, факторы транскрипции и химерные полипептиды.
Антитела, которые могут экспрессироваться, включают моноклональные антитела, поликлональные антитела и антительные фрагменты, обладающие биологической активностью, включая мультивалентные и/или мультиспецифичные формы любых из вышеописанных.
Природные антитела, как правило, включают четыре полипептидные цепи, две идентичные тяжелые (H) и две идентичные легкие (L) цепи, связанные между собой дисульфидными связями. Каждая тяжелая цепь включает вариабельный участок (VH) и константный участок (CH), CH-участок, включающий в своей нативной форме три домена, CH1, CH2 и CH3. Каждая легкая цепь включает вариабельный участок (VL) и константный участок, включающий один домен, CL.
VH и VL участки могут дополнительно подразделяться на два участка гипервариабельности, обозначаемые как области определения комплементарности (CDR), чередующиеся с участками, которые более консервативны, обозначаемые как каркасные участки (FR). Каждый VH и VL состоит из трех CDR и четырех FR, располагающихся от N-конца к C-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Антительные фрагменты, которые могут экспрессироваться, включают часть интактного антитела, причем указанная часть обладает целевой биологической активностью. Антительные фрагменты, как правило, включают, по меньшей мере, один антиген-связывающий сайт. Примеры антительных фрагментов включают: (i) Fab-фрагменты, содержащие домены VL, CL, VH и CH1; (ii) Fab-производные, такие как Fab’-фрагмент, содержащий один или несколько остатков цистеина на C-конце домена CH1, который может образовывать бивалентные фрагменты с помощью дисульфидных мостиков между двумя Fab-производными; (iii) Fd-фрагмент, содержащий домены VH и CH1; (iv) Fd-производные, такие как Fd-производные, содержащие один или несколько остатков цистеина на C-конце домена CH1; (v) Fv-фрагменты, содержащие домены VL и VH одного плеча антитела; (vi) молекулы одноцепочечного антитела, такие как одноцепочечные Fv (scFv) антитела, в которых домены VL и VH ковалентно связаны; (vii) полипептид VH- или VL-домена без доменов константных участков, связанных с другим вариабельным доменом (с полипептидом домена VH или VL), то есть вместе или без доменов константных участков, (например, VH-VH, VH-VL, или VL-VL) (viii) антительные фрагменты в виде доменов, такие как фрагменты, состоящие из домена VH или домена VL, и антиген-связывающие фрагменты либо VH-, либо VL-доменов, такие как CDR-участки; (ix) так называемые "диатела", содержащие два антиген-связывающих сайта, например, вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL), в одной и той же полипептидной цепи; и (x) так называемые линейные антитела, содержащие пару тандемных Fd-сегментов, которые вместе с комплементарными полипептидами легкой цепи образуют пару антиген-связывающих участков.
Предпочтительные антигенные фрагменты, которые могут быть получены, представляют собой антитела млекопитающих, содержащие единственный вариабельный домен, который является антительным фрагментом, который содержит последовательности, характерные для вариабельных доменов иммуноглобулина, и который специфично связывается с антигеном (т.e., константа диссоциации составляет 500 нM или менее, как например, 400 нM или менее, предпочтительно, 250 нM или менее и наиболее предпочтительно, 100 нM или менее), и который связывается с антигеном как единственный вариабельный домен; то есть без какого-либо комплементарного вариабельного домена. Антитела, содержащие единственный вариабельный домен, включают полные антительные вариабельные домены, а также модифицированные вариабельные домены, например, в которых одна или несколько петель заменены последовательностями, которые не характерны для антительных вариабельных доменов, или антительные вариабельные домены, которые были укорочены или которые содержат N- или C-концевые протяженные фрагменты, а также свернутые в третичную структуру фрагменты вариабельных доменов. Предпочтительные одиночные вариабельные домены, которые могут быть получены, выбирают из группы VH и VL, включая Vкаппа и Vлямбда. Наиболее предпочтительные одиночные вариабельные домены являются человеческими или верблюжьими доменами, включая гуманизированные верблюжьи домены.
В случае, где целевой полипептид содержит две или более цепей, которые будут секретироваться, конкретно, где целевой полипептид представляет собой антитело или антительный фрагмент, содержащий две или более цепей, по меньшей мере, одна и, предпочтительно, каждая из цепей прикрепляется к лидеру секреции фибронектина и, соответственно, конструируются полинуклеотиды, кодирующие такие полипептиды. Применяемые лидеры секреции фибронектина могут быть одинаковыми или различными. Полинуклеотиды, кодирующие две или более цепей, могут содержаться в одной экспрессирующей кассете, но, предпочтительно, содержатся в различных экспрессирующих кассетах. В случае, где применяются различные экспрессирующие кассеты, они могут располагаться в различных векторах, но предпочтительно в одном векторе. Применяемые промоторы могут быть одинаковыми или различными.
Экспрессирующая система экспрессируется способами, хорошо известными в данной области для применяемых клеток. Предпочтительные методы экспрессии включают культивирование клеток-хозяев в ростовой среде и затем извлечение экспрессированного полипептида. Термин «ростовая среда» относится к питательной среде, используемой для выращивания клеток-хозяев. Во множестве воплощений применяется питательный раствор. Подходящие ростовые среды для данных клеток-хозяев и методы извлечения полипептидов хорошо известны в данной области.
Во множестве воплощений, извлечение полипептида включает одно или более из следующего: фильтрацию, центрифугирование, диафильтрацию, ионо-обменную хроматографию, аффинную хроматографию, такую как аффинная хроматография с Протеином A, Хроматографию Гидрофобного Взаимодействия (HIC), Гель-фильтрацию и ВЭЖХ.
Согласно предпочтительному аспекту настоящего изобретения предлагается способ получения целевого полипептида, где способ включает:
(a) трансфекцию или трансформацию клетки-хозяина экспрессирующим вектором для экспрессии целевого полипептида в клетке-хозяине, причем экспрессирующий вектор содержит экспрессирующую кассету, содержащую полинуклеотид, кодирующий рекомбинантный полипептид, функционально связанный с лидерной последовательностью секреции фибронектина или с его функциональным эквивалентом;
(b) культивирование клетки-хозяина при условиях, которые позволяют пролиферацию клетки-хозяина и экспрессию, и секрецию целевого полипептида из клетки-хозяина;
(c) и извлечение целевого полипептида.
Согласно следующему аспекту настоящего изобретения предлагается клетка яичника китайского хомяка, предпочтительно, CHOK1, DG44, DUXKB11 или CHO pro3-клетка, трансфецированная экспрессирующим вектором, содержащим экспрессирующую кассету, содержащую полинуклеотид, кодирующий целевой полипептид, функционально связанный с лидерной последовательностью секреции фибронектина или с ее функциональным эквивалентом.
Целевой полипептид, кодируемый в следующем аспекте настоящего изобретения, предпочтительно содержит моноклональное антитело. Может применяться экспрессирующая кассета, содержащая полинуклеотиды, кодирующие обе цепи моноклонального антитела, тяжелую и легкую, каждая из которых предпочтительно функционально связана с лидером секреции фибронектина. В некоторых воплощениях, применяются отдельные экспрессирующие кассеты, содержащие тяжелую и легкую цепи, которые могут быть расположены на отдельных векторах, но часто они располагаются на одном векторе. Применяемые лидеры секреции фибронектина могут быть одинаковыми или различными, но предпочтительно они одинаковые.
Во множестве предпочтительных воплощений, экспрессирующая кассета содержит промотор гена домашнего хозяйства, особенно промотор hEF1a, функционально связанный с плинуклеотидом, кодирующим целевой полипептид, и когда применяются две или более экспрессирующих кассет, то каждая экспрессирующая кассета содержит промотор гена домашнего хозяйства, предпочтительно один и тот же промотор, и наиболее предпочтительно, промотор hEF1a.
Одна или каждая экспрессирующая кассета для целевого полипептида предпочтительно содержит последовательность поли-А бычьего гормона роста.
Экспрессирующий вектор предпочтительно содержит маркер селекции, наиболее предпочтительно, маркерную систему дигидрофолатредуктазы. В некоторых воплощениях маркерная система дигидрофолатредуктазы содержит экспрессирующую кассету, дополнительно содержащую промотор мышиной фосфоглицераткиназы.
ДНК-конструкт, содержащий экспрессирующую кассету, содержащую промотор, эффективный в клетке млекопитающего, и полинуклеотид, кодирующий целевой полипептид, функционально связанный с лидерной последовательностью секреции фибронектина, образует другой аспект настоящего изобретения.
ДНК-конструкты предпочтительно содержат отдельные экспрессирующие кассеты для тяжелой и легкой цепей моноклонального антитела. Наиболее предпочтительно, каждая экспрессирующая кассета содержит одинаковый промотор, особенно промотор гена домашнего хозяйства, наиболее предпочтительно, промотор hEF1a. Особенно предпочтительно, когда каждая экспрессирующая кассета дополнительно содержит последовательность поли-А бычьего гормона роста. ДНК-конструкты часто предпочтительно содержат маркер селекции, наиболее предпочтительно, маркерную систему дигидрофолатредуктазы. В некоторых воплощениях маркерная система дигидрофолатредуктазы содержит экспрессирующую кассету, дополнительно содержащую промотор мышиной фосфоглицераткиназы.
Настоящее изобретение будет проиллюстрировано следующими частными примерами.
Пример 1
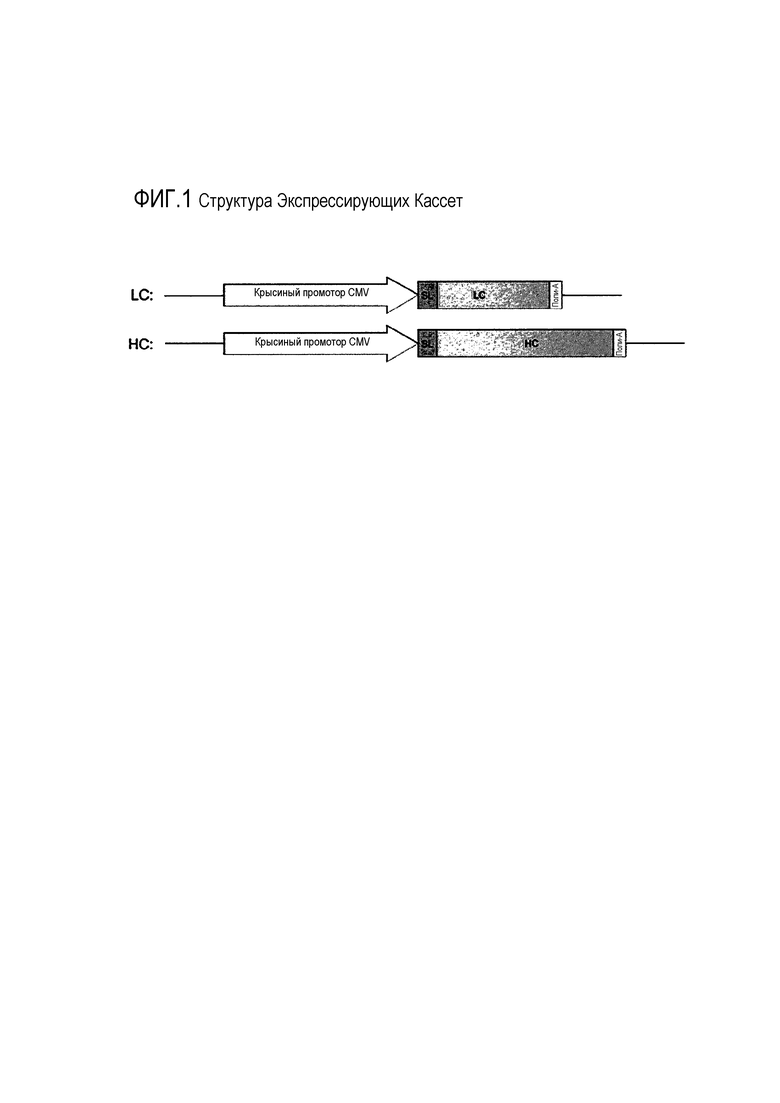
Для каждого тестируемого лидера секреции конструировали два вектора с одиночным геном, которые содержали либо тяжелую цепь hγ1 FL (HC) моноклонального антитела к MUC-1 или легкую цепь лямбда (LC) моноклонального антитела к MUC-1. Каждая экспрессирующая кассета содержала крысиный CMV-промотор, функционально связанный с полинуклеотидной последовательностью, кодирующей лидер секреции, который был связан в одной рамке с полинуклеотидной последовательностью, кодирующей зрелый полипептид HC или LC, и с последовательностью поли-А человеческого бетаглобина. Структура экспрессирующей кассеты проиллюстрирована на Фигуре 1.
Применяемые лидеры секреции представлены ниже:
Лидер секреции A: человеческий коллаген, последовательность MLSFVDTRTLLLLAVTLCLATCQS (SEQ ID No. 5)
Лидер секреции B: человеческий фибронектин, последовательность MLRGPGPGLLLLAVQCLGTAVPSTGA (SEQ ID No. 1)
Лидер секреции C: фибронектин китайского хомяка, последовательность MLRGPGPGLLLAVLCLGTAVRCTEA (SEQ ID No. 2)
Лидер секреции D: Альбумин китайского хомяка, последовательность MKWVTFLLLLFVSDSAFS (SEQ ID No. 6)
Клетки-хозяева CHO DG44 подсчитывали и высевали на лунки 6-луночного планшета с плотностью 1,2×106 клеток/на лунку в среде MEM-α с добавлением 10%-сыворотки, 2мM Глутамина и 0,45% глюкозы и инкубировали в течение ночи при 36,5°C, 7,5% CO2.
Для каждой трансфекции смешивали вместе 4 мкг векторов с одиночным геном HC и LC (2мкг) и разводили в 250мкл бессывороточной среды MEM-α (Life Technologies). Контроль трансфекции (только PBS) также был включен в эксперимент. Для каждой трансфекции 12,5мкл Липофектамина 2000 (Life Technologies) разводили в 250мкл бессывороточной среды MEM- α и смешивали. Смесь инкубировали при комнатной температуре (15-25°C) в течение 5 минут. Разведенную ДНК и реагент Липофектамин 2000TM объединяли, смешивали и инкубировали в течение 20 минут при комнатной температуре. Дополнительные 500мкл среды MEM-α добавляли в каждую смесь трансфекции, ростовую среду удаляли из лунки и затем добавляли комплекс в лунку 6-луночного планшета, содержащего клетки. Через 5 часов среду удаляли и добавляли свежую ростовую среду. Клетки инкубировали в течение 5 дней при 36,5°C, 7,5% CO2. Собирали надосадочную жидкость и очищали центрифугированием. Антительный титр определяли с использованием анализа с Протеином А Octet (Forte Bio).
Результаты представлены в Таблице 1 ниже.
Полученное антитело извлекают из надосадочной жидкости с помощью захвата с использованием Протеина A, элюции при низком pH и очищают с помощью катионообменной хроматографии с последующей анионообменной хроматографии. Элюэнт из анионообменной хроматографии является объектом для вирусной нанофильтрации с последующей заменой буфера и концентрированием.
Пример 2
Конструкция вектора
Конструировали векторы с двумя генами, которые содержали обе цепи, тяжелую hγ1 FL и легкую цепь лямбда человека моноклонального антитела к MUC-1, которые экспрессировались под управлением промотора hEF1a.
Конструировали дополнительные векторы с двумя генами, где промотор hEF1α заменяли либо на промотор hCMV-MIE, либо на крысиный промотор CMV.
Каждая экспрессирующая кассета внутри векторов с двумя генами состояла из промотора, функционально связанного с полинуклеотидной последовательностью, кодирующей сигнальный пептид фибронектина CHO Примера 1, который был связан с полинуклеотидной последовательностью, кодирующей зрелый полипептид HC или LC. Корректный процессинг мРНК гарантировали путем присутствия последовательности поли-А бычьего гормона роста.
Чтобы позволить селекцию стабильных клеточных линий, векторы также содержали копию мышиного гена дигидрофолатредуктазы (dhfr) под контролем промотора мышиного гена фосфоглицерата (mPGK) и ген устойчивости к гигромицину под контролем промотора тимидин киназы (TK).
Процедура субкультивирования клеток CHO DG44:
Клетки CHO DG44 стандартно культивировали в суспензии во флаконах со встряхиванием в среде EX-CELL ACF CHO (Sigma) с добавлением 8 мM L-глутамина и 1xHT (Life Technologies). Клетки высевали в концентрации 2×105 клеток/на мл, и клетки ресуспендировали каждые 3 дня. Флаконы культивировали при 37°C, 7,5% CO2 в инкубаторе с круговым встряхиванием при 140 об./мин..
Трансфекции для получения стабильных клеточных линий
Клетки, используемые для трансфекций, растили в суспензионной клеточной культуре, как подробно описано выше. Клетки из растущих культур центрифугировали и ресуспендировали до концентрации 2x107 клеток/мл. Объем клеточной суспензии 0,1 мл и 4 мкг линеаризованной плазмидной ДНК добавляли в кювету для электропорации. Кювету затем помещали в нуклеофектор Amaxa (Lonza) и нуклеофецировали. После трансфекции клетки добавляли к 20 мл предварительно нагретой среды EX-CELL ACF CHO (Sigma) с добавлением 8мM Глутамина и 1xHT во флакон T75. Трансфецированные клетки инкубировали при 37°C, 7,5% CO2. После удаления гипоксантина и тимидина (HT) (48часов после трансфекции) из среды и добавления 400мкг/мл Гигромицина B (Invitrogen) и 25нM MTX (144 часа после трансфекции) клетки высевали в 96-луночные планшеты с плотностью 5000 клеток/на лунку (2,5×104 клеток/мл). Планшеты инкубировали при 37°C в атмосфере 7,5% CO2 в воздухе. Планшеты отслеживали на предмет роста колоний в течение срока приблизительно до трех недель после трансфекции. Надосадочную жидкость из около 100 лунок, содержащих растущие клетки, собирали и анализировали на Антитела с использованием анализа Octet (Forte Bio) с протеином А. Лучшие 24 экспрессирующие колонии наращивали в 24-луночных планшетах и культивировали в течение 10 дней. Затем надосадочную жидкость анализировали на Антитела с использованием анализа с Протеином А Octet (Forte Bio). Результаты представлены в Таблице 2 ниже.
Пример 3
Очистка Антитела из надосадочной жидкости CHO
Надосадочную жидкость из рекомбинантных клеточных линий CHO DG44, полученных с использованием вектора с двумя генами под промотором hEF1α, описанного в Примере 2, очищали с использованием смолы с протеином А. 350мл осветленного продукта загружали на предварительно набитую колонку, содержащую смолу MabSelect SuRe (GE Healthcare). Смолу промывали сначала с помощью 20мM Фосфата Натрия, 1M NaCl (pH7) и затем с помощью 20мM Фосфата Натрия (pH7). Антитело затем элюировали с помощью 100мM Уксусной кислоты. Проводили количественную оценку извлеченного продукта с использованием анализа Octet (Forte Bio) с протеином А, результаты которого представлены в Таблице 3.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОПТИМИЗИРОВАННАЯ ЭКСПРЕССИОННАЯ КАССЕТА ДЛЯ ЭКСПРЕССИИ ПОЛИПЕПТИДА С ВЫСОКИМ ВЫХОДОМ | 2013 |
|
RU2682884C2 |
| ПРИМЕНЕНИЕ ВИТАМИНОВ И ГЕНОВ И БЕЛКОВ МЕТАБОЛИЗМА ВИТАМИНОВ ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА В КЛЕТКАХ МЛЕКОПИТАЮЩИХ | 2016 |
|
RU2736705C2 |
| АНТИТЕЛА ПРОТИВ CD19 ЧЕЛОВЕКА, ОБЛАДАЮЩИЕ ВЫСОКОЙ АФФИННОСТЬЮ | 2016 |
|
RU2761077C1 |
| СПОСОБ ПОЛУЧЕНИЯ МУЛЬТИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2018 |
|
RU2780629C1 |
| СПОСОБ ПОЛУЧЕНИЯ МУЛЬТИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2018 |
|
RU2750721C2 |
| НОВЫЕ АНТИ-IL 13 АНТИТЕЛА И ИХ ИСПОЛЬЗОВАНИЕ | 2004 |
|
RU2487887C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДОВ | 2015 |
|
RU2699715C2 |
| ВАРИАНТЫ КОШАЧЬИХ АНТИТЕЛ | 2021 |
|
RU2840969C1 |
| НОВЫЕ КЛЕТКИ ПОЗВОНОЧНЫХ И СПОСОБЫ РЕКОМБИНАНТНОЙ ЭКСПРЕССИИ ИНТЕРЕСУЮЩЕГО ПОЛИПЕПТИДА | 2015 |
|
RU2710726C2 |
| СПОСОБЫ И КОМПОЗИЦИЯ ДЛЯ СЕКРЕЦИИ ГЕТЕРОЛОГИЧНЫХ ПОЛИПЕПТИДОВ | 2010 |
|
RU2585488C2 |
Изобретение относится к биотехнологии. Описан способ получения целевого рекомбинантного полипептида, включающий: экспрессию вектора экспрессии для экспрессии целевого полипептида в клетке СНО, причем вектор экспрессии содержит экспрессирующую кассету, содержащую полинуклеотид, кодирующий целевой рекомбинантный полипептид, функционально связанный с лидером секреции фибронектина; и извлечение целевого рекомбинантного полипептида. Также описан способ получения целевого рекомбинантого полипептида, включающий: трансфекцию или трансформацию клетки СНО вектором для экспрессии экспрессии целевого полипептида в клетке СНО, причем вектор экспрессии содержит экспрессирующую кассету, содержащую полинуклеотид, кодирующий целевой рекомбинантный полипептид, функционально связанный с лидером секреции фибронектина; культивирование клетки СНО при условиях, которые обеспечивают пролиферацию клетки СНО и экспрессию и секрецию целевого рекомбинантного полипептида из клетки СНО; и извлечение целевого рекомбинантного полипептида. Представлена клетка яичника китайского хомяка для получения целевого рекомбинантного полипептида, трансфецированная экспрессирующим вектором, содержащим экспрессирующую кассету, содержащую полинуклеотид, кодирующий целевой рекомбинантный полипептид, функционально связанный с лидером секреции фибронектина. Также представлен способ получения рекомбинантного полипептида, который включает культивирование указанной клетки яичника китайского хомяка. Изобретение расширяет арсенал средств по получению целевых полипептидов. 4 н. и 26 з.п. ф-лы, 1 ил., 3 табл., 3 пр.
1. Способ получения целевого рекомбинантного полипептида, включающий:
(a) экспрессию вектора экспрессии для экспрессии целевого полипептида в клетке СНО, причем вектор экспрессии содержит экспрессирующую кассету, содержащую полинуклеотид, кодирующий целевой рекомбинантный полипептид, функционально связанный с лидером секреции фибронектина; и
(b) извлечение целевого рекомбинантного полипептида.
2. Способ по п.1, где лидер секреции фибронектина представляет собой лидер секреции фибронектина китайского хомячка.
3. Способ по п.2, где клетка СНО представляет собой клетку СНОК1, DG44, DUXKB11 или CHO pro3.
4. Способ по п.3, где клетка СНО представляет собой клетку DG44.
5. Способ по п.4, где экспрессирующая кассета содержит промотор hEF1a.
6. Способ по п.5, где экспрессирующая кассета содержит последовательность поли-A.
7. Способ по п.6, где последовательность поли-A выбрана из последовательности поли-А бетаглобина человека, последовательности поли-А бычьего гормона роста, ранней или поздней последовательности поли-А SV40.
8. Способ по п.2, где лидер секреции фибронектина имеет последовательность MLRGPGPGLLLAVLCLGTAVRCTEA.
9. Способ получения целевого рекомбинантого полипептида, включающий:
(a) трансфекцию или трансформацию клетки СНО вектором для экспрессии экспрессии целевого полипептида в клетке СНО, причем вектор экспрессии содержит экспрессирующую кассету, содержащую полинуклеотид, кодирующий целевой рекомбинантный полипептид, функционально связанный с лидером секреции фибронектина;
(b) культивирование клетки СНО при условиях, которые обеспечивают пролиферацию клетки СНО и экспрессию и секрецию целевого рекомбинантного полипептида из клетки СНО; и
(c) извлечение целевого рекомбинантного полипептида.
10. Способ по п.9, где лидер секреции фибронектина представляет собой лидер секреции фибронектина китайского хомячка.
11. Способ по п.10, где клетка СНО представляет собой клетку СНОК1, DG44, DUXKB11 или CHO pro3.
12. Способ по п.11, где клетка СНО представляет собой клетку DG44.
13. Способ по п.12, где экспрессирующая кассета содержит промотор hEF1a.
14. Способ по п.13, где экспрессирующая кассета содержит последовательность поли-A.
15. Способ по п.14, где последовательность поли-A выбрана из последовательности поли-А бетаглобина человека, последовательности поли-А бычьего гормона роста, ранней или поздней последовательности поли-А SV40.
16. Способ по п.10, где лидер секреции фибронектина имеет последовательность MLRGPGPGLLLAVLCLGTAVRCTEA.
17. Способ по п.1, в котором используют две экспрессирующие кассеты, причем одна экспрессирующая кассета содержит полинуклеотид, кодирующий легкую цепь моноклонального антитела, и вторая экспрессирующая кассета содержит полинуклеотид, кодирующий тяжелую цепь моноклонального антитела.
18. Способ по п.17, где две экспрессирующие кассеты содержат одинаковые промотор, лидер секреции и последовательность поли-А.
19. Способ по п.18, где промотор представляет собой промотор hEF1a, лидер секреции фибронектина представляет собой лидер секреции фибронектина китайского хомяка, и последовательность поли-А представляет собой последовательность поли-А бычьего бетаглобина.
20. Клетка яичника китайского хомяка для получения целевого рекомбинантного полипептида, трансфецированная экспрессирующим вектором, содержащим экспрессирующую кассету, содержащую полинуклеотид, кодирующий целевой рекомбинантный полипептид, функционально связанный с лидером секреции фибронектина.
21. Клетка яичника китайского хомяка по п.20, где целевой рекомбинантный полипептид содержит моноклональное антитело.
22. Клетка яичника китайского хомяка по п.21, в которой используют отдельные экспрессирующие кассеты, содержащие тяжелую и легкую цепи.
23. Клетка яичника китайского хомяка по п.22, где экспрессирующие кассеты располагаются на одном векторе.
24. Клетка яичника китайского хомяка по п.23, где каждая экспрессирующая кассета содержит промотор гена домашнего хозяйства, особенно промотор hEF1a, функционально связанный с полинуклеотидом, кодирующим целевой полипептид.
25. Клетка яичника китайского хомяка по п.24, где каждая кассета экспрессии содержит последовательность поли-А бычьего гормона роста.
26. Клетка яичника китайского хомяка по п.25, которая дополнительно содержит маркерную систему дигидрофолатредуктазы.
27. Клетка яичника китайского хомяка по п.26, где маркерная система дигидрофолатредуктазы содержит промотор мышиной фосфоглицераткиназы.
28. Клетка яичника китайского хомяка по п.27, где лидер секреции фибронектина представляет собой фибронектин CHO.
29. Клетка яичника китайского хомяка по п.28, где лидер секреции фибронектина имеет последовательность MLRGPGPGLLLAVLCLGTAVRCTEA.
30. Способ получения рекомбинантного полипептида, который включает культивирование клетки яичника китайского хомяка по любому из пп.20-29.
| WO 03093295 A2, 13.11.2003 | |||
| ВЕКТОР ДЛЯ ЭКСПРЕССИИ ПОЛИПЕПТИДОВ С СИАЛИДАЗНОЙ АКТИВНОСТЬЮ, СПОСОБ ОБЕСПЕЧЕНИЯ СИАЛИДАЗНОЙ АКТИВНОСТИ В КУЛЬТУРЕ КЛЕТОК И СПОСОБ РЕГУЛИРОВАНИЯ СВОЙСТВ Fc-СОДЕРЖАЩИХ МОЛЕКУЛ, ЭКСПРЕССИРУЕМЫХ В ЛИНИИ КЛЕТОК | 2007 |
|
RU2466189C2 |
| АНТИТЕЛА К DR5 И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2458072C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММОРТАЛИЗОВАННОЙ КЛЕТКИ ЧЕЛОВЕКА, СТАБИЛЬНО ТРАНСФИЦИРОВАННАЯ ИММОРТАЛИЗОВАННАЯ КЛЕТКА ЧЕЛОВЕКА, СПОСОБ РЕКОМБИНАНТНОЙ ПРОДУКЦИИ ЦЕЛЕВОГО БЕЛКА ЧЕЛОВЕКА, ПРИМЕНЕНИЕ ВЕКТОРА ТРАНСФЕКЦИИ | 2006 |
|
RU2453597C2 |
Авторы
Даты
2020-09-08—Публикация
2014-04-29—Подача