ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Данная заявка претендует на приоритет в отношении предварительной заявки на патент США №61/110187, озаглавленной "Method and System for Detection and/or Characterization of a Biological Particle in a Sample", поданной 31 октября 2008, которая включена в данную заявку.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам и системам для обнаружения, изоляции и/или идентификации микроорганизмов в образце. В частности, настоящее изобретение представляет собой прямой способ быстрой характеристики и/или идентификации микроорганизма с помощью масс-спектрометрии.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Обнаружение патогенных микроорганизмов в биологических жидкостях следует осуществлять в кратчайшее по возможности время, в частности, в случае септицемии, для которой смертность остается высокой, несмотря на широкий спектр антибиотиков, доступных врачам. Присутствие биологически активных агентов, таких как микроорганизмы, в жидкости организма пациента, в частности в крови, обычно определяют, используя флаконы гемокультуры. Инфекции системы кровообращения связаны с высокой заболеваемостью и смертностью, кроме того, осуществление современных способов диагностики, культивирование с последующей биохимической идентификацией и тестирование на чувствительность к антибиотикам может занять несколько суток. Обычно начинают эмпирическую терапию на основании клинических симптомов, и результаты тестов влияют на клинические решения только тогда, когда первоначальная терапия неудачна. Способность охарактеризовать инфекции кровообращения в пределах первых нескольких часов, предпочтительно в пределах часа, после положительного результата гемокультуры значительно усилило бы клиническую релевантность предоставленной диагностической информации. Для восполнения данной потребности предложены способы молекулярной амплификации, но при данном подходе остаются серьезные проблемы. Сама среда положительной гемокультуры представляет собой естественно амплифицированную популяцию микроорганизмов с потенциалом использования быстрых тестов идентификации (ID).
Традиционные автоматические фенотипические ID тесты, такие как системы Vitek®, Phoenix™ и Microscan®, или ручные фенотипические тесты, такие как API, требуют, чтобы микроорганизмы находились в соответствующей фазе роста и были свободны от мешающих сред и продуктов крови с целью получения надежных результатов. Эти системы используют колонии, выращенные из положительной культуры в течение 18-24 часов на средах в чашках Петри. Однако при стремлении получить более быстрые результаты некоторые лаборатории сообщили об использовании этих систем с микроорганизмами, выделенными из флаконов с положительными гемокультурами. Эти тесты "непосредственно из флакона" пригодны не для всех микроорганизмов (например, непригодны для грамположительных кокков), не подтверждены изготовителями тестов и, как правило, занимают 3-8 часов для получения результатов. Более быстрые и более широко специфичные тесты крайне необходимы в целях обеспечения врача клинически релевантными результатами в пределах первых нескольких часов, предпочтительно в пределах часа, после положительного результата культуры.
Масс-спектрометрические способы обладают потенциалом, предоставляющим возможность идентификации микроорганизмов очень быстро, но они могут столкнуться с интерференцией от множества соединений, присутствующих в жидких микробиологических культуральных средах и в клинических образцах, таких как кровь, или в их сочетании. Чаще всего используемые способы выделения микроорганизмов непосредственно из положительной гемокультуры представляют собой двухступенчатое дифференциальное центрифугирование и центрифугирование в пробирке для отделения сыворотки.
Другие описанные способы разделения, характеристики и/или идентификации микроорганизмов включают:
В патенте США №6177266 раскрыт способ хемотаксономической классификации бактерий биомаркерами, специфичными для рода, вида и штамма, созданными с помощью анализа масс-спектрометрии времяпролетной ионизации лазерной десорбцией с использованием матрицы (MALDI-TOF-MS) либо клеточных белковых экстрактов, либо целых клеток.
В патенте США №7070739 представлен способ экстракции, разделения и очистки микроорганизмов, включая вирусы, путем двумерного ультрацентрифугирования непосредственно из жидкостей организма или из гомогенизированной ткани. На первой стадии центрифугирования удаляют все частицы, имеющие более высокую скорость седиментации, чем те из микроорганизмов, которые нужно идентифицировать. На второй стадии ультрацентрифугирования используют зональное центрифугирование в градиенте плотности в жидкостях, заполненных с образованием градиента плотности широкого диапазона, используя специальные рифленые центрифужные пробирки. В соответствии с этим патентом этот метод разделения можно использовать для определения сгруппированных частиц с помощью светорассеяния или флуоресценции, используя красители, специфичные для нуклеиновых кислот, и для выделения сгруппированных частиц в очень малых объемах для характеристики с помощью масс-спектрометрии субъединиц вирусных белков и интактных вирусных частиц, а также с помощью флуоресцентного проточного цитометрического определения как массы нуклеиновых кислот, так и масс фрагментов, образуемых ферментами рестрикции.
В опубликованной заявке на патент США №2007/0175278 описано использование жидкой культуральной среды для культивирования интересующего образца, включающего, например, кровь, мочу, фекалии, внутривенные катетеры и т.д., линии промышленного производства, водные системы, пищевой продукт, косметическое изделие, фармацевтический препарат и криминалистический образец. Следовательно, микроорганизмы могут быть собраны из жидкой среды способами, известными в данной области техники, например, центрифугированием. Затем концентрированные микроорганизмы можно переносить на материал-носитель, необязательно после высушивания, для получения вибрационного спектра. В заявке на патент обсуждены различные способы идентификации и классификации микроорганизмов, включая вибрационную спектроскопию, такую как рамановская спектроскопия.
Однако эти способы имеют несколько недостатков при попытке разделить и охарактеризовать микроорганизмы из комплексных образцов, таких как культуральные среды, содержащие кровь. Полученные в результате препараты микроорганизмов часто содержат загрязняющие эритроциты, тромбоциты, липидные частицы, плазматические ферменты и клеточный детрит, что может вызвать плохие результаты. Эти способы также являются очень трудоемкими и небезопасными за счет стадий, которые могут привести в результате к аэрозольному воздействию потенциально опасных патогенов на пользователя. Необходимы простые, безопасные и надежные способы выделения микроорганизмов из клинических образцов (например, гемокультуры) и других комплексных образцов, которые свободны от этих интерферирующих материалов и совместимы с технологиями быстрой идентификации.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены способы разделения, характеристики и/или идентификации микроорганизмов в образце. Эти способы дают возможность характеристики и/или идентификации микроорганизмов быстрее, чем методы предшествующего уровня техники, приводя в результате к более быстрым диагнозам (например, у субъекта, страдающего или подозреваемого на септицемию) и идентификации зараженных материалов (например, пищевых продуктов и фармацевтических препаратов). Стадии, включенные в способы по изобретению, от получения образца для характеристики и/или идентификации микроорганизмов до получения клинически релевантной информации, дающей основания для действий, можно осуществлять в очень короткой временной рамке, например, менее чем примерно за 120 минут.
В одном аспекте настоящее изобретение направлено на способ характеристики и/или идентификации микроорганизма из тестируемого образца, включающий:
(a) получение тестируемого образца, о котором известно, что он содержит или может содержать микроорганизмы;
(b) селективный лизис клеток не микроорганизмов в тестируемом образце с получением лизированного образца;
(c) разделение микроорганизмов от других компонентов лизированного образца с образованием изолированного образца микроорганизма;
(d) исследование изолированного образца микроорганизма с помощью масс-спектрометрии для снятия масс-спектра этого микроорганизма; и
(e) характеристику и/или идентификацию этого микроорганизма в изолированном образце путем сравнения измеренного масс-спектра с референсными масс-спектрами и/или с известными или предсказанными массами клеточных компонентов известных микроорганизмов.
Еще в одном другом аспекте настоящее изобретение направлено на способ характеристики и/или идентификации микроорганизма из гемокультуры, включающий:
(a) получение образца из гемокультуры, о которой известно, что она содержит или может содержать микроорганизмы;
(b) селективный лизис клеток не микроорганизмов в образце с получением лизированного образца;
(c) наслаивание лизированного образца на плотностный буфер в герметичном контейнере;
(d) центрифугирование контейнера для разделения микроорганизмов от других компонентов образца и образование осадка микроорганизмов;
(e) исследование изолированного образца микроорганизмов с помощью масс-спектрометрии для снятия масс-спектра этого микроорганизма; и
(f) характеристику и/или идентификацию данного микроорганизма в изолированном образце путем сравнения измеренного масс-спектра с референсными масс-спектрами и/или с известными или предсказанными массами клеточных компонентов известных микроорганизмов.
Еще в одном аспекте настоящего изобретения селективный лизис клеток проводят с помощью лизирующего раствора, дополнительно содержащего композицию ферментов, включающую одну или более чем одну протеиназу и одну или более чем одну нуклеазу.
Еще в одном другом аспекте настоящее изобретение направлено на способ характеристики и/или идентификации микроорганизма, включающий:
(a) получение тестируемого образца, о котором известно, что он содержит или может содержать микроорганизмы;
(b) наслаивание тестируемого образца на плотностный буфер в контейнере;
(c) центрифугирование контейнера для разделения микроорганизмов от других компонентов образца и образование осадка микроорганизмов;
(d) исследование осадка с помощью масс-спектрометрии для снятия масс-спектра этого микроорганизма; и
(e) характеристику и/или идентификацию данного микроорганизма в изолированном образце путем сравнения измеренного масс-спектра с референсными масс-спектрами и/или с известными или предсказанными массами клеточных компонентов известных микроорганизмов.
В одной форме осуществления разделение осуществляют путем наслаивания тестируемого образца на плотностный буфер в контейнере и центрифугирование контейнера для осаждения микроорганизмов, в то время как среда тестируемого образца остается сверху плотностного буфера.
В другой форме осуществления способы включают стадию выделения осадка микроорганизма, ресуспендирования микроорганизма, отбора образца из суспензии и введения в масс-спектрометр и проведения масс-анализа на образце.
В другой форме осуществления способы дополнительно включают стадию выделения осадка микроорганизма, ресуспендирования микроорганизма и проведения дополнительных тестов идентификации или характеристики (например, лекарственной устойчивости, факторов вирулентности, антибиограммы).
Настоящее изобретение более подробно объяснено в графических материалах данной заявки и в приведенном ниже описании.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фиг.1 показаны масс-спектры различных микроорганизмов, обработанных и выделенных из гемокультуры.
На фиг.2 показаны масс-спектры пяти изолятов S.aureus, обработанных и выделенных из гемокультуры.
На фиг.3 показано сравнение масс-спектров Е.coli непосредственно с чашек с агаром и Е.coli, обработанной из культуральной среды гемокультуры в соответствии с настоящим изобретением.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение может быть осуществлено в различных формах и не должно рассматриваться как ограниченное формами осуществления, изложенными в данной заявке. Вероятнее, эти формы осуществления представлены, чтобы данное описание было более тщательным и полным и полностью передавало объем изобретения специалистам в данной области техники. Например, признаки, проиллюстрированные в отношении одной формы осуществления, могут быть включены в другие формы осуществления, а признаки, проиллюстрированные в отношении конкретной формы осуществления, могут быть удалены из этой формы осуществления. Кроме того, различные изменения и дополнения к предложенным здесь формам осуществления, которые не отклоняются от настоящего изобретения, будут очевидны специалистам в данной области техники в свете настоящего описания.
Если не определено иное, все технические и научные термины, используемые в данной заявке, имеют то же значение, которое общепринято понимают обычные специалисты в области техники, к которой принадлежит данное изобретение. Терминология, используемая в описании изобретения в данной заявке, предназначена только для целей описания конкретных форм осуществления и не предназначена для ограничения изобретения.
Определения
Как используют в данной заявке, единственное число может означать одно или более чем одно. Например, "клетка" может означать единственную клетку или множество клеток.
Как используют в данной заявке, "и/или" также относится к любой или ко всем возможным комбинациям одного или более чем одного из сопутствующих перечисленных пунктов и включает их, а также отсутствие комбинаций при интерпретации в альтернативе ("или").
Кроме того, термин "примерно", как используют в данной заявке по отношению к измеримому значению, такому как количество соединения или агента по данному изобретению, доза, время, температура и тому подобное, подразумевают как охватывающий вариации ±20%, ±10%, ±5%, ±1%, ±0,5% или даже ±0,1% указанного количества.
Как используют в данной заявке, термин "микроорганизм" предназначен для включения организмов, которые являются в целом одноклеточными, которые можно размножать и держать в лаборатории, включающие, но не ограниченные ими, грамположительные или грамотрицательные бактерии, дрожжи, плесневые грибы, паразиты и молликуты. Неограничивающие примеры грамотрицательных бактерий по данному изобретению включают бактерии следующих родов: Pseudomonas, Escherichia, Salmonella, Shigella, Enterobacter, Klebsiella, Serratia, Proteus, Campylobacter, Haemophilus, Morganella, Vibrio, Yersinia, Acinetobacter, Stenotrophomonas, Brevundimonas, Ralstonia, Achromobacter, Fusobacterium, Prevotella, Branhamella, Neisseria, Burkholderia, Citrobacter, Hafhia, Edwardsiella, Aeromonas, Moraxella, Brucella, Pasteurella, Providencia и Legionella. Heограничивающие примеры грамположительных бактерий по данному изобретению включают бактерии следующих родов: Enterococcus, Streptococcus, Staphylococcus, Bacillus, Paenibacillus, Lactobacillus, Listeria, Peptostreptococcus, Propionibacterium, Clostridium, Bacteroides, Gardnerella, Kocuria, Lactococcus, Leuconostoc, Micrococcus, Mycobacteria и Corynebacteria. Heограничивающие примеры дрожжей и плесневых грибов по данному изобретению включают дрожжи и плесневые грибы из следующих родов: Candida, Cryptococcus, Nocardia, Penicillium, Alternaria, Rhodotorula, Aspergillus, Fusarium, Saccharomyces и Trichosporon. He ограничивающие примеры паразитов по данному изобретению включают паразиты из следующих родов: Trypanosoma, Babesia, Leishmania, Plasmodium, Wucheria, Brugia, Onchocerca и Naegleria. Heограничивающие примеры молликутов по данному изобретению включают молликуты из следующих родов: Mycoplasma и Ureaplasma.
В одной форме осуществления, как более подробно описано здесь, микроорганизмы из образца или из ростовой среды можно разделить и исследовать, чтобы охарактеризовать и/или идентифицировать микроорганизм, присутствующий в образце. Как используют в данной заявке, термин "разделить" подразумевают как включающий любой образец микроорганизмов, который извлечен, сконцентрирован или иначе удален из его исходного состояния или из ростовой или культуральной среды. Например, в соответствии с данным изобретением микроорганизмы могут быть отделены (например, в виде разделенного образца) от не микроорганизмов или компонентов не микроорганизмов, которые иначе могут мешать характеристике и/или идентификации. Этот термин может включать слой микроорганизмов, проложенный между двумя другими слоями, например, микроорганизмы, собранные наверху градиента высокой плотности после центрифугирования, или слой микроорганизмов, собранный на твердой поверхности (например, на мембране фильтра). Этот термин может также включать коллекцию микроорганизмов, которая частично прошла через слой (например, плотностный буфер). Как таковой, разделенный образец микроорганизмов может включать любую коллекцию или слой микроорганизмов и/или их компонентов, которые являются более концентрированными, либо иначе отделенными от исходного образца, и могут находиться в диапазоне от тесно упакованного плотного комка микроорганизмов до диффузного слоя микроорганизмов. Компоненты микроорганизмов, которые могут содержаться в разделенной форме или в образце, включают без ограничения пили, флагеллы, фимбрии и капсулы в любой комбинации. Компоненты не микроорганизмов, которые отделяют от микроорганизмов, могут включать клетки не микроорганизмов (например, клетки крови и/или клетки другой ткани) и/или любые их компоненты.
Еще в одной другой форме осуществления, как более подробно описано здесь, микроорганизмы из образца или из ростовой среды могут быть изолированы и исследованы, чтобы охарактеризовать и/или идентифицировать микроорганизм, присутствующий в образце. Как используют в данной заявке, термин "изолированный" предназначен для включения любого образца микроорганизмов, который по меньшей мере частично очищен от его исходного состояния или от ростовой или культуральной среды и любых не микроорганизмов или компонентов не микроорганизмов, содержащихся в ней. Например, в соответствии с данным изобретением микроорганизмы могут быть изолированы (например, в виде изолированного образца) от не микроорганизмов или компонентов не микроорганизмов, которые иначе могут мешать характеристике и/или идентификации. Компоненты не микроорганизмов, которые отделяют от микроорганизмов, могут включать клетки не микроорганизмов (например, клетки крови и/или клетки другой ткани) и/или любые их компоненты.
Еще в одной другой форме осуществления, как более подробно описано здесь, микроорганизмы из образца или из ростовой среды могут быть осаждены и исследованы, чтобы охарактеризовать и/или идентифицировать микроорганизм, присутствующий в образце. Как используют в данной заявке, термин "осадок" предназначен для включения любого образца микроорганизмов, который спрессован или депонирован в массе микроорганизмов. Например, микроорганизмы из образца можно спрессовать или депонировать в массе на дне пробирки центрифугированием или другими способами, известными в данной области техники. Этот термин включает коллекцию микроорганизмов (и/или их компонентов) на дне и/или стенках контейнера после центрифугирования. Компоненты микроорганизмов, которые могут содержаться в осадке, включают без ограничения пили, флагеллы, фимбрии и капсулы в любой комбинации. В соответствии с данным изобретением микроорганизмы могут быть осаждены (например, в виде по существу очищенного осадка микроорганизмов) из не микроорганизмов или компонентов не микроорганизмов, которые иначе могут мешать характеристике и/или идентификации. Компоненты не микроорганизмов, которые отделяют от микроорганизмов, могут включать клетки не микроорганизмов (например, клетки крови и/или клетки другой ткани) и/или любые их компоненты.
Как используют в данной заявке, термин "плотностный буфер" относится к раствору, имеющему однородную плотность по всему раствору.
В настоящем изобретении предложены способы изоляции, характеристики и/или идентификации микроорганизмов в образце. Кроме того, этот способ может быть, в частности, полезен для разделения, характеристики и/или идентификации микроорганизмов из комплексных образцов, таких как культуральная среда, содержащая кровь. Быстрые способы также дают возможность для характеристики и/или идентификации микроорганизмов быстрее, чем методы предшествующего уровня техники, что приводит в результате к более быстрым диагнозам (например, у субъекта, страдающего или подозреваемого на септицемию) и характеристике/идентификации зараженных материалов (например, пищевых продуктов и фармацевтических препаратов). Стадии, вовлеченные в способы по изобретению, от получения образца до характеристики/идентификации микроорганизмов, можно осуществлять в очень короткой временной рамке с получением клинически релевантной информации, дающей основания для действий. В некоторых формах осуществления способы по изобретению можно осуществлять менее чем примерно за 120 минут, например, менее чем примерно за 110, 100, 90, 80, 70, 60, 50, 40, 30, 20, 15, 10, 5, 4, 3, 2 или 1 минуту. Огромная скорость способов по изобретению представляет усовершенствование по сравнению со способами предшествующего уровня техники. Эти способы можно применять для характеристики и/или идентификации любого микроорганизма, как описано в данной заявке. В одной форме осуществления микроорганизм представляет собой бактерию. В другой форме осуществления микроорганизм представляет собой дрожжи. В другой форме осуществления микроорганизм представляет собой плесневый гриб. В следующей форме осуществления микроорганизм представляет собой паразит. В другой форме осуществления микроорганизм представляет собой молликут. Кроме того, способы по изобретению могут быть полностью автоматизированы, уменьшая за счет этого риск обращения с инфекционными материалами и/или заражения образцов.
В одном аспекте настоящее изобретение направлено на способ характеристики и/или идентификации микроорганизма из тестируемого образца, включающий:
(a) получение тестируемого образца, о котором известно, что он содержит или может содержать микроорганизмы;
(b) селективный лизис клеток не микроорганизмов в тестируемом образце с получением лизированного образца;
(c) разделение микроорганизмов от других компонентов лизированного образца с образованием изолированного образца микроорганизма;
(d) исследование изолированного образца микроорганизма с помощью масс-спектрометрии для снятия масс-спектра этого микроорганизма; и
(e) характеристику и/или идентификацию этого микроорганизма в изолированном образце путем сравнения измеренного масс-спектра с референсными масс-спектрами и/или с известными или предсказанными массами клеточных компонентов известных микроорганизмов.
В другом аспекте настоящее изобретение направлено на способ характеристики и/или идентификации микроорганизма, включающий:
(a) получение тестируемого образца, известного как содержащий, или который может содержать микроорганизмы;
(b) наслаивание тестируемого образца на плотностный буфер в контейнере;
(c) центрифугирование контейнера для разделения микроорганизмов от других компонентов образца и образование осадка микроорганизмов;
(d) исследование осадка с помощью масс-спектрометрии для снятия масс-спектра этого микроорганизма; и
(e) характеристику и/или идентификацию данного микроорганизма в изолированном образце путем сравнения измеренного масс-спектра с референсными масс-спектрами и/или с известными или предсказанными массами клеточных компонентов известных микроорганизмов.
В другой форме осуществления изобретения способы включают выделение осадка микроорганизмов, образованного во время стадии отделения, или их части из разделительного контейнера перед исследованием микроорганизмов. Например, после образования осадка жидкости можно отсосать от осадка, а осадок ресуспендировать в подходящей среде (например, в среде, в которой микроорганизмы жизнеспособны). Ресуспендированные микроорганизмы можно извлечь из разделительного контейнера. Затем микроорганизмы можно исследовать для характеристики и/или идентификации, например, в суспензии или после того, как они повторно осаждены. В других формах осуществления ресуспендированные микроорганизмы можно исследовать в разделительном контейнере, например, в суспензии или после того, как они повторно осаждены. В следующей форме осуществления микроорганизмы, выделенные из осадка, можно использовать непосредственно для дальнейшего исследования (например, масс-спектроскопией) без ресуспендирования.
Образцы
Образцы, которые можно тестировать (то есть тестируемый образец) способами по изобретению, включают как клинические, так и неклинические образцы, в которых присутствие и/или рост микроорганизма существует, либо его можно подозревать, а также образцы материалов, которые обычно или время от времени тестируют на присутствие микроорганизмов. Количество используемого образца может значительно варьировать в зависимости от универсальности и/или чувствительности способа. Получение образца можно осуществить с помощью любого набора методик, известных специалистам в данной области техники, хотя одно из преимуществ настоящего изобретения состоит в том, что комплексные типы образцов, такие как, например, кровь, жидкости организма и/или другие непрозрачные вещества, можно тестировать непосредственно, используя систему небольшой обработки или без обширной обработки. В одной форме осуществления образец берут из культуры. В другой форме осуществления образец берут из микробиологической культуры (например, гемокультуры). В другой форме осуществления образец подозревают на наличие в нем микроорганизмов, либо оно известно.
Клинические образцы, которые можно тестировать, включают любой тип образца, типично тестируемого в клинических или исследовательских лабораториях, включая, но не ограничиваясь ими, кровь, сыворотку, плазму, фракции крови, суставную жидкость, мочу, семенную жидкость, слюну, фекалии, цереброспинальную жидкость, содержимое желудка, вагинальные секреции, гомогенаты тканей, пунктаты костного мозга, костные гомогенаты, мокроту, пунктаты, мазки и промывные воды мазков, другие жидкости организма и тому подобное. В другой форме осуществления клинический образец можно культивировать и использовать образец культуры.
Настоящее изобретение находит применение как в исследованиях, так и в ветеринарных и медицинских областях применения. Подходящими субъектами, от которых могут быть получены клинические образцы, обычно являются субъекты млекопитающих, но может быть и любое животное. Термин "млекопитающее", как используют в данной заявке, включает, но не ограничен ими, людей, приматов, не являющихся человеком, крупный рогатый скот, овец, коз, свиней, лошадей, кошек, собак, кроликов, грызунов (например, крыс или мышей) и т.д. Субъекты-люди включают новорожденных, детей, подростков, взрослых и пожилых субъектов. Субъекты, от которых могут быть получены образцы, включают без ограничения млекопитающих, птиц, рептилий, амфибий и рыб.
Неклинические образцы, которые можно тестировать, также включают вещества, охватывающие, но не ограниченные ими, пищевые продукты, напитки, фармацевтические препараты, косметические изделия, воду (например, питьевую воду, не питьевую воду и сточные воды), балласты морской воды, воздух, почву, бытовые стоки, растительный материал (например, семена, листья, стебли, корни, цветы, плоды), препараты крови (например, тромбоциты, сыворотку, плазму, фракции лейкоцитов и т.д.), образцы донорских органов или тканей, образцы биологического оружия и тому подобное. Способ также особенно хорошо пригоден для тестирования в реальном времени для мониторинга уровней заражения, контроля процесса, контроля качества и тому подобного в промышленных условиях. В другой форме осуществления неклинический образец можно культивировать и использовать образец культуры.
В одной форме осуществления изобретения образцы получают от субъекта (например, пациента), страдающего или подозреваемого на инфекцию микроорганизмов. В одной форме осуществления субъект страдает или подозреваем на септицемию, например, бактериемию или фунгемию. Образец может представлять собой образец крови непосредственно от субъекта. Образец может быть взят из гемокультуры, выращенной из образца крови пациента, например, гемокультуры BacT/ALERT®. Образец гемокультуры может быть взят из положительной гемокультуры, например, гемокультуры, которая показывает присутствие микроорганизма. В некоторых формах осуществления образец берут из положительной гемокультуры в пределах короткого времени после того, как она оказывается положительной, например, в пределах примерно 6 часов, например, в пределах примерно 5, 4, 3 или 2 часов или в пределах примерно 60 минут, например, примерно 55, 50, 45, 40, 35, 30, 25, 20, 15, 10, 5, 4, 3, 2 или 1 минуты. В одной форме осуществления образец берут из культуры, в которой микроорганизмы находятся в log фазе роста. В другой форме осуществления образец берут из культуры, в которой микроорганизмы находятся в стационарной фазе.
Настоящее изобретение обеспечивает высокую чувствительность обнаружения, характеристики и/или идентификации микроорганизмов. Это дает возможность обнаружения, характеристики и/или идентификации без первоначальной необходимости в прохождении стадий изоляции микроорганизмов путем выращивания их на твердой или полутвердой среде и отбора выросших колоний. Таким образом, в одной форме осуществления изобретения образец не является образцом из колонии микроорганизма (например, бактерии, дрожжей или плесневого гриба), выращенной на твердой или полутвердой поверхности.
Объем образца должен быть достаточно большим, чтобы получить изолированный образец микроорганизмов или осадок микроорганизмов, который можно исследовать после осуществления стадии отделения/изоляции способов по изобретению. Соответствующие объемы будут зависеть от источника образца и предполагаемого уровня микроорганизмов в образце. Например, положительная гемокультура будет содержать более высокий уровень микроорганизмов на объем, чем образец питьевой воды, подлежащий тестированию на заражение, поэтому меньший объем среды гемокультуры может быть необходим по сравнению с образцом питьевой воды. Как правило, размер образца может составлять менее чем примерно 50 мл, например, менее чем примерно 40, 30, 20, 15, 10, 5, 4, 3 или 2 мл. В некоторых формах осуществления размер образца может составлять примерно 1 мл, например, примерно 0,75, 0,5 или 0,25 мл. В некоторых формах осуществления, в которых разделение осуществляют в микромасштабе, размер образца может составлять менее чем примерно 200 мкл, например, менее чем примерно 150, 100, 50, 25, 20, 15, 10 или 5 мкл. В некоторых формах осуществления (например, когда ожидают, что образец содержит малое число микроорганизмов), размер образца может составлять примерно 100 мл или более, например, примерно 250, 500, 750 или 1000 мл или более.
Необязательная стадия лизиса
В некоторых формах осуществления после получения образца следующая стадия в способе по настоящему изобретению состоит в селективном лизисе нежелательных клеток, которые могут присутствовать в образце, например, клеток крови и/или клеток ткани. Клетки можно подвергать лизису, чтобы дать возможность отделить микроорганизмы от других компонентов образца. Отделение микроорганизмов от других компонентов предотвращает интерференцию во время стадии исследования. Если не ожидают, что клетки не микроорганизмов присутствуют в образце, или не ожидают, что они интерферируют на стадии исследования, нет необходимости проводить стадию лизиса. В одной форме осуществления клетками, подлежащими лизису, являются клетки не микроорганизмов, которые присутствуют в образце, но клетки микроорганизмов, которые могут присутствовать в образце, не подвергаются лизису. Однако в некоторых формах осуществления селективный лизис определенных классов микроорганизмов может быть желателен, и, следовательно, его можно осуществлять в соответствии со способами, как описанными в данной заявке, так и хорошо известными в данной области техники. Например, класс нежелательных микроорганизмов можно подвергать селективному лизису, например, дрожжи подвергаются лизису, тогда как бактерии не подвергаются, или наоборот. В другой форме осуществления желательные микроорганизмы подвергают лизису с целью отделения конкретного субклеточного компонента микроорганизмов, например, клеточных мембран или органелл. В одной форме осуществления все клетки не микроорганизмов подвергают лизису. В других формах осуществления часть клеток не микроорганизмов подвергают лизису, например, достаточное количество клеток, чтобы предотвратить интерференцию на стадии исследования, лизис клеток можно осуществлять любым способом, известным в данной области техники как эффективный для селективного лизиса клеток без лизиса или с лизисом микроорганизмов, включающим без ограничения добавление раствора для лизиса, разрушение ультразвуком, осмотический шок, химическую обработку и/или их комбинацию.
Раствор для лизиса является таким, чтобы обладать способностью к лизису клеток, например, клеток не микроорганизмов (например, путем солюбилизации мембран эукариотических клеток) и/или клеток микроорганизмов. В одной форме осуществления раствор для лизиса может содержать один или более чем один детергент и один или более чем один фермент и может, кроме того, включать дополнительные агенты. В одной форме осуществления детергент может представлять собой неденатурирующий литический детергент, такой как Тритон® Х-100, Тритон® X-100-R, Тритон® Х-114, NP-40, Genapol® C-100, Genapol® Х-100, Igepal® СА 630, Arlasolve™200, Brij® 96/97, CHAPS (3-[(3-холанидопропил)диметиламмоний]-1-пропансульфонат), октил-пара-D-глюкопиранозид, сапонин и нонаэтиленгликоля монододециловый эфир (С12Е9, полидоценол). Необязательно можно включать денатурирующие литические реагенты, такие как додецилсульфат натрия, М-лаурилсаркозин, деоксихолат натрия, желчные соли, гексадецилтриметиламмония бромид, SB3-10, SB3-12, амидосульфобетаин-14 и C7BzO. Необязательно можно также включать солюбилизаторы, такие как Brij® 98, Brij® 58, Brij® 35, Твин® 80, Твин® 20, Pluronic® L64, Pluronic® P84, недетергентные сульфобетаины (NDSB 201), амфиполы (PMAL-C8) и метил-β-цикподекстрин. Типично неденатурирующие детергенты и солюбилизаторы используют при концентрациях выше их критической концентрации мицеллообразования (ККМ), тогда как денатурирующие детергенты можно добавлять при концентрациях ниже их ККМ. Например, неденатурирующие литические детергенты можно использовать при концентрации от примерно 0,010% до примерно 10%, например, от примерно 0,015% до примерно 1,0%, например, от примерно 0,05% до примерно 0,5%, например, от примерно 0,10% до примерно 0,30% (конечная концентрация после разведения образцом). В другой форме осуществления могут быть предпочтительны детергенты, представляющие собой полиоксиэтиленовый детергент. Полиоксиэтиленовый детергент может содержать структуру C12-18/E9-10, где C12-18 обозначает длину углеродной цепи от 12 до 18 атомов углерода, а Е9-10 означает от 9 до 10 оксиэтиленовых гидрофильных концевых групп. Например, полиоксиэтиленовый детергент может быть выбран из группы, состоящей из Brij 97, Bnj 96V, Genapol® C-100, Genapol® Х-100, нонаэтиленгликоля монододецилового эфира (полидоценола) или их комбинации.
Ферменты, которые можно использовать в растворах для лизиса, включают без ограничения ферменты, которые расщепляют нуклеиновые кислоты и другие вещества, загрязняющие мембрану (например, протеиназу XXIII, ДНКазу, нейраминидазу, полисахаридазу, Glucanex® и Pectinex®). Другие добавки, которые можно использовать, включают без ограничения восстанавливающие агенты, такие как 2-меркаптоэтанол (2-Ме) или дитиотрейтол (DTT), и стабилизирующие агенты, такие как магний, пируват, а также увлажнители. Раствор для лизиса может быть забуферен при любом рН, который пригоден для лизиса желаемых клеток и зависит от множества факторов, включающих без ограничения тип образца, клетки, подлежащие лизису, и используемый детергент. В некоторых формах осуществления рН может находиться в диапазоне от примерно 2 до примерно 13, например, от примерно 6 до примерно 13, например, от примерно 8 до примерно 13, например, от примерно 10 до примерно 13. Буферы с подходящим рН включают любой буфер, способный к поддержанию рН в желаемом диапазоне, например, от примерно 0,05 М до примерно 1,0 М CAPS.
В одной форме осуществления образец и раствор для лизиса смешивают, а затем инкубируют в течение достаточного времени для того, чтобы произошла солюбилизация клеточных мембран, например, в течение 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 40, 50 или 60 секунд или примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 15 или 20 минут или дольше, например, от примерно 1 секунды до примерно 20 минут, от примерно 1 секунды до примерно 5 минут или от примерно 1 секунды до примерно 2 минут. Время инкубации зависит от силы раствора для лизиса, например, от концентрации детергента и/или ферментов. Как правило, более мягкие буферы для лизиса потребуют больше времени и большего разведения образца, чтобы полностью солюбилизировать клетки не микроорганизмов. Сила раствора для лизиса может быть выбрана на основе микроорганизмов, известных или подозреваемых на нахождение в образце. Для микроорганизмов, которые более чувствительны к лизису, можно использовать мягкий раствор для лизиса. Лизис может происходить при температуре от примерно 2°С до примерно 45°С, например, от примерно 15°С до примерно 40°С, например, от примерно 30°С до примерно 40°С. В одной форме осуществления раствор для лизиса можно набрать в шприц, а затем образец можно засасывать в шприц, так чтобы смешивание и инкубация происходили в шприце.
В некоторых формах осуществления как условия лизиса (например, раствор или время инкубации), так и стадии разделения и/или исследования могут быть достаточны для уничтожения некоторых или всех микроорганизмов в образце. Способы по настоящему изобретению в высокой степени универсальны и не требуют, чтобы все микроорганизмы были живыми, чтобы происходила изоляция и идентификация. В некоторых формах осуществления некоторые или все микроорганизмы могут быть мертвыми, где их гибель произошла до, во время и/или после осуществления стадий способов.
Дополнительные подробности и описание буферов для лизиса, рассматриваемых в практике данного изобретения, раскрыты в совместно поданной заявке на патент США, серийный №12/589,929, поданной 30 октября 2009, озаглавленной "Methods for Isolation and Identification of Microorganisms", содержание которой включено в данную заявку посредством ссылки.
Стадия разделения
Следующей стадией в способе по настоящему изобретению (например, стадией после того, как образец лизирован, если проводят стадию лизиса) является стадия разделения. Стадию разделения можно осуществлять, чтобы разделить микроорганизмы от других компонентов образца (например, не микроорганизмов или их компонентов) и сконцентрировать микроорганизмы в осадке, который можно исследовать в целях идентификации и характеристики. Разделение не обязательно должно быть полным, то есть не требуется, чтобы произошло 100% разделение. Требуется только то, чтобы разделение микроорганизмов от других компонентов образца было достаточным, чтобы дать возможность исследовать микроорганизмы без существенной интерференции со стороны других компонентов. Например, разделение может привести в результате к осадку микроорганизмов, который является чистым по меньшей мере на 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 96, 97, 98 или 99% или выше.
В одной форме осуществления разделение осуществляют посредством стадии центрифугирования, на которой образец (например, лизированный образец) помещают сверху на плотностный буфер в разделительном контейнере, и контейнер центрифугируют в условиях, которые дают возможность изолировать микроорганизмы (например, микроорганизмы могут образовать осадок на дне и/или на стенках контейнера). В соответствии с данной формой осуществления другие компоненты образца (например, не микроорганизмы или их компоненты, которые могут присутствовать в среде образца) остаются сверху на плотностном буфере или внутри верхней части плотностного буфера. Обычно для стадии разделения можно использовать любой известный контейнер. В одной форме осуществления разделительный контейнер представляет собой сепаратор, раскрытый в родственной заявке на патент, серийный №12/589,969, поданной 30 октября 2009, озаглавленной "Separation Device for Use in the Separation, Characterization and/or Identification of Microorganisms". Данная стадия разделения изолирует микроорганизмы от материалов в образце, таких как среда, клеточный детрит и/или другие компоненты, которые могли бы интерферировать при исследовании микроорганизмов (например, за счет собственной флуоресценции). В одной форме осуществления плотностный буфер также служит для разделения живых микроорганизмов и мертвых микроорганизмов (которые не проходят через плотностный буфер). В другой форме осуществления плотностный буфер не содержит градиента плотности ни до, ни после центрифугирования. Иными словами, разделительный контейнер не центрифугируют в течение достаточного количества времени и/или с достаточным ускорением для материала, образующего плотностный буфер, чтобы создать градиент плотности.
Плотность буфера выбрана таким образом, чтобы микроорганизмы в образце проходили через этот буфер, тогда как другие компоненты образца (например, культуральная среда гемокультуры, клеточный детрит) оставались сверху на плотностном буфере или не проходили весь путь через плотностный буфер. Плотностный буфер может быть также выбран таким образом, чтобы разделить живые микроорганизмы (которые проходят через буфер) и мертвые микроорганизмы (которые не проходят через буфер). Подходящие плотности будут зависеть от материала, используемого в плотностном буфере, и от образца, подлежащего разделению. В одной форме осуществления плотность буфера находится в интервале от примерно 1,025 до примерно 1,120 г/мл, например, от примерно 1,030 до примерно 1,070 г/мл, от примерно 1,040 до примерно 1,060 г/мл или в любом интервале от примерно 1,025 до примерно 1,120 г/мл. В другой форме осуществления плотность буфера составляет примерно 1,025, 1,030, 1,035, 1,040, 1,045, 1,050, 1,055, 1,060, 1,065, 1,070, 1,075, 1,080, 1,085, 1,090, 1,095, 1,100, 1,105, 1,110, 1,115 или 1,120 г/мл.
Материал для плотностного буфера может представлять собой любой материал, который имеет соответствующий диапазон плотности для способов по данному изобретению. В одной форме осуществления этот материал представляет собой коллоидный кремнезем. Коллоидный кремнезем может быть без покрытия (например, Ludox® (W.R.Grace, СТ)) или с покрытием, например, силаном (например, PureSperm® (Nidacon Int'l, Швеция) или Isolate® (Irvine Scientific, Santa Ana, CA)) или поливинилпирролидоном (например, Percoll™, Percoll™ Plus (Sigma-Aldrich, St. Louis, МО)). В одной форме осуществления выбран коллоидный кремнезем, проявляющий наименьшую интерференцию при спектроскопическом исследовании, например, материал с самой низкой собственной флуоресценцией. Коллоидный кремнезем может быть разведен в любой подходящей среде с образованием соответствующей плотности, например, в сбалансированных солевых растворах, в физиологическом растворе и/или в 0,25 М сахарозе. Соответствующие плотности могут быть получены с коллоидным кремнеземом при концентрации от примерно 15% до примерно 80% об./об., например, от примерно 20% до примерно 65% об./об. Другим подходящим материалом для плотностного буфера является йодированный контрастный агент, например, йогексол (Omnipaque™, NycoPrep™ или Nycodenz®) и йодиксанол (Visipaque™ или OptiPrep™). Соответствующие плотности могут быть получены с йогексолом или йодиксанолом при концентрации от примерно 10% до примерно 25% мас./об., например, от примерно 14% до примерно 18% мас./об., для образцов гемокультуры. Сахарозу можно использовать в качестве плотностного буфера при концентрации от примерно 10% до примерно 30% мас./об., например, от примерно 15% до примерно 20% масс./об., для образцов гемокультуры. Другие подходящие материалы, которые можно использовать для получения плотностного буфера, включают масла низкой вязкости, высокой плотности, такие как иммерсионное масло для микроскопа (например, Type DF; Cargille Labs, Нью-Йорк), минеральное масло (например, Drakeol®5, Draketex 50, Peneteck®; Penreco Co., Пенсильвания), силиконовое масло (полидиметилсилоксан), фторсиликоновое масло, силиконовый гель, метризоат-Фиколл® (LymphoPrep™), например, при концентрации от примерно 75% до примерно 100% для образцов гемокультуры, диатризоат-декстран (PolymorphoPrep™), например, при концентрации от примерно 25% до примерно 50% для образцов гемокультуры, карбоксиметилцеллюлозу, гидроксипропилметилцеллюлозу, полиэтиленоксид (высокой молекулярной массы), Pluronic® F127, Pluronic® F68, смеси соединений Pluronic®, полиакриловую кислоту, сшитый поливиниловый спирт, сшитый поливинилпирролидин, сополимер ПЭГ метилового эфира и метакрилата, пектин, агарозу, ксантан, геллан, Phytagel®, сорбит, Фиколл® (например, Фиколл® 400 при концентрации от примерно 10% до примерно 15% для образцов гемокультуры), глицерин, декстран (например, при концентрации от примерно 10% до примерно 15% для образцов гемокультуры), гликоген, хлорид цезия (например, при концентрации от примерно 15% до примерно 25% для образцов гемокультуры), перфторуглеродные жидкости (например, перфтор-н-октан), гидрофторуглеродные жидкости (например, Vertrel XF) и тому подобное, которые хорошо известны в данной области техники. В одной форме осуществления плотностный буфер выбран из одного или более чем одного из коллоидного кремнезема, йодиксанола, йогексола, хлорида цезия, метризоат-Фиколла®, диатризоат-декстрана, сахарозы, Фиколла® 400 и/или декстрана в любой комбинации. Плотностный буфер может также состоять из комбинации материалов, например, комбинации коллоидного кремнезема и масла. Некоторые комбинации вышеописанных соединений могут быть полезны для стадий разделения и считывания по настоящему изобретению.
Объем/высота плотностного буфера должна быть достаточна, чтобы достичь разделения микроорганизмов от других компонентов образца. Объем будет зависеть от размера и формы разделительного контейнера. Как правило, можно использовать объем от примерно 0,1 до примерно 5 мл, например, от примерно 0,2 до примерно 1 мл, например, от примерно 0,2 мл до примерно 0,5 мл. Если разделение осуществляют в микромасштабе, объем плотностного буфера может составлять от примерно 1 мкл до примерно 100 мкл, например, от примерно 5 мкл до примерно 50 мкл. Объем образца, нанесенного или наслоенного сверху на плотностный буфер, должен быть достаточным, чтобы обеспечить достаточное количество микроорганизмов для получения осадка, пригодного для исследования. Обычно можно использовать любой объем, который входит в контейнер. Например, можно использовать объем от примерно 0,1 мл до примерно 5 мл, например, от примерно 0,2 мл до примерно 1 мл, например, от примерно 0,2 мл до примерно 0,5 мл. Если разделение осуществляют в микромасштабе, объем образца может составлять от примерно 1 мкл до примерно 100 мкл, например, от примерно 5 мкл до примерно 50 мкл. Доступное пространство в контейнере для образца будет зависеть от размера и формы контейнера. В некоторых формах осуществления сверху на плотностный буфер можно поместить промежуточный слой (жидкости или твердого вещества) перед тем, как наносить или наслаивать образец сверху, чтобы предотвратить какое-либо смешивание плотностного буфера и образца. В одной форме осуществления промежуточный слой может представлять собой полиэтиленовые гранулы. В другой форме осуществления маленький пузырек воздуха можно расположить между плотностным буфером и образцом, чтобы предотвратить смешивание. В следующей форме осуществления плотностный буфер можно наслаивать сверху на материал высокой плотности (например, перфторуглеродную жидкость), так чтобы микроорганизмы проходили через плотностный буфер во время разделения и собирались на границе между плотностным буфером и материалом высокой плотности.
В одной форме осуществления изобретения разделительный контейнер центрифугируют в колебательном роторе, так что микроорганизмы образуют осадок непосредственно на дне контейнера. Контейнер центрифугируют при достаточном ускорении и в течение достаточного времени, чтобы разделить микроорганизмы (например, образовавшийся осадок) от других компонентов образца. Ускорение центрифугирования может составлять от примерно 1000×g до примерно 20000×g, например, от примерно 2500×g до примерно 15000×g, например, от примерно 7500×g до примерно 12500×g и т.д. Время центрифугирования может составлять от примерно 30 секунд до примерно 30 минут, например, от примерно 1 минуты до примерно 15 минут, например, от примерно 1 минуты до примерно 5 минут. Центрифугирование можно осуществлять при температуре от примерно 2°С до примерно 45°С, например, от примерно 15°С до примерно 40°С, например, от примерно 20°С до примерно 30°С. В одной форме осуществления разделительный контейнер содержит крышку, и крышку накладывают на контейнер с образованием герметичного закрытия перед центрифугированием. Наличие крышки уменьшает риск в результате обращения с микроорганизмами, которые являются или могут быть инфекционными и/или опасными, а также риск контаминации образца. Одним из преимуществ способов по изобретению является способность осуществлять одну или более чем одну из стадий этих способов (например, лизис, разделение, исследование и/или идентификацию) с микроорганизмами в герметичном контейнере (например, в герметично закрытом контейнере). Настоящие способы, включающие использование автоматизированных систем, позволяют избежать риска для здоровья и безопасности, связанного с обращением с высоковирулентными микроорганизмами, который встречается при выделении микроорганизмов из образцов для непосредственного тестирования. В одной форме осуществления контейнер не центрифугируют в течение достаточного времени и/или не подвергают достаточному ускорению, чтобы плотностной градиент образовался внутри плотностного буфера. Настоящее изобретение не включает ультрацентрифугирование образцов, например, центрифугирование при ускорениях выше, чем примерно 100000×g. Кроме того, настоящее изобретение не включает изопикническую (равновесную) седиментацию или бэндинг.
Разделительный контейнер может представлять собой любой контейнер достаточного объема, чтобы удерживать плотностный буфер и образец. Как отмечено в данной заявке, сепаратор, раскрытый в родственной заявке на патент США, серийный №12/589,969, поданной 30 октября 2009, озаглавленной "Separation Device for Use in the Separation, Characterization and/or Identification of Microorganisms", можно использовать в практике данного изобретения. В одной форме осуществления контейнер приспособлен или может быть приспособлен к центрифужному ротору. Объем контейнера может составлять от примерно 0,1 мл до примерно 25 мл, например, от примерно 1 мл до примерно 10 мл, например, от примерно 2 мл до примерно 8 мл. Если разделение осуществляют в микромасштабе, объем контейнера может составлять от примерно 2 мкл до примерно 100 мкл, например, от примерно 5 мкл до примерно 50 мкл. В одной форме осуществления контейнер имеет широкий внутренний диаметр в верхней части для удержания образца и основной части плотностного буфера и более узкий внутренний диаметр в нижней части, где собирается осадок микроорганизмов. Узкая часть может иметь внутренний диаметр от примерно 0,04 (1,02 мм) до примерно 0,12 (3,05 мм) дюймов, например, от примерно 0,06 (1,52) до примерно 0,10 (2,54 мм) дюймов, например, примерно 0,08 (2,03 мм) дюймов. Широкая часть может иметь внутренний диаметр от примерно 0,32 (8,13 мм) до примерно 0,40 (10,16 мм) дюймов, например, от примерно 0,34 (8,64 мм) до примерно 0,38 (9,65 мм) дюймов, например, примерно 0,36 (9,14 мм) дюймов. Для разделений в микромасштабе внутренние диаметры могут быть даже меньше. Например, внутренний диаметр узкой части может составлять от примерно 0,001 (0,03 мм) до примерно 0,04 (1,02 мм) дюймов, например, от примерно 0,002 (0,05 мм) до примерно 0,01 (0,254 мм) дюймов. Коническая часть внутреннего диаметра может соединять верхнюю и нижнюю часть. Коническая часть может иметь угол от примерно 20 до примерно 70 градусов, например, от примерно 30 до примерно 60 градусов. В одной форме осуществления нижняя узкая часть составляет менее половины от общей высоты контейнера, например, менее чем примерно 40%, 30%, 20% или 10% от общей высоты контейнера. Контейнер может иметь устройство для закрывания, которое присоединено или может быть снабжено резьбой для присоединения устройства для закрывания (например, колпачка), так что контейнер может быть герметично закрыт во время центрифугирования. В некоторых формах осуществления контейнер сконструирован так, чтобы образец или осадок микроорганизмов можно было легко выделить, либо иначе получить или извлечь из контейнера после разделения, либо вручную, либо автоматизированным способом (так, чтобы лаборанты не подвергались воздействию содержимого контейнера). Например, контейнер может содержать отъемную часть или отделяемую часть, которая содержит осадок, и которая может быть отделена от остальной части контейнера. В другой форме осуществления контейнер содержит средства для доступа к осадку после разделения, такие как одно или более чем одно отверстие или одна или более чем одна проницаемая поверхность для вставки шприца или другого дозатора или для вытягивания осадка. В одной форме осуществления контейнер может представлять собой пробирку, например, центрифужную пробирку. В другой форме осуществления контейнер может представлять собой чип или плату. В одной форме осуществления контейнер представляет собой отдельно стоящий контейнер, то есть устройство для разделения одного образца. В других формах осуществления контейнер является частью устройства, которое включает два или более чем два разделительных контейнера, так что множественные образцы можно разделять одновременно. В одной форме осуществления устройство включает 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 15, 20, 25, 30, 36, 42, 48, 60, 72, 84, 96 или большее число разделительных контейнеров.
В другой форме осуществления разделение осуществляют посредством стадии фильтрования, на которой образец (например, лизированный образец) помещают в устройство, оборудованное селективным фильтром или набором фильтров с размерами пор, которые задерживают микроорганизмы. Задержанные микроорганизмы можно вымыть путем осторожного пропускания подходящего буфера через фильтр. Затем вымытые микроорганизмы можно исследовать непосредственно на фильтре и/или выделить для исследования путем прямого отбора образца с поверхности фильтра или путем обратной промывки фильтра подходящим водным буфером.
Стадия исследования
В одной форме осуществления образец или осадок выделяют и/или ресуспендируют и необязательно извлекают из разделительного контейнера перед исследованием. В другой форме осуществления образец или осадок выделяют и/или ресуспендируют после исследования in situ, а затем проводят дополнительное исследование. Например, методики, такие как реакции латекс-агглютинации или автоматизированные тесты фенотипической идентификации, которые можно применять к изолированным микроорганизмам, но не к осадку микроорганизмов, можно осуществлять на выделенных и/или ресуспендированных микроорганизмах.
После того, как образец ресуспендирован, часть образца извлекают из суспензии и помещают на подложку для введения в масс-спектрометр. Высоко поглощающее вещество (например, матрицу) наносят сверху на образец; этот материал имеет очень высокий коэффициент оптического поглощения по отношению к частоте лазера, которую используют для ионизации образца (например, для азотного лазера длина волны испускания составляет 337 нм, поэтому поглощающий материал будет иметь высокий коэффициент поглощения при длине волны 337 нм). После того как образец и поглощающее вещество высушены, подложку помещают в масс-спектрометр. После периода времени, необходимого для откачивания образца (то есть удаления атмосферных газов из образца, чтобы он находился в окружающей среде 10-5-10-7 торр), образец вводят в ионизационную камеру масс-спектрометра. Образец выравнивают с системой. Когда достигнуто оптимальное выравнивание, дают импульс азотного лазера. Поглощение лазерной энергии матрицей вызывает ее абляцию с поверхности подложки вследствие высокой поглощенной энергии. Как побочный эффект, части клетки микроорганизма также подвергаются испарению и ионизации в этом процессе. Эти ионы ускоряются до известной кинетической энергии за счет генерации электростатического поля между подложкой и входом в пролетную трубку масс-спектрометра (то есть эта часть системы является дискриминатором массы/заряда). Все однозарядные ионы независимо от массы будут обладать одинаковой кинетической энергией при входе в пролетную трубку, но они будут иметь скорости, которые обратно пропорциональны их массам. Исходя из этого, ионы движутся вниз в пролетной трубке по направлению к детектору, и более легкие ионы достигают его раньше, чем более тяжелые ионы (пролетная трубка является дискриминатором массы/заряда). Детектор генерирует электрический заряд каждый раз, когда ион сталкивается с детектором. Выход детектора является оцифрованным, и этот выход выявляет отношение масса/заряд на одной оси и число столкновений на другой оси. В других формах осуществления микроорганизмы в осадке можно исследовать, используя такие методы масс-спектрометрии, как масс-спектрометрия MALDI-TOF, масс-спектрометрия электрораспылительной ионизацией с десорбцией (DESI), газовая хромато-масс-спектрометрия, жидкостная хромато-масс-спектрометрия, масс-спектрометрия электрораспылительной ионизацией (ESI) и спектрометрия в трубке селективного потока ионов (SIFT).
В некоторых формах осуществления изолированный образец или осадок можно исследовать спектроскопическим путем. В одной форме осуществления методы оптической спектроскопии можно использовать для анализа одного или более чем одного внутреннего свойства микроорганизмов, например, свойства, присутствующего внутри микроорганизма, в отсутствие дополнительных агентов, таких как красители, контрастные вещества, связывающие агенты и т.д. В других формах осуществления методы оптической спектроскопии можно использовать для анализа одного или более чем одного внешнего свойства микроорганизмов, например, свойства, которое может быть обнаружено только с помощью дополнительных агентов. Исследование можно проводить, используя, например, флуоресцентную спектроскопию, спектроскопию диффузного отражения, инфракрасную спектроскопию, терагерцевую спектроскопию, абсорбционную и трансмиссионную спектроскопию, рамановскую спектроскопию, включая рамановскую спектроскопию, усиленную поверхностью (SERS), рамановскую спектроскопию с пространственным смещением (SORS), рамановскую спектроскопию пропускания и/или резонансную рамановскую спектроскопию. Для усиления рамановского (SERS) и флуоресцентного сигналов микроорганизмы могут быть покрыты наночастицами золота и/или серебра перед центрифугированием, и/или внутренняя оптическая поверхность может быть предварительно покрыта коллоидами металлов определенного размера и формы (ссылки: Lakowicz, Anal. Biochem. 537:171 (2005) для флуоресценции; Efrima et al., J. Phys. Chem. B. (Letter) 102:5947 (1998) для SERS). В другой форме осуществления наночастицы присутствуют в плотностном буфере перед центрифугированием и связываются с микроорганизмами, когда микроорганизмы проходят через плотностный буфер. В других формах осуществления микроорганизмы в осадке можно исследовать, используя методы масс-спектрометрии, такие как масс-спектрометрия MALDI-TOF, масс-спектрометрия электрораспылительной ионизацией с десорбцией (DESI), газовая хромато-масс-спектрометрия, жидкостная хромато-масс-спектрометрия, масс-спектрометрия электрораспылительной ионизацией (ESI) и спектрометрия в трубке селективного потока ионов (SIFT).
В соответствии с изобретением контрольные измерения снимают с известных микроорганизмов, что, таким образом, дает возможность корреляции измеренных тестируемых данных с характеристикой интересующих микроорганизмов, используя различные математические методы, известные специалистам в данной области техники. Например, данные от образцов можно сравнивать с базовым уровнем или с контрольными измерениями, используя системы программного обеспечения, известные специалистам в данной области техники. Более конкретно данные можно анализировать с помощью ряда методов многофакторного анализа, такого как, например, общий дискриминационный анализ (GDA), частичный дискриминационный анализ наименьших квадратов (PLSDA), частичная регрессия наименьших квадратов, анализ главных компонентов (РСА), параллельный факторный анализ (PARAFAC), анализ нейронных сетей (NNA) и/или метод опорных векторов (SVM). Эти методы можно использовать, чтобы классифицировать неизвестные, представляющие интерес микроорганизмы на релевантные группы на основе существующей номенклатуры и/или на встречающиеся в природе группы на основе метаболизма, патогенности и/или вирулентности организма, при разработке системы мониторинга, определения и/или характеристики организма, как описано выше.
Еще в одной другой форме осуществления не спектроскопические измерения системой определения, такие как периоды времени определения и скорости роста, можно использовать, чтобы способствовать характеристике и/или идентификации микроорганизмов из изолированного образца или осадка. Кроме того, измерения, снятые с фотографического изображения нижней части сепаратора, могут обеспечить ценную информацию по идентичности изолята, такую как размер, форма, цвет и плотность осадка.
В некоторых формах осуществления изобретения характеристика и/или идентификация микроорганизмов в изолированном образце или осадке необязательно включает идентификацию точного вида. Характеристика охватывает как широкую категоризацию или классификацию биологических частиц, так и действительную идентификацию отдельного вида. Классификация микроорганизма из изолированного образца или осадка может включать определение фенотипических и/или морфологических характеристик микроорганизма. Например, характеристика биологических частиц может быть выполнена на основании наблюдаемых различий, таких как состав, форма, размер, кластеризация и/или метаболизм. В некоторых формах осуществления классификация интересующих биологических частиц может не требовать предшествующих знаний характеристик данной биологической частицы, но требует только соответствующих корреляций с эмпирическими измерениями, что, таким образом, делает этот способ более универсальным и легко приспосабливаемым, чем способы, основанные на событиях специфичного связывания или метаболических реакциях. Как используют в данной заявке, "идентификация" означает определение, к какому семейству, роду, виду и/или штамму принадлежит ранее неизвестный микроорганизм, например, идентификацию ранее неизвестного микроорганизма на уровне семейства, рода, вида и/или штамма.
В некоторых случаях характеристика охватывает модели классификации, которые обеспечивают достаточно полезную информацию для действия, которое нужно предпринять. Как используют в данной заявке, предпочтительные модели классификации включают группировку в одно или более чем одно из приведенного ниже: (1) группы по Граму; (2) клинические группы по Граму; (3) терапевтические группы и (4) функциональные группы.
(1) Группы по Граму: В пределах классификации групп по Граму микроорганизмы могут быть помещены в одну из трех широких категорий классификации на основе их реакции окрашивания по Граму и общего размера, где эти группы выбраны из одной или более чем одной из приведенных ниже: (а) грамположительные микроорганизмы, которые окрашиваются в темно-синий цвет при окрашивании по Граму; (б) грамотрицательные микроорганизмы, которые окрашиваются в красный цвет при окрашивании по Граму; и (в) дрожжевые клетки, которые окрашиваются в темно-синий цвет при окрашивании по Граму, но представляют собой очень большие округлые клетки, которые отличаются от бактерий по их морфологическим характеристикам и размеру.
(2) Клинические группы по Граму: Группы по Граму можно дополнительно разделить на несколько подкатегорий, представляющих различающиеся морфологические признаки. Эти подкатегории включают всю релевантную клиническую информацию, сообщаемую квалифицированным клиническим лаборантом, и, таким образом, дают более высокий уровень идентификации, чем положительная или отрицательная реакция по Граму. Эта конкретная классификация очень полезна, поскольку она исключает проблемы, основанные на качестве штамма по Граму и/или на уровне квалификации лаборанта, исследующего мазок, за счет предоставления эквивалентной клинически релевантной информации автоматизированной системой. Более конкретно подкатегории микроорганизмов, основанные на этой модели классификации, могут быть выбраны из одной или более чем одной из приведенных ниже: (а) кокки, которые представляют собой маленькие округлые клетки; (б) диплококки, которые представляют собой две маленькие округлые клетки, соединенные вместе; (в) палочки, которые имеют прямоугольную форму; и (г) бациллы, которые имеют палочковидную форму. Примеры этих подкатегорий, которые могут быть подтверждены дополнительной морфологической информацией, включают: (i) грамположительные кокки; (ii) грамположительные кокки в цепочках; (iii) грамположительные кокки в кластерах (то есть кластеров в форме "виноградной грозди"); (iv) грамположительные диплококки; (v) грамположительные палочки; (vi) грамположительные палочки с эндоспорами; (vii) грамотрицательные палочки; (viii) грамотрицательные коккобациллы; (ix) грамотрицательные диплококки; (х) дрожжи и (xi) мицелиальные грибы.
(3) Терапевтические группы: терапевтические группы включают множество видов микроорганизмов, которые при выделении из конкретных типов образцов лечат одним и тем же классом антибиотиков или смесью антибиотиков (например, как описано в "Sanford Guide to Antimicrobial Therapy 2008"). Во многих случаях идентичность на видовом уровне не требуется врачу, чтобы обеспечить переход от первоначальной эмпирической терапии к более направленной терапии, поскольку более чем один вид можно лечить одним и тем же антибиотиком(ами) выбора. Этот уровень классификации корректно помещает эти микроорганизмы "одного и того же лечения" в единые терапевтические категории. Примеры данного уровня характеристики включают способность отличать высоко резистентные виды Enterobacteriacae (ЕВ) от чувствительных видов ЕВ (Enterobacter spp. от Е.coli) или резистентные к флуконазолу виды Candida (С.glabrata и С.kruzei) от чувствительных видов Candida (С.albicans и С.parapsilosis) и т.д.
(4) Функциональные группы: В соответствии с изобретением микроорганизмы могут быть также помещены в несколько групп на основе сочетания метаболических, вирулентных и/или фенотипических характеристик. Неферментативные организмы можно четко отличить от ферментативных. Кроме того, виды микроорганизмов, которые продуцируют гемолизины, можно группировать отдельно от не гемолитических видов. В некоторых случаях эти группы представляют более широкие категории, чем уровень рода (например, бактерии группы кишечной палочки, грамотрицательные неферментативные палочки), в некоторых случаях на уровне рода (например, Enterococcus, Candida), и в некоторых случаях ближе к дискриминации видового уровня (например, коагулаза-отрицательные стафилококки, альфа-гемолитические стрептококки, бета-гемолитические стрептококки, коагулаза-положительные стафилококки, то есть S.aureus).
В дополнение к измерению внутренних свойств микроорганизмов в целях идентификации способы по настоящему изобретению могут дополнительно включать использование дополнительных идентификаторов, чтобы способствовать процессу разделения и/или идентификации. Агенты, которые связываются со специфичными микроорганизмами, такие как аффинные лиганды, можно использовать для разделения микроорганизмов, для идентификации класса или вида микроорганизма (например, посредством связывания с уникальным поверхностным белком или рецептором) и/или для идентификации характеристики микроорганизма (например, устойчивости к антибиотикам). Полезные идентификаторы включают без ограничения моноклональные и поликлональные антитела и их фрагменты (например, анти-Еар для идентификации S.aureus), нуклеиново-кислотные зонды, антибиотики (например, пенициллин, ванкомицин, полимиксин В), аптамеры, пептидные миметики, связывающие белки фагового происхождения, лектины, биомаркеры врожденного иммунитета хозяина (белки острой фазы, LPS-связывающий белок, CD14, маннозосвязывающий лектин, Toll-подобные рецепторы), белки иммунной защиты (например, дефензины, кателицидины, протеогрины, магаинины), бактериоцины (например, лантибиотики, такие как низин, мерсацидин, эпидермин, галлидермин и плантарицин С, и пептиды класса II), бактериофаги и красители, избирательные для нуклеиновых кислот, липидов, углеводов, полисахаридов, капсул/слизи или белков, или любую их комбинацию. Если сам агент не дает обнаруженного сигнала, этот агент может быть меченым, чтобы давать обнаруженный сигнал, например, путем конъюгации агента с соединением, совместимым с матрицей. Агент можно добавлять к микроорганизмам на любой стадии в способах по изобретению, например, когда получают образец, во время лизиса и/или во время разделения. В некоторых формах осуществления присутствие агента в осадке можно определить во время исследования осадка. Другие полезные идентификаторы включают субстраты для ферментов микроорганизмов, хелатирующие агенты и токсические соединения.
В одном аспекте изобретения способ может дополнительно включать стадию выделения осадка микроорганизмов и проведения дополнительных тестов. В одной форме осуществления осадок можно выделить путем отсасывания среды образца и плотностного буфера. В другой форме осуществления осадок можно выделить путем вставки шприца в контейнер и отсасывания осадка, в то время как среда образца и плотностный буфер остаются интактными. Затем выделенный осадок можно ресуспендировать в подходящей среде, например, в физиологическом растворе. Как только микроорганизмы ресуспендированы, их можно подвергать любым дополнительным тестам, которые желательны, как должно быть известно специалистам в данной области техники, и как описано выше. В частности, можно проводить любой тест, для которого требуются чистые образцы микроорганизмов, с ресуспендированными микроорганизмами. В некоторых формах осуществления можно проводить дополнительные тесты идентификации. Примеры тестов идентификации включают Vitek® 2, тесты амплифицированных и неамплифицированных нуклеиновых кислот (NAT), хромогенные анализы и реакции латекс-агглютинации, иммунологические анализы (например, использование меченых антител и/или других лигандов), масс-спектрометрию (например, MALDI-TOF масс-спектрометрию) и/или другие оптические методы, такие как инфракрасная спектроскопия (FTIR) или рамановская спектроскопия. Можно также проводить дополнительные тесты характеристики, такие как устойчивость к антибиотикам и/или другим лекарствам. Дополнительная характеристика может составлять часть теста, который был начат во время первоначальных стадий разделения и идентификации способа. Например, определение устойчивого к метициллину S.aureus можно начать путем добавления к образцу пенициллина, меченного флуоресцентной меткой, перед разделением микроорганизмов. Как только осадок выделен и ресуспендирован, можно определить уровень связанной метки.
В одном аспекте изобретения некоторые или все стадии способа могут быть автоматизированными. Автоматизация стадий способов не только дает возможность более эффективно протестировать большее число образцов, но также снижает риск ошибок человека при обращении с образцами, которые могут содержать вредные и/или инфекционные микроорганизмы.
В некоторых формах осуществления изобретения эти способы можно также использовать для определения присутствия микроорганизмов в тестируемом образце. В этих формах осуществления способы включают стадии:
(a) получение образца;
(b) необязательно лизис клеток в тестируемом образце с получением лизированного образца; и
(c) разделение микроорганизмов от других компонентов образца с образованием осадка микроорганизмов;
где присутствие осадка указывает на то, что микроорганизмы присутствуют в тестируемом образце. В одной форме осуществления осадок определяют невооруженным глазом. В других формах осуществления, как описано в данной заявке, осадок можно ресуспендировать, извлечь и подвергать исследованию с помощью масс-спектрометрии.
В некоторых формах осуществления способы определения можно использовать для мониторинга образцов на заражение микроорганизмами, например, пищевых продуктов, фармацевтических препаратов, питьевой воды и т.д. В одной форме осуществления эти способы можно осуществлять с повторением для постоянного мониторинга на заражение, например, раз в месяц, раз в неделю, раз в сутки, раз в час или по любой другой схеме периодичности. В другой форме осуществления образцы можно тестировать по необходимости, например, когда заражение подозревают. В следующих формах осуществления способы определения можно использовать, чтобы посмотреть присутствие микроорганизмов в клинических образцах, например, в гемокультурах. Например, образец можно отбирать из гемокультуры в определенные моменты времени и осуществлять способ определения на образце, чтобы определить, является ли эта гемокультура положительной. В одной форме осуществления образец может быть отобран в установленный момент времени после инокуляции культуры, например, через 24 часа после инокуляции, чтобы определить, является ли эта гемокультура положительной. В другой форме осуществления образцы можно отбирать из гемокультуры регулярно, например, каждые 12, 6, 4 или 2 часа или каждые 60, 50, 40, 30, 20, 15, 10 или 5 минут, чтобы идентифицировать положительные гемокультуры в пределах короткого промежутка времени как обнаружимо положительные. В некоторых формах осуществления способов определения за стадией определения могут необязательно следовать способы идентификации, которые описаны в данной заявке.
В одном аспекте изобретения некоторые или все стадии способа могут быть автоматизированными. Автоматизация стадий способов дает возможность более эффективно протестировать большее число образцов и снижает риск ошибок человека при обращении с образцами, которые могут содержать вредные и/или инфекционные микроорганизмы. Огромную важность составляет, однако, то, что автоматизация может давать критически значимые результаты в любое время дня или ночи без промедления. Несколько исследований показало, что более быстрая идентификация организмов, вызывающих сепсис, коррелирует с лучшим лечением пациента, более коротким периодом пребывания в больнице и более низкими общими затратами.
Дополнительные подробности и описание способа характеристики и/или идентификации микроорганизмов в соответствии с настоящим изобретением раскрыты в совместно поданных заявках на патент США, серийный №12/589,952 и 12/589,976, поданных 30 октября 2009, озаглавленных «Methods for separation, characterization, and/or identification of microorganisms using spectroscopy» и «Methods for separation, characterization, and/or identification of microorganisms using raman spectroscopy», соответственно, содержание которых включено в данную заявку посредством ссылки.
Настоящее изобретение описано более подробно в приведенных ниже примерах, которые предложены в качестве иллюстрации и никоим образом не предназначены для ограничения изобретения. Используют стандартные методы, хорошо известные в данной области техники, или методы, специально описанные ниже.
ПРИМЕРЫ
Пример 1. Способ лизиса-центрифугирования для идентификации микроорганизмов из гемокультур с помощью MALDI-TOF масс-спектрометрии
Микроорганизмы "высевали" при низком инокулуме во флаконы BacT/ALERT® SA, содержащие 10 мл крови человека. Образцы культуральной среды гемокультуры отбирали из флаконов в пределах нескольких минут после положительного мечения системой обнаружения микроорганизмов BacT/ALERT® 3D. Образцы культуральной среды обрабатывали для разделения микроорганизмов от крови и компонентов среды, которые могли интерферировать при последующем анализе, как описано ниже:
4,0 мл культуральной среды из свежих положительных гемокультур объединяли с 2,0 мл буфера для лизиса (0,45% Brij® 97 в 0,3 М CAPS, pH 11,7), перемешивали на вортексе в течение 5 секунд, а затем инкубировали в водяной бане на 37°С в течение 90 секунд. После инкубации 0,95 мл лизата наслаивали сверху на 0,5 мл плотностного буфера (14% мас./об. йогексол, 0,005% Pluronic F-108 в 10 мМ ГЭПЭС, pH 7,4) в каждой из четырех 1,5 мл конических центрифужных пробирок. Затем все четыре пробирки центрифугировали в течение 2 минут при 10000 д при 25°С до седиментации (осаждения) микроорганизмов через плотностный буфер. Лизированная кровь и среда оставались над буфером.
После завершения цикла центрифугирования надосадочную жидкость удаляли, и седиментированные (осажденные) микроорганизмы в каждой пробирке ресуспендировали 10 мкл дистиллированной воды. Ресуспендированные микроорганизмы из всех 4 пробирок объединяли в чистой пробирке и мягко перемешивали. Затем объем каждого обработанного образца регулировали таким образом, чтобы оптическая плотность при 660 нм (A660) конечной суспензии была равна 20/см. Обработанные образцы лидо хранили при 2-8°С в течение тех же суток тестирования, либо делили на аликвоты и замораживали при -70°С для тестирования на последующие сутки.
Пример 2. Анализ образцов микроорганизмов, обработанных из положительных гемокультур лизисом-центрифугированием, с помощью MALDI-TOF МС
Образцы, обработанные в соответствии с методом Примера 1, быстро оттаивали при 37°С (если были ранее заморожены), мягко перемешивали, а затем разводили до рабочей концентрации (1:4, 1:8 и 1:16) в дистиллированной воде. 1,0 мкл каждого разведенного образца наносили в двух повторах на подложку мишени MALDI-TOF. К одному из каждых двух повторов добавляли 1,0 мкл 50% муравьиной кислоты. Всем нанесенным образцам давали возможность высохнуть при температуре окружающей среды, а затем наносили 1,0 мкл раствора матрицы. Матрица состояла из смеси 50:50 Alpha-Cyano (раствора альфа-циано-4-гидроксикоричной кислоты, AnagnosTec GmbH, Германия) и DHB (2,5-дигидроксибензойной кислоты, AnagnosTec GmbH, Германия).
Для сравнения соответствующие изоляты микроорганизмов выращивали на среде с агаром, которая была пригодна для данного вида, и наносили непосредственно в виде мазка на подложку мишени MALDI-TOF в двух повторах. Микроорганизмы на одном из двух пятен разводили in situ 1,0 мкл дистиллированной воды с последующим добавлением 1,0 мкл 50% муравьиной кислоты. Обоим пятнам от данного изолята давали возможность высохнуть, а затем к каждому добавляли 1,0 мкл матричной смеси.
После того, как все образцы микроорганизмов были полностью высушены, масс-спектры MALDI-TOF снимали для каждого в диапазоне отношения масса/заряд 2000-34000 на масс-спектрометре Axima Assurance MALDI-TOF (Shimadzu Biotech North America, Maryland).
Репрезентативные масс-спектры избранных микроорганизмов, выделенных из положительных гемокультур, представлены на фиг.1-3. Для ясности диапазон отношения масса/заряд на фигурах сокращен, но несколько открытий, проиллюстрированных на этих фигурах, сохраняются для всех диапазонов масс.
На фиг.1 показаны спектры микроорганизмов, обработанных из засеянных гемокультур пяти клинических изолятов, усредненные для ясности иллюстрации, для каждого из четырех видов. Заметные различия в присутствии или отсутствии пиков при данном диапазоне отношения масса/заряд легко очевидны и являются характеристическими для этих организмов. Ни один пик масса/заряд не является общим для всех спектров, что указывает на то, что немногие, если какие-либо, потенциально маскирующие массы присутствуют в результате примесей из крови или культуральной среды после обработки в соответствии с настоящим изобретением.
На фиг.2 показаны пять индивидуальных масс-спектров для изолятов S.aureus, которые были показаны усредненными на фиг.1. Эти пять спектров показывают соответствие масс-спектра данному микроорганизму для всех различных клинических изолятов, даже при выращивании в различных гемокультурах от различных доноров крови.
На фиг.3 показаны усредненные спектры пяти изолятов E.coli, показанных на фиг.1, по сравнению со спектрами тех же пяти изолятов, образец которых взят непосредственно из колоний, выращенных на среде с агаром (триптический соевый агар с 5% овечьей кровью, bioMerieux Inc.). Сходство этих масс-спектров показывает, что обработка гемокультур эффективно удаляет материалы не микробного происхождения, сохраняя при этом те массы, которые являются специфичными для микроорганизма.
Пример 3. Идентификация образцов микроорганизмов, обработанных из положительных гемокультур лизисом-центрифугированием, MALDI-TOF МС, и имеющаяся в продаже база данных идентификации микроорганизмов
Сто двадцать три изолята микроорганизмов были выращены, обработаны и проанализированы масс-спектрометрией, как описано в примерах 1 и 2. Эти микроорганизмы включали 14 видов бактерий и дрожжей, обычно обнаруживаемых в клинических гемокультурах.
После снятия каждого масс-спектра таблицу пиков масс вводили в программное обеспечение идентификации микроорганизмов "Saramis" (AnagnosTec GmbH, Германия) для анализа. Это программное обеспечение построено на базе данных масс-спектров MALDI-TOF, собранных от микроорганизмов, выращенных на агаре.
В таблице 1 показаны результаты всех изолятов, выращенных как в гемокультуре, так и на средах с агаром параллельно из одних и тех же затравочных культур. Результаты в таблице 1 табулированы для всех культур, хотя концентрация клеток в конечной суспензии для некоторых изолятов была ниже целевой концентрации, указанной в примере 1. В случаях, где концентрация клеток была меньше 20% целевого значения, эти изоляты исключали из табуляции, и результаты остальных изолятов были перекомпилированы в таблице 2. На практике культуры с низким числом клеток можно компенсировать за счет снижения объема ресуспендирования осадка или за счет обработки большего объема гемокультуры.
Колонки "верно до вида" в таблицах 1 и 2 относятся к числу изолятов, где по меньшей мере один, а обычно большее число, спектров от серии целевых пятен для данного изолята идентифицировано правильно как один вид или как группа от двух до трех близкородственных видов на уровне достоверности по меньшей мере 90%. Подобным образом, изолят считают верно идентифицированным на уровне рода или семейства, если спектры совпадают с базой данных при достоверности по меньшей мере 90% с верным родом или семейством, но без указания на уровне вида. Колонки "Нет/Неверно ID" представляют собой изоляты, которые давали масс-спектры, которые обычно имели очень низкое качество для адекватной ID, приводя в результате к отсутствию надежной информации, или, редко, ошибочной идентификации. Эти критерии считали обоснованными для данного исследования, но программное обеспечение дает возможность специалисту установить интервал изменения соответствующих критериев достоверности идентификации для индивидуальных нужд.
Успех идентификации микроорганизмов посредством настоящего изобретения, почти на 95% верной на видовом уровне, отчетливо более высок, чем предшествующие исследования, проведенные ранее известными способами обработки, где сообщали о менее 76% верной идентификации (см., например, MAIER, Т. et. al., "Rapid Identification of Bacteria from Blood Cultures Using MALDI-TOF MS", Poster ICAAC 48th Annual Meeting, 2008; см. также, например, Drake et al., "MALDI-TOF Mass Spectrometry Based Identification of Clinically Important Microorganisms", ASMS Poster, Philadelphia 2009). Любое число математических моделей или баз данных масс-спектров можно использовать для идентификации микроорганизмов из гемокультуры, но эти результаты с имеющейся в продаже базой данных лучше всего показывают, что микроорганизмы, обработанные из гемокультуры по настоящему изобретению, достаточно свободны от контаминантных пиков массы, чтобы совпадать с базой данных спектров для выращенных на агаре из "чистых" колоний.
Приведенные выше примеры являются иллюстративными для настоящего изобретения и не должны быть истолкованы как ограничивающие его. Изобретение определено приведенной ниже формулой изобретения, где эквиваленты формулы изобретения должны быть включены в нее. Все публикации, заявки на патенты, патенты, патентные публикации и любые другие ссылки, цитируемые в данной заявке, включены полностью посредством ссылки на информацию, релевантную для предложения и/или параграфа, в котором представлена ссылка.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ ИЗ ТЕСТИРУЕМОГО ОБРАЗЦА ГЕМОКУЛЬТУРЫ | 2009 |
|
RU2541775C2 |
| СПОСОБЫ РАЗДЕЛЕНИЯ И ХАРАКТЕРИСТИКИ МИКРООРГАНИЗМОВ С ПОМОЩЬЮ ИДЕНТИФИКАТОРА | 2009 |
|
RU2533252C2 |
| СПОСОБЫ ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ С ПОМОЩЬЮ СПЕКТРОСКОПИИ (ВАРИАНТЫ) | 2009 |
|
RU2531225C2 |
| КОНТЕЙНЕР ДЛЯ ИЗОЛЯЦИИ И ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМА | 2009 |
|
RU2510844C2 |
| Способ идентификации бактерий из положительных гемокультур методом матричной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии (MALDI-TOF MS), у больных с инфекцией кровотока | 2020 |
|
RU2750611C1 |
| Способ идентификации Candida spp. и других дрожжеподобных грибов из положительной гемокультуры методом матричной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии (MALDI-TOF MS) у больных с инфекцией кровотока | 2020 |
|
RU2739758C1 |
| СПОСОБ ПРОБОПОДГОТОВКИ ОБРАЗЦОВ ДЛЯ ИДЕНТИФИКАЦИИ МИКОБАКТЕРИЙ ИЗ ПОЛОЖИТЕЛЬНЫХ ГЕМОКУЛЬТУР | 2023 |
|
RU2832069C1 |
| СПОСОБЫ ХАРАКТЕРИЗАЦИИ МИКРООРГАНИЗМОВ НА ТВЕРДЫХ И ПОЛУТВЕРДЫХ СРЕДАХ | 2009 |
|
RU2523903C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РОДА ВОЗБУДИТЕЛЕЙ БАКТЕРИЕМИЙ | 2011 |
|
RU2495939C2 |
| ОПИСАНИЕ ХАРАКТЕРИСТИК МИКРООРГАНИЗМОВ С ПОМОЩЬЮ MALDI-TOF | 2015 |
|
RU2698139C2 |
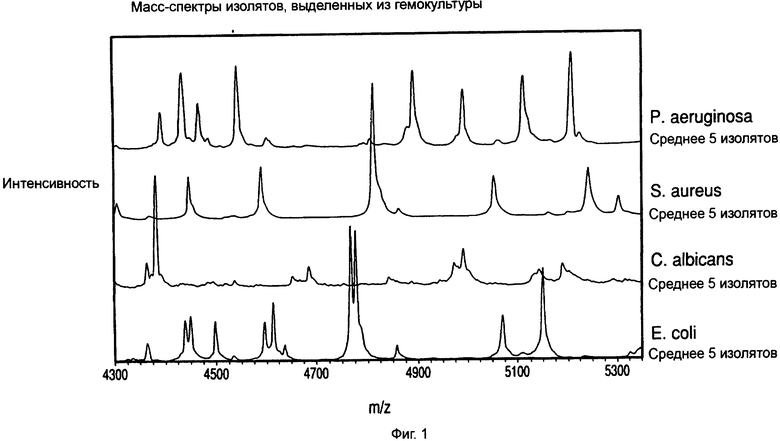
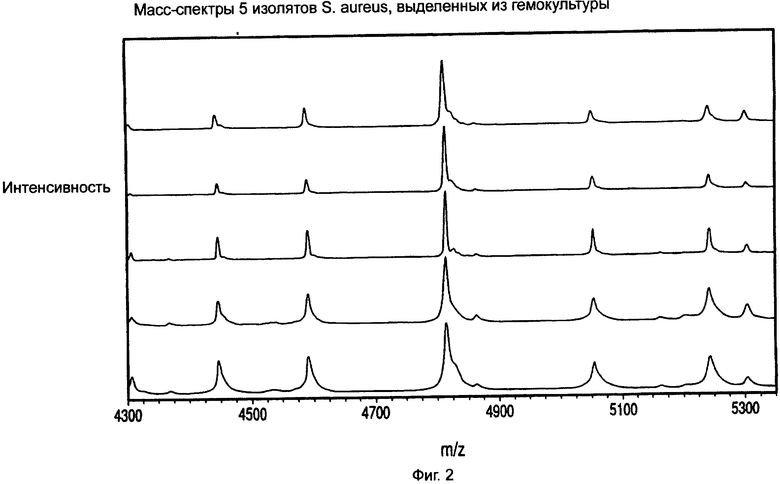

Изобретение относится к области микробиологии, а именно к способам (вариантам) идентификации микроорганизмов с помощью масс-спектрометрии. Сущность способа состоит в том, что осуществляют идентификацию микроорганизма из тестируемого образца, в том числе из гемокультуры. Способ включает следующие стадии: получение тестируемого образца, о котором известно, что он содержит или может содержать микроорганизмы; селективный лизис и солюбилизацию клеток не микроорганизмов в тестируемом образце лизирующим раствором, который имеет рН от приблизительно 8 до приблизительно 13, с получением лизированного образца; наслаивание указанного лизированного образца на гомогенный плотностный буфер в контейнере и центрифугирование контейнера для разделения и отделения указанного микроорганизма от других компонентов указанного лизированного образца, при этом указанный микроорганизм проходит через указанный плотностный буфер с образованием осадка микроорганизмов на дне указанного контейнера; исследование указанного осадка указанного микроорганизма с помощью масс-спектрометрии для снятия масс-спектра этого микроорганизма; идентификацию этого микроорганизма в указанном осадке путем сравнения измеренного масс-спектра с референсными масс-спектрами и/или с известными или предсказанными массами клеточных компонентов известных микроорганизмов. Использование заявленного способа позволяет быстро идентифицировать микроорганизмы на уровне рода, вида или штамма с помощью масс-спектрометрии. 2 н. и 14 з.п. ф-лы, 2 табл., 3 ил., 3 пр.
1. Способ идентификации микроорганизма из тестируемого образца, включающий:
(a) получение тестируемого образца, о котором известно, что он содержит или может содержать микроорганизмы;
(b) селективный лизис и солюбилизацию клеток не микроорганизмов в тестируемом образце лизирующим раствором с получением лизированного образца, при этом указанный лизирующий раствор имеет рН от приблизительно 8 до приблизительно 13;
(c) наслаивание указанного лизированного образца на гомогенный плотностный буфер в контейнере и центрифугирование контейнера для разделения и отделения указанного микроорганизма от других компонентов указанного лизированного образца, при этом указанный микроорганизм проходит через указанный плотностный буфер с образованием осадка микроорганизмов на дне указанного контейнера;
(d) исследование указанного осадка указанного микроорганизма с помощью масс-спектрометрии для снятия масс-спектра этого микроорганизма; и
(e) идентификацию этого микроорганизма в указанном осадке путем сравнения измеренного масс-спектра с референсными масс-спектрами и/или с известными или предсказанными массами клеточных компонентов известных микроорганизмов, при этом указанные микроорганизмы идентифицируют на уровне рода, на уровне вида или на уровне штамма.
2. Способ по п.1, где по меньшей мере часть указанного изолированного образца микроорганизмов со стадии (с) выделяют и помещают на субстрат-носитель перед стадией исследования (d).
3. Способ по п.1, где по меньшей мере часть изолированного образца микроорганизма со стадии (с) осаждают непосредственно на субстрате-носителе во время разделения перед стадией исследования (d).
4. Способ по п.1, где указанная масс-спектрометрия представляет собой масс-спектрометрию MALDI-TOF, масс-спектрометрию электрораспылительной ионизацией с десорбцией (DESI), газовую хромато-масс-спектрометрию, жидкостную хромато-масс-спектрометрию, масс-спектрометрию электрораспылительной ионизацией (ESI) и спектрометрию в трубке селективного потока ионов (SIFT).
5. Способ по п.1, где указанная идентификация дополнительно включает характеристику указанных микроорганизмов на основании одной или более чем одной фенотипической и/или морфологической характеристики.
6. Способ по п.1, где лизирующий раствор дополнительно содержит один или более чем один детергент.
7. Способ по п.6, где указанный один или более чем один детергент выбран из группы, состоящей из Тритона® Х-100, Тритона® X-100-R, Тритона® Х-114, NP-40, Genapol® C-100, Genapol® X-100, Igepal® CA 630, Arlasolve™200, Brij® 96/97, CHAPS, октил-D-глюкопиранозида, сапонина, нонаэтиленгликоля монододецилового эфира (C12E9, полидоценол), додецилсульфата натрия, N-лаурилсаркозина, дезоксихолата натрия, желчных солей, гексадецилтриметиламмония бромида, SB3-10, SB3-12, амидосульфобетаина-14, C7BzO, Brij® 98, Brij® 58, Brij® 35, Твин® 80, Твин® 20, Pluronic® L64, Pluronic® P84, не детергентных сульфобетаинов (NDSB 201), амфиполов (PMAL-C8) и метил-β-циклодекстрина.
8. Способ по п.6, где указанный детергент представляет собой полиоксиэтиленовый детергент, включающий структуру C12-18/E9-10.
9. Способ по п.6, где полиоксиэтиленовый детергент выбран из группы, состоящей из Brij® 97, Brij®96V, Genapol® C-100, Genapol® X-100 и полидоценола.
10. Способ по п.6, где указанный лизирующий раствор дополнительно содержит композицию ферментов, включающую одну или более чем одну протеиназу и одну или более чем одну нуклеазу.
11. Способ по п.6, где лизирующий раствор содержит один или более чем один буферный агент.
12. Способ по п.1, где плотностный буфер включает одно или более чем одно из коллоидного кремнезема, йодированных контрастных агентов, сахарозы, иммерсионного масла для микроскопа, минерального масла, силиконового масла, фторсиликонового масла, силиконового геля, метризоата-Фиколла®, диатризоата-декстрана, карбоксиметилцеллюлозы, гидроксипропилметилцеллюлозы, полиэтиленоксида (высокой молекулярной массы), Pluronic® F127, Pluronic® F68, полиакриловой кислоты, сшитого поливинилового спирта, сшитого поливинилпирролидина, сополимера метилового эфира ПЭГ и метакрилата, пектина, агарозы, ксантана, геллана, Phytagel®, сорбита, фиколла®, глицерина, декстрана, гликогена, хлорида цезия, перфторуглеродных жидкостей и/или гидрофторуглеродной жидкости и их комбинаций.
13. Способ по п.1, где указанный тестируемый образец представляет собой образец культуры, о которой известно, что она содержит микроорганизмы.
14. Способ по п.1, где указанный плотностный буфер обладает гомогенной плотностью от приблизительно 1,025 г/мл до приблизительно 1,120 г/мл.
15. Способ по п.1, где указанный плотностный буфер содержит хлорид цезия или йогексол.
16. Способ идентификации микроорганизма из гемокультуры, включающий:
(a) получение образца из гемокультуры, о которой известно, что она содержит или может содержать микроорганизмы;
(b) селективный лизис и солюбилизацию клеток не микроорганизмов в образце лизирующим раствором с получением лизированного образца, при этом указанный лизирующий раствор имеет рН от приблизительно 8 до приблизительно 13;
(c) наслаивание лизированного образца на гомогенный плотностный буфер в контейнере;
(d) центрифугирование контейнера для разделения и отделения микроорганизмов от других компонентов указанного лизированного образца, при этом указанный микроорганизм проходит через указанный плотностный буфер с образованием осадка микроорганизмов на дне указанного контейнера;
(e) исследование указанного осадка микроорганизмов с помощью масс-спектрометрии для снятия масс-спектра этого микроорганизма; и
(f) идентификацию данного микроорганизма в указанном осадке путем сравнения измеренного масс-спектра с референсными масс-спектрами и/или с известными или предсказанными массами клеточных компонентов известных микроорганизмов, при этом указанные микроорганизмы идентифицируют на уровне рода, на уровне вида или на уровне штамма.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| V.RYZHOV et.al | |||
| Rapid characterization of spores of Bacillus cereus group bacteria by matrix-assisted laser desorption-ionization time-of-flight mass spectrometry | |||
| // Applied and environmental microbiology, 2000 | |||
| Приспособление для соединения пучка кисти с трубкою или втулкою, служащей для прикрепления ручки | 1915 |
|
SU66A1 |
| M.LEFMANN et.al | |||
| Novel mass spectrometry-based tool for genotypic identification of | |||
Авторы
Даты
2014-06-20—Публикация
2009-10-30—Подача