Изобретение относится к области медицины, в частности к микробиологии с возможностью применения у больных в гематологии, и может быть использовано для идентификации Candida spp. и других дрожжеподобных грибов из положительной гемокультуры методом матричной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии (MALDI-TOF MS) у больных с инфекцией кровотока.
В настоящее время имеется отчетливая тенденция к росту числа грибковых инфекций и, соответственно, актуальным является улучшение уровня их диагностики. В развитии инвазивных грибковых инфекций имеют значение разные факторы, включающие не только состояние пациента, но и окружающую среду. Грибы относятся к основным возбудителями оппортунистических инфекций у иммунокомпрометированных пациентов.
В течение последних 10-15 лет наблюдается отчетливая тенденция к увеличению числа микотических инфекций. Так, дрожжеподобные грибы входят в число десяти наиболее часто выявляемых нозокомиальных патогенов; в отделениях интенсивной терапии они определяются на пятом месте, достигая 17%; среди инфекций кровотока Candida spp. занимают 4-е место, составляя 7,6%; примерно 7% случаев лихорадок неясной этиологии у больных, находящихся на лечении в стационаре, бывают обусловлены грибами. Причем данные микроорганизмы являются проблемными не только у онкогематологических больных. Так, при анализе 837 случаев кандидемий показано, что чаще всего они возникали у больных со злокачественными опухолями (26%) и после хирургического лечения (18,5%). При этом среди пациентов хирургического профиля наиболее высокая частота была зарегистрирована в абдоминальной хирургии, составив 13,5% (число больных 113). Частота кандидемий в кардиоторакальной хирургии была 4,3%, в отделениях общей хирургии - 1,7%. Грибковые инфекции являются нередкими осложнениями у больных с ожогами и после травм. Летальность у больных инвазивным кандидозом остается высокой и достигает 30-40%. По данным многоцентрового проспективного исследования, проведенного в России с 2005 по 2013 гг., среди 55 больных кандидемией, негативное влияние на результаты лечения больных кандидемией оказывала необходимость перевода больных в реанимацию, уменьшая частоту излечения в 50 раз.
Среди инфекций, вызванных дрожжеподобными грибами, основную долю (до 90%) составляют грибы рода Candida.
Риск развития грибковой инфекции определяется многими факторами, которые могут выступать синергистами. У пациентов со злокачественными опухолями дополнительными факторами риска являются длительная гранулоцитопения после проведения полихимиотерапии, нарушения клеточного иммунитета, колонизация слизистых оболочек Candida spp., тяжелые мукозиты при цитостатическом воздействии.
Одним из тяжелых осложнений является кандидемия - циркуляция грибов рода Candida в кровяном русле. Инвазивный кандидоз, вызванный грибами рода Candida, относится к частым и тяжелым осложнениям, для которых характерна более высокая летальность, требующая длительного лечения. Среди дрожжеподобных грибов преобладают С. albicans, однако, в последние годы наблюдается их снижение и увеличение таких грибов, как С. parapsilosis, С. tropicalis, С. krusei, С. glabrata.
В части случаев (5-7%) инфекции могут быть обусловлены другими дрожжеподобными грибами, такими как Saprochaete capitata, Saccharomyces cerevisiae, Rhodotorula spp., причем некоторые из них нуждаются в назначении особых антимикотиков, поскольку проявляют природную резистентность к некоторым противогрибковым препаратам.
Одна из ведущих причин высокой летальности у больных кандидемией - это несвоевременное и неадекватное назначение антимикотиков. В этой связи крайне важным является представление результатов идентификации возбудителей инфекции в максимально короткие сроки.
На сегодняшний день известно использование для выявления возбудителя грибковой инфекции полимеразной цепной реакции (ПЦР), с помощью которой исследуют материал, полученный при бронхоальвеолярном лаваже или пункции [Bretagne, Costa, Marmorat-Khuong. Detection of Aspergillus spesies DNA in bronchoalveolar lavage samples by competitive PCR // J. Clin. Mcrobiol.- 1995.- Vol. 33, N 5.- P. 1164-1168]. Возможно также определение специфических ДНК с помощью ПЦР в крови [Einsele, Hebart, Roller. Detection and identification of fungal pathogens in blood by using molecular probes // J. Clin. Mcrobiol- 1997.- Vol. 35, N6.- P. 1353-1360]. Микробиологическое исследование очень редко позволяет обнаружить присутствие возбудителя в гемокультуре; также недостаточно эффективны рутинные серологические исследования.
Известен также способ идентификации микроорганизмов в том числе дрожжеподобных грибов из тестируемого образца гемокультуры. Способ предусматривает получение тестируемого образца, селективный лизис и растворение клеток, не являющихся микроорганизмами тестируемого образца, наслаивание полученного лизата на плотностной буфер в герметичном контейнере и дальнейшее центрифугирование. Плотностный буфер имеет однородную плотность примерно от 1,025 г/мл до 1,120 г/мл. При этом микроорганизмы, проходя через указанный буфер, образуют осадок на дне контейнера. Осадок исследуют с использованием рамановской спектроскопии, что позволяет идентифицировать микроорганизм на уровне рода или вида. Изобретение позволяет идентифицировать дрожжеподобные грибы из клинических образцов менее чем за 120 мин (RU 2541775, 20.02.2015).
Наиболее близким техническим решением к заявленному изобретению является способ экспресс идентификации дрожжеподобных грибов рода Candida из положительной гемокультуры с помощью матрично-активированной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии (MALDI-TOF MS) при этом из флаконов, содержащих в качестве сорбента полимерные гранулы, к 1 мл его содержимого, помещенного в микропробирку, добавляют 200 мкл 5% водного раствора сапонина для лизиса эритроцитов. Смесь инкубируют в течение 5 мин при комнатной температуре, лизат центрифугируют (12000 об/мин, 1 мин), после чего удаляют супернатант. Далее осадок промывают 1 мл фосфатно-солевого буфера, затем повторно центрифугируют (12000 об/мин, 1 мин) и удаляют супернатант. К осадку добавляют сначала 300 мкл бидистилированной воды, перемешивают, затем 900 мкл этанола, центрифугируют (12000 об/мин, 2 мин), удаляют супернатант, осадок подсушивают при комнатной температуре в течение нескольких минут, после чего к нему последовательно добавляют сначала 20 мкл муравьиной кислоты, затем равное количество ацетонитрила. Полученную суспензию перемешивают, после чего центрифугируют (12000 об/мин, 2 мин), 1 мкл белкового экстракта наносят на мишень масс-спектрометра в двух повторностях, подсушивают, после чего добавляют раствор матрикса (а-циано-4-гидроксикоричная кислота) в соотношении 1:1 и оставляют до полного высыхания. Масс-спектры регистрируют в автоматическом режиме в диапазоне 2-20 кД. Идентификацию микроорганизмов осуществляют путем автоматического сравнения полученных масс-спектров с референсной базой данных, содержащей информацию более чем о 950 клинически значимых видах микроорганизмов (Попов Д.А., Овсеенко С.Т., Вострикова Т.Ю. Экспресс-идентификация положительных гемокультур с помощью метода прямой MALDI-TOF-масс-спектрометрии. Анестезиология и реаниматология, 2015, №5, с. 71-75). Недостатками данных методов является малое количество исследованных изолятов грибов (всего 2) и соответственно малое количество положительных результатов (только 1 из 2).
Технический результат заявленного способа заключается в расширении арсенала технических средств, предназначенных для идентификации микроорганизмов из кровотока, содержащего не только Candida spp., но и другие дрожжеподобные грибы с высокой достоверностью.
Технический результат достигается тем, что идентификацию дрожжеподобных грибов рода Candida и рода Rhodotorula проводят путем пробоподготовки положительной гемокультуры и идентификации дрожжеподобных грибов методом матрично-активированной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии, при этом пробоподготовку положительной гемокультуры осуществляют путем ее переноса из флакона с жидкой питательной средой, предназначенного для культивирования микроорганизмов, в пробирку с разделительным гелем и далее центрифугируют при 1000 оборотов в течение 2 минут, полученную надосадочную жидкость перемешивают, переносят в микроцентрифужную пробирку и центрифугируют при 14000 оборотах в течение 10 минут, после чего надосадочную жидкость удаляют, а к осадку добавляют деионизированную воду и перемешивают на вортексе, затем центрифугируют при 14000 оборотах в течение 2 минут, вновь удаляют надосадочную жидкость, а к осадку снова добавляют деионизированную воду и перемешивают на вортексе, после чего центрифугируют при 14000 оборотах в течение 2 минут, удаляют надосадочную жидкость, затем к осадку добавляют 0,1% додецилсульфат натрия, перемешивают на вортексе, затем оставляют микроцентрифужную пробирку на 10 мин для полного растворения осадка, далее центрифугируют при 14000 оборотах в течение 2 минут, после чего надосадочную жидкость удаляют, а к осадку добавляют деионизированную воду и перемешивают на вортексе, затем центрифугируют при 14000 оборотах в течение 2 минут, удаляют надосадочную жидкость, к осадку снова добавляют деионизированную воду и перемешивают на вортексе, после чего центрифугируют при 14000 оборотах в течение 2 минут, удаляют надосадочную жидкость, далее к осадку добавляют деионизированную воду и 96% этиловый спирт и еще раз перемешивают на вортексе, после чего центрифугируют при 14000 оборотах в течение 2 минут, затем удаляют надосадочную жидкость, далее оставляют микроцентрифужную пробирку с открытой крышкой до полного испарения спирта (примерно на 5-10 мин.), после чего проводят экстракцию белкового экстракта муравьиной кислотой и ацетонитрилом, полученную надосадочную жидкость наносят на мишень масс-спектрометра, после высыхания покрывают матрицей и проводят идентификацию дрожжеподобных грибов Candida spp. и Rhodotorula spp. до родовой принадлежности по значению коэффициента идентификации (score) от 1,1 до 1,5 и до видовой принадлежности - от 1,6 и выше.
Способ осуществляется следующим образом.
Кровь для микробиологического исследования берут у больных при температуре от 38°С и выше из периферической вены и/или из центрального венозного катетера. Вносят образцы крови в коммерческие флаконы с жидкой питательной средой, предназначенной для культивирования микроорганизмов (ВАСТЕС Рlus Аеrоbic/F, ВАСТЕС Рlus Аnaerobic/F, ВАСТЕС Мycosis-1С/F). Флаконы с кровью инкубируют в автоматическом анализаторе для гемокультур (ВD ВАСТЕС FХ, Весtоn Dickinson). После сигнала прибора о наличии положительной гемокультуры (то есть, получен рост микроорганизма во флаконе с питательной средой) используют предложенный способ пробоподготовки для идентификации дрожжеподобных грибов методом матричной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии. Для этого набирают 5-6 мл крови из флакона с жидкой питательной средой в пробирку (Моноветта 7,5 мл), содержащей сыворотку-гель (5 мин) и центрифугируют при 1000 оборотах (2 мин). Полученную надосадочную жидкость аккуратно перемешивают стерильной одноразовой пипеткой (15 сек), переносят 1 мл надосадочной жидкости (15 сек) в микроцентрифужную пробирку (1,5 мл) и центрифугируют при 14000 оборотах (10 мин). Надосадочную жидкость удаляют (30 сек), а к осадку добавляют 1 мл деионизированной воды и перемешивают на вортексе (30 сек). Далее центрифугируют при 14000 оборотах (2 мин). Надосадочную жидкость вновь удаляют (30 сек), к осадку добавляют 1 мл деионизированной воды, перемешивают на вортексе (30 сек), центрифугируют при 14000 оборотах (2 мин) и после удаления полученной надосадочной жидкости к осадку добавляют 1 мл 0,1% раствора додецилсульфата натрия, перемешивают смесь на вортексе (30 сек). Отстаивают 10 минут и центрифугируют при 14000 оборотах (2 мин). После чего надосадочную жидкость удаляют (30 сек), к осадку добавляют 1 мл деионизированной воды и перемешивают на вортексе (30 сек), центрифугируют при 14000 оборотах в течение 2 мин, удаляют надосадочную жидкость (30 сек), к осадку снова добавляют деионизированную воду и перемешивают на вортексе, центрифугируют при 14000 оборотах в течение 2 мин, затем удаляют надосадочную жидкость, а к осадку добавляют 300 мкл деионизированной воды и 900 мкл 96% этилового спирта, перемешивают на вортексе (30 сек) и центрифугируют при 14000 оборотах в течение 2 мин. Полученную надосадочную жидкость удаляют (30 сек) и оставляют центрифужную пробирку с открытой крышкой на 5 мин для полного испарения спирта. После чего добавляют 30 мкл муравьиной кислоты и 30 мкл ацетонитрила. Надосадочную жидкость наносят на мишень, после высыхания (5 мин) которой ее покрывают матрицей (α-циано-4-гидроксикоричная кислота) (5 мин).
Далее проводят идентификацию микроорганизмов методом матрично-активированной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии (MALDI-TOF MS) на анализаторе Microflex LT (Bruker Daltonics, Германия) (5 мин). В качестве критерия надежной родовой идентификации дрожжеподобных грибов используют коэффициент идентификации (Score) от 1,1 до 1,5, а видовой идентификации - от 1,6 и выше.
В период с июня 2016 года по ноябрь 2019 было исследовано 15 положительных гемокультур, полученных от больных. Забор крови от больных осуществляли при температуре от 38° и более из периферической вены и/или из центрального венозного катетера. Образцы крови вносили во флаконы для культивирования микроорганизмов и помещали их в автоматический анализатор для гемокультур. После получения сигнала на автоматическом анализаторе о наличии роста микроорганизмов во флаконе, проводили идентификацию Candida spp. и других дрожжеподобных грибов предложенным методом с помощью матрично-активированной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии (MALDI-TOF MS) и параллельно исследовали классическим методом на плотных питательных средах с целью получения культуры микроорганизмов и проведения их идентификации.
Из всех положительных флаконов Bactec микроорганизмы были выделены в монокультуре, из них было 14 изолятов Candida spp. и 1 Rhodotorula mucilaginosa. Спектр микроорганизмов, полученных из флаконов для культивирования микроорганизмов, представлен в таблице 1.

При применении предложенного метода успешная идентификация микроорганизмов до рода была получена в 80% (в 12 из 15) случаев, до вида в 66,7% (в 10 из 15). Результаты идентификации до рода и вида микроорганизмов, полученных предложенным методом, полностью совпали с результатами идентификации после культивирования микроорганизмов классическим методом (таблица 2).
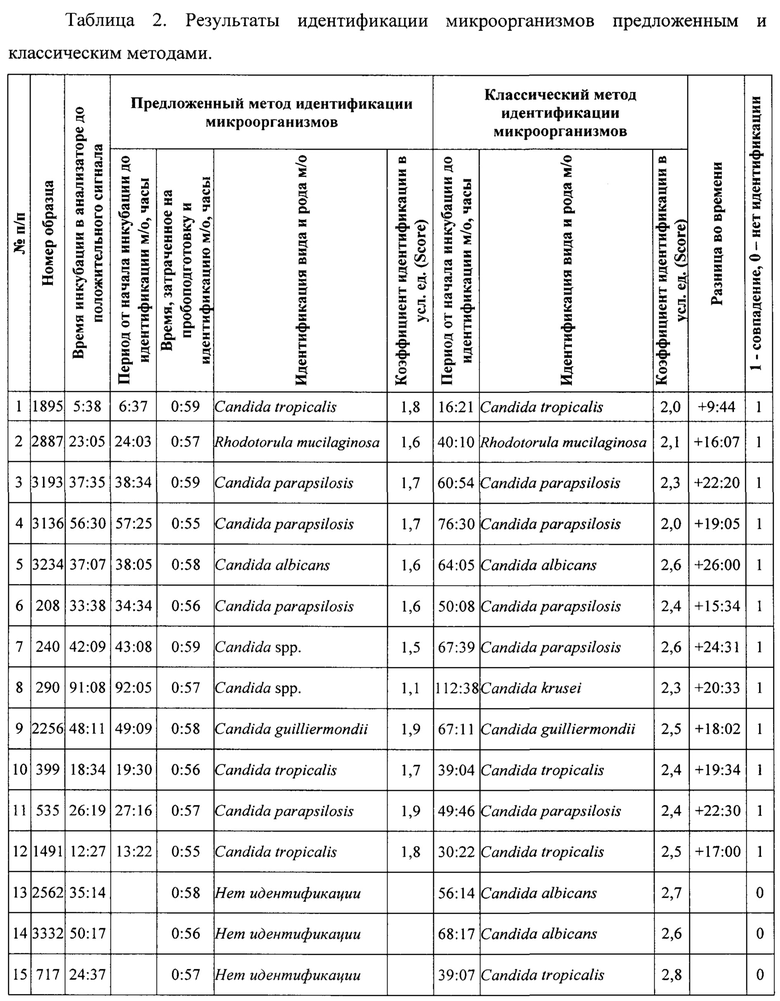
Медиана длительности инкубации флаконов с гемокультурой до получения положительного сигнала составила 35 ч 14 мин (разброс от 5 ч 38 мин до 91 ч 08 мин), причем медиана длительности инкубации разных видов дрожжеподобных грибов различалась и была минимальной для Candida tropicalis - 15 ч 31 мин (разброс от 5 ч 38 мин до 18 ч 34 мин), а максимальной для Candida krusei - 91 ч 08 мин. Медиана времени от начала инкубации флаконов с гемокультурой до получения результатов идентификации микроорганизмов всех дрожжеподобных грибов (n=12) предложенным методом была статистически значимо меньше и составила 36 ч 20 мин (разброс 6 ч 37 мин до 92 ч 05 мин) против 55 ч 31 мин (разброс от 16 ч 21 мин до 112 ч 38 мин) при идентификации микроорганизмов классическим методом (р=0,028). Идентификация грибов до рода Candida (n=11) предложенным методом составила 38 ч 05 мин (разброс 6 ч 37 мин до 92 ч 05 мин) против 60 ч 54 мин (разброс от 16 ч 21 мин до 112 ч 38 мин) классическим методом (р=0,039), таблица 3.
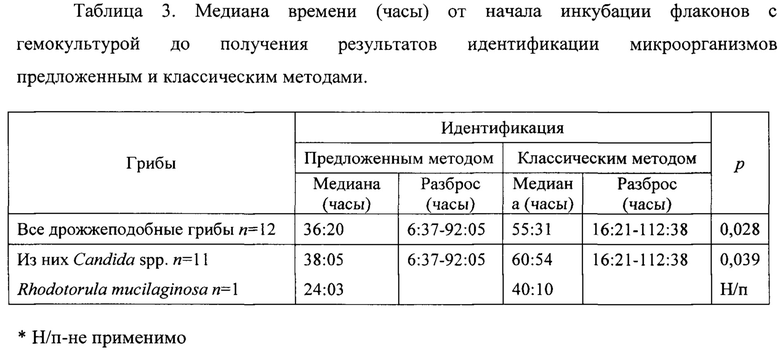
Затраты времени на проведение идентификации микроорганизмов предложенным методом, включая пробоподготовку и идентификацию на масс-спектрометре, составили от 55 мин до 59 мин, тогда как идентификация с помощью классического метода была получена только через 18-48 часов. Медиана разницы во времени между идентификацией дрожжеподобных грибов предложенным и классическим методом составила 19 ч 20 мин (разброс от 9 ч 44 мин до 26 ч 00 мин), таблица 3.
Примеры конкретного выполнения предложенного способа идентификации микроорганизмов.
Пример 1
Больная Ю., 36 лет, поступила в стационар 22.05.2018 г. с диагнозом лимфогранулематоз для проведения 2 курса химиотерапии по программе Dexa Beam. На фоне миелотоксического агранулоцитоза 30.05.2018 г. у больной было отмечено появление диареи и повышения температуры тела до 38,5°С. Было выполнено микробиологическое исследование крови из периферической вены и центрального венозного катетера, был назначен цефоперазон/сульбактам. На фоне применения цефоперазона/сульбактама наблюдалось повышение температуры до 39,8°С, появились септические отсевы на коже, и 01.06.2018 г. была произведена эскалация антибиотической терапии, включавшая отмену цефоперазон/сульбактама и назначение имипенема, амикацина и ванкомицина. Повторно 01.06.2018 г. было проведено микробиологическое исследование крови. При повторном исследовании была выявлена из гемокультуры Klebsiella pneumoniae (04.06.2019 г.). Состояние больной ухудшалось, была проведена дальнейшая модификация противомикробного лечения, включавшая назначение меропенема и ко листана и отмену предыдущих антибиотиков. После выполнения повторного микробиологического исследования крови от 05.06.2018 г. из периферической вены через 37 часов 07 минут после начала инкубации (06.06.2018) был зарегистрирован рост микроорганизмов. Был использован предложенный способ идентификации микроорганизмов из положительной гемокультуры методом матричной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии (MALDI-TOF MS) из флакона для культивирования микроорганизмов и параллельно был проведен рассев гемокультуры на плотные питательные среды. Используя предложенный способ, через 59 минут после сигнала автоматического анализатора о положительной гемокультуре была получена идентификация микроорганизмов - Candida albicans. Коэффициент идентификации (Score) составил 1,6. Таким обозом, идентификация Candida albicans была проведена через 38 часов от момента постановки флакона с кровью в автоматический анализатор для гемокультур. В этот же день (06.06.2018 г) у больной было отмечено ухудшение состояния в виде повышения температуры до 40°С с ознобом. Сразу после получения результатов предварительной идентификации микроорганизмов была проведена модификация антибактериальной терапии и был назначен микамин - противогрибковый препарат из группы эхинокандинов. Результат рутинной идентификации микроорганизмов из культуры был получен только на следующий день после положительного сигнала автоматического анализатора для гемокультур, в это время при добавлении противогрибкового препарата по результатам предварительной идентификации было достигнуто клиническое улучшение в виде снижения температуры с 40°С до 37,5°С. В результате лечения отмечена нормализация температуры и регрессия очагов отсевов на коже. Адекватная противогрибковая терапия была начата через 38 часов после взятия крови. Повторные микробиологические исследования крови от больной в течение 3-х дней (согласно рекомендациям) были отрицательными. Длительность лечения составила 14 дней (согласно рекомендациям не менее 14 дней).
Пример 2
Больной Г., 40 лет, с диагнозом острый миелобластный лейкоз поступил в стационар для проведения первого индукционного курса "7+3" с постоянным введением цитарабина по протоколу ОМЛ-17. Состояние больного при поступлении было тяжелым, наблюдались температура до 37,8°С, синусит, и курс химиотерапии был начат 02.02.2018 г. на фоне антимикробной терапии цефоперазоном/сульбактамом, кларитромицином и амикацином. Ежедневно с 02.02.2018 г. выполнялись микробиологические исследования крови из периферической вены и центрального венозного катетера. 09.02.2018 г. был отмечен вираж лихорадки с повышением температуры до 39,6°С, в связи с чем была проведена эскалация антибактериальной терапии, включающая отмену ранее применяемых антибиотиков и назначение имипенема. Через 5 часов 38 минут после начала инкубации крови во флаконах для культивирования микроорганизмов (от 10.02.2018 г) был зарегистрирован рост. Идентификация микроорганизмов была проведена предложенным способом и параллельно был осуществлен рассев гемокультуры на плотные питательные среды. Через 59 минут после положительного сигнала автоматического анализатора для гемокультур Bactec была получена идентификация микроорганизмов - Candida tropicalis (коэффициент идентификации 1,7). После получения результатов идентификации микроорганизмов предложенным методом (время от поступления флакона с кровью в лабораторию до идентификации - 19 ч. 30 мин) к терапии был добавлен противогрибковый препарат каспофунгин. Результат классической идентификации микроорганизмов на плотных питательных средах был получен только на следующий день (11.02.2018 г.) после положительного сигнала автоматического анализатора для гемокультур (время от поступления флакона с кровью в лабораторию до идентификации микроорганизмов предложенным методом составило 39 ч 04 мин). В это время (10.02.2018 г.) на фоне добавления противогрибкового препарата было достигнуто клиническое улучшение в виде снижения температуры с 39,6°С до 37°С. Повторные микробиологические исследования крови от больного в течение 3-х дней (согласно рекомендациям) были отрицательными. Каспофунгин был отменен через 15 суток.
Пример 3
Больная С., 55 лет, с диагнозом острый миелобластный лейкоз поступила в стационар 10.02.2017 г. для проведения первого индукционного курса полихимиотерапии (AzaAralda) с включением гипометилирующего препарата азацитидина. При поступлении состояние больной было крайне тяжелое, обусловленное дебютом острого лейкоза, двусторонней пневмонией, протекающей с гидротораксом и дыхательной недостаточностью, энтеропатией, синдромом массивного распада опухоли. Учитывая эпизод лихорадки с повышением температуры до 39°С, ежедневно с 10.02.2017 г. выполнялись микробиологические исследования крови из периферической вены и центрального венозного катетера. 14.02.2017 г. через 91 час 08 минут после начала инкубации крови во флаконах с жидкой питательной средой был зарегистрирован рост микроорганизмов. Была проведена идентификация микроорганизмов предложенным способом методом матричной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии (MALDI-TOF MS) и параллельно рассев гемокультуры на плотные питательные среды (классическим методом). Через 57 минут (14.02.2017 г.) после сигнала автоматического анализатора о положительной гемокультуре была получена идентификация микроорганизмов до рода - Candida spp. (коэффициент идентификации 1,1). После получения результатов идентификации микроорганизмов предложенным методом (14.02.2017 г.) к терапии был добавлен противогрибковый препарат микафунгин. Результат классической идентификации микроорганизмов, выделенных на твердых питательных средах, был получен только на следующий день (15.02.2017 г.) после сигнала автоматического анализатора о положительной гемокультуре. Изоляты Candida spp. были идентифицированы как С. krusei. При этом на фоне противогрибковый терапии было достигнуто некоторое снижение температуры с 39,0°С до 37,1°С, но с последующим повышением до 39,4°С и 17.02.2017 г. была проведена модификация противогрибковой терапии, включающая отмену микафунгина и назначение амфотерицина-В. В ходе лечения достигнуто клиническое улучшение в виде снижения температуры с 39,4°С до 37,0°С. Повторные микробиологические исследования крови от больной в течение 3-х дней (согласно рекомендациям) были отрицательными. Амфотерицин-В был отменен через 17 суток.
Пример 4
Больная И., 48 лет, поступила в стационар 10.01.2017 г. с диагнозом острый миелобластный лейкоз для проведения курса полихимиотерапии по программе "7+3 с идарубицином" по причине прогрессии основного заболевания. Курс полихимиотерапии был начат 11.01.2017 г. Появление фебрильной лихорадки было отмечено 20.01.2017 г. у больной. Было выполнено микробиологическое исследование крови из периферической вены и центрального венозного катетера, и был назначен пиперациллин/тазобактам. На фоне применения пиперациллин/тазобактама наблюдалось снижение температуры тела до субфебрильных значений. С целью индукции реакции трансплантат против лейкоза 24.01.2017 г. была выполнена трансфузия лимфоцитов донора с последующим введением интерлейкина-2. Учитывая эпизод лихорадки с повышением температуры до 39,0°С, больной ежедневно с 01.02.2017 г. выполнялись микробиологические исследования крови из периферической вены и центрального венозного катетера, и к лечению был добавлен амикацин, однако, на этом фоне сохранялась лихорадка со спонтанным снижением до субфебрильных и нормальных значений в течение суток. 03.02.2017 г. через 42 часа 09 минут после начала инкубации крови во флаконах для автоматического анализатора с жидкой питательной средой был зарегистрирован рост микроорганизмов. Были проведены идентификация микроорганизмов предложенным способом и параллельно рассев гемокультуры на плотные питательные среды. Через 59 минут после сигнала анализатора о положительной гемокультуре предложенным способом были идентифицированы микроорганизмы до рода - Candida spp. с коэффициентом идентификации 1,5. После получения результатов идентификации микроорганизмов предложенным способом к терапии 03.02.2017 г. был добавлен антимикотик (эхинокандин) - микафунгин. Результат классической идентификации микроорганизмов, выделенных на твердых питательных средах, был получен только на следующий день (04.02.2017 г.) после сигнала автоматического анализатора для гемокультур, и микроорганизмы из гемокультуры были идентифицированы как С. parapsilosis. Повторные микробиологические исследования крови от больной в течение 3-х дней (согласно рекомендациям) были отрицательными. Противогрибковая терапия не менялась. На фоне применения микафунгина 03.02.2017 г. было достигнуто клиническое улучшение в виде снижения температуры с 39,0°С до 37,1°С. Учитывая стойкую нормализацию температуры тела, согласно рекомендациям, микафунгин был отменен на 17-е сутки.
Таким образом, проведенное исследование показало высокую достоверность предложенного метода идентификации микроорганизмов у больных с кандидемией, а также сокращение времени до идентификации дрожжеподобных грибов в положительной гемокультуре, что является основополагающим для обеспечения максимальной эффективности лечения, предотвращения развития жизнеугрожающих состояний таких, как септический шок и полиорганная недостаточность. Доказано, что при кандидемий задержка этиотропной терапии на каждые 12 часов увеличивает показатели летальности в 2 раза, поэтому ранняя идентификация возбудителя крайне важна. На основании полученных результатов предложенный метод идентификации дрожжеподобных грибов из положительной гемокультуры с помощью матрично-активированной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии (MALDI-TOF MS) можно рекомендовать для использования в рутинной практике лабораторий микробиологии с целью сокращения времени представления результата.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ идентификации бактерий из положительных гемокультур методом матричной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии (MALDI-TOF MS), у больных с инфекцией кровотока | 2020 |
|
RU2750611C1 |
| СПОСОБ ПРОБОПОДГОТОВКИ ОБРАЗЦОВ ДЛЯ ИДЕНТИФИКАЦИИ МИКОБАКТЕРИЙ ИЗ ПОЛОЖИТЕЛЬНЫХ ГЕМОКУЛЬТУР | 2023 |
|
RU2832069C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РОДА ВОЗБУДИТЕЛЕЙ БАКТЕРИЕМИЙ | 2011 |
|
RU2495939C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ ИЗ ТЕСТИРУЕМОГО ОБРАЗЦА ГЕМОКУЛЬТУРЫ | 2009 |
|
RU2541775C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ ВОЗБУДИТЕЛЯ ИНФЕКЦИОННОГО ПОРАЖЕНИЯ КЛАПАНА СЕРДЦА | 2006 |
|
RU2314533C1 |
| СПОСОБЫ ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ С ПОМОЩЬЮ СПЕКТРОСКОПИИ (ВАРИАНТЫ) | 2009 |
|
RU2531225C2 |
| СПОСОБЫ РАЗДЕЛЕНИЯ, ХАРАКТЕРИСТИКИ И(ИЛИ) ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ С ПОМОЩЬЮ МАСС-СПЕКТРОМЕТРИИ | 2009 |
|
RU2519650C2 |
| СПОСОБЫ РАЗДЕЛЕНИЯ И ХАРАКТЕРИСТИКИ МИКРООРГАНИЗМОВ С ПОМОЩЬЮ ИДЕНТИФИКАТОРА | 2009 |
|
RU2533252C2 |
| СПОСОБ ПРОБОПОДГОТОВКИ ДЛЯ УСКОРЕННОЙ ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ ИЗ ПОЛОЖИТЕЛЬНЫХ ГЕМАТОЛОГИЧЕСКИХ КУЛЬТУР | 2021 |
|
RU2766185C1 |
| СПОСОБ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ МУЖСКОЙ РЕПРОДУКТИВНОЙ ФУНКЦИИ | 2022 |
|
RU2799245C1 |
Изобретение относится к области медицины, в частности к микробиологии. Раскрыт способ идентификации дрожжеподобных грибов рода Candida и рода Rhodotorula, включающий пробоподготовку положительной гемокультуры и идентификацию дрожжеподобных грибов методом матрично-активированной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии. При этом пробоподготовку положительной гемокультуры осуществляют путем ее переноса из флакона с жидкой питательной средой в пробирку с разделительным гелем и затем центрифугируют при 1000 оборотов в течение 2 минут. Полученную надосадочную жидкость подвергают многократным последовательным операциям центрифугирования и добавления деионизированной воды. Затем удаляют надосадочную жидкость, далее к осадку добавляют деионизированную воду и 96% этиловый спирт и еще раз перемешивают на вортексе, после чего центрифугируют при 14000 оборотах в течение 2 минут, затем удаляют надосадочную жидкость. Далее оставляют микроцентрифужную пробирку с открытой крышкой до полного испарения спирта, после чего проводят экстракцию белкового экстракта муравьиной кислотой и ацетонитрилом, полученную надосадочную жидкость наносят на мишень масс-спектрометра, после высыхания покрывают матрицей и проводят идентификацию дрожжеподобных грибов рода Candida и рода Rhodotorula до родовой принадлежности по значению коэффициента идентификации (score) от 1,1 до 1,5 и до видовой принадлежности - от 1,6 и выше. Изобретение обеспечивает расширение арсенала технических средств, предназначенных для ускоренной идентификации микроорганизмов из крови, содержащей дрожжеподобные грибы с высокой достоверностью. 3 табл., 4 пр.
Способ идентификации дрожжеподобных грибов рода Candida и рода Rhodotorula методом матричной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии, включающий пробоподготовку положительной гемокультуры и идентификацию дрожжеподобных грибов методом матрично-активированной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии, отличающийся тем, что пробоподготовку положительной гемокультуры осуществляют путем ее переноса из флакона с жидкой питательной средой, предназначенного для культивирования микроорганизмов, в пробирку с разделительным гелем и центрифугируют при 1000 оборотов в течение 2 минут, полученную надосадочную жидкость перемешивают, переносят в микроцентрифужную пробирку и центрифугируют при 14000 оборотах в течение 10 минут, после чего надосадочную жидкость удаляют, а к осадку добавляют деионизированную воду и перемешивают на вортексе, затем центрифугируют при 14000 оборотах в течение 2 минут, удаляют надосадочную жидкость, к осадку снова добавляют деионизированную воду и перемешивают на вортексе, после чего центрифугируют при 14000 оборотах в течение 2 минут, удаляют надосадочную жидкость, затем к осадку добавляют 0,1% додецилсульфат натрия, перемешивают на вортексе, микроцентрифужную пробирку оставляют на 10 мин для полного растворения осадка, далее центрифугируют при 14000 оборотах в течение 2 минут, после чего надосадочную жидкость удаляют, а к осадку добавляют деионизированную воду и перемешивают на вортексе, затем центрифугируют при 14000 оборотах в течение 2 минут, удаляют надосадочную жидкость, к осадку снова добавляют деионизированную воду и перемешивают на вортексе, после чего центрифугируют при 14000 оборотах в течение 2 минут, удаляют надосадочную жидкость, далее к осадку добавляют деионизированную воду и 96% этиловый спирт и еще раз перемешивают на вортексе, после чего центрифугируют при 14000 оборотах в течение 2 минут, затем удаляют надосадочную жидкость, далее оставляют микроцентрифужную пробирку с открытой крышкой до полного испарения спирта, после чего проводят экстракцию белкового экстракта муравьиной кислотой и ацетонитрилом, полученную надосадочную жидкость наносят на мишень масс-спектрометра, после высыхания покрывают матрицей и проводят идентификацию дрожжеподобных грибов рода Candida и рода Rhodotorula до родовой принадлежности по значению коэффициента идентификации (score) от 1,1 до 1,5 и до видовой принадлежности - от 1,6 и выше.
| ПОПОВ Д.А | |||
| и др | |||
| Ускоренные методы идентификации положительных гемокультур с применением MALDI-TOF масс-спектрометрии // Клин | |||
| Микробиол | |||
| Антимикроб | |||
| Химиотер., 2016, Т.18, стр.296-307 | |||
| ALIZADEH М | |||
| et al | |||
| Identification of Candida species isolated from vulvovaginitis using matrix assisted laser desorption ionization-time of flight mass |
Авторы
Даты
2020-12-28—Публикация
2020-03-05—Подача