Область техники
Изобретение относится к области традиционной китайской медицины, в частности к фармацевтической композиции для лечения бронхита и способам ее получения.
Уровень техники
Бронхит представляет собой воспаление слизистой оболочки трахеи и бронхов, вызванное бактериальными и вирусными инфекциями или раздражениями, обусловленными физическими и химическими факторами. Как правило, данное заболевание преимущественно характеризуется кашлем, мокротой, дискомфортом или болью за грудиной, затруднением дыхания и сопровождающими их обычными симптомами простуды. В соответствии с длительностью бронхит можно разделить на две формы: острый трахеобронхит и хронический бронхит. Хронический бронхит представляет собой бронхит, который, как правило, продолжается более двух месяцев и обостряется в течение двух лет подряд или продолжается три месяца подряд в течение одного года, что вызывает воспаление слизистой оболочки и периферических тканей. Большинство пациентов являются взрослыми, и часто обострение происходит весной и зимой. В традиционной китайской медицине бронхит принадлежит к категориям «кашель», «скопление жидкости-флегмы», «астматический синдром» и т.д.
Хронический бронхит относится к хроническому, неспецифическому воспалению слизистой оболочки трахеи и бронхов, а также периферических тканей, и клинически проявляется в виде кашля, мокроты или в хронической форме, сопровождаемой затруднением дыхания и проявляемой повторно. Если заболевание развивается медленно, оно часто осложняется обструктивной энфиземой легких и даже легочной гипертензией или легочно-сердечной недостаточностью. Согласно данным выборочного общего исследования, проведенного в Китае в 1973 году, распространенность хронического бронхита составляла примерно 3,82,% и с возрастом повышалась, достигая примерно 15% среди лиц старше 50 лет. Данные выборочного общего исследования, проведенного в Китае в 1992 году, показали, что распространенность хронического бронхита составляла 3,2%.
Причина заболевания хроническим бронхитом представляет собой совокупность разнообразных факторов. В дополнение к таким факторам, как окружающая среда, климат, наследственность, курение и т.д., вирусные и бактериальные инфекции являются чрезвычайно важными факторами. В дополнение к вышеуказанным этиологическим факторам хронический бронхит вызывают внутренние факторы организма, такие как дисфункция вегетативной нервной системы, которая может привести к гиперфункции парасимпатической нервной системы, так что восприимчивость дыхательных путей лиц, страдающих данным заболеванием, более высокая, чем у здоровых людей. Таким образом, слабые раздражители, не оказывающие влияние на здоровых людей, могут привести к сокращению и спазму бронхов, повышению выделения слизи и развитию таких симптомов, как кашель, мокрота, затруднение дыхания и т.д. В настоящее время лечение, основанное на достижениях западной медицины, в основном направлено на контроль инфекции, разжижение мокроты и остановку кашля, в то же время данный способ лечения не эффективен при устранении дисфункции как одного из внутренних факторов. После перенесения острой фазы, длившейся несколько дней, многие пациенты обычно ощущают ослабление лихорадки и отвращения к холоду и выделяют вязкую желтую мокроту. Однако такие симптомы, как кашель, мокрота и затруднение дыхания, не снимаются, а объем мокроты значительно увеличивается. Кроме того, длительный и высокодозированный прием антибиотиков широкого спектра действия в сочетании с глюкокортикоидами является дополнительной причиной внутрибольничного вторичного заражения. Существуют исследования, демонстрирующие, что лечение хронического бронхита средствами традиционной китайской медицины в соответствующих пропорциях на разных этапах является оптимальным в отношении эффективности и экономичности.
В традиционной китайской медицине лечение данного заболевания имеет довольно длинную историю. В рамках традиционной китайской медицины непрерывное исследование, направленное на выявление первопричин, способов, рецептов и лекарственных средств для лечения кашля, проводится врачами на протяжении многих поколений. При лечении, согласно традиционной китайской медицине, делают упор на принцип лечения второстепенного и основного одновременно. Дифференциацию синдрома и лечение проводят на разных стадиях, которые в соответствии с развитием заболевания могут быть отнесены к таким стадиям, как стадия экзопатогенного воздействия на легкие, стадия закупорки легких мутной флегмой, стадия застоя ци и стаза крови и стадия доминирования патогена над жизненной ци. С помощью фармакологических исследований было показано, что лечение хронического бронхита средствами традиционной китайской медицины включает различные действия, такие как остановка кашля, растворение флегмы, уменьшение одышки и противовоспалительные действия. В клиническом исследовании было продемонстрировано, что лечение средствами традиционной китайской медицины может значительно облегчить такие симптомы, как кашель, мокрота, затруднение дыхания и т.п. и в то же время имеет меньше побочных эффектов по сравнению с западной медициной. Поскольку в ходе лечения у большинства пациентов может наступить стадия ремиссии хронического бронхита, частота применения антибиотиков может быть снижена, так что физическое состояние пациента может быть улучшено, и интервалы между острыми приступами могут быть увеличены, и таким образом качество жизни пациента может быть повышено.
Таким образом, по-прежнему существует необходимость в разработке новых лекарственных композиций традиционной китайской медицины для лечения бронхита, в частности хронического бронхита.
Краткое описание изобретения
Для удовлетворения вышеописанной потребности согласно настоящему изобретению предложены фармацевтическая композиция для лечения бронхита и способ ее получения. Фармацевтическая композиция согласно настоящему изобретению приготовлена из лекарственных материалов в следующих долях по массе:
Фармацевтическая композиция согласно настоящему изобретению предпочтительно приготовлена из лекарственных материалов в следующих долях по массе:
Более предпочтительно, фармацевтическая композиция согласно настоящему изобретению приготовлена из лекарственных материалов в следующих долях по массе:
Как вариант, композиция может быть приготовлена из лекарственных материалов в следующих долях по массе:
Как вариант, композиция может быть приготовлена из лекарственных материалов в следующих долях по массе:
Как вариант, композиция может быть приготовлена из лекарственных материалов в следующих долях по массе:
Среди лекарственных материалов, применяемых в фармацевтической композиции согласно настоящему изобретению, PINELLIAE RHIZOMA (корневище пинеллии) предпочтительно представляет собой PINELLIAE RHIZOMA PRAEPARATUM CUM ALUMINE, ATRACTYLODIS MACROCEPHALAE RHIZOMA (корневище атрактилодеса крупноголового) предпочтительно представляет собой RHIZOMA ATRACTYLODIS MACROCEPHALAE TOSTUM CUM MELLE ET FURFURE (латинское название соответствует стандарту Китайских травяных препаратов (Standard of Chinese Herbal Pieces) провинции Шаньси, февраль 2008), ARMENIACAE SEMEN AMARUM (семена абрикоса) предпочтительно представляют собой ARMENIACAE SEMEN AMARUM TOSTUM (латинское название соответствует стандарту Китайских травяных препаратов (Standard of Chinese Herbal Pieces) провинции Шаньси, февраль 2008), a SCUTELLARIAE RADIX (корень шлемника) предпочтительно применяют в форме ломтиков.
В фармацевтической композиции согласно настоящему изобретению PINELLIAE RHIZOMA и CITRI RETICULATAE PERICARPIUM (кожура мандарина) представляют собой основные лекарственные средства. PINELLIAE RHIZOMA является острым на вкус, «теплым» по природе и входит в каналы селезенки, желудка и легких. Будучи «теплым» и «сухим» по природе и способным устранять влажность с помощью сухости, растворять флегму и оказывать опускающее действие, PINELLIAE RHIZOMA является основной травой для растворения флегмы и опускания восходящего потока вредоносной ци, а также имеет эффект остановки кашля. PINELLIAE RHIZOMA описана как «имеющая способность направлять вниз движение влаги-флегмы в легких и желудке, впитывать ци и ослаблять астму» (Yi Xue Zhong Zhong Can Xi Lu). В Yao Xing Lun также указано, что данная трава «рассеивает флегму, опускает ци легких, повышает аппетит и тонизирует селезенку и устраняет избыток флегмы и ощущение заложенности в груди». CITRI RETICULATAE PERICARPIUM является острой и горькой на вкус, «теплой» по природе, выступает в качестве важнейшей травы, действующей на ци системы каналов легких и селезенки, и служит для регулирования ци, активизации селезенки, устранения влажности и растворения флегмы. Так как CITRI RETICULATAE PERICARPIUM обладает ароматным запахом и способна перемещать и направлять ци вниз, она хорошо подходит и для регулирования ци, и для устранения влажности с помощью сухости, таким образом приводя к тонизированию ци селезенки, и тем самым уничтожает первопричину образования флегмы. Благодаря способности регулировать ци, сушить влажность, растворять флегму и направлять вниз восходящий вредоносный поток PINELLIAE RHIZOMA и CITRI RETICULATAE PERICARPIUM совместно применяют в качестве основных лекарственных средств, преимущественно влияющих на весь рецепт.
В фармацевтической композиции согласно настоящему изобретению ASTERIS RADIX ET RHIZOMA (корень и корневище астры), FARFARAE FLOS (цветы мать-и-мачехи), ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA (пория) и ARMENIACAE SEMEN AMARUM представляют собой содействующие лекарственные средства. ASTERIS RADIX ET RHIZOMA являются «теплыми» и «влажными» по природе, горькими на вкус и имеют очищающее действие. Данное лекарство оказывает значительный эффект растворения флегмы и ослабления кашля. В травнике Шэнь-Нуна указано, что ASTERIS RADIX ET RHIZOMA «главным образом представляют собой средство против кашля с одышкой и застоя ци в груди из-за холода и жара». FARFARAE FLOS могут увлажнять легкие и направлять ци вниз, ослаблять кашель и растворять флегму. В Ben Jing Feng Yuan представлены сведения, что данная трава имеет функции «увлажнения легких и растворения флегмы, остановки кашля и ослабления астмы». ASTERIS RADIX ET RHIZOMA и FARFARAE FLOS применяют, пользуясь их взаимным усилением, и данные травы являются хорошими лекарственными средствами для лечения хронического кашля и продолжительной одышки. Обе травы способны «быть теплыми, но не сухими, влажными, но не жирными», имеют специальные функции согревания и увлажнения ци легких, остановки кашля и растворения флегмы и, следовательно, увлажняют ци легких и восстанавливают легочную функцию очищения и опускания, благодаря чему флегма не может накапливаться в легких. Между тем, теплое и влажное свойства двух указанных лекарственных средств могут устранять повреждение инь, возникающее вследствие избытка в рецепте лекарственных веществ, обладающих свойствами тепла и сухости. ATRACTYLODIS MACROCEPHALAE RHIZOMA является сладким и горьким на вкус, «теплым» по природе. Данная трава может быть применена для пополнения ци и тонизирования селезенки, а также устранения влажности с помощью сухости, и в то же время для стимуляции диуреза. В Zhen Zhu Nang указано, что ATRACTYLODIS MACROCEPHALAE RHIZOMA хорошо подходит для «удаления влаги, благоприятного воздействия на ци, рассеивания флегмы и стимуляции диуреза». PORIA оказывает эффект тонизирования селезенки, стимуляции диуреза и удаления влаги и, таким образом, преимущественно действует на кашель, вызванный влагой-флегмой. Как записано в Shi Bu Zhai Yi Shu, «в качестве отдельно взятого лекарства PORIA является основным средством для лечения флегмы. PORIA может прекращать удерживание воды, так как природа флегмы представляет собой воду, а также может прекращать удерживание влаги, так как движение флегмы представляет собой влагу». Сочетание ATRACTYLODIS MACROCEPHALAE RHIZOMA и PORIA приводит к тонизированию селезенки, устранению влажности с помощью сухости и рассеиванию флегмы, таким образом, проявления и основы заболевания лечатся одновременно, так что устраняется влажность и тонизируется селезенка, благодаря чему флегма не может вырабатываться. ARMENIACAE SEMEN AMARUM являются горькими на вкус, слабо «теплыми» по природе и оказывают эффекты очищения с помощью горькости, опускания ци, остановки кашля и уменьшения одышки. После нагревания с перемешиванием (т.е. ARMENIACAE SEMEN AMARUM TOSTUM) не только уменьшается токсичность ARMENIACAE SEMEN AMARUM, но и усиливается функция увлажнения кишечника, помогающая устранить запор. В Ben Cao Bian Du указано, что «все орешки оказывают опускающий эффект, при этом семена абрикоса преимущественно опускают ци, что приводит к рассеиванию флегмы и остановке кашля, и в дальнейшем к увлажнению толстого кишечника…». Также в Yao Xing Lun указано, что ARMENIACAE SEMEN AMARUM «главным образом представляют собой средство против кашля с одышкой». Упомянутые выше лекарственные средства применяют совместно в качестве содействующих основным лекарственным средствам для тонизирования селезенки, устранения влажности и опускания потока вредоносной ци с тем, чтобы растворять флегму, ослаблять кашель и астму.
В фармацевтической композиции согласно настоящему изобретению PERILLAE FRUCTUS (плод периллы), RAPHANI SEMEN (семена редиса), SINAPIS SEMEN (семена горчицы), CINNAMOMI RAMULUS (ветвь коричника), SCUTELLARIAE RADIX (корень шлемника), FORSYTHIAE FRUCTUS (плод форзиции) и HOUTTUYNIAE HERBA (трава гуттунии) представляют собой вспомогательные лекарственные средства. PERILLAE FRUCTUS является острым на вкус, «теплым» по природе и имеет функции опускания ци, рассеивания флегмы, ослабления кашля и астмы. В Ri Hua Zi Ben Cao указано, что данный плод может «ослаблять кашель, увлажнять сердце и легкие и устранять флегму-ци». RAPHANI SEMEN являются острыми и сладкими на вкус, нейтральными по природе, входят в каналы селезенки, желудка и легких и имеют функции опускания ци, рассеивания флегмы, лечения накопления и непроходимости флегмы и одышки с кашлем. В справочнике Materia Medica указано, что данные семена могут «направлять ци вниз, чтобы уменьшить одышку, и воздействовать на флегму». SINAPIS SEMEN являются острыми на вкус, «теплыми» по природе и входят в канал легких. Данные семена имеют функции регулирования ци с помощью горького вкуса, согревания легких и рассеивания флегмы, а также могут уничтожать флегму в каналах и коллатералях. SINAPIS SEMEN применяют совместно с PERILLAE FRUCTUS и RAPHANI SEMEN против накопления флегмы и застоя ци так, чтобы растворять флегму путем распространения ци и улучшения проводимости коллатералей и способствовать PINELLIAE RHIZOMA в опускании восходящего потока вредоносной ци и устранении флегмы. CINNAMOMI RAMULUS является острой и сладкой на вкус и «теплой» по природе. С одной стороны, благодаря применению острого вкуса для распространения и «теплоты» для перемещения по каналам CINNAMOMI RAMULUS способна действовать на поверхности тела, чтобы ослабить наружный синдром и таким образом рассеять патогенные факторы и улучшить проводимость коллатералей. С другой стороны, данная трава способна создавать ян-ци в груди, доставляя энергию по каналам с помощью «теплоты», тем самым согревая и устраняя застой воды и влаги. CINNAMOMI RAMULUS совместно с PORIA и ATRACTYLODIS MACROCEPHALAE RHIZOMA могут согревать и поддерживать ян селезенки, тем самым уничтожая влажность и стимулируя диурез. SCUTELLARIAE RADIX является горьким на вкус и «холодным» по природе, входит в канал легких и имеет функции «чистки» жара, устранения влажности с помощью сухости и дренирования огня для обеспечения детоксикации. SCUTELLARIAE RADIX преимущественно «чистит» жар в легких, Дэн Си сказал об этом, что «поскольку SCUTELLARIAE RADIX служит для снижения флегмы, он может быть применен для изгнания огня». FORSYTHIAE FRUCTUS является горьким на вкус и «холодным» по природе. Данное средство, действуя наружно, может освобождать мышцы и внешнее и, действуя изнутри, «чистить» застойный жар и «имеет способность к поднятию и движению, а также рассеиванию,… может устранять наружные синдромы через мышцы, чистить жар и изгонять ветер, вследствие чего является основным лекарственным средством для лечения заболеваний, вызванных патогенным ветром-жаром» (Yi Xue Zhong Zhong Can Xi Lu). Действия FORSYTHIAE FRUCTUS по «чистке» жара и детоксикации в настоящем рецепте применяют для «чистки» жара-токсина, застоявшегося в коллатералях. HOUTTUYNIAE HERBA является острой на вкус, слабо «холодной» по природе, входит в канал легких, имеет функции «чистки» жара, детоксикации и изгнания гноя. Данная трава преимущественно «чистит» патогенный жар в канале легких и является основным лекарственным средством для лечения жара в легких. SCUTELLARIAE RADIX, FORSYTHIAE FRUCTUS и HOUTTUYNIAE HERBA, совместно используемые в рецепте, могут чистить жар в легких и жар-токсин, застоявшийся в коллатералях, и предотвращать образование флегмы-мути из-за возникновения жара.
В фармацевтической композиции согласно настоящему изобретению GLYCYRRHIZAE RADIX ET RHIZOMA (корневище и корень солодки) представляют собой направляющее лекарственное средство. GLYCYRRHIZAE RADIX ET RHIZOMA применяют с двумя целями; в неочищенном состоянии по двум причинам. Первая цель представляет собой применение GLYCYRRHIZAE RADIX ET RHIZOMA в качестве вспомогательного лекарственного средства для тонизирования селезенки и пополнения ци, а также увлажнения легких и ослабления кашля. Вторая цель представляет собой применение GLYCYRRHIZAE RADIX ET RHIZOMA в качестве направляющего лекарственного средства для того, чтобы регулировать действие лекарственных средств, входящих в рецепт, тем самым умеряя их свойства.
В свете вышеизложенного, полный рецепт фармацевтической композиции согласно настоящему изобретению характеризуется одновременным лечением заболевания на поверхности и источника заболевания, одновременным применением очищения и укрепления, а также теплотой без сухости по природе и сочетает действия по регулированию ци, тонизированию селезенки, рассеиванию влаги, растворению флегмы, опусканию ци, ослаблению кашля и астмы, детоксикации и т.п. Поскольку тонизирование селезенки приводит к прекращению образования флегмы, а рассеивание флегмы приводит к самопроизвольной циркуляции ци легких, кашель и одышка уменьшаются. Лекарственные средства, входящие в рецепт согласно настоящему изобретению, совместно достигают эффекта регулирования ци, устранения влажности, растворения флегмы и ослабления кашля.
В свете настоящего изобретения и в комбинации с общими принципами в данной области специалисты могут заменить отдельные компоненты фармацевтической композиции согласно настоящему изобретению на другие китайские лекарственные материалы, имеющие одинаковое или похожее действие в качестве компонента фармацевтической композиции.
Фармацевтическая композиция согласно настоящему изобретению может быть получена с помощью традиционных способов получения, известных в данной области. Например, различные лекарственные вещества, входящие в фармацевтическую композицию согласно настоящему изобретению, могут быть обработаны в соответствии со «Стандартом обработки лекарственных веществ в традиционной китайской медицине» или «Справочником традиционной китайской медицины».
Фармацевтическая композиция согласно настоящему изобретению предпочтительно может быть получена следующим способом, согласно которому:
(1) взвешивают отобранный чистый SCUTELLARIAE RADIX в соответствии с долей, определенной в рецепте, и измельчают указанный материал в мелкий порошок для дальнейшего применения;
(2) взвешивают отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS в соответствии с долями, определенными в рецепте, добавляют воду в количестве 8-12 об./масс. (мл/г) в расчете на массу лекарственных материалов и перегоняют смесь в течение 3-7 ч с выделением эфирных масел, и собирают эфирные масла для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирают в емкость; травяной остаток с этапа (2) совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ET RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергают экстракции водой, каждый раз в течение 1-3 ч, причем отношение количества воды к массе лекарственных материалов составляет 7-11 об./масс. (мл/г) при первой экстракции и 5-9 об./масс. (мл/г) при второй; затем объединяют водные экстракты и фильтруют их с последующим объединением фильтрата с вышеуказанным водным раствором, полученным в результате перегонки, после чего концентрируют смешанный раствор с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, для дальнейшего применения;
(4) взвешивают отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ET RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM в соответствии с долями, определенными в рецепте, указанные материалы дважды подвергают экстракции 40-70% раствором этанола в количестве 5-7 об./масс. (мл/г) на единицу массы лекарственных материалов, первый раз в течение 1-3 ч и второй раз в течение 1-2 ч; экстракты объединяют и фильтруют; этанол выделяют из фильтрата и концентрируют остаток с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С; после чего объединяют указанную прозрачную пасту с прозрачной пастой, полученной на этапе (3), для дальнейшего применения.
При этом мелкий порошок, полученный на этапе (1), эфирные масла, полученные на этапе (2), и объединенные прозрачные пасты, полученные на этапе (4), представляют собой активные компоненты фармацевтической композиции согласно настоящему изобретению.
Дозированные формы фармацевтической композиции согласно изобретению включают, но не ограничивается только ими, твердые капсулы, таблетки, порошки, жидкости для перорального применения, мягкие капсулы, пилюли, настойки, сиропы, суппозитории, гели, спреи или формы для инъекций.
Дозированные формы для препарата согласно настоящему изобретению могут быть получены в виде фармацевтически приемлемых традиционных дозированных форм традиционными способами, известными в данной области, например, такими как способы получения, описанные в Pharmaceutics of Chinese Medicine, Fan Biting (редактор), декабрь, 1997 год (первое издание), Шанхайское научно-техническое издательство.
При разработке различных фармацевтических средств согласно настоящему изобретению специалисты могут добавить различные фармацевтически приемлемые вспомогательные материалы, например, включающие, но не ограниченные только ими, наполнители, разрыхлители, смазывающие вещества, суспендирующие агенты, связующие, подсластители, вкусовые агенты, консерванты, матрицы или любые их смеси, в зависимости от различных дозированных форм фармацевтических средств согласно настоящему изобретению и в соответствии с общими принципами в данной области. Наполнители включают, но не ограничиваются только ими, крахмал, прежелатинизированный крахмал, лактозу, маннитол, хитин, микрокристаллическую целлюлозу, сахарозу или любые их смеси. Разрыхлители включают, но не ограничиваются только ими, крахмал, прежелатинизированный крахмал, микрокристаллическую целлюлозу, карбоксиметилкрахмал натрия, поперечно-связанный поливинилпирролидон, низкозамещенную гидроксипропилцеллюлозу, поперечно-связанную натриевую соль карбоксиметилцеллюлозы или любые их смеси. Смазывающие вещества включают, но не ограничиваются только ими, стеарат магния, лаурилсульфат натрия, тальк, диоксид кремния или любые их смеси. Суспендирующие агенты включают, но не ограничиваются только ими, поливинилпирролидон, микрокристаллическую целлюлозу, сахарозу, агар, гидроксипропилметилцеллюлозу или любые их смеси. Связующие включают, но не ограничиваются только ими, крахмальную суспензию, поливинилпирролидон, гидроксипропилметилцеллюлозу или любые их смеси. Подсластители включают, но не ограничиваются только ими, сахарин натрия, аспартам, сахарозу, цикламат натрия, глицирретиновую кислоту или любые их смеси. Вкусовые агенты включают, но не ограничиваются только ими, подсластители, различные эссенции или любые их смеси. Консерванты включают, но не ограничиваются только ими, парабены, бензойную кислоту, бензоат натрия, сорбиновую кислоту и ее соли, бензалкония бромид, хлоргексидина ацетат, эвкалиптовое масло или любые их смеси. Матрицы включают, но не ограничиваются только ими, ПЭГ-6000, ПЭГ-4000, воск насекомых или любые их смеси. Чтобы получить вышеописанные дозированные формы в соответствии с фармацевтикой традиционной китайской медицины, при получении данных дозированных форм могут быть дополнительно добавлены другие вспомогательные материалы, которые являются фармацевтически приемлемыми (например, вспомогательные материалы для различных дозированных форм, описанные в Pharmaceutics of Chinese Medicine, Fan Biting (редактор), декабрь, 1997 год (первая редакция), Шанхайское научно-техническое издательство).
В предпочтительном варианте реализации изобретения фармацевтическую композицию получают следующим способом, согласно которому:
(1) взвешивают отобранный чистый SCUTELLARIAE RADIX в соответствии с долей, определенной в рецепте, и измельчают указанный материал в мелкий порошок для дальнейшего применения;
(2) взвешивают отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS в соответствии с долями, определенными в рецепте, добавляют воду в количестве 8-12 об./масс. (мл/г) в расчете на массу лекарственных материалов, перегоняют смесь в течение 4-6 ч с выделением эфирных масел и собирают эфирные масла для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирают в емкость, травяной остаток с этапа (2) совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ET RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергают экстракции водой, каждый раз в течение 1-3 ч, причем отношение количества воды к массе лекарственных материалов составляет 7-11 об./масс. (мл/г) при первой экстракции и 5-9 об./масс. (мл/г) при второй; затем объединяют водные экстракты и фильтруют смесь, объединяют фильтрат и вышеуказанный водный раствор, полученный в результате перегонки, после чего концентрируют смешанный раствор с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, для дальнейшего применения;
(4) взвешивают отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ET RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM в соответствии с долями, определенными в рецепте, указанные материалы дважды подвергают экстракции 40-70% раствором этанола в количестве 5-7 об./масс. (мл/г) в расчете на массу лекарственных материалов, первый раз в течение 1-3 ч и второй раз в течение 1 ч; экстракты объединяют и фильтруют; этанол выделяют из фильтрата и концентрируют остаток с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С; после чего объединяют указанную прозрачную пасту с прозрачной пастой, полученной на этапе (3), для дальнейшего применения;
(5) гранулируют объединенные прозрачные пасты, полученные на этапе (4), с мелким порошком, полученным на этапе (1), в качестве основного материала и окончательно обрабатывают полученные гранулы для дальнейшего применения;
(6) обеспечивают следующие материалы для таблетирования (доли по массе);
гранулы, полученные на этапе (5) 340-600
коллоидный диоксид кремния 1,8-3,5
стеарат магния 1,8-3,5
(7) добавляют эфирные масла, полученные на этапе (2), к коллоидному диоксиду кремния и осуществляют таблетирование в соответствии с традиционным способом приготовления с получением фармацевтической композиции согласно настоящему изобретению.
В другом предпочтительном варианте реализации изобретения фармацевтическую композицию получают следующим способом, согласно которому:
(1) взвешивают отобранный чистый SCUTELLARIAE RADIX в соответствии с долей, определенной в рецепте, и измельчают указанный материал в мелкий порошок для дальнейшего применения;
(2) взвешивают отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS в соответствии с долями, определенными в рецепте, добавляют воду в количестве 9 об./масс. (мл/г) в расчете на массу лекарственных материалов и перегоняют смесь в течение 5 ч с выделением эфирных масел, и собирают эфирные масла для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирают в емкость, травяной остаток с этапа (2) совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ET RH1ZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергают экстракции водой, каждый раз в течение 4 ч, причем отношение количества воды к массе лекарственных материалов составляет 10 об./масс. (мл/г) при первой экстракции и 7 об./масс. (мл/г) при второй; затем объединяют водные экстракты и фильтруют, фильтрат объединяют с вышеуказанным водным раствором, полученным в результате перегонки, после чего концентрируют смешанный раствор с получением прозрачной пасты с относительной плотностью 1,17, термически измеренной при 60°С, для дальнейшего применения;
(4) взвешивают отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ET RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM в соответствии с долями, определенными в рецепте, указанные материалы дважды подвергают экстракции 60% раствором этанола в количестве 6 об./масс. (мл/г), первый раз в течение 2 ч и второй раз в течение 1 ч; экстракты объединяют и фильтруют смесь; этанол выделяют из фильтрата, остаток концентрируют с получением прозрачной пасты с относительной плотностью 1,17, термически измеренной при 60°С; и объединяют указанную прозрачную пасту с прозрачной пастой, полученной на этапе (3), для дальнейшего применения;
(5) гранулируют объединенные прозрачные пасты, полученные на этапе (4), с мелким порошком, полученным на этапе (1), в качестве основного материала и окончательно обрабатывают полученные гранулы для дальнейшего применения;
(6) обеспечивают следующие материалы для таблетирования (доли по массе):
гранулы, полученные на этапе (5) 470
коллоидный диоксид кремния 2,4
стеарат магния 2,4
(7) добавляют эфирные масла, полученные на этапе (2), к коллоидному диоксиду кремния и осуществляют таблетирование в соответствии с традиционным способом приготовления с получением фармацевтической композиции согласно настоящему изобретению.
Фармацевтическая композиция согласно настоящему изобретению была получена на основе теории заболеваний коллатералей в традиционной китайской медицине в сочетании с современными медицинскими исследованиями в области этиологии и патогенеза бронхита, а также годами клинической практики. Фармацевтическая композиция выполняет действия по регулированию ци, устранению влажности с помощью сухости, растворению флегмы и ослаблению кашля и оказывает хороший эффект при лечении бронхита, в частности, отличный эффект при лечении хронического бронхита.
Было экспериментально показано, что фармацевтическая композиция согласно настоящему изобретению способна останавливать кашель, рассеивать флегму, ослаблять астму и препятствовать воспалению и, в частности, оказывает отличный эффект при лечении хронического бронхита. Кроме того, было экспериментально показано, что фармацевтическая композиция согласно настоящему изобретению не имеет побочных эффектов и является безопасной.
Подробное описание изобретения
Настоящее изобретение будет дополнительно проиллюстрировано следующими Примерами и Примерами испытаний, которые в любом случае не ограничивают рамки настоящего изобретения.
Пример 1
Получение лекарства согласно настоящему изобретению в форме таблетки (таблетки предварительно названы Lian Hua Man Zhi)
Рецепт:
Способ получения:
(1) Отобранный чистый SCUTELLARIAE RADIX взвешивали в соответствии с массой, определенной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS взвешивали в соответствии с массами, отраженными в рецепте, с последующим добавлением воды в количестве 10 об./масс.(мл/г) в расчете на массу лекарственных материалов и перегонкой в течение 6 ч с выделением эфирных масел, эфирные масла собирали для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирали в емкость, травяной остаток после перегонки совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ЕТ RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергали экстракции водой, каждый раз в течение 1,5 ч, причем отношение количества воды к массе лекарственных материалов составляло 10 об./масс. (мл/г) при первой экстракции и 8 об./масс. (мл/г) при второй; затем водные экстракты объединяли и фильтровали, вышеупомянутый водный раствор, полученный в результате перегонки, добавляли к фильтрату, фильтрат концентрировали с получением прозрачной пасты с относительной плотностью 1,17, термически измеренной при 60°С, для дальнейшего применения;
(4) отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ET RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM взвешивали в соответствии с массами, отраженными в рецепте, и дважды подвергали экстракции 60% раствором этанола в количестве 7 об./масс. (мл/г) единиц объема (мл) на единицу массы (г) лекарственных материалов, первый раз в течение 3 ч, а второй в течение 2 ч; экстракты объединяли и фильтровали; этанол выделяли из фильтрата, а фильтрат концентрировали с получением прозрачной пасты с относительной плотностью 1,17, термически измеренной при 60°С, которую объединяли с прозрачной пастой, полученной на этапе (3), для дальнейшего применения;
(5) объединенные прозрачные пасты, полученные на этапе (4), с мелким порошком, полученным на этапе (1), в качестве основного материала гранулировали и окончательно обрабатывали для дальнейшего применения;
(6) сырье, применяемое для таблетирования, взвешивали согласно следующим долям по массе:
гранулы, полученные на этапе (5) 455
коллоидный диоксид кремния 2,2
стеарат магния 2,2
(7) эфирные масла, полученные на этапе (2), добавляли к коллоидному диоксиду кремния и получали испытуемые таблетки в соответствии с традиционным способом приготовления.
Пример 2
Получение лекарства согласно настоящему изобретению в форме капсулы
Рецепт:
Способ получения:
(1) Отобранный чистый SCUTELLARIAE RADIX взвешивали в соответствии с массой, определенной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS взвешивали в соответствии с массами, определенными в рецепте, с последующим добавлением воды в количестве 9 об./масс. (мл/г) в расчете на массу лекарственных материалов и перегонкой в течение 5 ч с выделением эфирных масел, эфирные масла собирали для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирали в другую емкость, травяной остаток после перегонки совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ЕТ RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергали экстракции водой, каждый раз в течение 1,5 ч, причем отношение количества воды к массе лекарственных материалов составляло 8 об./масс. (мл/г) при первой экстракции и 6 об./масс. (мл/г) при второй; затем водные экстракты объединяли, фильтровали, вышеупомянутый водный раствор, полученный в результате перегонки, добавляли к фильтрату, смесь концентрировали с получением прозрачной пасты с относительной плотностью 1,16, термически измеренной при 60°С, для дальнейшего применения;
(4) отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ЕТ RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM взвешивали в соответствии с массами, определенными в рецепте, и дважды подвергали экстракции 60% раствором этанола в количестве 5 об./масс. (мл/г) единиц объема (мл) на единицу массы (г) лекарственных материалов, первый раз в течение 2 ч, а второй в течение 1,5 ч; экстракты объединяли и фильтровали; этанол выделяли из фильтрата, а фильтрат концентрировали с получением прозрачной пасты с относительной плотностью 1,16, термически измеренной при 60°С, после чего объединяли с прозрачной пастой, полученной на этапе (3), для дальнейшего применения;
(5) капсулы получали в соответствии с традиционным способом приготовления.
Пример 3
Получение лекарства согласно настоящему изобретению в форме порошка
Рецепт:
Способ получения;
(1) Отобранный чистый SCUTELLARIAE RADIX взвешивали в соответствии с массой, определенной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS взвешивали в соответствии с массами, определенными в рецепте, с последующим добавлением воды в количестве 9 об./масс. (мл/г) в расчете на массу лекарственных материалов и перегонкой в течение 5 ч с выделением эфирных масел, эфирные масла собирали для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирали в другую емкость, травяной остаток после перегонки совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ЕТ RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергали экстракции водой, каждый раз в течение 1,5 ч, причем отношение количества воды к массе лекарственных материалов составляло 8 об./масс. (мл/г) при первой экстракции и 6 об./масс. (мл/г) при второй; затем водные экстракты объединяли, фильтровали, затем вышеупомянутый водный раствор, полученный в результате перегонки, добавляли к фильтрату, смесь концентрировали с получением прозрачной пасты с относительной плотностью 1,16, термически измеренной при 60°С, для дальнейшего применения;
(4) отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ET RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM взвешивали в соответствии с массами, определенными в рецепте, и дважды подвергали экстракции 60% раствором этанола в количестве 5 об./масс. (мл/г) единиц объема (мл) на единицу массы (г) лекарственных материалов, первый раз в течение 2 ч, а второй в течение 1,5 ч; экстракты объединяли и фильтровали; этанол выделяли из фильтрата, а фильтрат концентрировали с получением прозрачной пасты с относительной плотностью 1,16, термически измеренной при 60°С, которую объединяли с прозрачной пастой, полученной на этапе (3), для дальнейшего применения;
(5) порошок получали в соответствии с традиционным способом приготовления.
Пример 4
Получение лекарства согласно настоящему изобретению в форме жидкости для перорального применения
Рецепт:
Способ получения:
(1) Отобранный чистый SCUTELLARIAE RADIX взвешивали в соответствии с массой, определенной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS взвешивали в соответствии с массами, определенными в рецепте, с последующим добавлением воды в количестве 8 об./масс. (мл/г) в расчете на массу лекарственных материалов и перегонкой в течение 3 ч с выделением эфирных масел, эфирные масла собирали для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирали в другую емкость, травяной остаток после перегонки совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ЕТ RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергали экстракции водой, каждый раз в течение 1 ч, причем отношение количества воды к массе лекарственных материалов составляло 7 об./масс. (мл/г) при первой экстракции и 5 об./масс. (мл/г) при второй; затем водные экстракты объединяли, фильтровали, затем вышеупомянутый водный раствор, полученный в результате перегонки, добавляли к фильтрату, смесь концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, для дальнейшего применения;
(4) отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ЕТ RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM взвешивали в соответствии с массами, определенными в рецепте, и дважды подвергали экстракции 40-70% раствором этанола в количестве 5 об./масс. (мл/г) единиц объема (мл) на единицу массы (г) лекарственных материалов, первый раз в течение 1 ч и второй в течение 1 ч; экстракты объединяли и фильтровали; этанол выделяли из фильтрата, а фильтрат концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, которую объединяли с прозрачной пастой, полученной на этапе (3), для дальнейшего применения.
Из мелкого порошка, полученного на этапе (1), эфирных масел, полученных на этапе (2), и объединенных прозрачных паст, полученных на этапе (4), была приготовлена жидкость для перорального применения в соответствии с традиционным способом приготовления.
Пример 5
Получение лекарства согласно настоящему изобретению в форме мягкой капсулы
Рецепт:
Способ получения:
(1) Отобранный чистый SCUTELLARIAE RADIX взвешивали в соответствии с массой, определенной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS взвешивали в соответствии с массами, определенными в рецепте, с последующим добавлением воды в количестве 12 об./масс. (мл/г) в расчете на массу лекарственных материалов и перегонкой в течение 7 ч с выделением эфирных масел, эфирные масла собирали для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирали в другую емкость, травяной остаток после перегонки совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ЕТ RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергали экстракции водой, каждый раз в течение 3 ч, причем отношение количества воды к массе лекарственных материалов составляло 11 об./масс. (мл/г) при первой экстракции и 9 об./масс. (мл/г) при второй; затем водные экстракты объединяли, фильтровали, вышеупомянутый водный раствор, полученный в результате перегонки, добавляли к фильтрату, смесь концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, для дальнейшего применения;
(4) отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ЕТ RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM взвешивали в соответствии с массами, определенными в рецепте, и дважды подвергали экстракции 40-70% раствором этанола в количестве 7 об./масс. (мл/г) единиц объема (мл) на единицу массы (г) лекарственных материалов, первый раз в течение 3 ч, а второй в течение 2 ч; экстракты объединяли и фильтровали; этанол выделяли из фильтрата, а фильтрат концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, которую объединяли с прозрачной пастой, полученной на этапе (3), для дальнейшего применения.
Из мелкого порошка, полученного на этапе (1), эфирных масел, полученных на этапе (2), и объединенных прозрачных паст, полученных на этапе (4), были приготовлены мягкие капсулы в соответствии с традиционным способом приготовления.
Пример 6
Получение лекарства согласно настоящему изобретению в форме пилюли
Рецепт:
Способ получения:
(1) Отобранный чистый SCUTELLARIAE RADIX взвешивали в соответствии с массой, определенной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS взвешивали в соответствии с массами, определенными в рецепте, с последующим добавлением воды в количестве 10 об./масс. (мл/г) в расчете на массу лекарственных материалов и перегонкой в течение 5 ч с выделением эфирных масел, эфирные масла собирали для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирали в другую емкость, травяной остаток после перегонки совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ET RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергали экстракции водой, каждый раз в течение 2 ч, причем отношение количества воды к массе лекарственных материалов составляло 8 об./масс. (мл/г) при первой экстракции и 7 об./масс. (мл/г) при второй; затем водные экстракты объединяли, фильтровали, затем вышеупомянутый водный раствор, полученный в результате перегонки, добавляли к фильтрату, смесь концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, для дальнейшего применения;
(4) отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ET RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM взвешивали в соответствии с массами, определенными в рецепте, и дважды подвергали экстракции 60% раствором этанола в количестве 6 об./масс.(мл/г) единиц объема (мл) на единицу массы (г) лекарственных материалов, первый раз в течение 2 ч, а второй в течение 1,5 ч; экстракты объединяли и фильтровали; этанол выделяли из фильтрата, а фильтрат концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, которую объединяли с прозрачной пастой, полученной на этапе (3), для дальнейшего применения.
Из мелкого порошка, полученного на этапе (1), эфирных масел, полученных на этапе (2), и объединенных прозрачных паст, полученных на этапе (4), были приготовлены пилюли в соответствии с традиционным способом приготовления.
Пример 7
Получение лекарства согласно настоящему изобретению в форме настойки
Рецепт:
Способ получения:
(1) Отобранный чистый SCUTELLARIAE RADIX взвешивали в соответствии с массой, определенной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS взвешивали в соответствии с массами, определенными в рецепте, с последующим добавлением воды в количестве 11 об./масс. (мл/г) в расчете на массу лекарственных материалов и перегонкой в течение 4 ч с выделением эфирных масел, эфирные масла собирали для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирали в другую емкость, травяной остаток после перегонки совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ЕТ RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергали экстракции водой, каждый раз в течение 1,5 ч, причем отношение количества воды к массе лекарственных материалов составляло 8 об./масс. (мл/г) при первой экстракции и 6 об./масс. (мл/г) при второй; затем водные экстракты объединяли, фильтровали, вышеупомянутый водный раствор, полученный в результате перегонки, добавляли к фильтрату, смесь концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, для дальнейшего применения;
(4) отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ЕТ RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM взвешивали в соответствии с массами, определенными в рецепте, и дважды подвергали экстракции 65% раствором этанола в количестве 5 об./масс.(мл/г) единиц объема (мл) на единицу массы (г) лекарственных материалов, первый раз в течение 1 ч, а второй в течение 2 ч; экстракты объединяли и фильтровали; этанол выделяли из фильтрата, а фильтрат концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, которую объединяли с прозрачной пастой, полученной на этапе (3), для дальнейшего применения.
Из мелкого порошка, полученного на этапе (1), эфирных масел, полученных на этапе (2), и объединенных прозрачных паст, полученных на этапе (4), была приготовлена настойка в соответствии с традиционным способом приготовления.
Пример 8
Получение лекарства согласно настоящему изобретению в форме сиропа
Рецепт:
Способ получения:
(1) Отобранный чистый SCUTELLARIAE RADIX взвешивали в соответствии с массой, определенной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS взвешивали в соответствии с массами, определенными в рецепте, с последующим добавлением воды в количестве 9 об./масс. (мл/г) в расчете на массу лекарственных материалов и перегонкой в течение 6 ч с выделением эфирных масел, эфирные масла собирали для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирали в другую емкость, травяной остаток после перегонки совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ET RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергали экстракции водой, каждый раз в течение 3 ч, причем отношение количества воды к массе лекарственных материалов составляло 10 об./масс. (мл/г) при первой экстракции и 8 об./масс. (мл/г) при второй; затем водные экстракты объединяли, фильтровали, вышеупомянутый водный раствор, полученный в результате перегонки, добавляли к фильтрату, смесь концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, для дальнейшего применения;
(4) отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ET RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM взвешивали в соответствии с массами, определенными в рецепте, и дважды подвергали экстракции 55% раствором этанола в количестве 7 об./масс. (мл/г) единиц объема (мл) на единицу массы (г) лекарственных материалов, первый раз в течение 2,5 ч, а второй в течение 2 ч; экстракты объединяли и фильтровали; этанол выделяли из фильтрата, а фильтрат концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, которую объединяли с прозрачной пастой, полученной на этапе (3), для дальнейшего применения.
Из мелкого порошка, полученного на этапе (1), эфирных масел, полученных на этапе (2), и объединенных прозрачных паст, полученных на этапе (4), был приготовлен сироп в соответствии с традиционным способом приготовления.
Пример 9
Получение лекарства согласно настоящему изобретению в форме суппозитория
Рецепт:
Способ получения:
(1) Отобранный чистый SCUTELLARIAE RADIX взвешивали в соответствии с массой, определенной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS взвешивали в соответствии с массами, определенными в рецепте, с последующим добавлением воды в количестве 10 об./масс. (мл/г) в расчете на массу лекарственных материалов и перегонкой в течение 5 ч с выделением эфирных масел, эфирные масла собирали для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирали в другую емкость, травяной остаток после перегонки совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ЕТ RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергали экстракции водой, каждый раз в течение 1,5 ч, причем отношение количества воды к массе лекарственных материалов составляло 8 об./масс. (мл/г) при первой экстракции и 8 об./масс. (мл/г) при второй; затем водные экстракты объединяли, фильтровали, затем вышеупомянутый водный раствор, полученный в результате перегонки, добавляли к фильтрату, смесь концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, для дальнейшего применения;
(4) отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ЕТ RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM взвешивали в соответствии с массами, определенными в рецепте, и дважды подвергали экстракции 45% раствором этанола в количестве 6,5 об./масс. (мл/г) единиц объема (мл) на единицу массы (г) лекарственных материалов, первый раз в течение 3 ч, а второй в течение 2 ч; экстракты объединяли и фильтровали; этанол выделяли из фильтрата, а фильтрат концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, которую объединяли с прозрачной пастой, полученной на этапе (3), для дальнейшего применения.
Из мелкого порошка, полученного на этапе (1), эфирных масел, полученных на этапе (2), и объединенных прозрачных паст, полученных на этапе (4), был приготовлен суппозиторий в соответствии с традиционным способом приготовления.
Пример 10
Получение лекарства согласно настоящему изобретению в форме геля
Рецепт:
Способ получения:
(1) Отобранный чистый SCUTELLARIAE RADIX взвешивали в соответствии с массой, определенной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS взвешивали в соответствии с массами, определенными в рецепте, с последующим добавлением воды в количестве 11 об./масс. (мл/г) в расчете на массу лекарственных материалов и перегонкой в течение 5 ч с выделением эфирных масел, эфирные масла собирали для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирали в другую емкость, травяной остаток после перегонки совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ЕТ RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергали экстракции водой, каждый раз в течение 2,5 ч, причем отношение количества воды к массе лекарственных материалов составляло 10 об./масс. (мл/г) при первой экстракции и 8 об./масс, (мл/г) при второй; затем водные экстракты объединяли, фильтровали, вышеупомянутый водный раствор, полученный в результате перегонки, добавляли к фильтрату, смесь концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, для дальнейшего применения;
(4) отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ЕТ RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM взвешивали в соответствии с массами, определенными в рецепте, и дважды подвергали экстракции 50% раствором этанола в количестве 6,5 об./масс. (мл/г) единиц объема (мл) на единицу массы (г) лекарственных материалов, первый раз в течение 2 ч, а второй в течение 1,5 ч; экстракты объединяли и фильтровали; этанол выделяли из фильтрата, фильтрат концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, которую объединяли с прозрачной пастой, полученной на этапе (3), для дальнейшего применения.
Из мелкого порошка, полученного на этапе (1), эфирных масел, полученных на этапе (2), и объединенных прозрачных паст, полученных на этапе (4), был приготовлен гель в соответствии с традиционным способом приготовления.
Пример 11
Получение лекарства согласно настоящему изобретению в форме спрея
Рецепт:
Способ получения:
(1) Отобранный чистый SCUTELLARIAE RADIX взвешивали в соответствии с массой, определенной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS взвешивали в соответствии с массами, определенными в рецепте, с последующим добавлением воды в количестве 10 об./масс. (мл/г) в расчете на массу лекарственных материалов и перегонкой в течение 4 ч с выделением эфирных масел, эфирные масла собирали для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирали в другую емкость, травяной остаток после перегонки совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ET RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергали экстракции водой, каждый раз в течение 2 ч, причем отношение количества воды к массе лекарственных материалов составляло 8 об./масс. (мл/г) при первой экстракции и 8 об./масс. (мл/г) при второй; затем водные экстракты объединяли, фильтровали, вышеупомянутый водный раствор, полученный в результате перегонки, добавляли к фильтрату, смесь концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, для дальнейшего применения;
(4) отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ET RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM взвешивали в соответствии с массами, определенными в рецепте, и дважды подвергали экстракции 55% раствором этанола в количестве 6 об./масс. (мл/г) единиц объема (мл) на единицу массы (г) лекарственных материалов, первый раз в течение 3 ч, а второй в течение 1 ч; экстракты объединяли и фильтровали; этанол выделяли из фильтрата, фильтрат концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, которую объединяли с прозрачной пастой, полученной на этапе (3), для дальнейшего применения.
Из мелкого порошка, полученного на этапе (1), эфирных масел, полученных на этапе (2), и объединенных прозрачных паст, полученных на этапе (4), был приготовлен спрей в соответствии с традиционным способом приготовления.
Пример 12
Получение лекарства согласно настоящему изобретению в форме для инъекций
Рецепт:
Способ получения:
(1) Отобранный чистый SCUTELLARIAE RADIX взвешивали в соответствии с массой, определенной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS взвешивали в соответствии с массами, определенными в рецепте, с последующим добавлением воды в количестве 10 об./масс. (мл/г) в расчете на массу лекарственных материалов и перегонкой в течение 4 ч с выделением эфирных масел, эфирные масла собирали для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирали в другую емкость, травяной остаток после перегонки совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ЕТ RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергали экстракции водой, каждый раз в течение 2 ч, причем отношение количества воды к массе лекарственных материалов составляло 8 об./масс. (мл/г) при первой экстракции и 8 об./масс. (мл/г) при второй; затем водные экстракты объединяли, фильтровали, вышеупомянутый водный раствор, полученный в результате перегонки, добавляли к фильтрату, смесь концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, для дальнейшего применения;
(4) отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ЕТ RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM взвешивали в соответствии с массами, определенными в рецепте, и дважды подвергали экстракции 55% раствором этанола в количестве 6 об./масс. (мл/г) единиц объема (мл) на единицу массы (г) лекарственных материалов, первый раз в течение 3 ч, а второй в течение 1 ч; экстракты объединяли и фильтровали; этанол выделяли из фильтрата, а фильтрат концентрировали с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, которую объединяли с прозрачной пастой, полученной на этапе (3), для дальнейшего применения.
Из мелкого порошка, полученного на этапе (1), эфирных масел, полученных на этапе (2), и объединенных прозрачных паст, полученных на этапе (4), были приготовлены инъекционные растворы в соответствии с традиционным способом приготовления.
Согласно настоящему изобретению все применяемые в Примерах испытаний, включающих следующие фармакологические и токсикологические эксперименты, фармацевтические композиции (далее именуемые «лекарство согласно настоящему изобретению») были получены способом, изложенным в Примере 1.
Пример испытания 1 Эксперимент по исследованию способности лекарства согласно настоящему изобретению останавливать кашель.
1. Способность останавливать кашель, вызванный водным раствором аммиака, испытанная на мышах.
1.1. Объекты эксперимента
1.1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, подвергаемое испытанию, 6,25 г лекарственного сырья/г (т.е. 1 г лекарства был произведен из 6,25 г лекарственного сырья), предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060501 и в ходе эксперимента разбавленное дистиллированной водой до требуемой концентрации.
(2) Таблетка клоперастина гидрохлорида (ТКГ) в качестве положительного контроля из западной медицины, 10 мг/таблетка, произведенная Beijing Shuguang Pharmaceutical Co., Ltd., номер серии 060619, и годная до июня 2008 года.
(3) Капсула Gui Long Ke Chuan Ning (GLKCNC) в качестве положительного контроля из традиционной китайской медицины, 1 г лекарственного сырья/пилюля (0,3 г порошка в пилюле), произведенная Shanxi Guilong pharmaceutical Co., Ltd., номер разрешения SFDA Z-11; номер серии продукта: 060112; продукт годен до декабря 2007 года.
1.1.2. Животные:
Шестьдесят куныминских мышей класса II, среди которых число самцов и самок было одинаковым, со средней массой тела 19,90±0,66 г, предоставленных Институтом изучения лабораторных животных Китайской академии медицинских наук, номер лицензии SCXK (Jing) 2000-0006.
1.1.3. Рецепт корма для животных и пищевые ингредиенты:
Повседневный корм для крыс, выпущенный Beijing Ke Ao Xie Li Feed Co., Ltd., номер серии Jing Animal (2000) №.015. Основные компоненты [данные пекинской инспекции питания и здравоохранения (1997) №.083]: влажность ≤ 9,5%, зола ≤ 7,8%, белок ≥ 7,8%, жир ≥ 4,3%, сырая клетчатка ≤ 11,0%, лизин ≥ 1,39%, метионин + цистеин 0,3-0,54%, кальций 1,0%, фосфор 0,54%, фолиевая кислота 21,1 мг/кг, витамин A ≥ 11,4/кг, витамин D ≥ 98 мкг/кг, витамины группы В 24,11-164 мг/кг, калорийность 4,62 термии/кг.
1.1.4. Условия разведения животных:
Изолированные от окружающей среды помещения для разведения Центра лабораторных животных больницы «Сиюань» Академии традиционной китайской медицины, номер лицензии SCXK (Jing) 2003-0808. Температура воздуха: 22-24°С, относительная влажность 45-60%.
1.1.5. Реагент:
Водный раствор аммиака, произведенный Beijing Century Red Star Chemical Co., Ltd., номер серии 20060310.
1.2. Ход эксперимента.
Шестьдесят здоровых мышей были случайным образом разделены на следующие шесть групп: (1) контрольную группу, которой вводили дистиллированную воду (25 мл/кг); (2) группу ТКГ (12 мг/кг); (3) группу GLKCNC (2 г лекарственного сырья/кг); (4) группу низкой дозировки лекарства согласно настоящему изобретению (группу Н-дозировки, 3 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу С-дозировки, 6 г лекарственного сырья/кг); (6) группу высокой дозировки лекарства согласно настоящему изобретению (группу В-дозировки, 12 г лекарственного сырья/кг). Мышам внутрижелудочно вводили соответствующее лекарство или, в случае контрольной группы, дистиллированную воду в указанной дозе, дополненной до объема 25 мл/кг, один раз в день три дня подряд. Через 30 минут после последнего введения каждую мышь помещали в лабораторный стакан емкостью 500 мл, содержащий тампон, 0,2 мл водного раствора аммиака набирали в шприц емкостью 1 мл и вводили в тампон. Затем стакан быстро переворачивали. В течение 3 минут за мышами наблюдали, чтобы зафиксировать продолжительность инкубационного периода до появления кашля и частоту кашля. Сравнение групп проводили с помощью критерия Стьюдента.
1.3. Результаты испытания.
Результаты показаны в Таблице 1.


Из Таблицы 1 можно увидеть, что средняя и высокая дозы лекарства согласно настоящему изобретению, а также положительный контроль значительно продлевают инкубационный период до появления кашля, вызванного у мышей водным раствором аммиака, и уменьшают частоту кашля и обнаруживают значительное различие в действии по сравнению с контрольной группой (Р<0,05, Р<0,01, Р<0,001).
1.4. Краткое заключение.
Приведенные выше результаты показывают, что лекарство согласно настоящему изобретению способно значительно продлить инкубационный период до появления кашля, вызванного водным раствором аммиака, и уменьшить частоту кашля у мышей.
2. Способность останавливать кашель, вызванный лимонной кислотой, испытанная на морских свинках.
2.1. Объекты эксперимента
2.1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, подвергаемое испытанию, 6,25 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060501.
(2) GLKCNC в качестве контроля из традиционной китайской медицины, 1 г лекарственного сырья/пилюля (0,3 г порошка в пилюле), произведенная Shanxi Guilong pharmaceutical Co., Ltd., номер разрешения SFDA Z-11; номер серии продукта 060112; продукт годен до декабря 2007 года.
(3) ТКГ в качестве контроля из западной медицины, 10 мг/таблетка, произведенная Beijing Shuguang Pharmaceutical Co., Ltd., дата выпуска 2006 06, номер серии 060619, и годная до июня 2008 года.
2.1.2. Животные:
Шестьдесят чистокровных морских свинок класса I, среди которых число самцов и самок было одинаковым, со средней массой тела 206,65±6,92 г, предоставленных Пекинским центром по разведению животных, номер лицензии SCXK (Jing) 2002-0005.
2.1.3. Реагент:
Лимонная кислота, произведенная Пекинским химическим заводом, номер серии:960904.
2.1.4. Аппараты:
Воздушный насос, стеклянный сосуд в форме колокола емкостью 4 л и стеклянный распылитель.
2.2. Ход эксперимента
Перед началом эксперимента морских свинок по отдельности помещали в герметично закрываемый сосуд в форме колокола емкостью 4 л и в течение минуты распыляли 17,5% раствор лимонной кислоты с помощью стеклянного распылителя под давлением 400 мм рт.ст. Морские свинки были отобраны в соответствии с частотой кашля, фиксируемой в течение 5 минут. Морские свинки с частотой кашля менее 10 были отбракованы, а свинки, прошедшие отбор, были выбраны для участия в эксперименте. Шестьдесят отобранных морских свинок, среди которых число самцов и самок было одинаковым, были случайным образом разделены на следующие шесть групп: (1) контрольную группу, которой вводили дистиллированную воду (5 мл/кг); (2) группу ТКГ (7 мг/кг); (3) группу GLKCNC (1,2 г лекарственного сырья/кг); (4) группу низкой дозировки лекарства согласно настоящему изобретению (группу Н-дозировки, 1,75 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу С-дозировки, 3,5 г лекарственного сырья/кг); (6) группу высокой дозировки лекарства согласно настоящему изобретению (группу В-дозировки, 7 г лекарственного сырья/кг), при этом каждому животному внутрижелудочно вводили соответствующее лекарство в указанной дозе, дополненной до объема 5 мл/кг, один раз в день три дня подряд, тогда как животным контрольной группы вводили такое же количество физиологического раствора. Через 30 минут после последнего введения каждую морскую свинку помещали в герметично закрываемый сосуд в форме колокола емкостью 4 л и в течение минуты распыляли 17,5% раствор лимонной кислоты с помощью стеклянного распылителя под давлением 600 мм рт.ст. В течение 5 минут за морскими свинками наблюдали, чтобы зафиксировать продолжительность инкубационного периода до возникновения кашля и частоту кашля. Сравнение групп проводили с помощью критерия Стьюдента.
2.3. Результаты испытания
Результаты показаны в Таблице 2.

Результаты эксперимента показывают, что высокая и средняя дозы лекарства согласно настоящему изобретению значительно продлевают инкубационный период до появления кашля и уменьшают частоту кашля, и обнаруживают значительное различие в действии по сравнению с контрольной группой (Р<0,05, Р<0,01, Р<0,001). Низкая доза лекарства согласно настоящему изобретению имеет значительный эффект уменьшения частоты кашля (Р<0,05) и в то же время не имеет заметного эффекта продления инкубационного периода.
2.4. Краткое заключение
Вышеописанные результаты показывают, что лекарство согласно настоящему изобретению имеет значительный эффект продления инкубационного периода до появления кашля и уменьшения частоты кашля.
3. Вывод:
Экспериментальные исследования, описанные выше, показывают, что лекарство согласно настоящему изобретению имеет значительный эффект продления инкубационного периода до появления кашля, вызванного водным раствором аммиака или лимонной кислотой, и уменьшения частоты кашля у мышей или морских свинок, который означает, что лекарство согласно настоящему изобретению способно останавливать кашель.
Пример испытания 2 Эксперимент по исследованию способности лекарства согласно настоящему изобретению рассеивать флегму.
1. Влияние на количество мокроты у мышей, измеренное с помощью фенолового красного.
1.1. Объекты эксперимента
1.1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, подвергаемое испытанию, 6,25 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060501.
(2) GLKCNC в качестве контроля из традиционной китайской медицины, 1 г лекарственного сырья/пилюля (0,3 г порошка в пилюле), произведенная Shanxi Guilong pharmaceutical Co., Ltd., номер разрешения SFDA Z-11; номер серии продукта 060112; продукт годен до декабря 2007 года.
(3) Мукосольван в качестве контроля из западной медицины, 30 мг/таблетка, продукция Boehringer Ingelheim Int. Ltd., Германия, номер серии 206362, номер серии, присвоенный дистрибьютором, 030307.
1.1.2. Реагенты:
(1) Феноловый красный, 25 г/флакон, произведенный Пекинским химическим заводом, номер серии 20006017.
(2) NaOH, продукция Beijing Chemical Reagents Company, номер серии 060901.
1.1.3. Животные:
Шестьдесят мышей ICR категории СПФ (свободные от специфической патогенной микрофлоры), среди которых число самцов и самок было одинаковым, со средней массой тела 19,02±1,2 г, предоставленных Vital River Laboratory Animal Technology Co., Ltd., Пекин, номер лицензии SCXK (Jing) 2002-0003.
1.1.4. Оборудование:
Спектрофотометр, работающий в УФ и видимой области спектра, модель UV-120-02, продукция Shimadzu Corporation, Япония.
1.2. Ход эксперимента
Шестьдесят здоровых мышей были случайным образом разделены на следующие шесть групп: (1) контрольную группу, которой вводили дистиллированную воду (25 мл/кг); (2) группу мукосольвана (16 мг/кг); (3) группу GLKCNC (2 г лекарственного сырья/кг); (4) группу низкой дозировки лекарства согласно настоящему изобретению (группу Н-дозировки, 3 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу С-дозировки, 6 г лекарственного сырья/кг); (6) группу высокой дозировки лекарства согласно настоящему изобретению (группу В-дозировки, 12 г лекарственного сырья/кг). Каждой мыши внутрижелудочно вводили соответствующее лекарство или, в случае контрольной группы, дистиллированную воду в указанной дозе, дополненной до объема 25 мл/кг, один раз в день три дня подряд. Перед проведением эксперимента мыши были лишены еды, но имели неограниченный доступ к воде. После последнего введения каждой мыши вводили 500 мг/кг физиологического раствора, содержащего 5% фенолового красного. Через 30 минут мышь умерщвляли и фиксировали в положении на спине. Кожу на шее разрезали посередине и открывали трахею. В открытой трахее проделывали небольшое отверстие и через отверстие в трахею примерно на 0,3 см вставляли тупую иглу шприца 7 калибра, а затем крепко перевязывали шелковой нитью. Дыхательные пути три раза промывали 0,5 мл физиологического раствора, набираемого в шприц емкостью 1 мл, а промывочную жидкость отбирали в пробирку. Данный этап повторяли 3 раза. К промывочной жидкости в пробирке добавляли 0,1 мл раствора NaOH с молярной концентрацией 1 моль/л, делая жидкость основной. Значение оптической плотности (ОП) промывочной жидкости определяли с помощью спектрофотометра UV-120-02, работающего в УФ и видимой областях спектра, при длине волны 546 нм, при этом уровень фенолового красного в промывочной жидкости (мкг/мл) рассчитывали на основе стандартной кривой фенолового красного. Сравнение групп проводили с помощью критерия Стьюдента.
1.3. Результаты испытания
Результаты показаны в Таблице 3.

Из Таблицы 3 можно увидеть, что высокая и средняя дозы лекарства согласно настоящему изобретению, а также лекарство, представляющее собой положительный контроль, значительно повышают количество секрета и обнаруживают значительное различие в действии по сравнению с контрольной группой (Р<0,05, Р<0,01, Р<0,001).
1.4. Краткое заключение
Вышеописанные результаты показывают, что лекарство согласно настоящему изобретению имеет значительный эффект, выражающийся в повышении объема выделяемой мокроты у мышей, измеренного с помощью фенолового красного.
2. Влияние на количество мокроты у крыс, измеренное с помощью капиллярной трубки.
2.1. Объекты эксперимента
2.1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, подвергаемое испытанию, 6,25 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060501.
(2) GLKCNC в качестве контроля из традиционной китайской медицины, 1 г лекарственного сырья/пилюля (0,3 г порошка в пилюле), произведенная Shanxi Guilong pharmaceutical Co., Ltd., номер разрешения SFDA Z-11; номер серии продукта 060112; продукт годен до декабря 2007 года.
(3) Мукосольван в качестве контроля из западной медицины, 30 мг/таблетка, продукция Boehringer Ingelheim Int. Ltd., Германия, номер серии 206362, номер серии, присвоенный дистрибьютором, 030307.
2.1.2. Животные:
Шестьдесят крыс линии Вистар категории СПФ, среди которых число самцов и самок было одинаковым, со средней массой тела 174,38±7,64 г, предоставленных Институтом изучения лабораторных животных Китайской академии медицинских наук, номер лицензии SCXK (Jing) 2000-0006.
2.2. Ход эксперимента.
Шестьдесят здоровых крыс были случайным образом разделены на следующие шесть групп: (1) контрольную группу, которой вводили дистиллированную воду (10 мл/кг); (2) группу мукосольвана (11 мг/кг); (3) группу GLKCNC (1,5 г лекарственного сырья/кг); (4) группу низкой дозировки лекарства согласно настоящему изобретению (группу Н-дозировки, 2 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу С-дозировки, 4 г лекарственного сырья/кг); (6) группу высокой дозировки лекарства согласно настоящему изобретению (группу В-дозировки, 8 г лекарственного сырья/кг). В ходе эксперимента каждую крысу внутрибрюшинно анестезировали 3,5% раствором хлоралгидрата (10 мл/кг), клали горизонтально на спину и фиксировали. Кожу на шее разрезали и открывали трахею, в середине которой на уровне нижнего края щитовидного хряща между двумя хрящами иглой шприца прокалывали отверстие. Часть стеклянной капиллярной трубки общей длиной 5 см и внутренним диаметром 0,8 мм вставляли в отверстие до такой степени, чтобы трубка прикасалась только ко внутренней стенке трахеи. Когда стеклянная капиллярная трубка наполнялась мокротой, ее немедленно заменяли на другую. Объем мокроты в капиллярах определяли в течение 1 часа перед введением соответствующих лекарств или, в случае контрольной группы, физиологического раствора. Через час животным экспериментальных групп дуоденально вводили соответствующие лекарства в указанных дозах, дополненных до объема 10 мл/кг, в то время как животным контрольной группы вводили такое же количество физиологического раствора. У всех животных определяли среднее количество выделившейся за час мокроты в 1 и 2 часы после введения. Сравнение групп проводили с помощью критерия Стьюдента со средним количеством мокроты, выделявшейся в течение 1 часа перед введением, в качестве нормальной величины.
2.3. Результаты испытания.
Результаты показаны в Таблице 4.

Из Таблицы 4 можно увидеть, что высокая, средняя и низкая дозы лекарства согласно настоящему изобретению, а также лекарство, представляющее собой положительный контроль, значительно повышают количество выделений из дыхательных путей крыс и демонстрируют значительное различие в действии по сравнению с контрольной группой (Р<0,05, Р<0,01,Р<0,001).
2.4. Краткое заключение
Вышеописанные результаты показывают, что лекарство согласно настоящему изобретению имеет значительный эффект повышения количества жидкости, выделяемой дыхательными путями крыс.
3. Вывод:
Два экспериментальных исследования, описанных выше, подтверждают, что лекарство согласно настоящему изобретению имеет эффект рассеивания флегмы.
Пример испытания 3 Эксперимент по исследованию способности лекарства согласно настоящему изобретению уменьшать одышку.
1. Влияние лекарства согласно настоящему изобретению на уменьшение одышки, вызванной гистамином и ацетилхолином, у морской свинки.
1.1. Объекты эксперимента
1.1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, подвергаемое испытанию, 6,25 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060501.
(2) GLKCNC в качестве контроля из традиционной китайской медицины, 1 г лекарственного сырья/пилюля (0,3 г порошка), произведенная Shanxi Guilong pharmaceutical Co., Ltd., номер разрешения SFDA Z-11; номер серии продукта 060112; продукт годен до декабря 2007 года.
(3) Аминофиллин в качестве контроля из западной медицины, 0,1 г/таблетка, продукция Beijing Zizhu Pharmaceutical Co., Ltd, номер серии 20061202.
1.1.2. Животные:
Шестьдесят чистокровных белых морских свинок класса I, среди которых число самцов и самок было одинаковым, со средней массой тела 198,55±6,30 г, предоставленных Пекинским центром по разведению животных, номер лицензии SCXK (Jing) 2002-0005.
1.1.3. Реагент:
(1) Ацетилхолин хлорид, 1 г/флакон, продукция Пекинской компании химических реактивов, номер серии 060211.
(2) Фосфат гистамина, 5 г/флакон, продукция Шанхайского института биологии Китайской Академии наук, продукт №1702.
1.14. Оборудование:
Аппараты, помогающие вызвать астму, а именно воздушный компрессор и стеклянный распылитель, и стеклянный сосуд в форме колокола емкостью 4 л.
1.2. Ход эксперимента.
Предварительно были отобраны здоровые морские свинки, среди которых число самцов и самок было одинаковым. Морских свинок по отдельности помещали в стеклянный сосуд в форме колокола емкостью 4 л и в течение 20 с при давлении 400 мм рт.ст. распыляли смешанные в равных объемах жидкости, содержащие соответственно 2% хлорид ацетилхолина и 0,1% фосфат гистамина. В течение 6 минут после распыления за морскими свинками наблюдали, чтобы зафиксировать продолжительность инкубационного периода астматического спазма (времени, через которое происходит астматический спазм, после прекращения распыления). Морские свинки, демонстрирующие продолжительность инкубационного периода астматического спазма свыше 120 с, не прошли отбор. Шестьдесят отобранных морских свинок были случайным образом разделены на следующие шесть групп по 10 животных в каждой: (1) контрольную группу, которой вводили дистиллированную воду (5 мл/кг); (2) группу аминофиллина (0,05 г/кг); (3) группу GLKCNC (1,2 г лекарственного сырья/кг); (4) группу низкой дозировки лекарства согласно настоящему изобретению (группу Н-дозировки, 1,75 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу С-дозировки, 3,5 г лекарственного сырья/кг); (6) группу высокой дозировки лекарства согласно настоящему изобретению (группу В-дозировки, 7 г лекарственного сырья/кг). Животным испытательных групп внутрижелудочно вводили соответствующее лекарство в указанной дозе, дополненной до объема 5 мл/кг, один раз в день три дня подряд, тогда как животным контрольной группы вводили такое же количество физиологического раствора. Эксперимент по вызову астмы был проведен через 30 минут после последнего введения. Морских свинок по отдельности помещали в стеклянный сосуд в форме колокола емкостью 4 л и в течение 20 с при давлении 400 мм рт.ст. распыляли смешанные в равных объемах жидкости, содержащие соответственно 2% хлорида ацетилхолина и 0,1% фосфата гистамина. Затем в течение 6 минут за морскими свинками наблюдали, чтобы зафиксировать продолжительность инкубационного периода астматического спазма (также известного как инкубационный период вызова астмы), то есть время, через которое происходит астматический спазм, и время падения морской свинки после прекращения распыления. Инкубационный период, который длился более чем 6 мин, считали равным 360 с. Результаты эксперимента в разных группах сравнивали с помощью критерия Стьюдента.
1.3. Результаты испытания.
Результаты показаны в Таблице 5.
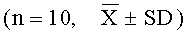
Из Таблицы 5 можно увидеть, что средняя и высокая дозы лекарства согласно настоящему изобретению способны значительно продлить инкубационный период и отсрочить падение морских свинок из-за астмы, вызванной ацетилхолин хлоридом и фосфатом гистамина, по сравнению с контрольной группой (Р<0,05, Р<0,01, Р<0,001). Низкая доза лекарства согласно настоящему изобретению может значительно отсрочить падение по сравнению с контрольной группой (Р<0,05).
1.4. Краткое заключение
Результаты эксперимента, приведенные выше, показывают, что лекарство согласно настоящему изобретению имеет значительный эффект уменьшения одышки при астме, вызванной ацетилхолин хлоридом и фосфатом гистамина, у морских свинок.
2. Влияние на аллергический спазм бронхов, вызванный овальбумином, у морских свинок.
2.1. Объекты эксперимента
2.1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, подвергаемое испытанию, 6,25 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060501, в ходе эксперимента экстракт указанного лекарства, измельченный в порошок, разбавляли до требуемой концентрации.
(2) GLKCNC в качестве контроля из традиционной китайской медицины, 1 г лекарственного сырья/пилюля (0,3 г порошка в пилюле), произведенная Shanxi Guilong pharmaceutical Co., Ltd., номер разрешения SFDA Z-11; дата выпуска 2006.01.01.; номер серии продукта 060112; продукт годен до декабря 2007 года.
(3) Аминофиллин в качестве контроля из западной медицины, 0,1 г/таблетка, продукция Beijing Zizhu Pharmaceutical Co., Ltd, номер серии 20061202.
2.1.2. Животные:
Шестьдесят чистокровных белых морских свинок класса I, среди которых число самцов и самок было одинаковым, со средней массой тела 222,33±20,0 г, предоставленных Пекинским центром по разведению животных, номер лицензии SCXK (Jing) 2002-0005.
2.1.3. Реагенты:
(1) Антиген: Овальбумин, 50 г/флакон, продукция Sigma, каталожный номер А5253, упакованный Beijing Xin Hui Ze Ao Science and Technology Co., Ltd.
(2) Адъювант: Вакцина против коклюша 30·109 Ед/мл, 2 мл/ампула, продукция Национального института по контролю фармацевтической и биологической продукции, номер серии 04-1.
2.14. Оборудование:
Аппараты, помогающие вызвать астму, а именно воздушный компрессор и стеклянный распылитель, и стеклянный сосуд в форме колокола емкостью 4 л.
2.2. Ход эксперимента.
Эксперимент проводили в два этапа. Во-первых, морские свинки были сенсибилизированы. Было отобрано шестьдесят здоровых и чистокровных белых морских свинок, и каждой из них в заднюю конечность внутримышечно вводили 4 мг овальбумина (0,1 мл физиологического раствора, содержащего 4% овальбумина) и в то же время для сенсибилизации внутрибрюшинно вводили вакцину против коклюша, содержащую 2×1010 бактерий. В течение 14 дней после инъекции, сенсибилизированные животные были подвергнуты эксперименту. Во-вторых, на десятый день после сенсибилизации животных случайным образом разделяли на следующие шесть групп по 10 животных в каждой: (1) контрольную группу, которой вводили дистиллированную воду (5 мл/кг); (2) группу аминофиллина (0,05 г/кг); (3) группу GLKCNC (1,2 г лекарственного сырья/кг); (4) группу низкой дозировки лекарства согласно настоящему изобретению (группу Н-дозировки, 1,75 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу С-дозировки, 3,5 г лекарственного сырья/кг); (6) группу высокой дозировки лекарства согласно настоящему изобретению (группу В-дозировки, 7 г лекарственного сырья/кг). Животным испытательных групп внутрижелудочно вводили соответствующее лекарство в указанной дозе, дополненной до объема 5 мл/кг, один раз в день пять дней подряд, тогда как животным контрольной группы вводили такое же количество физиологического раствора. Через 30 минут после последнего введения морских свинок по отдельности помещали в герметично закрываемый сосуд в форме колокола емкостью 4 л и полминуты при постоянном давлении 400 мм рт.ст. распыляли 5% раствор овальбумина. Затем в течение 6 минут (360 с) за морскими свинками, при которых проводили распыление, наблюдали, чтобы зафиксировать продолжительность инкубационного периода астматического спазма и количество животных, у которых проявились одышка, судороги и падение, а также смерть. Для животного, у которого в течение 6 минут не проявилась одышка, а также судороги и падение, инкубационный период считали равным 360 с. Результаты эксперимента в разных группах сравнивали с помощью критерия Стьюдента. Количество умерших животных было проверено с помощью критерия хи-квадрат.
2.3. Результаты испытания.
Результаты показаны в Таблице 6.
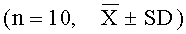
Из Таблицы 6 можно увидеть, что низкая, средняя и высокая дозы лекарства согласно настоящему изобретению, а также лекарство, выступающее как положительный контроль, могут продлить инкубационный период астмы, отсрочить возникновение одышки, судорог и падение и снизить число умерших животных и демонстрируют значительное различие в действии по сравнению с контрольной группой (Р<0,05, Р<0,01, Р<0,001).
2.4. Краткое заключение
Результаты эксперимента показывают, что низкая, средняя и высокая дозы лекарства согласно настоящему изобретению могут продлить инкубационный период аллергического спазма бронхов и отсрочить возникновение одышки, судорог и падение, а также могут снизить число умерших животных, тем самым значительно ослабляя аллергический спазм бронхов, вызванный овальбумином.
3. Вывод:
Два экспериментальных исследования, описанных выше, показывают, что лекарство согласно настоящему изобретению имеет эффект уменьшения одышки.
Пример испытания 4 Эксперимент по исследованию противовоспалительного эффекта лекарства согласно настоящему изобретению.
1. Влияние на опухоль уха, вызванную ксилолом, у мышей.
1.1. Объекты эксперимента
1.1.1. Животные:
Шестьдесят самцов куныминских мышей класса II со средней массой тела 19,77±0,91 г, предоставленных племенным хозяйством Института изучения лабораторных животных Китайской академии медицинских наук, номер лицензии SCXK (Jing) 2000-0006.
1.1.2. Лекарства:
(1) Лекарство согласно настоящему изобретению, подвергаемое испытанию, 6,25 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060501.
(2) GLKCNC в качестве контроля из традиционной китайской медицины, 1 г лекарственного сырья/пилюля (0,3 г порошка в пилюле), произведенная Shanxi Guilong pharmaceutical Co., Ltd., номер разрешения SFDA Z-11; номер серии продукта 060112; продукт годен до декабря 2007 года.
(3) Таблетка аспирина, покрытая энтеросолюбильной оболочкой, в качестве контроля из западной медицины, 0,3 г/таблетка, произведенная Yantai Second Pharmaceutical Factory, номер серии 011102. В ходе эксперимента вышеописанные лекарства смешивали с дистиллированной водой, доводя до требуемых концентраций.
1.2. Ход эксперимента.
Шестьдесят здоровых мышей были случайным образом разделены на следующие шесть групп по десять животных в каждой: (1) контрольную группу, которой вводили физиологический раствор (25 мл/кг); (2) группу аспирина (0,2 г/кг); (3) группу GLKCNC (2 г лекарственного сырья/кг); (4) группу низкой дозировки лекарства согласно настоящему изобретению (группу Н-дозировки, 3 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу С-дозировки, 6 г лекарственного сырья/кг); (6) группу высокой дозировки лекарства согласно настоящему изобретению (группу В-дозировки, 12 г лекарственного сырья/кг). Животным испытательных групп внутрижелудочно вводили соответствующее лекарство в указанной дозе, дополненной до объема 25 мл/кг, один раз в день три дня подряд, тогда как животным контрольной группы вводили такое же количество физиологического раствора. На третий день через 30 минут после введения в правое ухо каждой мыши закапывали 0,1 мл ксилола. Пятнадцать минут спустя животных умерщвляли путем смещения позвонков. С помощью дырокола проделывали отверстия диаметром 6 мм в аналогичных местах правого и левого ушей. Кусочки правого и левого ушей по отдельности взвешивали на электронных весах. Степень опухания уха каждой мыши рассчитывали путем вычитания массы кусочка левого уха из массы кусочка правого. Степень опухания уха у мышей различных групп сравнивали с помощью критерия Стьюдента.
1.3. Результаты испытания.
Результаты показаны в Таблице 7.
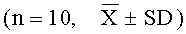
Как показано в Таблице 7 правые уши мышей контрольной группы значительно опухают с увеличением толщины, и разница между кусочками правого и левого ушей очевидна. Высокая и средняя дозы лекарства согласно настоящему изобретению, а также лекарство, выступающее как положительный контроль, могут значительно подавлять воспаление уха у мышей, вызванное ксилолом, поскольку опухоль правых ушей у мышей значительно уменьшилась, и демонстрируют значительное различие в действии по сравнению с контрольной группой (Р<0,05, Р<0,01), в то время как низкая доза лекарства согласно настоящему изобретению не демонстрирует заметного эффекта подавления роста опухоли и проявляет незначительное различие в действии по сравнению с контрольной группой. Результаты эксперимента показывают, что средняя и высокая дозы лекарства согласно настоящему изобретению имеют лучшее противовоспалительное действие на модель опухоли уха у мыши, вызванной ксилолом.
1.4. Краткое заключение
Результаты эксперимента показывают, что средняя и высокая дозы лекарства согласно настоящему изобретению оказывают значительное противовоспалительное действие на модель опухоли уха, вызванной ксилолом, у мыши.
2. Влияние на опухоль подушечки стопы крыс, вызванную каррагинаном.
2.1. Объекты эксперимента
2.1.1. Лекарства;
(1) Лекарство согласно настоящему изобретению, подвергаемое испытанию, 6,25 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060501.
(2) GLKCNC в качестве контроля из традиционной китайской медицины, 1 г лекарственного сырья/пилюля (0,3 г порошка), произведенная Shanxi Guilong pharmaceutical Co., Ltd, номер разрешения SFDA Z-11; номер серии продукта 060112; продукт годен до декабря 2007 года.
(3) Таблетка аспирина, покрытая энтеросолюбильной оболочкой, в качестве контроля из западной медицины, 0,3 г/таблетка, произведенная Yantai Second Pharmaceutical Factory, номер серии 011102.
В ходе эксперимента вышеописанные лекарства были получены в требуемых концентрациях с помощью разбавления дистиллированной водой.
(4) Каррагинан, продукция SIGMA, номер серии 117Н0151, полученный в требуемых для эксперимента концентрациях.
2.1.2. Животные:
Шестьдесят самцов белых крыс линии Вистар класса I со средней массой тела 157,05±8,49 г, предоставленных Институтом изучения лабораторных животных Китайской академии медицинских наук, номер лицензии SCXK (Jing) 2000-0006.
2.2. Ход эксперимента.
Шестьдесят здоровых крыс были случайным образом разделены на следующие шесть групп: (1) контрольную группу, которой вводили дистиллированную воду (10 мл/кг); (2) группу аспирина (150 мг/кг); (3) группу GLKCNC (1,5 г лекарственного сырья/кг); (4) группу низкой дозировки лекарства согласно настоящему изобретению (группу Н-дозировки, 2 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу С-дозировки, 4 г лекарственного сырья/кг); (6) группу высокой дозировки лекарства согласно настоящему изобретению (группу В-дозировки, 8 г лекарственного сырья/кг). Перед введением соответствующего лекарства или, в случае контрольной группы, физиологического раствора объем левой задней конечности каждого животного определяли методом капиллярной амплификации и принимали в качестве значения. Животным испытательных групп внутрижелудочно вводили соответствующее лекарство в указанной дозе, дополненной до объема 10 мл/кг, один раз в день три дня подряд, тогда как животным контрольной группы внутрижелудочно вводили такое же количество физиологического раствора. Воспаление у каждой крысы вызывали с помощью подкожной инъекции 0,05 мл раствора, содержащего 1% каррагинана, в левую подушечку стопы через 30 минут после последнего введения. Объем (мл) левой задней конечности крыс определяли через 0,5, 1, 2, 4 и 6 часов после инъекции. Сравнение групп проводили на основании различия объема левой конечности до и после введения вещества, вызывающего воспаление, с помощью критерия Стьюдента.
2.3. Результаты испытания.
Результаты показаны в Таблице 8.

Как показано в Таблице 8, низкая, средняя и высокая дозы лекарства согласно настоящему изобретению, а также лекарство, выступающее в качестве положительного контроля, имеют значительный эффект подавления опухания конечности крысы в каждый из моментов времени, а именно через 0,5, 1, 2, 4 и 6 часов после введения вещества, вызывающего воспаление, и демонстрируют значительное различие в действии по сравнению с контрольной группой (Р<0,05, Р<0,01,Р<0,001).
2.4. Краткое заключение
Результаты показывают, что низкая, средняя и высокая дозы лекарства согласно настоящему изобретению оказывают значительный эффект подавления воспалительного опухания подушечки стопы крысы, вызванного каррагинаном.
3. Влияние на гранулему, вызванную небольшим тампоном, у крыс.
3.1. Объекты эксперимента
3.1.1. Животные:
Шестьдесят крыс линии Вистар класса II, среди которых число самцов и самок было одинаковым, со средней массой тела 132,37±6,31 г, предоставленных племенным хозяйством Института изучения лабораторных животных Китайской академии медицинских наук, номер лицензии SCXK (Jing) 2000-0006.
3.1.2. Лекарства:
(1) Лекарство согласно настоящему изобретению, подвергаемое испытанию, 6,25 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060501.
(2) GLKCNC в качестве контроля из традиционной китайской медицины, 1 г лекарственного сырья/пилюля (0,3 г порошка), произведенная Shanxi Guilong pharmaceutical Co., Ltd., номер разрешения SFDAZ-11; номер серии 060112.
(3) Таблетка аспирина, покрытая энтеросолюбильной оболочкой, в качестве контроля из западной медицины, 0,3 г/таблетка, выпущенная Yantai Second Pharmaceutical Factory, номер серии 051102. В ходе эксперимента лекарство было получено в требуемых концентрациях с помощью разбавления дистиллированной водой.
(4) Натриевая соль ампициллина для инъекций (ASI), 0,5 г/флакон, произведенная North China Pharmaceutical Co., Ltd., номер серии F0111207.
3.2. Ход эксперимента.
Шестьдесят здоровых крыс были случайным образом разделены на следующие шесть групп по 10 животных в каждой: (1) контрольную группу, которой вводили дистиллированную воду (10 мл/кг); (2) группу аспирина (150 мг/кг); (3) группу GLKCNC (1,5 г лекарственного сырья/кг); (4) группу низкой дозировки лекарства согласно настоящему изобретению (группу Н-дозировки, 2 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу С-дозировки, 4 г лекарственного сырья/кг); (6) группу высокой дозировки лекарства согласно настоящему изобретению (группу В-дозировки, 8 г лекарственного сырья/кг). В ходе эксперимента крысе внутрибрюшинно вводили раствор, содержащий 3,5% хлоралгидрата, выбривали шерсть в подмышечной области и фиксировали животное в положении на спине. Кожу подмышечной впадины дезинфицировали стандартным способом, а затем надрезали с образованием разреза. Через разрез в левую и правую подмышечные впадины соответственно имплантировали небольшие тампоны определенной массы (примерно 30 мг каждый ватный шарик), которые были стерилизованы в автоклаве и в которые добавляли 0,1 мл натриевой соли ампициллина на 1 мг тампона, а затем сушили в сушильном шкафу при температуре 50°С. Введение соответствующего лекарства или физиологического раствора выполняли через 2 часа после операции. Животным испытательных групп внутрижелудочно вводили соответствующее лекарство в указанной дозе, дополненной до объема 10 мл/кг, один раз в день три дня подряд, тогда как животным контрольной группы внутрижелудочно вводили такое же количество физиологического раствора. Животным испытательных групп внутрижелудочно вводили соответствующее лекарство в указанной дозе, дополненной до объема 10 мл/кг, один раз в день семь дней подряд, тогда как животным контрольной группы вводили такое же количество физиологического раствора. Через 7 дней после введения спустя, животных умерщвляли путем смещения шейных позвонков. Тампоны удаляли, чтобы с помощью электронных весов измерить их массу во влажном состоянии, а затем помещали в сушильный шкаф с температурой 60°С на 12 ч, после чего измеряли их массу в сухом состоянии. Для каждой группы рассчитывали средние значения массы поствоспалительной гранулемы во влажном и сухом состоянии, из которых вычитали первоначальную массу ватного шарика, и с помощью критерия Стьюдента проводили сравнение групп.
3.3. Результаты теста.
Результаты показаны в Таблице 9.

Как показано в Таблице 9, низкая, средняя и высокая дозы лекарства согласно настоящему изобретению, а также лекарство, выступающее в качестве положительного контроля, могут заметно подавлять массу гранулемы, вызванной тампоном, во влажном и сухом состоянии и демонстрируют значительное различие в действии по сравнению с контрольной группой (Р<0,05, Р<0,01, Р<0,001). Результаты показывают, что низкая, средняя и высокая дозы лекарства согласно настоящему изобретению оказывают заметный эффект подавления роста гранулемы в модели воспаления у крысы, вызванного тампоном,
3.4. Краткое заключение
Результаты эксперимента показывают, что лекарство согласно настоящему изобретению оказывает лучшее противовоспалительное действие на модель воспаления, при котором образуется гранулема, вызванная тампоном, у крыс.
4. Вывод:
Три экспериментальных исследования, описанных выше, подтверждают, что лекарство согласно настоящему изобретению обладает противовоспалительным действием.
Пример испытания 5 Влияние лекарства согласно настоящему изобретению на животное как модель хронического бронхита.
1. Объекты эксперимента
1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, 6,25 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co, Ltd, номер серии 060401, в ходе эксперимента применяемое в форме порошка экстракта.
(2) GLKCNC, 1 г лекарственного сырья/пилюля (0,3 г порошка в пилюле), произведенная Shanxi Guilong pharmaceutical Co, Ltd, номер разрешения SFDA Z-11; дата выпуска 2006.01.01, номер серии продукта 060112; продукт годен до декабря 2007 года.
1.2. Животные:
Сто здоровых мышей КМ категории СПФ, среди которых число самцов и самок было одинаковым, с массой тела 18-20 г, предоставленных племенным хозяйством Института изучения лабораторных животных Китайской академии медицинских наук, номер лицензии SCXK (Jing) 2004-0001.
1.3. Оборудование:
Пластмассовые коробки 40×30×22 (см).
γ-счетчик SN-6110 (с зондом) для радиоиммунологического анализа, произведенный Shanghai Hesuo Rihuan Photoelectric Instrument Co., Ltd.
1.4. Реагент:
Набор для радиоиммуноанализа интерлейкин-6 (IL-6 RIA KIT), номер серии продукта IF1 501, произведенный Tianjin Nine Tripods Medical & Bioengineering Co., Ltd.
2. Ход эксперимента.
Воспроизведение животной модели: Перед проведением эксперимента мышей равномерно распределяли по пластиковым коробкам (40×30×22 см). Каждая коробка имела отверстие для вентиляции и была соединена с Т-образной трубкой, которая одним из оставшихся концов была соединена со шприцем емкостью 50 мл, а другим с зажженной сигаретой (сигарета представляет собой сигарету марки Qian Men без фильтра, произведенную Shanghai Cigarette Factory). С помощью шприца через Т-образную трубку дым сигареты непрерывно поступал в коробку. Животных окуривали дважды в день по утрам и во второй половине дня соответственно, каждый раз в течение 30 минут, с помощью двух сигарет. После эксперимента, проводимого в течение 6 недель, несколько мышей были случайным образом выбраны и умерщвлены. Легкие умерщвленной мыши немедленно извлекали, фиксировали в 10% растворе формалина и подвергали окраске гематоксилином и эозином. На восьмую неделю, после того как посредством изучения патологии под микроскопом были обнаружены такие патологические изменения, как воспалительная инфильтрация в бронхах, отслоение клеток эпителия и т.д., окуренных мышей случайным образом разделяли на шесть групп по 15 животных в каждой: (1) стандартную контрольную группу (дистиллированная вода, 25 мл/кг); (2) модельную группу (дистиллированная вода в количестве 25 мл/кг + окуривание); (3) группу с GLKCNC в качестве положительного лекарства + окуривание (2 г лекарственного сырья/кг); (4) группу лекарства согласно настоящему изобретению (3 г лекарственного сырья/кг) + окуривание; (5) группу с лекарством согласно настоящему изобретению (6 г лекарственного сырья/кг)+окуривание; (6) группу с лекарством согласно настоящему изобретению (12 г лекарственного сырья/кг) + окуривание. Животным из групп с лекарством внутрижелудочно вводили соответствующее лекарство в указанной дозе, дополненной до объема 25 мл/кг, один раз в день четыре недели подряд. Животным контрольной и модельной групп внутрижелудочно вводили такое же количество физиологического раствора. Одновременно с введением животных из групп с лекарством окуривали (согласно тому же способу, что и выше) в общей сложности более 11 недель. В ходе данного периода животных держали под постоянным наблюдением, учитывая их внешний вид, отношение к еде и смертность. Одиннадцать недель спустя, у животных по группам отбирали кровь из орбитального синуса. Сыворотку каждой пробы выделяли и центрифугировали со скоростью 3000 об/мин в течение 5 минут. Надосадочную жидкость собирали для определения интерлейкина-6. Путем определения уровня интерлейкина-6 устанавливали воспалительную реакцию и функцию противоинфекционной защиты организма мышей. Затем животных умерщвляли. Легкие немедленно извлекали, фиксировали в 10% формалине, разрезали с получением гистологических срезов, подвергали окраске гематоксилином и эозином и изучали для установления патологических изменений. (1) Каждый срез изучали для установления степени инфильтрации стенки бронхов и бронхиол различных участков легкого воспалительными клетками и относили к одному из трех классов: +, ++ и +++, в соответствии с долей области бронхов и бронхиол различных участков легкого, инфильтрованной воспалительными клетками, по сравнению со всем срезом и количеством воспалительных клеток. (2) Каждый срез оценивали по результатам изучения, произведенного для установления степени отслоения клеток эпителия от всей слизистой оболочки бронхов, и относили к одному из трех классов: -, +, и ++. (3) На каждом срезе изучали десять случайно выбранных бронхиол и в соответствии с количеством секрета в просвете каждой бронхиолы и папиллярной гиперплазией клеток эпителия слизистой оболочки оценивали как принадлежащие к одному из четырех классов: -, +, ++ и +++. (4) Отношение площади слизистой оболочки стенки к общей площади бронхиол определяли таким образом, с помощью мультимедийной системы анализа текста и цветных изображений патологий (MPIAS-500) десять бронхиол каждого животного рассматривали с одинаковым увеличением на неизменном расстоянии, и поскольку были запечатлены область, занимаемая всей бронхиолой, и область просвета каждой бронхиолы, была рассчитана площадь слизистой оболочки стенки бронхиолы. Таким образом, степень гиперплазии клеток эпителия слизистой оболочки бронхиолы отображали с помощью среднего значения отношений площадей слизистых оболочек стенок к общим площадям бронхиол.
3. Количественная оценка патологических изменений и статистическая обработка.
(1) Изучение патологий проводили на модели хронического бронхита для установления показателей воспалительной инфильтрации в слизистой оболочке бронхов, количества секрета в бронхах, отслоения клеток эпителия бронхов и гиперплазии клеток эпителия слизистой оболочки, при этом каждый показатель полуколичественно оценивали так: "-" оценивали в 0, "+" оценивали в 1 балл, "++" оценивали в 2 балла, а "+++" оценивали в 3 балла.
(2) Результаты эксперимента попарно сравнивали со средними в группах с помощью критерия Стьюдента.
4. Результаты испытания.
4.1. Внешний вид и смертность.
В отношении внешнего вида, активности и отношения к еде, окуренные животные модельной группы выглядели несколько хуже, чем животные стандартной контрольной группы, а животные испытательных групп и группы GLKCNC демонстрировали незначительные различия в отношении указанных показателей по сравнению с животными стандартной контрольной группы. В ходе окуривания и окуривания с одновременным введением вышеуказанных веществ ни одно из животных в индивидуальных группах не умерло.
4.2. Влияние на уровень интерлейкина-6.
Результаты показаны в Таблице 10.

Из Таблицы 10 можно увидеть, что количество интерлейкина-6, измеренное в модельной группе, подвергаемой окуриванию, является значительно более высоким, чем в контрольной группе (Р<0,001), а количество интерлейкина-6, измеренное в группах, подвергаемых окуриванию и лечению, является значительно меньшим, чем в модельной группе, подвергаемой окуриванию, (Р<0,01, Р<0,001). Это означает, что in vivo уровень интерлейкина-6 у мышей лекарственных групп является значительно сниженным, что свидетельствует о подавлении воспалительной реакции и противоинфекционной защите мышей.
4.3. Патоморфологические изменения.
Изучение под оптическим микроскопом.
(1) Стандартная контрольная группа: альвеолы выглядели чистыми, эпителий слизистой оболочки бронхов и бронхиол на различных участках не был поврежден, в трахее присутствовало незначительное количество секрета, гиперплазия эпителия слизистой оболочки бронхов не проявлялась, и было обнаружено незначительное количество воспалительного клеточного инфильтрата вокруг бронхов и мелких сосудов.
(2) Модельная группа: альвеолы выглядели достаточно чистыми; на внешней поверхности бронхов и бронхиол на различных участках был обнаружен воспалительный клеточный инфильтрат различных размеров; можно было видеть, что эпителий слизистой оболочки бронхов подвергся разрушению, некрозу и отслоению различной степени; в просвете бронхов наблюдалось большее количество секрета и кровоизлияние; и часть эпителия слизистой оболочки бронхов подверглась папиллярной гиперплазии.
(3) Группа с окуриванием + GLKCNC: альвеолы выглядели достаточно чистыми; на внешней поверхности бронхов и бронхиол на различных участках можно было видеть слабо выраженный воспалительный клеточный инфильтрат; эпителий слизистой оболочки бронхов подвергся значительно более слабому разрушению, некрозу и отслоению по сравнению с модельной группой; количество секрета в просвете бронхов было значительно меньше по сравнению с модельной группой; папиллярная гиперплазия эпителия слизистой оболочки бронхов была значительно слабее по сравнению с модельной группой.
(4) Группа с окуриванием + лекарством согласно настоящему изобретению: альвеолы выглядели достаточно чистыми; различные степени воспаления бронхов и бронхиол на различных участках легкого были значительно меньше по сравнению с модельной группой; отслоение эпителия слизистой оболочки было значительно слабее; количество секрета в просвете бронхов было значительно меньше по сравнению с модельной группой; и гиперплазия эпителия также была значительно меньше.

Из Таблицы 11 можно увидеть, что инфильтрация воспалительными клетками слизистой оболочки бронхов животных модельной группы была высокой, что означает значительное различие по сравнению со стандартной контрольной группой (Р<0,01). Инфильтрации воспалительными клетками в индивидуальных лекарственных группах являются значительно более слабыми по сравнению со стандартной контрольной группой, то есть результаты значительно отличаются (Р<0.05, Р<0.01).

Из Таблицы 12 можно увидеть, что отслоение клеток эпителия бронхов животных модельной группы является значительно более серьезным, чем стандартной контрольной группы (Р<0,001); отслоения клеток эпителия бронхов животных индивидуальных лекарственных групп являются значительно более слабыми по сравнению с модельной группой (Р<0,001, Р<0,01, Р<0,05).

Из Таблицы 13 можно увидеть, что количество секрета и кровоизлияние в просвете бронхов животных модельной группы является большим, чем стандартной контрольной группы, причем разница значительна (Р<0,001); а по сравнению с модельной группой количество секрета в просвете бронхов животных из групп с индивидуальными дозами лекарства согласно настоящему изобретению является значительно сниженным, причем разница значительна (Р<0,001, Р<0,01,Р<0,05).

Из Таблицы 14 можно увидеть, что папиллярная гиперплазия эпителия слизистой оболочки бронхов животных модельной группы является более высокой, чем стандартной контрольной группы, причем разница значительна (Р<0,001); а по сравнению с модельной группой папиллярная гиперплазия эпителия слизистой оболочки бронхов животных из групп с индивидуальными дозами лекарства согласно настоящему изобретению является значительно более низкой (Р<0,01, Р<0,001).

Из Таблицы 15 можно увидеть, что площадь слизистой оболочки стенки бронхиол животных модельной группы больше, чем контрольной группы, причем разница значительна (Р<0,001); а площадь слизистой оболочки стенки бронхиол животных из групп с индивидуальными дозами лекарства значительно меньше, чем модельной группы (Р<0,001). Это означает, что все дозы лекарства согласно настоящему изобретению, применяемого в группах с индивидуальными дозами, могут уменьшать гиперплазию клеток эпителия бронхиол, увеличивать площадь просвета бронхиол и повышать объем легочной вентиляции.
5. Вывод:
Модель хронического бронхита у мыши создавали с помощью сигарет, примененных в качестве отдельного раздражителя. Мышам в группах, в которых испытывали лекарство согласно настоящему изобретению, его вводили внутрижелудочно при таких же условиях, как и в случае модельной группы. Результаты эксперимента показывают, что внешний вид, активность и отношение к еде мышей групп, в которых испытывали лекарство согласно настоящему изобретению, были лучше, чем в модельной группе и соответствовали показателям контрольной группы. In vivo лекарство согласно настоящему изобретению значительно снижало уровень интерлейкина-6 у мышей, который подавлял воспалительную реакцию и противоинфекционную защиту организма мышей. На микроскопическом уровне степень воспаления слизистой оболочки бронхов, количество секрета в бронхах и отслоение и гиперплазия клеток эпителия бронхов у мышей испытательных групп по сравнению с модельной группой уменьшались в различной степени, при этом разница была значительной.
Как было экспериментально показано, лекарство согласно настоящему изобретению может приводить к норме различные патологические изменения при хроническом бронхите, вызванные пассивным курением, у мышей, вызывая положительный эффект при лечении хронического бронхита.
Пример испытания 6 Токсикологическое исследование лекарства согласно настоящему изобретению.
1. Испытание на острую токсичность (эксперимент с применением максимальной дозы).
Эксперимент по исследованию острой токсичности лекарства согласно настоящему изобретению проводили на мышах. Поскольку величину ЛД50 невозможно было измерить, в качестве альтернативы эксперимент проводили с применением максимальной дозы. Мышам внутрижелудочно вводили максимальный объем лекарства в максимальной концентрации. Результат показывает, что при введении мышам максимальной дозы, равной 243 г лекарственного сырья/кг, что превышает клиническую дозу в 378 раз (клиническая доза представляет собой 45 г лекарственного сырья/чел/день, массу тела человека принимали, равной 70 кг), нежелательной лекарственной реакции и смерти животных выявлено не было. По завершении эксперимента животных вскрывали и в каждом из органов не наблюдали никаких нарушений, видимых невооруженным глазом.
2. Долгосрочное токсикологическое испытание.
В ходе эксперимента применяли 120 крыс линии Вистар, разделенных на контрольную группу и группы, на которых испытывали лекарство согласно настоящему изобретению, вводимое в дозах, равных 8 г, 16 г и 32 г лекарственного сырья/кг, что превышает клиническую дозу соответственно в 12,5, 25 и 50 раз (45 г лекарственного сырья/чел/день). Лекарство согласно настоящему изобретению внутрижелудочно вводили испытуемым животным 24 недели подряд. Животные были подвергнуты наблюдению для установления влияния лекарства согласно настоящему изобретению на различные показатели. Результаты эксперимента показывают, что дозы лекарства согласно настоящему изобретению не имеют заметного влияния на массу тела, потребление пищи, гемограмму периферической крови, электрокардиограмму и индекс органа; PTs крыс группы низкой дозировки после введения лекарства в течение 12 недель, а также групп высокой, средней и низкой дозировки после введения лекарства в течение 24 недель является более низким, чем контрольной группы, что представляет собой статистическое расхождение в связи с низким стандартным отклонением измеренных величин и не несет физиологического смысла; наконец, в период восстановления (выведение лекарства происходит в течение 4 недель) ПВ и АПТВ животных испытательных групп обнаруживают незначительное различие по сравнению с контрольной группой. Среди измеренных значений двенадцати биохимических показателей крови уровень глюкозы у животных группы низкой дозировки после введения лекарства в течение 12 недель является более высоким, чем контрольной группы (Р<0,05), но тем не менее находится в пределах нормального диапазона значений физиологического показателя. Уровни ACT, общего белка и креатинина у животных группы низкой дозировки, а также уровни АЛТ и общего белка у животных группы средней дозировки после введения лекарства в течение 12 недель являются более низкими, чем контрольной группы (Р<0,05), но указанные показатели тем не менее находятся в пределах соответствующих нормальных диапазонов значений. После введения лекарства в течение 24 недель уровни ACT, общего белка и креатинина у животных групп средней и высокой дозировки и уровни альбумина и мочевины у животных группы высокой дозировки являются более низкими, чем контрольной группы (Р<0,05, Р<0,01), но указанные показатели тем не менее находятся в пределах соответствующих нормальных диапазонов значений. В период восстановления уровень билирубина у животных группы низкой дозировки является более высоким, чем контрольной группы (Р<0,05), а уровни креатинина и мочевины у животных группы низкой дозировки являются более низкими, чем контрольной группы (Р<0,05, Р<0,01), и тем не менее указанные показатели находятся в пределах соответствующих нормальных диапазонов значений. Прочие показатели обнаруживают незначительное различие по сравнению с контрольной группой. В ходе медико-патологического исследования заметных патологических изменений, вызванных действием лекарства согласно настоящему изобретению, в органах не обнаружено.
3. Вывод.
В ходе испытания на острую токсичность (эксперимент с применением максимальной дозы) и долгосрочного токсикологического испытания различные показатели животных испытательных групп не обнаруживают значительных различий по сравнению с контрольной группой. В ходе медико-патологического исследования заметных патологических изменений, вызванных действием лекарства согласно настоящему изобретению, в органах не обнаружено.
В связи с вышеизложенным, лекарство согласно настоящему изобретению обладает следующим действием: останавливает кашель, рассеивает флегму, уменьшает одышку и противодействует воспалению, а также обладает хорошим терапевтическим действием при бронхите, в частности обладает отличной эффективностью при хроническом бронхите.
Изобретение относится к фармацевтической промышленности, в частности к фармацевтической композиции для лечения бронхита. Фармацевтическая композиция для лечения бронхита содержит порошок SCUTELLARIAE RADIX; эфирное масло, полученное из смеси растений CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS; сконцентрированный водный экстракт, полученный из травяного остатка, оставшегося после получения эфирного масла, и смеси растений, состоящей из ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ET RHIZOMA, FARFARAE FLOS, FORSYTHIAE FRUCTUS; сконцентрированный этанольный экстракт из PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ET RHIZOMA, HOUTTUYNIAE HERBA, ARMENIACAE SEMEN AMARUM. Заявленная фармацевтическая композиция эффективна в устранении мокроты, облегчении кашля, ослаблении астмы, а также сопротивлении воспалению, и оказывает хороший лечебный эффект при лечении бронхита. 10 з.п. ф-лы, 15 табл., 12 пр.
1. Фармацевтическая композиция для лечения бронхита, характеризующаяся тем, что указанная фармацевтическая композиция приготовлена из лекарственных материалов в следующих долях по массе:
при этом указанная фармацевтическая композиция получена согласно этапам, включающим:
(1) взвешивание отобранного чистого SCUTELLARIAE RADIX в соответствии с долей, определенной в рецепте, и измельчение указанного материала в мелкий порошок для дальнейшего применения;
(2) взвешивание отобранных чистых CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS в соответствии с долями, определенными в рецепте, добавление воды в количестве 8-12 об./масс. (мл/г) в расчете на массу лекарственных материалов и перегонку смеси в течение 3-7 ч с выделением эфирных масел и сбор эфирных масел для дальнейшего применения;
(3) сбор водного раствора, полученного в результате перегонки на этапе (2), в емкости, двукратную экстракцию травяного остатка с этапа (2) совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ET RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS водой, каждый раз в течение 1-3 ч, причем отношение количества воды к массе лекарственных материалов составляет 7-11 об./масс. (мл/г) при первой экстракции и 5-9 об./масс. (мл/г) при второй; объединение водных экстрактов и фильтрацию смеси, объединение фильтрата с вышеуказанным водным раствором, полученным в результате перегонки, и концентрирование с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, для дальнейшего применения;
(4) взвешивание отобранных чистых PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ET RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM в соответствии с долями, определенными в рецепте, двукратную экстракцию указанных материалов 40-70%-ным раствором этанола в количестве 5-7 об./масс. (мл/г) на единицу массы лекарственных материалов, первый раз в течение 1-3 ч и второй в течение 1-2 ч; объединение экстрактов и фильтрацию смеси; выделение этанола из фильтрата, концентрирование остатка с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С; и объединение указанной прозрачной пасты с прозрачной пастой, полученной на этапе (3), для дальнейшего применения;
при этом мелкий порошок, полученный на этапе (1), эфирные масла, полученные на этапе (2), и объединенные прозрачные пасты, полученные на этапе (4), представляют собой активные компоненты указанной фармацевтической композиции.
2. Фармацевтическая композиция для лечения бронхита по п.1, отличающаяся тем, что указанная фармацевтическая композиция приготовлена из лекарственных материалов в следующих долях по массе:
3. Фармацевтическая композиция для лечения бронхита по п.1, отличающаяся тем, что указанная фармацевтическая композиция приготовлена из лекарственных материалов в следующих долях по массе:
4. Фармацевтическая композиция для лечения бронхита по п.1, отличающаяся тем, что указанная фармацевтическая композиция приготовлена из лекарственных материалов в следующих долях по массе:
5. Фармацевтическая композиция для лечения бронхита по п.1, отличающаяся тем, что указанная фармацевтическая композиция приготовлена из лекарственных материалов в следующих долях по массе:
6. Фармацевтическая композиция для лечения бронхита по п.1, отличающаяся тем, что указанная фармацевтическая композиция приготовлена из лекарственных материалов в следующих долях по массе:
7. Фармацевтическая композиция по любому из пп.1-6, отличающаяся тем, что PINELLIAE RHIZOMA представляет собой PINELLIAE RHIZOMA PRAEPARATUM CUM ALUMINE, ATRACTYLODIS MACROCEPHALAE RHIZOMA представляет собой RHIZOMA ATRACTYLODIS MACROCEPHALAE TOSTUM CUM MELLE ET FURFURE, ARMENIACAE SEMEN AMARUM представляют собой ARMENIACAE SEMEN AMARUM TOSTUM, a SCUTELLARIAE RADIX находится в форме ломтиков.
8. Фармацевтическая композиция по любому из пп.1-6, отличающаяся тем, что указанная фармацевтическая композиция находится в дозированной форме в виде твердой капсулы, таблетки, порошка, жидкости для перорального применения, мягкой капсулы, пилюли, настойки, сиропа, суппозитория, геля, спрея или формы для инъекций.
9. Фармацевтическая композиция по п.8, отличающаяся тем, что таблетку фармацевтической композиции получают согласно следующим этапам, на которых:
(1) взвешивают отобранный чистый SCUTELLARIAE RADIX в соответствии с долей, определенной в рецепте, и измельчают указанный материал в мелкий порошок для дальнейшего применения SCUTELLARIAE RADIX;
(2) взвешивают отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS в соответствии с долями, определенными в рецепте, добавляют воду в количестве 8-12 об./масс. (мл/г) в расчете на массу лекарственных материалов, подвергают смесь перегонке в течение 4-6 ч с выделением эфирных масел и собирают эфирные масла для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирают в емкость, травяной остаток с этапа (2) совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ET RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергают экстракции водой, каждый раз в течение 1-3 ч, причем отношение количества воды к массе лекарственных материалов составляет 7-11 об./масс. (мл/г) при первой экстракции и 5-9 об./масс.(мл/г) при второй; затем объединяют водные экстракты и фильтруют смесь, объединяют фильтрат с вышеуказанным водным раствором, полученным в результате перегонки, и концентрируют с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С, для дальнейшего применения;
(4) взвешивают отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ET RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM в соответствии с долями, определенными в рецепте, указанные материалы дважды подвергают экстракции 40-70% раствором этанола в количестве 5-7 об./масс. (мл/г) на единицу массы лекарственных материалов, первый раз в течение 1-3 ч и второй в течение 1-2 ч; объединяют экстракты и фильтруют смесь; выделяют этанол из фильтрата, концентрируют остаток с получением прозрачной пасты с относительной плотностью 1,15-1,20, термически измеренной при 60°С; и объединяют указанную прозрачную пасту с прозрачной пастой, полученной на этапе (3), для дальнейшего применения;
(5) гранулируют объединенные прозрачные пасты, полученные на этапе (4), с мелким порошком, полученным на этапе (1), в качестве основного материала и окончательно обрабатывают полученные гранулы для дальнейшего применения;
(6) обеспечивают следующие материалы для таблетирования в долях по массе:
гранулы, полученные на этапе (5) 340-600
коллоидный диоксид кремния 1,8-3,2
стеарат магния 1,8-3,2
(7) добавляют эфирные масла, полученные на этапе (2), к коллоидному диоксиду кремния и осуществляют таблетирование в соответствии с традиционным способом приготовления с получением фармацевтической композиции в форме таблетки.
10. Фармацевтическая композиция по п.8, отличающаяся тем, что таблетку фармацевтической композиции получают согласно следующим этапам, на которых:
(1) взвешивают отобранный чистый SCUTELLARIAE RADIX в соответствии с долей, определенной в рецепте, и измельчают указанный материал в мелкий порошок для дальнейшего применения SCUTELLARIAE RADIX;
(2) взвешивают отобранные чистые CITRI RETICULATAE PERICARPIUM и CINNAMOMI RAMULUS в соответствии с долями, определенными в рецепте, добавляют воду в количестве 9 об./масс. (мл/г) в расчете на массу лекарственных материалов, подвергают смесь перегонке в течение 5 ч с выделением эфирных масел и собирают эфирные масла для дальнейшего применения;
(3) водный раствор, полученный в результате перегонки на этапе (2), собирают в емкость, травяной остаток с этапа (2) совместно с ATRACTYLODIS MACROCEPHALAE RHIZOMA, PORIA, GLYCYRRHIZAE RADIX ET RHIZOMA, FARFARAE FLOS и FORSYTHIAE FRUCTUS дважды подвергают экстракции водой, каждый раз в течение 3 ч, причем отношение количества воды к массе лекарственных материалов составляет 10 об./масс. (мл/г) при первой экстракции и 7 об./масс. (мл/г) при второй; затем объединяют водные экстракты и фильтруют смесь, объединяют фильтрат с вышеуказанным водным раствором, полученным в результате перегонки, и концентрируют с получением прозрачной пасты с относительной плотностью 1,17, термически измеренной при 60°С, для дальнейшего применения;
(4) взвешивают отобранные чистые PINELLIAE RHIZOMA, PERILLAE FRUCTUS, SINAPIS SEMEN, RAPHANI SEMEN, ASTERIS RADIX ET RHIZOMA, HOUTTUYNIAE HERBA и ARMENIACAE SEMEN AMARUM в соответствии с долями, определенными в рецепте, указанные материалы дважды подвергают экстракции 60% раствором этанола в количестве 6 об./масс. (мл/г) на единицу массы лекарственных материалов, первый раз в течение 2 ч и второй в течение 1 ч; объединяют экстракты и фильтруют смесь; выделяют этанол из фильтрата, концентрируют остаток с получением прозрачной пасты с относительной плотностью 1,17, термически измеренной при 60°С; и объединяют указанную прозрачную пасту с прозрачной пастой, полученной на этапе (3), для дальнейшего применения;
(5) гранулируют объединенные прозрачные пасты, полученные на этапе (4), с мелким порошком, полученным на этапе (1), в качестве основного материала и окончательно обрабатывают полученные гранулы для дальнейшего применения;
(6) обеспечивают следующие материалы для таблетирования в долях по массе:
гранулы, полученные на этапе (5) 470
коллоидный диоксид кремния 2,4
стеарат магния 2,4
(7) добавляют эфирные масла, полученные на этапе (2), к коллоидному диоксиду кремния и осуществляют таблетирование в соответствии с традиционным способом приготовления с получением фармацевтической композиции в форме таблетки.
11. Фармацевтическая композиция для лечения бронхита по любому из пп.1-6, отличающаяся тем, что указанный бронхит представляет собой хронический бронхит.
| Устройство для управления приводом передвижения грузовой тележки | 1987 |
|
SU1562296A1 |
| CN1593560 A, 16.03.2005 | |||
| CЕКРЕТЫ КИТАЙСКОЙ МЕДИЦИНЫ | |||
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
| В.И | |||
| ЧУЕШОВ и др | |||
| Промышленная технология лекарств | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат, предназначенный для летания | 0 |
|
SU76A1 |
| МИНИНА С.А., КАУХОВА И.Е., Химия и | |||
Авторы
Даты
2014-06-27—Публикация
2009-06-30—Подача