2420-177183RU/071
СПОСОБ ИММУНОЛОГИЧЕСКОГО АНАЛИЗА БЕЛКА CXCL1 ЧЕЛОВЕКА
Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу количественного определения белка CXCL1 человека (далее в настоящем документе обозначаемого как CXCL1 человека). Более конкретно, настоящее изобретение относится к способу иммунологического анализа, т.е. способу количественного определения CXCL1 человека, в котором используют комбинацию моноклональных антител или их фрагменты, каждый из которых специфично связывается с участком частичной последовательности в любом из трех специфичных участков аминокислотной последовательности, содержащей CXCL1 человека. Также, настоящее изобретение относится к специфично связывающимся с CXCL1 человека моноклональным антителам или их фрагментам, которые можно использовать в описанном выше способе количественного определения белка CXCL1 человека.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
CXCL1 человека представляет собой разновидность хемокина, принадлежащего к семейству CXC. В крови этот белок находится в тромбоцитах, и известно, что CXCL1 подвергается повышенной экспрессии при воспалительных реакциях способом, аналогичным способу повышения экспрессии других членов семейства CXC.
В последние годы было опубликовано, что CXCL1 человека функционирует в качестве фактора, связанного с опухолевым процессом. Таким образом, ожидают, что CXCL1 человека может служить в качестве маркера злокачественной опухоли уротелия за счет определения количества CXCL1 человека в моче (Hiroaki Kawanishi et al, 2008, Clinical Cancer Research, vol. 14, No. 9, 2579-2587; и W02007/026895). Дополнительно опубликовано, что количество CXCL1 человека изменяется на уровне гена и на уровне белка в тканях или в крови пациентов с другими злокачественными опухолями, такими как злокачественная опухоль толстого кишечника, злокачественная опухоль яичников или злокачественная меланома (Gong Yang et al, 2006, PNAS, vol. 103, No. 44, 16472-16477; Yu Wen et al, 2006, Clinical Cancer Research, vol. 12, No. 20, 5951-5959; и Jing Luan et al, 1997, Journal of Leukocyte Biology, vol. 62, No. 5, 588-597). CXCL1 человека, в дополнение к злокачественной опухоли уротелия, дает потенциальную возможность чрезвычайно раннего и/или раннего обнаружения перечисленных выше злокачественных опухолей.
Однако, для обнаружения указанных выше злокачественных опухолей, способы количественного определения с использованием существующего в настоящее время способа иммуноферментного анализа обладают недостаточной чувствительностью. Например, в W02007/026895 описан набор для количественного определения CXCL1 человека, выпускаемый R&D SYSTEMS, Inc. (далее в настоящем документе R&D SYSTEMS), где, несмотря на то, что концентрация на пределе детекции составляет около 20 пг/мл, концентрация CXCL1 человека в моче здорового субъекта не достигает предела детекции. Следовательно, для количественного определения CXCL1 человека необходим способ с более высокой чувствительностью.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Таким образом, в варианте осуществления настоящего изобретения, задачей настоящего изобретения является разработка способа иммунологического анализа для количественного определения CXCL1 человека с более высокой чувствительностью. Более конкретно, целью настоящего изобретения является осуществление способа количественного определения CXCL1 человека с более высокой чувствительностью посредством иммунологического анализа с использованием комбинации антител или участков распознавания антигена, каждый из которых специфично связывается с последовательностью в любом из 3 определенных положений в аминокислотной последовательности, составляющей CXCL1 человека.
Также, в другом варианте осуществления настоящего изобретения, задачей настоящего изобретения является создание моноклональных антител или их фрагментов, специфично распознающих CXCL1 человека. Более конкретно, другой задачей настоящего изобретения является создание моноклональных антител или их фрагментов, которые можно использовать в описанном выше способе обнаружения CXCL1 человека с более высокой чувствительностью, которые содержат новые аминокислотные последовательности, специфично распознающие CXCL1 человека, и которые обладают более высокой аффинностью к CXCL1 человека по сравнению с аффинностью традиционных антител.
Средства решения задач
В результате тщательных исследований, необходимых для достижения указанных выше задач, авторы настоящего изобретения обнаружили, что CXCL1 человека может быть определен способом с более высокой чувствительностью, чем общепринятые способы, посредством иммунологического определения с использованием комбинации моноклональных антител или участков распознавания антигена, специфично связывающихся с участком частичной последовательности в 3 определенных положениях в аминокислотной последовательности, составляющей CXCL1 человека. Также, авторы настоящего изобретения добились успехов в получении моноклональных антител, содержащих новые аминокислотные последовательности, специфично связывающиеся с частичными последовательностями в 3 положениях указанного выше CXCL1 человека и в получении гибридом, продуцирующих такие антитела. Кроме того, авторы настоящего изобретения выделили гены, кодирующие аминокислотные последовательности, содержащие антитела, и определили нуклеотидные последовательности. Это позволило получить рекомбинантные антитела и фрагменты рекомбинантных антител. Настоящее изобретение выполнено на основе указанных выше результатов с целью обеспечения следующих пунктов (1)-(15).
(1) Способ иммунологического анализа белка CXCL1 человека, посредством которого CXCL1 человека или его фрагмент в образце количественно определяют, используя два или более типов моноклональных антител к CXCL1 человека или их фрагменты, где:
два или более типов моноклональных антител к CXCL1 человека или их фрагменты специфично распознают любой из участков последовательности в аминокислотных последовательностях, представленных в SEQ ID NO:1-3, которые представляют собой частичные последовательности аминокислотной последовательности, составляющей белок CXCL1 человека; и два или более типов моноклональных антител против CXCL1 человека или их фрагменты специфично распознают участки последовательности, которые отличаются друг от друга.
(2) Способ иммунологического анализа белка CXCL1 человека по (1), посредством которого белок CXCL1 человека или его фрагмент в образце количественно определяют, используя моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:3.
(3) Способ иммунологического анализа белка CXCL1 человека по (1) или (2), посредством которого белок CXCL1 человека или его фрагмент в образце количественно определяют, используя моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:1, и моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:3.
(4) Способ иммунологического анализа белка CXCL1 человека по (1) или (2), посредством которого белок CXCL1 человека или его фрагмент в образце количественно определяют, используя моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:2, и моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:3.
(5) Способ иммунологического анализа белка CXCL1 человека по любому пункту (1)-(4), где образец представляет собой ткань, взятую после оперативного вмешательства, кровь, сыворотку, плазму крови, мочу, спинномозговую жидкость, слюну, лимфу, слезную жидкость или семенную жидкость.
(6) Моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает частичную последовательность, представленную в SEQ ID NO:3, в аминокислотной последовательности, составляющей белок CXCL1 человека, где:
в составе легких цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:4, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:5, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:6;
в составе тяжелых цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:7, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:8, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:9.
(7) Моноклональное антитело к CXCL1 человека или его фрагмент по (6), содержащее аминокислотную последовательность, представленную в SEQ ID NO:10, в вариабельной области легкой цепи и аминокислотную последовательность, представленную в SEQ ID NO:11, в вариабельной области тяжелой цепи.
(8) Моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает частичную последовательность, представленную в SEQ ID NO:1, в аминокислотной последовательности, составляющей белок CXCL1 человека, где:
в составе легких цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:12, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:13, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:14; и
в составе тяжелых цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:15, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:16, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:17.
(9) Моноклональное антитело к CXCL1 человека или его фрагмент по (8), содержащее аминокислотную последовательность, представленную в SEQ ID NO:18, в вариабельной области легкой цепи и аминокислотную последовательность, представленную в SEQ ID NO:19, в вариабельной области тяжелой цепи.
(10) Моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает частичную последовательность, представленную в SEQ ID NO:3, в аминокислотной последовательности, составляющей белок CXCL1 человека, где:
в составе легких цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:20, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:21, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:22; и
в составе тяжелых цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:23, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:24, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:25.
(11) Моноклональное антитело к CXCL1 человека или его фрагмент по (10), содержащее аминокислотную последовательность, представленную в SEQ ID NO:26, в вариабельной области легкой цепи и аминокислотную последовательность, представленную в SEQ ID NO:27, в вариабельной области тяжелой цепи.
(12) Моноклональное антитело к CXCL1 человека или его фрагмент, которое представляет собой моноклональное антитело или его фрагмент, которое специфично распознает частичную последовательность, представленную в SEQ ID NO:2, в аминокислотной последовательности, составляющей белок CXCL1 человека, где:
в составе легких цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:28, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:29, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:30; и
в составе тяжелых цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:31, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:32, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:33.
(13) Моноклональное антитело к CXCL1 человека или его фрагмент по (12), содержащее аминокислотную последовательность, представленную в SEQ ID NO:34, в вариабельной области легкой цепи и аминокислотную последовательность, представленную в SEQ ID NO:35, в вариабельной области тяжелой цепи.
(14) Моноклональное антитело к CXCL1 человека или его фрагмент, которое представляет собой моноклональное антитело или его фрагмент, которое специфично распознает частичную последовательность, представленную в SEQ ID NO:3, в аминокислотной последовательности, составляющей белок CXCL1 человека, где:
в составе легких цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:36, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:37, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:38; и
в составе тяжелых цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:39, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:40, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:41.
(15) Моноклональное антитело к CXCL1 человека или его фрагмент по (14), содержащее аминокислотную последовательность, представленную в SEQ ID NO:42, в вариабельной области легкой цепи и аминокислотную последовательность, представленную в SEQ ID NO:43, в вариабельной области тяжелой цепи.
Эффект изобретения
Согласно настоящему изобретению концентрацию CXCL1 человека можно количественно определять с более высокой чувствительностью, чем чувствительность общепринятых способов. Также можно получить высокоаффинное моноклональное антитело к CXCL1 человека или его фрагмент, специфично распознающее CXCL1 человека.
КРАТКОЕ ОПИСАНИЕ фигур
На фигуре 1 представлен иммунологический анализ по общепринятому способу с использованием “сэндвич” способа ELISA, в котором используют моноклональное антитело, которое специфично распознает любую из аминокислотных последовательностей, представленных в SEQ ID NO:1-3, и коммерчески доступный набор.
На фигуре 2 представлен “сэндвич” способ ELISA, в котором в качестве меченого антитела используют моноклональное антитело, которое специфично распознает аминокислотную последовательность, представленную в SEQ ID NO:3.
На фигуре 3 представлен “сэндвич” способ ELISA для определения CXCL1 человека в моче с использованием моноклонального антитела, которое специфично распознает аминокислотную последовательность, представленную в SEQ ID NO:1 или 2, и моноклональное антитело, которое специфично распознает аминокислотную последовательность, представленную в SEQ ID NO:3.
На фигуре 4 представлен график, показывающий результаты определения CXCL1 человека в буфере посредством иммобилизованного коммерчески доступного антитела, которое специфично распознает аминокислотную последовательность, представленную в SEQ ID NO:2, и выполнения “сэндвич” способа ELISA с использованием меченного биотином антитела по настоящему изобретению, распознающего аминокислотную последовательность, представленную в SEQ ID NO:3, или меченного биотином коммерчески доступного поликлонального антитела к CXCL1 человека.
На фигуре 5 представлен график, показывающий результаты определения CXCL1 человека в буфере посредством иммобилизации 5 типов антител (IgG1-1, IgG1-3, IgG1-10, IgG1-14 и IgG2b-1) по настоящему изобретению и коммерчески доступного антитела, а затем осуществления “сэндвич” способа ELISA с использованием меченного биотином поликлонального антитела к CXCL1 человека.
На фигуре 6 представлен график, показывающий результаты определения CXCL1 человека в плазме крови посредством иммобилизации 5 типов антител по настоящему изобретению и коммерчески доступного антитела, а затем осуществления “сэндвич” способа ELISA с использованием меченного биотином поликлонального антитела к CXCL1 человека.
На фигуре 7 представлен график, показывающий результаты определения CXCL1 человека в моче посредством иммобилизации 5 типов антител по настоящему изобретению и коммерчески доступного антитела, а затем осуществления “сэндвич” способа ELISA с использованием меченного биотином поликлонального антитела к CXCL1 человека.
На фигуре 8 представлено графическое изображение (1) подавления способности к инвазии у злокачественных клеток мочевого пузыря 5 типами антител по настоящему изобретению и коммерчески доступным антителом.
На фигуре 9 представлено графическое изображение (2) подавления способности к инвазии у злокачественных клеток мочевого пузыря 4 типами антител по настоящему изобретению и коммерчески доступного антитела.
СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее варианты осуществления изобретения будут описаны более подробно.
1. Моноклональное антитело к CXCL1 человека и его фрагмент
Используемый в настоящем описании термин “CXCL1 человека” относится к белку или его природному мутанту, содержащему аминокислотную последовательность в соответствии с NM_001511 в Genbank. Термин “природный мутант” относится к мутанту, существующему в природе. Примеры такого мутанта включают мутант, содержащий аминокислотную последовательность с делецией, заменой, добавлением или инсерцией одной или нескольких аминокислот в указанной выше аминокислотной последовательности CXCL1 человека, и мутант, идентичность аминокислотных последовательностей которого составляет 95% или более, предпочтительно 98% или более и более предпочтительно 99% или более с указанной выше аминокислотной последовательностью CXCL1 человека. В настоящем описании термин “идентичность” относится к проценту (%) общего количества аминокислотных остатков рассматриваемой аминокислотной последовательности, которые являются идентичными аминокислотным остаткам аминокислотной последовательности CXCL1 человека, где выравнивание двух аминокислотных последовательностей проводили таким образом, чтобы достичь максимально возможной степени совпадения между ними. В этом случае, выравнивание последовательностей можно выполнять, вводя или не вводя пропуски, и при расчете процента учитывают количество введенных пропусков. Также, термин «несколько» относится к целому числу между 2 и 10, такому числу, как целое число между 2 и 7, 2 и 5, 2 и 4, и 2 и 3. Конкретные примеры природного мутанта включают мутанты, созданные на основе полиморфизма, такого как SNP (однонуклеотидный полиморфизм), и мутанты, полученные при сплайсинге. Указанная выше замена предпочтительно представляет собой консервативную аминокислотную замену. В случае если замена является консервативной аминокислотной заменой, мутант, полученный в результате консервативной аминокислотной замены, может иметь структуру или свойства, по существу эквивалентные структуре и свойствам CXCL1 человека, который имеет указанную выше аминокислотную последовательность. В качестве консервативных аминокислот известны, например, неполярные аминокислоты (глицин, аланин, фенилаланин, валин, лейцин, изолейцин, метионин, пролин и триптофан) и полярные аминокислоты (аминокислоты, отличные от неполярных аминокислот), заряженные аминокислоты (кислые аминокислоты (аспарагиновая кислота и глутаминовая кислота) и основные аминокислоты (аргинин, гистидин и лизин)) и незаряженные аминокислоты (аминокислоты, отличные от заряженных аминокислот), ароматические аминокислоты (фенилаланин, триптофан и тирозин), разветвленные аминокислоты (лейцин, изолейцин и валин) и алифатические аминокислоты (глицин, аланин, лейцин, изолейцин и валин).
Используемый в настоящем описании термин “моноклональное антитело” относится к полипептиду, содержащему каркасную область (FR), полученную из иммуноглобулина или его фрагмента, и определяющую комплементарность область (CDR) и обладающему способностью к специфическому связыванию и распознаванию антигена. Таким образом, в настоящем изобретении термин “моноклональное антитело к CXCL1 человека” относится к полипептиду, способному к специфичному связыванию CXCL1 человека или его фрагмента и специфичному распознаванию CXCL1 человека или его фрагмента. Термин “специфичное связывание” относится к связыванию только антигена-мишени (CXCL1 человека или его фрагмента в настоящем изобретении).
Типичная молекула иммуноглобулина состоит из тетрамера, в котором две части, каждая из которой состоит из двух полипептидных цепей, обозначаемых как тяжелая цепь и легкая цепь, соединяются друг с другом посредством дисульфидной связи. Тяжелая цепь на N-конце содержит вариабельную область тяжелой цепи (VH) и на С-конце содержит константную область тяжелой цепи (CH). Легкая цепь на N-конце содержит вариабельную область легкой цепи (VL) и на C-конце содержит константную область легкой цепи (CL). Среди этих областей, особенно важными являются VH и VL, поскольку они вовлечены в специфичное связывание антитела. Каждая VH и VL содержит приблизительно 110 аминокислотных остатков, где представлены три определяющие комплементарность области (CDR1, CDR2 и CDR3), непосредственно вовлеченные в специфичное связывание антигена, и четыре каркасные области (FR1, FR2, FR3 и FR4), которые функционируют как каркасные структуры вариабельных областей. Известно, что определяющая комплементарность область формирует конформационную комплементарность с молекулой антигена и определяет специфичность соответствующего антитела (E. A. Kabat et al., 1991, Sequences of proteins of immunological interest, Vol. 1, eds. 5, опубликовано NIH). Тогда как в антителах одинаковых типов аминокислотные последовательности константных областей остаются почти неизменными, аминокислотные последовательности определяющих комплементарность областей в антителах являются высоковариабельными. Таким образом, определяющие комплементарность области также обозначают как гипервариабельные области. В вариабельной области такие определяющие комплементарность области (CDR) и каркасные области располагаются по направлению от аминоконца к карбоксиконцу в порядке FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. VL и VH образуют друг с другом димер таким образом, что формируется антигенсвязывающий участок в пределах молекулы иммуноглобулина. Что касается иммуноглобулинов, то известны классы IgG, IgM, IgA, IgE и IgD. Антитело по настоящему изобретению может принадлежать любому из этих классов и предпочтительно представляет собой IgG.
Антитело, используемое в настоящем изобретении, можно получать от любого животного, включая птиц и млекопитающих. Примеры такого животного или птицы включают мышей, крыс, морских свинок, кроликов, коз, ослов, овец, верблюдов, лошадей, кур и людей. Кроме того, “моноклональное антитело” в настоящем изобретении может быть синтезировано химически или синтезировано с использованием способа рекомбинантной ДНК. Например, рекомбинантные антитела, такие как химерные антитела и гуманизированные антитела, также включены в настоящее изобретение.
Термин “химерное антитело” относится к антителу, полученному путем замены константной области антитела константной областью другого антитела. Пример такого антитела представляет собой антитело, полученное путем замены константной области моноклонального антитела мыши к CXCL1 человека константной областью антитела человека. Более конкретный пример такого антитела представляет собой антитело, в котором VL содержит любую аминокислотную последовательность, представленную в SEQ ID NO:10, 18, 26, 34 или 42 VL моноклонального антитела мыши к CXCL1 человека, CL содержит аминокислотную последовательность CL произвольного антитела человека, и/или VH содержит аминокислотную последовательность, представленную в SEQ ID NO:11, 19, 27, 35 или 43 VH моноклонального антитела мыши к CXCL1 человека, и CH содержит аминокислотную последовательность CH произвольного антитела человека.
Термин “гуманизированное антитело” относится к мозаичному антителу, полученному путем искусственного комбинирования антитела, т.е. участка CDR с FR, происходящего, как правило, из не принадлежащего человеку антитела, такого как антитело мыши, и константной области антитела человека. Пример такого антитела представляет собой антитело, полученное комбинированием каждого CDR моноклонального антитела мыши к CXCL1 человека с каждой FR и константной областью произвольного антитела человека. Участки CDR в вариабельной области являются, в основном, ответственными за антигенсвязывающую специфичность антитела. Таким образом, если получают, как описано выше, рекомбинантное антитело, которое обладает характеристиками связывания, аналогичными характеристикам связывания антитела, то получение полной аминокислотной последовательности антитела не является необходимым. В частности, при использовании существующего способа рекомбинантной ДНК получают мозаичное антитело, заменяя последовательность ДНК, кодирующую каждый участок CDR, происходящий из антитела, на последовательность ДНК, кодирующую соответствующий участок CDR, происходящий из антитела человека, и затем подвергают экспрессии. Таким образом, можно получать рекомбинантное антитело, которое имитирует характеристики антитела. Такой способ обозначают как получение антитела с пересаженным CDR (Nature, 1986, Vol. 321, 522). Кроме того, если для обнаружения CXCL1 человека или его фрагмента используют антитело к CXCL1 человека или его фрагмент по настоящему изобретению, не всегда необходимо, чтобы антитело представляло собой гуманизированное антитело. При использовании способа пересаживания в антителах FR и константная область могут происходить из антитела любого, не являющегося человеком животного.
Кроме того, “антитело” в настоящем изобретении может также представлять собой антитело с множественной специфичностью. Термин “антитело с множественной специфичностью” относится к поливалентному антителу, которое представляет собой специфичное антитело, имеющее множество антигенсвязывающих участков в пределах одной молекулы, в силу чего эти антигенсвязывающие участки связывают различные эпитопы. Примером такого поливалентного антитела является биспецифическое антитело, имеющее два антигенсвязывающих участка, такое как IgG, где два антигенсвязывающих участка связывают различные эпитопы. В настоящем изобретении такое антитело с множественной специфичностью является предпочтительным, в котором антигенсвязывающие участки способны к связыванию различных эпитопов, представленных на CXCL1 человека. Эти антитела можно получать известными способами, используя метод рекомбинантной ДНК, искусственно внося изменения в IgG или подобный.
Используемый в настоящем описании термин “его фрагмент” в выражении “моноклональное антитело или его фрагмент” относится к частичной области антитела и конкретно относится к полипептидной цепи или ее комплексу с активностью, по существу эквивалентной антигенспецифичной активности связывания антитела. Примеры такого фрагмента включают часть антитела, содержащую по меньшей мере один указанный выше антигенсвязывающий участок и, конкретно, полипептидную цепь или ее комплекс, по меньшей мере с одной VL и по меньшей мере с одной VH. Конкретные примеры такой полипептидной цепи или ее комплекса включают множество достаточно охарактеризованных фрагментов антител и тому подобное, полученных посредством расщепления иммуноглобулина различными пептидазами. Более конкретные примеры таких фрагментов антител включают Fab, F(ab')2 и Fab'. Fab представляет собой фрагмент, полученный расщеплением молекулы IgG папаином, который выполняет расщепление в участке, расположенном ближе к N-концевой стороне, чем дисульфидная связь в шарнирной области. Fab состоит из полипептида, содержащего VH и CH1, который, из трех доменов (CH1, CH2 и CH3), составляющих СH, непосредственно граничит с VH, и легкую цепь. F(ab')2 представляет собой димер Fab', который получен посредством расщепления молекулы IgG пепсином в участке, расположенном ближе к C-концевой стороне, чем дисульфидная связь в шарнирной области. Fab' имеет структуру, по существу эквивалентную структуре Fab, хотя его цепь H является немного более длинной, чем цепь H Fab, поскольку она содержит шарнирную часть. (Fundamental Immunology, Paul ed., 3d ed., 1993). Fab' может быть получен восстановлением F(ab')2 в мягких условиях и последующим расщеплением дисульфидной связи в шарнирной области. Все эти фрагменты антител содержат антигенсвязывающие участки, так что они способны специфично связываться с антигенами (т.е. с CXCL1 человека или его фрагментом по настоящему изобретению).
Указанный выше “его фрагмент” по настоящему изобретению можно синтезировать химически или синтезировать, используя способ рекомбинантной ДНК. Примером такого фрагмента является фрагмент антитела, вновь синтезированного с использованием способа рекомбинантной ДНК. Конкретные примеры такого фрагмента включают, но не ограничиваются ими, молекулу мономерного полипептида, полученную искусственным связыванием одного или нескольких VL и одного или нескольких VH антитела по настоящему изобретению, посредством линкерного пептида или подобного, имеющего подходящую длину и последовательность, и многомерный полипептид. Примеры такого полипептида включают одноцепочечный Fv (scFv: одноцепочечный фрагмент вариабельной области) (см. каталог Pierce and Handbook, 1994-1995, Pierce Chemical co., Rockford, IL) и синтетические антитела, такие как диатело, триатело и тетратело. В молекуле иммуноглобулина VL и VH, как правило, отдельно располагаются на различных полипептидных цепях (легкая цепь и тяжелая цепь). Одноцепочечный Fv представляет собой синтетический фрагмент антитела, имеющий структуру, в которой эти вариабельные области соединены гибким линкером, имеющим достаточную длину, и связанные области располагаются в одной полипептидной цепи. В пределах одноцепочечного Fv обе вариабельные области могут объединяться друг с другом с образованием единого функционального антигенсвязывающего участка. Одноцепочечный Fv можно получить, используя известные способы, включением рекомбинантной ДНК, кодирующей одноцепочечный Fv, в фаговый геном и последующим осуществлением экспрессии ДНК. Диатело представляет собой молекулу, имеющую структуру, основанную на димерной структуре одноцепочечного Fv (Holliger et al., 1993, Proc. Natl. Acad. Sci. U.S.A., 90: 6444-6448). Например, если длина указанного выше линкера короче, чем приблизительно 12 аминокислотных остатков, то два вариабельных участка в пределах одноцепочечного Fv не могут подвергаться самообъединению. Однако два вариабельных участка являются причиной образования диатела, и конкретно, наличие двух одноцепочечных Fv является причиной для их взаимодействия друг с другом, включая объединение VL одной цепи Fv и VH другой цепи Fv. Следовательно, могут быть образованы два функциональных антигенсвязывающих участка (Marvin et al., 2005, Acta Pharmacol. Sin., 26: 649-658). Кроме того, к C-концу одноцепочечного Fv добавляют остаток цистеина, так что между двумя цепями Fv может быть образована дисульфидная связь и, тем самым, становится возможным создание стабильного диатела. (Olafsen et al, 2004, Prot. Engr. Des. Sel., 17: 21-27). Как описано выше, диатело представляет собой двухвалентный фрагмент антитела. Однако для каждого антигенсвязывающего участка не является необходимым связывание одних и тех же эпитопов, и они могут обладать биспецифичностью, т.е. антигенсвязывающие участки распознают и специфически связываются с различными эпитопами. Например, один антигенсвязывающий участок может включать VL, которая содержит CDR, содержащие аминокислотные последовательности, представленные в SEQ ID NO:36, 37 и 38 (соответствующие CDR1, CDR2 и CDR3, соответственно), и VH, которая содержит CDR, содержащие аминокислотные последовательности, представленные в SEQ ID NO:39, 40 и 41 (соответствующие CDR1, CDR2 и CDR3, соответственно). Другой антигенсвязывающий участок может включать VL, которая содержит CDR, содержащие аминокислотные последовательности, представленные в SEQ ID NO:28, 29 и 30 (соответствующие CDR1, CDR2 и CDR3, соответственно), и VH, которая содержит CDR, содержащие аминокислотные последовательности, представленные в SEQ ID NO:31, 32 и 33 (соответствующие CDR1, CDR2 и CDR3, соответственно). Триатело и тетратело имеют структуру тримера и тетрамера, соответственно, основанную на структуре одноцепочечного Fv аналогичным диателу образом. Триатело и тетратело представляют собой, соответственно, трехвалентный фрагмент антитела и четырехвалентный фрагмент антитела или могут представлять собой антитела с множественной специфичностью.
Кроме того, примеры указанного выше “его фрагмента” включают фрагменты антител, которые идентифицируют, используя библиотеки фаговых дисплеев (например, см. McCafferty et al., 1990, Nature, Vol. 348, 522-554), и которые обладают антигенсвязывающей способностью. Кроме того, см. также, например, Kuby, J., Immunology, 3rd ed., 1998, W. H. Freeman & Co., New York.
Настоящее изобретение относится к антителу или его фрагменту с аминокислотными последовательностями, составляющими вариабельные области с желаемой активностью связывания с CXCL1 человека и его CDR. Конкретно, настоящее изобретение относится к антителу или его фрагменту, содержащему вариабельную область иммуноглобулина, содержащую аминокислотную последовательность, представленную в любой из SEQ ID NO:4-43.
В антителе или его фрагменте по настоящему изобретению CDR1, CDR2 и CDR3 в составе легких цепей могут содержать аминокислотные последовательности, представленные, соответственно, в SEQ ID NO:4, 5 и 6, и CDR1, CDR2 и CDR3 в составе тяжелых цепей могут содержать аминокислотные последовательности, представленные, соответственно, в SEQ ID NO:7, 8 и 9.
Также, в антителе или его фрагменте по настоящему изобретению VL и VH могут содержать аминокислотные последовательности, представленные, соответственно, в SEQ ID NO:10 и 11.
В антителе или его фрагменте по настоящему изобретению CDR1, CDR2 и CDR3 в составе легких цепей могут содержать аминокислотные последовательности, представленные, соответственно, в SEQ ID NO:12, 13 и 14, и CDR1, CDR2 и CDR3 в составе тяжелых цепей могут содержать аминокислотные последовательности, представленные, соответственно, в SEQ ID NO:15, 16 и 17.
Также, в антителе или его фрагменте по настоящему изобретению VL и VH могут содержать аминокислотные последовательности, представленные, соответственно, в SEQ ID NO:18 и 19.
В антителе или его фрагменте по настоящему изобретению CDR1, CDR2 и CDR3 в составе легких цепей могут содержать аминокислотные последовательности, представленные, соответственно, в SEQ ID NO:20, 21 и 22, и CDR1, CDR2 и CDR3 в составе тяжелых цепей могут содержать аминокислотные последовательности, представленные, соответственно, в SEQ ID NO:23, 24 и 25.
Также, в антителе или его фрагменте по настоящему изобретению VL и VH могут содержать аминокислотные последовательности, представленные, соответственно, в SEQ ID NO:26 и 27.
В антителе или его фрагменте по настоящему изобретению CDR1, CDR2 и CDR3 в составе легких цепей могут содержать аминокислотные последовательности, представленные, соответственно, в SEQ ID NO:28, 29 и 30, и CDR1, CDR2 и CDR3 в составе тяжелых цепей могут содержать аминокислотные последовательности, представленные, соответственно, в SEQ ID NO:31, 32 и 33.
Также, в антителе или его фрагменте по настоящему изобретению VL и VH могут содержать аминокислотные последовательности, представленные, соответственно, в SEQ ID NO:34 и 35.
В антителе или его фрагменте по настоящему изобретению CDR1, CDR2 и CDR3 в составе легких цепей могут содержать аминокислотные последовательности, представленные, соответственно, в SEQ ID NO:36, 37 и 38, и CDR1, CDR2 и CDR3 в составе тяжелых цепей могут содержать аминокислотные последовательности, представленные, соответственно, в SEQ ID NO:39, 40 и 41.
Также, в антителе или его фрагменте по настоящему изобретению VL и VH могут содержать аминокислотные последовательности, представленные, соответственно, в SEQ ID NO:42 и 43.
Антитело или его фрагмент по настоящему изобретению можно модифицировать. Термин “модифицированный или модификация”, используемый в настоящем описании, относится как к функциональной модификации, необходимой для антитела или его фрагмента по настоящему изобретению для обеспечения активности специфического связывания с CXCL1 человека (например, гликозилирование), так и к модификации мечения, необходимой для определения антитела или его фрагмента по настоящему изобретению. Примеры упомянутых выше меток для антитела включают флуоресцентные красители (FITC, родамин, Texas red, Cy3 и Cy5), флуоресцентные белки (например, PE, APC и GFP), ферменты (например, пероксидаза хрена, щелочная фосфатаза и глюкозооксидаза) и биотин или (стрепт)авидин. Кроме того, в процесс гликозилирования антитела по настоящему изобретению можно вносить изменения, необходимые для достижения более высокой аффинности антитела к антигену-мишени. Такое изменение может быть достигнуто, например, изменением одного или нескольких участков гликозилирования в пределах последовательности антитела. Более конкретно, например, одну или несколько аминокислотных замен вводят в аминокислотную последовательность, содержащую один или несколько участков гликозилирования в пределах FR, с тем, чтобы удалить участки гликозилирования, таким образом можно осуществлять дегликозилирование в этих участках. Такое дегликозилирование является эффективным для увеличения аффинности антитела к антигену (патент США № 5714350 и патент США № 6350861).
Моноклональные антитела или их фрагменты, которые используют в способе измерения по настоящему изобретению, перед использованием предпочтительно верифицируют в отношении их перекрестной реактивности относительно других антигенов (белки или их фрагменты) для подтверждения их активности специфичного связывания с CXCL1 человека или его фрагментом. Что касается антитела или его фрагмента по настоящему изобретению, примеры антигенов, для которых должно быть подтверждено наличие перекрестной реактивности, включают белки, принадлежащие к семейству CXC, и конкретно, белок CXCL2 человека и белок CXCL3 человека, которые имеют структурную аналогию с CXCL1 человека. Также, в дополнение к указанным выше белкам, другие белки, имеющие структуры, частично общие со структурой CXCL1 человека, являются более предпочтительными, как предварительно подтверждено в отношении их перекрестной реактивности с антителами или их фрагментами, для использования в способе измерения по настоящему изобретению. Для подтверждения наличия перекрестной реактивности можно применять способ ELISA, используя в качестве антигена CXCL1 человека. В центре реакции антитела, подлежащего тестированию на его специфичность реакции, т.е. моноклонального антитела к CXCL1 человека и его фрагмента, с CXCL1 человека, другой белок-антиген, перекрестную реактивность которого необходимо подтвердить, также одновременно присутствует в реакционном центре. Наблюдая их конкуренцию, можно подтвердить наличие перекрестной реактивности. Такой способ подтверждения перекрестной реактивности, с использованием принципа конкурентного ингибирования, не требует получения реакционной системы для всех антигенов, так что можно быстро выполнить скрининг.
2. Способ получения моноклонального антитела и гибридомы
Моноклональное антитело к CXCL1 человека по настоящему изобретению или гибридому, продуцирующую антитело, можно получить следующим способом, но не ограничиваясь им. Антитело и гибридому также можно получить любыми другими известными в данной области способами.
A. Способ получения моноклонального антитела к CXCL1 человека
Моноклональное антитело к CXCL1 человека, специфично связывающееся с частичной областью аминокислотной последовательности, представленной в любой из SEQ ID NO:1-3 в аминокислотной последовательности, составляющей CXCL1 человека, получают:
способом, включающим получение моноклонального антитела с использованием в качестве иммуногена полноразмерного CXCL1 человека, а затем скринингом в направлении специфичности связывания антитела с частичной областью аминокислотной последовательности из любой SEQ ID NO:1-3; или
способом, включающим предварительное получение моноклонального антитела с использованием в качестве иммуногена частичной последовательности CXCL1 человека, которая представлена в SEQ ID NO:1, 2 или 3.
A1. Получение CXCL1 человека
Сначала получают CXCL1 человека, который используют в качестве иммуногена (антигена). CXCL1 человека может представлять собой любой тип CXCL1 человека, такой как природный CXCL1 человека, рекомбинантный CXCL1 человека или CXCL1 человека, полученный посредством химического синтеза полноразмерной или частичной аминокислотной последовательности, такого как пептидный синтез.
Природный CXCL1 человека можно получать из образцов, принадлежащих человеку, включающих жидкость организма человека, такую как кровь или моча, или из супернатантов культур на основе клеток человека известными способами разделения и очистки, такими как гель-хроматография, ионообменная хроматография и аффинная хроматография.
Рекомбинантный CXCL1 человека можно получать из клеток известными способами разделения и/или очистки белка, после введения ДНК, кодирующей белок, в микроорганизмы, в клетки насекомых или в клетки животного, с последующей экспрессией ДНК.
Синтетический CXCL1 человека можно синтезировать способами, известными в области техники, такими как способ твердофазного пептидного синтеза, используя, например, общедоступную информацию об аминокислотной последовательности CXCL человека. В частности, кДНК последовательность CXCL1 человека описана в GenBank под номером доступа X12510. Белок-носитель, такой как KLH (гемоцианин морского блюдца), OVA (овальбумин) или БСА (бычий сывороточный альбумин), можно присоединять к синтетическому CXCL1 человека и затем можно использовать полученный в результате продукт.
Кроме того, если в качестве иммуногена используют частичную последовательность CXCL1 человека, представленную в любой из SEQ ID NO:1-3, то иммуноген может быть природным, рекомбинантным или химически синтезированным иммуногеном, аналогично случаю иммунизации полноразмерной последовательностью.
Например, если в качестве иммуногена используют частичную последовательность природного CXCL1 человека, то первоначально очищенный CXCL1 человека обрабатывают соответствующей протеазой, такой как трипсин, и затем выделяют фракции белка, составляющие пики, и фракционируют, используя колонку с обращенной фазой. Определяют аминокислотную последовательность пептида, содержащегося в каждом фракционированном пике, используя масс-спектрометр. В качестве иммуногена можно использовать частичную последовательность, представленную в SEQ ID NO:1, 2 или 3, или пик, который является частью частичной последовательности.
Также, если в качестве иммуногена используют частичную аминокислотную последовательность рекомбинантного CXCL1 человека, то частичные аминокислотные последовательности, представленные в SEQ ID NO:1-3 в указанной выше последовательности ДНК, кодирующей CXCL1 человека, или части последовательности ДНК, кодирующей частичные аминокислотные последовательности, встраивают в экспрессирующий вектор способом, аналогичным способу получения полноразмерного CXCL1 человека, и затем вектор вводят в различные клетки. Таким образом, можно получать рекомбинантный CXCL1 человека, содержащий частичные аминокислотные последовательности, представленные в SEQ ID NO:1-3, или их части.
Получение частичных аминокислотных последовательностей рекомбинантного CXCL1 человека, которые представлены в SEQ ID NO:1-3 (далее в настоящем документе обозначаемые как частичные последовательности CXCL1 человека), подробно описывается в настоящем документе.
(a) Получение полинуклеотида, кодирующего рекомбинантную частичную последовательность CXCL1 человека
Способ получения полинуклеотида подробно описан в примере 1 ниже, так что его не указывают в данном разделе настоящего документа.
В качестве вектора, который используют для экспрессии частичной последовательности CXCL1 человека, можно использовать фаг или плазмиду, которая способна автономно реплицироваться в микроорганизме-хозяине. Например, примеры плазмиды включают плазмиды, полученные из Escherichia coli (например, pET16b, pGEX6p, pUC118, pUC119, pUC18 и pUC19), плазмиды, полученные из Bacillus subtilis (например, pUB11O и pTP5), и плазмиды, полученные из дрожжей (например, Yep13, YEp24 и YCp50). Примеры фага включают фаги λ (например, λ gt11 и λ ZAP). Кроме того, в качестве векторов также можно использовать вирусы животных, такие как вирус вакцинии, и вирусы насекомых, такие как бакуловирус.
Пример способа встраивания полинуклеотида, кодирующего частичную последовательность CXCL1 человека, в указанный выше вектор включает расщепление очищенного полинуклеотида подходящим ферментом рестрикции и дальнейшее лигирование, с использованием ДНК лигазы или т.п., полученного продукта в вектор, подвергнутый расщеплению подходящим ферментом рестрикции.
(b) Введение экспрессирующего вектора с частичной последовательностью CXCL1 человека в хозяина
Полученный экспрессирующий вектор с частичной последовательностью CXCL1 человека встраивают в хозяина, который может экспрессировать белок CXCL1 человека, и таким образом получают трансформант, экспрессирующий частичную последовательность CXCL1 человека. Примеры хозяина, который используется в настоящем изобретении, конкретно не ограничены, при условии, что хозяин является подходящим для используемого вектора и может экспрессировать CXCL1 человека. Например, соответствующим образом используют бактерии (например, Escherichia coli и Bacillus subtilis), дрожжи, клетки насекомых, клетки животных (клетки COS и клетки CHO (Journal of immunology, 1998, Vol. 160, 3393-3402)) и т.п. Примеры способа встраивания указанного выше вектора в бактерии конкретно не ограничены, при условии, что способ представляет собой известный способ встраивания вектора в бактерии. Примеры такого способа включают способ теплового шока, способ с использованием ионов кальция и способ электропорации. Все эти способы являются известными в данной области и описаны в различных документах. Например, см. Sambrook, J. et al., 1989, Molecular Cloning: A Laboratory Manual Second Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York. Кроме того, для трансформации клеток животных предпочтительно использовать способ с липофектином (PNAS, 1989, Vol. 86, 6077), (PNAS, 1987, Vol. 84, 7413), способ электропорации, способ с фосфатом кальция (Virology, 1973, Vol. 52, 456-467), способ с DEAE-декстраном или т.п.
Если в качестве хозяев используют бактерии, то экспрессирующий вектор с частичной последовательностью CXCL1 человека предпочтительно автономно реплицируется в клетках бактерии и предпочтительно входит в состав последовательности промотора, последовательности, связывающей рибосомы, последовательности ДНК, кодирующей частичную последовательность CXCL1 человека, и последовательности терминации транскрипции. Кроме того, в экспрессирующем векторе может также содержаться ген, кодирующий регулятор, который контролирует промотор. Любой промотор может быть использован в настоящем изобретении, при условии, что он может функционировать в клетках хозяина, например, Escherichia coli.
Если в качестве хозяина используют эукариотическую клетку, такую как клетка дрожжей, клетка животного или клетка насекомого, то трансформант, экспрессирующий частичную последовательность CXCL1 человека, может быть получен аналогично способам, известным в данной области. Если необходимо, в дополнение к последовательности промотора и последовательности ДНК, кодирующей частичную последовательность CXCL1 человека, к экспрессирующему вектору с частичной последовательностью CXCL1 человека, который используют в такой эукариотической клетке, также можно присоединять цис-элемент, такой как энхансер, сигнал сплайсинга (например, донорный участок, акцепторный участок и участок точки ветвления), дополнительный сигнал polyA, последовательность селективного маркера, последовательность, связывающая рибосому (SD последовательность), и тому подобное.
(c) Культура трансформанта и экспрессия рекомбинантной частичной последовательности CXCL1 человека
Далее, указанный выше трансформант культивируют. Трансформант культивируют в среде согласно способу, который обычно используют для культивирования клеток-хозяев. Например, если в качестве хозяина используют микроорганизм, то примеры среды, которую используют в настоящем изобретении, конкретно не ограничены, при условии, что среда содержит источники углерода, источники азота, неорганические соли и тому подобное, способные усваиваться микроорганизмами, и способствует росту и репликации. Можно использовать либо природную, либо синтетическую среду. Более конкретный пример такой среды представляет собой, но не ограничивается этим, среду LB. Кроме того, для селективной культуры трансформанта, если необходимо, в среду можно добавлять антибиотики, такие как ампициллин или тетрациклин. Культивирование, как правило, выполняют в аэробных условиях, таких как аэрация и перемешивание культуры приблизительно при 37°C в течение 6-24 часов. Во время периода культивирования pH предпочтительно поддерживают в области нейтрального рН. До необходимого значения pH доводят, используя неорганическую или органическую кислоту, раствор щелочи или т.п. Если трансформант представляет собой клетку животного, такую как клетка CHO, то клетки-хозяева высевают в DMEM (Gibco) из расчета 1×105 клеток/мл и затем культивируют при 37°C, используя инкубатор с 5% CO2. В процессе культивирования в среду можно добавлять антибиотики, если необходимо, такие как ампициллин или тетрациклин.
Если указанный выше экспрессирующий вектор с частичной последовательностью CXCL1 человека представляет собой индуцирующий экспрессию белка вектор, содержащий систему контроля экспрессии белка (например, ген-репрессор и оператор, при условии, что хозяином является микроорганизм), то указанный выше трансформант должен быть подвергнут предварительной обработке, чтобы индуцировать экспрессию частичной последовательности CXCL1 человека. Способ индукции экспрессии различается в зависимости от системы контроля экспрессии белка, содержащейся в векторе. Таким образом, для каждой системы можно проводить обработку, подходящую для индукции экспрессии. Например, система контроля экспрессии белка, которая обычно наиболее часто используется для индуцирующего экспрессию белка вектора, при использовании бактерии в качестве хозяина, представляет собой систему, содержащую ген-репрессор lac и оператор lac. Эта система может индуцировать экспрессию под воздействием IPTG (изопропил-1-тио-β-D-галактозид). Для трансформанта, который имеет содержащий эту систему вектор, экспрессирующий CXCL1 человека, подходящее количество IPTG (например, в конечной концентрации 1 мМ) добавляют в среду для экспрессии целевого CXCL1 человека.
(d) Выделение и/или получение частичного фрагмента рекомбинантного CXCL1 человека
После культивирования, когда частичный фрагмент CXCL1 человека продуцируется в микроорганизмах или клетках, микроорганизмы или клетки собирают и затем подвергают разрушению, с тем, чтобы можно было экстрагировать белок. Также, если частичный фрагмент CXCL1 человека продуцируется во внешнюю среду микроорганизмов или клеток, то культуральную среду используют, не подвергая дополнительной обработке, или микроорганизмы или клетки извлекают из культуральной среды путем центрифугирования или т.п. и затем можно использовать супернатант. Затем, независимо или в комбинации, соответствующим образом используют общие способы очистки белка, такие как осаждение сульфатом аммония, гель-хроматография, ионообменная хроматография и аффинная хроматография, с тем, чтобы можно было выделить и очистить CXCL1 человека из культуры клеток. Независимо от способа получения, наличие частичного фрагмента CXCL1 человека можно подтвердить SDS-электрофорезом в полиакриламидном геле или т.п.
A2. Получение клеток, продуцирующих антитело к частичной последовательности CXCL1 человека
Иммуноген, полученный в A1, растворяют в буфере, с тем, чтобы получить раствор иммуногена. На этой стадии, если необходимо, может быть добавлен адъювант для более эффективной иммунизации. Примеры такого адъюванта включают коммерчески доступный полный адъювант Фрейнда (FCA) и неполный адъювант Фрейнда (FIA). Адъюванты могут быть использованы независимо или смешанными, а затем использованы.
Затем, указанный выше полученный раствор иммуногена вводят млекопитающим, таким как крысы, мыши (например, инбредные мыши линии BALB/c) или кролики, для иммунизации. Примеры способа введения иммуногена включают, но не ограничиваются ими, подкожные инъекции с использованием FIA или FCA, интраперитонеальную инъекцию с использованием FIA и внутривенную инъекцию с использованием раствора хлорида натрия в концентрации 0,15 моль/л. Однократную дозу иммуногена определяют соответствующим образом в зависимости от вида животного, подлежащего иммунизации, пути введения и тому подобное, в диапазоне от приблизительно 30 мкг до 200 мкг на животное. Кроме того, интервалы между дозами иммунизации конкретно не ограничивают. После первичной иммунизации последующую иммунизацию осуществляют в диапазоне интервалов от нескольких суток до нескольких недель, предпочтительно в диапазоне от 1 до 4 недель, с последующими 2-6 бустер-инъекциями и предпочтительно 3-4 бустер-инъекциями. После первичной иммунизации в сыворотке иммунизированного животного способом ELISA (Enzyme-Linked Immuno Sorbent Assay (твердофазный иммуноферментный анализ)) или т.п. измеряют титр антитела. Если титр антитела достигает плато, иммуноген внутривенно или интраперитонеально инъецируют для заключительной иммунизации. На 2-5 сутки после заключительной иммунизации, предпочтительно на 3 сутки после заключительной иммунизации, собирают продуцирующие антитела клетки.
B. Способ получения гибридомы, продуцирующей моноклональное антитело к частичной последовательности CXCL1 человека
B1. Получение продуцирующих антитела клеток от иммунизированного животного и слияние клеток
Продуцирующие антитела клетки, полученные от иммунизированного животного, подвергают слиянию с миеломными клетками, таким образом, могут быть получены гибридомы, продуцирующие специфично распознающее моноклональное антитело к частичной последовательности CXCL1 человека. Примеры продуцирующих антитела клеток включают клетки селезенки, клетки лимфоузла и клетки периферической крови. Предпочтительными являются клетки селезенки или клетки региональных лимфоузлов. В качестве миеломных клеток, подлежащих слиянию с продуцирующими антитела клетками, как правило, можно использовать доступные устойчивые клеточные линии, полученные из клеток мышей или т.п. Клеточные линии, которые предпочтительно используют в настоящем изобретении, обладают селективностью по отношению к лекарственному средству, и если они не подверглись слиянию, то не способны к выживанию в селективной среде HAT (содержащей гипоксантин, аминоптерин и тимидин), а способны к росту, только будучи слитыми с продуцирующими антитела клетками. Кроме того, устойчивые клеточные линии, которые предпочтительно используют в настоящем изобретении, получают из клеток животных одинаковых видов или линий иммунизированных животных. Конкретные примеры миеломных клеток включают клеточные линии, происходящие от мышей BALB/c, дефектные по гипоксантин-гуанин-фосфорибозилтрансферазе (HGPRT), такие как P3X62-Ag.8 (ATCCTIB9), P3X63-Ag.8. U1 (JCRB9085), P3/NSI/1-Ag4-1 (JCRB0009), P3×63Ag8. 653(JCRB0028) и Sp2/0-Ag14 (JCRB0029).
Для клеточного слияния миеломных клеток с продуцирующими антитела клетками в среде для культивирования клеток животных, такой как бессывороточная среда DMEM или RPMI1640, смешивают продуцирующие антитела клетки и миеломные клетки в соотношении в диапазоне от приблизительно 1:1 до 20:1, с последующей реакцией слияния в присутствии ускорителя клеточного слияния. В качестве ускорителя клеточного слияния можно использовать полиэтиленгликоль или т.п. со средней молекулярной массой в диапазоне от 1500 до 4000 Да в концентрации приблизительно 10%-80%. Также, если необходимо, в комбинации можно использовать вспомогательный ингредиент, такой как диметилсульфоксид, для повышения эффективности слияния. Кроме того, продуцирующие антитела клетки можно подвергать слиянию с миеломными клетками, используя коммерчески доступный аппарат для слияния клеток, с использованием электростимуляции (например, электропорации) (Nature, 1977, Vol. 266, 550-552).
B2. Отбор целевой гибридомы
В качестве способа для отбора из клеток гибридом, продуцирующих целевое моноклональное антитело к частичной последовательности CXCL1 человека, после процесса клеточного слияния, например, клеточную суспензию соответствующим образом разводят средой RPMI1640, содержащей эмбриональную телячью сыворотку, или тому подобное, клетки высевают в 96-луночный планшет для микротитрования из расчета приблизительно 2×106 клеток/лунку, в каждую лунку добавляют селективную среду и затем клетки культивируют соответствующим образом до замены селективной среды. Температура при культивировании находится в пределах от 20°C до 40°C и предпочтительно составляет примерно 37°C. Если миеломные клетки представляют собой клеточную линию, дефектную по HGPRT или тимидинкиназе (TK), то только гибридомы продуцирующих антитела клеток и миеломные клетки могут избирательно расти и осуществлять пролиферацию, используя селективную среду, содержащую гипоксантин, аминоптерин и тимидин (среда HAT). Следовательно, клетки, которые растут в такой селективной среде приблизительно около 10 суток после начала культивирования, могут быть отобраны как гибридомы.
Гибридомы, отобранные с использованием среды HAT, в первую очередь подвергают скринингу в отношении их активности связывания с природным или рекомбинантным CXCL1 человека, или с аминокислотной последовательностью, представленной в SEQ ID NO:1-3, в качестве показателя. Затем гибридомы, продуцирующие антитело, которое обладает активностью связывания с CXCL1 человека, тестируют на перекрестную реактивность. Конкретно, их активность связывания с другими членами семейства CXC верифицируют и отбирают антитела с подходящей активностью. Термин “подходящая перекрестная реактивность” для применения по отношению к антителу относится к пренебрежимо малой перекрестной реактивности. Например, по отношению к моноклональному антителу, которое используют для иммунологического анализа, можно указать, что антитело никогда не будет перекрестно реагировать, если интенсивность сигнала вследствие перекрестной реакции представлена на фоновом уровне, в пределах менее чем 1% интенсивности сигнала, полученного в результате специфической реакции, измеренной в заключительной системе измерения.
Для подтверждения способности вступать в реакцию с CXCL1 человека или перекрестной реактивности с другими членами семейства CXC можно использовать, например, способ ELISA. Для способа ELISA подготавливают микропланшет путем иммобилизации CXCL1 человека или его фрагмента на микропланшете в качестве антигена и затем, для проведения реакции, добавляют в микропланшет образец, полученный посредством соответствующего разведения супернатанта культуры гибридомы. После проведения реакции в течение достаточного времени лунки промывают и затем меченое вторичное антитело против иммуноглобулина дополнительно добавляют для осуществления реакции. Лунки снова промывают и затем выполняют итоговое измерение, используя метку вторичного антитела, связанного с содержимым лунок. Таким образом, активность связывания антигена, которая имеет место в супернатанте культуры, можно узнать количественно.
B3. Продукция антител с использованием гибридомы
Гибридому в настоящем изобретении можно использовать для продукции антитела посредством получения асцитных жидкостей, используя мышей. Конкретно, гибридому интраперитонеально инокулируют мышам, чьи клетки использовали в качестве партнера слияния при получении гибридомы, или мышам nude, а затем асцитные жидкости соответствующим образом собирают, так что могут быть получены асцитные жидкости, содержащие антитело. Более конкретно, гибридому, полученную с использованием клеток Sp/0 в качестве партнера слияния, интраперитонеально инокулируют мышам линии BALB/c на 10 сутки после инокуляции пристином, так что могут быть получены асцитные жидкости.
Кроме того, гибридому в настоящем изобретении культивируют, используя подходящую среду, так что она может быть использована для продукции антител. Конкретно, гибридому инокулируют в гибридомной среде SFM (Gibco) из расчета 1×105 клеток/мл и затем культивируют в инкубаторе с 5% CO2 при 37°C до тех пор, пока гибридома не потеряет жизнеспособность, так что может быть получен супернатант культуры, содержащий антитело, но способы этим не ограничиваются.
3. Способ получения рекомбинантного моноклонального антитела к частичной последовательности CXCL1 человека
Антитело или его фрагмент по настоящему изобретению можно также получать способами рекомбинантной ДНК, используя последовательность кДНК, кодирующую аминокислотную последовательность моноклонального антитела, которое специфично распознает частичную последовательность CXCL1 человека, описанную в настоящем изобретении.
Например, используя последовательность ДНК, кодирующую аминокислотную последовательность, которая кодирует вариабельную область антитела, полученного от гибридомы, продуцирующей моноклональное антитело к частичной последовательности CXCL1 человека (где гибридома получена способом, указанным выше в B2), нуклеотидную последовательность VH и нуклеотидную последовательность VL лигируют с нуклеотидными последовательностями, кодирующими произвольные выбранные нуклеотидные последовательности CL и CH, соответственно. Таким образом, каждый полинуклеотид включают в подходящий экспрессирующий вектор и затем вектор встраивают в клетки-хозяева, обеспечивая, тем самым, возможность экспрессии полной молекулы иммуноглобулина. Также, используя способ пересаживания CDR в антителах, полинуклеотид, кодирующий аминокислотную последовательность CDR в пределах вариабельной области, полученный способом, указанным выше в B2, лигируют с полинуклеотидом, кодирующим каждую FR произвольно выбранного иммуноглобулина, полученный в результате продукт включают в подходящий экспрессирующий вектор, а затем вектор встраивают в клетки-хозяева с получением, посредством экспрессии, полной молекулы иммуноглобулина. Каждый полинуклеотид можно синтезировать химически или синтезировать, используя способ Fujimoto et al., известный как способ синтеза длинноцепочечной ДНК (Hideya Fujimoto, Method for Preparation of Synthetic Gene, Plant Cell Engineering Series 7, Plant PCR Experimental Protocols, 1997, Shujunsha, p95-100). Также, CDR, описываемый в настоящем изобретении, получают из иммуноглобулина мыши. Таким образом, подлежащие лигированию последовательности CL, CH и области FR получают предпочтительно от мышей, или их можно получать от произвольно выбранных животных, таких как люди. В настоящее время целесообразно экспрессировать тяжелую цепь и легкую цепь в одной клетке-хозяине, чтобы сделать возможным получение димера, содержащего тяжелую цепь и легкую цепь. Конкретно, например, клетки подвергают совместной трансформации экспрессирующим вектором легкой цепи и экспрессирующим вектором тяжелой цепи, а затем из трансформированных клеток можно получить антитело по настоящему изобретению. Альтернативно, полинуклеотид, кодирующий указанную выше аминокислотную последовательность, непосредственно включают в подходящий экспрессирующий вектор, а затем вектор встраивают в клетки-хозяева, так им образом, ген может быть экспрессирован в виде фрагмента молекулы иммуноглобулина. Альтернативно, как описано выше, полинуклеотиды, кодирующие VL и VH, содержащие указанные выше аминокислотные последовательности, или легкую цепь и тяжелую цепь соединяют, используя подходящий линкер, и затем встраивают в фаг, таким образом, ген может быть экспрессирован в виде одноцепочечного Fv или синтетического фрагмента антитела, такого как диатело. Кроме того, согласно способу фагового дисплея антител (Brinkmann et al., 1995, J Immunol Methods, 182, 41-50, International Patent Publication W097/13844 и International Patent Publication WO90-02809), который получил распространение в последние годы, посредством которого рекомбинантное антитело экспрессируют на поверхности фага, используя способы генетической инженерии, гены, кодирующие тяжелую цепь и легкую цепь, искусственно переставляют, измененные одноцепочечные Fv-антитела экспрессируют в виде фаговых слитых белков, и таким образом могут быть получены специфические антитела.
Получение полинуклеотида, кодирующего рекомбинантное моноклональное антитело к частичной последовательности CXCL1 человека или его фрагмент, получение вектора, в который встраивают полинуклеотид, и способ встраивания вектора в хозяина можно осуществлять, используя способы рекомбинантной ДНК, известные в данной области, как описано в указанном выше разделе “A. Способ получения антитела к CXCL1 человека”. Целевое рекомбинантное антитело к CXCL1 человека или его фрагмент можно получать из культурального раствора трансформированных клеток или из внутреннего содержимого клеток.
В качестве экспрессирующего вектора для иммуноглобулина можно использовать, например, плазмиду, фагмиду, космиду, вирусный вектор (например, вектор на основе вируса SV40, вектор на основе вируса EB и вектор на основе вируса BPV) или тому подобное, но примеры не ограничиваются этими векторами. Например, вектор BCMGS Neo, который представляет собой разновидность векторов на основе BPV, представляет собой желаемый вектор, посредством которого эффективно экспрессируют чужеродный ген, когда трансформируют в клетки COS7 или т.п. (Hajime Karasuyama “Bovine Papilloma Virus Vector”, под редакцией Masami Muramatsu и Hiroto Okayama, Experimental Medicine Separate Volume: Genetic Engineering Handbook, 1991, YODOSHA (Japan), 297-299.
Указанный выше вектор может также содержать, в дополнение к полинуклеотиду, кодирующему антитело или его фрагмент, регуляторные элементы, необходимые для экспрессии указанного выше антитела или его фрагмента (например, промотор, энхансер, терминатор, участок полиаденилирования и участок сплайсинга), или, если необходимо, селективный маркер.
В качестве хозяина для трансформации, в дополнение к хозяевам, перечисленным в указанном выше разделе “A. Способ получения моноклонального антитела к CXCL1 человека”, можно соответствующим образом использовать клетки Sp2/0 (миелома мыши) (European Journal of Cancer Research Preview (1996) Vol. 5, 512-519; Cancer Research (1990) Vol. 50, 1495-1502).
В настоящем изобретении клетки-хозяева, содержащие вектор для экспрессии антитела или его фрагмента, культивируют согласно общепринятому способу, так что может быть продуцировано антитело в полученном супернатанте культуры или внутри клеток-хозяев. Конкретно, если клетки CHO используют в качестве клеток-хозяев, то клетки-хозяева высевают в DMEM (Gibco) из расчета 1×105 клеток/мл и затем культивируют в инкубаторе с 5% CO2 при 37°C, так что может быть получен супернатант культуры, содержащий антитело. Также, например, если клетка-хозяин представляет собой Escherichia coli, то клетки высевают и культивируют в общепринятой среде, такой как среда LB, которую используют для культивирования Escherichia coli, и затем индуцируют экспрессию белка, так что может быть продуцировано антитело в полученном супернатанте культуры или внутри клеток-хозяев.
Если антитело или его фрагмент, которое представляет собой продукт экспрессии, содержит константную область, то антитело или его фрагмент можно очистить и/или выделить из супернатанта культуры или клеточного лизата, используя колонку с белком A, колонку с белком G, колонку для аффинной хроматографии с антителом к иммуноглобулину или т.п. При этом, если такой продукт экспрессии экспрессируется в форме, состоящей только из вариабельной области, и, таким образом, не содержит константную область, то указанный выше способ очистки применять нельзя. В результате применяют другие подходящие способы очистки. Например, антитело или его фрагмент экспрессируют в виде структуры, в которой последовательность с меткой, которая является эффективной для очистки, такая как последовательность с гистидиновой меткой, соединяют с C-концом, таким образом, продукт экспрессии может быть очищен методом аффинной хроматографии с использованием соответствующего лиганда. Если продукт экспрессии не является указанным выше меченым слитым белком, то его можно очищать общепринятым для очистки белков способом, таким как осаждение сульфатом аммония, ионообменная хроматография, хроматография с обращенной фазой, гель-фильтрация или хроматография на гидроксиапатите.
4. Доказательство наличия эпитопа на CXCL1 человека, распознаваемого полученным моноклональным антителом к CXCL1 человека
Наличие эпитопа на CXCL1 человека, распознаваемого полученным моноклональным антителом к CXCL1 человека, можно доказать следующим образом.
Вначале CXCL1 человека, подвергнутый восстановительному алкилированию, подвергают реакции с моноклональным антителом к CXCL1 человека, так что образуется комплекс антиген-антитело. Затем осуществляют обработку протеолитическим ферментом, используя подходящую протеазу, такую как трипсин. При выполнении обработки трипсином антитело не так легко поддается разрушению. Таким образом, комплекс антиген-антитело можно выделить, используя сефарозу с белком G или т.п. В то же время антиген, отличный от части, защищенной посредством связывания с антителом, разрушается при обработке протеазой. Соответственно, выделенный комплекс антиген-антитело анализируют посредством LC-MS, для того чтобы можно было идентифицировать подобный участок, защищенный связыванием с антителом, т.е. эпитоп на CXCL1 человека, который распознает антитело.
Кроме того, наличие эпитопа на CXCL1 человека, который распознается моноклональным антителом к CXCL1 человека, можно также подтвердить, например, способом конкуренции, используя синтетический пептид. Сначала синтетический пептид с 4-8 аминокислотами, каждая из аминокислотной последовательности, составляющий CXCL1 человека, получают способом твердофазного синтеза или подобным. В эксперименте по доказательству связывания с CXCL1 человека, с использованием указанного выше способа ELISA, при взаимодействии моноклонального антитела к CXCL1 человека с иммобилизованным CXCL1 человека, в реакцию включают синтезированный пептид. Если подтверждается ингибирование связывания моноклонального антитела к CXCL1 человека, то можно заключить, что аминокислотная последовательность синтезированного пептида представляет собой эпитоп, распознаваемый моноклональным антителом к CXCL1 человека.
5. Способ определения CXCL1 человека
В настоящем изобретении способ иммунологического анализа CXCL1 человека можно осуществлять, используя полученное моноклональное антитело или его фрагмент. Способ измерения по настоящему изобретению представляет собой способ с превосходной специфичностью к CXCL1 человека, так что может быть обеспечен способ иммунологического анализа, идеальный для CXCL1 человека.
Термин “образец(цы)”, который используют в способе измерения по настоящему изобретению, относится к различным образцам, которые могут содержать CXCL1 человека. Примеры такого образца включают культивированные клетки, содержащие ДНК, кодирующую CXCL1 человека или его фрагмент, лизат культивированных клеток, супернатант культуры и человеческий образец. Термин “человеческий образец” относится к любым биологическим образцам, полученным от человека, таким как ткань, полученная от человека (например, ткань, полученная после оперативного вмешательства), и жидкости организма, такие как кровь, сыворотка, плазма крови, моча, спинномозговая жидкость, слюна, лимфатическая жидкость, слезная жидкость и жидкость семенников. Предпочтительно, такой образец представляет собой кровь, сыворотку, плазму крови или мочу. Кроме того, образец в настоящем изобретении может представлять собой не только жидкий образец, но также твердый образец. Например, можно использовать образец тканевого среза. Способ измерения CXCL1 человека по настоящему изобретению удобно проводить на образце тканевого среза, поскольку посредством способа можно наблюдать in situ наличие или отсутствие и локализацию CXCL1 человека.
Настоящее изобретение характеризуют, используя комбинацию двух или более типов и предпочтительно 2 типа указанного выше моноклонального антитела к частичной последовательности CXCL1 человека или его фрагмент, которые специфично распознают любой участок последовательности аминокислотных последовательностей, представленных в SEQ ID NO:1-3, которые представляют собой частичные последовательности аминокислотной последовательности, составляющей CXCL1 человека, и специфично распознают участки последовательности, отличающиеся друг от друга. Более предпочтительно, настоящее изобретение характеризуют, используя такую комбинацию, содержащую моноклональное антитело к CXCL1 человека, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:3. Комбинации моноклональных антител к частичной последовательности CXCL1 человека или их фрагменты, которые распознают различные участки аминокислотной последовательности CXCL1 человека, способствуют увеличению чувствительности при определении CXCL1 человека.
Иммунологический анализ по настоящему изобретению можно выполнять известными способами иммунологического анализа, используя меченое антитело, такими как способ ELISA, способ EIA, способ флуоресцентного иммунологического анализа, способ радиоиммунологического анализа или способ люминесцентного иммунологического анализа, или способ поверхностного плазмонного резонанса (способ SPR), способ пьезокварцевого микровзвешивания (способ QCM) или т.п. Способ иммунологического анализа по настоящему изобретению можно предпочтительно применять в способе иммунологического анализа с использованием меченого антитела.
Способ ELISA также обозначают как способ твердофазного иммуноферментного анализа, который представляет собой способ количественного анализа целевого антигена, включающий определение незначительного количества целевого антигена, содержащегося в образце, с использованием меченного ферментом антитела или антигена и действием фермента в реакции антиген-антитело, проявляющимся в окрашивании, которое регистрируется посредством измерения оптической плотности или интенсивности флуоресценции. Конкретно, способ включает иммобилизацию антитела или его фрагмента по настоящему изобретению, или CXCL1 человека или его фрагмента на твердофазной подложке и последующей ферментативно определяемой иммунологической реакцией между антителом или т.п. и CXCL1 человека или т.п. Примеры такого способа включают прямой способ, непрямой способ и способ “сэндвича”. Настоящее изобретение распространяется на способ “сэндвича”. Относительно способов измерения для ELISA см. известные способы (Edited by Japanese Society of Laboratory Medicine “Clinical Pathology Extra Special Edition NO. 53, Immunoassay for Clinical Examination - Technology and Application-”, The Clinical Pathology Press, 1983; Edited by Eiji Ishikawa et al., “Enzyme Immunoassay”, Third Edition, IGAKU-SHOIN, 1987; Edited by Tsunehiro Kitagawa et al., “Protein Nucleic Acid Enzyme Separate Volume No. 31 Enzyme Immunoassay”, KYORITSU SHUPPAN CO., LTD, 1987; Edited by Minoru Irie “Radioimmunoassay”, Kodansha Scientific Ltd., 1974; и Edited by Minoru Irie “Radioimmunoassay Part II”, Kodansha Scientific Ltd., 1979). В качестве указанной выше твердофазной подложки можно использовать нерастворимые подложки в форме шариков, микропланшеты, пробирки, полоски, образцы для испытаний или т.п., сделанные из такого материала, как полистирол, поликарбонат, поливинилтолуол, полипропилен, полиэтилен, поливинилхлорид, нейлон, полиметакрилат, латекс, желатин, агароза, целлюлоза, сефароза, стекло, металл, керамический материал, магнитный материал или т.п. Иммобилизации антитела или его фрагмента, или CXCL1 человека или его фрагмента по настоящему изобретению на твердофазной подложке можно достичь посредством связывания согласно известному способу, такому как способ физической адсорбции, способ с образованием химической связи, или комбинацией этих способов.
В качестве указанного выше меченого вещества, например: в случае способа ELISA можно использовать пероксидазу (POD), щелочную фосфатазу, β-галактозидазу, уреазу, каталазу, глюкозооксидазу, лактатдегидрогеназу, амилазу, комплекс биотин-авидин или т.п.; в случае флуоресцентного иммунологического анализа можно использовать флуоресцеинизотиоцианат, тетраметилродаминизотиоцианат, замещенный родаминизотиоцианат, дихлортриазинизотиоцианат, Alexa480, AlexaFluor488 или т.п.; или в случае радиоиммунологического анализа можно использовать тритий, йод 125, йод 131 или т.п. Однако примеры такого меченого вещества не ограничиваются этими примерами.
В качестве иммунолюминесцентного анализа можно использовать систему NADH-FMNH2-люциферазы, систему люминол-пероксид водорода-POD, систему сложного эфира акридиния, систему соединения диоксетана или т.п. В качестве способа связывания меченого антигена и антитела, в случае способа ELISA, можно использовать известный способ, такой как глутаральдегидный способ, малеимидный способ, пиридилсульфидный способ или способ с перйодной кислотой, и в случае радиоиммунологического анализа можно использовать известный способ, такой как способ с хлорамином-T или способ Болтон-Хантера.
Кроме того, способ иммунологического анализа по настоящему изобретению можно также осуществлять путем измерения, визуально или посредством использования оптического способа, проходящего света или рассеянного света, отражающего образование агглютинатов-иммунных комплексов, которые возникают при иммунонефелометрии, реакции латексной агглютинации, латексной турбидиметрии, реакции гемагглютинации, реакции агглютинации частиц или т.п. При этом в качестве растворителя можно использовать фосфатный буфер, глициновый буфер, буфер на основе Tris, буфер Гудса или т.п. Кроме того, можно также включать катализатор, такой как полиэтиленгликоль или неспецифический ингибитор реакции.
В способе иммунологического анализа по настоящему изобретению предпочтительно выбирают 2 типа из 3 типов указанного выше моноклонального антитела к частичной последовательности CXCL1 человека или его фрагментов и затем используют. Что касается конкретных способов, то в качестве примера описывают случай, в котором используют моноклональное антитело, специфично распознающее участок аминокислотной последовательности, представленный в SEQ ID NO:1, и моноклональное антитело, специфично распознающее участок аминокислотной последовательности, представленный в SEQ ID NO:3. Однако вариант осуществления настоящего изобретение не ограничен этим примером.
Например, если способ иммунологического анализа по настоящему изобретению применяют для “сэндвич” способа ELISA, то сначала моноклональное антитело, специфично распознающее участок аминокислотной последовательности, представленный в SEQ ID NO:1, иммобилизуют на нерастворимой подложке. Можно иммобилизовать либо один тип, либо несколько типов антитела, при условии, что оно (они) специфично распознает(ют) участок аминокислотной последовательности, представленный в SEQ ID NO:1. Затем образец, содержащий CXCL1 человека, вступает в реакцию на поверхности, на которой иммобилизовано антитело, так что на твердой подложке образуется комплекс иммобилизованного антитела и CXCL1 человека. Затем несвязанные соединения, отличные от CXCL1 человека, присутствующего в образце, удаляют промыванием достаточным количеством смывающего раствора. Кроме того, получают меченое моноклональное антитело, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:3, и затем меченое антитело вступает в реакцию на подложке, с которой связан комплекс иммобилизованного антитела и CXCL1 человека. После промывки достаточным количеством смывающего раствора осуществляют определение, используя метку, так что можно определить CXCL1 человека, присутствующий в образце. На данном этапе в настоящем изобретении можно использовать либо один тип, либо несколько типов меченого антитела, при условии, что оно (они) представляет собой моноклональное антитело, специфично распознающее участок аминокислотной последовательности, представленный в SEQ ID NO:3. Предпочтительно используют два или более типов меченого антитела и более предпочтительно используют 2 типа меченого антитела. Также, если вид животного, от которого получают моноклональное антитело, специфично распознающее участок аминокислотной последовательности, представленный в SEQ ID NO:1, отличается от вида животного, от которого получают моноклональное антитело, специфично распознающее участок аминокислотной последовательности, представленный в SEQ ID NO:3, то детекцию можно также осуществлять, используя меченое вторичное антитело, которое распознает антитело, специфично распознающее участок аминокислотной последовательности, представленный в SEQ ID NO:3, без меченого моноклонального антитела, специфично распознающего участок аминокислотной последовательности, представленный в SEQ ID NO:3.
Приведенное выше описание аналогичным образом применяют в случае, в котором используют моноклональное антитело, специфично распознающее участок аминокислотной последовательности, представленный в SEQ ID NO:2. Также, антитела, которые используют для иммобилизации и мечения, можно, наоборот, использовать для мечения и иммобилизации, соответственно.
Меченое антитело и образец, содержащий CXCL1 человека, предварительно смешивают, чтобы образовать комплекс антиген-антитело, и затем комплекс может вступать в реакцию с иммобилизованным антителом. Если антитело, которое иммобилизуют, представляет собой антитело, меченное биотином, биотинилированное иммобилизованное антитело, то образец, содержащий CXCL1 человека, и антитело, меченное меткой, отличной от биотина, смешивают вместе, чтобы образовать комплекс антиген-антитело. После этого комплекс вступает в реакцию на подложке, на которой иммобилизован авидин, таким образом, можно детектировать комплекс антиген-антитело, используя мечение, отличное от биотинилирования.
Кроме того, тест-полоски для иммунохроматографии также можно использовать для способа иммунологического анализа по настоящему изобретению. Такая тест-полоска для иммунохроматографии содержит, например, принимающую образец зону, которая сделана из материала, легко впитывающего образец, зону реагента, содержащую меченое диагностическое средство по настоящему изобретению, зону продвижения, в которой мигрирует продукт реакции образца и диагностического средства, и зону проявления для связывания продукта реакции, образование которого приводит к развитию окрашивания. Коммерчески доступная диагностика беременности или т.п. представляют собой вариант, аналогичный описанному выше. Принцип способа измерения является таким, как описано ниже. Сначала образец наносят на принимающую образец зону, и принимающая образец зона поглощает образец и затем обеспечивает распространение образца к зоне реагента. После этого, в зоне реагента, CXCL1 человека в образце вступает в реакцию с указанным выше меченым моноклональным антителом к частичной последовательности CXCL1 человека или его фрагментом, посредством реакции антиген-антитело, а затем образованный реакционный комплекс мигрирует в зону продвижения, чтобы достичь зоны проявления. В зоне проявления указанный выше реакционный комплекс вступает в реакцию с другим типом моноклонального антитела к частичной последовательности CXCL1 человека, который отличается от меченого моноклонального антитела и распознает другую частичную последовательность CXCL1, и затем реакционный комплекс подвергается связыванию, таким образом, наблюдают окрашивание, обусловленное меткой реакционного комплекса. Указанная выше тест-полоска для иммунохроматографии проявляет очень низкую степень инвазивности, не принося ни боли, ни риска при использовании реагентов пользователями. Следовательно, такую тест-полоску можно использовать для контролирования состояния в домашних условиях. По результатам контроля проводят тщательное обследование и/или лечение (например, хирургическое вмешательство) в условиях любого медицинского института, что обеспечивает возможность управлять состоянием для предотвращения метастазов и/или рецидива. Кроме того, в настоящее время тест-полоску можно производить в большом количестве, с низкими затратами, например, способом получения, раскрытым в JP Patent Publication (Kokai) No. 10-54830 A (1998).
В качестве примера, ниже, описан случай, в котором используют моноклональное антитело, специфично распознающее участок аминокислотной последовательности, представленный в SEQ ID NO:1, и моноклональное антитело, специфично распознающее участок аминокислотной последовательности, представленный в SEQ ID NO:3. Сначала образец, содержащий CXCL1 человека, наносят на принимающую образец зону и затем принимающая образец зона поглощает образец, обеспечивая распространение образца до зоны реагента. Затем, в зоне реагента, содержащийся в образце CXCL1 человека, полученный из уротелиальных злокачественных клеток, вступает в реакцию с моноклональным антителом, специфично распознающим меченый участок аминокислотной последовательности, представленный в SEQ ID NO:1 по настоящему изобретению. Комплекс, образующийся в результате реакции, мигрирует в зону продвижения для достижения зоны проявления. В зоне проявления указанный выше реакционный комплекс вступает в реакцию с моноклональным антителом, специфично распознающим участок аминокислотной последовательности, представленный в SEQ ID NO:3, так что наблюдается окрашивание.
В качестве способа измерения по настоящему изобретению можно использовать способ поверхностного плазмонного резонанса (способ SPR). Термин “явление поверхностного плазмонного резонанса” относится к явлению, посредством которого интенсивность отраженного света значимо ослаблялась лазерным излучением на тонкую металлическую пленку под определенным углом падения (угол резонанса). Датчик SPR, в котором используется принцип явления SPR, позволяет с высокой интенсивностью осуществлять измерение материала, адсорбированного на поверхности тонкой металлической пленки. Таким образом, антитело и/или целевой антиген предварительно иммобилизуют на поверхности тонкой металлической пленки и затем осуществляют пропускание образца над поверхностью тонкой металлической пленки. Появляется возможность определения различия между количеством вещества, адсорбированного на поверхности тонкой металлической пленки до пропускания образца, и его количеством после пропускания образца. Способ измерения замещением, непрямой конкурентный способ и подобные известны, и можно применять любой из этих способов. Эти способы известны в данной области. Например, см. Kazuhiro Nagata and Hiroshi Handa, Experimental Method for Realtime Analysis of Biomaterial Interaction, Springer-Verlag Tokyo, Tokyo, 2000.
Кроме того, для способа измерения по настоящему изобретению можно также использовать способ пьезокварцевого микровзвешивания (способ QCM). В этом способе используется явление, при котором вещество адсорбируют на поверхность электрода, присоединенного к кварцевому осциллятору, резонансная частота кварцевого осциллятора уменьшается в зависимости от массы. Датчик QCM с использованием данного способа представляет собой датчик измерения массы, который способен количественно уловить очень незначительное количество адсорбированного вещества на основе величины изменения резонансной частоты в воде. Этот способ является известным в данной области. Например, см. J. Christopher Love, L. A. Estroff, J. K. Kriebel, R. G. Nuzzo, G. M. Whitesides, 2005, Self-Assembled Monolayers of a Form of Nanotechnology, Chemical Review, 105: 1103-1169; Toyosaka Morizumi, Takamichi Nakamoto, 1997, Sensor Engineering, Shokodo Co., Ltd.
6. Набор для определения CXCL1 человека
Настоящее изобретение можно использовать в виде набора для осуществления указанных иммунологических способов измерения. Конкретно, для создания набора можно комбинировать не только антитело или его фрагмент по настоящему изобретению, но также меченое вторичное антитело, кроме того, субстрат, необходимый для обнаружения метки, положительный контроль и отрицательный контроль, буфер, который используют для разведения или промывки образцов и т.п.
ПРИМЕРЫ
Настоящее изобретение будет дополнительно описано конкретно со ссылкой на примеры. Однако настоящее изобретение не ограничено этими примерами.
Пример 1. Получение рекомбинантного CXCL1 человека с использованием Escherichia coli
Получение гена CXCL1 человека
Для получения рекомбинантного CXCL1 человека, который используют в качестве иммуногена для антитела, сначала получали мРНК CXCL1 человека из клеток HEK293. мРНК получали, используя Qiashredder и малый набор RNeasy (Qiagen), согласно вложенным протоколам в отношении деталей.
Затем синтезировали кДНК, используя полученную общую мРНК в качестве матрицы для обратной транскриптазы SuperscriptII (Invitrogen), таким образом, конструировали библиотеку кДНК человека. Реакцию обратной транскрипции осуществляли согласно вложенным протоколам с указанным выше ферментом.
После этого выполняли ПЦР, используя в качестве матрицы полученную библиотеку кДНК человека и набор праймеров, состоящих из нуклеотидных последовательностей, представленных в SEQ ID NO:44 и 45. Нуклеотидная последовательность, представленная в SEQ ID NO:44, содержит часть 5'-концевого участка гена CXCL1 человека и последовательность распознавания Nde I в 3'-5' направлении. Нуклеотидная последовательность, представленная в SEQ ID NO:45, содержит часть 3'-концевого участка гена CXCL1 человека и последовательность распознавания BamH I в 5'-3' направлении. Раствор ПЦР, содержащий KOD ДНК полимеразу (Toyobo Co., Ltd.) в качестве ДНК полимеразы, 10 нг библиотеки кДНК и 10 пмоль каждого праймера, получали согласно вложенным протоколам с KOD. Что касается условий реакции, то после 10 минут нагревания при 94°C цикл, состоящий из 94°C в течение 30 секунд, 55°C в течение 30 секунд и 72°C в течение 1 минуты, повторяли 30 раз, а затем в конце температуру сохраняли при 72°C в течение 4 минут. Амплифицированный фрагмент ДНК очищали, используя колонки Quantum prep PCR Kleen Spin Columns (Bio-rad). В результате реакции получали полноразмерный продукт ПЦР приблизительно в 300 п.н.
Реакцию лигирования выполняли для включения полученного фрагмента ДНК в разомкнутую кольцевую pUC118 (Takara Bio Inc.), расщепленную Hinc II и обработанную BAP. В качестве ДНК лигазы использовали ligation High (Toyobo Co., Ltd.). Реакцию проводили согласно вложенному протоколу. Затем компетентные клетки трансформировали, используя раствор, полученный после реакции лигирования. В качестве компетентных клеток использовали штамм Escherichia coli, DH5α (Takara Bio Inc.). Конкретно трансформацию выполняли согласно вложенным протоколам. Трансформированные клетки наносили на планшет с LB, содержащей антибиотик ампициллин в концентрации 100 мкг/мл, и затем культивировали в течение ночи при 37°C. Полученный трансформант культивировали в течение ночи при 37°C в жидкой среде LB, содержащей 100 мкг/мл ампициллина. Целевую pUC118_CXCL1 получали посредством Mini-Prep.
Затем pUC118_CXCL1 расщепляли ферментами рестрикции, Nde I и BamH I, и затем реакционный раствор подвергали электрофорезу в агарозном геле. После электрофореза фрагмент приблизительно в 300 п.н., наличие которого подтверждали ультрафиолетовым излучением, вырезали из геля и затем экстрагировали фрагмент ДНК. Экстрагирование выполняли, используя колонку PCR GFX Column (GE HEALTHCARE BIO-SCIENCES). Для включения экстрагированного фрагмента ДНК в экспрессирующий вектор pET16b (Novagen) (фрагмент приблизительно 6 т.п.н.), который расщепляли Nde I/BamH I, осуществляли реакцию лигирования. После этого проводили трансформацию DH5α, используя раствор, полученный после реакции лигирования, культивирование трансформанта и Mini-Prep. Таким образом, получали целевую pET16b_CXCL1. Каждую стадию выполняли согласно указанным выше способам.
Получение рекомбинантного CXCL1 человека
Для получения рекомбинантного CXCL1 человека штамм Escherichia coli, Rosetta-Gami 2 (Novagen) трансформировали с использованием pET 16b_CXCL1. Полученный трансформант предварительно культивировали в течение ночи при 37°C в 30 мл среды LB, содержащей ампициллин и хлорамфеникол. Затем трансформант, подвергнутый предварительному культивированию, инокулировали в 3 л той же среды и затем культивировали при 37°C в течение 3 часов. Добавляли IPTG в конечной концентрации 1 мМ, культивирование выполняли при 32°C в течение 6 часов, индуцировали экспрессию целевого рекомбинантного CXCL1 человека и, таким образом, путем центрифугирования получали микроорганизмы.
Полученные микроорганизмы промывали PBS и затем получали нерастворимую фракцию в виде преципитата, используя B-PER (PIERCE). Конкретные процедуры проводили согласно вложенным протоколам. Затем нерастворимую фракцию солюбилизировали, используя реагент для солюбилизации телец включения (PIERCE), и затем CXCL1 человека, слитый с гистидиновой меткой, адсорбировали, используя металлоаффинную смолу TALON (CLONETECH). Смолу с адсорбированным белком промывали PBS, содержащим 10 мМ имидазола, и затем элюировали, используя раствор 1 M имидазола.
Затем выполняли рефолдинг белка, используя полученную после элюирования фракцию. Сначала фракцию диализовали в течение ночи против раствора PBS, содержащего 6 M мочевину. К диализному раствору для разведения постепенно добавляли PBS, до тех пор, пока конечная концентрация мочевины в диализном растворе не достигала 1 M. В заключение, диализ выполняли в течение ночи против свежеприготовленного раствора PBS. Полученный раствор для рефолдинга подвергали электрофорезу в акриламидном геле. Наличие очищенного CXCL1 человека, слитого с гистидиновой меткой, с молекулярной массой приблизительно 10000 Да подтверждали окрашиванием в кумасси бриллиантовом синем.
Пример 2. Получение и отбор моноклонального антитела мыши к CXCL1 человека
Получение мыши, продуцирующей антитело к CXCL1 человека
100 мкл 0,3 мг/мл раствора CXCL1 человека, полученного в примере 1, смешивали со 100 мкл эмульсии MPL+TDM (Corixa). Суммарное количество раствора вводили интраперитонеально мыши BALB/c в возрасте 7 недель. Через 2 недели и через 4 недели вводили такое же количество аналогичным образом полученного раствора CXCL1 человека. После этого получали 100 мкл крови от мыши через хвостовую вену, выдерживали в течение ночи, а затем центрифугировали при 5000×g в течение 5 минут. Таким образом, получали супернатант в виде плазмы крови.
100 мкл 1 мкг/мл раствора CXCL1 человека добавляли в каждую лунку 96-луночного полистирольного планшета (Greiner Bio-One) и затем иммобилизовали в течение ночи. Затем из каждой лунки удаляли белковый раствор, вливали туда 200 мкл раствора BlockAce (Dainippon Sumitomo Pharma Co., Ltd), разведенного в 4 раза, и затем планшет выдерживали в течение 1 часа при комнатной температуре. После этого планшет промывали PBS-T, таким образом, получали иммобилизованный на планшете CXCL1 человека. Полученную выше плазму крови разбавляли в 100 раз, 100 мкл разведенной плазмы крови добавляли в каждую лунку планшета с иммобилизованным CXCL1 человека, а затем планшет выдерживали в при комнатной температуре течение 1 часа. После этого из каждой лунки удаляли раствор и затем планшет промывали PBS-T. Добавляли 100 мкл меченного HRP раствора антитела к IgG мыши (Dako) и затем планшет выдерживали при комнатной температуре в течение 1 часа. Раствор из каждой лунки удаляли. После промывки с использованием PBS-T добавляли 100 мкл раствора TMB и оставляли для прохождения реакции в течение 15 минут. Развитие окрашивания вследствие реакции наблюдали при оптической плотности 450 нм. Исходя из развития окрашивания определяли, что в образце крови продуцируется антитело к CXCL1 человека.
Получение моноклонального антитела к CXCL1 человека
Раствор CXCL1 человека, полученный аналогично приведенному выше способу, интраперитонеально вводили мыши, для которой было подтверждено наличие продукции антитела к CXCL1 человека. Через 3 суток выполняли спленэктомию. В иссеченной селезенке, используя шприц, делали отверстие и затем через отверстие инъецировали среду RPMI1640 (GIBCO), чтобы подвергнуть экструзии клетки селезенки, и таким образом получали раствор клеток селезенки. Полученный раствор клеток селезенки центрифугировали при 1200 об/мин. в течение 7 минут. Супернатант удаляли и промывали средой RPMI1640. Супернатант снова суспендировали в среде RPMI1640, подсчитывали количество клеток и, таким образом, получали раствор миеломных клеток SP2/0, содержащий 1/10 общего количества клеток селезенки. Оба раствора клеток смешивали, смесь центрифугировали при 2200 об/мин. в течение 10 минут и затем удаляли супернатант. Клетки высвобождали постукиванием, 1 мл раствора, полученного смешиванием PEG (ROCHE) с HBSS (GIBCO) в соотношении 5:1, добавляли к клеткам и смесь затем перемешивали. В следующих способах, если не указано иначе, растворы или среды во всех случаях хранили при 37°C и затем использовали.
Среду RPMI1640 (9 мл) медленно добавляли в течение 5 минут к раствору клеток, дополненному PEG и HBSS. Смесь осторожно перемешивали и затем центрифугировали при 2200 об/мин. в течение 10 минут. Супернатант удаляли. Полученные осажденные клетки суспендировали в среде RPMI1640, дополненной 15% FCS и HAT (ROCHE), и затем 200 мкл суспензии на лунку добавляли в 96-луночный планшет для клеточных культур (Greiner Bio-One), с последующим культивированием в течение 1 недели при 37°C в 5% CO2.
Колонии, выросшие в условиях дополнения HAT, определяли как гибридомы, полученные из клеток селезенки, слитых с миеломными клетками. Супернатант из каждой лунки, в которой выросли такие колонии, разбавляли в 5 раз. Добавляли 100 мкл разведенного раствора в каждую лунку планшета с иммобилизованным CXCL1 человека и затем наличие или отсутствие продукции антител подтверждали способом, аналогичным описанному выше. Лунки, для которых подтвердили наличие продукции антител, определяли как “положительные”. Колонии в “положительных” лунках суспендировали в среде RPMI, содержащей 15% FCS и HT (Invitrogen), и затем клонирование положительных клонов выполняли способом лимитирующих разведений. 75 типов гибридомы, полученных в результате клонирования, подвергали акклиматизации в среде SFM (GIBCO) и затем осуществляли продукцию антител. Гибридомы инокулировали в 60 мл 100% среды SFM из расчета 1×105 клеток/мл и затем культивировали в течение 10 суток до тех пор, пока клетки не погибли. Каждый культуральный раствор центрифугировали при 3000 об/мин. в течение 15 минут для осаждения клеток. Антитела, содержащиеся в полученной культуре супернатанта, очищали, используя набор MabTrap (GE HEALTHCARE BIO-SCIENCES).
Отбор моноклонального антитела к CXCL1 человека
Из указанных выше 75 типов очищенных антител отбирали антитело с высокой аффинностью к CXCL1 человека следующими способами. Сначала из каждого очищенного антитела готовили раствор с концентрацией 10 мкг/мл. Раствор добавляли в 96-луночный планшет из полистирола (Greiner Bio-One) из расчета 100 мкл на лунку, с последующей иммобилизацией в течение ночи. Затем раствор очищенного антитела из каждой лунки удаляли, добавляли 200 мкл раствора BlockAce (Dainippon Sumitomo Pharma Co., Ltd.), разведенного в 4 раза, и затем выдерживали в течение часа при комнатной температуре. После этого раствор удаляли, планшет промывали PBS-T и таким образом получали планшет, на котором было иммобилизовано очищенное антитело. Затем рекомбинантный CXCL1 человека серийно разводили от 1000 пг/мл до 15 пг/мл для получения раствора антигена. Раствор антигена добавляли в указанный выше планшет, на котором было иммобилизовано очищенное антитело, из расчета 100 мкл на лунку, с последующим прохождением реакции в течение 1 часа при комнатной температуре. После этого удаляли раствор антигена, планшет промывали PBS-T, а затем в каждую лунку добавляли 100 мкл 50 мкг/мл меченного биотином поликлонального антитела к CXCL1 человека (R&D SYSTEMS), с последующим прохождением реакции в течение 1 часа при комнатной температуре. Раствор из каждой лунки удаляли, планшет промывали PBS-T, а затем 100 мкл раствора авидин-HRP (R&D SYSTEMS) оставляли для прохождения реакции в течение 30 минут при комнатной температуре. Кроме того, раствор авидин-HRP удаляли, планшет промывали PBS-T, а затем добавляли 100 мкл раствора TMB, с последующим прохождением реакции в течение 15 минут. Реакцию останавливали добавлением 100 мкл 2 н. раствора серной кислоты. Наличие окрашивания подтверждали измерением оптической плотности при 450 нм. Очищенные антитела в тех лунках, где произошла цветная реакция, убедительно показали наличие высокой аффинности к CXCL1 человека. В результате отобрали 5 типов антител, IgG1-1, IgG1-3, IgG1-10, IgGl-14 и IgG2b-1.
Определение последовательности кДНК и аминокислотных последовательностей легкой и тяжелой цепей моноклонального антитела с использованием гибридомы
Для отобранных 5 типов антитела определяли последовательности кДНК и аминокислотные последовательности легкой и тяжелой цепей. Сначала гибридому, продуцирующую каждое антитело, культивировали при 37°C в атмосфере 5% CO2, используя среду RPMI1640, дополненную 15% FCS, до достижения клетками концентрации 1×106 клеток/мл. Затем раствор культуры центрифугировали при 1200 об/мин. в течение 5 минут и собирали клетки. Из собранных гибридом получали мРНК. Получение осуществляли, используя Qiashredder и набор RNeazy mini (Qiagen), согласно вложенным протоколам в отношении деталей. Затем синтезировали кДНК, используя в качестве матрицы полученную общую мРНК и праймер Oligo dT с обратной транскриптазой Superscriptll (Invitrogen), таким образом, конструировали библиотеку кДНК.
Затем выполняли ПЦР, используя в качестве матрицы библиотеку кДНК, полученную для каждой гибридомы, и Mouse Ig Primer (Novagen). Продукт амплификации (кДНК вариабельной области иммуноглобулина мыши) вставляли в участок EcoR I вектора ZERO BLUNT PCR TOPO (Invitrogen) для лигирования. Лигирование выполняли, используя Ligation High (Toyobo Co., Ltd.), согласно вложенным протоколам. Раствором реакции лигирования трансформировали компетентные клетки. В качестве компетентных клеток использовали клетки DH5α (Takara Bio Inc.) согласно вложенным протоколам в отношении деталей. Трансформированные клетки помещали в планшет LB, содержащий 100 мкг/мл ампициллина, и затем культивировали при 37°C в течение ночи. Четыре клона трансформантов, полученные от каждого продукта амплификации, инокулировали в жидкую среду LB, содержащую 100 мкг/мл ампициллина, и затем культивировали при 37°C в течение ночи. В результате получения раствора векторной ДНК из каждого культурального раствора получали посредством Mini-Prep, для каждого продукта амплификации, 4 типа раствора вектора, в который включена ДНК, кодирующая моноклональное антитело.
Полученные растворы вектора подвергали анализу на последовательность ДНК участка, кодирующего моноклональное антитело, с использованием праймера M13. Анализ выполняли, используя генетический анализатор 3130×1 (Applied Biosystems). Клоны, не имеющие стоп-кодона в пределах встроенного участка, определяли как последовательности ДНК, кодирующие целевые моноклональные антитела. Определяли последовательности ДНК легкой и тяжелой цепей указанных выше 5 антител (IgG1-1, IgG1-3, IgG1-10, IgG1-14 и IgG2b-1). Для определенных последовательностей ДНК определяли кодируемые ими аминокислотные последовательности в зависимости от частоты использования кодона в Escherichia coli, таким образом, можно было получить последовательности, представленные в SEQ ID NO:4-43.
Аминокислотные последовательности, представленные в SEQ ID NO:36-43, получали как аминокислотные последовательности, кодирующие IgG1-1. Более конкретно, SEQ ID NO:36, 37 и 38 кодируют CDR1, CDR2 и CDR3 легкой цепи IgG1-1, соответственно. Также, SEQ ID NO:39, 40 и 41 кодируют CDR1, CDR2 и CDR3 тяжелой цепи того же IgG1-1, соответственно. Кроме того, SEQ ID NO:42 и 43 кодируют полноразмерную вариабельную область легкой цепи и полноразмерную вариабельную область тяжелой цепи IgG1-1, соответственно.
Аминокислотные последовательности, представленные в SEQ ID NO:28-35, получали как аминокислотные последовательности, кодирующие IgG1-3. Более конкретно, SEQ ID NO:28-33 кодируют, в следующем порядке, CDR1-3 легкой цепи и CDR1-3 тяжелой цепи IgG1-3. Также, SEQ ID NO:34 и 35 кодируют полноразмерную вариабельную область легкой цепи и полноразмерную вариабельную область тяжелой цепи IgG1-3, соответственно.
Аминокислотные последовательности, представленные в SEQ ID NO:4-11, получали как аминокислотные последовательности, кодирующие IgG1-10. Более конкретно, SEQ ID NO:4-9 кодируют, в следующем порядке, CDR1-3 легкой цепи и CDR1-3 тяжелой цепи IgG1-10. SEQ ID NO:10 и 11 кодируют полноразмерную вариабельную область легкой цепи и полноразмерную вариабельную область тяжелой цепи IgG1-10, соответственно.
Аминокислотные последовательности, представленные в SEQ ID NO:20-27, получали как аминокислотные последовательности, кодирующие IgG1-14. Более конкретно, SEQ ID NO:20-25 кодируют, в следующем порядке, CDR1-3 легкой цепи и CDR1-3 тяжелой цепи IgG1-14. SEQ ID NO:26 и 27 кодируют полноразмерную вариабельную область легкой цепи и полноразмерную вариабельную область тяжелой цепи IgG1-14, соответственно.
Аминокислотные последовательности, представленные в SEQ ID NO:12-19, получали как аминокислотные последовательности, кодирующие IgG2b-1. Более конкретно, SEQ ID NO:12-17 кодируют, в следующем порядке, CDR1-3 легкой цепи и CDR1-3 тяжелой цепи IgG2b-1. SEQ ID NO:18 и 19 кодируют полноразмерную вариабельную область легкой цепи и полноразмерную вариабельную область тяжелой цепи IgG2b-1, соответственно.
Пример 3. Анализ частичной последовательности CXCL1 человека, распознаваемой отобранным антителом
В отношении 5 антител, отобранных в примере 2, анализируют эпитоп на аминокислотной последовательности CXCL1 человека, распознаваемый каждым антителом.
Сначала к 100 мкл 1 мкг/мкл раствора CXCL1 человека добавляли DTT до конечной концентрации 10 мМ. Реакцию проводили при 95°C в течение 5 минут для восстановления дисульфидных связей в пределах CXCL1. Затем добавляли йодацетамид с конечной концентрацией 20 мМ и затем проводили реакцию алкилирования тиольных групп в условиях светового экранирования при 37°C в течение 30 минут. Добавляли 20 мкг каждого антитела, отобранного в примере 2, к полученным 12 мкг восстановленного и алкилированного CXCL человека. Буфер Tris-HCl (100 мМ, pH 8,0) добавляли к каждой смеси до объема 100 мкл, с последующим прохождением реакции в течение 1 часа при комнатной температуре со встряхиванием и перемешиванием.
Затем трипсин (Promega), аминопептидазу M (ROCHE) и карбоксипептидазу Y (ROCHE) добавляли до конечных концентраций 0,2 мкг, 0,5 мкЕд и 0,02 мкг, соответственно, с последующим прохождением реакции при 37°C в течение 2 часов или более. Каждый реакционный раствор смешивали со стеклянными шариками с белком A (GE HEALTHCARE BIO-SCIENCES), которые предварительно были заблокированы 1% БСА-PBS и затем промыты PBS в буфере NP-40 (буфер 100 мМ Tris-HCl (pH8,0), 5 мМ ЭДТА, 150 мМ NaCl, 1% NP-40), с последующим прохождением реакции при 4°C в течение 30 минут.
Каждый из реакционных растворов промывали 25 мМ аммоний- карбонатным буфером (pH 8,0). Комплекс антиген-антитело элюировали, используя 100 мкл 0,1% муравьиной кислоты. Полученные элюаты подвергали LC-MS анализу с Q-TOF Premier (Waters-MicroMass). LC-MS анализ осуществляли согласно протоколам, приложенным к прибору.
В результате была выявлена частичная последовательность CXCL1 человека, распознаваемая каждым антителом, полученным в примере 2, и представлена в таблице 1.
Справочный пример 1. Анализ частичной последовательности CXCL1 человека, распознаваемой коммерчески доступным антителом
Моноклональное антитело, включенное в качестве антитела для иммобилизации в коммерчески доступный набор для определения CXCL1 человека Human CXCL1/GRO alpha DuoSet (R&DSYSTEMS), подвергали анализу эпитопа на аминокислотной последовательности CXCL1 человека, распознаваемого способом, аналогичным способу в примере 3.
В результате была выявлена частичная последовательность CXCL1 человека, распознаваемая коммерчески доступным антителом, и представлена в таблице 1.
Пример 4. Определение CXCL1 человека “сэндвич” способом ELISA с использованием моноклонального антитела IgG2b-1 и моноклонального антитела IgG1-10
CXCL1 человека измеряли “сэндвич” способом ELISA, используя антитело IgG2b-1, показанное в примере 3 применительно к специфичному распознаванию участка аминокислотной последовательности, представленного в SEQ ID NO:1, и меченное биотином антитело IgG1-10, показанное в примере 3 применительно к специфичному распознаванию участка аминокислотной последовательности, представленного в SEQ ID NO:3. IgG1-10 подвергали биотилированию с использованием биотина Sulfo-NHS Biotin (PIERCE), согласно вложенным протоколам в отношении деталей. Сначала получали 10 мкг/мл раствора IgG2b-1 в PBS и затем добавляли в 96-луночный планшет из полистирола (Greiner Bio-One) из расчета 100 мкл на лунку, с последующей иммобилизацией в течение ночи. На следующие сутки раствор удаляли, добавляли 200 мкл 1% раствора BSA-PBS (SIGMA) и затем полученный продукт выдерживали в течение 1 часа при комнатной температуре. После этого планшет промывали PBS-T, таким образом, получали планшет, на котором было иммобилизовано очищенное антитело. Затем получали раствор антигена серийным разведением рекомбинантного CXCL1 человека 1% раствором BSA-PBS, от 500 пг/мл до 7,8 пг/мл. Раствор антигена добавляли в планшет из расчета 100 мкл на лунку, с последующим прохождением реакции при комнатной температуре в течение 1 часа. Затем раствор антигена из каждой лунки удаляли, планшет промывали PBS-T и затем 100 мкл 1 мкг/мл меченного биотином IgG1-10, разведенного 1% BSA-PBS, оставляли для прохождения реакции в течение 1 часа при комнатной температуре. После промывания оставляли 100 мкл раствора авидин-HRP (R&D SYSTEMS) для прохождения реакции при комнатной температуре в течение 30 минут. Авидин-HRP также разводили 1% БСА-PBS. После промывания с использованием PBS-T добавляли 100 мкл раствора TMB и проводили реакцию в течение 15 минут. Добавляли 100 мкл 2 н. раствора серной кислоты, чтобы остановить реакцию, и затем измеряли оптическую плотность при 450 нм. Результаты представлены на фиг.1.
Пример 5. Определение CXCL1 человека “сэндвич” способом ELISA с использованием моноклонального антитела IgG2b-1 и моноклонального антитела IgG1-14
CXCL1 человека измеряли “сэндвич” способом ELISA, используя моноклональное антитело IgG2b-1, показанное в примере 3 применительно к специфичному распознаванию участка аминокислотной последовательности, представленного в SEQ ID NO:1, и меченное биотином моноклональное антитело IgG1-14, показанное в примере 3 применительно к специфичному распознаванию участка аминокислотной последовательности, представленного в SEQ ID NO:3. Биотинилирование IgG1-14 и “сэндвич” ELISA проводили аналогично способу в примере 4. Результаты представлены на фиг.1.
Пример 6. Определение CXCL1 человека “сэндвич” способом ELISA с использованием моноклонального антитела IgG1-3 и моноклонального антитела IgG1-14
CXCL1 человека измеряли “сэндвич” способом ELISA, используя антитело IgG1-3, показанное в примере 3 применительно к специфичному распознаванию участка аминокислотной последовательности, представленного в SEQ ID NO:2, и меченное биотином антитело IgG1-14, показанное в примере 3 применительно к специфичному распознавания участка аминокислотной последовательности, представленного в SEQ ID NO:3. Биотинилирование IgG1-14 и “сэндвич” ELISA проводили аналогично способу в примере 4. Результаты представлены на фиг.1.
Сравнительный пример 1. Определение CXCL1 человека “сэндвич” способом ELISA с использованием коммерчески доступного набора
Рекомбинантный CXCL1 человека измеряли, используя коммерчески доступный набор для определения CXCL1 человека, Human CXCL1/GRO alpha DuoSet (R&D SYSTEMS). В данном наборе моноклональное антитело мыши к CXCL1 человека (распознающее аминокислотную последовательность, представленную в SEQ ID NO:2) иммобилизовали и для определения использовали биотинилированное (меченное биотином) поликлональное антитело козы. Иммобилизацию выполняли на 96-луночном планшете из полистирола (Greiner Bio-One). Конкретно, экспериментальные способы выполняли согласно вложенным протоколам. Результаты представлены на фиг.1, 4 и 5.
Результаты примеров 4-6 и сравнительного примера 1 показали, что в сравнении с коммерчески доступным набором для определения CXCL1 человека, используя традиционный способ, иммунологический анализ по настоящему изобретению позволил определить 7,8 пг/мл CXCL1 человека, и чувствительность определения способа иммунологического анализа по настоящему изобретению увеличилась.
Пример 7. Определение CXCL1 человека “сэндвич” способом ELISA с использованием моноклонального антитела IgG2b-1 и смеси моноклональных антител IgG1-10 и IgG1-14
CXCL1 человека измеряли “сэндвич” способом ELISA, используя антитело IgG2b-1, показанное в примере 3 применительно к специфичному распознаванию участка аминокислотной последовательности, представленного в той же SEQ ID NO:1, и меченное биотином антитело IgG1-10, показанное в примере 3 применительно к специфичному распознаванию участка аминокислотной последовательности, представленного в SEQ ID NO:3, или смесь меченного биотином IgG-10 и меченного биотином IgG1-14. Биотинилирование антител и “сэндвич” ELISA проводили аналогично способу в примере 4. Результаты представлены на фиг. 2.
При использовании в качестве меченых антител 2 типов моноклонального антитела, специфично распознающих один и тот же участок аминокислотной последовательности, представленный в SEQ ID NO:3, интенсивность сигнала была более высокой при каждой концентрации, чем интенсивность сигнала в случае одного типа антитела при той же концентрации. Показано, что использование 2 типов антитела приводило к повышенной чувствительности определения CXCL1 человека до большей степени, чем чувствительность определения в случае использования одного типа меченого антитела, распознающего ту же последовательность.
Пример 8. Определение CXCL1 человека, добавленного к моче, “сэндвич” способом ELISA с использованием моноклонального антитела IgG2b-1 и моноклонального антитела IgG1-10 или IgG1-14
CXCL1 человека, добавленный к моче, измеряли “сэндвич” способом ELISA, используя антитело IgG2b-1, показанное в примере 3 применительно к специфичному распознаванию участка аминокислотной последовательности, представленного в SEQ ID NO:1, и меченное биотином антитело IgG1-10 или меченное биотином антитело IgG1-14, показанное в примере 3 применительно к специфичному распознаванию участка аминокислотной последовательности, представленного в SEQ ID NO:3. IgG1-10 и IgG1-14 биотинилировали, используя Sulfo-NHS Biotin (PIERCE), согласно вложенным протоколам в отношении деталей. Сначала получали раствор IgG2b-1 в PBS с концентрацией 10 мкг/мл и затем добавляли в 96-луночный планшет из полистирола (Greiner Bio-One) из расчета 100 мкл на лунку, с последующей иммобилизацией в течение ночи. На следующие сутки раствор удаляли, добавляли 200 мкл 1% раствора BSA-PBS (SIGMA) и полученный в результате продукт выдерживали в течение 1 часа при комнатной температуре. После этого планшет промывали PBS-T, таким образом, получали планшет, на котором было иммобилизовано очищенное антитело. Затем рекомбинантный CXCL1 человека добавляли к моче человека, собранной за сутки, до концентрации 250 пг/мл. Мочу, к которой добавлен антиген, подвергали серийному разведению до 3,9 пг/мл мочой этого же человека и затем раствор добавляли из расчета 100 мкл на лунку, с последующим прохождением реакции в течение 1 часа при комнатной температуре. Затем раствор антигена из каждой лунки удаляли и планшет промывали PBS-T. 100 мкл 1 мкг/мл меченного биотином IgG1-10, разведенного 1% БСА-PBS, оставляли для прохождения реакции в течение 1 часа при комнатной температуре. После промывки оставляли 100 мкл раствора авидин-HRP (R&D SYSTEMS) для прохождения реакции в течение 30 минут при комнатной температуре. Авидин-HRP также разводили 1% БСА-PBS. После промывки с использованием PBS-T добавляли 100 мкл раствора TMB и оставляли для прохождения реакции в течение 15 минут. Добавляли 100 мкл 2 н. раствора серной кислоты для остановки реакции и затем измеряли оптическую плотность при 450 нм. Результаты представлены на фиг.3.
Пример 9. Определение CXCL1 человека, добавленного к моче, “сэндвич” способом ELISA с использованием моноклонального антитела IgG1-3 и моноклонального антитела IgG1-14
CXCL1 человека, добавленный к моче, измеряли “сэндвич” способом ELISA, используя антитело IgG1-3, показанное в примере 3 применительно к специфичному распознаванию участка аминокислотной последовательности, представленного в SEQ ID NO:2, и меченное биотином антитело IgG1-14, показанное в примере 3 применительно к специфичному распознаванию участка аминокислотной последовательности, представленного в SEQ ID NO:3. Биотинилирование антитела и “сэндвич” ELISA проводили аналогично способу в примере 8. Результаты представлены на фиг.3.
Сравнительный пример 2. Определение CXCL1 человека в моче “сэндвич” способом ELISA с использованием коммерчески доступного набора
Рекомбинантный CXCL1 человека, добавленный к моче, измеряли с использованием коммерчески доступного набора для определения CXCL1 человека, Human CXCL1/GRO alpha DuoSet (R&D SYSTEMS). Конкретно, экспериментальные способы выполняли согласно вложенным протоколам. Раствор CXCL1, содержащий мочу человека, получали аналогично способу в примере 8. Результаты представлены на фиг.3.
Исходя из результатов примеров 8-9 и сравнительного примера 2 было показано, что в сравнении с коммерчески доступным набором определения CXCL1 человека, используя традиционный способ, способ иммунологического анализа по настоящему изобретению позволил определить 31,25 пг/мл CXCL1 человека даже в моче и увеличил чувствительность определения.
Пример 10. Определение CXCL1 “сэндвич” способом ELISA с использованием моноклонального антитела, содержащегося в коммерчески доступном наборе, и моноклонального антитела IgG1-10
CXCL1 человека, добавленный к буферу, измеряли “сэндвич” способом ELISA, используя моноклональное антитело мыши, содержащееся в коммерчески доступном наборе, Human CXCL1/GRO alpha DuoSet (R&D SYSTEMS) и показанное в примере 3 применительно к специфичному распознаванию участка аминокислотной последовательности, представленного в SEQ ID NO:2, и меченное биотином антитело IgG1-10, показанное в примере 3 применительно к специфичному распознавания участка аминокислотной последовательности, представленного в SEQ ID NO:3. IgG1-10 подвергали биотинилированию, используя Sulfo-NHS Biotin (PIERCE), согласно вложенным протоколам в отношении деталей. Сначала получали 4 мкг/мл раствора в PBS моноклонального антитела мыши, находящегося в коммерчески доступном наборе, и затем добавляли в 96-луночный планшет из полистирола (Greiner Bio-One) из расчета 100 мкл на лунку, с последующей иммобилизацией в течение ночи. На следующие сутки раствор удаляли, добавляли 200 мкл 1% раствора БСА-PBS (SIGMA) и затем полученный продукт выдерживали в течение 1 часа при комнатной температуре. После этого планшет промывали PBS-T, таким образом, получали планшет, на котором было иммобилизовано очищенное антитело. Затем получали раствор антигена серийным разведением от 500 пг/мл до 7,8 пг/мл рекомбинантного CXCL1 человека 1% раствором БСА-PBS. Раствор антигена добавляли из расчета 100 мкл на лунку и оставляли для прохождения реакции в течение 1 часа при комнатной температуре. Затем удаляли из каждой лунки раствор антигена и планшет промывали PBS-T. 100 мкл 1 мкг/мл меченного биотином IgG1-10, разведенного 1% БСА-PBS, оставляли для прохождения реакции в течение 1 часа при комнатной температуре. После промывания оставляли 100 мкл раствора авидин-HRP (R&D SYSTEMS) для прохождения реакции в течение 30 минут при комнатной температуре. Авидин-HRP также разводили 1% БСА-PBS. После промывания с использованием PBS-T добавляли 100 мкл раствора TMB и оставляли для прохождения реакции в течение 15 минут. Добавляли 100 мкл 2 н. раствора серной кислоты для остановки реакции и затем измеряли оптическую плотность при 450 нм. Результаты представлены на фиг.4.
Показано, что даже при использовании моноклонального антитела, включенного в коммерчески доступный набор в качестве антитела, распознающего SEQ ID NO:2, можно определить 7,8 пг/мл CXCL1 человека “сэндвич” способом ELISA, используя антитело, распознающее SEQ ID NO:3, в комбинации с указанным выше моноклональным антителом. Кроме того, показано, что согласно “сэндвич” способу ELISA с использованием комбинации моноклонального антитела, включенного в коммерчески доступный набор, и антитела, распознающего SEQ ID NO:3, чувствительность определения в результате повышена по сравнению с чувствительностью определения с использованием коммерчески доступного набора, т.е. сравнительный пример 1.
Пример 11. Определение CXCL1 человека способом ELISA с использованием полученного антитела
После получения 10 мкг/мл раствора в PBS каждого из 5 типов антитела, IgG1-1, IgG1-3, IgG1-10, IgG1-14 и IgG2b-1, отобранных в примере 2, раствор PBS добавляли в 96-луночный планшет из полистирола (Greiner Bio-One) из расчета 100 мкл на лунку, с последующей иммобилизацией в течение ночи. На следующие сутки раствор удаляли, добавляли 200 мкл 1% раствора БСА-PBS (SIGMA) и затем полученный в результате продукт выдерживали в течение 1 часа при комнатной температуре. После этого планшет промывали PBS-T, таким образом, получали планшет, на котором было иммобилизовано очищенное антитело. Затем получали раствор антигена серийным разведением рекомбинантного белка CXCL1 человека 1% раствором БСА-PBS, от 125 пг/мл до 15 пг/мл. Раствор антигена добавляли из расчета 100 мкл на лунку, с последующим проведением реакции в течение 1 часа при комнатной температуре. Затем раствор антигена из каждой лунки удаляли, планшет промывали PBS-T и затем 100 мкл 50 нг/мл меченного биотином поликлонального антитела к CXCL1 человека (R&D SYSTEMS), разведенного с использованием 1% БСА-PBS, оставляли для прохождения реакции в течение 1 часа при комнатной температуре. После промывания оставляли 100 мкл раствора авидин-HRP (R&D SYSTEMS) для прохождения реакции в течение 30 минут при комнатной температуре. Авидин-HRP также разводили 1% БСА-PBS. После промывания PBS-T добавляли 100 мкл раствора TMB и оставляли для прохождения реакции в течение 15 минут. Добавляли 100 мкл 2 н. раствора серной кислоты для остановки реакции и затем измеряли оптическую плотность при 450 нм. Результаты представлены на фиг.5.
Исходя из результатов примеров 10 и 11 и сравнительного примера 1 было показано, что все антитела IgG1-1, IgG1-3, IgG1-10, IgG1-14 и IgG2b-1 по настоящему изобретению продемонстрировали интенсивность сигнала более высокую, чем интенсивность сигнала, полученная от коммерчески доступного антитела, и, таким образом, обладают более высоким потенциалом для CXCL1 человека.
Пример 12. Определение CXCL1 человека в плазме крови с использованием полученного антитела
CXCL1 человека, растворенный в плазме крови, определяли с использованием 5 типов антитела, IgG1-1, IgG1-3, IgG1-10, IgG1-14 и IgG2b-1, отобранных в примере 2.
Сначала для каждого антитела получали 10 мкг/мл раствора PBS и добавляли в 96-луночный планшет из полистирола (Greiner Bio-One) из расчета 100 мкл на лунку, с последующей иммобилизацией в течение ночи.
На следующие сутки раствор удаляли, добавляли 200 мкл 1% раствора БСА-PBS (SIGMA), разведенного в 4 раза, и полученный в результате продукт выдерживали в течение 1 часа при комнатной температуре. После промывания PBS-T получали планшет, на котором было иммобилизовано очищенное антитело.
Затем получали раствор плазмы крови, содержащий 500 пг/мл рекомбинантного белка CXCL1 человека. Получали серию разведений для раствора антигена в плазме крови путем серийного разведения указанного выше раствора, используя ту же плазму крови, до 125 пг/мл. Каждый раствор антигена добавляли из расчета 100 мкл на лунку, оставляли для прохождения реакции в течение 1 часа при комнатной температуре и затем удаляли раствор антигена с последующим промыванием PBS-T.
После этого добавляли 100 мкл 50 нг/мл меченного биотином поликлонального антитела к CXCL1 человека (R&D SYSTEMS), разведенного 1% раствором БСА-PBS, и оставляли для прохождения реакции в течение 1 часа при комнатной температуре. После промывания оставляли 100 мкл раствора авидин-HRP (R&D SYSTEMS), разведенного 1% БСА-PBS, для прохождения реакции в течение 30 минут при комнатной температуре. После промывания PBS-T добавляли 100 мкл раствора TMB и оставляли для прохождения реакции в течение 15 минут. Добавляли 100 мкл 2 н. раствора серной кислоты для остановки реакции и затем измеряли оптическую плотность при 450 нм. Результаты представлены на фиг. 6.
Сравнительный пример 3. Определение CXCL1 человека в плазме крови с использованием коммерчески доступного антитела
CXCL1 человека, растворенный в плазме крови, определяли с использованием MAB275 (R&D SYSTEMS), который представлял собой коммерчески доступное моноклональное антитело к CXCL1 человека. Получали 10 мкг/мл раствора MAB275, разведенного PBS, и затем добавляли в 96-луночный планшет из полистирола (Greiner Bio-One) из расчета 100 мкл на лунку, с последующей иммобилизацией в течение ночи. Последующие процедуры осуществляли способом, аналогичным способу в примере 6. Результаты представлены на фиг.6.
Исходя из результатов примера 12 и сравнительного примера 3 было показано, что CXCL1 человека, растворенный в плазме крови, можно также определять, используя 5 типов антител по настоящему изобретению.
Пример 13. Определение CXCL1 человека в моче с использованием полученного антитела
CXCL1 человека, растворенный в моче, определяли с использованием 5 типов антител, IgG1-1, IgG1-3, IgG1-10, IgG1-14 и IgG2b-1, отобранных в примере 2.
Сначала получали раствор каждого антитела в PBS (10 мкг/мл) и затем добавляли в 96-луночный планшет из полистирола (Greiner Bio-One) из расчета 100 мкл на лунку, с последующей иммобилизацией в течение ночи. На следующие сутки раствор удаляли, добавляли 200 мкл 1% раствора БСА-PBS (SIGMA), разведенного в 4 раза, и затем полученный в результате продукт выдерживали в течение 1 часа при комнатной температуре. После промывания с использованием PBS-T получали планшет, на котором было иммобилизовано очищенное антитело.
Затем получали раствор мочи, содержащий 500 пг/мл рекомбинантного белка CXCL1 человека. Получали серии разведений для раствора антигена в моче путем серийного разведения раствора антигена в моче до 125 пг/мл той же самой мочой. Каждый раствор антигена в моче добавляли из расчета 100 мкл на лунку, с последующим прохождением реакции в течение 1 часа при комнатной температуре. Раствор антигена удаляли и затем лунки промывали PBS-T.
После этого добавляли 100 мкл 50 нг/мл меченного биотином поликлонального антитела к CXCL1 человека (R&D SYSTEMS), разведенного 1% БСА-PBS, и оставляли для прохождения реакции в течение 1 часа при комнатной температуре. После промывания оставляли 100 мкл раствора авидин-HRP (R&D SYSTEMS), разведенного 1% БСА-PBS, для прохождения реакции в течение 30 минут при комнатной температуре. После промывания PBS-T добавляли 100 мкл раствора TMB и оставляли для прохождения реакции в течение 15 минут. Добавляли 100 мкл 2 н. раствора серной кислоты для остановки реакции и затем измеряли оптическую плотность при 450 нм. Результаты представлены на фиг.7.
Сравнительный пример 4. Определение CXCL1 человека в моче с использованием коммерчески доступного антитела
CXCL1 человека, растворенный в моче, определяли с использованием коммерчески доступного моноклонального антитела к CXCL1 человека, MAB275 (R&D SYSTEMS). Получали 10 мкг/мл раствора MAB275, разведенного PBS, и затем добавляли в 96-луночный планшет из полистирола (Greiner Bio-One) из расчета 100 мкл на лунку, с последующей иммобилизацией в течение ночи. Последующие процедуры выполняли способом, аналогичным способу в примере 13. Результаты представлены на фиг.7.
Исходя из результатов примера 13 и сравнительного примера 4 было показано, что CXCL1 человека, растворенный в моче, можно определить с использованием 4 из 5 типов антител по настоящему изобретению.
Пример 14. Эксперимент (1) по измерению активности подавления способности к инвазии у злокачественных клеток мочевого пузыря с использованием моноклональных антител IgG1-1, IgG1-3, IgG1-10, IgG1-14 и IgG2b-1
Для 5 типов антител, IgG1-1, IgG1-3, IgG1-10, IgG1-14 и IgG2b-1, отобранных в примере 2, определяли активность подавления, которая снижает способность к инвазии у злокачественных клеток мочевого пузыря.
Сначала клетки T24, которые представляют собой злокачественные клетки мочевого пузыря, инокулировали в среду RPMI1640, дополненную 10% FCS и 12,5 мМ HEPES, из расчета 1,0×105 клеток/мл, с последующим предварительным культивированием в течение 40 часов. После предварительного культивирования клетки собирали и затем смешивали с каждым из антител для получения растворов клеток. Каждый раствор клеток подвергали измерению на способность к инвазии, используя Matrigel Invasion Chamber (BD Falcon), согласно вложенным протоколам в отношении деталей. Добавляли 100 мкл суспензии 2,0×105 клеток/мл в PBS и каждое антитело добавляли до конечной концентрации 10 мкг/мл в Matrigel Invasion Chamber. Инвазию культуры проводили при 37°C в атмосфере 5% CO2 в течение 5 часов. После культивирования нижнюю часть камеры окрашивали реагентом Diff-Quick (Sysmex) и затем подсчитывали количество злокачественных клеток мочевого пузыря, которые проникли в нижнюю часть камеры. Используя микроскоп, подсчитывали количество клеток в пределах 5 полей зрения, каждое размером 0,8 см × 0,6 см, и затем оценивали результаты. В каждом случае измерение проводили два раза (n=2). Суммарное значение усреднено и представлено на фиг.8.
Сравнительный пример 5. Эксперимент по измерению активности подавления способности к инвазии у злокачественных клеток мочевого пузыря с использованием коммерчески доступного антитела
У коммерчески доступного моноклонального антитела к CXCL1 человека, MAB275 (R&D SYSTEMS), измеряли активность подавления, которая снижает способность к инвазии у злокачественных клеток мочевого пузыря. Измерение проводили способом, аналогичном способу в примере 14. Результаты представлены на фиг.8.
Как показано в примере 14 и сравнительном примере 5, 5 антител по настоящему изобретению продемонстрировали равную или более высокую активность подавления, чем активность подавления коммерчески доступного антитела, и конкретно, высокую активность продемонстрировали IgG1-1, IgG1-10, IgG1-14 и IgG2b-1.
Пример 15. Эксперимент (2) по измерению активности подавления способности к инвазии у злокачественных клеток мочевого пузыря с использованием моноклональных антител IgG1-3, IgG1-10, IgG1-14 и IgG2b-1
Из 5 типов антител, отобранных в примере 2, у 4 типов (IgG1-3, IgG1-10, IgG1-14 и IgG2b-1) измеряли активность подавления, которая снижает способность к инвазии у злокачественных клеток мочевого пузыря. В частности, в отличие от примера 14, антитела не смешивали непосредственно перед измерением способности к инвазии, но смешивали на стадии предварительного культивирования.
Сначала клетки T24, которые представляют собой злокачественные клетки мочевого пузыря, инокулировали в среду RPMI1640, дополненную 10% FCS и 12,5 мМ HEPES, из расчета 1,0×105 клеток/мл и затем каждое антитело добавляли до конечной концентрации 10 мкг/мл, с последующим культивированием в течение 40 часов. После культивирования клетки собирали и затем смешивали с каждым антителом для получения растворов клеток. Для каждого раствора клеток проводили измерение способности к инвазии, используя Matrigel Invasion Chamber (BD Falcon). После этого выполняли эксперимент, аналогичный эксперименту в примере 14, но только время для инвазии культуры было изменено и составляло 6,5 часов. Подсчитывали количество клеток, которые осуществили инвазию, способом, аналогичным способу в примере 14. Результаты представлены на фиг.8.
Сравнительный пример 6. Эксперимент 2 по измерению активности подавления способности к инвазии у злокачественных клеток мочевого пузыря с использованием коммерчески доступного антитела
Для MAB275 (R&D SYSTEMS), которое представляло собой коммерчески доступное моноклональное антитело к CXCL1 человека, проводили измерение способности к подавлению, которая снижает способность к инвазии у злокачественных клеток мочевого пузыря. В отличие от сравнительного примера 5, антитело не смешивали непосредственно перед измерением способности к инвазии, но смешивали на стадии предварительного культивирования. Это осуществляли способом, аналогичным способу в примере 15. Результаты представлены на фиг.9.
Исходя из результатов примера 15 и сравнительного примера 6 все 4 антитела, включенные в настоящее изобретение, продемонстрировали способность к подавлению более высокую, чем способность к подавлению коммерчески доступного антитела.
Промышленное применение
По настоящему изобретению, концентрацию CXCL1 человека можно измерять способом по настоящему изобретению с более высокой чувствительностью, чем у общепринятых способов. Таким образом, настоящее изобретение является применимым для определения злокачественной опухоли, такой как злокачественная опухоль уротелия.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДОТВРАЩЕНИЯ РАКА ЖЕЛЧНОГО ПУЗЫРЯ | 2013 |
|
RU2649802C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ РАКА | 2013 |
|
RU2631804C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДОТВРАЩЕНИЯ РАКА ПЕЧЕНИ | 2013 |
|
RU2640245C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2012 |
|
RU2641260C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ РАКА | 2013 |
|
RU2633505C2 |
| СПОСОБЫ РАЗРУШЕНИЯ КЛЕТОК С ИСПОЛЬЗОВАНИЕМ ЭФФЕКТОРНЫХ ФУНКЦИЙ АНТИ-EphA4 АНТИТЕЛ | 2007 |
|
RU2429246C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ РАКА | 2011 |
|
RU2607366C2 |
| ДИАГНОСТИКА И ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛА ПРОТИВ EREG | 2007 |
|
RU2537245C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ РАКА | 2013 |
|
RU2632645C2 |
| ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА К ОНКОСТАТИНУ М И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2600444C2 |
























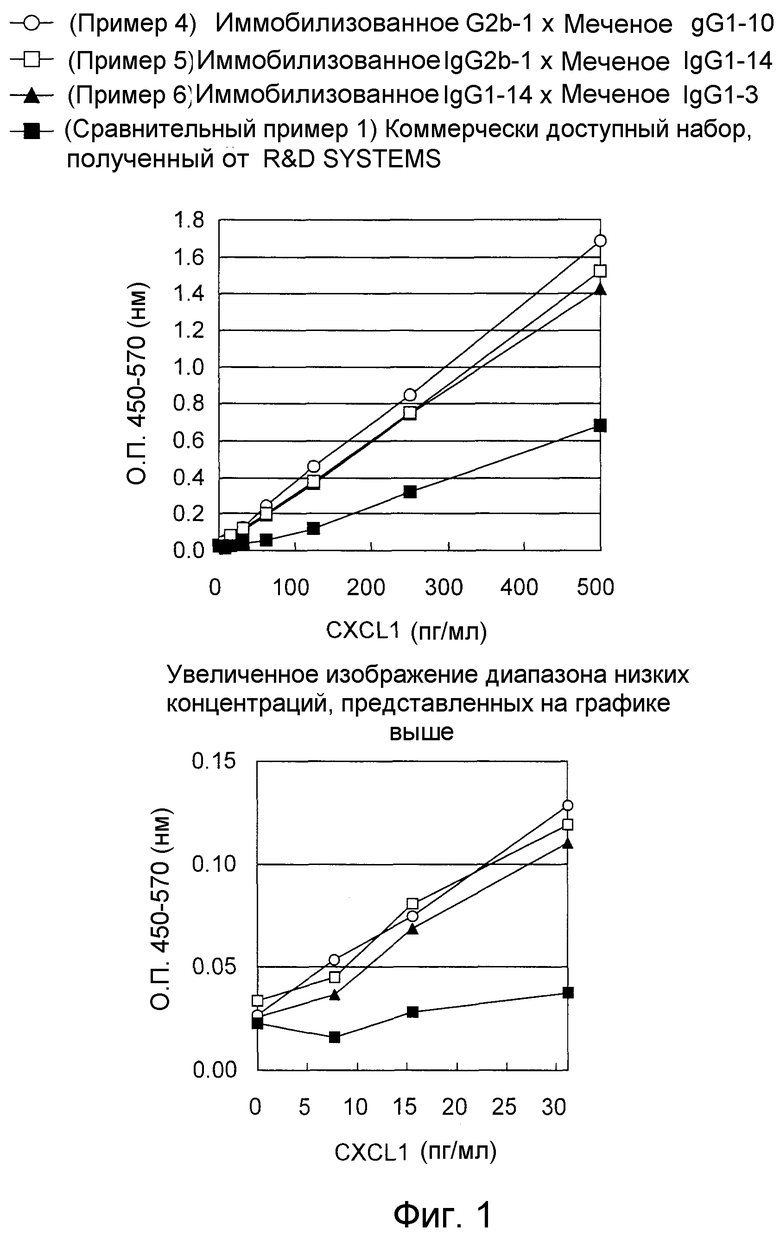
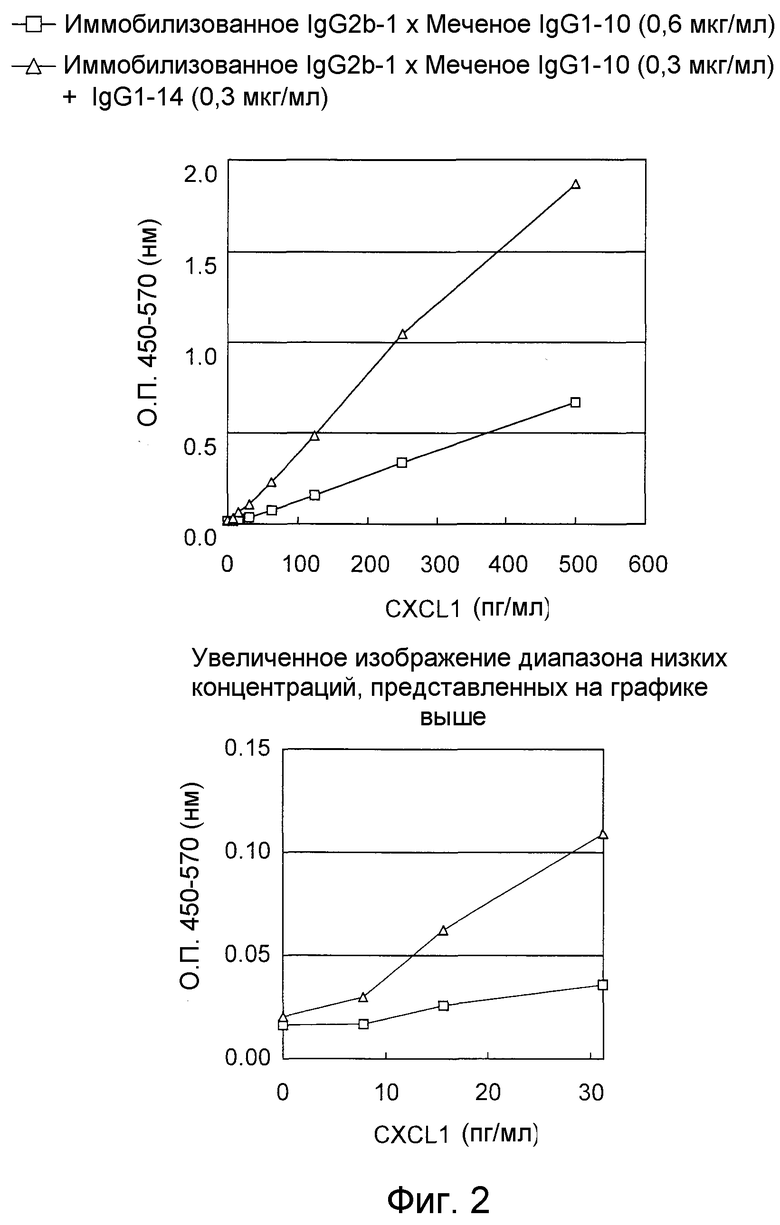
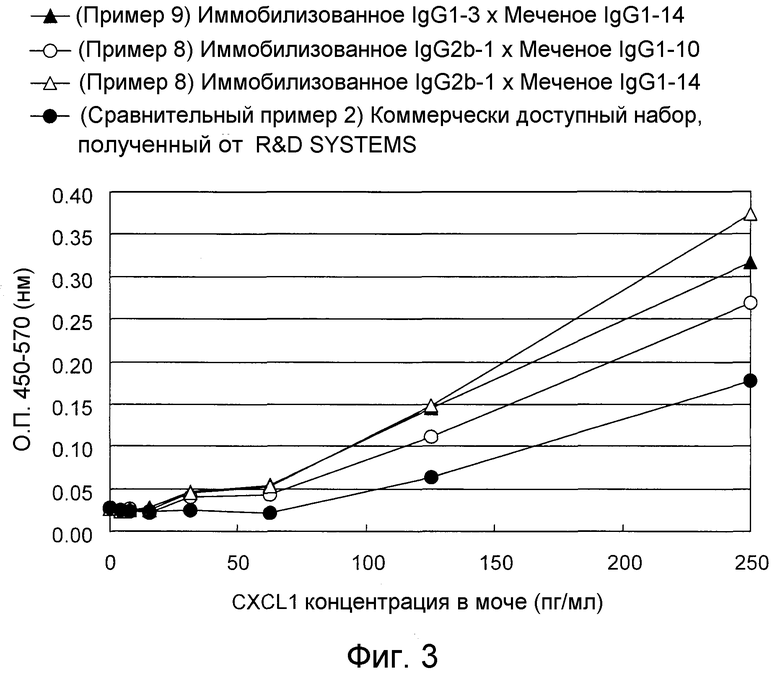
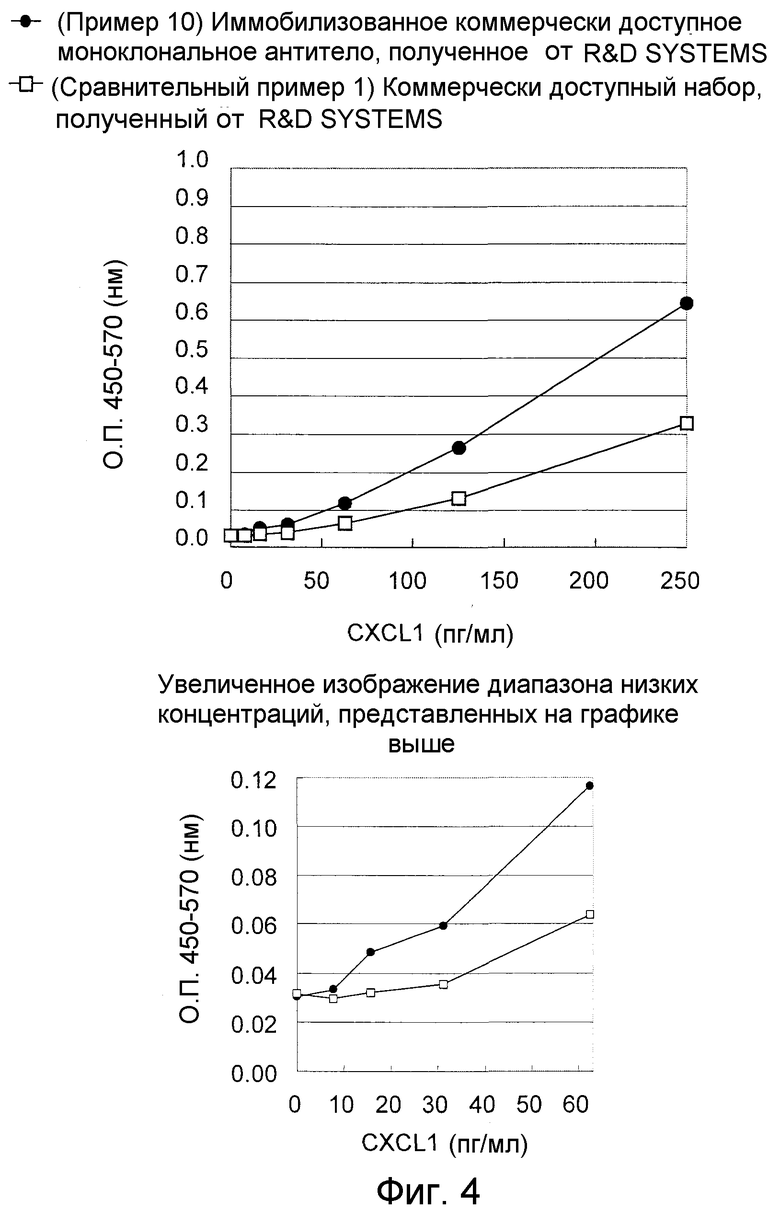
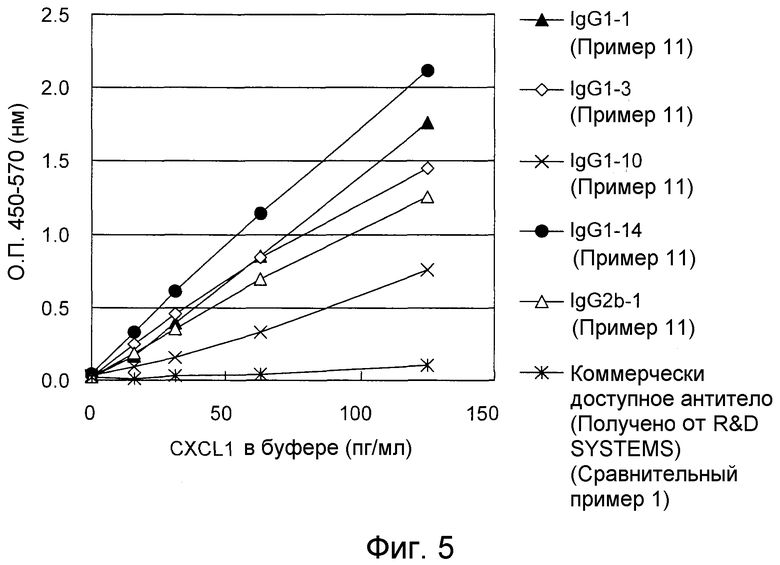
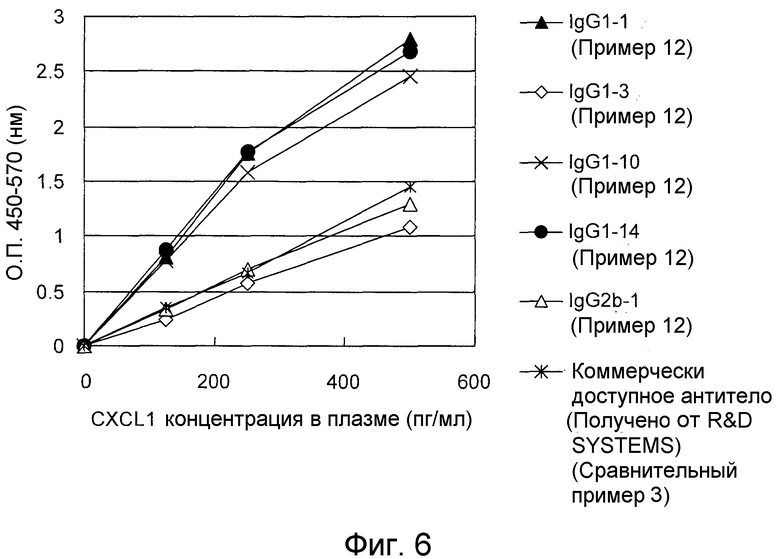

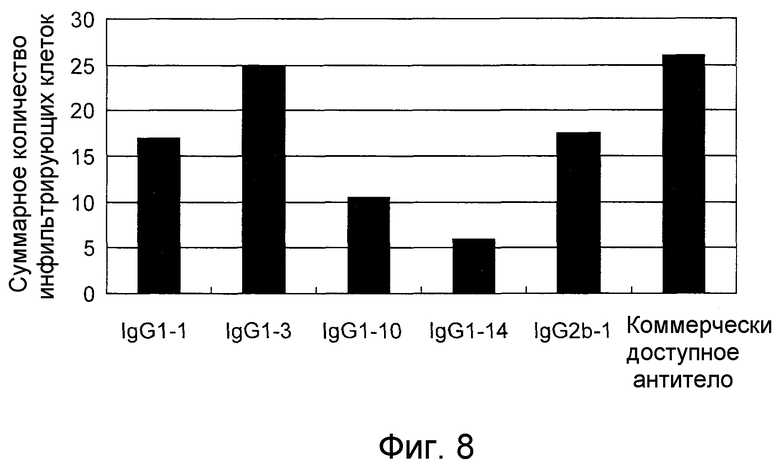

Изобретение относится к биохимии. Описан способ иммунологического анализа белка CXCL1 человека. Измеряют CXCL1 человека или его фрагмент в образце, используя два или более типов моноклональных антител к CXCL1 человека или их фрагменты. Каждый из двух или более типов моноклональных антител к CXCL1 человека или их фрагментов специфично распознают любой из участков последовательности аминокислотных последовательностей, представленных в SEQ ID NO:1-3, которые представляют собой частичные последовательности аминокислотной последовательности, составляющей белок CXCL1 человека. При этом два или более типов моноклональных антител к CXCL1 человека или их фрагментов специфично распознают участки последовательности, отличающиеся друг от друга. Представлены моноклональные антитела или их фрагменты, каждый из которых специфично распознает любой участок аминокислотной последовательности, представленный в SEQ ID NO:1-3, и имеет новую аминокислотную последовательность. Изобретение позволяет определять с высокой чувствительностью белок CXCL1 человека. 6 н. и 9 з.п. ф-лы, 9 ил., 1 табл., 21 пр.
1. Способ иммунологического анализа белка CXCL1 человека, включающий количественное определение CXCL1 человека или его фрагмента в образце, используя два или три моноклональных антител против CXCL1 человека или их фрагменты, где:
моноклональные антитела против CXCL1 человека или их антигенсвязывающие фрагменты специфично распознают любой из участков последовательности аминокислотных последовательностей, представленных в SEQ ID NO:1-3, которые представляют собой частичные последовательности аминокислотной последовательности, составляющей белок CXCL1 человека; и дополнительно
по меньшей мере два моноклональных антитела против CXCL1 человека или их антигенсвязывающих фрагмента распознают отличные друг от друга участки последовательности.
2. Способ иммунологического анализа белка CXCL1 человека по п.1, посредством которого белок CXCL1 человека или его фрагмент в образце количественно определяют, используя моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:3.
3. Способ иммунологического анализа белка CXCL1 человека по п.1 или 2, посредством которого белок CXCL1 человека или его фрагмент в образце количественно определяют, используя моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:1, и моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:3.
4. Способ иммунологического анализа белка CXCL1 человека по п.1 или 2, посредством которого белок CXCL1 человека или его фрагмент в образце количественно определяют, используя моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:2, и моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:3.
5. Способ иммунологического анализа белка CXCL1 человека по п.1 или 2, где образец представляет собой ткань, полученную после оперативного вмешательства, кровь, сыворотку, плазму крови, мочу, спинномозговую жидкость, слюну, лимфу, слезную жидкость или семенную жидкость.
6. Моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:3, где:
в составе легких цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:4, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:5, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:6;
в составе тяжелых цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:7, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:8, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:9.
7. Моноклональное антитело к CXCL1 человека или его фрагмент по п.6, содержащее аминокислотную последовательность, представленную в SEQ ID NO:10, в вариабельной области легкой цепи и аминокислотную последовательность, представленную в SEQ ID NO:11, в вариабельной области тяжелой цепи.
8. Моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:1, где:
в составе легких цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:12, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:13, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:14; и
в составе тяжелых цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:15, CDRR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:16, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:17.
9. Моноклональное антитело к CXCL1 человека или его фрагмент по п.8, содержащее аминокислотную последовательность, представленную в SEQ ID NO:18, в вариабельной области легкой цепи и аминокислотную последовательность, представленную в SEQ ID NO:19, в вариабельной области тяжелой цепи.
10. Моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:3, где:
в составе легких цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:20, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:21, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:22; и
в составе тяжелых цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:23, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:24, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:25.
11. Моноклональное антитело к CXCL1 человека или его фрагмент по п.10, содержащее аминокислотную последовательность, представленную в SEQ ID NO:26, в вариабельной области легкой цепи и аминокислотную последовательность, представленную в SEQ ID NO:27, в вариабельной области тяжелой цепи.
12. Моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:2, где:
в составе легких цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:28, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:29, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:30; и
в составе тяжелых цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:31, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:32, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:33.
13. Моноклональное антитело к CXCL1 человека или его фрагмент по п.12, содержащее аминокислотную последовательность, представленную в SEQ ID NO:34, в вариабельной области легкой цепи и аминокислотную последовательность, представленную в SEQ ID NO:35, в вариабельной области тяжелой цепи.
14. Моноклональное антитело к CXCL1 человека или его фрагмент, которое специфично распознает участок аминокислотной последовательности, представленный в SEQ ID NO:3, где:
в составе легких цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:36, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:37, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:38; и
в составе тяжелых цепей, CDR1 содержит аминокислотную последовательность, представленную в SEQ ID NO:39, CDR2 содержит аминокислотную последовательность, представленную в SEQ ID NO:40, и CDR3 содержит аминокислотную последовательность, представленную в SEQ ID NO:41.
15. Моноклональное антитело к CXCL1 человека или его фрагмент по п.14, содержащее аминокислотную последовательность, представленную в SEQ ID NO:42, в вариабельной области легкой цепи и аминокислотную последовательность, представленную в SEQ ID NO:43, в вариабельной области тяжелой цепи.
| WO 2006074430 A2, 13.07.2006 | |||
| СПОСОБ ЗАПИСИ И ВОСПРОИЗВЕДЕНИЯ ЗВУКА | 1929 |
|
SU16041A1 |
Авторы
Даты
2014-07-10—Публикация
2009-10-29—Подача