По настоящей заявке испрашивается приоритет предварительной заявки США No. 60/777794, поданной 28 февраля 2006, содержание которой включено в настоящее описание в качестве ссылки в полном объеме.
Область техники
Настоящее изобретение относится к способам разрушения клеток с использованием эффекторной функции анти-EphA4 антител и к композициям, в которых они используются.
Уровень техники
Рак поджелудочной железы имеет самый высокий показатель смертности среди злокачественных новообразований, и продолжительность жизни пациентов в 4% составляет 5 лет. Каждый год приблизительно у 28000 пациентов диагностируют рак поджелудочной железы, и почти все пациенты умирают от этого заболевания. (Greenlee, R. T., et al., (2001) CA Cancer J Clin, 51:15-36). Неблагоприятный прогноз этого заболевания связан с трудностями ранней диагностики и слабой отвечаемости на существующие в настоящее время способы лечения (Greenlee, R. T., et al., (2001) CA Cancer J Clin, 51:15-36, Klinkenbijl, J. H., et al., (1999) Ann Surg, 230: 776-82; обсуждение 782-4.). В частности, в настоящее время отсутствуют идентифицированные опухолевые маркеры, которые позволяют проводить надежный скрининг на ранней, потенциально излечимой стадии заболевания.
В исследовании, направленном на выяснение механизмов канцерогенеза, был обнаружен целый ряд подходящих молекул-мишеней для разработки противоопухолевых средств. Например, было показано, что ингибитор фарнезилтрансферазы (FTI) является эффективным при лечении Ras-зависимых опухолей на животных моделях (Sun J et al., (1998) Oncogene, 16:1467-73.). Это фармацевтическое средство было разработано для ингибирования путей передачи сигналов факторов роста, относящихся к Ras, которые зависят от посттранкрипционного фарнезилирования. Клинические испытания у людей с применением противоопухолевых средств в сочетании с анти-HER2 моноклональным антителом, трастузумабом для получения антагонистического действия в отношении прото-онкогена HER2/neu, показали успешное улучшение клинического ответа и улучшение общего коэффициента выживаемости у пациентов с раком груди. Ингибитор тирозинкиназы STI-571 представляет собой ингибитор, который селективно дезактивирует слитый белок bcr-ab1. Это фармацевтическое средство было разработано для лечения хронического миелолейкоза, при котором значительную роль в трансформации лейкоцитов играет постоянная активация тирозинкиназы bcr-ab1. Такие фармацевтические средства предназначены для подавления канцерогенной активности специфических генных продуктов (Molina MA, et al., (2000) Cancer Res, 16:4744-9). Таким образом, потенциальными мишенями для разработки новых противоопухолевых средств в основном являются генные продукты с активированной экспрессией злокачественных клеток.
Другая терапевтическая стратегия включает применение антител, которые связываются со злокачественными клетками. Ниже представлены некоторые характерные подходы, использующиеся при лечении злокачественных заболеваний антителами:
терапия Missile: в этом подходе фармацевтическое средство связывают с антителом, которое специфически связывается со злокачественными клетками, тем самым давая возможность этому средству специфически воздействовать на злокачественные клетки. Такое нацеленное распределение позволяет интенсивно воздействовать на злокачественные клетки даже тем средствам, которые оказывают серьезные побочные эффекты. Кроме фармацевтических средств, также были описаны подходы, когда с антителом связывают предшественников фармацевтических средств, ферменты, которые метаболизируют эти предшественники до активной формы, и так далее.
Применение антител, которые нацеливают функциональные молекулы: в этом подходе ингибируется связывание факторов роста и злокачественных клеток благодаря использованию, например, антител, которые связываются с рецепторами факторов роста или факторами роста. Пролиферация некоторых злокачественных клеток в значительной степени зависит от факторов роста. Например, известно, что некоторые типы рака зависят от эпителиального фактора роста (EGF) или фактора роста эндотелия сосудов (VEGF) для роста клеток. Для таких типов рака можно предположить, что ингибирование связывания факторов роста и злокачественных клеток будет иметь терапевтический эффект.
Цитотоксичность антител: антитела, которые связываются с определенными видами антигенов, могут быть цитотоксичными для злокачественных клеток. С такими типами антител молекула антитела сама обладает непосредственным противоопухолевым действием. Антитела, которые демонстрируют цитотоксичность в отношении злокачественных клеток, привлекают внимание в качестве препаратов антител, как предполагается, будут иметь высокую противоопухолевую эффективность.
Описание изобретения
Авторами настоящего изобретения ранее была представлена информация о том, что EphA4 является геном, связанным с раком поджелудочной железы, экспрессия которого активирована в злокачественных клетках поджелудочной железы. См. WO2004/031412, приведенную в качестве ссылки в полном объеме. Кроме того, авторы представили сведения о том, что siРНК против EphA4 супрессирует пролиферацию клеток поджелудочной железы. См. WO2005/083086, приведенную в качестве ссылки в полном объеме. В настоящей заявке авторы изобретения исследовали антитела, способные индуцировать цитотоксичность, уделяя большое внимание генам, таким как EphA4, которые проявляют повышенную экспрессию в злокачественных клетках. Результаты показали, что сильная цитотоксичность может быть индуцирована в клетках, экспрессирующих EphA4, если эти клетки контактируют с анти-EphA4 антителами, таким образом, было создано настоящее изобретение.
В частности, настоящее изобретение относится к следующим фармацевтическим композициям или способам:
[1] фармацевтической композиции для разрушения клеток, экспрессирующих EphA4, эта композиция содержит в качестве активного ингредиента анти-EphA4 антитело, которое обладает эффекторной функцией антитела;
[2] фармацевтической композиции по пункту [1], при этом клетка, экспрессирующая EphA4, представляет собой злокачественную клетку поджелудочной железы;
[3] фармацевтической композиции по пункту [1], в которой анти-EphA4 антитело представляет собой моноклональное антитело;
[4] фармацевтической композиции по пункту [1], в которой эффекторная функция антитела представляет собой либо антитело-зависимую цитотоксичность, либо комплемент-зависимую цитотоксичность, либо и то, и другое;
[5] фармацевтической композиции по пункту [1], в которой антитело состоит из цепи VH и VL, каждая цепь VH и VL содержит аминокислотные последовательности CDR, обозначенные как CDR1, CDR2 и CDR3, разделенные аминокислотными последовательностями каркаса, аминокислотная последовательность каждой CDR в каждой цепи VH и VL выбрана из группы, состоящей из:
VHCDR1 человека: ELSMH (SEQ ID NO:10),
VH CDR2 человека: GFDPEDGETIYAQKFQG (SEQ ID NO:11),
VH CDR3 человека: AQPFHWGDDAFDI (SEQ ID NO:12),
VL CDR1 человека: SGSSSNIGSNTVN (SEQ ID NO:15),
VL CDR2 человека: SNNQRPS (SEQ ID NO:16),
VL CDR3 человека: AAWDDSLNGPV (SEQ ID NO:17); и
VH CDR1 человека: SNSAAWN (SEQ ID NO:20),
VH CDR2 человека: RTYYRSKWYNDYAVSVKS (SEQ ID NO:21),
VH CDR3 человека: DSLRSFDY (SEQ ID NO:22),
VL CDR1 человека: SGSSSNIGNNYVS (SEQ ID NO:24),
VL CDR2 человека: DNNKRPS (SEQ ID NO:25),
VL CDR3 человека: GTWDSSLSAVV (SEQ ID NO:26);
[6] композиции по пункту [5], где VH человека соответствует аминокислотной последовательности SEQ ID NO:27 или 29, а VL человека соответствует аминокислотной последовательности SEQ ID NO:28 или 30;
[7] композиции по пункту [5], где антитело дополнительно включает Fc домен IgG1 человека;
[8] антителу, состоящему из цепи VH и VL, каждая цепь VH и VL содержит аминокислотные последовательности CDR, обозначенные как CDR1, CDR2 и CDR3, разделенные аминокислотными последовательностями каркаса, аминокислотная последовательность каждой CDR в каждой цепи VH и VL выбрана из группы, состоящей из:
VH CDR1 человека: ELSMH (SEQ ID NO:10),
VH CDR2 человека: GFDPEDGETIYAQKFQG (SEQ ID NO:11),
VH CDR3 человека: AQPFHWGDDAFDI (SEQ ID NO:12),
VL CDR1 человека: SGSSSNIGSNTVN (SEQ ID NO:15),
VL CDR2 человека: SNNQRPS (SEQ ID NO:16),
VL CDR3 человека: AAWDDSLNGPV (SEQ ID NO:17); и
VH CDR1 человека: SNSAAWN (SEQ ID NO:20),
VH CDR2 человека: RTYYRSKWYNDYAVSVKS (SEQ ID NO:21),
VH CDR3 человека: DSLRSFDY (SEQ ID NO:22),
VL CDR1 человека: SGSSSNIGNNYVS (SEQ ID NO:24),
VL CDR2 человека: DNNKRPS (SEQ ID NO:25),
VL CDR3 человека: GTWDSSLSAVV (SEQ ID NO:26);
[9] антителу по пункту [8], в котором VH человека соответствует аминокислотной последовательности SEQ ID NO:27 или 29, а VL человека соответствует аминокислотной последовательности SEQ ID NO:28 или 30;
[10] антителу по пункту [8], дополнительно включающему Fc домен IgG1 человека;
[11] выделенному полинуклеотиду, кодирующему антитело по пункту [8];
[12] вектору, содержащему полинуклеотид по пункту [11];
[13] выделенной клетке-хозяину, содержащей вектор по пункту [12];
[14] способу получения антитела, включающему стадии культивирования клетки-хозяина по пункту [13], так, чтобы экспрессировался полинуклеотид, и восстановления антитела из культуры клетки-хозяина;
[15] фармацевтической композиции для разрушения клеток, экспрессирующих EphA4, содержащей полинуклеотид по пункту [11], или вектору, содержащему полинуклеотид;
[16] способу разрушения клеток, экспрессирующих EphA4, включающему стадии:
а) контактирования клеток, экспрессирующих EphA4, с анти-EphA4 антителом, и
b) разрушения клеток, экспрессирующих EphA4, под действием эффекторной функции антитела, связавшегося с клеткой;
[17] иммуногенной композиции для индукции антитела, которое обладает эффекторной функцией в отношении клеток, экспрессирующих EphA4, содержащей в качестве активного ингредиента EphA4 его иммунологически активный фрагмент или ДНК, которая может экспрессировать EphA4, или его иммунологически активный фрагмент;
[18] способу индукции антитела, которое обладает эффекторной функцией в отношении клетки, экспрессирующей EphA4, включающему стадию введения EphA4, его иммунологически активного фрагмента или клетки, или ДНК, которая экспрессирует EphA4, или его иммунологически активный фрагмент; и
[19] способу лечения или профилактики рака поджелудочной железы у пациента, включающему стадию введения указанному пациенту фармацевтически эффективного количества анти-EphA4 антитела, или его иммунологически активного фрагмента, при этом антитело обладает эффекторной функцией антитела.
Настоящее изобретение относится к фармацевтическим композициям для разрушения клеток, экспрессирующих EphA4, за счет эффекторной функции антитела, содержащим в качестве активного ингредиента анти-EphA4 антитело. Настоящее изобретение также относится к применению анти-EphA4 антитела для получения фармацевтических композиций для разрушения клеток, экспрессирующих EphA4, с использованием эффекторной функции анти-EphA4 антитела. Фармацевтические композиции по настоящему изобретению состоят из анти-EphA4 антител и фармацевтически приемлемых носителей.
Авторы настоящего изобретения использовали микрочипы кДНК для анализа генной экспрессии злокачественных клеток предстательной железы или поджелудочной железы, а нормальные клетки получали у пациентов с раком предстательной железы или поджелудочной железы. Затем был идентифицирован ряд генов, экспрессия которых специфически повышена в злокачественных клетках поджелудочной железы. Среди этих генов с измененной экспрессией в злокачественных клетках поджелудочной железы, один из генов, ген рецептора Eph A4 (обозначенный как «EphA4»), кодирующий цитоплазматический мембранный белок с низким уровнем экспрессии в основных органах, был выбран в качестве кандидатного гена-мишени для лечения рака поджелудочной железы (Nakamura T, et al., (2004) Oncogene. 2004 Mar 25;23(13):2385-400). Выбирая гены с пониженным уровнем экспрессии в основных органах, предполагалось, что можно будет избежать опасности побочных эффектов. Было подтверждено, что из белков, кодируемых генами, выбранными таким образом, анти-EphA4 антитела обладают эффекторной функцией в отношении клеток, экспрессирующих EphA4.
Данные, полученные авторами настоящего изобретения, показывают, что в усиленной экспрессионной системе, EphA4, меченный c-myc-His, был локализован в цитоплазматической мембране, что подтвердилось при иммунофлуоресцентной микроскопии. Ген EphA4 кодирует аминокислотную последовательность, которая, как предполагали, функционирует как сигнальный пептид на его N-конце. Как указано выше, было отмечено, что этот белок преимущественно локализован на цитоплазматической мембране, и, следовательно, было сделано предположение, что он является трансмембранным белком. Кроме того, пониженный уровень экспрессии этого гена в основных органах и его повышенная экспрессия в злокачественных клетках поджелудочной железы определили EphA4 в качестве подходящего клинического маркера и терапевтической мишени.
Условия, необходимые для разрушения злокачественных клеток с помощью эффекторной функции, например, включают следующее:
- экспрессию большого числа молекул антигена на поверхности мембраны злокачественных клеток,
- одинаковое распределение антигенов в злокачественной ткани,
- задержку связывания антигенов с антителами на клеточной поверхности в течение длительного времени.
Более конкретно, например, антигены, распознаваемые антителами, должны экспрессироваться на поверхности клеточной мембраны. Кроме того, предпочтительно, чтобы соотношение антиген-положительных клеток было на максимально высоком уровне в клетках, формирующих злокачественные ткани. В идеале, все злокачественные клетки являются антиген-положительными. В тех случаях, когда антиген-положительные и отрицательные клетки перемешаны в популяции злокачественных клеток, клинический терапевтический эффект антител, специфичных к ним, будет значительно снижен.
В основном, если на клеточной поверхности экспрессируется максимально возможное число молекул, то можно ожидать эффективные эффекторные функции. Также важно, чтобы антитело, связанное с таким антигеном, не проникало в клетки. Некоторые рецепторы проникают в клетки (эндоцитоз) после связывания с лигандом. Аналогично, антитела, связанные с антигенами клеточной поверхности также могут проникать в клетки. Этот феномен, посредством которого антитела, связанные с антигенами клеточной поверхности, проникают в клетку, называется интернализацией. При интернализации константная область антитела (Fc) проникает в клетку. Однако клетки или молекулы, необходимые для осуществления эффекторной функции, остаются снаружи антиген-экспрессирующей клетки. Таким образом, интернализация ингибирует эффекторную функцию антитела. Следовательно, если желательно использовать эффекторную функцию антитела, то важно подобрать антиген, который приведет к ограничению интернализации антитела. Авторы настоящего изобретения впервые обнаружили, что EphA4 является антигеном-мишенью, обладающим этим свойством.
Единственное и множественное число в настоящей заявке используется взаимозаменяемо и обозначает «по меньшей мере одно», если не указано иного.
«Выделенный» или «очищенный» полипептид представляет собой полипептид, по существу свободный от клеточного материала, например углеводов, липидов или других загрязняющих белков источника клеток или ткани, из которых этот белок получен, и/или, по существу, свободен от химических предшественников или других химических веществ при химическом синтезе. Термин «по существу свободный от клеточного материала» охватывает препараты полипептида, в которых этот полипептид отделен от клеточных компонентов клеток, из которых он выделен или получен рекомбинантным путем. Следовательно, полипептид, который по существу свободен от клеточного материала, включает препараты полипептида, содержащие примерно меньше 30%, 20%, 10% или 5% (от сухой массы) гетерогенного белка (также обозначенного в настоящем описании как «загрязняющий белок»). В тех случаях, когда полипептид получен рекомбинантным путем, он также предпочтительно по существу свободен от клеточной среды, которая содержит препараты полипептида вместе с культуральной средой, составляющей примерно меньше 20%, 10% или 5% от объема белкового препарата. В тех случаях, когда полипептид получают химическим синтезом, он предпочтительно по существу свободен от химических предшественников или других химических веществ, включает препараты полипептида с химическими предшественниками или другими химическими веществами, участвующими в синтезе этого белка, составляющими примерно меньше 30%, 20%, 10%, 5% (от сухой массы) объема белкового препарата. Конкретный препарат белка содержит выделенный или очищенный полипептид, может быть подтвержден, например, при появлении одиночной полосы при электрофорезе белкового препарата в полиакриламидном геле с додецилсульфатом натрия (SDS) и окрашивании этого геля Кумасси бриллиантовым синим. В предпочтительном варианте осуществления антитела по настоящему изобретению или их фрагменты являются выделенными или очищенными.
«Выделенная» или «очищенная» молекула нуклеиновой кислоты представляет собой молекулу, которая отделена от других молекул нуклеиновой кислоты, которые находятся в природном источнике этой молекулы нуклеиновой кислоты. «Выделенная» или «очищенная» молекула нуклеиновой кислоты, например молекула кДНК, может быть по существу свободной от другого клеточного материала, или культуральной среды, при получении рекомбинантными технологиями, или по существу свободной от химических предшественников или других химических веществ при синтезе химическим путем. В предпочтительном варианте осуществления молекулы нуклеиновой кислоты, кодирующие антитела по настоящему изобретению или их фрагменты, являются выделенными или очищенными.
«Антитела» и «иммуноглобулины» представляют собой гликопротеины, имеющие одинаковые структурные характеристики. Несмотря на то, что антитела обладают специфичностью связывания в отношении определенного антигена, иммуноглобулины включают как антитела, так и другие антителоподобные молекулы, для которых антигенная специфичность не была определена. Низкий уровень продукции полипептидов последнего вида, например, отмечен в лимфатической системе и высокий уровень - в миеломах.
«Нативные антитела и иммуноглобулины» обычно представляют собой гетеротетрамерные гликопротеины размером примерно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью посредством одной ковалентной дисульфидной связи, хотя число дисульфидных связей между тяжелыми цепями различных типов иммуноглобулинов может изменяться. Между цепями каждой тяжелой и легкой цепи на равном расстоянии друг от друга также расположены дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует ряд константных доменов (CH). Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на другом конце (CL); константный домен легкой цепи совпадает с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи совпадает с вариабельным доменом тяжелой цепи. Считается, что некоторые аминокислотные остатки образуют поверхность взаимодействия между вариабельными доменами легкой и тяжелой цепи (Chothia et al., (1985) J Mol Biol.; 186:651-63; Novotny и Haber, (1985) Proc Natl Acad Sci USA.; 82:4592-6).
Термин «вариабельный» обозначает, что последовательности некоторых частей вариабельных доменов значительно различаются у различных антител, и, следовательно, предполагается, что они вовлечены в связывание и специфичность каждого конкретного антитела в отношении конкретного антигена. Однако вариабельность в вариабельных доменах антител распределена неравномерно. Скорее она главным образом сконцентрирована в трех сегментах, называемых «областями, определяющими комплементарность» (также известных как «CDR») или гипервариабельных областях вариабельных доменов как легкой, так и тяжелой цепи. Наиболее консервативные части вариабельных доменов называются каркасной областью (FR). Каждый вариабельный домен нативной тяжелой и легкой цепи включает четыре каркасные области, главным образом принимающие β-складчатую конфигурацию, соединенные тремя CDR, которые образуют петли, соединяющие, и в некоторых случаях, образующие часть β-складчатой структуры. CDR каждой цепи удерживаются вместе в непосредственной близости каркасными областями и с CDR другой цепи вносят вклад в образование трехмерного антиген-связывающего сайта антитела (Kabat et al., (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, Md.). Константные домены напрямую не вовлечены в связывание антитела с антигеном, но проявляют различные эффекторные функции, например опосредуют участие антитела в антитело-зависимой цитотоксичности.
Папаин расщепляет антитело на два идентичных антиген-связывающих фрагмента, называемых «Fab» фрагментами, каждый с одним антиген-связывающим сайтом, и остаточный «Fc» фрагмент. Обработка пепсином дает F(ab')2 фрагмент, который имеет два антиген-связывающих сайта. «Fv» представляет собой минимальный фрагмент антитела, который содержит полный антиген-распознающий и связывающий сайт. Эта область обычно состоит из димера вариабельного домена одной тяжелой и одной легкой цепи, находящихся в прочной нековалентной связи. В такой конфигурации три CDR каждого вариабельного домена взаимодействуют с определенным антиген-связывающим сайтом на поверхности димера VH-VL. Совместно, шесть CDR обеспечивают антиген-связывающую специфичность антитела. Однако, даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных к антигену) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью, чем весь связывающий сайт.
Фрагмент Fab также содержит константный домен легкой цепи и первый константный домен (CH-1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab наличием нескольких дополнительных остатков на карбоксильном конце CH-1 домена тяжелой цепи, включая один или несколько цистеинов шарнирной области антитела. Fab'-SH в настоящем описании является обозначением Fab', в котором остаток (остатки) цистеина константных доменов несут свободную тиольную группу. Фрагменты F(ab')2 антитела исходно были получены как части Fab' фрагментов, которые имеют между собой шарнирные цистеины. Другие химические соединения фрагментов антитела также известны из уровня техники.
«Легкие цепи» антител (иммуноглобулинов) любого позвоночного можно отнести к одному из двух четко различимых типов, называемых κ (каппа) и λ (лямбда) соответственно, на основании аминокислотных последовательностей их константных доменов.
В зависимости от аминокислотной последовательности константного домена тяжелых цепей иммуноглобулины можно отнести к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них дополнительно можно разделить на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов известны из уровня техники.
Термин «моноклональное антитело», используемое в настоящей заявке, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела в этой популяции являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в минимальных количествах. Моноклональные антитела являются высокоспецифичными, направленными против одного антигенного сайта. Более того, в отличие от обычных (поликлональных) препаратов антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты антигена. Кроме специфичности, моноклональные антитела предпочтительны тем, что могут синтезироваться гибридомной культурой, не загрязненной другими иммуноглобулинами. Следовательно, определение «моноклональное» указывает на характер антитела, полученного по существу из гомогенной популяции антител, и не должно рассматриваться как требование получения антитела каким-то конкретным способом. Например, моноклональные антитела по настоящему изобретению могут быть получены методом гибридом, впервые описанным Kohler и Milstein, (1975) Nature.; 256:495-7, или могут быть получены методами рекомбинантных ДНК (Cabilly et al., (1984) Proc Natl Acad Sci USA.; 81:3273-7).
Описанные в настоящем документе моноклональные антитела, в частности, включают в себя «химерные» антитела или иммуноглобулины, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, происходящих из конкретных видов или принадлежащих конкретному классу или подклассу антител, а остальная цепь(и) идентична или гомологична соответствующим последовательностям антител, происходящих из других видов, или принадлежащим другим классам или подклассам антител, а также фрагменты таких антител, при условии, что они обладают желательной биологической активностью (Cabilly et al., supra; Morrison et al., (1984) Proc Natl Acad Sci USA.; 81:6851-5). Наиболее распространенные химерные антитела или иммуноглобулины состоят из фрагментов антитела человека и крысы/мыши, в основном константной области антитела человека и вариабельных областей антитела мыши.
«Гуманизированные» формы антител, не являющихся антителами человека (например, крысы или мыши), представляют собой особые химерные иммуноглобулины, иммуноглобулиновые цепи и фрагменты которых содержат минимальную последовательность, происходящую из иммуноглобулина, не являющегося иммуноглобулином человека. Такие фрагменты также включают Fv, Fab, Fab', F(ab')2, и другие антиген-связывающие субпоследовательности антител. Главным образом, гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки области, определяющей комплементарность (CDR) реципиентного антитела, заменены остатками CDR видов, не являющихся человеком (донорное антитело), например мыши, крысы или кролика, обладающими желаемой специфичностью, аффинностью и функциональной активностью. В некоторых случаях Fv остатки каркасной области иммуноглобулина человека могут быть заменены соответствующими остатками, не принадлежащими человеку. В контексте настоящего изобретения, только несколько, два или, предпочтительно, один остаток каркасной области (областей) в гуманизированном антителе заменен остатками, не принадлежащими человеку. Более того, гуманизированные антитела могут содержать остатки, которые не обнаруживаются ни в реципиентном антителе, ни в последовательностях введенной CDR или каркасной области. Эти модификации обычно вводят для дополнительной очистки и оптимизации функции антитела. В основном, гуманизированное антитело включает по существу все по меньшей мере из одного и, обычно, двух, вариабельных доменов, в которых все или по существу все CDR соответствуют областям иммуноглобулина, не принадлежащего человеку, и все или по существу все каркасные области представляют собой области консенсусной последовательности иммуноглобулина человека. Гуманизированное антитело в оптимальном случае также включает по меньшей мере часть константной области иммуноглобулина (Fc), обычно иммуноглобулина человека. Дополнительное подробное описание представлено в статье Jones et al., (1986) Nature.; 321:522-5; Riechmann et al., (1988) Nature.; 332:323-7; Presta, (1992) Curr Opin Struct Biol. 2:593-6.
«Одноцепочечные Fv» или «sFv» фрагменты антител состоят из VH и VL доменов антитела, при этом домены находятся в одной полипептидной цепи. Предпочтительно, полипептид Fv дополнительно включает полипептидный линкер между VH и VL доменами, который обеспечивает образование желаемой трехмерной структуры sFv, необходимой для связывания с антигеном. Был описан ряд способов определения химических структур для преобразования природно соединенных, но разделенных химически легкой и тяжелой полипептидных цепей из V области антитела в sFv молекулу, которая будет укладываться в трехмерную структуру, по существу сходную со структурой антиген-связывающего сайта (патент США № 5091513, 5132405 и 4946778; Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenberg and Moore eds., Springer-Verlag, New York, pp. 269-315(1994)).
Fc-область (фрагмент, кристаллизуемый) указанный выше, происходит из каркасной части «Y» антитела и состоит из двух тяжелых цепей, которые обеспечивают от двух до трех константных доменов каждый (в зависимости от класса антитела). Fc связывается с различными клеточными рецепторами и белками комплемента. Таким образом, она опосредует различные физиологические эффекты антител (опсонизацию, клеточный лизис, дегрануляцию тучных клеток, базофилов и эозинофилов и другие процессы).
Некоторые клетки (например, тучные клетки и фагоциты) на своей поверхности имеют специфические рецепторы для связывания с антителами. Эти рецепторы называются Fc-рецепторами и, как предполагает название, взаимодействуют с Fc-областью некоторых антител (например, IgA, IgG, IgE). Взаимодействие конкретного антитела с Fc-рецептором на конкретной клетке запускает эффекторную функцию клетки (например, фагоцитоз у фагоцитов, дегрануляцию у тучных клеток), что, в конечном счете, приведет к разрушению чужеродного микроорганизма. Fc-рецепторы являются изотип-специфичными, что обеспечивает иммунной системе большую гибкость, так как в различных ситуациях необходимы только определенные иммунные механизмы для ответа на антигены. Соответственно в контексте настоящего изобретения термин «эффекторная функция» относится к цитотоксичности, при которой вовлечены Fc-области антител. Альтернативно, эффекторную функцию также можно объяснить как роль, которая определяет биологическую активность, запускаемую распознаванием антигена антителом. Например, функции, которые запускают эффект, посредством которого Fc-области антител, связанные с антигенами, разрушают клетки, экспрессирующие эти антигены, также можно отнести к эффекторной функции антитела. В настоящей заявке предпочтительными клетками-мишенями являются злокачественные клетки.
Как правило, связывание антитела с антигеном не имеет непосредственного биологического эффекта. Существенные биологические эффекты скорее являются следствием вторичных «эффекторных функций» антител. Иммуноглобулины опосредуют целый ряд таких эффекторных функций. Обычно способность осуществлять конкретную эффекторную функцию требует, чтобы антитело связалось со своим антигеном. Однако не каждый иммуноглобулин будет опосредовать эффекторные функции. Примеры известных эффекторных функций антител включают антитело-зависимую клеточную цитотоксичность (ADCC), комплемент-зависимую цитотоксичность (CDC) и нейтрализующую активность. Каждая функция описана ниже.
Антитело-зависимая клеточная цитотоксичность (ADCC).
Эффекторные функции клетки, осуществляемые Fc-областями различных антител строго зависят от класса антител. Существуют клетки, которые содержат Fc-рецепторы, специфичные к Fc-области иммуноглобулина классов IgG, IgE или IgA. Каждая Fc-область антител классов IgG, IgE и IgA связывается со специфическим Fc-рецептором, и клетки, которые экспрессируют соответствующий Fc-рецептор, распознают и связывают антитела, связанные с мембранами клетки или т.д. В результате, например, клетки, которые имеют Fc-рецепторы, активируются, и осуществляют внутриклеточный транспорт антитела.
Например, антитело класса IgG распознается Fc-рецепторами на T-клетках, NK клетках, нейтрофилах и макрофагах. Эти клетки связываются с Fc-областью антител класса IgG, активируются под их действием и проявляют цитотоксичность в отношении клеток, с которыми эти антитела связались. Клетки, такие как T-клетки, NK клетки, нейтрофилы, макрофаги, которые приобретают цитотоксичность благодаря эффекторной функции антитела, называются эффекторными клетками. В частности, антитела класса IgG активируют эффекторные клетки посредством Fc-рецепторов этих клеток, а затем уничтожают клетки-мишени, с которыми связаны вариабельные области этих антител. Этот процесс называется антитело-зависимой клеточной цитотоксичностью (ADCC). ADCC можно разделить по типу эффекторных клеток, следующим образом:
ADMC: IgG-зависимая макрофагальная цитотоксичность, и
ADCC: IgG-зависимая NK-клеточная цитотоксичность.
Настоящее изобретение не ограничено типами эффекторых клеток, определяющими ADCC. Другими словами, в настоящем изобретении ADCC также включает ADMC, при которой эффекторными клетками являются макрофаги.
Известно, что антитело-зависимая ADCC является важным механизмом в совокупности противоопухолевых эффектов, в частности в способах лечения злокачественных заболеваний с использованием антител (Clynes RA, et al., (2000) Nature Med., 6: 443-6.). Например, сообщалось о прямой зависимости между терапевтическим эффектом химерных антител против CD20 антитела и ADCC (Cartron G, et al., (2002) Blood, 99: 754-8.). Следовательно, в контексте настоящего изобретения ADCC также является чрезвычайно важной среди других эффекторных функций антител.
ADCC является ключевой эффекторной функцией для клинической эффективности моноклональных антител, в частности в области лечения злокачественных заболеваний. Например, считается, что ADCC является важным механизмом противоопухолевых эффектов ритуксана, герцептина и тому подобное, клиническое применение которых уже началось. Ритуксан и герцептин являются известными терапевтическими средствами для лечения неходжкинской лимфомы и метастазирующего рака груди соответственно.
В настоящее время механизм ADCC-опосредованной цитотоксичности в общих чертах можно объяснить следующим образом: эффекторные клетки, которые связываются с клетками-мишенями посредством антител, расположенных на клеточной поверхности, по-видимому индуцируют апоптоз клетки-мишени путем передачи нескольких коротких сигналов смерти клеткам-мишеням. Более конкретно, ADCC опосредуется в первую очередь через ряд близкородственных Fcγ-рецепторов как с активирующими, так и ингибирующими функциями. В любом случае антитела, которые индуцируют цитотоксичность эффекторными клетками, в контексте настоящего изобретения относятся к антителам, которые обладают эффекторной функцией.
Для оценки активности ADCC молекулы, представляющей интерес, можно провести in vitro анализ ADCC, например, описанный в патенте США № 5500362 или 5821337.
Альтернативно или дополнительно, активность ADCC молекулы, представляющей интерес, можно оценить in vivo, например, на животной модели, например, описанной в статье Clynes et al., (1998) Proc Natl Acad Sci USA.; 95:652-56.
Комплемент-зависимая цитотоксичность (CDC).
Известно, что Fc-области иммуноглобулинов, связанные с антигенами, активируют пути комплемента. Также было обнаружено, что путь активации может отличаться в зависимости от класса иммуноглобулина. Например, антитела IgM и IgG человека активируют классический путь. С другой стороны, IgA, IgD и IgE не активируют этот путь, а именно функция активации комплемента ограничена антителами класса IgM и IgG. В частности, функция лизиса клеток, с которыми связаны вариабельные области антитела, называется комплемент-зависимой цитотоксичностью (CDC).
Активированный комплемент формирует, с помощью множества реакций, C5b-9 мембраноатакующий комплекс (MAC), обладающий мембраноразрушающей активностью. Предположительно MAC, образующийся таким образом, разрушает вирусные частицы и клеточные мембраны, независимо от эффекторных клеток. MAC-опосредованная цитотоксичность основана на следующем механизме. MAC обладает сильной аффинностью связывания клеточных мембран. MAC, связанный с клеточной мембраной, открывает пору в мембране, облегчая поступление воды в клетку и выход ее из клетки. В результате клеточная мембрана дестабилизируется или изменяется осмотическое давление, и клетка разрушается. Цитотоксичность вследствие активированного комплемента распространяется только на мембрану, близкую к антителу, которое связано с антигеном. По этой причине MAC-опосредованная цитотоксичность зависит от специфичности антитела. ADCC и CDC могут проявлять цитотоксичность независимо друг от друга. Однако, на практике, эти типы цитотоксичности могут действовать сообща в живых организмах.
Для оценки CDC активности молекулы, представляющей интерес, можно провести анализ CDC, например, описанный у Gazzano-Santoro et al., (1997) J Immunol Methods.; 202:163-71.
Нейтрализующая активность.
Антитела, способные лишать патогены инфицирующей способности и активности токсинов, известны из уровня техники. Антитело-опосредованная нейтрализация может быть достигнута за счет связывания вариабельного участка антитела с антигеном, или, альтернативно, может потребоваться привлечение комплемента. Например, в некоторых случаях противовирусные антитела нуждаются в посредничестве комплемента для лишения вируса его инфекционной способности. Fc-области необходимы для активации комплемента. Следовательно, такие антитела обладают эффекторной функцией, для которой требуется Fc для нейтрализации вирусов и клеток.
Из указанных эффекторных функций предпочтительными являются либо ADCC, либо CDC, либо обе. Настоящее изобретение основано на данных о том, что определенные анти-EphA4 антитела связываются с клетками, экспрессирующими EphA4, а затем проявляют эффекторную функцию.
Настоящее изобретение также относится к способам разрушения клеток, экспрессирующих EphA4, такие способы включают следующие стадии:
1) контактирование клеток, экспрессирующих EphA4, с анти-EphA4 антителами, и
2) разрушение клеток, экспрессирующих EphA4, благодаря эффекторной функции антител, которые связались с этими клетками.
В способах или фармацевтических композициях по настоящему изобретению любые клетки, экспрессирующие EphA4, могут быть разрушены или уничтожены. Например, злокачественные клетки поджелудочной железы являются предпочтительными в качестве клеток, экспрессирующих EphA4 по настоящему изобретению. Из них предпочтительными являются клетки карциномы поджелудочной железы.
Клетки и антитела могут быть приведены в контакт in vivo или in vitro. При in vivo нацеливании на злокачественные клетки, такие как клетки, экспрессирующие EphA4, способы по настоящему изобретению фактически представляют собой способы лечения или способы профилактики злокачественных заболеваний. В частности, настоящее изобретение относится к терапевтическим способам для лечения злокачественных заболеваний, которые включают следующие стадии:
1) введение пациенту, страдающему злокачественным заболеванием, антитела, которое связывается с EphA4, и
2) разрушение злокачественных клеток с помощью эффекторной функции этого антитела, связанного с этими клетками.
Авторы настоящего изобретения подтвердили, что антитела, связывающиеся с EphA4, эффективно разрушают клетки, экспрессирующие EphA4, в частности, злокачественные клетки поджелудочной железы, посредством эффекторной функции. Авторы настоящего изобретения также подтвердили, что с высокой вероятностью EphA4 имеет высокий уровень экспрессии в злокачественных клетках поджелудочной железы. Кроме того, уровни экспрессии EphA4 в нормальных тканях являются низкими. Объединяя эту информацию, можно предположить, что способы лечения рака поджелудочной железы, при которых вводят анти-EphA4 антитело, могут быть эффективными при незначительной опасности побочных эффектов.
Антитела, включающие Fc-область IgA, IgE или IgG, необходимы для представления ADCC. Равным образом, Fc-область антитела IgM или IgG является предпочтительной для представления CDC.
Однако антитела по настоящему изобретению не ограничены при условии, что они обладают желаемой эффекторной функцией. Варианты, аналоги или производные Fc-части могут быть получены, например, путем осуществления различных замен остатков или последовательностей. В частности, в настоящем изобретении рассматриваются антитела, состоящие из вариантов Fc, сконструированных с оптимизированной Fсγ рецепторной аффинностью и специфичностью, тем самым усиливая результирующую эффекторную функцию.
Вариант (или аналог) полипептидов включает варианты с инсерциями, в которых один или несколько аминокислотных остатков дополняют аминокислотную последовательность Fc. Инсерции могут быть расположены на одном из двух или обоих концах белка, или могут быть расположены в пределах внутренних областей аминокислотной последовательности Fc. Варианты с инсерциями с дополнительными остатками на одном из двух или обоих концах включают, например, слитые белки и белки, в том числе аминокислотные таги или метки. Например, Fc молекула может необязательно содержать N-концевой Met, в частности, в том случае, когда молекула экспрессируется рекомбинантно в бактериальной клетке, такой как E. coli.
В вариантах с делециями Fc один или несколько аминокислотных остатков в полипептиде Fc удалены. Делеции можно осуществлять на одном из двух или обоих концах полипептида Fc, либо удалением одного или нескольких остатков в пределах аминокислотной последовательности Fc. Варианты с делециями, следовательно, включают все фрагменты полипептидной последовательности Fc.
В случае вариантов с заменами Fc один или несколько аминокислотных остатков полипептида Fc удалены или заменены альтернативными остатками. Специалисту в данной области будет понятно, что индивидуальные инсерции, делеции, вставки или замены в аминокислотной последовательности, которые изменяют одну аминокислоту или небольшой процент аминокислот, приводят к сохранению исходной боковой цепи аминокислоты. Их также называют «консервативными заменами» или «консервативными модификациями», в которых изменение белка дает в результате белок со сходными функциями. Таблицы консервативных замен, в которых показаны функционально-подобные аминокислоты, хорошо известны из уровня техники. Примерами свойств аминокислотных боковых цепей являются гидрофобные аминокислоты (A, I, L, M, F, P, W, Y, V), гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S, T) и боковые цепи, имеющие следующие функциональные группы или характеристики в целом: алифатическую боковую цепь (G, A, V, L, I, P); боковую цепь, содержащую гидроксильную группу (S, T, Y); боковую цепь, содержащую атом серы (C, M); боковую цепь, содержащую карбоновую кислоту и амид (D, N, E, Q); боковую цепь, содержащую основание (R, K, H); боковую цепь, содержащую ароматическое кольцо (H, F, Y, W). Кроме того, следующие восемь групп содержат аминокислоты, которые являются консервативными заменами друг друга:
1) Аланин (A), глицин (G);
2) Аспарагиновая кислота (D), глутаминовая кислота (E);
3) Аспарагин (N), глутамин (Q);
4) Аргинин (R), лизин (K);
5) Изолейцин (I), лейцин (L), метионин (M), валин (V);
6) Фенилаланин (F), тирозин (Y), триптофан (W);
7) Серин (S), треонин (T); и
8) Цистеин (C), метионин (M) (смотри, например, Creighton, Proteins (1984)).
В одном из аспектов замены являются природно-консервативными. Однако настоящее изобретение не ограничено ими и также охватывает замены, которые являются неконсервативными, при условии, что полипептид сохраняет требуемую эффекторную функцию антитела.
Предпочтительно, Fc-область исходного полипептида представляет Fc-область иммуноглобулина человека, например нативную последовательность Fc-области IgG1 человека (A и не-A алотипов) или Fc-область IgG3 человека. В одном из вариантов осуществления вариант с улучшенной ADCC опосредует ADCC значительно более эффективно, чем антитело с нативной последовательностью Fc-области IgG1 или IgG3 и антиген-связывающей областью этого варианта. Предпочтительно, этот вариант включает или по существу состоит из замен двух или трех остатков в положениях 298, 333 и 334 Fc-области. Нумерацией остатков в тяжелой цепи иммуноглобулина является нумерация индекса EU по Kabat et al., (supra), как приведено в настоящем описании в качестве ссылки. Более предпочтительно, остатки в положениях 298, 333 и 334 замещены (например, остатками аланина). Более того, для получения варианта Fc-области с улучшенной активностью ADCC, как правило, проектируют вариант Fc-области с улучшенной аффинностью связывания в отношении FcγRIII, который считается важным FcR для опосредования ADCC. Например, можно ввести аминокислотную модификацию (например, инсерцию, делецию или замену) в исходную Fc-область в одном или нескольких аминокислотных положениях 256, 290, 298, 312, 326, 330, 333, 334, 360, 378 или 430 для получения такого варианта. Вариант с улучшенной аффинностью связывания в отношении FcγRIII дополнительно может иметь сниженную связывающую аффинность в отношении FcγRII, в частности, сниженную аффинность в отношении ингибирующего рецептора FcγRIIb.
Для сохранения требуемой эффекторной функции антитела, предпочтительно модифицировать (добавить, удалить, вставить или заменить) лишь небольшое число или небольшой процент аминокислот. Тем не менее, в объеме настоящего изобретения предусматриваются и входят многочисленные варианты аминокислотных инсерций, делеций и/или замен (например, от 1 до 50 аминокислот, предпочтительно, от 1 до 25 аминокислот, более предпочтительно от 1 до 10 аминокислот). Альтернативно, процент модифицированных аминокислот предпочтительно составляет 20% или менее, более предпочтительно, 15% или менее, более предпочтительно, 10%, еще более предпочтительно, от 1 до 5%. В основном предпочтительными являются консервативные аминокислотные замены, хотя настоящее изобретение ими не ограничено. Более того, изменения могут быть в виде измененных аминокислот, таких как пептидомиметики или D-аминокислоты.
Альтернативно, в настоящем изобретении активность ADCC может быть усилена путем модификации биохимических свойств не аминокислотной последовательности, а, например, гликоцепи, добавленной к Fc-области. Например, сообщалось, что отсутствие остатка фукозы у IgG может усиливать активность ADCC (Shinkawa et al, (2003) J. Biol. Chem.: 278(5): 3466-73.). Следовательно, антитело, лишенное остатка фукозы Fc-области является предпочтительным в контексте настоящего изобретения. Более конкретно, для усиления активности ADCC, остаток фукозы, присоединенный к CH2 домену Fc-области, может быть удален. В качестве клеток-хозяев для экспрессии антитела, лишенного остатка фукозы Fc-области, могут быть использованы клетки, отличные от CHO. В данном случае остаток фукозы добавлен к антителу посредством альфа 1,6-фукозилтрансферазы (FUT8), которая экспрессируется в CHO на высоком уровне.
Следовательно, антитела, полученные у человека, принадлежащие этим классам, являются предпочтительными по настоящему изобретению. Антитела человека могут быть получены с использованием антитело-продуцирующих клеток, взятых у людей, или химерных животных, которым трансплантированы гены антител человека (Ishida I, et al., (2002) Cloning and Stem Cells., 4: 91-102.).
Более того, Fc-области антитела могут связываться с произвольными вариабельными областями. В частности, химерные антитела, в которых вариабельные участки различных видов животных связаны с константными участками человека, известны из уровня техники. Альтернативно, химерное антитело «человек-человек» также может быть получено путем связывания вариабельных областей человека с произвольными константными областями. Кроме того, также известна технология CDR-трансплантации, в которой области, определяющие комплементарность (CDR), соответствующие вариабельным участкам антитела человека, заменяют CDR гетерологичных антител («Immunoglobulin genes», Academic Press (London), pp 260-274,1989; Roguska MA, et al., (1994) Proc. Natl. Acad. Sci. USA., 91: 969-73). Путем замены CDR заменяется связывающая специфичность антитела. То есть EphA4 человека будет распознаваться гуманизированными антителами, в которые были перенесены CDR EphA4-связывающих антител человека. Перенесенные антитела также можно назвать гуманизированными антителами. Антитела, полученные таким образом и снабженные Fc-областью, необходимой для эффекторной функции, могут быть использованы в качестве антител по настоящему изобретению, независимо от происхождения их вариабельных областей. Например, антитела, включающие Fc-область IgG человека, являются предпочтительными по настоящему изобретению, даже если их вариабельные области содержат аминокислотную последовательность иммуноглобулина другого класса или других видов.
Каждый VH и VL домен антител по настоящему изобретению включает три CDR, обозначенные как CDR1, CDR2 и CDR3, разделенных каркасными областями. Аминокислотные последовательности CDR конкретно не ограничены при условии, что антитело может специфически связываться с EphA4. Примеры предпочтительных аминокислотных последовательностей CDR включают, но ими не ограничиваются:
VH CDR1 человека: ELSMH (SEQ ID NO:10),
VH CDR2 человека: GFDPEDGETIYAQKFQG (SEQ ID NO:11),
VH CDR3 человека: AQPFHWGDDAFDI (SEQ ID NO:12),
VL CDR1 человека: SGSSSNIGSNTVN (SEQ ID NO:15),
VL CDR2 человека: SNNQRPS (SEQ ID NO:16),
VL CDR3 человека: AAWDDSLNGPV (SEQ ID NO:17); и
VH CDR1 человека: SNSAAWN (SEQ ID NO:20),
VH CDR2 человека: RTYYRSKWYNDYAVSVKS (SEQ ID NO:21),
VH CDR3 человека: DSLRSFDY (SEQ ID NO:22),
VL CDR1 человека: SGSSSNIGNNYVS (SEQ ID NO:24),
VL CDR2 человека DNNKRPS (SEQ ID NO:25),
VL CDR3 человека: GTWDSSLSAVV (SEQ ID NO:26).
В более предпочтительном варианте осуществления VH соответствует аминокислотной последовательности SEQ ID NO:27 или 29, а VL соответствует аминокислотной последовательности SEQ ID NO:28 или 30.
Как указано выше, антитела по настоящему изобретению могут быть моноклональными или поликлональными антителами. Даже при введении человеку поликлональные антитела человека могут быть получены с использованием указанных выше животных, которым перенесен ген антитела человека. Альтернативно, могут быть использованы иммуноглобулины, которые сконструированы с использованием генно-инженерных способов, например гуманизированные антитела, химерные антитела «человек-не-человек», и химерные антитела «человек-человек». Более того, известны способы получения моноклональных антител путем клонирования антитело-продуцирующих клеток человека.
EphA4 или фрагмент, включающий часть его пептида, может быть использован в качестве иммуногенов для получения антител по настоящему изобретению. EphA4 по настоящему изобретению может быть получен из любых видов, предпочтительно, из млекопитающего, например человека, мыши или крысы, более предпочтительно, из человека. Нуклеотидная последовательность и аминокислотная последовательность EphA4 человека известны из уровня техники. Так, нуклеотидная последовательность кДНК EphA4 (GenBank регистрационный № NM_004438) описана как SEQ ID NO:1, а аминокислотные последовательности, кодируемые этой нуклеотидной последовательностью, описаны как SEQ ID NO:2 (GenBank регистрационный № NP_004429). Специалист в данной области может выделить гены, содержащие представленную нуклеотидную последовательность стандартными способами с получением фрагмента этой последовательности, при необходимости, и получением белка, соответствующего целевой аминокислотной последовательности.
Например, ген, кодирующий белок EphA4 или его фрагмент, можно встроить в известный вектор экспрессии и использовать для трансформации клеток-хозяев. Желаемый белок или его фрагмент можно собрать из или в клетках-хозяевах, используя произвольные и стандартные способы, и использовать в качестве антигена. Кроме того, белки, их лизаты и химически синтезированные белки могут быть использованы в качестве антигенов. Более того, клетки, экспрессирующие белок EphA4 или его фрагмент, сами могут быть использованы в качестве иммуногенов.
При использовании пептидного фрагмента в качестве EphA4 иммуногена особенно предпочтительно выбрать аминокислотную последовательность, которая включает область, предположительно являющуюся внеклеточным доменом. Предположительно сигнальный пептид находится на N-конце EphA4, от положения 1 до 19. Таким образом, например, область, отличная от N-концевого сигнального пептида (т.е. начальные 19 аминокислотных остатков), является предпочтительной в качестве иммуногена для получения антител по настоящему изобретению. Другими словами, антитела, которые связываются с внеклеточными доменами EphA4, являются предпочтительными в качестве антител по настоящему изобретению.
Следовательно, предпочтительные антитела по настоящему изобретению представляют собой антитела, содержащие Fc-область, необходимую для эффекторной функции, и вариабельную область, которая может связываться с внеклеточным доменом EphA4. При введении человеку, предпочтительно, чтобы антитела имели Fc-область IgG.
Любое млекопитающее может быть иммунизировано таким антигеном. Однако предпочтительно оценить совместимость с родительскими клетками, используемыми в слиянии клеток. В основном, предпочтительными являются грызуны, зайцеобразные или приматы.
Грызуны включают, например, мышей, крыс и хомяков. Зайцеобразные включают, например, кроликов. Приматы включают, например, бесхвостых обезьян (обезьян старого света), таких как Macaca fascicularis, Macaca mulatta, гамадрилы и шимпанзе.
Способы иммунизации животных антигенами хорошо известны из уровня техники. Внутрибрюшинные или подкожные инъекции антигена являются стандартными способами иммунизации млекопитающих. В частности, антигены могут быть разбавлены и суспендированы в соответствующем количестве фосфатно-солевого буферного раствора (PBS), физиологическом растворе или тому подобное. По желанию, суспензии антигена могут быть перемешаны вместе с соответствующим количеством стандартного адъюванта, таким как полный адъювант Фрейнда, и введены млекопитающим после эмульгирования. Затем, предпочтительно, антигены, перемешанные с соответствующим количеством неполного адъюванта Фрейнда, вводят многократными дозами каждый день с четвертого по 21. Для иммунизации также может быть использован соответствующий носитель. После проведения иммунизации, как указано выше, могут быть использованы стандартные способы исследования сыворотки на повышение уровня желаемых антител.
Поликлональные антитела против белка EphA4 могут быть получены у иммунизированных млекопитающих, сыворотка которых была исследована на повышение желаемых антител. Этого можно достичь путем взятия крови у этих животных, или используя любой обычный способ выделения сыворотки крови. В контексте настоящего изобретения поликлональные антитела включают сыворотку, которая содержит поликлональные антитела, и фракции, которые содержат поликлональные антитела, выделенные из сыворотки. IgG и IgM могут быть получены из фракций, которые распознают белок EphA4, используя, например, аффинную колонку, соединенную с белком EphA4, а затем дополнительно очищая эту фракцию, используя колонки с белком А или с белком G. В настоящем изобретении в качестве поликлональных антител может быть использована антисыворотка. Альтернативно, также могут быть использованы очищенные IgG, IgM или подобные.
Для получения моноклональных антител иммуноциты могут быть взяты у млекопитающих, иммунизированных антигенами, исследованными на повышение уровня желаемых антител в сыворотке (как выше), и применены при слиянии клеток. Иммуноциты, используемые для слияния клеток, предпочтительно берутся из селезенки. Другие предпочтительные родительские клетки для слияния с указанными выше иммуногенами включают, но ими не ограничиваются, миеломные клетки млекопитающих, и более предпочтительно, миеломные клетки, которые имеют приобретенные свойства для селекции слитых клеток фармацевтическими агентами.
Вышеуказанные иммуноциты и миеломные клетки могут быть слиты с применением известных способов, например, описанными Milstein et al. (Galfre, G и Milstein, C, (1981) Methods. Enzymol.: 73, 3-46).
Гибридомы, полученные при слиянии клеток, могут быть выбраны путем культивирования в стандартной селективной среде, такой как среда HAT (среда, состоящая из гипоксантина, аминоптерина и тимидина). Клеточная культура в среде HAT обычно сохраняется в период от нескольких дней до нескольких недель, период, вполне достаточный для уничтожения всех клеток, отличных от желаемых гибридом (неслитых клеток). Можно провести стандартные предельные разведения, и гибридомные клетки, которые продуцируют желаемые антитела, подвергают скринингу и клонируют.
Животные могут быть иммунизированы антигенами с получением гибридом в указанном выше способе. Кроме того, лимфоциты человека из клеток, инифицированных вирусом EB, или подобным, могут быть иммунизированы in vitro с использованием белков, клеток, экспрессирующих белки, или их суспензий. Иммунизированные лимфоциты затем могут быть слиты с миеломными клетками, взятыми у человека, способными к неограниченному делению (U266 и тому подобное), с получением, таким образом, гибридом, которые продуцируют желаемые антитела человека, которые могут связываться с белком (опубликованная патентная заявка Японии, не прошедшая экспертизу No. (JP-A) Sho 63-17688).
Полученные гибридомы затем можно трансплантировать мышам в брюшную полость, и извлечь перитонеальный выпот. Полученные моноклональные антитела могут быть очищены, например, путем осаждения сульфатом аммония, колонок с белком А или белком G, DEAE ионообменной хроматографии или аффинных колонок, соединенных с белками по настоящему изобретению. Антитела по настоящему изобретению могут быть использованы не только при очистке и выявлении белков по настоящему изобретению, но также в качестве вероятных агонистов и антагонистов белков по настоящему изобретению. Эти антитела также можно использовать для терапии антителами заболеваний, опосредованных белками по настоящему изобретению. В тех случаях, когда полученные антитела вводят в организм человека (терапия антителами), предпочтительными являются антитела человека или гуманизированные антитела из-за их низкой иммуногенности.
Например, трансгенные животные, имеющие набор генов антител человека, могут быть иммунизированы антигенами, выбранными из белков, белок-экспрессирующих клеток или их суспензий. Антитело-продуцирующие клетки затем могут быть восстановлены из животных, слиты с миеломными клетками с получением гибридом, и могут быть получены антитела человека к белку из этих гибридом (см. международную публикацию № 92-03918, 94-02602, 94-25585, 96-33735 и 96-34096).
Альтернативно, иммуноциты, такие как иммунизированные лимфоциты, которые продуцируют антитела, могут быть иммортализованы с использованием генов злокачественных опухолей, и использованы для получения моноклональных антител.
Моноклональные антитела, получаемые таким образом, могут быть получены методами генной инженерии (см., например, Borrebaeck, C.A.K. и Larrick, J.W., (1990) Therapeutic Monoclonal Antibodies, MacMillan Publishers, UK). Например, рекомбинантные антитела могут быть получены путем клонирования ДНК, которая кодирует антитела из иммуноцитов, например, гибидом или иммунизированных лимфоцитов, которые продуцируют антитела, затем встраивая эти ДНК в соответствующие векторы; и трансформируя их в клетки-хозяева. Рекомбинантные антитела, полученные, как указано выше, также входят в объем настоящего изобретения.
Антитела могут быть модифицированы путем связывания с различными молекулами, например, полиэтиленгликоля (PEG). Антитела, модифицированные таким путем, могут быть использованы в настоящем изобретении. Модифицированные антитела могут быть получены путем химической модификации антител. Эти типы способов модификации являются общеизвестными для специалистов в данной области. Антитела могут быть модифицированы другими белками. Антитела, модифицированные белковыми молекулами, могут быть получены методами генной инженерии. То есть целевые белки могут быть экспрессированы путем слияния генов антител с генами, которые кодируют белки модификации. Например, эффекторная функция антитела может быть усилена в отношении связывания с цитокинами или хемокинами. Действительно, было подтверждено увеличение эффекторной функции антител для белков, слитых с IL-2, GM-CSF, и подобным (Penichet ML, et al., (2001) Human Antibodies, 10: 43-9.). IL-2, IL-12, GM-CSF, TNF, хемотаксический фактор эозинофилов (RANTES) и подобное могут быть включены в цитокины или хемокины, которые усиливают эффекторную функцию.
Альтернативно, антитела по настоящему изобретению могут быть получены в виде химерных антител, которые содержат вариабельную область антитела, не являющегося антителом человека, или в виде гуманизированных антител, которые содержат область, определяющую комплементарность, антитела, не являющегося антителом человека (CDR), каркасную область антитела человека (FR) и константную область. Такие антитела могут быть получены с использованием известных способов.
Стандартные методики молекулярной биологии могут быть использованы для получения последовательностей ДНК, кодирующих химерные CDR-трансплантированные продукты. Гены, кодирующие CDR антитела, представляющего интерес, могут быть получены, например, с помощью полимеразной цепной реакции (ПЦР) для синтеза вариабельной области из РНК антитело-продуцирующих клеток (см., например, Larrick et al., «Methods: a Companion to Methods in Enzymology», vol. 2: страница 106 (1991); Courtenay-Luck, «Genetic Manipulation of Monoclonal Antibodies» in Monoclonal Antibodies: Production, Engineering and Clinical Application; Ritter et al., (eds.), страница 166 (Cambridge University Press, 1995), и Ward et al., «Genetic Manipulation and Expression of Antibodies» в Monoclonal Antibodies: Principles and Applications; Birch et al., (eds.), страница 137 (Wiley-Liss, Inc., 1995)). Последовательности ДНК, кодирующие химерные и CDR-трансплантированные продукты, могут быть синтезированы полностью или частично, методиками олигонуклеотидного синтеза. Методики сайт-направленного мутагенеза и полимеразной цепной реакции могут быть использованы в соответствующих случаях. Например, может быть использован сайт-направленный мутагенез с использованием олигонуклеотидов, описанный в статье Jones et al., (1986) Nature.; 321:522-5. Также может быть использован сайт-направленный мутагенез с использованием олигонуклеотидов заданных вариабельных областей, как, например, описано в статье Verhoeyen et al., (1988) Science.; 239:1534-6 или Riechmann et al., (supra). Также может быть использовано ферментативное заполнение разорванных олигонуклеотидов, с использованием ДНК полимеразы T4, как например, описано в статье Queen et al., (1989) Proc Natl Acad Sci USA.; 86:10029-33; публикация PCT WO 90/07861.
Любая подходящая система клетка-хозяин/вектор может быть использована для экспрессии последовательностей ДНК, кодирующих CDR-трансплантированные тяжелые и легкие цепи. Могут быть использованы бактериальные, например E. Coli, и другие микробные системы, в частности, для экспрессии фрагментов антител, таких как фрагменты FAb и (Fab')2, и, особенно, Fv-фрагментов и одноцепочечных фрагментов антитела, например одноцепочечных Fv. Могут быть использованы системы экспрессии клеток-хозяев эукариот, например, млекопитающих, в частности, для продукции более крупных CDR-трансплантированных продуктов антител, в том числе полных молекул антител. Подходящие клетки-хозяева млекопитающих включают клетки CHO и миеломные или гибридомные клеточные линии.
Антитела, полученные, как указано выше, могут быть очищены до однородности. Например, антитела могут быть очищены или разделены обычными способами, используемыми для очистки и разделения белков. Например, антитела могут быть разделены и выделены с использованием соответственно выбранных сочетаний колоночной хроматографии, включая, но ими не ограничиваясь, аффинную хроматографию, фильтрацию, ультрафильтрацию, солевую преципитацию, диализ, электрофорез в полиакриламидном геле с SDS, изоэлектрофокусирование и так далее (Antibodies: A Laboratory Manual, Harlow and David, Lane (edit.), Cold Spring Harbor Laboratory, 1988).
В качестве аффинных колонок могут быть использованы колонки с белком A и колонки с белком G. Используемые колонки с белком А, приводимые в качестве примера, включают в себя Hyper D, POROS и Sepharose FF (Pharmacia).
В качестве примера хроматография (за исключением аффинной хроматографии) включает ионообменную хроматографию, гидрофобную хроматографию, гель-фильтрацию, хроматографию с обращенной фазой и адсорбционную хроматографию («Strategies for Protein Purification and Characterization: A Laboratory Course Manual» Daniel R. Marshak et al., (1996) Cold Spring Harbor Laboratory Press.). Хроматографию можно проводить в соответствии с методикой проведения жидкофазных хроматографий, таких как HPLC или FPLC.
Например, антиген-связывающая активность антител по настоящему изобретению может быть измерена путем измерения поглощения, ферментативными анализами иммуносорбции (ELISA), ферментативными анализами (EIA), радиоиммуноанализами (RIA) и/или способами иммунофлуоресценции. В ELISA антитело по настоящему изобретению обычно иммобилизовано на планшете, белок по настоящему изобретению добавляют к планшету, а затем добавляют образец, содержащий желаемое антитело, например культуральный супернатант клеток, продуцирующих антитело, или очищенное антитело. Затем добавляют вторичное антитело, которое распознает первичное антитело, и меченное ферментом, таким как щелочная фосфатаза, и планшет инкубируют. После промывания в планшет добавляют ферментный субстрат, такой как п-нитрофенилфосфат, измеряют абсорбцию и оценивают антиген-связывающую активность образцов. Фрагменты белка (C-концевые или N-концевые фрагменты, и тому подобное) могут быть использованы таким же образом, как и белки. Связывающую активность антител по настоящему изобретению можно оценить с помощью BIAcore (Pharmacia).
Кроме того, с помощью следующих способов, кратко описанных в примерах, можно оценить эффекторную функцию антитела. Например, клетки-мишени, экспрессирующие EphA4, могут быть инкубированы с эффекторными клетками в присутствии антитела, эффекторную функцию которого оценивают. Если определяется разрушение клеток-мишеней, можно подтвердить, что антитело обладает эффекторной функцией, которая индуцирует ADCC. Уровень наблюдаемого разрушения клеток-мишеней в отсутствие либо антител, либо эффекторных клеток, можно сравнить в качестве контроля с уровнем эффекторной функции. Клетки, которые явно экспрессируют EphA4, могут быть использованы в качестве клеток-мишеней. В частности, могут быть использованы разнообразные клеточные линии, у которых подтверждена экспрессия EphA4 в примерах. Эти клеточные линии могут быть получены из банков клеток. Кроме того, можно выбрать моноклональные антитела, которые обладают более мощной эффекторной функцией.
В настоящем изобретении анти-EphA4 антитела можно вводить людям или животным в качестве фармацевтических агентов. В настоящем изобретении животные, которым можно вводить антитела, включают, но ими не ограничиваются, мышей, крыс, морских свинок, кроликов, цыплят, кошек, собак, овец, свиней, коров, обезьян, павианов и шимпанзе. Антитела можно вводить пациентам непосредственно, и, кроме того, вводить в состав лекарственных форм, используя известные фармацевтические технологии получения лекарственных средств. Например, в зависимости от требований, антитела можно вводить парентерально в инъецируемой форме, такой как стерильный раствор или суспензия с водой или другими произвольными фармацевтически приемлемыми жидкостями. Например, этот тип соединений можно смешивать с приемлемыми носителями или растворителями, такими как стерильная вода, физиологический раствор, растительные масла, эмульгаторы, суспензионные агенты, поверхностно-активные вещества, стабилизаторы, вкусовые ароматические вещества, эксципиенты, растворители, консерванты, связующие агенты и тому подобное, с получением общепринятых единичных доз, необходимых для использования в качестве фармацевтического средства.
Другие изотонические растворы, в том числе физиологический раствор, глюкоза и адъюванты (такие как D-сорбит, D-манноза, D-маннитол и хлорид натрия) могут быть использованы в качестве инъекционного водного раствора. Их также можно использовать с соответствующими растворителями, такими как спирты, в частности этанолы и полиатомные спирты (например, пропиленгликоли и полиэтиленгликоли), и неионные поверхностно-активные вещества (например, Полисорбат 80TM или HCO-50).
В качестве масляного раствора могут быть использованы кунжутные масла или соевые масла, а в качестве растворителя могут быть использованы бензилбензоат или бензиловые спирты. В состав композиции могут быть введены буферные растворы (фосфатные буферы, ацетатнатриевые буферы и подобные), анальгетики (гидрохлорид прокаина или тому подобное), стабилизаторы (бензиловый спирт, фенолы или тому подобное) и антиоксиданты. Полученные инъекционные композиции могут быть упакованы в подходящие ампулы.
В настоящем изобретении анти-EphA4 антитела можно вводить пациентам, например, внутриартериально, внутривенно, подкожно, интраназально, трансбронхиально, внутримышечно или наносить местно. Внутрисосудистое (внутривенное) введение капельно или инъекционно, является примером общего способа системного введения антител пациентам, страдающим раком поджелудочной железы. Способы местного концентрирования антител, используемых в качестве лекарственных средств в первичном очаге или очаге метастазирования в легких, включают местные инъекции с помощью бронхоскопа (бронхоскопия) и локальную инъекцию под руководством CT или с помощью торакоскопии. Способы местного концентрирования антител, используемых в качестве лекарственных средств, в первичном очаге или очаге метастазирования в печени, включают местную инъекцию путем инъекции в портальную систему печени или артериальной инфузии. Кроме того, способы, в которых внутриартериальный катетер вставлен рядом с веной, которая обеспечивает питательными веществами злокачественные клетки, для местного введения противораковых средств, таких как антитела, используемые в качестве лекарственных средств, являются эффективными в качестве местных контрольных способов лечения метастатических очагов, а также первичных очагов рака поджелудочной железы.
Хотя дозы и способы введения изменяются в зависимости от массы тела пациента и возраста, и способа введения, эти параметры могут быть определены специалистом в данной области обычными способами. Кроме того, ДНК, кодирующая антитело, может быть встроена в вектор, используемый для генной терапии, и этот вектор можно вводить для лечения. Дозы и способы введения изменяются в зависимости от массы тела пациента, возраста и состояния, однако, специалист в данной области может выбрать их подходящим образом.
Анти-EphA4 антитела можно вводить в живой организм в таком количестве, чтобы могла быть подтверждена цитотоксичность, основанная на эффекторной функции, против клеток, экспрессирующих EphA4. Например, несмотря на то, что существует определенное количество различий, зависящих от симптомов, обычная доза анти-EphA4 антитела составляет от 0,1 мг до 250 мг/кг в день. Обычно доза для взрослого (массой тела 60 кг) составляет от 5 мг до 17,5 г/день, предпочтительно, от 5 мг до 10 г/день, и более предпочтительно от 100 мг до 3 г/день. Режим дозирования - от одного до десяти раз через интервал от двух до десяти дней, и, например, улучшение наблюдается после трех-шести раз введения.
Несмотря на то, что антитела по настоящему изобретению сохраняют эффекторную функцию, в некоторых вариантах осуществления цитотоксические средства могут быть связаны с этими антителами, с использованием известных методик. Цитотоксические средства многочислены и различны и включают в себя, но не только, цитотоксические лекарственные средства или токсины, или активные фрагменты таких токсинов. Подходящие токсины и их соответствующие фрагменты включают, но ими не ограничиваются, А-цепь дифтерийного токсина, А-цепь экзотоксина, А-цепь рицина, А-цепь абрина, курцин, кротин, феномицин, эномицин, ауристатин и тому подобное. Цитотоксические средства также включают радиохимические вещества, полученные путем конъюгации радиоизотопов с антителами по изобретению или связывания радионуклида с хелатирующим агентом, который был ковалентно присоединен к антителу. Способы получения таких конъюгатов хорошо известны из уровня техники.
Альтернативно, последовательности нуклеиновых кислот, кодирующих антитела или их функциональные производные, можно вводить для лечения или профилактики заболеваний, связанных с клетками, экспрессирующими EphA4, таких как рак поджелудочной железы, путем генной терапии. Генная терапия относится к терапии, проводимой путем введения пациенту экспрессированной или экспрессируемой нуклеиновой кислоты. В этом варианте осуществления нуклеиновые кислоты продуцируют кодируемое ими антитело или фрагмент антитела, которое в свою очередь опосредует профилактический или терапевтический эффект.
Любой способ генной терапии, доступный из уровня техники, может быть использован в соответствии с настоящим изобретением. Характерные способы описаны ниже.
Для общего обзора способов генной терапии см. Goldspiel et al., (1993) Clin. Pharm.; 12:488-505; Wu и Wu, (1991) Biotherapy.; 3:87-95; Tolstoshev, (1993) Ann Rev Pharmacol Toxicol.; 32:573-96; Mulligan, (1993) Science.; 260:926-32; Morgan и Anderson, (1993) Ann Rev Biochem.; 62:191-217; Clare Robinson Trends Biotechnol.; 11(5):155-215. Способы, общеизвестные в области технологии рекомбинантных ДНК, которые могут быть использованы, описаны в статье Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY (1993); Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990).
В предпочтительном аспекте композиция по изобретению включает нуклеиновые кислоты, кодирующие антитело, указанные нуклеиновые кислоты являются частью вектора экспрессии, который экспрессирует антитело или его фрагменты или химерные белки, или тяжелые, или легкие цепи в подходящем хозяине. В частности, такие нуклеиновые кислоты имеют промоторы, предпочтительно, гетерологичные промоторы, функционально связанные с областью, кодирующей антитело, указанный промотор является идуцибельным или конститутивным, и, необязательно, тканеспецифичным. В другом конкретном варианте осуществления используют молекулы нуклеиновой кислоты, в которых последовательности, кодирующие антитело, и любые другие желаемые последовательности фланкированы участками, которые способствуют гомологичной рекомбинации в желаемом участке генома, таким образом, обеспечивая интрахромосомную экспрессию нуклеиновых кислот, кодирующих антитело (Koller and Smithies, (1989) Proc Natl Acad Sci USA.; 86:8932-5; Zijlstra et al., (1989) Nature.; 342:435-8). В особых вариантах осуществления экспрессированная молекула антитела представляет собой одноцепочечное антитело; альтернативно, последовательности нуклеиновой кислоты могут включать в себя последовательности, кодирующие как тяжелую, так и легкую цепи антитела, или их фрагменты.
Доставка нуклеиновых кислот пациенту может быть либо прямой, в этом случае пациент напрямую подвергается воздействию нуклеиновой кислоты или векторов, несущих нуклеиновую кислоту, либо опосредованной, в этом случае клетки сначала трансформируют нуклеиновыми кислотами in vitro, затем трансплантируют пациенту. Эти два подхода известны как генная терапия in vivo или ex vivo соответственно.
В одном из вариантов осуществления последовательность(и) нуклеиновой кислоты можно непосредственно вводить in vivo, где эта последовательность экспрессируется и продуцирует кодируемый продукт. Это можно осуществить любым из многочисленных способов, известных из уровня техники, например, путем конструирования их как части соответствующего вектора экспрессии нуклеиновой кислоты и введения его таким образом, чтобы они стали внутриклеточными, например, путем инфицирования с использованием дефектных или аттенуированных ретровирусных или других вирусных векторов (см. патент США № 4980286), или путем непосредственной инъекции «голой» ДНК, или путем бомбардировки микрочастицами (например, генной пушки; Biolistic, Dupont), или покрывая липидами или рецепторами клеточной поверхности или трансфектирующими агентами, инкапсулированием в липосомы, микрочастицы или микрокапсулы, или путем введения их связанными с пептидом, который, как известно, входит в ядро, путем введения его связанным с лигандом, подвергаемом эндоцитозу, опосредованному рецептором (см., например, Wu и Wu, (1987) J Biol Chem.; 262:4429-32) (который может быть использован для нацеливания на типы клеток, специфически экспрессирующие эти рецепторы), и тому подобное. В другом варианте осуществления могут быть образованы комплексы нуклеиновая кислота-лиганд, в которых лиганд содержит фузогенный вирусный пептид для разрушения эндосом, что позволяет нуклеиновой кислоте избежать разрушения лизосомами. В другом варианте осуществления нуклеиновая кислота может быть нацелена in vivo для специфического захвата клеткой и экспрессии, путем нацеливания на специфический рецептор (см., например, публикации PCT WO 92/06180, WO 92/22635, WO92/20316, W093/14188 или WO 93/20221). Альтернативно, нуклеиновую кислоту можно вводить внутриклеточно и встраивать в ДНК клетки-хозяина для экспрессии путем гомологичной рекомбинации (Koller and Smithies, (1989) Proc Natl Acad Sci USA.; 86:8932-5; Zijlstra et al., (1989) Nature.; 342:435-8).
В одном из вариантов осуществления используют вирусные векторы, которые содержат последовательности нуклеиновой кислоты, кодирующие антитело по изобретению или его фрагменты. Например, может быть использован ретровирусный вектор (см. Miller et al., (1993) Methods Enzymol.; 217:581-99). Такие ретровирусные векторы содержат компоненты, необходимые для правильной упаковки вирусного генома и интеграции в ДНК клетки-хозяина. Последовательности нуклеиновой кислоты, кодирующие антитело, используемое в генной терапии, клонируют в один или несколько векторов, которые облегчают доставку гена пациенту. Дополнительное подробное описание ретровирусных векторов представлено в статье Boesen et al., (1994) Biotherapy.; 6:291-302, в которой описывается использование ретровирусного вектора для доставки гена mdr 1 в гематопоэтические стволовые клетки для того, чтобы сделать их более резистентными к химиотерапии. Другие ссылки, иллюстрирующие применение ретровирусов в генной терапии: Clowes et al, (1994) J Clin Invest.; 93:644-51; Kiem et al., (1994) Blood.; 83:1467-73; Salmons и Gunzberg, (1993) Hum Gene Ther.; 4:129-41; Grossman и Wilson, (1993) Curr Opin Genet Dev.; 3:110-4.
Другим примером вирусного вектора, который может быть использован в генной терапии, является аденовирус. Аденовирусы являются особенно подходящими носителями для доставки генов в респираторный эпителий. Природные аденовирусы инфицируют респираторный эпителий, вызывая заболевание с умеренной степенью тяжести. Другими мишенями для систем доставки на основе аденовирусов являются печень, центральная нервная система, клетки эндотелия и мышцы. Преимуществом аденовирусов является их способность инфицировать неделящиеся клетки. Kozarsky и Wilson, (1993) Curr Opin Genet Dev.; 3:499-503 представляют обзор генной терапии, основанной на аденовирусах. Bout et al., (1994) Hum Gene Ther.; 5:3-10 демонстрирует применение аденовирусных векторов для переноса генов в респираторный эпителий резус-макак. Другие примеры использования аденовирусов в генной терапии представлены в статье Rosenfeld et al., (1991) Science.; 252:431-4; Rosenfeld et al., (1992) Cell.; 68:143-55; Mastrangeli et al, (1993) J Clin Invest.; 91:225-34; публикация PCT WО94/12649; Wang et al., (1995) Gene Ther.; 2:775-83. В предпочтительном варианте осуществления используют аденовирусные векторы.
Адено-ассоциированный вирус (AAV) был предложен для использования в генной терапии (Walsh et al., (1993) Proc Soc Exp Biol Med.; 204:289-300; патент США № 5436146).
Другой подход к генной терапии включает перенос гена в клетки тканевой культуры такими способами, как электропорация, липофекция, трансфекция, опосредованная фосфатом кальция или вирусное инфицирование. Обычно способ переноса включает перенос в клетки селектируемого маркера. Затем клетки подвергают селекции для выделения тех клеток, которые получили и экспрессируют перенесенный ген. Затем эти клетки могут быть доставлены пациенту.
В этом варианте осуществления нуклеиновую кислоту вводят в клетку до введения in vivo полученной в результате рекомбинантной клетки. Такое введение можно выполнить любым способом, известным из уровня техники, включая, но ими не ограничиваясь, трансфекцию, электропорацию, микроинъекцию, инфицирование вирусным или бактериофаговым вектором, содержащим последовательности нуклеиновой кислоты, слияние клеток, перенос гена, опосредованный хромосомами, перенос генов, опосредованный микроклетками, слияние сферопластов и тому подобное. Из уровня техники известно большое число методик ведения чужеродных генов в клетки (см., например, Loeffler и Behr, (1993) Methods Enzymol.; 217:599-618; Cotton et al., 1993, Methods Enzymol.; 217:618-44; Cline MJ. Pharmacol Ther. 1985; 29(1):69-92.), и они могут быть использованы с настоящим изобретением, при условии, что необходимые функции, связанные с развитием, и физиологические функции клеток-реципиентов не нарушаются. Эта методика должна обеспечивать стабильный перенос нуклеиновой кислоты в клетку так, чтобы нуклеиновая кислота экспрессировалась клеткой и, предпочтительно, наследовалась и экспрессировалась ее клеточным потомством.
Полученные в результате рекомбинантные клетки могут быть доставлены пациенту различными способами, известными из уровня техники. Рекомбинантные клетки крови (например, гематопоэтические стволовые клетки или клетки-предшественники) предпочтительно вводят внутривенно. Количество клеток, предусмотренное для использования, зависит от желаемого эффекта, состояния пациента и тому подобное и может быть определено специалистом в данной области.
Клетки, в которые нуклеиновая кислота может быть введена для целей генной терапии, включают любой желаемый доступный тип клеток, в том числе, но не только, эпителиальные клетки, эндотелиальные клетки, кератиноциты, фибробласты, мышечные клетки, гепатоциты; клетки крови, такие как Т-лимфоциты, В-лимфоциты, моноциты, макрофаги, нейтрофилы, эозинофилы, мегакариоциты, гранулоциты; различные стволовые клетки или клетки-предшественники, в частности гематопоэтические стволовые клетки или клетки-предшественники, например, полученные из костного мозга, пуповинной крови, периферической крови, печени эмбриона и тому подобное. В предпочтительном варианте осуществления клетки, используемые для генной терапии, являются аутологичными пациенту.
В одном из вариантов осуществления, в котором рекомбинантные клетки используют в генной терапии, последовательности нуклеиновой кислоты, кодирующие антитело или его фрагмент, могут быть введены в клетки, так, чтобы они экспрессировались клетками или их потомством, и рекомбинантные клетки затем вводят in vivo для терапевтического эффекта. В конкретном варианте осуществления используют стволовые клетки или клетки-предшественники. Любые стволовые и/или клетки-предшественники, которые могут быть выделены и выращены in vitro, потенциально могут быть использованы в соответствии с этим вариантом настоящего изобретения (см., например, публикацию PCT WO 94/08598; Stemple и Anderson, (1992) Cell.; 71:973-85; Rheinwald, (1980) Methods Cell Biol.; 21 A:229-54; Pittelkow и Scott, (1986) Mayo Clin Proc.; 61:771-7).
В одном из предпочтительных вариантов осуществления нуклеиновая кислота, вводимая для целей генной терапии, включает индуцибельный промотор, функционально связанный с кодирующей областью, так, чтобы экспрессия этой нуклеиновой кислоты была контролируема посредством осуществления контроля за наличием или отсутствием соответствующего индуктора транскрипции.
Кроме того, настоящее изобретение относится к иммуногенным композициям для индукции антител, обладающих эффекторыми функциями в отношении клеток, экспрессирующих EphA4, где композиции содержат в качестве активного ингредиента EphA4 или иммунологически активный фрагмент EphA4, или ДНК или клетку, которая может его экспрессировать. Альтернативно, настоящее изобретение относится к применению EphA4 или иммунологически активного фрагмента EphA4, или ДНК или клетки, которая может экспрессировать его, в получении иммуногенных композиций для индукции антител, обладающих эффекторными функциями в отношении клеток, экспрессирующих EphA4.
Введение анти-EphA4 антител повреждает злокачественные клетки благодаря эффекторной функции этих антител. Таким образом, если EphA4 антитела могут быть индуцированы in vivo, то могут быть достигнуты терапевтические эффекты, эквивалентные введению антитела. В тех случаях, когда вводят иммуногенные композиции, состоящие из антигенов, целевые антитела могут быть индуцированы in vivo. Иммуногенные композиции по настоящему изобретению, таким образом, особенно применимы в вакцинной терапии против клеток, экспрессирующих EphA4. Следовательно, иммуногенные композиции по настоящему изобретению являются эффективными, например, в качестве вакцинных композиций для лечения рака поджелудочной железы.
Иммуногенные композиции по настоящему изобретению могут содержать в качестве активного ингредиента EphA4 или иммунологически активный фрагмент EphA4. В контексте настоящего изобретения иммунологически активный фрагмент EphA4 относится к фрагменту, который может индуцировать анти-EphA4 антитела, которые распознают EphA4 и обладают эффекторной функцией. Ниже EphA4 и иммунологически активные фрагменты EphA4 описаны в качестве иммуногенных белков. Индуцирует ли заданный фрагмент целевые антитела, фактически можно определить путем иммунизации животного, и подтверждая активность индуцированных антител. Индукцию антител и подтверждение их активности можно провести, например, используя способы, описанные в разделе «Примеры».
Иммуногенные композиции по настоящему изобретению могут содержать фармацевтически приемлемые носители, а также иммуногенные белки, активные ингредиенты. При необходимости композиции также можно объединить с адъювантом. Убитые туберкулезные бактерии, дифтерийный токсоид, сапонин и так далее, могут быть использованы в качестве адъюванта.
Альтернативно, ДНК, кодирующие иммуногенные белки, или клетки, удерживающие эти ДНК в экспрессируемом состоянии, могут быть использованы в качестве иммуногенных композиций. Хорошо известны способы использования ДНК, экспрессирующих антиген-мишень в качестве иммуногенов, так называемые ДНК вакцины. ДНК вакцины могут быть получены путем вставки ДНК, кодирующей EphA4 или его фрагмент, в соответствующий вектор экспрессии.
Ретровирусные векторы, аденовирусные векторы, адено-ассоциированные вирусные векторы, Сендай-вирусные векторы или подобные являются примерами подходящих векторов. Кроме того, ДНК, в которых ДНК, кодирующая иммуногенный белок, функционально связана ниже промотора, могут быть напрямую введены в клетки в виде «голой» ДНК, а затем экспрессированы. «Голая» ДНК может быть инкапсулирована в рибосомах или вирусных оболочечных векторах и введена в клетки.
Полипептиды EphA4 и полинуклеотиды по изобретению также могут быть использованы для индукции иммунного ответа in vivo, включая продукцию антител и цитотоксических Т-лимфоцитов (CTL), специфичных к клеткам, экспрессирующим EphA4. В таких способах индукция CTL под действием желаемого пептида может быть достигнута презентированием пептида Т-клеткам посредством антиген презентирующей клетки (APC) либо in vivo, либо ex vivo.
Например, клетки крови пациента, например мононуклеарные клетки периферической крови (PBMC), могут быть собраны, трансформированы с помощью вектора, который может экспрессировать иммуногенные белки, и возвращены пациенту. Трансформированные клетки крови затем продуцируют иммуногенные белки в организме пациента, и индуцируют целевые антитела. Альтернативно, PBMC пациента могут быть взяты, приведены в контакт с полипептидом ex vivo, и с последующей индукцией APC или CTL, эти клетки можно вводить пациенту. APC или CTL, индуцированные in vitro, могут быть перед введением клонированы. Путем клонирования и выращивания клеток, имеющих высокую активность повреждения клеток-мишеней, клеточная иммунотерапия может осуществляться более эффективно. Более того, APC и CTL, выделенные таким образом, могут быть использованы для клеточной иммунотерапии не только пациентов, у которых эти клетки получены, а также у пациентов с подобным типом опухолей.
Известно, что обычно при использовании полипептида для клеточной иммунотерапии эффективность индукции CTL повышается при объединении множества полипептидов с различной структурой, и при приведении их в контакт с APC, в частности с дендритными клетками. Следовательно, при стимуляции APC фрагментами белка предпочтительно использовать смесь фрагментов многочисленных типов.
Индукция противоопухолевого иммунитета под действием полипептида может быть подтверждена наблюдением индукции продукции антител против опухолей. Например, если антитела против полипептида индуцируют у лабораторных животных, иммунизированных полипептидом, и когда рост опухолевых клеток супрессируется этими антителами, то считается, что полипептид обладает способностью индуцировать противоопухолевый иммунитет.
Если ДНК, кодирующие иммуногенные белки, или клетки, трансформированные ими, используют в качестве иммуногенных композиций по настоящему изобретению, то их можно объединять с иммуногенными белками, а также белками-переносчиками, которые усиливают их иммуногенные свойства.
Как указано выше, настоящее изобретение относится к способам индукции антител, которые обладают эффекторной функцией в отношении клеток, экспрессирующих EphA4, и эти способы включают стадию введения EphA4, иммунологически активного фрагмента EphA4, или ДНК, или клеток, которые могут его экспрессировать. Способы по настоящему изобретению включают индукцию антител, которые обладают эффекторной функцией, повреждающей клетки, экспрессирующие EphA4, такие как злокачественные клетки поджелудочной железы. Как результат, могут быть получены терапевтические эффекты в отношении рака поджелудочной железы и подобных.
Каждый день от 0,1 мг до 250 мг на килограмм иммуногенных композиций по настоящему изобретению можно вводить перорально или парентерально. Парентеральное введение включает подкожную инъекцию и внутривенную инъекцию. Вводимая доза для одного взрослого обычно составляет от 5 мг до 17,5 г/день, предпочтительно от 5 мг до 10 мг/день, и более предпочтительно, от 100 мг до 3 г/день.
Настоящее изобретение также относится к способам лечения или профилактики злокачественных заболеваний у пациента. В некоторых вариантах осуществления способ включает стадию введения фармацевтически эффективного количества анти-EphA4 антитела, или его иммунологически активного фрагмента, где это антитело обладает эффекторной функцией антитела.
Все цитируемые в настоящем описании ссылки на предшествующий уровень техники приведены в настоящем описании в качестве ссылки в полном объеме.
Краткое описание чертежей
На фиг.1 представлена фотография, представляющая результаты полуколичественного ОТ-ПЦР анализа гена EphA4 в клеточных линиях рака поджелудочной железы.
На фиг.2 представлены результаты анализа ADCC с использованием герцептина и анти-EphA4 антитела человека 65 и 336 в отношении клеточных линий рака поджелудочной железы, MIAPaca-2 и PK-45P, гиперэкспрессирующих и низкоэкспрессирующих EphA4.
Наилучший способ осуществления изобретения
Далее, настоящее изобретение подробно описывается со ссылкой на примеры. Однако материалы, способы и тому подобное описывают только иллюстративные аспекты изобретения и не предназначены для ограничения объема настоящего изобретения. По существу, материалы, способы и тому подобное, аналогичные или эквивалентные описанным в настоящем описании, могут быть использованы в практике или проведении настоящего изобретения.
Клеточная линия.
Клеточные линии рака толстой кишки человека или рака поджелудочной железы высевали в виде монослоя в соответствующей среде с 10% эмбриональной сывороткой теленка. Клеточные линии, используемые в эксперименте, представлены в таблице 1.
*2 Минимальная поддерживающая среда Игла
*3 Модифицированная среда Мак-Коя 5A
Более того, следующие клеточные линии были использованы в анализах ADCC, с использованием анти-EphA4 антител: карцинома поджелудочной железы: MIAPaca-2.
Антитело человека.
Скрининг библиотек фаговой экспрессии с использованием культуры клеток.
Для скрининга scFV антител человека против EphA4, использовали фаговую библиотеку AIMS4, кодирующую scFV антител человека (WO 01/62907). Способ скрининга описан в P2005-185281A.
Для первого скрининга сначала клетки MIAPaca-2 с высокой экспрессией EphA4 культивировали в 15 см чашках, собирали с использованием 2 мг/мл коллагеназы I (Gibco BRL)/буфера для диссоциации клеток (Gibco BRL) и промывали охлажденным PBS. Раствор фаговой библиотеки антитела человека (2×1013 КОЕ) перемешивали с 4×107 клеток, BSA и NaN3/MEM. Затем конечную концентрацию доводили до 1%BSA-0,1%NaN3/MEM в общем объеме 1,6 мл, и смесь осторожно перемешивали в течение четырех часов при 4°C. После этого половину реакционного раствора распределяли в одну из двух пробирок и центрифугировали при 3000 об/мин в органическом растворителе (дибутилфталат:циклогексан=9:1) в течение двух минут. После удаления супернатанта клетки ресуспендировали в 0,7 мл 1% BSA/MEM, и центрифугировали в равном объеме слабополярного растворителя. Эту стадию повторяли дважды. Супернатант удаляли и клетки затем ресуспендировали в 0,3 мл PBS, замораживали жидким азотом и растапливали при 37°C.
Этими фагами заражали 20 мл E. coli DH12S (OD 0,5) в течение одного часа, и инфицированные клетки переносили в 600 мл 2× среды YTGA (2× YT, 200 мкг/мл сульфата ампициллина, 1% глюкозы) и культивировали в течение ночи при 30°C. 10 мл этой смеси добавляли к 200 мл 2× среды YTA (2× YT, 200 мкг/мл сульфата ампициллина) и культивировали в течение 1,5 часов при 37°C. После дополнительной инкубации добавляли 1×1011 хелперного фага KО7 и снова культивировали в течение одного часа при 37°C. Через один час после инкубации, как описано выше, добавляли 800 мл 2× YTGAK (2× YT, 200 мкг/мл сульфата ампициллина, 0,05% глюкозы, 50 мкг/мл канамицина) и культивировали в течение ночи при 30°C. Эту культуру центрифугировали при 8000 об/мин в течение десяти минут. Супернатант смешивали с 200 мл жидкого PEG (20% полиэтиленгликоля 6000, 2,5 M NaCl) и центрифугировали при 8000 об/мин в течение 10 минут для осаждения фага. Этот осадок суспендировали в 10 мл PBS и часть суспензии использовали для проверки количества E. сoli, инфицированных фагом.
Для второго скрининга использовали 0,8 мл реакционного раствора (1% BSA-0,1% NaN3/MEM), культивированные клетки (2×107) и фаг 1-го скрининга (1×1010). Общий объем реакционного раствора составил половину использованного для 1-го скрининга. Процедура 3-го скрининга была похожа на 2-й скрининг, за исключением того, что 2×107 клеток 293T трансфектировали EPHA4 и использовали 1×109 фага 2-го скрининга.
Секвенирование ДНК, проверка экспрессии и клеточный ELISA антительного клона
E. coli, которую подвергали скринингу и разбавляли, как описано выше, затем культивировали на питательном агаре с 100 мкг/мл ампициллина. Полученные колонии выделяли и инкубировали в течение ночи при 30°C с 2× среды YTGA. ДНК получали из культуры с помощью PI-50 (Kurabo), и ДНК последовательность определяли дидезокси способом.
Кроме того, 0,05 мл культуры культивировали с 1,2 мл 2× YTAI (2× YT, 200 мкг/мл сульфата ампициллина, 0,5 мM IPTG) при 30°C, и супернатанты собирали центрифугированием при 15000 об/мин в течение 5 минут.
Экспрессию антитела выявляли в виде слитого белка cp3. Более конкретно, супернатант приводили во взаимодействие с MaxisorpTM (NUNC) в течение двух часов при 37°C и аспирировали прореагировавший раствор. Планшет с антителами блокировали 5% BSA в течение двух часов при 37°C, блокирующий раствор удаляли. Кроличье анти-cp3 антитело (MBL), разбавленное 1:2000 с помощью 0,05% Tween/PBS, добавляли в планшет и проводили реакцию при комнатной температуре в течение одного часа с последующим промыванием PBS. Меченое HRP козье антитело против кроличьего IgG (MBL) разбавляли 1:2000 с помощью 0,05% Tween/PBS, добавляли в планшет и реакцию проводили при комнатной температуре в течение одного часа с последующим промыванием PBS. 100 мкл раствора OPD добавляли в планшет и реакцию проводили при комнатной температуре в течение 15 минут, и реакцию останавливали добавлением 2M сернокислого аммония. Слитые белки выявляли измерением поглощения при 492 нм с помощью SPECTRAmax 340PC (Molecular Devices).
Проведение клеточного ELISA осуществляли следующим образом. Сначала 1×105 клеток культивировали в 96-луночных планшетах в течение ночи, среду заменяли на 200 мкл 5% обезжиренного молока/PBS. После выстаивания в течение трех часов на льду 100 мкл супернатанта и 100 мкл 10% обезжиренного молока перемешивали и оставляли на ночь на льду. После пятикратных промываний с использованием PBS, хранившегося на льду, клетки взаимодействовали со 100 мкл 5 мкг/мл мышиного анти-cp3 моноклонального антитела, 5% обезжиренного молока/PBS в течение двух часов при 4°C. После пятикратного промывания с помощью PBS, хранившегося на льду, раствор, состоящий из 25 мкл пероксидазы, меченной ENVISION + полимерный реактив и 75 мкл 15% обезжиренного молока/PBS взаимодействовал с клетками в течение двух часов при 4°C. После пятикратных промываний с использованием PBS, хранившегося на льду, реакцию останавливали добавлением 2 M сернокислого аммония, и поглощение реакционной смеси измеряли при 492 нм с помощью SPECTRAmax 340PC (Molecular Devices).
scFV антитела человека, позитивно реагирующие с антигенами, что подтверждается проточной цитометрией, преобразовывали в полную форму IgG в IFA. Эти два клона имели следующие аминокислотные последовательности.
65: SEQ ID NO:9 (VH) и SEQ ID NO:14 (VL)
336: SEQ ID NO:19 (VH) и SEQ ID NO:23 (VL)
Эти scFV антитела человека преобразовывали в полную форму IgG в IRA. Следующие аминокислотные последовательности использовали в качестве константных областей тяжелой цепи (CH) и легкой цепи (CL).
CH (CH1, CH2 и CH3):
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMSRTPEVTCVVVDVSHEDPEVKFNWYVDGWVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPEEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEAPHNHYTQKSLSLSPGK (SEQ ID NO:13)
CL:
QPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS (SEQ ID NO:18)
Полуколичественная ОТ-ПЦР для EphA4.
Общую РНК экстрагировали из клеточных линий с использованием набора Rneasy® Kit (QIAGEN). Кроме того, мРНК очищали из общей РНК с помощью Олиго (dT)-целлюлозной колонки (Amersham Biosciences) и синтезировали до односпиральной кДНК путем обратной транскрипции (ОТ), используя систему Superscript First-Strand Synthesis (Invitrogen). Готовили соответствующие разведения каждой односпиральной кДНК для последующей ПЦР амплификации путем мониторинга GAPDH и β-актина в качестве количественного контроля. Последовательности используемых праймеров представляли собой следующее:
5'-GAAGGCGTGGTCACTAAATGTAA-3' (SEQ ID NO:3) и
5'-TTTAATTTCAGAGGGCGAAGAC-3' (SEQ ID NO:4) для EphA4,
5'-GTCAGTGGTGGACCTGACCT-3' (SEQ ID NO:5) и
5'-GGTTGAGCACAGGGTACTTTATT-3' (SEQ ID NO:6) для GAPDH,
5'-GAGGTGATAGCATTGCTTTCG-3' (SEQ ID NO:7) и
5'-CAAGTCAGTGTACAGGTAAGC-3' (SEQ ID NO:8) для β-актина.
Все ПЦР реакции включали в себя исходную денатурацию при 94°C в течение 2 мин и состояли из 94°C 30 с, 58°C 30 с и 72°C 1 мин 21 цикл для GAPDH, 20 циклов для β-актина или 28-32 цикла для EphA4 на амплификаторе GeneAmp PCR system 9700 (PE Applied Biosystems). Гиперэкспрессия EphA4 была обнаружена в клеточной линии рака поджелудочной железы Miapaca-2 (Фиг.1). Кроме того, для выявления эффективности анти-EphA4 антитела человека в отношении различных типов рака была подтверждена экспрессия EphA4.
Анализ проточной цитометрией.
Злокачественные клетки (5×106) инкубировали при 4°C в течение 30 минут с очищенным поликлональным антителом (pAb), моноклональными антителами (mAb), кроличьим IgG (контроль для pAb) или мышиным IgG (контроль для mAb). Клетки промывали фосфатным буферным раствором (PBS), а затем инкубировали при 4°C в течение 30 минут в меченом ФИТЦ красителе Alexa Fluor 488. Клетки снова промывали в PBS и анализировали на проточном цитометре (FACSCalibur®, Becton Dickinson), а затем анализировали с помощью программного обеспечения BD CellQuestTM Pro (Becton Dickinson). Среднюю интенсивность флуоресценции (MFI) определяли как соотношение проточной цитометрической интенсивности (интенсивность каждого белок-специфичного антитела/интесивность кроличьего IgG).
Используя клетки, гиперэкспрессирующие EphA4, исследовали соотношения связывания анти-EphA4 антител на клеточной поверхности. Как результат, более высокая доля анти-EphA4 антител человека 65 и 336 связалась с клетками MIAPaca-2 (MFI: 12,64 и 15,54, соответственно), чем IgG человека (контроль).
Исследования ADCC.
Клетки-мишени подвергали воздействию 0,8 мкМ кальцеин ацетоксиметилового сложного эфира (Кальцеин-AM, DOJINDO) при 37°C в течение 30 минут. Кальцеин-AM становится флуоресцентным после расщепления кальцеина-AM под действием клеточных эстераз, которые продуцируют флуоресцентное производное кальцеина. Злокачественные клетки-мишени промывали дважды до добавления в исследование и затем клетки помещали в 96-луночные U-донные планшеты (4×103 клеток/лунку). Мононуклеарные клетки периферической крови человека (PMBC) собирали у здорового человека, разделяли, используя центрифугирование в градиенте плотности Ficoll-Paque (Amersham Biosciences), а затем использовали в качестве эффекторных клеток. Злокачественные клетки-мишени (Т) и эффекторные клетки (E) совместно инкубировали в 250 мкл среды AIM-V в 96-луночных планшетах E:T соотношение 100:1 с анти-EphA4 антителом человека с различными концентрациями (0, 0,01, 0,1, 1, 10, 100 мкг/лунку) или контрольным антителом герцептином (Roche). Эту инкубацию проводили в трех повторах, в 250 мкл среды AIM-V (Life Technologies, Inc), при 37°C в течение шести часов. Контрольные исследования включали в себя инкубирование клеток-мишеней только с анти-EphA4 антителом человека или эффекторными клетками. Герцептин использовали в качестве контроля в нескольких экспериментах.
ADCC эффекты анти-EphA4 антитела человека (65 и 336) в отношении этих клеток оценивали исходя из флуоресцентных изображений жизнеспособности клеток, быстро полученных с использованием анализатора IN Cell Analyzer 1000 (Amersham Bioscience). Эти изображения были в числовом виде преобразованы в количество жизнеспособных клеток (площадь клетки для клеток-мишеней) путем подсчета флуоресцирующих объектов или везикул, используя программное обеспечение Developer tool ver.5.21 (Amersham Bioscience).
Герцептин использовали в качестве контроля в нескольких экспериментах. Непосредственного повреждения клеток MIAPaca-2 под действием анти-EphA4 антител человека 65 и 336 как таковых, не наблюдалось. Однако анти-EphA4 антитела человека 65 и 336 индуцировали ADCC в клетках MIAPaca-2, которые гиперэкспрессировали EphA4 (Фиг.2), несмотря на то, что нет эффекта против клеток PK-45P с низкой экспрессией EphA4 (Фиг.2).
Промышленная применимость.
Настоящее изобретение основано, по меньшей мере частично, на обнаружении того, что клетки, экспрессирующие EphA4, могут повреждаться под действием цитотоксичности антител. Авторами настоящего изобретения было идентифицировано, что ген EphA4 строго экспрессируется при раке поджелудочной железы. Таким образом, лечение заболевания, связанного с клетками, экспрессирующими EphA4, например, рака поджелудочной железы, эффективно проводить с использованием антител, которые связываются с EphA4. Результаты, фактически подтвержденные авторами настоящего изобретения, демонстрируют цитотоксичность вследствие эффекта ADCC в клеточных линиях рака поджелудочной железы, в присутствии EphA4 антител.
Хотя изобретение было подробно описано и дана ссылка на его конкретные варианты осуществления, специалисту в данной области будет очевидно, что различные изменения и модификации могут быть сделаны, не выходя за рамки и не меняя сущность изобретения, ограниченного прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВЫДЕЛЕННОЕ АНТИ-CD30 АНТИТЕЛО (ВАРИАНТЫ), ХОЗЯЙСКАЯ КЛЕТКА, СПОСОБ ПОЛУЧЕНИЯ ХИМЕРНОГО ИЛИ ГУМАНИЗИРОВАННОГО ВАРИАНТА АНТИ-CD30 АНТИТЕЛ (ВАРИАНТЫ), СПОСОБ ИНГИБИРОВАНИЯ РОСТА КЛЕТОК CD30+ И СПОСОБ ИНГИБИРОВАНИЯ РОСТА ОПУХОЛЕВЫХ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ CD30 | 2006 |
|
RU2492186C2 |
| ВЫДЕЛЕННОЕ АНТИТЕЛО ПРОТИВ СПЕЦИФИЧЕСКОГО МЕМБРАННОГО АНТИГЕНА ПРОСТАТЫ (PSMA) И СПОСОБ ИНГИБИРОВАНИЯ РОСТА КЛЕТОК, ЭКСПРЕССИРУЮЩИХ PSMA | 2006 |
|
RU2421466C2 |
| АНТИ-CD40-АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2012 |
|
RU2609647C2 |
| ЛЕЧЕНИЕ РАКА ПРИ ПОМОЩИ НАПРАВЛЕННЫХ НА МИШЕНЬ АНТИТЕЛ IN VIVO | 2011 |
|
RU2642305C2 |
| АНТИТЕЛА ПРОТИВ АЛЬФА5-БЕТА 1 И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2528736C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CD19 И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО, СВЯЗАННОГО С ТРАНСПЛАНТАЦИЕЙ И АУТОИММУННОГО ЗАБОЛЕВАНИЯ | 2007 |
|
RU2495882C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ КЛАУДИНА-18 ДЛЯ ЛЕЧЕНИЯ РАКА | 2008 |
|
RU2571923C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ КЛАУДИНА-18 ДЛЯ ЛЕЧЕНИЯ РАКА | 2008 |
|
RU2682285C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К КЛАУДИНУ 6 (CLDN6) | 2010 |
|
RU2675997C2 |
| СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СПЕЦИФИЧНЫЕ ПО ОТНОШЕНИЮ К HER3, И ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2620068C2 |





















































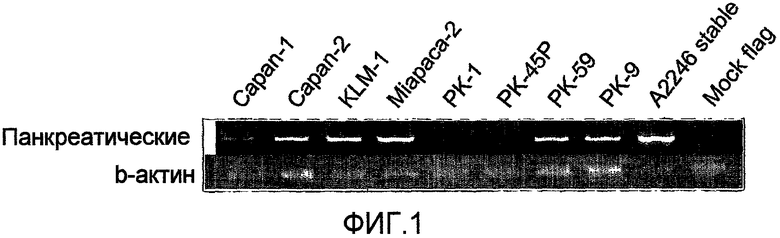
Настоящее изобретение относится к иммунологии и биотехнологии. Предложен способ лечения или профилактики злокачественной опухоли, клетки которой экспрессируют EphA4. Способ включает введение анти-EphA4 антитела, где антитело имеет IgG1 человека, включает VH и VL области, каждая из которых содержит по три соответствующих CDR. Описана фармацевтическая композиция на основе антитела для применения в указанном способе. Предложенные изобретения могут найти применение в терапии рака поджелудочной железы. 2 н. и 9 з.п. ф-лы, 2 ил., 1 табл.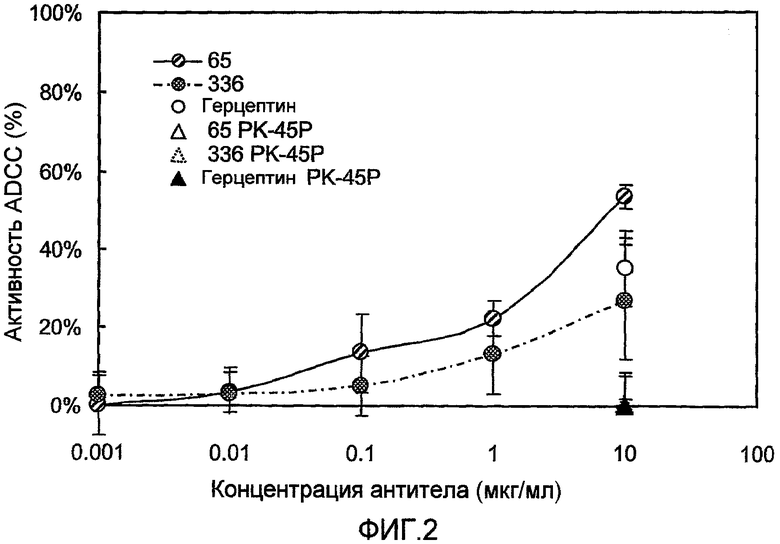
1. Способ лечения или профилактики злокачественной опухоли, клетки которой экспрессируют EphA4, у индивида, включающий стадию введения указанному индивиду антитела против EphA4 или его иммунологически активного фрагмента, где антитело имеет Fc-домен IgG1 человека и обладает эффекторной функцией антитела, где антитело содержит цепь VH и VL, каждая цепь VH и VL содержит аминокислотные последовательности CDR, обозначенные как CDR1, CDR2 и CDR3, разделенные аминокислотными последовательностями каркасной области, и аминокислотные последовательности каждой CDR в каждой цепи VH и VL выбраны из группы, состоящей из:
VH CDR1 человека: ELSMH (SEQ ID NO: 10),
VH CDR2 человека: GFDPEDGETIYAQKFQG (SEQ ID NO: 11),
VH CDR3 человека: AQPFHWGDDAFDI (SEQ ID NO: 12),
VL CDR1 человека: SGSSSNIGSNTVN (SEQ ID NO: 15),
VL CDR2 человека: SNNQRPS (SEQ ID NO: 16),
VL CDR3 человека: AAWDDSLNGPV (SEQ ID NO: 17); и
VH CDR1 человека: SNSAAWN (SEQ ID NO: 20),
VH CDR2 человека: RTYYRSKWYNDYAVSVKS (SEQ ID NO: 21),
VH CDR3 человека: DSLRSFDY (SEQ ID NO: 22),
VL CDR1 человека: SGSSSNIGNNYVS (SEQ ID NO: 24),
VL CDR2 человека: DNNKRPS (SEQ ID NO: 25),
VL CDR3 человека: GTWDSSLSAVV (SEQ ID NO: 26).
2. Способ по п.1, где злокачественная опухоль, клетки которой экспрессируют EphA4, представляет собой рак поджелудочной железы.
3. Способ по п.1, где анти-ЕрhА4 антитело представляет собой моноклональное антитело.
4. Способ по п.1, где указанная эффекторная функция антитела представляет собой либо антитело-зависимую цитотоксичность, либо комплемент-зависимую цитотоксичность, либо и то, и другое.
5. Способ по п.1, где VH человека содержит аминокислотную последовательность SEQ ID NO: 27 или 29, a VL человека содержит аминокислотную последовательность SEQ ID NO: 28 или 30.
6. Способ по п.1, где доза антитела против Eph4, вводимая индивидууму, составляет от 0,1 мг до 250 мг/кг в сутки.
7. Фармацевтическая композиция, предназначенная для применения в способе по п.1, где композиция содержит анти-ЕрhА4 антитело, где антитело имеет домен Fc IgG1 человека, и обладает эффекторной функцией антитела, где антитело содержит цепь VH и VL, каждая цепь VH и VL содержит аминокислотные последовательности CDR, обозначенные как CDR1, CDR2 и CDR3, разделенные аминокислотными последовательностями каркасной области, и аминокислотные последовательности каждой CDR в каждой цепи VH и VL выбраны из группы, состоящей из:
VH CDR1 человека: ELSMH (SEQ ID NO: 10),
VH CDR2 человека: GFDPEDGETIYAQKFQG (SEQ ID NO: 11),
VH CDR3 человека: AQPFHWGDDAFDI (SEQ ID NO: 12),
VL CDR1 человека: SGSSSNIGSNTVN (SEQ ID NO: 15),
VL CDR2 человека: SNNQRPS (SEQ ID NO: 16),
VL CDR3 человека: AAWDDSLNGPV (SEQ ID NO: 17); и
VH CDR1 человека: SNSAAWN (SEQ ID NO: 20),
VH CDR2 человека: RTYYRSKWYNDYAVSVKS (SEQ ID NO: 21),
VH CDR3 человека: DSLRSFDY (SEQ ID NO: 22),
VL CDR1 человека: SGSSSNIGNNYVS (SEQ ID NO: 24),
VL CDR2 человека: DNNKRPS (SEQ ID NO: 25),
VL CDR3 человека: GTWDSSLSAVV (SEQ ID NO: 26), где антитело против Eph4 входит в состав лекарственной формы, где доза антитела против Eph4, вводимая индивидууму, составляет от 0,1 мг до 250 мг/кг в сутки.
8. Фармацевтическая композиция по п.7, где злокачественная опухоль, клетки которой экспрессируют EphA4, представляет собой рак поджелудочной железы.
9. Фармацевтическая композиция по п.7, где анти-ЕрhА4 антитело представляет собой моноклональное антитело.
10. Фармацевтическая композиция по п.7, где указанная эффекторная функция антитела представляет собой либо антитело-зависимую цитотоксичность, либо комплемент-зависимую цитотоксичность, либо и то, и другое.
11. Композиция по п.7, где VH человека содержит аминокислотную последовательность SEQ ID NO: 27 или 29, а VL человека содержит аминокислотную последовательность SEQ ID NO: 28 или 30.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| ASHIDA SHINGO et al., "Molecular features of the transition from prostatic intraepithelial neoplasia (PIN) to prostate cancer: Gemome-wide gene expression profiles of prostate cancers and PINs", Cancer research, vol.64, no | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| СПОСОБ ЛЕЧЕНИЯ НЕРЕЗЕКТАБЕЛЬНОГО РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ | 2002 |
|
RU2234962C2 |
Авторы
Даты
2011-09-20—Публикация
2007-02-22—Подача