Область техники, к которой относится изобретение
Изобретение относится к антителу к CGRP для применения при профилактике и/или лечении воспалительной боли и/или симптомов воспалительной боли, а также к способу лечения и/или профилактики воспалительной боли и/или симптомов воспалительной боли с применением антитела к CGRP.
Уровень техники
Воспалительный процесс представляет собой сложную последовательность биохимических и клеточных событий, активируемых в ответ на повреждение ткани или наличие посторонних веществ, которая приводит к опуханию и боли (Levine and Taiwo, 1994, Textbook of Pain, 45-56). Боль при артритах является наиболее распространенной воспалительной болью. Ревматоидная болезнь является одним из самых распространенных хронических воспалительных заболеваний в развитых странах, а ревматоидный артрит - частая причина инвалидности. Точная этиология ревматоидного артрита неизвестна, однако современные гипотезы предполагают, что важную роль могут играть как генетические, так и микробиологические факторы (Grennan & Jayson, 1994, Textbook of Pain, 397-407). Считалось, что почти 16 миллионов американцев имеют симптоматический остеоартрит (ОА) или дегенеративную болезнь суставов, при этом большинство из них старше 60 лет, и, как ожидают, общая заболеваемость вырастет до 40 миллионов по мере увеличения возраста популяции, что делает это колоссальной проблемой здравоохранения (Houge & Mersfelder, 2002, Ann Pharmacother., 36, 679-686; McCarthy et al., 1994, Textbook of Pain, 387-395). Большинство пациентов с остеоартритом обращаются за медицинской помощью из-за ассоциированной боли. Артрит оказывает значительное влияние на психосоциальную и физическую функцию и, как известно, является ведущей причиной инвалидности в преклонном возрасте. Анкилозирующий спондилит также является ревматическим заболеванием, которое вызывает артрит позвоночника и крестцово-подвздошных сочленений. Он варьирует от периодических приступов боли в пояснице, которые происходят в течение жизни, до тяжелой хронической болезни, которая поражает позвоночник, периферические суставы и другие органы тела.
Другим типом воспалительной боли является висцеральная боль, которая включает боль, ассоциированную с воспалительной болезнью кишечника (ВБК). Висцеральная боль является болью, связанной с внутренними органами, которые включают органы брюшной полости. Указанные органы включают половые органы, селезенку и часть пищеварительной системы. Боль, связанная с внутренними органами, может быть подразделена на висцеральную боль органов пищеварения и висцеральную боль непищеварительных органов. Часто встречающиеся желудочно-кишечные (ЖК) заболевания, которые вызывают боль, включают функциональное расстройство кишечника (ФРК) и воспалительную болезнь кишечника (ВБК). Данные ЖК заболевания охватывают широкий спектр патологических состояний, которые в настоящее время поддаются лечению лишь в незначительной степени, и включают, в отношении ФРК, гастроэзофагеальный рефлюкс, диспепсию, синдром раздраженного кишечника (СРК) и синдром функциональной абдоминальной боли (СФАБ), а также, в отношении ВБК, болезнь Крона, илеит и неспецифический язвенный колит, все из которых систематически вызывают висцеральную боль. Другие типы висцеральной боли включают боль, связанную с дисменореей, циститом и панкреатитом, а также тазовую боль.
Существует особо важная медицинская потребность в выявлении новых фармацевтически активных соединений, которые нарушают ключевые стадии процесса воспалительной боли и в особенности предназначены для лечения и/или профилактики боли при артрите и/или симптомов боли при артрите.
Неожиданно авторы настоящего изобретения обнаружили, что введение антитела к CGRP эффективно при профилактике и/или лечении воспалительной боли, боли при артрите и, в частности, боли при остеоартрите.
CGRP (пептид, связанный с геном кальцитонина) представляет собой нейропептид из 37 аминокислот, который действует как нейромедиатор в центральной нервной системе. Он связывается с высокой аффинностью с рецептором CGRP, с подобным рецептору кальцитонина рецептором (CRLR), активируя аденилатциклазу и продукцию протеинкиназы А.
Было показано, что при спинальном введении приникающие центрально низкомолекулярные селективные CGRP-антагонисты оказались эффективными при лечении нейропатических и ноцицептивных болей (Adwanikar et al., Pain 2007), что позволяет предположить, что удаление эндогенного CGRP в спинном мозге оказывает антиноцицептивное действие. Кроме того, показали, что интратекальное введение иммунной сыворотки против CGRP восстанавливало ноцицептивное поведение в моделях артрита на грызунах (Kuraishi, Y., et al. Neurosci. lett (1998) 92, 325-329).
Неожиданно авторы настоящего изобретения обнаружили, что введение антитела к CGRP оказалось эффективно, в случае периферического сайта действия, при профилактике и/или лечении воспалительной боли и, в частности, боли при остеоартрите, при периферическом введении. Указанный периферический путь введения обеспечивает очевидное преимущество по сравнению с требованием введения антител интратекально или спинально, что представляется более рискованным и неудобным методом.
Краткое описание изобретения
В настоящем изобретении предложено применение антитела к антагонисту CGRP для получения лекарственного средства для профилактики и/или лечения воспалительной боли и/или симптомов воспалительной боли, где полученное лекарственное средство предназначено для периферического введения.
В настоящем изобретении также предложен способ профилактики и/или лечения воспалительной боли и/или симптомов воспалительной боли у индивида, включающий периферическое введение указанному индивиду терапевтически эффективного количества антитела к антагонисту CGRP.
В одном из вариантов осуществления антитело к антагонисту CGRP при введении действует периферически.
Описание фигур
Фиг.1: модель боли при остеоартрите. Антитело G2 вводили в дозе 1 и 10 мг/кг, внутривенно (1 мл/кг, в/в), а "неактивное" антитело (не связывается с CGRP) вводили в дозе 10 мг/кг в/в, в качестве отрицательного контроля. Оба антитела растворяли в растворе носителя, содержащем PBS + 0,01% Tween 20. В данном исследовании целекоксиб использовали в качестве положительного контроля. Его суспендировали в растворе 0,5% метилцеллюлозы и 0,025% Tween 20 и вводили перорально с пищей (1 мл/кг) в дозе 30 мг/кг, два раза в день, в течение всей продолжительности исследования. Болевые ответы оценивали в день 2, 3, 7 и 10 после начала фармакологического исследования (день 0) и оценивали согласно полностью слепому методу. Приведенные данные представляют собой среднее ± SEM для группы из 6 крыс. *p<0,05 и p<0,01 в сравнении с базовым значением (тест Даннетта в GraphPad Prism). На фигуре, слева направо, столбик 1 = базовая линия, столбики 2-5 = неактивное антитело, столбики 6-9 = G2 при дозе 1 мг/мл, столбики 10-13 = G2 при дозе 10 мг/мл, столбики 14-17 = целекоксиб 30 мг/мл.
Фиг.2: данные анализа связывания демонстрируют, что антитело G1 ингибирует связывание α-CGRP с CGRP1 рецептором.
Фиг.3a: уровень концентрации антитела к CGRP (мкг/мл) в сыворотке в зависимости от времени после в/в введения 10 мг/кг, измеренный с помощью анти-IgG ELISA.
Фиг.3b: уровень концентрации антитела к CGRP (мкг/мл) в сыворотке в зависимости от времени после в/в введения 10, 30, 100 мг/кг, измеренный с помощью анти-IgG ELISA.
Фиг.4: аланиновое сканирование с использованием C-концевого фрагмента CGRP (CGRP 25-37). Изменение аффинности выражено в кратности потери аффинности и показывает, что антитело G1 к CGRP связывается с C-концевой областью α-CGRP человека.
Фиг.5: конкуренция в растворе с использованием Biacore: для определения специфичности G1 использовали CGRP, фрагменты CGRP или пептиды, сходные по последовательности с CGRP.
Фиг.6: последовательности CGRP человека, яванского макака, крысы, мыши, собаки и кролика. Неконсервативные между видами остатки подчеркнуты, эпитоп G1 выделен жирным шрифтом.
Фиг.7: данные показывают, что G1 ингибирует нейрогенную гиперемию на коже, начиная с 90 минут после обработки. G1 вводили внутривенно (1 мл/кг). Данные получены от 6-8 или 13 крыс в группе. *p=0,05, **p=0,01 в сравнении с группой, получавшей носитель (фосфатно-соляной буфер), в каждый момент времени (AVOVA).
Таблица 1: Kd и IC50 антител к CGRP измеряли при 25°C против человеческого α-CGRP [muMab7E9 = мышиный предшественник G1. Его KD для крысиного β-CGRP = 1 нМ. RN4901 = мышиное антитело, узнающее тот же эпитоп, что и G1, но демонстрирующее ту же аффинность и селективность в крысах (β-CGRP KD = 17 нм); G1 = гуманизированное антитело на основе muMab7E9 (KD в отношении крысиного βCGRP = 0,1 нМ)].
Таблица 2: аффинности связывания G1, определенные с помощью Biacore
Описание изобретения
Общие методики
При осуществлении настоящего изобретения на практике, если не указано иное, используют стандартные методики молекулярной биологии (включая генноинженерные методики), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в пределах знаний специалиста в данной области техники. Такие методики полностью описаны в литературе, такой как Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (MJ. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J. E. CeIMs, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J. P. Mather and P. E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J. B. Griffiths, and D. G. Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D. M. Weir and CC. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J. M. Miller and M. P. Calos, eds., 1987); Current Protocols in Molecular Biology (F. M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (MuIMs et al., eds., 1994); Current Protocols in Immunology (J. E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (CA. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P. Shepherd and C Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J. D. Capra, eds., Harwood Academic Publishers, 1995); and Cancer: Principles and Practice of Oncology (VT. DeVita et al., eds., J. B. Lippincott Company, 1993).
Определения
"Антитело" представляет собой молекулу иммуноглобулина, способную специфически связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., по меньшей мере, через один сайт узнавания антигена, расположенный в вариабельной области молекулы иммуноглобулина. Используемый в настоящей заявке данный термин охватывает не только интактные поликлональные или моноклональные антитела, но также и их фрагменты (такие, как Fab, Fab', F(ab')2, Fv, dAb), одноцепочечные антитела (ScFv), их мутанты, химерные антитела, диатела, слитые белки, включающие часть антитела, и любую другую модифицированную конфигурацию молекулы иммуноглобулина, включающую сайт узнавания антигена. Антитело включает антитело любого класса, такое как IgG, IgA или IgM (или их подкласс), при этом антитело необязательно должно принадлежать к какому-либо конкретному классу. В зависимости от аминокислотной последовательности константного домена тяжелых цепей иммуноглобулины можно отнести к различным классам. Существуют пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, причем некоторые из них дополнительно могут быть разделены на подклассы (изотипы), например IgGl, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются альфа, дельта, эпсилон, гамма и мю соответственно. Структуры и трехмерные конфигурации субъединиц различных классов иммуноглобулинов хорошо известны.
"Fv" представляет собой фрагмент антитела, который содержит полноразмерный антиген-узнающий и связывающий сайт. В двухцепочечных типах Fv данная область состоит из димера вариабельных доменов тяжелой и легкой цепей, связанных прочной, нековалентной связью. В одноцепочечных типах Fv один вариабельный домен тяжелой и один вариабельный домен легкой цепи могут быть соединены ковалентной связью через гибкий пептидный линкер, в результате чего легкая и тяжелая цепи могут связываться с образованием димерной структуры, аналогичной димеру двухцепочечного Fv. Именно в такой конфигурации три CDR каждого вариабельного домена взаимодействуют, определяя антигенсвязывающую специфичность на поверхности VH-VL димера. Впрочем, даже один вариабельный домен (или половина Fv, включающая только 3 CDR, специфичных в отношении антигена) обладает способностью распознавать и связывать антиген, хотя обычно с более низкой аффинностью, чем весь связывающий сайт.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов дополнением нескольких остатков на C-конце домена CH1 тяжелой цепи, включающем один или более остатков цистеина из шарнирных областей антитела. F(ab)2-фрагмент является бивалентным фрагментом, включающим два Fab-фрагмента, связанные дисульфидным мостиком в шарнирной области.
Антитело может иметь один или более связывающих сайтов (для соединения с антигеном). Если в антителе присутствует более одного связывающего сайта, связывающие сайты могут быть идентичными друг другу или могут быть различными. Например, природный иммуноглобулин содержит два идентичных связывающих сайта, одноцепочечное антитело или Fab-фрагмент имеют один связывающий сайт, тода как "биспецифичное" или "бифункциональное" антитело (диатело) имеет два различных связывающих сайта, относительно последовательности и/или распознавания антигена/эпитопа.
"Выделенное антитело" является антителом, которое: (1) не связано с компонентами природного окружения, включая другие антитела природного окружения, которые сопровождают антитело в его нативном состоянии, (2) не содержит других белков из тех же видов, (3) экспрессировано клеткой, которая принадлежит к другому виду, или (4) не встречается в природе.
"Моноклональное антитело" относится к гомогенной популяции антител, где моноклональное антитело состоит из аминокислот (природных и неприродных), которые включены в селективное связывание антигена. Популяция моноклональных антител является высокоспецифичной, будучи направленной против одного антигенного сайта. Термин "моноклональное антитело" охватывает не только интактные моноклональные антитела и полноразмерные моноклональные антитела, но также и его фрагменты (такие, как Fab, Fab', F(ab')2, Fv), одноцепочечные фрагменты (ScFv), его мутанты, слитые белки, включающие часть антитела, а также любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая включает сайт узнавания антигена необходимой специфичности и обладает способностью связываться с антигеном. Данный термин не должен быть ограничен в том, что касается источника антитела или способа, которым оно было получено (например, с применением гибридомы, фаговой селекции, рекомбинантной экспрессии, трансгенных животных и т.д.).
Используемые в настоящей заявке "гуманизированные" антитела относятся к формам антител, которые не являются человеческими (например, мышиным) и представляют собой специфические химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие, как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие субпоследовательности антител), которые содержат минимальную последовательность, происходящую из иммуноглобулина, который не является человеческим. Большей частью гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в которых остатки определяющей комплементарность области (CDR) реципиента заменены остатками CDR из видов, не относящихся к человеку (донорное антитело), таких как мышь, крыса или кролик, обладающие необходимой специфичностью, аффинностью и биологической активностью. В некоторых случаях остатки каркасной области Fv (FR) человеческого иммуноглобулина заменены соответствующими остатками, не являющимися человеческими. Кроме того, гуманизированное антитело может включать остатки, которые не присутствуют ни в реципиентном антителе, ни в последовательностях донорной CDR или каркасной области, а включены для дополнительного улучшения и оптимизации эффективности антитела. Как правило, гуманизированное антитело включает по существу все, по меньшей мере, из одного, а обычно двух вариабельных доменов, в которых все или по существу все CDR области соответствуют областям иммуноглобулина, не являющегося человеческим, а все или по существу все FR области представляют собой области консенсусной последовательности человеческого иммуноглобулина. Гуманизированное антитело оптимально также включает, по меньшей мере, фрагмент константной области или домен (Fc) иммуноглобулина, обычно человеческого иммуноглобулина. Антитела могут содержать Fc-области, которые модифицированы, как описано в WO 99/58572. Другие формы гуманизированных антител содержат одну или более одной CDR (одну, две, три, четыре, пять, шесть), которые изменены по сравнению с исходным антителом, которые также именуются как одна или более одной CDR, "происходящие из" одной или более одной CDR исходного антитела.
Используемое в настоящей заявке "человеческое антитело" означает антитело, аминокислотная последовательность которого соответствует аминокислотной последовательности антитела, продуцируемого человеком, и/или получена с использованием любой из методик получения человеческих антител, известных в данной области техники или раскрытых в настоящей заявке. Данное определение человеческого антитела включает антитела, содержащие, по меньшей мере, один полипептид тяжелой цепи человеческого иммуноглобулина или, по меньшей мере, один полипептид легкой цепи человеческого иммуноглобулина. Одним из таких примеров является антитело, включающее полипептиды легкой цепи мышиного антитела и полипептиды тяжелой цепи человеческого антитела. Человеческие антитела могут быть получены с применением различных способов, известных в данной области техники. В одном из вариантов осуществления человеческое антитело выбрано из фаговой библиотеки, экспрессирующей человеческие антитела (Vaughan et al., 1996, Nature Biotechnology, 14:309-314; Sheets et al., 1998, PNAS, (USA) 95:6157-6162; Hoogenboom and Winter, 1991, J. Mol. Biol., 227:381; Marks et al., 1991, J. Mol. Biol., 222:581). Человеческие антитела также могут быть получены путем введения локуса человеческого иммуноглобулина в трансгенное животное, например мышь, у которой гены эндогенных иммуноглобулинов были частично или полностью инактивированы. Подобный подход описан в патентах США 5,545,807; 5,545,806; 5,569,825; 5,625,126; 5,633,425 и 5,661,016. В альтернативе человеческое антитело может быть получено путем иммортализации человеческих В-лимфоцитов, которые продуцируют антитело, направленное против антигена-мишени (такие В-лимфоциты могут быть выделены у индивидуума или могут быть иммунизированы in vitro). См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, стр. 77 (1985); Boerner et al., 1991, J. Immunol., 147 (1):86-95; а также патент США 5,750,373.
Одноцепочечное антитело (scFc) представляет собой антитело, в котором VL и VH области спарены с образованием моновалентной молекулы через синтетический линкер, который позволяет получить их в виде одной белковой цепи (Bird et al. Science, 242: 423-426 (1988) и Huston et al., Proc. Natl. Acad. Sci. USA, 85:5879-5883 (1988)).
Диатела представляют собой бивалентные, биспецифические антитела, в которых VH и VL домены экспрессированы на одной полипептидной цепи, но с использованием линкера, который слишком короток и поэтому не допускает спаривания между двумя указанными доменами на одной цепи, в результате чего домены вынуждены спариваться с комплементарными доменами другой цепи, образуя два антигенсвязывающих сайта.
"Химерные антитела" относятся к антителам, в которых одна часть каждой из аминокислотных последовательностей тяжелой и легкой цепи гомологична соответствующим последовательностям в антителах, полученных из конкретного вида или принадлежащих к конкретному классу, тогда как другой сегмент цепей гомологичен соответствующим последовательностям другого вида или класса. Как правило, в химерных антителах вариабельная область и легкой, и тяжелой цепей имитирует вариабельные области антител, полученных из млекопитающего одного вида, тогда как константные фрагменты гомологичны последовательностям в антителах, полученных из другого вида. Одно очевидное преимущество таких химерных форм состоит в том, что, например, вариабельные области могут быть получены удобным способом из известных на данный момент источников, с использованием общедоступных гибридом или В-лимфоцитов из организмов-хозяев за исключением человека, в комбинации с константными областями, полученными, например, из препаратов клеток человека. Хотя вариабельная область обладает преимуществом легкости получения и на ее специфичность не влияет ее источник, константная область, являющаяся человеческой, с меньшей вероятностью будет вызывать иммунный ответ у субъекта-человека при введении антител, по сравнению с константной областью из источника, не относящегося к человеку. Впрочем, определение не ограничивается данным конкретным примером.
"Функциональная Fc-область" обладает, по меньшей мере, одной эффекторной функцией Fc-области нативной последовательности. Примеры "эффекторных функций" включают связывание C1q; комплементзависимую цитотоксичность (CDC); связывание с Fc-рецептором; антителозависимую клеточноопосредованную цитотоксичность (ADCC); фагоцитоз; негативную регуляцию рецепторов клеточной поверхности (например, рецептора В-клеток; BCR) и т.д. Такие эффекторные функции, как правило, требуют, чтобы Fc-область была объединена со связывающим доменом (например, вариабельным доменом антитела), и могут быть оценены с помощью различных анализов, известных в данной области техники для оценки таких эффекторных функций антитела.
"Fc-область нативной последовательности" включает аминокислотную последовательность, идентичную аминокислотной последовательности Fc- природной области. "Вариант Fc-области" включает аминокислотную последовательность, которая отличается от нативной последовательности Fc-области модификацией, по меньшей мере, одной аминокислоты, но в то же время сохраняет, по меньшей мере, одну эффекторную функцию Fc-области нативной последовательности. Предпочтительно, вариант Fc-области содержит замену, по меньшей мере, одной аминокислоты по сравнению с Fc-областью нативной последовательности или с Fc-областью исходного полипептида, например, приблизительно от одной до десяти аминокислотных замен и предпочтительно приблизительно от одной до пяти аминокислотных замен в Fc-области нативной последовательности или в Fc-области исходного полипептида. Вариант Fc-области в настоящей заявке предпочтительно обладает, по меньшей мере, приблизительно 80% идентичностью последовательности с Fc-областью нативной последовательности и/или с Fc-областью исходного полипептида и наиболее предпочтительно, по меньшей мере, приблизительно 90% идентичностью последовательности, более предпочтительно, по меньшей мере, приблизительно 95%, по меньшей мере, приблизительно 96%, по меньшей мере, приблизительно 97%, по меньшей мере, приблизительно 98%, по меньшей мере, приблизительно 99% идентичностью последовательности с Fc-областью нативной последовательности и/или с Fc-областью исходного полипептида.
Используемая в настоящей заявке "антителозависимая клеточноопосредованная цитотоксичность" и "ADCC" относится к клеточноопосредованной реакции, в которой неспецифические цитотоксические клетки, которые экспрессируют Fc-рецепторы (FcR) (например, натуральные клетки-киллеры (NK), нейтрофилы и макрофаги), распознают связанное антитело на клетке-мишени, а затем вызывают лизис этой клетки-мишени. Активность ADCC интересующей молекулы может быть оценена с помощью анализа ADCC in vitro, такого как описанного в патентах США 5,500,362 или 5,821,337. Эффекторные клетки, применяемые в таких анализах, включают мононуклеарные клетки периферической крови (РВМС) и NK-клетки. Альтернативно или дополнительно, активность ADCC интересующей молекулы может быть оценена in vivo, например, в животной модели, такой как описанная в Clynes et al., 1998, PNAS (USA), 95:652-656.
Используемый в настоящей заявке "Fc-рецептор" и "FcR" описывает рецептор, который связывается с Fc-областью антитела. Предпочтительный FcR представляет собой нативную последовательность человеческого FcR. Кроме того, предпочтительный FcR представляет собой рецептор, который связывается с антителом IgG (гамма-рецептор), и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и формы, образующиеся в результате альтернативного сплайсинга указанных рецепторов. Рецепторы FcγRII включают FcγRIIA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), имеющие сходные аминокислотные последовательности, которые отличаются в основном своими цитоплазматическими доменами. Обзор FcR приведен в Ravetch and Kinet, 1991, Ann. Rev. Immunol., 9:457-92; Capel et al., 1994, Immunomethods, 4:25-34; и de Haas et al., 1995, J. Lab. Clin. Med., 126:330-41. "FcR" также включает неонатальный рецептор FcRn, который ответственен за перенос материнских IgG эмбриону (Guyer et al., 1976, J. Immunol., 117:587; и Kim et al., 1994, J. Immunol., 24:249).
"Комплементзависимая цитотоксичность" и "CDC" относятся к лизису мишени в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например, антителом), находящейся в комплексе с когнатным антигеном. Для оценки активации комплемента может быть проведен анализ CDC, например, как описано Gazzano-Santoro et al., J. Immunol. Methods, 202:163 (1996).
Используемые в настоящей заявке термины "G1" и "антитело G1" используют попеременно и относятся к антителу, продуцируемому экспрессирующими векторами, имеющими номера АТСС-РТА-6867 и АТСС-РТА-6866. Аминокислотная последовательность вариабельных областей тяжелой цепи и легкой цепи приведена в SEQ ID NO:1 и 2. Фрагменты CDR антитела G1 (включая CDR Чотиа и Кэбата) схематически показаны на Фиг.5 WO2007/054809, содержание которой настоящим полностью включено путем отсылки. Полинуклеотиды, кодирующие вариабельные области тяжелой и легкой цепи, приведены в SEQ ID NO:9 и 10. Свойства антитела G1 описаны в Примерах WO2007/054809, полное содержание которых настоящим полностью включено путем отсылки. G1 представляет собой гуманизированное моноклональное блокирующее антитело (IgG2), которое блокирует связывание и активность нейропептида CGRP (a и b), а также его эффект нейрогенной вазодилатации, вызванной секрецией CGRP. G1 представляет собой моноклональное IgG2Δa антитело к антагонисту CGRP, полученного из мышиного предшественника антитела к антагонисту CGRP, обозначенного muMAb7E9, как идентифицировано в скрининге с использованием клеток селезенки, полученных из мыши, иммунизированной человеческим и крысиным CGRP, которые были слиты с клетками плазмоцитомы мыши. G1 был создан путем переноса CDR легкой и тяжелой цепи, полученных из muMAb7E9, в самую близкую последовательность человеческой зародышевой линии, с последующим введением, по меньшей мере, 1 мутации в каждую CDR и 2 каркасных мутаций в VH. Две мутации были введены в Fc-домен G1 в целях супрессии активации человеческого Fc-рецептора. Было показано, что G1 и muMab7E9 распознают один и тот же эпитоп.
Используемые в настоящей заявке термины "G2" и "антитело G2" используются попеременно и относятся к мышиному моноклональному антителу CGRP крысы, как описано в статье Wong HC et al. Hybridoma 12:93-106 (1993). Аминокислотная последовательность вариабельных областей тяжелой цепи и легкой цепи приведена в SEQ ID NO:19 и 20. Полинуклеотиды, кодирующие вариабельные области тяжелой и легкой цепей, приведены в SEQ ID NO:27 и 28. Фрагменты CDR антитела G2 приведены в SEQ ID NO:21-26. Было показано, что G2 распознает тот же эпитоп, что и G1.
Используемое в настоящей заявке "иммуноспецифическое" связывание антител относится к антигенспецифическому связывающему взаимодействию, которое встречается между антигенсвязывающим сайтом антитела и специфическим антигеном, распознаваемым данным антителом (то есть антитело взаимодействует с конкретным белком в ELISA или другом иммуноанализе и не взаимодействует на детектируемом уровне с другими белками).
Эпитоп, который "специфично связывается" или "предпочтительно связывается" (используемый попеременно в настоящем описании) с антителом или полипептидом, является термином, хорошо известным в уровне техники, при этом способы определения такого специфичного или селективного связывания также известны в уровне техники. Считается, что молекула проявляет "специфичное связывание" или "предпочтительное связывание", если она взаимодействует или связывается, с более высокой частотой, более высокой скоростью, с более высокой продолжительностью и/или с более высокой аффинностью, со специфической клеткой или веществом, чем с другими клетками или веществами. Антитело "специфично связывается" или "предпочтительно связывается" с мишенью, если оно связывается с большей аффинностью, авидностью, с большей скоростью и/или с большей продолжительностью, чем оно связывается с другими веществами. Также при прочтении данного определения следует понимать, что, например, антитело (или фрагмент, или эпитоп), которое специфично или селективно связывается с одной мишенью, может специфично или селективно связываться с другой мишенью или же нет. Кроме того, "специфичное связывание" или "предпочтительное связывание" не обязательно требует (хотя и может включать) исключительное связывание. Как правило, но не обязательно, ссылка на связывание означает предпочтительное связывание.
Термины "полипептид", "олигопептид", "пептид" и "белок" попеременно используются в настоящей заявке для отсылки к полимерам аминокислот любой длины. Полимер может быть линейным или разветвленным, может включать модифицированные аминокислоты и может прерываться компонентами, которые не являются аминокислотами. Данные термины также охватывают аминокислотный полимер, модифицированный естественным путем или искусственно; например, образование дисульфидной связи, гликозилирование, липидизация, ацетилирование, фосфорилирование или любая другая манипуляция или модификация, такая как конъюгирование с метящим компонентом. Также в определение включены, например, полипептиды, содержащие один или более аналогов аминокислоты (включающих, например, неприродные аминокислоты и т.д.), а также другие модификации, известные в уровне техники. Следует понимать, что поскольку полипептиды настоящего изобретения основаны на антителе, данные полипептиды могут существовать в виде одиночных цепей или ассоциированных цепей.
"Полинуклеотид" или "нуклеиновая кислота", попеременно используемые в настоящем изобретении, относятся к полимерам нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут являться дезоксирибонуклеотидами, рибонуклеотидами, модифицированными нуклеотидами или основаниями и/или их аналогами или любым субстратом, который может быть включен в полимер ДНК- или РНК-полимеразой. Полинуклеотид может включать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. В случае присутствия модификации нуклеотидной структуры она может быть произведена до или после сборки полимера. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например, путем конъюгирования с метящим компонентом. Другие типы модификаций включают, например, "кэпы", замену одного или более природных нуклеотидов аналогом, межнуклеотидные модификации, такие как, например, модификации незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации, содержащие боковые группировки, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), модификации интеркаляторами (например, акридин, псорален и т.д.), модификации, содержащие хелатообразователи (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), содержащие алкилирующие соединения, с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т.д.), а также модифицированные формы полинуклеотида(ов). Кроме того, любая из гидроксильных групп, обычно присутствующих в сахарах, может быть замещена, например, фосфонатными группами, фосфатными группами, защищена стандартными защитными группами или активирована с получением дополнительных связей с дополнительными нуклеотидами или может быть конъюгирована с твердыми носителями. 5'- и 3'-концевая ОН-группа может быть фосфорилирована или замещена аминами или органическими кэпирующими группами из 1-20 атомов углерода. Другие гидроксилы также могут быть дериватизированы в стандартные защитные группы. Полинуклеотиды также могут содержать аналогичные формы рибозных или дезоксирибозных сахаров, общеизвестных в уровне техники, включая, например 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидорибозу, карбоциклические аналоги сахаров, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и неосновные нуклеозидные аналоги, такие как метилрибозид. Одна или более фосфодиэфирных связей может быть замещена альтернативными связывающими группами. Указанные альтернативные связывающие группы включают, помимо прочих, варианты осуществления, в которых фосфат замещен на P(O)S ("тиоат"), P(S)S ("дитиоат"), "(O)NR2 ("амидат"), P(O)R, P(O)OR', СО или СН2 ("формацеталь"), в которых каждый R или R' независимо представляет собой Н или замещенный или незамещенный алкил (1-20 С), необязательно содержащий эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралдил. Не все связи в полинуклеотиде должны быть идентичными. Предшествующее описание применимо ко всем упомянутым в настоящем описании полинуклеотидам, включая РНК и ДНК.
"Вариабельная область" антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи антитела, одной или в комбинации. Вариабельные области каждой из тяжелой и легкой цепей состоят из четырех каркасных областей (FR), связанных тремя областями, определяющими комплементарность (CDR), также известными как гипервариабельные области. CDR в каждой цепи удерживаются вместе посредством FR и, вместе с CDR другой цепи, вносят вклад в формирование антигенсвязывающего сайта антител. Существуют, по меньшей мере, два метода определения CDR: (1) подход, основанный на межвидовой вариабельности последовательности (т.е. Kabat et al. Sequences of Proteins of Immunological Interest (5th ed., 1991, National Institutes of Health, Bethesda MD)); и (2) метод, основанный на кристаллографических исследованиях комплексов антиген-антитело (Chothia et al. (1989) Nature 342:877; Al-lazikani et al. (1997) J. Molec. Biol. 273:927-948)). Используемая здесь CDR может относиться к CDR, определенной с помощью любого из методов или комбинации обоих методов.
"Константная область" антитела относится к константной области легкой цепи антитела или константной области тяжелой цепи антитела, одной или в комбинации.
Используемое в настоящей заявке "антитело к антагонисту CGRP" (попеременно называемое "антитело к CGRP") относится к антителу, способному связываться с CGRP и ингибировать биологическую активность CGRP и/или последующий сигнальный путь (пути), опосредованный(ые) CGRP. Антитело к антагонисту CGRP охватывает антитела, которые блокируют, оказывают антагонистическое действие, подавляют или снижают (в том числе существенно) биологическую активность CGRP. В рамках настоящего изобретения следует четко понимать, что термин "антитело к антагонисту CGRP" охватывает все ранее идентифицированные термины, наименования, а также функциональные состояния и характеристики, посредством которых собственно CGRP, биологическая активность CGRP или проявления биологической активности по существу сводятся к нулю, уменьшаются или нейтрализуются в любой значимой степени. Примеры антител к антагонисту CGRP приведены в настоящей заявке.
Используемый в настоящей заявке "по существу чистый" относится к веществу, которое, по меньшей мере, на 50% является чистым (то есть не содержит примесей), более предпочтительно является чистым, по меньшей мере, на 90%, более предпочтительно является чистым, по меньшей мере, на 95%, более предпочтительно является чистым, по меньшей мере, на 98%, более предпочтительно является чистым, по меньшей мере, на 99%.
"Клетка-хозяин" включает отдельную клетку или культуру клеток, которая может являться или является реципиентом для вектора(ов), предназначенного для включения полинуклеотидных вставок. Клетки-хозяева включают потомство одной клетки-хозяина, при этом данное потомство может и не быть обязательно полностью идентичным (по морфологии или по комплементарности геномной ДНК) исходной родительской клетке вследствие природной, случайной или преднамеренной мутации. Клетка-хозяин включает клетки, трансфицированные in vivo полинуклеотидом(ами) настоящего изобретения.
Используемый в настоящей заявке термин "лечение" представляет собой некоторый подход для достижения благоприятных или желаемых клинических результатов. В рамках настоящего изобретения благоприятные или желаемые клинические результаты включают одно или более из следующего: улучшение или облегчение любого аспекта воспалительной боли и/или симптома воспалительной боли. В рамках настоящего изобретения благоприятные или желаемые клинические результаты включают, помимо прочих, одно или более из следующего: уменьшение тяжести, облегчение боли и/или симптома, связанного с воспалительной болью.
"Эффективное количество" лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для того, чтобы привести к благоприятным или желаемым результатам, включая такие клинические результаты, как облегчение или снижение ощущения боли. Эффективное количество может быть введено за одно или более введений. В рамках изобретения эффективное количество лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для лечения, облегчения, снижения интенсивности и/или предотвращения развития воспалительной боли или симптома, связанного с воспалительной болью. Как понимается в клиническом контексте, эффективное количество лекарственного средства, соединения или фармацевтической композиции может быть достигнуто или не достигнуто в сочетании с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, "эффективная доза" может рассматриваться в контексте введения одного или более терапевтических средств, причем одно средство может рассматриваться как вводимое в эффективном количестве, если в сочетании с одним или более других средств достигается или может быть достигнут желаемый результат.
В одном варианте осуществления "получают для" в настоящей заявке означает, что лекарственное средство находится в виде дозированной формы или подобного, в надлежащей упаковке и/или с маркировкой, указывающей, что средство предназначено для периферического введения.
"Уменьшение частоты возникновения" воспалительной боли и/или симптома, связанного с воспалительной болью, означает любое уменьшение тяжести (которое может включать снижение потребности и/или количества (например, воздействия) других лекарственных средств и/или способов лечения, обычно используемых при данных состояниях), продолжительности и/или частоты.
"Уменьшение интенсивности" воспалительной боли и/или симптома, связанного с воспалительной болью, означает уменьшение или улучшение, связанное с одним или более симптомами воспалительной боли и/или симптомами, связанными с воспалительной болью, по сравнению с состоянием в отсутствие введения антитела к антагонисту CGRP. "Уменьшение интенсивности" также включает сокращение или уменьшение продолжительности симптома.
"Облегчение" воспалительной боли и/или симптома, связанного с воспалительной болью, означает уменьшение степени одного или более нежелательных клинических проявлений воспалительной боли у одного лица или группы лиц, получавших антитело к антагонисту CGRP в соответствии с изобретением.
Используемое в настоящем описании "замедление" развития воспалительной боли означает задержку, воспрепятствование, сдерживание, торможение, стабилизацию и/или отсрочку развития воспалительной боли и/или симптома, связанного с воспалительной болью. Указанное замедление может иметь различную продолжительность, зависеть от истории болезни и/или индивидуума, подвергаемого лечению. Как очевидно специалистам в данной области техники, достаточное или значительное замедление может, по сути, охватывать профилактику, в результате которой у индивидуума не развивается воспалительная боль. Способ, который "замедляет" развитие симптома, представляет собой способ, который снижает вероятность развития симптома в данный период времени и/или снижает степень симптомов в данный период времени по сравнению с тем, когда данный способ не применяют. Подобные сравнения, как правило, основаны на клинических исследованиях с использованием статистически значимого количества субъектов.
"Биологический образец" охватывает множество типов образцов, полученных от человека, и может использоваться в диагностическом или контрольном анализе. Определение охватывает кровь и другие жидкие образцы биологического происхождения, твердые образцы тканей, такие как биоптат или культура тканей или клеток, полученных из него, а также производные культуры. Определение также включает образцы, которые подвергались каким-либо манипуляциям после их получения, таким как обработка реагентами, солюбилизация или обогащение некоторыми компонентами, такими как белки или полинуклеотиды, или включение в полутвердую или твердую матрицу в целях получения срезов. Термин "биологический образец" охватывает клинический образец, а также включает клетки в культуре, клеточные супернатанты, лизаты клеток, сыворотку, плазму, биологическую жидкость и образцы ткани.
"Индивид" или "субъект" представляет собой позвоночное, предпочтительно млекопитающее, более предпочтительно человека. Млекопитающие также включают, помимо прочих, сельскохозяйственных животных (таких, как коровы), спортивных животных, домашних животных (таких, как кошки, собаки и лошади), приматов, мышей и крыс.
Используемый в настоящей заявке "вектор" означает конструкцию, которая способна доставлять, а предпочтительно экспрессировать один или более целевых генов или последовательностей в клетке-хозяине. Примеры векторов включают, помимо прочего, вирусные векторы, голые ДНК- или РНК-экспрессионные векторы, плазмидные, космидные или фаговые векторы, ДНК- или РНК-экспрессионные векторы, ассоциированные с катионными конденсирующими агентами, ДНК- или РНК-экспрессионные векторы, инкапсулированные в липосомах, а также некоторые эукариотические клетки, такие как клетки-продуценты.
Используемая в настоящей заявке "последовательность, регулирующая экспрессию" означает последовательность нуклеиновой кислоты, которая направляет транскрипцию нуклеиновой кислоты. Последовательность, регулирующая экспрессию, может быть промотором, таким как конститутивный или индуцируемый промотор, или энхансером. Последовательность, регулирующая экспрессию, функционально связана с транскрибируемой последовательностью нуклеиновой кислоты.
Используемый в настоящей заявке "фармацевтически приемлемый носитель" включает любой материал, который при соединении с активным ингредиентом позволяет указанному ингредиенту сохранять биологическую активность и не обладает реактивностью в отношении иммунной системы субъекта. Примеры включают, помимо прочего, любой стандартный фармацевтический носитель, такой как фосфатно-соляной буферный раствор, вода, эмульсии, такие как эмульсия масло/вода, а также различные типы смачивающих агентов. Предпочтительными разбавителями для введения в аэрозольной форме или парентерального введения являются фосфатно-соляной буферный раствор или физиологический (0,9%) раствор хлорида натрия. Композиции, содержащие такие носители, получают общеизвестными стандартными способами (см., например, Remington's Pharmaceutical Sciences, 18th edition, A. Gennaro, ed., Mack Publishing Co., Easton, PA, 1990; а также Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing, 2000).
Термин "вводимый периферически", используемый в настоящей заявке, относится к пути, которым необходимо доставлять вещество, лекарственное средство и/или антитело к антагонисту CGRP, в частности он означает нецентральную, неспинальную, неинтратекальную, непрямую доставку в ЦНС. Термин относится к путям введения, отличным от тех, которые были перечислены непосредственно выше, и включает введение таким путем, который является пероральным, сублингвальным, буккальным, местным, ректальным, посредством ингаляции, трансдермальным, подкожным, внутривенным, внутриартериальным, внутримышечным, внутрисердечным, внутрикостным, внутрикожным, внутрибрюшинным, трансмукозальным, вагинальным, интравитреальным, внутрисуставным, околосуставным, местным или накожным.
Термин "действует периферически", используемый в настоящей заявке, относится к участку действия вещества, соединения, лекарственного средства и/или антитела к антагонисту CGRP, при этом указанный сайт находится в пределах периферической нервной системы, в отличие от центральной нервной системы, а указанное соединение, лекарственное средство и/или антитело к антагонисту CGRP ограничено неспособностью проникать через барьер в ЦНС и мозг при периферическом введении. Термин "проникающий центрально" относится к способности вещества проникать через барьер в мозг или ЦНС.
Предполагается, что термин "KOff", используемый в настоящей заявке, относится к константе скорости диссоциации антитела из комплекса антитело/антиген.
Предполагается, что термин "Kd", используемый в настоящей заявке, относится к константе диссоциации взаимодействия антитело-антиген.
Настоящее изобретение направлено на лекарственное средство для профилактики и/или лечения воспалительной боли и/или симптомов воспалительной боли, а также на способы профилактики и/или лечения воспалительной боли и/или симптомов воспалительной боли у индивида.
В первом аспекте изобретение обеспечивает применение антитела к антагонисту CGRP для получения лекарственного средства для профилактики и/или лечения воспалительной боли и/или симптомов воспалительной боли, где лекарственное средство получают для периферического введения или где лекарственное средство вводят периферически.
Во втором аспекте изобретения предложено антитело к антагонисту CGRP для применения в профилактике и/или лечении воспалительной боли и/или симптомов воспалительной боли, где антитело получено для периферического введения или где антитело вводят периферически.
В третьем аспекте изобретение обеспечивает применение антитела к антагонисту CGRP для получения лекарственного средства для уменьшения интенсивности, контроля, снижения частоты или замедления развития или прогрессии воспалительной боли и/или симптомов воспалительной боли, где лекарственное средство получают для периферического введения или где лекарственное средство вводят периферически. В альтернативе данного аспекта изобретения предложено антитело к антагонисту CGRP для применения в целях уменьшения интенсивности, контроля, снижения частоты или замедления развития или прогрессии воспалительной боли и/или симптомов воспалительной боли, где антитело получено для периферического введения или где антитело вводят периферически.
В четвертом аспекте изобретения предложен способ профилактики и/или лечения воспалительной боли и/или симптомов воспалительной боли у индивида, включающий периферическое введение индивиду эффективного количества антитела к антагонисту CGRP.
В пятом аспекте изобретения предложен способ уменьшения интенсивности, контроля, снижения частоты или замедления развития или прогрессии воспалительной боли и/или симптомов воспалительной боли у индивида, включающий периферическое введение индивиду эффективного количества антитела к антагонисту CGRP.
Согласно предпочтительному варианту осуществления настоящего изобретения индивидом предпочтительно является млекопитающее, например домашнее животное, такое как лошадь, кошка или собака, или сельскохозяйственное животное, такое как овца, корова или свинья. Наиболее предпочтительно млекопитающим является человек.
Согласно предпочтительному варианту осуществления настоящего изобретения лекарственное средство и/или антитело к антагонисту CGRP получают для перорального, сублингвального, буккального, местного, ректального, ингаляционного, трансдермального, подкожного, внутривенного, внутриартериального, внутримышечного, внутрисердечного, внутрикостного, внутрикожного, внутрибрюшинного, трансмукозального, вагинального, интравитреального, внутрисуставного, околосуставного, местного или накожного введения.
Согласно другому предпочтительному варианту осуществления лекарственное средство получают для периферического введения до, и/или во время, и/или после развития воспалительной боли.
В одном варианте осуществления антитело к антагонисту CGRP при введении действует периферически. В одном варианте осуществления антитело к антагонисту CGRP не вводят центрально, спинально или интратекально.
Согласно предпочтительному варианту осуществления настоящего изобретения воспалительная боль является болью при артрите, которая может представлять собой боль при ревматоидном артрите или боль при остеоартрите. Предпочтительно, воспалительная боль является болью при остеоартрите.
Применения и способы изобретения могут быть предназначены для улучшения физической функции у индивида с остеоартритом и/или уменьшения неподвижности у индивида с остеоартритом.
Диагностика или оценка боли при ревматоидном артрите известны в уровне техники. Оценка может быть выполнена на основе измерений, известных в уровне техники, таких как характеристика пациента на наличие боли с использованием различных шкал боли. См., например, Katz et al., Surg Clin North Am. (1999) 79 (2):231-52; Caraceni et al. J Pain Symptom Manage (2002) 23(3):239-55. Кроме того, широко применяются шкалы для определения состояния заболевания, такие как American College of Rheumatology (ACR) (Felson, et al., Arthritis and Rheumatism (1993) 36(6):729-740), Health Assessment Questionnaire (HAQ) (Fries, et al., (1982) J. Rheumatol. 9: 789-793), the Paulus Scale (Paulus, et al., Arthritis and Rheumatism (1990) 33:477-484), а также Arthritis Impact Measure Scale (AIMS) (Meenam, et al., Arthritis and Rheumatology (1982) 25:1048-1053).
В одном варианте осуществления уменьшение интенсивности, контроль, снижение частоты или замедление развития или прогрессии боли при ревматоидном артрите и/или симптомов боли при ревматоидном артрите измеряют с применением одной или более шкал из ACR, HAQ и AIMS.
Диагностика или оценка боли при остеоартрите известны в уровне техники. Оценка может быть выполнена на основе измерений, известных в уровне техники, таких как характеристика пациента на наличие боли с использованием различных шкал боли. См., например, Katz et al., Surg Clin North Am. (1999) 79 (2):231-52; Caraceni et al. J Pain Symptom Manage (2002) 23(3):239-55. Например, WOMAC Ambulation Pain Scale (шкала боли при движении) (включающая боль, неподвижность и физическую функцию) и 100 mm Visual Analogue Scale (VAS) (визуальная аналоговая шкала) могут использоваться для оценки боли и оценки реакции на лечение.
В одном варианте осуществления уменьшение интенсивности, контроль, снижение частоты или замедление развития или прогрессии боли при остеоартрите и/или симптомов боли при остеоартрите измеряют с применением одной или более шкал из WOMAC Ambulation Pain Scale и VAS.
Согласно предпочтительному варианту осуществления настоящего изобретения антитело к антагонисту CGRP связывается с CGRP, более предпочтительно связывается с CGRP и ингибирует способность CGRP связываться с рецептором CGRP. Предпочтительно антитело к антагонисту CGRP связывается и с CGRP человека, и с CGRP грызуна, предпочтительно с CGRP человека и крысы. Более предпочтительно антитело связывается с человеческим CGRP, еще предпочтительнее антитело к антагонисту CGRP связывается с человеческим α-CGRP или с человеческим α-CGRP и/или β-CGRP. Наиболее предпочтительно антитело к антагонисту CGRP представляет собой антитело, которое проявляется одним или более из следующих функциональных свойств: (a) связывается с CGRP; (b) блокирует связывание CGRP с его рецептором (рецепторами); (c) блокирует или уменьшает активацию рецептора CGRP, включая активацию цАМФ; (d) ингибирует, блокирует, подавляет или снижает биологическую активность CGRP, включая последующие сигнальные пути, опосредованные CGRP, такие как связывание рецептора и/или индуцирование клеточного ответа на CGRP; (e) предотвращает, уменьшает интенсивность или устраняет любой аспект воспалительной боли; (f) увеличивает клиренс CGRP; и (g) ингибирует (снижает) синтез, продукцию или секрецию CGRP. Антитела изобретения, включая G1 и G2, как известно, связывают CGRP, устраняя его биологическую доступность, например, в сыворотке, предотвращая, таким образом, доступ CGRP к его рецептору, а также последующие клеточные ответы и биологические эффекты CGRP, такие как гиперемия и расширение сосудов.
В другом предпочтительном варианте осуществления изобретения антитело к антагонисту CGRP связывается с фрагментом CGRP, более предпочтительно с фрагментом CGRP, а также с полноразмерным CGRP. Предпочтительно, антитело к антагонисту CGRP связывается с областью или фрагментом CRGP. C-концевая область или фрагмент CRGP предпочтительно включают аминокислоты CGRP 19-37, или 25-37, или 29-37, или альтернативно 30-37, или альтернативно 31-37. В следующем варианте осуществления C-концевая область или фрагмент CRGP предпочтительно включают аминокислоты CGRP 32-37, наиболее предпочтительно 33-37. Предпочтительно CGRP представляет собой либо α-CGRP, либо β-CGRP, более предпочтительно человека или грызуна, еще предпочтительнее человека или крысы, более предпочтительно человека, еще предпочтительнее α-CGRP или β-CGRP человека, наиболее предпочтительно α-CGRP человека.
В другом предпочтительном варианте осуществления изобретения антитело к антагонисту CGRP специфично связывается с аминокислотной последовательностью GSKAF. Предпочтительно последовательность CGRP GSKAF представляет собой эпитоп, с которым связывается антитело к антагонисту CGRP, предпочтительно в положении 33 - 37, наиболее предпочтительно последовательность является GXXXF, где X может являться любой аминокислотой, предпочтительно в положениях CGRP 33-37, при этом концы определены аминокислотами G33 и F37 CGRP.
В одном варианте осуществления настоящего изобретения предложено антитело к антагонисту CGRP, которое специфично связывается с эпитопом, определенным аминокислотами G33-F37 CGRP. Антитело к антагонисту CGRP может специфично связываться с эпитопом, определенным аминокислотной последовательностью GSKAF.
В одном варианте осуществления настоящего изобретения предложено применение такого антитела в применениях и способах, определенных в различных аспектах настоящего изобретения.
В одном варианте осуществления антитело к антагонисту CGRP ингибирует или предотвращает активацию рецептора CGRP. Предпочтительно антитело к CGRP имеет IC50 в пределах от 0,0001 (0,1 нМ) до 500 мкМ. В некоторых предпочтительных вариантах осуществления IC50 находится в пределах от 0,0001 мкМ до, или составляет приблизительно, 250 мкМ, 100 мкМ, 50 мкМ, 10 мкМ, 1 мкМ, 500 нМ, 250 нМ, 100 нМ, 50 нМ, 20 нМ, 15 нМ, 10 нМ, 5 нМ, 1 нМ или 0,5 нМ, как измерено в анализе связывания in vitro. В некоторых других предпочтительных вариантах осуществления IC50 меньше, чем любое значение из 500 пМ, или 100 пМ, или 50 пМ, как измерено в анализе связывания in vitro. В другом более предпочтительном варианте осуществления IC50 составляет 1,2 нМ или 31 нМ.
В следующем предпочтительном варианте осуществления применяемое антитело к антагонисту CGRP способно конкурировать с антителом, описанным выше, за связывание с CGRP или фрагментом CGRP, или с фрагментом CGRP, так же как и с полноразмерным CGRP, предпочтительно с C-концевой областью или фрагментом CRGP, предпочтительно C-концевой областью или фрагментом CRGP, включающими аминокислоты CGRP 19-37, или 25-37, или 29-37, или альтернативно 30-37, или также альтернативно 31-37. В другом варианте осуществления C-концевая область или фрагмент CRGP предпочтительно включает аминокислоты CGRP 32-37, наиболее предпочтительно 33-37.
В другом предпочтительном варианте осуществления антитело к антагонисту CGRP или его антигенсвязывающий фрагмент, применяемый в изобретении, способен конкурировать с антителом к антагонисту CGRP, описанным выше, в частности G1 или G2, как описано в настоящей заявке, за:
(a) связывание с CGRP или фрагментом CGRP, или с фрагментом CGRP, так же как и полноразмерным CGRP, предпочтительно C-концевой областью или фрагментом CRGP, предпочтительно C-концевой областью или фрагментом CRGP, включающими аминокислоты CGRP 19-37, или 25-37, или 29-37, или альтернативно 30-37, или также альтернативно 31-37, предпочтительно аминокислоты 32-37, наиболее предпочтительно 33-37, предпочтительно CGRP представляет собой альфа- или бета-CGRP, предпочтительно бета, более предпочтительно грызуна или человека, наиболее предпочтительно человека,
(b) связывание с последовательностью эпитопа GSKAF, предпочтительно в положении аминокислот 33-37 CGRP, как определено в (a), более предпочтительно с последовательностью GXXXF, где X является любой аминокислотой, предпочтительно GXXXF в положении аминокислот 33-37 CGRP, как определено в (a),
(c) связывание, как описано в (a) или (b), по существу с такой же Kd и/или по существу с такой же KOff, и/или
(d) связывание с CGRP и ингибирование/антагонизм в отношении биологической активности CGRP и/или последующего пути (путей), предпочтительно CGRP представляет собой альфа- или бета-CGRP, предпочтительно бета, более предпочтительно грызуна или человека, наиболее предпочтительно человека.
Антитело к антагонисту CGRP предпочтительно связывается с CGRP, областью CGRP или фрагментом CGRP с аффинностью связывания (Kd) в диапазоне от 0,000001 мкМ (0,001 нМ) или 0,00001 мкМ (0,01 нм) до 500 мкМ. В некоторых предпочтительных вариантах осуществления аффинность связывания (Kd) находится в пределах от 0,000001 мкМ или 0,00001 мкМ до, или составляет приблизительно, 250 мкМ, 100 мкМ, 50 мкМ, 10 мкМ, 1 мкМ, 500 нМ, 250 нМ, 100 нМ, 50 нМ, 20 нМ, 15 нМ, 10 нМ, 5 нМ, 1 нМ, 0,5 нМ, 1 нМ, 0,05 нМ или 0,01 нМ, 0,005 нМ, 0,001 нМ, как измерено в анализе связывания in vitro. В некоторых других предпочтительных вариантах осуществления аффинность связывания (Kd) меньше, чем любое значение из 500 пМ, или 100 пМ, 50 пМ, или 10 пМ, 5 пМ, 1 пМ, как измерено в анализе связывания in vitro. В другом более предпочтительном варианте осуществления аффинность связывания (Kd) составляет 0,04 нМ или 16 нМ.
Антитело к антагонисту CGRP, применяемое в настоящем изобретении, может быть выбрано из следующей группы, включающей: моноклональные антитела, поликлональные антитела, фрагменты антитела (например, Fab, Fab', F(ab')2, Fv, Fc и т.д.), химерные антитела, биспецифические антитела, гетероконъюгированные антитела, одноцепочечные (ScFv) антитела, их мутанты, слитые белки, включающие фрагмент антитела (например, доменное антитело), гуманизированные антитела, а также любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая включает сайт распознавания антигена, обладающий требуемой специфичностью, включая гликозилированные варианты антител, варианты антител по аминокислотной последовательности и ковалентно модифицированные антитела. Антитело к антагонисту CGRP может быть мышиным, крысиным, человеческим или иметь любое другое происхождение (включая химерные или гуманизированные антитела). В некоторых вариантах осуществления антитело к антагонисту CGRP может быть гуманизированным, но более предпочтительно является человеческим. Предпочтительно антитело к антагонисту CGRP является выделенным, более предпочтительно оно по существу является чистым. В том случае когда антитело к антагонисту CGRP является фрагментом антитела, фрагмент предпочтительно сохраняет функциональные свойства исходного антитела, а именно связывание CGRP и/или антагонистическую активность, как описано в функциональных свойствах выше.
Примеры антител к антагонисту CGRP известны в уровне техники. Следовательно, согласно предпочтительному варианту осуществления настоящего изобретения антитело к антагонисту CGRP, применяемое в настоящем изобретении, предпочтительно представляет собой антитело к CGRP, как в целом или конкретно раскрыто в любом из следующих документов: (i) WO2007/054809, (ii) WO2007/076336, (iii) Tan et al., Clin. Sci. (Lond). 89:565-73, 1995, (iv) Sigma (Missouri, US), номер по каталогу C7113 (клон #4901), (v) Plourde et al., Peptides 14:1225-1229, 1993, или антитело, которое включает или состоит из следующего:
(a) фрагмент указанного антитела (например, Fab, Fab', F(ab')2, Fv, Fc, ScFv и т.д.),
(b) легкая цепь указанного антитела,
(c) тяжелая цепь указанного антитела,
(d) одна или более вариабельных областей из легкой цепи и/или тяжелой цепи указанного антитела,
(e) одна или более CDR (одна, две, три, четыре, пять или шесть CDR) указанного антитела,
(f) CDR H3 из тяжелой цепи указанного антитела,
(g) CDR L3 из легкой цепи указанного антитела,
(h) три CDR из легкой цепи указанного антитела,
(i) три CDR из тяжелой цепи указанного антитела,
(j) три CDR из легкой цепи и три CDR из тяжелой цепи указанного антитела,
(k) одно или более из (a)-(j).
Согласно предпочтительному варианту осуществления настоящего изобретения антитело к антагонисту CGRP представляет собой антитело G2 или антитело G1. Согласно наиболее предпочтительному варианту осуществления настоящего изобретения применяемое антитело к антагонисту CGRP является антителом к CGRP, G1, как конкретно раскрыто в заявке на патент WO2007/054809, или включает его варианты, показанные в Таблице 6 WO2007/054809, а также включает антитела, функционально эквивалентные G1, то есть включающие консервативные замены аминокислотных остатков или одну или более делеций или дополнений аминокислот, которые не воздействуют существенно на их функциональные свойства, например связывание CRGP или антагонистическую активность в отношении CRGP, а также варианты, которые имеют увеличенную или уменьшенную активность и/или связывание. Используемые в настоящей заявке термины "G1" и "антитело G1" используются попеременно для отсылки к антителу, полученному с применением векторов экспрессии, имеющих регистрационные номера в Американской коллекции типовых культур ATCC PTA-6867 и ATCC PTA-6866, как раскрыто в заявке WO2007/054809.
Согласно следующему варианту осуществления настоящего изобретения антитело к антагонисту CGRP включает или состоит из полипептида, выбранного из следующего: (a) антитело G1 или его варианты, показанные в Таблице 6 WO2007/054809; (b) фрагмент или область антитела G1 или его вариантов, показанных в Таблице 6 WO2007/054809; (c) легкая цепь антитела G1 или его вариантов, показанных в Таблице 6 WO2007/054809; (d) тяжелая цепь антитела G1 или его вариантов, показанных в Таблице 6 WO2007/054809; (e) одна или более вариабельных областей из легкой цепи и/или тяжелой цепи антитела G1 или его вариантов, показанных в Таблице 6 WO2007/054809; (f) одна или более CDR (одна, две, три, четыре, пять или шесть CDR) антитела G1 или его вариантов, показанных в Таблице 6 WO2007/054809; (g) CDR H3 из тяжелой цепи антитела G1 или его вариантов, показанных в Таблице 6 WO2007/054809; (h) CDR L3 из легкой цепи антитела G1 или его вариантов, показанных в Таблице 6 WO2007/054809; (i) три CDR из легкой цепи антитела G1 или его вариантов, показанных в Таблице 6 WO2007/054809; j) три CDR из тяжелой цепи антитела G1 или его вариантов, показанных в Таблице 6 WO2007/054809; (k) три CDR из легкой цепи и/или три CDR из тяжелой цепи антитела G1 или его вариантов, показанных в Таблице 6 WO2007/054809; и (i) антитело, включающее любое из (b)-(k). Изобретение также предоставляет полипептиды, включающие одно или более из вышеперечисленного. В некоторых вариантах осуществления, по меньшей мере, одна, две, три, четыре, пять или шесть CDR, по меньшей мере, приблизительно на 85%, 86%, 87%, 88%, 89%, 90%, 95%, 96%, 97%, 98% или 99% идентичны, по меньшей мере, одной, двум, трем, четырем, пяти или шести CDR G1 или его вариантов, показанных в Таблице 6 WO2007/054809.
Определение областей CDR находится в компетенции квалифицированного специалиста. Подразумевается, что в некоторых вариантах осуществления CDR могут являться комбинацией CDR Кэбата и Чотиа. В некоторых вариантах осуществления CDR представляют собой CDR Кэбата. В других вариантах осуществления CDR представляют собой CDR Чотиа.
Антитело к антагонисту CGRP предпочтительно включает или состоит из фрагмента или области антитела G1 (например, Fab, Fab', F(ab')2, Fv, Fc, ScFv и т.д.) или его вариантов, показанных в Таблице 6 WO2007/054809. Предпочтительно указанный фрагмент или область обладают функциональными свойствами антитела к антагонисту CGRP, например связывающей активностью и/или антагонистической активностью в отношении CGRP, и включают или состоят из одного или более из легкой цепи, тяжелой цепи, фрагмента, содержащего одну или более вариабельных областей из легкой цепи и/или тяжелой цепи или одну или более CDR из легкой цепи и/или тяжелой цепи антитела G1.
Согласно другому предпочтительному варианту осуществления изобретения антитело к антагонисту CGRP включает вариабельную область легкой цепи, LCVR, которая включает пептид с последовательностью, выбранной из группы, состоящей из SEQ ID NO:28-32, и/или вариабельную область тяжелой цепи, HCVR, которая включает пептид с последовательностью, выбранной из группы, состоящей из SEQ ID NO:34-38 заявки на патент WO2007/076336.
Более предпочтительно антитело к антагонисту CGRP включает полипептид LCVR согласно SEQ ID NO, как показано в Таблице 1 заявки на патент WO2007/076336, и также включает полипептид HCVR согласно SEQ ID NO, как показано в Таблице 1 заявки на патент WO2007/076336.
Согласно следующему варианту осуществления изобретения применяемое антитело к антагонисту CGRP включает CDR легкой цепи (CDRL), выбранную из группы, состоящей из SEQ ID NO:8-13, и/или CDR тяжелой цепи (CDRH), выбранную из группы, состоящей из SEQ ID NO:14-22 заявки на патент WO2007/076336.
Способы получения и выделения антител к антагонисту CGRP из заявки WO2007/076336, а также данные, демонстрирующие их связывание с CGRP и антагонистические характеристики, описаны в заявке WO2007/076336.
Предпочтительно антитело к антагонисту CGRP, применяемое в настоящем изобретении, включает домен VH, который по аминокислотной последовательности, по меньшей мере, на 85%, по меньшей мере, на 86%, по меньшей мере, на 87%, по меньшей мере, на 88%, по меньшей мере, на 89%, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99% или на 100% идентичен SEQ ID NO:1 или SEQ ID NO:19, представленным в настоящей заявке.
Предпочтительно антитело к антагонисту CGRP включает домен VL, который по аминокислотной последовательности, по меньшей мере, на 85%, по меньшей мере, на 86%, по меньшей мере, на 87%, по меньшей мере, на 88%, по меньшей мере, на 89%, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99% или на 100% идентичен SEQ ID NO:2 или SEQ ID NO:20, представленным в настоящей заявке.
Антитело к антагонисту CGRP предпочтительно включает домен VH и домен VL, которые по аминокислотной последовательности, по меньшей мере, на 85%, по меньшей мере, на 86%, по меньшей мере, на 87%, по меньшей мере, на 88%, по меньшей мере, на 89%, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99% или на 100% идентичны SEQ ID NO:1 и 2 соответственно или SEQ ID NO:19 и 20 соответственно, представленным в настоящей заявке.
Предпочтительно антитело к антагонисту CGRP включает домен VH, который по аминокислотной последовательности, по меньшей мере, на 90% идентичен SEQ ID NO:1, и домен VL, который по аминокислотной последовательности, по меньшей мере, на 90% идентичен SEQ ID NO:2, представленным в настоящей заявке.
В альтернативе антитело к антагонисту CGRP предпочтительно включает домен VH, который по аминокислотной последовательности, по меньшей мере, на 90% идентичен SEQ ID NO:19, и домен VL, который по аминокислотной последовательности, по меньшей мере, на 90% идентичен SEQ ID NO:20, представленным в настоящей заявке.
Антитело к антагонисту CGRP предпочтительно включает, по меньшей мере, одну CDR, выбранную из группы, состоящей из: (a) CDR H1, приведенную в SEQ ID NO:3 или 21; (b) CDR H2, приведенную в SEQ ID NO:4 или 22; (c) CDR H3, приведенную в SEQ ID NO:5 или 23; (d) CDR L1, приведенную в SEQ ID NO:6 или 24; (e) CDR L2, приведенную в SEQ ID NO:7 или 25; (f) CDR L3, приведенную в SEQ ID NO:8 или 26; и (g) варианты CDR L1, CDR L2 и CDR H2, как показано в Таблице 6 WO2007/054809.
Согласно предпочтительному варианту осуществления настоящего изобретения константная область тяжелой цепи антитела к антагонисту CGRP может относиться к любому типу константной области, такому как IgG, IgM, IgD, IgA и IgE, а также к любому из изотипов, таких как IgG1, IgG2, IgG3 и IgG4.
Более предпочтительно антитело к антагонисту CGRP включает тяжелую цепь, полученную с применением вектора экспрессии с регистрационным номером ATCC PTA-6867. Более предпочтительно антитело к антагонисту CGRP включает легкую цепь, полученную с применением вектора экспрессии с регистрационным номером ATCC PTA-6866. Более предпочтительно антитело к антагонисту CGRP получено с применением векторов экспрессии с регистрационными номерами ATCC PTA-6867 и PTA-6866.
Предпочтительно антитело к антагонисту CGRP, применяемое в настоящем изобретении, представляет собой антитело G1 или антитело G2, которые определены в настоящей заявке.
Согласно следующему варианту осуществления изобретения антитело к антагонисту CGRP включает модифицированную константную область, как, например, описанную в WO2007/054809. Предпочтительно модифицированная константная область иммунологически инертна, включая частичную иммунологическую инертность, при этом она не вызывает комплементопосредованный лизис, не стимулирует антителозависимую клеточноопосредованную цитотоксичность (ADCC), не активирует микроглию. Предпочтительно модифицированная константная область обладает пониженной, одной или более из перечисленных, активностью. Наиболее предпочтительно константная область модифицирована, как описано в Eur. J. Immunol. (1999) 29:2613-2624; заявке PCT PCT/GB99/01441; и/или заявке на патент Великобритании 9809951.8. Согласно предпочтительному варианту осуществления изобретения антитело к антагонисту CGRP включает константную область тяжелой цепи IgG2 человека, включающую следующие мутации: A330, P331 на S330, S331 (нумерация аминокислот соответствует последовательности IgG2 дикого типа). Eur. J. Immunol. (1999) 29:2613-2624.
Способы получения и выделения антител к антагонисту CGRP заявки WO2007/054809, а также данные, демонстрирующие их связывание с CGRP и их антагонистическую характеристику, описаны в заявке WO2007/054809. Последовательности SEQ ID NO:1-14 из указанной заявки представлены в настоящей заявке как SEQ ID NO:1-14 соответственно.
Согласно другому варианту осуществления настоящего изобретения лекарственное средство получают для периферического введения от одного до 7 раз в неделю, более предпочтительно от одного до четырех раз в месяц, более предпочтительно от одного до шести раз в течение 6-месячного периода, более предпочтительно от одного до двенадцати раз в течение года. Предпочтительно лекарственное средство получают для периферического введения в период, выбранный из следующего: один раз ежедневно, один раз каждые два, три, четыре, пять или шесть дней, еженедельно, один раз каждые две недели, один раз каждые три недели, ежемесячно, один раз каждые два месяца, один раз каждые три месяца, один раз каждые четыре месяца, один раз каждые пять месяцев, один раз каждые шесть месяцев, один раз каждые семь месяцев, один раз каждые восемь месяцев, один раз каждые девять месяцев, один раз каждые десять месяцев, один раз каждые одиннадцать месяцев или один раз в год. Согласно предпочтительным вариантам осуществления лекарственное средство получают для периферического введения через путь, выбранный из одного или более следующего: перорально, сублингвально, буккально, местно, ректально, посредством ингаляции, трансдермально, подкожно, внутривенно, внутриартериально или внутримышечно, посредством внутрисердечного введения, интраназально, интрадермально, интраперитонеально, трансмукозально, вагинально, интравитреально, накожно, интраартикулярно, периартикулярно или местно.
Согласно следующему варианту осуществления настоящего изобретения лекарственное средство получают для периферического введения с концентрацией антитела от 0,1 до 200 мг/мл; предпочтительно приблизительно или от 0,1 до приблизительно 0,5, 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 мг/мл ±10% погрешность, наиболее предпочтительно 50 мг/мл.
Согласно другому варианту осуществления настоящего изобретения лекарственное средство получают для периферического введения с концентрацией антитела от 0,1 до 200 мг/кг массы тела; предпочтительно приблизительно или от 0,1 до приблизительно 0,5, 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 мг/кг массы тела ±10% погрешность, наиболее предпочтительно 10 мг/кг.
Согласно предпочтительному варианту осуществления настоящего изобретения антитело к антагонисту CGRP имеет время полужизни in vivo, составляющее более чем 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112, 114, 116, 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148, 150, 152, 154, 156, 158, 160, 162, 164, 166, 168, 170, 172, 174, 176, 178, 180, 182, 184, 186, 188, 190, 192, 194, 196, 198, 200, 202, 204, 206, 208 или 210 дней ±1 день, более предпочтительно более чем 7, 8, 9, 10, 11 или 12 месяцев.
Предпочтительно антитело к антагонисту CGRP имеет время полужизни in vivo, превышающее 6 дней.
Согласно следующему предпочтительному варианту осуществления настоящего изобретения лекарственное средство и/или антитело к антагонисту CGRP не оказывает воздействий на центральную нервную систему и/или нарушает когнитивные функции. Предпочтительно лекарственное средство и/или антитело к антагонисту CGRP не вызывают какие-либо из следующих эффектов: амнезию, спутанность сознания, деперсонализацию, гипестезию, нарушение мышления, тризм, вертиго, акатизию, апатию, атаксию, околоротовую парестезию, возбуждение ЦНС, эмоциональную лабильность, эйфорию, галлюцинации, враждебность, гиперестезию, гиперкинезию, гипотонию, нарушение координации, усиление либидо, маниакальную реакцию, миоклонию, невралгию, нейропатию, психоз, пароксизм, нарушение речи, ступор, суицидальное мышление, головокружение, сонливость, бессонницу, беспокойство, тремор, депрессию или парестезию. Наиболее предпочтительно лекарственное средство и/или антитело к антагонисту CGRP не вызывают нарушения моторной координации или внимания.
Согласно другому варианту осуществления настоящего изобретения лекарственное средство и/или антитело к антагонисту CGRP не вызывают нарушения дыхательной, почечной или желудочно-кишечной функции.
Согласно следующему варианту осуществления настоящего изобретения лекарственное средство и/или антитело к антагонисту CGRP не вызывают эффектов физической и/или психологической зависимости. Предпочтительно лекарственное средство и/или антитело к антагонисту CGRP не демонстрируют сродства к опиатным, бензодиазепиновым, фенилциклидиновым (PCP) рецепторам или рецепторам N-метил-D-аспарагиновой кислоты (NMDA), или не стимулируют ЦНС, или не оказывают какого-либо седативного или эйфорического эффекта.
В одном варианте осуществления антитело к антагонисту CGRP, при введении, уменьшает интенсивность, контролирует, снижает частоту или замедляет развитие или прогрессию ощущения центральной боли.
В другом варианте осуществления эффект антитела к антагонисту CGRP не уступает и/или превышает эффекты НПВС и/или опиатов в аналогичных моделях воспалительной боли. В одном варианте осуществления антитело к антагонисту CGRP эффективно при лечении неподдающихся терапии групп боли.
Согласно другому аспекту настоящего изобретения предлагается применение или способ согласно любому другому аспекту изобретения, где антитело к антагонисту CGRP вводят отдельно, последовательно или одновременно в сочетании с одним или более другими фармакологически активными соединениями или средствами, которые предпочтительно применяются для лечения воспалительной боли. Предпочтительно дополнительное средство (средства) выбрано из одного или более следующего:
(i) опиоидного аналгетика, например морфина, героина, гидроморфона, оксиморфона, леворфанола, леваллорфана, метадона, меперидина, фентанила, кокаина, кодеина, дигидрокодеина, оксикодона, гидрокодона, пропоксифена, налмефена, налорфина, налоксона, налтрексона, бупренорфина, буторфанола, налбуфина или пентазоцина;
(ii) нестероидного противовоспалительного средства (НПВС), например аспирина, диклофенака, дифлусинала, этодолака, фенбуфена, фенопрофена, флуфенисала, флурбипрофена, ибупрофена, индометацина, кетопрофена, кеторолака, меклофенамовой кислоты, мефенамовой кислоты, набуметона, напроксена, оксапрозина, фенилбутазона, пироксикама, сулиндака, толметина или зомепирака, ингибиторов циклооксигеназы-2 (COX-2), целекоксиба; рофекоксиба; мелоксикама; JTE-522; L-745,337; NS398 или их фармацевтически приемлемой соли;
(iii) седативного средства из группы барбитуратов, например амобарбитала, апробарбитала, бутабарбитала, буталбитала, мефобарбитала, метарбитала, метогекситала, пентобарбитала, фенобарбитала, секобарбитала, талбутала, тиамилала или тиопентала или их фармацевтически приемлемой соли;
(iv) бензодиазепина, обладающего седативным действием, например хлордиазепоксида, клоразепата, диазепама, флуразепама, лоразепама, оксазепама, темазепама или триазолама или их фармацевтически приемлемой соли;
(v) антагониста H1, обладающего седативным действием, например дифенилгидрамина, пириламина, прометазина, хлорфенирамина или хлорциклизина или их фармацевтически приемлемой соли;
(vi) седативного средства, такого как глутетимид, мепробамат, метаквалон или дихлоралфеназон или их фармацевтически приемлемой соли;
(vii) миорелаксанта, например баклофена, каризопродола, хлорзоксазона, циклобензаприна, метокарбамола или орфренадрина или их фармацевтически приемлемой соли;
(viii) антагониста рецептора NMDA, например декстрометорфана ((+)-3-гидрокси-N-метилморфинана) или его метаболита декстрорфана ((+)-3-гидрокси-N-метилморфинана), кетамина, мемантина, пирролохинолин-хинона или цис-4-(фосфонометил)-2-пиперидинкарбоновой кислоты или их фармацевтически приемлемой соли;
(ix) альфа-адренергического средства, например доксазозина, тамсулозина, клонидина или 4-амино-6,7-диметокси-2-(5-метансульфонамидо-1,2,3,4-тетрагидроизохинол-2-ил)-5-(2-пиридил)хиназолина;
(x) трициклического антидепрессанта, например дезипрамина, имипрамина, амитриптилина или нортриптилина;
(xi) противосудорожного средства, например карбамазепина или вальпроата;
(xii) антагониста тахикининов (NK), в особенности антагониста рецепторов NK-3, NK-2 или NK-1, например (αR,9R)-7-[3,5-бис(трифторметил)бензил]-8,9,10,11-тетрагидро-9-метил-5-(4-метилфенил)-7H-[1,4]диазоцино[2,1-g][1,7]нафтиридин-6-13-диона (TAK-637), 5-[[(2R,3S)-2-[(1R)-1-[3,5-бис(трифторметил)фенил]-этокси-3-(4-фторфенил)-4-морфолинил]метил]-1,2-дигидро-3H-1,2,4-триазол-3-она (MK-869), ланепитанта, дапитанта или 3-[[2-метокси-5-(трифторметокси)фенил]метиламино]-2-фенил-пиперидина (2S,3S);
(xiii) антагониста мускариновых рецепторов, например оксибутина, толтеродина, пропиверина, тропсия хлорида или дарифенацина;
(xiv) ингибитора COX-2, например целекоксиба, рофекоксиба или валдекоксиба;
(xv) неселективного ингибитора COX (предпочтительно с защитой ЖКТ), например нитрофлурбипрофена (HCT-1026);
(xvi) анальгетика, получаемого из каменноугольной смолы, в частности парацетамола;
(xvii) нейролептического средства, такого как дроперидол;
(xviii) агониста ваниллойдных рецепторов (например, резинфератоксина) или антагониста (например, капсазепина);
(xix) бета-адренергического средства, такого как пропранолол;
(xx) местного анастетика, такого как мексилетин;
(xxi) кортикостероида, такого как дексаметазон;
(xxii) агониста или антагониста серотониновых рецепторов;
(xxiii) холинергического (никотинового) анальгетика;
(xxiv) Трамадола (торговая марка);
(xxv) ингибитора PDEV, такого как силденафил, варденафил или таладафил;
(xxvi) альфа-2-дельта лиганда, такого как габапентин или прегабалин;
(xxvii) каннабиноида; и
(xxviii) антидепрессанта, такого как амитриптилин (Элавил), тразодон (Дезирел) и имипрамин (Тофранил), или противосудорожных средств, таких как фенитоин (Дилантин) или карбамазепин (Тегретол).
Согласно следующему аспекту настоящего изобретения предложена фармацевтическая композиция для профилактики и/или лечения воспалительной боли и/или симптомов воспалительной боли или для уменьшения интенсивности, контроля, снижения частоты или замедления развития или прогрессии воспалительной боли и/или симптомов воспалительной боли у индивида, содержащая антитело к антагонисту CGRP и фармацевтически приемлемый носитель и/или инертный наполнитель, где композицию получают для периферического введения.
Согласно другому аспекту настоящего изобретения предложен набор, включающий:
(a) фармацевтическую композицию, определенную выше; и
(b) инструкции для периферического введения эффективного количества указанной фармацевтической композиции индивиду в целях профилактики и/или лечения воспалительной боли и/или симптомов воспалительной боли или для уменьшения интенсивности, контроля, снижения частоты или замедления развития или прогрессии воспалительной боли и/или симптомов воспалительной боли.
Набор может включать одну или более емкостей, содержащих антитело к антагонисту CGRP или полипептид, описанный в настоящей заявке, а также инструкции по применению в соответствии с любым из способов и применений изобретения. Набор может дополнительно включать описание выбора лица, подходящего для лечения, основанное на выявлении того, имеет ли данное лицо воспалительную боль или подвергается риску развития воспалительной боли. Инструкции по периферическому введению фармацевтической композиции могут включать информацию касательно дозировки, схемы введения доз и путей введения для намеченного лечения.
Предпочтительные признаки каждого аспекта изобретения применимы в равной степени к другим аспектам с учетом соответствующих изменений.
ПРИМЕРЫ
Настоящее изобретение далее описывается с помощью следующих примеров, которые предназначены для иллюстрации, но не ограничения изобретения.
Следующие примеры и фигуры приведены в отношении антитела G1, человеческого моноклонального антитела к CGRP человека; а также антитела G2, мышиного моноклонального антитела к CGRP крысы (Wong HC et al. Hybridoma 12:93-106 (1993)).
Пример 1: Механические модели боли при остеоартрите (ОА) (рассечение внутреннего мениска (MMT))
Рассечение внутреннего мениска (MMT) на одном заднем колене крысы приводит к развитию поражений хряща и других изменений в суставе, подобных тем, которые наблюдаются при ОА. Развивающаяся боль в суставе приводит к развитию долговременных изменений в нагрузке (оцениваемых с использованием измерителя ограничения подвижности) на задние конечности крысы и механической (тактильной) аллодинии (оцениваемой с использованием нитей фон Фрея), на задней лапке, которые имеют длительность нескольких недель. Исследования проводили в соответствии со слепым методом, когда исследователю не известна идентичность соединения/контроля или терапии животного.
Антитело G2 (моноклональное антитело к CGRP) устраняло недостаточность нагрузки на заднюю лапку с ОА при наиболее высокой тестируемой дозе, 10 мг/кг, в/в. Его эффект был сопоставим с эффектом целекоксиба. Оба соединения устраняли изменение в нагрузке на конечность с ОА, выравнивая ее до нормального значения. При более низкой дозе какого-либо эффекта не наблюдали. Данный эффект длился в течение 10 дней после введения, когда уровень в плазме антитела G2 достиг среднего значения 65,1±3 мкг/мл (6,3±0,3 мкг/мл, для более низкой дозы в течение 10 дней после в/в введения).
Отрицательный контроль, неактивное антитело, то есть антитело, не связывающее CGRP (см. Фиг.1), продемонстрировало эффект в отношении нагрузки на лапку в ранних моментах времени. Данный эффект являлся неожиданным и не поддавался объяснению, но был непродолжительным и не наблюдался при аллодинии в конце исследования (Фиг.1).
Повторные эксперименты в тех же условиях, с использованием буфера в качестве отрицательного контроля, не показали эффекта в отношении нагрузки на лапку для отрицательного контроля, а для G1 показали изменение нагрузки на конечность с ОА до нормального значения.
Пример 2: Анализ связывания
Анализ связывания выполняли с целью измерения IC50 антител к CGRP, G2 и G1, при блокировании связывания α-CGRP человека с CGRP1-рецептором на клетках SK-N-MC.
Строили кривые зависимости от дозы и значения Ki определяли с использованием уравнения: Ki=IC50/(1+([лиганд]/KD); Фиг.2, где равновесная константа диссоциации для человеческого α-CGRP и CGRP1-рецептора KD = 0,37 пМ, как представлено в клетках SK-N-MC. Приведенное значение IC50 (в отношении молекул IgG) переводили в сайты связывания, чтобы его можно было сравнить с аффинностями (KD), определенными на Biacore с использованием N-биотинилированных α-CGRP человека и крысы, адсорбированных в отдельных проточных ячейках при низких уровнях (обычно 100 активных единиц) для обеспечения поверхности реакции, тогда как немодифицированная проточная ячейка служила контрольным каналом. G1 титровали по поверхности чипа, аффинности связывания выводили из показателя кинетических констант скорости (KD=kOff/kOn), см. Таблицу 1.
Аффинность связывания G1 с человеческим α и β CGRP была эквивалентной (Kd=0,155 и 0,152 нМ соответственно). Аффинность связывания G2 с крысиным α и β CGRP была эквивалентной (16 и 17 нМ соответственно). Кроме того, аффинность связывания G1 была в 40 раз более сильной в случае человеческого α-CGRP, чем крысиного α-CGRP (Kd=0,042 и 1,22 нМ соответственно), и аналогичной в случае β-CGRP человека и крысы (Kd=0,155 и 0,152 нМ соответственно). Антитело G1 также демонстрировало хорошую межвидовую селективность и связывало крысиный α-CGRP с такой же аффинностью, как и антитело G2 (приблизительно 1,2 нМ), Таблица 2.
G1 связывало α- и β-CGRP человека и яванского макака с высокой аффинностью (KD=63 и 155 пМ соответственно). G1 показало видовую селективность в отношении CGRP человека/яванского макака и связывало α- и β-CGRP других видов, например крысы, с более низкой аффинностью (KD=2,57 нМ и 152 пМ соответственно).
Пример 3: Время полужизни in vivo антитела к CGRP
Измерение антитела к CGRP в сыворотке крысы, Фиг.3, показало, что время полужизни составляет порядка 7 дней. Антитело периферически ограничено, так как имеет молекулярную массу приблизительно 150000, Фиг.3a, 3b, т.е. оно не проникает в центральную нервную систему и не пересекает гематоэнцефалический барьер.
Пример 4: Селективность антитела к CGRP
Специфичность антитела G1 к человеческому или крысиному CGRP определяли с использованием чипа Biacore для "измерения" свободной концентрации предварительно смешанного комплекса mAb+пептид. Как и ожидали, в ходе преинкубирования антитела G1 с человеческим или крысиным CGRP, реакция была полностью блокирована. Напротив, преинкубирование G1 с избытком амилина, кальцитонина или адреномедуллина было сопоставимо с контрольным ответом (G1 и буфер), что подтверждает то, что G1 не образовывал комплекса с указанными пептидами (Фиг.5).
Пример 5: Идентификация эпитопа, связываемого антителом G1
Анализ взаимодействия проводили при 25ºC на системе Biacore 3000TM, оборудованной сенсорными чипами со стрептавидиным покрытием (SA) (Biacore AB, Uppsala, Sweden) с использованием стандартного проточного буфера Biacore (HBS-P). Сначала подтверждали, что N-биотинилированный фрагмент 25-37 α-CGRP человека связывался с такой же аффинностью с антителом G1, как и полноразмерный N-биотинилированный α-CGRP человека. Затем каждую аминокислоту в положениях 27-37 отдельно мутировали с заменой аланином и выражали кратность потери аффинности в сравнении с фрагментом дикого типа. N-биотинилированные фрагменты абсорбировали в отдельных проточных ячейках на низких уровнях (обычно 100 активных единиц) с получением реакционных поверхностей, тогда как немодифицированная проточная ячейка служила контрольным каналом. Получали очищенные Fab-фрагменты антитела G1. Fab-фрагменты титровали на чипе, используя 1 мкМ в качестве верхней концентрации в двукратном серийном разведении. Фазы ассоциации и диссоциации контролировали при 100 мкл/мин в течение 1 минуты и 5 минут соответственно. Поверхности регенерировали смесью 35% этанола + 25 мМ NaOH + 0,5M NaCl.
Результаты аланинового сканирования показали, что антитело G1 связывается с C-концевой областью человеческого α-CGRP, а именно с остатками 25-37, и демонстрирует специфичное связывание в отношении области (т.е. потеря аффинности заметно возрастает при мутации в области специфичного связывания), которая может быть определена как эпитоп и находится в пределах последних 5 C-концевых аминокислот, то есть от G33A до F37A. Большинство существенных изменений аффинности вызываются при мутации G33A и F37A (Фиг.4). C-концевой Phe важен для селективности антитела G1 в отношении CGRP по сравнению с родственными пептидами и представителями семейства генов (Фиг.6).
Таким образом, в одном варианте осуществления настоящее изобретение предоставляет антитело к антагонисту CGRP, которое специфично связывается с эпитопом, определяемым аминокислотами G33-F37 CGRP. Антитело к антагонисту CGRP может специфично связываться с эпитопом, определяемым аминокислотной последовательностью GSKAF, более конкретно с эпитопом CGRP, определяемым как GXXXF, где X может являться любой аминокислотой, причем G33 и F37 являются наиболее важными остатками эпитопа, определяющими высокую аффинность связывания антитела к антагонисту CGRP.
Пример 6: Анализ показателей физической или психологической зависимости
Ни антитело G1, ни антитело G2 не демонстрировали проникновение в ЦНС. Кроме того, долговременные наблюдения за животными (крысы), получавшими одно из антител в дозах, используемых в предыдущих примерах, не подтверждали неблагоприятные эффекты на ЦНС, такие как седативный эффект или возбуждение/эйфорическое поведение, в сравнении с контрольными животными. Данные наблюдения указывают на отсутствие риска зависимости для антител и, следовательно, значительно повышают безопасность антител по сравнению с существующими опиатами, применяемыми в современных способах лечения боли.
Пример 7: Анализ показателей неблагоприятных эффектов в отношении желудочно-кишечного тракта
Исследование in vivo применения антитела G2 на крысах в течение 1 месяца и сравнительное исследование применения антитела G1 в течение 1 недели продемонстрировали, что неблагоприятные эффекты в отношении желудочно-кишечного тракта не проявлялись в поведении, потреблении пищи, выделении стула или гистопатологии по сравнению с контрольными животными. Данные наблюдения указывают на отсутствие риска неблагоприятного воздействия на желудочно-кишечный тракт для антител и, следовательно, на значительно улучшенную безопасность антител по сравнению с существующими НПВС, применяемыми в современных способах лечения боли.
Пример 8: G1 и G2 в качестве антител к антагонисту CGRP
Известным последствием биологической активности CGRP является генерация нейрогенной гиперемии при доставке in vivo. Как было продемонстрировано, G1 и G2 являются антителами к антагонисту CGRP, поскольку они предотвращают развитие нейрогенной гиперемии in vivo.
С помощью модели нейрогенной гиперемии кожи на крысах эффективность G1 тестировали на предмет его способности блокировать эффект CGRP in vivo. Подкожный нерв у крысы стимулировали электрическим током, вызывая высвобождение CGRP из нервных окончаний, приводящее к расширению сосудов, при этом изменения кровотока могли быть измерены с использованием методов лазерной доплеровской флоуметрии.
Изменения параметров кровотока выражали как площадь под кривой (AUC, изменение в произвольных доплеровских единицах потока, умноженное на время). Антагонист рецептора CGRP CGRPs-37 (400 нмоль/кг, в/в) использовали в качестве положительного контроля, чтобы подтвердить специфичность модели (данные не показаны). Для определения эффекта G1 перед введением дозы каждому животному базовый ответ кровотока на возбуждение индуцировали двумя стимуляциями подкожного нерва с интервалом в 30 минут. Крысам вводили G1, после того как ответ кровотока на вторую стимуляцию возвращался к базовым уровням (приблизительно через 10 минут после стимуляции), а затем с 30-минутными интервалами проводили еще четыре стимуляции.
Результаты (Фиг.7) продемонстрировали, что у животных, которым вводили носитель, какого-либо существенного изменения ответа кровотока не происходило, а у крыс, получавших G1, наблюдали значительное уменьшение ответа кровотока, начиная с 90 и 120 минут после введения дозы 10 мг/кг и 1 мг/кг соответственно. Подобная активность была достигнута с использованием G2. Кроме того, в других тестах на модели нейрогенной гиперемии и вазодилатации G1 показывал заметный эффект через 7 дней после в/в введения дозы (расчетное значение ED50=6 мкг/мл в модели стимуляции подкожного нерва). Выводы из проведенных тестов заключаются в том, что G1 и G2 демонстрируют антагонистическую активность к CGRP.
Подобная способность антител блокировать функцию CGRP также показана в публикации Zeller J, et. al. Br J Pharmacol. 2008 Dec; 155(7):1093-103. Epub 2008 Sep 8.
Ниже приведены последовательности антител, применяемых при осуществлении настоящего изобретения.
Последовательности антител
Аминокислотная последовательность вариабельной области тяжелой цепи антитела G1 (SEQ ID NO:1)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYWISWVRQAPGKGLEWVAEIRSESDASATHYAEAVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCLAYFDYGLAIQNYWGQGTLVTVSS
Аминокислотная последовательность вариабельной области легкой цепи антитела G1 (SEQ ID NO:2)
EIVLTQSPATLSLSPGERATLSCKASKRVTTYVSWYQQKPGQAPRLLIYGASNRYLGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCSQSYNYPYTFGQGTKLEIK
CDR H1 антитела G1 (расширенная CDR) (SEQ ID NO:3)
GFTFSNYWIS
CDR H2 антитела G1 (расширенная CDR) (SEQ ID NO:4)
EIRSESDASATHYAEAVKG
CDR H3 антитела G1 (SEQ ID NO:5)
YFDYGLAIQNY
CDR L1 антитела G1 (SEQ ID NO:6)
KASKRVTTYVS
CDR L2 антитела G1 (SEQ ID NO:7)
GASNRYL
CDR L3 антитела G1 (SEQ ID NO:8)
SQSYNYPYT
Нуклеотидная последовательность вариабельной области тяжелой цепи антитела G1 (SEQ ID NO:9)
GAAGTTCAGCTGGTTGAATCCGGTGGTGGTCTGGTTCAGCCAGGTGGTTCCCTGCGTCTGTCCTGCGCTGCTTCCGGTTTCACCTTCTCCAACTACTGGATCTCCTGGGTTCGTCAGGCTCCTGGTAAAGGTCTGGAATGGGTTGCTGAAATCCGTTCCGAATCCGACGCGTCCGCTACCCATTACGCTGAAGCTGTTAAAGGTCGTTTCACCATCTCCCGTGACAACGCTAAGAACTCCCTGTACCTGCAGATGAACTCCCTGCGTGCTGAAGACACCGCTGTTTACTACTGCCTGGCTTACTTTGACTACGGTCTGGCTATCCAGAACTACTGGGGTCAGGGTACCCTGGTTACCGTTTCCTCC
Нуклеотидная последовательность вариабельной области легкой цепи антитела G1 (SEQ ID NO:10)
GAAATCGTTCTGACCCAGTCCCCGGCTACCCTGTCCCTGTCCCCAGGTGAACGTGCTACCCTGTCCTGCAAAGCTTCCAAACGGGTTACCACCTACGTTTCCTGGTACCAGCAGAAACCCGGTCAGGCTCCTCGTCTGCTGATCTACGGTGCTTCCAACCGTTACCTCGGTATCCCAGCTCGTTTCTCCGGTTCCGGTTCCGGTACCGACTTCACCCTGACCATCTCCTCCCTGGAACCCGAAGACTTCGCTGTTTACTACTGCAGTCAGTCCTACAACTACCCCTACACCTTCGGTCAGGGTACCAAACTGGAAATCAAA
Аминокислотная последовательность тяжелой цепи полноразмерного антитела G1 (включая модифицированный IgG2, как описано в настоящей заявке) (SEQ ID NO:11)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYWISWVRQAPGKGLEWVAEIRSESDASATHYAEAVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCLAYFDYGLAIQNYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSWTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVWDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPSSIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
Аминокислотная последовательность легкой цепи полноразмерного антитела G1 (SEQ ID NO:12)
EIVLTQSPATLSLSPGERATLSCKASKRVTTYVSWYQQKPGQAPRLLIYGASNRYLGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCSQSYNYPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
Нуклеотидная последовательность тяжелой цепи полноразмерного антитела G1 (включая модифицированный IgG2, как описано в настоящей заявке) (SEQ ID NO:13)
GAAGTTCAGCTGGTTGAATCCGGTGGTGGTCTGGTTCAGCCAGGTGGTTCCCTGCGTCTGTCCTGCGCTGCTTCCGGTTTCACCTTCTCCAACTACTGGATCTCCTGGGTTCGTCAGGCTCCTGGTAAAGGTCTGGAATGGGTTGCTGAAATCCGTTCCGAATCCGACGCGTCCGCTACCCATTACGCTGAAGCTGTTAAAGGTCGTTTCACCATCTCCCGTGACAACGCTAAGAACTCCCTGTACCTGCAGATGAACTCCCTGCGTGCTGAAGACACCGCTGTTTACTACTGCCTGGCTTACTTTGACTACGGTCTGGCTATCCAGAACTACTGGGGTCAGGGTACCCTGGTTACCGTTTCCTCCGCCTCCACCAAGGGCCCATCTGTCTTCCCACTGGCCCCATGCTCCCGCAGCACCTCCGAGAGCACAGCCGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCAGAACCTGTGACCGTGTCCTGGAACTCTGGCGCTCTGACCAGCGGCGTGCACACCTTCCCAGCTGTCCTGCAGTCCTCAGGTCTCTACTCCCTCAGCAGCGTGGTGACCGTGCCATCCAGCAACTTCGGCACCCAGACCTACACCTGCAACGTAGATCACAAGCCAAGCAACACCAAGGTCGACAAGACCGTGGAGAGAAAGTGTTGTGTGGAGTGTCCACCTTGTCCAGCCCCTCCAGTGGCCGGACCATCCGTGTTCCTGTTCCCTCCAAAGCCAAAGGACACCCTGATGATCTCCAGAACCCCAGAGGTGACCTGTGTGGTGGTGGACGTGTCCCACGAGGACCCAGAGGTGCAGTTCAACTGGTATGTGGACGGAGTGGAGGTGCACAACGCCAAGACCAAGCCAAGAGAGGAGCAGTTCAACTCCACCTTCAGAGTGGTGAGCGTGCTGACCGTGGTGCACCAGGACTGGCTGAACGGAAAGGAGTATAAGTGTAAGGTGTCCAACAAGGGACTGCCATCCAGCATCGAGAAGACCATCTCCAAGACCAAGGGACAGCCAAGAGAGCCACAGGTGTATACCCTGCCCCCATCCAGAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTGAAGGGATTCTATCCATCCGACATCGCCGTGGAGTGGGAGTCCAACGGACAGCCAGAGAACAACTATAAGACCACCCCTCCAATGCTGGACTCCGACGGATCCTTCTTCCTGTATTCCAAGCTGACCGTGGACAAGTCCAGATGGCAGCAGGGAAACGTGTTCTCTTGTTCCGTGATGCACGAGGCCCTGCACAACCACTATACCCAGAAGAGCCTGTCCCTGTCTCCAGGAAAGTAA
Нуклеотидная последовательность легкой цепи полноразмерного антитела G1 (SEQ ID NO:14)
GAAATCGTTCTGACCCAGTCCCCGGCTACCCTGTCCCTGTCCCCAGGTGAACGTGCTACCCTGTCCTGCAAAGCTTCCAAACGGGTTACCACCTACGTTTCCTGGTACCAGCAGAAACCCGGTCAGGCTCCTCGTCTGCTGATCTACGGTGCTTCCAACCGTTACCTCGGTATCCCAGCTCGTTTCTCCGGTTCCGGTTCCGGTACCGACTTCACCCTGACCATCTCCTCCCTGGAACCCGAAGACTTCGCTGTTTACTACTGCAGTCAGTCCTACAACTACCCCTACACCTTCGGTCAGGGTACCAAACTGGAAATCAAACGCACTGTGGCTGCACCATCTGTCTTCATCTTCCCTCCATCTGATGAGCAGTTGAAATCCGGAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCGCGCGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCCGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACCCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGTTCTCCAGTCACAAAGAGCTTCAACCGCGGTGAGTGCTAA
Сравнение аминокислотной последовательности человеческого и крысиного CGRP (человеческий α-CGRP (SEQ ID NO:15); человеческий β-CGRP (SEQ ID NO:16); крысиный α-CGRP (SEQ ID NO:17) и крысиный β-CGRP (SEQ ID NO:18)):
NH2-ACDTATCVTHRLAGLLSRSGGVVKNNFVPTNVGSKAF-CONH2 (SEQ ID NO:15)
NH2-ACNTATCVTHRLAGLLSRSGGMVKSNFVPTNVGSKAF-CONH2 (SEQ ID NO:16)
NH2-SCNTATCVTHRLAGLLSRSGGVVKDNFVPTNVGSEAF-CONH2 (SEQ ID NO:17)
NH2-SCNTATCVTHRLAGLLSRSGGVVKDNFVPTNVGSKAF-CONH2 (SEQ ID NO:18)
Аминокислотная последовательность вариабельной области тяжелой цепи антитела G2 (SEQ ID NO:19)
EVQLQQSGPELVKPGASVKMSCKASGYTFTSSVMHWVKQKPGQGLEWIGYINPYNDGTKYNEKFKGKATLTSDKSSSTAYMELSSLTSEDSAVYYCAKGGNDGYWGQGTTLTVSS
Аминокислотная последовательность вариабельной области легкой цепи антитела G2 (SEQ ID NO:20)
EIVLTQSPTTMAASPGEKITITCSASSSISSIYLHWYQQKPGFSPKVLIYRASNLASGVPARFSGSGSGTSYSLTIGTMEAEDVATYYCQQGSTIPFTFGSGTKLEIK
CDR H1 антитела G2 (расширенная CDR) (SEQ ID NO:21)
SSVMH
CDR H2 антитела G2 (расширенная CDR) (SEQ ID NO:22)
YINPYNDGTKYNEKFKG
CDR H3 антитела G2 (SEQ ID NO:23)
GGNDGY
CDR L1 антитела G2 (SEQ ID NO:24)
SASSSISSIYLH
CDR L2 антитела G2 (SEQ ID NO:25)
RASNLAS
CDR L3 антитела G2 (SEQ ID NO:26)
QQGSTIPFT
Нуклеотидная последовательность вариабельной области тяжелой цепи антитела G2 (SEQ ID NO:27)
GAGGTCCAGCTGCAGCAGTCTGGACCTGAGCTGGTAAAGCCTGGGGCTTCAGTGAAGATGTCCTGCAAGGCTTCTGGATACACATTCACTAGCTCTGTTATGCACTGGGTGAAGCAGAAGCCTGGGCAGGGCCTTGAGTGGATTGGATATATTAATCCTTACAATGATGGTACTAAGTACAATGAGAAGTTCAAAGGCAAGGCCACACTGACTTCAGACAAATCCTCCAGCACAGCCTACATGGAACTCAGCAGCCTGACCTCTGAGGACTCTGCGGTCTATTACTGTGCAAAAGGGGGTAACGATGGCTACTGGGGCCAAGGCACTACTCTCACAGTCTCCTCA
Нуклеотидная последовательность вариабельной области легкой цепи антитела G2 (SEQ ID NO:28)
GAAATTGTGCTCACCCAGTCTCCAACCACCATGGCTGCATCTCCCGGGGAGAAGATCACTATCACCTGTAGTGCCAGCTCAAGTATAAGTTCCATTTACTTGCATTGGTATCAGCAGAAGCCAGGATTCTCCCCTAAAGTCTTGATTTATAGGGCATCCAATCTGGCTTCTGGAGTCCCAGCTCGCTTCAGTGGCAGTGGGTCTGGGACCTCTTACTCTCTCACAATTGGCACCATGGAGGCTGAAGATGTTGCCACTTACTACTGCCAGCAGGGTAGTACTATACCATTCACGTTCGGCTCGGGGACAAAGTTGGAAATAAAA
Аминокислотная последовательность тяжелой цепи полноразмерного антитела G2 (не включая Fc-домен) (SEQ ID NO:29)
EVQLQQSGPELVKPGASVKMSCKASGYTFTSSVMHWVKQKPGQGLEWIGYINPYNDGTKYNEKFKGKATLTSDKSSSTAYMELSSLTSEDSAVYYCAKGGNDGYWGQGTTLTVSSAKTTPPSWPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRD
Аминокислотная последовательность легкой цепи полноразмерного антитела G2 (SEQ ID NO:30)
EIVLTQSPTTMAASPGEKITITCSASSSISSIYLHWYQQKPGFSPKVLIYRASNLASGVPARFSGSGSGTSYSLTIGTMEAEDVATYYCQQGSTIPFTFGSGTKLEIKRADAAPTVSIFPPSSEQLTSGGASWCFLNNFYPRDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC
Нуклеотидная последовательность тяжелой цепи полноразмерного антитела G2 (не включая Fc-домен) (SEQ ID NO:31)
GAGGTCCAGCTGCAGCAGTCTGGACCTGAGCTGGTAAAGCCTGGGGCTTCAGTGAAGATGTCCTGCAAGGCTTCTGGATACACATTCACTAGCTCTGTTATGCACTGGGTGAAGCAGAAGCCTGGGCAGGGCCTTGAGTGGATTGGATATATTAATCCTTACAATGATGGTACTAAGTACAATGAGAAGTTCAAAGGCAAGGCCACACTGACTTCAGACAAATCCTCCAGCACAGCCTACATGGAACTCAGCAGCCTGACCTCTGAGGACTCTGCGGTCTATTACTGTGCAAAAGGGGGTAACGATGGCTACTGGGGCCAAGGCACTACTCTCACAGTCTCCTCAGCCAAAACGACACCCCCATCTGTCTATCCACTGGCCCCTGGATCTGCTGCCCAAACTAACTCCATGGTGACCCTGGGATGCCTGGTCAAGGGCTATTTCCCTGAGCCAGTGACAGTGACCTGGAACTCTGGATCCCTGTCCAGCGGTGTGCACACCTTCCCAGCTGTCCTGCAGTCTGACCTCTACACTCTGAGCAGCTCAGTGACTGTCCCCTCCAGCACCTGGCCCAGCGAGACCGTCACCTGCAACGTTGCCCACCCGGCCAGCAGCACCAAGGTGGACAAGAAAATTGTGCCCAGGGAT
Нуклеотидная последовательность легкой цепи полноразмерного антитела G2 (SEQ ID NO:32)
GAAATTGTGCTCACCCAGTCTCCAACCACCATGGCTGCATCTCCCGGGGAGAAGATCACTATCACCTGTAGTGCCAGCTCAAGTATAAGTTCCATTTACTTGCATTGGTATCAGCAGAAGCCAGGATTCTCCCCTAAAGTCTTGATTTATAGGGCATCCAATCTGGCTTCTGGAGTCCCAGCTCGCTTCAGTGGCAGTGGGTCTGGGACCTCTTACTCTCTCACAATTGGCACCATGGAGGCTGAAGATGTTGCCACTTACTACTGCCAGCAGGGTAGTACTATACCATTCACGTTCGGCTCGGGGACAAAGTTGGAAATAAAACGGGCTGATGCTGCACCAACTGTATCCATCTTCCCACCATCCAGTGAGCAGTTAACATCTGGAGGTGCCTCAGTCGTGTGCTTCTTGAACAACTTCTACCCCAGAGACATCAATGTCAAGTGGAAGATTGATGGCAGTGAACGACAAAATGGTGTCCTGAACAGTTGGACTGATCAGGACAGCAAAGACAGCACCTACAGCATGAGCAGCACCCTCACATTGACCAAGGACGAGTATGAACGACATAACAGCTATACCTGTGAGGCCACTCACAAGACATCAACTTCACCCATCGTCAAGAGCTTCAACAGGAATGAGTGTTAA
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ БОЛИ | 2009 |
|
RU2522493C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ВИСЦЕРАЛЬНОЙ БОЛИ ПУТЕМ ВВЕДЕНИЯ АНТИТЕЛ-АНТАГОНИСТОВ, НАПРАВЛЕННЫХ ПРОТИВ ПЕПТИДА, СВЯЗАННОГО С ГЕНОМ КАЛЬЦИТОНИНА | 2010 |
|
RU2535074C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ МИГРЕНОЗНОЙ ГОЛОВНОЙ БОЛИ | 2015 |
|
RU2707745C2 |
| АНТИТЕЛА ПРОТИВ ФАКТОРА РОСТА НЕРВОВ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2012 |
|
RU2644235C2 |
| ОТБОР ПАЦИЕНТОВ С ГОЛОВНОЙ БОЛЬЮ, ВОСПРИИМЧИВЫХ К АНТИТЕЛАМ, НАПРАВЛЕННЫМ ПРОТИВ КАЛЬЦИТОНИН ГЕН-РОДСТВЕННОГО ПЕПТИДА | 2018 |
|
RU2770066C2 |
| ХИМЕРНЫЙ БЕЛОК, СОСТАВЛЕННЫЙ ИЗ ДОМЕНА АНТАГОНИСТА NGF И ДОМЕНА АНТАГОНИСТА TNFα | 2015 |
|
RU2678810C2 |
| БЕЛКИ, СВЯЗЫВАЮЩИЕ ПРОСТАГЛАНДИН Е2, И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2559525C2 |
| Лечение остеоартрита | 2009 |
|
RU2712273C2 |
| ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕ RET, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2821548C2 |
| АНТИТЕЛА ПРОТИВ CCR2 | 2009 |
|
RU2547595C2 |
















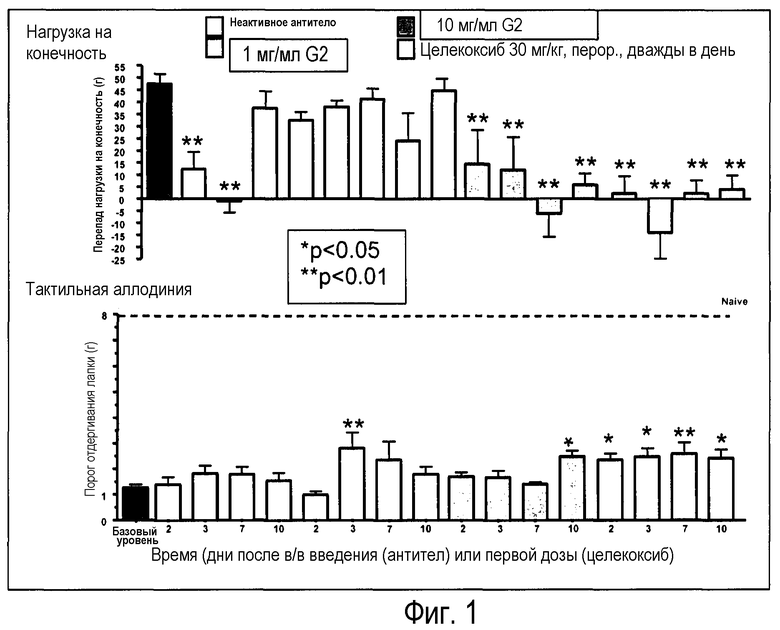
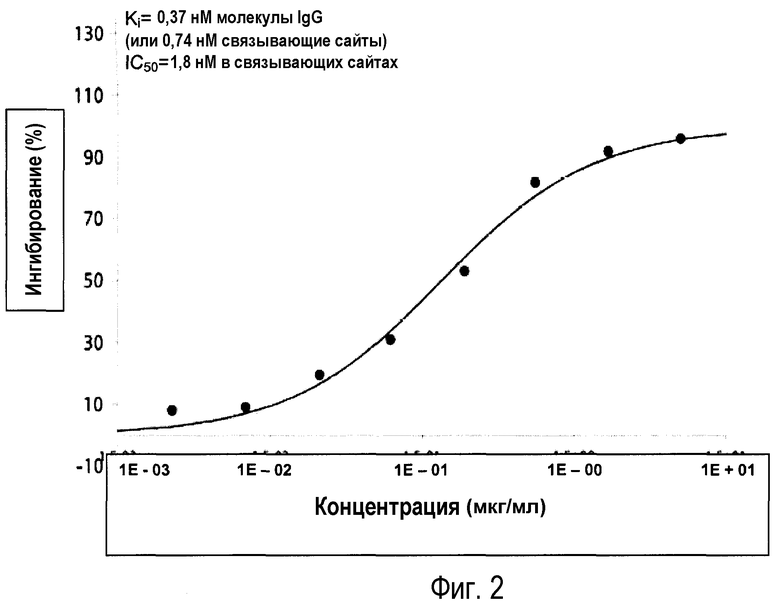
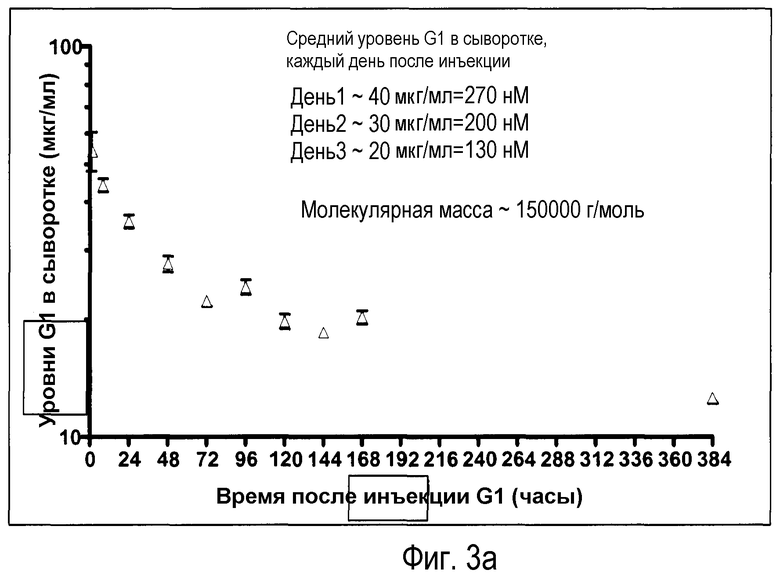
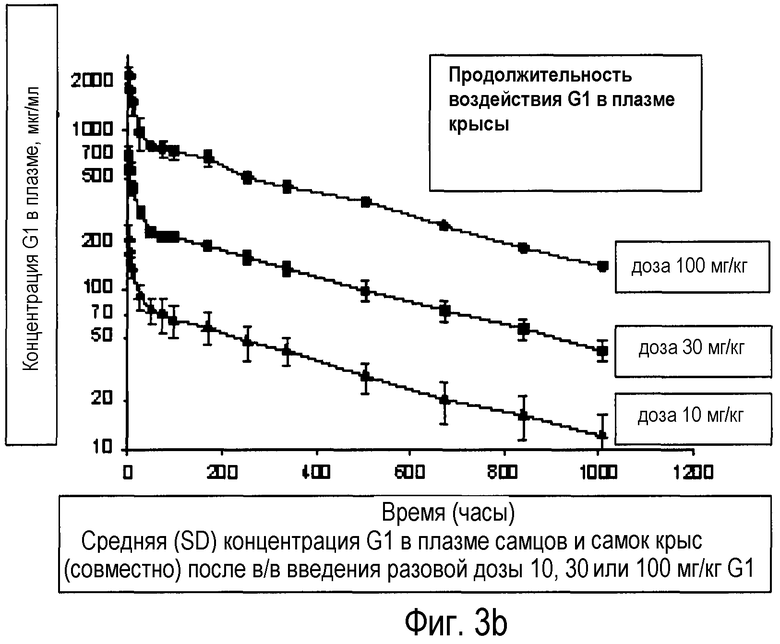
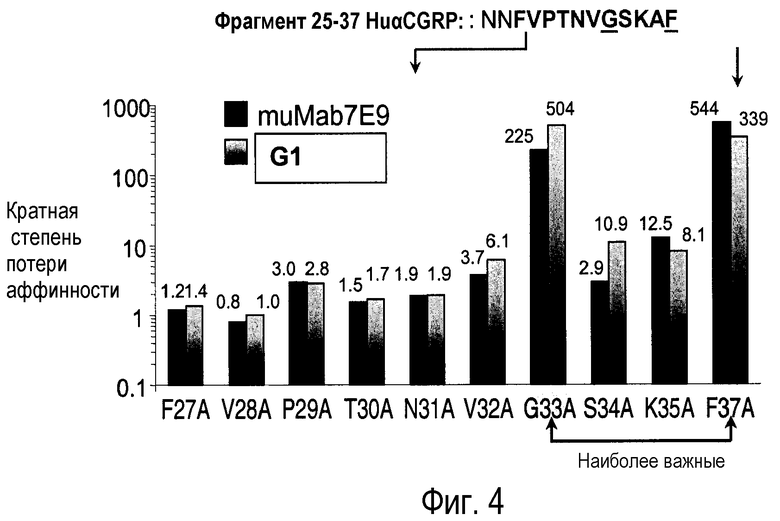
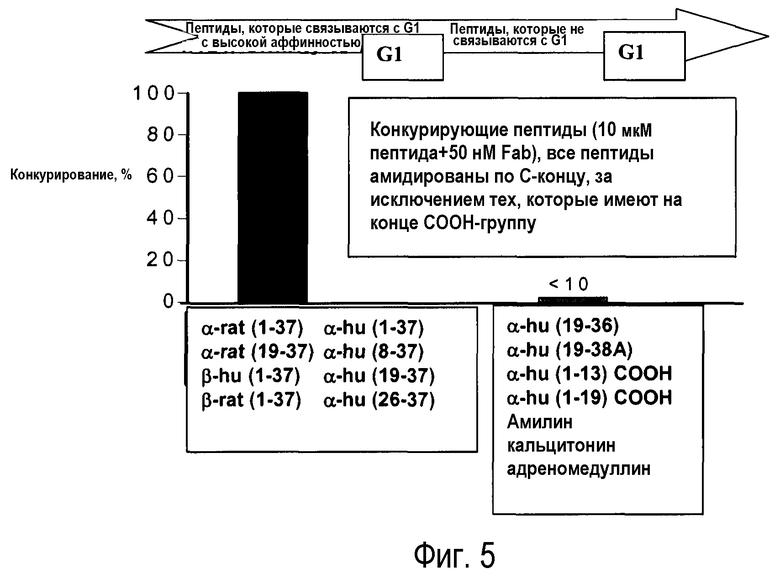

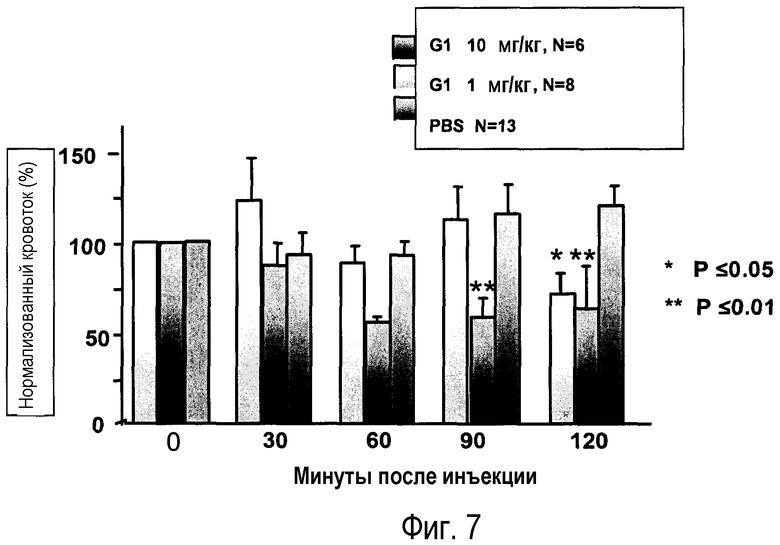
Группа изобретений относится к медицине и касается использования антитела-антагониста CGRP для профилактики и лечения воспалительной боли. Предложено применение антитела-антагониста CGRP для получения лекарственного средства для периферического введения для профилактики и/или лечения боли при артрите и способ лечения и/или профилактики боли при артрите, включающий периферическое введение индивиду терапевтически эффективного количества антитела-антагониста CGRP. Также предложены фармацевтическая композиция для периферического введения для лечения и/или профилактики боли при артрите, содержащая антитело-антагонист CGRP и фармацевтически приемлемый носитель, и набор, включающий эту композицию и инструкцию по применению. Группа изобретений обеспечивает эффективное лечение боли при артрите антителом-антагонистом CGRP при периферическом введении, являющимся более удобным и безопасным способом введения лекарственных препаратов по сравнению с центральным введением. 4 н. и 25 з.п. ф-лы, 8 ил., 2 табл., 8 пр.
1. Применение антитела-антагониста CGRP для получения лекарственного средства для профилактики и/или лечения боли при артрите и/или симптомов боли при артрите, где лекарственное средство получают для периферического введения.
2. Применение по п.1, где лекарственное средство получают для перорального, сублингвального, ингаляционного, трансдермального, подкожного, внутривенного, внутриартериального, внутрисуставного, околосуставного, местного и/или внутримышечного введения.
3. Применение по п.2, где лекарственное средство получают для подкожного или внутривенного введения.
4. Применение по п.1, где антитело-антагонист CGRP при введении действует периферически.
5. Применение по п.1, где боль при артрите является болью при остеоартрите.
6. Применение по п.1, где антитело-антагонист CGRP:
(a) связывается с CGRP;
(b) блокирует связывание CGRP с его рецептором;
(c) блокирует или понижает активацию рецептора CGRP;
(d) ингибирует, блокирует, подавляет или снижает биологическую активность CGRP;
(e) повышает клиренс CGRP; и/или
(д) замедляет синтез, продукцию или секрецию CGRP.
7. Применение по п.1, где антитело-антагонист CGRP:
(i) является человеческим антителом,
(ii) является гуманизированным антителом,
(iii) является моноклональным антителом,
(iv) связывает CGRP с Kd 50 нМ или меньшей (согласно измерению с помощью поверхностного плазменного резонанса при 37°С); и/или
(v) имеет время полужизни in vivo, составляющее, по меньшей мере, 7 дней.
8. Применение по п.1, где антитело-антагонист CGRP специфично связывается с С-концевой областью CGRP.
9. Применение по п.7, где антитело-антагонист CGRP специфично распознает эпитоп, определенный последовательностью GSKAF.
10. Применение по п.1, где антитело к CGRP содержит домен VH, который по аминокислотной последовательности, по меньшей мере, на 90% идентичен SEQ ID NO:1 или 19.
11. Применение по п.1, где антитело к CGRP содержит домен VL, который по аминокислотной последовательности, по меньшей мере, на 90% идентичен SEQ ID NO:2 или 20.
12. Применение по п.11, где антитело к CGRP дополнительно содержит домен VH, который по аминокислотной последовательности, по меньшей мере, на 90% идентичен SEQ ID NO:1 или 19.
13. Применение по п.1, где антитело к CGRP содержит, по меньшей мере, одну CDR, выбранную из группы, состоящей из:
(a) CDR HI, приведенной в SEQ ID NO:3 или 21;
(b) CDR H2, приведенной в SEQ ID NO:4 или 22;
(c) CDR Н3, приведенной в SEQ ID NO:5 или 23;
(d) CDR L1, приведенной в SEQ ID NO:6 или 24;
(e) CDR L2, приведенной в SEQ ID NO:7 или 25;
(f) CDR L3, приведенной в SEQ ID NO:8 или 26; и
(g) вариантов LI, L2 и H2.
14. Применение по п.1, где антитело к CGRP включает домен VH, который по аминокислотной последовательности, по меньшей мере, на 90% идентичен SEQ ID NO:1, и домен VL, который по аминокислотной последовательности, по меньшей мере, на 90% идентичен SEQ ID NO:2.
15. Применение по п.1, где антитело к CGRP содержит тяжелую цепь, полученную с применением вектора экспрессии с регистрационным номером АТСС РТА-6867.
16. Применение по п.1, где антитело к CGRP содержит легкую цепь, полученную с применением вектора экспрессии с регистрационным номером АТСС РТА-6866.
17. Применение по п.1, где антитело к CGRP получено с применением векторов экспрессии с регистрационными номерами АТСС РТА-6867 и РТА-6866.
18. Применение по п.1, где лекарственное средство получают для периферического введения с концентрацией антитела в диапазоне 5-100 мг/мл.
19. Применение по п.1, где лекарственное средство получают для периферического введения с концентрацией антитела в диапазоне 1-100 мг/кг массы тела.
20. Применение по п.1, где лекарственное средство не вызывает повреждения ЦНС, или моторной координации, или внимания.
21. Применение по п.1, где антитело-антагонист CGRP не является молекулой, проникающей центрально, спинально или интратекально.
22. Способ лечения и/или профилактики боли при артрите и/или симптомов боли при артрите у индивида, включающий периферическое введение индивиду терапевтически эффективного количества антитела-антагониста CGRP.
23. Способ по п.22, где лекарственное средство вводят периферически.
24. Способ по п.22, где лекарственное средство получают для периферического введения подкожной или внутривенной инъекцией один, два, три или четыре раза в месяц.
25. Способ по п.22, где антитело-антагонист CGRP не вводят центрально, спинально или интратекально.
26. Способ по п.22, где антитело к CGRP вводят отдельно, последовательно или одновременно в сочетании с одним или более другими фармакологически активными соединениями.
27. Способ по п.26, где одно или более других фармакологически активных соединений выбраны из:
(i) опиоидного анальгетика, например морфина, героина, гидроморфона, оксиморфона, леворфанола, леваллорфана, метадона, меперидина, фентанила, кокаина, кодеина, дигидрокодеина, оксикодона, гидрокодона, пропоксифена, налмефена, налорфина, налоксона, налтрексона, бупренорфина, буторфанола, налбуфина или пентазоцина;
(ii) нестероидного противовоспалительного средства (НПВС), например аспирина, диклофенака, дифлусинала, этодолака, фенбуфена, фенопрофена, флуфенисала, флурбипрофена, ибупрофена, индометацина, кетопрофена, кеторолака, меклофенамовой кислоты, мефенамовой кислоты, набуметона, напроксена, оксапрозина, фенилбутазона, пироксикама, сулиндака, толметина или зомепирака или их фармацевтически приемлемой соли;
(iii) седативного средства из группы барбитуратов, например амобарбитала, апробарбитала, бутабарбитала, буталбитала, мефобарбитала, метарбитала, метогекситала, пентобарбитала, фенобарбитала, секобарбитала, талбутала, тиамилала или тиопентала или их фармацевтически приемлемой соли;
(iv) бензодиазепина, обладающего седативным действием, например хлордиазепоксида, клоразепата, диазепама, флуразепама, лоразепама, оксазепама, темазепама или триазолама или их фармацевтически приемлемой соли,
(v) антагониста H1, обладающего седативным действием, например дифенилгидрамина, пириламина, прометазина, хлорфенирамина или хлорциклизина или их фармацевтически приемлемой соли;
(vi) седативного средства, такого как глутетимид, мепробамат, метаквалон или дихлоралфеназон или их фармацевтически приемлемая соль;
(vii) миорелаксанта, например баклофена, каризопродола, хлорзоксазона, циклобензаприна, метокарбамола или орфренадрина или их фармацевтически приемлемой соли,
(viii) антагониста рецептора NMDA, например декстрометорфана ((+)-3-гидрокси-N-метилморфинана) или его метаболита декстрорфана ((+)-3-гидрокси-N-метилморфинана), кетамина, мемантина, пирролохинолин-хинона или цис-4-(фосфонометил)-2-пиперидинкарбоновой кислоты или их фармацевтически приемлемой соли;
(ix) альфа-адренергического средства, например доксазозина, тамсулозина, клонидина или 4-амино-6,7-диметокси-2-(5-метансульфонамидо-1,2,3,4-тетрагидроизохинол-2-ил)-5-(2-пиридил)хиназолина;
(х) трициклического антидепрессанта, например дезипрамина, имипрамина, амитриптилина или нортриптилина;
(xi) противосудорожного средства, например карбамазепина или вальпроата;
(xii) антагониста тахикининов (NK), в частности антагониста рецепторов NK-3, NK-2 или NK-1, например (αR,9R)-7-[3,5-бис(трифторметил)бензил]-8,9,10,11-тетрагидро-9-метил-5-(4-метилфенил)-7Н-[1,4]диазоцино[2,1-д] [1,7]нафтиридин-6-13-диона (ТАК-63 7), 5-[[(2R,3S)-2-[(1R)-1-[3,5-бис(трифторметил)фенил]этокси-3-(4-фторфенил)-4-морфолинил]метил]-1,2-дигидро-3Н-1,2,4-тиазол-3-она (МК-869), ланепитанта, дапитанта или 3-[[2-метокси-Б-(трифторметокси)-фенил]метиламине]-2-фенил-пиперидина (2S,3S);
(xiii) антагониста мускариновых рецепторов, например оксибутина, толтеродина, пропиверина, тропсия хлорида или дарифенацина;
(xiv) ингибитора СОХ-2, например целекоксиба, рофекоксиба или валдекоксиба;
(xv) неселективного ингибитора СОХ (предпочтительно с защитой ЖКТ), например нитрофлурбипрофена (НСТ-1026);
(xvi) анальгетика, полученного из каменноугольной смолы, в частности парацетамола;
(xvii) нейролептика, такого как дроперидол;
(xviii) агониста ваниллойдных рецепторов (например, резинфератоксина) или антагониста (например, капсазепина);
(xix) бета-адренергического средства, такого как пропранолол;
(хх) местного анестетика, такого как мексилетин;
(xxi) кортикостероида, такого как дексаметазон;
(xxii) агониста или антагониста серотониновых рецепторов;
(xxiii) холинергического (никотинового) анальгетика;
(xxiv) Трамадола (торговая марка);
(xxv) ингибитора PDEV, такого как силденафил, варденафил или таладафил;
(xxvi) альфа-2-дельта лиганда, такого как габапентин или прегабалин; и
(xxvii) каннабиноида.
28. Фармацевтическая композиция для лечения и/или профилактики боли при артрите и/или симптомов боли при артрите у индивида, содержащая антитело-антагонист CGRP и фармацевтически приемлемый носитель, где композиция получена для периферического введения.
29. Набор, включающий:
(a) фармацевтическую композицию по п.28, и
(b) инструкции для периферического введения терапевтически эффективного количества указанной фармацевтической композиции индивиду в целях лечения и/или профилактики боли при артрите и/или симптомов боли при артрите.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| KURAISHI Y | |||
| et al | |||
| Antinociception induced in rats by intrathecal administration of antiserum against calcitonin gene-related peptide | |||
| Neurosci Lett | |||
| Механическая топочная решетка с наклонными частью подвижными, частью неподвижными колосниковыми элементами | 1917 |
|
SU1988A1 |
| ELSHOURBAGY N.A | |||
| et al | |||
| Molecular Cloning and Characterization of the Porcine Calcitonin Gene-Related Peptide | |||
Авторы
Даты
2012-11-27—Публикация
2009-03-03—Подача