Изобретение относится к биотехнологии и может быть использована в медицине, ветеринарии, клинической лабораторной диагностике для выявления ДНК бактерии Coxiella burnetii в пробах, а также для решения научно-исследовательских задач по изучению данного микроорганизма.
Известны различные диагностические наборы для выявления С.burnetii с помощью ПЦР в реальном времени, в качестве мишени для праймеров и зонда используются различные гены:
1) ген com 1 (Brennan R., Samuel J., 2003), используются праймеры следующих последовательностей: FAF216 5′ GCACTATTTTTAGCCGGAACCTT 3′ и RAF290 5′ TTGAGGAGAAAAACTGGATTGAGA 3′, амплифицирующие фрагмент 74-п.н. Недостатком использования данного набора праймеров является их применимость только в технологии РВ-ПЦР, использующей интеркалирующие красители. Этот метод обладает пониженной специфичностью по сравнению с технологией с использованием флуоресцентного зонда, а также усложняет детекцию ДНК С.burnetii из-за необходимости постамплификационных манипуляций: построения кривой плавления продукта РВ-ПЦР или его визуализации с помощью электрофореза в агарозном геле. Кроме того, авторы указывают лишь косвенные показатели чувствительности и специфичности для описываемого набора праймеров и зонда. При этом тестирование набора показало, что максимальная чувствительность РВ-ПЦР с его использованием: составляет 500-1000 ГЭ/мл раствора ДНК.
2) ген транспозазы инсерционного мобильного элемента IS1111 (Klee S. et al., 2006, Panning М. et al., 2008, Tissot-Dupont H., Raoult D., 2008), набор праймеров и зонда к этому гену амплифицирует фрагмент 295 п.н., последовательности праймеров: Cox-F 5′ GTCTTAAGGTGGGCTGCGTG 3′ (219-238) и Cox-R 5′ CCCCGAATCTCATTGATCAGC 3′ (493-513), а зонда - Сох-ТМ FAM-5′ AGCGAACCATTGGTATCGGACGTT-TAMRA-TATGG 3′ (259-287). Недостатком набора является многокопийность гена-мишени: поскольку количество копий в зависимости от изолята может варьировать существенным образом (до 10-кратных различий), это препятствует количественному измерению накопления С.burnetii.
3) ген изоцитрат-дегидрогеназы icd (Klee S. et al., 2006), мишенью является участок длиной 76 п.н., а праймеры имеют следующую последовательность: icd-439F 5′ CGTTATTTTACGGGTGTGCCA 3′ (439-459) и icd-514R 5′ CAGAATTTTCGCGGAAAATCA 3′ (494-514), а зонд - FAM-5′ ССС GGT САА ААС GCC TGA AAA GGT GAA ТА 3′ - TAMRA.
Недостатками набора является обеспечение чувствительности ПЦР-РВ, не позволяющей обеспечить потребности РВ-ПЦР при работе с биологическим материалом со слабым накоплением С.burnetii, т.к. позволяет выявлять в пробе 10 геномных эквивалентов и выше.
Таким образом, применение указанных нуклеотидных последовательностей в качестве мишеней для амплификации не обеспечивает одновременно достаточных специфичности и чувствительности при детекции в биологическом материале с малым накоплением возбудителя, что является существенным недостатком диагностического набора, либо не позволяет проводить количественную оценку содержания ДНК С.burnetii.
Заявляемое изобретение отвечает требованиям количественного измерения числа копий целевой ДНК в образце, при высокой чувствительности РВ-ПЦР, основанной на амплификации гена с известным числом копий. Ранее применявшиеся мишени не могли обеспечить и подобных результатов.
В качестве прототипа выбран набор набор праймеров и зонда icd (Klee S. et al., 2006), мишенью которого является участок длиной 76 п.н. гена изоцитрат-дегидрогеназы, имеющие следующую последовательность: icd-439F 5′ CGTTATTTTACGGGTGTGCCA 3′ (439-459) и icd-514R 5′ CAGAATTTTCGCGGAAAATCA 3′ (494-514) и зонд: FAM-5′ ССС GGT САА AAC GCC TGA AAA GGT GAA ТА 3′ - TAMRA.
Ген icd, являясь hause-keeping-геном, обладает высокой консервативностью, что подтверждено, в частности, секвенированием этого гена для многочисленных штаммов С.burnetii, а также сравнительным анализом нуклеотидных последовательностей гена icd С.burnetii с последовательностями, имеющимися в GenBank: идентичность нуклеотидной последовательности гена icd в пределах вида С.burnetii составляет 99-100%. Высокая степень специфичности подтверждена показателем сходства icd С.burnetii с нуклеотидными последовательностями организмов других видов: показатель сходства не превышал 87%.
Условия реакции: первый цикл: 80° - 2 мин; 95° - 4 мин; последующие 40 циклов: 95° - 15 с; 60° - 40 с.
Оптимальный состав реакционной смеси, на 1 пробу общим объемом 25 мкл: 2,5 мМ каждого дНТФ; 10х ПЦР буфер; 25 мМ MgCl2; праймеры, по 300 нМ каждого, 25U Tag ДНК-полимеразы с ингибирующими активность фермента антителами; деионизированная вода, 100 нМ зонда, меченного флуоресцеином.
При этих условиях реакции получены результаты, которые продемонстрировали недостаточное соответствие данного набора праймеров и зонда требованиям специфичности и чувствительности (более 1000 ГЭ/мл раствора ДНК) при работе с полевым (органы животных) материалом.
Таким образом, никакие из существующих праймеров для детекции С.burnetii не отвечают потребностям молекулярной диагностики патогена, так как не позволяют выявлять ДНК возбудителя в образцах с малым содержанием бактерий С.burnetii.
Изобретение направлено на усовершенствование диагностического набора для выявления коксиелл Бернета путем разработки новых синтетических праймеров и зонда.
При этом обеспечен технический результат - повышение специфичности и чувствительности (с возможностью детекции менее 10 ГЭ целевой ДНК/мл раствора ДНК) ПЦР-РВ.
При выборе оптимальных ДНК-мишеней учитывались специфические особенности генома С.burnetii, а также степень изученности различных участков генома и наличие в базе данных GenBank необходимого количества депонированных нуклеотидных последовательностей. Основными показателями последовательностей-мишеней рассматриваемых генов были: видовая специфичность, внутривидовой консерватизм, количество копий в геноме.
Авторами предложены оригинальные последовательности синтетических олигонуклеотидов:
GroEL F 5′ CTTCTACTGTTATGACGCCTTCTTTGC 3′
GroEL R 5′ CGCAAGTAGGCACCATTTCTGC 3′,
и флуоресцентного зонда -
GroEL Probe 5′ FAM-CACTTTCTCCATCGCTTCCGCAATAATA-TAMRA 3′.
Характеристика набора праймеров и зонда и участка амплифицируемой геномной ДНК
Продукт гена groEL - белок-шаперонин Hsp60 относится к классу функционально сходных белков, экспрессия которых усиливается при повышении температуры или при других стрессирующих клетку условиях. Повышение экспрессии гена groEL регулируется на этапе транскрипции. Чрезвычайное усиление экспрессии гена groEL является частью клеточного ответа на тепловой шок и вызывается в основном фактором теплового шока.
Кроме того, Hsp60 играет важную роль в метаболизме и жизнеобеспечении бактерии, что связано, прежде всего, с его участием в составе шаперониновой системы GroEL/GroES в фолдинге белков в цитозоле бактерий (Takemoto К., Niwa Т., et al., 2011).
Кодируемый геном groEL белок-шаперонин Hsp60 является специфическим лигандом толл-подобных рецепторов (TLRs) млекопитающих, которые являются представителями рецепторов для детекции консервативных молекулярных паттернов, ассоциированных с патогенами (PAMPs). Таким образом, бактериальные белки теплового шока являются мощными модуляторами механизмов врожденного и приобретенного иммунитета к инфекционным агентам, включая бактерию С.burnetii (Lundberg A.M., Hansson G.K., 2010).
Описан положительный опыт использования гена groEL в диагностических целях с использованием его в качестве мишени для амплификации в стандартной ПЦР (Yuasa Y., Yoshiie К., et al., 1996; Фрейлихман О.А., Панферова Ю.А., Токаревым Н.К., 2009).
Ген groEL описан как мишень для генотипической характеристики изолятов и штаммов гамма-протеобактерий (Chomel В.В., Wey AC, et al., 2003).
Видовая специфичность и внутривидовая консервативность этого гена делает его эффективной мишенью не только для диагностики, но и для дифференциации бактериальных видов (Leclerque A., Kleespies R.G., 2008).
Высокая степень консервативности гена подтверждена сравнением опубликованных в настоящее время секвенсов groEL С.burnetii с нуклеотидными последовательностями других организмов (база данных BLASTA): число совпадений не превышало 83%; идентичность нуклеотидной последовательности гена groEL (htpAB) в пределах вида С.burnetii составляет 99-100%.
Для оценки специфичности и чувствительности праймеров использовались следующие образцы ДНК С.burnetii из коллекции штаммов НИИЭМ им. Пастера:
- Монголия (штамм №103 коллекции музея риккетсиозных культур НИИЭМ им. Гамалеи АМН СССР);
- Уфа-1 (Glazunova О, Roux V, et al. // Emerg. Infect. Dis. 2005 Aug; 11(8):1211-7);
- Cimex-1 - Луга (Glazunova O, Roux V, et al. // Emerg Infect Dis. 2005 Aug; 11(8):1211-7);
- Желтогорлая Мышь - Луга (E. Kovacova, M. Vavrekova, et al. // Eur. Journ. of Epidemiol. 10:9-15, 1994);
- Полевка обыкновенная - Невель (Glazunova О, Roux V, et al. // Emerg Infect Dis. 2005 Aug; 11(8):1211-7);
- Henzerling (Glazunova O, Roux V, et al. // Emerg Infect Dis. 2005 Aug; 11(8):1211-7);
- Ixodes-3 - Луга (E. Kovacova, M. Vavrekova, et al. // Eur. Journ. of Epidemiol. 10:9-15, 1994);
- Уфа-2 (Glazunova O, Roux V, et al. // Emerg Infect Dis. 2005 Aug; 11(8):1211-7);
- Полевая Мышь - Луга (Glazunova О, Roux V, et al. // Emerg Infect Dis. 2005 Aug; 11(8):1211-7);
- Казахстан-Слепни (Glazunova O, Roux V, et al. // Emerg Infect Dis. 2005 Aug; 11(8):1211-7);
- Ixodes-2 - Луга (Glazunova О, Roux V, et al. // Emerg Infect Dis. 2005 Aug; 11(8):1211-7);
- Вакцинный штамм M-44.
Оценка специфичности праймеров производилась с использованием следующих образцов тотальной ДНК:
- ДНК из органов (почки, печень, селезенка) мелких диких млекопитающих, отловленных в пригородах Санкт-Петербурга для исследования на инфицированность возбудителем Ку-лихорадки;
- ДНК из крови людей с лихорадкой неясного генеза;
- ДНК из крови морской свинки, которой была введена кровь больного лихорадкой неясного генеза;
- ДНК из крови интактных морских свинок;
- ДНК распространенных патогенов (Leptospira sp., Mycoplasma sp., Gardnerella sp., Ureaplasma sp.).
Чувствительность праймеров оценивалась в разведениях от 1:10 до 1:109 ДНК С.burnetii штаммов М-44 и Henzerling.
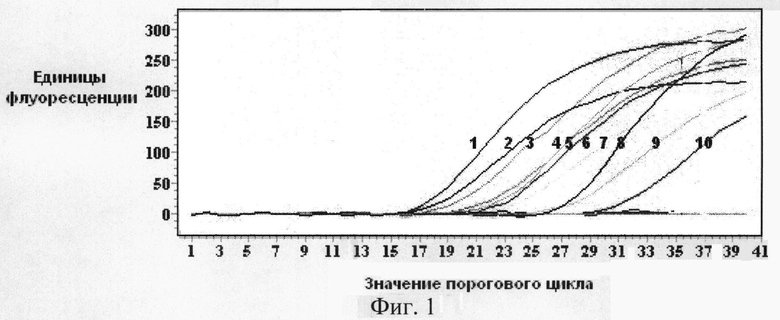
Сущность изобретения подтверждается чертежами, где на фигуре 1 представлены кривые флуоресценции, отражающие динамику образования продукта реакции в ходе ПЦР-РВ по технологии TaqMan с праймерами groEL для проб, содержащих ДНК С.burnetii. Номера кривых флуоресценции соответствуют номерам образцов.
Изобретение реализуется следующим образом.
Пример 1. Разработка специфических праймеров и зонда
Праймеры и зонд разрабатывали с помощью программ Epimer, Primer3, Vector NTI 8 на основе данных о полногеномной нуклеотидной последовательности хромосомной ДНК штаммов Nine RSA493 (АСС NC 002971); RSA 331 (АСС NC 010117) и нуклеотидной последовательности гена groEL (АСС AF146284) в соответствии со следующими основными требованиями: не проявляет случайную гомологию с неродственными нуклеотидными последовательностями; для зонда - не превышает по длине 29 нуклеотидов, характеризуется G/C-насыщенностью от 20 до 80% и расчетной температурой плавления (Tm) 68-70°C; отличается высоким содержанием C и отсутствием 5′-концевых G-нуклеотидов; не содержит поли- G/C повторов и участков формирующих нежелательные вторичные структуры.
Параметры праймеров соответствовали следующим требованиям: размер продукта ПЦР должен составлять около 50 п.н., температура плавления 58-60°C, длина праймера: 20-30 п.н., GC состав: 20-80%, минимальное образование вторичных структур и димеров, также нежелательны G/C на 3′ конце праймеров (не более трех из пяти последних нуклеотидов). Праймеры и зонд изготовлены ЗАО «Синтол» (Москва).
Для целей амплификации была отобрана пара праймеров, ограничивающая фрагмент гена groEL (табл.1, рис.1). Ген имеет длину 1561 п.н., фрагмент длиной 99 п.н. занимает позицию на гене с 1127 п.н. по 1226 п.н.
Ниже представлена нуклеотидная последовательность гена groEL штамма Q212 (АСС NC 011527) С.burnetii, амплифицируемая заявленным набором олигонуклеотидных праймеров и зонда.
1127 cttct actgttatga cgccttcttt gcccactttc tccatcgctt ccgcaataat atctccaatc gacttatccg aattcgcaga aatggtgcct acttgcg 1226
Пример 2. Проведение РВ-ПЦР
Для проведения ПНР в реальном времени использовался набор реагентов «Комплект реагентов для проведения ПЦР-РВ» производства ОАО «Синтол» (Москва). ПЦР проводились на приборе для ПЦР в реальном времени ДТ-322 «ДНК-технология» (Москва).
Условия ПЦР-РВ: программа амплификации: один цикл 95°C - 10 мин, далее - 35 циклов, включающих этапы 95°C - 15 с, 60°C - 1 мин.
Состав реакционной смеси (из расчета на одну пробу общим объемом 25 мкл): дНТФ (2,5 мМ) - 2,5 мкл; 10х реакционный буфер - 2,5 мкл; MgCl2 (25 мМ) - 2,5; праймеры (10 пМ) - 0,7 мкл каждого; флуоресцентный зонд (10 пМ) - 1 мкл; Tag-полимераза (5 Е/мкл) - 0,4 мкл, стерильная деионизированная вода - 11,7. ДНК (10 нг/мкл) - 4 мкл.
Использованная технология ПЦР-РВ: TaqMan, метод - абсолютное околичествление (с построением стандартной кривой).
Результаты оценивались путем сопоставления значений цикла начала флуоресценции (Ct) для контрольных и исследуемых образцов при условии эффективности амплификации 95-100% и путем анализа стандартной кривой.
При указанных параметрах амплификации и составе реакционной смеси получены числовые значения, представленные в таблице 2. Эти значения характеризуют минимальные циклы, на которых регистрируется начало флуоресценции и абсолютные количественные показатели содержания целевой ДНК.
При анализе результатов расчет базовой линии производился по среднему значению в диапазоне циклов с 3 по 7 (первые 2 цикла не включали в диапазон, поскольку на них может наблюдаться более сильная флуоресценция из-за недостаточно стабилизировавшейся реакции).
При этих условиях реакции получены следующие результаты, характеризующие минимальные циклы, на которых регистрируется начало флуоресценции, и абсолютные количественные показатели содержания ГЭ целевой ДНК (таблица 2).
Как видно из таблицы 2, наблюдалась обратная зависимость значения цикла пороговой флуоресценции от количества целевой ДНК в пробе. Так, наименьшее значение циклов соответствовало максимальной концентрации субстрата. В образцах, не содержащих ДНК С.burnetii, репортерная флуоресценция отсутствовала.
В качестве стандарта для определения абсолютного количества ГЭ использовался образец с содержанием 105 ГЭ ДНК С.burnetii.
Анализ показал высокую специфичность и чувствительность ПЦР-РВ с использованием сконструированного набора праймеров и зонда, что позволяет выявлять 10 и менее ГЭ С.burnetii в пробе, в отличие от прототипа, для которого абсолютная чувствительность не определена.
В отличие от прототипа, чувствительность и специфичность созданного набора апробирована на широкой панели биологических образцов и группе штаммов С.burnetii, представляющих большой набор источников и географических точек выделения.
Разработанный универсальный набор праймеров и зонда и адаптированные для его использования условия ПЦР-РВ позволяет повысить эффективность и точность идентификации возбудителя лихорадки Ку путем индикации генетического материала С.burnetii в пробах биологического происхождения методом РВ-ПЦР.
Перечень последовательностей
синтетические олигонуклеотиды
GroEL F 5′ CTTCTACTGTTATGACGCCTTCTTTGC 3′
GroEL R 5′ CGCAAGTAGGCACCATTTCTGC 3′,
флуоресцентный зонд
GroEL Probe 5′ FAM-CACTTTCTCCATCGCTTCCGCAATAATA-TAMRA 3′.
| название | год | авторы | номер документа |
|---|---|---|---|
| Набор для выявления возбудителя лептоспироза в биологическом материале методом полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) | 2019 |
|
RU2744186C1 |
| Способ выявления ДНК вируса гепатита В в биологическом материале при низкой вирусной нагрузке на основе двухэтапной ПЦР с детекцией по трем мишеням в режиме реального времени | 2020 |
|
RU2763173C1 |
| Способ детекции филогенетических сублиний генотипа Beijing Mycobacterium tuberculosis в формате реального времени | 2020 |
|
RU2743365C1 |
| Система олигонуклеотидных праймеров и зонда для выявления ДНК Mycoplasma bovis | 2019 |
|
RU2740808C1 |
| Система олигонуклеотидных праймеров и зонда для выявления ДНК Mycoplasma bovigenitalium | 2019 |
|
RU2732626C1 |
| Способ идентификации вариантов А и В вируса герпеса человека 6-го типа | 2016 |
|
RU2627607C1 |
| Способ детекции и генотипирования патогенных лептоспир в клинических образцах | 2024 |
|
RU2840144C1 |
| Способ детекции генотипа Mycobacterium tuberculosis Beijing 14717-15-кластер методом полимеразной цепной реакции в формате реального времени | 2023 |
|
RU2839699C2 |
| НАБОР ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ФЛУОРЕСЦЕНТНО-МЕЧЕНОГО ЗОНДА ДЛЯ ИДЕНТИФИКАЦИИ ВОЗБУДИТЕЛЯ БЛАСТОМИКОЗА BLASTOMYCES DERMATITIDIS | 2016 |
|
RU2639498C1 |
| Способ выявления наличия мутаций, приводящих к резистентности у Mycoplasma genitalium к макролидным и фторхинолоновым антибиотикам | 2019 |
|
RU2725477C1 |
Изобретение относится к области биотехнологии и касается набора для выявления Ку-лихорадки методом ПЦР-РВ. Охарактеризованный набор содержит синтетические олигонуклеотиды, ограничивающие фрагмент гена groEL:
GroEL F 5′ CTTCTACTGTTATGACGCCTTCTTTGC 3′
GroEL R 5′ CGCAAGTAGGCACCATTTCTGC 3′,
и флуоресцентный зонд:
GroEL Probe 5′ FAM-CACTTTCTCCATCGCTTCCGCAATAATA-TAMRA 3′.
Изобретение может быть использовано в медицине, ветеринарии, клинической лабораторной диагностике для выявления ДНК бактерии Coxiella burnetii в пробах, а также для решения научно-исследовательских задач по изучению данного микроорганизма. 2 табл., 2 пр.
Набор для выявления возбудителя Ку-лихорадки в биологическом материале методом полимеразной цепной реакции в режиме реального времени (ПЦР-РВ), содержащий синтетические олигонуклеотиды, ограничивающие фрагмент гена groEL, и олигонуклеотид, меченный флуоресцентной меткой (флуоресцентный зонд), отличающийся тем, что синтетические олигонуклеотиды имеют следующую структуру:
GroEL F 5′ CTTCTACTGTTATGACGCCTTCTTTGC 3′
GroEL R 5′ CGCAAGTAGGCACCATTTCTGC 3′,
а флуоресцентный зонд -
GroEL Probe 5′ FAM-CACTTTCTCCATCGCTTCCGCAATAATA-TAMRA 3′
| И.С | |||
| Тартаковский, Современные подходы к диагностике атипичных пневмоний, Клиническая микробиология и антимикробная химиотерапия, 2000, N1, Том 2, стр.60-68 | |||
| JP 2004283153 A, 14.10.2004 | |||
| US 0007252937 B2, 07.08.2007 |
Авторы
Даты
2014-08-10—Публикация
2012-07-19—Подача