Область техники
Изобретение относится к медицине и биологии, а именно, к диагностике инфекций, передающихся половым путем, и, более конкретно, к ДНК-анализу полученного у пациентов клинического (биологического) материала, содержащего Mycoplasma genitalium, и может быть использовано для выявления в полученном у пациентов клиническом (биологическом) материале, содержащем указанные микоплазмы, наличия у указанных микоплазм мутаций, ассоциированных с резистентностью к макролидным и к фторхинолоновым антибиотикам.
Уровень техники
Инфекции урогенитального тракта - одна из серьезных проблем современного здравоохранения, создающая угрозу репродуктивному здоровью населения. Большое значение среди инфекций урогенитального тракта имеет Mycoplasma genitalium, далее также указываемая как M. genitalium (Dupin N., Bijaoui G., Schwarzinger M. et al. Detection and quantification of Mycoplasma genitalium in male patients with urethritis. - Clin. Infect Dis. 2003; 37: 602 - 605; Horner P., Thomas B., Gilroy C.B. et al. Role of Mycoplasma genitalium and Ureaplasma urealyticum in acute and chronic nongonococcal urethritis. - Clin. Infect Dis. 2001; 32: 995 - 1003; Taylor-Robinson D., Gilroy C.B., Thomas B.J. et al. Mycoplasma genitalium in chronic non-gonococcal urethritis. - Int J STD AIDS 2004; 15: 21 - 25). Как и другие представители рода Mycoplasma (далее также указываются как микоплазмы), M. genitalium относятся к классу Молликуты (Mollicutes) - специализированной ветви микроорганизмов, родственной грамм-положительным бактериям. M. genitalium относится к инфекциям, передающимся половым путем (далее - ИППП), и является поверхностным паразитом слизистых оболочек, в основном поражая эпителий урогенитального тракта (Taylor S. N. Mycoplasma genitalium. - Curr Infect Dis Rep. 2005; 7 (6): 453-457). Далее в настоящем описании, если не оговорено особо, термин "микоплазмы" относится именно к M. genitalium. У мужчин инфекция M. genitalium зачастую вызывает уретриты, составляя примерно от 15% до 25% негонококковых уретритов, у женщин - уретриты и цервициты (Taylor-Robinson D., Jensen J.S. Mycoplasma genitalium: from chrysalis to multicolored butterfly. - Clin Microbiol Rev. 2011 Jul; 24(3):498-514). Кроме того, в литературе показано, что у женщин инфекция M. genitalium связана с повышенным риском воспалительных заболеваний органов малого таза (ВЗОМТ), преждевременными родами, самопроизвольным прерыванием беременности и трубным бесплодием (Lis R., Rowhani-Rahbar A., Manhart L.E. Mycoplasma genitalium infection and female reproductive tract disease: A meta-analysis. - Clin Infect Dis. 2015 Aug 1; 61(3):418-26).
Наиболее активными антибиотиками, подавляющими рост микоплазм, являются макролидные антибиотики (далее также указываются как макролиды), включая, без ограничения, кларитромицин, рокситромицин, азитромицин, спирамицин, джозамицин, мидекамицин и мидекамицина ацетат, и фторхинолоновые антибиотики (далее также указываются как фторхинолоны), включая, без ограничения, ломефлоксацин, норфлоксацин, офлоксацин, пефлоксацин, гатифлоксацин, гемифлоксацин и ципрофлоксацин, спарфлоксацин, левофлоксацин и моксифлоксацин (Deguchi T., Yasuda M., Maeda S. Non-chlamydial non-gonococcal urethritis. - Nippon Rinsho 2009; 67(1): 167 - 171 и Bébéar C., de Barbeyrac B., Dewilde A. et al. Multicenter study of the in vitro sensitivity of genital mycoplasma to antibiotics. - Pathol Biol (Paris) 1993; 41(4): 289 - 293). Было показано, что чувствительность различных штаммов M. genitalium к макролидным и фторхинолоновым антибиотикам неодинакова, вследствие чего такое лечение у определенной части пациентов терпит неудачу из-за развития у этих пациентов устойчивых к макролидным антибиотикам штаммов M. genitalium (Jernberg E., Moghaddam A., Moi H. Azithromycin and moxifloxacin for microbiological cure of Mycoplasma genitalium infection: an open study. - Int. J. STD AIDS 2008 Oct; 19(10): 676 -679; Bradshaw C.S., Chen M.Y., Fairley C.K. Persistence of Mycoplasma genitalium following azithromycin treatment. - PLoS One 3:e3618; Jensen J.S., Bradshaw C.S., Tabrizi S.N. et al. Azithromycin treatment failure in Mycoplasma genitalium-positive patients with nongonococcal urethritis is associated with induced macrolide resistance. - Clin Infect Dis. 2008; 47 (12): 1546 - 1553 (далее - Jensen J.S., Bradshaw C.S. et al., 2008); Bradshaw C.S., Jensen J.S. et al. Azithromycin failure in Mycoplasma genitalium urethritis. - Emerg Infect Dis. 2006 Jul; 12(7): 1149 - 1152; Bradshaw CS, Lim YM, Tabrizi SN, Twin J, Bush M, Garland SM, Fairley CK. The effectiveness of 1g of azithromycin for Mycoplasma genitalium infections: a five-year review. Paper no. 179. - Australasian Sexual Health Conference, 2010, Sydney, Australia).
Таким образом, выявление в полученном у пациентов клиническом (биологическом) материале, содержащем микоплазмы M. genitalium, наличия микоплазм, имеющих мутации, ассоциированные с резистентностью к макролидным и фторхинолоновым антибиотикам, является важной задачей, решение которой необходимо как для выбора или корректировки адекватной антибиотикотерапии инфекции, вызванной M. genitalium, так и для контроля эпидемиологического процесса. В качестве клинического (биологического) материала, в котором выявляют наличие M. genitalium и устанавливают наличие у M. genitalium мутаций, ассоциированных с резистентностью к макролидным и фторхинолоновым антибиотикам, предпочтительно, но без ограничения, используют: у женщин - мазок из влагалища, соскоб из уретры, цервикального канала или первую порцию свободно выпущенной мочи; у мужчин - соскоб из уретры, первую порцию свободно выпущенной мочи, секрет предстательной железы или эякулят; у детей и у женщин, не имеющих в анамнезе половых контактов с проникновением - отделяемое уретры, задней ямки преддверия влагалища или отделяемое влагалища; при осмотре девочек с использованием детских гинекологических кресел возможно также получение клинического материала, представляющего собой отделяемое цервикального канала. Предпочтительно, но без ограничения ими, в качестве клинического (биологического) материала используют: у мужчин - соскоб из уретры или мочу, у женщин - мазок из влагалища.
Резистентность M. genitalium к макролидным антибиотикам, как показано, обусловлена мутациями (нуклеотидными заменами) в позициях A2058 и A2059 в V регионе (V домене) гена 23S рРНК (рибосомной РНК) M. genitalium, включая мутации A2058G, A2059G и A2058C, а также более редко встречающиеся мутации A2062G, A2062T, A2058T и C2055G. Указанные мутации, далее вместе также называемые "мутации резистентности к макролидам", описаны в уровне техники в работах Jensen JS, Bradshaw CS, Tabrizi SN, Fairley CK, Hamasuna R. Azithromycin treatment failure in Mycoplasma genitalium-positive patients with nongonococcal urethritis is associated with induced macrolide resistance. - Clin. Infect. Dis. 2008; 47(12):1546 - 1553; Bissessor M, Tabrizi SN, Twin J, Abdo H, Fairley CK, Chen MY, Vodstrcil LA, Jensen JS, Hocking JS, Garland SM, Bradshaw CS. Macrolide resistance and azithromycin failure in a Mycoplasma genitalium-infected cohort and response of azithromycin failures to alternative antibiotic regimens. - Clin Infect Dis. 2015 Apr 15; 60(8):1228-36; Vester B., Douthwaite S. Macrolide resistance conferred by base substitutions in 23S rRNA. - Antimicrob. Agents Chemother. 2001; 45(1):1 - 12; Shipitsyna E., Rumyantseva T. et al. Prevalence of macrolide and fluoroquinolone resistance-mediating mutations in Mycoplasma genitalium in five cities in Russia and Estonia. - PLoS One. 2017 Apr 13; 12(4): e0175763). Показано, что в отдельных странах и регионах до 50% штаммов M. genitalium устойчивы к макролидным антибиотикам (Murray G.L., Bradshaw C.S. et al. Increasing Macrolide and Fluoroquinolone Resistance in Mycoplasma genitalium. - Emerg Infect Dis. 2017 May; 23(5): 809-812).
В свою очередь, резистентность M. genitalium к фторхинолоновым антибиотикам, применяемым для лечения устойчивых к макролидам микобактериальных инфекций, как показано, обусловлена мутациями в регионе (области) QRDR гена parC, определяющем устойчивость к хинолонам (Shimada Y., Deguchi T., Nakane K. et al. Emergence of clinical strains of Mycoplasma genitalium harbouring alterations in ParC associated with fluoroquinolone resistance. - Int J Antimicrob Agents 2010 Sep; 36(3): 255 - 258). Распространенность устойчивых к фторхинолоновым антибиотикам штаммов M. genitalium достаточно высока и в некоторых странах составляет до 47% (Kikuchi M, Ito S et al. Remarkable increase in fluoroquinolone-resistant Mycoplasma genitalium in Japan. - J Antimicrob Chemother. 2014 Sep; 69(9):2376-82), а у некоторой части пациентов, как показано, M. genitalium содержит мутации резистентности и к макролидным, и к фторхинолоновым антибиотикам (см. указанную выше работу Murray G.L., Bradshaw C.S. et al., 2017).
Среди наиболее важных мутаций, ассоциированных с резистентностью M. genitalium к фторхинолоновым антибиотикам, следует отметить мутации G248A, G259T, A260T, A290G и ряд других мутаций гена ParC (Allan Pillay. Overview of molecular diagnostics and antimicrobial resistance detection in STD pathogens. - Atlanta (USA), 20 - 23 September 2016, 2016 STD Prevention Conference).
Таким образом, задача своевременного и быстрого выявления в полученном у пациентов клиническом материале (далее также указывается как биологический материал), содержащем M. genitalium, наличия у M. genitalium мутаций, ассоциированных с резистентностью к макролидным и фторхинолоновым антибиотикам, является очень важной. В литературе неоднократно предпринимались попытки решения данной задачи методами полимеразной цепной реакции (ПЦР). В соответствии с действующими Федеральными клиническими рекомендациями по ведению больных урогенитальными заболеваниями, вызванными M. genitalium, подготовленными Рахматулиной М.Р., Соколовским Е.В. и соавторами (Российское общество дерматовенерологов и косметологов и Российское общество акушеров-гинекологов (ФГБУ "Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова" Министерства здравоохранения РФ (кафедра акушерства и гинекологии, кафедра неонатологии службы научно-организационного обеспечения), Российское общество акушеров-гинекологов, Российское общество неонатологов, Россия, Москва, 2015), единственно допустимыми методами для диагностики инфекции, вызванной M. genitalium, являются методы амплификации нуклеиновых кислот. Наиболее доступным и распространенным на территории РФ является методом амплификации нуклеиновых кислот для выявления M. genitalium является ПЦР в реальном времени (ПЦР-РВ).
Одна из попыток решения данной задачи с использованием ПЦР-РВ была предпринята в работе Hamasuna R., Osada Y., Jensen J.S. Antibiotic susceptibility testing of Mycoplasma genitalium by TaqMan 5’ nuclease real-time PCR. - Antimicrob Agents Chemother. 2005; 49: 4993 - 4998 (далее - Hamasuna R. et al., 2005). В работе Hamasuna R. et al., 2005 определяли чувствительность M. genitalium к различным антибиотикам, включая макролидные антибиотики (эритромицин, кларитромицин и азитромицин) и фторхинолоновые антибиотики (ципрофлоксацин, левофлоксацин и моксифлоксацин), используя метод ПЦР-РВ с Taq-ДНК-полимеразой (c выщеплением 5’-концевой метки).
Однако методика, используемая Hamasuna R. et al., 2005, требует длительного, в течение нескольких месяцев, культивирования M. genitalium, что невозможно в условиях лабораторий медицинских учреждений при проведении большого числа анализов клинического материала, полученного у пациентов. Кроме того, культивирование M. genitalium в лабораториях медицинских учреждений крайне затруднительно ввиду высокой требовательности микоплазм к составу питательных сред и крайне медленным ростом микоплазм. Данное обстоятельство делает невозможным широкое применение методики, предложенной в работе Hamasuna R. et al., 2005, в рядовых медицинских учреждениях для выявления в полученном у пациентов клиническом материале, содержащем M. genitalium, наличия у M. genitalium мутаций, обусловливающих их резистентность к макролидным и фторхинолоновым антибиотикам, непосредственно после обращения пациента в медицинское учреждение.
Кроме того, метод ПЦР-РВ c выщеплением 5’-концевой метки, используемый Hamasuna R. et al., 2005, отличается низкой чувствительностью. Это затрудняет широкое применение данного метода, поскольку M. genitalium часто встречается у пациентов в низких концентрациях, а культуральный метод, используемый Hamasuna R. et al., 2005, не всегда позволяет получить культуру микоплазм из низких концентраций.
В принадлежащем SEAPRO THERANOSTICS INTERNATIONAL (NL) патенте US 7005257 B1 "Detection of antibiotic resistance in microorganisms", опубликованном 28.02.2006 (МПК: C07H 21/02, C07H 21/04, C12N 15/09, C12Q 1/02, C12Q 1/68, G01N 33/15, G01N 33/50), описан способ выявления наличия мутаций резистентности микоплазм, таких как Mycoplasma pneumoniae и Mycoplasma hyopneumoniae (далее - M. pneumoniae и M. hyopneumoniae соответственно), к макролидным антибиотикам, включающий: (а) подготовку клинического материала, содержащего микроорганизмы, которые, предположительно, могут быть резистентны к макролидным антибиотикам, (б) in situ контактирование указанного клинического материала со смесью гибридизационных зондов, специфичных к региону пептидилтрансферазы 23S рРНК, причем указанная смесь гибридизационных зондов специфически детектирует точечные мутации гена 23S рРНК в позициях, соответствующих одному или нескольким из нуклеотидов в позициях 2032, 2057, 2058, 2059 и 2611 гена 23S рРНК Escherichia coli, в условиях, обеспечивающих специфичность гибридизации указанных зондов, причем указанная смесь содержит также гибридизационный зонд, специфичный к нуклеиновой кислоте "дикого" типа, и (в) анализ исследуемого клинического материала с целью выявления in situ гибридизации между указанными гибридизационными зондами и нуклеиновыми кислотами микроорганизма в исследуемом клиническом материале, указывающей на наличие мутаций резистентности к макролидным антибиотикам, причем микроорганизмы согласно указанному способу не культивируют до момента контакта с указанным гибридизационным зондом и где указанный гибридизационный зонд, специфичный к нуклеиновой кислоте исследуемого микроорганизма "дикого" типа, является не меченным, а указанные гибридизационные зонды, специфически детектирующие точечные мутации V региона гена 23S рРНК в позициях, соответствующих одному или нескольким из нуклеотидов в позициях 2032, 2057, 2058, 2059 и 2611 гена 23S рРНК Escherichia coli, - меченные (флуоресцеином или флуорофором Cy3).
Предпочтительно, в соответствии с патентом US 7005257 B1, используют гибридизационные зонды ClaR1, ClaR2 и ClaR3 последовательностей cggggtcttcccgtctt, cggggtcttcccgtctt и cggggtcttgccgtctt соответственно, позволяющие выявить наличие в исследуемом клиническом материале точечных мутаций в позициях 2058 и 2059 гена 23S рРНК M. pneumoniae и M. hyopneumoniae.
В другом предпочтительном воплощении технического решения согласно патенту US 7005257 B1, гибридизационные зонды могут представлять собой нуклеиновые кислоты или аналоги нуклеиновых кислот, например, пептидо-нуклеиновые кислоты.
Способ в соответствии с патентом US 7005257 B1 направлен на выявление наличия мутаций резистентности к антибиотикам у M. pneumoniae и M. hyopneumoniae, но не у M. genitalium. Кроме того, способ по патенту US 7005257 B1 позволяет выявлять только наличие мутаций резистентности микоплазм к макролидным антибиотикам, не рассматривая выявление мутаций резистентности к фторхинолоновым антибиотикам.
В работе Эйдельштейн И.А. и соавторов "Выявление мутаций устойчивости к макролидам в гене 23S рРНК Mycoplasma pneumoniae с помощью полимеразной цепной реакции в режиме реального времени" - Тихоокеанский медицинский журнал 2015, №1, стр. 63 - 66 (далее - Эйдельштейн И.А. и соавт., 2015) предложен способ выявления мутаций резистентности к макролидам в гене 23S рРНК у Mycoplasma pneumoniae, использующий ПЦР-РВ с эффектом гашения зонда праймером. В способе согласно работе Эйдельштейн И.А. и соавт., 2015 используется смесь для ПЦР, включающая олигонуклеотидные праймеры Mpn2617-Fw (концентрация 0,8 мкМ), Mpn2617-Rv (концентрация 0,2 мкМ), Mpn2063-Fw2 (концентрация 0,8 мкМ) и Mpn2063-Rv2 (концентрация 0,2 мкМ), а также зонды Mpn2617-Pb (концентрация 0,2 мкМ) и Mpn2063-Pb2 (концентрация 0,2 мкМ), дНТФ (концентрация 0,2 мМ), MgCl2 (концентрация 2 мМ), 2,5 единиц ДНК полимеразы SNP Detect, 1х ПЦР буфер SNP Detect и 3 мкл исследуемого образца ДНК. Амплификацию и анализ кривых плавления зондов согласно Эйдельштейн И.А. и соавт., 2015 выполняют по следующей программе: начальная инкубация - 15 минут при 95°C; 55 циклов денатурации по 20 секунд при 95°C и 15 секунд отжига-элонгации при 55°C с детекцией флуоресценции на каналах FAM (карбоксифлуоресцеина) и JOE (R6G) (6-карбоксиродамина), с последующим анализом кривых плавления с начальной инкубацией 2 минуты при 45°C и последующим повышением температуры на 1°C каждые 10 секунд до 85°C с детекцией флуоресценции на каналах FAM и JOE (R6G). Последовательности "дикого" типа и мутаций в гене 23S рРНК согласно работе Эйдельштейн И.А. и соавт., 2015 идентифицируют в соответствии с температурой плавления зондов.
Способ согласно работе Эйдельштейн И.А. и соавт., 2015 позволяет выявить мутации (нуклеотидные замены) в позициях 2063, 2064 и 2617 гена 23S рРНК, что соответствует позициям 2057, 2058 и 2611 в соответствии с нумерацией для Escherichia coli (согласно Brosius et al., 1978). Однако способ согласно работе Эйдельштейн И.А. и соавт., 2015 включает стадию анализа кривых плавления, что повышает трудоемкость данной методики. Кроме того, способ согласно Эйдельштейн И.А. и соавт., 2015 не выявляет наличие микоплазм, содержащих мутации резистентности к фторхинолоновым антибиотикам, а также не рассматривает выявление мутаций резистентности к макролидным антибиотикам именно у M. genitalium, будучи направлен только на Mycoplasma pneumoniae. Наконец, способ согласно Эйдельштейн И.А. и соавт., 2015 выявляет лишь микоплазмы, содержащие мутации резистентности к макролидным антибиотикам, локализованные в позициях 2063, 2064 и 2617 гена 23S, тогда как показано, что мутации резистентности микоплазм к макролидным антибиотикам могут быть локализованы и в иных позициях гена 23S.
В работе Peuchant O. et al. Increased macrolide resistance of Mycoplasma pneumoniae in France directly detected in clinical specimens by real-time PCR and melting curve analysis. - J Antimicrob Chemother 2009 Jul; 64(1): 52 - 58, далее обозначаемой как Peuchant O. et al., 2009, раскрыт способ выявления мутаций резистентности микоплазм, таких как Mycoplasma pneumoniae, к макролидным антибиотикам, включающий дуплексную амплификацию двух фрагментов гена 23S рРНК Mycoplasma pneumoniae с одновременной гибридизацией четырех зондов и анализом кривых плавления, причем амплификацию фрагмента ДНК Mycoplasma pneumoniae длиной 262 пар оснований, который может содержать мутации в позициях 2058, 2059 и 2062 гена 23S рРНК, осуществляли с использованием праймеров F1-Mpn и R1-Mpn последовательностей GAAGGAGGTTAGCGCAA и TTCTCTACATGATAATGTCCTG соответственно, а амплификацию фрагмента ДНК Mycoplasma pneumoniae длиной 495 пар оснований, который может содержать мутации в позиции 2611 V региона гена 23S рРНК, осуществляли с использованием праймеров F3-Mpn и R4-Mpn последовательностей GGATAAAAGCTACTCCGGG и CTGCGTATTTCCTACCAAAG соответственно. Для дуплексного анализа регионов, содержащих мутацию в гене 23S рРНК Mycoplasma pneumoniae, согласно Peuchant O. et al., 2009 разрабатывали два набора гибридизационных зондов, причем каждая пара зондов включала в себя сенсорный зонд, меченный по 5'-концу LC-Red 640 или LC-Red 705, который гибридизуется с регионом гена 23S рРНК, содержащим мутацию устойчивости к макролидам, и якорный зонд, меченный по 3'-концу флуоресцеином, причем указанный якорный зонд гибридизуется с V регионом гена 23S рРНК, содержащим мутацию устойчивости к макролидам, на три или четыре основания ближе к 5'-концу, чем сенсорный зонд. Смесь для дуплексной ПЦР в реальном времени согласно Peuchant O. et al., 2009 включала в себя 2 мкл матричной ДНК, 1,6 мкл MgCl2 (25 мМ), 1 мкл четырех праймеров (при концентрации каждого из праймеров, составляющей 5 мкМ), 2 мкл четырех зондов (при концентрации каждого из зондов, составляющей 20 мкМ) и 2 мкл зондов производства компании Roche "FastStart DNA Master Hybridization Probes". Согласно Peuchant O. et al., 2009, проводили начальный цикл денатурации при 95°С в течение 10 мин. с последующими 50 циклами амплификации при 95°С в течение 10 сек. со скоростью перехода, составляющей 20°С/сек., отжигом праймеров при 58°С в течение 20 сек. и элонгацией цепи при 72°С в течение 20 сек. Затем, согласно Peuchant O. et al., 2009, осуществляли этап плавления: при 95°С - в течение 1 сек. и при 35°С - в течение 40 сек. с последующим медленным повышением температуры до 85°С со скоростью 0,1°С/сек., непрерывно регистрируя флуоресценцию, с завершающим этапом охлаждения в течение 30 сек. до 40°С.
Способ согласно Peuchant O. et al., 2009, таким образом, требует анализа кривых плавления, что повышает трудоемкость методики. Кроме того, Peuchant O. et al., 2009 выявляют мутации антибиотикорезистентности только у Mycoplasma pneumoniae, не рассматривая выявление мутаций антибиотикорезистентности у M. genitalium. Кроме того, Peuchant O. et al., 2009 вообще не рассматривают выявление мутаций резистентности микоплазм к фторхинолоновым антибиотикам.
Из работы Touati A., Peuchant O., Jensen J.S., Bébéar C., Pereyre S. Direct detection of macrolide resistance in Mycoplasma genitalium isolates from clinical specimens from France by use of real-time PCR and melting curve analysis. - J Clin Microbiol 2014 May; 52(5): 1549 - 1555, далее обозначаемой как Touati A., Peuchant O. et al., 2014, известен способ выявления мутаций резистентности M. genitalium к макролидным антибиотикам, основанный на ПЦР-РВ в варианте FRET (резонансный перенос энергии флуоресценции) и анализа кривых плавления, включающий: амплификацию и детектирование точечных мутаций с использованием пары праймеров и пары зондов. В одном из существующих на данный момент методов выявления мутаций, основанных на ПЦР-РВ, детектирование мутаций A2058G, A2059G, А2058С (согласно Brosius et al., 1978) осуществляется с помощью праймеров к гену 23S рРНК и зондов, которые содержат флуорофор на 5'-конце и гаситель - на 3'-конце; связывание этого зонда с ампликоном и последующее расщепление за счет 5'-экзонуклеазной активности Taq-полимеразы сопровождается нарастанием флуоресценции. Выявление мутаций согласно Touati A., Peuchant O. et al., 2014 проводят с использованием постамплификационного анализа кривых плавления.
Способ, предложенный в работе Touati A., Peuchant O. et al., 2014, обладает следующими недостатками: во-первых, он не позволяет одновременно выявлять в одном и том же клиническом материале нуклеотидные замены в позиции 2611 в гене 23S рРНК М. genitalium и М. pneumoniae; во-вторых, он не позволяет выявлять все возможные виды мутаций, детектируя наличие только трех мутаций, включая мутации в позиции A2058G, A2059G и А2058С в гене 23S рРНК М. genitalium, в-третьих, он не был адаптирован и апробирован для выявления мутаций к макролидным антибиотикам у М. pneumoniae и, в-четвертых, данный способ не позволяет одновременно выявить мутации резистентности к фторхинолоновым антибиотикам.
В патенте RU 2646123 C1 "СПОСОБ ВЫЯВЛЕНИЯ МУТАЦИЙ, ПРИВОДЯЩИХ К РЕЗИСТЕНТНОСТИ У Mycoplasma genitalium И Mycoplasma pneumoniae К МАКРОЛИДНЫМ АНТИБИОТИКАМ", принадлежащем Федеральному государственному бюджетному образовательному учреждению высшего образования "Смоленский государственный медицинский университет" Министерства здравоохранения Российской Федерации (RU), опубликованном 01.03.2018 (МПК: A61B 10/00), раскрыт предлагаемый в качестве ближайшего аналога заявляемого способа способ выявления мутаций, приводящих к резистентности у M. genitalium и M. pneumoniae к макролидным антибиотикам, включающий амплификацию выделенной ДНК исследуемого образца, ПЦР-амплификацию мишени: 2058 и 2059 позиции гена 23S рРНК M. genitalium, оценку кривых плавления зондов на детектируемом канале FAM, отличающийся тем, что в реакционную пробирку в мультиплексном варианте добавляют пару праймеров и один зонд для каждой позиции М. pneumoniae и М. genitalium. Для детекции мутаций в мультиплексном варианте в двух целевых участках гена 23S рРНК М. pneumoniae и М. genitalium, включающих позиции 2058-2059 и 2611, добавляют два реверсных праймера для М. pneumoniae: Mpn2611-Rv AAGCAACACTCTTCAATCTTCC(T-BHQ1)А и Mpn2059-Rv3 ATCAATATTATGCTACAGTAAAGCT(T-BHQ1)CAG, а также два реверсных праймера для М. genitalium: Mge2611-Rev AGCAAAGCTCTTCAATCTTCC(T-BHQ1)G и Mge2059-Rv3 ATCAATATTATGCTACAGTAAAGCT(T-BHQ1)CACG; для детекции целевой последовательности, располагающейся внутри участка связывания праймеров, разрабатывают два олигонуклеотидных зонда, содержащих флуорофоры (FAM и R6G) на 3'-конце и полностью комплементарные последовательностям 23S рРНК "дикого" типа, содержащих флуорофоры (FAM и R6G) для каждой детектируемой мишени 2058, 2059, а также 2611 позиции гена 23S рРНК M. genitalium или M. pneumoniae, проводят амплификацию ДНК-мишени с последующим этапом плавления зондов, при этом визуально оценивают полученные пики одновременно на двух детектируемых каналах FAM и JOE (R6G), сравнивают температуры плавления полученных пиков с контрольными образцами и делают вывод о наличии мутации в исследуемом образце: если на канале FAM исследуемый образец имеет Tm = 62°С±0,3°С, это свидетельствует о наличии "дикого" фенотипа (фенотипа без мутации); если Tm = 52°С±0,3°С, это свидетельствует о наличии мутации A2058/2059G; если Tm = 55°С±0,3°С, это свидетельствует о наличии мутации А2059С; если Tm = 56,8°С±0,3°С, это свидетельствует о наличии мутации А2058С; если на канале JOE (R6G) исследуемый образец имеет Tm = 62°С±0,3°С, это свидетельствует о наличии "дикого" фенотипа - без мутации; если Tm = 53°С±0,3°С, это свидетельствует о наличии мутации A2611G; если Tm = 54,5°С±0,3°С, это свидетельствует о наличии мутации А2611Т.
Таким образом, способ в соответствии с патентом RU 2646123 C1, как и способ согласно работе Touati A., Peuchant O. et al., 2014, требует анализа кривых плавления, что усложняет выявление микоплазм, имеющих мутации, ассоциированные с резистентностью к макролидным антибиотикам, а также затрудняет проведение большого числа анализов (например, в условиях медицинского учреждения при необходимости выявления микоплазм, резистентных к антибиотикам, у большого числа пациентов) и не позволяет одновременно выявлять наличие в исследуемом клиническом материале, полученном от пациентов, M. genitalium, имеющих мутации резистентности к фторхинолоновым антибиотикам.
Раскрытие изобретения
Задачей заявляемого изобретения является, таким образом, разработка способа, позволяющего выявлять в полученном у пациентов клиническом (биологическом) материале, содержащем M. genitalium, наличия у M. genitalium мутаций, ассоциированных с резистентностью к макролидным и фторхинолоновым антибиотикам, который легко мог бы быть использован в лабораториях медицинских учреждений при проведении большого числа анализов полученного у пациентов клинического (биологического) материала для подбора или корректировки адекватной антибиотикотерапии инфекции M. genitalium, а также для контроля эпидемиологического процесса.
Достигаемый технический результат заключается в обеспечении обладающего высокой чувствительностью способа, использующего ПЦР-РВ, не требующего ни использования дополнительных ферментов, ни осуществления дополнительных стадий анализа, позволяющий выявить наличие у M. genitalium, содержащихся в полученном от пациента исследуемом клиническом материале, мутаций на участке V домена гена 23S рРНК, ассоциированных с резистентностью к макролидным антибиотикам, а также наличие у M. genitalium, содержащихся в полученном от пациента исследуемом клиническом материале, мутаций на участке QRDR гена ParC, ассоциированных с резистентностью M. genitalium к фторхинолоновым антибиотикам.
Поставленные задачи решаются, а технический результат - достигается предлагаемым в настоящем изобретении способом выявления наличия мутаций, приводящих к резистентности у Mycoplasma genitalium к макролидным и фторхинолоновым антибиотикам, включающим:
(а) выделение из исследуемого клинического материала ДНК, включая ДНК Mycoplasma genitalium;
(б) ПЦР-амплификацию мишеней, включая участок фрагмента гена гиразы указанной Mycoplasma genitalium GyrB, участок V домена гена 23S рРНК указанной Mycoplasma genitalium и участок QRDR гена ParC указанной Mycoplasma genitalium, с флуоресцентной детекцией накопления продуктов амплификации,
(в) построение кривой накопления продуктов амплификации для каждой из указанных мишеней, с указанием по оси абсцисс номера цикла ПЦР, а по оси ординат - величины F и с последующим определением максимального уровня флуоресценции fмакс. для каждого исследуемого образца для следующих упомянутых мишеней: 1) участок V домена гена 23S рРНК указанной Mycoplasma genitalium и 2) участок QRDR гена ParC указанной Mycoplasma genitalium и последующим определением для мишеней участок V домена гена 23S рРНК указанной Mycoplasma genitalium и участок QRDR гена ParC указанной Mycoplasma genitalium максимального уровня флуоресценции Fмакс. во всей постановке, включая положительные контроли, с последующим вычислением величины F = [fмакс./Fмакс.] * 100%, и с последующим определением тангенса угла наклона k линейной части указанной кривой относительно оси x,
(г) определение общей концентрации Mycoplasma genitalium в каждом исследуемом образце путем амплификации фрагмента гена гиразы GyrB, определения значения порогового цикла Ct и вычисления десятичного логарифма указанного значения,
(д) определение концентрации Mycoplasma genitalium в исследуемом образце, полученное в результате амплификации ДНК Mycoplasma genitalium с использованием праймеров, амплифицирующих участок V домена гена 23S рРНК Mycoplasma genitalium, потенциально содержащий мутации, приводящие к резистентности Mycoplasma genitalium к макролидным антибиотикам, с последующим вычислением десятичного логарифма указанной концентрации,
(е) определение концентрации Mycoplasma genitalium в исследуемом образце, полученное в результате амплификации ДНК Mycoplasma genitalium с использованием праймеров, амплифицирующих фрагмент QRDR гена ParC Mycoplasma genitalium, потенциально содержащий мутации, приводящие к резистентности Mycoplasma genitalium к фторхинолоновым антибиотикам, с последующим вычислением десятичного логарифма указанной концентрации,
(ж) вычисление разности десятичного логарифма общей концентрации Mycoplasma genitalium в исследуемом образце, вычисленного на этапе (г), и десятичного логарифма концентрации Mycoplasma genitalium в исследуемом образце, полученного в результате амплификации ДНК Mycoplasma genitalium с использованием праймеров, амплифицирующих участок V домена гена 23S рРНК Mycoplasma genitalium, вычисленного на этапе (д),
(з) вычисление разности десятичного логарифма общей концентрации Mycoplasma genitalium в исследуемом образце, вычисленного на этапе (г), и десятичного логарифма концентрации Mycoplasma genitalium в исследуемом образце, полученного в результате амплификации ДНК Mycoplasma genitalium с использованием праймеров, амплифицирующих фрагмент QRDR гена ParC Mycoplasma genitalium, вычисленного на этапе (е),
причем в качестве праймеров, амплифицирующих участок V домена гена 23S рРНК Mycoplasma genitalium, используют прямой праймер Mg23S-1992f последовательности CCATCTCTTGACTGTCTCGGCTAT (SEQ ID NO: 1) и обратный праймер Mg23S-2138r последовательности CCTACCTATTCTCTACATGGTGGTGTT (SEQ ID NO: 2), при этом для детекции целевой последовательности, располагающейся внутри участка связывания указанных праймеров, используют зонд Mg23SZwt1-1A последовательности ACGGGGTCTTTCC (SEQ ID NO: 3), где указанный зонд содержит флуорофор (флуоресцентную метку) на 5'-конце и гаситель - на 3'-конце,
в качестве праймеров, амплифицирующих фрагмент QRDR гена ParC Mycoplasma genitalium, используют прямой праймер MG-PARC-A последовательности TGGGCTTAAAACCCACCACT (SEQ ID NO: 4) и обратный праймер MG-PARC-B последовательности CGGGTTTCTGTGTAACGCAT (SEQ ID NO: 5), при этом для детекции целевой последовательности, располагающейся внутри участка связывания указанных праймеров, используют зонд MgParCZwt1 последовательности CATCATAAATGGAACTAT (SEQ ID NO: 6), где указанный зонд содержит флуорофор (флуоресцентную метку) на 5'-конце и гаситель - на 3'-конце,
а в качестве праймеров, амплифицирующих фрагмента гена гиразы Mycoplasma genitalium GyrB, используют прямой праймер последовательности CCCACAAGAAGCAAACGCTATCATCAGA (SEQ ID NO: 7) и обратный праймер последовательности CCAGCACTATCACCCTCAACAATGTAAAGT (SEQ ID NO: 8), при этом для детекции целевой последовательности, располагающейся внутри участка связывания указанных праймеров, используют зонд последовательности CGACGAGTTAACTCCCTAGCCTCGTC (SEQ ID NO: 9), содержащий флуорофор (флуоресцентную метку) на 5'-конце и гаситель - на 3'-конце,
и причем амплификацию проводят по следующей программе:
1-й этап: 95°С в течение 15 минут - 1 цикл;
2-й этап: 95°С в течение 5 секунд, 60°С в течение 20 секунд, 72°С в течение 15 секунд - 5 циклов;
3-й этап: 95°С в течение 5 секунд, 60°С в течение 20 секунд с детекцией флуоресцентного сигнала, 72°С в течение 15 секунд - 40 циклов,
при этом,
если величина F для фрагмента 23S рРНК составляет менее 15%, или если разность, вычисленная на этапе (ж), составляет более 0,6, или если k составляет менее 0,9, то делают вывод о наличии в исследуемом образце мутаций, приводящих к резистентности у Mycoplasma genitalium к макролидным антибиотикам,
а если величина F для фрагмента гена ParC составляет менее 15%, или если разность, вычисленная на этапе (з), составляет более 1,0, или если k составляет менее 0,6, то делают вывод о наличии в исследуемом образце мутаций, приводящих к резистентности у Mycoplasma genitalium к фторхинолоновым антибиотикам.
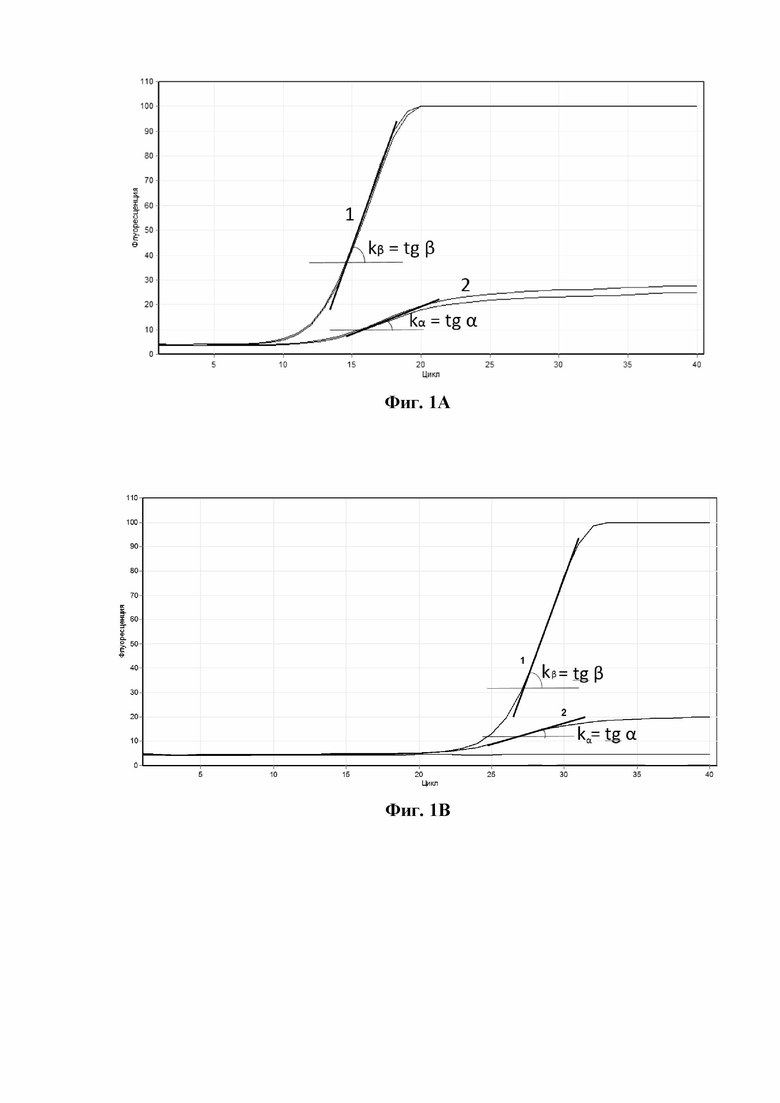
Кривая накопления продуктов амплификации, получаемая на этапе (в), в общем виде имеет S-образную форму, причем срединная часть указанной кривой является линейной. Угол наклона α линейной части указанной кривой и тангенс этого угла (k = tg α) определяется так, как показано ниже на фигуре 1 и как пояснено в настоящем описании в разделе "Краткое описание фигур".
Для целей настоящего описания все нуклеотидные последовательности, включая последовательности SEQ ID NO: 1 - 9, указываются в направлении от 5'-конца к 3'-концу, в соответствии с существующими правилами записи нуклеотидных последовательностей (см, например: Кнорре Д.Г., Мызина С.Д. Биологическая химия. - Учебник для химических, биологических и медицинских вузов (3-е издание), Москва, "Высшая школа", 2000. - 479 с.).
Общую концентрацию M. genitalium в каждом исследуемом образце на стадии (г) заявляемого способа определяют в соответствии с методикой, раскрытой в работе Shipitsyna E, Zolotoverkhaya E, Dohn B, Benkovich A, Savicheva A, Sokolovsky E, et al. First evaluation of polymerase chain reaction assays used for diagnosis of Mycoplasma genitalium in Russia. - J Eur Acad Dermatol Venereol. 2009; 23: 1164 - 1172, включенной в настоящее описание посредством ссылки, принимая за нулевое значение (за интенсивность флуоресценции контрольных образцов, не содержащих продуктов амплификации фрагмента гена гиразы GyrB) интенсивность флуоресценции в нулевом цикле ПЦР, не содержащем продуктов амплификации, затем рассчитывая стандартное отклонение (SD) изменений, умножая его на 10 и получая таким образом пороговое значение. Пороговый уровень флуоресценции (пороговое значение) определяется автоматически программным обеспечением прибора. Значение цикла амплификации в точке пересечения кинетической кривой накопления продукта амплификации с линией порогового уровня флуоресценции, т.е. значение цикла амплификации, при котором впервые достигается значение большее, чем пороговое значение, обозначают как "значение порогового цикла" ("значение Ct").
Праймеры Mg23S-1992f и Mg23S-2138r последовательностей SEQ ID NO: 1 и SEQ ID NO: 2 соответственно известны из вышеупомянутой работы Jensen J.S., Bradshaw C.S. et al., 2008.
Праймеры MG-PARC-A и MG-PARC-B последовательностей SEQ ID NO: 4 и SEQ ID NO: 5 соответственно известны из работы Deguchi, T., Yasuda, M., Asano, M., Tada, K., Iwata, H., Komeda, H. et al. DNA gyrase mutations in quinoloneresistant clinical isolates of Neisseria gonorrhoeae. - Antimicrobial Agents and Chemotherapy (1995) 39, 561-563 (далее - Deguchi T., Yasuda M. et al., 1995).
Зонд Mg23SZwt1-1A (SEQ ID NO: 3), созданный авторами в рамках настоящего изобретения, полностью комплементарен последовательности V региона гена 23S рРНК M. genitalium "дикого" типа и может быть полностью или частично комплементарен последовательности V региона гена 23S рРНК Mycoplasma genitalium, имеющей мутации в V регионе гена 23S. Под "частично комплементарным" для целей настоящего изобретения понимается зонд Mg23SZwt1-1A, по меньшей мере на 69,2%, более предпочтительно, по меньшей мере на 76,9%, более предпочтительно, по меньшей мере на 84,6%, и, наиболее предпочтительно, по меньшей мере на 92,3% комплементарный последовательности V региона гена 23S рРНК M. genitalium.
Зонд MgParCZwt1 (SEQ ID NO: 6), созданный авторами в рамках настоящего изобретения, полностью комплементарен последовательности QRDR гена ParC M. genitalium "дикого" типа и может быть полностью или частично комплементарен последовательности QRDR гена ParC M. genitalium, имеющей мутации в регионе QRDR гена ParC. Под "частично комплементарным" для целей настоящего изобретения понимается зонд MgParCZwt1, по меньшей мере на 77,8%, более предпочтительно, по меньшей мере на 83,35%, более предпочтительно, по меньшей мере на 88,9%, и, наиболее предпочтительно, по меньшей мере на 94,45% комплементарный последовательности QRDR гена ParC M. genitalium.
Зонд SEQ ID NO: 9 полностью комплементарен последовательности гена гиразы GyrB M. genitalium.
Перечень сокращений:
ВЗОМТ - воспалительные заболевания органов малого таза
ЗНК - «запертые» нуклеиновые кислоты
ИППП - инфекции, передающиеся половым путем
КВД - кожно-венерологический диспансер
НККДЦ - научно-консультативный клинико-диагностический центр
ПКО - положительный контрольный образец
ПЦР - полимеразная цепная реакция
ПЦР-РВ - полимеразная цепная реакция в реальном времени
рРНК - рибосомальная РНК
Cy5 - цианин 5
Cy5.5 - цианин 5.5
FAM - карбоксифлуоресцеин
FRET - резонансный перенос энергии флуоресценции (метод исследования)
JOE - 6-карбокси-4',5'-дихлор-2',7'-диметоксифлуоресцеин
R6G - 6-карбоксиродамин
ROX - карбокси-Х-родамин
TaqMAN ПЦР-РВ - ПЦР-РВ с Taq ДНК-полимеразой (с выщеплением 5'-концевой метки)
QRDR - quinolone-resistance determining region или область (регион), определяющая устойчивость к хинолонам
Изобретение поясняется схемами, приведенными на фигурах 1 и 2.
Краткое описание фигур.
На фигуре 1A представлена схема определения k - тангенса угла наклона линейной части кривой накопления продуктов амплификации для "дикого" типа M. genitalium (угол β) и для мутантного типа M. genitalium, содержащего мутации, ассоциированные с устойчивостью микоплазмы к макролидным антибиотикам (угол α). Кривая 1 - "дикий" тип M. genitalium, 0,9 ≤ kβ < ∞; кривая 2 - мутантный тип M. genitalium, содержащий мутации, ассоциированные с устойчивостью микоплазмы к макролидным антибиотикам, 0 < kα < 0,9.
На фигуре 1В представлена схема k - тангенса угла наклона линейной части кривой накопления продуктов амплификации для "дикого" типа M. genitalium (угол β) и для мутантного типа M. genitalium, содержащего мутации, ассоциированные с устойчивостью микоплазмы к фторхинолоновым антибиотикам (угол α). Кривая 1 - "дикий" тип M. genitalium, 0,6 ≤ kβ < ∞; кривая 2 - мутантный тип M. genitalium, содержащий мутации, ассоциированные с устойчивостью микоплазмы к или фторхинолоновым антибиотикам.
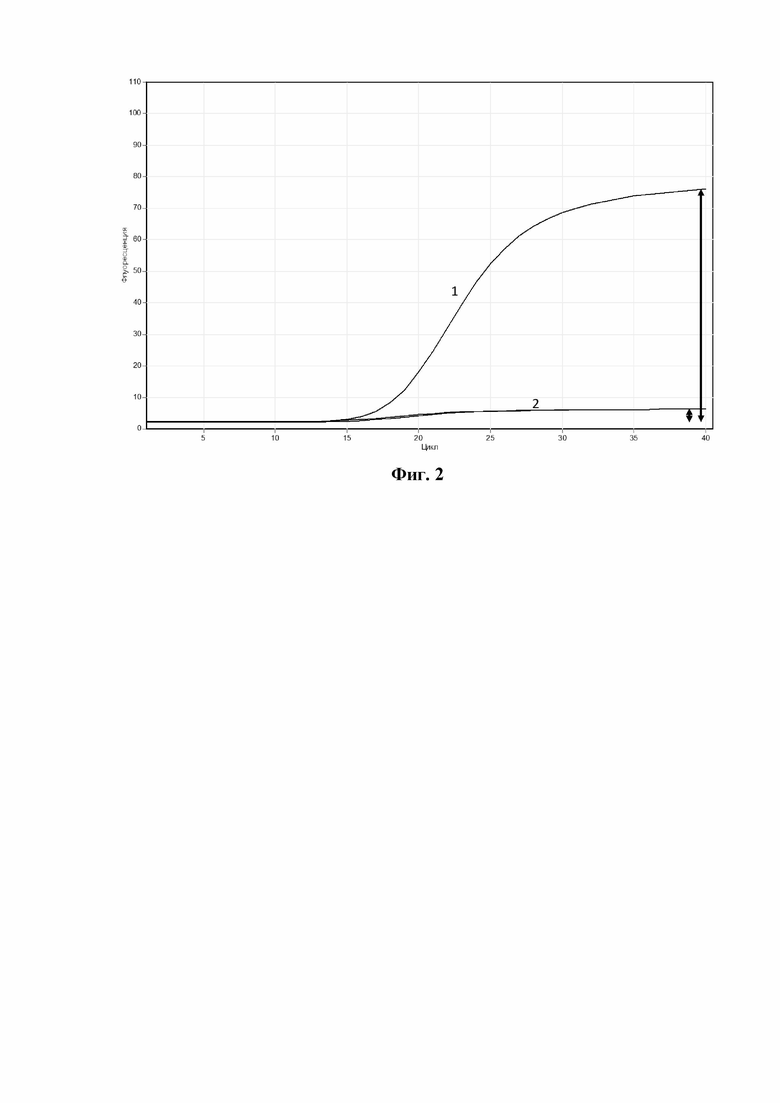
На фигуре 2 представлена схема определения F - максимального уровня флуоресцентного сигнала в образце, содержащем M. genitalium, для "дикого" типа M. genitalium (FWT) и для мутантного типа M. genitalium, содержащего мутации, ассоциированные с устойчивостью микоплазмы к макролидным или фторхинолоновым антибиотикам (FMut). Кривая 1 - "дикий" тип M. genitalium, FWT = 100%; кривая 2 - мутантный тип M. genitalium, содержащий мутации, ассоциированные с устойчивостью микоплазмы к макролидным или фторхинолоновым антибиотикам, FMut < 15% от FWT.
Предпочтительные варианты осуществления изобретения.
В предпочтительных, но не ограничивающих объем притязаний вариантах осуществления заявляемого способа, гаситель на 3'-концах зондов Mg23SZwt1-1A, MgParCZwt1 и зонда последовательности SEQ ID NO: 9 выбран из темновых гасителей флуоресценции BHQ-1, BHQ-2 и BHQ-3, а флуорофор на 5'-концах зондов Mg23SZwt1-1A, MgParCZwt1 и зонда последовательности SEQ ID NO: 9 выбран из карбоксифлуоресцеина (далее - FAM), 6-карбоксиродамина (далее - R6G), 6-карбокси-4',5'-дихлор-2',7'-диметоксифлуоресцеина (далее - JOE), карбокси-Х-родамина (далее - ROX), цианина 5 (далее - Cy5) и цианина 5.5 (далее - Cy5.5), при условии, что если тот или иной из указанных флуорофоров использован для какой-то одной из мишеней, то для других мишеней используются остальные флуорофоры, и что флуорофоры FAM и R6G могут использоваться только с гасителем BHQ-1, флуорофоры JOE, ROX и Cy5 - только с гасителем BHQ-2, а флуорофор Cy5.5 - только с гасителем BHQ-3. В наиболее предпочтительном, но не ограничивающем объем притязаний варианте осуществления заявляемого способа, гаситель на 3'-конце зонда Mg23SZwt1-1A представляет собой BHQ-1, на 3'-конце зонда MgParCZwt1 - BHQ-1, а на 3'-конце зонда последовательности SEQ ID NO: 9 - BHQ-2, тогда как флуорофор на 5'-конце зонда Mg23SZwt1-1A, предпочтительно (без ограничения), представляет собой FAM, на 5'-конце зонда MgParCZwt1 - R6G, а на 5’-конце зонда последовательности SEQ ID NO: 9 - ROX.
Также в предпочтительных, но не ограничивающих объем притязаний вариантах осуществления изобретения, зонды Mg23SZwt1-1A и MgParCZwt1 содержат по крайней мере один, более предпочтительно, по крайней мере два, более предпочтительно, по крайней мере три и, наиболее предпочтительно, по крайней мере четыре запертых нуклеотида, далее также вместе обозначаемых как ЗНК (сокращение от "запертые нуклеиновые кислоты"). Запертыми, в соответствии с принятой в данной области техники терминологией, называются нуклеотиды и содержащие такие нуклеотиды нуклеиновые кислоты, в сахаридном остатке рибозы которых имеется дополнительная связь между 2' атомом кислорода и 4' атомом углерода, "запирающая" сахаридный остаток рибозы в конформации 3'-эндо, в результате чего увеличивается ее термостабильность (Lundin K.E., Højland T. et al. Chapter Two - Biological Activity and Biotechnological Aspects of Locked Nucleic Acids. - Advances in Genetics 2013, vol. 82, pp. 47 - 107). Праймеры и зонды, содержащие ЗНК, как показано, обеспечивают более высокую чувствительность и более высокую производительность ПЦР, в сравнении с праймерами и зондами, не содержащими ЗНК (Ballantyne K.N., van Oorschot R.A., Mitchell R.J. Locked nucleic acids in PCR primers increase sensitivity and performance. - Genomics 2008 Mar; 91(3): 301 - 305).
В наиболее предпочтительном, но не ограничивающем варианте осуществления изобретения, зонд Mg23SZwt1-1A последовательности SEQ ID NO: 3 содержит ЗНК в позициях, обозначенных знáком +: ACGGG+G+TCT+T+TCC (здесь и далее в настоящем описании знак + в записях нуклеотидных последовательностей указывается перед тем ЗНК, к которому он относится). Кроме того, в наиболее предпочтительном, но не ограничивающем варианте осуществления изобретения, зонд MgParCZwt1 последовательности SEQ ID NO: 6 также содержит ЗНК в позициях, обозначенных знáком +: CA+T+CATAAATGGAA+C+TAT.
Реализация предлагаемого способа подтверждается приведенными ниже примерами, которые приводятся лишь в целях иллюстрации изобретения, а не для ограничения объема притязаний.
Пример 1.
Пациент Р. (мужчина) обратился в частную клинику с жалобами на зуд в половых органах. Со слов пациента, в указанной частной клинике у него была обнаружена инфекция M. genitalium, которую безуспешно пытались вылечить. Первым был назначен препарат тетрациклинового ряда, но через две недели эрадикации M. genitalium не произошло, и был назначен другой препарат также тетрациклинового ряда, который так же не привел к успешному излечению. Это согласуется с рядом исследований, в которых было показано, что эффективность некоторых препаратов тетрациклинового ряда против M. genitalium низка и составляет около 40-50% (Manhart L.E. et al. Standard treatment regimens for nongonococcal urethritis have similar but declining cure rates: a randomized controlled trial. - Clin. Infect. Dis. 2013 Apr; 56(7):934-42; Mena L.A., Mroczkowski T.F et al. A randomized comparison of azithromycin and doxycycline for the treatment of Mycoplasma genitalium-positive urethritis in men. - 2009 Jun 15; 48(12):1649-54; Schwebke, J. R. et al. Re‑evaluating the treatment of nongonococcal urethritis: emphasizing emerging pathogens - a randomized clinical trial. - Clin Infect Dis. 2011 Jan 15; 52(2): 163-170).
После неудачи лечения препаратами тетрациклинового ряда мужчина обратился в кожно-венерологический диспансер (далее - КВД). В КВД наличие M. genitalium подтвердили методом ПЦР в реальном времени. Третьим антибиотиком, который Р. принимал, был макролидный антибиотик джозамицин, принимаемый перорально по 500 мг 3 раза в сутки в течение 10 дней. На этом этапе полученный у пациента биологический материал (соскоб из уретры) был передан на исследование предлагаемым в настоящем изобретении способом с использованием для выявления мутаций резистентности M. genitalium к макролидам прямого и обратного праймеров Mg23S-1992f и Mg23S-2138r и зонда Mg23SZwt1-1A (ACGGG+G+TCT+T+TCC), содержащего в позициях, отмеченных знáком +, запертые нуклеотиды, и при этом содержащего на 3’-конце гаситель BHQ-1, а на 5’-конце - флуорофор FAM, а для выявления мутаций резистентности M. genitalium к фторхинолонам - прямого и обратного праймеров MG-PARC-A и MG-PARC-B и зонда MgParCZwt1 (CA+T+CATAAATGGAA+C+TAT), содержащего в позициях, отмеченных знáком +, запертые нуклеотиды, и при этом содержащего на 3’-конце гаситель BHQ-1, а на 5’-конце - флуорофор R6G.
В результате применения предлагаемого в настоящем изобретении способа было подтверждено наличие в биологическом материале, полученном у пациента, M. genitalium, а также показано наличие мутаций в V регионе гена 23S рРНК. Данное заключение было сделано на основе параметров, полученных для исследуемого образца: F = 13%, k=0,63 и разности десятичного логарифма общей концентрации M. genitalium в исследуемом образце, и десятичного логарифма концентрации M. genitalium в исследуемом образце, полученного в результате амплификации ДНК M. genitalium с использованием праймеров, амплифицирующих участок 5 домена гена 23S рРНК M. genitalium, составившей 0,7. Два параметра (F и k) из трех соответствовали генотипу M. genitalium, несущему мутации в области, ассоциированной с устойчивостью к действию макролидов.
Для области QRDR гена ParC были определены следующие коэффициенты: F = 0%, k = 0 и разности десятичного логарифма общей концентрации M. genitalium в исследуемом образце, и десятичного логарифма концентрации M. genitalium в исследуемом образце, полученного в результате амплификации ДНК M. genitalium с использованием праймеров, амплифицирующих участок 5 домена гена 23S рРНК M. genitalium, равной 4. Все три коэффициента соответствуют генотипу M. genitalium, несущему мутации в области, ассоциированной с устойчивостью к действию фторхинолонов. Полученные результаты объясняют отсутствие желаемого эффекта от приема антибактериальных препаратов. Для подтверждения биологический материал, полученный у пациента, отправили на исследование независимым методом - секвенированием по Сэнгеру (согласно работе Sanger F., Nicklen S., Coulson A. R. DNA sequencing with chain-terminating inhibitors. - Proc Natl Acad Sci U S A. 1977, vol. 74, issue 12, pp. 5463-5467, включенной в настоящее описание посредством ссылки). По результатам секвенирования участков гена 23S рРНК и гена ParC, было показано наличие у M. genitalium мутации, ассоциированной с устойчивостью к макролидам - A2059G, а также мутации, ассоциированной с устойчивостью к фторхинолонам - G248T (замена серина на изолейцин в 83 положении белковой последовательности).
Одновременно с забором биологического материала пациента для тестирования предлагаемым в настоящем изобретении способом, пациенту был назначен фторхинолоновый антибиотик моксифлоксацин (фторхинолон IV поколения) в дозе 400 мг 2 раза в сутки перорально в течение 14 дней. Через три недели, когда пациент принес результаты контроля лечения, эрадикации M. genitalium также не произошло, после чего был назначен перорально 1 г четырежды в день в течение 10 дней пристинамицин - антибактериальное средство широкого спектра действия, активное, в том числе, и в отношении M. genitalium (Mast Y., Wohlleben W. Streptogramins - two are better than one! - Int J Med Microbiol., 2014 Jan; 304(1): 44-50), представляющее собой смесь макролида пристинамицина IA, спектр действия которого аналогичен спектру действия эритромицина, и пристинамицина IIA (стрептограмина A). На контроль лечения пациент Р. не явился.
Пример 2.
Пациент В. (мужчина) обратился в Центральный НИИ эпидемиологии Научно-консультативный клинико-диагностический центр (далее - НККДЦ) с жалобами на зуд и жжение во время полового акта, появившиеся вскоре после незащищенного полового контакта с новым половым партнером. У пациента был получен биологический материал (соскоб из уретры), который был проанализирован на наличие инфекций, передающихся половым путем (далее - ИППП). Ни одной ИППП, кроме M. genitalium, обнаружено не было. В целях эрадикации M. genitalium пациенту был назначен джозамицин (16-членный макролидный антибиотик) в дозе 500 мг 3 раза в сутки перорально в течение 10 дней.
Через две недели пациент повторно сдал анализы на наличие M. genitalium, которая вновь была обнаружена. После этого ему был назначен антибиотик другого типа - моксифлоксацин (фторхинолоновый антибиотик IV поколения) в дозе 400 мг 2 раза в сутки перорально в течение 10 дней. По результатам ПЦР исследования, проведенного по окончании данного лечения, M. genitalium вновь присутствовала и образцы биологического материала пациента В. (соскоб из уретры и первая порция утренней мочи) были переданы на исследование предлагаемым в настоящем изобретении способом с использованием для выявления мутаций резистентности M. genitalium к макролидам прямого и обратного праймеров Mg23S-1992f и Mg23S-2138r и зонда Mg23SZwt1-1A(ACGGG+G+TCT+T+TCC), содержащего в позициях, отмеченных знáком +, запертые нуклеотиды, и при этом содержащего на 3’-конце гаситель BHQ-3, а на 5’-конце - флуорофор Cy5.5, а для выявления мутаций резистентности M. genitalium к фторхинолонам - прямого и обратного праймеров MG-PARC-A и MG-PARC-B и зонда MgParCZwt1 (CA+T+CATAAATGGAA+C+TAT), содержащего в позициях, отмеченных знáком +, запертые нуклеотиды, и при этом содержащего на 3’-конце гаситель BHQ-2, а на 5’-конце - флуорофор JOE.
В результате применения способа в соответствии с изобретением в обоих образцах исследуемого биологического материала, полученного у пациента, была обнаружена M. genitalium, содержащая мутации устойчивости к макролидам. Вывод сделан на основании коэффициентов F = 10,7 и 9,5 %, k = 0,5 и 0,44 для образца соскоба из уретры и первой порции утренней мочи, соответственно, а разность десятичного логарифма общей концентрации M. genitalium в исследуемом образце, и десятичного логарифма концентрации M. genitalium в исследуемом образце, полученного в результате амплификации ДНК M. genitalium с использованием праймеров, амплифицирующих участок 5 домена гена 23S рРНК M. genitalium, была определена для образца соскоба из уретры равной 0,74 и 1,1 для образца первой порции мочи. Данные результаты объясняют неудачу лечения джозамицином.
Наличие мутаций в области QRDR гена ParC были также определены на основании коэффициентов F = 7,7 и 6,5 %, k = 0,35 и 0,33 для образца соскоба из уретры и первой порции утренней мочи соответственно, а разность десятичного логарифма общей концентрации M. genitalium в исследуемом образце и десятичного логарифма концентрации M. genitalium в исследуемом образце, полученного в результате амплификации ДНК M. genitalium с использованием прямого и обратного праймеров MG-PARC-A и MG-PARC-B, амплифицирующих участок QRDR гена ParC M. genitalium, была определена для образца соскоба из уретры равной 2,2 и 3,1 для образца первой порции мочи.
Оба образца биологического материала были переданы на исследование методом секвенирования по Сэнгеру (аналогично примеру 1), в результате которого было подтверждено наличие мутаций, ассоциированных с устойчивостью M. genitalium к макролидам - A2058G и мутаций, ассоциированных с устойчивостью M. genitalium к фторхинолонам - G259A (замена аспарагиновой кислоты на аспарагин в белковой последовательности) для обоих типов биологического материала. Поскольку лечение моксифлоксацином не привело к эрадикации M. genitalium, пациенту был назначен тетрациклиновый антибиотик - доксициклина моногидрат в дозе 100 мг перорально 2 раза в сутки в течение 10 дней. На контроль лечения пациент В. так же, как и пациент Р., не явился.
В рамках изобретения, таким образом, разработан высоко чувствительный основанный на ПЦР-РВ способ выявления в полученном у пациентов клиническом материале, содержащем M. genitalium, наличия у M. genitalium мутаций, ассоциированных с резистентностью к макролидным и фторхинолоновым антибиотикам, не требующий ни использования дополнительных ферментов, ни осуществления дополнительных стадий анализа, который легко может быть использован в лабораториях медицинских учреждений при проведении большого числа анализов полученного у пациентов клинического (биологического) материала для подбора или корректировки адекватной антибиотикотерапии инфекции M. genitalium, а также для контроля эпидемиологического процесса.
--->
Перечень последовательностей
<110> Федеральное бюджетное учреждение науки "Центральный научно-исследовательский институт эпидемиологии" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ЦНИИЭ Роспотребнадзора)
<120> Способ выявления наличия мутаций, приводящих к резистентности у Mycoplasma genitalium к макролидным и фторхинолоновым антибиотикам
<160> 9
<210> 1
<211> 24
<212> ДНК
<213> Mycoplasma genitalium
<223> прямой праймер для амплификации участка V домена гена 23S рРНК Mycoplasma genitalium
<400> 1
ccatctcttg actgtctcgg ctat 24
<210> 2
<211> 27
<212> ДНК
<213> Mycoplasma genitalium
<223> обратный праймер для амплификации участка V домена гена 23S рРНК Mycoplasma genitalium
<400> 2
cctacctatt ctctacatgg tggtgtt 27
<210> 3
<211> 13
<212> РНК
<213> Mycoplasma genitalium
<223> зонд для детекции целевой последовательности внутри участка V домена гена 23S рРНК Mycoplasma genitalium
<400> 3
acggggtctt tcc 13
<210> 4
<211> 20
<212> ДНК
<213> Mycoplasma genitalium
<223> прямой праймер для амплификации фрагмента QRDR гена ParC Mycoplasma genitaliumH HРНК
<400> 4
tgggcttaaa acccaccact 20
<210> 5
<211> 20
<212> ДНК
<213> Mycoplasma genitalium
<223> обратный праймер для амплификации фрагмента QRDR гена ParC Mycoplasma genitaliumH HРНК
<400> 5
cgggtttctg tgtaacgcat 20
<210> 6
<211> 18
<213> Mycoplasma genitalium
<223> зонд для детекции целевой последовательности внутри фрагмента QRDR гена ParC Mycoplasma genitalium
<400> 6
catcataaat ggaactat 18
<210> 7
<211> 28
<213> Mycoplasma genitalium
<223> прямой праймер для амплификации фрагмента гена гиразы Mycoplasma genitalium GyrB
<400> 7
cccacaagaa gcaaacgcta tcatcaga 28
<210> 8
<211> 30
<213> Mycoplasma genitalium
<223> обратный праймер для амплификации фрагмента гена гиразы Mycoplasma genitalium GyrB
<400> 8
ccagcactat caccctcaac aatgtaaagt 30
<210> 9
<211> зонд для детекции целевой последовательности внутри фрагмента гена гиразы Mycoplasma genitalium GyrB
<400> 9
cgacgagtta actccctagc ctcgtc 26
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выявления мутаций в участках генов parC и gyrA QRDR, приводящих к резистентности у Mycoplasma genitalium к антибиотикам фторхинолонового ряда | 2021 |
|
RU2778666C1 |
| СПОСОБ ВЫЯВЛЕНИЯ МУТАЦИЙ, ПРИВОДЯЩИХ К РЕЗИСТЕНТНОСТИ У Mycoplasma genitalium И Mycoplasma pneumoniae К МАКРОЛИДНЫМ АНТИБИОТИКАМ | 2017 |
|
RU2646123C1 |
| ДНК-ЧИП ДЛЯ ИДЕНТИФИКАЦИИ ГЕНЕТИЧЕСКИХ ДЕТЕРМИНАНТ АНТИБИОТИКОРЕЗИСТЕНТНОСТИ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИЙ, ПРИВОДЯЩИХ К НАРУШЕНИЮ РЕПРОДУКТИВНЫХ ФУНКЦИЙ ЧЕЛОВЕКА, НАБОР ОЛИГОНУКЛЕОТИДОВ ДЛЯ ИММОБИЛИЗАЦИИ НА ДНК-ЧИПЕ | 2016 |
|
RU2685188C2 |
| Способ определения Helicobacter pylori | 2017 |
|
RU2744190C1 |
| ОЛИГОНУКЛЕОТИДНЫЙ БИОЧИП ДЛЯ ИДЕНТИФИКАЦИИ ГЕНЕТИЧЕСКИХ ДЕТЕРМИНАНТ РЕЗИСТЕНТНОСТИ Neisseria gonorrhoeae К АНТИМИКРОБНЫМ ПРЕПАРАТАМ, НАБОР ОЛИГОНУКЛЕОТИДОВ, ИСПОЛЬЗУЕМЫХ ДЛЯ ИММОБИЛИЗАЦИИ НА БИОЧИПЕ | 2016 |
|
RU2636457C2 |
| ОДНОВРЕМЕННОЕ ОПРЕДЕЛЕНИЕ, ИДЕНТИФИКАЦИЯ И ДИФФЕРЕНЦИАЦИЯ ЭУБАКТЕРИАЛЬНЫХ ТАКСОНОВ С ПОМОЩЬЮ ГИБРИДИЗАЦИОННОГО АНАЛИЗА | 1995 |
|
RU2154106C2 |
| СПОСОБ ОБНАРУЖЕНИЯ МИКРООРГАНИЗМОВ, ПРИНАДЛЕЖАЩИХ ВИДУ MYCOPLASMA PNEUMONIAE И/ИЛИ MYCOPLASMA GENITALIUM | 2010 |
|
RU2575075C2 |
| СПОСОБ ОБНАРУЖЕНИЯ НАЛИЧИЯ МИКРООРГАНИЗМОВ В БИОЛОГИЧЕСКОМ ОБРАЗЦЕ | 2007 |
|
RU2435865C2 |
| Способ выявления ДНК микроорганизмов класса Mollicutes в крови и других биоматериалах методом ПЦР-РВ | 2023 |
|
RU2831277C1 |
| СПОСОБ ДИФФЕРЕНЦИАЦИИ ШТАММОВ БАКТЕРИЙ ПО ГЕНУ РИБОСОМАЛЬНОЙ РНК | 2008 |
|
RU2386695C1 |
Изобретение относится к области биотехнологии. Изобретеение представляет собой способ включает в себя выделение ДНК исследуемого образца, включающего ДНК M. genitalium, ПЦР-амплификацию мишеней, включая участок фрагмента гена гиразы указанной M. genitalium GyrB, участок V домена гена 23S рРНК указанной M. genitalium и участок QRDR гена ParC указанной M. genitalium, с флуоресцентной детекцией накопления продуктов амплификации с использованием зондов CGACGAGTTAACTCCCTAGCCTCGTC, Mg23SZwt1-1A и MgParCZwt1, содержащих различные флуорофоры на 5'-концах и гасители – на 3'-концах, с последующим построением кривой накопления продуктов амплификации и с определением k – тангенса угла наклона линейной части кривой накопления продуктов амплификации, F – максимального уровня флуоресцентного сигнала в образце, содержащем M. genitalium и разности десятичного логарифма общей концентрации M. genitalium в исследуемом образце и десятичного логарифма концентрации M. genitalium в исследуемом образце, полученного в результате амплификации ДНК M. genitalium с использованием прямого и обратного праймеров, амплифицирующих мишень, выбранную из участка V домена гена 23S рРНК указанной M. genitalium и участка QRDR гена ParC указанной M. genitalium, при этом, если величина F для фрагмента 23S рРНК составляет менее 15%, или если разность десятичного логарифма общей концентрации M. genitalium в исследуемом образце и десятичного логарифма концентрации M. genitalium в исследуемом образце, полученного в результате амплификации ДНК M. genitalium с использованием прямого и обратного праймеров, амплифицирующих участок V домена гена 23S рРНК M. genitalium, составляет более 0,6, или если k составляет менее 0,9, то делают вывод о наличии в исследуемом образце мутаций, приводящих к резистентности у M. genitalium к макролидным антибиотикам, а если величина F для фрагмента гена ParC составляет менее 15%, или если разность десятичного логарифма общей концентрации M. genitalium в исследуемом образце и десятичного логарифма концентрации M. genitalium в исследуемом образце, полученного в результате амплификации ДНК M. genitalium с использованием прямого и обратного праймеров, амплифицирующих участок QRDR гена ParC M. genitalium, составляет более 1,0, или если k составляет менее 0,6, то делают вывод о наличии в исследуемом образце мутаций, приводящих к резистентности у M. genitalium к фторхинолоновым антибиотикам. Изобретение обеспечивает способ выявления мутаций M. genitalium, использующий ПЦР-РВ, не требующий ни использования дополнительных ферментов, ни осуществления дополнительных стадий анализа, при этом позволяющий выявить наличие у M. genitalium, содержащихся в полученном от пациента исследуемом клиническом материале, мутаций на участке V домена гена 23S рРНК, ассоциированных с резистентностью к макролидным антибиотикам, а также наличие у M. genitalium, содержащихся в полученном от пациента исследуемом клиническом материале, мутаций на участке QRDR гена ParC, ассоциированных с резистентностью M. genitalium к фторхинолоновым антибиотикам. 3 з.п. ф-лы, 2 пр., 3 ил.
1. Способ выявления наличия мутаций, приводящих к резистентности у Mycoplasma genitalium к макролидным и фторхинолоновым антибиотикам, включающий:
(а) выделение из исследуемого клинического материала ДНК, включая ДНК Mycoplasma genitalium;
(б) ПЦР-амплификацию мишеней, включая участок фрагмента гена гиразы указанной Mycoplasma genitalium GyrB, участок V домена гена 23S рРНК указанной Mycoplasma genitalium и участок QRDR гена ParC указанной Mycoplasma genitalium, с флуоресцентной детекцией накопления продуктов амплификации,
(в) построение кривой накопления продуктов амплификации для каждой из указанных мишеней, с указанием по оси абсцисс номера цикла ПЦР, а по оси ординат – величины F и с последующим определением максимального уровня флуоресценции fмакс. для каждого исследуемого образца для следующих упомянутых мишеней: 1) участок V домена гена 23S рРНК указанной Mycoplasma genitalium и 2) участок QRDR гена ParC указанной Mycoplasma genitalium и последующим определением для мишеней участок V домена гена 23S рРНК указанной Mycoplasma genitalium и участок QRDR гена ParC указанной Mycoplasma genitalium максимального уровня флуоресценции Fмакс. во всей постановке, включая положительные контроли, с последующим вычислением величины F = [fмакс./Fмакс.] × 100%, и с последующим определением тангенса угла наклона k линейной части указанной кривой относительно оси x,
(г) определение общей концентрации Mycoplasma genitalium в каждом исследуемом образце путем амплификации фрагмента гена гиразы GyrB, определения значения порогового цикла Ct и вычисления десятичного логарифма указанного значения,
(д) определение концентрации Mycoplasma genitalium в исследуемом образце, полученное в результате амплификации ДНК Mycoplasma genitalium с использованием праймеров, амплифицирующих участок V домена гена 23S рРНК Mycoplasma genitalium, потенциально содержащий мутации, приводящие к резистентности Mycoplasma genitalium к макролидным антибиотикам, с последующим вычислением десятичного логарифма указанной концентрации,
(е) определение концентрации Mycoplasma genitalium в исследуемом образце, полученное в результате амплификации ДНК Mycoplasma genitalium с использованием праймеров, амплифицирующих фрагмент QRDR гена ParC Mycoplasma genitalium, потенциально содержащий мутации, приводящие к резистентности Mycoplasma genitalium к фторхинолоновым антибиотикам, с последующим вычислением десятичного логарифма указанной концентрации,
(ж) вычисление разности десятичного логарифма общей концентрации Mycoplasma genitalium в исследуемом образце, вычисленного на этапе (г), и десятичного логарифма концентрации Mycoplasma genitalium в исследуемом образце, полученного в результате амплификации ДНК Mycoplasma genitalium с использованием праймеров, амплифицирующих участок V домена гена 23S рРНК Mycoplasma genitalium, вычисленного на этапе (д),
(з) вычисление разности десятичного логарифма общей концентрации Mycoplasma genitalium в исследуемом образце, вычисленного на этапе (г), и десятичного логарифма концентрации Mycoplasma genitalium в исследуемом образце, полученного в результате амплификации ДНК Mycoplasma genitalium с использованием праймеров, амплифицирующих фрагмент QRDR гена ParC Mycoplasma genitalium, вычисленного на этапе (е),
причем в качестве праймеров, амплифицирующих участок V домена гена 23S рРНК Mycoplasma genitalium, используют прямой праймер Mg23S-1992f последовательности CCATCTCTTGACTGTCTCGGCTAT (SEQ ID NO: 1) и обратный праймер Mg23S-2138r последовательности CCTACCTATTCTCTACATGGTGGTGTT (SEQ ID NO: 2), при этом для детекции целевой последовательности, располагающейся внутри участка связывания указанных праймеров, используют зонд Mg23SZwt1-1A последовательности ACGGGGTCTTTCC (SEQ ID NO: 3), где указанный зонд содержит флуорофор (флуоресцентную метку) на 5'-конце и гаситель – на 3'-конце,
в качестве праймеров, амплифицирующих фрагмент QRDR гена ParC Mycoplasma genitalium, используют прямой праймер MG-PARC-A последовательности TGGGCTTAAAACCCACCACT (SEQ ID NO: 4) и обратный праймер MG-PARC-B последовательности CGGGTTTCTGTGTAACGCAT (SEQ ID NO: 5), при этом для детекции целевой последовательности, располагающейся внутри участка связывания указанных праймеров, используют зонд MgParCZwt1 последовательности CATCATAAATGGAACTAT (SEQ ID NO: 6), где указанный зонд содержит флуорофор (флуоресцентную метку) на 5'-конце и гаситель – на 3'-конце,
а в качестве праймеров, амплифицирующих фрагмента гена гиразы Mycoplasma genitalium GyrB, используют прямой праймер последовательности CCCACAAGAAGCAAACGCTATCATCAGA (SEQ ID NO: 7) и обратный праймер последовательности CCAGCACTATCACCCTCAACAATGTAAAGT (SEQ ID NO: 8), при этом для детекции целевой последовательности, располагающейся внутри участка связывания указанных праймеров, используют зонд последовательности CGACGAGTTAACTCCCTAGCCTCGTC (SEQ ID NO: 9), содержащий флуорофор (флуоресцентную метку) на 5'-конце и гаситель – на 3'-конце,
и причем амплификацию проводят по следующей программе:
1-й этап: 95°С в течение 15 минут – 1 цикл;
2-й этап: 95°С в течение 5 секунд, 60°С в течение 20 секунд, 72°С в течение 15 секунд – 5 циклов;
3-й этап: 95°С в течение 5 секунд, 60°С в течение 20 секунд с детекцией флуоресцентного сигнала, 72°С в течение 15 секунд – 40 циклов,
при этом,
если величина F для фрагмента 23S рРНК составляет менее 15%, или если разность, вычисленная на этапе (ж), составляет более 0,6, или если k составляет менее 0,9, то делают вывод о наличии в исследуемом образце мутаций, приводящих к резистентности у Mycoplasma genitalium к макролидным антибиотикам,
а если величина F для фрагмента гена ParC составляет менее 15%, или если разность, вычисленная на этапе (з), составляет более 1,0, или если k составляет менее 0,6, то делают вывод о наличии в исследуемом образце мутаций, приводящих к резистентности у Mycoplasma genitalium к фторхинолоновым антибиотикам.
2. Способ по п. 1, где гаситель в последовательности SEQ ID NO: 3 представляет собой BHQ-1, а флуорофор представляет собой FAM.
3. Способ по п. 1, где гаситель в последовательности SEQ ID NO: 6 представляет собой BHQ-1, а флуорофор представляет собой R6G.
4. Способ по п. 1, где гаситель в последовательности SEQ ID NO: 9 представляет собой BHQ-2, а флуорофор представляет собой ROX.
| СПОСОБ ВЫЯВЛЕНИЯ МУТАЦИЙ, ПРИВОДЯЩИХ К РЕЗИСТЕНТНОСТИ У Mycoplasma genitalium И Mycoplasma pneumoniae К МАКРОЛИДНЫМ АНТИБИОТИКАМ | 2017 |
|
RU2646123C1 |
| КОЛЕСНИКОВА Е.А | |||
| и др | |||
| Молекулярно-биологическая характеристика бактерий родов Ureaplasma и mycoplasma, ассоциированных с заболеваниями урогенитального тракта (обзор), Медиаль, N2 (20), ноябрь, 2017, с.57-64 | |||
| JERGEN S., et al | |||
| Azithromycin treatment failure in Mycoplasma genitalium-positive patients with Nongonococcal | |||
Авторы
Даты
2020-07-02—Публикация
2019-11-15—Подача