Изобретение относится к биотехнологии, а именно к молекулярной биологии, и может быть использовано в медицине, ветеринарии, клинической лабораторной диагностике для выявления ДНК бактерий рода Leptospira в биологических образцах, а также для решения научно-исследовательских задач по изучению данного микроорганизма.
Лептоспироз - острое инфекционное заболевание человека и животных, которое регистрируется в Российской Федерации повсеместно, где ежегодно выявляется от 1,5 до 2,5 тысяч заболеваний людей этой инфекцией (Батанова В.В., Каршин С.П., Веревкина М.Н. Суспензионный антигенный лептоспирозный диагностикум // Ветеринарная патология. - 2016. - №1. - С. 35-42.). Лептоспироз занимает первое место среди зоонозных инфекций по широте распространения очагов на территории России и продолжает стоять в ряду распространенных зоонозных природно-очаговых инфекций (Соболева Г.Л. Актуальные вопросы лептоспироза людей и животных / Г.Л. Соболева, Ю.В. Ананьина, И.В. Непоклонова // Российский ветеринарный журнал. - 2017. - №8. - С. 13-17).
Возбудитель лептоспироза - бактерии рода Leptospira. Заболевание вызывают патогенные геномовиды лептоспир, входящие в состав вида L. interrogans s.l., а также так называемые промежуточные виды, способные служить этиологическим агентом лептоспироза при определенных условиях, - это лептоспиры, относящиеся к виду L. biflexa s.l., но по геномным свойствам отличающиеся как от типичных патогенных, так и от сапрофитных видов (Perolat Р, Chappel RJ, Adler В, Baranton G, Bulach DM, Billinghurst ML, Letocart M, Merien F, Serrano MS. Leptospira fainei sp.nov., isolated from pigs in Australia // Int J Syst Bacteriol. - 1998. - V. 48 Pt 3. - P. 851-8). В странах с тропическим и субтропическим климатом частота выявления у пациентов с клиническим диагнозом лептоспироз лептоспир промежуточных видов достигает высоких значений, в ряде случаев доминируя над частотой выявления типичных патогенных лептоспир (Balamurugan V, Gangadhar NL, Mohandoss N, Thirumalesh SR, Dhar M, Shome R, Krishnamoorthy P, Prabhudas K, Rahman H. Characterization of leptospira isolates from animals and humans: phylogenetic analysis identifies the prevalence of intermediate species in India // Springerplus. - 2013. - V. 2. -P. 362. doi: 10.1186/2193-1801-2-362; Chiriboga J, Barragan V, Arroyo G, Sosa A, Birdsell DN, Espana K, Mora A, Espin E, Mejia ME, Morales M, Pinargote C, Gonzalez M, Hartskeerl R, Keim P, Bretas G, Eisenberg JN, Trueba G. High Prevalence of Intermediate Leptospira spp.DNA in Febrile Humans from Urban and Rural Ecuador // Emerg Infect Dis. - 2015. - V. 12. - P. 2141-7. doi: 10.3201/eid2112.140659). С учетом активных миграционных процессов населения на современном этапе и риска его заражения за пределами РФ, выявление лептоспир этой группы является также актуальным. Важным элементом эффективности лабораторной диагностики лептоспироза при этом является дифференциация лептоспир, принадлежащих к группам патогенных и промежуточных от группы непатогенных, или сапрофитных, с одной стороны, и полный охват всего видового разнообразия лептоспир, ассоциированных с возникновением лептоспироза, - с другой, что позволяет реализовать предлагаемое изобретение, с помощью которого возможно детектировать следующие геномовиды: патогенные, - Leptospira santarosai, L. kirschneri, L. noguchii, L. alexendari, L. interrogans, L. alstoni, L. weilii, L. borgpetersenii и промежуточные, - L. kmetyi, L. mayottensis, L. inadai, L. fainei, L. licerasiae, L.wolffii, L. broomii.
Основным недостатком существующих наборов для детекции лептоспир в биологическом материале методом ПЦР-РВ является их недостаточная чувствительность, связанная с высоким внутривидовым и внутриродовым генетическим разнообразием лептоспир, перечень вновь выявляемых видов которых ежегодно растет (Vincent AT, Schiettekatte О, Goarant С, Neela VK, Bemet E, Thibeaux R, Ismail N, Mohd Khalid MKN, Amran F, Masuzawa T, Nakao R, Amara Korba A, Bourhy P, Veyrier FJ, Picardeau M. Revisiting the taxonomy and evolution of pathogenicity of the genus Leptospira through the prism of genomics. // PLoS Negl Trop Dis. -2019. - 23;13(5):e0007270), и высокая вариабельность генома лептоспир обусловливает ситуацию, когда впервые установленные методом секвенирования нуклеотидные последовательности, доступные для ознакомления в базе данных GenBank Национального центра биотехнологической информации США или полученные за счет собственных ресурсов при секвенировании штаммов собственной научной коллекции позволяют выявить ситуацию несоответствия (сходство менее 90%) нуклеотидных последовательностей праймеров и зондов искомой нуклеотидной последовательности, используемой в качестве мишени.
Известно большое число наборов, включающие два праймера и зонд, предназначенных для выявления Leptospira с помощью метода 1ГЦР в реальном времени, в которых в качестве мишени для праймеров и зонда используются различные гены (таблица 1). Анализ всех доступных в литературе к моменту исследования мишеней для амплификации ДНК возбудителей рода Leptospira показал, что их возможное использование в целях рутинной лабораторной диагностики лептоспироза потенциально не позволяет достичь достаточного (в пределах 95-100%) уровня специфичности и чувствительности ПЦР-РВ. Основную проблему при этом составляет недостаточная для успешной детекции идентичность нуклеотидных последовательностей (различия составляют 20% и более) праймеров и зонда, с учетом того, что снижение идентичности этих последовательностей друг другу до 99% и менее влечет снижение чувствительности и специфичности ПЦР-РВ вплоть до полного отсутствия результативности. Характер и степень этих различий описаны в графе «Недостатки» таблицы 1.

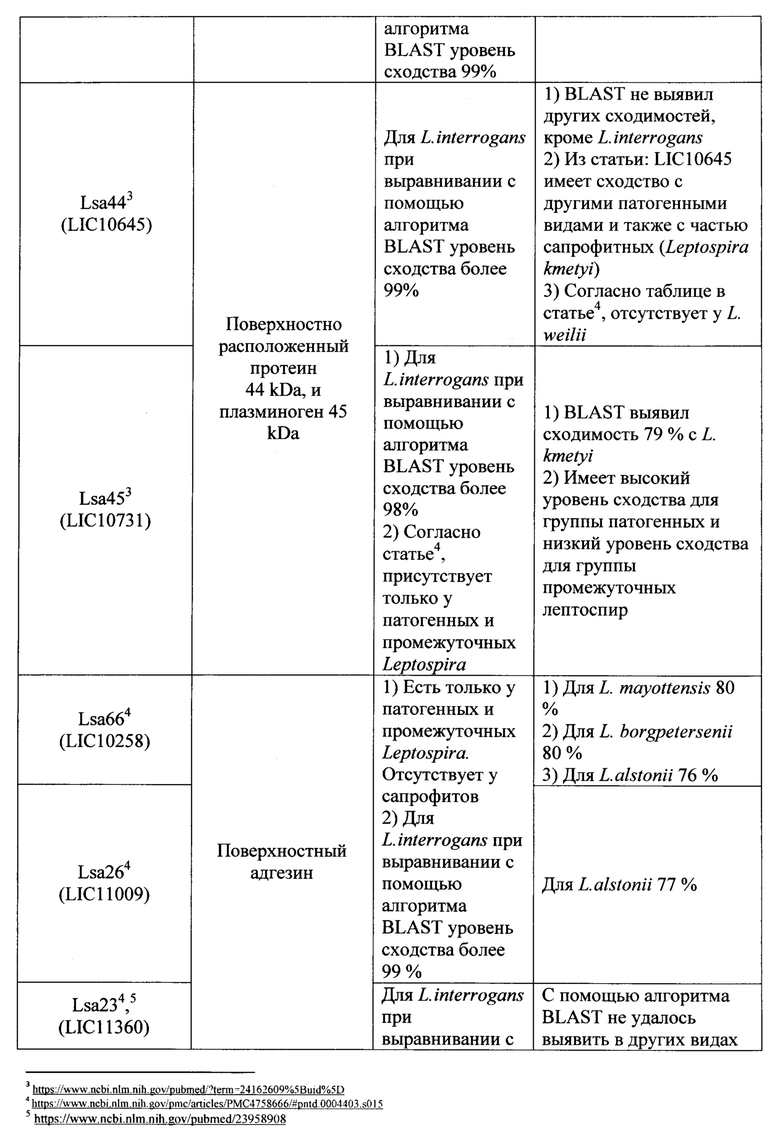
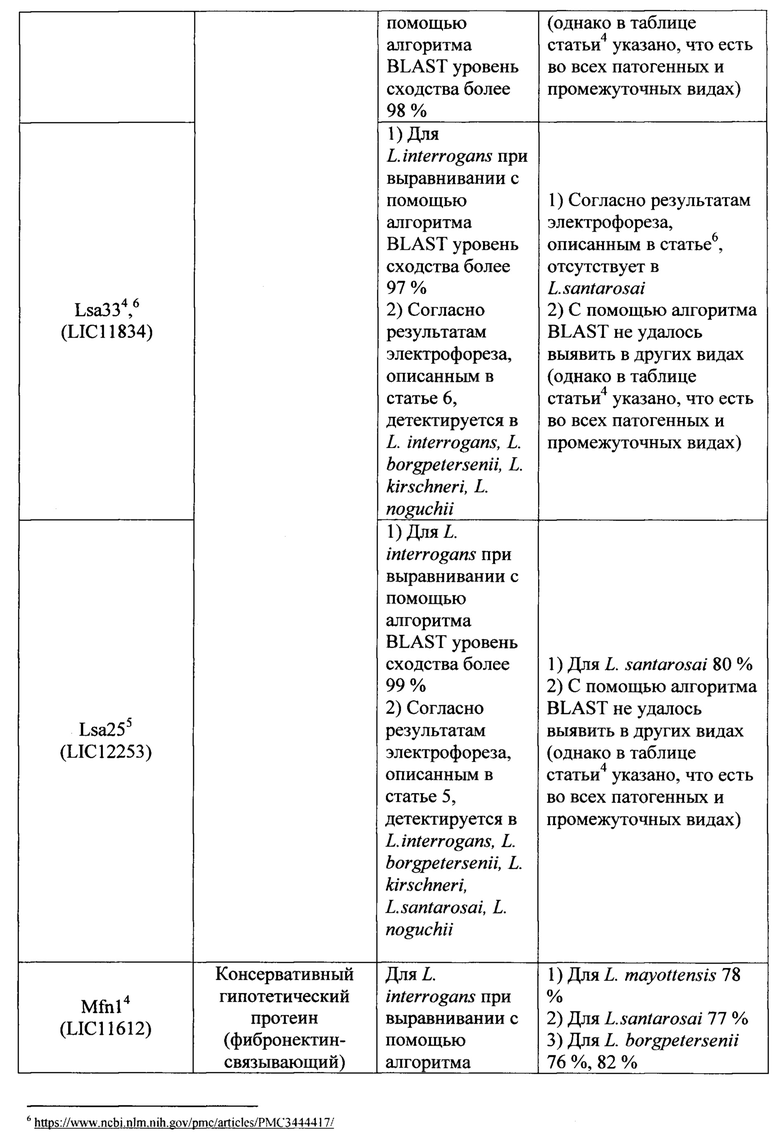
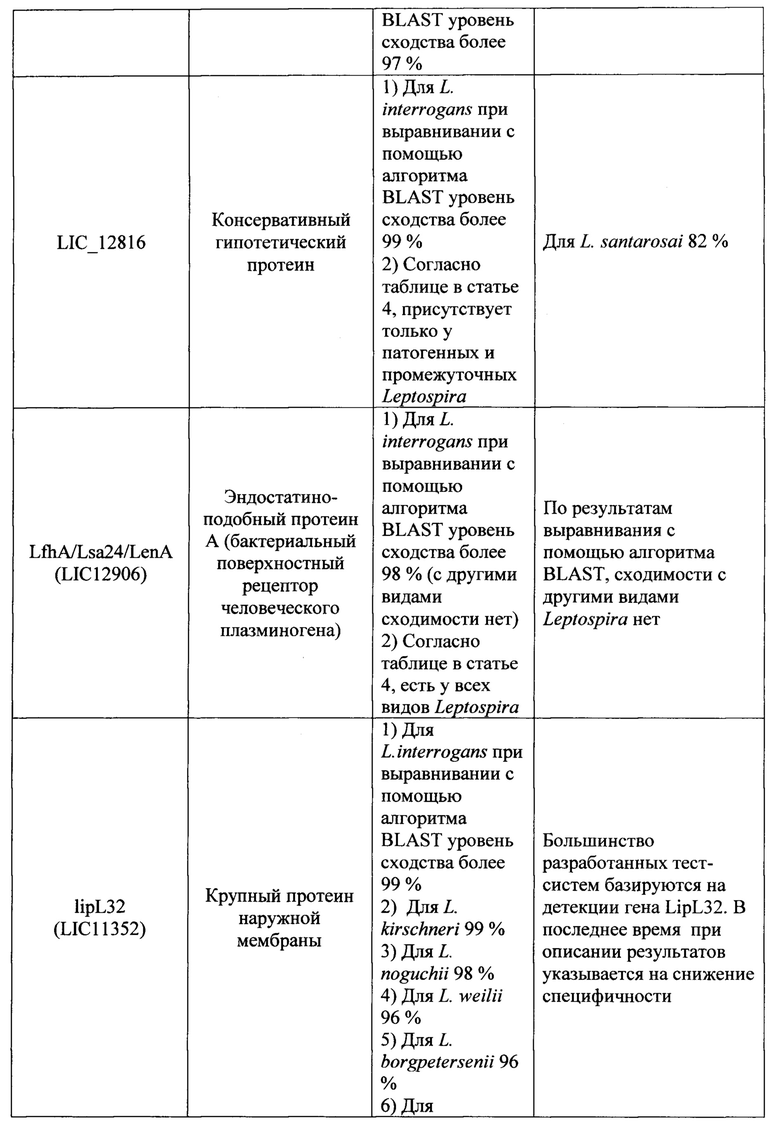
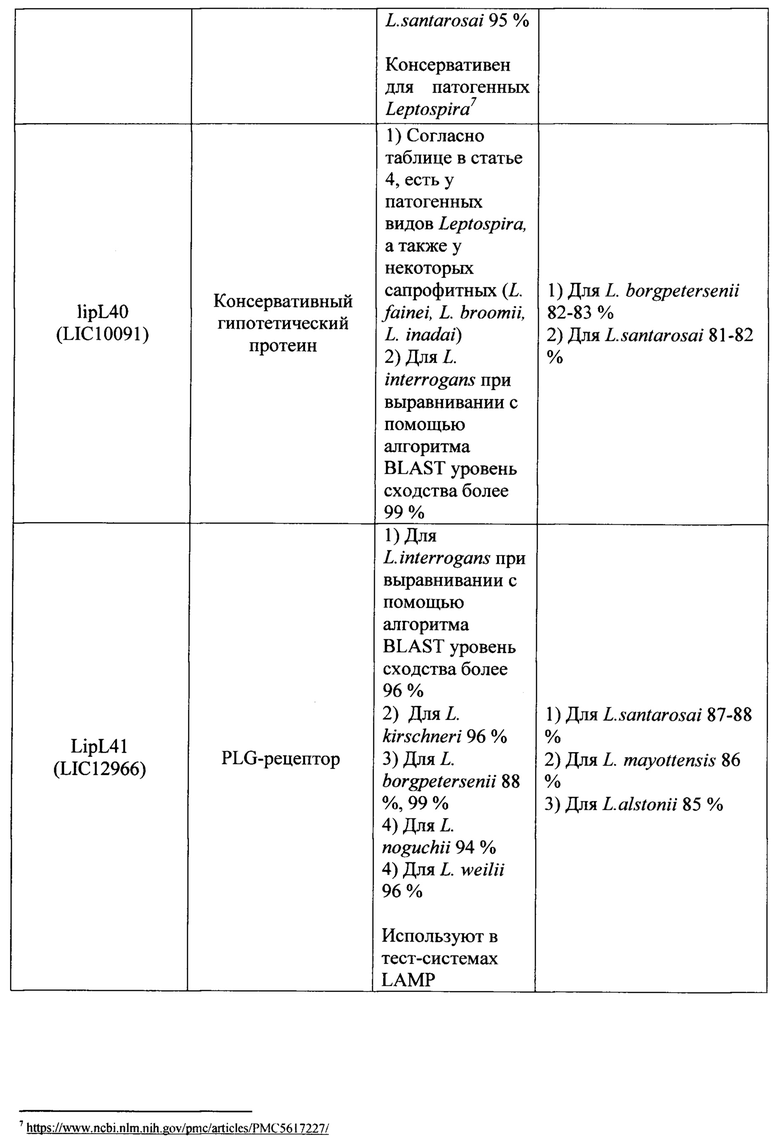
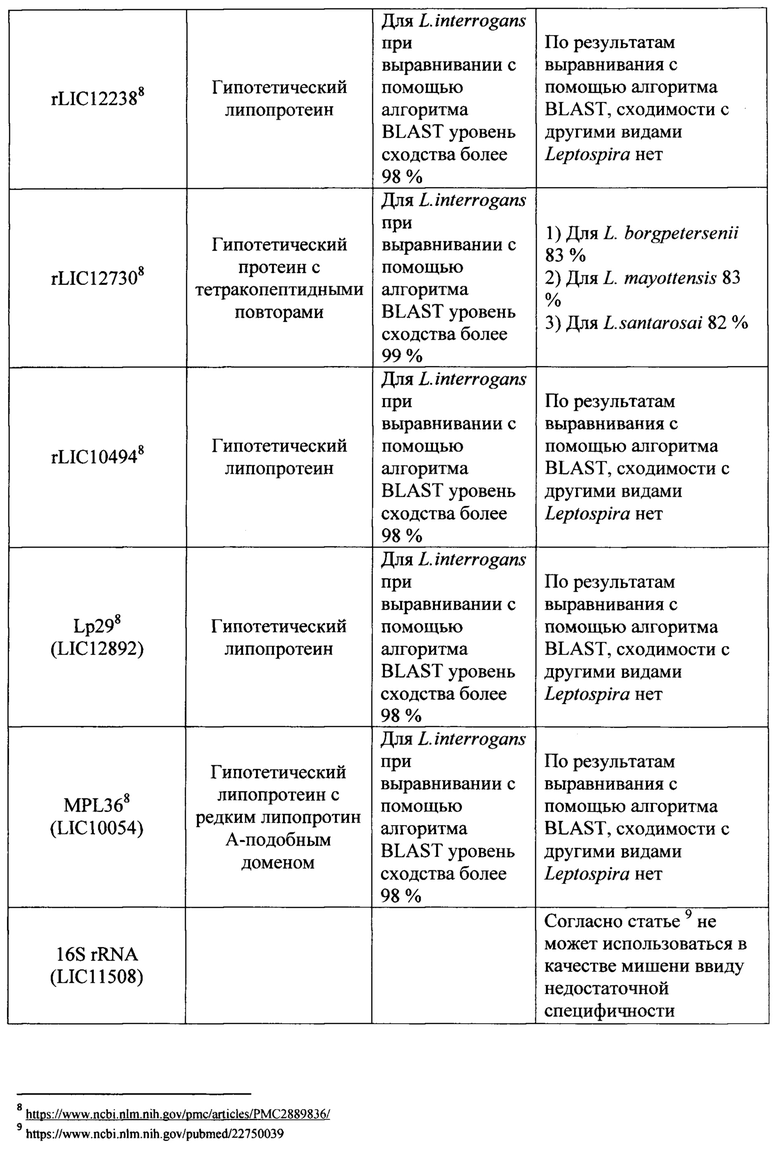
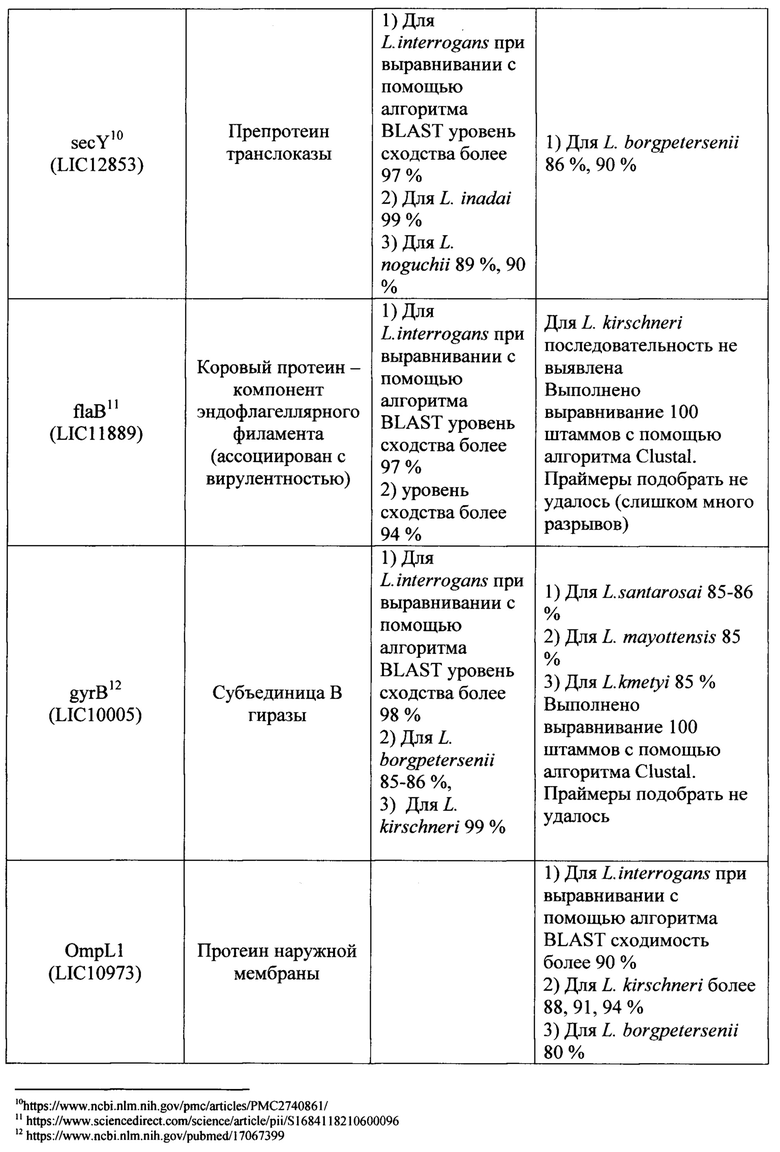
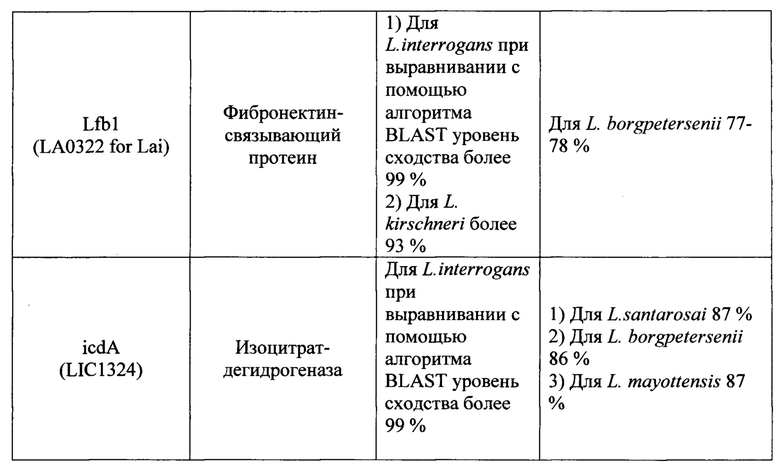
Ряд перспективных мишеней, как например, ген LipL32 на данном этапе не оправдывает широкого распространения в целях диагностики, т.к. на момент создания известных наборов праймеров и зонда данные о нуклеотидных последовательностях отдельных генов и полных геномов лептоспир были весьма скудными. За 2018-2019 гг. база данных Национального центра биотехнологической информации NCBI (https://www.ncbi.nlm.nih.gov) пополнились десятками полногеномных последовательностей представителей рода Leptospira, что позволяет выявить несоответствие существующих наборов праймеров и зонда требованиям специфичности набора вследствие больших различий (сходство менее 90%) фрагментов генов, являющихся мишенью и локусами отжига праймеров и зонда, для разных штаммов в группе диагностически значимых геномовидов рода Leptospira.
Существующие в России коммерциализированные диагностические тест-системы для выявления лептоспир методом ГТЦР в режиме реального времени (ПЦР-РВ) не позволяют выявлять группу промежуточных видов лептоспир. Это набор для выявления возбудителя лептоспироза (Leptospira spp.) «Лепто-ИДС» (ООО «Инновационные диагностические системы») http://ids-lab.ru/catalog/pcr-nabory/ptsr-nabory-na-infektsii-v-rezhime-realnogo-vremeni/leptospiroz-leptospi/, и АмплиСенс® Leptospira-FL (ООО «Интерлабсервис»), - в настоящее время снят с производства.
В качестве прототипа выбран набор, амплифицирующий фрагмент гена 16S rRNA (Backstedt ВТ, Buyuktanir О, Lindow J, Wunder EA Jr, Reis MG, Usmani-Brown S, Ledizet M, Ko A, Pal U. Efficient Detection of Pathogenic Leptospires Using 16S Ribosomal RNA. // PLoS One. - 2015. - 10(6): e0128913.
Схема реализации для прототипа схожа со схемой для реализации изобретения: проводится количественная ПЦР в режиме реального времени (ПЦР-РВ). Но прототип обладает более низкой по сравнению с предлагаемым изобретением чувствительностью: 100 ГЭ/мл биологического материала (суспензия органов, кровь, моча, др.) для прототипа, и 10 ГЭ/мл биологического материала - для предлагаемого изобретения. Также предлагаемый авторами прототипа набор позволяет детектировать только патогенные лептоспиры, принадлежащие к виду L. interrogans, при этом промежуточные виды лептоспир, принадлежащие к виду L. biflexa, являющиеся потенциальными этиологическими агентами лептоспироза, не детектируются. Кроме того, прототип реализуется в формате мечения специфического продукта интеркалирующим красителем (SybrGreen), что не подразумевает наличия флуоресцентно-меченого зонда, в отличие от изобретения, где специфический продукт метится за счет флуорофоров флуоресцентно-меченого зонда. Вариант, применяемый в изобретении, позволяет добиваться более высокой специфичности и чувствительности ПЦР-РВ.
Таким образом, никакие из существующих праймеров для детекции Leptospira spp. не отвечают потребностям молекулярной диагностики патогена, так как не позволяют с высокой специфичностью (100%) и чувствительностью (10 ГЭ/мл биологического материала) выявлять одновременно ДНК геномовидов лептоспир, принадлежащих к видам Leptospira interrogans s.l. и L. biflexa s.l., род Leptospira, относящихся к группе патогенных (L. santarosai, L. kirschneri, L. noguchii, L. alexendari, L. interrogans, L. alstoni, L. weilii, L. borgpetersenii) и промежуточных (L. kmetyi, L. mayottensis, L. inadai, L.fainei, L. licerasiae, L.wolffii, L. broomii) в биологическом материале от людей и животных и объектах внешней среды за счет высокой специфичности предлагаемого набора олигонуклеотидных праймеров и флуоресцентно-меченного зонда.
Изобретение направлено на создание набора олигонуклеотидных праймеров и флуоресцентно-меченного зонда для выявления методом ГЩР в режиме реального времени специфического (со степенью сходства 100%) участка генома геномовидов лептоспир, принадлежащих к видам Leptospira interrogans s.l. и L. biflexa s.l., род Leptospira, относящихся к группе патогенных (L. santarosai, L. kirschneri, L. noguchii, L. alexendari, L. interrogans, L. alstoni, L. weilii, L. borgpetersenii) и промежуточных (L. kmetyi, L. mayottensis, L. inadai, L.fainei, L. licerasiae, L.wolffii, L. broomii).
Изобретение позволит осуществлять выявление ДНК геномовидов лептоспир, принадлежащих к видам Leptospira interrogans s.l. и L. biflexa s.l., род Leptospira, относящихся к группе патогенных (L. santarosai, L. kirschneri, L. noguchii, L. alexendari, L. interrogans, L. alstoni, L. weilii, L. borgpetersenii) и промежуточных (L. kmetyi, L. mayottensis, L. inadai, L. fainei, L. licerasiae, L.wolffii, L. broomii) в биологическом материале от людей и животных, в объектах внешней среды, диагностировать лептоспироз, установить источник инфекции в очаге, а также проводить мониторинг за циркуляцией лептоспир на территории РФ.
Технический результат: обеспечение наиболее эффективного выявления ДНК геномовидов лептоспир, принадлежащих к видам Leptospira interrogans s.l. и L. biflexa s.l., род Leptospira, относящихся к группе патогенных (L. santarosai, L. kirschneri, L. noguchii, L. alexendari, L. interrogans, L. alstoni, L. weilii, L. borgpetersenii) и промежуточных (L. kmetyi, L. mayottensis, L. inadai, L.fainei, L. licerasiae, L.wolffii, L. broomii) в биологическом материале от людей и животных и объектах внешней среды за счет высокой специфичности предлагаемого набора олигонуклеотидных праймеров и флуоресцентно-меченного зонда.
Авторами предложены оригинальные последовательности синтетических олигонуклеотидов:
16SleptoN2F 5' - ATGTGATGATGGTACCTGCCT - 3'
16SleptoN2R 5' - ACGCTTGCACCATACGTATTA - 3',
а флуоресцентный зонд -
16SleptoN2Pr 5' - HEX - TAACTACGTGCCAGCAGCC - BHQ - 3',
имеющий конфигурацию TaqMan, несущий флуорохром FAM на 5'-конце и гаситель флуоресценции BHQ-1 на 3'-конце.
Сущность изобретения сводится к следующему.
1) Выбор мишени
Ген 16SrRNA кодирует синтез 16S субъединицы рибосомальной РНК лептоспир. Выбор данной мишени обусловлен ее высокой диагностической ценностью, связанной с высокой и постоянной экспрессией в микробной клетке, относительно высокой копийностью в геноме (минимум две копии гена), а также с обширной представленностью нуклеотидных последовательностей гена 16S rRNA в базах данных, что позволяет реализовать задачу подбора более специфичных праймеров и зонда с целью охвата всех диагностически значимых лептоспир - представителей группы патогенных и промежуточных, исключая группу свободноживущих.
2) Множественное выравнивание
Осуществляли сравнение выбранной нуклеотидной последовательности - гена 16S rRNA - с последовательностями других гомологичных генов микроорганизмов близкородственных видов. Для этого использовали подход множественного выравнивания, который позволил выявить консервативные и вариабельные участки гена-мишени. Использовали семейство программ Clustal (W, X, W2), а также пакет программ Vector NTI.
Получены результаты выравнивания групп патогенных и промежуточных лептоспир на примере видов L. interrogans, L. borgpetersenii, L. kirschneri (фигуры 1-3), желтым цветом на нуклеотидной последовательности выделены последовательности праймеров, прямого (forward) и обратного (revers), и зонда (probe)). Результаты демонстрируют идентичность, равную 100% для консенсусных регионов гена 16S rRNA для всех диагностируемых с помощью предлагаемого изобретения геномовидов рода Leptospira, на основании сравнения всех описанных и доступных на данный момент в базах данных нуклеотидных последовательностей гена 16S rRNA вида Leptospira spp.что характеризует теоретически предсказанную высокую специфичность и чувствительность праймеров и зонда.
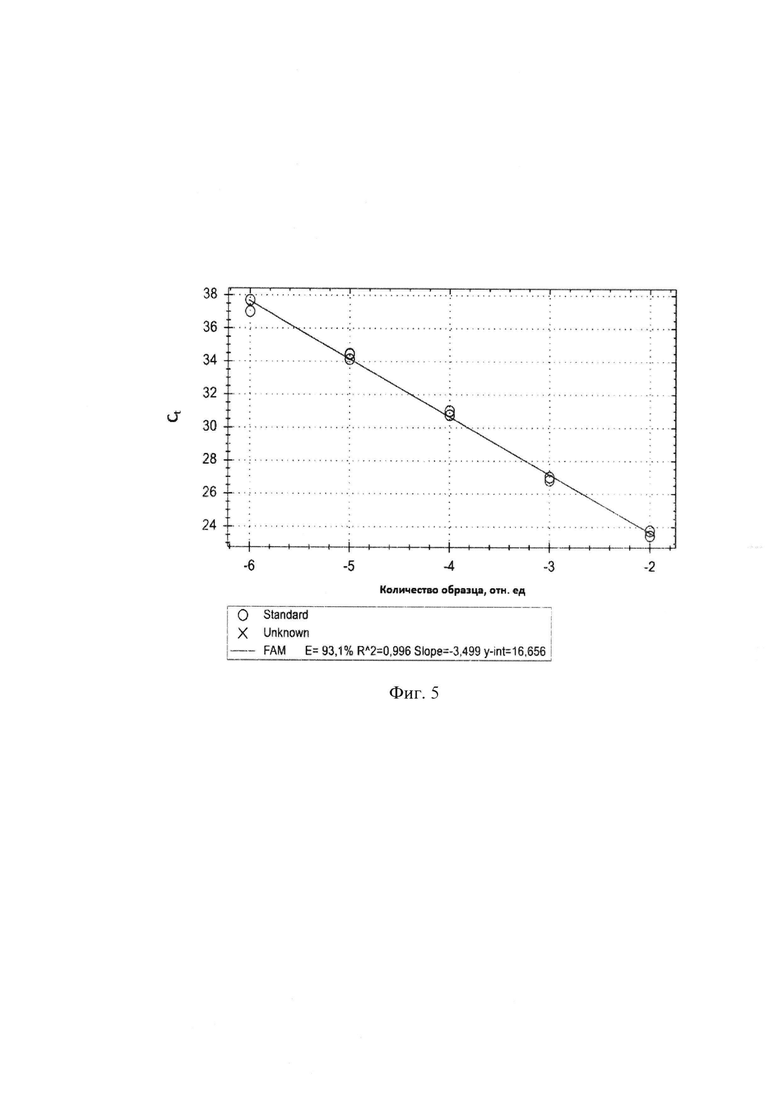
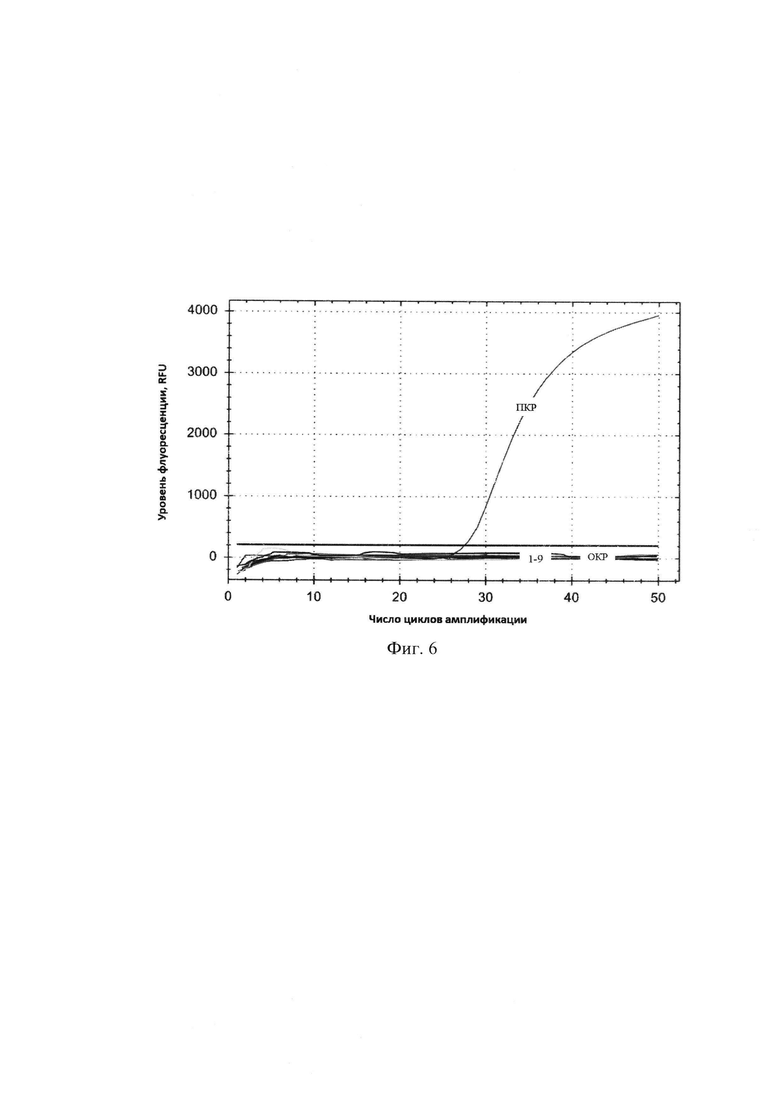
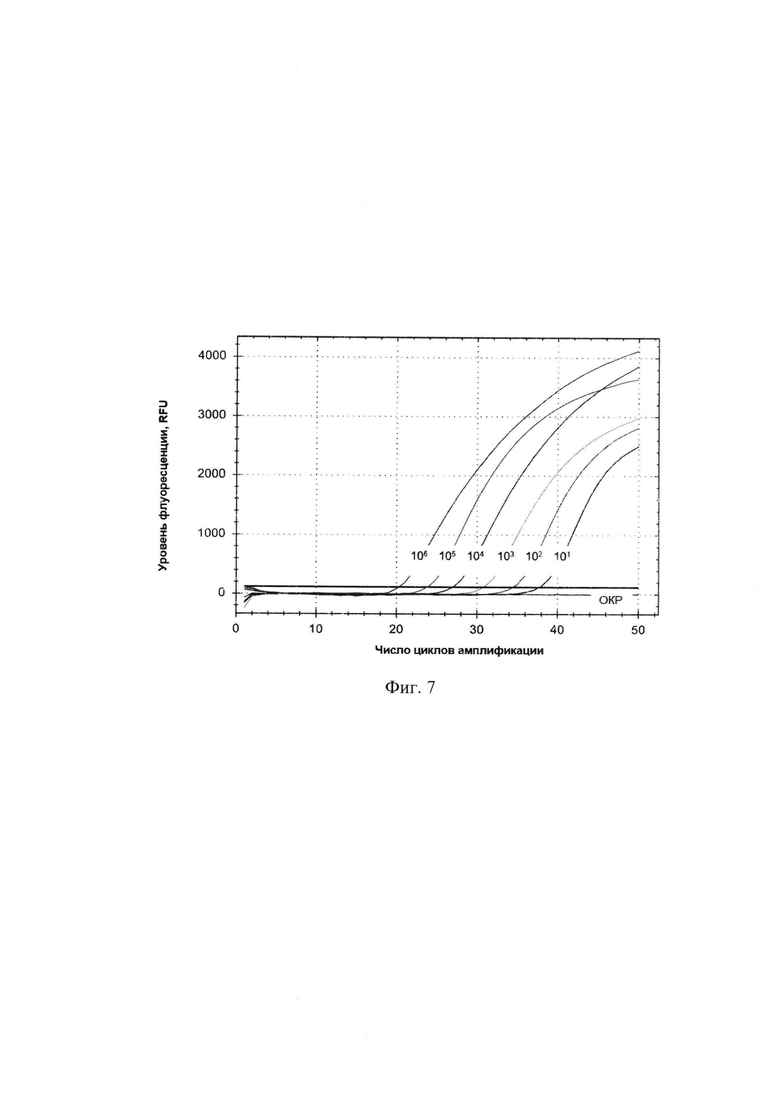
Сущность изобретения поясняется чертежами, где на фигуре 1 представлены результаты множественного выравнивания последовательности гена 16S Leptospira interrogans (100 штаммов), на фигуре 2 - результаты множественного выравнивания последовательности гена 16S Leptospira borgpetersenii (93 штамма), на фигуре 3 - результаты множественного выравнивания последовательности гена 16S Leptospira kirschneri (46 штаммов), на фигуре 4 - кинетические кривые, полученные в результате амплификации гена 16S rRNA L. interrogans в концентрациях от 105 до 101 ГЭ/мл, на фигуре 5 - стандартная кривая, полученная в результате амплификации гена 16S rRNA, на фигуре 6 - Кинетическая кривая, характеризующая контроль специфичности набора для амплификации фрагмента гена 16S rRNA, на фигуре 7 - кинетические кривые, полученные в ходе проведения ПЦР-РВ с ДНК Leptospira spp. в концентрациях от 101 до 106 ГЭ/мл крови.
3) Подбор праймеров и зонда, характеристика набора праймеров и зонда и участка амплифицируемой геномной последовательности
При отборе праймеров соблюдался ряд установленных эмпирических требований, выполнение которых позволяет добиться высокой специфичности и эффективности амплификации (Li, K. Primer Design for RT-PCR / K. Li, A. Brownley // Methods in Molecular Biology - 2010. - Vol. 630. - P. 271-299.):
- длина амшшфицируемого фрагмента 70-180 п.н.;
- длина праймеров составляет 18-25 п.н.;
- GC-состав находится в пределах 40-60%;
- значения Tm (температуры плавления) праймеров должны находиться в диапазоне 54-61°С;
- разница значений Tm праймеров не должна превышать 4-5°С;
- значения Tm для зондов типа TaqMan составляют 58-63°С.
С помощью программы Vector NTI 11.0 (Invitrogen, США) определялись основные характеристики подобранных олигонуклеотидных праймеров и зондов.
Праймеры, зонд и ампликон охарактеризованы, исходя из позиционирования на гене 16S rRNA типового штамма Pomona DB37, вид L. interrogans (Genbank, accession: JQ988858.1), и имеют характеристики, указанные в таблице 2.

Для каждой последовательности праймера и зонда определялись температуры плавления (Tm), GC-состав, позиция в гене. Праймеры фланкируют амплифицируемый фрагмент, представленный последовательностью:
5'-ATGTGATGATGGTACCTGCCTAAAGCACCGGCTAACTACGTGCCA GCAGCCGCGGTAATACGTATGGTGCAAGCGT-3' длиной 74 п.н., расположенной на гене в позиции 393-467 п.н.
4) ПЦР в режиме реального времени
Для оценки специфичности и чувствительности праймеров использовались следующие образцы.
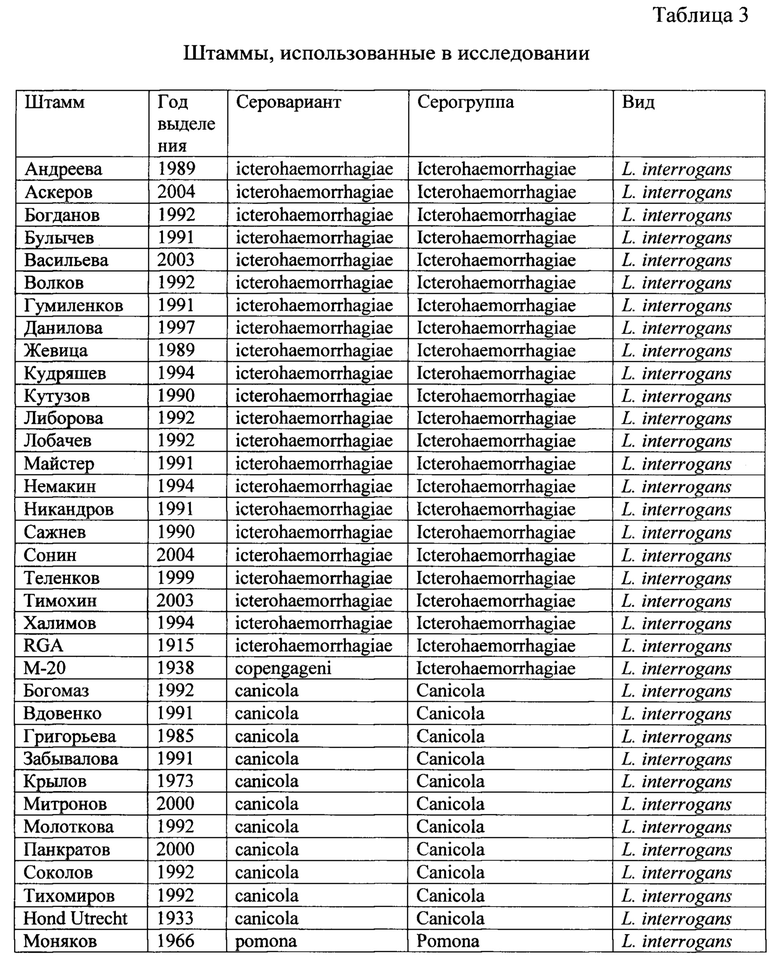
1) Штаммы лептоспир: Использованы 48 штаммов лептоспир из рабочей коллекции лептоспир лаборатории зооантропонозных инфекций ФБУН НИИЭМ им. Пастера оригинальные штаммы лептоспир, выделенные из крови людей и животных, больных лептоспирозом, в 1957-2003 годах, и типовые штаммы лептоспир. Исследована ДНК 48 штаммов Leptospira interrogans, в том числе геномовид Leptospira interrogans, серогрупп Pomona (7 штаммов), Canicola (10 штаммов) и Icterohaemorrhagiae (21 штамм), геномовид Leptospira kirschneri серогруппа Grippotyphosa (6 штаммов), геномовид Leptospira borgpetersenii серогруппа Tarassovi (4 штамма), находящихся в коллекции штаммов НИИЭМ им. Пастера. Список штаммов приведен в таблице 3.
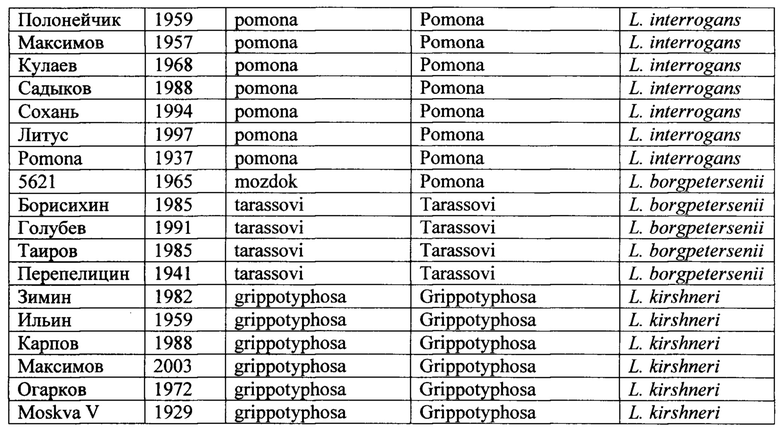
Преимущественно перечисленные штаммы ранее охарактеризованы в различных исследованиях методами контроля:
Зуева Е.В., Стоянова Н.А., Токаревич Н.К., Тотолян А.А. MALDI-TOF масс-спектрометрический анализ штаммов Leptospira spp., используемых в серодиагностике лептоспироза. // Журнал микробиологии, эпидемиологии и иммунобиологии. 2015. №6. С. 28-36.
Зуева Е.В., Стоянова Н.А., Токаревич Н.К. Применение метода MALDI-TOF масс-спектрометрии для контроля коллекции штаммов Leptospira, используемых в серодиагностике лептоспироза. // Молекулярная диагностика: сб. тр. VIII Всерос. науч. - практ. конф. с междунар. участием / Под ред. В.И. Покровского. М., 2014. Т. 1. С. 510-511
Останкова Ю.В., Семенов А.В., Стоянова Н.А., Токаревич Н.К., Любимова Н.Е., Петрова О.А., Ананьина Ю.В., Петров Е.М. // Типирование штаммов Leptospira spp. на основе 16S рРНК Журнал эпидемиологии, микробиологии и иммунобиологии. 2016. №1, С. 35-39
Ваганова А.Н., Фрейлихман О.А., Стоянова Н.А., Токаревич Н.К. Межвидовой полиморфизм рестрикционных профилей гена LipL32 патогенных лептоспир // Бюллетень экспериментальной биологии и медицины. 2010. Т. 149, №5. С. 543-545.
2) Образцы тотальной ДНК из биологического материала:
- ДНК из органов (почки, печень, селезенка) мелких диких млекопитающих, отловленных в пригородах Санкт-Петербурга (n=150);
- ДНК из крови здоровых доноров (n=20);
- ДНК из крови людей с лабораторно подтвержденным диагнозом лептоспироз (реакция микроагглютинации с двукратным возрастанием титра) (n=50);
- ДНК из крови интактных морских свинок (n=10);
- ДНК из мочи собак с лабораторно подтвержденным диагнозом лептоспироз (реакция микроагглютинации с двукратным возрастанием титра) (n=20);
3) ДНК гетерологичных микроорганизмов (Escherichia coli, Borrelia burgdorferi s.l., Rickettsia prowazekii, Rickettsia conorii, Brucella abortus, Mycoplasma genitalium, Mycoplasma hominis, Chlamydia trachomatis, Trichomonas vaginalis, Ureaplasma urealiticum, Ureaplasma parvum, Gardnerella vaginalis, Candida albicans, Klebsiella oxytoca, Coxiella burnetii)/
Изобретение реализуется следующим образом.
Пример 1. Проведение реакции ПЦР-РВ
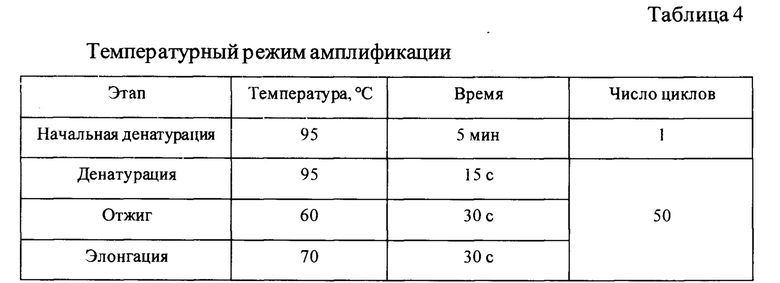
ПЦР-РВ осуществлялась в амлификаторе CFX96 Touch Real-Time («Bio-Rad Laboratories», США) при следующем температурном режиме, представленном в таблице 4.
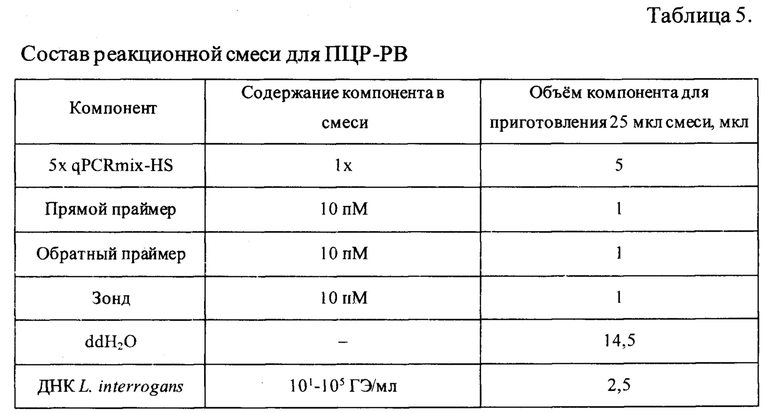
Объем смеси для амплификации ДНК лептоспир составлял 25 мкл и включал в свой состав реакционную смесь qPCRmix-HS («Евроген», Россия), синтезированные олигонуклеотидные праймеры и зонд («Beagle biotechnology)), Россия), деионизированную воду (ddH2O), а также исследуемую ДНК. Оптимизированный состав смеси для амплификации представлен в таблице 5. Для амплификации положительного контроля и построения стандартной кривой использовались последовательные 10-кратные разведения ДНК (от 10-6 до 10-1), выделенной из бактериальной суспензии L. interrogans с начальной концентрацией 108 ГЭ/мл. Полученным разведениям ДНК соответствовали концентрации от 101 до 106 ГЭ/мл.
Детекция уровней флуоресценции проводилась в конце стадии отжига праймеров по каналу FAM.
Пример 2. Контроль результатов, полученных с помощью предлагаемого изобретения
1) Определение показателей эффективности ПЦР-РВ с разработанным набором праймеров и зонда
Определение показателей эффективности набора проводили с помощью полученных в результате амплификации кривых накопления флуоресцентного сигнала, а также стандартных кривых. С помощью кривых накопления оценивался пороговый цикл амплификации, а также аналитическая чувствительность разработанных систем (минимальное детектируемое количество ДНК в образце). Критериями оценки эффективности амплификации служили показатели, характеризующие стандартную кривую: значения среднего уровня корреляции, средние значения наклона стандартной кривой, а также процентные показатели эффективности реакции, вычисляемые программой амплификатора автоматически.
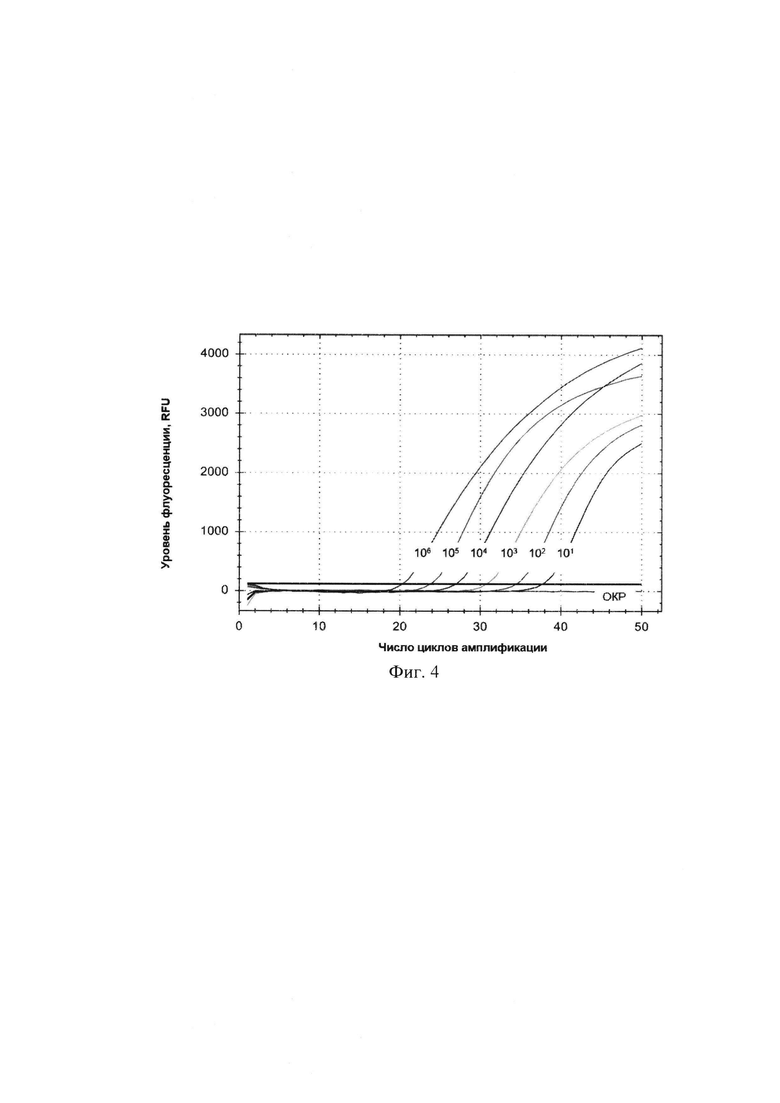
На фигуре 4 представлены кривые накопления флуоресцентного сигнала, полученные в результате амплификации фрагмента гена 16S rRNA. В диапазоне концентраций 101-105 ГЭ/мл целевой ДНК в пробе, кривые накопления имели сигмовидную форму, наблюдалась тенденция выхода на плато. Аналитическая чувствительность набора составила 101 ГЭ/мл. На фигуре 5 представлена стандартная кривая - график зависимости показателя Ct стандартных разведений от логарифма концентрации стандарта, построенный в результате амплификации данного фрагмента ДНК.
Линейность полученной стандартной кривой отражает значение среднего уровня корреляции (R2), которое должно находится в диапазоне 0,98-1 (Real-time PCR handbook [Электронный ресурс] / Life technologies. - Режим доступа: http://www.gene-quantification.com/real-time-pcr-handbook-life-technologies-update-flr.pdf). В результате амплификации фрагмента гена 16S rRNA показатель R2 составил 0,988, что свидетельствует высокому уровню корреляции между абсолютными концентрациями ДНК L. interrogans и значениями Ct. Для получения воспроизводимых результатов, эффективность амплификации (Е) должна достигать 90% - 110%, что соответствует значениям среднего уровня наклона стандартной кривой (Slope) от -3,58 до -3,10.
Эффективность реакции составила 93,1%, что соответствует тангенсу угла наклона -3,499 и коэффициенту корреляции 0,988.
2) Результаты контроля специфичности разработанного набора В результате контроля специфичности разработанного набора были получены кривые накопления флуоресцентного сигнала, представленные на фигуре 6. Номерами 1-9 обозначены штаммы соответствующих гетерологичных видов микроорганизмов: E.coli, U. urealiticum, U. parvum, K. pneumoniae, K. oxytoca, С.burnetii, М. hominis, В. burgdorferi, а также Т. vaginalis.
Проверка специфичности показала отсутствие перекрестных реакций с ДНК гетерологичных видов микроорганизмов, а также с биологическим материалом, не содержащим L. interrogans, что свидетельствует о внутривидовой консервативности выбранной ДНК-мишени. Полученные результаты также подтверждают высокую специфичность подобранных олигонуклеотидных праймеров и зондов.
Анализ показал высокую специфичность и чувствительность ПЦР-РВ с использованием сконструированного набора праймеров и зонда, что позволяет выявлять в концентрации до 10 ГЭ/мл биологического материала одновременно ДНК геномовидов лептоспир, принадлежащих к видам Leptospira interrogans s.l. и L. biflexa s.l., род Leptospira, относящихся к группе патогенных (L. santarosai, L. kirschneri, L. noguchii, L. alexendari, L. interrogans, L. alstoni, L. weilii, L. borgpetersenii) и промежуточных (L. kmetyi, L. mayottensis, L. inadai, L. fainei, L. licerasiae, L. wolffii, L. broomii) (фигура 7) в отличие от прототипа, обладающего меньшей чувствительностью и не обладающего способностью детектировать лептоспир промежуточной группы.
В отличие от прототипа, чувствительность и специфичность созданного набора апробирована на широкой панели биологических образцов и группе штаммов L. interrogans, представляющих большой набор источников и географических точек выделения.
Разработанный универсальный набор праймеров и зонда и адаптированные для его использования условия ПЦР-РВ позволяет повысить эффективность и точность идентификации возбудителя лептоспироза путем индикации генетического материала L. interrogans в пробах биологического происхождения методом РВ-ПЦР.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ детекции и генотипирования патогенных лептоспир в клинических образцах | 2024 |
|
RU2840144C1 |
| Тест-штамм Leptospira interrogans серогруппы Icterohaemorrhagiae серовара copenhageni для детекции антител к L. icterohaemorrhagiae | 2016 |
|
RU2607006C1 |
| Тест-штамм Leptospira interrogans серогруппы Grippotyphosa серовара grippotyphosa для детекции антител к L. grippotyphosa | 2020 |
|
RU2752978C1 |
| Способ индикации патогенных лептоспир с помощью метода мультиплексной ПЦР | 2024 |
|
RU2836990C1 |
| Тест-штамм Leptospira interrogans серогруппы Canicola серовара canicola для детекции антител к L. canicola | 2018 |
|
RU2707539C2 |
| Тест-штамм Leptospira interrogans серогруппы Icterohaemorrhagiae для детекции антител к L. icterohaemorrhagiae | 2023 |
|
RU2799846C1 |
| НАБОР ДЛЯ ВЫЯВЛЕНИЯ ВОЗБУДИТЕЛЯ КУ-ЛИХОРАДКИ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ (ПЦР-РВ) | 2012 |
|
RU2525059C2 |
| Вирулентный штамм бактерий Leptospira interrogans серогруппы Icterohaemorrhagiae серовара copenhageni, используемый для экспериментального изучения лептоспирозной инфекции | 2021 |
|
RU2768008C1 |
| Способ идентификации сероваров бактерий рода Leptospira методом MALDI-TOF масс-спектрометрии | 2017 |
|
RU2661108C1 |
| ТЕСТ-ШТАММ МИКРООРГАНИЗМА Helicobacter pylori ГКПМ-Оболенск В-7215 ДЛЯ ИНДИКАЦИИ И ИДЕНТИФИКАЦИИ Helicobacter pylori В ОБРАЗЦАХ БИОПТАТОВ СЛИЗИСТОЙ ОБОЛОЧКИ ЖЕЛУДКА ИЛИ ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ | 2015 |
|
RU2595422C1 |








Изобретение относится к биотехнологии и может быть использовано в медицине, ветеринарии, клинической лабораторной диагностике. Предложен набор для выявления возбудителя лептоспироза в биологическом материале методом полимеразной цепной реакции в режиме реального времени (ПЦР-РВ). Набор содержит синтетические олигонуклеотиды: 16SleptoN2F 5' - ATGTGATGATGGTACCTGCCT - 3', 16SleptoN2R 5' - ACGCTTGCACCATACGTATTA - 3'; а также флуоресцентный зонд 16SleptoN2Pr 5' - HEX - TAACTACGTGCCAGCAGCC - BHQ - 3'. Изобретение обеспечивает эффективное выявление ДНК геномовидов лептоспир патогенных и промежуточных групп за счет высокой специфичности. 5 табл., 2 пр., 7 ил.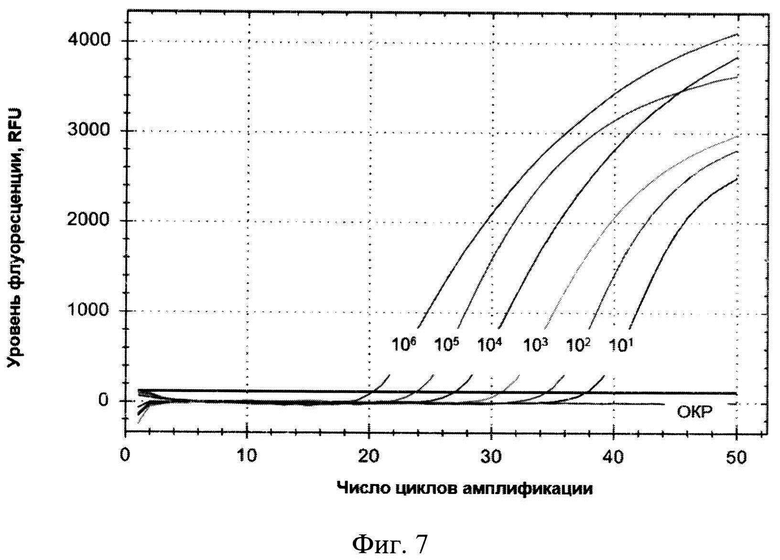
Набор для выявления возбудителя лептоспироза в биологическом материале методом полимеразной цепной реакции в режиме реального времени (ПЦР-РВ), содержащий синтетические олигонуклеотиды и олигонуклеотид, меченный флуоресцентной меткой (флуоресцентный зонд), отличающийся тем, что синтетические олигонуклеотиды имеют следующую структуру:
16SleptoN2F 5' - ATGTGATGATGGTACCTGCCT - 3'
16SleptoN2R 5' - ACGCTTGCACCATACGTATTA - 3',
а флуоресцентный зонд -
16SleptoN2Pr 5' - HEX - TAACTACGTGCCAGCAGCC - BHQ - 3'.
| BACKSTEDT B.T | |||
| et al | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| PLoS One | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Тест-система для выявления ДНК возбудителя лептоспироза (Leptospira spp.) у сельскохозяйственных животных | 2018 |
|
RU2680094C1 |
| FABRICE M | |||
| et al | |||
| A rapid and quantitative method for the detection of Leptospira species in human leptospirosis, FEMS Microbiology Letters, Volume 249, Issue 1, August 2005, p | |||
| Способ подпочвенного орошения с применением труб | 1921 |
|
SU139A1 |
Авторы
Даты
2021-03-03—Публикация
2019-10-31—Подача