ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка притязает на приоритет согласно 35 U.S.C. §119(e) на основании предварительной заявки на выдачу патента США No. 61/114385, поданной 13 ноября 2008, при этом указанная предварительная заявка включена в настоящее описание в виде ссылки в полном объеме.
УКАЗАНИЕ, КАСАЮЩЕЕСЯ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Список последовательностей, прилагаемый к настоящей заявке, представлен в текстовом формате вместо бумажной копии и при этом включен в описание в виде ссылки. Название текстового файла, содержащего список последовательностей 910180_418PC_SEQUENCE_LISTING.txt. Текстовый файл имеет размер 324 KB, создан 14 ноября 2009 и представлен в электронном виде через EFS-Web одновременно с подачей описания.
УРОВЕНЬ ТЕХНИКИ
Область техники, к которой относится изобретение
Настоящее описание, в общем, относится к композициям и способам лечения B-клеточных расстройств и более конкретно к применению CD37-специфичных связывающих молекул в сочетании с ингибиторами mTOR или фосфатидилинозитол-3-киназы (PI3K), включая их композиции, которые действуют синергетически при лечении или профилактике связанных с B-клетками гиперпролиферативных заболеваний, таких как лимфома, карцинома, миелома или тому подобные.
Описание области техники
Иммунная система человека обычно защищает организм от проникновения чужеродных веществ и патогенов. Одним из компонентов иммунной системы являются B-лимфоциты, также называемые B-клетками, которые продуцируют антитела, которые защищают организм в результате связывания и, в некоторых случаях, опосредования распада чужеродного вещества или патогена. Однако в некоторых случаях функции иммунной системы могут нарушаться, что приводит к заболеванию. Например, существует множество злокачественных опухолей, аутоиммунных заболеваний и воспалительных заболеваний, в которые вовлечена неконтролируемая пролиферация B-клеток.
B-клетки можно идентифицировать по молекулам на их клеточной поверхности, таким как CD37. CD37 является высоко гликозилированным белком с молекулярной массой 40-52 кДа, который относится к тетраспаниновому трансмембранному семейству антигенов клеточной поверхности, которые в высокой степени экспрессируются на нормальных продуцирующих антитела B-клетках, но не экспрессируются на пре-B-клетках или плазматических клетках. Кроме нормальных B-клеток почти все злокачественные новообразования B-клеточного происхождения являются позитивными по экспрессии CD37, включая хронический лимфоцитарный лейкоз (CLL), неходжкинскую лимфому (NHL) и лейкоз ворсистых клеток (Moore et al., J. Pathol. 152: 13 (1987); Merson and Brochier, Immunol. Lett. 19: 269 (1988); и Faure et al., Am. J. Dermatopathol. 12: 122 (1990)).
Разработано несколько CD37-специфичных способов иммунотерапии. Мышиное моноклональное IgG1-антитело, специфичное для CD37, MB-1, метили 131I и тестировали в клиническом испытании при лечении NHL (смотри Press et al., J. Clin. Oncol. 7:1027 (1989); Bernstein et al., Cancer Res. (Suppl.) 50:1017 (1990); Press et al., Front. Radiat. Ther. Oncol. 24:204 (1990); Press et al., Adv. Exp. Med. Biol. 303:91 (1991) and Brown et al., Nucl. Med. Biol. 24:657 (1997)).
У антитела MB-1 отсутствуют Fc-эффекторные функции, такие как зависимая от антител клеточная цитотоксичность (ADCC), и «голое» антитело MB-1 не ингибировало рост опухоли в модели ксенотрансплантата in vivo (Buchsbaum et al., Cancer Res. 52: 6476 (1992)). Кроме того, иммуноконъюгат, содержащий адриамицин, связанный с G28-1, другим мышиным моноклональным анти-CD37, вводили мышам, и показано, что интернализуется с внутриклеточным высвобождением адриамицина (смотри Braslawsky et al., Cancer Immunol. Immunother. 33: 367 (1991)). Сконструированный слитый белок, названный малым модульным иммунофармацевтическим продуктом (SMIPTM), направленный к CD37, в настоящее время проходит испытания на человеке (смотри, например, публикации заявок на выдачу патента США 2003/0133939 и 2007/0059306; публикацию PCT № WO 2009/126944).
Хотя было проведено всестороннее исследование основанной на антителах терапии, в данной области сохраняется потребность в альтернативных или улучшенных композициях и способах лечения ассоциированных с B-клетками расстройств или заболеваний.
СУЩНОСТЬ ИЗОБЕРТЕНИЯ
Настоящее изобретение относится к способам, композициям и наборам для применения CD37-специфичных связывающих молекул в сочетании с ингибиторами mTOR или PI3K для уменьшения количества B-клеток или лечения заболевания или расстройства, ассоциированного с аномальной активностью B-клеток.
В одном аспекте настоящее изобретение относится к способу уменьшения количества B-клеток или лечения заболевания или расстройства, ассоциированного с аномальной активностью B-клеток, у субъекта, у которого имеется или предполагается наличие заболевания или расстройства, включающему в себя лечение (т.е. введение) субъекту терапевтически эффективного количества CD37-специфичной связывающей молекулы и терапевтически эффективного количества ингибитора mTOR или PI3K. Предлагаются и описаны в настоящей публикации дополнительные способы по пунктам 2-20.
В другом аспекте настоящее изобретение относится к набору для лечения неходжкинской лимфомы, содержащему: (a) стандартную дозу CD37-специфичной связывающей молекулы и (b) стандартную дозу ингибитора mTOR или PI3K. Предлагаются и описаны в настоящей публикации дополнительные наборы по пункту 22.
В другом аспекте настоящее изобретение относится к композиции, содержащей: (a) CD37-специфичную связывающую молекулу и (b) ингибитор mTOR или фосфатидилинозитол-3-киназы (PI3K). Предлагаются и описаны в настоящей публикации дополнительные композиции по пунктам 24-36.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 показано влияние сочетания CAS-024 и рапамицина на рост клеток Rec-1. Обе молекулы использовали в эквимолярных концентрациях.
На фиг. 2 показано влияние сочетания CAS-024 и рапамицина на рост клеток SU-DHL-6. Обе молекулы использовали в эквимолярных концентрациях.
На фиг. 3A и 3B показаны графики комбинационного индекса (CI) для линий клеток Rec-1 и SU-DHL-6. Значения CI иллюстрируют взаимодействие CAS-024 и рапамицина, указанное на графике против (A) уровней эффекта и (B) среднего CI±95% доверительный интервал для полного диапазона эффекта.
На фиг. 4 показано влияние сочетания CAS-024 и темсиролимуса на рост клеток SU-DHL-6. Обе молекулы использовали в эквимолярных концентрациях.
На фиг. 5 показано влияние сочетания CAS-024 и темсиролимуса на рост клеток Rec-1. Обе молекулы использовали в эквимолярных концентрациях.
На фиг. 6 показаны графики CI сочетания CAS-024 с темсиролимусом для линии клеток SU-DHL-6 против уровней эффекта.
На фиг. 7 показаны графики CI сочетания CAS-024 с темсиролимусом для линии клеток Rec-1 против уровней эффекта.
На фиг. 8 показаны графики CI сочетания CAS-024 с темсиролимусом для линий клеток Rec-1 и SU-DHL-6. Значения CI представляют собой средний CI±95% доверительный интервал для полного диапазона эффекта.
Фиг. 9 представляет собой график CI для сочетания CAS-024 с LY294002 в случае линии клеток SU-DHL-6 против уровней эффекта. Значения представляют собой среднее из трех независимых экспериментов.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение относится к композициям и способам комбинированного применения CD37-специфичных связывающих молекул и ингибиторов mTOR или PI3K для уменьшения количества B-клеток, которые ассоциированы с некоторыми заболеваниями или расстройствами, такими как злокачественная опухоль. Неожиданный результат применения такого сочетания заключается в том, что такие соединения действуют синергетически, что приводит к более сильному снижению количества B-клеток. В связанном аспекте настоящее изобретение относится к способам лечения индивидуума, у которого имеется или у которого предполагается наличие заболевания, ассоциированного с аномальной активностью B-клеток, такого как B-клеточная лимфома, например, B-клеточная неходжкинская лимфома (NHL) или B-клеточный лейкоз, такой как хронический лимфоцитарный лейкоз или тому подобные.
Перед тем, как приступить к более подробному изложению настоящего изобретения, для его понимания может быть полезным знакомство с определениями некоторых терминов, используемых в настоящем описании. Дополнительные определения изложены на протяжении данного описания.
Следует понимать, что в настоящем описании любой диапазон концентраций, диапазон значений в процентах, диапазон отношений или область целых значений включает любое целое число в указанном диапазоне и в соответствующих случаях его дробную часть (такую как одна десятая и одна сотая целого числа), если не указано иное. Также следует понимать, что любой диапазон чисел, указанный в настоящем описании, относящийся к любому физическому признаку, такому как субъединицы полимера, размер или плотность, включает любое целое число в указанном диапазоне, если не оговорено особо. В используемом в настоящем описании смысле «примерно» означает ±20% от указанного диапазона, значения или структуры, если не указано иное. Следует понимать, что термины в единственном числе в используемом в настоящем описании смысле относятся к «одному или нескольким» из указанных компонентов. Следует понимать, что использование альтернативы (например, «или») означает любой один, оба или любое сочетание альтернативных вариантов. В используемом в настоящем описании смысле термины «включают» и «содержат» используют как синонимы. Кроме того, следует понимать, что отдельные соединения или группы соединений, полученные в результате различных сочетаний структур и заместителей, описанные в настоящей публикации, раскрыты в настоящем описании в такой же степени, как в том случае, когда каждое соединение или группа соединений указана отдельно. Таким образом, выбор конкретных структур или конкретных заместителей входит в объем настоящего изобретения.
«Связывающий домен» или «связывающая область» согласно настоящему изобретению может представлять собой, например, любой белок, полипептид, олигопептид или пептид, который обладает способностью специфично узнавать и связываться с биологической молекулой (например, CD37) или комплексом, содержащим больше одной одинаковых или разных молекул, или совокупностью или агрегатом. Примеры связывающих доменов включают вариабельные области одноцепочечных антител (например, доменные антитела, sFv, scFv, Fab). Известно множество анализов для идентификации связывающих доменов согласно настоящему изобретению, которые специфично связывают конкретную мишень, включая Вестерн-блот, ELISA или анализ Biacore®.
Связывающие домены и их слитые белки согласно настоящему изобретению могут быть способны к связыванию в требуемой степени, включая «специфичное или избирательное связывание», с мишенью, при незначительном связывании других компонентов, присутствующих в тестируемом образце, если они связывают молекулу-мишень с аффинностью или Ka (т.е., константой равновесной ассоциации конкретного равновесия связывания в единицах 1/M), например, больше или равной примерно 105 М-1, 106 М-1, 107 М-1, 108 М-1, 109 М-1, 1010 М-1, 1011 М-1, 1012 М-1 или 1013 М-1. «Высоко аффинные» связывающие домены относятся к таким связывающим доменам, которые имеют Ka, составляющую, по меньшей мере, 107 М-1, по меньшей мере 108 М-1, по меньшей мере 109 М-1, по меньшей мере 1010 М-1, по меньшей мере 1011 М-1, по меньшей мере 1012 М-1, по меньшей мере 1013 М-1 или выше. Термин «низко аффинные» связывающие домены относится к таким связывающим доменам, которые имеют Ka до 107 М-1, до 106 М-1 до 105 М-1 или меньше. Альтернативно аффинность может быть определена в виде равновесной константы диссоциации (Kd) для конкретного взаимодействия при связывании в единицах М (например, от 10-5 М до 10-13 М). Аффинности полипептидов связывающих доменов и слитых белков согласно настоящему изобретению легко можно определить, используя обычные методики (смотри, например, Scatchard et al. (1949) Ann. N.Y. Acad. Sci. 51: 660, и патенты США № 5283173, 5468614 или эквивалент).
Термин «CD37-специфичная связывающая молекула» относится к белку, полипептиду, олигопептиду или пептиду, которые преимущественно связываются с белковым антигеном CD37 человека (смотри, например, номера доступа в GenBank EAW52467.1, EAW52468.1, BAG62633.1, BAH14719.1, BAG62877.1, NP 001765.1 и NP 001035120.1), по сравнению с другими белками и связываются с Ka, по меньшей мере, примерно 106 М-1 (например, по меньшей мере, примерно 107 М-1, 108 М-1, 109 М-1, 1010 М-1, 1011 М-1, 1012 М-1 или 1013 М-1).
Термин «CD37-специфичный связывающий домен» относится к части или домену CD37-специфичной связывающей молекулы, непосредственно отвечающему за связывание CD37. CD37-специфичный связывающий домен сам по себе (т.е., без любой другой части CD37-специфичной связывающей молекулы) связывается с CD37 с Ka, составляющей, по меньшей мере, примерно 106 М-1 (например, по меньшей мере, примерно 107 М-1, 108 М-1, 109 М-1, 1010 М-1, 1011 М-1, 1012 М-1 или 1013 M-1). CD37-специфичный связывающий домен сам по себе может быть достаточным в качестве CD37-специфичной связывающей молекулы. Примеры CD37-специфичных связывающих доменов включают CD37-специфичные фрагменты scFv и Fab, которые могут быть основаны на вариабельных доменах или CDR анти-CD37-антитела, таких как вариабельные домены или CDR из моноклональных антител G28-1, IPO24, WR17, MB371, HH1 или HD28.
Каждый из терминов, понятных специалистам в области методики антител, приведен в значении, принятом в данной области, если в настоящем описании специально не определено иное. Известно, что антитела имеют антигенсвязывающие вариабельные домены, шарнирную область и константные области, которые опосредуют эффекторную функцию. Термин «антитело» относится к интактному антителу, содержащему, по меньшей мере, две тяжелых (H) цепи и две легких (L) цепи, связанные между собой дисульфидными связями, в также к антигенсвязывающей части интактного антитела, которая обладает или сохраняет способность связывать молекулу-мишень. Моноклональное антитело или его антигенсвязывающая часть может быть нечеловеческим, химерным, гуманизированным или человеческим. Обзор структуры и функций иммуноглобулинов можно найти, например, в публикации Harlow et al., Eds., Antibodies: A Laboratory Manual, Chapter 14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, 1988).
Например, термины «VL» и «VH» относятся к вариабельному связывающему домену легкой и тяжелой цепи антитела, соответственно. Вариабельные связывающие домены состоят из дискретных хорошо охарактеризованных подобластей, известных как «определяющие комплементарность области» (CDR) и «каркасные области» (FR). Более конкретно, каждый VH- и VL-домен антитела состоит из трех CDR и четырех FR, расположенных от аминоконца к карбоксильному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Вариабельные домены тяжелой и легкой цепи могут быть слиты вместе линкерной аминокислотной последовательностью с образованием «одноцепочечного вариабельного фрагмента» (scFv). «Линкер вариабельных доменов» представляет собой аминокислотную последовательность длиной примерно от 5 до 35 аминокислот (например, (GlynSer)m, где n и m означают целые числа, независимо выбранные из 1-6, предпочтительно n равно 4 и m равно 3, 4 или 5), расположенную между и связывающую вариабельный домен тяжелой цепи с вариабельным доменом легкой цепи или связывающую вариабельный домен легкой цепи с вариабельным доменом тяжелой цепи, которая обеспечивает спейсерную функцию, совместимую с взаимодействием двух вариабельных доменов, так что полученный в результате полипептид сохраняет аффинность специфичного связывания с той же молекулой-мишенью, что и молекула-мишень антитела, имеющего такие же вариабельные области легкой и тяжелой цепи.
Антитела имеют шарнирную последовательность, которая обычно расположена между Fab-частью и константной областью (но нижняя область шарнира может включать в себя аминоконцевую часть константной области). В качестве исходного условия шарнир иммуноглобулина действует как гибкий спейсер, позволяя Fab-части свободно перемещаться в пространстве. Согласно кристаллическим исследованиям шарнирный домен IgG можно функционально и структурно подразделить на три области: верхнюю, центральную или среднюю и нижнюю области шарнира (Shin et al. (1992) Immunol. Rev. 130: 87). Примерами верхней области шарнира являются последовательности EPKSCDKTHT (SEQ ID NO: 263), которая найдена в IgG1, ERKCCVE (SEQ ID NO: 270), которая найдена в IgG2, ELKTPLGDTTHT (SEQ ID NO: 271) или EPKSCDTPPP (SEQ ID NO: 272), которые найдены в IgG3, и ESKYGPP (SEQ ID NO: 273), которая найдена в IgG4. Примерами средней или центральной областей шарнира является последовательность CPPCP (SEQ ID NO: 274), которая найдена в IgG1 и IgG2, CPRCP (SEQ ID NO: 275), которая найдена в IgG3, и CPSCP (SEQ ID NO: 276), которая найдена в IgG4. В то время как каждое из IgG1-, IgG2- и IgG4-антител, по-видимому, имеет один верхний и средний шарнир, IgG3 имеет четыре шарнира в тандеме - один представлен последовательностью ELKTPLGDTTHTCPRCP (SEQ ID NO: 277) и три EPKSCDTPPPCPRCP (SEQ ID NO: 278).
В IgA- и IgD-антителах, по-видимому, отсутствует IgG-подобная центральная область, и IgD, по-видимому, имеет две верхних области шарнира в тандеме (смотри, например, ESPKAQASSVPTAQPQAEGSLAKATTAPATTRNT, SEQ ID NO: 279, и GRGGEEKKKEKEKEEQEERETKTP, SEQ ID NO: 280). Примеры верхних областей шарнира дикого типа, найденные в IgA1- и IgA2-антителах, представляют собой последовательности VPSTPPTPSPSTPPTPSPS (SEQ ID NO: 281) и VPPPPP (SEQ ID NO: 282), соответственно. Напротив, в IgE- и IgM-антителах отсутствует типичная шарнирная область, и вместо этого они имеют CH2-домен с шарнироподобными свойствами. Примеры последовательностей, подобных верхней области шарнира CH2 дикого типа IgE и IgM, приведены в виде последовательности

и последовательности

соответственно.
В используемом в настоящем описании смысле «шарнирная область иммуноглобулина дикого типа» относится к встречающимся в природе аминокислотным последовательностям верхнего и среднего шарнира, расположенными между и связывающими домены CH1 и CH2 (в случае IgG, IgA и IgD) или расположенными между и связывающими доменые CH1 и CH3 (в случае IgE и IgM), находящиеся в тяжелой цепи антитела.
В используемом в настоящем описании смысле «измененная шарнирная область иммуноглобулина» относится к (a) шарнирной области иммуноглобулина дикого типа, имеющей до 30% изменений аминокислот (например, до 25%, 20%, 15%, 10% или 5% аминокислотных замен или делеций), или (b) части шарнирной области иммуноглобулина дикого типа, имеющей длину примерно от 5 аминокислот (например, примерно от 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислот) до примерно 120 аминокислот (предпочтительно имеющей длину примерно от 10 до примерно 40 аминокислот или примерно от 15 до примерно 30 аминокислот, или примерно от 15 до примерно 20 аминокислот, или примерно от 20 до примерно 25 аминокислот), которая имеет примерно до 30% изменений аминокислот (например, примерно до 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2% или 1% аминокислотных замен или делеций или их сочетания), и имеет центральную область шарнира IgG, которая указана в виде последовательностей SEQ ID NO: 274-276.
Кроме того, антитела содержат константные области. Термин «CL» относится к «константной области легкой цепи иммуноглобулина» или «константной области легкой цепи», т.е., константной области легкой цепи антитела. Термин «CH» относится к «константной области тяжелой цепи иммуноглобулина» или «константной области тяжелой цепи», которая дополнительно делится, в зависимости от изотипа антитела, на домены CH1, CH2 и CH3 (IgA, IgD, IgG) или CH1, CH2, CH3 и CH4 (IgE, IgM). Часть доменов константной области составляет Fc-область (область «кристаллизуемого фрагмента») антитела и отвечает за эффекторные функции (такие как зависимая от антител опосредованная клетками цитотоксичность (ADCC), зависимый от антител клеточный фагоцитоз (ADCP), комплементзависимая цитотоксичность (CDC) и связывание комплемента), связывание с Fc-рецепторами (например, CD16, CD32, FcRn), длительное время полужизни in vivo, связывание белка A и возможно даже перенос через плаценту (смотри Capon et al. (1989) Nature 337: 525).
Примеры доменов CH2 человека дикого типа указаны в виде последовательностей SEQ ID NO: 285-293, домены CH3 человека дикого типа указаны в виде последовательностей SEQ ID NO: 294-302, и домены CH4 человека дикого типа указаны в виде последовательностей SEQ ID NO: 303 и 304. «Измененная константная область иммуноглобулина» относится к константной области иммуноглобулина, идентичность последовательности которой с константной областью дикого типа, составляет, по меньшей мере, 75% (например, 80%, 82%, 84%, 86%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 99,5%). Например, «измененная область CH2 иммуноглобулина» или «измененная область CH2» относится к области CH2, идентичность последовательности которой с областью CH2 иммуноглобулина дикого типа (например, CH2 человека) составляет, по меньшей мере, 75% (например, 80%, 82%, 84%, 86%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 99,5%). Подобным образом «измененная область CH3 иммуноглобулина» или «измененная область CH3» относится к области CH3, идентичность последовательности которой с областью CH3 иммуноглобулина дикого типа (например, CH3 человека) составляет, по меньшей мере, 75% {например, 80%, 82%, 84%, 86%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 99,5%).
«Идентичность последовательностей» в используемом в настоящем описании смысле относится к процентному содержанию аминокислотных остатков в одной последовательности, которые идентичны аминокислотным остаткам в другой эталонной полипептидной последовательности после выравнивания последовательностей и при необходимости введения пробелов, чтобы достичь максимальной идентичности последовательностей в процентах, и не учитывая любые консервативные замены в качестве части идентичности последовательностей. Значения идентичности последовательностей в процентах получают с применением компьютерной программы NCBI BLAST2.0, как определено в публикации Altschul et al. (1997) «Gapped BLAST and PSI-BLAST: a new generation of protein database search programs», Nucleic Acids Res. 25: 3389-3402, используя значения параметров, установленные по умолчанию.
В некоторых вариантах измененная область или домен иммуноглобулина содержит только консервативные аминокислотные замены домена иммуноглобулина дикого типа. В некоторых других вариантах измененный домен иммуноглобулина содержит только неконсервативные аминокислотные замены домена иммуноглобулина дикого типа. В других вариантах измененный домен иммуноглобулина содержит как консервативные, так и неконсервативные аминокислотные замены.
Термин «консервативная замена» понимают в данной области как замену одной аминокислоты другой аминокислотой, которая обладает сходными свойствами. Примеры консервативных замен хорошо известны в данной области (смотри, например, публикацию PCT № WO 97/09433, стр. 10; Lehninger, Biochemistry, Second Edition; Worth Publishers, Inc. NY:NY (1975), pp.71-77; Lewin, Genes IV, Oxford University Press, NY and Cell Press, Cambridge, MA (1990), p. 8). В некоторых вариантах консервативная замена включает замену лейцина на серин.
«Производное» в используемом в настоящем описании смысле относится к химически или биологически модифицированному варианту соединения, который структурно подобен исходному соединению и (фактически или теоретически) может быть получен из такого исходного соединения. В общем, «производное» отличается от «аналога» тем, что исходное соединение может быть первичным материалом для создания «производного», тогда как для создания «аналога» в качестве первичного материала не обязательно использование исходного соединения.
«Низкомолекулярный модульный иммунофармацевтический (SMIPTM) белок или полипептид» относится к одноцепочечному слитому белку, который содержит в направлении от амино-конца к карбоксильному концу: (i) связывающий домен, который специфично связывает молекулу-мишень, (ii) линкерный полипептид {например, шарнир иммуноглобулина или его производное) и (iii) (a) полипептид CH2 иммуноглобулина и полипептид CH3 иммуноглобулина IgG, IgA или IgD, или (b) полипептид CH3 иммуноглобулина и полипептид CH4 иммуноглобулина IgM или IgE (смотри, публикации патентов США № 2003/0133939, 2003/0118592 и 2005/0136049; и публикацию PCT № WO 2005/017148).
«Белок PIMS» является молекулой, обратной SMIP, в которой связывающий домен расположен на карбоксильном конце слитого белка. Конструкции и способы получения белков PIMS описаны в публикации PCT № WO 2009/023386 и в публикации заявки на выдачу патента США № US 2009/0148447, и описание таких конструкций, которые содержат CD37-связывающий домен, включено в настоящее описание в виде ссылки. Примером молекулы PIMS является одноцепочечный полипептид, содержащий в направлении от амино-конца к карбоксильному концу константную подобласть, полученную из антитела (например, область, которая содержит CH2-домен и CH3-домен), линкерный пептид (например, область «стебля» молекулы CD или ее функциональный вариант) и связывающий домен (например, CD37). В некоторых вариантах PIMS дополнительно содержит второй линкерный пептид, расположенный с амино-конца по отношению к константной подобласти (например, область шарнира иммуноглобулина), который может быть таким же или другим, отличным от линкерного пептида между константной подобластью и связывающим доменом.
«Белок SCORPION» представляет собой слитый белок, содержащий два связывающих домена, которые включают в себя вариабельные области иммуноглобулина или подобных иммуноглобулину молекул. Конструкции и способы получения белков SCORPION описаны в публикации PCT № WO 2007/146968 и в публикации заявки на выдачу патента США № US 2009/0175867, и описание таких конструкций, которые могут содержать CD37-связывающий домен, включено в настоящее описание в виде ссылки. Примером белка SCORPION является одноцепочечный поливалентный или полиспецифичный связывающий белок с эффекторной функцией, содержащий в направлении от амино-конца к карбоксильному концу: (a) первый связывающий домен, содержащий вариабельные области иммуноглобулина или подобной иммуноглобулину молекулы, (b) первый линкерный пептид, (c) константную подобласть иммуноглобулина, обеспечивающую эффекторную функцию, (d) второй линкерный пептид и (e) второй связывающий домен, содержащий вариабельные области иммуноглобулина или подобной иммуноглобулину молекулы. В некоторых вариантах первый и второй связывающие домены связываются с одной и той же мишенью (например, CD37). В некоторых других вариантах первый и второй связывающие домены связывают разные мишени.
В используемом в настоящем описании смысле, если не указано иное, положение аминокислотного остатка в вариабельной области молекулы иммуноглобулина или в слитом белке, содержащем области или домены иммуноглобулина, пронумерованы согласно правилу нумерации Кабата (Kabat, Sequences of Proteins of Immunological Interest, 5th ed. Bethesda, MD: Public Health Service, National Institutes of Health (1991)), и положение аминокислотного остатка в константной области молекулы иммуноглобулина пронумеровано согласно номенклатуре EU (Ward et al., 1995 Therap. Immunol. 2: 77-94; Kabat, выше).
«Ассоциированное с B-клетками расстройство или заболевание» или «заболевание или расстройство, ассоциированное с аномальной активностью B-клеток» относится к заболеванию или расстройству, ассоциированному с (например, вызывающему или возникающему в результате) аномальной активностью B-клеток или активностью, которая отклоняется от нормального, характерного или ожидаемого течения. Например, ассоциированное с B-клетками расстройство или заболевание может включать не соответствующую норме пролиферацию B-клеток, которые имеют поврежденную или дефектную ДНК или другие клеточные компоненты. Аномальная активность B-клеток может включать пролиферацию клеток, характеризуемую несоответствующими высокими уровнями деления B-клеток, несоответствующими низкими уровнями апоптоза B-клеток или и тем и другим признаками. При таких заболеваниях может происходить аномальная пролиферация B-клеток в одном месте или в нескольких местах, и могут присутствовать группы B-клеток или ткань (ткани) либо канцерогенные, либо неканцерогенные, доброкачественные или злокачественные. Ассоциированное с B-клетками расстройство или заболевание также может включать аномальную продукцию антител, например, продукцию аутоантител, или сверхпродукцию антител, когда более желательны нормальные уровни их продукции. Также в настоящем изобретении предполагается, что аномальная активность B-клеток может возникать в некоторых субпопуляциях B-клеток, и не наблюдаться в других субпопуляциях, или может вызывать неподходящую стимуляцию T-клеток, например, в результате неподходящей презентации антигена T-клеткам или другим B-клеточным путем.
«Лечение» или «осуществление лечения» относится либо к терапевтическому лечению, либо профилактическому/превентивному лечению. Терапевтическое лечение может улучшать, по меньшей мере, один симптом заболевания у пациента, получающего лечение, или может задерживать ухудшение в случае прогрессирующего заболевания у пациента или предотвращать появление дополнительных ассоциированных симптомов или заболеваний или способствовать любому сочетанию указанных выше эффектов.
«Терапевтически эффективное количество (или доза)» или «эффективное количество (или доза)» специфично связывающей молекулы {например, CD37-специфичной связывающей молекулы) или соединения (например, ингибитора mTOR, ингибитора PI3K) относится к такому количеству соединения или сочетания соединений, которое достаточно для того, чтобы получить результат в виде улучшения одного или нескольких симптомов заболевания, подвергаемого лечению, задержки ухудшения в случае прогрессирующего заболевания или предотвращения появления дополнительных ассоциированных симптомов или заболеваний или любого их сочетания.
«Субъектом, у которого имеется или у которого предполагается наличие заболевания, ассоциированного с аномальной активностью B-клеток» является субъект (человек или другое животное), у которого заболевание или симптом расстройства может быть вызван аномальной активностью B-клеток или пролиферацией B-клеток, может быть усилен аномальной активностью B-клеток или может быть облегчен в результате регуляции B-клеточной активности. Примерами таких заболеваний являются B-клеточное злокачественное новообразование или B-клеточная злокачественная опухоль (например, B-клеточная лимфома, B-клеточный лейкоз или B-клеточная миелома), заболевание, характеризуемое продукцией аутоантител (например, аутоиммунные заболевания) или воспалением, или заболевание, характеризуемое несоответствующей стимуляцией T-клеток, вызванной неподходящей презентацией T-клеткам антигена B-клетками или вызванной другими путями, в которые вовлечены B-клетки.
CD37-специфичные связывающие молекулы
CD37-специфичные связывающие молекулы, применимые для комбинированной терапии, описанной в настоящей публикации, содержат CD37-специфичный связывающий домен. CD37-специфичный связывающий домен может быть использован отдельно или в встроенным в каркас, включая применение в форме анти-CD37-антитела или его антигенсвязывающего фрагмента, Fab-части или (Fab)2-части анти-CD37-антитела, одноцепочечного Fv (scFv) против CD37, анти-CD37-SMIP-белка, анти-CD37-PIMS-белка, анти-CD37-SCORPION-белка или тому подобной.
Основанные на иммуноглобулине CD37-специфичные связывающие домены, применимые в настоящем изобретении, включают домены, известные в данной области, которые описаны в настоящей публикации, или домены, созданные различными способами, известными в данной области (смотри, например, патенты США № 6291161 и 6291158). Например, CD37-специфичные связывающие домены можно идентифицировать с помощью скрининга фаговой Fab-библиотеки в отношении Fab-фрагментов, которые специфично связываются с CD37 (смотри Hoet et al. (2005) Nature Biotechnol. 23: 344). Дополнительно можно использовать традиционные методики создания гибридом, такие как использование CD37 в качестве иммуногена в обычных системах (например, мыши, HuMAb-мышь®, TC-мышьTM, KM-мышь®, ламы, овцы, цыплята, крысы, хомячки, кролики и т.д.), для разработки анти-CD37-антител, имеющих представляющие интерес CD37-специфичные связывающие домены.
Источниками других связывающих доменов являются вариабельные домены CD37-специфичных антител различных видов (которые могут быть использованы в формате антител, sFv, scFv, Fab или растворимый VH-домен или доменные антитела), включая человека, грызунов, птиц и овец. Дополнительными источниками связывающих доменов являются вариабельные домены антител из других видов, таких как верблюдовые (верблюды, дромадеры или ламы (Ghahroudi etal. (1997) FEBS Letters 414:521; Vincke et al. (2009) J. Biol. Chem. 284:3273; and Hamers-Casterman et al. (1993) Nature, 363:446; and Nguyen et al. (1998) J. Mol. Biol., 275:413), акулы-няньки (Roux et al. (1998) Proc. Natl. Acad. Sci. (USA) 95: 11804), пятнистые химеры (Nguyen et al. (2002) Immunogenetics, 54: 39) или миноги (Herrin et al., (2008) Proc. Natl. Acad. Sci. (USA) 105: 2040 и Alder et al. (2008) Nature Immunol. 9: 319). Такие антитела, очевидно, могут образовывать антигенсвязывающие области с использованием только вариабельной области тяжелой цепи, т.е. такие функциональные антитела являются гомодимерами только тяжелых цепей (называемыми «антителами на основе тяжелых цепей») (Jespers et al. (2004) Nature Biotechnol. 22:1161; Cortez-Retamozo et al. (2004) Cancer Res. 64:2853; Baral et al. (2006) Nature Med. 12:580, and Barthelemy et al. (2008) J. Biol. Chem. 283:3639).
Другими альтернативными источниками CD37-специфичных связывающих доменов являются последовательности, которые кодируют библиотеки случайных пептидов, или последовательности, которые кодируют сконструированное разнообразие аминокислот в областях петель альтернативных, не относящихся к антителам каркасов, таких как домены фибриногена (смотри, например, Weisel et al. (1985) Science 230: 1388), домены Кунитца (смотри, например, патент США № 6423498), белки с повторами анкирина (Binz et al. (2003) J. Mol. Biol. 332: 489 и Binz et al. (2004) Nature Biotechnology 22: 575), связывающие домены фибронектина (Richards et al. (2003) J. Mol. Biol. 326:1475; Parker et al. (2005) Protein Eng. Des. Sel. 18:435 and Hackel et al. (2008) J. Mol. Biol. 381:1238), минибелки с цистеиновыми узлами (Vita et al. (1995) Proc. Natl. Acad. Sci. (USA) 92: 6404; Martin et al. (2002) Nature Biotechnol. 21: 71 и Huang et al. (2005) Structure 13: 755), тетратрикопептидные повторяющиеся домены (Main et al. (2003) Structure 11: 497 и Cortajarena et al. (2008) ACS Chem. Biol. 3: 161), богатые лейцином повторяющиеся домены (Stumpp et al. (2003) J. Mol. Biol. 332: 471), домены липокалина (смотри, например, публикацию PCT № WO 2006/095164, Beste et al. (1999) Proc. Natl. Acad. Sci. (USA) 96: 1898 и Schonfeld et al. (2009) Proc. Natl. Acad. Sci. (USA) 106: 8198), V-подобные домены (смотри, например, публикацию заявки на выдачу патента США № 2007/0065431), лектиновые домены C-типа (Zelensky and Gready (2005) FEBS J. 272: 6179; Beavil et al. (1992) Proc. Natl. Acad. Sci. (USA) 89: 753 и Sato et al. (2003) Proc. Natl. Acad. Sci. (USA) 100: 7779), mAb2 или FcabTM (смотри, например, публикации PCT № WO 2007/098934; WO 2006/072620), или тому подобные (Nord at al. (1995) Protein Eng. 8:601; Nord et al. (1997) Nature Biotechnol. 15:772; Nord et al. (2001) Eur. J. Biochem. 268:4269; and Binz et al. (2005) Nature Biotechnol. 23:1257).
В некоторых вариантах CD37-специфичный связывающий домен содержит VH-домен, полученный из или основанный на VH моноклонального анти-CD37-антитела. В следующих вариантах CD37-специфичный связывающий домен содержит VL-домен, полученный из или основанный на VL моноклонального анти-CD37-антитела. В следующих вариантах CD37-специфичый связывающий домен содержит VH-домен и VL-домен, полученный из или основанный на VH и VL, соответственно, из одного моноклонального анти-CD37-антитела или, по меньшей мере, из двух разных моноклональных анти-CD37-антител. В предпочтительном варианте домены VH и VL получены из моноклонального антитела G28-1 (SEQ ID NO: 241 и 236, соответственно) или из моноклонального антитела или SMIP-белка CAS-024 (SEQ ID NO: 245 и 238, соответственно).
В некоторых вариантах CD37-специфичный связывающий домен содержит домены VH и VL, каждый из которых независимо модифицирован так, чтобы он содержал одну или несколько (например, 2, 3, 4, 5, 6, 7, 8, 9, 10) инсерций аминокислот, одну или несколько (например, 2, 3, 4, 5, 6, 7, 8, 9, 10) делеций аминокислот, одну или несколько (например, 2, 3, 4, 5, 6, 7, 8, 9, 10) аминокислотных замен (например, консервативных аминокислотных замен) или их сочетание, по сравнению с доменами VH и VL дикого типа, соответственно, исходного моноклонального анти-CD37-антитела или антител. Инсерция(ии), делеция(ии) или замена(ны) могут быть где угодно в домене VH, домене VL или обоих доменах, включая изменения на амино-конце или карбоксильном конце или на обоих концах каждого или обоих доменов, при условии, что каждый CDR содержит нулевые изменения или не больше одного, двух или трех изменений, и при условии, что CD37-связывающий домен, содержащий модифицированный VH-домен, VL-домен или оба домена, может специфично связывать CD37 с аффинностью, сходной или большей, чем аффинность связывающего домена дикого типа.
CD37-специфичные связывающие домены, содержащие домены VL и VH иммуноглобулина, будут содержать всего две, три, четыре, пять или предпочтительно шесть CDR (т.е., три в VL и три в VH). Такие CDR могут представлять собой CDR человека или CDR животного, отличного от человека, или их варианты, содержащие не более одного, двух или трех изменений аминокислот на CDR. В некоторых вариантах CD37-специфичный связывающий домен содержит (a) вариабельный домен легкой цепи, который содержит CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, и (b) вариабельный домен тяжелой цепи, который содержит CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи.
Примерами CDR являются CDR1 легкой цепи, указанная в виде последовательностей SEQ ID NO: 61 (RASENVYSYLA), SEQ ID NO: 62 (RTSENVYSYLA), SEQ ID NO: 311 (KASQDVSTAVA) или SEQ ID NO: 312 (RASSSIVYMH); CDR1 тяжелой цепи, указанная в виде последовательностей SEQ ID NO: 63 (GYNMN), SEQ ID NO: 313 (GYSFTDFNMY) или SEQ ID NO: 314 (GFTFRSYGMS); CDR2 легкой цепи, указанная в виде последовательностей SEQ ID NO: 64 (FAKTLAE), SEQ ID NO: 315 (WASTRHT) или SEQ ID NO: 316 (DTSKLAS); CDR2 тяжелой цепи, указанная в виде последовательностей SEQ ID NO: 65 (NIDPYYGGTTYNRKFKG), SEQ ID NO: 317(YIDPYNGDTTYNQKFKG) или SEQ ID NO: 318 (SINSDGGSTYYPDVKG); CDR3 легкой цепи, указанная в виде последовательностей SEQ ID NO: 66 (QHHSDNPWT), SEQ ID NO: 319 (QQHYSTPLT) или SEQ ID NO: 320 (HQRSSYPTT); и CDR3 тяжелой цепи, указанная в виде последовательностей SEQ ID NO: 67 (SVGPFDY), SEQ ID NO: 68 (SVGPFDS), SEQ ID NO: 69 (SVGPMDY), SEQ ID NO: 321 (GPNWVAMDY) или SEQ ID NO: 322 (GGALIVTSDAMDY). предпочтительной CDR1 легкой цепи является последовательность SEQ ID NO: 61 (RASENVYSYLA), и предпочтительной CDR3 тяжелой цепи является последовательность SEQ ID NO: 68 (SVGPFDS) или SEQ ID NO: 69 (SVGPMDY). Дополнительные примеры CDR указаны в виде последовательностей SEQ ID NO: 128-137 (в случае последовательностей CDR1 легкой цепи), 138 и 139 (в случае последовательностей CDR2 тяжелой цепи), и 213 и 215-219 (в случае последовательностей CDR3 тяжелой цепи). Дополнительные примеры CDR можно найти в публикации PCT № WO 2009/126944, и описание таких CDR включено в настоящее описание в виде ссылки.
В следующих вариантах связывающие домены, специфичные для CD37 человека, содержат домены VL и VH иммуноглобулина, которые являются нечеловеческими, гуманизированными или человеческими. В используемом в настоящем описании смысле «гуманизированный CD37-специфичный связывающий домен» относится к связывающему домену, содержащему домены VL и VH иммуноглобулина животного, отличного от человека, которые образует связывающий домен, специфичный для CD37 человека, и каждый из которых имеет, по меньшей мере, одну, две, три или предпочтительно четыре каркасных области человека.
Термин «каркасная область человека» относится к каркасным областям (FR) человека, встречающимся в вариабельных доменах иммуноглобулина, которые могут представлять собой (i) FR человека дикого типа из встречающихся в природе последовательностей зародышевой линии или соматических последовательностей, (ii) измененные FR человека, содержащие менее чем примерно 50% (например, предпочтительно менее чем примерно 45%, 40%, 30%, 25%, 20%, 15%, 10%, 5% или 1%) аминокислот, соответствующих аминокислотам животного, отличного от человека, в соответствующих положениях FR, или (iii) измененные FR животного, отличного от человека, содержащие, по меньшей мере, примерно 50% (например, по меньшей мере, примерно 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%) аминокислот, соответствующих аминокислотам человека в соответствующих положениях FR, для того, чтобы уменьшить иммуногенность.
Примеры FR человека указаны в виде последовательностей SEQ ID NO: 140-146 (FR1 тяжелой цепи человека), SEQ ID NO: 147, 150 и 151 (FR2 тяжелой цепи человека), SEQ ID NO: 154-160 (FR3 тяжелой цепи человека), SEQ ID NO: 161-163, 168 и 169 (FR4 тяжелой цепи человека), SEQ ID NO: 170-172, 175 и 177-181 (FR1 легкой цепи человека), SEQ ID NO: 182, 184-188 и 191 (FR2 легкой цепи человека), SEQ ID NO: 194-198, 203 и 205 (FR3 легкой цепи человека) и SEQ ID NO: 206-210 (FR4 легкой цепи человека). Дополнительные примеры областей FR человека можно найти в CD37-специфичных SMIP-белках, предлагаемых в настоящем изобретении, таких как CAS-001, CAS-002, CAS-003 и CAS-024 (SEQ ID NO: 248, 249, 250 и 253, соответственно).
В некоторых вариантах CD37-специфичные связывающие домены содержат гуманизированную вариабельную область тяжелой цепи, которая содержит в направлении от своего амино-конца к карбоксильному концу: FR1 тяжелой цепи человека, CDR1 тяжелой цепи, которая указана в SEQ ID NO: 63, FR2 тяжелой цепи человека, CDR2 тяжелой цепи, которая указана в SEQ ID NO: 65, FR3 тяжелой цепи человека, CDR3 тяжелой цепи, которая указана в SEQ ID NO: 67, 68 или 69, и FR4 тяжелой цепи человека. В следующих вариантах CD37-специфичные связывающие домены содержат, по существу состоят или состоят из гуманизированной вариабельной области тяжелой цепи, которая содержит в направлении от своего амино-конца к карбоксильному концу: FR1 тяжелой цепи человека, которая указана в SEQ ID NO: 144, CDR1 тяжелой цепи, которая указана в SEQ ID NO: 63, FR2 тяжелой цепи человека, которая указана в SEQ ID NO: 151, CDR2 тяжелой цепи, которая указана в SEQ ID NO: 65, FR3 тяжелой цепи человека, которая указана в SEQ ID NO: 158, CDR3 тяжелой цепи, которая указана в SEQ ID NO: 67, 68 или 69, и FR4 тяжелой цепи человека, которая указана в SEQ ID NO: 161. Дополнительные примеры гуманизированных легких цепей указаны в SEQ ID NO: 242-245 и включают легкие цепи в гуманизированных CD37-специфичных SMIP-белках, предлагаемых в настоящем изобретении.
В следующих вариантах гуманизируют только вариабельный домен легкой или тяжелой цепи. Например, CD37-специфичные связывающие домены могут содержать гуманизированный вариабельный домен легкой цепи (т.е., вариабельную область легкой цепи, которая содержит, по меньшей мере, одну FR человека) и вариабельную область тяжелой цепи животного, отличного от человека (например, мыши или крысы). Альтернативно, CD37-специфичные связывающие домены могут содержать вариабельный домен легкой цепи животного, отличного от человека (например, мыши или крысы) и гуманизированный вариабельный домен тяжелой цепи (т.е., вариабельную область тяжелой цепи, которая содержит, по меньшей мере, одну FR человека). Оба типа CD37-специфичных связывающих доменов можно назвать «гибридными CD37-специфичными связывающими доменами человека-животного, отличного от человека» или «химерными CD37-специфичными связывающими доменами».
В некоторых вариантах CD37-специфичные связывающие домены имеют форму scFv-фрагмента. В предпочтительном варианте CD37-специфичный связывающий домен представляет собой человеческий или гуманизированный CD37-специфичный scFv, который содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи, связанные вместе линкером вариабельных доменов. В следующих вариантах вариабельные домены и легкой и тяжелой цепи гуманизированы и могут содержать гуманизированный вариабельный домен легкой цепи, который указан в SEQ ID NO: 238, и гуманизированный вариабельный домен тяжелой цепи, который указан в SEQ ID NO: 245. В следующих вариантах гуманизирован вариабельный домен scFv только легкой или только тяжелой цепи.
В предпочтительном варианте карбоксильный конец VL-домена в гуманизированном CD37-специфичном scFv связан с амино-концом VH-домена через линкер вариабельных доменов. Таким образом, полученный scFv содержит в направлении от своего амино-конца к карбоксильному концу: VL-домен, линкер вариабельных доменов и VH-домен. В другом предпочтительном варианте карбоксильный конец VH-домена в гуманизированном CD37-специфичном scFv связан с амино-концом VL-домена через линкер вариабельных доменов. Таким образом, полученный в результате scFv имеет в направлении от своего амино-конца к карбоксильному концу: VH-домен, линкер вариабельных доменов и VL-домен. В предпочтительном варианте VH- и VL-домены scFv получены из моноклонального антитела G28-1 (SEQ ID NO: 241 и 236, соответственно) или из моноклонального антитела или SMIP-белка CAS-024 (SEQ ID NO: 245 и 238, соответственно), и линкер вариабельных доменов имеет примерно от пяти до 35 аминокислот, предпочтительно примерно от 15 до примерно 25 аминокислот.
В некоторых вариантах линкер вариабельных доменов, связывающий домены VH и VL или домены VL и VH, относится к семейству (GlynSer), которое описано в настоящей публикации. Например, линкер вариабельных доменов содержит (GlynSer)m, где n и m могут означать целое число, независимо выбранное из 1-6. В некоторых предпочтительных вариантах n равно 4 и m равно 1, 2, 3, 4, 5 или 6, и более предпочтительно n равно 4, и m равно 3, 4 или 5. В следующих вариантах одна или две других аминокислоты, отличных от Gly или Ser, могут присутствовать на амино-конце, карбоксильном конце или на обоих концах. В некоторых других вариантах одна или две аминокислоты в (GlynSer)m могут быть заменены другой аминокислотой, отличной от Gly или Ser. Пример последовательности, связывающей вариабельные домены, включающей в себя последовательность (Gly4Ser)5, приведен в SEQ ID NO: 229. Дополнительные примеры последовательностей, связывающих вариабельные домены, приведены в SEQ ID NO: 225-228.
В некоторых вариантах CD37-специфичная связывающая молекула или связывающий домен конкурирует за связывание с белком CD37 человека с моноклональным антителом (мАт) G28-1, мАт CAS-024 или SMIP-белком CAS-024. В используемом в настоящем описании смысле «конкурирует за связывание» означает, что связывание с молекулой-мишенью связывающей молекулы, специфичной для такой мишени, снижается или ингибируется в присутствии другой связывающей молекулы, специфичной для той же мишени - это значит, что две разные связывающие молекулы, такие как два разных анти-CD37-антитела, могут связываться с одним и тем же или сходным антигенсвязывающим участком или эпитопом (например, относящимся к последовательности или конформационным), или могут стерически затруднять связывание с соседними антигенсвязывающими участками или эпитопами. Например, связывание мАт G28-1 с CD37 снижается в присутствии SMIP-белка CAS-024 по сравнению со связыванием CD37 моноклональным антителом G28-1 в отсутствие SMIP-белка CAS-024 (т.е., CAS-024 конкурирует с мАт G28-1 в отношении связывания с CD37). Анализы конкурентного связывания известны в данной области, например, описаны в примере 2 в публикации PCT № WO 2007/014278 и в примерах 4-6 в публикации PCT № WO 2009/126944, и могут быть использованы для определения того, способен ли данный CD37-специфичный связывающий домен или CD37-специфичная связывающая молекула конкурировать с мАт G28-1, мАт CAS-024 или SMIP-белком CAS-024 за связывание с CD37.
CD37-специфичные связывающие молекулы согласно настоящему изобретению могут содержать шарнирный или линкерный полипептид, который связывает CD37-специфичный связывающий домен с константной областью Fc иммуноглобулина. В используемом в настоящем описании смысле «шарнирная область», «шарнир», «шарнирный полипептид» или «линкерный полипептид» относится к (a) шарнирной области иммуноглобулина дикого типа; (b) измененной шарнирной области иммуноглобулина; (c) пептиду, основанному или полученному из внутридоменной области представителя надсемейства иммуноглобулинов; (d) области «стебля» молекулы кластера дифференцировки (CD) или ее функциональному варианту; или (e) области «стебля» лектинов C-типа, семейства мембранных белков типа II (смотри, например, примеры последовательностей области «стебля» лектина, приведенные в публикации заявки PCT № WO 2007/146968, такие как последовательности SEQ ID NO: 111, 113, 115, 117, 119, 121, 123, 125, 127, 129, 131, 133, 135, 149, 151, 153, 155, 157, 159, 161, 163, 165, 167, 169, 231, 233, 235, 237, 239, 241, 243, 245, 247, 249, 251, 253, 255, 257, 259, 261, 263, 265, 267, 269, 271, 273, 275, 277, 279, 281, 287, 289, 297, 305, 307, 309-311, 313-331, 346, 373-377, 380 или 381, приведенные в указанной публикации, и описание таких последовательностей включено в настоящее описание в виде ссылки) или их функциональному варианту.
В некоторых вариантах шарнирная область является шарнирной областью иммуноглобулина дикого типа, такой как шарнир IgG, шарнир IgA, шарнир IgD, шарнир IgE или его функциональный фрагмент {например, длиной от 4 до 20 или от 5 до 15 аминокислот), который содержит, по меньшей мере, центральную область шарнира IgG1. В некоторых предпочтительных вариантах шарнирная область может представлять собой шарнирную область антитела, выбранную из IgG1 человека, IgG2 человека, IgG3 человека, IgG4 человека, или их функциональных вариантов. В некоторых вариантах шарнирная область представляет собой шарнирную область иммуноглобулина человека дикого типа или ее функциональный вариант. Примерами шарниров для таких вариантов являются шарнирная область IgG1 человека дикого типа, которая указана в SEQ ID NO: 90, шарнир IgA1 человека дикого типа, который указан в SEQ ID NO: 115, шарнир IgA2 человека дикого типа, который указан в SEQ ID NO: 116, шарнир IgG3 человека дикого типа, который указан в SEQ ID NO: 118, часть шарнира IgG3 человека, которая указана в SEQ ID NO: 258, и шарнир IgD человека, который указан в SEQ ID NO: 127. В некоторых вариантах один или несколько аминокислотных остатков могут быть добавлены к амино- или карбоксильному концу шарнирной области иммуноглобулина дикого типа в виде части конструкции слитого белка. Такие аминокислотные остатки называют «соединительными аминокислотами» (смотри, например, SEQ ID NO: 231-235).
В некоторых вариантах шарнирная область представляет собой измененную (мутантную) шарнирную область иммуноглобулина дикого тип, такую как измененная шарнирная область иммуноглобулина IgG дикого типа. Например, шарнирная область IgG1 человека дикого типа содержит три остатка цистеина - расположенный ближе всего к N-концу цистеин называют первым цистеином, тогда как самый близкий к C-концу цистеин в шарнирной области является третьим цистеином. В некоторых вариантах мутантная шарнирная область IgG1 человека имеет только два остатка цистеина, например, шарнирная область IgG1 человека, в котором один из трех (первый, второй или третий) остаток цистеина заменен серином, предпочтительно второй цистеин. В некоторых других вариантах мутантная шарнирная область IgG1 человека имеет только один остаток цистеина, предпочтительно третий цистеин. В некоторых вариантах пролин, расположенный с C-концевой стороны по отношению к третьему цистеину в шарнирной области IgG1 человека, заменен, например, серином. Примеры мутантных шарнирных областей IgG1 человека указаны в SEQ ID NO: 92, 94, 102, 104, 255, 256, 106, 108, 257, 96, 110, 112, 98 и 100. Примеры мутантных частей шарнирных областей IgG3 человека указаны в SEQ ID NO: 120, 126, 259-261, 122 и 124. В некоторых вариантах один или несколько аминокислотных остатков могут быть добавлены на амино- или карбоксильном конце мутантной шарнирной области иммуноглобулина в виде части конструкции слитого белка. Примеры таких модифицированных шарнирных областей указаны курсивом в последовательностях SEQ ID NO: 231-235.
В некоторых вариантах шарнирная область содержит или имеет последовательность, которая, по меньшей мере на 80%, по меньшей мере на 81%, по меньшей мере на 82%, по меньшей мере на 83%, по меньшей мере на 84%, по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% идентична шарнирной области иммуноглобулина дикого типа, такой как шарниры IgG1, IgG2, IgG3, IgG4, IgA1, IgA2 IgD и IgE человека дикого типа.
Альтернативные шарнирные или линкерные последовательности могут быть получены из частей рецепторов клеточной поверхности, которые связывают IgV-подобные или IgC-подобные домены. Области между IgV-подобными доменами, когда рецептор клеточной поверхности содержит множественные IgV-подобные домены в тандеме, и между IgC-подобными доменами, когда рецептор клеточной поверхности содержит множественные тандемные IgC-подобные области, также можно использовать в качестве соединительной области или линкерного пептида. Типичные шарнирные или линкерные последовательности междоменных областей между IgV-подобными и IgC-подобными или между IgC-подобными или IgV-подобными доменами имеются в CD2, CD4, CD22, CD33, CD48, CD58, CD66, CD80, CD86, CD96, CD150, CD166 и CD244. Дополнительные альтернативные шарниры могут быть получены из связанных дисульфидной связью областей рецепторов типа II из представителей неиммуноглобулинового суперсемейства, таких как CD69, CD72 и CD161.
В некоторых вариантах шарнирные или линкерные последовательности имеют от 2 до 150 аминокислот, от 5 до 60 аминокислот, от 2 до 40 аминокислот, предпочтительно имеют 8-20, более предпочтительно имеют 12-15 аминокислот и, главным образом, могут быть гибкими, но также могут обеспечивать свойства меньшей гибкости, или в основном могут содержать α-спиральную структуру с минимальной β-слоистой структурой. Предпочтительно шарнирные и линкерные последовательности стабильны в плазме и сыворотке и устойчивы к протеолитическому расщеплению. В некоторых вариантах первый лизин в верхней шарнирной области IgG1 подвергают мутации, чтобы минимизировать протеолитическое расщепление, предпочтительно лизин заменяют метионином, треонином, аланином или глицином или делетируют. Последовательности нуклеиновой кислоты, кодирующие примеры линкеров, указаны в SEQ ID NO: 89, 91, 93, 95, 97, 99, 101, 103, 105, 107, 109, 111, 117, 119, 121, 123 и 125.
CD37-специфичные связывающие молекулы согласно настоящему изобретению могут содержать константную подобласть, полученную из антитела, такую как области CH2 и CH3 IgG, IgA или IgD и области CH3 и CH4 IgM или IgE.
CH2-домен, который образует часть CD37-специфичной связывающей молекулы, может представлять собой CH2-домен иммуноглобулина дикого типа или измененный CH2-домен иммуноглобулина, основанный или полученный из некоторых классов или подклассов иммуноглобулинов (например, IgG1, IgG2, IgG3, IgG4, IgA1, IgA2 или IgD) и из разных видов (включая человека, мышь, крысу и других млекопитающих). В некоторых вариантах CH2-домен представляет собой CH2-домен иммуноглобулина человека дикого типа, такой как CH2-домены дикого типа IgG1, IgG2, IgG3, IgG4, IgA1, IgA2 или IgD человека, которые указаны в SEQ ID NO: 285, 290-292 и 286-288, соответственно. В некоторых предпочтительных вариантах CH2-домен представляет собой CH2-домен IgG1 человека дикого типа, который указан в SEQ ID NO: 285. В некоторых вариантах CH2-домен представляет собой измененный CH2-домен иммуноглобулина человека, такой как измененный CH2-домен, основанный или полученный из CH2-домена дикого типа антител IgG1, IgG2, IgG3, IgG4, IgA1, IgA2 или IgD человека. Например, измененный CH2-домен может представлять собой CH2-домен IgG1 человека с одной, двумя, тремя, четырьмя, пятью, шестью или большим количество мутаций в положениях 234-238, 253, 255-258, 290, 297, 310, 318, 320, 322, 331 и 339 (положения пронумерованы согласно нумерации EU). В некоторых вариантах измененный CH2-домен содержит: (i) аминокислотную замену аспарагина в положении 297; (ii) одну или несколько аминокислотных замен или делеций в положениях 234-238; (iii) по меньшей мере, одну аминокислотную замену или делецию в положениях 253, 310, 318, 320, 322 или 331; (iv) аминокислотную замену аспарагина в положении 297 и одну или несколько замен или делеций в положениях 234-238; (v) аминокислотную замену аспарагина в положении 297 и, по меньшей мере, одну замену или делецию в положении 253, 310, 318, 320, 322 или 331; (vi) одну или несколько аминокислотных замен или делеций в положениях 234-238 и, по меньшей мере, одну аминокислотную замену или делецию в положении 253, 310, 318, 320, 322 или 331; или (vi) аминокислотную замену аспарагина в положении 297, одну или несколько аминокислотных замен или делеций в положениях 234-238 и, по меньшей мере, одну аминокислотную замену или делецию в положении 253, 310, 318, 320, 322 или 331. Например, в некоторых вариантах измененный CH2-домен представляет собой CH2-домен IgG1 человека с аланиновой заменой в положении 297. В некоторых других вариантах измененный CH2-домен представляет собой CH2-домен IgG1 человека с аланиновыми заменами в положениях 235, 318, 320 и 322 (т.е., CH2-домена IgG1 человека с заменами L235A, E318A, K320A и K322A) (SEQ ID NO: 305). В некоторых других вариантах измененный CH2-домен представляет собой CH2-домен IgG1 человека с аланиновыми заменами в положениях 234, 235, 237, 318, 320 и 322 (т.е., CH2-домен IgG1 человека с заменами L234A, L235A, G237A, E318A, K320A и K322A) (SEQ ID NO: 306). Мутации в указанных выше положениях могут снижать или устранять ADCC-активность, ADCP-активность, связывание Fc-рецептора или фиксацию комплемента.
CH3-домен, который образует часть CD37-специфичной связывающей молекулы, может представлять собой CH3-домен иммуноглобулина дикого типа или измененный CH3-домен иммуноглобулина из некоторых классов или подклассов иммуноглобулинов (например, IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE, IgM) разных видов (включая человека, мышь, крысу и других млекопитающих). В некоторых вариантах CH3-домен представляет собой CH3-домен иммуноглобулина человека дикого типа, такой как CH3-домены дикого типа IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE или IgM человека, которые указаны в SEQ ID NO: 294, 299-301, 295-298 и 302, соответственно. В некоторых предпочтительных вариантах CH3-домен представляет собой CH3-домен IgG1 человека дикого типа, который указан в SEQ ID NO: 294. В некоторых вариантах CH3-домен представляет собой измененный CH3-домен иммуноглобулина человека, такой как измененный CH3-домен, основанный или полученный из CH3-домена дикого типа антител IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE или IgM человека. Например, измененный CH3-домен может представлять собой CH3-домен IgG1 человека с одной или двумя мутациями в положениях H433 и N434 (положения пронумерованы согласно нумерации EU). Мутации в таких положениях могут быть вовлечены в фиксацию комплемента. В некоторых других вариантах измененный CH3-домен может представлять собой CH3-домен IgG1 человека, но с одной или двумя аминокислотными заменами в положении F405 или Y407. Аминокислоты в таких положениях вовлечены во взаимодействие с другим CH3-доменом.
CH4-домен, который образует часть CD37-специфичной связывающей молекулы, может представлять собой CH4-домен иммуноглобулина дикого типа или измененный CH4-домен иммуноглобулина из молекул IgE или IgM. В некоторых вариантах CH4-домен представляет собой CH4-домен иммуноглобулина человека дикого типа, такой как CH4-домены дикого типа молекул IgE и IgM человека, которые указаны в SEQ ID NO: 303 и 304, соответственно. В некоторых вариантах CH4-домен представляет собой измененный CH4-домен иммуноглобулина человека, такой как измененный CH4-домен, основанный или полученный из CH4-домена молекул IgE или IgM человека, которые имеют мутации, которые увеличивают или снижают иммунологическую активность, которая как известно ассоциирована с Fc-областью IgE или IgM.
В некоторых вариантах константная подобласть CD37-специфичной связывающей молекулы содержит сочетание доменов CH2, CH3 и/или CH4 (т.е., более одного константного субдомена, выбранного из CH2, CH3 и CH4). Например, константная подобласть может содержать домены CH2 и CH3 или домены CH3 и CH4. Множественные константные субдомены, которые образуют константную подобласть, могут быть основаны или получены из одной и той же молекулы иммуноглобулина (например, константная подобласть, образованная из CH2 и CH3 IgG1 человека, которая указана в SEQ ID NO: 246), или молекул иммуноглобулина одного и того же класса или подкласса. Альтернативно множественные константные субдомены могут быть основаны или получены из разных молекул иммуноглобулинов или молекул иммуноглобулинов разных классов или подклассов. Например, в некоторых вариантах константная подобласть содержит как CH3-домен IgM человека, так CH3-домен IgG1 человека.
В некоторых предпочтительных вариантах константная подобласть содержит CH2-домен IgG1 человека дикого типа и CH3-домен IgG1 человека дикого типа. В некоторых других предпочтительных вариантах константная подобласть содержит измененный CH2-домен IgG1 человека (например, имеющий аминокислотную мутацию в положении N297, имеющий аминокислотную мутацию в положении N297 и, по меньшей мере, одну дополнительную аминокислотную мутацию в положениях 234-238, имеющий аминокислотные мутации в положениях 234, 235, 237, 318, 320 и 322) и CH3-домен человека дикого типа, так что константная подобласть не стимулирует иммунологические активности, такие как ADCC, ADCP, CDC, связывание Fc-рецептора или любое их сочетание. В других вариантах измененный CH2-домен IgG1 человека может иметь мутации, известные в данной области, которые усиливают иммунологические активности, такие как ADCC, ADCP, CDC, связывание Fc-рецептора или любое их сочетание. В некоторых других предпочтительных вариантах константная подобласть содержит CH3-домен IgM человека дикого типа и CH4-домен IgM человека дикого типа или CH3-домен IgE человека дикого типа и CH4-домен IgE человека дикого типа.
В некоторых вариантах CD37-специфичная связывающая молекула может содержать одну или несколько дополнительных областей. Такие дополнительные области могут представлять собой лидерную последовательность на амино-конце для секреции экспрессированной CD37-специфичной связывающей молекулы, хвостовую последовательность на карбоксильном конце в целях идентификации или очистки (например, эпитопные метки для регистрации или очистки, включая 6-гистидиновую метку или эпитоп FLAG) или дополнительные аминокислотные остатки, которые являются результатом применения конкретных систем экспрессии. Примеры лидерных пептидов согласно настоящему изобретению включают природные лидерные последовательности или другие, такие как последовательности, которые указаны в SEQ ID NO: 223 и 224.
В некоторых вариантах слитые белки могут иметь один или несколько (например, 2-8) аминокислотных остатков между двумя доменами (например, между вариабельными доменами иммуноглобулина и линкерным полипептидом, между связывающим доменом и линкерным полипептидом или шарниром, между линкерным полипептидом или шарниром и полипептидом CH2-области иммуноглобулина или между полипептидом CH2-области иммуноглобулина и полипептидом CH3-области иммуноглобулина), такие аминокислотные остатки являются результатом создания конструкции слитого белка (например, аминокислотные остатки появляются в результате использования сайта ферментов рестрикции при конструировании молекулы нуклеиновой кислоты, кодирующей одноцепочечный полипептид). Как описано в настоящей публикации, такие аминокислотные остатки могут быть названы «соединительными аминокислотами» или «соединительными аминокислотными остатками».
В используемом в настоящем описании смысле белок «состоит по существу из одного домена (например, CD37-специфичного связывающего домена) или нескольких доменов (например, CD37-специфичного связывающего домена, линкерного полипептида, CH2-области иммуноглобулина, CH3-области иммуноглобулина), если другие части белка (например, аминокислоты на амино- или карбоксильном конце или между двумя доменами) в сочетании составляют не более 20% (например, не более 15%, 10%, 8%, 6%, 5%, 4%, 3%, 2% или 1%) длины белка и по существу не влияют (т.е., не уменьшают активность более чем на 50%, например, более чем на 40%, 30%, 25%, 20%, 15%, 10% или 5%) активность белка, такую как аффинность по отношению к CD37 или способность уменьшать количество B-клеток. В некоторых вариантах CD37-специфичная связывающая молекула представляет собой белок SMIP, по существу состоящий из CD37-специфичного связывающего домена, шарнирного полипептида иммуноглобулина, полипептида CH2-области иммуноглобулина и полипептида CH3-области иммуноглобулина. Такие молекулы могут дополнительно содержать соединительные аминокислоты на амино- или карбоксильном конце молекулы или между двумя разными доменами (например, между связывающим доменом и шарнирным полипептидом, между шарнирным полипептидом и полипептидом CH2-области иммуноглобулина и/или между полипептидом CH2-области иммуноглобулина и полипептидом CH3-области иммуноглобулина).
В некоторых вариантах CD37-специфичные связывающие молекулы представляют собой анти-CD37-антитела, включая антитела, известные в данной области. Примерами анти-CD37-антител являются HD28, G28-1, HH1, BI14, WR17 и F93G6, используемые для характеристики CD37-антигена на третьем симпозиуме по HLDA (смотри, Ling and MacLennan, pp. 302-335, Leucocyte Typing III. White Cell Differentiation Antigens, Oxford University Press, 1987). Другие CD37-специфичные антитела, которые были описаны, включают RFB-7, Y29/55, MB-1, M-B371, M-B372 и IPO-24 (смотри Moldenhaurer (2000) J. Biol. Regul. Homeost. Agents 14: 281, где показано, что все такие антитела узнают один эпитоп CD37). В публикации Schwartz-Albiez с соавторами (J. Immunol. 140: 905, 1988) отмечено, что эпитоп вероятно расположен в углеводном остатке CD37. Другим CD37-специфичным антителом является SB3 (Biosys). В некоторых предпочтительных вариантах любые такие анти-CD37-антитела являются химерными или гуманизированными антителами или их антигенсвязывающими частями для применения в сочетании с ингибитором mTOR или ингибитором PI3K, как описано в настоящей публикации.
В предпочтительном варианте CD37-связывающий домен согласно настоящему изобретению представляет собой антигенсвязывающую часть антитела или включает в себя вариабельные домены иммуноглобулина, которые специфично связываются с CD37. Примерами CD37-антигенсвязывающих частей антитела являются (i) Fab-фрагмент, антигенсвязывающая часть, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab')2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из VH- и CH1-доменов; (iv) Fv-фрагмент, состоящий из VL- и VH-доменов из одного плеча антитела, (v) фрагмент доменного Ab (Ward et al. (1989) Nature 341: 544), состоящего из VH-домена; (vi) одноцепочечный вариабельный фрагмент (scFv), состоящий из VL- и VH-доменов, связанных 5-35-аминокислотным линкером (смотри, например, Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85: 5879; Shan et al. (1999) J. Immunol. 162: 6589), и (vii) изолированная CDR.
В некоторых вариантах CD37-специфичные связывающие молекулы представляют собой CD37-специфичные полипептиды SMIP. Например, CD37-специфичная связывающая молекула может представлять собой CD37-специфичный полипептид SMIP, который содержит в направлении от своего амино-конца к карбоксильному концу: (a) CD37-специфичный связывающий домен, (ii) шарнирную область или линкерный полипептид, (iii) (a) полипептид CH2 иммуноглобулина IgG, IgA или IgD и полипептид CH3 иммуноглобулина IgG, IgA или IgD, или (b) полипептид CH3 иммуноглобулина IgM или IgE и полипептид CH4 иммуноглобулина IgM или IgE. CD37-специфичный связывающий домен, линкерный полипептид, полипептид CH2 иммуноглобулина, полипептид CH3 иммуноглобулина, полипептид CH4 иммуноглобулина описаны в настоящей публикации.
Типичные CD37-специфичные полипептиды SMIP содержат последовательность, указанную в SEQ ID NO: 2 или 253. Дополнительные примеры CD37-специфичных полипептидов SMIP описаны в публикации PCT № WO 2005/017148, такие как (1) G28-1 scFv (SSS-S) H WCH2 WCH3, содержащий scFv G28-1, измененный шарнир IgG1 человека, в котором все три остатка цистеина и пролин, расположенный на карбоксильном конце по отношению к третьему цистеину в шарнирной области IgG1 человека мутированы до остатков серина, и домены CH2 и CH3 IgG1 человека дикого типа; (2) G28-1 scFv IgAH WCH2 WCH3, содержащий scFv G28-1, часть шарнира IgA человека и домены CH2 и CH3 IgG1 человека; (3) G28-1 scFv VHL11 S (SSS-S) H WCH2 CH3, содержащий scFv G28-1, измененный шарнир IgG1 человека, в котором все три остатка цистеина и пролин на карбоксильном конце по отношению к третьему цистеину в шарнирной области мутированы до остатков серина, и домены CH2 и CH3 IgG1 человека, где лейцин в положении 11 вариабельной области тяжелой цепи заменен на серин; (4) G28-1 scFv VH L11S (CSS-S) H WCH2 CH3, содержащий scFv G28-1, измененный шарнир IgG1 человека, в котором остатки цистеина во втором и третьем положениях и пролин на карбоксильном конце по отношению к третьему цистеину заменены остатками серина, и домены CH2 и CH3 IgG1 человека, где лейцин в положении 11 вариабельной области тяжелой цепи заменен серином; (5) G28-1 scFv VHL11 S (CSC-S) H WCH2 CH3, содержащий scFv G28-1, измененный шарнир IgG1 человека, в котором остаток цистеина во втором положении и пролин на карбоксильном конце по отношению к цистеину в третьем положении заменены остатками серина, и домены CH2 и CH3 IgG1 человека, где лейцин в положении 11 вариабельной области тяжелой цепи заменен серином; (6) G28-1 scFv VH11 S (SSC-P) H WCH2 WCH3, содержащий scFv G28-1, измененный шарнир IgG1 человека, в котором первый и второй остатки цистеина в шарнирной области мутированы до остатков серина, и домены CH2 и CH3 IgG1 человека, где лейцин в положении 11 вариабельной области тяжелой цепи заменен серином; (7) G28-1 scFv VH11 S (SCS-S) H WCH2 WCH3, содержащий scFv G28-1, измененный шарнир IgG1 человека, в котором первый и третий остатки цистеина и пролин на карбоксильном конце по отношению к третьему цистеину в шарнирной области мутированы до остатков серина, и домены CH2 и CH3 IgG1 человека, где лейцин в положении 11 вариабельной области тяжелой цепи заменен серином; (8) G28-1 scFv VHL11 S (CCS-P) H WCH2 WCH3, содержащий scFv G28-1, измененный шарнир IgG1 человека, в котором третий остаток цистеина в шарнирной области заменен серином, и домены CH2 и CH3 IgG1 человека, где лейцин в положении 11 вариабельной области тяжелой цепи заменен серином (9) G28-1 scFv VHL11 S (SCC-P) H WCH2 WCH3, содержащий scFv G28-1, измененный шарнир IgG1 человека, в котором первый цистеин заменен серином, и домены CH2 и CH3 человека, где лейцин в положении 11 вариабельной области тяжелой цепи заменен серином; (10) G28-1 scFv VH L11S mIgE CH2 CH3 CH4, содержащий scFv G28-1 и области CH2, CH3 и CH4 IgE мыши, где лейцин в положении 11 вариабельной области тяжелой цепи заменен серином; (11) G28-1 scFv VH L11S mIgA WIgACH2 T4CH3, содержащий scFv G28-1, шарнир IgA мыши и CH2 IgA дикого типа и укороченный CH3-домен IgA, в котором отсутствуют 4 аминокислоты на карбоксильном конце GTCY (SEQ ID NO: 265); (12) G28-1 scFv VHL11S hIgE CH2 CH3 CH4, содержащий scFv G28-1 и области CH2, CH3 и CH4 IgE человека, где лейцин в положении 11 вариабельной области тяжелой цепи заменен серином; и (13) G28-1 scFv VHL11S hIgAH WIgACH2 TCH3, содержащий scFv G28-1, часть шарнира IgA человека, CH2 IgA дикого типа и укороченный CH3-домен IgA, в котором отсутствуют 4 аминокислоты на карбоксильном конце GTCY (SEQ ID NO: 265), где лейцин в положении 11 вариабельной области тяжелой цепи заменен серином; при этом все указанные примеры включены в настоящее описание в виде ссылки.
В предпочтительных вариантах CD37-специфичные полипептиды SMIP содержат гуманизированные CD37-специфичные связывающие домены. В некоторых вариантах гуманизированные CD37-специфичные полипептиды SMIP имеют, по меньшей мере, 70-процентную идентичность (например, по меньшей мере, 70%, 72%, 74%, 76%, 80%, 82%, 84%, 85%, 86%, 88%, 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99%) с полипептидом, указанным в SEQ ID NO: 2 или 253, и специфично связывает CD37. Типичные гуманизированные CD37-специфичные полипептиды SMIP содержат, по существу состоят или состоят из любой аминокислотной последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 52, 80, 82, 84, 86, 88, 222 и 262, но без лидерных последовательностей, а также SEQ ID NO: 247-254 и 266-269. Изолированные молекулы нуклеиновых кислот, которые кодируют типичные гуманизированные CD37-специфичные полипептиды SMIP, предлагаемые в настоящем изобретении, включают молекулы, которые содержат последовательности SEQ ID NO: 5, 7, 9, 11 , 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 51, 79, 81, 83, 85, 87 и 221.
В предпочтительном варианте CD37-специфичная связывающая молекула содержит или состоит из аминокислотной последовательности, которая указана в SEQ ID NO: 253. В другом предпочтительном варианте CD37-специфичная связывающая молекула по существу состоит из аминокислотной последовательности, которая указана в SEQ ID NO: 253. В еще одном предпочтительном варианте CD37-специфичная связывающая молекула состоит из аминокислотной последовательности, которая указана в SEQ ID NO: 253.
В некоторых вариантах CD37-специфичные связывающие молекулы представляют собой CD37-специфичные полипептиды PIMS. Например, CD37-специфичный полипептид PIMS может содержать в направлении от своего амино-конца к карбоксильному концу константную подобласть, полученную из антитела (например, область, которая содержит CH2-домен и CH3-домен IgG, IgA или IgD, или область, которая содержит CH3-домен и CH4-домен IgM или IgE), линкер пептид и CD37-специфичный связывающий домен (включая гуманизированный CD37-специфичный связывающий домен). В некоторых вариантах CD37-специфичный полипептид PIMS может дополнительно содержать второй линкерный пептид, который может быть таким же как линкерный пептид между константной подобластью и CD37-специфичным связывающим доменом или другим. CD37-специфичный связывающий домен, линкер полипептид, CH2-полипептид иммуноглобулина, CH3-полипептид иммуноглобулина, CH4-полипептид иммуноглобулина описаны в настоящей публикации.
В некоторых вариантах CD37-специфичные связывающие молекулы представляют собой CD37-специфичные полипептиды SCORPION. Например, CD37-специфичный белок SCORPION может быть одноцепочечным поливалентным связывающим белком с эффекторной функцией, содержащим в направлении от амино-конца к карбоксильному концу: (a) первый связывающий домен, содержащий вариабельные домены из иммуноглобулина или иммуноглобулин-подобной молекулы, (b) первый шарнирный или линкерный пептид, (c) константную подобласть иммуноглобулина, обеспечивающую эффекторную функцию, (d) второй шарнирный или линкерный пептид и (e) второй связывающий домен, содержащий вариабельные домены из иммуноглобулина или иммуноглобулин-подобной молекулы, где первый связывающий домен, второй связывающий домен или оба, и первый и второй связывающие домены, специфично связываются с CD37 человека. CD37-специфичный связывающий домен, шарнирный или линкерный полипептид и константная подобласть иммуноглобулина описаны в настоящей публикации.
В следующих вариантах Fc-область иммуноглобулина (например, области CH2, CH3 и/или CH4) CD37-специфичных связывающих молекул согласно настоящему изобретению может иметь измененную картину гликозилирования по сравнению с эталонной последовательностью иммуноглобулина. Например, можно использовать любой из множества генетических способов, чтобы изменить один или несколько конкретных аминокислотных остатков, которые образуют сайт гликозилирования (смотри Co et al. (1993) Mol. Immunol. 30: 1361; Jacquemon et al. (2006) J. Thromb. Haemost. 4: 1047; Schuster et al. (2005) Cancer Res. 65: 7934; Warnock et al. (2005) Biotechnol. Bioeng. 92: 831), таких как N297 CH2-домена (нумерация EU). Альтернативно могут быть сконструированы клетки-хозяева, продуцирующие слитые белки согласно настоящему изобретению, так чтобы получить измененную картину гликозилирования. Например, в одном из способов, известных в данной области, получают измененное гликозилирование в форме разветвленных нефукозилированных вариантов, которые увеличивают ADCC. Такие варианты являются результатом экспрессии в клетке-хозяине, содержащей фермент, модифицирующий олигосахариды. Альтернативно предполагается использование методики Potelligent BioWa/Kyowa Hakko для уменьшения содержания фукозы в гликозилированных молекулах согласно настоящему изобретению. В одном известном способе предлагается клетка-хозяин CHO для получения рекомбинантных иммуноглобулинов, которая модифицирует картину гликозилирования Fc-области иммуноглобулина посредством продуцирования GDP-фукозы.
Альтернативно используют химические методики для изменения картины гликозилирования слитых белков согласно настоящему изобретению. Например, множество ингибиторов гликозидазы и/или маннозидазы обеспечивают один или несколько требуемых эффектов в отношении увеличения активности ADCC, повышения связывания Fc-рецептора и изменения картины гликозилирования. В некоторых вариантах клетки, экспрессирующие CD37-специфичную связывающую молекулу согласно настоящему изобретению, выращивают в культуральной среде, содержащей модификатор углеводов в концентрации, которая повышает ADCC иммуногликопротеидных молекул, продуцируемых указанной клеткой-хозяином, при этом указанный модификатор углеводов присутствует в концентрации, составляющей менее 800 мкМ. В предпочтительном варианте клетки, экспрессирующие такие полиспецифичные слитые белки, выращивают в культуральной среде, содержащей кастаноспермин или кифунензин, более предпочтительно кастаноспермин в концентрации 100-800 мкМ, например, 100 мкМ, 200 мкМ, 300 мкМ, 400 мкМ, 500 мкМ, 600 мкМ, 700 мкМ или 800 мкМ. Способы изменения гликозилирования модификатором углеводов, таким как кастаноспермин, описаны в публикации заявки на выдачу патента США № 2009/0041756 или в публикации PCT № WO 2008/052030.
Настоящая заявка относится к применению ингибиторов mTOR или PI3K в сочетании с любыми CD37-специфичными связывающими молекулами, описанными в настоящей публикации или известными в данной области для уменьшения количества B-клеток или лечения заболеваний или расстройств, ассоциированных с аномальной активностью B-клеток.
Ингибиторы mTOR
В качестве описания уровня техники, гиперпролиферативные заболевания (такие как злокачественная опухоль) могут быть следствием аномальной передачи клеточных сигналов. Например, мишенью рапамицина у млекопитающих («mTOR») является крупная, многодоменная сериновая/треониновая киназа, которая имеет каталитический домен, обладающий гомологией с PI3K-семейством протеинкиназ. mTOR (также известная как белок 1, ассоциированный с комплексом FK506-связывающий белок 12-рапамицин, или FRAP) является важной промежуточной молекулой в передаче сигнала ниже пути PI3K/AKT, которая ингибирует апоптоз и функционирует в качестве сенсора уровней питательных вещества и энергии и окислительно-восстановительного статуса (смотри, например, Tokunaga et al. (2004) Biochem. Biophys. Res. Commun. 313:443; Grunwald et al. (2002) Cancer Res. 62:6141; Stolovich et al. (2002) Mol. Cell Biol. 22:8101). mTOR, по-видимому, вовлечена в клеточный рост, пролиферацию клеток, подвижность клеток, жизнеспособность клеток, синтез белка и транскрипцию (смотри, например, Hay and Sonenberg (2004) Genes Dev. 18: 1926; Beevers et al. (2006) Int. J. Cancer 119: 757). Нарушение регуляции пути mTOR является фактором, который вносит вклад в развитие различных патологических процессов у человека, особенно различных типов злокачественной опухоли (Beevers et al., 2006), которые содержат трансформированные B-клетки (смотри Wlodarski et al. (2005) Cancer Res. 65: 7800; Leseux et al. (2006) Blood 108: 4156). Путь mTOR также вовлечен в развитие мультиформной глиобластомы, почечно-клеточной карциномы и множественной миеломы.
mTOR присутствует в клетках в двух комплексах, комплексе mTOR 1 (mTORC1) и комплексе mTOR 2 (mTORC2) (Wullschleger et al. (2006) Cell 124: 471). mTORC1 состоит из mTOR, регуляторного ассоциированного белка mTOR (Raptor), белка, подобного β-субъединице LST8/G-белка (mLST8/GβL), и PRAS40. Для такого комплекса характерны классические признаки mTOR, поскольку он функционирует в качестве сенсора питательных веществ/энергии/окислительно-восстановительного статуса и контролирует синтез белка.
mTORC1 регулирует активность, по меньшей мере, двух белков: P70S6-киназы 1 и 4E-BP1, белка 1, связывающего эукариотический фактор инициации 4E (elF4E). mTORC1 фосфорилирует p70S6-киназу 1 по серину 389 и треонину 412. Такое фосфорилирование можно выявить в экстрактах целых клеток, обработанных фактором роста, с использованием антитела, специфичного для остатка фосфосерина 389. Также показано, что mTORC1 фосфорилирует, по меньшей мере, четыре остатка 4E-BP1.
mTORC2 состоит из mTOR, нечувствительного к рапамицину спутника mTOR (Rictor), GβL и белка, взаимодействующего с активируемой стрессом протеинкиназой млекопитающих (mSIN1). Было показано, что mTORC2 функционирует в качестве важного регулятора цитоскелета посредством стимуляции стрессорных волокон F-актина, паксиллина, RhoA, Rac, Cdc42 и протеинкиназы Cα (PKCα). Он фосфорилирует сериновую/треониновую протеинкиназу AKT/PKB по остатку серина 473.
В используемом в настоящем описании смысле термин «ингибитор mTOR» относится к соединению или лиганду, который ингибирует, по меньшей мере, одну активность mTOR, такую как активность сериновой/треониновой протеинкиназы, по меньшей мере, на одном из ее субстратов {например, p70S6-киназы 1, 4E-BP1, AKT/PKB и eEF2). Специалист в данной области легко может определить, является ли соединение, такое как рапамицин или его аналог или производное ингибитором mTOR. Конкретный способ идентификации таких соединений или лигандов описан, например, в публикации заявки на выдачу патента США № 2003/0008923.
В некоторых вариантах ингибитор mTOR ингибирует, по меньшей мере, одну активность mTORC1. В следующих вариантах ингибитор mTOR ингибирует, по меньшей мере, одну активность mTORC2. В следующих вариантах ингибитор mTOR ингибирует, по меньшей мере, одну активность mTORC1 и, по меньшей мере, одну активность mTORC2. В некоторых вариантах ингибитор mTOR представляет собой соединение или лиганд, который ингибирует репликацию в клетке посредством блокирования прохождения клеточного цикла из G1 в S-фазу за счет ингибирования фосфорилирования серина 389 или треонина 412 киназой p70s6.
Предпочтительный ингибитор mTOR, рапамицин (непатентованное название USAN сиролимус), описан в патенте США № 3929992. В некоторых вариантах композицию, содержащую CD37-специфичную связывающую молекулу, можно сочетать или использовать в сочетании с ингибитором mTOR, таким как рапамицин (сиролимус), темсиролимус, дефоролимус, эверолимус, такролимус, зотаролимус, куркумин, фарнезилтиосалициловая кислота или тому подобные.
В используемом в настоящем описании смысле термин «аналог рапамицина или его производное» включает соединения, имеющие структуру центральной части рапамицина, которая определена в публикации заявки на выдачу патента США № 2003/0008923 (описание структуры центральной части рапамицина включено в настоящее описание в виде ссылки), которые могут быть химически или биологически модифицированы, но при этом все еще сохраняют свойства ингибирования mTOR. Такие производные включают сложные эфиры, простые эфиры, оксимы, гидразоны и гидроксиламины рапамицина, а также соединения, в которых функциональные группы в структуре центральной части рапамицина были модифицированы, например, в результате восстановления или окисления. Фармацевтически приемлемые соли таких соединений также считают производными рапамицина.
Конкретные примеры сложных эфиров и простых эфиров рапамицина являются сложными эфирами и простыми эфирами гидроксильных групп в положениях 42 и/или 31 ядра рапамицина, и сложными эфирами и простыми эфирами гидроксильной группы в положении 27 (после химического восстановления 27-кетона). Конкретными примерами оксимов, гидразонов и гидроксиламинов являются кетон в положении 42 (после окисления 42-гидроксильной группы) и 27-кетон ядра рапамицина.
Примеры 42- и/или 31-сложных эфиров и простых эфиров рапамицина описаны в следующих патентах, которые включены в настоящее описание в виде ссылки в полном объеме: сложные алкиловые эфиры (патент США № 4316885); сложные аминоалкиловые эфиры (патент США № 4650803); фторированные сложные эфиры (патент США № 5100883); сложные эфиры амидов (патент США № 5118677); карбаматные сложные эфиры (патент США № 5118678); простые силиловые эфиры (патент США № 5120842); сложные аминоэфиры (патент США № 5130307); ацетали (патент США № 551413); сложные аминодиэфиры (патент США № 5162333); сульфонатные и сульфатные сложные эфиры (патент США № 5177203); сложные эфиры (патент США № 5221670); сложные алкоксиэфиры (патент США № 5233036); простые O-ариловые, -алкиловые, -алкениловые и -алкиниловые эфиры (патент США № 5258389); сложные карбонатные эфиры (патент США № 5260300); арилкарбонильные и алкоксикарбонильные карбаматы (патент США № 5262423); карбаматы (патент США № 5302584); сложные гидроксиэфиры (патент США № 5362718); стерически затрудненные сложные эфиры (патент США № 5385908); гетероциклические сложные эфиры (патент США № 5385909); гем-дизамещенные сложные эфиры (патент США № 5385910); эфиры аминоалканоевой кислоты (патент США № 5389639); фосфорилкарбаматные сложные эфиры (патент США № 5391730); карбаматные сложные эфиры (патент США № 5411967); карбаматные сложные эфиры (патент США № 5434260); амидинокарбаматные сложные эфиры (патент США № 5463048); карбаматные сложные эфиры (патент США № 5480988); карбаматные сложные эфиры (патент США № 5480989); карбаматные сложные эфиры (патент США № 5489680); затрудненные сложные эфиры N-оксидов (патент США № 5491231); сложные эфиры биотина (патент США № 5504091); O-алкиловые сложные эфиры (патент США № 5665772); и сложные ПЭГ-эфиры рапамицина (патент США № 5780462).
Примеры 27-сложных эфиров и простых эфиров рапамицина описаны в патенте США № 5256790, который включен в настоящее описание в виде ссылки в полном объеме.
Примеры оксимов, гидразонов и гидроксиламинов рапамицина описаны в патентах США № 5373014, 5378836, 5023264 и 5563145, которые включены в настоящее описание в виде ссылки. Получение таких оксимов, гидразонов и гидроксиламинов описано в перечисленных выше патентах. Получение 42-оксорапамицина описано в патенте США № 5023263, который включен в настоящее описание в виде ссылки.
Другие соединения, входящие в объем термина «аналог или производное рапамицина» включают соединения и классы соединений, называемых «рапалогами», описанные, например, в публикации WO 98/02441 и приведенных в ней ссылках, и «эпирапалоги», описанные, например, в публикации WO 01/14387 и приведенных в ней ссылках.
Другим соединением, входящим в объем термина «производные рапамицина», является эверолимус, 4-O-(2-гидроксиэтил)рапамицин, полученный из макролидного антибиотика, продуцируемого Streptomyces hygroscopicus (Novartis). Эверолимус также известен как Certican®, RAD-001 и SDZ-RAD. Другим предпочтительным ингибитором mTOR является зотаролимус, антипролиферативное средство (Abbott Laboratories). Зотаролимус, как полагают, ингибирует пролиферацию гладкомышечных клеток, оказывая цитостатическое действие в результате ингибирования mTOR. Другим предпочтительным ингибитором mTOR является такролимус, макролидный лактон, являющийся иммунодепрессантом, выделенный из почвенного гриба Streptomyces tsukubaensis. Такролимус также известен как FK 506, FR 900506, фуджимицин, L 679934, цукубаенолид, PROTOPIC® и PROGRAF®. Другими предпочтительными ингибиторами mTOR являются AP-23675, AP-23573 и AP-23841 (Ariad Pharmaceuticals).
Предпочтительные производные рапамицина включают эверолимус, CCI-779 (сложный 42-эфир рапамицина и 3-гидрокси-2-(гидроксиметил)-2-метилпропионовой кислоты; патент США № 5362718); 7-эпирапамицин; 7-тиометилрапамицин; 7-эпитриметоксифенилрапамицин; 7-эпитиометилрапамицин; 7-деметоксирапамицин; 32-деметоксирапамицин; 2-десметилрапамицин и 42-O-(2-гидрокси)этилрапамицин (патент США № 5665772).
Примеры соединений ингибиторов mTOR формулы A, приведенные в US 2008/0214596 (Novartis), включены в настоящее описание в виде ссылки.
Соединения формулы A также описаны, например, в публикациях PCT № WO 94/09010, WO 95/16691, WO 96/41807, WO 99/15530 и в патенте США № 5362718, и описание таких соединений включено в настоящее описание в виде ссылки. Такие соединения могут быть получены с использованием способов, описанных в таких публикациях.
Дополнительные ингибиторы mTOR включают ингибиторы TORC1 и TORC2. Например, OSI-027 (OSI Pharmaceuticals) является низкомолекулярным ингибитором TORC1/TORC2. OSI-027 ингибирует оба комплекса передачи сигналов TORC1 и TORC2, обеспечивая возможность полного прерывания аномальной передачи сигнала по этому пути. Кроме того, также можно использовать торкинибы, ингибирующие с АТФ ингибиторы киназного домена mTOR и ингибиторы как mTORC1, так и mTORC2, также могут быть использованы в сочетании с CD37-специфичными связывающими молекулами согласно настоящему изобретению. Примеры торкинибов включают PP242 и PP30 (смотри, Feldman et al. (2009) PLoS Biology 7: 371) и Torin1 (Thoreen et al. (2009) J. Biol. Chem. 284: 8023).
Ингибиторы PI3K
Фосфоинозитид-3-киназы (PI3-киназы или PI3K) составляют семейство родственных ферментов-переносчиков внутриклеточных сигналов, способных фосфорилировать гидроксильную группу в 3 положении цикла инозитола в фосфатидилинозитоле (PtdIns или PI). Такие ферменты также известны как фосфатидилинозитол-3-киназы. На основании первичной структуры, регуляции и субстратной специфичности in vitro по отношению к липидам семейство фосфоинозитол-3-киназ можно разделить на три разных класса: класс I, класс II и класс III (смотри Leevers et al. (1999) Current Op. Cell Biol. 11: 219).
PI3K класса I отвечают за продукцию фосфатидилинозитол-3-фосфата (PI(3)P), фосфатидилинозитол-(3,4)-дифосфата (PI(3,4)P2) и фосфатидилинозитол-(3,4,5)-трифосфата (PI(3,4,5)P3). PI3K активируется сопряженными с G-белком рецепторами и рецепторами тирозинкиназ. PI3K класса I являются гетеродимерными молекулами, состоящими из регуляторной и каталитической субъединиц; кроме того, они делятся на две подгруппы IA и IB на основании сходства последовательностей. PI3K класса IA состоят из одной из пяти регуляторных субъединиц p85α, p55α, p50α, p85β или p55γ, связанной с каталитической субъединицей p110α, β или δ. Две первых изоформы p110 (α и β) экспрессируются во всех клетках, но p110δ главным образом экспрессируется в лейкоцитах. Было выдвинуто предположение, что p110δ развивается параллельно с адаптивной иммунной системой. Регуляторная субъединица p101 и каталитическая субъединица p110γ составляют PI3K типа IB.
PI3K связывали с разнообразной группой клеточных функций, включая клеточный рост, пролиферацию, дифференцировку, подвижность, жизнеспособность и внутриклеточный транспорт. Многие из таких функций имеют отношение к способности PI3K класса I активировать протеинкиназу B (PKB, aka AKT). p110α PI3K класса IA подвергается мутации во многих злокачественных опухолях, и многие из таких мутаций заставляют киназу быть более активной. PtdIns(3,4,5)P3-фосфатаза PTEN, которая антагонизирует передачу сигнала PI3K, отсутствует во многих опухолях. Поэтому активность PI3K вносит вклад в трансформацию клеток и развитие злокачественной опухоли. Сообщения свидетельствуют о том, что p110α может играть роль в жизнеспособности клеток, тогда как p110β может быть более важным для стимуляции клеточной пролиферации (смотри Benistant et al. (2000) Oncogene 19: 5083). Изоформы p110δ и p110γ регулируют разные аспекты иммунных ответов (Rommel et al. (2007) Nat. Rev. Immunol. 7: 191; Ruckle et al. (2007) Nat. Rev. Drug Discov. 5: 903). Было высказано предположение, что изоформа p100γ играет ключевую роль в качестве модулятора воспаления и аллергии (Wymann et al. (2003) Biochem. Soc. Trans. 31: 275), тогда как изоформа p100δ, как предполагается, является необходимой для полной передачи сигналов рецепторов B- и T-клеточных антигенов (Okkenhaug et al. (2002) Science 297: 1031). PI3K также является ключевым компонентом пути передачи сигнала инсулина.
PI3K класса II содержат три каталитических изоформы (C2α, C2β и C2γ), но в отличие от классов I и III, не содержат регуляторных белков. PI3K класса II катализируют продукцию PI(3)P и PI(3,4)P2 из PI. C2α и C2β экспрессируются по всему организму; однако экспрессия C2γ ограничена гепатоцитами. Представлены некоторые доказательства того, что PI3K класса II, подобно PI3K класса I, могут быть активированы внешними стимулами через рецепторную тирозинкиназу (RTK), рецепторы цитокинов и интегрины, что свидетельствует о роли в развитии злокачественной опухоли, заживлении ран и передачи сигнала инсулина.
PI3K класса III продуцируют только PI(3)P из PI, но более сходны по структуре с классом I, так как они существуют в виде гетеродимеров, имеющих каталитическую (Vps34) и регуляторную (p150) субъединицы. PI3K класса III, по-видимому, в основном вовлечены в транспорт белков и везикул, созревание фагосом и аутофагию (Falasca et al. (2007) Biochem. Soc. Trans. 35: 211).
Различные 3-фосфорилированные фосфоинозитиды, которые продуцируются ферментами PI3K (например, PtdIns3P, PtdIns(3,4)P2, PtdIns(3,5)P2 и PtdIns(3,4,5)P3) функционируют в механизме, посредством которого соответствующая группа передающих сигналы белков, содержащих домен PX домен, домен гомологии с плекстрином (PH-домены), FYVE-домены и другие фосфоинозитид-связывающие домены привлекаются в различные клеточные мембраны благодаря прямым взаимодействиям липид-белок (Fruman et al. (1998) Annu. Rev. Biochem. 67: 481; Hawkins et al. (2006) Biochem. Soc. Trans. 34: 647). Например, AKT активируется в результате активности PI3-киназы, поскольку AKT требует образования молекулы PtdIns(3,4,5)P3 (или «PIP3») для перемещения к клеточной мембране. Затем в PIP3 AKT фосфорилируется другой киназой, называемой фосфоинозитид-зависимой протеинкиназой (PDPK1), и при этом активируется. Показано, что путь передачи сигнала «PI3K/AKT» регулируется в случае очень разнообразного множества клеточных активностей - прежде всего пролиферации и жизнеспособности клеток.
Кроме AKT и PDK1, другая родственная сериновая-треониновая киназа, SGK, связывается с молекулой PIP3, образуемой в результате активности PI3-киназы. PI3K также вовлечена в долговременную потенциацию (LTP). Путь PI3K также мобилизует многие белки ниже в каскаде, включая mTOR, GSK3β и PSD-95.
В используемом в настоящем описании смысле термин «ингибитор PI3K» относится к соединению, которое ингибирует, по меньшей мере, одну активность PI3K класса I, II или III, по меньшей мере, на одном из субстратов (например, фосфорилирование фосфатидилинозитола с получением фосфатидилинозитол-3-фосфата (PI(3)P), фосфатидилинозитол-(3,4)-дифосфата (PI(3,4)P2) или фосфатидилинозитол-(3,4,5)-трифосфата (PI(3,4,5)P3). Специалист в данной области легко может определить, является ли соединение, такое как вортманнин или LY294002, ингибитором PI3K. Конкретный способ идентификации таких соединений или лиганда описан, например, в патентах США № 5858753, 5882910 и 5985589, Jackson et al. (2005) Nat. Med. 11: 507, Pomel et al. (2006) J. Med. Chem. 49: 3857; Palanki et al. (2007) J. Med. Chem. 50: 4279), и описание таких способов включено в настоящее описание в виде ссылки.
В некоторых вариантах ингибитор PI3K ингибирует активность PI3K класса I. Например, ингибитор PI3K может ингибировать p110α, p110β, p110γ или p110δ. В предпочтительных вариантах ингибитор PI3K блокирует или снижает активность p110γ или p110δ по сравнению с необработанным p110γ или p110δ. В некоторых вариантах ингибитор PI3K ингибирует активность PI3K класса II. Например, ингибитор PI3K может ингибировать PI3K-C2α, PI3K-C2β или PI3K-C2γ. В некоторых вариантах ингибитор PI3K ингибирует активность PI3K класса III, Vps34.
В некоторых вариантах ингибитор PI3K является избирательным или специфичным по отношению к конкретной изоформе PI3K. Ингибитор является «избирательным» или «специфичным» по отношению к конкретной изоформе PI3K, если он ингибирует конкретную изоформу PI3K более эффективно, чем другие изоформы PI3K. Например, ингибитор, специфичный по отношению к конкретной изоформе PI3K, может иметь IC50 для конкретной изоформы PI3K не более чем примерно 1/10 (например, не более чем примерно 1/20, 1/30, 1/40, 1/50, 1/60, 1/80, 1/100, 1/200, 1/300, 1/400, 1/500, 1/600, 1/800 или 1/1000) от IC50 для других изоформ PI3K. Например, ингибитор, специфичный по отношению к p110δ, может иметь значение IC50 для p110δ не более чем примерно 1/10 от IC50 для других изоформ PI3K (например, p110α, p110β или p110γ).
В предпочтительных вариантах ингибитор PI3K является специфичным по отношению к p110α, p110β, p110γ или p110δ. В некоторых вариантах ингибитор PI3K ингибирует два или более класса или подкласса PI3K. В некоторых вариантах ингибитор PI3K также является ингибитором mTOR.
Предпочтительным ингибитором PI3K является LY294002 (2-морфолин-4-ил-8-фенилхромен-4-он) или вортманнин. LY294002 и вортманнин являются ингибиторами широкого спектра действия против PI3K и также могут ингибировать mTOR. Ингибиторы PI3K, применимые в комбинированной терапии с CD37-специфичными связывающими молекулами, включают производные вортманнина, такие как PX-866 (смотри, Ihle et al., Mol. Cancer Ther. 3: 763-72, 2004).
Примеры p110γ-специфичных ингибиторов, применимых в настоящем описании, включают фуран-2-илметилентиазолидиндионы (AS-252424) (смотри, Pomel et al., 2006, выше) и 3,3'-(2,4-диаминоптеридин-6,7-диил)дифенол (смотри, Palanki et al., выше). Примеры p110δ-специфичных ингибиторов, применимых в настоящем изобретении, включают IC486068 и IC87114 (ICOS Corp., в настоящее время Eli Lilly and Company) и CAL-101 и CAL-263 (Calistoga Pharmaceuticals). Другим ингибитором PI3K, который можно использовать в сочетании с CD37-специфичной связывающей молекулой, является CAL-120, ингибитор PI3K, который ингибирует p110δ и p110β (Calistoga Pharmaceuticals). Другим примером ингибитора PI3K, который можно использовать в сочетании с CD37-специфичной связывающей молекулой, является GDC-0941 бисмезилат-(2-(1H-индазол-4-ил)-6-(4-метансульфонилпиперазин-1-илметил)-4-морфолин-4-илтиено[3,2-d]пиримидин, бимезилатная соль), избирательный ингибитор p110α и P110δ.
Дополнительные ингибиторы PI3K включают производные пиразола, описанные в публикации PCT № WO 2009/059030, производные аминотриазола, описанные в WO 2009/068482, соединение имидазотиадиазола, описанное в WO 2009/040552, конденсированные соединения пиримидин-4-она, специфичное для p110δ, описанные в WO 2009/064802, соединения морфолинопиримидина, которые ингибируют p110α, описанные в WO 2009/066084, производное 4-пиримидин-4-илморфолина, описанное в WO 2009/042607, соединение 4-морфолин-4-илтиенопиримидина, описанное в WO 2009/036082, производное пиридосульфоноамида, описанное в WO 2009/055418, производные пиридопиримидина, которые ингибируют p110α и/или p110γ, описанные в WO 2009039140, гетероциклические производные, которые ингибируют p110α, описанные в WO 2009046448, фуранопиримидины и золопиримидины, специфичные для p110δ, описанные в WO 2008/152394 и WO 2008/152390, соединения хиназолина, специфичные для p110δ, описанные в WO 2008/152387, пиримидин-замещенные производные пурина, описанные в WO 2009/045175, соединения тиенопиримидина и пиразолопиримидина, описанные в WO 2009/052145, аналоги имидазолопиримидина, пирролопиримидина и пиразолопиримидина, описанные в WO 2009/070524, замещенный имидазопиридазин, описанный в WO 2008/138834, производные тиенопиримидиена, избирательные по отношению к p110δ, описанные в WO 2009/053715, производные пурина, избирательные по отношению к p110δ, описанные в WO 2009/053716, 2-(морфолин-4-ил)-замещенные производные пурина, описанные в WO 2009/045174, ингибиторы PI3Kδ (p110δ), описанные в патентах США № 6518277 и 6800620 и в публикации заявки на выдачу патента США № 2005/0261317, и BGT226, XL765 и BEZ235 (Novartis).
Сочетания и фармацевтические композиции
Настоящее изобретение относится к сочетаниям и фармацевтическим композициям, которые содержат CD37-специфичные связывающие молекулы и ингибиторы mTOR, ингибиторы PI3K или любые их сочетания.
В некоторых вариантах настоящее изобретение относится к CD37-специфичной связывающей молекуле и ингибитору mTOR. CD37-специфичная связывающая молекула может представлять собой любую молекулу, предлагаемую в настоящем описании или известную в данной области, включая CD37-специфичные антитела, scFv, Fab, SMIP, PIMS и полипептиды SCORPION. Ингибитором mTOR может быть любой ингибитор mTOR, известный в данной области или предлагаемый в настоящем изобретении. Например, в некоторых вариантах сочетание или композиция согласно настоящему изобретению содержит CD37-специфичное антитело или SMIP-белок и ингибитор mTOR, выбранный из сиролимуса, темсиролимуса, дефоролимуса, эверолимуса, такролимуса, зотаролимуса, куркумина или фарнезилтиосалициловой кислоты. В других предпочтительных вариантах композиция содержит CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, или последовательности SEQ ID NO: 309 и 310, соответственно, или CD37-специфичный полипептид SMIP, содержащий последовательность SEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 52, 60, 80, 82, 84, 86, 88 или 253.
В некоторых предпочтительных вариантах сочетание или композиция согласно настоящему изобретению содержит (1) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и сиролимус, (2) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и темсиролимус, (3) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и эверолимус, (4) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и дефоролимус, (5) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и PP242, или (6) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и PP30. В некоторых других предпочтительных вариантах сочетание или композиция согласно настоящему изобретению содержит (1) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и сиролимус, (2) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и темсиролимус, (3) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и эверолимус, (4) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и дефоролимус, (5) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и PP242, или (6) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и PP30. В других предпочтительных вариантах сочетание или композиция согласно настоящему изобретению содержит (1) CD37-специфичный SMIP-полипептид, содержащий последовательность SEQ ID NO: 253, и сиролимус, (2) CD37-специфичный SMIP-полипептид, содержащий последовательность SEQ ID NO: 253, и темсиролимус, (3) CD37-специфичный SMIP-полипептид, содержащий последовательность SEQ ID NO: 253, и эверолимус, (4) CD37-специфичный SMIP-полипептид, содержащий последовательность SEQ ID NO: 253, и дефоролимус, (5) CD37-специфичный SMIP-полипептид, содержащий последовательность SEQ ID NO: 253, и PP242, или (6) CD37-специфичный SMIP-полипептид, содержащий последовательность SEQ ID NO: 253, и PP30.
В следующих вариантах настоящее изобретение относится к CD37-специфичной связывающей молекуле и ингибитору PI3K. CD37-специфичная связывающая молекула может представлять собой любую молекулу, предлагаемую в настоящем описании, включая CD37-специфичные антитела, scFv, Fab, полипептиды SMIP, PIMS и SCORPION. Ингибитором PI3K может быть любой ингибитор PI3K, известный в данной области или предлагаемый в настоящем описании. Например, в некоторых вариантах сочетание или композиция согласно настоящему изобретению содержит CD37-специфичное антитело или SMIP-белок и ингибитор PI3K, выбранный из LY294002, вортманнина, p110γ-специфичных ингибиторов и p110δ-специфичных ингибиторов. В некоторых таких вариантах композиция содержит CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, или последовательности SEQ ID NO: 309 и 310, соответственно, или CD37-специфичный SMIP-полипептид, содержащий последовательность SEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 52, 60, 80, 82, 84, 86, 88 или 253.
В некоторых вариантах композиция согласно настоящему изобретению содержит (1) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и LY294002, (2) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и p110γ-специфичный ингибитор, или (3) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и p110δ-специфичный ингибитор. В некоторых других вариантах композиция согласно настоящему изобретению содержит (1) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и LY294002, (2) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и p110γ-специфичный ингибитор, или (3) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и p110δ-специфичный ингибитор. В некоторых других вариантах композиция согласно настоящему изобретению содержит CD37-специфичный SMIP-полипептид, содержащий последовательность SEQ ID NO: 253, и LY294002, или последовательность SEQ ID NO: 253 и p110γ-специфичный ингибитор, или последовательность SEQ ID NO: 253 и p110δ-специфичный ингибитор.
В некоторых вариантах CD37-специфичная связывающая молекула и ингибитор mTOR или PI3K готовят вместе в растворе или суспензии. В таких препаратах молярно соотношение CD37-специфичной связывающей молекулы и ингибитора mTOR или PI3K может быть в диапазоне от 1:1000 до 1000:1, например от 1:1000 до 1:500, от 1:500 до 1:100, от 1:100 до 1:10, от 1:10 до 1:1, от 1:5 до 5:1, от 1:1 до 10:1, от 10:1 до 1:10, от 10:1 до 100:1, от 100:1 до 500:1 или от 500:1 до 1000:1.
Фармацевтические композиции предпочтительно содержат один или несколько фармацевтически приемлемых носителей. Фраза «фармацевтически или фармакологически приемлемый» относится к молекулярным объектам и композициям, которые не вызывают аллергических или других побочных действий при введении с использованием путей, хорошо известных в данной области, которые описаны ниже. «Фармацевтически приемлемые носители» включают любые и все клинически применимые растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, средства для изотоничности и замедления всасывания и тому подобные. Кроме того, соединения могут образовывать сольваты с водой или обычными органическими растворителями. Такие сольваты также предусмотрены.
Подходящие фармацевтически приемлемые носители, которые можно использовать в фармацевтических композициях согласно настоящему изобретению, включают воду, фармацевтически приемлемый органический растворитель, коллаген, поливиниловый спирт, поливинилпирролидон, карбоксивиниловый полимер, натрий-карбоксиметилцеллюлозу, полиарилат натрия, альгинат натрия, водорастворимый декстран, карбоксиметиловый крахмал натрия, пектин, метилцеллюлозу, этилцеллюлозу, ксантановую камедь, аравийскую камедь, казеин, желатин, агар, диглицерин, глицерин, пропиленгликоль, полиэтиленгликоль, вазелин, парафин, стеариловый спирт, стеариновую кислоту, сывороточный альбумин человека (HSA), маннит, сорбит, лактозу, фармацевтически приемлемое поверхностно-активное вещество и тому подобные. Используемые носители выбирают, но без ограничения, из приведенных выше веществ или в соответствующих случаях из их сочетаний, в зависимости от формы дозирования согласно настоящему изобретению.
Препарат фармацевтической композиции будет варьировать в соответствии с выбранным путем введения (например, раствор, эмульсия, таблетки). В случае растворов или эмульсий подходящие носители включают, например, водные или спиртовые/водные растворы, эмульсии или суспензии, включая физиологический раствор и забуференные среды. Парентеральные носители могут включать раствор хлорида натрия, раствор декстрозы Рингера, декстрозу и хлорид натрия, лактированный раствор Рингера или нелетучие масла. Внутривенные носители могут содержать различные добавки, консерванты или жидкие, питательные добавки или добавки электролита.
Множество водных носителей, например, вода, забуференная вода, 0,4% раствор соли, 0,3% глицин или водные суспензии могут содержать активное соединение (например, CD37-специфичную связывающую молекулу и ингибитор mTOR или PI3K) в смеси с эксципиентами, подходящими для производства водных суспензий. Такими эксципиентами являются суспендирующие средства, например, карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и аравийская камедь; диспергирующие средства или увлажнители могут представлять собой встречающийся в природе фосфатид, например, лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например, стеарат полиоксиэтилена, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например, гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными эфирами, полученными из жирных кислот и гексита, такие как моноолеат полиоксиэтиленсорбита, или продукты конденсации этиленоксида с неполными эфирами, полученными из жирных кислот и ангидридов гексита, например, моноолеат полиэтиленсорбитана. Водные суспензии также могут содержать один или несколько консервантов, например, этил или н-пропил, п-гидроксибензоат.
Композиции связывающей молекулы, ингибитора или сочетания могут бить лиофилизированы для хранения и перерастворения в подходящем носителе перед применением. Показано, что такой способ является эффективным в случае обычных иммуноглобулинов. Можно применять любые подходящие методики лиофилизации и перерастворения. Специалистам в данной области будет понятно, что лиофилизация и перерастворение могут приводить к утрате активности антитела в разной степени, и что необходимо корректировать используемые уровни для компенсации.
Диспергируемые порошки и гранулы, подходящие для получения водной суспензии посредством добавления воды, содержат активное соединение в смеси с диспергирующим средством или увлажнителем, суспендирующим средством и одним или несколькими консервантами. Примеры подходящих диспергирующих средств или увлажнителей и суспендирующих средств уже приведены выше.
В некоторых вариантах фармацевтические композиции согласно настоящему изобретению могут быть в форме, подходящей для перорального введения, например, в форме таблетки, капсулы, раствора или суспензии. Такие препараты могут быть получены согласно любому способу, известному в данной области для получения пероральных препаратов, и могут содержать одно или несколько средств, включая подсластители, корригенты, красители и консерванты. Если композиции имеют форму таблеток, они могут содержать эксципиенты для таблеток, такие как наполнитель или разбавитель (например, карбонат кальция или натрия, лактозу, фосфат кальция или натрия), дезинтегрирующее средство (кукурузный крахмал или альгиновую кислоту), связывающее средство (например, крахмал, желатин или аравийскую камедь), скользящее средство, смазочное средство (например, стеарат магния, стеариновую кислоту или тальк), антиадгезивное средство, корригент или краситель.
Концентрация CD37-специфичной связывающей молекулы или ингибитора mTOR или PI3K в таких препаратах может широко варьировать, например, от менее чем примерно 0,5%, обычно или, по меньшей мере, примерно от 1%, вплоть до 15 или 20% масс., и может быть выбрана, главным образом, на основе объемов жидкости, вязкости и т.д. в соответствии с конкретным выбранным способом введения. Типичная фармацевтическая композиция для парентеральной инъекции может быть приготовлена так, чтобы она содержала 1 мл стерильной забуференной воды и 50 мг антитела. Типичная композиция для внутривенной инфузии может быть приготовлена так, чтобы она содержала 250 мл стерильного раствора Рингера и 150 мг антитела. Имеющиеся способы получения парентерально вводимых композиций известны или очевидны для специалистов в данной области и описаны более подробно, например, в Remington's Pharmaceutical Science, 15th ed., Mack Publishing Company, Easton, Pa. (1980).
Фармацевтические композиции могут быть в форме стерильной инъекционной водной, масляной суспензии, дисперсии или стерильных порошков для приготовления стерильных инъекционных растворов или дисперсий для немедленного применения. Суспензия может быть приготовлена согласно известному уровню техники с использованием подходящих диспергирующих средств или увлажнителей и суспендирующих средств, которые указаны выше. Стерильный инъекционный препарат также может представлять собой стерильный инъекционный раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Носителем может быть растворитель или дисперсная среда, содержащая, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и тому подобные), их подходящие смеси, растительные масла, раствор Рингера и изотоничный раствор хлорида натрия. Кроме того, обычно используют стерильные нелетучие масла в качестве растворителя или среды для суспендирования. С этой целью можно использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, в препаратах инъекционных средств применяют жирные кислоты, такие как олеиновая кислота.
Во всех случаях форма должна быть стерильной и должна быть текучей в такой степени, чтобы ее можно было легко вводить шприцем. Надлежащую текучесть можно поддерживать, например, используя покрытие, такое как лецитин, поддерживая требуемый размер частиц в случае дисперсии и используя поверхностно-активные вещества. Форма должна быть стерильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Предотвращение действия микроорганизмов можно обеспечить, используя различные антибактериальные или противогрибковые средства, например, парабены, хлорбутанол, фенол, сорбиновую кислоту, тимеросал или тому подобные. Во многих случаях может быть желательным включение средств для изотоничности, например, сахаров или хлорида натрия. Пролонгированное всасывание инъекционных композиций может быть достигнуто благодаря использованию в композициях средств, замедляющих всасывание, например, моностеарата алюминия и желатина.
Композиции, применимые для введения, могут быть приготовлены с усилителями поглощения или всасывания, чтобы повысить их эффективность. Такие усилители включают, например, салицилат, гликохолат/линолеат, гликолят, апротинин, бацитрацин, SDS, капрат и тому подобные. Смотри, например, Fix (J. Pharm. Sci., 85: 1282-1285, 1996) и Oliyai и Stella (Ann. Rev. Pharmacol. Toxicol., 32: 521-544, 1993).
Кроме того, свойства гидрофильности и гидрофобности композиций, предлагаемых для применения в настоящем описании, хорошо сбалансированы, тем самым повышая применимость композиций и in vitro и особенно in vivo, тогда как другие композиции, в которых отсутствует такой баланс, применимы в значительно меньшей степени. В частности, композиции, предлагаемые для применения в изобретении, имеют подходящую степень растворимости в водной среде, которая обеспечивает возможность всасывания и биодоступность в организме, при этом также имеют определенную степень растворимости в липидах, которая позволяет соединениям проходить через клеточную мембрану в предполагаемое место действия. Таким образом, предлагаемые композиции являются максимально эффективными, когда они могут быть доставлены к месту активности антигена-мишени.
Типичная композиция CD37-специфичной связывающей молекулы, подходящая для внутривенной инфузии, содержит CD37-специфичное антитело (например, антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, или SEQ ID NO: 309 и 310, соответственно) в диапазоне концентраций примерно от 0,5 до примерно 25 мг/мл, таком как примерно от 0,5 до примерно 2,5, примерно от 2,5 до примерно 10 и примерно от 10 до примерно 25 мг/мл.
Типичная композиция CD37-специфичной связывающей молекулы, подходящая для подкожного введения, содержит CD37-специфичное антитело (например, антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, или SEQ ID NO: 309 и 310, соответственно) в диапазоне концентраций примерно от 25 до примерно 250 мг/мл, таком как примерно от 25 до примерно 100 и примерно от 100 до примерно 250 мг/мл.
Типичная композиция CD37-специфичной связывающей молекулы, подходящая для внутривенной инфузии, содержит CD37-специфичный SMIP-полипептид (например, SMIP-полипептид, содержащий последовательность SEQ ID NO: 253) в диапазоне концентраций примерно от 0,5 до примерно 25 мг/мл, таком как примерно от 0,5 до примерно 2,5, примерно от 2,5 до примерно 10 и примерно от 10 до примерно 25 мг/мл.
Типичная композиция CD37-специфичной связывающей молекулы, подходящая для подкожного введения, содержит CD37-специфичный SMIP-полипептид (например, SMIP-полипептид, содержащий последовательность SEQ ID NO: 253) в диапазоне концентраций примерно от 25 до примерно 250 мг/мл, таком как примерно от 25 до примерно 100 и примерно от 100 до примерно 250 мг/мл.
Типичная композиция ингибитора mTOR представляет собой раствор, который содержит рапамицин в диапазоне концентраций от 0,1 до 5 мг/мл (например, 1 мг/мл), подходящий для перорального введения. Другая типичная композиция ингибитора mTOR представляет собой таблетку, которая содержит от 0,1 до 5 мг (например, от 0,1 до 0,5 мг, от 0,5 до 1 мг, от 1 до 2 мг, от 2 до 3 мг или от 3 до 5 мг; или 0,25, 0,5, 1 или 2 мг) рапамицина, подходящую для перорального введения. Другая типичная композиция ингибитора mTOR представляет собой пероральный раствор, который содержит рапамицин в диапазоне концентраций примерно от 0,1 до примерно 10 мг/мл (например, от 0,1 до 0,5 мг/мл, от 0,5 до 1 мг/мл, от 1 до 5 мг/мл или от 5 до 10 мг/мл; или примерно 0,5, 1 или 2 мг/мл). Другая типичная композиция ингибитора mTOR представляет собой раствор, который содержит темсиролимус в диапазоне концентраций от 1 до 50 мг/мл (например, от 1 до 5 мг/мл, от 5 до 10 мг/мл, от 10 до 20 мг/мл, от 20 до 30 мг/мл или от 30 до 50 мг/мл; или 5, 10 или 25 мг/мл). Такая композиция может быть дополнительно разбавлена перед введением посредством внутривенной инфузии. Другая типичная композиция ингибитора mTOR представляет собой таблетку, которая содержит от 1 до 25 мг (например, от 1 до 2,5 мг, от 2,5 до 5 мг, от 5 до 10 мг или от 10 до 25 мг, или 1, 2,5, 5, 10, 15, 20 или 25 мг) эверолимуса, подходящую для перорального введения. Другие типичные композиции ингибиторов PI3K представляют собой пероральные препараты CAL-101, CAL-120 и CAL-263. Такие пероральные препараты могут содержать примерно от 50 мг до примерно 500 мг, например, примерно от 50 мг до примерно 100 мг, примерно от 100 мг до примерно 200 мг, примерно от 200 мг до примерно 300 мг, примерно от 300 мг до примерно 400 мг и примерно от 400 мг до примерно 500 мг.
Способы лечения
Настоящее изобретение относится к способу уменьшения количества B-клеток или лечения заболевания или расстройства, ассоциированного с аномальной активностью B-клеток (например, B-клеточных злокачественных опухолей и аутоиммунных или воспалительных заболеваний) у субъекта, у которого имеется или предполагается наличие заболевания или расстройства. Способ включает в себя лечение субъекта с использованием CD37-специфичной связывающей молекулы и ингибитора mTOR, CD37-специфичной связывающей молекулы и ингибитора PI3K или любого их сочетания. Сочетание CD37-специфичной связывающей молекулы (например, анти-CD37-антитела или SMIP-белка) и ингибитора mTOR или PI3K может действовать синергетически, приводя к уменьшению количества B-клеток или лечению заболевания или расстройства, ассоциированного с аномальной активностью B-клеток.
Два или более соединений, которые действуют синергетически, взаимодействуют так, что совместный эффект соединений выше, чем сумма отдельных эффектов каждого соединения при введении по отдельности (смотри, например, Berenbaum, Pharmacol. Rev. 41: 93, 1989). Например, взаимодействие между CD37-специфичным SMIP и другим средством или соединением можно анализировать с помощью различных механистических и эмпирических моделей (смотри, например, Ouzounov et al., Antivir. Res. 55: 425, 2002). В обычно применяемом способе анализа взаимодействия в сочетании средств используют конструирование изобол (кривых одинакового эффекта, также называемых изоболограммами), на которых сочетание средств (da, db) представлено точкой на графике, оси которого являются осями доз отдельных средств (смотри, например, Ouzounov et al., выше; смотри также Tallarida, J. Pharmacol. Exp. Therap. 298: 865, 2001).
Другой способ анализа взаимодействий лекарственных средств между собой (антагонизма, аддитивности, синергизма), известный в данной области, включает в себя определение комбинационных индексов (CI) согласно принципу медианного эффекта, чтобы получить оценки значений IC50 для соединений, вводимых по отдельности и в сочетании (смотри, например, Chou, Synergism and Antagonism Chemotherapy. Eds. Chou and Rideout. Academic Press, San Diego Calif., 61-102, 1991; компьютерная программа CalcuSynTM). Значение CI меньше единицы означает синергетическую активность, равное единице означает аддитивную активность, и значение больше единицы означает антагонизм.
Еще одним примером способа является способ независимого эффекта (Pritchard and Shipman, Antiviral Res. 74: 181, 1990; Pritchard and Shipman, Antiviral Therapy 7: 9, 1996; компьютерная программа MacSynergyTM II, University of Michigan, Ann Arbor, Mich.). Компьютерная программа MacSynergyTM II обеспечивает возможность трехмерного (3-D) исследования взаимодействия соединений путем сравнения рассчитанной аддитивной поверхности с наблюдаемыми данными с созданием дифференциальных графиков, которые выявляют области (по объему) статистически большие, чем ожидаемые (синергия) или меньшие чем ожидаемые (антагонизм) взаимодействия соединений. Например, композицию, содержащую CD37-специфичную связывающую молекулу и ингибитор mTOR или PI3K, можно считать композицией, обладающей синергетической активностью или оказывающей синергетическое действие, когда величина синергии, полученная в результате вычисления по величине пиков синергии, предпочтительно примерно на 15% выше, чем аддитивный эффект (то есть, эффекты каждого средства по отдельности, сложенные вместе), примерно на 50% выше, предпочтительно примерно в 2-10-раз выше или предпочтительно примерно в 3-5-раз или больше, чем аддитивный эффект.
В следующих вариантах CD37-специфичную связывающую молекулу и ингибитор mTOR или PI3K можно вводить для синергетического воздействия при лечении B-клеточных злокачественных новообразований или B-клеточных злокачественных опухолей. Типичные B-клеточные злокачественные новообразования или B-клеточные злокачественные опухоли включают B-клеточные лимфомы, такие как различные формы болезни Ходжкина, неходжкинская лимфома (NHL) или лимфомы центральной нервной системы, лимфома из малых лимфоцитов, лейкозы, такие как пролимфоцитарный лейкоз, острый лимфобластный лейкоз (ALL), острый миелоидный лейкоз (AML), хронический лимфоцитарный лейкоз (CLL), лейкоз ворсистых клеток и хронический миобластный лейкоз и миеломы (такие как множественная миелома). Дополнительные B-клеточные злокачественные опухоли включают лимфому из малых лимфоцитов, B-клеточный пролимфоцитарный лейкоз, лимфоплазмоцитарная лимфома (включая макроглобулинемию Вальденстрема), лимфомы из клеток маргинальной зоны (включая лимфому из клеток маргинальной зоны селезенки и нодальную B-клеточную лимфому маргинальной зоны), плазмацитарную миелому/плазмацитому, солитарную плазмацитому костей, экстраоссальную плазмацитому, нодальную лимфому маргинальной зоны, экстранодальную B-клеточную лимфому маргинальной зоны, ассоциированной со слизистой оболочкой (MALT) лимфоидной ткани), фолликулярную лимфому, лимфому из мантийных клеток (MCL), диффузную B-крупноклеточную лимфому, трансформирующую B-крупноклеточную лимфому, медиастинальную (тимическую) B-крупноклеточную лимфому, внутрисосудистую B-крупноклеточную лимфому, первичную выпотную лимфому, лимфому/лейкоз Беркитта, B-клеточную пролиферацию с неопределенным злокачественным потенциалом, лимфоматоидный гранулематоз и посттрансплантационное лимфопролиферативное расстройство.
В некоторых вариантах B-клеточным злокачественным новообразованием, для лечения которого можно использовать соединения, композиции или сочетания согласно настоящему изобретению, является лимфома Беркитта. Лимфома Беркитта (или «B-клеточное злокачественное заболевание Беркитта» или «опухоль Беркитта», или «злокачественная лимфома типа Беркитта») представляет собой злокачественную опухоль лимфатической системы (в частности, B-лимфоцитов). Заболевание можно разделить на три основных клинических варианта: эндемический, спорадический и ассоциированный с иммунологической недостаточностью.
B-клеточные злокачественные заболевания, отличающиеся от болезни Беркитта, которые можно лечить соединениями, композициями, или сочетаниями согласно настоящему изобретению, включают B-клеточный хронический лимфоцитарный лейкоз (CLL)/лимфому из малых лимфоцитов, B-клеточный пролимфоцитарный лейкоз, острый лимфобластный лейкоз (ALL), лимфоплазмоцитарную лимфому (включая, но без ограничения, макроглобулинемию Вальденстрема), лимфомы из клеток маргинальной зоны (включая, но без ограничения, лимфому из B-клеток маргинальной зоны селезенки, нодальную лимфому маргинальной зоны и экстранодальную B-клеточную лимфому маргинальной зоны, ассоциированной со слизистой оболочкой лимфоидной ткани (MALT), лейкоз ворсистых клеток, плазмацитарную миелому/плазмацитому, фолликулярную лимфому, лимфому из клеток мантийной зоны (MCL), диффузную B-крупноклеточную лимфому, трансформирующую B-крупноклеточную лимфому, медиастинальную B-крупноклеточную лимфому, внутрисосудистую B-крупноклеточную лимфому, первичную выпотную лимфому и неходжкинскую лимфому (NHL).
Композиции и комбинированная терапия согласно настоящему изобретению также применимы при лечении расстройств, характеризуемых продуцированием аутоантител (например, аутоиммунные заболевания). Аутоиммунные заболевания включают артрит, ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит, полихондрию, псориатический артрит, псориаз, дерматит, полимиозит/дерматомиозит, миозит с тельцами включения, воспалительный миозит, токсический эпидермальный некролиз, системная склеродерма и склероз, синдром CREST, воспалительное заболевание кишечника, болезнь Крона, язвенный колит, респираторный дистресс-синдром, менингит, энцефалит, увеит, колит, гломерулонефрит, аллергические состояния, экзему, астму, состояния, в которые вовлечена инфильтрация T-клеток, и хронические воспалительные реакции, атеросклероз, аутоиммунный миокардит, нарушение адгезии лейкоцитов, системную красную волчанку (СКВ), подострую кожную красную волчанку, люпус, ювенильный диабет, рассеянный склероз, аллергический энцефаломиелит, нейромиелит, ревматизм, хорею Сиденхама, иммунные реакции, ассоциированные с острой и гиперчувствительностью замедленного типа, опосредованной цитокинами и T-лимфоцитами, туберкулез, саркоидоз, гранулематоз, включая гранулематоз Вегенера и болезнь Чарга-Штраусса, агранулецитоз, васкулит (включая васкулит/ангиит при гиперчувствительности, ANCA и ревматоидный васкулит), апластическую анемию, анемию Даймонда-Блэкфана, иммунную гемолитическую анемию, включая аутоиммунную гемолитическую анемию (AIHA), пернициозную анемию, истинную эритроцитарную аплазию (PRCA), недостаточность фактора VIII, гемофилию A, аутоиммунную нейтропению, панцитопению, лейкопению, заболевания, в которые вовлечен диапедез лейкоцитов, воспалительные расстройства центральной нервной системы (ЦНС), синдром полиорганной недостаточности, бульбоспинальный паралич, заболевания, опосредованные комплексом антиген-антитело, гломерулонефрит с образованием антител к базальной мембране, антифосфолипидный синдром, аллергический неврит, болезнь Бехчета, синдром Кастельмана, синдром Гудпасчера, миастенический синдром Ламберта-Итона, синдром Шегрена, синдром Стивенса-Джонсона, отторжение трансплантатов солидных органов, болезнь «трансплантат против хозяина» (GVHD), буллезный пемфигоид, пемфигус, аутоиммунные полиэндокринопатии, серонегативные спондилоартропатии, болезнь Рейтера, синдром ригидного человека, гигантоклеточный артериит, нефрит с отложением иммунных комплексов, IgA-нефропатию, IgM-полиневропатии или опосредованную IgM нейропатию, идиопатическую тромбоцитопеническую пурпуру (ITP), тромботическую тромбоцитопеническую пурпуру (TTP), пурпуру Шенлейна-Геноха, аутоиммунную тромбоцитопению, аутоиммунное заболевание семенников и яичника, включая аутоиммунный орхит и оофорит, первичный гипотиреоидизм; аутоиммунные эндокринные заболевания, включая аутоиммунный тиреоидит, хронический тиреоидит (тиреоидит Хашимото), подострый тиреоидит, идиопатический гипотиреидизм, Аддисонову болезнь, диффузный токсический зоб, аутоиммунные полигландулярные синдромы (или полигландулярные эндокринопатические синдромы), диабет типа I также называемый инсулинозависимым диабетом (IDDM) и синдром Шихана; аутоиммунный гепатит, лимфоидный интерстициальный пневмонит (HIV), облитерирующий бронхиолит (нетрансплантационный) против NSIP, синдром Гийена-Барре, васкулит крупных сосудов (включая ревматоидную полимиалгию и гигантоклеточный артериит (Такаясу)), васкулит средних сосудов (включая болезнь Кавасаки и нодозный полиартериит), нодозный полиартериит (PAN), анкилозирующий спондилит, болезнь Бергера (IgA-нефропатию), быстро прогрессирующий гломерулонефрит, первичный билиарный цирроз, целиакию-спру (глютеновую энтеропатию), криоглобулинемию, криоглобулинемию, ассоциированную с гепатитом, хроническое обструктивное легочное заболевание (COPD), боковой амиотрофический склероз (ALS), заболевание коронарной артерии, семейную средиземноморскую лихорадку, микроскопический полиангиит, синдром Когана, синдром Вискотта-Олдриджа и облитерирующий тромбангиит, аутоиммунное заболевание щитовидной железы (такое как диффузный токсический зоб и тиреоидит Хашимото), синдром Шегрена и идиопатическую воспалительную миопатию (IIM), включая дерматомиозит (DM) и полимиозит (PM).
Композиции или комбинированную терапию согласно настоящему изобретению предпочтительно используют для лечения B-клеточных лимфом или лейкозов, таких как B-клеточная неходжкинская лимфома (NHL) (включая лимфому Беркитта, хронический лимфоцитарный лейкоз (CLL), лимфому из малых лимфоцитов (SLL), диффузную B-крупноклеточную лимфому, фолликулярную лимфому, иммунобластную крупноклеточную лимфому, лимфобластную лимфому из предшественников B-клеток и лимфому из клеток мантийной зоны), лейкоз ворсистых клеток, B-клеточный пролимфоцитарный лейкоз, лимфома дендритных клеток CD37+, лимфоплазмоцитарная лимфома, лимфома из клеток маргинальной зоны селезенки, экстранодальную лимфому B-клеток маргинальной зоны, ассоциированной со слизистой оболочкой (MALT) лимфоидной ткани, нодальную лимфому из B-клеток маргинальной зоны, медиастинальную (тимическую) B-крупноклеточную лимфому, внутрисосудистую B-крупноклеточную лимфому и первичную выпотную лимфому.
Кроме того, композиции или комбинированную терапию согласно настоящему изобретению предпочтительно используют для лечения заболевания, характеризуемого продукцией аутоантител, такого как идиопатическая воспалительная миопатия, ревматоидный артрит, ювенильный ревматоидный артрит, бульбоспинальный паралич, диффузный токсический зоб, сахарный диабет типа I, гломерулонефрит с образованием антител к базальной мембране, быстро прогрессирующий гломерулонефрит, болезнь Бергера (IgA-нефропатия), системная красная волчанка (СКВ), болезнь Крона, язвенный колит, идиопатическая тромбоцитопеническая пурпура (ITP), антифосфолипидный синдром, нейрооптикомиелит, рассеянный склероз, аутоиммунное заболевание, дерматомиозит, полимиозит или макроглобулинемия Вальденстрема. В других предпочтительных вариантах, композиции или комбинированную терапию согласно настоящему изобретению применяют для лечения заболевания, характеризуемого несоответствующей стимуляцией T-клеток, ассоциированной с B-клеточным путем.
В некоторых случаях генетические повреждения могут быть связаны или вызваны некоторыми злокачественными опухолями. Например, цитогенетический анализ выявил, что лимфома из клеток мантийной зоны (MCL) тесно ассоциирована с транслокацией t(11;14)(q13;q32) (Rimokh et al., Genes Chromo. Cancer 2: 223 (1990); Leroux et al., Br. J. Haematol. 77: 346 (1991); Vandenberghe et al., Br. J. Haematol. 81: 212 (1992)). Такая транслокация помещает последовательности гена тяжелой цепи иммуноглобулина (IGH) рядом с локусом BCL-1, приводя к повышающей регуляции гена CCND1 и следовательно к сверхэкспрессии циклина D1 (de Boer et al., Cancer Res. 53: 4148 (1993); de Boer et al., Oncogene 10: 1833 (1995)). Считается, что сверхэкспрессия циклина D1 имеет место у 100% пациентов с MCL, но t(11;14)(q13;q32) встречается только у 70%-75% (Leroux et al., 1991; Vandenberghe et al., 1992). Кроме того, частота такой транслокации в других злокачественных опухолях составляет 10-20% в случае B-пролимфоцитарного лейкоза, плазмацитарного лейкоза и лимфомы селезенки с ворсинчатыми лимфоцитами, и 2-5% в случае хронического лимфоцитарного лейкоза и в случае множественной миеломы (Huret, Atlas Genet. Cytogenet. Oncol. Haematol. (May 1998)). В следующих вариантах композиции согласно настоящему изобретению применяют для лечения лимфомы клеток мантийной зоны или множественной миеломы, ассоциированной с хромосомной транслокацией t(11;14)(q13;q32) или сверхэкспрессией циклина D1.
Способ согласно настоящему изобретению включает в себя стадии введения CD37-специфичной связывающей молекулы и введение ингибитора mTOR или PI3K. В некоторых вариантах сочетание соединений можно вводить одновременно, вместе в одном и том же фармацевтически приемлемом носителе или раздельно (но одновременно). В других вариантах CD37-иммунотерапевтическое средство и ингибитор mTOR или PI3K можно вводить последовательно (например, с интервалом в один, два, три, четыре, пять, шесть или семь дней; с интервалом в одну, две, три или четыре недели; или тому подобным интервалом), в любом порядке и в любом сочетании.
Связывающую молекулу, ингибитор или комбинированные композиции можно вводить перорально, местно, трансдермально, парентерально, с помощью ингаляционного спрея, вагинально, ректально или с помощью внутричерепной инъекции или с использованием любого сочетания указанных путей. При раздельном введении CD37-специфичный ингибитор и ингибитор mTOR или PI3K можно вводить одним и тем же путем или разными путями. Например, в одном варианте CD37-специфичную связывающую молекулу вводят парентерально, а ингибитор mTOR или PI3K вводят перорально, при этом введение может быть одновременным или последовательным. Термин «парентеральный» в используемом в настоящем описании смысле включает подкожные инъекции, внутривенные, внутримышечные, интрацистернальные инъекции или способы инфузии. Также предполагается введение с помощью внутривенной, интрадермальной, внутримышечной инъекции, инъекции внутрь молочной железы, внутрибрюшинной, интратекальной, ретробульбальной, внутрилегочной инъекции и/или с помощью хирургической имплантации в конкретное место. Обычно композиции по существу не содержат пирогенов, а также других примесей, которые могут быть опасными для реципиента. Инъекция или инфузия, особенно внутривенная, является предпочтительной для введения CD37-специфичной связывающей молекулы.
В одном варианте введение осуществляют в место злокачественной опухоли или пораженную ткань, нуждающуюся в лечении, путем прямой инъекции в данное место или посредством замедленной доставки или механизма замедленного высвобождения, с помощью которого можно доставлять препарат внутрь организма. Например, биологически разрушаемые микросферы или капсулы или другие биологически разрушаемые полимерные структуры, способные обеспечивать замедленную доставку композиции (например, растворимый полипептид, антитело или ингибитор), могут быть включены в препараты согласно изобретению, имплантируемые вблизи злокачественной опухоли.
Фармацевтические композиции также могут быть доставлены в организм пациента в множество мест. Множественные введения могут быть осуществлены одновременно или могут быть осуществлены на протяжении определенного периода времени. В некоторых случаях полезно обеспечение непрерывного потока фармацевтической композиции. Могут быть введены дополнительные терапевтические средства по схеме, определяемой на основе периодов времени, измеряемых, например, часами, сутками, неделями, месяцами.
Связывающая молекула, ингибитор или сочетания и композиции согласно настоящему изобретению могут содержать одну или больше одной связывающей молекулы, ингибитора или любое их сочетание. Также в настоящем изобретении предлагается введение связывающей молекулы, ингибитора или сочетаний и композиций вместе с дополнительным терапевтическим средством, например, с использованием предварительного лечения стероидами или ацетаминофеном. Дополнительные терапевтические средства, предполагаемые в настоящем изобретении, перечислены в абзаце ниже.
Дополнительным терапевтическим средством может быть ассоциированная с B-клетками молекула. Другие ассоциированные с B-клетками молекулы, предполагаемые в настоящем изобретении, включают связывающие молекулы, которые связываются с другими молекулами на поверхности B-клеток, отличными от CD37. Ассоциированные с B-клетками молекулы включают CD19 (антиген B-лимфоцитов CD19, также называемый поверхностным антигеном B-лимфоцитов B4 или Leu-12), CD20 (CD20-специфичные связывающие молекулы включают TRU-015, ритуксимаб, офатумумаб, окрелизумаб), CD21, CD22 (B-клеточный рецептор CD22, также называемый Leu-14, молекулой клеточной адгезии B-лимфоцитов или BL-CAM), CD23, CD40 (B-клеточный поверхностный антиген CD40, также называемый представителем 5 суперсемейства рецепторов фактора некроза опухолей, рецептором CD40L или Bp50), CD80 (антиген активации T-лимфоцитов CD80, также называемый антигеном активации B7-1, B7, B7-1 или BB1), CD86 (антиген активации T-лимфоцитов CD86, также называемый антигеном активации B7-2, B70, FUN-1 или BU63), CD137 (также называемый представителем 9 суперсемейства рецепторов фактора некроза опухолей), CD152 (также называемый белком 4 цитотоксических T-лимфоцитов или CTLA-4), L6 (ассоциированный с опухолями антиген L6, также называемый представителем 1 суперсемейства трансмембранных белков 4, поверхностных маркеров мембранного компонента 1 или M3S1), CD30 (антиген активации лимфоцитов CD30, также называемый представителем 8 суперсемейства рецепторов фактора некроза опухолей, рецептором CD30L или Ki-1), CD50 (также называемый молекулой межклеточной адгезии 3 (ICAM3) или ICAM-R), CD54 (также называемый молекулой межклеточной адгезии-1 (ICAM1) или рецептором риновирусов основной группы), B7-H1 (лиганд для иммуноингибирующего рецептора, экспрессируемый активированными T-клетками, B-клетками и миелоидными клетками, также называемый PD-L1; смотри Dong, et al., «B7-H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin-10 secretion», Nat. Med., 5: 1365-1369 (1999), CD134 (также называемый представителем 4 суперсемейства рецепторов фактора некроза опухолей, OX40, рецептором OX40L, антигеном ACT35 или рецептор TAX-транкрипционно активируемого гликопротеида 1), 41BB (рецептор лиганда 4-1BB, T-клеточный антиген 4-1BB или T-клеточный антиген ILA), CD153 (также называемый представителем 8 суперсемейства лигандов фактора некроза опухолей, лиганд CD30 или CD30-L), CD154 (также называемый представителем 5 суперсемейства лигандов фактора некроза опухолей, TNF-родственный белок активации, TRAP или T-клеточный антиген Gp39), Toll-рецепторы или тому подобные.
Цитокины и факторы роста являются дополнительными терапевтическими средствами, предусмотренными в настоящем изобретении, и к ним относятся один или несколько из следующих средств: TNF, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IFN, G-CSF, Meg-CSF, GM-CSF, тромбопоэтин, фактор стволовых клеток и эритропоэтин. Фармацевтические композиции или сочетания согласно настоящему изобретению также могут включать в себя другие известные ангиопоэтины, например Ang-1, Ang-2, Ang-4, Ang-Y, и/или ангиопоэтин-подобный полипептид человека и/или фактор роста эндотелия сосудов (VEGF). Факторы роста для применения в фармацевтических композициях согласно изобретению включают ангиогенин, морфогенный белок костей 1, морфогенный белок костей 2, морфогенный белок костей 3, морфогенный белок костей 4, морфогенный белок костей 5, морфогенный белок костей 6, морфогенный белок костей 7, морфогенный белок костей 8, морфогенный белок костей 9, морфогенный белок костей 10, морфогенный белок костей 11, морфогенный белок костей 12, морфогенный белок костей 13, морфогенный белок костей 14, морфогенный белок костей 15, рецептор морфогенного белка костей IA, рецептор морфогенного белка костей IB, полученный из головного мозга нейротрофический фактор, цилиарный нейротрофический фактор, рецептор α цилиарного нейротрофического фактора, индуцируемый цитокинами хемотаксический фактор нейтрофилов 1, индуцируемый цитокинами хемотаксический фактор нейтрофилов 2α, индуцируемый цитокинами хемотаксический фактор нейтрофилов 2β, фактор роста эндотелиальных клеток β, эндотелин 1, эпидермальный рост фактор, полученный из эпителия аттрактант нейтрофилов, фактор роста фибробластов 4, фактор роста фибробластов 5, фактор роста фибробластов 6, фактор роста фибробластов 7, фактор роста фибробластов 8, фактор роста фибробластов 8b, фактор роста фибробластов 8c, фактор роста фибробластов 9, фактор роста фибробластов 10, кислый фактор роста фибробластов, основной фактор роста фибробластов, полученный из линии глиальных клеток рецептор нейротрофического фактора α1, полученный из линии глиальных клеток рецептор нейротрофического фактора α2, связанный с ростом белок, связанный с ростом белок α, связанный с ростом белок β, связанный с ростом белок γ, гепарин-связывающий эпидермальный фактор роста, фактор роста гепатоцитов, рецептор фактора роста гепатоцитов, инсулиноподобный фактор роста I, рецептор инсулиноподобного фактора роста, инсулиноподобный фактор роста II, белок, связывающий инсулиноподобный фактор роста, фактор роста кератиноцитов, ингибирующий лейкоз фактор, рецептор ингибирующего лейкоз фактора α, фактор роста нервов, рецептор фактора роста нервов, нейротрофин-3, нейротрофин-4, фактор роста плаценты, фактор роста плаценты 2, полученный из тромбоцитов фактор роста эндотелиальных клеток, полученный из тромбоцитов фактор роста, цепь A полученного из тромбоцитов фактора роста, полученный из тромбоцитов фактор роста AA, полученный из тромбоцитов фактор роста AB, цепь B полученного из тромбоцитов фактора роста, полученный из тромбоцитов фактор роста BB, рецептор α полученного из тромбоцитов фактора роста, рецептор β полученного из тромбоцитов фактора роста, фактор, стимулирующий рост пре-B-клеток, фактор стволовых клеток, рецептор фактора стволовых клеток, трансформирующий фактор роста α, трансформирующий фактор роста β, трансформирующий фактор роста β1, трансформирующий фактор роста β1.2, трансформирующий фактор роста β2, трансформирующий фактор роста β3, трансформирующий фактор роста β5, латентный трансформирующий фактор роста β1, белок I, связывающий трансформирующий фактор роста β, белок II, связывающий трансформирующий фактор роста β, белок III, связывающий трансформирующий фактор роста β, рецептор фактора некроза опухолей типа I, рецептор фактора некроза опухолей типа II, рецептор активатора плазминогена урокиназного типа, фактор роста эндотелия сосудов и химерные белки и их биологически или иммунологически активные фрагменты.
Примерами химиотерапевтических средств, предлагаемых в качестве дополнительных терапевтических средств, являются алкилирующие средства, такие как азотистые иприты (например, мехлорэтамин, циклофосфамид, ифосфамид, мелфалан и хлорамбуцил); нитрозомочевины (например, кармустин (BCNU), ломустин (CCNU) и семустин (метил-CCNU)); этиленимины и метилмеламины (например, триэтиленмеламин (TEM), триэтилентиофосфорамид (тиотепа) и гексаметилмеламин (HMM, алтретамин)); алкилсульфонаты (например, бусульфан); и триазины (например, дакарбазин (DTIC)); антиметаболиты, такие как аналоги фолиевой кислоты (например, метотрексат, триметрексат и пеметрексед (антифолат против множества мишеней)); аналоги пиримидина (такие как 5-фторурацил (5-FU), фтордезоксиуридин, гемцитабин, цитозинарабинозид (AraC, цитарабин), 5-азацитидин и 2,2'-дифтордезоксицитидин); аналоги пурина (например, 6-меркаптопурин, 6-тиогуанин, азатиоприн, 2'-дезоксикоформицин (пентостатин), эритрогидроксинониладенин (EHNA), флударабинфосфат, 2-хлордезоксиаденозин (кладрибин, 2-CdA)); ингибиторы топоизомеразы типа I, такие как камптотецин (CPT), топотекан и иринотекан; природные продукты, такие как эпиподофилотоксины (например, этопозид и тенипозид); алкалоиды барвинка (например, винбластин, винкристин и винорелбин); противоопухолевые антибиотики, такие как актиномицин D, доксорубицин и блеомицин; радиосенсибилизаторы, такие как 5-бромдезоксиуридин, 5-йоддезоксиуридин и бромдезоксицитидин; координационные комплексы платины, такие как цисплатин, карбоплатин и оксалиплатин; замещенные мочевины, такие как гидроксимочевина; производные метилгидразина, такие как N-метилгидразин (MIH) и прокарбазин; и бифункциональные соединения, таких как бендамустин (аналог пурина и алкилирующий агент).
Дополнительные терапевтические средства, предусмотренные настоящим изобретением для лечения аутоиммунных заболеваний, называют иммунодепрессантами, которые действуют, подавляя или маскируя иммунную систему индивидуума, подвергаемого лечению. Иммунодепрессантами являются, например, нестероидные противовоспалительные лекарственные средства (НПВС), анальгетики, глюкокортикоиды, модифицирующие заболевание противоревматические лекарственные средства (БМПРП) для лечения артрита или модификаторы биологических ответов. Композиции, приведенные в описании БМПРП, кроме РА также применимы для лечения многих других аутоиммунных заболеваний.
Примеры НПВС выбраны из группы, состоящей из ибупрофена, напроксена, напроксена-натрия, ингибиторов ЦОГ-2, таких как виокс и целебрекс, и сиалилаты. Примеры анальгетиков выбраны из группы, состоящей из ацетаминофена, оксикодона, трамадола или гидрохлорида пропоксифена. Примеры глюкокортикоидов выбраны из группы, состоящей из кортизона, дексаметазона, гидрокортизона, метилпреднизолона, преднизолона или преднизона. Примеры модификаторов биологических ответов включают молекулы, направленные против маркеров клеточной поверхности (например, CD19, CD20 и т.д.), ингибиторов цитокинов, таких как антагонисты TNF (например, этанерцепт (Enbrel®), адалимумаб (Humira®) и инфликсимаб (Remicade®)), ингибиторов хемокинов и ингибиторов молекул адгезии. Модификаторы биологических ответов включают моноклональные антитела, а также рекомбинантные формы молекул. Примеры БМПРП включают азатиоприн, циклофосфамид, циклоспорин, метотрексат, пеницилламин, лефлуномид, сульфасалазин, гидроксихлорохин, золото (пероральное (ауранофин) и внутримышечное) и миноциклин. В предпочтительных вариантах композиции или сочетания анти-CD37 с ингибитором mTOR или PI3K согласно настоящему изобретению применяют вместе с метотрексатом.
Предполагается, что композиция или сочетание CD37-специфичной связывающей молекулы с ингибитором mTOR или PI3K и дополнительное терапевтическое средство могут быть приготовлены и введены в виде одного и того же препарата. Альтернативно каждое из средств вводят в виде отдельного препарата, но одновременно (например, одновременно или с интервалом в несколько минут), последовательно (например, с задержкой, по меньшей мере, от несколько часов до суток или недели или больше между введениями каждого из средств), или в любом сочетании.
В другом аспекте дополнительное терапевтическое средство вводят перед введением связывающей молекулы, ингибитора или комбинированной композиции. Термин «перед введением» относится к введению дополнительного терапевтического средства в пределах 10 или более минут, часов или одной недели до лечения связывающей молекулой, ингибитором или комбинированной композицией. Кроме того, предполагается, что дополнительное терапевтическое средство вводят после введения композиции связывающей молекулы. Термин «введение после» предназначен для описания введения в пределах 10 или больше минут, часов или недель после лечения или введения связывающей молекулы, ингибитора или комбинированной композиции.
Кроме того, предполагается, что при введении связывающей молекулы в сочетании с дополнительным терапевтическим средством, когда дополнительным терапевтическим средством является цитокин или фактор роста или химиотерапевтическое средство, введение также может включать применение радиотерапевтического средства или лучевой терапии. Лучевую терапию, используемую в сочетании с композицией антитела, применяют как определено лечащим врачом, и в дозах, обычно назначаемых пациентам, подвергаемым лечению по поводу злокачественной опухоли.
Сочетания и фармацевтические композиции согласно настоящему изобретению (например, сочетания или композиции, содержащие CD37-специфичную связывающую молекулу, ингибитор mTOR или PI3K или дополнительное терапевтическое средство) вводят в дозах и таким способом (например, используя количества, схемы и пути), которые согласуются с надлежащей медицинской практикой. Факторы, учитываемые в указанном контексте, включают конкретное расстройство или заболевание, подвергаемое лечению, конкретную CD37-специфичную связывающую молекулу, конкретный ингибитор mTOR или PI3K, конкретное дополнительное терапевтическое средство (если таковое имеется), конкретное млекопитающее, подвергаемое лечению, клиническое состояние отдельного пациента, место доставки, способ введения, схему введения и другие факторы, известные лечащим врачам.
Фармацевтические композиции согласно настоящему изобретению можно вводить в виде одной дозы или множества доз. Стандартные исследования зависимости доза-ответ, сначала в моделях на животных, а затем в клиническом испытании, можно использовать для определения оптимальных доз в случае конкретных патологических состояний и популяций пациентов.
В общем, начальное терапевтически эффективное количество CD37-специфичной связывающей молекулы, ингибитора mTOR или PI3K или дополнительного терапевтического средства при введении, например, посредством внутривенной инъекции или инфузии или посредством подкожной инъекции, может быть в диапазоне примерно от 0,1 до 1000 мг/кг массы тела пациента, таком как примерно от 0,1 до 1 мг/кг, примерно от 1 до 10 мг/кг, примерно 10-50 мг/кг, примерно 50-100 мг/кг, примерно 100-500 мг/кг или примерно 500-1000 мг/кг массы тела пациента. Эффективные количества CD37-специфичной связывающей молекулы и ингибитора mTOR или PI3K при использовании в комбинированной терапии согласно настоящему изобретению, меньше, чем соответствующие количества при использовании отдельно. Введение CD37-специфичной связывающей молекулы, ингибитора mTOR или PI3K или дополнительного терапевтического средства можно повторять еженедельно, ежемесячно, каждые три месяца, каждые шесть месяцев, каждый год или каждые два года в одной и той же дозе или в дозе, отличающейся от начальной дозы (например, в трехкратной, двукратной дозе, в дозе, составляющей две трети, половину, третью часть, четвертую часть от начальной дозы), в зависимости от фармакокинетических (ФК) и фармакодинамических (ФД) свойств, включая всасывание, распределение, метаболизм и выведение конкретной CD37-специфичной связывающей молекулы, конкретного ингибитора mTOR или PI3K или конкретного дополнительного терапевтического средства.
Доза CD37-специфичной связывающей молекулы, ингибитора mTOR или PI3K или дополнительного терапевтического средства при пероральном введении может быть в диапазоне от 0,1 до 1000 мг CD37-специфичной связывающей молекулы, ингибитора mTOR или PI3K или дополнительного терапевтического средства, например от 0,1 до 1 мг, от 1 до 10 мг, от 10 до 50 мг, от 50 до 100 мг, от 100 до 500 мг или 500-1000 мг. Дозу можно вводить дважды в сутки, один раз в сутки, один раз в неделю, один раз в месяц или более часто или менее часто, также в зависимости от фармакокинетических (ФК) и фармакодинамических (ФД) свойств, включая всасывание, распределение, метаболизм и выведение конкретной CD37-специфичной связывающей молекулы, конкретного ингибитора mTOR или PI3K или конкретного дополнительного терапевтического средства.
Введение связывающей молекулы, ингибитора или комбинированной композиции уменьшает популяцию B-клеток, по меньшей мере, на 20% после лечения однократной дозой. В одном варианте популяция B-клеток уменьшается, по меньшей мере, примерно на 20, примерно на 30, примерно на 40, примерно на 50, примерно на 60, примерно на 70, примерно на 80, примерно на 90 или примерно на 100%. Уменьшение количества B-клеток определяют как уменьшения абсолютного количества B-клеток ниже нижнего предела нормального диапазона. Восстановление B-клеток определяют как восстановление абсолютного количества B-клеток, например, до 70%, 80%, 90% от исходного значения у субъекта или до нормального диапазона. Кроме того, введение связывающей молекулы, ингибитора или комбинированной композиции согласно настоящему изобретению приводит к требуемым клиническим эффектам в отношении заболевания или расстройства, подвергаемого лечению.
В некоторых вариантах пациенты, страдающие от B-клеточной злокачественной опухоли, получают лечение согласно описанию и демонстрируют общий благотворный ответ на лечение на основе кинических критериев, хорошо известных и широко применяемых в данной области, и которые описаны ниже, таких как уменьшение размера опухоли, уменьшение количества опухолей или ослабление симптомов заболевания.
Примеры клинических критериев представлены Национальным институтом США по исследованию рака (NCI), в которых некоторые классы злокачественных опухолей разделены на клинически категории «вялотекущих» и «агрессивных» лимфом. Вялотекущие лимфомы включают лимфомы фолликулярных клеток, разделенные на цитологические «степени», диффузные лимфомы из мелких лимфоцитов/хронический лимфоцитарный лейкоз (CLL), лимфоплазмацитоидная/макроглобулинемия Вальденстрема, лимфома из клеток маргинальной зоны и лейкоз ворсистых клеток. Агрессивные лимфомы включают диффузную, смешанную и крупноклеточную лимфому, лимфому Беркитта/диффузную мелкоклеточную лимфому с нерасщепленными ядрами, лимфобластную лимфому, лимфому из клеток мантийной зоны и связанную со СПИДом лимфому. В некоторых случаях используют международный прогностический индекс (IPI) для агрессивной и фолликулярной лимфомы. Факторы, учитываемые в IPI, включают возраст (возраст <60 лет по сравнению с возрастом >60 лет), сывороточную лактатдегидрогеназу (нормальные уровни по сравнению с повышенными), общий функциональный статус (0 или 1 по сравнению с 2-4) (смотри определение ниже), стадию заболевания (I или II по сравнению с III или IV) и вовлечение экстранодальных участков (0 или 1 по сравнению с 2-4). Пациенты с 2 или более факторами риска имеют менее чем 50% вероятность безрецидивной и общей выживаемости в течение 5 лет.
Общий функциональный статус в случае агрессивного IPI определяют следующим образом: описание степени: 0 - полностью активен, способен выполнять всю работу, которую осуществлял до болезни, без ограничений; 1 - ограничено выполняет физически напряженную работу, но является ходячим и способен выполнять легкую или сидячую работу, например, легкую домашнюю работу, работу в офисе; 2 - является ходячим и способен полностью себя обслуживать, но не способен осуществлять никакую производственную деятельность, до 50% дневного времени или немного больше чем 50% дневного времени проводит в постели; 3 - способен только к ограниченному самообслуживанию, проводит в постели или сидя больше 50% дневного времени; 4 - полная инвалидность, не способен обслуживать себя, полностью прикован к постели или стулу; и 5 - гибель (смотри The International Non-Hodgkin's Lymphoma Prognostic Factors Project. A predictive model for aggressive non- Hodgkin's lymphoma. N. Engl. J. Med. 329: 987-94, 1993).
В общем, степень лимфомы оценивают клинически, используя такой критерий, что лимфома низкой степени злокачественности присутствует в виде нодального заболевания и часто является вялотекущей или медленно растущей. Заболевание средней и высокой степени злокачественности обычно присутствует в виде намного более агрессивного заболевания с крупными экстранодальными объемными опухолями.
Систему классификации Ann Arbor также можно использовать для измерения прогрессирования опухолей, особенно неходжкинских лимфом. Более подробное описание смотри в The International Non-Hodgkin's Lymphoma Prognostic Factors Project: A predictive model for aggressive non-Hodgkin's lymphoma, New England J. Med. (1993) 329: 987. Согласно критериям Cheson для оценки NHL, разработанным в сотрудничестве с Национальным институтом исследования рака (Cheson et al., J. Clin. Oncol. 1999, 17: 1244; Grillo-Lopez et al., Ann Oncol. 2000, 11: 399), полный ответ получают, когда имеет место полное исчезновение всех регистрируемых клинических и радиографических признаков заболевания и связанных с заболеванием симптомов, размер всех лимфатических узлов возвращается к нормальному, селезенка уменьшается в размере и костный мозг очищен от поражения лимфомой. Сходные критерии разработаны для различных других форм злокачественных опухолей или гиперпролиферативных заболеваний и легко доступны специалисту в данной области. Смотри, например, публикацию Cheson с соавторами (Clin. Adv. Hematol. Oncol. 2006, 4: 4-5), в которой описаны критерии для оценки CLL; публикацию Cheson с соавторами (J. Clin. Oncol. 2003, 21: 4642-9), в которой описаны критерии для AML; публикацию Cheson с соавторами (Blood 2000, 96: 3671-4), в которой описаны критерии миелодиспластических синдромов.
В одном аспекте терапевтический эффект способов согласно изобретению определяют по уровню ответа, например, неполный ответ определяют как уменьшение опухоли менее чем до половины от ее исходного размера. Полный ответ определяют как полное устранение заболевания, подтверждаемое клинической или радиобиологической оценкой. В одном варианте у индивидуума, получающего лечение согласно изобретению, наблюдается, по меньшей мере, частичный ответ на лечение. В другом аспекте неподтвержденный полный ответ получают, когда у пациента наблюдают полное исчезновение заболевания и уменьшение размера селезенки, но лимфатические узлы уменьшаются более чем на 75% и костный мозг не определен. Неподтвержденный полный ответ удовлетворяет и превосходит критерии неполного ответа. Общий ответ определяют как уменьшение, по меньшей мере, на 50 процентов общей опухолевой нагрузки.
В другом аспекте ответ на терапию у пациентов, имеющих B-клеточную злокачественную опухоль, проявляется в виде замедления прогрессирования заболевания по сравнению с пациентами, не получающими терапии. Измерение замедленного прогрессирования заболевания или любого из указанных выше факторов можно осуществлять способами, хорошо известными в данной области, включая сканирование костей, CT-сканирование, сканирование с использованием галлия, лимфангиограмму, MRI, PET-сканирования, ультразвуковое исследование и тому подобные.
В некоторых вариантах способ уменьшения количества B-клеток или лечения заболевания или расстройства, ассоциированного с аномальной активностью B-клеток, у субъекта, у которого имеется или предполагается наличие заболевания или расстройства, включает в себя лечение субъекта с использованием сочетания CD37-специфичной связывающей молекулы и ингибитора mTOR. Например, способ может включать в себя введение субъекту, нуждающемуся в таком лечении, CD37-специфичной связывающей молекулы и ингибитора mTOR, выбранного из сиролимуса, темсиролимуса, дефоролимуса, эверолимуса, такролимуса, зотаролимуса, куркумина или фарнезилтиосалициловой кислоты. В некоторых из указанных выше вариантов CD37-специфичной связывающей молекулой является CD37-специфичное антитело или CD37-специфичная связывающая молекула.
В следующих вариантах CD37-специфичной связывающей молекулой является CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, или SEQ ID NO: 309 и 310, соответственно. В следующих вариантах CD37-специфичной связывающей молекулой является CD37-специфичный SMIP-полипептид, такой как SMIP-полипептид, содержащий аминокислотную последовательность, которая указана в SEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 52, 60, 80, 84, 86, 88 или 253. В некоторых предпочтительных вариантах сочетание включает в себя (1) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и сиролимус, (2) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и темсиролимус, (3) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и эверолимус, (4) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и дефоролимус, (5) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и PP242, или (6) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и PP30. В некоторых других предпочтительных вариантах сочетание включает в себя (1) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и сиролимус, (2) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и темсиролимус, (3) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и эверолимус, (4) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и дефоролимус, (5) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и PP242, или (6) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и PP30. В других предпочтительных вариантах сочетание включают в себя (1) CD37-специфичный SMIP-полипептид, содержащий последовательность SEQ ID NO: 253, и сиролимус, (2) CD37-специфичный SMIP-полипептид, содержащий последовательность SEQ ID NO: 253, и темсиролимус, (3) CD37-специфичный SMIP-полипептид, содержащий последовательность SEQ ID NO: 253, и эверолимус, (4) CD37-специфичный SMIP-полипептид, содержащий последовательность SEQ ID NO: 253, и дефоролимус, (5) CD37-специфичный SMIP-полипептид, содержащий последовательность SEQ ID NO: 253, и PP242, или (6) CD37-специфичный SMIP-полипептид, содержащий последовательность SEQ ID NO: 253, и PP30.
В некоторых других вариантах способ уменьшения количества B-клеток или лечения заболевания или расстройства, ассоциированного с аномальной активностью B-клеток, у субъекта, у которого имеется или предполагается наличие заболевания или расстройства, включает в себя лечение субъекта с использованием сочетания CD37-специфичной связывающей молекулы и ингибитора PI3K. Например, способ может включать в себя введение субъекту, нуждающемуся в таком лечении, CD37-специфичной связывающей молекулы и ингибитора PI3K, выбранного из LY294002, вортманнина, p110γ-специфичных ингибиторов или p110δ-специфичных ингибиторов. В некоторых из указанных выше вариантов CD37-специфичной связывающеей молекулой является CD37-специфичное антитело или CD37-специфичный SMIP-полипептид.
В следующих вариантах CD37-специфичной связывающей молекулой является CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, или SEQ ID NO: 309 и 310, соответственно. В следующих вариантах CD37-специфичной связывающей молекулой является CD37-специфичный SMIP-полипептид, такой как SMIP-полипептид, содержащий аминокислотную последовательность, которая указана в SEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 52, 60, 80, 84, 86, 88 или 253. В некоторых предпочтительных вариантах сочетание включает в себя (1) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и LY294002, (2) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и p110γ-специфичный ингибитор, или (3) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, и p110δ-специфичный ингибитор. В некоторых других предпочтительных вариантах сочетание согласно настоящему изобретению включает в себя (1) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и LY294002, (2) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и p110γ-специфичный ингибитор, или (3) CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 309 и 310, соответственно, и p110δ-специфичный ингибитор. В других предпочтительных вариантах сочетание включает в себя CD37-специфичный SMIP-полипептид, содержащий аминокислотную последовательность, которая указана в SEQ ID NO: 253, и ингибитор PI3K LY294002, или SEQ ID NO: 253 и p110γ-специфичный ингибитор, или SEQ ID NO: 253 и p110δ-специфичный ингибитор.
В некоторых предпочтительных вариантах CD37-специфичную связывающую молекулу (например, CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308, соответственно, или SEQ ID NO: 309 и 310, соответственно, или CD37-специфичный SMIP, содержащий последовательность SEQ ID NO: 253) вводят в дозах в диапазоне примерно от 0,03 мг/кг до примерно 20 мг/кг (например, от 0,03 до 0,1 мг/кг, от 0,1 до 0,5 мг/кг, от 0,5 до 2,5 мг/кг, от 2,5 до 5 мг/кг, от 5 до 7,5 мг/кг, от 7,5 до 10 мг/кг, от 10 до 12,5 мг/кг, от 12,5 до 15 мг/кг, от 15 до 17,5 мг/кг или от 17,5 до 20 мг/кг) массы тела субъекта на одно введение с интервалом между введениями в диапазоне от 1 суток до 180 суток (например, от 1 до 7 суток, от 1 до 14 суток, от 1 до 30 суток, от 1 до 60 суток, от 1 до 90 суток, от 1 до 120 суток, от 1 до 150 суток; или ежедневно, еженедельно, ежемесячно, каждые 2 месяца, каждые 3 месяца, каждые 4 месяца, каждые 5 месяцев или каждые 6 месяцев). В некоторых предпочтительных вариантах CD37-специфичную связывающую молекулу вводят внутривенно (например, путем внутривенной инфузии или инъекции). В некоторых других предпочтительных вариантах CD37-специфичную связывающую молекулу вводят подкожно.
В некоторых предпочтительных вариантах используют рапамицин в качестве ингибитора mTOR в сочетании с CD37-специфичной связывающей молекулой. Рапамицин можно вводить перорально в начальной дозе от 1 до 15 мг (например, от 1 до 2,5 мг, от 2,5 до 5 мг, от 5 до 7,5 мг, от 7,5 до 10 мг, от 10 до 12,5 мг или от 12,5 до 15 мг или примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 мг) в 1 день с последующими ежедневными поддерживающими дозами от 0,2 до 5 мг (например, от 0,2 до 0,5 мг, от 0,5 до 1 мг, от 1 до 2 мг, от 2 до 3 мг, от 3 до 4 мг или от 4 до 5 мг; или 0,2, 0,4, 0,5, 0,6, 0,8, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5 или 5 мг). В некоторых вариантах рапамицин вводят перорально в начальной дозе 6 мг в 1 день с последующими ежедневными поддерживающими дозами 2 мг. В некоторых других вариантах рапамицин вводят перорально в начальной дозе до 15 мг в 1 день с последующими ежедневными поддерживающими дозами 5 мг.
В некоторых предпочтительных вариантах используют темсиролимус в качестве ингибитора mTOR в сочетании с CD37-специфичной связывающей молекулой. Темсиролимус можно вводить посредством внутривенной инфузии в дозе примерно от 1 до 25 мг (например, от 1 до 2,5 мг, от 2,5 до 5 мг, от 5 до 7,5 мг, от 7,5 до 10 мг, от 10 до 12,5 мг, от 12,5 до 15 мг, от 15 до 20 мг или от 20 до 25 мг, или примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 мг) один раз в неделю. В некоторых вариантах темсиролимус вводят посредством внутривенной инфузии в дозе 25 мг в течение 30-60-минутного периода один раз в неделю.
В некоторых предпочтительных вариантах используют эверолимус в качестве ингибитора mTOR в сочетании с CD37-специфичной связывающей молекулой. Эверолимус можно вводить перорально ежедневно в дозе примерно от 1 до примерно 10 мг (например, от 1 до 2,5 мг, от 2,5 до 5 мг, от 5 до 7,5 мг или от 7,5 до 10 мг; или 1, 2, 2,5, 3, 4, 5, 6, 7, 7,5, 8, 9 или 10 мг). В некоторых вариантах эверолимус вводят перорально ежедневно в дозе 5 мг. В некоторых вариантах эверолимус вводят перорально ежедневно в дозе 10 мг.
В некоторых предпочтительных вариантах используют CAL-101, CAL-120 или CAL-263 в качестве ингибитора PI3K с CD37-специфичной связывающей молекулой. CAL-101, CAL-120 или CAL-263 можно вводить перорально два раза или один раз в сутки ежедневно в диапазоне доз примерно от 10 до примерно 500 мг (например, от 10 до 25 мг, от 25 до 50 мг, от 50 до 75 мг, от 75 до 100 мг, от 100 до 150 мг, от 150 до 200 мг, от 200 до 250 мг, от 250 до 300 мг, от 300 до 350 мг, от 350 до 400 мг, от 400 до 450 мг или от 450 до 500 мг; или 10, 20, 25, 30, 40, 50, 60, 70, 75, 80, 90, 100, 125, 150, 175, 200, 250, 300, 350, 400, 450 или 500 мг). В некоторых вариантах, CAL-101 вводят перорально два раза в сутки ежедневно в дозе 50 мг, 100 мг, 200 мг или 350 мг на одно введение.
Для получения требуемых синергетических эффектов CD37-специфичной связывающей молекулы и ингибитора mTOR или PI3K (например, уменьшения количества или истощение B-клеток или достижения клинического улучшения) предпочтительно, чтобы CD37-специфичная связывающая молекула и ингибитор mTOR или PI3K одновременно присутствовали в организме субъекта, подвергаемого лечению. В некоторых предпочтительных вариантах CD37-специфичную связывающую молекулу сначала вводят в тот же день, что и ингибитор mTOR или PI3K. В некоторых других предпочтительных вариантах CD37-специфичную связывающую молекулу сначала вводят в пределах 30 суток (например, 1, 2, 3, 4, 5, 6, 7, 10, 14, 21 или 30 суток) до начального введения ингибитора mTOR или PI3K. В некоторых других предпочтительных вариантах CD37-специфичную связывающую молекулу сначала вводят в пределах 30 суток (например, 1, 2, 3, 4, 5, 6, 7, 10, 14, 21 или 30 суток) после начального введения ингибитора mTOR или PI3K.
Наборы
В качестве дополнительного аспекта изобретение относится к наборам, которые содержат одно или несколько соединений или композиций, применимых в способах согласно настоящему изобретению, упакованных таким образом, который облегчает их применение при практическом осуществлении способов согласно изобретению. В самом простом варианте такой набор содержит соединение или композицию, описанные в настоящей публикации, которые применимы на практике при осуществлении способа согласно изобретению, упакованные в емкость, такую как герметично закрытый флакон или сосуд, с этикеткой, прикрепленной к емкости или входящей в упаковку, на которой описано применение соединения или композиции при практическом осуществлении способа согласно изобретению. Предпочтительно соединение или композицию упаковывают в стандартной лекарственной форме. Набор может дополнительно содержать устройство, подходящее для введения композиция предпочтительным путем введения или для практического осуществления скринингового анализа. Набор может содержать этикетку, на которой описано применение композиции(ий) связывающей молекулы в способе согласно изобретению.
В некоторых вариантах набор согласно настоящему изобретению содержит CD37-специфичную связывающую молекулу и ингибитор mTOR или PI3K, упакованные отдельно друг от друга в виде стандартных доз или в виде независимых стандартных доз с инструкциями или без инструкций относительно того вводятся ли одновременно или последовательно. Например, набор согласно настоящему изобретению, подходящий для лечения лимфомы клеток мантийной зоны, может содержать стандартную дозу CD37-специфичной связывающей молекулы (например, CD37-специфичного антитела или CD37-специфичного полипептида SMIP) и стандартную дозу ингибитора mTOR, которые упакованы раздельно. В некоторых вариантах набор может содержать дополнительное терапевтическое средство (например, CD20-специфичную связывающую молекулу (такую как TRU-015, ритуксимаб, офатумумаб или окрелизумаб), цитокин, хемокин, фактор роста, химиотерапевтическое средство или радиотерапевтическое средство) в другой отдельной емкости.
В некоторых других вариантах CD37-специфичную связывающую молекулу и ингибитор mTOR или PI3K готовят вместе. Полученные препараты могут быть упакованы в емкостях для одной дозы или множества доз, и их можно хранить в высушенном вымораживанием (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, такого как вода для инъекций, непосредственно перед применением.
ПРИМЕРЫ
ПРИМЕР 1
CD37-СПЕЦИФИЧНЫЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ
Различные CD37-специфичные связывающие белки могут быть с компонентами, примеры которых приведены в настоящем описании. Например, могут быть получены CD37-специфичные антитела или SMIP-молекулы, и такие молекулы могут быть химерными, гуманизированными или человеческими. Более конкретно CDR вариабельных областей легкой цепи можно найти в SEQ ID NO: 236-240 и 247-254, и предпочтительные CDR вариабельных доменов тяжелой цепи включают последовательности SEQ ID NO: 241-245 и 247-254. Также предпочтительные вариабельные области легкой и тяжелой цепей представлены в SEQ ID NO: 236-240 и SEQ ID NO: 241-245, соответственно. Предпочтительные вариабельные области легкой и тяжелой цепей также можно найти в SEQ ID NO: 247-254. Предпочтительные линкеры вариабельных доменов включают последовательности SEQ ID NO: 225-229, тогда как предпочтительные шарниры включают последовательности SEQ ID NO: 230-235.
Предпочтительные CD37-специфичные SMIP-полипептиды содержат последовательности SEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 52, 80, 82, 84, 86, 88, 222 и 262 (но без лидерных последовательностей), а также последовательности SEQ ID NO: 247-254 и 266-269. Конкретным предпочтительным вариантом является CAS-024 [G28-1 VH (M99F, Y102S) - VL (T25A) scFv (SSC-P) H WCH2 WCH3], который представляет собой рекомбинантный, состоящий из 483 аминокислот одноцепочечный слитый белок, который связывается с CD37 человека. Связывающая домен содержит гуманизированный scFv, основанный на CDR вариабельных областей антитела G28-1, включающих мутации в CDR3 тяжелой цепи и в CDR1 легкой цепи. Вариабельные домены связаны (25-аминокислотной) последовательностью (G4S)5 (SEQ ID NO: 229), которая связана посредством состоящей из трех аминокислот связки (GDQ) с амино-концом модифицированной верхней и центральной области шарнира IgG1 (где первые два из трех цистеинов, встречающихся в таких шарнирных областях, заменены серином). Карбоксильный конец шарнира слит с эффекторным доменом, содержащим домены CH2 и CH3 IgG1. Аминокислотная последовательность CAS-024 указана в SEQ ID NO: 253.
Предпочтительные примеры составных частей CD-37-специфичных SMIP-молекул включают лидерные последовательности, которые используются для экспрессии и экспорта, но которые удаляются из зрелого слитого белка при экспорте из клетки, и которые указаны в SEQ ID NO: 223 и 224; линкерные последовательности, используемые для связывания вариабельных доменов легкой и тяжелой цепи с образованием связывающих scFv-доменов, которые указаны в SEQ ID NO: 225-229; шарниры, используемые для связывания связывающих scFv-доменов с эффекторными доменами, которые указаны в SEQ ID NO: 230-235; вариабельные области легкой цепи, которые указаны в SEQ ID NO: 236-240; вариабельные области тяжелой цепи, которые указаны в SEQ ID NO: 241-245; и эффекторные домены), а также некоторые CD-37-специфичные SMIP-молекулы, включая слитый белок CAS-024, представленные в SEQ ID NO: 247-253.
ПРИМЕР 2
ИНГИБИРОВАНИЕ РОСТА СОЧЕТАНИЕМ CD37-СПЕЦИФИЧНОГО CAS-024 и РАПАМИЦИНА
CAS-024 [G28-1 VH (M99F, Y102S) - VL (T25A) scFv (SSC-P) H WCH2 WCH3] описан в примере 1. Нуклеотидная последовательность, кодирующая CAS-024 (включая лидерную последовательность) указана в SEQ ID NO: 221. Рапамицин (Sigma, St. Louis, MO) растворяли в ДМСО и хранили при -20°C вплоть до использования. Линиями клеток человека, экспрессирующими CD37, были клетки Rec-1 (линия клеток лимфомы мантийных клеток) и SU-DHL-6 (линия клеток диффузной крупноклеточной лимфомы)(обе линии из DSMZ, Braunschweig, Germany).
Клетки Rec-1 и SU-DHL-6 высевали по 1×104 клеток/лунку в 100 мкл среды в 96-луночные планшеты. Клетки, обрабатывали различными концентрациями CAS-024 (концентрации смотри на фиг. 1 и 2) после предварительной инкубации с антителом против F(ab)'2 IgG человека и планшеты инкубировали в течение 96 часов при 37°C, 5% CO2 в присутствии серийных разведений рапамицина. Конечный объем в каждой лунке составлял 150 мкл. После инкубации планшеты охлаждали до комнатной температуры и метили, используя 100 мкл/лунку реагенты для регистрации ATPlite (Perkin Elmer, Boston, MA). В анализе измеряли клеточный АТФ в качестве маркера жизнеспособных клеток. Образцы анализировали, регистрируя люминесценцию с использованием устройства для считывания планшетов Topcount NXT (Perkin Elmer, Waltham, MA). Данные приводили, используя подгонку кривой по 4 параметрам с помощью Prism (версия 4.0, компьютерная программа Graphpad, San Diego, CA), и значения IC50 определяли в виде концентрации, которая приводит к 50% ингибированию по сравнению с необработанными культурами.
Чтобы определить, действуют ли такие соединения синергетически, для анализа данных применяли способ медианного эффекта/комбинационного индекса (CI) (Chou and Talalay). Числовое значение, установленное для каждого сочетания лекарственных средств в случае предварительно определяемых уровней доз, обеспечивает возможность количественного сравнения взаимодействий между лекарственными средствами в разных сочетаниях лекарственных средств. Значения CI распределяют взаимодействия по трем категориям: синергизм, аддитивность и антагонизм (CI<1,0,=1 или >1,0, соответственно). После мечения и приведения данных определяют значения CI, используя пакет компьютерных программ Calcusyn (Biosoft®, Cambridge, UK).
Сочетание CD37-связывающей молекулы с ингибитором mTOR рапамицином ингибировало рост клеток Rec-1 (фиг. 1) и SU-DHL-6 (фиг. 2) больше, чем любое из соединений отдельно. Действительно, измеренные CI CAS-024 и рапамицина неожиданно строго соответствовали синергизму в ингибировании клеточного роста (смотри фиг. 3).
ПРИМЕР 3
ИНГИБИРОВАНИЕ РОСТА СОЧЕТАНИЕМ CD37-СПЕЦИФИЧНОГО CAS-024 и ТЕМСИРОЛИМУСА
Влияние сочетания CAS-024 с другим ингибитором mTOR, темсиролимусом, на рост клеток Rec-1 и SU-DHL-6 и значения CI определяли, используя способы, которые описаны в примере 2. Используемые концентрации CAS-024 и темсиролимуса указаны на фиг. 4 и 5.
Результаты показывают, что сочетание CAS-024 с темсиролимусом ингибировало рост клеток SU-DHL-6 (фиг. 4) и Rec-1 (фиг. 5) больше, чем любое из соединений отдельно. Измеренные значения CI показывают, что CAS-024 в сочетании с темсиролимусом синергетически ингибировало рост клеток SU-DHL-6 и Rec-1 (фиг. 6-8).
ПРИМЕР 4
ИНГИБРОВАНИЕ РОСТА СОЧЕТАНИЕМ CD37-СПЕЦИФИЧНОГО CAS-024 и LY294002
Влияние сочетания CAS-024 с ингибитором PI3K, LY294002, на рост клеток Rec-1 и SU-DHL-6 и значения CI определяли, используя способы, которые описаны в примере 2. Диапазоны используемых концентраций CAS-024 и LY294002 составляли от 2 до 0,2 нМ и от 50 до 0,4 мкМ, соответственно.
Результаты показывают, что CAS-024 в сочетании с LY294002 синергетически ингибировал рост клеток SU-DHL-6 и Rec-1 (фиг. 9).
Различные варианты, описанные выше, можно сочетать для получения дополнительных вариантов. Все патенты США, публикации заявок на выдачу патентов США, иностранные патенты, заявки на выдачу иностранных патентов и непатентные публикации, упоминаемые в данном описании и/или перечисленные в материалах заявки, включены в настоящее описание в виде ссылки в полном объеме. Аспекты приведенных вариантов могут быть модифицированы, если необходимо использовать концепции различных патентов, заявок и публикаций для получения дополнительных вариантов.
Указанные и другие изменения могут быть осуществлены в вариантах в свете приведенного выше подробного описания. В общем, следует понимать, что термины, используемые в следующей далее формуле изобретения, не следует считать ограничивающими формулу изобретения конкретными вариантами, приведенными в описании и формуле изобретения, а следует считать, что они включают все возможные варианты вместе с полным объемом эквивалентов, на которые дает право формула изобретения. Соответственно формула изобретения не ограничена описанием.
| название | год | авторы | номер документа |
|---|---|---|---|
| СВЯЗЫВАЮЩЕЕСЯ С CD37 ИММУНОТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО И ЕГО КОМБИНАЦИЯ С БИФУНКЦИОНАЛЬНЫМ ХИМИОТЕРАПЕВТИЧЕСКИМ СРЕДСТВОМ | 2009 |
|
RU2531754C2 |
| СНИЖЕНИЕ КОЛИЧЕСТВА В-КЛЕТОК С ИСПОЛЬЗОВАНИЕМ CD37-СПЕЦИФИЧЕСКИХ И CD20-СПЕЦИФИЧЕСКИХ СВЯЗЫВАЮЩИХ МОЛЕКУЛ | 2006 |
|
RU2423381C2 |
| ОДНОЦЕПОЧЕЧНЫЕ МУЛЬТИВАЛЕНТНЫЕ СВЯЗЫВАЮЩИЕ БЕЛКИ С ЭФФЕКТОРНОЙ ФУНКЦИЕЙ | 2007 |
|
RU2487888C2 |
| БЕЛКИ, СВЯЗЫВАЮЩИЕ СПЕЦИФИЧЕСКИЙ МЕМБРАННЫЙ АНТИГЕН ПРОСТАТЫ, И СООТВЕТСТВУЮЩИЕ КОМПОЗИЦИИ И СПОСОБЫ | 2012 |
|
RU2632647C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО РЕЦЕПТОРА АНТИГЕНА ПРОТИВ CD19 | 2015 |
|
RU2718542C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2731202C2 |
| CD37-СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И ИХ ИММУНОКОНЪЮГАТЫ | 2011 |
|
RU2610662C9 |
| АНТИТЕЛА ПРОТИВ PD-1 И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2788616C2 |
| ПОЛИПЕПТИДЫ, СВЯЗЫВАЮЩИЕСЯ С CD3 | 2013 |
|
RU2673153C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА К CD33 | 2015 |
|
RU2747384C2 |
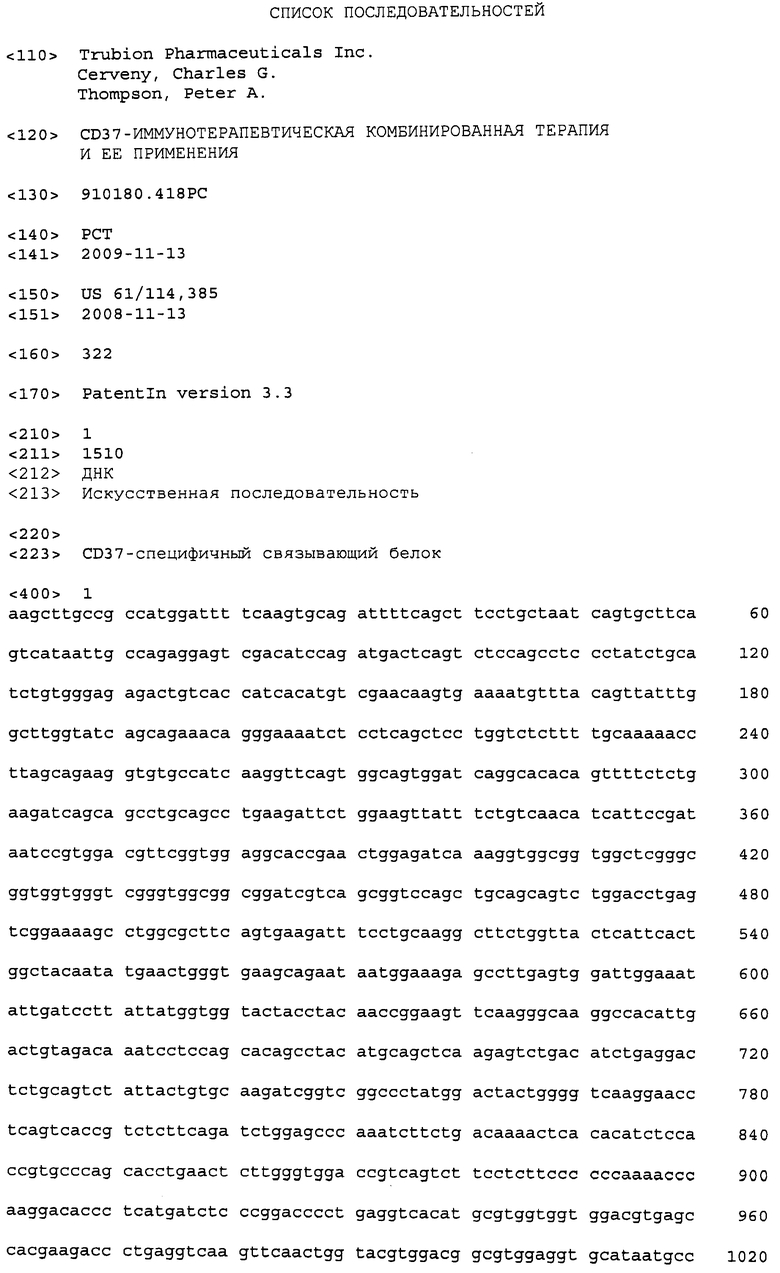




































































































































































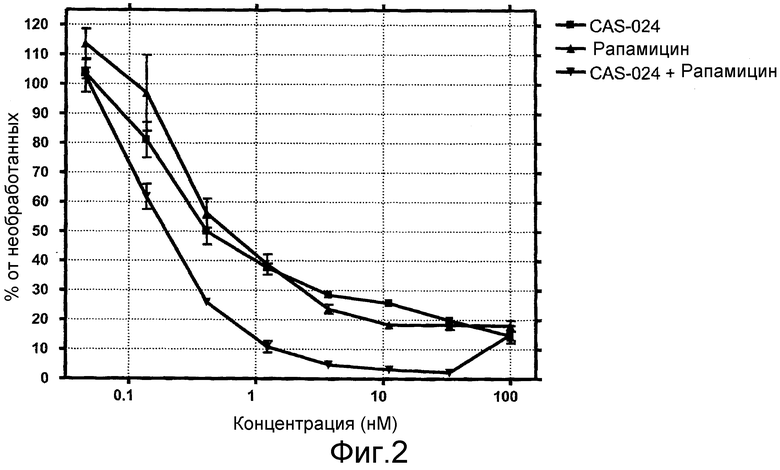
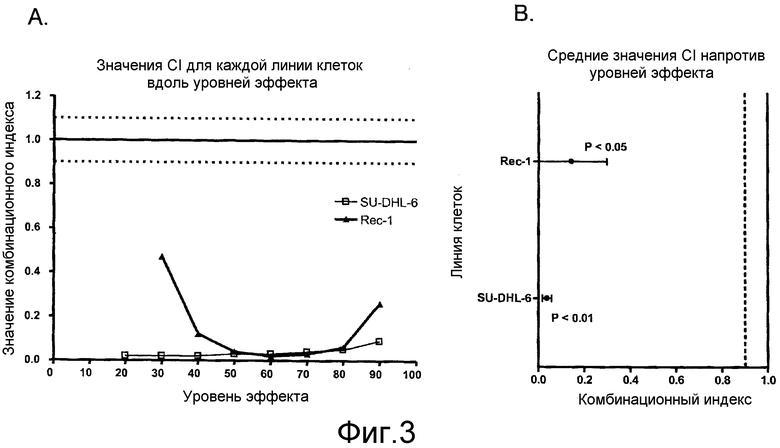
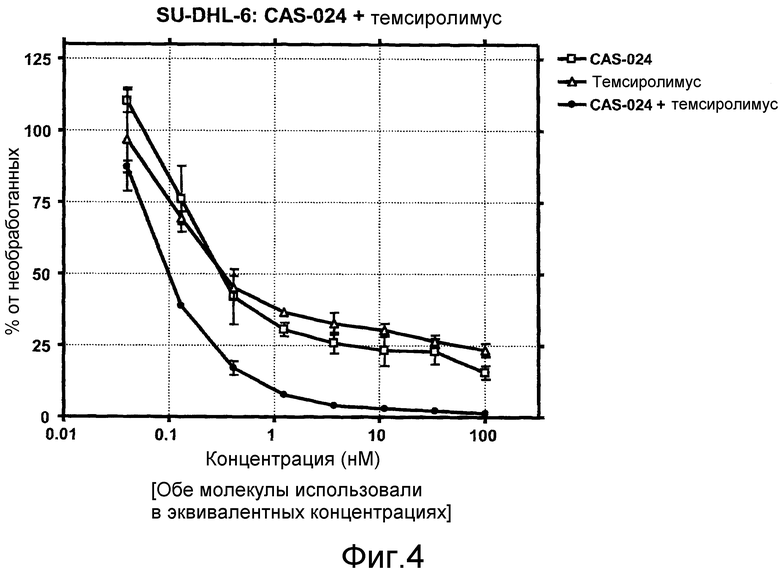
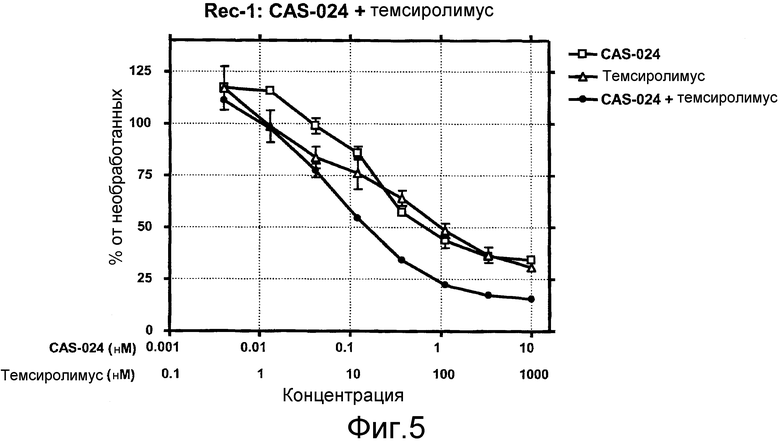
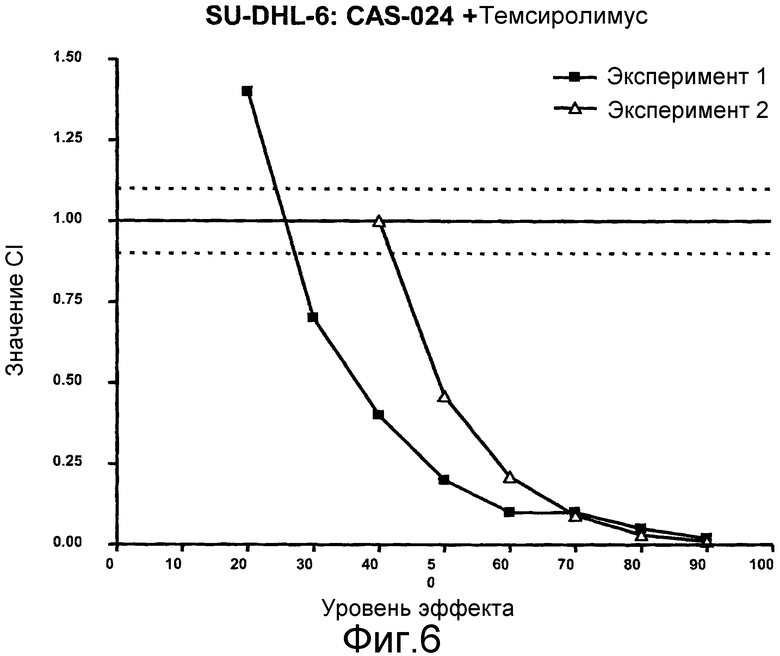
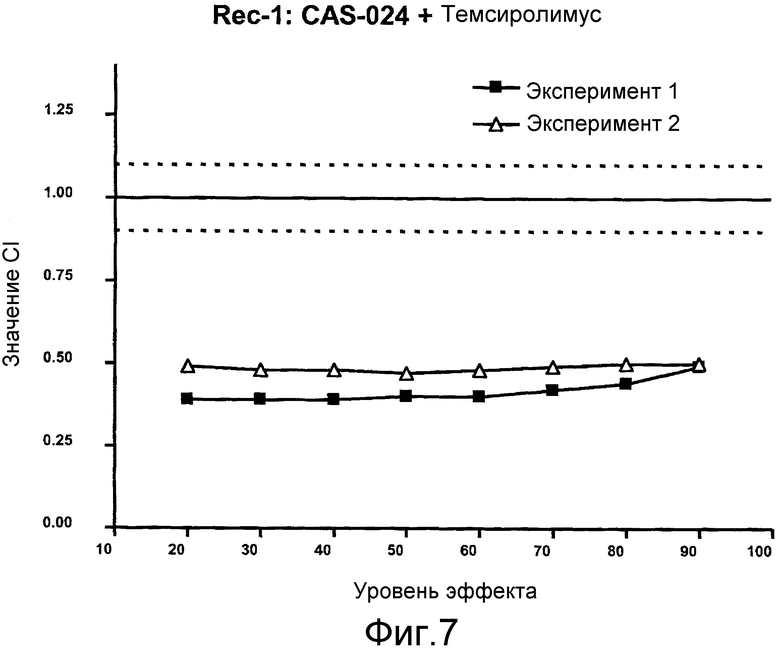
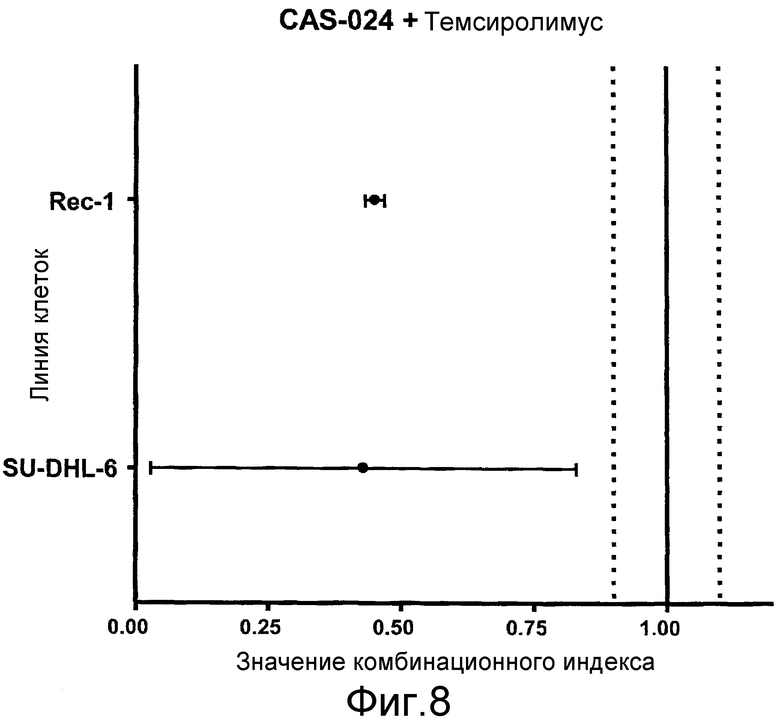
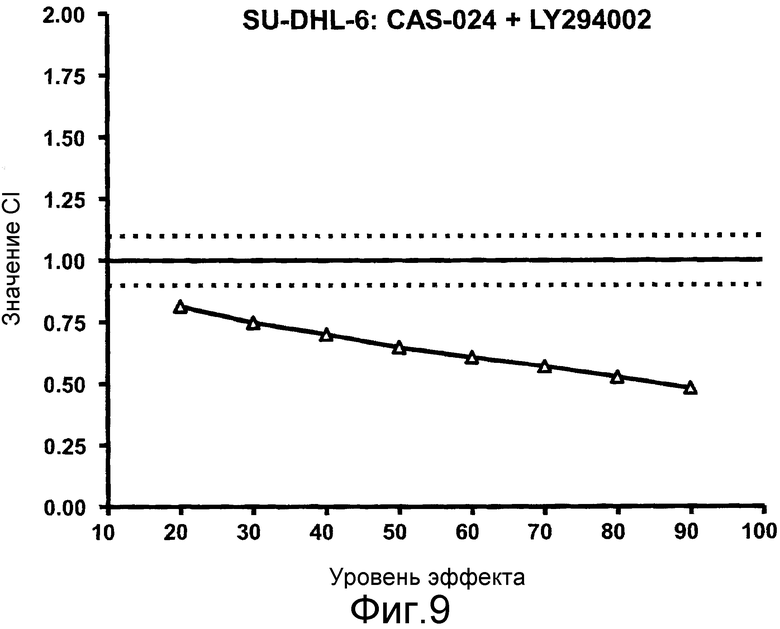
Группа изобретений относится к способам уменьшения количества В-клеток или лечения заболевания или расстройства, связанного с патологической активностью В-клеток. Для этого индивиду вводят терапевтически эффективное количество CD37-специфичной связывающей молекулы и терапевтически эффективное количество ингибитора mTOR или PI3K. Также предложены композиция и набор для лечения неходжкинской лимфомы. Группа изобретений обеспечивает синергический эффект при введении CD37-специфичных связывающих молекул(SMIP) в сочетании с ингибиторами mTOR или ингибиторами PI3K для лечения или профилактики связанного с B-клетками гиперпролиферативного заболевания. 3 н. и 33 з.п. ф-лы, 9 ил., 4 пр.
1. Способ уменьшения количества В-клеток или лечения заболевания или расстройства, связанного с патологической активностью В-клеток, у индивида, страдающего этим заболеванием или расстройством, или у которого предполагается это заболевание или расстройство, включающий лечение индивида терапевтически эффективным количеством CD37-специфичной связывающей молекулы и терапевтически эффективным количеством ингибитора mTOR или PI3K.
2. Способ по п.1, в котором способ включает введение индивиду ингибитора mTOR.
3. Способ по п.2, в котором ингибитором mTOR является сиролимус, темсиролимус или торкиниб.
4. Способ по п.2, в котором ингибитором mTOR является дефоролимус, эверолимус, такролимус, зотаролимус, куркумин или фарнезилтиосалициловая кислота.
5. Способ по п.1, в котором способ включает введение индивиду ингибитора PI3K.
6. Способ по п.5, в котором ингибитором PI3K является Р110δ-специфичный ингибитор.
7. Способ по п.1, в котором CD37-специфичной связывающей молекулой является CD37-специфичное антитело или его антигенсвязывающая часть или белок SMIP.
8. Способ по п.1, в котором CD37-специфичной связывающей молекулой является гуманизированное антитело или его антигенсвязывающая часть, или гуманизированный белок SMIP.
9. Способ по п.1, в котором CD37-специфичной связывающей молекулой является гуманизированный CD37-специфичный белок SMIP, содержащий аминокислотную последовательность SEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 52, 60, 80, 82, 84, 86 или 88.
10. Способ по п.1, в котором CD37-специфичной связывающей молекулой является гуманизированный CD37-специфичный белок SMIP, содержащий аминокислотную последовательность SEQ ID NO:253.
11. Способ по п.1, в котором CD37- специфичной связывающей молекулой является гуманизированное CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308 соответственно или SEQ ID NO: 309 и 310 соответственно.
12. Способ по п.2, в котором CD37-специфичная связывающая молекула содержит белок SMIP, имеющий аминокислотную последовательность SEQ ID NO:253, и в котором ингибитором mTOR является сиролимус или темсиролимус.
13. Способ по п.2, в котором CD37-специфичная связывающая молекула содержит антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308 соответственно или SEQ ID NO: 309 и 310 соответственно, и в котором ингибитором mTOR является сиролимус, темсиролимус или торкиниб.
14. Способ по п.1, в котором CD37-специфичную связывающую молекулу и ингибитор mTOR или PI3K вводят последовательно.
15. Способ по п.1, в котором CD37-специфичную связывающую молекулу и ингибитор mTOR или PI3K вводят одновременно.
16. Способ по п.15, в котором CD37-специфичную связывающую молекулу и ингибитор mTOR или PI3K вводят в состав вместе.
17. Способ по п.1, в котором CD37-специфичную связывающую молекулу вводят парентерально, а ингибитор mTOR или PI3K вводят перорально.
18. Способ по любому из пп.1-17, в котором расстройством или заболеванием, связанным с патологической активностью В-клеток, является В-клеточная лимфома или лейкоз, такие как В-клеточная неходжкинская лимфома (NHL) (включая лимфому Беркитта, хронический лимфоцитарный лейкоз (CLL), мелкоклеточную лимфоцитарную лимфому (SLL), диффузную крупноклеточную В-клеточную лимфому, фолликулярную лимфому, иммунобластную крупноклеточную лимфому, лимфобластную лимфому из предшественников В-клеток и лимфому из клеток мантийной зоны), волосатоклеточный лейкоз, макроглобулинемия Вальденстрема, В-клеточный пролимфоцитарный лейкоз, лимфома дендритных клеток CD37+, лимфоплазмоцитарная лимфома, лимфома из клеток маргинальной зоны селезенки, экстранодальная лимфома из В-клеток маргинальной зоны, поражающая лимфоидную ткань слизистых оболочек (MALT), нодальная лимфома из В-клеток маргинальной зоны, медиастинальная (тимическая) В-крупноклеточная лимфома, внутрисосудистая В-крупноклеточная лимфома и первичная лимфома с выпотом; заболевание, характеризуемое продукцией аутоантител, такое как идиопатическая воспалительная миопатия, ревматоидный артрит, ювенильный ревматоидный артрит, миастения гравис, болезнь Грайвса, сахарный диабет типа I, гломерулонефрит с образованием антител против базальной мембраны, быстро прогрессирующий гломерулонефрит, болезнь Борже (IgA-нефропатия), системная красная волчанка (SLE), болезнь Крона, язвенный колит, идиопатическая тромбоцитопеническая пурпура (ITP), антифосфолипидный синдром, нейрооптикомиелит, рассеянный склероз, аутоиммунное заболевание, дерматомиозит, полимиозит или макроглобулинемия Вальденстрема; или заболевание, характеризуемое стимуляцией Т-клеток, связанных с В-клеточным путем.
19. Способ по любому из пп.1-17, в котором индивид дополнительно имеет хромосомную транслокацию t(11;14)(q13;q32) или сверхэкспрессию циклина D1.
20. Способ по п.19, в котором расстройством или заболеванием, связанным с патологической активностью В-клеток, является лимфома клеток мантийной зоны.
21. Набор для лечения неходжкинской лимфомы, содержащий:
(a) CD37-специфичную связывающую молекулу и
(b) ингибитор mTOR или PI3K.
22. Набор по п.21, дополнительно содержащий CD20-специфичную связывающую молекулу, такую как TRU-015, ритуксимаб, офатумумаб, окрелизумаб; цитокин; хемокин; фактор роста; химиотерапевтическое средство, такое как бендамустин; или радиотерапевтическое средство.
23. Композиция для уменьшения количества В-клеток или лечения заболевания или расстройства, связанного с патологической активностью В-клеток, у индивида, страдающего этим заболеванием или расстройством, или у которого предполагается это заболевание или расстройство, содержащая:
(a) CD37-специфичную связывающую молекулу и
b) ингибитор mTOR или фосфатидилинозитол-3-киназы (PI3K).
24. Композиция по п.23, в которой композиция содержит ингибитор mTOR.
25. Композиция по п.24, в которой ингибитором mTOR является сиролимус, темсиролимус или торкиниб.
26. Композиция по п.24, в которой ингибитором mTOR является дефоролимус, эверолимус, такролимус, зотаролимус, куркумин или фарнезилтиосалициловая кислота.
27. Композиция по п.23, в которой композиция содержит ингибитор PI3K.
28. Композиция по п.27, в которой ингибитором PI3K является p110δ-специфичный ингибитор.
29. Композиция по п.23, в которой CD37-специфичной связывающей молекулой является CD37-специфичное антитело или его антигенсвязывающая часть или белок SMIP.
30. Композиция по п.23, в которой CD37-специфичной связывающей молекулой является гуманизированное антитело или его антигенсвязывающая часть или гуманизированный белок SMIP.
31. Композиция по п.23, в которой CD37-специфичной связывающей молекулой является гуманизированный CD37-специфичный белок SMIP, содержащий аминокислотную последовательность SEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 52, 60, 80, 82, 84, 86 или 88.
32. Композиция по п.23, в которой CD37-специфичной связывающей молекулой является гуманизированный CD37-специфичный белок SMIP, содержащий аминокислотную последовательность SEQ ID NO: 253.
33. Композиция по п.23, в которой CD37-специфичной связывающей молекулой является гуманизированное CD37-специфичное антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308 соответственно или SEQ ID NO: 309 и 310 соответственно.
34. Композиция по п.24, в которой CD37-специфичная связывающая молекула содержит белок SMIP с аминокислотной последовательностью SEQ ID NO:253 и в которой ингибитором mTOR является сиролимус, темсиролимус или торкиниб.
35. Композиция по п.24, в которой CD37-специфичная связывающая молекула содержит антитело, легкие и тяжелые цепи которого содержат последовательности SEQ ID NO: 307 и 308 соответственно или SEQ ID NO: 309 и 310 соответственно, и в которой ингибитором mTOR является сиролимус, темсиролимус или торкиниб.
36. Композиция по любому из пп.23-35, дополнительно содержащая CD20-специфичную связывающую молекулу, такую как TRU-015, ритуксимаб, офатумумаб, окрелизумаб; цитокин; хемокин; фактор роста; химиотерапевтическое средство, такое как бендамустин; или радиотерапевтическое средство.
| US2007059306 A1, 15.03.2007 | |||
| US20050272758 A1, 8.12.2005 | |||
| EP1939203 A2, 02.07.2008 | |||
| TAMBURINI J | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2014-08-20—Публикация
2009-11-13—Подача