Область техники
Настоящее изобретение относится к константным областям антител, имеющим улучшенные физико-химические свойства (стабильность и гомогенность), иммуногенность (антигенность) и безопасность, и/или время полужизни в плазме, и антителам, включающим указанные константные области.
Предпосылки создания изобретения
В качестве лекарственных средств антитела привлекают к себе внимание, поскольку они в высокой степени стабильны в плазме (крови) и имеют немногочисленные неблагоприятные эффекты. Из них в продаже имеется ряд лекарственных средств - антител типа IgG, и множество антител - лекарственных средств - разрабатывается в настоящее время (непатентный документ 1 и 2).
Почти все имеющиеся в настоящее время в продаже антитела - лекарственные средства - являются антителами подкласса IgG1. Предполагается, что антитела типа IgG1 полезны в качестве противораковых лекарственных средств - антител, поскольку они связываются с рецептором Fcγ и вызывают активность ADCC (антителозависимую клеточно-опосредованную цитотоксичность). Однако связывание Fc-домена с рецептором Fcγ, которое является важным для такой эффекторной функции, как ADCC, может вызывать ненужные неблагоприятные эффекты, и поэтому из антител - лекарственных средств, предназначенных для нейтрализации биологической активности, предпочтительно исключить такую активность связывания (непатентный документ 3). Кроме того, поскольку рецептор Fcγ экспрессируется в антигенпрезентирующих клетках, связывающиеся с рецептором Fcγ молекулы проявляют тенденцию к представленности в качестве антигенов. Сообщалось, что иммуногенность усиливается и может усиливаться при связывании белка или пептида с Fc-доменом IgG1 (непатентный документ 4 и патентный документ 1). Полагают, что взаимодействие между Fc-доменом антитела и рецептором Fcγ является причиной серьезных неблагоприятных эффектов, с которыми столкнулись в клинических испытаниях фазы I TGN1412 (непатентный документ 5). Следовательно, в антителах - лекарственных средствах, предназначенных для нейтрализации биологической активности антигена, связывание с рецептором Fcγ считается вредным ввиду неблагоприятного эффекта и иммуногенности.
Способом ослабления связывания с рецептором Fcγ является смена подтипа антитела IgG с IgG1 на IgG2 или IgG4; однако этот способ не способен полностью ингибировать связывание (непатентный документ 6). Одним из опубликованных способов полного ингибирования связывания с рецептором Fcγ является искусственное изменение Fc-домена. Например, следствием эффекторных функций антител против CD3 и антител против CD4 являются неблагоприятные эффекты. Поэтому в связывающийся с рецептором Fcγ Fc-домен были введены аминокислоты, которые не присутствуют в последовательности дикого типа (WT) (непатентные документы 3 и 7), и в настоящее время проводятся клинические испытания для оценки антител против CD3, которые не связываются с рецептором Fcγ, и антител против CD4, которые имеют мутированный Fc-домен (непатентные документы 5 и 8). В альтернативном случае не связывающиеся с рецептором Fcγ (FcγR) антитела можно приготовить путем смены связывающегося с FcγR домена IgG1 (в положениях 233, 234, 235, 236, 327, 330 и 331 в Европейской системе нумерации) на последовательность домена IgG2 или IgG4 (непатентный документ 9 и патентный документ 2). Однако эти молекулы содержат новые неприродные пептидные последовательности из девяти-двенадцати аминокислот, которые могут быть пептидным Т-клеточным эпитопом и, следовательно, создавать угрозу возникновения иммуногенности. Нет предшествующего сообщения о не связывающихся с рецептором Fcγ антителах, для которых преодолены эти проблемы.
Между тем физико-химические свойства белков - антител, в частности гомогенность и стабильность, очень важны при разработке антител - лекарственных средств. Для подтипа IgG2 сообщалось о гетерогенности, возникшей в результате дисульфидных связей в шарнирной области (непатентный документ 10 и патентный документ 3). Нелегко произвести их в качестве лекарственного средства в крупном масштабе, пока между производствами сохраняется связанная с целевыми веществами/родственными веществами гетерогенность. Поэтому для молекул антител, разрабатываемых в качестве лекарственных средств, желательны, насколько возможно, единые вещества.
IgG2 и IgG4 являются неустойчивыми в кислотных условиях. Антитела типа IgG, как правило, подвергаются воздействию кислотных условий в процессе очистки с использованием белка A и в процессе инактивации вируса. Поэтому требуется внимание в отношении стабильности IgG2 и IgG4 во время этих процессов, и предпочтительно, когда молекулы антител, разработанные в качестве лекарственных средств, являются также устойчивыми в кислотных условиях. Такие проблемы свойственны природным IgG2 и IgG4 и не связывающимся с рецептором Fcγ антителам, происходящим из IgG2 или IgG4 (непатентные документы 6 и 7 и патентный документ 2). При разработке антител в лекарственные средства желательным является разрешение этих проблем.
Антитела типа IgG1 относительно устойчивы в кислотных условиях, и в этом типе антител также низка степень гетерогенности, возникшей в результате дисульфидных связей в шарнирной области. Однако имеется сообщение, что в шарнирной области антител типа IgG1 пептидные связи подвергаются неферментативному расщеплению в растворах при хранении этих антител в виде композиций, и в результате в качестве примесей образуются Fab-фрагменты (непатентный документ 11). При разработке антител в лекарственные средства желательным является ослабление образования примеси.
Кроме того, сообщалось (непатентный документ 12) о делеции C-концевого остатка аминокислоты лизина и подавлении амидирования C-концевой аминогруппы вследствие делетирования обеих из двух C-концевых аминокислот, глицина и лизина, для исключения гетерогенности C-концевой последовательности антитела. При разработке антител в лекарственные средства исключение такой гетерогенности является предпочтительным.
Предпочтительно константная область антитела - лекарственного средства, направленного на нейтрализацию антигена, имеет последовательность, которая преодолевает все описанные выше проблемы. Однако о константной области, удовлетворяющей всем указанным требованиям, еще не сообщалось.
Полагают, что предпочтительной формой введения антитела - лекарственного средства - является подкожное введение композиции при хронических аутоиммунных заболеваниях и подобных. Недорогие, подходящие антитела - лекарственные средства, которые можно вводить подкожно с более длительными интервалами, можно обеспечить путем увеличения времени полужизни антитела в плазме для пролонгирования его терапевтического эффекта и тем самым уменьшения вводимого количества белка, и путем придания антителу высокой стабильности, так что можно приготовить композиции с высокими концентрациями.
Как правило, необходимо, чтобы подкожные композиции были композициями с высокими концентрациями. В плане стабильности или подобного, как правило, считают, что концентрационный предел композиций антител типа IgG составляет приблизительно 100 мг/мл (непатентный документ 13). Следовательно, обеспечение стабильности при высокой концентрации является проблемой. Однако не опубликовано сообщение о повышении стабильности IgG при высоких концентрациях путем введения замен аминокислот в его константную область. Сообщалось о способе увеличения времени полужизни антитела в плазме, и в этом способе замещаются аминокислоты в константной области (непатентные документы 14 и 15); однако введение не встречающихся в природе последовательностей в константную область не является предпочтительным ввиду угрозы возникновения иммуногенности.
Как описано выше, когда антитело - лекарственное средство - предназначено для нейтрализации антигена, предпочтительно, когда преодолены все описанные выше проблемы в отношении последовательности константной области. Однако о константной области, удовлетворяющей всем указанным требованиям, еще не сообщалось. Таким образом, существуют потребности в константных областях антител, в отношении которых преодолены описанные выше проблемы.
Ниже приведены документы известного уровня техники, соответствующего настоящему изобретению.
[Непатентный документ 1] Janice M Reichert, Clark J Rosensweig, Laura B Faden & Matthew C Dewitz. Monoclonal antibody successes in the clinic. Nature Biotechnology (2005) 23, 1073-1078
[Непатентный документ 2] Pavlou AK, Belsey MJ. The therapeutic antibodies market to 2008. Eur. J. Pharm. Biopharm. 2005 Apr; 59(3): 389-96
[Непатентный документ 3] Reddy MP, Kinney CA, Chaikin MA, Payne A, Fishman-Lobell J, Tsui P, Dal Monte PR, Doyle ML, Brigham-Burke MR, Anderson D, Reff M, Newman R, Hanna N, Sweet RW, Truneh A. Elimination of Fc receptor-dependent effector functions of a modified IgG4 monoclonal antibody to human CD4. J. Immunol. 2000 Feb 15; 164(4): 1925-33
[Непатентный документ 4] Guyre PM, Graziano RF, Goldstein J, Wallace PK, Morganelli PM, Wardwell K, Howell AL. Increased potency of Fc-receptor-targeted antigens. Cancer Immunol. Immunother. 1997 Nov-Dec; 45(3-4): 146-8
[Непатентный документ 5] Strand V, Kimberly R, Isaacs JD. Biologic therapies in rheumatology: lessons learned, future directions. Nat. Rev. Drug Discov. 2007 Jan; 6(1):75-92
[Непатентный документ 6] Gessner JE, Heiken H, Tamm A, Schmidt RE. The IgG Fc receptor family. Ann. Hematol. 1998 Jun; 76(6): 231-48
[Непатентный документ 7] Cole MS, Anasetti C, Tso JY. Human IgG2 variants of chimeric anti-CD3 are nonmitogenic to T cells. J. Immunol. 1997 Oct 1; 159(7): 3613-21
[Непатентный документ 8] Chau LA, Tso JY, Melrose J, Madrenas J. HuM291 (Nuvion), a humanized Fc receptor-nonbinding antibody against CD3, anergizes peripheral blood T cells as partial agonist of the T cell receptor. Transplantation 2001 Apr 15; 71(7): 941-50
[Непатентный документ 9] Armour KL, Clark MR, Hadley AG, Williamson LM. Recombinant human IgG molecules lacking Fcgamma receptor I binding and monocyte triggering activities. Eur. J. Immunol. 1999 Aug; 29(8): 2613-24
[Непатентный документ 10] Chu GC, Chelius D, Xiao G, Khor HK, Coulibaly S, Bondarenko PV. Accumulation of Succinimide in a Recombinant Monoclonal Antibody in Mildly Acidic Buffers Under Elevated Temperatures. Pharm. Res. 2007 Mar 24; 24(6): 1145-56
[Непатентный документ 11] AJ Cordoba, BJ Shyong, D Breen, RJ Harris. Nonenzymatic hinge region fragmentation of antibodies in solution. J. Chromatogr. B. Anal. Technol. Biomed. Life Sci. (2005) 818, 115-121
[Непатентный документ 12] Johnson KA, Paisley-Flango K, Tangarone BS, Porter TJ, Rouse JC. Cation exchange-HPLC and mass spectrometry reveal C-terminal amidation of an IgG1 heavy chain. Anal. Biochem. 2007 Jan 1; 360(1): 75-83
[Непатентный документ 13] Shire SJ, Shahrokh Z, Liu J. Challenges in the development of high protein concentration formulations. J. Pharm. Sci. 2004 Jun; 93(6): 1390-402
[Непатентный документ 14] Hinton PR, Xiong JM, Johlfs MG, Tang MT, Keller S, Tsurushita N. An engineered human IgG1 antibody with longer serum half-life. J. Immunol. 2006 Jan 1; 176(1): 346-56
[Непатентный документ 15] Ghetie V, Popov S, Borvak J, Radu C, Matesoi D, Medesan C, Ober RJ, Ward ES. Increasing the serum persistence of an IgG fragment by random mutagenesis. Nat. Biotechnol. 1997 Jul; 15(7): 637-40
[Патентный документ 1] US 20050261229A1
[Патентный документ 2] WO 99/58572
[Патентный документ 3] US 2006/0194280
Описание изобретения
Проблемы, решаемые настоящим изобретением
Настоящее изобретение было успешно создано ввиду указанных выше фактов. Целью настоящего изобретения является предоставление константных областей антител, которые имеют улучшенные физико-химические свойства (стабильность и гомогенность), иммуногенность, безопасность и фармакокинетику (сохранение в плазме (крови)) с помощью изменения аминокислот.
Способ разрешения проблем
Авторы настоящего изобретения провели специальные исследования для создания константных областей антител, которые улучшены благодаря изменению их аминокислотных последовательностей и имеют улучшенные физико-химические свойства (стабильность и гомогенность), иммуногенность, безопасность и фармакокинетику. В результате авторы настоящего изобретения с успехом улучшили константную область антитела так, что она имела повышенную устойчивость в кислотных условиях, сниженную гетерогенность, возникающую в результате дисульфидных связей в шарнирной области, сниженную гетерогенность, возникающую из С-конца тяжелой цепи, и повышенную стабильность при высоких концентрациях, а также обнаружили новые последовательности константных областей, имеющие ослабленную активность связывания с рецептором Fcγ, при минимизации создания новых пептидных T-клеточных эпитопов.
Настоящее изобретение относится к константным областям антител, которые лучше по показателям безопасности, угрозы возникновения иммуногенности, физико-химических свойств (стабильности и гомогенности) и фармакокинетики благодаря улучшению с помощью изменения аминокислот; антителам, включающим такую константную область антитела; фармацевтическим композициям, включающим такое антитело; и способам их получения. Конкретнее, настоящим изобретением предоставляются:
[1] константная область антитела человека, выбираемая из:
(a) константной области антитела человека, которая включает как делецию Gly в положении 329 (положении 446 в Европейской системе нумерации, смотри последовательности представляющих иммунологический интерес белков, публикацию NIH № 91-3242), так и делецию Lys в положении 330 (положении 447 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 1;
(b) константной области антитела человека, которая включает как делецию Gly в положении 325 (положении 446 в Европейской системе нумерации), так и делецию Lys в положении 326 (положении 447 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2; и
(c) константной области антитела человека, которая включает как делецию Gly в положении 326 (положении 446 в Европейской системе нумерации), так и делецию Lys в положении 327 (положении 447 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3;
[2] константная область IgG2, в которой аминокислоты в положениях 209 (положении 330 в Европейской системе нумерации), 210 (положении 331 в Европейской системе нумерации) и 218 (положении 339 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами;
[3] константная область IgG2, в которой аминокислота в положении 276 (положении 397 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 заменена другой аминокислотой;
[4] константная область IgG2, в которой аминокислоты в положениях 14 (положении 131 в Европейской системе нумерации), 102 (положении 219 в Европейской системе нумерации) и/или 16 (положении 133 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами;
[5] константная область IgG2 в соответствии с [4], в которой аминокислоты в положениях 20 (положении 137 в Европейской системе нумерации) и 21 (положении 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами;
[6] константная область IgG2, в которой His в положении 147 (положении 268 в Европейской системе нумерации), Arg в положении 234 (положении 355 в Европейской системе нумерации) и/или Gln в положении 298 (положении 419 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами;
[7] константная область IgG2, в которой аминокислоты в положениях 209 (положении 330 в Европейской системе нумерации), 210 (положении 331 в Европейской системе нумерации), 218 (положении 339 в Европейской системе нумерации), 276 (положении 397 в Европейской системе нумерации), 14 (положении 131 в Европейской системе нумерации), 16 (положении 133 в Европейской системе нумерации), 102 (положении 219 в Европейской системе нумерации), 20 (положении 137 в Европейской системе нумерации), и 21 (положении 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами;
[8] константная область IgG2 в соответствии с [7], которая дополнительно включает как делецию Gly в положении 325 (положении 446 в Европейской системе нумерации), так и делецию Lys в положении 326 (положении 447 в Европейской системе нумерации);
[9] константная область IgG2, в которой аминокислоты в положениях 276 (положении 397 в Европейской системе нумерации), 14 (положении 131 в Европейской системе нумерации), 16 (положении 133 в Европейской системе нумерации), 102 (положении 219 в Европейской системе нумерации), 20 (положении 137 в Европейской системе нумерации) и 21 (положении 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами;
[10] константная область IgG2 в соответствии с [9], которая дополнительно включает как делецию Gly в положении 325 (положении 446 в Европейской системе нумерации), так и делецию Lys в положении 326 (положении 447 в Европейской системе нумерации);
[11] константная область IgG2, в которой Cys в положении 14 (положении 131 в Европейской системе нумерации), Arg в положении 16 (положении 133 в Европейской системе нумерации), Cys в положении 102 (положении 219 в Европейской системе нумерации), Glu в положении 20 (положении 137 в Европейской системе нумерации), Ser в положении 21 (положении 138 в Европейской системе нумерации), His в положении 147 (положении 268 в Европейской системе нумерации), Arg в положении 234 (положении 355 в Европейской системе нумерации) и Gln в положении 298 (положении 419 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами;
[12] константная область IgG2 в соответствии с [11], которая дополнительно включает как делецию Gly в положении 325 (положении 446 в Европейской системе нумерации), так и делецию Lys в положении 326 (положении 447 в Европейской системе нумерации);
[13] константная область IgG2, в которой Cys в положении 14 (положении 131 в Европейской системе нумерации), Arg в положении 16 (положении 133 в Европейской системе нумерации), Cys в положении 102 (положении 219 в Европейской системе нумерации), Glu в положении 20 (положении 137 в Европейской системе нумерации), Ser в положении 21 (положении 138 в Европейской системе нумерации), His в положении 147 (положении 268 в Европейской системе нумерации), Arg в положении 234 (положении 355 в Европейской системе нумерации), Gln в положении 298 (положении 419 в Европейской системе нумерации) и Asn в положении 313 (положении 434 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами;
[14] константная область IgG2 в соответствии с [13], которая дополнительно включает как делецию Gly в положении 325 (положении 446 в Европейской системе нумерации), так и делецию Lys в положении 326 (положении 447 в Европейской системе нумерации);
[15] константная область IgG4, в которой аминокислота в положении 289 (положении 409 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 заменена другой аминокислотой;
[16] константная область IgG4, в которой аминокислоты в положении 289 (положении 409 в Европейской системе нумерации), положениях 14, 16, 20, 21, 97, 100, 102, 103, 104 и 105 (положениях 131, 133, 137, 138, 214, 217, 219, 220, 221 и 222 в Европейской системе нумерации соответственно) и положениях 113, 114 и 115 (положениях 233, 234 и 235 в Европейской системе нумерации соответственно) заменены другими аминокислотами, а аминокислота в положении 116 (положении 236 в Европейской системе нумерации) делетирована из аминокислотной последовательности SEQ ID NO: 3;
[17] константная область IgG4 в соответствии с [16], которая дополнительно включает как делецию Gly в положении 326 (положении 446 в Европейской системе нумерации), так и делецию Lys в положении 327 (положении 447 в Европейской системе нумерации);
[18] константная область IgG1, в которой Asn в положении 317 (положении 434 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 1 заменен другой аминокислотой;
[19] константная область IgG1 в соответствии с [18], которая дополнительно включает как делецию Gly в положении 329 (положении 446 в Европейской системе нумерации), так и делецию Lys в положении 330 (положении 447 в Европейской системе нумерации);
[20] константная область IgG2, в которой Ala в положении 209 (положении 330 в Европейской системе нумерации), Pro в положении 210 (положении 331 в Европейской системе нумерации), Thr в положении 218 (положении 339 в Европейской системе нумерации), Cys в положении 14 (положении 131 в Европейской системе нумерации), Arg в положении 16 (положении 133 в Европейской системе нумерации), Cys в положении 102 (положении 219 в Европейской системе нумерации), Glu в положении 20 (положении 137 в Европейской системе нумерации) и Ser в положении 21 (положении 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами;
[21] константная область IgG2 в соответствии с [20], которая дополнительно включает как делецию Gly в положении 325 (положении 446 в Европейской системе нумерации), так и делецию Lys в положении 326 (положении 447 в Европейской системе нумерации);
[22] константная область IgG2, в которой Cys в положении 14 (положении 131 в Европейской системе нумерации), Arg в положении 16 (положении 133 в Европейской системе нумерации), Cys в положении 102 (положении 219 в Европейской системе нумерации), Glu в положении 20 (положении 137 в Европейской системе нумерации) и Ser в положении 21 (положении 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами;
[23] константная область IgG2 в соответствии с [22], которая дополнительно включает как делецию Gly в положении 325 (положении 446 в Европейской системе нумерации), так и делецию Lys в положении 326 (положении 447 в Европейской системе нумерации);
[24] константная область антитела человека, включающая аминокислотную последовательность SEQ ID NO: 5;
[25] константная область антитела человека, включающая аминокислотную последовательность SEQ ID NO: 7;
[26] константная область антитела человека, включающая аминокислотную последовательность SEQ ID NO: 9;
[27] константная область антитела человека, включающая аминокислотную последовательность SEQ ID NO: 35;
[28] константная область антитела человека, включающая аминокислотную последовательность SEQ ID NO: 36;
[29] константная область антитела человека, включающая аминокислотную последовательность SEQ ID NO: 37;
[30] константная область антитела человека, включающая аминокислотную последовательность SEQ ID NO: 43;
[31] константная область антитела человека, включающая аминокислотную последовательность SEQ ID NO: 57 (M40ΔGK);
[32] константная область антитела человека, включающая аминокислотную последовательность SEQ ID NO: 55 (M86ΔGK);
[33] антитело, включающее константную область в соответствии с любым из [1]-[32];
[34] антитело против рецептора IL-6, включающее константную область в соответствии с любым из [1]-[32]; и
[35] фармацевтическая композиция, включающая константную область в соответствии с любым из [1]-[32].
Краткое описание чертежей
Фиг.1 представляет собой диаграмму, на которой демонстрируется результат использования гель-фильтрации для анализа процента агрегатов в WT-IgG1, WT-IgG2, WT-IgG4, IgG2-M397V и IgG4-R409K, очищенных с помощью элюции соляной кислотой.
Фиг.2 представляет собой диаграмму, на которой демонстрируется результат анализа с помощью катионообменной хроматографии (IEC) WT-IgG1, WT-IgG2 и WT-IgG4.
Фиг.3 представляет собой схему, на которой демонстрируется предсказанное образование дисульфидных связей в шарнирной области WT-IgG2.
Фиг.4 представляет собой схему, на которой демонстрируется предсказанное образование дисульфидных связей в шарнирной области IgG2-SKSC.
Фиг.5 представляет собой диаграмму, на которой демонстрируется результат анализа с помощью катионообменной хроматографии (IEC) WT-IgG2 и IgG2-SKSC.
Фиг.6 представляет собой диаграмму, на которой демонстрируется результат анализа с помощью катионообменной хроматографии (IEC) гуманизированного антитела PM-1, антитела с C-концевой ΔK в Н-цепи и антитела с C-концевой ΔGK в Н-цепи.
На фиг.7 демонстрируется сравнение количеств WT-IgG1, WT-IgG2, WT-IgG4, WT-M14ΔGK, WT-M17ΔGK и WT-M11ΔGK, связывающихся с FcγRI.
Фиг.8 представляет собой графическое представление, демонстрирующее сравнение количеств WT-IgG1, WT-IgG2, WT-IgG4, WT-M14ΔGK, WT-M17ΔGK и WT-M11ΔGK, связывающихся с FcγRIIa.
Фиг.9 представляет собой графическое представление, демонстрирующее сравнение количеств WT-IgG1, WT-IgG2, WT-IgG4, WT-M14ΔGK, WT-M17ΔGK и WT-M11ΔGK, связывающихся с FcγRIIb.
Фиг.10 представляет собой графическое представление, демонстрирующее сравнение количеств WT-IgG1, WT-IgG2, WT-IgG4, WT-M14ΔGK, WT-M17ΔGK и WT-M11ΔGK связывающихся с FcγRIIIa (Val).
Фиг.11 представляет собой диаграмму, на которой демонстрируется увеличение агрегирования при анализе стабильности WT-IgG1, WT-M14ΔGK, WT-M17ΔGK и WT-M11ΔGK при высоких концентрациях.
Фиг.12 представляет собой диаграмму, на которой демонстрируется увеличение Fab-фрагментов при анализе стабильности WT-IgG1, WT-M14ΔGK, WT-M17ΔGK и WT-M11ΔGK при высоких концентрациях.
Фиг.13 представляет собой диаграмму, на которой демонстрируется результат анализа с помощью катионообменной хроматографии (IEC) WT-IgG2, WT-M14ΔGK и WT-M31ΔGK.
Фиг.14 представляет собой график зависимости от времени концентраций в плазме WT-IgG1 и WT-M14 после внутривенного введения трансгенным по FcRn человека мышам.
Фиг.15 представляет собой график зависимости от времени концентраций в плазме WT-IgG1, WT-M44, WT-M58 и WT-M73 после внутривенного введения трансгенным по FcRn человека мышам.
Фиг.16 представляет собой диаграмму, на которой демонстрируется оценка на основе катионообменной хроматографии эффекта на гетерогенность, оказываемого константной областью антител WT и F2H/L39 против рецептора IL-6, антитела H0L0 против рецептора IL-31 и антитела H0L0 против RANKL.
Фиг.17 представляет собой диаграмму, на которой демонстрируется оценка на основе катионообменной хроматографии эффекта на гетерогенность, оказываемого цистеином в СН1-домене антител WT и F2H/L39 против рецептора IL-6.
Фиг.18 представляет собой диаграмму, на которой демонстрируется оценка на основе DSC эффекта на пик денатурации, оказываемого цистеином в СН1-домене антител WT и F2H/L39 против рецептора IL-6.
Фиг.19 представляет собой график, на котором демонстрируются нейтрализующие BaF/g130 активности тоцилизумаба, контроля и Fv5-M83.
Фиг.20 представляет собой график, на котором демонстрируются нейтрализующие BaF/g130 активности тоцилизумаба, Fv3-M73 и Fv4-M73.
Фиг.21 представляет собой график зависимости от времени концентрации в плазме яванских макак тоцилизумаба, контроля, Fv3-M73, Fv4-M73, и Fv5-M83 после внутривенного введения.
Фиг.22 представляет собой график зависимости от времени концентрации CRP у яванских макак после внутривенного введения тоцилизумаба, контроля, Fv3-M73, Fv4-M73 или Fv5-M83.
Фиг.23 представляет собой график зависимости от времени концентрации несвязанного растворимого рецептора IL-6 у яванских макак после внутривенного введения тоцилизумаба, контроля, Fv3-M73, Fv4-M73 или Fv5-M83.
Фиг.24 представляет собой график зависимости от времени концентраций в плазме WT-IgG1, WT-M14 и WT-M58 после внутривенного введения трансгенным по FcRn человека мышам.
Вариант осуществления изобретения
Настоящим изобретением предоставляются константные области антител, физико-химические свойства (стабильность и гомогенность), иммуногенность, безопасность и/или фармакокинетика которых улучшены с помощью изменения аминокислотной последовательности константной области антитела; антитела, включающие такую константную область; фармацевтические композиции, включающие такое антитело; и способы их получения.
Здесь константная область относится к константной области Ig типа IgG1, IgG2 или IgG4. Предпочтительно константной областью антитела является константная область антитела человека. Известны аминокислотные последовательности константных областей IgG1, IgG2 и IgG4 человека (константной области IgG1 человека, SEQ ID NO: 1; константной области IgG2 человека, SEQ ID NO: 2; и константной области IgG4 человека, SEQ ID NO: 3). Содержащие аминокислотные замены константные области антител настоящего изобретения могут включать другие замены или модификации аминокислот при условии, что они включают замены аминокислот настоящего изобретения. Следовательно, константные области IgG2, включающие замены аминокислот настоящего изобретения в константной области IgG2, включающей аминокислотную последовательность SEQ ID NO: 2, включают константные области IgG2, которые включают одну или несколько замен и/или модификаций аминокислот в аминокислотной последовательности SEQ ID NO: 2 и, кроме того, включают замены аминокислот настоящего изобретения, а также константные области IgG2, которые включают замены аминокислот настоящего изобретения и, кроме того, включают одну или несколько замен и/или модификаций аминокислот. Это же распространяется на константные области IgG1, включающие аминокислотную последовательность SEQ ID NO: 1, и константные области IgG4, включающие аминокислотную последовательность SEQ ID NO: 3. Последовательность константной области IgG4 была изменена для повышения стабильности шарнирной области (Mol. Immunol. 1993 Jan; 30(1):105-8). Кроме того, сахарная цепочка в положении 297 в Европейской системе нумерации может быть сахарной цепочкой любой структуры (например, она может быть продуцирована с использованием E. coli), или может не быть какой-либо сахарной цепочки, связанной в этом сайте.
<IgG2, имеющий измененные аминокислоты>
Настоящим изобретением предоставляются константные области IgG2 с повышенной устойчивостью в кислотных условиях.
Конкретнее, настоящим изобретением предоставляются константные области IgG2, в которых Met в положении 276 (положении 397 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 заменен другой аминокислотой. Тип аминокислоты после замены особенно не ограничен; однако предпочтительной является замена на Val. Устойчивость антитела в кислотных условиях можно повысить с помощью замены Met в положении 276 (положении 397 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой.
Предоставляемые настоящим изобретением константные области IgG2, которые имеют повышенную устойчивость в кислотных условиях, могут также иметь другие замены, делеции, добавления и/или вставки аминокислот при условии, что они имеют по крайней мере описанную выше замену аминокислоты.
Настоящим изобретением предоставляются константные области IgG2 со сниженной гетерогенностью шарнирной области.
Конкретнее, настоящим изобретением предоставляются константные области IgG2, в которых Cys в положении 14 (положении 131 в Европейской системе нумерации), Arg в положении 16 (положении 133 в Европейской системе нумерации), и/или Cys в положении 102 (положении 219 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами. Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены Cys в положении 14 (положении 131 в Европейской системе нумерации) на Ser, Arg в положении 16 (положении 133 в Европейской системе нумерации) на Lys и Cys в положении 102 (положении 219 в Европейской системе нумерации) на Ser IgG2-SKSC).
Эти замены могут снизить гетерогенность, возникающую из шарнирной области IgG2. Константные области IgG2 настоящего изобретения, включающие аминокислотные замены, включают константные области IgG2, включающие по крайней мере один из трех типов аминокислотных замен, описанных выше; однако предпочтительно константные области IgG2 включают замены Cys в положении 14 и Cys в положении 102 другими аминокислотами или все три типа аминокислотных замен, описанных выше.
Предоставляемые настоящим изобретением константные области IgG2, которые имеют сниженную гетерогенность, могут также иметь другие замены, делеции, добавления и/или вставки аминокислот при условии, что они имеют по крайней мере описанные выше замены аминокислот.
Например, мутированием Cys в положении 14 и Arg в положении 16 в константной области IgG2, включающей аминокислотную последовательность SEQ ID NO: 2, можно создать не встречающиеся в природе, новые пептидные последовательности из девяти-двенадцати аминокислот, которые могут стать пептидными T-клеточными эпитопами, и, следовательно, вызвать угрозу иммуногенности. Даже при введении описанных выше аминокислотных замен можно избежать образования не встречающихся в природе T-клеточных эпитопов с помощью замены Glu в положении 20 (положении 137 в Европейской системе нумерации) и Ser в положении 21 (положении 138 в Европейской (EU) системе нумерации) другими аминокислотами. Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены Glu в положении 20 на Gly и Ser в положении 21 на Gly.
Настоящим изобретением также предоставляются константные области IgG2 с ослабленной активностью связывания с рецептором Fcγ.
Конкретнее, настоящим изобретением также предоставляются константные области IgG2, включающие аминокислотную последовательность, в которой Ala в положении 209 (EU330), Pro в положении 210 (EU331) и/или Thr в положении 218 (EU339) аминокислотной последовательности SEQ ID NO: 2 замены Ser, Ser и Ala соответственно. Уже сообщалось, что замены Ala в положении 209 (EU330) и Pro в положении 210 (EU331) способствуют ослаблению связывания с рецептором Fcγ (Eur. J. Immunol. 1999 Aug; 29(8): 2613-24). Ввиду угрозы возникновения иммуногенности, эти изменения, однако, не являются предпочтительными, поскольку они приводят к созданию происходящих не из человека пептидов, которые могут стать T-клеточными эпитопами. Однако связывание IgG2 с рецептором Fcγ можно ослабить с помощью замены Thr в положении 218 (EU339) на Ala в то же самое время, а пептиды из 9-12 аминокислот, которые могут стать T-клеточными эпитопами, происходят только из человека.
Константные области IgG2 настоящего изобретения, включающие замены аминокислот, включают по крайней мере один из трех типов аминокислотных замен, описанных выше; однако предпочтительно константные области IgG2 включают все три типа описанных выше аминокислотных замен. В предпочтительном варианте осуществления константные области IgG2 настоящего изобретения, включающие аминокислотные замены, включают константные области IgG2, включающие аминокислотную последовательность, в которой Ala в положении 209 (EU330), Pro в положении 210 (EU331) и Thr в положении 218 (EU339) в аминокислотной последовательности SEQ ID NO: 2 заменены Ser, Ser и Ala соответственно.
Предоставляемые настоящим изобретением константные области IgG2, которые имеют ослабленную активность связывания с рецептором Fcγ, могут также иметь другие замены, делеции, добавления и/или вставки аминокислот при условии, что они имеют по крайней мере описанные выше замены аминокислот.
Настоящим изобретением предоставляются константные области IgG2 со сниженной C-концевой гетерогенностью.
Конкретнее, настоящим изобретением предоставляются константные области IgG2, включающие аминокислотную последовательность, в которой Gly в положении 325 (положении 446 в Европейской системе нумерации) и Lys в положении 326 (положении 447 в Европейской системе нумерации) делетированы из аминокислотной последовательности SEQ ID NO: 2. Гетерогенность, возникающую из C-конца Н-цепи антитела, можно снизить только в случае делетирования обеих указанных аминокислот.
Предоставляемые настоящим изобретением константные области IgG2, которые имеют сниженную C-концевую гетерогенностью, могут также иметь другие замены, делеции, добавления и/или вставки аминокислот при условии, что они имеют по крайней мере описанные выше делеции аминокислот.
Настоящим изобретением, кроме того, предоставляются константные области IgG2 с улучшенной фармакокинетикой.
Конкретнее, настоящим изобретением предоставляются константные области IgG2, в которых His в положении 147 (положении 268 в Европейской системе нумерации), Arg в положении 234 (положении 355 в Европейской системе нумерации) и Gln в положении 298 (положении 419 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами. Эти замены аминокислот способствуют улучшению фармакокинетики антител. Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены His в положении 147 (положении 268 в Европейской системе нумерации) на Gln, Arg в положении 234 (положении 355 в Европейской системе нумерации) на Gln и Gln в положении 298 (положении 419 в Европейской системе нумерации) на Glu. Константные области IgG2 с заменами аминокислот настоящего изобретения включают константные области IgG2, включающие по крайней мере один из трех типов аминокислотных замен, описанных выше; однако предпочтительно константные области IgG2 включают все три типа аминокислотных замен, описанных выше.
Ниже представлен предпочтительный вариант IgG2 настоящего изобретения, который имеет повышенную устойчивость в кислотных условиях, сниженную гетерогенность в шарнирной области и/или ослабленную активность связывания с рецептором Fcγ.
Предоставляются антитела, включающие константную область IgG2, включающую аминокислотную последовательность, в которой Ala в положении 209, Pro в положении 210, Thr в положении 218, Met в положении 276, Cys в положении 14, Arg в положении 16, Cys в положении 102, Glu в положении 20 и Ser в положении 21 в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами.
Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены Ala в положении 209 (положении 330 в Европейской системе нумерации) на Ser, Pro в положении 210 (положении 331 в Европейской системе нумерации) на Ser, Thr в положении 218 (положении 339 в Европейской системе нумерации) на Ala, Met в положении 276 (положении 397 в Европейской системе нумерации) на Val, Cys в положении 14 (положении 131 в Европейской системе нумерации) на Ser, Arg в положении 16 (положении 133 в Европейской системе нумерации) на Lys, Cys в положении 102 (положении 219 в Европейской системе нумерации) на Ser, Glu в положении 20 (положении 137 в Европейской системе нумерации) на Gly и Ser в положении 21 (положении 138 в Европейской системе нумерации) на Gly.
Такие константные области IgG2 включают, например, константные области IgG2, включающие аминокислотную последовательность SEQ ID NO: 4 (M14).
В другом предпочтительном варианте осуществления константные области IgG2 настоящего изобретения включают константные области IgG2, являющиеся следствием делеции Gly в положении 325 и Lys в положении 326 в описанных выше константных областях IgG2 для снижения C-концевой гетерогенности. Такие антитела включают, например, IgG2, которые включают константную область, включающую аминокислотную последовательность SEQ ID NO: 5 (M14ΔGK).
Ниже представлен предпочтительный вариант IgG2 настоящего изобретения, который имеет сниженную гетерогенность в шарнирной области и/или ослабленную активность связывания с рецептором Fcγ.
Предоставляются антитела, включающие константную область IgG2, включающую аминокислотную последовательность, в которой Ala в положении 209, Pro в положении 210, Thr в положении 218, Cys в положении 14, Arg в положении 16, Cys в положении 102, Glu в положении 20 и Ser в положении 21 в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами.
Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены Ala в положении 209 (положении 330 в Европейской системе нумерации) на Ser, Pro в положении 210 (положении 331 в Европейской системе нумерации) на Ser, Thr в положении 218 (положении 339 в Европейской системе нумерации) на Ala, Cys в положении 14 (положении 131 в Европейской системе нумерации) на Ser, Arg в положении 16 (положении 133 в Европейской системе нумерации) на Lys, Cys в положении 102 (положении 219 в Европейской системе нумерации) на Ser, Glu в положении 20 (положении 137 в Европейской системе нумерации) на Gly и Ser в положении 21 (положении 138 в Европейской системе нумерации) на Gly.
Такие константные области IgG2 включают, например, константные области IgG2, включающие аминокислотную последовательность SEQ ID NO: 54 (M86).
В другом предпочтительном варианте осуществления константные области IgG2 настоящего изобретения включают константные области IgG2, являющиеся следствием делеции Gly в положении 325 и Lys в положении 326 в описанных выше константных областях IgG2 для снижения C-концевой гетерогенности. Такие антитела включают, например, IgG2, которые включают константную область, включающую аминокислотную последовательность SEQ ID NO: 55 (M86ΔGK).
Ниже приведен другой предпочтительный вариант константных областей IgG2 настоящего изобретения, который имеет повышенную устойчивость в кислотных условиях и сниженную гетерогенность в шарнирной области.
Предоставляются константные области IgG2, включающие аминокислотную последовательность, в которой Met в положении 276, Cys в положении 14, Arg в положении 16, Cys в положении 102, Glu в положении 20 и Ser в положении 21 в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами.
Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены Met в положении 276 (положении 397 в Европейской системе нумерации) на Val, Cys в положении 14 (положении 131 в Европейской системе нумерации) на Ser, Arg в положении 16 (положении 133 в Европейской системе нумерации) на Lys, Cys в положении 102 (положении 219 в Европейской системе нумерации) на Ser, Glu в положении 20 (положении 137 в Европейской системе нумерации) на Gly и Ser в положении 21 (положении 138 в Европейской системе нумерации) на Gly.
Такие константные области IgG2 включают, например, константные области IgG2, включающие аминокислотную последовательность SEQ ID NO: 6 (M31).
В другом предпочтительном варианте осуществления константные области IgG2 настоящего изобретения включают константные области IgG2, дополнительно включающие делецию Gly в положении 325 и Lys в положении 326 в описанных выше константных областях IgG2. Такие антитела включают, например, константные области IgG2, включающие аминокислотную последовательность SEQ ID NO: 7 (M31ΔGK).
Ниже приведен другой предпочтительный вариант константных областей IgG2 настоящего изобретения, который имеет сниженную гетерогенность в шарнирной области.
Предоставляются константные области IgG2, включающие аминокислотную последовательность, в которой Cys в положении 14, Arg в положении 16, Cys в положении 102, Glu в положении 20 и Ser в положении 21 в аминокислотной последовательности SEQ ID NO: 2 заменены другими аминокислотами.
Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены Cys в положении 14 (положении 131 в Европейской системе нумерации) на Ser, Arg в положении 16 (положении 133 в Европейской системе нумерации) на Lys, Cys в положении 102 (положении 219 в Европейской системе нумерации) на Ser, Glu в положении 20 (положении 137 в Европейской системе нумерации) на Gly и Ser в положении 21 (положении 138 в Европейской системе нумерации) на Gly.
Такие константные области IgG2 включают, например, константные области IgG2, включающие аминокислотную последовательность SEQ ID NO: 56 (M40).
В другом предпочтительном варианте осуществления константные области IgG2 настоящего изобретения включают константные области IgG2, дополнительно включающие делецию Gly в положении 325 и Lys в положении 326 в описанных выше константных областях IgG2. Такие антитела включают, например, константные области IgG2, включающие аминокислотную последовательность SEQ ID NO: 57 (M40ΔGK).
Настоящим изобретением предоставляются константные области IgG2, включающие аминокислотную последовательность, в которой Cys в положении 14 (положении 131 в Европейской системе нумерации), Arg в положении 16 (положении 133 в Европейской системе нумерации), Cys в положении 102 (положении 219 в Европейской системе нумерации), Glu в положении 20 (положении 137 в Европейской системе нумерации), Ser в положении 21 (положении 138 в Европейской системе нумерации), His в положении 147 (положении 268 в Европейской системе нумерации), Arg в положении 234 (положении 355 в Европейской системе нумерации) и Gln в положении 298 (положении 419 в Европейской системе нумерации) заменены другими аминокислотами, и попутно Gly в положении 325 (положении 446 в Европейской системе нумерации) и Lys в положении 326 (положении 447 в Европейской системе нумерации) делетированы из аминокислотной последовательности SEQ ID NO: 2.
Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены Cys в положении 14 на Ser, Arg в положении 16 на Lys, Cys в положении 102 на Ser, Glu в положении 20 на Gly, Ser в положении 21 на Gly, His в положении 147 на Gln, Arg в положении 234 на Gln и Gln в положении 298 на Glu.
В частности, настоящим изобретением предоставляется константная область антитела, включающая аминокислотную последовательность SEQ ID NO: 35 (M58).
Настоящим изобретением предоставляются константные области IgG2, включающие аминокислотную последовательность, в которой Cys в положении 14 (положении 131 в Европейской системе нумерации), Arg в положении 16 (положении 133 в Европейской системе нумерации), Cys в положении 102 (положении 219 в Европейской системе нумерации), Glu в положении 20 (положении 137 в Европейской системе нумерации), Ser в положении 21 (положении 138 в Европейской системе нумерации), His в положении 147 (положении 268 в Европейской системе нумерации), Arg в положении 234 (положении 355 в Европейской системе нумерации), Gln в положении 298 (положении 419 в Европейской системе нумерации) и Asn в положении 313 (положении 434 в Европейской системе нумерации) заменены другими аминокислотами, и попутно Gly в положении 325 (положении 446 в Европейской системе нумерации) и Lys в положении 326 (положении 447 в Европейской системе нумерации) делетированы из аминокислотной последовательности SEQ ID NO: 2.
Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены Cys в положении 14 на Ser, Arg в положении 16 на Lys, Cys в положении 102 на Ser, Glu в положении 20 на Gly, Ser в положении 21 на Gly, His в положении 147 на Gln, Arg в положении 234 на Gln, Gln в положении 298 на Glu и Asn в положении 313 на Ala.
В частности, настоящим изобретением предоставляется константная область антитела, включающая аминокислотную последовательность SEQ ID NO: 37 (M73).
Эти константные области антител были оптимизированы для ослабления активности связывания с рецептором Fcγ, уменьшения угрозы возникновения иммуногенности, повышения устойчивости в кислотных условиях, снижения гетерогенности, улучшения фармакокинетики и/или большей стабильности при приготовлении по сравнению с константной областью IgG1.
<IgG4, имеющий измененные аминокислоты>
Настоящим изобретением предоставляются константные области IgG4, которые устойчивы в кислотных условиях.
Конкретнее, настоящим изобретением предоставляются константные области IgG4, включающие аминокислотную последовательность, в которой Arg в положении 289 (положении 409 в Европейской системе нумерации) аминокислотной последовательности SEQ ID NO: 3 заменен другой аминокислотой. Тип аминокислоты после замены особенно не ограничен; однако предпочтительной является замена на Lys. Устойчивость антитела в кислотных условиях можно повысить с помощью замены Arg в положении 277 (положении 409 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 другой аминокислотой.
Предоставляемые настоящим изобретением константные области IgG4, которые имеют повышенную устойчивость в кислотных условиях, могут также иметь другие замены, делеции, добавления и/или вставки аминокислот при условии, что они имеют по крайней мере описанную выше аминокислотную замену.
Настоящим изобретением предоставляются константные области IgG4 со сниженной C-концевой гетерогенностью.
Настоящим изобретением предоставляются константные области IgG4, в которых Gly в положении 326 (положении 446 в Европейской системе нумерации) и Lys в положении 327 (положении 447 в Европейской системе нумерации) делетированы в константной области IgG4, включающей аминокислотную последовательность SEQ ID NO: 3. Гетерогенность, возникающую из C-конца Н-цепи антитела, можно снизить только в случае делетирования обеих указанных аминокислот.
Предоставляемые настоящим изобретением константные области IgG4, которые имеют сниженную C-концевую гетерогенностью, могут также иметь другие замены, делеции, добавления и/или вставки аминокислот при условии, что они имеют по крайней мере описанные выше делеции аминокислот.
Другой предпочтительный вариант IgG4 настоящего изобретения, который имеет повышенную устойчивость в кислотных условиях, сниженную гетерогенную в шарнирной области и/или ослабленную активность связывания с рецептором Fcγ, включает IgG4, включающий константную область, описанную ниже.
Предоставляются константные области IgG4, включающие аминокислотную последовательность, в которой Cys в положении 14, Arg в положении 16, Glu в положении 20, Ser в положении 21, Arg в положении 97, Ser в положении 100, Tyr в положении 102, Gly в положении 103, Pro в положении 104, Pro в положении 105, Glu в положении 113, Phe в положении 114, Leu в положении 115 и Arg в положении 289 заменены другими аминокислотами, и попутно Gly в положении 116 делетирован из аминокислотной последовательности SEQ ID NO: 3.
Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены Cys в положении 14 (положении 131 в Европейской системе нумерации) на Ser, Arg в положении 16 (положении 133 в Европейской системе нумерации) на Lys, Glu в положении 20 (положении 137 в Европейской системе нумерации) на Gly, Ser в положении 21 (положении 138 в Европейской системе нумерации) на Gly, Arg в положении 97 (положении 214 в Европейской системе нумерации) на Thr, Ser в положении 100 (положении 217 в Европейской системе нумерации) на Arg, Tyr в положении 102 (положении 219 в Европейской системе нумерации) на Ser, Gly в положении 103 (положении 220 в Европейской системе нумерации) на Cys, Pro в положении 104 (положении 221 в Европейской системе нумерации) на Val, Pro в положении 105 (положении 222 в Европейской системе нумерации) на Glu, Glu в положении 113 (положении 233 в Европейской системе нумерации) на Pro, Phe в положении 114 (положении 234 в Европейской системе нумерации) на Val, Leu в положении 115 (положении 235 в Европейской системе нумерации) на Ala и Arg в положении 289 (положении 409 в Европейской системе нумерации) на Lys.
Такие константные области IgG4 включают, например, константные области IgG4, включающие аминокислотную последовательность SEQ ID NO: 8 (M11).
В предпочтительном варианте осуществления константные области IgG4 настоящего изобретения включают константные области IgG4, дополнительно включающие делецию Gly в положении 325 (положении 446 в Европейской системе нумерации) и Lys в положении 326 (положении 447 в Европейской системе нумерации) в описанной выше константной области IgG4. Такие антитела включают, например, константные области IgG4, включающие аминокислотную последовательность SEQ ID NO: 9 (M11ΔGK).
<IgG1, имеющий измененные аминокислоты>
Настоящим изобретением предоставляются константные области IgG1 со сниженной C-концевой гетерогенностью.
Конкретнее, настоящим изобретением предоставляются константные области IgG1, имеющие делецию Gly в положении 329 (положении 446 в Европейской системе нумерации) и Lys в положении 330 (положении 447 в Европейской системе нумерации) в константной области IgG1, включающей аминокислотную последовательность SEQ ID NO: 1. Гетерогенность, возникающую из C-конца Н-цепи антитела, можно снизить только в случае делетирования обеих указанных аминокислот.
Настоящим изобретением предоставляются константные области IgG1 с улучшенной фармакокинетикой.
Настоящим изобретением предоставляются константные области IgG1, включающие аминокислотную последовательность, в которой Asn в положении 317 (положении 434 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 1 заменен другой аминокислотой. Тип аминокислоты после замены особенно не ограничен; однако предпочтительной является замена на Ala.
Настоящим изобретением предоставляется константная область, имеющая делецию Gly в положении 329 и Lys в положении 330 в аминокислотной последовательности SEQ ID NO: 36. Конкретнее, настоящим изобретением предоставляется константная область антитела, включающая аминокислотную последовательность SEQ ID NO: 43 (M83).
Предоставляемые настоящим изобретением константные области IgG1, которые имеют сниженную C-концевую гетерогенностью, могут также иметь другие замены, делеции, добавления и/или вставки аминокислот при условии, что они имеют по крайней мере описанные выше делеции аминокислот.
Настоящим изобретением также предоставляются антитела, включающие любую из описанных выше константных областей антител. Тип и происхождение антител настоящего изобретения особенно не ограничены при условии, что они включают описанную выше константную область антитела, и они могут быть любыми антителами.
Антитела настоящего изобретения также включают модифицированные продукты антител, включающих любую из аминокислотных замен, описанных выше. Происхождение антител особенно не ограничено. Антитела включают антитела человека, мыши, крысы и кролика. Антитела настоящего изобретения могут быть химерными, гуманизированными, полностью гуманизированными антителами или т.п. В предпочтительном варианте осуществления антитела настоящего изобретения являются гуманизированными антителами.
В альтернативном случае константные области антител, описанные выше, и/или молекулы антител, включающие описанную выше константную область антитела, можно связать, в виде молекулы слияния с Fc, с антителоподобной связывающей молекулой (каркасными молекулами), биоактивными пептидами, связывающими пептидами или подобными.
Антитела настоящего изобретения также включают продукты модификации антитела, включающего любую из описанных выше константных областей.
Такие продукты модификации антитела включают, например, антитела, связанные с различными молекулами, такими как полиэтиленгликоль (PEG) и цитотоксические вещества. Такие продукты модификации антитела можно получить с помощью химического модифицирования антител настоящего изобретения. Способы модифицирования антител уже широко известны в этой области.
Антитела настоящего изобретения могут также быть биспецифическими антителами. “Биспецифическое антитело” относится к антителу, которое имеет вариабельные области в одной молекуле, которые распознают различные эпитопы. Эпитопы могут быть представлены в одной молекуле или в раздельных молекулах.
Описанные выше константные области антител можно использовать в качестве константной области в антителе против произвольно выбранного антигена. Антиген особенно не ограничен.
Антитела настоящего изобретения можно также получить, например, с помощью следующих способов. В одном варианте получения антител настоящего изобретения один или несколько аминокислотных остатков в константной области сначала делетируют или заменяют представляющими интерес аминокислотами. Способы замещения одного или нескольких аминокислотных остатков представляющими интерес аминокислотами включают, например, сайт-направленный мутагенез (Hashimoto-Gotoh, T., Mizuno, T., Ogasahara, Y., and Nakagawa, M. An oligodeoxyribonucleotide-directed dual amber method for site-directed mutagenesis. Gene (1995) 152, 271-275; Zoller, M.J., and Smith, M. Oligonucleotide-directed mutagenesis of DNA fragments cloned into M13 vectors. Methods Enzymol. (1983) 100, 468-500; Kramer, W., Drutsa, V., Jansen, H.W., Kramer, B., Pflugfelder, M., and Fritz, H.J. The gapped duplex DNA approach to oligonucleotide-directed mutation construction. Nucleic Acids Res. (1984) 12, 9441-9456; Kramer W., and Fritz H.J. Oligonucleotide-directed construction of mutations via gapped duplex DNA Methods. Enzymol. (1987) 154, 350-367; Kunkel, T.A. Rapid and efficient site-specific mutagenesis without phenotypic selection. Proc. Natl. Acad. Sci. USA (1985) 82, 488-492). Эти способы можно использовать для замены целевых аминокислот в константной области антитела представляющими интерес аминокислотами.
В другом варианте получения антител сначала готовят антитело, которое связывается с представляющим интерес антигеном, с помощью способов, известных квалифицированным в данной области техники специалистам. Если приготовленное антитело происходит из не являющегося человеком животного, его можно гуманизировать. Связывающую активность антитела можно определить с использованием известных способов. Затем один или несколько аминокислотных остатков в константной области антитела делетируют или заменяют представляющими интерес аминокислотами.
Конкретнее, настоящее изобретение относится к способам продукции антител, которые включают стадии:
(a) экспрессии ДНК, кодирующей Н-цепь, в которой один или несколько аминокислотных остатков в константной области делетированы или заменены представляющими интерес аминокислотами, и ДНК, кодирующей легкую цепь; и
(b) сбора продуктов экспрессии стадии (a).
Первой стадией способов продукции настоящего изобретения является экспрессия ДНК, кодирующей Н-цепь антитела, в которой один или несколько аминокислотных остатков в константной области делетированы или заменены представляющими интерес аминокислотами, и ДНК, кодирующей L-цепь антитела. ДНК, кодирующую H-цепь, в которой один или несколько аминокислотных остатков в константной области делетированы или заменены представляющими интерес аминокислотами, можно приготовить, например, путем получения ДНК, кодирующей константную область H-цепи дикого типа, и введения соответствующей замены, так чтобы кодон, кодирующий конкретную аминокислоту в константной области, кодировал представляющую интерес аминокислоту.
В альтернативном случае ДНК, кодирующую H-цепь, в которой один или несколько аминокислотных остатков в константной области делетированы или заменены представляющими интерес аминокислотами, можно также приготовить путем разработки и затем химического синтеза ДНК, кодирующей белок, в котором один или несколько аминокислотных остатков в константной области H-цепи дикого типа делетированы или заменены представляющими интерес аминокислотами.
Тип аминокислотной замены включает описанные здесь замены, но не ограничивается ими.
В альтернативном случае ДНК, кодирующую Н-цепь, в которой один или несколько аминокислотных остатков в константной области делетированы или заменены представляющими интерес аминокислотами, можно также приготовить в виде объединения частичных ДНК. Такие объединения частичных ДНК включают, например, объединение ДНК, кодирующей вариабельную область, с ДНК, кодирующей константную область, и объединение ДНК, кодирующей Fab-область, с ДНК, кодирующей Fc-область, но не ограничиваются ими. ДНК, кодирующую L-цепь, можно также приготовить в виде объединения частичных ДНК.
Способы экспрессии описанных выше ДНК включают описанные ниже способы. Например, вектор для экспрессии H-цепи конструируют встраиванием ДНК, кодирующей вариабельную область H-цепи, в экспрессионный вектор вместе с ДНК, кодирующей константную область Н-цепи. Подобным образом, вектор для экспрессии L-цепи конструируют встраиванием ДНК, кодирующей вариабельную область L-цепи, в экспрессионный вектор вместе с ДНК, кодирующей константную область L-цепи. Альтернативно, гены этих H- и L-цепей можно встроить в один вектор. Экспрессионные векторы включают, например, векторы на основе вируса SV40, векторы на основе вируса Эпштейна-Барра и векторы на основе BPV (папилломавируса), но не ограничиваются ими.
Клетки-хозяев котрансформируют вектором для экспрессии антитела, сконструированным с использованием описанных выше способов. Такие клетки-хозяева включают описанные выше клетки, такие как клетки CHO (яичника китайского хомячка), а также микроорганизмы, такие как E. coli, дрожжи и Bacillus subtilis, и клетки растений и животных (Nature Biotechnology (2007) 25, 563-565; Nature Biotechnology (1998) 16, 773-777; Biochemical and Biophysical Research Communications (1999) 255, 444-450; Nature Biotechnology (2005) 23, 1159-1169; Journal of Virology (2001) 75, 2803-2809; Biochemical and Biophysical Research Communications (2003) 308, 94-100). Предпочтительно трансформацию можно успешно выполнить, используя электропорацию, способ с использованием липофектина (R.W. Malone et al., Proc. Natl. Acad. Sci. USA (1989) 86, 6077; P.L. Felgner et al., Proc. Natl. Acad. Sci. USA (1987) 84, 7413), способ с использованием фосфата кальция (F. L. Graham & A.J. van der Eb, Virology (1973) 52, 456-467), способ с использованием DEAE-декстрана и подобных способов.
На следующей стадии продукции антител собирают продукты экспрессии, полученные на стадии (a). Продукты экспрессии можно собрать, например, путем культивирования трансформантов и затем выделения продуктов из трансформированных клеток или сред для культивирования клеток. Выделение и очистку антител можно успешно выполнить с использованием соответствующей комбинации способов, таких как центрифугирование, фракционирование с использованием сульфата аммония, высаливание, ультрафильтрация, хроматографии на колонках с 1q, FcRn, белком A и белком G, аффинная хроматография, ионообменная хроматография и гель-фильтрация.
<Способы повышения устойчивости константной области IgG2 в кислотных условиях>
Настоящее изобретение также относится к способам повышения устойчивости антител в кислотных условиях, которые включают стадию замещения Met в положении 276 (положении 397 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 (IgG2) другой аминокислотой. Способы повышения устойчивости антител в кислотных условиях настоящего изобретения могут включать другие стадии замещения аминокислот при условии, что они включают стадию замещения Met в положении 276 (положении 397 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 (IgG2) другой аминокислотой. Тип аминокислоты после замены особенно не ограничен; однако предпочтительной является замена на Val. Способ замещения аминокислот особенно не ограничен. Замещение можно успешно выполнить, например, с использованием сайт-направленного мутагенеза, описанного выше, или способа, описанного в примерах.
<Способы снижения гетерогенности, возникающей из шарнирной области константной области IgG2>
Настоящее изобретение также относится к способам снижения гетерогенности антител, которые включают стадию замещения Cys в положении 14 (положении 131 в Европейской системе нумерации), Arg в положении 16 (position 133 в Европейской системе нумерации) и/или Cys в положении 102 (положении 219 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 (IgG2) другими аминокислотами. Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены Cys в положении 14 на Ser, Arg в положении 16 на Lys и Cys в положении 102 на Ser. Способы снижения гетерогенности антител настоящего изобретения могут включать другие стадия замещения аминокислот при условии, что они включают стадию замещения Cys в положении 14 (положении 131 в Европейской системе нумерации), Arg в положении 16 (положении 133 в Европейской системе нумерации) и/или Cys в положении 102 (положении 219 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 (IgG2). Способ замещения аминокислот особенно не ограничен. Замещение можно успешно выполнить, например, с использованием сайт-направленного мутагенеза, описанного выше, или способа, описанного в примерах. При замещении аминокислот могут быть заменены все три аминокислоты, приведенные выше, или могут быть заменены одна или две (например, в положениях 14 и 102) из них.
<Способы снижения гетерогенности, возникающего в результате делетирования C-концевых аминокислот в константной области IgG2>
Настоящее изобретение также относится к способам снижения гетерогенности антител, которые включают стадию делетирования Gly в положении 325 (положении 446 в Европейской системе нумерации) и Lys в положении 326 (положении 447 в Европейской системе нумерации) в константной области IgG2, включающей аминокислотную последовательность SEQ ID NO: 2. Способы снижения гетерогенности антител настоящего изобретения могут включать другие стадия замещения аминокислот при условии, что они включают стадию делетирования Gly в положении 325 (положении 446 в Европейской системе нумерации) и Lys в положении 326 (положении 447 в Европейской системе нумерации) в константной области IgG2, включающей аминокислотную последовательность SEQ ID NO: 2. Способ замещения аминокислот особенно не ограничен. Замещение можно успешно выполнить, например, с использованием сайт-направленного мутагенеза, описанного выше, или способа, описанного в примерах.
<Способы улучшения фармакокинетики с помощью замещения аминокислот константной области IgG2>
Настоящее изобретение также относится к способам улучшения фармакокинетики антитела, которые включают стадию замещения His в положении 14 (EU268), Arg в положении 234 (EU355) и/или Gln в положении 298 (EU419) в константной области IgG2, включающей аминокислотную последовательность SEQ ID NO: 2. Способы улучшения фармакокинетики антитела настоящего изобретения могут включать другие стадия замещения аминокислот при условии, что они включают описанную выше стадию. Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены His в положении 147 (EU268) на Gln, Arg в положении 234 (EU355) на Gln и Gln в положении 298 (EU419) на Glu.
Настоящее изобретение также относится к способам улучшения фармакокинетики антитела, которые включают стадию замещения Asn в положении 313 (EU434) в константной области IgG2, включающей аминокислотную последовательность SEQ ID NO: 2 или 35 (M58). Тип аминокислоты после замены особенно не ограничен; однако предпочтительной является замена на Ala. Способы улучшения фармакокинетики антитела настоящего изобретения могут включать другие стадия замещения аминокислот при условии, что они включают описанную выше стадию.
<Способы улучшения фармакокинетики с помощью замещения аминокислот константной области IgG1>
Настоящее изобретение также относится к способам улучшения фармакокинетики антитела, которые включают стадию замещения Asn в положении 317 (EU434) в константной области IgG1, включающей аминокислотную последовательность SEQ ID NO: 1. Тип аминокислоты после замены особенно не ограничен; однако предпочтительной является замена на Ala. Способы улучшения фармакокинетики антитела настоящего изобретения могут включать другие стадия замещения аминокислот при условии, что они включают описанную выше стадию.
Настоящее изобретение также относится к способам улучшения фармакокинетики антитела и снижения гетерогенности, возникающего в результате делетирования C-концевых аминокислот, которые включают стадию замещения Asn в положении 317 (EU434) и делетирования Gly в положении 329 (EU446) и Lys в положении 330 (EU447) в константной области IgG1, включающей аминокислотную последовательность SEQ ID NO: 1. Тип аминокислоты после замены особенно не ограничен; однако предпочтительной является замена на Ala. Способы улучшения фармакокинетики антитела настоящего изобретения могут включать другие стадия замещения аминокислот при условии, что они включают описанную выше стадию.
<Способы ослабления связывания с FcγR при сохранении последовательности человека в константной области IgG2>
Настоящее изобретение также относится к способам ослабления связывания антитела с FcγR, которые включают стадию замещения Ala в положении 209 (EU330) на Ser, Pro в положения 210 (EU331) на Ser и Thr в положении 218 (EU339) на Ala в константной области IgG2, включающей аминокислотную последовательность SEQ ID NO: 2. Способы ослабления связывания антитела с FcγR настоящего изобретения могут включать другие стадии замещения аминокислот при условии, что они включают стадию замещения Ala в положении 209 (EU330) на Ser, Pro в положения 210 (EU331) на Ser и Thr в положении 218 (EU339) на Ala в константной области IgG2, включающей аминокислотную последовательность SEQ ID NO: 2. Способ замещения аминокислот особенно не ограничен. Замещение можно успешно выполнить, например, с использованием сайт-направленного мутагенеза, описанного выше, или способа, описанного в примерах.
Настоящее изобретение также относится к способам снижения гетерогенности, возникающей из шарнирной области IgG2, способам повышения устойчивости антитела в кислотных условиях, способам снижения гетерогенности антител, возникающей из С-конца, и/или способам ослабления связывания антитела с FcγR, все из которых включают, в константной области IgG2, включающей аминокислотную последовательность SEQ ID NO: 2 (M14ΔGK), стадии:
(a) замещения Ala в положении 209 (положении 330 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(b) замещения Pro в положении 210 (положении 331 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(c) замещения Thr в положении 218 (положении 339 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(d) замещения Met в положении 276 (положении 397 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(e) замещения Cys в положении 14 (положении 131 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(f) замещения Arg в положении 16 (положении 133 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(g) замещения Cys в положении 102 (положении 219 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(h) замещения Glu в положении 20 (положении 137 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(i) замещения Ser в положении 21 (положении 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой; и
(j) делетирования Gly в положении 325 и Lys в положении 326 (положениях 446 и 447 в Европейской системе нумерации соответственно) из аминокислотной последовательности SEQ ID NO: 2.
Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены Ala в положении 209 (положении 330 в Европейской системе нумерации) на Ser, Pro в положении 210 (положении 331 в Европейской системе нумерации) на Ser, Thr в положении 218 (положении 339 в Европейской системе нумерации) на Ala, Met в положении 276 (положении 397 в Европейской системе нумерации) на Val, Cys в положении 14 (положении 131 в Европейской системе нумерации) на Ser, Arg в положении 16 (положении 133 в Европейской системе нумерации) на Lys, Cys в положении 102 (положении 219 в Европейской системе нумерации) на Ser, Glu в положении 20 (положении 137 в Европейской системе нумерации) на Gly и Ser в положении 21 (положении 138 в Европейской системе нумерации) на Gly.
Настоящее изобретение также относится к способам снижения гетерогенности, возникающей из шарнирной области IgG2, способам снижения гетерогенности, возникающей из С-конца, и/или способам ослабления связывания антитела с FcγR, все из которых включают, в константной области IgG2, включающей аминокислотную последовательность SEQ ID NO: 2 (M86ΔGK), стадии:
(a) замещения Ala в положении 209 (положении 330 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(b) замещения Pro в положении 210 (положении 331 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(c) замещения Thr в положении 218 (положении 339 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(d) замещения Cys в положении 14 (положении 131 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(e) замещения Arg в положении 16 (положении 133 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(f) замещения Cys в положении 102 (положении 219 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(g) замещения Glu в положении 20 (положении 137 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(h) замещения Ser в положении 21 (положении 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой; и
(i) делетирования Gly в положении 325 и Lys в положении 326 (положениях 446 и 447 в Европейской системе нумерации соответственно) из аминокислотной последовательности SEQ ID NO: 2.
Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены Ala в положении 209 (положении 330 в Европейской системе нумерации) на Ser, Pro в положении 210 (положении 331 в Европейской системе нумерации) на Ser, Thr в положении 218 (положении 339 в Европейской системе нумерации) на Ala, Cys в положении 14 (положении 131 в Европейской системе нумерации) на Ser, Arg в положении 16 (положении 133 в Европейской системе нумерации) на Lys, Cys в положении 102 (положении 219 в Европейской системе нумерации) на Ser, Glu в положении 20 (положении 137 в Европейской системе нумерации) на Gly и Ser в положении 21 (положении 138 в Европейской системе нумерации) на Gly.
Способы настоящего изобретения могут включать другие стадии, такие как замещение и делетирование аминокислот, при условии, что они включают описанные выше стадии. Способы замещения и делетирования аминокислот особенно не ограничены. Замещение и делетирование можно успешно выполнить, например, с использованием сайт-направленного мутагенеза, описанного выше, или способа, описанного в примерах.
Настоящее изобретение также относится к способам снижения гетерогенности, возникающей из шарнирной области IgG2, способам повышения устойчивости антитела в кислотных условиях и/или способам снижения гетерогенности, возникающей из С-конца, все из которых включают, в константной области IgG2, включающей аминокислотную последовательность SEQ ID NO: 2 (M31ΔGK), стадии:
(a) замещения Met в положении 276 (положении 397 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(b) замещения Cys в положении 14 (положении 131 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(c) замещения Arg в положении 16 (положении 133 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(d) замещения Cys в положении 102 (положении 219 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(e) замещения Glu в положении 20 (положении 137 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(f) замещения Ser в положении 21 (положении 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой; и
(g) делетирования Gly в положении 325 и Lys в положении 326 (положениях 446 and 447 в Европейской системе нумерации соответственно) из аминокислотной последовательности SEQ ID NO: 2.
Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены Met в положении 276 (положении 397 в Европейской системе нумерации) на Val, Cys в положении 14 (положении 131 в Европейской системе нумерации) на Ser, Arg в положении 16 (положении 133 в Европейской системе нумерации) на Lys, Cys в положении 102 (положении 219 в Европейской системе нумерации) на Ser, Glu в положении 20 (положении 137 в Европейской системе нумерации) на Gly и Ser в положении 21 (положении 138 в Европейской системе нумерации) на Gly.
Кроме того, настоящее изобретение относится к способам снижения гетерогенности, возникающей из шарнирной области IgG2, и/или способам снижения гетерогенности антитела, возникающей из С-конца, все из которых включают, в константной области IgG2, включающей аминокислотную последовательность SEQ ID NO: 2 (M40ΔGK), стадии:
(a) замещения Cys в положении 14 (положении 131 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(b) замещения Arg в положении 16 (положении 133 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(c) замещения Cys в положении 102 (положении 219 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(d) замещения Glu в положении 20 (положении 137 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой;
(e) замещения Ser в положении 21 (положении 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 другой аминокислотой; и
(f) делетирования Gly в положении 325 и Lys в положении 326 (положениях 446 и 447 в Европейской системе нумерации соответственно) из аминокислотной последовательности SEQ ID NO: 2.
Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены Cys в положении 14 (положении 131 в Европейской системе нумерации) на Ser, Arg в положении 16 (положении 133 в Европейской системе нумерации) на Lys, Cys в положении 102 (положении 219 в Европейской системе нумерации) на Ser, Glu в положении 20 (положении 137 в Европейской системе нумерации) на Gly и Ser в положении 21 (положении 138 в Европейской системе нумерации) на Gly.
Настоящее изобретение также относится к способам снижения гетерогенности антител, возникающей из шарнирной области IgG2, способам улучшения фармакокинетики и/или способам снижения гетерогенности антител, возникающей из С-конца, все из которых включают, в константной области IgG2, включающей аминокислотную последовательность SEQ ID NO: 2 (M58), стадии:
(a) замещения Cys в положении 14 (положении 131 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Ser;
(b) замещения Arg в положении 16 (положении 133 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Lys;
(c) замещения Cys в положении 102 (положении 219 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Ser;
(d) замещения Glu в положении 20 (положении 137 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Gly;
(e) замещения Ser в положении 21 (положении 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Gly;
(f) замещения His в положении 147 (положении 268 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Gln;
(g) замещения Arg в положении 234 (положении 355 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Gln;
(h) замещения Gln в положении 298 (положении 419 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Glu; и
(i) делетирования Gly в положении 325 и Lys в положении 326 (положениях 446 и 447 в Европейской системе нумерации соответственно) из аминокислотной последовательности SEQ ID NO: 2.
Настоящее изобретение также относится к способам снижения гетерогенности антител, возникающей из шарнирной области IgG2, способам улучшения фармакокинетики и/или способам снижения гетерогенности антител, возникающей из С-конца, все из которых включают, в константной области IgG2, включающей аминокислотную последовательность SEQ ID NO: 2 (M73), стадии:
(a) замещения Cys в положении 14 (положении 131 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Ser;
(b) замещения Arg в положении 16 (положении 133 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Lys;
(c) замещения Cys в положении 102 (положении 219 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Ser;
(d) замещения Glu в положении 20 (положении 137 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Gly;
(e) замещения Ser в положении 21 (положении 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Gly;
(f) замещения His в положении 147 (положении 268 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Gln;
(g) замещения Arg в положении 234 (положении 355 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Gln;
(h) замещения Gln в положении 298 (положении 419 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Glu;
(i) замещения Asn в положении 313 (положении 434 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 2 на Ala; и
(j) делетирование Gly в положении 325 и Lys в положении 326 (положениях 446 and 447 в Европейской системе нумерации соответственно) из аминокислотной последовательности SEQ ID NO: 2.
Способы настоящего изобретения могут включать другие стадии, такие как замещение и делетирование аминокислот, при условии, что они включают описанные выше стадии. Способы замещения и делетирования аминокислот особенно не ограничены. Замещение и делетирование можно успешно выполнить, например, с использованием сайт-направленного мутагенеза, описанного выше, или способа, описанного в примерах.
<Способы повышения устойчивости константной области IgG4 в кислотных условиях>
Настоящее изобретение также относится к способам повышения устойчивости антител в кислотных условиях, которые включают стадию замещения Arg в положении 289 (положении 409 в Европейской системе нумерации) константной области IgG4, включающей аминокислотную последовательность SEQ ID NO: 3, другой аминокислотой. Способы повышения устойчивости антител в кислотных условиях настоящего изобретения могут включать другие стадии замещения аминокислот при условии, что они включают стадию замещения Arg в положении 289 (положении 409 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 (константной области IgG4 человека) другой аминокислотой. Тип аминокислоты после замены особенно не ограничен, однако предпочтительной является замена на Lys. Способ замещения аминокислот особенно не ограничен. Замещение можно успешно выполнить, например, с использованием сайт-направленного мутагенеза, описанного выше, или способа, описанного в примерах.
Способы снижения гетерогенности, возникающего в результате делетирования C-концевых аминокислот в константной области IgG4
Настоящее изобретение также относится к способам снижения гетерогенности антитела, которые включают стадию делетирования Gly в положении 326 (положении 446 в Европейской системе нумерации) и Lys в положении 327 (положении 447 в Европейской системе нумерации) в константной области IgG4, включающей аминокислотную последовательность SEQ ID NO: 3 (Mol. Immunol. 1993 Jan; 30(1): 105-8). Способы снижения гетерогенности настоящего изобретения могут включать другие стадии замещения аминокислот при условии, что они включают стадию делетирования Lys в положении 327 (положении 447 в Европейской системе нумерации) и/или Gly в положении 326 (положении 446 в Европейской системе нумерации) в константной области IgG4, включающей аминокислотную последовательность SEQ ID NO: 3. Способ замещения аминокислот особенно не ограничен. Замещение можно успешно выполнить, например, с использованием сайт-направленного мутагенеза, описанного выше, или способа, описанного в примерах.
Настоящее изобретение также относится к способам повышения устойчивости в кислотных условиях, способам снижения гетерогенности, возникающей из С-конца, и/или способам ослабления связывания антитела с FcγR, все из которых включают, в константной области IgG4, включающей аминокислотную последовательность SEQ ID NO: 3 (M11ΔGK), стадии:
(a) замещения Cys в положении 14 (положении 131 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 другой аминокислотой;
(b) замещения Arg в положении 16 (положении 133 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 другой аминокислотой;
(c) замещения Glu в положении 20 (положении 137 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 другой аминокислотой;
(d) замещения Ser в положении 21 (положении 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 другой аминокислотой;
(e) замещения Arg в положении 97 (положении 214 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 другой аминокислотой;
(f) замещения Ser в положении 100 (положении 217 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 другой аминокислотой;
(g) замещения Tyr в положении 102 (положении 219 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 другой аминокислотой;
(h) замещения Gly в положении 103 (положении 220 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 другой аминокислотой;
(i) замещения Pro в положении 104 (положении 221 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 другой аминокислотой;
(j) замещения Pro в положении 105 (положении 222 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 другой аминокислотой;
(k) замещения Glu в положении 113 (положении 233 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 другой аминокислотой;
(l) замещения Phe в положении 114 (положении 234 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 другой аминокислотой;
(m) замещения Leu в положении 115 (положении 235 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 другой аминокислотой;
(n) делетирования Gly в положении 116 (положении 236 в Европейской системе нумерации) из аминокислотной последовательности SEQ ID NO: 3;
(o) замещения Arg в положении 289 (положении 409 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO: 3 другой аминокислотой; и
(p) делетирования Gly в положении 236 и Lys в положении 237 (положениях 446 и 447 в Европейской системе нумерации соответственно) из аминокислотной последовательности SEQ ID NO: 3.
Тип аминокислоты после замены особенно не ограничен; однако предпочтительными являются замены Cys в положении 14 (положении 131 в Европейской системе нумерации) на Ser, Arg в положении 16 (положении 133 в Европейской системе нумерации) на Lys, Glu в положении 20 (положении 137 в Европейской системе нумерации) на Gly, Ser в положении 21 (положении 138 в Европейской системе нумерации) на Gly, Arg в положении 97 (положении 214 в Европейской системе нумерации) на Thr, Ser в положении 100 (положении 217 в Европейской системе нумерации) на Arg, Tyr в положении 102 (положении 219 в Европейской системе нумерации) на Ser, Gly в положении 103 (положении 220 в Европейской системе нумерации) на Cys, Pro в положении 104 (положении 221 в Европейской системе нумерации) на Val, Pro в положении 105 (положении 222 в Европейской системе нумерации) на Glu, Glu в положении 113 (положении 233 в Европейской системе нумерации) на Pro, Phe в положении 114 (положении 234 в Европейской системе нумерации) на Val, Leu в положении 115 (положении 235 в Европейской системе нумерации) на Ala и Arg в положении 289 (положении 409 в Европейской системе нумерации) на Lys.
Способы настоящего изобретения могут включать другие стадии, такие как замещение и делетирование аминокислот, при условии, что они включают описанные выше стадии. Способы замещения и делетирования аминокислот особенно не ограничены. Замещение и делетирование можно успешно выполнить, например, с использованием сайт-направленного мутагенеза, описанного выше, или способа, описанного в примерах.
<Способы снижения гетерогенности, возникающего в результате делетирования C-концевых аминокислот в константной области IgG1>
Настоящее изобретение также относится к способам снижения гетерогенности антител, которые включают стадию делетирования Gly в положении 329 (положении 446 в Европейской системе нумерации) и Lys в положении 330 (положении 447 в Европейской системе нумерации) в константной области IgG1, включающей аминокислотную последовательность SEQ ID NO: 1. Способы снижения гетерогенности антитела настоящего изобретения могут включать другие стадии замещений аминокислот при условии, что они включают стадию делетирования Lys в положении 330 (положении 447 в Европейской системе нумерации) и Gly в положении 329 (положении 446 в Европейской системе нумерации) в константной области IgG1, включающей аминокислотную последовательность SEQ ID NO: 1. Способ замещения аминокислот особенно не ограничен. Замещение можно успешно выполнить, например, с использованием сайт-направленного мутагенеза, описанного выше, или способа, описанного в примерах.
Описанные выше константные области антител особенно не ограничены и могут использоваться для любых антител. Примеры антител, в которых используется константная область настоящего изобретения, включают:
(a) тяжелую цепь, которая включает аминокислотную последовательность SEQ ID NO: 48 (VH4-M73);
(b) тяжелую цепь, которая включает аминокислотную последовательность SEQ ID NO: 46 (VH3-M73);
(c) тяжелую цепь, которая включает аминокислотную последовательность SEQ ID NO: 44 (VH5-M83);
(d) легкую цепь, которая включает аминокислотную последовательность SEQ ID NO: 49 (VL1-каппа);
(e) легкую цепь, которая включает аминокислотную последовательность SEQ ID NO: 47 (VL3-каппа);
(f) легкую цепь, которая включает аминокислотную последовательность SEQ ID NO: 45 (VL5-каппа);
(g) антитело, которое включает тяжелую цепь (a) и легкую цепь (d) (FV3-M73);
(h) антитело, которое включает тяжелую цепь (b) и легкую цепь (e) (FV4-M73); and
(i) антитело, которое включает тяжелую цепь (c) и легкую цепь (f) (FV5-M83).
<Фармацевтические композиции, включающие антитела>
Настоящим изобретением предоставляются фармацевтические композиции, включающие антитело настоящего изобретения.
Фармацевтические композиции настоящего изобретения могут быть составлены, помимо антител, с фармацевтически приемлемыми носителями с помощью известных способов. Например, композиции можно использовать парентерально, когда антитела составлены в стерильный раствор или суспензию для инъекции, используя воду или любую другую фармацевтически приемлемую жидкость. Например, композиции могут быть составлены путем объединения соответствующим образом антител с фармацевтически приемлемыми носителями или средами, в частности стерильной водой или физиологическим солевым раствором, растительными маслами, эмульгаторами, суспендирующими агентами, поверхностно-активными веществами, стабилизаторами, корригентами, наполнителями, носителями, консервантами, связующими веществами и подобными, путем смешивания их в стандартную дозу и форму, требуемую для общепринятых фармацевтических разработок. Содержание активного ингредиента в такой композиции регулируют, так чтобы можно было получить соответствующую дозу в пределах требуемого диапазона.
Стерильные композиции для инъекции можно составить, используя такие носители, как дистиллированная вода для инъекции, в соответствии со стандартными протоколами.
Используемые для инъекции водные растворы включают, например, физиологический солевой раствор и изотонические растворы, содержащие глюкозу или другие вспомогательные средства, такие как D-сорбит, D-манноза, D-маннит и натрия хлорид. Они могут использоваться в соединении с подходящими солюбилизаторами, такими как спирт, в частности этиловый спирт, полиспирты, такие как пропиленгликоль и полиэтиленгликоль, и неионные поверхностно-активные вещества, такие как Polysorbate 80TM и HCO-50.
Масла включают кунжутное масло и соевое масло и могут быть объединены с солюбилизаторами, такими как бензилбензоат или бензиловый спирт. Их можно также составить в рецептуру с буферами, например фосфатными буферами или натрийацетатными буферами; анальгетиками, например прокаина гидрохлоридом; стабилизаторами, например бензиловым спиртом или фенолом; или антиоксидантами. Приготовленные инъекционные растворы обычно распределяют по аликвотам и в соответствующие ампулы.
Введение предпочтительно выполняют парентерально, и оно, в частности, включает инъекцию, интраназальное введение, внутрилегочное введение и чрескожное введение. Например, инъекционные растворы можно вводить системно или место с помощью внутривенной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции или подкожной инъекции.
Кроме того, способ введения можно соответствующим образом выбрать в соответствии с возрастом и симптомами пациента. Однократную дозу фармацевтической композиции, содержащей антитело или полинуклеотид, кодирующий антитело, можно выбрать, например, из диапазона, составляющего от 0,0001 до 1000 мг на кг веса тела. Альтернативно, доза может находиться, например, в диапазоне, составляющем от 0,001 до 100000 мг/человека. Однако доза не ограничена этими значениями. Доза и способ введения варьируют в зависимости от веса тела, возраста и симптомов пациента и могут быть соответственно выбраны квалифицированными в данной области техники специалистами.
Используемыми здесь трехбуквенными и однобуквенными кодами для соответствующих аминокислот являются следующие коды:
Аланин: Ala (A)
Аргинин: Arg (R)
Аспарагин: Asn (N)
Аспарагиновая кислота: Asp (D)
Цистеин: Cys (C)
Глютамин: Gln (Q)
Глютаминовая кислота: Glu (E)
Глицин: Gly (G)
Гистидин: His (H)
Изолейцин: Ile (I)
Лейцин: Leu (L)
Лизин: Lys (K)
Метионин: Met (M)
Фенилаланин: Phe (F)
Пролин: Pro (P)
Серин: Ser (S)
Треонин: Thr (T)
Триптофан: Trp (W)
Тирозин: Tyr (Y)
Валин: Val (V)
Все документы предшествующего уровня техники, приведенные здесь, включены в целом посредством ссылки.
Примеры
Ниже настоящее изобретение дополнительно конкретно описывается со ссылкой на примеры, но не следует истолковывать, что оно ограничивается ими.
[Пример 1] Повышение устойчивости IgG2 и IgG4 в кислотном условии
Конструирование векторов для экспрессии преобразованных в IgG2 или IgG4 гуманизированных антител против рецептора IL-6 и экспрессия антител
Для ослабления активности связывания с рецептором Fcγ константную область гуманизированного антитела против рецептора IL-6 человека, гуманизированного антитела PM-1 (Cancer Res. 1993 Feb 15;53(4): 851-6), которое является антителом изотипа IgG1, замещали константной областью IgG2 или IgG4 (Mol. Immunol. 1993 Jan; 30(1): 105-8) для создания молекул WT-IgG2 (SEQ ID NO: 13) и WT-IgG4 (SEQ ID NO: 14). Для экспрессии IgG использовали вектор для экспрессии в клетках животных. Осуществляли конструирование экспрессионного вектора, при котором константную область гуманизированного антитела PM-1 (IgG1), использованного в ссылочном примере 1, расщепляли NheI/NotI и затем замещали константной областью IgG2 или IgG4 при лигировании. Нуклеотидную последовательность каждого фрагмента ДНК определяли с использованием ДНК-секвенатора (ABI PRISM 3730xL DNA Sequencer или ABI PRISM 3700 DNA Sequencer (Applied Biosystems)), используя набор BigDye Terminator Cycle Sequencing Kit (Applied Biosystems) в соответствии с прилагаемым руководством. Используя L-цепь дикого типа (SEQ ID NO: 15), экспрессировали WT-IgG1, WT-IgG2 и WT-IgG4 с помощью описанного ниже способа. Клетки HEK293H, происходящие из рака первичной почки человека, (Invitrogen) суспендировали в среде DMEM (Invitrogen), дополненной 10% фетальной бычьей сыворотки (Invitrogen). Клетки (10 мл/чашку; при клеточной плотности, составляющей 5 - 6 x 105 клеток/мл) засевали в чашки для адгезивных клеток (с диаметром 10 см; CORNING) и культивировали в термостате с CO2 (37οC, 5% CO2) в течение одного целого дня и ночи. Затем среду удаляли аспирацией и добавляли 6,9 мл среды CHO-S-SFM-II (Invitrogen). Приготовленную смесь плазмидных ДНК (всего 13,8 мг) объединяли с 20,7 мкл 1 мкг/мл полиэтиленимина (Polysciences Inc.) и 690 мкл среды CHO-S-SFMII. Получаемую в результате смесь инкубировали при комнатной температуре в течение 10 минут и затем добавляли к клеткам в каждой чашке. Клетки инкубировали в термостате с CO2 (при 37°C в 5% CO2) в течение 4-5 часов. Затем в чашки добавляли 6,9 мл среды CHO-S-SFM-II (Invitrogen) и клетки инкубировали в термостате с CO2 в течение трех дней. Супернатанты культур собирали и центрифугировали (при приблизительно 2000 g, в течение 5 мин, при комнатной температуре) для удаления клеток и стерилизовали пропусканием через 0,22-мкм фильтр MILLEX(R)-GV (Millipore). Образцы хранили при 4°C до использования.
(1) Гуманизированное антитело PM-1 (VH PM-1 + Н-цепь IgG1), SEQ ID NO: 12 (аминокислотная последовательность)
(2) VH гуманизированного PM-1 + H-цепь IgG2, SEQ ID NO: 13 (аминокислотная последовательность)
(3) VH гуманизированного PM-1 + H-цепь IgG4, SEQ ID NO: 14 (аминокислотная последовательность)
Очистка WT-IgG1, WT-IgG2 и WT-IgG4 благодаря элюции с белка A, используя соляную кислоту
50 мкл сефарозы SepharoseTM Fast Flow (Amersham Biosciences) с рекомбинатным белком А, суспендированной в TBS, добавляли к полученным супернатантам культур и объединенные растворы смешивали при перевертывании при 4°C в течение четырех часов или более. Растворы переносили в чашки 0,22-мкм фильтра Ultrafree(R)-MC (Millipore). После трех промывок 500 мкл TBS смолы SepharoseTM с рекомбинантным белком А суспендировали в 100 мкл 10 мМ HCl/150 мМ NaCl (pH 2,0), и смеси инкубировали в течение двух минут для элюции антител (элюции соляной кислотой). Элюаты немедленно нейтрализовали добавлением 6,7 мкл 1,5M Tris-HCl (pH 7,8). Элюцию проводили дважды, получая 200 мкл очищенных антител.
Анализ гель-фильтрацией WT-IgG1, WT-IgG2 и WT-IgG4, очищенных с помощью элюции соляной кислотой
Проценты агрегата в очищенных образцах, полученных при элюции соляной кислотой, определяли с помощью анализа гель-фильтрацией.
Способ оценки агрегирования:
Система: Waters Alliance
Колонка: G3000SWxl (TOSOH)
Подвижная фаза: 50 мМ натрия фосфат, 300 мМ KCl, pH 7,0
Скорость потока, длина волны: 0,5 мл/мин, 220 нм
Результат показан на фиг.1. В то время как процент агрегата в WT-IgG1 после очистки составлял приблизительно 2, проценты агрегата в WT-IgG2 и WT-IgG4 после очистки составляли приблизительно 25. Это говорит о том, что IgG1 является кислотоустойчивым во время элюции соляной кислотой, и в отличие от него IgG2 и IgG4 являются неустойчивыми и подвергаются денатурации/агрегированию. Следовательно, было установлено, что устойчивость IgG2 и IgG4 в кислотных условиях ниже устойчивости IgG1. Белок A часто использовался для очистки молекул IgG, и молекулы IgG элюируются с белка A в кислотных условиях. Кроме того, инактивацию вируса, которая необходима при разработке молекул IgG в качестве лекарственных средств, обычно проводят в кислотных условиях. Поэтому желательно, чтобы устойчивость молекул IgG в кислотных условиях была выше. Однако установлено, что устойчивость молекул IgG2 и IgG4 в кислотных условиях ниже устойчивости IgG1, и впервые предполагается, что существует проблема денатурации/агрегирования в кислотных условиях при разработке молекул IgG2 и IgG4 в качестве лекарственных средств. Желательно, чтобы проблема денатурации/агрегирования была преодолена при разработке их в качестве лекарственных средств. Однако на сегодняшний день не опубликовано сообщение о способе разрешения этой проблемы через замещение аминокислот.
Приготовление и оценка WT-IgG2 и WT-IgG4, имеющих измененный CH3-домен
Было установлено, что устойчивость молекул IgG2 и IgG4 в кислотных условиях ниже устойчивости IgG1. Поэтому были проверены измененные для повышения устойчивости в кислотных условиях формы молекул IgG2 и IgG4. Согласно моделям константных областей молекул IgG2 и IgG4 полагали, что одним из возможных дестабилизирующих факторов в кислотных условиях является нестабильность в месте сопряжения доменов CH3-CH3. Полагали, что метионин в положении 397 в Европейской системе нумерации в IgG2 или аргинин в положении 409 в Европейской системе нумерации в IgG4 дестабилизирует сопряжение CH3/CH3. Поскольку положения 397 и 409 в Европейской системе нумерации в IgG1 занимают валин и лизин соответственно, приготовлены измененное антитело IgG2, которое включает замену на валин метионина в положении 397 в Европейской системе нумерации (IgG2-M397V, SEQ ID NO: 16 (аминокислотная последовательность)), и измененное антитело IgG4, которое включает замену на лизин аргинина в положении 409 в Европейской системе нумерации (IgG4-R409K, SEQ ID NO: 17 (аминокислотная последовательность)).
Способы, использованные для конструирования векторов для экспрессии представляющих интерес антител и экспрессии и очистки антител, были одинаковыми со способами, использованными для описанной выше элюции соляной кислотой. Анализ гель-фильтрацией проводили для определения процентов агрегата в очищенных образцах, полученных при элюции соляной кислотой с белка A.
Способ оценки агрегирования:
Система: Waters Alliance
Колонка: G3000SWxl (TOSOH)
Подвижная фаза: 50 мМ натрия фосфат, 300 мМ KCl, pH 7,0
Скорость потока, длина волны: 0,5 мл/мин, 220 нм
Результат показан на фиг 1. В то время как процент агрегата в WT-IgG1 после очистки составлял приблизительно 2, проценты агрегата в WT-IgG2 и WT-IgG4 после очистки составляли приблизительно 25. Напротив, проценты агрегата в вариантах с измененным CH3-доменом, IgG2-M397V и IgG4-R409K, были соизмеримыми (приблизительно 2%) с процентом в IgG1. Этот факт свидетельствует о том, что устойчивость антитела изотипа IgG2 или IgG4 в кислотных условиях можно повысить с помощью замены на валин метионина IgG2 в положении 397 в Европейской системе нумерации или замены на лизин аргинина IgG4 в положении 409 в Европейской системе нумерации соответственно. Очищенные антитела подвергали диализу против раствора, содержащего 20 мМ натрия ацетат, 150 мМ NaCl, pH 6,0 (EasySEP, TOMY). Дифференциальную сканирующую калориметрию (определения температуры точки тепловой денатурации и значения Tm) проводили при скорости нагревания 1°C/мин с 40 до 100°C при концентрации белка, составляющей приблизительно 0,1 мг/мл. Кроме того, определяли температуры точки тепловой денатурации WT-IgG2, WT-IgG4, IgG2-M397V и IgG4-R409K. Результаты показали, что значение Tm для измененного CH3-домена выше в случае IgG2-M397V и IgG4-R409K, чем в случае WT-IgG2 и WT-IgG4 дикого типа соответственно. Это говорит о том, что IgG2-M397V и IgG4-R409K также лучше по показателю термоустойчивости, чем WT-IgG2 и WT-IgG4 соответственно.
IgG2 и IgG4 подвергаются воздействию кислотных условий в процессе инактивации вируса и в процессе очистки с использованием белка A. Поэтому была проблематичной денатурация/агрегирование в указанных выше процессах. Однако было обнаружено, что проблему можно решить, используя IgG2-M397V и IgG4-R409K для последовательностей константных областей IgG2 и IgG4. Таким образом, выявлено, что эти изменения очень полезны при разработке лекарственных средств - антител изотипа IgG2 и IgG4. Кроме того, о полезности IgG2-M397V и IgG4-R409K также свидетельствовал тот факт, что они лучше по термоустойчивости.
[Пример 2] Снижение гетерогенности, происходящей в результате дисульфидных связей в IgG2
Очистка WT-IgG1, WT-IgG2 и WT-IgG4 благодаря элюции уксусной кислотой с белка A
50 мкл сефарозы SepharoseTM Fast Flow (Amersham Biosciences) с рекомбинатным белком А, суспендированной в TBS, добавляли к полученным в примере 1 супернатантам культур, и объединенные растворы смешивали при перевертывании при 4°C в течение четырех часов или более. Растворы переносили в чашки 0,22-мкм фильтра Ultrafree(R)-MC (Millipore). После трех промывок 500 мкл TBS смолы SepharoseTM с рекомбинантным белком А суспендировали в 100 мкл водного раствора, содержащего 50 мМ натрия ацетат (pH 3,3), и смеси инкубировали в течение двух минут для элюции антител. Элюаты немедленно нейтрализовали добавлением 6,7 мкл 1,5M Tris-HCl (pH 7,8). Элюцию проводили дважды, получая 200 мкл очищенных антител.
Анализ WT-IgG1, WT-IgG2 и WT-IgG4 с помощью катионообменной хроматографии (IEC)
Очищенные WT-IgG1, WT-IgG2 и WT-IgG4 анализировали на гомогенность с помощью катионообменной хроматографии.
Способ оценки с использованием IEC:
Система: Waters Alliance
Колонка: ProPac WCX-10 (Dionex)
Подвижная фаза
A: 25 мМ MES-NaOH, pH 6,1
B: 25 мМ MES-NaOH, 250 мМ Na-ацетат, pH 6,1
Скорость потока, длина волны: 0,5 мл/мин, 280 нм
Градиент В: 50%-75% (75 мин) при анализе WT-IgG1
B: 30%-55% (75 мин) при анализе WT-IgG2 и WT-IgG4
Результат показан на фиг.2. При анализе с помощью ионообменной хроматографии WT-IgG2 продемонстрировал более одного пика, в то время как WT-IgG1 и WT-IgG4 продемонстрировали единственный пик. Это говорит о том, что молекула IgG2 более гетерогенна, чем IgG1 и IgG4. Действительно сообщалось, что изотипы IgG2 имеют гетерогенность, происходящую в результате дисульфидных связей в шарнирной области (непатентный документ 10). Поэтому предполагается, что продемонстрированные на фиг.2 гетеропики IgG2 также являются целевым веществом/родственными веществами, происходящими в результате дисульфидных связей. Нелегко произвести их в качестве лекарственного средства в крупном масштабе, пока между производствами сохраняется связанная с целевыми веществами/родственными веществами гетерогенность. Поэтому для молекул антител, разрабатываемых в качестве лекарственных средств, желательны насколько возможно гомогенные (менее гетерогенные) вещества. Для IgG2 дикого типа существует проблема гомогенности, которая важна при разработке антител - лекарственных средств. Действительно, в документе US20060194280 (A1) показано, что в результате дисульфидных связей природный IgG2 дает различные гетеропики при анализе с помощью ионообменной хроматографии, и что среди этих пиков биологическая активность варьирует. В документе US20060194280 (A1) сообщается о рефолдинге в процессе очистки в качестве способа объединения гетеропиков в единственный пик, но применение такого способа при продукции является дорогостоящим и сложным. Поэтому предпочтительный способ объединения гетеропиков в единственный пик основан на замещении аминокислот. Хотя гетерогенность, возникающая в результате дисульфидных связей в шарнирной области, должна быть преодолена для разработки IgG2 в качестве лекарственных средств, на сегодняшний день еще не опубликовано сообщение о способе разрешения этой проблемы через замещение аминокислот.
Приготовление и оценка измененных СН1-домена и шарнирной области WT-IgG2
Как показано на фиг.3, существуют различные возможные наборы дисульфидных связей для молекулы IgG2. Возможными причинами гетерогенности, происходящей из шарнирной области IgG2, являлись дифференциальный набор дисульфидного связывания и свободных цистеинов. IgG2 имеет два цистеина (в положениях 219 и 220 в Европейской системе нумерации) в верхнем шарнирном участке, и цистеины, примыкающие к двум цистеина верхнего шарнирного участка, включают цистеин в положении 131 в Европейской системе нумерации в СН1-домене H-цепи и С-концевой цистеин L-цепи, и два соответствующих цистеина в верхнем шарнирном участке H-цепи партнера по димеризации. Конкретно, всего существует восемь цистеинов около верхнего шарнирного участка IgG2, когда антитело находится в объединенной форме H2L2. Это может быть причиной различных гетерогенных типов вследствие неправильного дисульфидного связывания и свободных цистеинов.
Последовательность шарнирной области и CH1-домен IgG2 изменяли для снижения гетерогенности, возникающей из шарнирной области IgG2. Проверки проводили во избежание гетерогенности IgG2 вследствие дифференциального набора дисульфидного связывания и свободных цистеинов. Результат проверки различных измененных антител наводил на мысль, что гетерогенности можно избежать без снижения термоустойчивости с помощью замещения серином и лизином цистеина и аргинина в положениях 131 и 133 в Европейской системе нумерации соответственно, в СН1-домене H-цепи и замещения серином цистеина в положении 219, в Европейской системе нумерации, в верхнем шарнирном участке H-цепи последовательности константной области IgG2 дикого типа (в дальнейшем IgG2-SKSC) (IgG2-SKSC, SEQ ID NO: 18). Эти замещения могли бы сделать возможным образованием в IgG2-SKSC гомогенной ковалентной связи между H- и L-цепями, которая является дисульфидной связью между C-концевым цистеином L-цепи и цистеином в положении 220 в Европейской системе нумерации (Фиг.4).
Описанные в ссылочном примере 1 способы использовали для конструирования вектора для экспрессии IgG2-SKSC и экспрессии и очистки IgG2-SKSC. Очищенные IgG2-SKSC и IgG2 дикого типа (WT-IgG2) анализировали на гомогенность с помощью катионообменной хроматографии.
Способ оценки с использованием IEC:
Система: Waters Alliance
Колонка: ProPac WCX-10 (Dionex)
Подвижная фаза
A: 25 мМ MES-NaOH, pH 5,6
B: 25 мМ MES-NaOH, 250 мМ Na-ацетат, pH 5,6
Скорость потока, длина волны: 0,5 мл/мин, 280 нм
Градиент В: 50%-100% (75 мин)
Результат показан на фиг.5. Установлено, как и ожидалось выше, что IgG2-SKSC элюируется в единственном пике, в то время как WT-IgG2 дает множество пиков. Это говорит о том, что гетерогенности, происходящей в результате дисульфидных связей в шарнирной области IgG2, можно избежать при использовании таких изменений, как изменения, использованные для создания IgG2-SKSC, которые делают возможным образование единственной дисульфидной связи между C-концевым цистеином L-цепи и цистеином в положении 220 в Европейской системе нумерации. Температуры точки тепловой денатурации WT-IgG1, WT-IgG2 и IgG2-SKSC определяли с помощью таких же способов, как и способы, описанные в примере 1. В результате установлено, что WT-IgG2 дает пик для Fab-домена, которые имеет меньшее значение Tm, чем в случае WT-IgG1, в то время как IgG2-SKSC не дает такого пика. Это говорит о том, что IgG2-SKSC лучше, чем WT-IgG2 также по термоустойчивости.
Хотя полагали, что IgG2 дикого типа имеет проблему, связанную с гомогенностью, которая важна при разработке антител - лекарственных средств, было установлено, что эту проблему можно разрешить с помощью использования IgG2-SKSC для получения последовательности константной области IgG2. Таким образом, IgG2-SKSC очень полезен при разработке лекарственных средств - антител изотипа IgG2. Кроме того, о полезности IgG2-SKSC также свидетельствовал тот факт, что он лучше по термоустойчивости.
[Пример 3] Снижение C-концевой гетерогенности в молекулах IgG
Конструирование вектора для экспрессии антитела с C-концевой ΔGK в Н-цепи из WT-IgG1
Сообщалось (непатентный документ 12) о гетерогенности C-концевых последовательностей антитела, делеции C-концевого аминокислотного остатка лизина и подавлении амидирования C-концевой аминогруппы вследствие делетирования обеих из двух C-концевых аминокислот, глицина и лизина. Отсутствие такой гетерогенности является предпочтительным при разработке антител - лекарственных средств. Действительно, в гуманизированном антителе PM-1 тоцилизумабе основным компонентом является последовательность, в которой отсутствует C-концевая аминокислота лизин, которая кодируется нуклеотидной последовательностью, но без посттрасляционной модификации, и также сосуществует минорный компонент, имеющий лизин, в качестве гетерогенности. Поэтому для снижения C-концевой гетерогенности изменяли С-концевую аминокислотную последовательность. Конкретно, авторы настоящего изобретения изменили нуклеотидную последовательность IgG1 дикого типа с делетированием C-концевых лизина и глицина из константной области H-цепи IgG1, и определили, может ли амидирование C-концевой аминогруппы быть подавлено при делетировании двух C-концевых аминокислот глицина и лизина.
Мутации вводили в C-концевую последовательность H-цепи, используя вектор pB-CH, кодирующий гуманизированное антитело PM-1 (WT), получаемое в ссылочной примере 1. Нуклеотидную последовательность, кодирующую Lys в положении 447 и/или Gly в положении 446 в Европейской системе нумерации, превращали в стоп-кодон путем введения мутации, используя набор для сайт-направленного мутагенеза QuikChange (Stratagene) в соответствии со способом, описанным в прилагаемом руководстве. Таким образом, были сконструированы векторы для экспрессии антитела, разработанного так, что в нем отсутствует C-концевая аминокислота лизин (в положении 447 в Европейской системе нумерации), и антитела, разработанного так, что в нем отсутствуют две C-концевые аминокислоты глицин и лизин (в положениях 446 и 447 в Европейской системе нумерации соответственно). Антитела с C-концевой ΔK и ΔGK в Н-цепи получали экспрессией сконструированных H-цепей и L-цепи гуманизированного антитела PM-1. Антитела экспрессировали и очищали с помощью способа, описанного в ссылочном примере 1.
Очищенное антитело с C-концевой ΔGK в Н-цепи анализировали с помощью катионообменной хроматографии согласно следующей процедуре. Эффект C-концевой делеции на гетерогенность оценивали анализом с помощью катионообменной хроматографии, используя очищенное антитело с C-концевой ΔGK в Н-цепи, в соответствии с описанным ниже способом. Ниже приведены условия анализа с помощью катионообменной хроматографии. Сравнивали хроматограммы для гуманизированного антитела PM-1, антитела с C-концевой ΔK в Н-цепи и антитела с C-концевой ΔGK в Н-цепи.
Колонка: ProPac WCX-10 (Dionex)
Подвижная фаза
A: 25 ммоль/л MES/NaOH, pH 6,1
B: 25 ммоль/л MES/NaOH, 250 ммоль/л NaCl, pH 6,1
Скорость потока: 0,5 мл/мин
Градиент: 25% B (5 мин)→(105 мин)→67% B→(1 мин)→100% B (5 мин)
Детекция: 280 нм
На фиг.6 показан результат анализа не измененного гуманизированного антитела PM-1, антитела с C-концевой ΔK в Н-цепи и антитела с C-концевой ΔGK в Н-цепи. Согласно непатентному документу 10 основной пик с более длительным временем удержания, чем время удержания главного пика содержит С-конец H-цепи с Lys в положении 449 и С-конец H-цепи с амидированным Pro в положении 447. Выраженность основного пика была значительно уменьшена в случае антитела с C-концевой ΔGK в Н-цепи, в то время как в случае антитела с C-концевой ΔK в Н-цепи такого значительного уменьшения не наблюдалось. Это говорит о том, что C-концевую гетерогенность H-цепи можно снизить, только когда из Н-цепи делетированы две C-концевых аминокислоты.
С помощью дифференциальной сканирующей калориметрии определяли температуру точки тепловой денатурации антитела с C-концевой ΔGK в Н-цепи для оценки эффекта делетирования двух остатков на С-конце Н-цепи на термоустойсивость. Для проведения дифференциальной сканирующей калориметрии проводили диализ антитела против 20 мМ ацетатного буфера (pH 6,0), содержащего 150 мМ NaCl, для смены буфера. После полной деаэрации растворы гуманизированного антитела PM-1 и антитела с C-концевой ΔGK в Н-цепи и контрольный раствор (внешний диализат) помещали в калометрические ячейки и полностью термически уравновешивали при 40°C. Затем образцы сканировали при повышении температуры с 40 до 100°C со скоростью, составляющей приблизительно 1K/мин. Были определены результирующие пики денатурации (Rodolfo et al., Immunology Letters, 1999, p. 47-52). В результате установлено, что C-концевая делеция не оказывает эффект на температуру тепловой денатурации CH3-домена.
Таким образом, гетерогенность, возникающую из C-концевой аминокислоты, можно снизить без воздействия на термоустойчивость антитела с помощью делетирования C-концевого лизина и глицина из константной области H-цепи на уровне нуклеотидной последовательности. Поскольку все константные области антител человека изотипа IgG1, IgG2 и IgG4 содержат Gly и Lys в положениях 446 и 447 в Европейской системе нумерации в своих C-концевых последовательностях, предполагают, что способ снижения гетерогенности, возникающей из C-концевых аминокислот, открытый в этом примере и других, также применим к константным областям IgG2 и IgG4.
[Пример 4] Конструирование M14ΔGK с новой оптимизированной последовательностью константной области
Когда антитело - лекарственное средство - направлено на нейтрализацию антигена, такие эффекторные функции, как ADCC Fc-домена, являются ненужными, а следовательно, является ненужным связывание с рецептором Fcγ. Предполагается, что связывание с рецептором Fcγ является вредным ввиду иммуногенности и неблагоприятного эффекта (непатентные документы 5 и 6). Не требуется, чтобы гуманизированное антитело изотипа IgG1 против рецептора IL-6 тоцилизумаб связывалось с рецептором Fcγ, поскольку для его использования в качестве терапевтического средства для заболеваний, ассоциированных с IL-6, таких как ревматоидный артрит, только требуется, чтобы оно специфически связывалось с рецептором IL-6 и нейтрализовало его биологическую активность.
Конструирование и оценка не связывающихся с рецептором Fcγ, оптимизированных константных областей M14ΔGK, M11ΔGK и M17ΔGK
Возможным способом ослабления связывания с рецептором Fcγ является преобразование антитела IgG со сменой изотипа IgG1 на изотип IgG2 или IgG4 (Ann. Hematol. 1998 Jun; 76(6): 231-48). В качестве способа полного исключения связывания с рецептором Fcγ сообщалось о способе внесения искусственного изменения в Fc-домен. Например, поскольку эффекторные функции антитела против CD3 и антитела против CD4 вызывают неблагоприятные эффекты, были введены мутации аминокислот, не присутствующие в последовательности дикого типа, в связывающуюся с рецептором Fcγ область Fc-домена (непатентные документы 3 и 7), и в настоящее время результирующие не связывающиеся с рецептором Fcγ антитела против CD3 и CD4 клинически испытываются (непатентные документы 5 и 8). В соответствии с другим сообщением (патентным документом 3) не связывающиеся с рецептором Fcγ антитела можно приготовить с помощью превращения связывающегося с FcγR домена IgG1 (в положениях 233, 234, 235, 236, 327, 330 и 331 в Европейской системе нумерации) в последовательность IgG2 (в положениях 233, 234, 235 и 236 в Европейской системе нумерации) или IgG4 (в положениях 327, 330 и 331 в Европейской системе нумерации). Однако если все указанные выше мутации будут введены в IgG1, будут созданы новые пептидные последовательности из девяти аминокислот, которые потенциально служат в качестве неприродных пептидных Т-клеточных эпитопов, и это увеличивает угрозу возникновения иммуногенности. Угроза возникновения иммуногенности должна быть минимизирована при разработке антител - лекарственных средств.
Для преодоления указанной выше проблемы рассматривались изменения в константной области IgG2. В связывающемся с FcγR домене константной области IgG2 остатки в положениях 327, 330 и 331 в Европейской системе нумерации отличаются от не связывающейся последовательности IgG4, в то время как остатки в положениях 233, 234, 235 и 236 в Европейской системе нумерации являются аминокислотами не связывающегося типа. Поэтому необходимо изменить аминокислоты в положениях 327, 330 и 331 в Европейской системе нумерации в последовательность IgG4 (G2Δa описана в Eur. J. Immunol. 1999 Aug; 29(8): 2613-24). Однако, поскольку аминокислотой в положении 339 в Европейской системе нумерации в IgG4 является аланин, в то время как соответствующим остатком в IgG2 является треонин, простое изменение аминокислот в положениях 327, 330 и 331 в Европейской системе нумерации в последовательность IgG4 неблагоприятно создает новую пептидную последовательность из 9 аминокислот, потенциально служащую в качестве неприродного пептидного T-клеточного эпитопа, и, следовательно, увеличивает угрозу возникновения иммуногенности. Затем авторы настоящего изобретения установили, что создание новой пептидной последовательно можно предотвратить введением замены на аланин треонина в положении 339 в Европейской системе нумерации в IgG2, помимо описанного выше изменения.
Помимо описанных выше мутаций были введены другие мутации, и они представляли собой замещение на валин метионина в положении 397 в Европейской системе нумерации в IgG2, которое, как обнаружено в примере 1, повышает устойчивость IgG2 в кислотных условиях; и замещение на серин цистеина в положении 131 в Европейской системе нумерации, замещение на лизин аргинина в положении 133 в Европейской системе нумерации и замещение на серин цистеина в положении 219 в Европейской системе нумерации, которые, как обнаружено в примере 2, снижают гетерогенность, возникающую в результате дисульфидных связей в шарнирной области. Кроме того, поскольку мутации в положениях 131 и 133 создают новую пептидную последовательность из 9 аминокислот, потенциально служащую в качестве неприродного пептидного T-клеточного эпитопа, и, следовательно, создают угрозу возникновения иммуногенности, пептидную последовательность вокруг положений 131-139 превращали в природную последовательность человека путем введения замены на глицин глютаминовой кислоты в положении 137 в Европейской системе нумерации и замены на глицин серина в положении 138 в Европейской системе нумерации. Кроме того, делетировали глицин и лизин в положениях 446 и 447 в Европейской системе нумерации из С-конца H-цепи для снижения C-концевой гетерогенности. Последовательность константной области, имеющую все введенные мутации, назвали M14ΔGK (M14ΔGK, SEQ ID NO: 5). Хотя существует мутация с заменой цистеина в положении 219 на серин в M14ΔGK, в виде новой пептидной последовательности из 9 аминокислот, которая потенциально служит в качестве пептидного T-клеточного эпитопа, угроза возникновения иммуногенности считалась очень низкой, поскольку характеристика аминокислоты серина схожа с характеристикой цистеина. Предсказание иммуногенности с помощью TEPITOPE также говорит о том, что нет различия в иммуногенности.
Вектор для экспрессии последовательности H-цепи антитела, вариабельная область которой была дикого типа (WT), а константная область была M14ΔGK (M14ΔGK, SEQ ID NO: 5; WT-M14ΔGK, SEQ ID NO: 19), конструировали с помощью описанного в ссылочном примере способа. Антитело, имеющее WT-M14ΔGK в качестве H-цепи и WT в качестве L-цепи, экспрессировали и очищали с помощью описанного в ссылочном примере способа.
Кроме того, в WT-M11ΔGK (M11ΔGK, SEQ ID NO: 8; WT-M11ΔGK, SEQ ID NO: 21) были введены мутации с использованием такого же способа в константную область IgG4 в положениях 233, 234, 235 и 236 в Европейской системе нумерации (G4Δb описана в Eur. J. Immunol. 1999 Aug; 29(8): 2613-24; это изменение вновь создает нечеловеческую последовательность и, следовательно, увеличивает угрозу возникновения иммуногенности) для ослабления связывания с рецептором Fcγ. Помимо указанного выше изменения, для уменьшения угрозы возникновения иммуногенности были введены мутации в положении 131, 133, 137, 138, 214, 217, 219, 220, 221 и 222 в Европейской системе нумерации, вследствие чего набор дисульфидного связывания в шарнирной области был таким же, как и в случае M14ΔGK; была введена мутация в положении 409 в Европейской системе нумерации (пример 1) для повышения устойчивости в кислотных условиях; и были делетированы аминокислоты в положениях 446 и 447 в Европейской системе нумерации (пример 3) для снижения C-концевой гетерогенности.
Кроме того, конструировали WT-M17ΔGK (M17ΔGK, SEQ ID NO: 10; WT-M17ΔGK, SEQ ID NO: 20) путем введения мутаций в константную область IgG1 в положениях 233, 234, 235, 236, 327, 330, 331 и 339 в Европейской системе нумерации (G1Δab, описана в Eur. J. Immunol. 1999 Aug; 29(8): 2613-24) для ослабления связывания с рецептором Fcγ и путем делетирования аминокислот в положениях 446 и 447 в Европейской системе нумерации для снижения C-концевой гетерогенности (пример 3).
WT-M17ΔGK или WT-M11ΔGK использовали в качестве H-цепи, и WT использовали в качестве L-цепи. Эти антитела экспрессировали и очищали с помощью описанного в примере 1 способа.
Оценка WT-M14ΔGK, WT-M17ΔGK и WT-M11ΔGK на связывание с рецептором Fcγ
Связывание с FcγRI определяли описанным ниже способом. Используя Biacore T100, рецептору I Fcγ (в дальнейшем FcγRI) человеческого происхождения, иммобилизованному на сенсорном чипе, предоставляли возможность взаимодействовать с IgG1, IgG2, IgG4, M11ΔGK, M14ΔGK или M17ΔGK в качестве аналита. Сравнивали количества связавшегося антитела. Измерения проводили, используя рекомбинантный человеческий FcRIA/CD64 (R&D systems) в качестве FcγRI человеческого происхождения и IgG1, IgG2, IgG4, M11ΔGK, M14ΔGK и M17ΔGK в качестве образцов. FcγRI подвергали иммобилизации на сенсорном чипе CM5 (BIACORE) с помощью способа соединения взаимодействием с аминами. Конечное количество иммобилизованного hFcγRI составляло приблизительно 13000 RU (условных единиц). Используемым подвижным буфером был HBS-EP+, а скорость потока составляла 20 мкл/мин. Концентрацию в образце доводили до 100 мкг/мл, используя HBS-EP+. Анализ включал две стадии: фазу ассоциации в течение двух минут, на которой инъецировали 10 мкл раствора антитела, и фазу диссоциации в течение последующих четырех минут, на которой инъецируемый раствор заменяли HBS-EP+. После фазы диссоциации сенсорный чип регенерировали инъецированием 20 мкл 5 мМ едкого натра. Ассоциация, диссоциация и регенерация составляют один цикл анализа. Для получения сенсорограмм инъецировали растворы различных антител. В качестве аналитов IgG4, IgG2, IgG1, M11, M14 и M17 инъецировали в указанном порядке. Этот ряд инъекций повторяли дважды. На фиг.7 показан результат сравнения данных по определенным количествам связавшегося антитела. Сравнение показывает, что количество связавшегося антитела уменьшается в следующем порядке: IgG1>IgG4>>IgG2=M11ΔGK=M14ΔGK=M17ΔGK. Таким образом, было выявлено, что связывание с FcγRI IgG2 дикого типа, M11ΔGK, M14ΔGK и M17ΔGK слабее связывания IgG1 и IgG4 дикого типа.
Связывание с FcγRIIa определяли описанным ниже способом. Используя Biacore T100, рецептору IIa Fcγ (в дальнейшем FcγRIIa) человеческого происхождения, иммобилизованному на сенсорном чипе, предоставляли возможность взаимодействовать с IgG1, IgG2, IgG4, M11ΔGK, M14ΔGK или M17ΔGK в качестве аналита. Сравнивали количества связавшегося антитела. Измерения проводили, используя рекомбинантный человеческий FcRIIA/CD32a (R&D systems) в качестве FcγRIIa человеческого происхождения и IgG1, IgG2, IgG4, M11ΔGK, M14ΔGK и M17ΔGK в качестве образцов. FcγRIIa подвергали иммобилизации на сенсорном чипе CM5 (BIACORE) с помощью способа соединения взаимодействием с аминами. Конечное количество иммобилизованного FcγRIIa составляло приблизительно 3300 RU. Используемым подвижным буфером был HBS-EP+, а скорость потока составляла 20 мкл/мин. В это время подвижный буфер инъецировали до стабилизации базисной прямой. Измерения проводили после стабилизации базисной прямой. Иммобилизованному FcγRIIa предоставляли возможность взаимодействовать с антителом каждого изотипа IgG (IgG1, IgG2 или IgG4) или антителом с введенными мутациями (M11ΔGK, M14ΔGK или M17ΔGK) в качестве аналита. Измеряли количество связавшегося антитела. Используемым подвижным буфером был HBS-EP+, а скорость потока составляла 20 мкл/мин. Температура во время измерения составляла 25οC. Концентрацию каждого IgG или его измененной формы доводили до 100 мкг/мл. Инъецировали 20 мкл аналита, и ему предоставляли возможность взаимодействовать с иммобилизованным FcγRIIa. После взаимодействия аналит подвергали диссоциации от FcγRIIa, и сенсорный чип регенерировали инъецированием 200 мкл подвижного буфера. В качестве аналитов IgG4, IgG2, IgG1, M11ΔGK, M14ΔGK и M17ΔGK инъецировали в указанном порядке. Этот ряд инъекций повторяли дважды. На фиг.8 показан результат сравнения данных по определенным количествам связавшегося антитела. Сравнение показывает, что количество связавшегося антитела уменьшается в следующем порядке: IgG1>IgG2=IgG4>M11ΔGK=M14ΔGK=M17ΔGK. Таким образом, было выявлено, что связывание с FcγRIIa M11ΔGK, M14ΔGK и M17ΔGK слабее связывания IgG1, IgG2 и IgG4 дикого типа.
Связывание с FcγRIIb определяли описанным ниже способом. Используя Biacore T100, рецептору IIb Fcγ (в дальнейшем FcγRIIb) человеческого происхождения, иммобилизованному на сенсорном чипе, предоставляли возможность взаимодействовать с IgG1, IgG2, IgG4, M11ΔGK, M14ΔGK или M17ΔGK в качестве аналита. Сравнивали количества связавшегося антитела. Измерения проводили, используя рекомбинантный человеческий FcRIIB/C (R&D systems) в качестве FcγRIIb человеческого происхождения и IgG1, IgG2, IgG4, M11ΔGK, M14ΔGK и M17ΔGK в качестве образцов. FcγRIIb подвергали иммобилизации на сенсорном чипе CM5 (BIACORE) с помощью способа соединения взаимодействием с аминами. Конечное количество иммобилизованного FcγRIIИ составляло приблизительно 4300 RU. В это время подвижный буфер инъецировали до стабилизации базисной прямой. Измерения проводили после стабилизации базисной прямой. Иммобилизованному FcγRIIb предоставляли возможность взаимодействовать с антителом каждого изотипа IgG (IgG1, IgG2 или IgG4) или антителом с введенными мутациями (M11ΔGK, M14ΔGK или M17ΔGK) в качестве аналита. Измеряли количество связавшегося антитела. Используемым подвижным буфером был HBS-EP+, а скорость потока составляла 20 мкл/мин. Температура во время измерения составляла 25°C. Концентрацию каждого IgG или его измененной формы доводили до 200 мкг/мл. Инъецировали 20 мкл аналита, и ему предоставляли возможность взаимодействовать с иммобилизованным FcγRIIb. После взаимодействия аналит подвергали диссоциации от FcγRIIb, и сенсорный чип регенерировали инъецированием 200 мкл подвижного буфера. В качестве аналитов IgG4, IgG2, IgG1, M11ΔGK, M14ΔGK и M17ΔGK инъецировали в указанном порядке. Этот ряд инъекций повторяли дважды. На фиг.9 показан результат сравнения данных по определенным количествам связавшегося антитела. Сравнение показывает, что количество связавшегося антитела уменьшается в следующем порядке: IgG4>IgG1>IgG2>M11ΔGK=M14ΔGK=M17ΔGK. Таким образом, было выявлено, что связывание с FcγRIIb M11ΔGK, M14ΔGK и M17ΔGK слабее связывания IgG1, IgG2 и IgG4 дикого типа.
Связывание с FcγRIIIa определяли описанным ниже способом. Используя Biacore T100, рецептору IIIa Fcγ (в дальнейшем FcγRIIIa) человеческого происхождения, иммобилизованному на сенсорном чипе, предоставляли возможность взаимодействовать с IgG1, IgG2, IgG4, M11ΔGK, M14ΔGK или M1ΔGK 7 в качестве аналита. Сравнивали количества связавшегося антитела. Измерения проводили, используя hFcγRIIIaV-His6 (рекомбинантный hFcγRIIIaV-His6, приготовленный в компании заявителя) в качестве FcγRIIIa человеческого происхождения и IgG1, IgG2, IgG4, M11ΔGK, M14ΔGK и M17ΔGK в качестве образцов. FcγRIIIa подвергали иммобилизации на сенсорном чипе CM5 (BIACORE) с помощью способа соединения взаимодействием с аминами. Конечное количество иммобилизованного hFcγRIIIaV-His6 составляло приблизительно 8200 RU. Используемым подвижным буфером был HBS-EP+, а скорость потока составляла 5 мкл/мин. Концентрацию в образце доводили до 250 мкг/мл, используя HBS-EP+. Анализ включал две стадии: фазу ассоциации в течение двух минут, на которой инъецировали 10 мкл раствора антитела, и фазу диссоциации в течение последующих четырех минут, на которой инъецируемый раствор заменяли HBS-EP+. После фазы диссоциации сенсорный чип регенерировали инъецированием 20 мкл 5 мМ соляной кислоты. Ассоциация, диссоциация и регенерация составляют один цикл анализа. Для получения сенсорограмм инъецировали растворы различных антител. В качестве аналитов IgG4, IgG2, IgG1, M11ΔGK, M14ΔGK и M17ΔGK инъецировали в указанном порядке. На фиг.10 показан результат сравнения данных по определенным количествам связавшегося антитела. Сравнение показывает, что количество связавшегося антитела уменьшается в следующем порядке: IgG1>>IgG4>IgG2>M17ΔGK>M11ΔGK=M14ΔGK. Таким образом, было выявлено, что связывание с FcγRIIIa M11ΔGK, M14ΔGK и M17ΔGK слабее связывания IgG1, IgG2 и IgG4 дикого типа. Кроме того, установлено, что связывание с FcγRIIIa M11ΔGK и M14ΔGK слабее связывания M17ΔGK, содержащего мутацию G1Δab, о которой сообщалось в Eur. J. Immunol. 1999 Aug; 29(8): 2613-24.
Описанный выше факт свидетельствует о том, что связывание с рецептором Fcγ WT-M14ΔGK, WT-M17ΔGK и WT-M11ΔGK заметно ослаблено по сравнению с IgG1 дикого типа. Угрозы возникновения иммуногенности вследствие опосредованной рецептором Fcγ интернализации в APC и неблагоприятных эффектов, вызванных эффекторной функцией, такой как ADCC, можно избежать с помощью использования WT-M14ΔGK, WT-M17ΔGK или WT-M11ΔGK в качестве константной области. Таким образом, WT-M14ΔGK, WT-M17ΔGK и WT-M11ΔGK полезны в качестве последовательности константной области антитела - лекарственного средства, направленного на нейтрализацию антигенов.
Оценка WT-M14ΔGK, WT-M17ΔGK и WT-M11ΔGK на стабильность при высоких концентрациях
WT-M14ΔGK, WT-M17ΔGK и WT-M11ΔGK оценивали на стабильность при высоких концентрациях. Очищенные антитела WT-IgG1, WT-M14ΔGK, WT-M17ΔGK и WT-M11ΔGK подвергали диализу против раствора, содержащего 20 мМ гистидина хлорид, 150 мМ NaCl, pH 6,5 (EasySEP, TOMY), и затем концентрировали с использованием ультрафильтров. Антитела проверяли на стабильность при высоких концентрациях. Условиями были следующие условия.
Антитела: WT-IgG1, WT-M14ΔGK, WT-M17ΔGK и WT-M11ΔGK
Буфер: 20 мМ гистидин хлорид, 150 мМ NaCl, pH 6,5
Концентрация: 61 мг/мл
Температура хранения и промежуток времени: 40°C в течение двух недель, 40°C в течение одного месяца, 40°C в течение двух месяцев.
Способ оценки агрегирования:
Система: Waters Alliance
Колонка: G3000SWxl (TOSOH)
Подвижная фаза: 50 мМ натрия фосфат, 300 мМ KCl, pH 7,0
Скорость потока, длина волны: 0,5 мл/мин, 220 нм
Анализировали образцы, разведенные в 100 раз.
Проценты агрегата в исходных композициях (непосредственно после приготовления) и композициях, хранившихся при различных условиях, определяли с помощью описанной выше гель-фильтрации. Различия (увеличение количества) в проценте агрегата относительно исходных композиций показаны на фиг.11. В результате установлено, что количества агрегата в WT-M14ΔGK, WT-M17ΔGK и WT-M11ΔGK были увеличены только слегка по сравнению с WT-IgG1 и составляли приблизительно половину от содержания в диком типе. Кроме того, как показано на фиг.12, увеличенное количество Fab-фрагмента было соизмеримым между WT-IgG1 и WT-M17ΔGK, в то время как количества, увеличенные в WT-M14ΔGK и WT-M11ΔGK, составляли приблизительно одну четвертую от количества в диком типе. Пути деградации композиций антитела типа IgG включают образование агрегата и образованием продукта деградации в виде Fab, как описано в WO 2003/039485. Основываясь на двух критериях, агрегации и образовании Fab-фрагмента, было установлено, что WT-M14ΔGK и WT-M11ΔGK обладают лучшей стабильностью в композициях, чем WT-IgG1. Таким образом, даже для антител, которые имеют константную область IgG1 со слабой стабильностью и не могли быть приготовлены в виде антител - лекарственных средств - в жидких композициях с высокими концентрациями, ожидалось, что использование WT-M14ΔGK, WT-M17ΔGK или WT-M11ΔGK в качестве константной области даст возможность получить более стабильные жидкие композиции с высокими концентрациями.
В частности, ожидалось, что M14ΔGK будет очень полезен в качестве новой последовательности константной области, которая могла бы (1) преодолеть неустойчивость исходной молекулы IgG2 в кислотных условиях; (2) снизить гетерогенность, возникающую в результате дисульфидных связей в шарнирной области; (3) не связываться с рецептором Fcγ; (4) иметь минимизированное количество новых пептидных последовательностей из 9 аминокислот, которые потенциально служат в качестве пептидных T-клеточных эпитопов; и (5) иметь большую стабильность, чем IgG1 в композициях с высокими концентрациями.
[Пример 5] Приготовление и оценка M31ΔGK
Приготовленный в примере 4 M14ΔGK изменяли путем замещения на последовательность IgG2 аминокислот в положениях 330, 331 и 339 в Европейской системе нумерации для конструирования M31ΔGK (M31ΔGK, SEQ ID NO: 7). Вектор для экспрессии последовательности Н-цепи антитела, вариабельная область которой имеет дикий тип, а последовательностью константной области является M31ΔGK (WT-M31ΔGK, SEQ ID NO: 22), конструировали с помощью описанного в ссылочном примере 1 способа. Используя Н-цепь WT-M31ΔGK и L-цепь дикого типа, WT-M31ΔGK экспрессировали и очищали с помощью описанного в ссылочном примере 1 способа.
Помимо WT-M31ΔGK, в то же самое время WT-IgG2 и WT-M14ΔGK экспрессировали и очищали, анализировали с помощью катионообменной хроматографии с использованием описанной ниже процедуры. Используемыми при анализе с помощью катионообменной хроматографии условиями были следующие условия. Сравнивали хроматограммы для WT-IgG2, WT-M14ΔGK и WT-M31ΔGK.
Колонка: ProPac WCX-10 (Dionex)
Подвижная фаза
A: 25 ммоль/л MES/NaOH, pH 6,1
B: 25 ммоль/л MES/NaOH, 250 ммоль/л NaCl, pH 6,1
Скорость потока: 0,5 мл/мин
Градиент: 0% B (5 мин)→(65 мин)→100% B→(1 мин)
Детекция: 280 нм
На фиг.13 показан результат анализа WT-IgG2, WT-M14ΔGK и WT-M31ΔGK. Установлено, что, подобно WT-M14ΔGK, WT-M31ΔGK элюируется в виде единственного пика, в то время как WT-IgG2 дает множество пиков. Это означает, что гетерогенности, происходящей в результате дисульфидных связей в шарнирной области IgG2, можно также избежать в WT-M31ΔGK.
[Пример 6] Оценка сохранения в плазме WT-M14
Способ оценки сохранения в плазме человека
Известно, что длительное сохранение (медленное удаление) молекулы IgG в плазме обусловлено функционированием FcRn, который известен в качестве рецептора реутилизации молекулы IgG (Nat. Rev. Immunol. 2007 Sep; 7(9): 715-25). После захвата в эндосомы благодаря пиноцитозу, в кислотных условиях внутри эндосомы (приблизительно pH 6,0), молекулы IgG связываются с FcRn, экспрессируемым в эндосомах. В то время как молекулы IgG, которые не связываются с FcRn, переносятся и подвергаются деградации в лизосомах, связавшиеся с FcRn молекулы перемещаются на клеточную поверхность и затем высвобождаются из FcRn обратно в плазму снова в нейтральные условия в плазме (приблизительно pH 7,4).
Известные антитела типа IgG включают изотипы IgG1, IgG2, IgG3 и IgG4. Сообщалось, что периоды полужизни в плазме этих изотипов у человека составляют приблизительно 36 дней для IgG1 и IgG2; приблизительно 29 дней для IgG3; и 16 дней для IgG4 (Nat. Biotechnol. 2007 Dec; 25(12): 1369-72). Поэтому считают, что самым длительным является сохранение в плазме IgG1 и IgG2. Как правило, изотипами антител, используемыми в качестве лекарственных средств, являются IgG1, IgG2 и IgG4. Опубликованные способы дальнейшего улучшения фармакокинетики этих антител типа IgG включают способы увеличения описанного выше связывания с FcRn человека, и это успешно выполняют с помощью изменения последовательности константной области IgG (J. Biol. Chem. 2007 Jan 19; 282(3): 1709-17; J. Immunol. 2006 Jan 1; 176(1): 346-56).
Существуют видоспецифические различия между FcRn мыши и FcRn человека (Proc. Natl. Acad. Sci. USA. 2006 Dec 5; 103(49): 18709-14). Поэтому для предсказания сохранения антител типа IgG, которые имеют измененную последовательность константной области, в плазме человека желательно оценить связывание с FcRn человека и сохранение в плазме трансгенных по FcRn человека мышей (Int. Immunol. 2006 Dec; 18(12): 1759-69).
Оценка связывания с FcRn человека
FcRn представляет собой комплекс FcRn и β2-микроглобулина. Праймеры в виде олиго-ДНК готовили на основе опубликованной последовательности гена FcRn человека (J. Exp. Med. (1994) 180 (6), 2377-2381). ДНК-фрагмент, кодирующий целый ген, получали с помощью ПЦР, используя кДНК человека (Human Placenta Marathon-Ready cDNA, Clontech) в качестве матрицы и приготовленные праймеры. Используя полученный ДНК-фрагмент в качестве матрицы, ДНК-фрагмент, кодирующий экстраклеточный домен, содержащий сигнальный участок (Met1-Leu290), амплифицировали с помощью ПЦР и встраивали в вектор для экспрессии в клетках животных (аминокислотная последовательность FcRn человека определена в SEQ ID NO: 24). Подобным образом, праймеры в виде олиго-ДНК готовили на основе опубликованной последовательности гена β2-микроглобулина человека (Proc. Natl. Acad. Sci. USA. (2002) 99 (26), 16899-16903). ДНК-фрагмент, кодирующий целый ген, получали с помощью ПЦР, используя кДНК человека (Human Placenta Marathon-Ready cDNA, Clontech) в качестве матрицы и приготовленные праймеры. Используя полученный ДНК-фрагмент в качестве матрицы, ДНК-фрагмент, кодирующий целый β2-микроглобулин, содержащий сигнальный участок (Met1-Met119), амплифицировали с помощью ПЦР и встраивали в вектор для экспрессии в клетках животных (аминокислотная последовательность β2-микроглобулина представлена в SEQ ID NO: 25).
Растворимый FcRn человека экспрессировали следующим образом. Сконструированные для FcRn человека и β2-микроглобулина плазмиды вводили в клетки линии происходящих из рака первичной почки человека клеток HEK293H (Invitrogen), используя 10% фетальной бычьей сыворотки (Invitrogen), с помощью липофекции. Супернатант получаемой в результате культуры собирали, и FcRn очищали, используя сефарозу Sepharose 6 Fast Flow (Amersham Biosciences) с IgG, с использованием способа, описанного в J. Immunol. 2002 Nov 1; 169(9): 5171-80, с последующей дополнительной очисткой, используя HiTrap Q HP (GE Healthcare).
Связывание с FcRn человека определяли, используя Biacore 3000. Антитело связывали с белком L или кроличьим антителом против цепи каппа IgG человека, иммобилизованным на сенсорном чипе, FcRn человека добавляли в качестве аналита для взаимодействия с антителом, и аффинность (KD) рассчитывали, исходя из количества связавшегося FcRn человека. Конкретно, белок L или кроличье антитело против цепи каппа IgG человека подвергали иммобилизации на сенсорном чипе CM5 (BIACORE) с помощью способа соединения взаимодействием с аминами, используя 50 мМ Na-фосфатный буфер (pH 6,0), содержащий 150 мМ NaCl, в качестве подвижного буфера. Затем антитело разбавляли подвижным буфером, содержащим 0,02% Tween20, и инъецировали для связывания с чипом. Затем инъецировали FcRn человека, и определяли связывание FcRn человека с антителом.
Аффинность рассчитывали, используя программное обеспечение BIAevaluation. Полученные сенсорограммы использовали для расчета количества hFcRn, связавшегося с антителом непосредственно перед концом инъецирования FcRn человека. Аффинность антитела в отношении FcRn человека рассчитывали приведением в соответствие со способом определения аффинности в устойчивом состоянии.
Оценка сохранения в плазме трансгенных по FcRn человека мышей
Фармакокинетику в трансгенных по FcRn человека мышах (мышах B6.mFcRn-/-.hFcRn Tg линии 276+/+; Jackson Laboratories) определяли следующим способом. Антитело внутривенно вводили мышам один раз в дозе 1 мг/кг, и кровь брали в соответствующие моменты времени. Взятую кровь немедленно центрифугировали при 15000 оборотах/мин и 4°C в течение 15 минут для получения плазмы крови. Отделенную плазму хранили в холодильнике при -20°C или ниже до использования. Концентрацию в плазме определяли с помощью ELISA.
Прогнозная оценка сохранения WT-M14 в плазме человека
Связывания WT-IgG1 и WT-M14 с FcRn человека определяли с помощью BIAcore. Показанный в таблице 1 результат указывает на то, что связывание WT-M14 слегка больше связывания WT-IgG1.
Как показано на фиг.14, сохранение в плазме, однако, было соизмеримо между WT-IgG1 и WT-M14 после оценки с использованием трансгенных по FcRn человека мышей. Этот факт говорит о том, что сохранение константной области M14 в плазме человека соизмеримо с сохранением константной области IgG1.
[Пример 7] Приготовление WT-M44, WT-M58 и WT-M73, имеющих улучшенную фармакокинетику
Приготовление молекулы WT-M58
Как описано в примере 6, сохранение WT-M14 в плазме трансгенных по FcRn человека мышей соизмеримо с сохранением WT-IgG1. Известные способы улучшения фармакокинетики включают способы понижения изоэлектрической точки антитела и способы усиления связывания с FcRn. Здесь описанные ниже модификации были введены для улучшения фармакокинетики WT-M14. Конкретно, в WT-M31ΔGK, приготовленный из WT-M14, как описано в примере 4, были введены следующие замены: замена на метионин валина в положении 397; замена на глютамин гистидина в положении 268; замена на глютамин аргинина в положении 355 и замена на глютаминовую кислоту глютамина в положении 419 в Европейской системе нумерации. Эти четыре замены введены в WT-M31ΔGK для создания WT-M58 (аминокислотная последовательность SEQ ID NO: 26). Экспрессионные векторы готовили с помощью такого же, как и способ, описанный в примере 1. WT-M58 и L (дикого типа) использовали в качестве H- и L-цепи соответственно. WT-M58 экспрессировали и очищали с помощью способа, описанного в примере 1.
Конструирование молекулы WT-M73
С другой стороны, создавали WT-M44 (аминокислотную последовательность SEQ ID NO: 27) путем введения в IgG1 замены на аланин аминокислоты в положении 434, в Европейской системе нумерации. Также создавали WT-M83 (аминокислотную последовательность SEQ ID NO: 58) путем делетирования глицина в положении 446 в Европейской системе нумерации и лизина в положении 447 в Европейской системе нумерации для снижения гетерогенности С-конца H-цепи. Кроме того, создавали WT-M73 (аминокислотную последовательность SEQ ID NO: 28) путем введения в WT-M58 замены аланина в положении 434 в Европейской системе нумерации.
Векторы для экспрессии указанных выше антител конструировали с использованием способа, описанного в примере 1. WT-M44, WT-M58 или WT-M73 использовали в качестве H-цепи, в то время как L (дикого типа) использовали в качестве L-цепи. WT-M44, WT-M58 и WT-M73 экспрессировали и очищали с помощью способа, описанного в примере 1.
Прогнозная оценка сохранения WT-M44, WT-M58 и WT-M73 в плазме человека
Связывания WT-IgG1, WT-M44, WT-M58 и WT-M73 с FcRn человека определяли с помощью BIAcore. Показанный в таблице 2 результат указывает на то, связывания WT-M44, WT-M58 и WT-M73 сильнее связывания WT-IgG1 и приблизительно в 2,7, 1,4 и 3,8 раз превышают связывание WT-IgG1 соответственно.
В результате оценки WT-IgG1, WT-M14 и WT-M58 на сохранение их в плазме трансгенных по FcRn человека мышей, как показано на фиг. 24, подтвердили, что WT-M58 сохраняются в плазме более длительное время, чем WT-IgG1 и WT-M14. Кроме того, WT-IgG1, WT-M44, WT-M58, и WT-M73 были оценены на сохранение их в плазме трансгенных по FcRn человека мышей. Подтвердили, что, как показано на фиг.15, все из WT-M44, WT-M58 и WT-M73 имеют улучшенную фармакокинетику относительно WT-IgG1. Эффект улучшения фармакокинетики коррелировал с активностью связывания с FcRn человека. В частности, уровень WT-M73 в плазме в день 28 был выше приблизительно в 16 раз уровня WT-IgG1. Этот факт говорит о том, что фармакокинетика антител с константной областью M73 в организме человека также значительно улучшена по сравнению с антителами с константной областью IgG1.
[Пример 8] Эффект новых константных областей M14 и M58 на снижение гетерогенности различных антител
Как описано в примере 4, установлено, что гетерогенность, возникающую из шарнирной области IgG2, можно снизить с помощью превращения константной области IgG2 в M14 в гуманизированном антителе PM1 (WT) против рецептора IL-6. Антитела типа IgG2, отличные от гуманизированного антитела PM1, также проверили для определения того, может ли гетерогенность быть снижена с помощью превращения их константных областей в M14 или M58.
Отличными от гуманизированного антитела PM1 антителами были: антитело F2H/L39 против рецептора IL-6 (аминокислотные последовательности F2H/L39_VH и F2H/L39_VL определены в SEQ ID NO: 29 и 30 соответственно); антитело H0L0 против рецептора IL-31 (аминокислотные последовательности H0L0_VH и H0L0_VL определены в SEQ ID NO: 31 и 32 соответственно); и антитело DNS против RANKL (аминокислотные последовательности DNS_VH и DNS_VL определены в SEQ ID NO: 33 и 34 соответственно). Для каждого из этих антител создавали антитела с константной областью IgG1 (SEQ ID NO: 1), константной областью IgG2 (SEQ ID NO: 2), или M14 (SEQ ID NO: 5) или M58 (SEQ ID NO: 35).
Созданные антитела оценивали на гетерогенность с помощью катионообменной хроматографии, используя требуемый градиент и соответствующую скорость потока в колонке ProPac WCX-10 (Dionex) (подвижная фаза A: 20 мМ натрия ацетат (pH 5,0), подвижная фаза B: 20 мМ натрия ацетат/1M NaCl (pH 5,0)). Результат оценки, полученной с помощью катионообменной хроматографии (IEC), продемонстрирован на фиг.16.
Установлено, как продемонстрировано на фиг.16, что превращение константной области из типа IgG1 в тип IgG2 увеличивает гетерогенность не только гуманизированного антитела PM1 (WT) против рецептора IL-6, но также антитела F2H/L39 против рецептора IL-6, антитела H0L0 против рецептора IL-31 и антитела DNS против RANKL. Напротив, гетерогенность всех этих антител можно было снизить с помощью превращения их константной области в M14 или M58. Следовательно, было установлено, что, независимо от типа антигена и последовательности вариабельной области антитела, гетерогенность, возникающую из природного IgG2, можно снизить с помощью замещения на серины цистеинов в положении 131, в Европейской системе нумерации, в СН1-домене H-цепи и в положении 219, в Европейской системе нумерации, в верхнем шарнирном участке H-цепи.
[Пример 9] Эффект новой константной области M58 на улучшение фармакокинетики различных антител
Как описано в примере 7, установлено, что превращение константной области из IgG1 в M58 в гуманизированном антителе PM1 (WT) против рецептора IL-6 усиливает связывание с FcRn человека и фармакокинетику в трансгенных по FcRn человека мышах. Поэтому антитела типа IgG1, отличные от гуманизированного антитела PM1, также проверяли для определения того, может ли превращение их константной области в М58 улучшить их фармакокинетику.
Отличными от гуманизированного антитела PM1 (WT) антителами были антитело H0L0 против рецептора IL-31 (аминокислотные последовательности H0L0_VH и H0L0_VL определены в SEQ ID NO: 31 и 32 соответственно) и антитело DNS против RANKL (аминокислотные последовательности DNS_VH и DNS_VL определены в SEQ ID NO: 33 и 34 соответственно). Для каждого из этих антител создавали антитела с константной областью IgG1 (SEQ ID NO: 1) или M58 (SEQ ID NO: 35), и оценивали их связывание с FcRn человека способом, описанным в примере 6. Результат показан в таблице 3.
Установлено, как показано в таблице 3, что в результате превращения константной области из типа IgG1 в М58, как и в случае антитела против рецептора IL-6 WT, связывания как антитела H0L0 против рецептора IL-31, так и антитела DNS против RANKL с FcRn человека усиливались. Это говорит о возможности улучшения, независимо от типа антигена и последовательности вариабельной области антитела, фармакокинетики в организме человека при превращении константной области из типа IgG1 в М58.
[Пример 10] Эффект цистеина в СН1-домене на гетерогенность и устойчивость
Как описано в примере 2, цистеины в шарнирной области и СН1-домене IgG2 замещали для снижения гетерогенности природного IgG2. С помощью оценки различных измененных антител выявлено, что гетерогенность можно снизить без снижения устойчивости, используя SKSC (SEQ ID NO: 38). SKSC (SEQ ID NO: 38) является измененной константной областью, полученной при замене на серии цистеина в положении 131 и замене на лизин аргинина в положении 133, в Европейской системе нумерации, в СН1-домене Н-цепи и замене на серии цистеина в положении 219, в Европейской системе нумерации, в верхнем шарнирном участке Н-цепи последовательности константной области IgG2 дикого типа.
Между тем другим возможным способом снижения гетерогенности является единственная замена на серии цистеина в положении 219 или на серии цистеина в положении 220, в Европейской системе нумерации, в шарнирной области Н-цепи. Измененную константную область SC (SEQ ID NO: 39) IgG2 получали путем замещения на серии цистеина в положении 219, а CS (SEQ ID NO: 40) получали путем замещения на серии цистеина в положении 220, в Европейской системе нумерации, в IgG2. Готовили WT-SC (SEQ ID NO: 41) и WT-CS (SEQ ID NO: 42), имеющие SC и CS соответственно, и сравнивали их с WT-IgG1, WT-IgG2, WT-SKSC и WT-M58 по показателю гетерогенности и термоустойчивости. Кроме того, из F2H/L39 (аминокислотные последовательности F2H/L39_VH и F2H/L39_VL определены в SEQ ID NO: 29 и 30 соответственно), которое является антителом против рецептора IL-6, отличающимся от дикого типа, готовили F2H/L39-IgG1, F2H/L39-IgG2, F2H/L39-SC, F2H/L39-CS, F2H/L39-SKSC и F2H/L39-M14, которые имеют константную область IgG1 (SEQ ID NO: 1), IgG2 (SEQ ID NO: 2), SC (SEQ ID NO: 39), CS (SEQ ID NO: 40), SKSC (SEQ ID NO: 38) или M14 (SEQ ID NO: 5) соответственно. Антитела сравнивали в отношении гетерогенности.
WT-IgG1, WT-IgG2, WT-SC, WT-CS, WT-SKSC, WT-M58, F2H/L39-IgG1, F2H/L39-IgG2, F2H/L39-SC, F2H/L39-CS, F2H/L39-SKSC и F2H/L39-M14 оценивали на гетерогенность с помощью катионообменной хроматографии, используя требуемый градиент и соответствующую скорость потока в колонке ProPac WCX-10 (Dionex) (подвижная фаза A: 20 мМ натрия ацетат (pH 5,0), подвижная фаза B: 20 мМ натрия ацетат/1M NaCl (pH 5,0)). Результат оценки, полученной с помощью катионообменной хроматографии, продемонстрирован на фиг.17.
Установлено, как продемонстрировано на фиг.17, что превращение константной области из типа IgG1 в тип IgG2 увеличивает гетерогенность как дикого типа, так и F2H/L39. Напротив, гетерогенность значительно снижалась при превращении константной области в SKSC и M14 или M58. Между тем превращение константной области в SC значительно снижало гетерогенность, как и в случае SKSC. Однако превращение в CS не снижало гетерогенность в достаточной степени.
При приготовлении стабильных композиций при разработке антител - лекарственных средств, помимо низкой гетерогенности, обычно желательная высокая устойчивость. Поэтому для оценки устойчивости определяли температуру точки тепловой денатурации (значение Tm) с помощью дифференциальной сканирующей калориметрии (DSC) (VP-DSC; Microcal). Температура точки тепловой денатурации (значение Tm) служит показателем устойчивости. Для приготовления стабильных композиций в качестве лекарственных средств желательна более высокая температура точки тепловой денатурации (значение Tm) (J. Pharm. Sci. 2008 Apr; 97(4): 1414-26). WT-IgG1, WT-IgG2, WT-SC, WT-CS, WT-SKSC и WT-M58 подвергали диализу (EasySEP; TOMY) против раствора, содержащего 20 мМ натрия ацетат, 150 мМ NaCl, pH 6,0. Дифференциальную сканирующую калориметрию проводили при скорости нагревания 1°C/мин с 40 до 100°C и при концентрации белка, составляющей приблизительно 0,1 мг/мл. Полученные с помощью DSC кривые денатурации представлены на фиг.18. Список значений Tm Fab-доменов приведен в таблице 4 ниже.
Значения Tm WT-IgG1 и WT-IgG2 были почти одинаковыми (приблизительно 94°C; Tm IgG2 была на приблизительно 1°C ниже). Между тем значения Tm WT-SC и WT-CS составляли приблизительно 86°C и, следовательно, значительно ниже значений Tm WT-IgG1 и WT-IgG2. С другой стороны, значения Tm WT-M58 и WT-SKSC составляли приблизительно 94°C и соразмеримы со значениями Tm WT-IgG1 и WT-IgG2. Это говорит о том, что WT-SC и WT-CS являются заметно неустойчивыми по сравнению с IgG2, и поэтому предпочтительными при разработке антител - лекарственных средств - являются WT-SKSC и WT-M58, оба из которых также включают замену на серин цистеина в CH1-домене. Полагают, что причиной значительного снижения Tm в WT-SC и WT-CS относительно IgG2 являются различия в наборе дисульфидного связывания между WT-SC или WT-CS и IgG2.
Кроме того, сравнение кривых денатурации при DSC показало, что каждый из WT-IgG1, WT-SKSC и WT-M58 дает острый и единственный пик денатурации для Fab-домена. Напротив, каждый из WT-SC и WT-CS давал более широкий пик денатурации для Fab-домена. WT-IgG2 также давал пик с плечом со стороны более низкой температуры пика денатурации для Fab-домена. Как правило, считается, что один компонент дает острый пик денатурации при DSC, и, если присутствуют два или более компонентов с различными значениями Tm (т.е. гетерогенностью), пик денатурации становится шире. Конкретно, описанный выше результат говорит о возможности содержания в каждом из WT-IgG2, WT-SC и WT-CS двух или более компонентов, и поэтому гетерогенность природного IgG2 не была достаточно снижена в WT-SC и WT-CS. Этот факт говорит о том, что не только цистеины в шарнирной области, но также цистеины в CH1-домены вовлечены в гетерогенность IgG2 дикого типа, и для снижения гетерогенности при DSC необходимо изменить не только цистеины в шарнирной области, но также цистеины в CH1-домене. Кроме того, как описано выше, устойчивости, сравнимой с устойчивостью IgG2 дикого типа, можно достигнуть только при замещении цистеинов как в шарнирной области, так и в CH1-домене.
Указанный выше факт говорит о том, что, в плане гетерогенности и устойчивости, SC и CS, которые являются константными областями с введенной заменой на серин только цистеина шарнирной области, являются непригодными в качестве константных областей для снижения гетерогенности, возникающей из шарнирной области IgG2. Таким образом, обнаружено, что гетерогенность можно значительно снизить при сохранении устойчивости, равной устойчивости IgG2, только когда, помимо цистеина в шарнирной области, цистеин в положении 131, в Европейской системе нумерации, в CH1-домене замещен серином. Такие константные области включают M14, M31, M58 и M73, описанные выше. В частности, M58 и M73 устойчивы и менее гетерогенны, и демонстрируют улучшенную фармакокинетику, и поэтому ожидается, что они будут полезны в качестве константных областей для антител - лекарственных средств.
[Пример 11] Создание полностью гуманизированных антител против рецептора IL-6 с улучшенной фармакокинетикой/фармакодинамикой (PK/PD)
Для создания полностью гуманизированного антитела против рецептора IL-6 с улучшенной PK/PD создавали описанные ниже молекулы с помощью изменения тоцилизумаба (H-цепь, WT-IgG1 (SEQ ID NO: 12); L-цепь, WT (SEQ ID NO: 15)). Были приготовлены следующие полностью гуманизированные антитела против рецептора IL-6, в которых используется в качестве константной области M73 или M83, приготовленные в примере 7: Fv3-M73 (H-цепь, VH4-M73, SEQ ID NO: 48; L-цепь, VL1-каппа, SEQ ID NO: 49), Fv4-M73 (H-цепь, VH3-M73, SEQ ID NO: 46; L-цепь, VL3-каппа, SEQ ID NO: 47) и Fv5-M83 (H-цепь, VH5-M83, SEQ ID NO: 44; L-цепь, VL5-каппа, SEQ ID NO: 45).
Аффинности приготовленных Fv3-M73, Fv4-M73 и Fv5-M83 в отношении рецептора IL-6 сравнивали с аффинностью тоцилизумаба. Определенные аффинности этих антител против рецептора IL-6 приведены в таблице 5 (что касается способа, смотри ссылочный пример). Кроме того, их BaF/gp130-нейтрализующие активности сравнивали с активностями тоцилизумаба и контроля (известного антитела против рецептора IL-6 с высокой аффинностью, описанного в ссылочном примере, и hIgG1 VQ8F11-21, описанного в US 2007/0280945) (что касается способа, смотри ссылочный пример). Результаты, полученные при определении биологических активностей этих антител, используя BaF/gp130, показаны на фиг.19 (тоцилизумаб, контроль и Fv5-M83 с использованием конечной концентрации IL-6, составляющей 300 нг/мл) и фиг. 20 (тоцилизумаб, Fv3-M73 и Fv4-M73 с использованием конечной концентрации IL-6, составляющей 30 нг/мл). Как показано в таблице 5, Fv3-M73 и Fv4-M73 имеют аффинность, которая приблизительно в два - три раза выше аффинности тоцилизумаба, в то время как Fv5-M83 демонстрирует аффинность, которая приблизительно в 100 раз выше аффинности тоцилизумаба (поскольку было трудно определить аффинность Fv5-M83, взамен определили аффинность Fv5-IgG1, который имеет константную область типа IgG1; как правило, полагают, что константная область не оказывает эффект на аффинность). Как показано на фиг.20, Fv3-M73 и Fv4-M73 демонстрируют слегка большие активности, чем тоцилизумаб. Как показано на фиг.19, Fv5-M83 имеет очень большую активность, которая более чем в 100 раз превышает активность тоцилизумаба по показателю 50% ингибирующей концентрации. Fv5-M83 также демонстрирует приблизительно в 10 раз большую нейтрализующую активность по показателю 50% ингибирующей концентрации, чем контроль (известное антитело против рецептора IL-6 с высокой аффинностью).
Изоэлектрические точки тоцилизумаба, контроля, Fv3-M73, Fv4-M73 и Fv5-M83 определяли с помощью изоэлектрофокусировки, используя известный квалифицированным в данной области техники специалистам способ. В результате установлено, что изоэлектрическая точка равнялась приблизительно 9,3 для тоцилизумаба; приблизительно 8,4-8,5 для контроля; приблизительно 5,7-5,8 для Fv3-M73; приблизительно 5,6-5,7 для Fv4-M73 и 5,4-5,5 для Fv5-M83. Таким образом, каждое антитело имело значительно более низкую изоэлектрическую точку по сравнению с тоцилизумабом и контролем. Кроме того, рассчитывали теоретическую изоэлектрическую точку вариабельных областей VH/VL с помощью GENETYX (GENETYX CORPORATION). В результате установлено, что теоретическая изоэлектрическая точка равняется 9,20 для тоцилизумаба; 7,79 для контроля; 5,49 для Fv3-M73; 5,01 для Fv4-M73 и 4,27 для Fv5-M83. Таким образом, каждое антитело имело значительно более низкую изоэлектрическую точку по сравнению с тоцилизумабом и контролем. Соответственно полагали, что фармакокинетика Fv3-M73, Fv4-M73 и Fv5-M83 улучшена по сравнению с тоцилизумабом и контролем.
T-клеточные эпитопы в последовательности вариабельной области тоцилизумаба, Fv3-M73, Fv4-M73 или Fv5-M83 анализировали, используя TEPITOPE (Methods. 2004 Dec; 34(4): 468-75). В результате было предсказано, что тоцилизумаб имеет T-клеточные эпитопы, многих из которых могли бы связываться с HLA. Напротив, число последовательностей, которые согласно предсказанию связываются с T-клеточными эпитопами, было значительно уменьшено в Fv3-M73, Fv4-M73 и Fv5-M83. Кроме того, каркасная область Fv3-M73, Fv4-M73 или Fv5-M83 не имеет мышиной последовательности и, следовательно, является полностью гуманизированной. Это говорит о возможности значительно более низкой угрозы возникновения иммуногенности в Fv3-M73, Fv4-M73 и Fv5-M83, чем в тоцилизумабе.
[Пример 12] Анализ PK/PD полностью гуманизированных антител против рецептора IL-6 в макаках
Каждое из антител: тоцилизумаба, контроля, Fv3-M73, Fv4-M73 и Fv5-M83 вводили внутривенно один раз в дозе 1 мг/кг яванским макакам для определения зависимостей от времени их концентраций в плазме (в отношении способа смотри ссылочный пример). Зависимости от времени концентраций в плазме тоцилизумаба, Fv3-M73, Fv4-M73 и Fv5-M83 после внутривенного введения продемонстрированы на фиг.21. В результате установлено, что каждое из антител Fv3-M73, Fv4-M73 и Fv5-M83 демонстрирует значительно улучшенную фармакокинетику в яванских макаках по сравнению с тоцилизумабом и контролем. Из них, Fv3-M73 и Fv4-M73 продемонстрировали значительно улучшенную фармакокинетику по сравнению с тоцилизумабом.
Оценивали эффективность каждого антитела в нейтрализации связанного с мембраной рецептора IL-6 яванского макака. IL-6 яванского макака вводили подкожно в нижнюю часть спины в дозе 5 мкг/кг каждый день с дня 6 до дня 18 после введения антитела (с дня 3 до дня 10 для тоцилизумаба), и концентрацию CRP в каждом животном определяли спустя 24 часа (в отношении способа смотри ссылочный пример). Зависимость от времени концентрации CRP после введения каждого антитела продемонстрирована на фиг.22. Для оценки эффективности каждого антитела в нейтрализации растворимого рецептора IL-6 яванского макака определяли концентрацию несвязанного растворимого рецептора IL-6 яванского макака в плазме яванских макак и рассчитывали процент нейтрализации растворимого рецептора IL-6 (что касается способа, смотри ссылочный пример). Зависимость от времени процента нейтрализации растворимого рецептора IL-6 после введения каждого антитела продемонстрирована на фиг.23.
Каждое из антител Fv3-M73, Fv4-M73 и Fv5-M83 нейтрализовало связанный с мембраной рецептор IL-6 яванского макака более устойчивым образом и подавляло увеличение CRP в течение большего периода времени, чем тоцилизумаб и контроль (известное антитело против рецептора IL-6 с высокой аффинностью). Кроме того, каждое из антител Fv3-M73, Fv4-M73 и Fv5-M83 нейтрализовало растворимый рецептор IL-6 яванского макака более устойчивым образом и подавляло увеличение несвязанного растворимого рецептора IL-6 яванского макака в течение большего периода времени, чем тоцилизумаб и контроль. Эти факты свидетельствуют о том, что все антитела Fv3-M73, Fv4-M73 и Fv5-M83 лучше в обеспечении нейтрализации связанного с мембраной и растворимого рецепторов IL-6, чем тоцилизумаб и контроль. Из них Fv3-M73 и Fv4-M73 заметно лучше в обеспечении нейтрализации. Между тем Fv5-M83 подавляло CRP и несвязанный растворимый рецептор IL-6 яванского макака сильнее, чем Fv3-M73 и Fv4-M73. Поэтому полагают, что Fv5-M83 сильнее Fv3-M73, Fv4-M73 и контроля (известного антитела против рецептора IL-6 с высокой аффинностью) в нейтрализации связанного с мембраной и растворимого рецепторов IL-6. Считалось, что результаты in vivo, полученные при использовании яванских макак, являются отражением более высокой аффинности Fv5-M83 в отношении рецептора IL-6 и большей биологической активности Fv5-M83 в системе анализа BaF/gp130, чем контроль.
Эти факты говорят о том, что Fv3-M73 и Fv4-M73 значительно лучше в обеспечении своих активностей в качестве нейтрализующего рецептор IL-6 антитела, чем тоцилизумаб и контроль и, следовательно, предоставляют возможность значительно снизить дозу и частоту введения. Кроме того, установлено, что Fv5-M83 заметно лучше по показателю степени активности в качестве нейтрализующего рецептор IL-6 антитела, а также обеспечения своей активности. Поэтому ожидают, что Fv3-M73, Fv4-M73 и Fv5-M83 будут полезны в качестве лекарственных средств - антагонистов IL-6.
[Ссылочный пример]
Приготовление растворимого рекомбинантного рецептора IL-6 яванского макака (cIL-6R)
Праймеры в виде олиго-ДНК получали на основе опубликованной последовательности гена рецептора IL-6 макака-резус (Birney et al., Ensembl 2006, Nucleic Acids Res. 2006 Jan 1; 34 (Database issue): D556-61). ДНК-фрагмент, кодирующий целый ген рецептора IL-6 яванского макака, получали с помощью ПЦР, используя праймеры и, в качестве матрицы, кДНК, приготовленную из поджелудочной железы яванского макака. Получаемый в результате ДНК-фрагмент встраивали в вектор для экспрессии в клетках животных, и, используя вектор, получали линию клеток CHO с устойчивой экспрессией (линию cyno.sIL-6R-продуцирующих клеток CHO). Среду от культивирования cyno.sIL-6R-продуцирующих клеток CHO подвергали очистке, используя колонку HisTrap (GE Healthcare Bioscience), и затем концентрировали с использованием Amicon Ultra-15 Ultracel-10k (Millipore). Конечный очищенный образец растворимого рецептора IL-6 яванского макака (в дальнейшем cIL-6R) получали благодаря дальнейшей очистке на колонке для гель-фильтрации Superdex200pg16/60 (GE Healthcare Bioscience).
Приготовление рекомбинантного IL-6 яванского макака (cIL-6)
IL-6 яванского макака готовили описанным ниже способом. Нуклеотидную последовательность, кодирующую 212 аминокислоты, депонированную под входящим № в SWISSPROT - P79341, получали и клонировали в вектор для экспрессии в клетках животных. Получаемый в результате вектор вводили в клетки CHO для получения линии клеток с устойчивой экспрессией (линии cyno.IL-6-продуцирующих клеток CHO). Среду от культивирования cyno.sIL-6R-продуцирующих клеток CHO подвергали очистке, используя колонку SP-Sepharose/FF (GE Healthcare Bioscience), и затем концентрировали с использованием Amicon Ultra-15 Ultracel-10k (Millipore). Конечный очищенный образец IL-6 яванского макака (в дальнейшем cIL-6) получали благодаря дальнейшей очистке на колонке для гель-фильтрации Superdex75pg26/60 (GE Healthcare Bioscience) с последующей концентрацией с использованием Amicon Ultra-15 Ultracel-5k (Millipore).
Приготовление известного антитела против рецептора IL-6 с высокой аффинностью
Вектор для экспрессии в клетках животных конструировали для экспрессии hIgG1 VQ8F11-21, известного антитела против рецептора IL-6 с высокой аффинностью. hIgG1 VQ8F11-21 описывается в US 2007/0280945 A1 (US 2007/0280945 A1; аминокислотные последовательности H-цепи и L-цепи определены в SEQ ID NO: 19 и 27 соответственно). Вариабельную область антитела конструировали с помощью ПЦР, используя комбинацию синтетических олиго-ДНК (совокупности ПЦР). IgG1 использовали в качестве константной области. Вариабельные и константные области антитела объединяли вместе с помощью совокупности ПЦР и затем встраивали в вектор для экспрессии в клетках животных для конструирования вектора для экспрессии представляющих интерес H-цепи и L-цепи. Нуклеотидные последовательности получаемых в результате экспрессионных векторов определяли с помощью известного квалифицированным в данной области техники специалистам способа. Антитело против рецептора IL-6 с высокой аффинностью (в дальнейшем сокращенно «контроль») экспрессировали и очищали, используя сконструированные экспрессионные векторы, с помощью описанного в примере 1 способа.
Оценка биологической активности с использованием экспрессирующих gp130 человека клеток BaF3 (BaF/gp130)
Нейтрализующую рецептор IL-6 активность определяли, используя клетки BaF3/gp130, которые пролиферируют зависимым от IL-6/рецептора IL-6 образом. После трех промывок средой RPMI1640, дополненной 10% FBS, клетки BaF3/gp130 суспендировали при 5×104 клеток/мл в RPMI1640, дополненной 600 нг/мл или 60 нг/мл интерлейкина-6 человека (TORAY) (конечная концентрация 300 нг/мл или 30 нг/мл соответственно), соответствующим количеством рекомбинантного растворимого рецептора IL-6 человека (SR344) и 10% FBS. Суспензии клеток распределяли (50 мкл/лунку) по 96-луночным планшетам (CORNING). Затем очищенные антитела разбавляли RPMI1640, содержащей 10% FBS, и добавляли в каждую лунку (50 мкл/лунку). Клетки культивировали при 37οC в 5% CO2 в течение трех дней. Реагент WST-8 (Cell Counting Kit-8; Dojindo Laboratories) двукратно разбавляли PBS. Немедленно после этого в каждую лунку добавляли 20 мкл реагента, измеряли оптическую плотность при 450 нм (контрольная длина волны: 620 нм), используя SUNRISE CLASSIC (TECAN). После культивирования в течение двух часов снова измеряли оптическую плотность при 450 нм (контрольная длина волны: 620 нм). Нейтрализующую рецептор IL-6 активность определяли, используя изменение оптической плотности в течение двух часов в качестве показателя.
Основанный на Biacore анализ связывания с рецептором IL-6
Кинетику реакции взаимодействия антигена с антителом анализировали, используя Biacore T100 (GE Healthcare). Взаимодействие SR344-антитело определяли с помощью иммобилизации соответствующих количеств анти-IgG (специфичных для γ-цепи) F(ab')2 на сенсорном чипе с помощью способа соединения взаимодействием с аминами, связывания представляющих интерес антител на чипе при pH 7,4 и затем пропускания рецептора IL-6 - SR344, установленного до различных концентраций при pH 7,4, над чипом в качестве аналита. Все измерения проводили при 37οC. Кинетические параметры, константу скорости ассоциации ka (1/Ms) и константу скорости диссоциации kd (1/сек) рассчитывали из сенсорограмм, полученных при измерении. Затем на основе констант скоростей определяли KD (M). Соответствующие параметры определяли, используя программное обеспечение для оценки Biacore T100 (GE Healthcare).
Анализ PK/PD для определения концентраций антител, CRP и несвязанного растворимого рецептора IL-6 в плазме макак
Концентрацию в плазме яванских макак определяли с помощью ELISA, используя известный квалифицированным в данной области техники специалистам способ.
Концентрацию CRP определяли с использованием автоматического анализатора (TBA-120FR; Toshiba Medical Systems Co.), используя CRP Cias R (KANTO CHEMICAL CO., INC.).
Концентрацию несвязанного растворимого рецептора IL-6 яванского макака в плазме яванских макак определяли описанным ниже способом. Все антитела типа IgG (IgG яванского макака, антитело против рецептора IL-6 человека и комплекс антитело против рецептора IL-6 человека-растворимый рецептор IL-6 яванского макака) в плазме адсорбировали на белке A с помощью загрузки 30 мкл плазмы яванского макака на соответствующее количество смолы Sepharose Fast Flow (GE Healthcare) с рекомбинантным белком А, обезвоженной в чашке 0,22-мкм фильтра (Millipore). Затем раствор в чашке осаждали, используя высокоскоростную центрифугу, для сбора проходящего раствора. Проходящий раствор не содержит комплекс белок A-связанное антитело против рецептора IL-6-растворимый рецептор IL-6 яванского макака. Следовательно, концентрацию несвязанного растворимого рецептора IL-6 можно определить, измеряя концентрацию растворимого рецептора IL-6 яванского макака в растворе, который прошел сквозь белок A. Концентрацию растворимого рецептора IL-6 яванского макака определяли, используя известный квалифицированным в данной области техники специалистам способ определения концентраций растворимого рецептора IL-6 человека. В качестве стандарта использовали растворимый рецептор IL-6 яванского макака (cIL-6R), приготовленный, как описано выше.
Затем процент нейтрализации растворимого рецептора IL-6 рассчитывали по следующей формуле:

Промышленная применимость
Настоящим изобретением предоставляются константные области антител, подходящие для лекарственных средств, физико-химические свойства (стабильность и гомогенность), иммуногенность, безопасность и фармакокинетика которых улучшены с помощью изменения аминокислот.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДИФИЦИРОВАННАЯ КОНСТАНТНАЯ ОБЛАСТЬ АНТИТЕЛА | 2023 |
|
RU2837820C2 |
| МОДИФИЦИРОВАННАЯ КОНСТАНТНАЯ ОБЛАСТЬ АНТИТЕЛА | 2021 |
|
RU2797273C2 |
| МОЛЕКУЛЫ АНТИТЕЛ С УЛУЧШЕННЫМИ СВОЙСТВАМИ | 2009 |
|
RU2430111C1 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, СПОСОБНАЯ К МНОГОКРАТНОМУ СВЯЗЫВАНИЮ ДВУХ ИЛИ БОЛЕЕ МОЛЕКУЛ АНТИГЕНА | 2014 |
|
RU2756029C2 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, СПОСОБНАЯ К МНОГОКРАТНОМУ СВЯЗЫВАНИЮ ДВУХ ИЛИ БОЛЕЕ МОЛЕКУЛ АНТИГЕНА | 2021 |
|
RU2841525C2 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ, СОДЕРЖАЩИЙ МОЛЕКУЛЫ АНТИТЕЛ С УЛУЧШЕННЫМИ СВОЙСТВАМИ | 2010 |
|
RU2565809C2 |
| АНТИТЕЛО ПРОТИВ NR10 И ЕГО ПРИМЕНЕНИЕ | 2008 |
|
RU2531521C2 |
| АНТИТЕЛО ПРОТИВ NR10 И ЕГО ПРИМЕНЕНИЕ | 2009 |
|
RU2487136C2 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, СПОСОБНАЯ К МНОГОКРАТНОМУ СВЯЗЫВАНИЮ ДВУХ ИЛИ БОЛЕЕ МОЛЕКУЛ АНТИГЕНА | 2009 |
|
RU2571225C2 |
| Антитела со сниженным связыванием с технологическими примесями | 2017 |
|
RU2771330C2 |































































































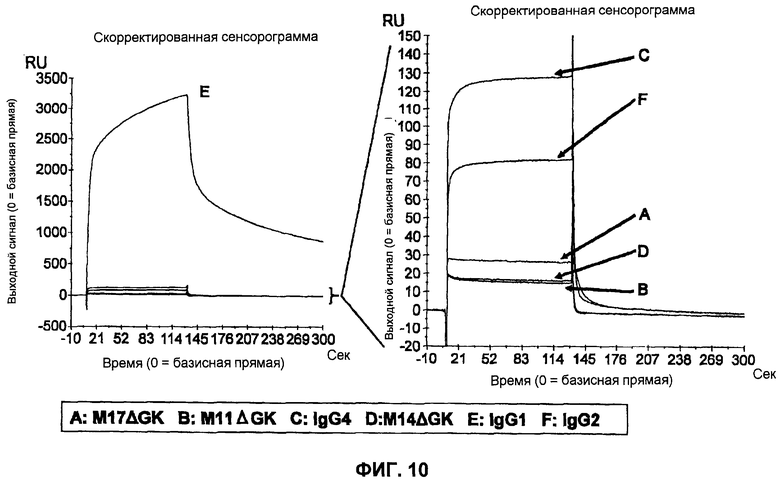
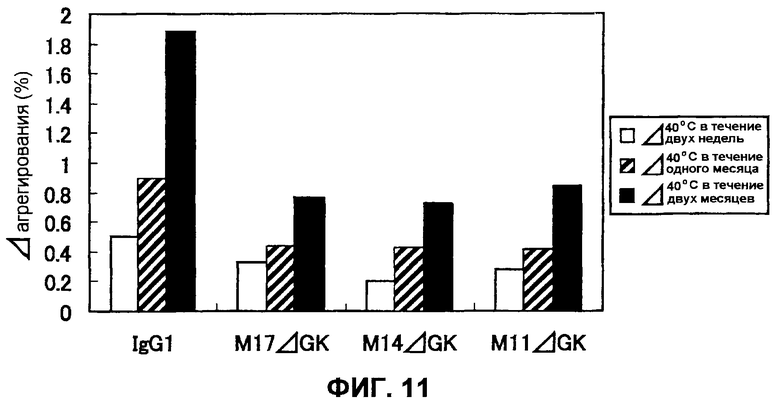




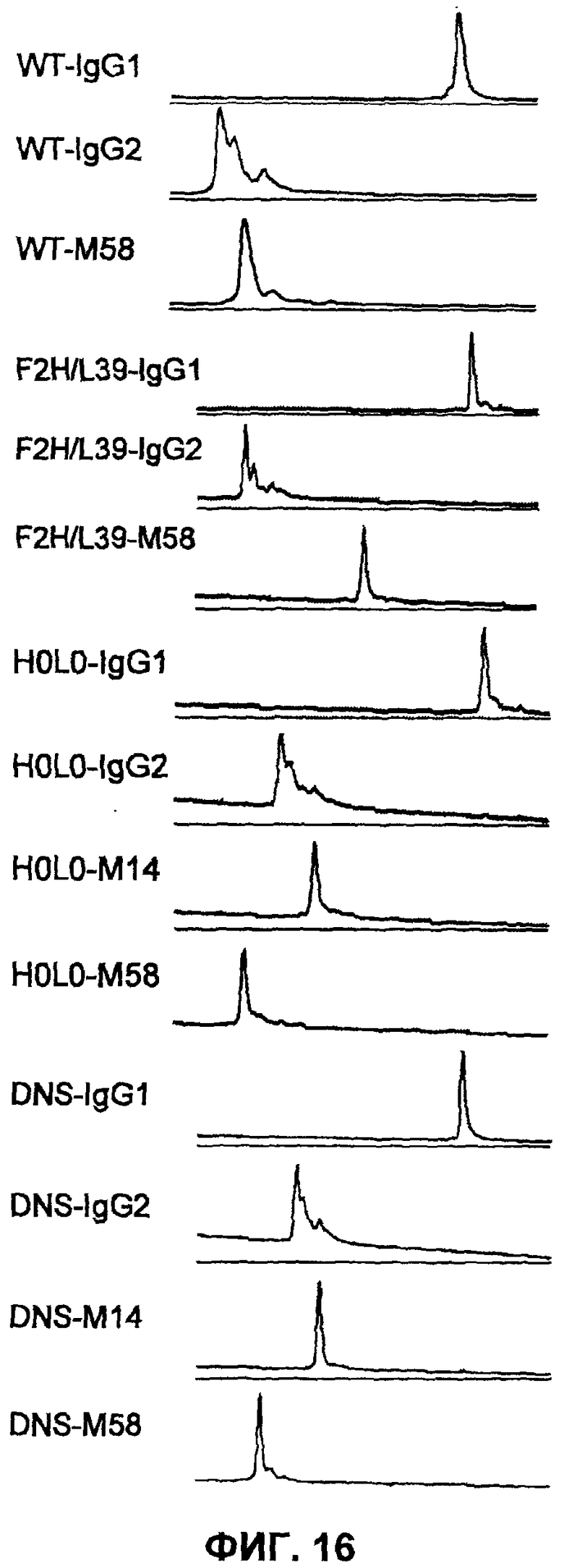
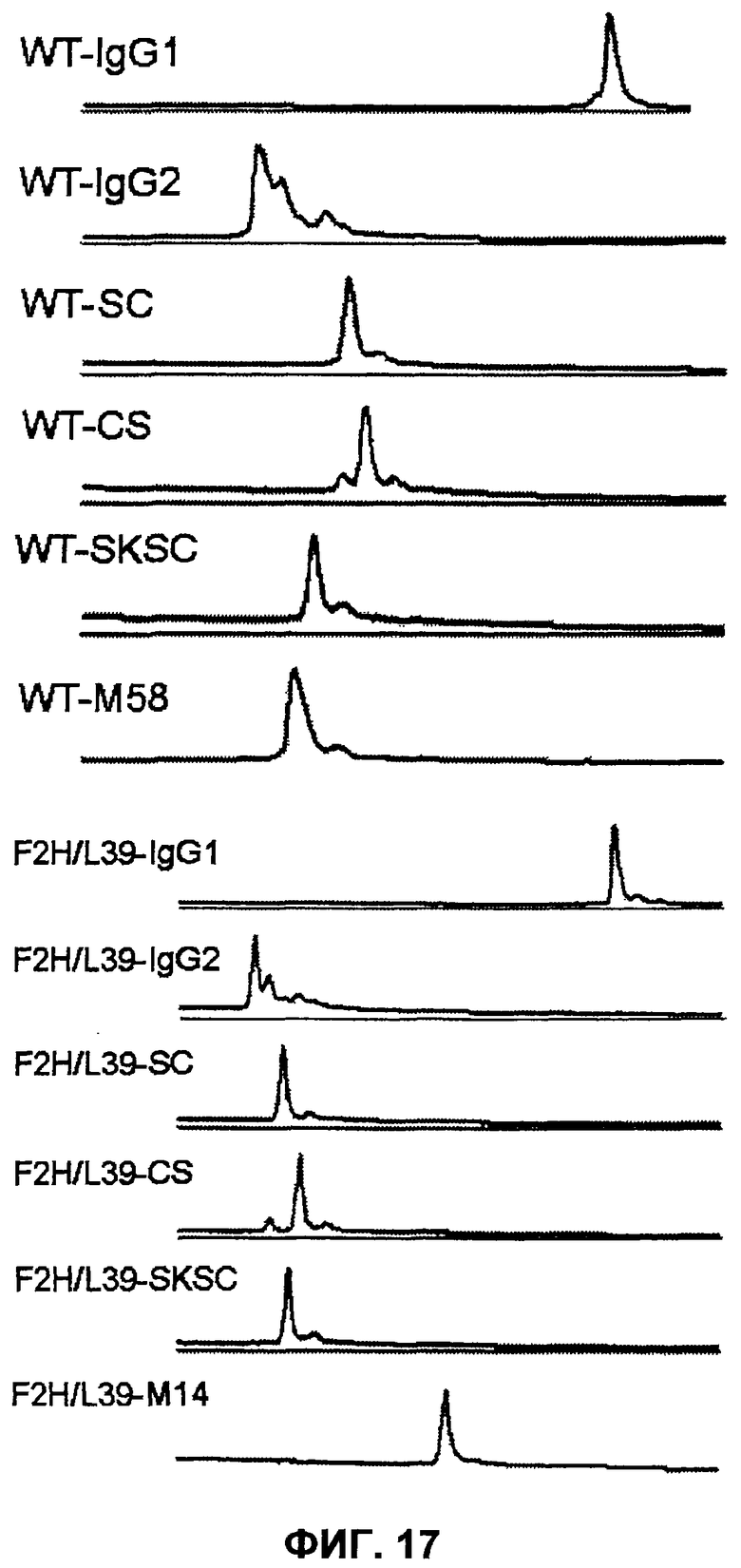
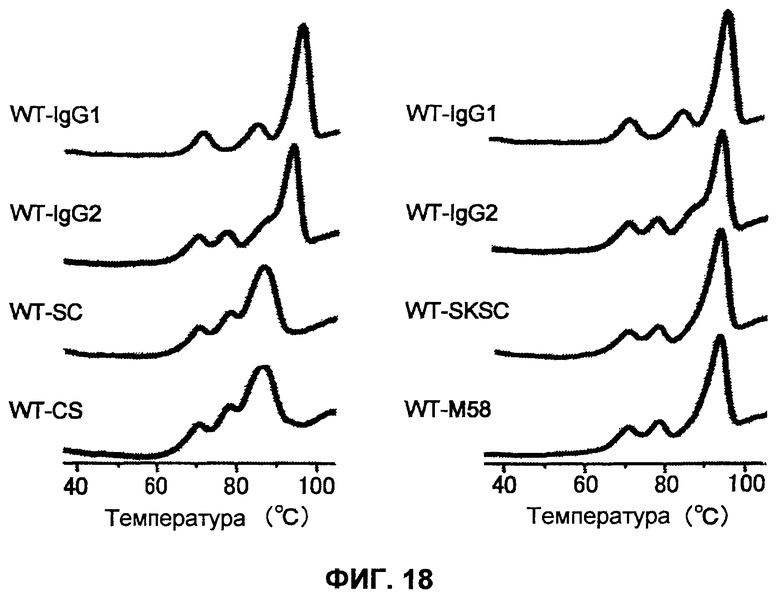
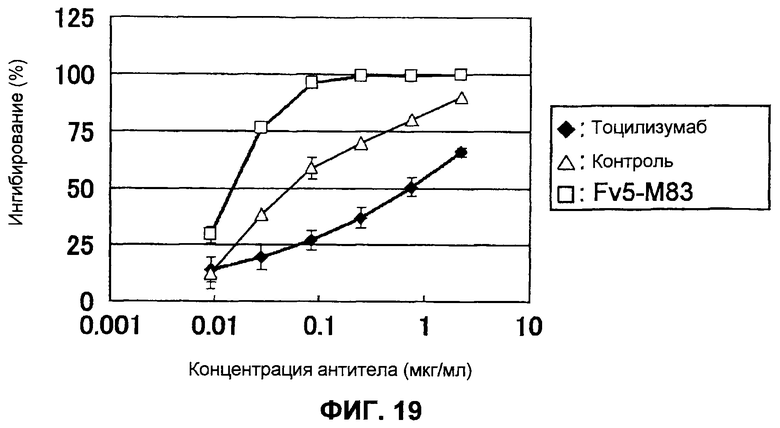





Изобретение относится к области биотехнологии и иммунологии. Предложены различные варианты антител со сниженной гетерогенностью, возникающей из С-конца Н-цепи, что увеличивает их стабильность при высоких концентрациях. Предложенные антитела обладают улучшенными физико-химическими свойствами (стабильностью и гомогенностью), иммуногенностью, безопасностью и фармакокинетикой. 15 н.п. ф-лы, 24 ил., 5 табл., 12 пр.
1. Константная область тяжелой цепи антитела IgG человека со сниженной С-концевой гетерогенностью, выбираемая из:
(a) константной области тяжелой цепи антитела IgG1 человека, которая включает как делецию Gly в положении 329 (положении 446 в Европейской системе нумерации), так и делецию Lys в положении 330 (положении 447 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO:1;
(b) константной области тяжелой цепи антитела IgG2 человека, которая включает как делецию Gly в положении 325 (положении 446 в Европейской системе нумерации), так и делецию Lys в положении 326 (положении 447 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO:2; и
(c) константной области тяжелой цепи антитела IgG4 человека, которая включает как делецию Gly в положении 326 (положении 446 в Европейской системе нумерации), так и делецию Lys в положении 327 (положении 447 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO:3.
2. Константная область тяжелой цепи IgG2 человека со сниженной С-концевой гетерогенностью, в которой аминокислоты в положениях 209 (положение 330 в Европейской системе нумерации), 210 (положение 331 в Европейской системе нумерации), 218 (положение 339 в Европейской системе нумерации), 276 (положение 397 в Европейской системе нумерации), 14 (положение 131 в Европейской системе нумерации), 16 (положение 133 в Европейской системе нумерации), 102 (положение 219 в Европейской системе нумерации), 20 (положение 137 в Европейской системе нумерации) и 21 (положение 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO:2 заменены другими аминокислотами и которая дополнительно содержит как делецию Gly в положении 325 (положение 446 в Европейской системе нумерации), так и делецию Lys в положении 326 (положение 447 в Европейской системе нумерации).
3. Константная область тяжелой цепи IgG2 человека со сниженной С-концевой гетерогенностью, в которой аминокислоты в положениях 276 (положение 397 в Европейской системе нумерации), 14 (положение 131 в Европейской системе нумерации), 16 (положение 133 в Европейской системе нумерации), 102 (положение 219 в Европейской системе нумерации), 20 (положение 137 в Европейской системе нумерации) и 21 (положение 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO:2 заменены другими аминокислотами и которая дополнительно содержит как делецию Gly в положении 325 (положение 446 в Европейской системе нумерации), так и делецию Lys в положении 326 (положение 447 в Европейской системе нумерации).
4. Константная область тяжелой цепи IgG2 человека со сниженной С-концевой гетерогенностью, в которой Cys в положении 14 (положение 131 в Европейской системе нумерации), Arg в положении 16 (положение 133 в Европейской системе нумерации), Cys в положении 102 (положение 219 в Европейской системе нумерации), Glu в положении 20 (положение 137 в Европейской системе нумерации), Ser в положении 21 (положение 138 в Европейской системе нумерации), His в положении 147 (положение 268 в Европейской системе нумерации), Arg в положении 234 (положение 355 в Европейской системе нумерации) и Gln в положении 298 (положение 419 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO:2 заменены другими аминокислотами и которая дополнительно содержит как делецию Gly в положении 325 (положение 446 в Европейской системе нумерации), так и делецию Lys в положении 326 (положение 447 в Европейской системе нумерации).
5. Константная область тяжелой цепи IgG2 человека со сниженной С-концевой гетерогенностью, в которой Cys в положении 14 (положение 131 в Европейской системе нумерации), Arg в положении 16 (положение 133 в Европейской системе нумерации), Cys в положении 102 (положение 219 в Европейской системе нумерации), Glu в положении 20 (положение 137 в Европейской системе нумерации), Ser в положении 21 (положение 138 в Европейской системе нумерации), His в положении 147 (положение 268 в Европейской системе нумерации), Arg в положении 234 (положение 355 в Европейской системе нумерации), Gln в положении 298 (положение 419 в Европейской системе нумерации) и Asn в положении 313 (положение 434 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO:2 заменены другими аминокислотами и которая дополнительно содержит как делецию Gly в положении 325 (положение 446 в Европейской системе нумерации), так и делецию Lys в положении 326 (положение 447 в Европейской системе нумерации).
6. Константная область тяжелой цепи IgG2 человека со сниженной С-концевой гетерогенностью, в которой Ala в положении 209 (положение 330 в Европейской системе нумерации), Pro в положении 210 (положение 331 в Европейской системе нумерации), Thr в положении 218 (положение 339 в Европейской системе нумерации), Cys в положении 14 (положение 131 в Европейской системе нумерации), Arg в положении 16 (положение 133 в Европейской системе нумерации), Cys в положении 102 (положение 219 в Европейской системе нумерации), Glu в положении 20 (положение 137 в Европейской системе нумерации) и Ser в положении 21 (положение 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO:2 заменены другими аминокислотами и которая дополнительно содержит как делецию Gly в положении 325 (положение 446 в Европейской системе нумерации), так и делецию Lys в положении 326 (положение 447 в Европейской системе нумерации).
7. Константная область тяжелой цепи IgG2 человека со сниженной С-концевой гетерогенностью, в которой Cys в положении 14 (положение 131 в Европейской системе нумерации), Arg в положении 16 (положение 133 в Европейской системе нумерации), Cys в положении 102 (положение 219 в Европейской системе нумерации), Glu в положении 20 (положение 137 в Европейской системе нумерации) и Ser в положении 21 (положение 138 в Европейской системе нумерации) в аминокислотной последовательности SEQ ID NO:2 заменены другими аминокислотами и которая дополнительно содержит как делецию Gly в положении 325 (положение 446 в Европейской системе нумерации), так и делецию Lys в положении 326 (положение 447 в Европейской системе нумерации).
8. Константная область тяжелой цепи антитела IgG2 человека со сниженной С-концевой гетерогенностью, содержащая аминокислотную последовательность SEQ ID NO:5.
9. Константная область тяжелой цепи антитела IgG2 человека с повышенной устойчивостью в кислотных условиях, со сниженной гетерогенностью в шарнирной области и со сниженной С-концевой гетерогенностью, содержащая аминокислотную последовательность SEQ ID NO:7.
10. Константная область тяжелой цепи антитела IgG4 человека со сниженной С-концевой гетерогенностью, содержащая аминокислотную последовательность SEQ ID NO:9.
11. Константная область тяжелой цепи антитела IgG2 человека со сниженной С-концевой гетерогенностью, содержащая аминокислотную последовательность SEQ ID NO:35.
12. Константная область тяжелой цепи антитела IgG2 человека со сниженной С-концевой гетерогенностью, содержащая аминокислотную последовательность SEQ ID NO:37.
13. Константная область тяжелой цепи антитела IgG1 человека со сниженной С-концевой гетерогенностью, содержащая аминокислотную последовательность SEQ ID NO:43.
14. Константная область тяжелой цепи антитела IgG2 человека со сниженной С-концевой гетерогенностью, содержащая аминокислотную последовательность SEQ ID NO:57 (M40ΔGK).
15. Константная область тяжелой цепи антитела IgG2 человека со сниженной С-концевой гетерогенностью, содержащая аминокислотную последовательность SEQ ID NO:55 (M86ΔGK).
| Вагонетка для кабельной висячей дороги, переносной радиально вокруг центральной опоры | 1920 |
|
SU243A1 |
| Architectural features can influence synthesis of its oligosaccharide chains and affect superoxide production triggered through human Fcgamma receptor I" EUROPEAN JOURNAL OF BIOCHEMISTRY, BLACKWELL PUBLISHING, BERLIN, DE LNKD- | |||
Авторы
Даты
2014-08-20—Публикация
2008-09-26—Подача