Изобретение относится к ветеринарной медицине, в частности к патологической морфологии, и может быть использовано в ветеринарной практике при проведении прижизненной диагностики инфекционной анемии цыплят.
Инфекционная анемия цыплят (ИАЦ, цирковирусная инфекция, «синее крыло») - высококонтагиозная вирусная болезнь птиц раннего возраста, характеризующаяся поражением кроветворной и иммунной систем, серозно-геморрагическими отеками подкожной клетчатки, кровоизлияниями и некрозами кожи [3]. Данная болезнь впервые была зарегистрирована в Японии в 1979 году [1]. В настоящее время вспышки инфекционной анемии регистрируются во многих странах с развитым птицеводством, в том числе и в России [3, 5]. Инфекционная анемия наносит значительный экономический ущерб, который обусловлен гибелью птицы, низкими приростами и оплатой корма, снижением категорийности тушек, повышенной выбраковкой, расходами на лечение вторичных инфекций и проведение соответствующих ветеринарно-санитарных мероприятий.
Проявление болезни у цыплят чаще всего является следствием первичного инфицирования серонегативных родителей в начале или на пике яйценоскости. При этом у кур-несушек болезнь клинически не проявляется, сохраняются высокие показатели яйценоскости, оплодотворяемости и выводимости инкубационных яиц. Однако в течение 3-6 недель инкубационное яйцо, полученное от инфицированного поголовья, служит потенциальным источником заражения потомства. За этот период у инфицированных родителей вырабатывается достаточное количество антител к вирусу ИАЦ, которые препятствуют дальнейшей вертикальной передаче возбудителя [7, 13]. Цыплята с пассивным иммунитетом устойчивы как к экспериментальному, так и естественному заражению вирусом ИАЦ при условии, если у них отсутствуют признаки иммуносупрессии, вызванные действием других вирусов [12]. Кроме того, инфекционная анемия очень часто протекает в ассоциации с другими вирусными инфекциями с развитием тяжелого комбинированного иммунодефицита [13, 14, 17]. В таких случаях доминируют морфологические признаки осложняющих болезней - инфекционной бурсальной болезни (ИББ), а также реовирусной инфекции. В результате своевременная диагностика инфекционной анемии оказывается весьма затруднительной [6].
Известны способы диагностики инфекционной анемии цыплят, основанные на использовании различных лабораторных тестов [6, 8, 9, 11, 13]. Способы выделения и идентификации вируса инфекционной анемии цыплят имеют недостатки, прежде всего связанные с недостаточной чувствительностью (иммунофлуоресцентный метод), большой длительностью, трудоемкостью, неуниверсальностью процедуры (культуральный метод). Выявление антител к вирусам в сыворотке цыплят с помощью твердофазного ИФА является ретроспективным методом (выявляет не самого возбудителя, а регистрирует ответ организма на инфекцию). Выявление методом ИФА вирусного антигена в биологических образцах ограничено недостаточной чувствительностью. Следовательно, традиционные методы, в силу перечисленных ограничений, не позволяют своевременно и с высокой чувствительностью выявлять вируса инфекционной анемии цыплят в исследуемых образцах.
В настоящее время для диагностики инфекционной анемии цыплят используют полимеразная цепная реакция (ПЦР), для выполнения которой (помимо одинаковых для всех ПНР наборов реагентов, отличающихся высокой стоимостью) при диагностике определенной инфекции необходимо наличие специфических праймеров. Обычно эти короткие олигонуклеотиды, длиной порядка двадцати оснований, получаемые в результате химического синтеза. Они комплементарны искомой ДНК-мишени, гибридизуются с ней, а затем копируются полимеразой. Однако ПЦР имеет неоспоримые недостатки, заключающиеся в ряде его преимуществ. И в первую очередь, высокая чувствительность метода (позволяет выявить всего лишь одну молекулу нуклеиновой кислоты в пробе) нередко приводит к получению ложноположительного результата, связанного либо с персистенцией вирусов, либо с контаминацией образцов на разных этапах диагностического процесса (забор материала, хранение и транспортировка, пробоподготовка и т.д.) [15, 16]. Поэтому ПЦР требует для своего выполнения несколько специальных помещений для разделения разных этапов диагностического процесса, снабженных отдельными комплектами оборудования, материалов, лабораторной одежды. Во-вторых, спектр применения ПЦР в условиях практической ветеринарии пока ограничивается и достаточно высокой стоимостью препаратов, квалификацией исследователей и необходимостью специального оборудования.
Наиболее близким решением, принятым за прототип, является известный способ диагностики инфекционной анемии цыплят, основанный на выявлении морфологических изменений в органах и тканей больной и павшей птицы [10]. Метод включает в себе отбор кусочков органов, фиксация их в 10%-ном растворе формалина, обезвоживание в этиловом спирте, заключение в парафин. Объектами для оценки морфологических изменений служат гистосрезы органов и тканей, окрашенные гематоксилин-эозином. Критериями для постановки диагноза на ИАЦ по морфологическим изменениям являются: резкое уменьшение гемоцитопоэтических и увеличение числа жировых клеток в костном мозге, наличие в кроветворных клетках внутриядерных базофильных включений, атрофия и делимфатизация паренхимы тимуса, фабрициевой бурсы, селезенки, слепокишечных миндалин, апоптоз гепатоцитов печени. Результаты гистологического исследования сочетаются с данными патологоанатомического вскрытия (общая анемия, гидремия, аплазия и ожирение костного мозга, атрофия тимуса и бурсы Фабрициуса, острая венозная гиперемия кожи в области крыльев - «синее крыло») и дополняются результатами гематологического исследования (панцитопения, снижение уровня гемоглобина, уменьшение показателей гематокрита).
Диагностика болезни известным способом, предусматривающим анализ гистологических срезов, является трудоемкой и занимает достаточно длительный срок, необходима квалификация и опыт исследователя. Кроме того, и главное: перечисленные выше морфологические признаки характерны для острого (классического) течения инфекционной анемии, которое проявляется у восприимчивых цыплят до 14-дневного возраста и не позволяет диагностировать скрытое течение инфекции.
Выбранный нами способ выявления специфических апоптозных телец в мазках крови и пунктата костного мозга больных цыплят ранее не использовался для диагностики инфекционной анемии цыплят, так как явление вирусиндуцированного апоптоза при латентном течении болезни ранее не было описано.
Цель изобретения - разработка способа прижизненной диагностики латентного течения инфекционной анемии цыплят, включающего морфологическую оценку мазков крови и пунктата костного мозга больных цыплят, отличающего тем, что выявляют вирусиндуцированные апоптозные тельца, и при наличии в поле зрения 3-5 и более апоптозных телец ставят диагноз на инфекционную анемию цыплят.
Технический результат изобретения заключается в проведении анализа на наличие в мазках крови и пунктата костного мозга больных цыплят специфических апоптозных телец в световом микроскопе.
Нами были проведены предварительные исследования по изучению морфологической картины крови и пунктата костного мозга птиц, инфицированных и неинфицированных вирусом ИАЦ. Инфицированность цыплят вирусом ИАЦ определяли в ПЦР. Исследования показали, что морфологические показатели у инфицированных и неинфицированных цыплят имели достоверные различия, характеризующиеся с выявлением вирусиндуцированных апоптозных телец у инфицированных цыплят.
Способ осуществляется следующим образом. У больной или с подозрением на болезнь птицы осуществляют забор проб крови из Крыловой вены, а пунктат костного мозга - из верхней части диафиза плюсневозаплюсневой кости с латеральной ее поверхности, готовят мазки на тонких обезжиренных предметных стеклах, высушивают на воздухе, фиксируют в метаноле и окрашивают по Романовскому-Гимза [2, 4]. Изучение мазков проводят в световом микроскопе с использованием иммерсионного объектива с большим увеличением.
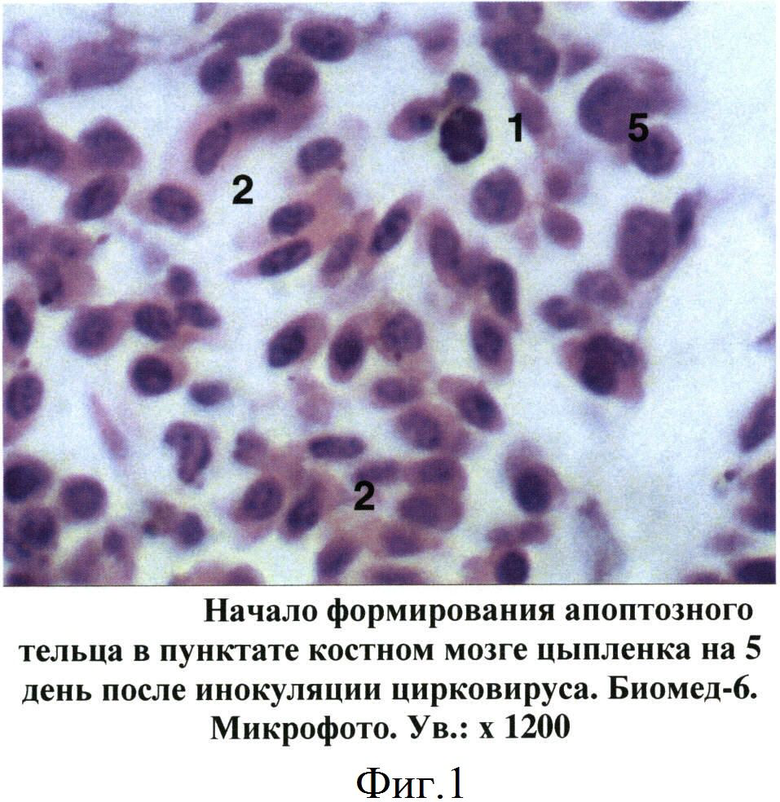
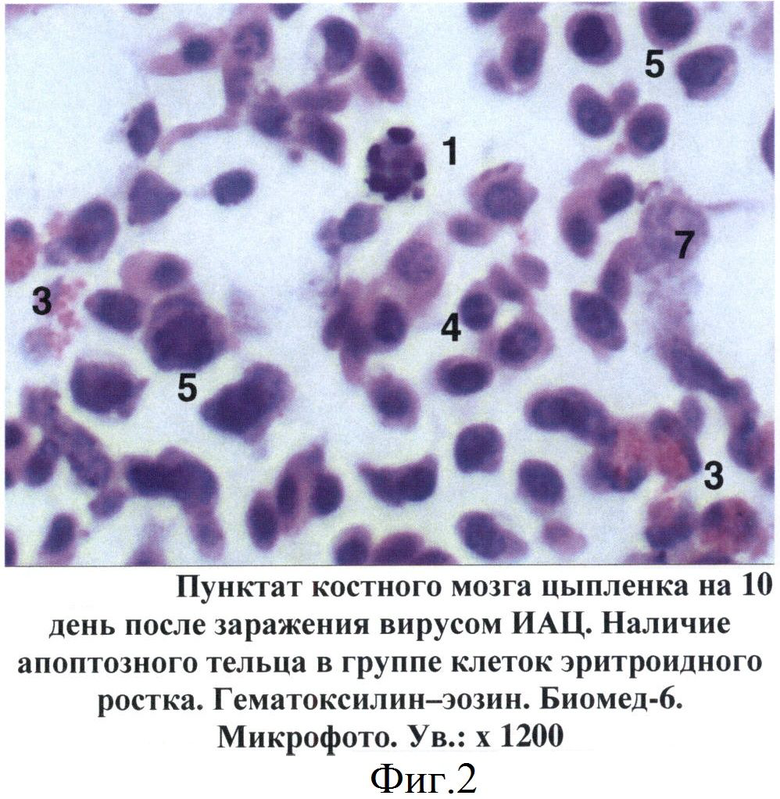
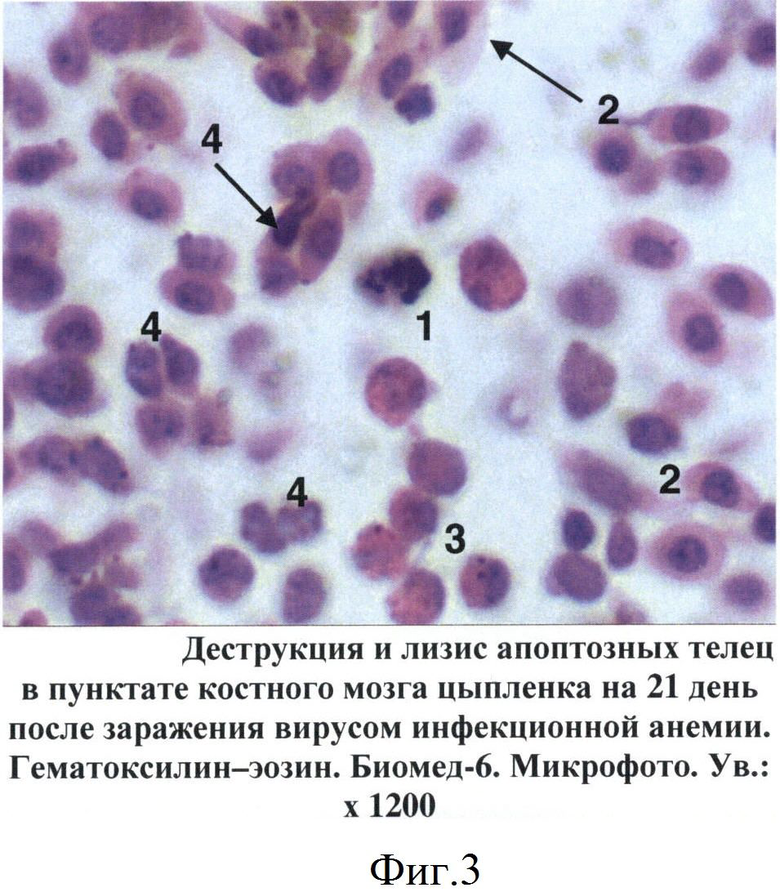
При изучении пунктатов костного мозга, полученных от больных цыплят, установлен ряд специфических изменений, не зависимо от состояния птицы, которые послужили критериями для постановки диагноза на ИАЦ. Так, уже на 5 день после заражения в гистологических срезах костного мозга цыплят отмечены признаки апоптоза гемопоэтических клеток, относящихся главным образом к эритроидному и гранулоцитарному росткам кроветворения. Вначале в пораженных клетках происходила конденсация и маргинация хроматина в ядре, которое становилось изрезанным или фрагментированным (фиг.1). В последующем (на 7-14 дни после заражения) отмечалось сморщивание клеток и образование апоптозных телец, состоящих из фрагментов цитоплазмы и ядра. При световой микроскопии сформированные апоптозные тельца имели вид округлых или овальных частиц с оксифильной цитоплазмой и темно-синими фрагментами хроматина ядра (фиг.2). В более поздние сроки отмечены деструкция и лизис апоптозных телец (фиг.3).
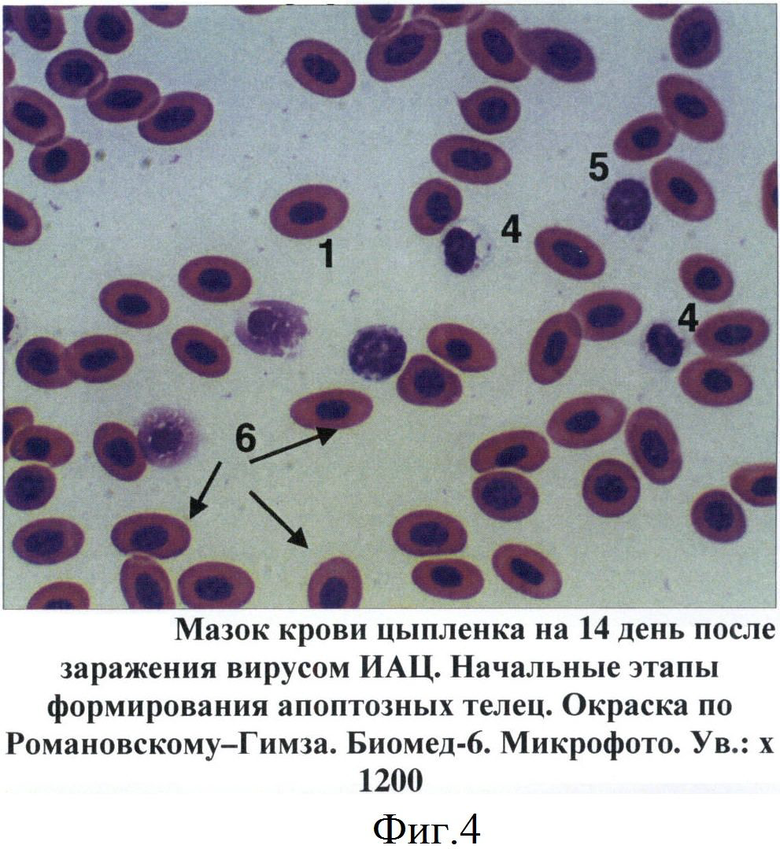
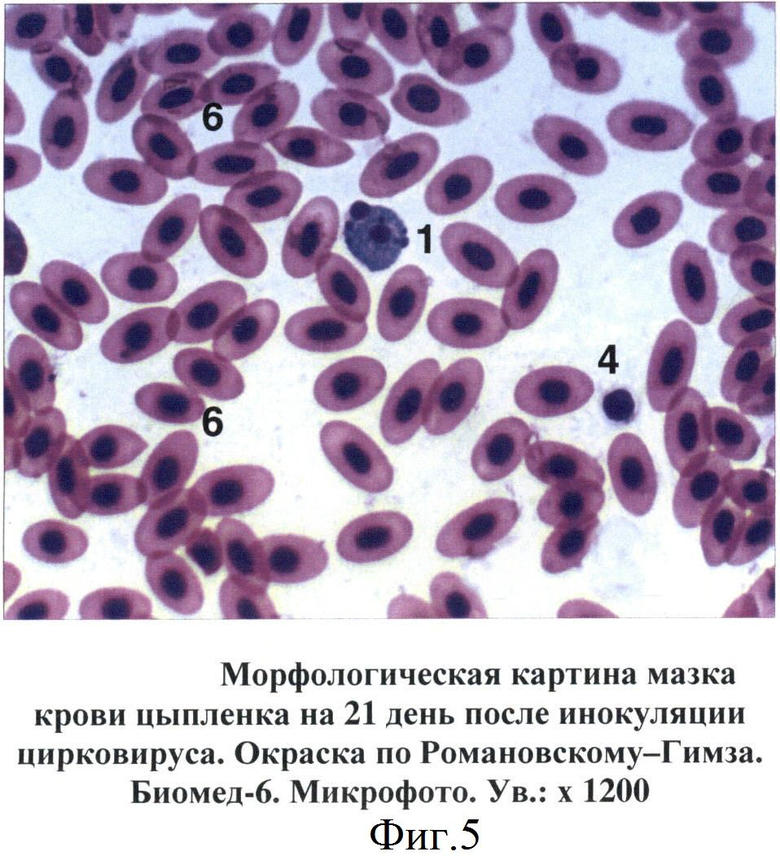
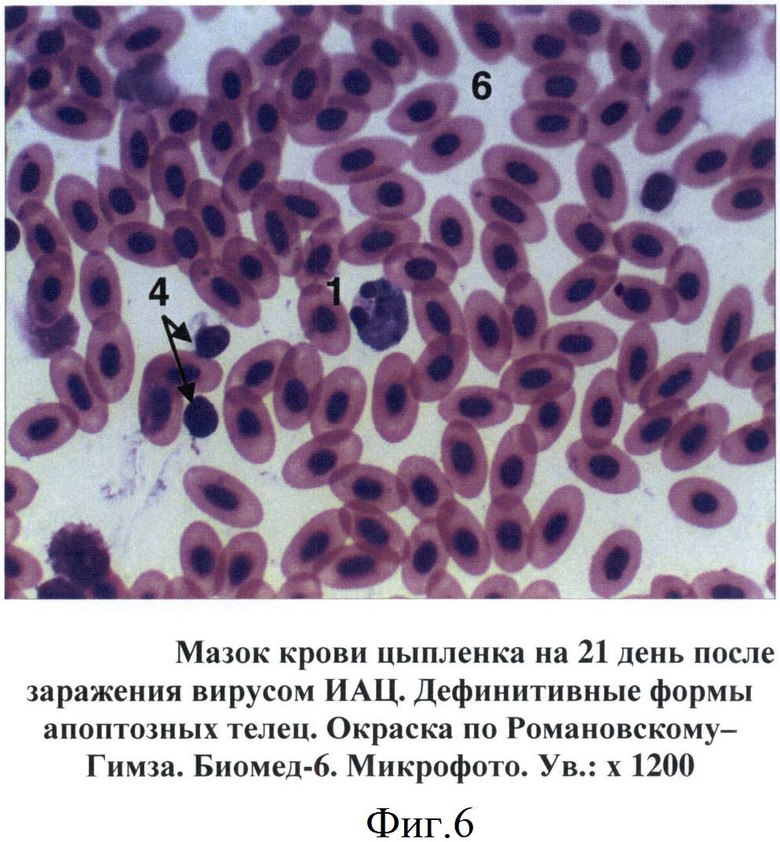
В мазках крови птиц апоптозные тельца выявлялись на 7-14 дни после инокуляции вируса ИАЦ. Вначале они представляли собой сферические образования диаметром от 6 до 10 мкм. Цитоплазма просматривалась в виде тонкого неравномерного ободка, отличалась базофильностью, окрашиваясь в цвета от светло-голубого до темно-синего (фиг.4). Большую часть таких образований занимало ядро с фрагментированным хроматином. Дефинитивные формы апоптозных телец представляли собой более крупные структуры округло-овальной формы. Цитоплазма таких телец была слабо базофильной. Фрагменты ядра отличались выраженной базофильностью, имели округлую форму, размеры варьировали от 0,4 до 2-3 мкм (фиг.5, 6).
Пример 1. Птицепредприятие мясного направления. Согласно анамнестическим данным в хозяйстве наблюдается повышение заболеваемости и падежа птиц различных возрастных групп. У цыплят с 14-дневного возраста отмечалось отставание в росте и развитии, взъерошенность перьевого покрова, апатия, общая анемия. Данные патологоанатомического вскрытия: постовариальная гипотрофия, дистрофия печени и почек, острая венозная гиперемия легких, признаки анемии.
Для оценки эффективности предлагаемого способа прижизненной диагностики инфекционной анемии в трех корпусах, где содержится птица 15, 25 и 35 дневного возраста из общего стада для исследования произвольно (по принципу случайной выборки) отобрали по 10 голов в каждой группе.
Индивидуально у цыплят осуществляли забор крови из Крыловой вены а также пунктат костного мозга из верхней части диафиза плюсно заплюсневой кости с латеральной ее поверхности. Затем готовили по 3 мазка от каждого цыпленка на обезжиренных предметных стеклах, высушивали на воздухе, фиксировали в метаноле и окрашивали по Романовскому-Гимза. Готовые мазки изучали в световом микроскопе с использованием иммерсионного объектива с большим увеличением (×100). Результаты исследований мазков приведены в таблицах 1, 2 и 3.
Для подтверждения диагноза исследуемых цыплят подвергали эвтаназии и отбирали биоматериал для проведения молекулярно-биологических исследований путем постановки полимеразной цепной реакции (ПЦР) в режиме реального времени с целью выявления генома цирковируса. Результаты исследований показали, что при обнаружении в мазках крови и пунктата костного мозга цыплят 3-5 и более апоптозных телец было подтверждено наличие вируса ИАЦ с помощью ПЦР.
Пример 2. Птицепредприятие мясного направления. Весной 2010 года среди цыплят-бройлеров наблюдали клинические признаки и патологоанатомические изменения, характерные для инфекционной анемии: общее угнетение, отказ от корма, бледность слизистых оболочек и кожи. Подкожные, внутрикожные и внутримышечные кровоизлияния различных форм и размеров с признаками отека наблюдались в области груди, бедра, голени, брюшины и на внутренней стороне крыльев. На плюсне и подошве лап отмечались подкожные кровотечения и язвенно-некротические поражения. Из пораженных участков кожи выделялся кровянисто-серозный экссудат. Продолжительность болезни составила 7-10 суток. Максимальный отход был на 3-й день с начала появления симптомов ИАЦ. Отход птицы за 10 суток клинической манифестации болезни составил около 7,0%. Установить этологию инфекции вирусологическими методами исследования не удалось. Диагноз был подтвержден исследованиями сывороток крови переболевшей птицы в ИФА на 40-сутки их выращивания.
В последующем клинические случаи проявления болезни не отмечались. Для оценки эпизоотического состояния предприятия проведены сравнительная оценка морфологических изменений в мазках крови и пунктата костного мозга цыплят в возрасте 20, 30 и 40 суток и биоматериала на наличие генома вируса ИАЦ с помощью ПЦР как описано ранее (пример 1).
Результаты морфологических исследований мазков представлены в таблицах 4, 5 и 6.
Из данных таблиц следует, что скрытое течение ИАЦ согласно морфологическим изменениям наблюдается во всех исследованных группах птицы. Результаты исследований мазков на наличие аппотозных телец по предлагаемому способу и биоматериала на вирус ИАЦ в ПЦР полностью совпадают.
Пример 3. Птицепредприятие яичного направления. Ранее и на начало данных исследований предприятие считался благополучным по инфекционной анемии, хотя при исследовании сывороток крови птицы в ИФА выявляются специфические антитела к вирусу ИАЦ в высоких титрах.
Для оценки эпизоотического состояния предприятия проведены сравнительная оценка морфологических изменений в мазках крови и пунктата костного мозга цыплят в возрасте 30, 60 и 120 суток и биоматериала на наличие генома вируса ИАЦ с помощью ПЦР как описано ранее (пример 1).
Результаты морфологических исследований мазков представлены в таблицах 7, 8 и 9. Данные, представленные в таблицах, свидетельствуют об эффективности предлагаемого способа прижизненной диагностики ИАЦ путем выявления апоптозных телец в мазках крови или пунктата костного мозга цыплят, которые согласуются с результатами исследования биоматериала в ПЦР и указывают на латентное течение инфекции на данном предприятии.
Технической задачей заявляемого решения является упрощение способа и эффективности диагностики болезни, так как позволяет выявлять латентное инфекционной анемии непосредственно в производственных условиях и независимо от возраста исследуемой птицы.
Источники информации
1. Болезни домашних и сельскохозяйственных птиц / Б.У.Кэлнек [и др.]; под ред. Б.У.Кэлнека, X.Джона Барнса, Чарльза У.Биерда и др.; пер. с англ. И.Григорьева, С.Дорош, Н.Хрущева, И.Суровцев. - М.: АКВАРИУМ БУК, 2003. - С.850-870.
2. Болотников И.А. Гематология птиц / И.А.Болотников, Ю.В.Соловьев. - Л.: Наука, 1980. - 115 с.
3. Инфекционная анемия цыплят / А.С.Алиев [и др.] // Ветеринарная медицина. - 2011. - №1. - С.49-53.
4. Карпуть И.М. Гематологический атлас сельскохозяйственных животных / И.М.Карпуть. - Минск: Ураджай, 1986. - 183 с.
5. Серологический мониторинг инфекционной анемии цыплят и молекулярно-биологическая характеристика изолятов вируса / В.А.Лобанов [и др.] // Вестник Российской академии сельскохозяйственных наук. - 2003. - №2. - С.66-69.
6. Bulow V.V. Untersuchungen uber den Erreger der infektiosen Anamie bei Huhnerkuken (CAA) in vitro: Vermehrung Titration Semm Neutralisationstest und indirekter Immunofluoreszentest / V.V.Bulow, M.B.Bertram // Zentralblatt fur Veterinarmedizin. - 1985. - Vol.32. - P. 679-693.
7. Chettle N.J. An outbreak of disease due to chicken anaemia agent in broiler chickens in England / N.J.Chettle // Vet. Rec. - 1989. - Vol.124. - P.211-215.
8. Detection of chicken anemia virus in the gonads and in the progeny of broiler breeder hens with high neutralizing antibody titer / L.Brentano [et al.] // Vet. Microbiol. - 2005. - Vol.105. - P.65-72.
9. Development of ELISA to detect serum antibody to chicken amenta agent / D. Todd [et al.] // Avian Diseases. - 1990. - Vol.34. - P.359-363.
10. Hegazy A.M. Chicken infectious anemia virus (CAV) in broilers and laying hens in Sharkia province, Egypt / A.M.Hegazy, F.M.Abdallah, L.K.AbdEl Sarnie, A.A.Nazim // Journal of American Science. - 2010. - Vol.6(9). - P.752-761.
11. Hoop R.K. The use of immunofluorescence and imrnunoperoxidase straining in studying the pathogenesis of chicken anemia agent in experimentally infected chickens / R.K.Hoop, R.L.Reece // Avian Pathol. - 1991.- Vol.20. - P.349-355.
12. Matemal antibody and its effects on the susceptibility to chicken anemia agent / N.Yuasa [et al.] // Avian Dis. - 1980. - Vol.24. - P.197-201.
13. McNulty M.S. Chicken anaemia agent: a review / M.S. McNulty // Avian Pathology. - 1991. - Vol.20, №1. - P.187-203.
14. Miles A.M. Coinfection of specific-pathogen-free chickens with Marek's disease virus (MDV) and chicken infectious anemia virus: effect of MDV pathotype / A.M.Miles, S.M.Reddy, R.W.Morgan // Avian Dis. - 2001. - Vol.45. - P.9-18.
15. Standardization and application of polymerase chain reaction and indirect immunofluorescent technique for detection of chicken infectious anaemia virus / K.Dhama [et al.] // J.Camp. Microbiol. Immunol. Infect. Dis. - 2002. - Vol.23. - P.11-22.
16. Van Santen V.L. Biological characteristics of chicken anemia virus regenerated from clinical specimen by PCR / V.L.van Santen, H.Toro, F.J.Hoerr // Avian Dis. - 2007. - Vol.51. - P.66-77.
17. Vielitz E. Anaemia-dermatitc of broilers: field observations on its occurrence, transmission and Prevention / E.Vielitz, H.Landgraf // Avian Pathol. - 1988. - Vol.17. - P.113-120.
Обозначения чертежей:
Фиг.1 - Начало формирования апоптозного тельца в пунктате костного мозге цыпленка на 5 день после инокуляции цирковируса.
Фиг.2 - Пунктат костного мозга цыпленка на 10 день после заражения вирусом ИАЦ. Наличие апоптозного тельца в группе клеток эритроидного ростка.
Фиг.3 - Деструкция и лизис апоптозных телец в пунктате костного мозга цыпленка на 21 день после заражения вирусом инфекционной анемии.
Фиг.4 - Мазок крови цыпленка на 14 день после заражения вирусом ИАЦ. Начальные этапы формирования апоптозных телец.
Фиг.5 - Морфологическая картина мазка крови цыпленка на 21 день после инокуляции цирковируса.
Фиг.6 - Мазок крови цыпленка на 21 день после заражения вирусом ИАЦ. Дефинитивные формы апоптозных телец.
Ссылочные обозначения:
1 - апоптозные тельца
2 - оксифильные нормоциты
3 - эозинофильные гранулоциты
4 - тромбоциты
5 - клетки лимфоидного ростка
6 - эритроциты
7 - макрофаги
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ ВИРУСА ИНФЕКЦИОННОЙ АНЕМИИ ЦЫПЛЯТ № 2722 В ГКВ ДЛЯ ПРОИЗВОДСТВА ДИАГНОСТИКУМОВ | 2012 |
|
RU2489487C1 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ | 2001 |
|
RU2205021C2 |
| Штамм "ИК-4" вируса инфекционной анемии цыплят | 2017 |
|
RU2659095C1 |
| ШТАММ ВИРУСА ИНФЕКЦИОННОЙ АНЕМИИ ЦЫПЛЯТ "МЕ-77" ДЛЯ ПРОИЗВОДСТВА ИНАКТИВИРОВАННЫХ СОРБИРОВАННЫХ И ЭМУЛЬГИРОВАННЫХ ВАКЦИН И ДИАГНОСТИКУМОВ | 2016 |
|
RU2646116C1 |
| ШТАММ "52/70-М" ВИРУСА ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ДЛЯ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ ВАКЦИНЫ И ОЦЕНКИ ИХ ИММУНОГЕННОСТИ | 2003 |
|
RU2261274C2 |
| Способ профилактики болезни Гамборо | 1991 |
|
SU1824443A1 |
| СИНТЕТИЧЕСКИЕ ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ И СПОСОБ ВЫЯВЛЕНИЯ ДНК ВИРУСА ИНФЕКЦИОННОЙ АНЕМИИ ЦЫПЛЯТ С ПОМОЩЬЮ СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ В ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2011 |
|
RU2481403C1 |
| ШТАММ "НОВОСИБИРСКИЙ" ВИРУСА ГРИППА ПТИЦ Influenzae virus avicum ДЛЯ КОНТРОЛЯ ИММУНОГЕННОЙ И АНТИГЕННОЙ АКТИВНОСТИ ВАКЦИН И ИЗГОТОВЛЕНИЯ БИОПРЕПАРАТОВ ДЛЯ ДИАГНОСТИКИ И СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ ГРИППА ПТИЦ | 2006 |
|
RU2323740C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ ЭМУЛЬГИРОВАННОЙ ВАКЦИНЫ ПРОТИВ ГРИППА ПТИЦ И ВАКЦИНА ИНАКТИВИРОВАННАЯ ЭМУЛЬГИРОВАННАЯ ПРОТИВ ГРИППА ПТИЦ | 2008 |
|
RU2358760C1 |
| Диагностический набор для выявления антител к вирусу гриппа птиц и идентификации подтипа гемагглютинирующего вирусного агента в реакции торможения гемагглютинации | 2023 |
|
RU2815532C1 |
Изобретение относится к ветеринарной медицине, в частности, к патологической гистологии. Способ прижизненной диагностики латентного течения инфекционной анемии цыплят включает морфологическую оценку мазков крови и пунктата костного мозга больных цыплят. В мазках крови и пунктата костного мозга выявляют вирусиндуцированные апоптозные тельца, и при наличии в поле зрения 3-5 и более апоптозных телец ставят диагноз на инфекционную анемию цыплят. Изобретение обеспечивает снижение трудоемкости способа и сроков постановки диагноза, а также позволяет диагностировать скрытое течение инфекции. 9 табл., 3 пр., 6 ил.
Способ прижизненной диагностики латентного течения инфекционной анемии цыплят, включающий морфологическую оценку мазков крови и пунктата костного мозга больных цыплят, отличающийся тем, что выявляют вирусиндуцированные апоптозные тельца, и при наличии в поле зрения 3-5 и более апоптозных телец ставят диагноз на инфекционную анемию цыплят.
| HEGAZY, A.M | |||
| Chicken infectious anemia virus (CAV) in broilers and laying hens in Sharkia province, Egypt / A.M.Hegazy, F.M.Abdallah, L.K.AbdEl Sarnie, A.A.Nazim // Journal of American Science | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Патрон для электрической лампочки накаливания с цоколем Свана | 1923 |
|
SU752A1 |
| CN 0101358248B, 01.02.2012 | |||
| US 0005789567A, 04.08.1998 | |||
| CN 0102344974A, 08.02.2012 | |||
Авторы
Даты
2014-09-10—Публикация
2013-01-16—Подача