Область техники
Изобретение относится к биотехнологии, белковой инженерии и молекулярной медицине, а именно к получению рекомбинантных однодоменных антител, избирательно связывающих белок фактор некроза опухолей человека, в том числе продуцируемый клетками макрофагально-моноцитарного ряда. Изобретение может быть применимо при заболеваниях, характеризующихся патологическим воспалительным процессом, опосредованным сверхэкспрессией фактора некроза опухолей, таких как септический шок, аутоиммунные и онкологические заболевания.
Уровень техники
Фактор некроза опухолей (ФНО) - цитокин, который играет ключевую роль в патогенезе некоторых заболеваний. Нарушение регуляции и избыточная продукция ФНО приводит к аутоиммунным патологиям, в том числе ревматоидному артриту [Elliott MJ, et al., Treatment of rheumatoid arthritis with chimeric monoclonal antibodies to tumor necrosis factor alpha. Arthritis Rheum; 1993. Р.1681-1690], псориазу [Benoit S, et al., Treatment of recalcitrant pustular psoriasis with infliximab: effective reduction of chemokine expression. The British journal of dermatology; 2004. Р.1009-1012], анкилозирующему спондилоартриту (болезни Бехтерева), а также к хроническому воспалению стенки кишечника, вызванному микрофлорой - болезни Крона [Haraoui В. Differentiating the efficacy of the tumor necrosis factor inhibitors Seminars in arthritis and rheumatism; 2005. Р.7-11]. При этом было обнаружено, что блокировка ФНО моноклональными антителами снижает выработку интерлейкина I [Brennan FM, et al., Inhibitory effect of TNF alpha antibodies on synovial cell interleukin-1 production in rheumatoid arthritis Lancet; 1989. Р.244-247] и других провоспалительных цитокинов [Haworth С, et al., Expression of granulocyte-macrophage colony-stimulating factor in rheumatoid arthritis: regulation by tumor necrosis factor-alpha. Eur J Immunol; 1991. Р.2575-2579]. Ключевая роль ФНО в патогенезе аутоиммунитета, например при ревматоидном артрите, подтвердилась при блокировке биологического эффекта ФНО in vivo [Fong Y, et al. Antibodies to cachectin/tumor necrosis factor reduce interleukin 1 beta and interleukin 6 appearance during lethal bacteremia J Exp Med; 1989. Р.1627-1633]. Одновременно повышенная концентрация ФНО и рецептора к ФНО на поверхности клеток была обнаружена в биоптатах синовиальной оболочки больных [Saxne Т, et al., Detection of tumor necrosis factor alpha but not tumor necrosis factor beta in rheumatoid arthritis synovial fluid and serum. Arthritis Rheum; 1988. Р.1041-1045]. В хронической стадии заболевания в воспаленных синовиальных тканях активированные макрофаги представляют собой основной источник «повреждающего» ФНО, и количество макрофагов вместе со степенью экспрессии ФНО коррелирует с клинической тяжестью картины и болевым синдромом [Tak PP et al., Analysis of the synovial cell infiltrate in early rheumatoid synovial tissue in relation to local disease activity. Arthritis and rheumatism; 1997. Р.217-225.]
Однако ФНО представляет собой цитокин широкого спектра действия, в норме играющий роль в защите от патогенов, формировании лимфоидных органов в процессе онтогенеза и развитии воспалительной реакции. ФНО вырабатывается преимущественно клетками иммунной системы: макрофагами, нейтрофилами, лимфоцитами и дендритными клетками [Vilcek J, Lee TH. Tumor necrosis factor. New insights into the molecular mechanisms of its multiple actions. J Biol Chem; 1991. Р.7313-7316], а рецепторы к ФНО конститутивно экспрессируются на поверхности всех клеток организма. Для устранения симптомов определенных воспалительных заболеваний можно использовать блокаторы сигнального пути ФНО, такие как моноклональные антитела к ФНО (например, адалимумаб или инфликсимаб) или гибридные белки на основе рецептора к ФНО (например, этанэрцепт). Целый ряд рекомбинантных блокаторов ФНО в настоящее время успешно применяется в клинике: этанэрцепт (коммерческое название Энбрел), ФНОР2, слитый с Fc-фрагментом человеческого IgG1, химерное полноразмерное антитело инфликсимаб, включающее мышиные и человеческие участки (торговая марка Ремикейд), человеческие полноразмерные антитела адалимумаб (торговая марка Хумира) и голимумаб (торговая марка Симпони); F(ab)2 фрагмент антитела мыши афелимомаб; ПЭГилированный Fab-фрагмент гуманизированного антитела мыши цертолизумаб пегол (торговая марка Цимзия).
Примеры блокирующих ФНО антител широко отражены в международных и российских патентах, например в патенте RU 2270030 «Способ ингибирования активности человеческого TNF α (варианты), применение выделенного антитела человека или его антигенсвязывающего фрагмента в качестве компонента для производства лекарственного средства (варианты) и выделенное человеческое антитело или его антигенсвязывающий фрагмент», который соответствует антителу адалимумаб; в патенте RU 2416645 «Одноцепочечное антитело, связывающее фактор некроза опухоли альфа, ДНК, плазмидная ДНК и способ получения одноцепочечного антитела», который соответствует оптимизированному под систему экспрессии в клетках яичников китайского хомячка антителу инфликсимаб; в патенте RU2377253 «Антитела, специфичные к фактору некроза опухолей, и их применение», который соответствует антителу голимумаб, и т.д. Однако данные молекулы осуществляют неспецифическое блокирование каскада передачи сигнала ФИО, приводя к нежелательным побочным эффектам, к которым относятся: реактивация латентной формы туберкулеза [Keane J, et al. Tuberculosis associated with infliximab, a tumor necrosis factor alpha-neutralizing agent. N Engl J Med; 2001. Р.1098-1104], усиление демиелинизации при рассеянном склерозе [van Oosten BW, et al. Increased MRI activity and immune activation in two multiple sclerosis patients treated with the monoclonal anti-tumor necrosis factor antibody cA2. Neurology; 1996. Р.1531-1534] и индуцированная ФНО-блокаторами системная красная волчанка [Shakoor N, et al., Drug-induced systemic lupus erythematosus associated with etanercept therapy. Lancet; 2002. Р.579-580]. В силу широко спектра действия ФНО и плейотропного эффекта его блокирование представляется целесообразным проводить специфически, как минимум разграничивая действие блокатора на клетки - продуценты ФНО лимфоцитарного ряда (блокирующий эффект должен быть минимальным) и клетки - продуценты ФНО макрофагально-моноцитарного ряда (блокирующий эффект должен быть максимальным).
Наиболее близким аналогом настоящего изобретения являются однодоменные антитела ламы, указанные в патенте RU 2455312, «Однодоменные антитела, направленные против фактора некроза опухолей альфа, и их применение». Они представляют собой полипептид, включающий в себя рекомбинантное однодоменное антитело ламы к ФНО, в количестве не менее двух субъединиц, и дополнительные субъединицы, также являющиеся однодоменными антителами, которые связываются с сывороточными белками. Антитела, описанные в патенте RU 2455312, получены на основе однодоменных антител ламы. Производные однодоменных антител ламы к ФНО содержат дополнительные субъединицы, которые также являющиеся однодоменными антителами и связываются с сывороточными белками, что направлено на увеличение срока циркуляции миниантител в кровотоке, но не обеспечивает тканеспецифической доставки и селективного наведения на отдельные клеточные источники ФНО. Производные однодоменных антител ламы к ФНО, описанные в патенте RU 2455312, блокируют ФНО-сигналинг системно, за счет своих ФНО-связывающих доменов, что препятствует созданию на их основе специфических ФНО-блокаторов.
Таким образом, цель настоящего изобретения состояла в том, чтобы создать новые антитела, которые эффективно связывали бы ФНО, но не блокировали бы его активность при системном воздействии. При этом такие антитела могут найти применение как сами по себе, в виде компонента новой диагностической системы для определения уровня ФНО у пациентов, так и в виде биспецифических производных, направленных на избирательное блокирование ФНО-сигналинга, в момент секреции этого цитокина иммунными клетками отдельной популяции, например инфильтрировавшимися в очаг воспаления макрофагами.
Раскрытие изобретения
Задачей, решаемой авторами настоящего изобретения, является создание новых антител, эффективно связывающих ФНО, а также антител, эффективно связывающих ФНО, но не блокирующих его активность при системном воздействии, в частности биспецифических производных, направленных на избирательное блокирование ФНО, продуцируемого клетками макрофагально-моноцитарного ряда.
Технический результат настоящего изобретения заключается в получении новых антител, обеспечивающих связывание ФНО человека и позволяющих создавать их производные, способные селективно блокировать ФНО, производимый отдельной популяцией клеток иммунной системы, в частности производные, представляющее собой селективный блокатор ФНО, направленный на ФНО, продуцируемый клетками макрофагально-моноцитарного ряда.
Поставленная задача решается благодаря разработке рекомбинантного однодоменного мини-антитела VHH (названного авторами настоящего изобретения «VHH-41»), способного связывать белок фактор некроза опухолей (ФНО) человека и имеющего вариабельный домен, характеризующийся последовательностью аминокислот, представленной в SEQ ID NO:1.
Также частным вариантом настоящего изобретения является упомянутый выше фрагмент ДНК, имеющий нуклеотидную последовательность SEQ ID NO:2.
Также настоящее изобретение предоставляет способ получения упомянутого выше антитела, включающий следующие стадии:
а) конструирование вектора, содержащего упомянутый выше фрагмент ДНК под промотором, обеспечивающим его экспрессию;
б) трансформацию клеток-продуцентов вектором, полученным на стадии а);
в) экспрессию антитела в клетках-продуцентах;
г) выделение и очистку антитела из клеток-продуцентов.
Также частным вариантом настоящего изобретения является способ выявления и определения уровня фактора некроза опухоли человека в биологическом образце, включающий:
а) приведение в контакт биологического образца с антителом по п.1,
б) определение связывания указанного антитела с указанным образцом, и
в) сравнение связывания, обнаруженного на стадии (б), со стандартом, соответствующим нормальному или повышенному уровню содержания фактора некроза опухоли человека.
В основе настоящего изобретения находятся неклассические полноразмерные антитела, которые применялись для создания всех ныне применяющихся блокаторов ФНО, а малые однодоменные антитела на основе верблюжьих мини-антител, которые имеют ряд преимуществ по сравнению с классическими антителами для практического применения в области терапии заболеваний.
Рекомбинантные однодоменные антитела получают на основе особых неканонических однодоменных антител, существующих в норме наряду с классическими антителами у животных семейства Верблюдовых (и у некоторых видов акул). Эти особые антитела состоят из димера только одной укороченной (без первого константного района СН1) тяжелой цепи иммуноглобулина и полнофункциональны в отсутствие легкой цепи иммуноглобулина. Для собственно специфического узнавания и связывания антигена при этом необходим и достаточен лишь один вариабельный домен (VHH, «мини-антитело», «nanobody» или однодоменное антитело) этого антитела. Организация вариабельных доменов (VHH) неканонических антител в значительной степени подобна той, что у вариабельных доменов (VH) классических антител (у человека VH-домены иммуноглобулинов подкласса IgG3 имеют особо выраженную гомологию с VH и VHH верблюдовых). В обоих случаях V-домены состоят из четырех консервативных каркасных участков (FR, «framework regions»), окружающих три гипервариабельных участка (определяющие комплементарность, CDR, от «complementarity determining regions»). В обоих случаях домены формируют типичную для V-домена иммуноглобулина пространственную структуру из двух бета-листов [Padlan E.A. X-Ray crystallography of antibodies. Adv. Protein Chem. 1996; 49: 57-133. Muyldermans S., Cambillau C., Wyns L. Recognition of antigens by single-domain antibody fragments: the superfluous luxury of paired domains. TIBS 2001; 26: 230-235]. В этой структуре все три гипервариабельных участка сгруппированы с одной стороны V-домена (где они участвуют в узнавании антигена) и располагаются в петлях, соединяющих бета-структуры. Однако имеются и важные отличия, связанные с функционированием VHH в формате одного домена. Так, гипервариабельные участки CDR1 и CDR3 заметно увеличены в случае VHH. Часто в гипервариабельных участках VHH обнаруживаются цистеиновые остатки, причем присутствующие сразу в двух участках (чаще всего в CDR1 и CDR3, реже - в CDR2 и CDR3). При исследовании кристаллических структур VHH было показано, что эти цистеиновые остатки формируют новые дисульфидные связи, что приводит к дополнительной стабилизации структуры петель данного антигена. Наиболее явным и воспроизводимым отличительным признаком VHH являются четыре замены гидрофобных аминокислотных остатков на гидрофильные во втором каркасном участке (Val37Phe, Gly44Glu, Leu45Arg, Trp47Gly согласно нумерации Кабат). Этот каркасный участок в случае VH домена является высоко консервативным, обогащен гидрофобными аминокислотными остатками и особо важен для образования связи с вариабельным доменом VL легкой цепи. VHH-домен в этом плане сильно отличается: указанные замены гидрофобных аминокислот на гидрофильные делают невозможной ассоциацию VHH и VL. Эти замены также объясняют высокую растворимость VHH, антитела, когда его получают в виде рекомбинантного белка [Тиллиб С.В. «Верблюжьи антитела» - эффективный инструмент для исследований, диагностики и терапии. Молекулярная биология 2011; 45(1): 77-85].
По сравнению с традиционными и чисто рекомбинантными антителами верблюжьи антитела обладают рядом преимуществ, что позволяет предполагать большой потенциал их будущего использования в различных исследованиях и при создании новых биотехнологических устройств, а также в клинических целях для диагностики и лечения заболеваний, в том числе:
- удобство способа получения и селекции верблюжьих мини-антител;
- небольшой размер 13-15 кДа, обеспечивающий высокую биодоступность;
- возможность образовывать «выпуклые» антигенсвязывающие участки, способные связываться с углублениями и активными центрами антигенов-мишеней;
- высокий выход и простота системы экспрессии, в качестве которой можно использовать Е. coli;
- легкость в проведении генно-инженерных манипуляций, включая создание бифункциональных и полифункциональных производных.
Разработанное авторами настоящего изобретения рекомбинантное однодоменное мини-антитело VHH, названное VHH-41, не имеет участков гомологии ни с одним из ранее описанных антител к ФНО; гипервариабельные участки этих антител также не имеют гомологии, как следствие - принципиально разными свойствами будут обладать и гуманизированные производные этих антител.
Кроме того, авторами настоящего изобретения, разработано производное рекомбинантного однодоменного мини-антитела VHH-41, содержащее дополнительные субъединицы, которые связываются с белками-макрофагальными маркерами, что позволяет осуществлять тканеспецифическую доставку и селективное наведение на отдельные клеточные источники ФНО. В частности, разработанное производное рекомбинантного однодоменного мини-антитела VHH-41 позволяет осуществлять направленное воздействие на специфическую блокировку ФНО, синтезируемого клетками макрофагально-моноцитарного ряда. Производные антитела VHH-41 блокируют ФНО-сигналинг только после связывания и с ФНО, и с макрофагальным маркером, обеспечивая специфичность блокирующего действия.
Указанное производное может быть использовано для лечения, и/или предупреждения, и/или облегчения состояния, связанного с воспалительным ответом, вызванным клетками макрофагально-моноцитарного ряда.
В одном из вариантов реализации настоящее изобретение представляет собой рекомбинантное однодоменное антитело VHH-41, содержащее последовательность аминокислот вариабельного домена SEQ ID NO:1, способное связывать белок фактор некроза опухолей (ФНО) человека.
В другом варианте реализации настоящее изобретение представляет собой фрагмент ДНК, кодирующий рекомбинантное однодоменное антитело VHH-41. Частным примером таких последовательностей является SEQ ID NO:2. При этом необходимо учитывать, что полипептиды однодоменных антител, соответствующих настоящему изобретению, могут кодироваться большим множеством молекул нуклеиновых кислот, что является результатом хорошо известного в данной области техники явления вырожденности генетического кода. Суть его состоит в том, что любая аминокислота (за исключением триптофана и метионина), входящая в состав природных пептидов, может кодироваться более чем одним триплетным нуклеотидным кодоном. Любая из этих вырожденных кодирующих молекул нуклеиновых кислот может входить в состав кассет, экспрессирующих антитела, заявленные в соответствии с настоящим изобретением, и относится к области действия настоящего изобретения.
В другом варианте реализации настоящее изобретение представляет собой способ получения антитела VHH-41 или его производного, предусматривающий следующие стадии:
а) конструирование вектора, содержащего последовательность нуклеотидов, кодирующую антитело VHH-41 или его производное, под обеспечивающим высокий уровень экспрессии промотором, конститутивным либо индуцибельным, который также может содержать последовательности, позволяющие селективно очистить полученное антитело, на основе любого коммерчески доступного вектора, известного специалисту в данной области техники;
б) трансфекция/трансформация клеток-продуцентов предварительно полученным вектором, при этом клетками продуцентами предпочтительно являются микроорганизмы, более предпочтительно прокариотические, наиболее предпочтительно Е. coli, однако в качестве продуцентов могут использоваться любые другие системы экспрессии, известные специалисту в данной области техники, включая дрожжей, клеточные культуры млекопитающих и насекомых, и т.д.;
в) экспрессия антитела в клетках-продуцентах, при этом экспрессия может быть конститутивной, либо, предпочтительно, индуцибельной, внутриклеточной либо секреторной, предпочтительно направленной в периплазматическое пространство в случае продуцента Е. coli, либо в любой стандартной модификации, известной специалисту в данной области техники;
г) выделение и очистка антитела из клеток-продуцентов с использованием гексагистидиновой метки и аффинной хроматографии или любой стандартной методики, известной специалисту в данной области техники.
В другом варианте реализации настоящее изобретение представляет собой способ выявления и определения уровня фактора некроза опухоли человека в биологическом образце, включающий:
а) приведение в контакт биологического образца с антителом по п.1,
б) определение связывания указанного антитела с указанным образцом, и
в) сравнение связывания, обнаруженного на стадии (б), со стандартом, соответствующим нормальному или повышенному уровню содержания фактора некроза опухоли человека.
Согласно настоящему изобретению в качестве биологического образца могут быть использованы, например, цельная кровь, плазма, сыворотка крови, ткани, отдельные клетки, межклеточная жидкость, слезная жидкость и др. Определение связывания антитела с биологическим образцом может осуществляться любым стандартным методом, известным специалисту в данной области, в частности иммуноферментным анализом. В качестве стандарта могут быть использованы препараты рекомбинантного ФНО, имеющие концентрацию активного вещества, соответствующую нормальному или повышенному уровню ФНО, характерному для исследуемого типа образца, известному специалисту в данной области техники.
Краткое описание чертежей
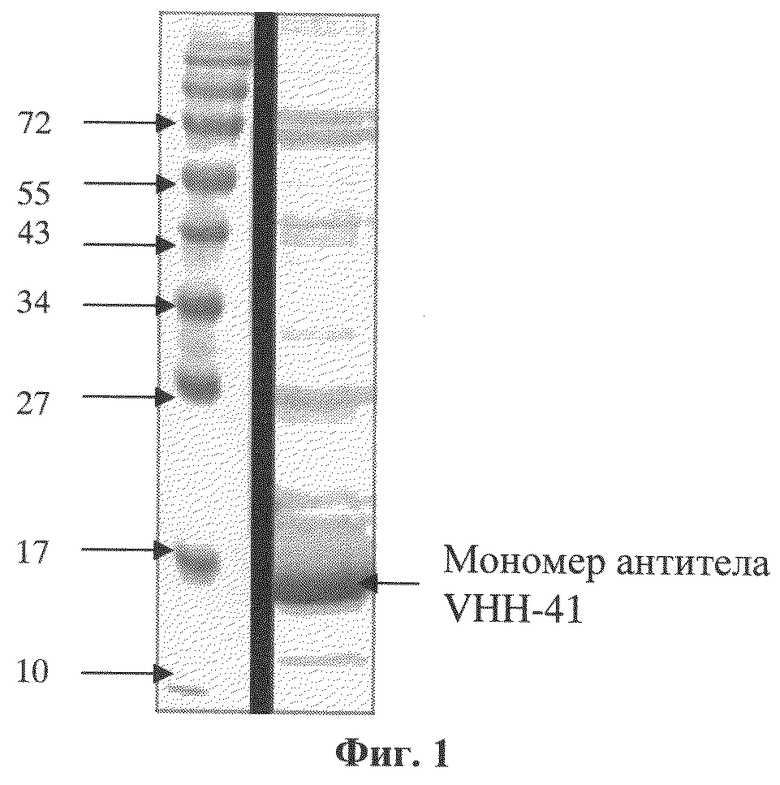
Фиг.1. Результаты анализа антитела VHH-41 методом денатурирующего электрофореза в полиакриламидном геле. Проведена электрофореграмма рекомбинантного антитела VHH-41 после аффинной очистки. Мономер антитела имеет молекулярную массу 16 кДа, совпадающую с расчетной.
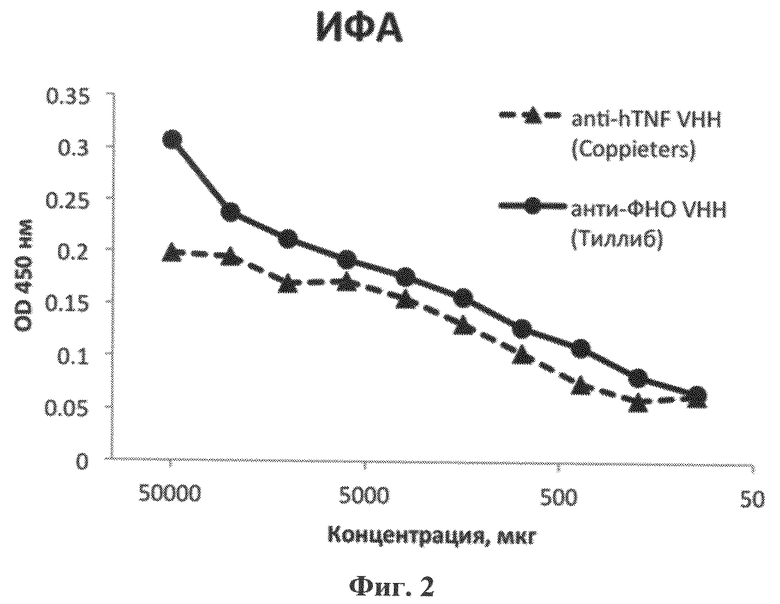
Фиг.2. Результаты твердофазного ИФА антитела VHH-41 и контрольного мини-антитела, специфичного к чФНО [Coppieters, K., Dreier, Т., Silence, К., de Haard, Н., Lauwereys, M., Casteels, P., Beirnaert, E., et al. (2006). Formatted anti-tumor necrosis factor alpha VHH proteins derived from camelids show superior potency and targeting to inflamed joints in a murine model of collagen-induced arthritis. Arthritis & Rheumatism, 54(6), 1856-1866. doi:10.1002/art.21827]. Антитело VHH-41 демонстрирует аффинность к человеческому ФНО, сопоставимую с аффинностью контрольных мини-антител к чФНО.
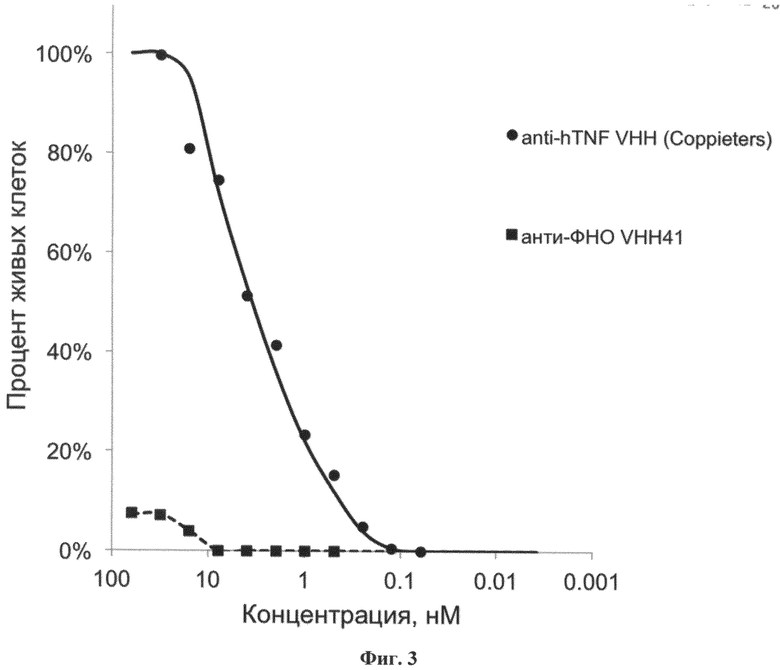
Фиг.3. Результаты цитотоксического теста антитела VHH-41 и контрольного мини-антитела, специфичного к чФНО. Антитело VHH-41, в отличие от контрольного мини-антитела, само по себе не имеет блокирующей активности в отношении ФНО и не препятствует ФНО-индуцируемому апоптозу клеток.
Фиг.4. Гипервариабельные участки молекулы мини-антитела VHH-41. На чертеже приведена аминокислотная последовательность мини-антитела VHH-41 и отмечены его Гипервариабельные участки CDR1, CDR2, CDR3 (показаны черными стрелками) и гексагистидиновая метка для аффинной очистки антитела (показана черной стрелкой).
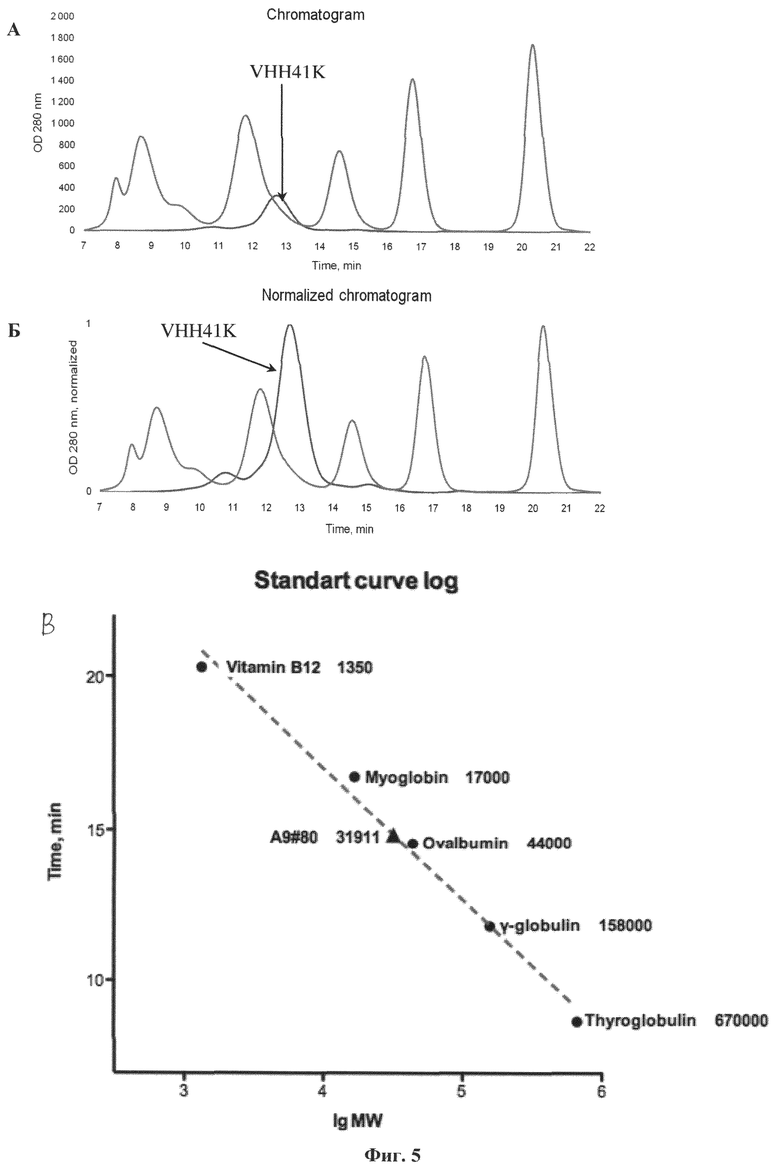
Фиг.5. Результаты хроматографии производного антитела VHH-1, имеющего дополнительную димеризующуюся субъединицу в виде флуоресцентного белка Katushka. На рисунке показаны: А) необработанная хроматограмма производного мини-антитела VHH-1, полученная методом эксклюзионной водной хроматографии (гель-фильтрации), Б) его нормализованная хроматограмма и В) график расчета его молекулярной массы по молекулярным массам калибровочных веществ. Как видно из результатов, производное мини-антитела VHH-1, имеющего дополнительную димеризующуюся субъединицу в виде слитого с ним флуоресцентного белка Katushka [Shcherbo D, Merzlyak ЕМ, Chepurnykh TV, Fradkov AF, Ermakova GV, Solovieva EA, Lukyanov KA, Bogdanova EA, Zaraisky AG, Lukyanov S, Chudakov DM. Bright far-red fluorescent protein for whole-body imaging. Nature Methods. 2007, V.4, No9, р.741-746], преимущественно существует в растворе в форме димера.
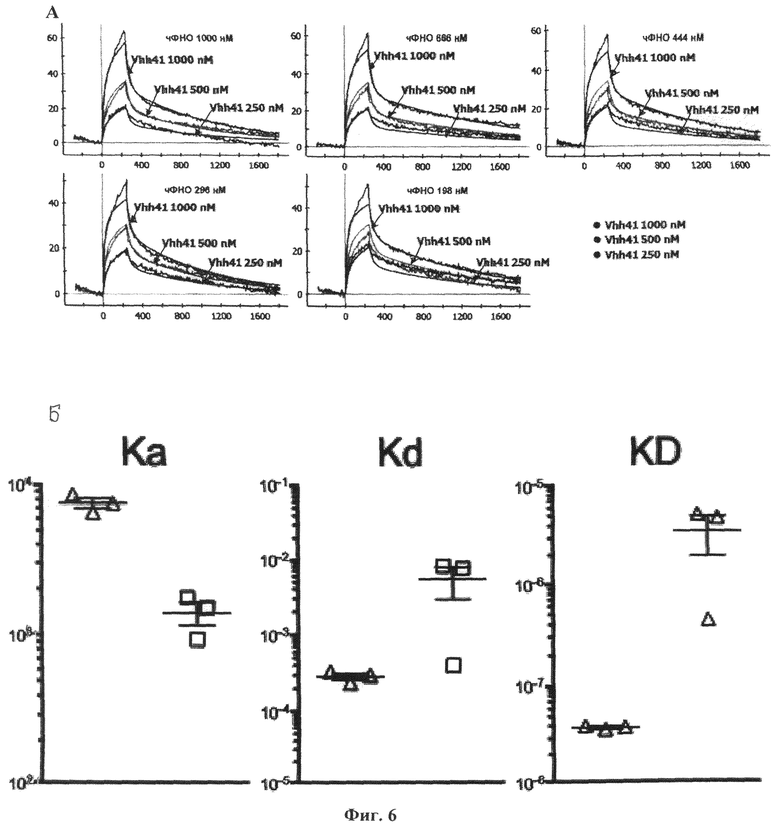
Фиг.6. Кинетика связывания, скорость ассоцации, скорость диссоциации и константа диссоциации мономера и димерного производных антитела VHH-41 к ФНО человека. На рисунке показаны: А) сенсограммы, характеризующие кинетику связывания однодоменного антитела VHH-41 в убывающих развдениях с рекомбинантным ФНО человека, иммобилизированном на поверхности чипа для измерения поверхностного плазменного резонанса также в убывающих разведениях. Всего представлены 15 кривых для 15 отдельных взаимодействий. Б) скорость ассоциации (Ka), скорость диссоциации (Kd) и константа диссоциации (KD) мономеров исходного мини-антитела VHH-41 (квадраты) и димеров его производного VHH-41-К, содержащих димеризующую субъединицу белка Katushka (треугольники). Данные были получены методом поверхностного плазменного резонанса на приборе Proteon XPR36 (BioRad) с использованием препаратов очищенных рекомбинантных мини-антител и очищенного рекомбинантного ФНО человека. Для эксперимента использовались иммобилизованный на поверхности биочипа рекомбинантный ФНО человека в концентрациях 1000, 666, 444, 296, 198 нМ и однодоменные мини-антитела VHH-41 в концентрации 1 мкМ, 500 и 250 нМ, всего было проанализировано 15 взаимодействий. По результатам эксперимента видно, что связывание с ФНО димерного производного VHH-41-К имеет аффинность приблизительно на два порядка сильнее, чем связывание исходного мономерного мини-антитела VHH-41. Таким образом, для практического применения более перспективными представляются производные исходного мини-антитела VHH-41, включая бивалентные, поливалентные и биспецифические.
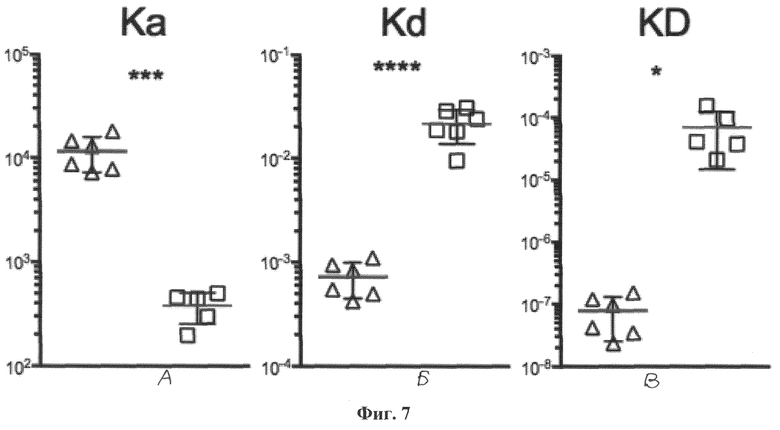
Фиг.7. График, демонстрирующий скорость ассоциации, скорость диссоциации и константу диссоциации димеров антитела VHH-41 к ФНО человека с интактными и измененными направленным мутагенезом гипервариабельными участками. На чертеже показаны: А) скорость ассоциации (Ka), Б) скорость диссоциации (Kd) и В) константа диссоциации (KD) димеров исходного мини-антитела VHH-41 с интактными гипервариабельными участками (треугольники) и димеров его производного с гипервариабельными участками, измененными в ходе сайт-направленного мутагенеза (квадраты). Данные были получены методом поверхностного плазменного резонанса на приборе Proteon XPR36 (BioRad) с использованием препаратов очищенных рекомбинантных мини-антител и очищенного рекомбинантного ФНО человека. Для эксперимента использовались иммобилизованный на поверхности биочипа рекомбинантный ФНО человека в концентрациях 1000, 666, 444, 296, 198 нМ и однодоменные мини-антитела VHH-41 (нормальное и измененное мутагенезом) в разведении 500 нМ и 1 мкМ соответственно, всего было проанализировано 10 взаимодействий для каждого антитела. По результатам эксперимента видно, что связывание с ФНО исходного димера мини-антитела VHH-41 имеет аффиность приблизительно 100 нМ, а димера антитела с измененными гипервариабельными участками - 100 мкМ. Поскольку изменение гипервариабельных участков приводит к ухудшению аффиности мини-антитела на три порядка, тем самым показана высокая специфичность к ФНО димера мини-антитела VHH-41.
ПРИМЕРЫ
Пример 1
Получение библиотеки вариабельных доменов однодоменных антител.
Иммунизация.
Двугорбого верблюда Camelus bactrianus последовательно иммунизировали 5 раз. В качестве антигена использовали рекомбинантный ФНО. Рекомбинантный ФНО человека экспрессировали в клетках Е. coli и очищали по протоколу, опубликованному ранее (Мутанты фактора некроза опухолей человека: получение и некоторые свойства / Л.Н.Шингарова, Л.Н.Сагайдак, Р.Л.Турецкая, С.А.Недоспасов, Д.С.Есипов, В.Г.Коробко // Биоорг. химия. - 1996. - Т.22, вып.4. - С.243-251. - ISSN 0132-3423.)
Первую инъекцию проводили антигеном, смешанным с полным адъювантом Фрейнда в соотношении 1:1. Затем антиген смешивали с неполным адъювантом Фрейнда (1:1) и проводили последовательно еще 4 инъекции, соответственно через 1 месяц и трижды - через 2 недели. Забор крови (150 мл) проводили через 5 дней после последней инъекции. Для предотвращения свертывания взятой крови добавляли гепарин 35 ед./мл и ЭДТА (2 мМ).
Выделение В-лимфоцитов.
Кровь разводили в 2 раза стандартным солевым раствором (PBS), содержащим 1 мМ ЭДТА. На 15 мл-ступеньку специальной среды (Histopaque-1077, Sigma) с плотностью 1,077 г/мл наслаивали 35 мл разбавленного раствора крови и проводили центрифугирование в течение 20 мин при 800 g. Мононуклеарные клетки (лимфоциты и моноциты) отбирали из интерфазной зоны плазма/Histopaque, после чего промывали раствором PBS, содержащим 1 мМ ЭДТА.
Выделение РНК из В-лимфоцитов.
Суммарную РНК из В-лимфоцитов выделяли с помощью реагента TRIzol (Invitrogen). Затем поли(А)-содержащую РНК выделяли на колонке с олиго(dТ)-целлюлозой из тотальной РНК. Концентрацию РНК определяли с помощью биофотометра (Eppendorf) и качество выделенной РНК проверяли с помощью электрофореза в 1,5%-ном агарозном геле с формальдегидом.
Реакция обратной транскрипции: синтез кДНК на матрице поли(А)+РНК. выделенной из В-лимфоцитов.
Реакцию обратной транскрипции проводили в 40 мкл по стандартному протоколу [Sambrook et al., 1989] с использованием обратной транскриптазы Н-M-MuLV, 1 мкг РНК и 1 мкг праймера олиго(dT)15 в качестве затравки.
Амплификация фрагментов кДНК, кодирующих вариабельные домены антител.
Продукты обратной транскрипции (1 мкл) использовали в качестве матрицы в полимеразной цепной реакции объемом 50 мкл, содержащей два праймера CALL001 (5'-gtcctggctgctcttctacaagg-3') и CALL002 (5'-ggtacgtgctgttgaactgttcc-3') в количестве 20 пмоль в следующих условиях: 95°С, 90 с, (95°С - 30 с, 59°С - 120 с, 72°С - 90 с)×30 циклов, 72°С, 300 с. Продукты амплификации разделяли в агарозном геле, содержащем бромистый этидий. Продукты амплификации размером 600-800 п.н., соответствующие неканоническим антителам, выделялись из геля с помощью набора QIAEX II (QIAGEN, США) и использовались в качестве матрицы в аналогичной реакции амплификации с праймерами 5'-ccagccggccatggctgatgtgcagctggtggagtctgg-3' и 5'-ggactagtgcggccgcttgaggagacggtgacctgggt-3', содержащими дополнительные последовательности, соответствующие участкам узнавания рестрикционных эндонуклеаз, соответственно Ncol и Notl.
Создание библиотеки вариабельных доменов однодоменных антител.
Полученные продукты амплификации клонировали по сайтам Ncol и Notl в фагмидный вектор pHEN4 и, используя в качестве фага-помощника бактериофаг М13К07 (New England Biolabs, США), получали фаговую библиотеку с поверхностной экспрессией вариабельных доменов однодоменных антител, как описано [Hamers-Casterman et al., 1993; Nguyen et al., 2001; Saerens et al., 2004; Rothbauer et al., 2006].
Пример 2
Селекция мини-антител, специфически узнающих ФИО.
Селекцию мини-антител проводили методом фагового дисплея с использованием рекомбинантного ФНО, иммобилизованного на дне лунок 96-луночного ИФА-планшета. Использовали полистироловые иммунологические планшеты с высокой сорбцией MICROLON 600 (Greiner Bio-One). Для блокировки использовали 1%-ный BSA (Sigma-Aldrich, США) и/или 1%-ное обезжиренное молоко (Bio-Rad, США) в PBS. Процедуру селекции и последующей амплификации отбираемых фаговых частиц (содержащих ген мини-антитела внутри, а экспрессирующееся мини-антитело - в составе поверхностного фагового белка pill) повторяли, как правило, последовательно три раза. Все манипуляции проводили, как описано [Hamers-Casterman et al., 1993; Nguyen et al., 2001; Saerens et al., 2004; Rothbauer et al., 2006].
Пример 3
Продукция мини-антитела VHH-41.
Полученную кДНК мини-антитела VHH-41 переклонировали в экспрессионный плазмидный вектор - модифицированный вектор pHEN6 [Conrath K.E., Lauwereys M., Galleni M., Matagne A., Frere J.M., Kinne J., Wyns L., Muyldermans S. Beta-lactamase inhibitors derived from single-domain antibody fragments elicited in the Camelidae. Antimicrob. Agents Chemother. 2001; 45:2807-12], обеспечивающий присоединение к С-концу мини-антитела полигистидинового (His)6-эпитопа (сразу вслед за НА-эпитопом, кодируемым в векторе pHEN6). Благодаря наличию на N-конце экспрессируемой последовательности сигнального пептида (pelB) нарабатываемый рекомбинантный белок (мини-антитело) накапливается в периплазме бактерий, что позволяет эффективно его выделять методом осмотического шока, не разрушая собственно бактериальные клетки. Продукцию мини-антител проводили в Е. coli (штамм BL21). Экспрессию индуцировали добавлением 1 мМ индолил-бета-В-галактопиранозида и клетки инкубировали при интенсивном перемешивании в течение 7 часов при 37°С или в течение ночи при 29°С. Мини-антитела VHH-41 выделяли из периплазматического экстракта с использованием аффинной хроматографии на Ni-NTA-агарозе с использованием системы для очистки QIAExpressionist (QIAGEN, США). Результаты очистки мини-антитела VHH-41 приведены на ФИГ.1, структура мини-антитела VHH-41 показана на ФИГ.4.
Пример 4
Определение биологической активности мини-антител VHH-41.
Измерение биологической активности и оценку эффективности блокировки ФНО проводили с помощью цитотоксического теста на клетках мышиной фибросаркомы линии L929, чувствительных к ФНО. Вкратце, клетки линии L929 были посажены в 96-луночный планшет из расчета по 5×104 клеток на лунку. Постоянная концентрация рекомбинантного ФНО человека (чФНО) 20 нг/мл и Актиномицина Д маннитола 4 мкг/мл (Sigma A5156), охарактеризованная ранее как вызывающая гибель 95% клеток, и убывающие разведения тканеспецифического блокатора чФНО добавляли к монослою L929 клеток в 96-луночные планшеты. После инкубации в течение 24 часов к клеткам добавляли раствор МТТ (Sigma M5655) до конечной концентрации 6 пМ/мл. Через 16 часов кристаллы формазана солюбилизировали 10% раствором додецилсульфата натрия в диметилсульфоксиде, после чего измеряли оптическую активность на микропланшетном фотометре при длине волны 540 нм с референсным значением 492 нм. Значения оптической плотности были пересчитаны на количество живых клеток. Результаты исследования показали, что VHH-41 эффективно связывает ФНО, но сам по себе не блокирует цитотоксическое действие чФНО на клетки мышиной фибросаркомы линии L929 (См. ФИГ 3).
Пример 5
Исследование физико-химических свойств мини-антитела VHH-41 методом поверхностного плазмонного резонанса.
Подтверждение способности мини-антитела VHH-41 связывать чФНО было выполнено с помощью метода твердофазного ИФА (См. Фиг.2). Для дальнейшего определения физико-химических свойств мини-антитела VHH-41, определяющих его аффинность, были проведены измерения его кинетики связывания с чФНО. Определение скорости ассоциации, скорости диссоциации и константы диссоциации мини-антитела VHH-41 проводились с помощью прибора поверхностного плазмонного резонанса Proteon XPR36 (Bio-Rad).
Для этого препарат очищенного рекомбинантного ФНО человека в цитратном буфере (рН=5.5) был иммобилизован на GLC-чипе, по протоколу производителя, в пяти различных концентрациях - 198 нМ, 296 нМ, 444 нМ, 666 нМ и 1000 нМ. После серии промывок и установлении базовой линии на поверхность чипа были нанесены препараты очищенных рекомбинантных мини-антител VHH41 в фосфатно-солевом буфере в концентрациях 250нМ, 500 нМ и 1000 нМ. В двух повторностях были проанализированы все 15 взаимодействий для каждого сочетания концентрации чФНО и рекомбинантного мини-антитела. Полученные кривые ассоциации - диссоциации представлены на ФИГ 6.
По результатам эксперимента видно, что связывание с ФНО димерного производного VHH-41-K имеет аффинность приблизительно на два порядка сильнее, чем связывание исходного мономерного мини-антитела VHH-41. Таким образом, для практического применения более перспективными представляются производные исходного мини-антитела VHH-41, включая бивалентные, поливалентные и биспецифические. При этом аффинность димерного мини-антитела VHH41 сопоставима с известной из уровня техники аффинностью коммерческого препарата инфликсимаба. При этом производные мини-антитела VHH-41, несущие измененные последовательности аминокислот гипервариабельных участков, имеют существенно сниженную аффинность к ФНО (Фиг.7), что свидетельствует о высокой специфичности исходного мини-антитела VHH-41.


Изобретение относится области иммунологии и биотехнологии. Предложено однодоменное антитело (VHH), способное связывать цитокин фактор некроза опухолей (ФНО, TNF) человека, фрагмент ДНК, кодирующий антитело по изобретению, способ получения антитела по изобретению, а также способ выявления и определения уровня содержания ФНО человека в биологическом образце. Настоящее изобретение обеспечивает специфическую блокировку ФНО клеток макрофагально-моноцитарного ряда и может найти дальнейшее применение в терапии заболеваний, связанных с нежелательным ФНО-зависимым воспалительным ответом. 4 н.п. ф-лы, 5 пр., 7 ил.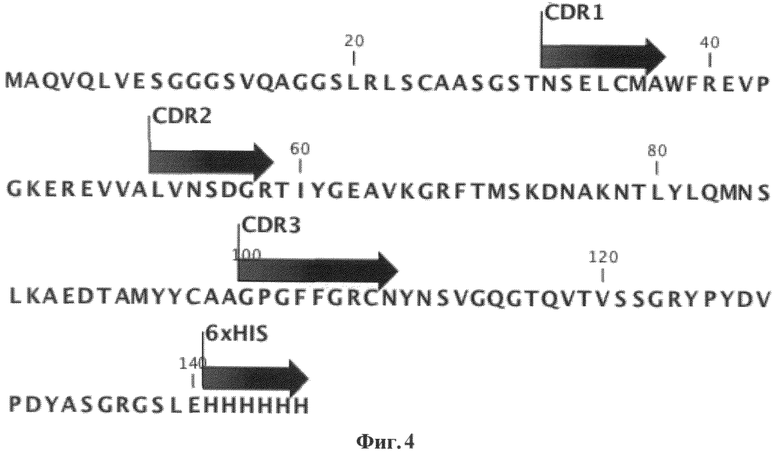
1. Рекомбинантное однодоменное мини-антитело VHH, способное связывать белок фактор некроза опухолей человека и характеризующееся последовательностью аминокислот вариабельного домена, представленной в SEQ ID NO:1.
2. Фрагмент ДНК, кодирующий рекомбинантное однодоменное мини-антитело VHH по п.1 и имеющий нуклеотидную последовательность SEQ ID NO:2.
3. Способ получения антитела по п.1, включающий следующие стадии:
а) конструирование вектора, содержащего фрагмент ДНК по п.2 под промотором, обеспечивающим его экспрессию;
б) трансформацию клеток-продуцентов вектором, полученным на стадии а);
в) экспрессию антитела в клетках-продуцентах;
г) выделение и очистку антитела из клеток-продуцентов.
4. Способ выявления и определения уровня содержания фактора некроза опухоли человека в биологическом образце, включающий:
а) приведение в контакт биологического образца с антителом по п.1,
б) определение связывания указанного антитела с указанным образцом, и
в) сравнение связывания, обнаруженного на стадии (б), со стандартом, соответствующим нормальному или повышенному уровню содержания фактора некроза опухоли человека.
| COPPIETERS K | |||
| et al | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| СПОСОБ ИЗМЕРЕНИЯ ОПОРНОЙ ПЛОЩАДИ НЕРОВНОСТЕЙ | 2006 |
|
RU2301967C1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| JP | |||
Авторы
Даты
2014-10-10—Публикация
2012-11-07—Подача