Настоящее изобретение сделали при поддержке правительства согласно гранту №RO1NS52839, который был предоставлен Национальному институту неврологических заболеваний и инсульта. Правительство имеет права на данное изобретение.
Область изобретения
Настоящее изобретение относится к области лечения ишемических состояний и заболеваний, в частности миокардиальной ишемии, ишемии головного мозга и ишемии конечностей, с применением моноцитов, выделенных из периферической крови, пуповинной крови человека (HUCB) и костного мозга. Настоящее изобретение относится к терапии на основе популяций терапевтических клеток, обогащенных недифференцированными клетками моноцитарной линии дифференцировки, их композициям и способам получения. Настоящее изобретение также относится к способам применения таких терапий и композициям для лечения или предупреждения ишемии или, в противном случае, для стимуляции тканевой перфузии и улучшения образования коллатеральных кровеносных сосудов. Согласно одному объекту настоящего изобретения, популяция мононуклеарных клеток, обогащенная недифференцированными клетками моноцитарной линии дифференцировки, применяется для лечения ишемии сердца и стенокардии. Согласно другому объекту настоящего изобретения, заболеванием является инсульт, и недифференцированные клетки моноцитарной линии дифференцировки выделяют из человеческой периферической крови, пуповинной крови человека (HUCB) и костного мозга.
Уровень техники
Стенокардия связана с болью и дискомфортом в груди, что вызвано недостаточным притоком крови к сердечной мышце. Распространение случаев стенокардии у взрослых жителей США старше 20 лет оценивается в размере 9,100,000. Стабильная стенокардия представляет собой стенокардию, при которой боль предсказуемым образом возникает при физических усилиях или при воздействии на субъект эмоционального стресса. Распространение случаев стабильной стенокардии у взрослых жителей США старше 45 (без соответствующего инфаркта миокарда) составляет 500,000. Смотрите Rosamond etal. Circulation 117(4): e25 (2008).
В настоящее время терапии включают аспирин, бета-блокаторы (например, карведилол, пропранолол, атенолол), нитроглицерин (для экстренной помощи), сосудорасширяющие средства, такие как блокаторы кальциевых каналов (например, нифедипин (Адалат) и амлодипин), мононитрат изо-сорбида и никорандил, ингибиторы канала If (например, ивабрадин), АСЕ ингибиторы, статины и ранолазин (Ранекса). Однако такие терапии, как правило, только лечат боль, без предотвращения периодического повторения боли, но не все виды стенокардии отвечают на такое лечение. Клинические испытания проводят с применением CD34 стволовых клеток для лечения рефракторной стенокардии, с целью исследования возможности применения стволовых клеток для порождения новой васкуляризации, что должно приводить к предотвращению повторного возникновения боли. Однако еще не было показано, что такое лечение является безопасным и эффективным. Таким образом, существует необходимость в способе лечения, оказывающем продолжительный эффект на стенокардию, особенно рефракторную стенокардию.
Уход за пациентами с рефракторной стенокардией является сложным и требует многостороннего подхода. В настоящее время терапии включают аспирин, бета-блокаторы (например, карведилол, пропранолол, атенолол), нитроглицерин (для экстренной помощи), сосудорасширяющие средства, такие как блокаторы кальциевых каналов (например, нифедипин (Адалат) и амлодипин), мононитрат изосорбида и никорандил, ингибиторы канала If (например, ивабрадин), АСЕ ингибиторы, статины и ранолазин (Ранекса). И такие терапии, при попытке уменьшить боль, как правило, включают сложные режимы с изнурительными схемами приема многочисленных различных лекарственных средств и их комбинаций. Однако такие терапии, как правило, лечат боль, без предотвращения периодического повторения боли, но не все виды стенокардии отвечают на такое лечение.
В дополнение к фармацевтическим терапиям, стенокардию можно лечить интервенционистскими методами, такими как чрескожная транслюминальная коронарная ангиопластика или операция аортокоронарного шунтирования (АКШ), но такие терапии не подходят некоторым больным стенокардией из-за ряда факторов, таких как неблагоприятная анатомия коронарного русла, тонкие коронарные артерии, дистальное или диффузионное коронарное поражение и т.д. Рекомендации американской кардиологической ассоциации по альтернативным терапиям включают трансмиокардиальную реваскуляризацию лазерным скальпелем (Класс 11a), усиленную наружную контрпульсацию и стимуляцию спинного мозга (Класс 11b).
Исследуются новые способы лечения, включая применение популяций стволовых клеток. В ряде исследований на первых стадиях была показана регенерация сердечной ткани в случае инфаркта миокарда при применении фракций, содержащих мононуклеарные стволовые клетки костного мозга. Такие исследования показали: (i) регенерацию миокарды после инфаркта; (ii) уменьшение размера инфаркта; и (iii) экспрессию de novo кардиальных белков клетками костного мозга человека. При продолжении этих предшествующих исследований несколько групп показали регенеративный потенциал мезенхимальных клеток, происходящих из костного мозга, на различных экспериментальных моделях сердца, причем результаты первоначально основывались на их миогенном и ангиогенном потенциале.
Клинические испытания, в основном на пациентах с острым инфарктом миокарда и с интракоронарной доставкой стволовых клеток, уже были проведены для исследования безопасности и эффективности аутологичной трансплантации клеток для улучшения восстановления сердца. Однако эти испытания показали спорные результаты без очевидных оснований для расхождений, исходя из дизайна клинического исследования и клеточных популяций или способов доставок.
В случае ишемической болезни сердца некоторые клинические испытания показали, по меньшей мере, безопасность мононуклеарных стволовых клеток, происходящих из костного мозга, с различными степенями эффективности. Наиболее общий способ доставки в этих испытаниях представляет собой интрамиокардиальную инфузию стволовых клеток - либо трансэндокардиальную, либо трансэпикардиальную.
В случае рефракторной стенокардии, некоторые группы провели клинические испытания, в основном, применяя мононуклеарные клетки костного мозга (ВММС), сначала в качестве единственного лечения или вместе с АКШ.
Для примера, Hamano et al. ввели ВММС трансэпикардиальным способом, вместе с АКШ, пяти неоперабельным пациентам "no option" с ишемической кардиомиопатией. Результаты показали объективное увеличение миокардиальной перфузии в инъецированной области у трех пациентов. Однако однозначность результатов этого исследования нарушал сопутствующий эффект от АКШ, и терапевтические эффекты лечения ВММС остались неясными.
Другие исследователи сообщили о первоначальных результатах, полученных при эндомиокардиальной инъекции ВММС, доставляемых перкутанным катетером, ведомым электромеханическим картированием (NOGA™ система). В общем, эти нерандомизированные испытания показали, что ВММС, непосредственно перенесенные в ишемический миокард, приводили к ослаблению симптомов, а также к повышению способности переносить физическую нагрузку и улучшенной миокардиальной перфузии и функции у пациентов с рефракторной стенокардией, однако такие результаты наблюдались у некоторых, но не у всех пациентов. В большинстве этих испытаний принимали участие неоперабельные пациенты "no option" с ишемической кардиомиопатией.
Недавно сообщили о первом ожидаемом рандомизированном исследовании, при котором ВММС эндомиокардиально вводили при серьезной коронарной болезни сердца (PROTECT-CAD). Это исследование показало значительное увеличение продолжительности физических нагрузок, фракции выброса левого желудочка и уменьшение симптомов вызываемой стрессом ишемии миокарда в группе, подлежащей лечению.
Losordo et al. осуществили дважды слепое рандомизированное плацебо-контролируемое испытание фазы 1/Па с эскалацией дозы эндомиокардиальной инъекцией аутогенных CD34* стволовых клеток в случае рефракторной стенокардии. Параметры эффективности, включая частоту стенокардии, действенность нитроглицерина, продолжительность физических нагрузок и CCSAC класс, показали тенденцию к улучшению симптомов у пациентов, подвергающихся лечению с применением CD34+ клеток, по сравнению с пациентами, получающими плацебо.
Таким образом, для неоперабельных пациентов "no option" со стенокардией клинические испытания с применением мононуклеарных стволовых клеток, происходящих из костного мозга, показали некоторое улучшение миокардиальной перфузии и, но в меньшей степени, улучшение вентрикулярной функции. В большинстве этих исследований участвовали пациенты с ишемической кардиомиопатией, со снижением фракции выброса левого желудочка от умеренного до серьезного (LVEF). Однако не было данных по терапии на основе терапевтических клеток (то есть, мононуклеарных клеток или мезодермальных стволовых клеток), которые могли бы подтвердить реальное уменьшение боли или улучшение перфузии у большинства или у всех пациентов, подвергшихся лечению.
От около 5 до около 15% пациентов с хроническим заболеванием коронарных артерий показывают сильную стенокардию, приводящую к потере дееспособности, которая не подлежит контролю комбинацией обычных терапевтических инструментов, включая многократно повторяющееся лечение с применением лекарственной терапии, чрескожную транслюминальную коронарную ангиопластику (РТСА) и операцию аортокоронарного шунтирования (АКШ) (35, 37). Тяжелая стенокардия часто приводит к существенному ухудшению качества жизни. Уменьшение симптомов у неоперабельных пациентов "no option" с рефракторной стенокардией является сложным и требующим больших усилий процессом. Альтернативные терапии согласно рекомендациям американской кардиологической ассоциации (11, 14), такие как трансмиокардиальная реваскуляризация лазерным скальпелем, усиленная наружная контрпульсация и стимуляция спинного мозга, в лучшем случае, все обеспечивают скромные результаты (9, 26, 31, 45). Подавляющее большинство пациентов с рефракторной стенокардией (75%) сохранили функцию левого желудочка, причем для них коэффициент смертности является более низким, чем у пациентов с коронарной болезнью сердца (36, 54); и эта группа пациентов быстро растет.
Клеточная терапия, особенно трансплантация аутологичных клеток костного мозга, появилась как новый возможный метод лечения для восстановления сердца. Некоторые гипотетические механистические объяснения связаны с миогенным и ангиогенным потенциалом стволовых клеток, и активацией роста резидентных клеток-предшественников через паракринные эффекты (2, 15-17, 22, 48, 49, 52). Хотя регенерация миокардиальной ткани и сопутствующее восстановление инфарктной области уже были показаны на экспериментальных моделях животных, существует неопределенность в отношении переноса этих результатов на человека (7, 33), применение ВММС трансплантации для регенерации сердечной ткани является не стандартным для клинической практики.
С одной стороны, у пациентов с рефрактерной стенокардией могут наступить улучшения в результате проведения терапии на основе клеток, особенно в отношении ангиогенеза. Ангиогенные эффекты, как считается среди исследователей, очень важны при исследовании влияния клеточной терапии на пациента-человека (8).
В некоторых преклинических исследованиях сообщили о ангиогенных эффектах (8, 28, 33, 48). Улучшение ангиогенеза наблюдалась в случае трансплантации в сердце c-kit клеток костного мозга (ВМ), по сравнению с мышами, представляющими собой отрицательный контроль (40). Мобилизация мышиных ВМ клеток в кровоток после острого инфаркта миокарда приводит к регенерации миоцитов и сосудистых структур (39). Недавнее исследование на нечеловекообразных приматах с применением подобного протокола показало улучшение локальной перфузии у ВМ-обработанных животных, что позволяет сделать предположении о наличии потенциальных ангиогенных эффектов (30). Это функциональное преимущество имплантации ВМ клеток вероятно связано с паракринным эффектом, усилением ангиогенеза через локальное высвобождение многочисленных факторов роста, таких как васкулярный эндотелиальный фактор роста и получаемый из стромальных клеток фактор 1, среди прочего (8, 48).
В клинических испытаниях, в которых принимали участие пациенты с рефракторной стенокардией, которым вводились происходящие из костного мозга стволовые клетки или ВММС, наблюдалось улучшение симптомов и способности переносить физическую нагрузку, а также улучшение миокардиальной перфузии (4, 6, 8, 12, 13, 19, 21, 41, 53, 55, 56, 59). Beeres et al. (3) провели испытание, применяя интрамиокардиальную инъекцию аутогенных ВММС 25 пациентам с рефракторной стенокардией, которое показало длительные положительные эффекты, оказываемые на ангинальные симптомы и миокардиальную перфузию. Losordo et al. (34) осуществили дважды слепое рандомизированное плацебо-контролируемое испытание фазы I/IIa с эскалацией дозы, применяя эндомиокардиальную инъекцию аутологичных CD34+ стволовых клеток пациентам с рефракторной стенокардии, демонстрируя увеличения продолжительности физической нагрузки в дополнение к улучшению класса стенокардии согласно классификации Канадской ассоциации кардиологов (CCSAC) у пациентов с введенными CD34+ клетками. Ramshorst et al. (58) провели рандомизированное контролированное испытание интрамиокардиальной инъекции клеток костного мозга в случае рефракторной стенокардии, с краткосрочным наблюдением (3-6 месяцев), показывая скромное улучшение миокардиальной перфузии, по сравнению с пациентами, получающими плацебо.
Наблюдая минимальное улучшение в отношении левого желудочка и принимая во внимание клинический ответ в предшествующем испытании рефрактерной стенокардии, предположили, что первичным действием при трансплантации стволовых клеток костного мозга человеку является стимуляция миокардиального ангиогенеза, но не чисто миогенез. В данном случае, ангиогенез несомненно может улучшить левожелудочковую функцию посредством спасения или восстановления гибернирующего миокарда, но до ограниченной степени, что было продемонстрировано этими испытаниями и некоторыми мета-анализами (1, 32, 44).
Предшествующие преклинические и клинические исследования подтвердили потенциальную применимость, безопасность и эффективность терапии стволовыми клетками для восстановления ткани сердечной мышцы, причем в исследовании участвовали пациенты с заболеваниями от острого инфаркта миокарда до хронической ишемической болезни сердца (33).
Наиболее значимым вопросом является возможность применения лабораторных результатов во врачебной практике. Различия в дизайне клинического исследования, получении стволовых и мононуклеарных клеток, и методиках инфузии дали некоторую надежду, но в общем была показаны невоспроизводимые результаты в различных исследованиях (43).
Цереброваскулярным заболеванием, рассматриваемым в качестве одного из наиболее распространенных пяти неконтагиозных заболеваний, болеют около 50 миллионов человек во всем мире, что приводит к около 5.5 миллионам смертей в год. Из этих 50 миллионов инсульт происходит у коло 40 миллионов человек.
Инсульт - это другое состояние, в котором ишемия также играет значительную роль, как и в стенокардии. Инсульт является третьей основной причиной смертности в развитых странах и является основной причиной потери дееспособности у взрослых людей. В настоящее время существует только один доступный способ лечения. Заболевание сосудов влияет на когнитивную и двигательную функцию и приводит к изменениям в иммунной системе. Это исследование сфокусировано на патофизиологии инсульта и развитии новой клеточной терапии (на основе клеток, полученных из пуповинной крови (HUCB)), что, как было показано в более ранних исследованиях, улучшает двигательную дисфункцию и уменьшает размеры инфаркта. Роль иммунного/воспалительного ответа в развитии черепно-мозговой травмы после инсульта до конца не ясна. После ишемического события иммунный ответ приводит к притоку нейтрофилов, Т-клеток, В-клеток, природных клеток-киллеров, а также микроглий в подвергшееся инфаркту полушарие и изменению профиля этих же иммунных клеток в периферической крови. В этом исследовании было изучено, могут ли положительные эффекты от введения HUCB быть связаны со специфической клеточной популяцией.
Лечение инсульта можно разделить на две категории: предупреждение и неотложная медицинская помощь. Предупреждающее лечение в настоящее время основывается на антитромбоцитарных средствах, антикоагуляционных средствах, хирургическом лечении, пластической операции на сосудах, регулировании образа жизни и медицинской поддержке. В качестве антитромбоцитарного средства обычно применяется аспирин. Применение антикоагуляционных средств, как оказалось, не имеет статистической значимости. Хирургическое лечение, как оказалось, является эффективным для отдельных подгрупп. Пластическая операция на сосудах все еще является экспериментальной методикой с недостаточным количеством данных для анализа. Регулирование образа жизни включает отказ от курения, регулярные занятия физической культурой, регулирование питания, ограничение потребления соли и умеренное потребление спиртных напитков. Медицинская поддержка включает лекарственное лечение, направленное на понижение кровяного давления, понижение содержания холестерина, контроль развития диабета и контроль проблем с кровотоком.
Срочная медицинская помощью заключается в применении тромболитиков, нейрозащитных средств, терапии на основе оксигенированной фторуглеродной питательной эмульсии (OFNE), Нейроперфузии, терапии на основе ингибиторов тромбоцитов GPIIb/IIIa и реабилитации/физиотерапии.
Тромболитические средства индуцируют или замедляют тромболиз, наиболее часто применяемым средством является тканевый плазминогенный активатор (t-PA). Рекомбинантный t-PA (rt-PA) способствует восстановлению церебральной циркуляции путем растворения (разложения) сгустков, которые препятствуют потоку крови. Такое лечение является эффективным, с крайне коротким терапевтическим окном. Тромболитические средства должны вводиться в течение трех часов после приступа. Также необходимо провести компьютерную томографию перед применением лечения, таким образом, уменьшая количество располагаемого времени. Genetech Pharmaceuticals производит ACTIV ASE® и в настоящее время является единственным источником rt-PA.
Нейрозащитные средства представляют собой лекарственные средства, которые минимизируют эффекты от ишемического каскада и включают, например, антагонисты глутамата, антагонисты кальция, антагонисты опиатов, GAB A-A агонисты, ингибиторы кальпаина, ингибиторы киназ и антиоксиданты. В настоящее время продолжаются некоторые клинические испытания острого ишемического инсульта. Благодаря их комплементарным функциям подавления коагуляции и защиты головного мозга, методики неотложного лечения будут наиболее вероятно включать комбинацию тромболитической и нейрозащитной терапий. Однако подобно тромболитикам большинство нейрозащитных средств, для достижения эффекта, необходимо вводить в течение 6 часов после инсульта.
Терапия посредством оксигенированной фторуглеродной питательной эмульсии (OFNE) доставляет кислород и питательные вещества в головной мозг через цереброспинальную жидкость. Нейроперфузия - это экспериментальная методика, в ходе которой обогащенная кислородом кровь перенаправляется через головной мозг, в качестве способа минимизации опасности ишемического инсульта. Терапия ингибиторами тромбоцитов GPIIb/IIIa ингибирует способность гликопротеиновых GPIIb/IIIa рецепторов на тромбоцитах к агрегации или скоплению. Реабилитационная физиотерапия должна быть своевременной и начинаться сразу после инсульта, однако, она не может привести к изменениям в пораженных областях головного мозга. Целью реабилитации является улучшение функции таким образом, чтобы субъект, переживший инсульт, мог настолько сохранить способность жить самостоятельно, насколько это возможно.
Хотя некоторые методики неотложного лечения дали надежду при проведении клинических испытаний, исследование, проводимое в Кливленде, показало, что только 1.8% пациентов проявляли симптомы инсульта, даже после t-PA лечения (Katz an IL, et at., 2000 JAMA, 283:1151-1158). t-PA является в настоящее время наиболее широко применяемым из вышеупомянутых методик неотложного лечения инсульта, однако, число пациентов, получающих любое новое "эффективное" неотложное лечение инсульта, как оценивают, составляет меньше 10%. Эти статистические данные показывают ясную необходимость в возможности неотложного лечения инсульта в период времени более 24 часов после инсульта.
Для некоторых методик неотложного лечения (то есть, t-PA) время введения является решающим. Недавние исследования показали, что 42% пациентов, переживших инсульт, ожидали до 24 часов прежде чем быть доставленными в госпиталь, со средним временем доставки около 6 часов после инсульта. t-PA, как было показано, повышает восстановление у 113 пациентов, которые подверглись лечению, однако недавнее исследование, проведенное по поручению FDA (стандартное лечение альтеплазой) показало, что около трети времени трех-часового лечения было потеряно, приводя к неэффективному лечению. За исключением реабилитации, остальные методики неотложного лечения все еще проходят клинические испытания и не являются широкодоступными в США, особенно в сельской местности, где может не быть крупных медицинских центров с необходимыми специалистами по неврологии и персоналом отделения скорой помощи, таким образом, доступность любого из этих новых методов диагностики инсульта и терапии может быть ограничена некоторое время.
Затраты на лечение инсульта в США составляют более 43 миллиардов долларов, включая как прямые, так и косвенные затраты. Прямые затраты составляют около 60% от общего количества и включают затраты на пребывание в госпитале, оплату врачебной помощи и затраты на реабилитацию. Эти затраты, как правило, составляют $15,000 на пациента в первые три месяца; однако в около 10% случаев затраты составляют более $35,000. Косвенные затраты составляют оставшуюся часть и включают компенсацию потери дееспособности пережившим инсульт пациентом и потери дееспособности опекуном пережившего инсульт пациента (смотрите National Institute of Neurological Disorders and Stroke, NIH).
Около 750,000 случаев инсульта происходит каждый год в США, из которых 1/3 приводит к смерти. Из оставшихся в живых пациентов около 1/3 слегка теряют дееспособность, 1/3 становится недееспособной в умеренной степени, и у 1/3 пациентов наступает серьезная потеря дееспособности. Ишемический инсульт составляет 80% от этих случаев инсульта.
В том возрасте, в котором сейчас находится послевоенное поколение, общее число инсультов, как предполагают, существенно увеличивается. Риск инсульта увеличивается с возрастом. После 55 лет риск инсульта удваивается каждые десять лет, около 40% 80-летних перенесли инсульт.
Также со временем увеличивается риск повторного инсульта. Риск повторного инсульта составляет 25-40% первые пять лет после первого. Так как послевоенное поколение достигает своего золотого возраста, этот рынок существенно вырастет. Также, спрос на эффективное лечение возрастет до критической точки.
Неспособность эффективно ослабить разрушающие эффекты инсульта приводит к необходимости разрабатывать новые терапевтические стратегии как минимизации первичной мозговой травмы, так и восстановления поражения головного мозга сразу после того, как патологический каскад инсульта пошел своим чередом.
Трансплантация моноцитов была предложена как средство лечения инсульта. Из-за сложности эффективного лечения пациентов после инсульта в данной области техники существует необходимость в способах улучшения лечения инсульта.
Неоваскуляризация представляет собой интегральный процесс воспалительных реакций и последующего восстановительного каскада в пораженной ткани. Моноциты/макрофаги играют ключевую роль в воспалительном процессе, включая ангиогенез, а также защитных механизмах, благодаря проявлению бактерицидного и иммуномодулирующего действия. Проведенные в настоящее время исследования показали помощь моноцитов/макрофагов в регуляции ангиогенеза в ишемической ткани, опухолях и хроническом воспалении. В отношении неоваскуляризации, сопровождающейся восстановлением ткани, моноциты/макрофаги должны быть весьма привлекательны для терапии на основе клеток, благодаря их значительным преимуществам, таким как неонкогенность, нетератогенность, отсутствие этических споров по их поводу, многочисленные функции, включая проангиогенные факторы и факторы роста, и легкое самоустранение. Не только источники взрослого организма, такие как костный мозг и периферическая кровь, но и пуповинная кровь (UCB), могут быть потенциальными источниками аутологичных или аллогенных моноцитов/макрофагов. В качестве первого кандидата особенно UCB моноциты должны рассматриваться, благодаря их быстрой возможности применимости, низкому подавлению иммунной системой и многочисленным функциям, таким как противовоспалительная реакция, в силу уникальной иммунной и воспалительной незрелости, а также проангиогенной способности. Общие характеристики и потенциальные моноциты/макрофаги представлены для терапии на основе клеток, особенно с фокусов на неоваскуляризацию и UCB-получаемые моноциты.
Одна представляющая интерес функция моноцитов/макрофагов состоит в повышении ангиогенеза, связанного с воспалительными реакциями. Ангиогенез (или неоваскуляризация) является основным элементом воспалительных процессов, включая последующие каскады восстановления [Sunderkotter, 1994 #4]. В ходе первоначального процесса восстановления циркулирующие моноциты крови проникают в ткани [Bosco, 2008 #3]. В начале, близлежащие эндотелиальные и воспалительные клетки регулируют этот проход моноцитов через стенку сосудов путем высвобождения ряда адгезионных и хемотаксических веществ [Baggiolini, 2000 #9; Imhof, 2004 #2; Bosco, 2008 #3]. Вдоль хемотаксических и кислородных градиентов между нормальной и пораженной тканью проникшие из сосудов моноциты перемещаются и собираются в гипоксическом и/или некротическом центрах нездоровых тканей перед дифференциацией в макрофаги тканей. Подходящие патологические ткани, к которым подходят моноциты/макрофаги для накапливания, являются следующими: солидные опухоли, миокардиальный или церебральный инфаркт, синовиальное соединение хронического артрита или атероматозная бляшка, бактериальная инфекция и раны [Baggiolini, 2000 #9; Murdoch, 2004 #1; Bosco, 2008 #3; Mantovani, 2002 #15] (Фиг.8).
После дифференциации моноцитов в макрофаги, макрофаги в тканях, как известно, существуют в виде поляризованных популяций, М1 и М2 подгрупп [Mantovani, 2004 #67; Sica, 2006 #16; Mantovani, 2004 #67; Mantovani, 2002 #15]. В то время как М1 поляризованные макрофаги являются сильными воспалительными клетками, которые продуцируют провоспалительные цитокины и фагоцитируют патогены, М2 макрофаги модулируют воспалительные ответы и способствуют ангиогенезу и восстановлению ткани [Mantovani, 2004 #67; Sica, 2006 #16; Mantovani, 2004 #67; Mantovani, 2002 #15]. Интересно, что при генной экспрессии макрофагов, комбинации М1 и М2 подгрупп в начале заживления раны превращается в доминирование М2 генов позже [Deonarine, 2007 #68]. В ходе начальной стадии процесса заживления раны М1 макрофаги приводят к прямой воспалительной реакции, которая очищает рану и устраняют микробы и пораженные ткани, тогда как восстановление ткани и ангиогенез начинаются благодаря М2 макрофагам в то же самое время. На последней стадии, когда очистка М1 макрофагами уже почти завершена, преобладающие М2 макрофаги продолжают свою работу, способствуя восстановлению ткани и ангиогенезу [Deonarine, 2007 #68]. Накапливание, очевидно, предполагает, что рекрутированные моноциты/макрофаги способствуют модуляции и регуляции неоваскуляризации в ишемической ткани, опухолях и хроническом воспалении, таком как подвергшееся артриту синовиальное соединение и атеросклероз.
Сущность изобретения
Предпосылкой к созданию настоящего изобретения является ощущаемая в течение долгого периода времени необходимость в способах и композициях для лечения ишемии (предпочтительными примерами которой являются стенокардия и инсульт) и для улучшения перфузии, которые устраняют основные причины ишемии, и скорее приводят к улучшенной перфузии, чем просто к устранению боли, вызванной такими состояниями, и повышают надежность эффективности терапии для таких состояний на основе терапевтических клеток.
Моноциты, которые происходят из монобластов, клеток-предшественников гемопоэтических стволовых клеток в костном мозге (ВМ), циркулируют в кровотоке перед проникновением в ткани тела. В тканях моноциты дифференцируют в различные типы резидентных макрофагов тканей в зависимости от их анатомического расположения, например клетки Лангерганса в коже, купферовские клетки печени, остеокласты в костях, микроглии в центральной нервной системе, альвеолярный макрофаги в легких и синовиальные клетки типа А в синовиальном соединении (Bosco, et al., 2008, Gordon, 2003, Imhof and Aurrand-Lions, 2004, Murdoch, et al., 2004, Sunder-kotter. Et al., 1994) (Фиг.8).
Моноциты/макрофаги могут осуществлять фагоцитоз, применяя медиаторы, такие как антитела или компоненты комплемента, которые покрывают микробы, или путем связывания с патогенами непосредственно через специфические рецепторы, которые распознают их (эндоцитоз). Кроме того, моноциты/макрофаги способны убивать клетку-хозяина, инфицированную патогенами, через ответ иммунной системы, благодаря опосредованной антителами клеточной цитотоксичности (Nathan, 1987, Sunderkotter, et al., 1994). Более того, они являются уникальными иммунорегуляторными клетками, способными как стимулировать, так и сдерживать иммунную активность, включая представление антигена Т -клеткам и контролированную секрецию широкого ряда цитокинов и факторов роста (Bosco, et al., 2008, Murdoch, et al., 2004, Paulnock, et al., 2000). Кратко, моноциты/макрофаги играют главную роль во врожденной защитной системе, благодаря способности убивать патогены, включая фагоцитоз и клеточную цитотоксичность, и способности к иммуномодуляции (Bosco, et al., 2008, Paulnock, et al., 2000).
Стенокардия и инсульт являются примерами ишемических состояний или состояния, когда пациент нуждается в улучшенной перфузии. В этом отношении, настоящее изобретение частично удовлетворяет потребность в новых уникальных способах лечения стенокардии, инсульта или других форм ишемии. При других ишемических состояниях или состоянии, когда пациент нуждается в улучшенной перфузии, также существует необходимость в улучшении посредством подобных терапий.
В одном варианте выполнения настоящего изобретения способ содержит введение недифференцированных моноцитов субъекту, нуждающемуся в лечении, где недифференцированные моноциты вводятся субъекту системно, в количестве и в момент времени, специальным образом определенные для эффективности лечения.
Объектом настоящего изобретения является способ лечения ишемии у субъекта, содержащий инъекцию популяции терапевтических клеток, обогащенной недифференцированными клетками моноцитарной линии дифференцировки, в ишемическую ткань субъекта. В некоторых вариантах выполнения настоящего изобретения ишемией является сердечная ишемия, и ишемической тканью является сердечная мышца. Другим объектом настоящего изобретения является способ улучшения перфузии у субъекта, содержащий инъекцию популяции терапевтических клеток, обогащенной недифференцированными клетками моноцитарной линии дифференцировки, в ткань субъекта, нуждающуюся в улучшенной перфузии. В определенных вариантах выполнения настоящего изобретения тканью является сердечная мышца. Еще одним объектом настоящего изобретения является способ лечения стенокардии у субъекта, содержащий инъекцию популяции терапевтических клеток, обогащенной недифференцированными клетками моноцитарной линии дифференцировки в сердечную мышцу субъекта. В вариантах выполнения любого объекта настоящего изобретения способы могут включать инъекцию, по меньшей мере, 105 недифференцированных клеток моноцитарной линии дифференцировки в популяции терапевтических клеток, обогащенной недифференцированными клетками моноцитарной линии дифференцировки. Следующие объекты и варианты выполнения настоящего изобретения могут кроме того включать вариант выполнения настоящего изобретения, когда популяция недифференцированных моноцитарных клеток вводится в сердечную мышцу путем, по меньшей мере, двух отдельных инъекций, по меньшей мере, трех отдельных инъекций, по меньшей мере, четырех отдельных инъекций, по меньшей мере, пяти отдельных инъекций, по меньшей мере, десяти отдельных инъекций, по меньшей мере, двадцати отдельных инъекций, по меньшей мере, тридцати отдельных инъекций, по меньшей мере, сорока отдельных инъекций, по меньшей мере, пятидесяти отдельных инъекций, по меньшей мере, шестидесяти отдельных инъекций, по меньшей мере, семидесяти отдельных инъекций, по меньшей мере, восьмидесяти отдельных инъекций, по меньшей мере, девяноста отдельных инъекций или, по меньшей мере, ста отдельных инъекций, или, по меньшей мере, двухсот отдельных инъекций. Следующие объекты и варианты выполнения настоящего изобретения могут кроме того включать вариант выполнения настоящего изобретения, когда инъекция составляет от 0.05 мл до 0,5 мл или около 0.2 мл. Следующие объекты и варианты выполнения настоящего изобретения могут кроме того включать вариант выполнения настоящего изобретения, когда популяция терапевтических клеток, обогащенная недифференцированными клетками моноцитарной линии дифференцировки, является аутологичной или аллогенной. Следующие объекты и варианты выполнения настоящего изобретения могут кроме того включать вариант выполнения настоящего изобретения, когда популяция терапевтических клеток является популяцией мононуклеарных клеток, то есть недифференцированными клетками моноцитарной линии дифференцировки или моноцитарными стволовыми клетками. Следующие объекты и варианты выполнения настоящего изобретения могут кроме того включать вариант выполнения настоящего изобретения, когда перед инъекцией следует стадия, выбранная из следующих стадий: выделение стволовых клеток из образца, применяя способ, который приводит к обогащению недифференцированными клетками моноцитарной линии дифференцировки; культивирование популяции терапевтических клеток в условиях обогащения недифференцированными клетками моноцитарной линии дифференцировки; и добавление недифференцированных клеток моноцитарной линии дифференцировки к популяции терапевтических клеток.
Другой объект настоящего изобретения относится к инъецируемым терапевтическим средствам и содержит устройство, способное доставлять отмеренные инъекции терапевтического средства в ишемическую ткань, где устройство содержит резервуар для терапевтического средства, и терапевтическое средство содержит популяцию терапевтических клеток, обогащенную недифференцированными клетками моноцитарной линии дифференцировки. В одном варианте выполнения настоящего изобретения популяция терапевтических клеток представляет собой мононуклеарную клеточную популяцию. Следующие объекты и варианты выполнения настоящего изобретения могут кроме того включать вариант выполнения настоящего изобретения, когда популяция терапевтических клеток, обогащенная недифференцированными клетками моноцитарной линии дифференцировки, содержит, по меньшей мере, 105 недифференцированных клеток моноцитарной линии дифференцировки.
Краткое описание чертежей
На Фиг.1 приведено сравнение между числом недифференцированных интрамиокардиально инъецированных моноцитов (число клеток x 10^6, x-ось) и улучшением миокардиальной перфузии (%, y-ось), через шесть месяцев после проведения клеточной терапии. Корреляция между числом введенных путем инъекции недифференцированных моноцитов и улучшением миокардиальной перфузии показана графически и является статистически значимой (p<0.05, FD=6).
На Фиг.2 приведено сравнение между числом интрамиокардиальных инъекций (x-ось) и улучшением миокардиальной перфузии (%, y-ось), через шесть месяцев после проведения клеточной терапии. Этот график показывает, что улучшение перфузии обусловлено инъекцией клеток, а не физическим воздействием иголок или инфузией жидкости, так как в этом случае не наблюдается значимой корреляции между улучшением миокардиальной перфузии и числом инъекций (p=n.s; FD=6).
На Фиг.3 показаны изменения в CCSAC в последующие 18 месяцев. Каждая линия на графике обозначает одного пациента, зарегистрированного в ReACT, и соответствующее улучшение CCSAC через 18 месяцев контроля. Ось x обозначает класс по CCSAC (номер 4 для рефракторной стенокардии и номер 0 для отсутствия боли). Ось y обозначает контроль пациента из месяца в месяц. Таблица слева показывает статистический анализ на основе одностороннего критерия Вилкоксона для улучшения CCSAC за 3, 6, 12 и 18 месяцы контроля. Относительно базовой линии; изменение класса стенокардии является статистически значимым, если p<0.0125 (0.05/4) (коррекция Бонферрони).
На Фиг.4 показаны изменения в миокардиальной ишемической области, оцениваемые с помощью стресс-сцинтиграфии с технецием на 12 месяц контроля. Каждая линия на графике обозначает одного пациента, зарегистрированного в ReACT, и соответствующее оцененное с помощью сцинтиграфии улучшение ишемической области миокарда за 12 месяцев контроля. Ось x обозначает процент оцененной с помощью сцинтиграфии миокардиальной ишемической области. Ось y обозначает контроль пациента из месяца в месяц (сцинтиграфический анализ проводился только для шестого и двенадцатого месяцев). Таблица внизу справа показывает статистический анализ на основе одностороннего критерия Вилкоксона для оцененного с помощью сцинтиграфии улучшения ишемической области миокарда на шестой и двенадцатый месяц контроля. Относительно базовой линии; изменение оцененного с помощью сцинтиграфии улучшения ишемической области миокарда является статистически значимым, если p<0.025 (0.05/2) (коррекция Бонферрони).
Фиг.5: Моноциты и макрофаги являются решающим компонентом пуповинной крови для восстановления поражения головного мозга после окклюзии средней мозговой артерии (МСАО) у крыс. А) После МСАО наблюдается существенное поражение ипсилатерального полушария, особенно в полосатом теле, гиппокампе и коре головного мозга. HUCB лечение через 48 часов после МСАО уменьшает размер поражения, тогда как удаление CD14+ моноцитов и макрофагов из фракции пуповинной крови человека (HUCB) уменьшает этот эффект. B) При удалении CD14+ моноцитов и макрофагов из HUCB, объем инфаркта после МСАО возвращается до предшествующего уровня объема инфаркта, то есть как при отсутствии лечения крыс с МСАО. Объем инфаркта у CD14 обедненной группы был значительно выше, чем у HUCB обработанной группы.
Фиг.6: Ступенчатое измерение двигательной асимметрии. A) После МСАО уменьшается число шагов, которые может совершить поврежденная конечность. HUCB введение улучшает работоспособность этой конечности, которая вновь теряется при удалении CD14+ клеток (моноцитов и макрофагов) из HUCB фракции. В) Инъекция только CD14+ HUCB клеток улучшает двигатльную функцию повреждненой передней конечности.
Фиг.7: Спонтанная активность уменьшается при введении CD14+ HUCB клеток. После МСАО, крысы становятся гиперактивными. Введение моноцитов и макрофагов пуповинной крови уменьшает активность до нормальных уровней (базовая линия) по многочисленным параметрам движения, включая А) горизонтальную активность, В) общую дистанцию, преодаляемую в клетке, С) вертикальную активность (подъем на задние лапы) и D) вращение против часовой стрелки.
Фиг.8: Схематическое изображение онтогенеза моноцитов/макрофагов. Плюрипотентные стволовые клетки дифференцируют в миелоидные или лимфоидные клетки-предшественники в костном мозге. Клетки-предшественники гранулоцитов-моноцитов происходят из общей миелоидной клетки-предшественника перед дифференциацией в миелобласт и монобласт. Моноциты дифференцируются из монобласта и затем перемещаются из костного мозга в кровь. Моноциты крови дифференцируют в различные типы резидентных макрофагов в зависимости от их анатомического расположения после проникновения в ткань. С другой стороны, в начале воспалительного процесса пополнение и трансэндотелиальная миграция циркулирующих моноцитов дополняется рядом адгезионных и хемотаксических веществ, экспрессированных воспалительными клетками. Рекрутированные моноциты мигрируют вдоль хемотаксических и кислородных градиентов между нормальными и пораженными тканями и накапливаются в воспалительных и гипоксических центрах в ишемии, или солидных опухолях, или хронических воспалениях, перед дифференциацией в макрофаги, которые имеют поляризацию, М1 или М2 подгруппы.
Подробное описание предпочтительных вариантов выполнения настоящего изобретение
Предпосылкой к созданию настоящего изобретения является ощущаемая в течение долгого периода времени необходимость в способах и композициях для лечения ишемии и для улучшения перфузии в общем. Предпочтительным лечением является лечение миокардиальной ишемии и стенокардии. Способы и композиции связаны, в частности, с удивительным открытием, что обогащение популяции стволовых клеток недифференцированными клетками моноцитарной линии дифференцировки повышает надежность эффективности терапевтических средств на основе стволовых клеток.
Костный мозг и популяции стволовых клеток, происходящие из костного мозга, являются природным источником широкого спектра цитокинов, которые участвуют в контроле ангиогенных и воспалительных процессов.
В ходе различных стадий ангиогенеза экспрессируются различные цитокины, такие как фактор некроза опухоли-альфа (TNFα), интерлейкины (ILs), интерферон-д (IFN-g) и фактор стимуляции колоний макрофагов (MCSF). Эти цитокины индуцируют гладкий миоцит к экспрессии интерстициальной коллагеназы и стромелизина, которые в свою очередь снижают локальный коллаген, приводя к истончению кровеносных сосудов и их беспорядочному вздутию. Цитокины, экспрессируемые к стенках сосудов, являются потенциальными хемоаттрактантами для индуцируемой воспалительными клетками экспрессии адгезионных молекул на эндотелии и их контрлигандов на лейкоцитах, способствуют активности тромбоцитов и тромбозу, и ингибируют тромболиз.
Моноциты, то есть недифференцированные моноциты, или промоноциты костного мозга могут активироваться в ответ на хемотаксическое воздействие и подвергаются конечной дифференциации в макрофаги. Макрофаги играют ключевую роль в ангиогенезе благодаря их способности секретировать протеазы, факторы роста, монокины, и влияют на каждую фазу ангиогенного процесса, как, например, приводят к изменениям в локальном экстраклеточном матриксе, индуцируют эндотелиальные клетки для миграции или пролиферации и ингибируют рост сосудов с образованием дифференцированных капилляров.
Физиопатологический процесс ишемических заболеваний состоит в уменьшении перфузии крови в определенных областях тканей. Клетки в гипоперфузионной области страдают от нехватки достаточного снабжения кислородом и поэтому неспособны осуществлять их природные функции. В связи с этим индукция ангиогенеза может улучшить функцию ткани путем уменьшения или восстановления спящих клеток посредством увеличения снабжения кислородом.
Стандартный пациент с рефракторной стенокардией, с жизнеспособным миокардом и сохраненной или слегка подавленной функцией левого желудочка, является идеальным кандидатом для ангиогенной терапии, с применением интрамиокардиальной инъекции популяции стволовых клеток, обогащенной недифференцированными клетками моноцитарной линии дифференцировки, по настоящему изобретению.
Мы провели нерандомизированные клинические испытания на пациентах с рефракторной стенокардией, с сохраненной или слегка подавленной функцией левого желудочка, и интрамиокардиальной инъекцией ВММС в качестве единственно терапии, для того чтобы усилить миокардиальный поток крови через ангиогенез, для нас были важны только хорошо обоснованные результаты терапии стволовыми клетками костного мозга и уникальная специфическая потребность в лечении участвующих в испытаниях пациентов.
Определения
Как применяется в настоящем документе, термин "популяция терапевтических клеток" может обозначать либо популяцию мононуклеарных клеток, либо популяцию стволовых клеток, способных дифференцировать в клетки мезодермальной линии дифференцировки, либо и то, и другое.
Термин "пациент", как применяется в настоящем документе, включает животное, предпочтительно человека, которому предоставляется лечение, включая профилактическое лечение, с применением клеток согласно настоящему изобретению. В случае лечения инфекций, состояний и болезней, которые специфичны для конкретного животного, такого как пациент-человек, термин пациент относится к этому конкретному животному. Термин "донор" применяется для описания субъекта (животного, включая человека), у которого берут пуповинную кровь или клетки пуповинной крови для применения на пациенте.
Термин "пуповинная кровь", применяемый в настоящем документе, относится к крови, получаемой у новорожденного или плода, наиболее предпочтительно у новорожденного, и предпочтительно относится к крови, которую получают из пуповины или плаценты новорожденного. Предпочтительно, пуповинную кровь получают у новорожденного человека. Применение пуповинной крови в качестве источника мононуклеарных клеток обеспечивает преимущества благодаря легкости выделения пуповинной крови, без нанесения травмы донору. Напротив, получение клеток костного мозга у донора является травматичным. Клетки пуповинной крови могут применяться для аутологичной трансплантации или аллогенной трансплантации, когда и если необходимо. Пуповинную кровь предпочтительно получают непосредственно оттоком из пуповины и/или аспирацией иглой из полученной плаценты у корня или у раздутых вен. Как применяется в настоящем документе, термин "клетки пуповинной крови" относится к клеткам, которые присутствуют внутри пуповинной крови. В одном варианте выполнения настоящего изобретения, клетки пуповинной крови являются мононуклеарными клетками, которые выделяют из пуповинной крови с применением способов, известных специалиста в данной области техники. В следующем варианте настоящего изобретения, клетки пуповинной крови могут далее дифференцировать до введения пациенту.
Термин "эффективное количество" применяется в настоящем документе для описания концентраций или количеств компонентов, таких как средства дифференциации, клетки пуповинной крови, клетки - предшественники или прародители, специализированные клетки, такие как нервные и/или нейральные или глиальные клетки, агенты, позволяющие преодолеть гематоэнцефалический барьер, и/или другие средства, эффективные для получения надлежащего результата, включая дифференциацию стволовых клеток и/или клеток-предшественников в специализированные клетки, такие как нервные или нейральные и/или глиальные клетки, или для описания лечения неврологического нарушения или другого патологического состояния, включая поражение центральной нервной системы пациента, такое как инсульт, сердечный приступ или несчастный случай, или для осуществления трансплантации этих клеток пациенту, подлежащему лечению. Композиции по настоящему изобретению могут применяться для осуществления трансплантации клеток пуповинной крови внутри композиции, для получения благоприятных изменений в головном или спинном мозге или в заболевании или состоянии, подлежащем лечению, где таким изменением является улучшение (такое как остановка или обращение дегенерации заболевания или состояния, с уменьшением неврологического расстройства или улучшением неврологического ответа) или полное излечение заболевания или состояния, подлежащего лечению.
Термины "стволовые клетки" или "клетки-предшественники", как взаимозаменяемо применяется в настоящем документе, относятся к стволовым клеткам и клеткам-предшественникам, происходящим из пуповинной крови. Термины "стволовые клетки" и "клетки-предшественники" известны из области техники (например, Stem Cells: Scientific Progress and Future Research Directions, report prepared by the National Institutes of Health, June, 2001). Термин "нервные клетки" относится к клеткам, имеющим, по меньшей мере, признак нейронного или глиального фенотипа, как, например, исходя из одного или более нейрональных или глиальных маркеров, или клеток, которые будут дифференцировать в клетки, несущие нейрональные или глиальные маркеры. Примеры нейрональных маркеров, которые могут применяться для идентификации нейральных клеток согласно настоящему изобретению, включают, например, нейрон-специфичный ядерный белок, тирозингидроксилазу, белки, ассоциированные с микротрубочками, и кальбиндин, среди прочего. Термин "нервные клетки" также включает клетки, которые являются предшественникам нервных клеток, то есть стволовые клетки и/или клетки-предшественники, которые дифференцируют в нервные клетки или становятся нервными клетками, или клеткам, которые, в конечном счете, покажут нейрональные или глиальные маркеры, причем этот термин включает плюрипотентные стволовые клетки и/или клетки-предшественники, которые, в конечном счете, дифференцируют в нейральные и/или глиальные клетки. Все из вышеупомянутых клеток и их потомство должны пониматься как нервные клетки в целях настоящего изобретения. Нервные стволовые клетки представляют собой клетки, способные к пролиферации, проявлению самоподдержания или восстановлению за время жизни организма, и к генерации клонально связанного потомства нервных клеток. Нервные стволовые клетки приводят к образованию нейронов, астроцитов и олигодендроцитов в ходе развития и могут замещать ряд нервных клеток в головном мозге взрослого организма. Нервные стволовые клетки представляют собой нервные клетки в целях настоящего изобретения. Термины "нервные клетки" и "нейральные клетки", в общем, применяются взаимозаменяемо для многих объектов настоящего изобретения. Предпочтительные нервные клетки для применения в определенных объектах по настоящему изобретению включают те клетки, которые показывают один или более из нервных/нейрональных фенотипических маркеров, таких как Musashi-1, Nestin, NeuN, β-тубулин класса III, GFAP, NF-L, NF-M, белок, ассоциированный с микротрубочками (МАР2), 8100, CNPase, глипикан (особенно глипикан 4), нейрональный пентраксин II, нейронный PAS 1, связанный с ростом нейронов белок 43, белок усиления разрастания аксона, виментин, Hu, интернексин, 04, основной белок миелина и плейотрофин, среди прочего.
Как применяется в настоящем документе, "стволовая клетка" представляет собой клетку эмбриона, плода или взрослого организма, которая имеет, при определенных условиях, способность культивироваться через несколько делений без дифференциации или смерти. Кроме того, стволовые клетки могут, среди прочего, дифференцировать в, по меньшей мере, два отдельных типа клеток.
Как применяется в настоящем документе, "плюрипотентные стволовые клетки" имеют способность дифференцировать в, по меньшей мере, два различных типа клеток, принадлежащих различным зародышевым слоям (мезодерма, эндодерма и эктодерма), из которых происходят все клетки тела. Плюрипотентные клетки могут быть получены из эмбрионов.
"Эмбриональные стволовые клетки" представляют собой стволовые клетки, которые происходят из эмбриона, как правило, из группы клеток, называемых внутренней клеточной массой, которая является частью раннего эмбриона (4-5-дней), называемого бластоцистой. После удаления из бластоцисты клетки внутренней клеточной массы могут быть культивированы как любые другие стволовые клетки.
"Взрослая стволовая клетка" представляет собой стволовую клетку, выделенную из взрослого организма (то есть не из ткани эмбриона). Взрослые стволовые клетки, как и все стволовые клетки, способны создавать свои идентичные копии через множество циклов культивирования. Это свойство называется "самообновлением." Взрослые стволовые клетки, как правило, генерируют клетки-предшественники или клетки-прародители при определенных условиях, которые затем дифференцируют или развиваются в зрелые типы клеток, которые имеют характерные формы и специализированные функции, например клетки, которые формируют стенки кровеносных сосудов. Взрослые стволовые клетки могут быть выделены из множества тканей, включая, например, головной мозг, костный мозг, надкостницу, периферическую кровь, кровеносные сосуды, скелетную мышцу, эпителий кожи и пищеварительную систему, роговицу, пульпу зубов, сетчатку, печень, поджелудочную железу и жировую ткань. Предпочтительными источниками клеток являются периферическая кровь (с применением факторов стимуляции стволовых клеток костного мозга, таких как гранулоцитарный колониестимулирующий фактор - GCS-F, или без них) и костный мозг для недифференцированных клеток моноцитарной линии дифференцировки, и пуповинная кровь для недифференцированных моноцитов и моноцитарной клеточной линии дифференцировки.
Термин "введение" применяется в настоящем документе для описания процесса, посредством которого клетки по изобретению, такие как клетки пуповинной крови, полученные из пуповинной крови или полученные из них более дифференцированные клетки, вводятся пациенту в терапевтических целях. Клетки по изобретению могут вводить рядом способов, включая, но без ограничения к этому, парентеральный (этот термин относится к внутривенному и внутриартериальному, а также другим подходящим парентеральным путям), интратекальный, внутрижелудочковый, интрапаренхиматозный (включая введение в спинной мозг, стволовую часть мозга или двигательную область коры головного мозга), интрацистернальный, внутричерепной, интрастриарный и интранигральный, среди других способов, которые позволяют клеткам по изобретению мигрировать в основной целевой сайт, где они необходимы. Клетки по изобретению могут вводиться в форме интактной пуповинной крови или ее фракции (включая ее мононуклеарную фракцию или фракцию мононуклеарных клеток, включающую высокую концентрацию стволовых клеток или клеток-предшественников). Композиции согласно настоящему изобретению могут применяться без обработки средствами мобилизации или средствами дифференциации ("необработанные", то есть без дальнейшей обработки для дифференциации клеток внутри образца пуповинной крови) или после обработки ("обработанные") средством дифференциации или другим средством, которое заставляет стволовые клетки и/или клетки-предшественники внутри образца пуповинной крови дифференцировать в клетки, проявляющие дифференцированный фенотип, такой как нейронный и/или глиальный фенотип.
Недифференцированные моноциты могут вводиться системно или в целевой анатомический сайт, позволяя клеткам дифференцировать в ответ на физиологические сигналы, получаемые клеткой (например, сайт-специфическая дифференциация). Альтернативно, клетки могут подвергаться ex vivo дифференциации перед введением пациенту.
Введение часто зависит от заболевания или состояния, подлежащего лечению, и может предпочтительно осуществляться парентеральным путем, например внутривенно, путем введения в цереброспинальную жидкость или путем непосредственно введения в пораженную ткань головного мозга. Например, в случае болезни Альцгеймера, болезни Хантингтона и болезни Паркинсона, предпочтительным путем введения будет трансплантация непосредственно в полосатое тело (caudate cutamen) или непосредственно в черную субстанцию (болезнь Паркинсона). В случае бокового амиотрофического склероза (болезнь Лу Герига) и рассеянного склероза, предпочтительно введение осуществляют через цереброспинальную жидкость. В случае лизосомной болезни накопления, предпочтительным путем введения является внутривенный путь или введение через цереброспинальную жидкость. В случае инсульта, предпочтительный путь введения будет зависеть от того где произошел инсульт, но введение может также осуществляться непосредственно в пораженную ткань (которая может быть легко определена с применением MRI или других средств формирования изображения), или введение может осуществляться системно. В предпочтительном варианте выполнения настоящего изобретения, путь введения для лечения индивидуального постинсульта будет системным, посредством внутривенного или внутриартериального введения.
Термины "имплантация" и "трансплантация" применяются в качестве синонимов для описания процесса, посредством которого клетки по изобретению доставляются к сайту, где клетки, как предполагается, проявляют благоприятный эффект, такой как восстановление поражения центральной нервной системы пациента (может происходить восстановление когнитивного или поведенческого дефицита, вызванного поражением), лечение нейродегенеративного заболевания или устранение эффектов нервного поражения, вызванных инсультом, сердечно-сосудистым заболеванием, сердечным приступом или телесным повреждением, или травмой, или генетическим нарушением, или связанных с элементами и факторами окружающей среды, неблагоприятно воздействующими на головной мозг и/или спинной мозг, что может быть вызвано, например, несчастным случаем или другим происшествием. Клетки по изобретению могут также доставляться в удаленную область тела путем любого варианта способа введения, описанных выше, на основании клеточной миграции до соответствующей области. Предпочтительно клетки вводятся совместно с агентом, позволяющим преодолеть гематоэнцефалический барьер.
Термин "неонкогенность" относится к тому факту, что клетки не приводят к появлению новообразования или опухоли. Стволовые клетки и/или клетки-предшественники предпочтительно не связаны с неоплазией и раком.
Термин "нейродегенеративное заболевание" применяется в настоящем изобретении для описания заболевания, которое вызвано поражением центральной нервной системы, поражение которой может быть восстановлено и/или ослаблено путем трансплантации нервных клеток по изобретению в пораженные области головного мозга и/или спинного мозга пациента. Примеры нейродегенеративных заболеваний, которые можно лечить с применением нервных клеток и способов согласно настоящему изобретению, включают болезнь Паркинсона, болезнь Хантингтона, боковой амиотрофический склероз (болезнь Лу Герига), болезнь Альцгеймера, Синдром Ретта, лизосомную болезнь накопления ("болезнь белого вещества" или глиальная болезнь/демиелинизация, как описывается, например, в Folkerth, J. Neuropath. Exp.Neuro., September 1999, 58:9), включая синдром Санфилиппо, болезнь Гоше, болезнь Тея-Сакса (дефицит бета-гексозаминидазы), другие генетические заболевания, рассеянный склероз, черепно-мозговую травму или травму, вызванную ишемией, несчастными случаями, факторами окружающей среды и т.д., поражение спинного мозга, атаксию и алкоголизм. Кроме того, настоящее изобретение может применяться для уменьшения и/или исключения воздействий инсульта или сердечного приступа на центральную нервную систему пациента, или эффектов, которые в другом случае вызываются недостаточным кровотоком или ишемией в участке головного мозга указанного пациента, или которые происходят в результате физической травмы головного мозга и/или спинного мозга. Нейродегенеративные заболевания также включают, например, заболевания, связанные с нарушением неврологического развития, включая, например, аутизм и связанные неврологические заболевания, такие как шизофрения, среди множества других.
Термин "генная терапия" применяется для описания переноса и стабильной вставки новой генетической информации в клетки для терапевтического лечения заболеваний и нарушений. Чужеродный ген вставляется в клетку, которая пролиферирует, с распространением нового гена в клеточной популяции. Таким образом, клетки пуповинной крови или клетки-предшественники являются мишенью для переноса гена либо перед дифференциацией, либо после дифференциации до фенотипа нервных клеток. Стволовые клетки пуповинной крови или клетки-предшественники по настоящему изобретению могут быть генетически модифицированы гетерологичной нуклеотидной последовательностью и операбельно связанным промотором, который управляет экспрессией гетерологичной нуклеотидной последовательности. Нуклеотидная последовательность может кодировать различные белки и пептиды, представляющие интерес. Генные продукты, продуцируемые генетически модифицированными клетками, могут быть собраны in vitro, или клетки могут применяться в качестве векторов для in vivo доставки генных продуктов (например, генная терапия).
Клетки моноцитарной линии дифференцировки
Далее в описании приводятся примерные, но без ограничения к этому, методики и руководства для осуществления многих различных объектов настоящего изобретения.
Различные рассматриваемые клетки и клеточные популяции могут быть охарактеризованы рядом способов, включая, в качестве примера, характеристики роста (например, способность к удвоению популяции, время удвоения, пассажи до старения), анализ кариотипа (например, нормальный кариотип; материнская линия или неонатальная линия), проточную цито-метрию (например, FACS анализ), иммуногистохимию и/или иммуноцито-химию (например, для обнаружения эпитопов), анализ профиля генной экспрессии (например, матрица ДНК-чипов; полимеразная цепная реакция (например, ПЦР с обратной транскриптазой, ПЦР в режиме реального времени и обычная ПЦР)), белковую матрицу, анализ секреции белков (например, путем оценки коагулирующей активности плазмы или анализа PDC-кондиционированной среды, например, путем энзим-связанного иммуносорбентного анализа (ELISA)), смешанную лимфоцитарную реакцию (например, как измерено путем стимуляции РВМС), и/или другими способами, известными в данной области техники.
Выделенные клетки или клеточные популяции могут применяться для начала или посева клеточных культур для применения в настоящем изобретении. Такие выделенные клетки или клеточные популяции могут быть перенесены в стерильные сосуды для тканевых культур, либо непокрытые, либо покрытые экстраклеточным матриксом или лигандами, такими как ламинин, коллаген (природный, денатурированный или поперечно-сшитый), желатин, фибронектин и другие белки экстраклеточного матрикса. Клетки могут быть культивированы в любой культуральной среде, способной стимулировать рост клеток. Примеры такой среды (которую специалист в данной области может выбрать для соответствующего типа клеток или клеточной популяции среди любых других сред, доступных специалисту в данной области техники) включают DMEM (высокое или низкое содержание глюкозы), улучшенную DMEM, DMEM/MCDB 201, базальную среду Игла, среду Хама F10 (F10), среду Хама F-12 (F12), среду Дульбекко 17, модифицированная по способу Искова, среду для роста мезенхимальных стволовых клеток (MSCGM), DMEM/F12, RPMI 1640 и CELL-GRO-FREE. Культуральная среда может быть дополнена одним или более компонентами, подходящими для соответствующих клеток или клеточных популяций, включая, например, фетальную бычью сыворотку (FBS); лошадиную сыворотку (ES); человеческую сыворотку (HS); бета-меркаптоэтанол (ВМЕ или 2-МЕ); один или более факторов роста (например, тромбоцитарный фактор роста (PDGF), эпидермальный фактор роста (EGF), фибробластный фактор роста (FGF), фактор роста эндотелия сосудов (VEGF), инсулин-подобный фактор роста-1 (IGF-1), фактор ингибирования лейкозных клеток (LIF) и эритропоэтин (ЕРО)); аминокислоты, включая L-глутамин и L-валин; и один или более антибиотиков и/или противогрибковых средств для контроля бактериального заражения (таких как, например, пенициллин G. стрептомицин сульфат, амфотерицин В. гентамицин и нистатин, либо сами по себе, либо в комбинации). Клетки можно сеять в культуральных сосудах с плотностью, позволяющей разрастание клеток.
Способы выбора наиболее подходящей культуральной среды, приготовления среды и основанной на клеточной культуре методики в зависимости от типа клеток и клеточной популяции хорошо известны специалистам в данной области техники и описываются в различных источниках, включая Doyle et al., (eds.), 1995, CELL &TISSUE CULTURE: LABORATORY PROCEDURES, John Wiley & Sons, Chichester; and Ho and Wang (eds.), 1991, ANIMAL CELL BIOREACTORS, Butterworth-Heinemann, Boston.
Клетки и клеточные популяции, подходящие для применения по настоящему изобретению, могут быть увеличены путем культивирования в определенной среде роста, содержащей, по меньшей мере, один фактор, который стимулирует пролиферацию клеток (подходящий для соответствующих клеток или клеточных популяций). По меньшей мере, один фактор может включать, например, никотинамид, члены TGF-β семейства, включая TGF-β 1, 2 и 3, костные морфогенные белки (ВМР-2, -4, 6, -7, -11, -12, и -13), сывороточный альбумин, члены семейства фибробластных факторов роста, тромбоцитарный фактор роста-АА и-ВВ, обогащенную тромбоцитами плазму, инсулиновый фактор роста (IGF-I, -II), фактор роста и дифференцировки (GDF-5, -6, -8, -10, 11), глюкагоноподобный пептид -I и -II (GLP-I и -II), GLP-I и GLP-II миметики, Эксендин-4, ретиноевую кислоту, паратиреоидный гормон, инсулин, прогестерон, апротинин, гидрокортизон, этаноламин, бетамеркаптоэтанол, эпидермальный фактор роста (EGF), гастрин I и II, хелаторы меди, такие как триэтиленпентамин, форсколин, бутират натрия, активин, бетацеллюлин, ноггин, фактор роста нейронов, нодал, инсулин-трансферрин-селен (ITS), фактор роста гепатоцитов (HGF), фактор роста кератиноцитов (KGF), бычий экстракт гипофиза, белок, ассоциированный с островковым неогенезом (INGAP), протеасомные ингибиторы, ингибиторы пути notch, ингибиторы сигнального каскада sonic hedgehog, или их комбинации. Альтернативно, клетки, подходящие для применения по изобретению, могут быть размножены путем культивирования в кондиционированной среде (то есть, в определенной клеточной культуральной среде, в которой популяция клеток растет, позволяя клеткам вносить растворимые факторы в среду, так что кондиционированная среда включает соответствующие растворимые факторы для рассматриваемых клеток или клеточных популяций). В соответствии с настоящим изобретением в определенных вариантах выполнения изобретения, клетки удаляются из среды, в то время как растворимые факторы, которые продуцируются клетками, остаются.
В ходе кроветворения, наряду с моноцитарной линией дифференцировки гемопоэтические стволовые клетки сначала дифференцируют в общие миелоидные клетки-предшественники и затем в миелобласт. После миелобласта клетки затем дифференцируют в монобласт. Монобласт представляет собой первую клетку, которая, собственно, является частью клеток моноцитарной линии дифференцировки, которая, как зафиксирована, дифференцирует в моноцит. Монобласт дифференцирует в промоноцит, то есть недифференцированный моноцит. Промоноцит затем дифференцирует в моноцит, то есть зрелый или дифференцированный моноцит. Моноцит может затем подвергаться моноцитопоэзу либо в макрофаг, либо в миелоидную дендритную клетку. Клетки моноцитарной линии дифференцировки поэтому включают все типы клеток, начиная с монобласта до конечных клеток, полученных через моноцитопоэз.
Монобласты легко распознаются специалистом в данной области техники. Монобласты, как правило, имеют в длину от двенадцати до двадцати микрон. Объем ядра по отношению к цитоплазме составляет от 4:1 до 3:1, и подобно большинству миелоидных бластов, ядро имеет форму от круглой до овальной, с тонкой хроматиновой структурой. Обычно наблюдают от одного до четырех ядер. Ядро может быть центральным и эксцентрическим, оно может показывать очевидную вдавленность или складчатость. Цитоплазма является агранулярной, умеренно окрашенной до светло-базофильной и часто имеет интенсивно окрашенную периферию и выделяющуюся перинуклеарную зону.
Дифференцированные или зрелые моноциты подобным образом легко распознаются специалистом в данной области техники. Диаметр монобластов составляет, как правило, от тринадцати до двадцати пяти микрон. Дифференцированные моноциты представляют собой большие, циркулирующие фагоцитарные белые клетки крови, которые имеют одно большое, гладкое, хорошо определенное ядро, которое имеет овальную или овально-изогнутую форму. Большая область цитоплазмы имеет много внутренних везикул для обработки чужеродного материла и включает тонкие, азурофильные цитоплазматические гранулы. Дифференцированные моноциты, как правило, циркулируют в кровотоке в течение от около одного до около трех дней и затем посредством крови переходят в другие ткани, такие как легкие и печень. После миграции в другие ткани, дифференцированные моноциты подвергаются моноцитопоэзу в различные типы макрофагов в зависимости от типа ткани, в которую перемещаются моноциты. Промоноциты подобны моноцитам, но ядро промоноцитов является более радиально-симметричным, чем ядро зрелого моноцита, и объем ядра по отношению к цитоплазме выше, и они относятся к недифференцированным клеткам моноцитарной линии дифференцировки.
Клетки моноцитарной линии дифференцировки могут быть выделены из многочисленных источников, применяя способы, доступные специалистам в данной области техники. Примеры включают костный мозг, периферическую кровь и пуповинную кровь. Помимо получения моноцитарной линии дифференцировки непосредственно у субъекта, клетки моноцитарной линии дифференцировки могут быть получены путем дифференцирования стволовых клеток, включая, но без ограничения к этому, гемопоэтические стволовые клетки.
Мононуклеарные клеточные популяции
Мононуклеарные клеточные популяции могут быть выделены из многочисленных источников. Одним примером является выделение по градиенту плотности (варьирующемся от 1.0 г/л до 1.1 г/л, предпочтительно 1.077 г/л), как показано в примерах, приведенных ниже. Другие примеры включают костный мозг, периферическую кровь и пуповинную кровь. Помимо получения мононуклеарных клеток путем выделения непосредственно у субъекта, мононуклеарные клетки могут быть получены путем дифференцирования стволовых клеток, включая, но без ограничения к этому, гемопоэтические стволовые клетки.
Популяции стволовых клеток
Популяции стволовых клеток, подходящие для применения в способах по настоящему изобретению, могут быть получены из любых тканей, которые могут обеспечить стволовые клетки, способные дифференцировать в, по меньшей мере, клеточные типы мезодермальной линии дифференцировки.
Происходящие из костного мозга стволовые клетки относятся к двум наиболее изученным типам взрослых стволовых клеток. В настоящее время, такие происходящие из костного мозга стволовые клетки применяются для восстановления различных кровяных и иммунных компонентов в костном мозге через трансплантацию. В настоящее время идентифицированы два главных типа стволовых клеток, обнаруживаемые в костном мозге: гемопоэтические стволовые клетки (HSC, или CD34+ клетки) способны дифференцировать во все типы кровяных и иммунных клеток, и стромальные (мезенхимные) стволовые клетки (MSC), которые, как правило, предназначены для формирования костей, хрящей, мышц и жира. Однако, как было показано, оба типа происходящих из костного мозга стволовых клеток имеют более экстенсивную пластичность, чем ожидали.
Специалист в данной области техники может применять любые средства выделения и культивирования стволовых клеток, так как существует несколько хорошо известных способов. Например, гемопоэтические стволовые клетки могут быть получены из пуповинной крови, которая обильно снабжена такими клетками. Гемопоэтические клетки, выделенные из пуповинной крови, и гемопоэтические клетки, выделенные из костного мозга или периферической крови, проявляют, по существу, идентичное поведение при применении для трансплантации. Кроме того, плацента и костный мозг являются отличными источниками мезенхимальных стволовых клеток. Подобным образом, стволовые клетки, которые могут дифференцировать в клетки мезодермальной линии дифференцировки, происходят из жировой ткани (хотя, очевидно, являются не такими пластичными, как мезенхимальные стволовые клетки, происходящие из костного мозга), и подобные стволовые клетки вероятно присутствуют в других тканях.
Стволовые клетки могут быть выделены из многих тканей либо путем применения антител, которые связывают маркеры, специфичные к стволовым клеткам (например, SH2, SH3 и SH4 - смотрите патенты США №5,486,359 и 5,837,539), либо путем применения антител, которые связывают маркеры, специфичные к нежелательным клеткам, такие как CD4+ и CD8+ (Т клетки), CD45+ (panB клетки), GR-1 (гранулоциты), и lad (дифференцированные антигенпредставляющие клетки). Пример этого протокола можно найти у Izaba et al., I. Exp.Med. 176-1693 1702 (1992).
Гемопоэтические стволовые клетки могут, подобным образом, быть получены из различных источников, включая пуповинную кровь, костный мозг и мобилизированную периферическую кровь. Очищение гемопоэтических стволовых клеток можно осуществлять с помощью методик на основе аффинности антител (например, применение антител для связывания CD34, которые специфичны к гемопоэтическим клеткам). Методика аффинного колоночного выделения для выделения клеток с такими антителами может быть обнаружена у Но et al., Stem Cells 13 (suppl. 31: 100-105 (1995). Смотрите также, Brenner, Journal of Hematotherapy 2: 7-17 (1993). Способы аффинной очистки и культуральной экспансии мезенхимальных стволовых клеток также хорошо известны (смотрите, например, патенты США 5,486,359 и 5,837,539). Дополнительные примеры таких способов выделения можно обнаружить в патентах США №6,087,113, 6,261,549 и 5,914,262, U5,908,782, и US 20040058412.
Популяции терапевтических клеток, обогащенные клетками моноцитарной линии дифференцировки
Популяции терапевтических клеток могут быть обогащены любым способом, доступным специалисту в данной области техники. Один пример включает выделение популяции стволовых клеток и затем отбор тех популяций, которые обогащены недифференцированными моноцитами в результате выделения. Сущность этого способа показаны в примерах, приведенных ниже, за исключением того, что обогащение определяют после применения мононуклеарной клеточной популяции. Примеры можно легко модифицировать таким образом, что обогащение недифференцированными моноцитами будут измерять перед применением и затем отбирать те популяции, которые имеют достаточное обогащение и/или те популяции, которые подлежат дальнейшему обогащению. Так как популяции стволовых клеток и популяции мононуклеарных клеток включают клетки, которые могут быть индуцированы для дифференциации в клетки моноцитарной линии дифференцировки, один способ обогащения включает добавление одного или более соответствующих факторов для индукции такой дифференциации (которые известных специалисту в данной области техники) до клеточной популяции. Другие примеры обогащения включают добавление одного или более цитокинов или других факторов роста, которые способствуют индукции клеток моноцитарной линии дифференцировки к более быстрому делению или росту, чем клетки немоноцитарной линии дифференцировки в клеточной популяции и/или добавление одного или более факторов, которые селективно ингибируют деление или рост клеток, которые не относятся к клеткам моноцитарной линии дифференцировки. Наконец, клетки моноцитарной линии дифференцировки, полученные или культивированные отдельно, могут быть добавлены к популяции терапевтических клеток.
Примеры
Следующие примеры демонстрируют варианты применения способов и композиций, раскрытых в настоящем описании.
Пример 1 - Выделение мононуклеарной клеточной популяции, обогащенной клетками моноиитарной линии дифференцировки
Получение мононуклеарных клеток костного мозга осуществили с помощью Стандартного градиента плотности (варьирующегося от 1.0 г/л до 1.1 г/л, предпочтительно 1.077 г/л). Клеточные популяции, как раскрывается в Примере 2, приведенном ниже, имеют различные количества клеток моноцитарной линии дифференцировки.
Получение ВММС осуществляли с помощью разделения по градиенту плотности (в интервале от 1,0 г/л до 1,1 г/л, предпочтительно 1,077 г/л). 35 мл крови костного мозга аккуратно добавили без перемешивания к 10 мл среды Фиколл (объемы приведены из расчета на одну пробирку), поддерживая поверхностное натяжение интактной среды Фиколл. Это процедуру повторяют еще для девяти пробирок, что составляет 10 пробирок на человека. Пробирки затем центрифугируют при 350д - без торможения, в течение 40 минут, при 20°С. После разделения плотности мононуклеарное кольцо (граница раздела плазма/Фиколл) аккуратно собирают из 10 пробирок и суспендируют в четырех пробирках, при добавлении 0.9% физиологического раствора, с получением общего объема в пробирке - 45 мл. 4 пробирки центрифугировали при 400д, в течение 10 минут, при 20°C, для отделения клеток от оставшейся среды Фиколл. После удаления супернатанта мононуклеарные клетки из всех пробирок были собраны и объединены в одной пробирке с общим объемом 40 мл 0.9% физиологического раствора. Раствор мононуклеарных клеток снова центрифугировали при 400 g, в течение 10 минут, при 20°C. Супернатант снова удалили, и клеточный осадок суспендировали в 10 мл 0.9% физиологического раствора. После проверки клеток на соответствие таким критериям, как стерильность, жизнеспособность и отсутствие эндотоксинов, следуя надлежащей медицинской практике (GMP), и осуществления автоматического подсчета клеток, клетки суспендировали в 0.9% физиологическом растворе и 20% аутологической сыворотке для поддержания жизнеспособности клеток (аутологическую сыворотку сначала отфильтровали с применением 0.22 мкм фильтра, для удаления загрязняющих клеток), с получением конечной концентрации 1×107 клеток/мл. Полученный мононуклеарный раствор пропускают через 100 мкм фильтр для удаления сгруппировавшихся клеток.
Пример 2 - Корреляция между числом инъецированных недифференцированных моноцитов и терапевтическим результатом
В этом примере приводятся данные по пациентам, которых лечили с применением способов и композиций по настоящему изобретению.
Цель данного исследования состояла в оценке безопасности и эффективности разработанного протокола, протокола клеточной терапии рефракторной стенокардии (ReACT), в котором однократную серию многочисленных интрамиокардиальных инъекций специфической композиции ВММС осуществляли в отношении пациентов в качестве единственной хирургической терапии.
Терапия ReACT была разработана в соответствии с критериями надлежащей медицинской практики (GMP) и FDA стандартов.
Пациенты, внесенные в протокол, должны были проявлять симптомы рефрактерной стенокардии, обладать жизнеспособным миокардом (диагностированным с помощью стресс-сцинтиграфии с технецием), без дисфункции левого желудочка сердца (фракция выброса, по меньшей мере, 45%), и для них была невозможна миокардиальная реваскуляризация (либо РТСА, либо АКШ).
Восемь пациентов с рефракторной стенокардией участвовали в исследовании с сентября 2005 года до июля 2007 года. Все пациенты ранее подвергались хирургической реваскуляризации один раз (4 пациента), два раза (3 пациента) или четыре раза (1 пациент), без ослабления стенокардии. Характеристики базовой линии пациентов приводятся в Таблице 1.
Дополнительно четыре пациента с рефракторной стенокардией участвовали в исследовании и подвергались ReACT, но им одновременно требовалось обходное шунтирование коронарной артерии, и они были исключены из этого анализа. В настоящее время эти пациенты вынесены в отдельную группу.
Пациенты с рефракторной стенокардией, наблюдавшиеся в Sao Paulo Hospital, в Sao Paulo, Sao Paulo, Бразилия, в Федеральном университетском госпитале ишемической болезни сердца, были включены в это исследование. Протокол исследования (ReACT) был одобрен местным и национальным этическим комитетом (CEP-ЕРМ-0314/05), и все пациенты предоставили письменное согласие. Пациенты с рефракторной стенокардией, отнесенной к функциональному классу IV (стенокардия в состоянии покоя) согласно классификации стенокардии Канадской ассоциации кардиологов (CCSAC), несмотря на эффективную стандартную терапию, не подлежат лечению посредством обычной миокардиальной реваскуляризации и обладают жизнеспособным миокардом. Невозможность применения реваскуляризации - либо перкутанной, либо хирургической - была определена, по меньшей мере, двумя кардиологами и двумя сердечнососудистыми хирургами, на основании самой последней (за шесть месяцев) коронарограммы пациентов. Критерии исключения были следующими: (1) фракция выброса левого желудочка (LVEF)<45% на трансторакальный эхокардиограмме; (2) отсутствие жизнеспособного миокарда при радионуклидной визуализации; (3) положительные результаты при серологическом тестировании на вирус иммунодефицита человека (ВИЧ), гепатит типа А, В и С, человеческий Т клеточный лимфотропный вирус (HTLV) или болезнь Чагаса; (4) существенное заболевание сердечного клапана (5) хроническое почечное заболевание в отношении диализа; (6) чрезмерное употребления спиртных напитков и лекарственных препаратов; (7) любое другое медицинское состояние с оцениваемой продолжительностью жизни <5 лет; (8) участите в предыдущих исследованиях клеточной терапии; и (9) беременность.
Клиническое испытание фазы 1/Па проводили для однократного хирургического вмешательства, при котором мононуклеарные клетки костного мозга (полученные согласно Примеру 1) вводили посредством интрамиокардиальной инъекции в многочисленные точки введения инъекции у пациента, страдающего рефракторной стенокардией, с нормальной или слегка ухудшенной функцией левого желудочка. Рефракторную стенокардию пациентов определили обычным образом и отнесли к функциональному классу IV согласно классификации стенокардии Канадской ассоциации кардиологов (CCSAC), с полностью оптимизированным фармакологическим лечением и без какой-либо медицинской или возможной интервенционистской процедуры (АКШ и РТСА) - неоперабельные пациенты "по option".
У каждого пациента всего было взято 100 стволовых клеток костного мозга из подвздошного гребня, и их хранили в соляном растворе с концентрацией 80 U.I. гепарин/мл. Мононуклеарные клетки выделяли по градиенту плотности и разбавляли до конечной концентрации 107 клеток/мл, согласно ReACT и надлежащей медицинской практике (GMP). Осуществляли дифференциальный подсчет жизнеспособности клеток, мононуклеарных клеток, лейкоцитов, а также определяли содержание CD34+, проводили аэробные и анаэробные микробиологические испытания. Образцы сохраняли для следующего анализа.
Одну серию многократных инъекций в миокард левого желудочка осуществили хирургическим путем, через левую латеральную торакотомию, следующим образом: 0.2 мл (2×106 клеток)/инъекция, расстояние между точками введения инъекции составляет 1 см, и глубина введения в эпимиокрдиальную ткань составляет 1 см. Число инъекций (от 40 до 90) для каждого пациента определяется на основе протяженности жизнеспособной ишемической области миокарда, определенной с помощью радионуклидной визуализации, магнитно-резонансной визуализации (MRI), сцинтигра-фического изображения и фотоувеличение левожелудочковой камеры.
Ход исследования
Сердечный ритм пациентов контролировали в течение 48 часов после хирургического вмешательства. Клиническую оценку согласно CCSAC осуществляли на момент 3, 6, 12 и 18 месяца после хирургического вмешательства. Эхокардиограмму осуществляли в начальный момент времени и на момент 1, 3, 6 и 12 месяца, и магнитно-резонансную визуализацию сердца осуществляли в нулевой момент времени и на момент 6 и 12 месяцев с целью обеспечения безопасности. Радионуклидную визуализацию (перфузионная стресс-сцинтиграфия миокарда с технецием и MRI) осуществили в начальный момент времени и на момент 6 и 12 месяцев после проведения процедуры, для оценки доли ишемической области миокарда. В отношении объективного анализа (стресс-сцинтиграфии) ишемической области сердца важно отметить, что все пациенты, как полагали, имели 100% ишемической области жизнеспособного миокарда на стенках левого желудочка, что было определено с помощью стресс-сцинтиграфии с технецием, до инъекции клеточной композиции. Эти подлежащие восстановлению ишемические области сердца рассматривались как базовая линия, по сравнению со сцинтиграфическим анализом на момент 6 и 12 месяцев. Сцинтиграфический анализ проводили только на момент 6 и 12 месяцев.
Статистический анализ
Непараметрический тест Фридмана применяли для оценки изменения класса стенокардии по CCSAC через 3, 6 и 12 месяцев и оценки изменений в ишемической области миокарда через 6 и 12 месяцев. Для сравнения полученных результатов применялся тест Вилкоксона с коррекцией по Бонферрони. Корреляцию между результатами (класс стенокардии и ишемическая область миокарда после процедуры) и числом инъекций оценили с помощью теста Спирмена. Для сравнения функции левого желудочка по эхокардиограмме до лечения и через 12 месяцев после процедуры применяли непараметрический тест Вилкоксона.
Как показано ниже, улучшение миокардиальной перфузии у пациента (или ее отсутствие) коррелирует с дозой клеток моноцитарной линии дифференцировки, то есть недифференцированных моноцитов. Пациенты, получавшие самое большое число клеток моноцитарной линии дифференцировки, показали уменьшение класса стенокардии с IV до 0 (CCSAC).
Таблица 1А, приведенная ниже, показывает улучшение класса стенокардии и ишемической области миокарда, и концентрацию композиции, обогащенной недифференцированными моноцитами ВММС, при введении.
В Таблице 1В, приведенной ниже, показаны изменения класса стенокардии и ишемической области миокарда после введения композиции, обогащенной недифференцированными моноцитами ВММС.
Таблица 1В
Как можно увидеть на основании данных, приведенных в таблице 1А, существует строгое соответствие между числом недифференцированных моноцитов, инъецированных итрамиокардиально, и уменьшением или исключением симптомов стенокардии. Кроме того, корреляция является статистически значимой (p<0.05), таким образом, демонстрируя эффективность способов и композиций, как описано в настоящем изобретении.
Для того чтобы исключить эффект, обусловленный числом инъекций (который до определенной степени также коррелирует с дозой клеток моноцитарной линии дифференцировки), определили корреляцию между числом инъекций и улучшением миокардиальной перфузии. Фиг.2 графически иллюстрирует отсутствие такой корреляции. Как показано на Фиг.2, никакой статистически значимой корреляции не наблюдается.
Субъективное улучшение миокаодиальной ишемии
После процедуры миокардиальной инъекции согласно ReACT, наблюдалось прогрессивное улучшение серединного значения класса стенокардии, изменяющегося от класса 4 на начальный момент времени до 2.5 (р=0.008), 2 (р=0.008), 1 (р=0.004) и 1 (р=0.004) на момент 3, 6, 12 и 18 месяцев анализа, соответственно (Фиг.3 и Таблица 2).
Таблица 2, приведенная ниже, показывает коэффициенты корреляции Спирмена (rs) между содержанием недифференцированных моноцитов ВММС (промоцитов), лимфоцитами и CD34+ клетками, и улучшением класса стенокардии и % ишемической области миокарда в ходе исследования. По техническим причинам не был проведен подсчет клеток и процента для первого пациента, участвующего в анализе, причем в анализе участвовали только 7 пациентов.
Объективное улучшение миокардиальной ишемии
Прогрессивное уменьшение ишемической области миокарда наблюдали с помощью стресс-сцинтиграфии с технецием через 6 месяцев (уменьшение 39.4%, р=0.06) и 12 месяцев (уменьшение 84.4%, p<0.004), хотя различие было статистически значимым только на момент 12 месяцев. Важно отметить, что все пациенты, как полагали, имели 100% ишемической области жизнеспособного миокарда на специфических стенках левого желудочка, что было определено с помощью стресс-сцинтиграфии с технецием, до инъекции клеточной композиции. Эти начальные восстанавливаемые ишемические области сердца рассматривали как базовую линию, при сравнение с данными сцинтимграфического анализа на момент 6 и 12 месяцев (Фиг.4 и Таблица 2).
Корреляция между композицией ReACT и улучшением
ReACT имеет определенный процент моноцитов, и их специфическая композиция положительно коррелирует с клиническим ответом; особенно, улучшением класса по CCSAC (Таблица 3).
Другие клеточные типы, такие как лимфоциты или CD34+ клетки, не показывают корреляцию с улучшением класса по CCSAC или ишемической области миокарда.
Результаты этого исследования показывают, что ReACT может способствовать уменьшению симптомов рефракторной стенокардии у пациентов, для которых не подходит обычная миокардиальная реваскуляризация, и которые проявляют симптомы стенокардии, несмотря на максимальную лекарственную терапию. Результаты наших исследований показывают уменьшение симптомов стенокардии и уменьшение степени миокардиальной ишемии. Возможно, причинный механизм этого улучшения может быть связан с ангиогенными свойствами ReACT композиции.
В нашем исследовании ослабление симптомов начиналось еще на 3 месяц после процедуры и улучшение продолжалось до 12-го месяца, при дальнейшем улучшении до 18-го месяца, позволяя предположить, что ангиогенез начинается раньше и сохраняется до 18 месяца включительно после процедуры (смотрите Таблицу 2 и Фиг.3). Кроме того, так как у всех пациентов наблюдалось улучшение, связанное с прогрессивным ослаблением симптомов, это позволяет предположить, что эффект является устойчивым, а не кратковременным, и результат отличается от результатов других исследований (6). Соответственно, была показана тенденция к уменьшению процента миокардиальной ишемии, причем уменьшение становится значительным к 12-му месяцу. Тот факт, что уменьшение симптомов происходит намного раньше, чем улучшение перфузии, можно объяснить низкой пространственной разрешающей способностью и высокой вариабельностью радионуклидной визуализации, мешающими обнаружению небольших изменений, особенно в такой небольшой группе пациентов.
Естественный ход рефракторной стенокардии показывает, что может происходить спонтанная ремиссия даже серьезной стенокардии (9, 31, 54, 60). Если взглянуть на группы, получавшие лекарственное лечение и участвующие в рандомизированном исследовании, то видно, что от 0 до 19% пациентов, участвующих в испытании перкутанной миокардиальной лазерной реваскуляризации, и от 0 до 32% пациентов, участвующих в исследованиях хирургической миокардиальной лазерной реваскуляризации, показали улучшение, по меньшей мере, двух точек в классе по CCSAC через 12 месяцев, и 0-44% пациентов через 3 года (38). Наши результаты показали намного более поразительное и значительное улучшение класса по CCSAC, что было подтверждено тестированием с возрастающей нагрузкой миокардиальной перфузии.
В исследованиях рефракторной стенокардии в основном участвовали пациенты с дисфункцией левого желудочка от умеренной до серьезной (13, 41, 57). В итоге наши результаты показали более значительное уменьшение симптомов стенокардии и улучшение качества жизни, скорее чем увеличение фракции выброса левого желудочка (LVEF). В нашем исследовании, все пациенты имели LVEF≥45% в качестве базовой линии, и, как ожидали, не наблюдалось значительных изменений в LVEF на момент 12 месяца (р=0.726). Также предположили, что ангиогенез непосредственно связан с инфузией стволовых клеток, а не с миокардиальной пункцией, стимулирующей вторичный ангиогенез. С другой стороны, увеличение LVEF, как и улучшение миокардиальной перфузии, предполагает отсутствие функционального дефицита, обусловленного некрозом или фиброзом миокарда, вызванных интрамиокардиальными инъекциями ReACT, увеличивая безопасность процедуры.
Стандартная группа пациентов с симптомами рефракторной стенокардии и жизнеспособным миокардом была бы идеальным кандидатом для ангиогенной терапии, с применением ReACT интрамиокардиальной инъекции. По очевидным причинам, анализ LVEF не является конечной точкой для этой группы. Первичная терапевтическая цель состоит в улучшении миокардиальной перфузии, с применением ReACT в субъективном (CCSAC) и объективном (тестирование при возрастающей нагрузке с визуализацией) исследовании.
В отличие от других исследований (12, 57), в ReACT применяется специфическая клеточная композиция, которая, как оказалось, коррелирует с клиническим и сцинтиграфическим ответами; улучшение классификации стенокардии и уменьшение ишемической области миокарда, соответственно. Улучшение класса по CCSAC (субъективная оценка), с последующим коррелированным уменьшением ишемической области миокарда (объективная оценка), позволяет предположить, что неоангиогенез является основным механизмом действия стволовых клеток (Фиг.3 и 4). Следовательно, большая фракция недифференцированных моноцитов, представленная в ReACT, как оказалось, связана с ангиогенезом, который восстанавливает перфузию на ишемических областях миокарда после трансплантации клеток. Этот механизм еще не разъяснен и будет проанализирован в следующей фазе этого исследования. Тем не менее значительное соответствие между числом недифференцированных моноцитов и улучшением клинического ответа (r=-0.759, p<0.05) эффективно поддерживает связанный с клетками эффект от ReACT в этом исследовании.
Эта положительная корреляция между числом недифференцированных моноцитов в ReACT и стабильным улучшением класса стенокардии может указывать на важность этих клеток для механизма действия стволовых клеток ВММС и стабильного ангиогенеза миокарда. Также важным является то, что эти результаты обеспечивают гипотезу, что результаты данного исследования обусловлены клеточным эффектом ReACT композиции, а не неспецифическими эффектами методики ReACT. Следующие контролируемые исследования разъясняются далее.
Костный мозг является природным источником широкого спектра цитоки-нов, которые участвуют в контроле ангиогенных и воспалительных процессов. Лейкоциты костного мозга играют важную роль в ангиогенном механизме, и нейтрофиллы и моноциты играют ключевую роль в этом процессе (10, 24, 29, 47).
Недифференцированные моноциты и промоноциты костного мозга могут быть активированы в ответ на хемотаксические побудители и подвергаются конечной дифференциации в макрофаги. Макрофаги играют ключевую роль в ангиогенезе благодаря их способности секретировать протеазы, факторы роста и монокины, и влияют на каждую фазу ангиогенного процесса, включая изменения локального экстраклеточного матрикса, индукцию эндотелиальных клеток к миграции или пролиферации и ингибирование роста сосудов с образованием дифференцированных капилляров (5, 10, 46, 51).
Оптимальное число или оптимальная композиция стволовых клеток для способствования регенерации миокарда остается спорным среди различных исследователей, большинство из них не показывают доза-зависимый эффект (18,20). Iwasaki et al. (25) провел одно из исследований, которые демонстрируют положительную корреляцию между числом инъецированных стволовых клеток и миокардиальной регенерацией у крыс с экспериментальным острым инфарктом миокарда. Henning et al. (23) инъецировал стволовые клетки костного мозга, происходящие из пуповинной крови человека, крысам, перенесшим инфаркт, сравнивая различные дозы и пути введения (интрамиокардиальный, интракоронарный или внутривенный), демонстрируя более высокую эффективность интрамиокардиальной инъекции. В одном исследовании, мы провели ReACT с одной серией многочисленных инъекций 2×106 ВММС композиции/миокардиальной пункции. Не наблюдалось корреляции между числом инъекций и изменением класса стенокардии с течением времени, однако исследуемая группа была возможно слишком маленькой для любого значительного предположения, и так как было решено продолжать применение протокола ReACT, следующие данные могут подтверждать или не подтверждать это.
Интрамиокардиальный путь доставки клеточной композиции был выбран на основе экспериментальных данных, которые показывают более высокое миокардиальное поглощение стволовых клеток в процессе интрамиокардиальной инфузии, по сравнению с другими путями, такими как интракоронарный (либо антероградная, либо ретроградная инъекция) или транскоронарный (33, 42, 50). Также, хронический клинический признак рефрактерной стенокардии обеспечивает намного более безопасный профиль в случае интрамиокардиального подхода, без серьезного осложнения, подобно интрамиокардиальной инъекции в случае острого заболевания (острый инфаркт миокарда). Анализ, проведенный Perin et al. (42), позволил проанализировать безопасность и осуществимость эндомиокардиальной инъекции в случае острого инфаркта миокарда. Не наблюдалось опасных для жизни осложнений, и способ, как оказалось, был безопасным. Хотя, нельзя исключить значительного риска аритмии, если мы применяем прямую интрамиокардиальную инъекцию в острый нестабильный миокард.
Важно отметить, что, несмотря на благоприятные прогнозы, наше исследование имело некоторые ограничения. Несмотря на то, что наше исследование включало более высокое число пациентов, и продолжительность исследования была значительно больше, по сравнению с большинством опубликованных исследований рефракторной стенокардии, маленький размер группы, состоящей из 8 пациентов, осложняет определение эффективности, но позволяет продемонстрировать безопасность. В связи с этическими аспектами и неспособностью оправдать хирургическое интрамиокардиальное введение плацебо для этой группы, это было нерандомизированное открытое исследование; следовательно, эффект плацебо нельзя было исключить. Однако следует придать особое значение тому, что объективное увеличение миокардиальной перфузии было также оценено и это увеличение поддерживалось с течением времени.
Дальнейшие клинические исследования все еще необходимы для подтверждения наших результатов. Однако эффективность этой методики ReACT, применяемой в соответствии с техническим описанием и надлежащей медицинской практикой, а также получение специфических клеток согласно ReACT, как оказалось, приводят к более хорошим результатам, чем результаты, ранее представленные другими исследованиями.
В заключение, хирургическая трансплантация препарата, на основе аутологичных клеток, происходящих из костного мозга, согласно стандартному протоколу, может быть безопасной и эффективной методикой, способствующей достижению прогрессивного и стабильного улучшения у пациентов с рефракторной стенокардией.
Ссылки
Следующие ссылки упоминаются в примере 2 и в уровне техники.
1. Abdel-Latif, A.; Bolli, R.; TIeyjeh, I.M.; Montori, V.M.; Perin, E.C.; Hornung, C.A.; Zuba-Surma, E.K.; AI-Mallah, M.; Dawn, B. Adult bone marrow-derived cells for cardiac repair. A systematic review and meta-analysis. Arch. Intern. Med. 167: 989-997; 2007.
2. Anversa, P; Leri, A; Rota, M; Hosoda, T; Bearzi, C; et al. Concise review: stem cells, myocardial regeneration, and methodological artifacts. Stem Cells 2007:25:589-601.
3. Beeres, SLMA; Bax, JJ; Dibbets-Schneider, P; Stokkel, MPM; Fibbe, WE; et al. Sustained effect of autologous bone marrow mononuclear cell injection in patients with refractory angina pectoris and chronic myocardial ischemia: twelve-month follow-up results. Am Heart J 2006; 152: 684. e11-684. e16.
4. Beeres, SLMA; Bax, JJ; Kaandorp, ТА; Zeppenfeld, K; Lamb, HJ; et al. Usefulness of intramyocardial injecton of autologous bone marrow-derived mono-nuclear cells in patients with severe angina pectoris and stress-induced myocardial ischemia. Am. J. Cardiol. 2006; 97: 1326-31.
5. Benelli, R; Albini, A; Noonan, D. Neutrophils and angiogenesis: potential initiators of the angiogenic cascade. Cassatella MA (ed): The Neutrophil. Chem Immunol Allergy. Basel, Karger, 2003, vol. 83, pp.167-181.
6. Briguori, C; Reimers, B; Sarais, C; Napodano, M; Pascotto, P; et al. Direct intramyocardial percutaneous delivery of autologous bone marrow in patients with refractory myocardial angina. Am Heart J 2006; 151: 674-80.
7. Charwat, S.; Gyöngyösi, M; Lang, I; Graf, S; Beran, G; et al. Role of adult bone marrow stem cells in the repair of ischemic myocardium: current state of the art. Experimental Hematology 2008; 36: 672-80.
8. Cogle, CR; Madlambayan, GJ; Hubsher, G; Beckman, C; Speisman, R; et al. Marrow cell therapies for cardiovascular diseases. Experimental Hematology 2008; 36: 687-94.
9. DeJongste, MJL; Tio, RA; Foreman, RD. Chronic therapeutically refractory angina pectoris. Heart 2004; 90: 225-30.
10. Dirkx, AEM; oude Egbrink, MGA; Wagstaff, J; Griffioen, AW. Monocyte/macrophage infiltration in tumors: modulators of angiogenesis. J Leukoc Biol 2006; 80: 1183-96.
11. Fraker, Jr, TD; et al. 2007 Chronic Angina Focused Update of the ACC/AHA 2002 Guidelines for the Management of Patients With Chronic Stable Angina: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines Writing Group to Develop the Focused Update of the 2002 Guidelines for the Management of Patients With Chronic Stable Angina. Circulation, 2007; 116: 2762-72.
12. Fuchs, S; Kornowski, R.; Weisz, G; Satler, LF; Smits, PC; et al. Safety and feasibility of transendocardial autologous bone marrow cell transplantation in patients with advanced heart disease. Am J Cardiol 2006; 97: 823-9.
13. Fuchs, S; Satler, LF; Kornowski, R.; Okubagzi, P; Weisz, G; et al. Catheter-based autologous bone marrow myocardial injection in no-option patients with advanced coronary artery disease. A feasibility study. J. Am. Coll. Cardiol. 2003; 41: 1721-4.
14. Gibbons, RJ; et al. ACC/AHA 2002 Guideline Update for the Management of Patients With Chronic Stable Angina - Summary Article. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Comittee on the Management of Patients With Chronic Stable Angina). Circulation 2003; 107: 149-58.
15. Gordon, MY. Stem cells for regenerative medicine - Biological attributes and clinical application. Experimental Hematology 2008; 36: 726-32.
16. Guan, K; Hasenfuss, G. Do stem cells in the heart truly differentiate into cardiomyocites? J Molecular and Cellular Cardiology 2007; 43: 377-83.
17. Haider, H Kh; Ashraf, M. Bone marrow stem cell transplantation for cardiac repair. Am J Physiol Heart Circ Physiol 2005; 288: 2557-67.
18. Hale, SL; Dai, W; Dow, JS; Kloner, RA. Mesenchymal stem cell administration at coronary artery reperfusion in the rat by two delivery routes: a quantitative assessment. Life Sciences 2008; 83: 511-5.
19. Hamano, K; Nishida, M; Hirata, K; Mikamo, A; Li, T-S; et al. Local implantation of autologous bone marrow cells for therapeutic angiogenesis in patients with ischemic heart disease - Clinical trial and preliminary results. Jpn Circ J 2001:65:845-7.
20. Hashemi, SM; Ghods, S; Kolodgie, FD; Parcham-Azad, K; Keane, M; et al. A placebo controlled, dose-ranging, safety study of allogenic mesenchymal stem cells injected by endomyocardial delivery after an acute myocardial infarction. European Heart J 2008; 29: 251-9.
21. Hattori, R; Matsubara, H. Therapeutic angiogenesis forsvere ischemic heart diseases by autologous bone marrow cells transplantation. Molecular Cellular Biochemistry 2004; 264: 151-5.
22. Henning, RJ; Abu-Ali, H; Balis, JU; Morgan, MB; Willing, AE; et al. Human Umbilical cord blood mononuclear cells for the treatment of acute myocardial infarction. Cell Transplantation 2004; 13: 729-39.
23. Henning, RJ; Burgos, JD; Vasko, M; Alvarado, F; Sanberg, CD, et al. Human cord blood cells and myocardial infarction: effect of dose and route of administration on infarct size. Cell Transpl 2007; 16 (9): 907-17.
24. Hoefer, IE; Grundmann, S; van Royen, N; Voskuil, M; Schirmer, SH; et al. Leukocyte subpopulations and arteriogenesis: specific role of monocytes, lymphocytes and granulocytes. Atherosclerosis 2005; 181: 285-93.
25. Iwasaki, H; Kawamoto, A; Ishikawa, M; Oyamada, A; Nakamori, S; et al. Dose-dependent contribution of CD34-positive cell transplantation to concurrent vasculogenesis and cardiomyogenesis for functional regenerative recovery after myocardial infarction. Circulation 2006; 113: 1311-25.
26. Jolicoeur, EM; Granger, CB; Henry, TD; Holmes, DJ; Pepine, CJ; et al. Clinical and research issues regarding chronic advanced coronary artery disease: Part I: Contemporary and emerging therapies. Am Heart J 2008; 155: 418-34.
27. Kang, S; Yang, Y-j; Li, C-j; Gao, R-I. Effects of intracoronary autologous bone marrow cells on left ventricular function in acute myocardial infarction: a systematic review and meta-analysis for randomized controlled trials. Coronary artery disease 2008; 19: 327-35.
28. Kinnaird T; Stabile E; Burnett MS; Epstein SE. Bone marrow-derived cells for enhancing collateral development; mechanisms, animal data, and initial clinical experiences. Circ Res 2004; 95: 354-63.
29. Kusumanto, YH; Dam, WA; Hospers, GAP; Meijer, C; Mulder, NH. Platelets and granulocytes, in particular the neutrophils, form important compartments for circulating vascular endothelial growth factor. Angiogenesis 2003; 6: 283-7.
30. Laflamme, MA; Zbinden, S; Epstein, SE; Murry, CE. Cell-based therapy for myocardial ischemia and infarction: pathofhysiological mechanisms. Ann Rev Pathol Mech Dis 2007; 2: 307-39.
31. Leon, MB; Kornowski, R; Downey, WE; Weisz, G; Bairn, DS; et al. A blinded, randomized, placebo-controlled trial of percutaneous laser myocardial revascularization to improve angina symptoms in patients with severe coronary disease. J Am Coil Cardiol. 2005; 46: 1812-9.
32. Lipinski, MJ; Biondi-Zoccai, GGL; Abbate, A; Khianey, R; Sheiban, I; et al. Impact of intracoronary cell therapy on left ventricular function in the setting of acute myocardial infarction: A collaborative systematic review and meta-analysis of controlled clinical trials. J Am Coil Cardiol 2007; 50: 1761-7.
33. Losordo, DW; Renault, M-A. Therapeutic myocardial angiogenesis. Mi-crovascular Research 2007; 74: 159-71.
34. Losordo, DW; Schatz, RA; White, CJ; Udelson, JE; Veereshwarayya, V; et al. Intramyocardial transplantation of autologous CD34+ stem cells for intractable angina: A phase I/IIa double-blind, randomized controlled trial. Circulation 2007; 115: 3165-72.
35. Mannheimer, C; Camici, P; Chester, MR; Collins, A; DeJongste, M; et al. The problem of chronic refractory angina. Report from de ESC joint study group on the treatment of refractory angina. Eur Heart J 2002; 23: 355-70.
36. Moore, RK; Groves, D.; Bateson, S.; Barlow, P; Hammond, C; et al. Health related quality of life of patients with refractory angina before and one year after enrolment onto a refractory angina program. European Journal of Pain 2005; 9: 305-10.
37. Mukherjee, D; Bhatt, D; Roe, MT; Patel, V; Ellis, SG. Direct myocardial revascularization and angiogenesis: how many patients might be eligible? Am J Cardiol 1999; 84: 598-600.
38. Nordrehaug, JE; Salem, M. Treatment of chronic refractory angina pectoris - light at the end of the tunnel ? European Heart J 2006; 27: 1007-9.
39. Norol F; Merlet P; Isnard R; et al. Influence of mobilized stem cells on myocardial infarct repair in a nonhuman primate model. Blood 2003; 102: 4361-68.
40. Orlic D; Kajstura J; Chimenti S; et al. Bone marrow cells regenerate infarcted myocardium. Nature 2001; 410: 701-5.
41. Perin, EC; Dohmann, HFR; Borojevic, R; Silva, SA; Sousa, ALS; et al. Transendocardial, autologous bone marrow cell transplantation for severe, chronic ischemic heart failure. Circulation 2003; 107: 2294-2302.
42. Perin, EC; Silva, GV; Assad, JAR; Vela, D; Buja, LM; et al. Comparison of intracoronary and transendocardial delivery of allogeneic mesenchymal cells in a canine model of acute myocardial infarction. J Molecular Cellular Cardiology 2008; 44: 486-95.
43. Rana, JS; Mannam, A; Donnell-Fink, L; Gervino, EV; Selike, FW; et al. Longevity of the placebo effect in the therapeutic angiogenesis and laser myocardial revascularization trials in patients with coronary heart disease. Am J Cardiol 2005;95:1456-9.
44. Rosenzweig, A. Cardiac cell therapy - Mixed results from mixed cells. N Eng J Med 2006; 355 (12): 1274-7.
45. Saririan, M; Eisenberg, MJ. Myocardial laser revascularization for the treatment of end-stage coronary artery disease. J Am Coil Cardiol 2003; 41: 173-83.
46. Scapini, P; Morini, M; Tecchio, C; Minghelli, S; Di Carlo, E; et al. CXCLI/Macrophage inflammatory protein-2-induced angiogenesis in vivo is mediated by neutrophil-derived vascular endothelial growth factor-A. The Journal of Immunology 2004; 172: 5034-40.
47. Schruefer, R; Lutze, N; Schymeinsky, J; Walzog, B. Human neutrophils promote angiogenesis by a paracrine feedforward mechanism involving endothelial interleukin-8. Am J Physiol Heart Circ Physiol 2005; 288: H1186-H1192.
48. Schuldt, AJT; Rosen, MR; Gaudette, GR; Cohen, IS. Repairing damaged myocardium: evaluating cells used for cardiac regeneration. Current Treatment Options Cardiovascular Medicine 2008; 10: 59-72.
49. Steinhoff, G; Choi, Y-H; Stamm, C. Intramyocardial bone marrow stem cell treatment for myocardial regeneration. European Heart J Supplements 2006; 8 (Sup. H): H32-H39.
50. Sun, Z; Wu, J; Fujii, H; Wu, J; Li, S-H; Porozov S, Belleli A, Fulga V, Porat Y, Li RK. Human angiogenic cell precursors restore function in the infarcted heart: a comparison of cell delivery routes. European J Heart Failure 2008; 10: 523-33.
51. Sunderkotter, C; Steinbrink, K; Goebeler, M; Bhardwaj, R; Sorg, C. Mac-rophages and angiogenesis. J Leukoc Biol 1994; 55: 410-22.
52. Ting, AE; Mays, RW; Frey, MR; Hof, WV; Medicetty, S; et al. Therapeutic pathways of adult stem cell repair. Critical Reviews Oncology/Hematology 2008; 65: 81-93.
53. Tse, H-F; Kwong, Y-L; Chan, JKF; Lo, G; Ho, C-L; et al. Angiogenesis in is-chaemic myocardium by intramyocardial autologous bone marrow mononuclear cells implantation. Lancet, 2003; 361: 47-49.
54. Tse, H-F; Siu, C-W; Zhu, S-G; Songyan, L; Zhang, Q-Y; et al. Paracrine effects of direct intramyocardial implantation of bone marrow derived cells to enhance neovascularization in chronic ischaemic myocardium. European J Heart Failure 2007; 9: 747-53.
55. Tse, H-F; Thambar, S.; Kwong, Y-L; Rowlings, P; Bellamy, G; McCrohon J, Bastian B, Chan JK, Lo G, Ho CL, Lau CP. Safety of catheter-based intramyocardial autologous bone marrow cells implantation for therapeutic angiogenesis. Am J Cardiol 2006; 98: 60-2.
56. Tse, H-F; Thambar, S.; Kwong, Y-L; Rowlings, P; Bellamy, G; McCrohon J, Bastian B, Chan JK, Lo G, Ho CL, ParkerA, HauserTH, Lau CP. Comparative evaluation of long-term clinical efficacy with catheter-based percutaneous intramyocardial autologous bone marrow cell implantation versus laser myocardial revascularization in patients with severe coronary artery disease. Am Heart J 2007; 154: 982.e1-982.e6.
57. Tuma-Mubarak, J; Fernández-Vina, R; Carrasco-Yalan, A; Castillo-Aguirre, J; Rios-Diaz, H; et al. Refractory angina treatment by percutaneous retrograde sinus technique transplantation of unselected autologous bone marrow mono-nuclear cells: long-term follow-up.Abstracts, Cardiovasc Revascularization Med 2007; 8: 153-4.
58. van Ramshorst, J.; Bax, J.J.; Beeres, S.L.; Dibbets-Schneider, P.; Roes, S.D.; Stokkel, M.P.; de Roos, A.; Fibbe, W.E.; Zwaginga, J.J.; Boersma, E.; Schalij, M.J.; Atsma, D.E. Intramyocardial bone marrow cell injection for chronic myocardial ischemia: a randomized controlled trial. JAMA 301 (19); 1997-2004; 2009.
59. Vicario, J; Campo, С; Piva, J; Faccio, F; Gerardo, L; et al. One-year follow-up of transcoronary sinus administration of autologous bone marrow in patients with chronic refractory angina. Cardiovasc. Revascularization Med. 2005; 6: 99-107.
60. Yang, EH; Barsness, GW; Gersh, BJ; Chandrasekaran, K; Lerman, A. Current and future treatment strategies for refractory angina. Mayo Clin. Proc. 2004; 79 (10): 1284-92.
Пример 3 - Моноциты для ишемии головного мозга Методики молекулярной биологии
Стандартные методики молекулярной биологии, известные в области техники и конкретно не описанные в настоящей заявке, в общем, следуют из Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Springs Harbor Laboratory, New York (1989, 1992), и в Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Maryland (1989). Полимеразная цепная реакция (ПЦР) в общем осуществляется согласно протоколам ПЦР: A Guide to Methods and Applications, Academic Press, San Diego, California (1990). Реакции и методологии, включая другие методики на основе нуклеиновых кислот, если другого не установлено, осуществляют как в общем описано в Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Springs Harbor Laboratory Press, и методологии изложены в патентах США №4,666,828; 4,683,202; 4,801,531; 5,192,659; и 5,272,057, и включены в настоящий документ посредством ссылки. In situ ПЦР в комбинации с проточной цитометрией может применяться для обнаружения клеток, содержащих специфические последовательности ДНК и мРНК (смотрите, например, Testoni et al., Blood, 1996, 87:3822).
Стандартные способы иммунологии, известные из области техники и конкретно не описанные в настоящей заявке, в общем, следуют из Stites et al. (Eds.), Basic And Clinical Immunology, 8th Ed., Appleton & Lange, Norwalk, CT (1994); и Mishell and Shigi (Eds.), Selected Methods in Cellular Immunology, W.H. Freeman and Co., New York (1980).
Иммуноанализы
В общем, иммуноанализы применяются для анализа образца, такого как маркеры клеточной поверхности или тому подобное. Иммуноцитохимические анализы хорошо известны специалистам в данной области техники. В анализе могут применяться как поликлональные, так и моноклональные антитела. При необходимости другие иммуноанализы, такие как фермент, связывающий иммуносорбентный анализ (ELISAs) и радиоиммуноанализы (RIA), могут применяться, как известно специалистам в данной области техники. Доступные иммуноанализы широко описаны в патентах и научной литературе. Смотрите, например, патенты США №3,791,932; 3,839,153; 3,850,752; 3,850,578; 3,853,987; 3,867,517; 3,879,262; 3,901,654; 3,935,074; 3,984,533; 3,996,345; 4,034,074; 4,098,876; 4,879,219; 5,011,771; и 5,281,521, а также Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Springs Harbor, New York, 1989. Ряд других ссылок также может упоминаться в целях настоящего изобретения.
Получение антител
Антитела могут быть моноклональными, поликлональными или рекомбинантными. Антитела могут быть получены против иммуногена или его иммуногенной части, как, например, синтетический пептид на основе последовательности, или полученный рекомбинантно с помощью методики клонирования, или природный генный продукт и/или его части могут быть выделены и применяться в качестве иммуногена. Иммуногены могут применяться для получения антител путем стандартной методики получения антител, хорошо известной в данной области техники и в общем описанной в Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Springs Harbor, New York (1988) and Borrebaeck, Antibody Engineering- A Practical Guide by W.H. Freeman and Co. (1992). Фрагменты антител также могут быть получены из антител с помощью способов, известных в данной области техники, и включают Fab и F(ab')2. Для получения поликлональных антител носителя, такого как кролик или козел, иммунизируют иммуногеном или иммуногенным фрагментом, в общем, совместно с адъювантом, и, если необходимо, с носителем; антитела к иммуногену собирают из сыворотки. Далее, поликлональное антитело может быть абсорбировано из условия, что оно является моноспецифическим. То есть сыворотка подвергается действию родственных иммуногенов, так что кросс-реактивные антитела удаляются из сыворотки, демонстрируя их моноспецифичность.
Для получения моноклональных антител, соответствующего донора, как правило, мышь, гипериммунизируют иммуногеном, и выделяют селезеночные клетки, продуцирующие антитела. Эти клетки сливают с иммортализованными клетками, такими как миеломные клетки, с получением слитого клеточного гибрида, который является бессмертным и секретирует требуемые антитела. Клетки затем культивируют, и моноклональные антитела собирают из культуральной среды.
Для получения рекомбинантных антител информационную РНК из продуцирующих антитела В-лимфоцитов животных или гибридомы обратно-транскрибируют, с получением комплементарной ДНК (кДНК). кДНК антитела, которая может быть полной или частичной длины, амплифицируется и клонируется в фаг или плазмиду. кДНК может быть частичной длины тяжелой и легкой цепи кДНК, отделенной или связанной линкером. Антитело или фрагмент антитела экспрессируется, с применением подходящей экспрессионной системы. кДНК антитела также может быть получена путем скрининга подходящих экспрессионных библиотек. Антитело может быть связано с твердым субстратом-носителем или конъюгировано с обнаруживаемой составляющей, или может быть как связано, так и конъюгировано, как хорошо известно в данной области техники (Конъюгация флуоресцентных или ферментативных составляющих в общем обсуждается в Johnstone & Thorpe, Immunochemistry in Practice, Blackwell Scientific Publications, Oxford, 1982). Связывание антител с твердой подложкой-носителем также хорошо известно в данной области техники (смотрите Harlow & Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Publications, New York, 1988 and Borrebaeck, Antibody Engineering- A Practical Guide, W.H. Freeman and Co., 1992). Обнаруживаемые составляющие, подходящие согласно настоящему изобретению, могут включать, но без ограничения к этому, флуоресцентные, металлические, ферментативные и радиоактивные маркеры. Примеры включают биотин, золото, ферритин, щелочную фосфату, галактозидазу, пероксидазу, уреазу, флуоресцеин, родамин, тритий, 14 с, йодированный и зеленый флуоресцентный белок.
Генная терапия
Генная терапия, применяемая согласно настоящему изобретению, связана с переносом генного материала (например, ДНК или РНК), представляющего интерес, в организм реципиента, для лечения или предотвращения генетического или приобретенного заболевания или состояния. Представляющий интерес генетический материал кодирует продукт (например, белок, полипептид и пептид, функциональную РНК, антисмысловой), продуцирование которого in vivo является желательным. Например, представляющий интерес генетический материал кодирует гормон, рецептор, ферментный полипептид или пептид терапевтического значения. Альтернативно, представляющий интерес генный материал кодирует суицидный ген. Смотрите "Gene Therapy" in Advances in Pharmacology, Academic Press, San Diego, California, 1997.
Введение клеток для трансплантации
Недифференцированные моноциты по настоящему изобретению могут вводиться и дозироваться согласно надлежащей медицинской практике, принимая во внимание клиническое состояние отдельного пациента, место и способ введения, режим введения, возраст пациента, пол, массу тела и другие факторы, известные в медицинской практике. Поэтому фармацевтически "эффективное количество" в целях настоящего изобретения определяют из соображений, известных в области техники. Количество должно быть эффективным для достижения улучшения, включая, но без ограничения к этому, повышенный коэффициент выживаемости или более быстрое восстановление, или уменьшение или исключение симптомов, и другие факторы, которые выбираются при соответствующей оценке специалистом в данной области техники.
В способе по настоящему изобретению недифференцированные моноциты по настоящему изобретению могут вводиться различными путями, которые подходят для имплантации в центральную нервную систему, включая, но без ограничения к этому, внутривенное и внутриартериальное введение, интратекальное введение, внутрижелудочковое введение, интрапаренхиматозное введение, внутричерепное введение, интрацистернальное введение, интрастриарное и интранигральное введение. При желании клетки пуповинной крови вводятся вместе с иммуносупрессивным средством.
Фармацевтические композиции, содержащие эффективные количества клеток пуповинной крови, также предлагаются настоящим изобретением. Эти композиции содержат эффективное число клеток, необязательно, в комбинации с фармацевтически приемлемым носителем, добавкой или эксципиентом. Согласно определенным объектам настоящего изобретения клетки вводятся пациенту, нуждающемуся в трансплантации, в стерильном физиологическом растворе. Согласно другим объектам настоящего изобретения, клетки вводятся в сбалансированном солевом растворе Хэнкса (HBSS) или Isolyte S, pH 7.4. Также могут применяться другие подходы, включая применение клеточной среды, свободной от сыворотки. Системное введение клеток пациенту может быть предпочтительным при определенных признаках, тогда как прямое введение в место или вблизи больной и/или пораженной ткани, может быть предпочтительно при других признаках.
Фармацевтические композиции согласно настоящему изобретению предпочтительно содержат эффективное число клеток в растворе, в общем, в интервале от около 1.0×104 клеток до около 1.0×109 клеток, более предпочтительно от около 1×105 до около 1×107 клеток, даже более предпочтительно от около 2×105 до около 8×106 клеток, необязательно с фармацевтически приемлемым носителем, добавкой или эксципиентом.
Предпочтительно недифференцированные моноциты вводятся вместе с агентом, позволяющим преодолеть гематоэнцефалический барьер. В одном варианте выполнения изобретения, клетки объединяются с агентом, позволяющим преодолеть гематоэнцефалический барьер, до введения пациенту. В другом варианте выполнения изобретения, клетки вводятся пациенту отдельно от агента, позволяющего преодолеть гематоэнцефалический барьер. Необязательно, если клетки вводятся пациенту отдельно от агента, позволяющего преодолеть гематоэнцефалический барьер, существует временной интервал между введением клеток и агента, позволяющего преодолеть гематоэнцефалический барьер. Временной интервал может продолжаться от менее минуты до часов или дней. Оптимальное время и порядок введения легко, стандартным образом определяются специалистом в данной области техники.
В настоящем описании упоминаются различные публикации. Все упомянутые документы включены в настоящую заявку в полном объеме посредством ссылки, с целью более полного описания уровня техники, к которому относится настоящее изобретение. Следующие примеры не предназначены для ограничения объема и сущности настоящего изобретения, а скорее предназначены для иллюстрации определенных вариантов выполнения изобретения. Любые вариации в приведенных примерных способах, которые осуществляются специалистом в данной области техники, входят в объем настоящего изобретения.
Одна представляющая интерес функция зрелых моноцитов/макрофагов состоит в содействии ангиогенезу, связанному с воспалительными реакциями. Ангиогенез (или неоваскуляризация) является основным элементом воспалительных процессов, включая последующие каскады восстановления [Sunderkotter, 1994 #4]. В ходе более раннего процесса воспаления моноциты циркулирующей крови проникают из сосудов в ткани [Bosco, 2008 #3]. Первоначально, близлежащие эндотелиальные и воспалительные клетки регулируют проход моноцитов через стенки сосудов путем выделения ряда адгезивных и хемотаксических веществ [Baggiolini, 2000 #9; Imhof, 2004 #2; Bosco, 2008 #3]. Проникшие моноциты перемещаются вдоль хемотаксического и кислородного градиентов между нормальной и пораженной тканями и собираются в гипоксических и/или некротических центрах больных тканей перед дифференциацией в макрофаги ткани. Примеры патологических тканей, к которым подходят моноциты/макрофаги для аккумуляции, представляют собой следующие: твердые опухоли, миокардиальный и церебральный инфаркт, синовиальные соединения хронического артрита или атеросклеротическая бляшка, бактериальная инфекция и заживающие раны [Baggiolini, 2000 #9; Murdoch, 2004 #1; Bosco, 2008 #3; Mantovani, 2002 #15] (Фиг.8).
После дифференциации из моноцитов макрофаги, как известно, существуют в ткани в виде поляризованных популяций, М1 и М2 подгрупп [Mantovani, 2004 #67; Sica, 2006 #16; Mantovani, 2004 #67; Mantovani, 2002 #15].
В то время как М1 поляризованные макрофаги являются мощными воспалительными клетками, которые продуцируют провоспалительные цитокины и фагоцитируют патогены, М2 макрофаги модулируют воспалительные ответы и способствуют ангиогенезу и восстановлению ткани [Mantovani, 2004 #67; Sica, 2006 #16; Mantovani, 2004 #67; Mantovani, 2002 #15]. Относительно генной экспрессии макрофагов интересно отметить, что в заживлении раны сначала участвует комбинация М1 и М2 подгрупп, а затем М2 гены становятся доминантными [Deonarine, 2007 #68]. В ходе ранней стадии процесса заживления раны М1 макрофаги приводят к воспалительной реакции, которая способствует очищению рану путем удаления остатков микробов и/или пораженной ткани, тогда как восстановление ткани и ангиогенез индуцируются М2 макрофагами в то же самое время. На последней стадии, когда очищение М1 макрофагами уже почти завершилось, преобладающие М2 макрофаги продолжают свою работу, связанную с регенерацией ткани и индуцированием ангиогенеза [Deonarine, 2007 #68]. Аккумуляция очевидно предполагает, что прибывшие моноциты/макрофаги способствуют модуляции и регуляции неоваскуляризации в ишемической ткани, опухолях и хронических воспалениях, таких как артритический сустав и атеросклероз.
Ангиогенез при ишемии
Недифференцированные моноциты или промоноциты дают начало зрелым или дифференцированным моноцитам/макрофагам в циркулирующей крови посредством процесса, называемого дифференциацией.
В последнее время значение циркулирующих зрелых моноцитов/макрофагов для неоваскуляризации было показано в отношении ишемических заболеваний [Shireman, 2007 #23; Herold, 2004 #33; Capoccia, 2008 #32]. Артериогенез, структурный рост ранее установившихся артериолярных сетей в эффективные коллатеральные артерии, как оказывается, инициируется увеличением тангенциального напряжения в жидкости, которое является результатом артериальной обструкции внутри развивающихся коллатеральных артерий, и не индуцируется тканевой гипоксией и ишемией [Ito, 1997 #41; Heil, 2006 #19]. Напротив, ангиогенез, образование новых капилляров из ранее существующих кровеносных сосудов, индуцируется гипоксией, и плотность капилляров обеспечивает непроницаемость в участках серьезной и острой ишемии [Scholz, 2002 #20; Ito, 1997 #41].
Тогда как и артериогенез, и ангиогенез вызывают неоваскуляризацию через различные механизмы, зрелые моноциты/макрофаги вносят существенный вклад в обоих случаях. При артериогенезе внезапная обструкция притоку артериальной крови происходит в результате наличия эмбола, или прогрессивный стеноз увеличивает тангенциальное напряжение в жидкости в артериолярной сети, и, следовательно, число адгезивных молекул и хемокинов, таких как эндотелиальные адгезивные молекулы [Nagel, 1994 #21] и моноцитарный хемотаксический белок-1 (МСР-1) [Eischen, 1991 #22], значительно возрастает. Зрелые моноциты крови активируются и перетягиваются в коллатеральную артерию с помощью МСР-1. Затем они сразу проходят через стенки сосудов путем связывания с адгезивными молекулами и/или дифференцируют в тканевые макрофаги перед продуцированием множества факторов роста и цитокинов [Sunderkotter, 1994 #4], которые могут способствовать пролиферации эндотелиальных клеток и клеток гладкой мышцы [Heil, 2006 #19; Shireman, 2007 #23].
Ангиогенез представляет собой комбинацию более сложных процессов, многие из которых регулируются васкулярным эндотелиальным фактором роста (VEGF) и его рецепторами (VEGFR), которые, как известно, инициируют ангиогенез [Shireman, 2007 #23]. Недавно полученные данные позволяют предположить, что некоторые подгруппы ангиопоэтинов (Ang-1 и 2) и их рецепторы (Tie) играют важнейшую роль для вторичных стадий ангиогенного процесса, таких как созревание, стабилизация и ремоделирование сосудов [Thurston, 2003 #57]. Гипоксия и некроз тканей оказывают значительное воздействие на продуцирование VEGF/VEGFR и ангиопоэтин/Tie рецепторов [Milkiewicz, 2006 #24; Zhang, 2005 #56; Beck, 2000 #58;Murdoch, 2007 #59]. В свою очередь, VEGF и ангиопоэтин индуцируют приток эндотелиальных клеток-предшественников и зрелых моноцитов/макрофагов [Tammela, 2005 #25; Murdoch, 2007 #59].
Рекрутированные зрелые моноциты/макрофаги способствуют ангиогенезу с помощью нескольких потенциальных механизмов. Во-первых, макрофаги разрушают экстраклеточный матрикс, применяя металлопротеиназы матрикса и протеолитические ферменты, приводя к миграции эндотелиальных клеток [Moldovan, 2005 #26]. Путем прохода через экстраклеточный матрикс, факторы роста и эндотелиальные клетки перемещаются из образовавшихся сосудов, с формированием новых капилляров [Shireman, 2007 #23].
Во-вторых, зрелые моноциты/макрофаги высвобождают много проангиогенных цитокинов, таких как основной фактор роста фибробластов (bFGF), VEGF, интерлейкин-8 (IL-8), субстанция Р, фактор некроза опухоли-α (TNF-α), трансформирующий фактор роста (TGF)-α и -β, и простагландины [Sun-derkotter, 1994 #4; Moldovan, 2005 #26], которые оказывают непосредственное или косвенное действие на стимуляцию пролиферации эндотелиальных клеток, их миграцию и образование трубочек [Shireman, 2007 #23; Sunderkotter, 1994 #4]. Хотя, также как и проангиогенные факторы, зрелые моноциты/макрофаги также способны высвобождать анти-ангиогенные цитокины, такие как тромбоспондин 1, интерферон-α и -γ [Sunderkotter, 1994 #4], продуцирование ими ингибиторных цитокинов регулируется проангиогенными факторами. Например, IL-12 ингибируется увеличением Ang-2 [Murdoch, 2007 #59].
В третьих, зрелые моноциты/макрофаги могут дифференцировать в эндотелиальные клетки, которые непосредственно способствуют образованию стенок сосудов [Moldovan, 2005 #26; Moldovan, 2000 #28; Anghelina, 2006 #27]. При стимуляции соответствующими проангиогенными факторами, предшественники зрелых моноцитов/макрофагов могут трансдифференцировать в клетки, подобные эндотелиальным, которые встраиваются непосредственно в новые кровеносные сосуды [Schmeisser, 2003 #30; Schmeisser, 2002 #29; Shireman, 2007 #23; Hoenig, 2008 #31].
В-четвертых, под влиянием VEGF или гипоксии, эндотелиальные клетки продуцируют МСР-1 [Marumo, 1999 #34; Lakshminarayanan, 2001 #35], так же как и VEGF [Moldovan, 2005 #26], и ангиопоэтин [Murdoch, 2007 #59], все из которых активируют и привлекают зрелые моноциты/макрофаги [Shireman, 2007 #23]. Наоборот, зрелые моноциты/макрофаги не только повышающе регулируют Tie-2 (рецептор ангипоэтина) [Murdoch, 2007 #59], но также секретируют МСР-1 и VEGF, при активации гипоксией, которые оказывают влияние на эндотелиальные клетки и даже на самих себя путем аутодействия и паракринного действия, что, следовательно, приводит к удвоению эффекта, оказываемого на ангиогенные процессы [Ferrara, 2004 #60].
Ангиогенез в опухоли и хроническом воспалении
За последние десятилетия были собраны доказательства, что помимо опухолевых клеток самих по себе, зрелые моноциты/макрофаги также играют важную роль в ангиогенезе и развитии опухолей [Sunderkotter, 1994 #4], так как неопластические опухоли показывают неоваскуляризацию только в присутствии макрофагов [Mostafa, 1980 #64], и животные, обедненные моноцитами, показали значительное уменьшение ангиогенеза опухоли [Evans, 1977 #63]. Число макрофагов в опухолевой ткани больше, чем в большинстве нормальных тканей [Gouon-Evans, 2002 #79]. Усиленная мобилизация и дифференциация из циркулирующих зрелых моноцитов более вероятно приводит к увеличенному числу макрофагов в опухолевой ткани, чем к пролиферации макрофагов ткани самих по себе [Mantovani, 2002 #15; Schmid, 2007 #13]. Провоспалительные цитокины, которые индуцируются опухолевыми клетками и центральной гипоксией, привлекают зрелые моноциты/макрофаги к местам неопластического некроза и роста [Pugh-Humphreys, 1992 #44; Coussens, 2002 #78].
Как оказалось, в большинстве случаев, зрелые моноциты/макрофаги рекрутируются с усилением неоваскуляризации, что является критическим фактором для роста и развития опухоли. В большинстве опухолей значительно большую часть опухоль-ассоциированных макрофагов (TAMs) составляет М2 подгруппа макрофагов, которая усиливает ангиогенез, по сравнению с М1 подгруппой, которая убивает опухолевые клетки [Sironi, 2006 #17; Mantovani, 2002 #15; Sica, 2006 #16]. М2 ТАМ секретируют множество проангиогенных факторов, таких как VEGF, TNF-α, IL-8, TGF-β и bFGF [Mantovani, 2002 #15; Sica, 2006 #16; Murdoch, 2004 #1; Nozawa, 2006 #18; Schmid, 2007 #13; Mantovani, 2004 #67], и широкий ряд протеолитических ферментов [Nozawa, 2006 #18], которые могут разрушать внеклеточный матрикс и, в свою очередь, приводят к миграции эндотелиальных клеток для ангиогенеза [Moldovan, 2005 #26; Schmid, 2007 #13]. Важно отметить, что между ТАМ и сосудистыми плотностями наблюдалась значительная корреляция в случае рака толстой кишки [Oosterling, 2005 #10], рака молочной железы [Leek, 2002 #12] и панкреатического рака [Esposito, 2004 #11], что позволяет предположить, что ТАМ усиливают ангиогенез опухоли [Schmid, 2007 #13]. Кроме того, сильный приток ТАМ в значительной степени связан с плохим прогнозом для некоторых типов опухоли [Leek, 2002 #12; Oosterling, 2005 #10].
Ангиогенез также вносит свой вклад в патологию хронического воспаления. Состояние хронического воспаления может поддерживаться благодаря образованию новых сосудов, которые непрерывно доставляют воспалительные клетки к области воспаления и снабжают ее кислородом и питательными веществами [Jackson, 1997 #37]. Механизм и характерные признаки неоваскуляризации, связанной с хроническим воспалением, не отличаются от ангиогенеза, индуцированного ишемией или опухолью. Большинство цитокинов и факторов роста, как известно, могут быть продуцированы зрелыми моноцитами/макрофагами для регуляции ангиогенеза [Sun-derkotter, 1994 #4]. В ходе образования поверхностного диффузного сосудистого кератита при ревматоидном артрите и образования атеросклеротической бляшки при атеросклерозе, пролиферирующая воспалительная ткань содержит ряд воспалительных клеток, особенно моноцитов/макрофагов, формирующих новые сосуды, и полученные дифференцированием воспалительные медиаторы [Jackson, 1997 #37]. Конечным результатом является то, что увеличенное число зрелых моноцитов/макрофагов может наблюдаться для большинства воспалительных областей, где ангиогенез осуществляется в анормальной среде, включая патологические состояния, такие как ишемия, опухоль и хроническое воспалительное заболевание, а также заживление раны [Wagner, 2008 #38; Jackson, 1997 #37; Sunderkotter, 1994 #4; Hunt, 1984 #39].
Трансплантация зрелых моноцитов по сравнению с трансплантацией стволовых клеток
Ряд исследований был проведен для изучения терапевтического потенциала зрелых моноцитов/макрофагов для артериогенеза и/или ангиогенеза, в первую очередь на моделях ишемической болезни [Buschmann, 2001 #42; Heil, 2002 #43; Herold, 2004 #33; Ito, 1997 #45; Hirose, 2008 #65]. Для артериогенеза и ангиогенеза зрелые моноциты могут быть новыми и служить в качестве клеток-мишеней для клеточной терапии, направленной на усиление роста коллатеральных сосудов, с последующей регенерацией ткани, что может уменьшить локальную ишемию ткани и улучшить клинические результаты [Sasayama, 1992 #40; Krupinski, 1994 #54]. Неоваскуляризация из эндогенных зрелых моноцитов может быть индуцирована непосредственно инфузией МСР-1 [Ito, 1997 #45] или гранулоцитарно-макрофагальным колониестимулирующим фактором (GM-CSF) [Buschmann, 2001 #42], или косвенно, через эффект возобновления симптомов после введения 5-фторурацила [Heil, 2002 #43]; все эти вещества могут способствовать возврату к коллатеральным артериям и аккумуляции вокруг них, или пролиферации эндогенных моноцитов.
Кроме того, неоваскуляризация может быть достигнута путем трансплантации экзогенных аутологичных или аллогенных зрелых моноцитов, с применением ex vivo инженерии или без нее. Благодаря разработке эффективного способа выделения зрелых моноцитов из периферической крови [Herold, 2006 #46; Gonzalez-Barderas, 2004 #47; de Almeida, 2000 #48; Rep-nik, 2003 #49], может быть собрано необходимое количество аутологичных зрелых моноцитов. Хотя периферическая кровь дает ограниченное число зрелых моноцитов, число зрелых моноцитов может быть увеличено до количества клеток, необходимого для последующего применения, путем повторного сбора аутологичных зрелых моноцитов из периферической крови субъекта с помощью лейкапфереза [Herold, 2006 #46]. Развитие ex vivo тканевой инженерии приводит к новой стратегии применения зрелых моноцитов в качестве векторов для трансфекции терапевтического гена, например, доставки GM-CSF для усиления неоваскуляризации [Herold, 2004 #33], а также для непосредственно осуществления клеточной трансплантации. Эта разработка, от выделения из клеток до применения, должна сделать зрелые моноциты более ценными для регенеративной медицины, особенно с точки зрения усиления артериогенеза и ангиогенеза.
У трансплантации зрелых моноцитов, по сравнению с трансплантацией стволовых клеток, можно найти несколько преимуществ (Таблица 4). Во-первых, в отличие от клеток-предшественников/стволовых клеток они не способны к самообновлению и пролиферации, таким образом, уменьшая возможность образования опухоли из клеточного трансплантата. Во-вторых, они не могут дифференцировать в клетки других линий дифференцировки, что может позволить избежать нежелательных эффектов в специфических тканях, если их туда трансплантируют или они туда мигрируют. В-третьих, в отличие от тканей эмбриона и плода, они не связаны с этическими и моральными аспектами, связанными с получением и трансплантацией, потому что они могут быть легко собраны из периферической крови или костного мозга взрослого организма или в перинатальный период. В-четвертых, трансплантация зрелых моноцитов может позволить избежать иммунной реакции, такой как реакция «трансплантат против хозяина» (GvHD), которая часто возникает после трансфузии аллогенных лейкоцитов или ВМ трансплантации хозяину несовпадающего человеческого лейкоцитарного антигена (HLA). GvHD представляет собой иммунную реакцию, которая происходит в результате активации Т-клеток в трансплантате (донорных клетках) после обнаружения тканей-хозяина (реципиентных клеток) из-за антигенного отличия [Brichard, 2001 #75]. Активированные донорные Т-клетки продуцируют изобилие цитотоксических и воспалительных цитокинов и атакуют ткани хозяина. Что касается GvHD, независимо от HLA совпадения, трансплантация фракции зрелых моноцитов самой по себе должна быть в большей степени безопасной, чем трансплантация мононуклеарной фракции ВМ или GM-CSF, мобилизованных в периферической крови, которая наверняка включает лимфоциты. Наконец, зрелые моноциты/макрофаги могут секретировать ряд цитокинов, факторов роста и трофических веществ, которые могут непосредственно способствовать регенерации других тканей, а также ангиогенезу [Sunderkotter, 1994 #4]. Например, VEGF, как известно, способен стимулировать развитие нервных клеток [Jin, 2002 #55; Teng, 2008 #61].
Моноциты из пуповинной крови
Зрелые моноциты составляют около 5-10% от лейкоцитов периферической крови человека [Gordon, 2005 #72; Mielcarek, 1997 #74], тогда как недифференцированные моноциты или промоноциты содержат 2% ВМ мононуклеарных клеток [Mielcarek, 1997 #74]. Напротив, не сообщалось ни о каком различии между содержанием моноцитов в пуповиной крови (UCB) и периферической крови взрослого организма [Sorg, 2001 #73; Mills, 1996 #71]. Поэтому, ВМ и UCB, так же как и периферическая кровь, могут быть потенциальными кандидатами в качестве источника аутологичных или аллогенных недифференцированных моноцитов или зрелых моноцитов/макрофагов. На самом деле, ВМ и UCB в настоящее время являются стандартными источниками гемопоэтических клеток-предшественников, применяемых для воссоздания линий дифференцировки в крови после миелоаблативной терапии при злокачественном и доброкачественном заболевании крови. Однако потенциал этой популяции стволовых клеток для клеточной терапии также был продемонстрирован в случае других дегенеративных заболеваний, особенно ишемической болезни. Набираются доказательства, что доставка стволовых клеток костного мозга или стволовых клеток пуповинной крови к области ишемии путем прямой местной трансплантации или инъекции в кровь может улучшить состояние при патологическом изменении и ухудшении функций [Henning, 2007 #70; Chen, 2003 #51; Willing, 2003 #52; Newcomb, 2007 #26; Chang, 2007 #143]. Как полагают, это улучшение отчасти происходит в результате ангиогенеза, индуцированного стволовыми клетками в ишемическом и/или периишемическом центре [Chen, 2003 #51; Taguchi, 2004 #53; Chang, 2007 #143], даже несмотря на то/что механизмы, с помощью которых эти клетки оказывают их ангиогенные эффекты, не до конца понятны.
По существу, моноциты в UCB являются уникальными по сравнению с моноцитами, происходящими из костного мозга (ВМ) и периферической крови взрослого организма [Newcomb, 2007 #26]. Только моноциты взрослого организма активируются гепатоцитным фактором роста, который является существенным фактором для нормальных функций моноцитов, таких как презентация антигена [Jiang, 2001 #154]. UCB моноциты экспрессируют меньше лейкоцитарного антигена-DR человека, чем клетки взрослого человека, так что их цитотоксическая способность ниже [Theilgaard-Monch, 2001 #155]. Более того, UCB моноциты не дифференцируют в зрелые дендритные клетки до той степени, до которой дифференцируют зрелые моноциты, даже при стимуляции IL-4 и GM-CSF [Liu, 2001 #66]; дендритные клетки играют важную роль в активации природных Т-клеток. Секреторная функция также отличается для UCB моноцитов и моноцитов крови взрослого организма. Меньшая секреция IL-1R и TNF-α, оба из которых стимулируют воспаление, а также играют важную роль в иммунных реакциях, таких как GvHD [Hill, 1997 #76], UCB моноцитами после воздействия рекомбинантного интерферона-γ наиболее вероятно связана с различиями в экспрессии моноцитарных антигенов, таких как CD64, CD14, CD33 и CD45RO, по сравнению с моноцитами крови взрослого человека [Brichard, 2001 #75]. CD14+ моноциты/макрофаги в утробной децидуальной ткани и крови женщины с нормально протекающей беременностью преимущественно представляют собой М2 подгруппу, которая моделирует иммунную реакцию в системе мать-плод и способствуют ремоделированию ткани и ангиогенезу для поддержания успешного течения беременности [Gus-tafsson, 2008 #69]. Эти результаты позволяют предположить, что большинство UCB моноцитов также могут стать М2 поляризованными макрофагами, которые являются менее воспалительными и более ангиогенными, потому что децидуальные макрофаги возможно отчасти дифференцируют из UCB моноцитов.
Незрелость функции, стимулирующей иммунную реакцию и воспаление, у UCB моноцитов может способствовать более низкой заболеваемости, связанной с подавлением иммунитета, включая GvHD, и/или ингибированию опасной воспалительной реакции после трансплантации, даже если они происходят из аллогенного источника. Хотя трансплантация моноцитов из аутогенного ВМ или аутогенной периферической крови может позволить избежать иммунного отторжения и GvHD, сбор из костного мозга, сам по себе, нуждается в дополнительном времени, затратах и создает физическую нагрузку для пациента. Повторный сбор моноцитов и выделение их из собственной периферической крови пациента также требует дополнительного времени и затрат. Напротив, с точки зрения клеточной терапии, одним из самых лучших преимуществ UCB моноцитов, по сравнению с аутологичными моноцитами взрослого организма, является быстрая доступность. Например, для пациентов, перенесших удар, "доступное время" является критическим фактором, и восстановление, вмешательство и процесс манипуляции клетками могут оказаться неосуществимым в терапевтическом окне, согласно состоянию надлежащей медицинской практики на сегодняшний день (cGMP). Поскольку рассматриваются и осуществимость, и безопасность, UCB моноциты являются наиболее ценными аллогенными клетками, которыми можно заранее всецело манипулировать, без нанесения вреда донору или реципиенту перед трансплантацией, даже если клетки иммунологически не совпадают с клетками реципиента. Таблица 5 показывает преимущества UCB моноцитов для клеточной терапии.
Это превосходство UCB моноцитов по сравнению с моноцитами костного мозга и периферической крови приводит к более тщательному исследованию их многообещающей роли для клеточной терапии. Недавно наша группа показала на крысиной модели окклюзии средней церебральной артерии, что трансплантация UCB клеток человека, обедненных субпопуляцией моноцитов (CD14+), не приводит к улучшению нейрологического результата до той степени, что трансплантация других UCB клеток (обедненных Т-клетками, обедненных В-клетками, обедненных CD133+ и целой мононуклеарной фракции) (Womble, et al., 2008). В отношении ангиогенеза, полученные результаты позволяют предположить, что трансплантация обедненных моноцитами UCB клеток человека не могла бы индуцировать ангиогенез надлежащим образом и, в свою очередь, не привела бы к улучшению неврологической дисфункции. По меньшей мере, субпопуляция моноцитов UCB должна иметь критическое значение для UCB-индуцированного восстановления после инсульта.
Кроме того, на мышиной модели для синдрома Санфилиппо типа В (MPS III В) мы также показали, что двигательная дисфункция и память будут улучшаться после внутривенной трансплантации моноцитов/макрофагов из UCB человека (Garbuzova-Davis, et al., 2008). При MPS III В недостаток фермента α-N-ацетилглюкозаминидазы (Naglu) приводит к накоплению гепарансульфата (HS), гликозаминогликана внутри клеток и, наконец, приводит к прогрессивной церебральной и системной аномалии органов. Хотя гликозаминогликаны известны в качестве молекул внеклеточного матрикса, которые оказывают влияние на фагоцитарную способность макрофагов, функция моноцитов/макрофагов при патологическом состоянии с избытком HS, таком как синдром Санфилиппо, не ясна. В нашем исследовании, помимо неврологического улучшения, гистопатологическое исследование показало, что число микроглий (макрофаги в мозге) возросло во всех гиппокампальных областях мышей, с мутацией в гене Naglu, обработанных моноцитами, и уровни HS уменьшились в печени обработанных мышей. Более того, вздутие мочевого пузыря, обычно серьезная проблема для пожилых мышей, также уменьшилось у обработанных мышей. Эти результаты позволяют предположить, что введение UCB моноцитов/макрофагов человека приводит к улучшениям у мышиных моделей MPS III В, возможно благодаря влиянию трансплантированных клеток на механизмы фагоцитоза в условиях накопления HS при этом заболевании (Garbuzova-Davis, et al., 2008).
Конечно, эффективность моноцитов при клеточной трансплантации также была тщательно оценена перед клиническим терапевтическим применением, так как их специфическая роль и функция в воспалительном процессе и иммуномодуляции еще не до конца понятна. Их пагубный потенциал в отношении развития васкуляризации опухоли, диабетической ретинопатии, артрического поверхностного диффузного сосудистого кератита и атеросклеротической бляшки также может нуждаться в серьезном исследовании [Herold, 2006 #46]. Однако эти опасные побочные явления можно предупредить путем тщательной оценки, имеет ли предполагаемый реципиент ранее существующую злокачественность, неконтролируемый диабет, артрит, атеросклероз или нет. Если в ходе предшествующей лечению оценки пациенты показали наличие ранее существующего заболевания, которое может обостриться при трансплантации моноцитов, клеточная трансплантации не будет проводиться для этих пациентов. Это маловероятно, поскольку, как нам известно в меру наших знаний, не сообщалось об осложнениях, связанных с моноцитами, как, например, о прогрессии ранее существующей опухоли или хронического воспалительного заболевания, после ВМ или UCB трансплантации пациентам, с гематологической злокачественностью или незлокачественными заболеваниями, даже если моноциты содержат значительную часть ВМ и UCB.
Напротив, применение UCB моноцитов может предупреждать возможные вредные эффекты или оказывать противовоспалительные эффекты. Были собраны доказательства, что UCB мононуклеарные клетки обеспечивают противовоспалительную реакцию при некоторых болезненных состояниях. Ранее мы показали, что трансплантация UCB мононуклеарных клеток человека значительно уменьшает число CD45+/CD11b+ (микроглий/макрофагов) и CD45+/B220+ (В-клетка) клеток в мозге крыс с окклюзией средней церебральной артерии [Vendrame, 2005 #106]. Кроме того, UCB трансплантация уменьшает провоспалительные цитокины, такие как TNF-α и IL-1β [Vendrame, 2005 #106]. Недавно мы также обнаружили, что трансплантация UCB мононуклеарных клеток человека посредством внутривенной инъекции более пожилым крысам может значительно уменьшить число активированных микроглий и улучшить развитие нервных клеток [Bach-stetter, 2008 #5]. Хронический микроглиоз свидетельствует о хронической воспалительной реакции в мозговой ткани и участвует в поражении нервной структуры при ишемическом поражении, а также при других нейроде-генеративных заболеваниях, таких как болезнь Паркинсона и болезнь Альцгеймера [Streit, 1999 #9]. Поэтому полученные результаты позволяют предположить, что UCB мононуклеарные клетки могут улучшить неблагоприятную среду гиппокампа пожилого пациента путем противовоспалительной реакции и, затем, восстановительного потенциала нервных стволовых клеток/клеток-предшественников в организме пожилого пациента. На основании этих исследований можно сделать вывод, что моноцитарная фракция, которая содержит UCB мононуклеарные клетки в значительной степени, должна иметь потенциал к инициированию противовоспалительной реакции, которая может быть частично ответственна за функциональные улучшения, наблюдаемые на животных моделях повреждения, включая инсульт.
В заключении необходимо отметить, что недифференцированные моноциты или промоноциты являются прекрасной альтернативой трансплантации стволовых клеток в терапевтических целях, благодаря их способности усиливать артериогенез и ангиогенез при различных заболеваниях. Эти недифференцированные моноциты должны быть первыми кандидатами благодаря их выдающейся эффективности применения, безопасности и многочисленным функциям, таким как противоопухолевая реакция, а также ангиогенез.
Настоящее изобретение было описано иллюстративным образом, и необходимо понимать, что используемая терминология предназначается только для описания настоящего изобретения, но не для его ограничения. Очевидно, что возможны многочисленные вариации и модификации настоящего изобретения, и специалист в данной области техники может создать дополнительные варианты выполнения настоящего изобретения и его модификации, без отклонения от сущности и объема заявленного изобретения. Поэтому необходимо понимать, что в рамках приложенной формулы изобретения настоящее изобретение может быть осуществлено на практике образом, отличным от описанного. Соответственно, необходимо понимать, что приведенные в настоящей заявке чертежи и описание предложены в качестве примера, для облегчения понимания настоящего изобретения, и не должны истолковываться как ограничивающие объем настоящего изобретения.
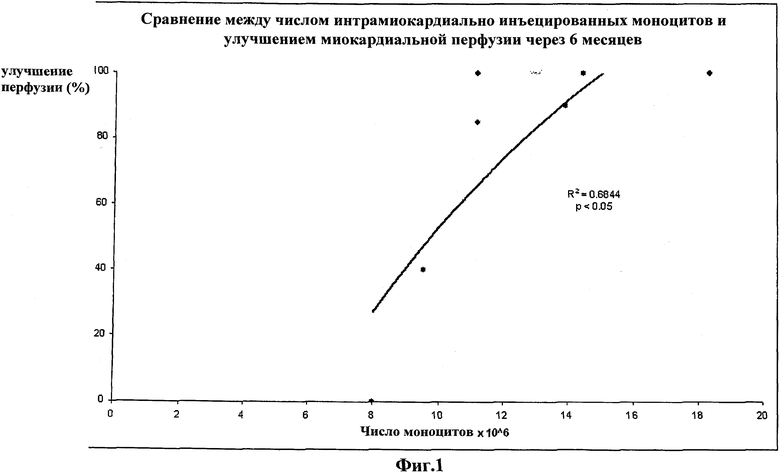
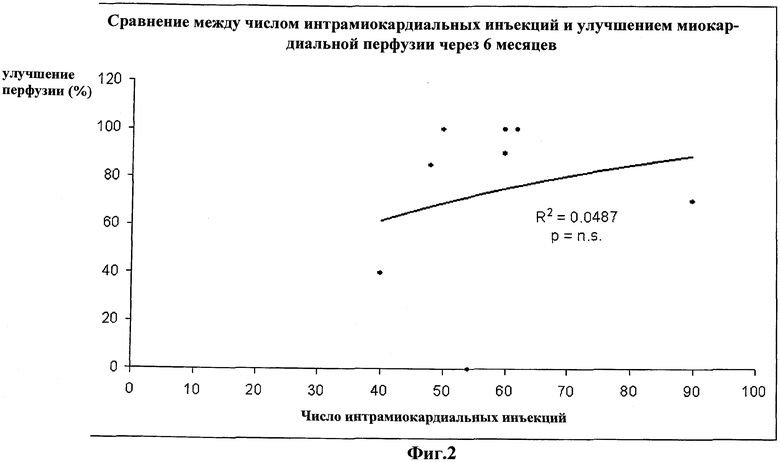
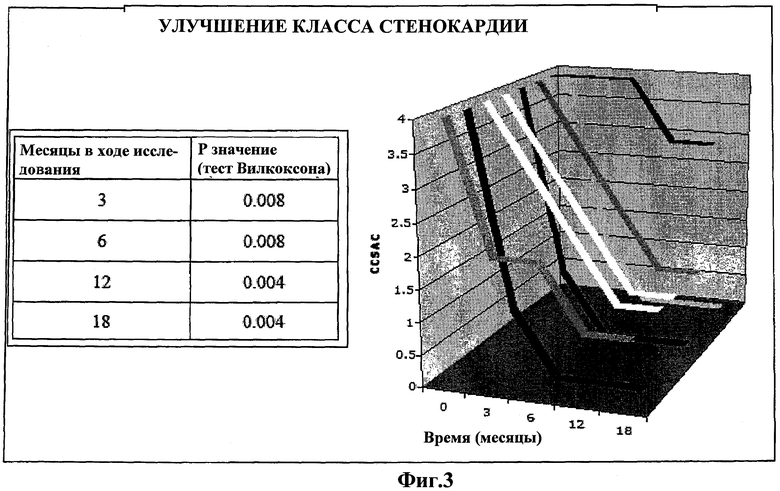
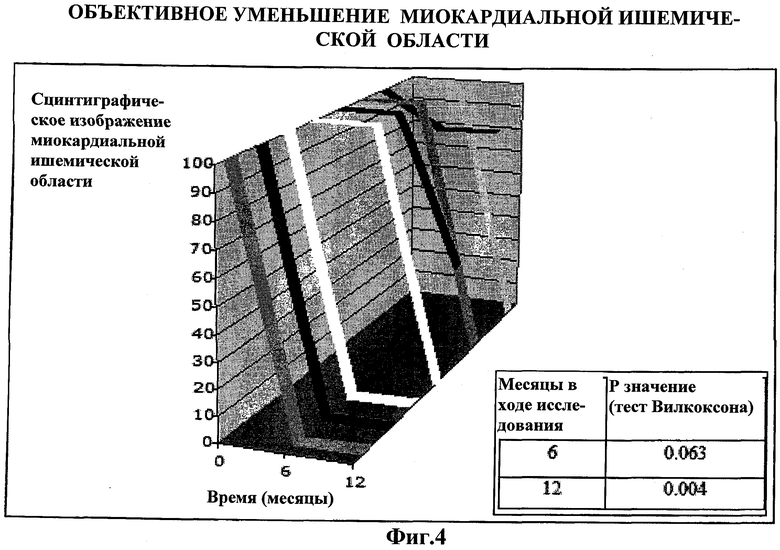
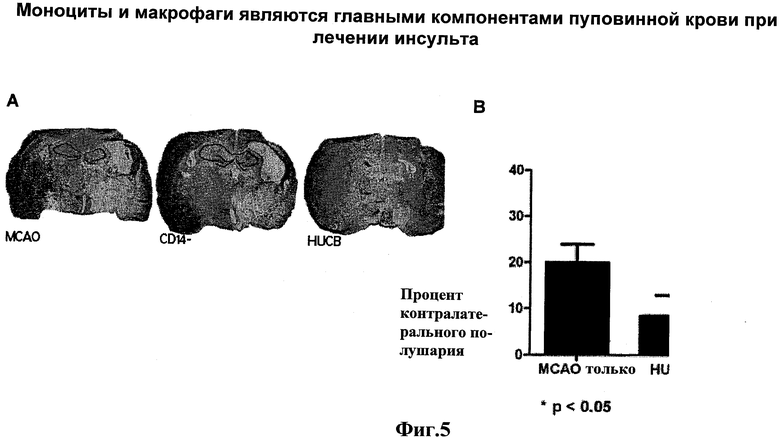
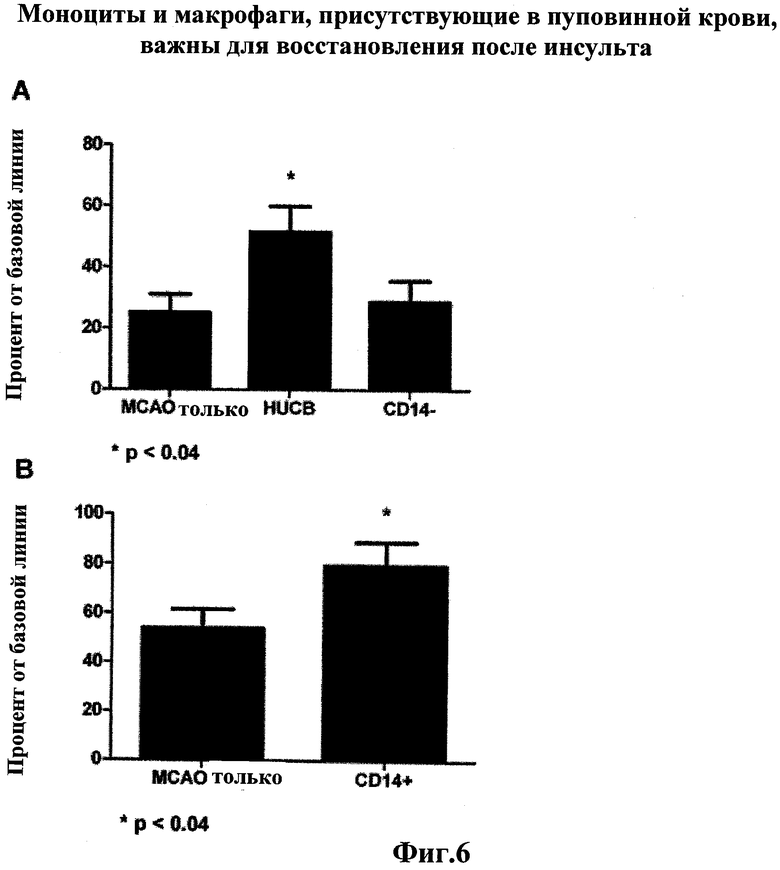
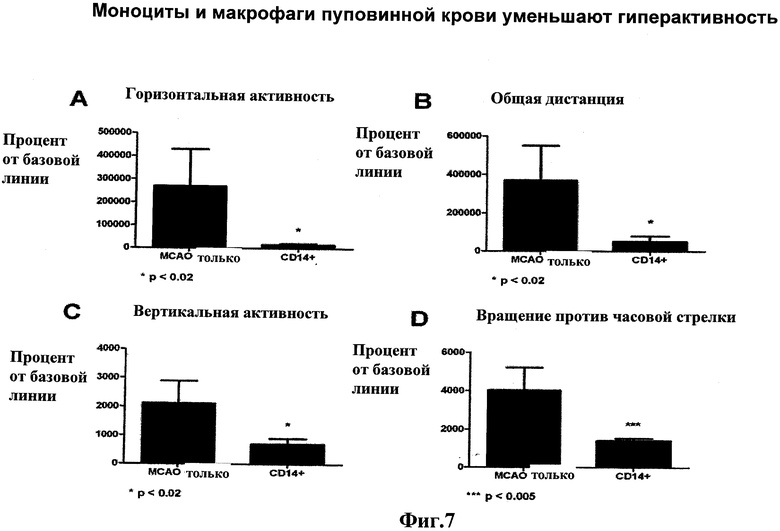
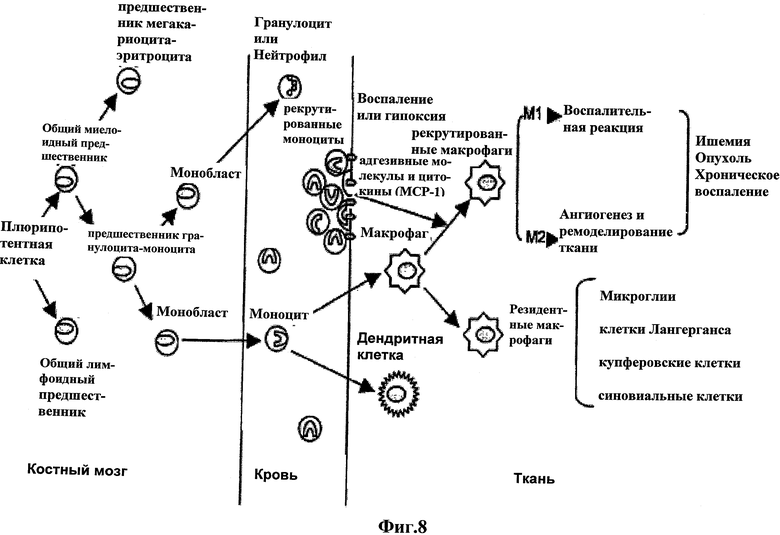
Изобретение относится к области биотехнологии, конкретно к клеточным технологиям, и может быть использовано в медицине. Популяцию мононуклеарных клеток или неэмбриональных стволовых клеток, обогащенную клетками моноцитарной линии дифференцировки, содержащей промоноциты, применяют для лечения ишемии у субъекта. Изобретение позволяет эффективно лечить ишемию у субъекта путем инъекции указанной популяции терапевтических клеток в ишемическую ткань субъекта. 2 н. и 11 з.п. ф-лы, 8 ил., 5 табл., 3 пр.
1. Применение популяции терапевтических клеток для лечения ишемии у субъекта, включающее инъекцию популяции терапевтических клеток в ишемическую ткань субъекта, где популяция терапевтических клеток содержит (i) популяцию мононуклеарных клеток, обогащенную клетками моноцитарной линии дифференцировки, или (ii) популяцию неэмбриональных стволовых клеток, обогащенную клетками моноцитарной линии дифференцировки посредством культивирования популяции неэмбриональных стволовых клеток в условиях, которые обогащают клетками моноцитарной линии дифференцировки, или добавления клеток моноцитарной линии дифференцировки к популяции неэмбриональных стволовых клеток, и где клетки моноцитарной линии дифференцировки содержат промоноциты.
2. Применение по п.1, где ишемией является сердечная ишемия, и ишемической тканью является ишемический миокард.
3. Применение по п.1, где популяция терапевтических клеток представляет собой популяцию мононуклеарных клеток и содержит 107 клеток моноцитарной линии дифференцировки.
4. Применение по п.1, где популяция терапевтических клеток инъецируется в миокард посредством по меньшей мере двух отдельных инъекций, по меньшей мере трех отдельных инъекций, по меньшей мере четырех отдельных инъекций, по меньшей мере пяти отдельных инъекций, по меньшей мере десяти отдельных инъекций, по меньшей мере двадцати отдельных инъекций, по меньшей мере тридцати отдельных инъекций или по меньшей мере сорока отдельных инъекций.
5. Применение по п.1, где инъекция составляет от 0.05 мл до 0.3 мл.
6. Применение по п.5, где инъекция составляет около 0.2 мл.
7. Применение по п.1, где популяция терапевтических клеток является аутологичной по отношению к субъекту.
8. Применение по п.1, где популяция терапевтических клеток является аллогенной по отношению к субъекту.
9. Применение по п.1, где популяцией терапевтических клеток является мононуклеарная клеточная популяция, и мононуклеарная клеточная популяция была получена из костного мозга, пуповинной крови или мобилизированной периферической крови.
10. Применение по п.1, где популяцией терапевтических клеток является мононуклеарная клеточная популяция, и мононуклеарная клеточная популяция была получена из костного мозга.
11. Применение по п.1, где популяцией терапевтических клеток является мононуклеарная клеточная популяция, и обогащение клетками моноцитарной линии дифференцировки включает выделение терапевтических клеток из образца, применяя способ, который приводит к обогащению клетками моноцитарной линии дифференцировки; культивирование популяции терапевтических клеток в условиях обогащения клетками моноцитарной линии дифференцировки; и/или добавление клеток моноцитарной линии дифференцировки к популяции терапевтических клеток.
12. Инъекционное терапевтическое средство для введения в ишемическую ткань посредством устройства, способного доставлять отмеренные инъекции терапевтического средства в ишемическую ткань, где устройство содержит резервуар для терапевтического средства, и терапевтическое средство содержит популяцию терапевтических клеток, где популяция терапевтических клеток содержит (i) популяцию мононуклеарных клеток, обогащенную клетками моноцитарной линии дифференцировки, или (ii) популяцию неэмбриональных стволовых клеток, обогащенную клетками моноцитарной линии дифференцировки посредством культивирования популяции неэмбриональных стволовых клеток в условиях, которые обогащают клетками моноцитарной линии дифференцировки, или добавления клеток моноцитарной линии дифференцировки к популяции неэмбриональных стволовых клеток, и где клетки моноцитарной линии дифференцировки содержат промоноциты.
13. Инъекционное терапевтическое средство по п.12, где популяция терапевтических клеток представляет собой популяцию мононуклеарных клеток и содержит по меньшей мере 107 клеток моноцитарной линии дифференцировки.
| US 20020034501 A1, 21.03.2002 | |||
| US 20080057043, 06.03.2008 | |||
| BEERES ET AL., Sustained effect of autologous bone marrow mononuclear cell injection in patients with refractory angina pectoris and chronic myocardial ischemia: Twelve-month follow-up results, AMERICAN HEART JOURNAL, 2006, v.152, n.4, p | |||
| МЕХАНИЧЕСКИЙ КАЛЕНДАРЬ | 1914 |
|
SU684A1 |
| PERIN EMERSON C | |||
| ET AL., Improved | |||
Авторы
Даты
2014-12-20—Публикация
2009-09-14—Подача