Область, к которой относится изобретение
Настоящее изобретение относится к способам, в которых используются композиции, содержащие по меньшей мере один термолизин-подобный нейтральный фермент протеазу, обладающий повышенной стабильностью при хранении и/или повышенной каталитической активностью, а также к указанным композициям. В некоторых вариантах изобретения, термолизин применяется для очистки и в других целях, требующих использования детергентов. В некоторых своих особенно предпочтительных вариантах, настоящее изобретение относится к способам, в которых используются термолизин-содержащие композиции, полученные или сконструированные в целях предотвращения индуцированной детергентом инактивации, а также к указанным композициям.
Предшествующий уровень техники
Бациллы (Bacilli) представляют собой грамположительные бактерии, секретирующие ряд применяемых в промышленности ферментов, которые с минимальными затратами могут быть продуцированы в больших объемах путем ферментации. Примерами секретируемых бациллами ферментов являются: сериновая протеаза субтилизин, цинк-содержащие нейтральные протеазы, альфа-амилазы и целлюлазы. Протеазы Bacillus широко применяются в текстильной промышленности, в производстве стиральных порошков и моющих средств, используемых в домашнем хозяйстве (Galante, Current Organic Chemistry, 7:1399-1422, 2003; and Showell, Handbook of Detergents, Part D: Formulation, Hubbard (ed.), NY: Taylor and Francis Group, 2006). Для высокоэффективного удаления окрашивающих веществ и пятен из белья, подвергаемого стирке, требуются протеазы. Однако жидкие препараты, включающие очищающие и моющие средства, обычно содержат модифицирующие добавки, поверхностно-активные вещества и вещества, образующие хелатные комплексы с металлами, которые обладают дестабилизирующим действием на большинство протеаз.
Детергенты и другие очищающие композиции обычно включают сложную комбинацию активных ингредиентов. Так, например, большинство очищающих продуктов включает систему поверхностно-активных веществ, ферменты для очистки, отбеливатели, модифицирующие добавки, ингибиторы образования мыльной пены, грязь-суспендирующие агенты, грязеотталкивающие агенты, оптические отбеливатели, мягчители, диспергирующие вещества, соединения, ингибирующие перенос красителя, абразивы, бактерициды и отдушки. Несмотря на сложный состав используемых в настоящее время детергентов, существуют множество красителей, которые трудно удалить полностью. Кроме того, часто образуется стойкий остаток, который приводит к изменению цвета (например, к пожелтению) и к ухудшению внешнего вида, вызываемому неполной очисткой. В последнее время, эти проблемы осложняются все возрастающим применением стирки при низких температурах (например, холодной водой) и более короткими циклами стирки. Кроме того, многие пятна состоят из сложных смесей волокнистых материалов, включающих, главным образом, углеводы и производные углеводов, волокно и компоненты клеточных стенок (например, растительный материал, компоненты древесины, грязь, содержащая почву/глину, и компоненты плодов). Присутствие таких пятен создает значительные трудности для приготовления и применения очищающих композиций.
Кроме того, цветная одежда быстрее изнашивается и теряет свой внешний вид. Часть ее окраски теряется в процессе стирки, а в частности, в процессе стирки в стиральных машинах и машинной сушки. Кроме того, очевидно, что потеря прочности при растяжении ткани является неизбежным результатом механического или химического действия, обусловленного ноской, изнашиванием и/или стиркой и сушкой. Таким образом, необходимо разработать средство для действенной и эффективной стирки цветной одежды, которая как минимум не ухудшала бы ее внешний вид.
В целом, несмотря на успехи в производстве очищающих композиций, необходимость в получении детергентов, которые обладали бы способностью удалять пятна, сохранять цвет ткани и ее внешний вид, а также предотвращать потерю окраски, остается актуальной. Кроме того, существует также необходимость в получении моющего средства и/или композиций по уходу за тканью, которые обеспечивали бы и/или сохраняли бы прочность ткани при растяжении, предохраняли бы ткань от образования складок и вздутий и/или от ее усадки, а также придавали ткани антистатические свойства и мягкость, сохраняли бы желаемый цвет ткани и придавали бы ей износостойкость и другие ценные свойства. В частности, необходимость в создании композиций, способных к удалению окрашивающих компонентов пятен, которые часто сохраняются на ткани после стирки, остается актуальной. Кроме того, необходимо также разработать более эффективные методы и композиции, которые могут быть использованы для отбеливания текстильных изделий.
Описание сущности изобретения
Настоящее изобретение относится к способам, в которых используются композиции, содержащие по меньшей мере один термолизин-подобный нейтральный фермент протеазу, обладающий повышенной стабильностью при хранении и/или повышенной каталитической активностью, а также к указанным композициям. В некоторых вариантах изобретения, термолизин применяется для очистки и в других целях, требующих использования детергентов. В некоторых своих особенно предпочтительных вариантах, настоящее изобретение относится к способам, в которых используются термолизин-содержащие композиции, полученные или сконструированные в целях предотвращения индуцированной детергентом инактивации, а также к указанным композициям.
Настоящее изобретение относится к композициям, содержащим выделенный термолизин и ингибитор нейтральной металлопротеазы, где указанным термолизином является термолизин Geobacillus или термолизин Bacillus. В некоторых вариантах изобретения, композиции согласно изобретению включают выделенный термолизин и ингибитор нейтральной металлопротеазы, выбранный из фосфорамидона и галардина. В некоторых вариантах изобретения, термолизином композиций согласно изобретению является термолизин G. caldoproteolyticus или G. stearothermophilus, а в других вариантах изобретения, термолизином композиций согласно изобретению является термолизин B. thermoproteolyticus. В некоторых конкретных вариантах изобретения, композиции согласно изобретению содержат термолизин, аминокислотная последовательность которого по меньшей мере на 50% (50-100%, а предпочтительно, по меньшей мере на 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%) идентична аминокислотной последовательности термолизина, содержащего аминокислотную последовательность, представленную в SEQ ID NO:3. В некоторых других вариантах изобретения, композиции согласно изобретению содержат термолизин, включающий аминокислотную последовательность, представленную в SEQ ID NO:3. В других вариантах изобретения, композиции согласно изобретению содержат термолизин, имеющий аминокислотную последовательность SEQ ID NO:3.
Кроме того, настоящее изобретение относится к выделенному варианту термолизина, обладающему повышенной стабильностью и/или эффективностью. В некоторых предпочтительных вариантах изобретения, вариантом термолизина является вариант термолизина Geobacillus, имеющий аминокислотную последовательность, содержащую одну или несколько замен в положениях, выбранных из положений, эквивалентных положениям 6, 7, 49, 56, 58, 61, 63, 65, 75, 128, 151, 156, 196, 273, 278 и 280 аминокислотной последовательности, представленной в SEQ ID NO:3. В подварианте этих вариантов, одной или несколькими заменами являются одна, две, три, четыре или пять замен в положениях, выбранных из положений, эквивалентных положениям 6, 7, 49, 56, 58, 61, 63, 65, 75, 128, 151, 156, 196, 273, 278 и 280 аминокислотной последовательности, представленной в SEQ ID NO:3. В других своих вариантах, настоящее изобретение относится к выделенному варианту термолизина Geobacillus, имеющему аминокислотную последовательность, содержащую одну или несколько замен в положениях, выбранных из положений, эквивалентных положениям 4, 6, 7, 36, 49, 53, 56, 58, 61, 63, 65, 75, 85, 108, 128, 129, 151, 156, 194, 195, 196, 261, 265, 273, 278, 280 и 297 аминокислотной последовательности, представленной в SEQ ID NO:3, и обладающему повышенной стабильностью и/или эффективностью. В подварианте этих вариантов, одной или несколькими заменами являются одна, две, три, четыре или пять замен в положениях, выбранных из положений, эквивалентных положениям 4, 6, 7, 36, 49, 53, 56, 58, 61, 63, 65, 75, 85, 108, 128, 129, 151, 156, 194, 195, 196, 261, 265, 273, 278, 280 и 297 аминокислотной последовательности, представленной в SEQ ID NO:3.
В некоторых других своих вариантах, настоящее изобретение относится к варианту термолизина, содержащему одну или несколько замен, выбранных из группы замен T006G, T006H, T006I, T006K, T006M, T006N, T006P, T006Q, T006R, T006V, T006W, T006Y, V007F, V007H, V007K, V007L, V007M, V007P, V007Q, V007R, V007T, V007Y, T049G, T049H, T049I, T049K, T049L, T049N, T049P, T049Q, T049W, A058I, A058P, A058R, F063I, F063L, F063P, S065K, S065Y, Y075G, Y075M, Y075T, Q128H, Q128I, Q128L, Q128M, Q128V, Q128Y, Y151D, Y151E, Y151H, Y151K, Y151M, Y151N, Y151Q, Y151R, Y151T, Y151V, Y151W, I156M, I156R, I156T, I156W, G196R, Q273I, Q273P, Q273Y, T278K, T278M, T278P, N280K, N280R, T006A, T006C, T049D, T049I, T049L, T049M, T049N, T049S, A056C, A056R, A056Y, A058S, S065C, S065E, S065I, S065T, S065V, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151D, Y151E, Y151H, Y151M, Y151N, Y151Q, Y151R, Y151S, Y151T, Y151V, Y151W, I156E, I156H, I156K, I156M, I156R, I156T, I156W, G196D, G196H, Q273A, Q273N, Q273T, Q273W, Q273Y, T278C, T278H, T278M, T278N, T278S, T278Y, N280E, N280I, N280L, N280M, N280S, T006C, T049D, T049N, T049Q, T049S, A056C, A056E, A058C, A058E, Q061E, Q061M, S065C, S065D, S065E, S065P, S065V, S065W, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151N, Y151S, Y151T и I156E, перечисленных в таблицах 7-1, 8-1 и 8-2, и обладающему повышенной стабильностью и/или эффективностью. В подварианте этих вариантов, одной или несколькими заменами являются одна, две, три, четыре или пять замен, выбранных из группы замен T006G, T006H, T006I, T006K, T006M, T006N, T006P, T006Q, T006R, T006V, T006W, T006Y, V007F, V007H, V007K, V007L, V007M, V007P, V007Q, V007R, V007T, V007Y, T049G, T049H, T049I, T049K, T049L, T049N, T049P, T049Q, T049W, A058I, AO58P, A058R, F063I, F063L, F063P, S065K, S065Y, Y075G, Y075M, Y075T, Q128H, Q128I, Q128L, Q128M, Q128V, Q128Y, Y151D, Y151E, Y151H, Y151K, Y151M, Y151N, Y151Q, Y151R, Y151T, Y151V, Y151W, I156M, I156R, I156T, I156W, G196R, Q273I, Q273P, Q273Y, T278K, T278M, T278P, N280K, N280R, T006A, T006C, T049D, T049I, T049L, T049M, T049N, T049S, A056C, A056R, A056Y, A058S, S065C, S065E, S065I, S065T, S065V, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151D, Y151E, Y151H, Y151M, Y151N, Y151Q, Y151R, Y151S, Y151T, Y151V, Y151W, I156E, I156H, I156K, I156M, I156R, I156T, I156W, G196D, G196H, Q273A, Q273N, Q273T, Q273W, Q273Y, T278C, T278H, T278M, T278N, T278S, T278Y, N280E, N280I, N280L, N280M, N280S, T006C, T049D, T049N, T049Q, T049S, A056C, A056E, A058C, A058E, Q061E, Q061M, S065C, S065D, S065E, S065P, S065V, S065W, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151N, Y151S, Y151T и I156E, перечисленных в таблицах 7-1, 8-1 и 8-2.
Кроме того, настоящее изобретение относится к выделенному варианту термолизина, обладающему повышенной стабильностью и/или эффективностью по сравнению с термолизином Geobacillus sp. дикого типа (например, термолизином, содержащим аминокислотную последовательность, представленную в SEQ ID NO:3). В некоторых своих вариантах, настоящее изобретение относится к выделенному варианту термолизина, обладающему улучшенными свойствами, включающими одно или несколько таких свойств, как повышенная термостабильность, повышенная эффективность при более низком или более высоком рН, и повышенная аутолитическая стабильность.
В некоторых своих вариантах, настоящее изобретение относится к клеткам-хозяевам Bacillus sp., трансформированным полинуклеотидом, кодирующим вариант термолизина, имеющий аминокислотную последовательность, которая на 50-99% (по меньшей мере на 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%) идентична аминокислотной последовательности SEQ ID NO:3.
Настоящее изобретение также относится к способам продуцирования фермента, обладающего активностью термолизина, где указанные способы включают: (i) трансформацию клетки-хозяина экспрессионным вектором, содержащим полинуклеотид, кодирующий вариант термолизина, имеющий аминокислотную последовательность, которая на 50-99% (по меньшей мере на 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%) идентична аминокислотной последовательности термолизина, содержащего аминокислотную последовательность, представленную в SEQ ID NO:3, и (ii) культивирование трансформированной клетки-хозяина в условиях, подходящих для продуцирования термолизина. Способ согласно изобретению также включает, но необязательно, сбор полученного термолизина. В некоторых своих вариантах, настоящее изобретение относится к способам продуцирования фермента, обладающего активностью термолизина, где указанный способ включает (i) трансформацию клетки-хозяина экспрессионным вектором, содержащим полинуклеотид, кодирующий вариант термолизина, имеющий аминокислотную последовательность, которая по меньшей мере на 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности термолизина, содержащего аминокислотную последовательность, представленную в SEQ ID NO:3, и (ii) культивирование трансформированной клетки-хозяина в условиях, подходящих для продуцирования термолизина. Указанные способы также включают, но необязательно, стадию сбора полученного термолизина. В некоторых других своих вариантах, настоящее изобретение относится к способу продуцирования фермента, обладающего активностью термолизина, где указанный способ включает (i) трансформацию клетки-хозяина Bacillus sp. (например, B. subtilis) экспрессионным вектором, содержащим полинуклеотид, кодирующий вариант термолизина, имеющий аминокислотную последовательность, которая на 50-99% (по меньшей мере на 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%) идентична аминокислотной последовательности термолизина, содержащего аминокислотную последовательность, представленную в SEQ ID NO:3, и (ii) культивирование трансформированной клетки-хозяина в условиях, подходящих для продуцирования термолизина. Указанные способы также включают, но необязательно, стадию сбора полученного термолизина.
В некоторых своих вариантах, настоящее изобретение относится к композициям, содержащим по меньшей мере один вариант термолизина, полученный из рекомбинантной клетки-хозяина Bacillus sp. согласно изобретению. В некоторых вариантах изобретения, указанная композиция, содержащая по меньшей мере один вариант термолизина, также содержит по меньшей мере один ион кальция и/или ион цинка. В некоторых альтернативных вариантах изобретения, указанная композиция, содержащая по меньшей мере один вариант термолизина, также содержит по меньшей мере один стабилизатор. В подварианте этих вариантов, указанный стабилизатор выбран из буры, глицерина, ионов цинка, ионов кальция и формиата кальция. В некоторых вариантах изобретения, указанным стабилизатором является по меньшей мере один конкурентный ингибитор, который стабилизирует термолизин в присутствии анионогенного поверхностно-активного вещества. Альтернативно, композиции, содержащие по меньшей мере один вариант термолизина, содержат по меньшей мере один ион кальция и/или ион цинка в комбинации по меньшей мере с одним стабилизатором. Любой из перечисленных выше стабилизаторов может быть объединен по меньшей мере с одним ионом кальция и/или ионом цинка с получением композиций, содержащих по меньшей мере один вариант термолизина. В подварианте этих вариантов, указанный стабилизатор выбран из буры, глицерина, ионов цинка, ионов кальция и формиата кальция. В некоторых других вариантах изобретения, указанным стабилизатором является по меньшей мере один конкурентный ингибитор, который стабилизирует термолизин в присутствии анионогенного поверхностно-активного вещества.
В других своих вариантах, настоящее изобретение относится к композиции, включающей по меньшей мере один вариант термолизина, полученный из рекомбинантной клетки-хозяина Bacillus sp. согласно изобретению, в комбинации по меньшей мере с одним дополнительным ферментом или производным фермента, выбранным из протеаз, амилаз, липаз, маннаназ, пектиназ, кутиназ, оксидоредуктаз, гемицеллюлаз и целлюлаз. В некоторых вариантах изобретения, композиция, содержащая по меньшей мере один вариант термолизина и по меньшей мере один дополнительный фермент или производное фермента, выбранные из протеаз, амилаз, липаз, маннаназ, пектиназ, кутиназ, оксидоредуктаз, гемицеллюлаз и целлюлаз, также содержит по меньшей мере один стабилизатор. В подварианте этих вариантов, указанный стабилизатор выбран из буры, глицерина, ионов цинка, ионов кальция и формиата кальция. В некоторых вариантах изобретения, стабилизатором является по меньшей мере один конкурентный ингибитор, который стабилизирует термолизин в присутствии анионогенного поверхностно-активного вещества. Альтернативно, композиции, включающие по меньшей мере один вариант термолизина, содержат по меньшей мере один ион кальция и/или ион цинка в комбинации по меньшей мере с одним стабилизатором. Любой из вышеупомянутых стабилизаторов может быть объединен по меньшей мере с одним ионом кальция и/или ионом цинка с получением композиций, содержащих по меньшей мере один вариант термолизина. В подварианте этих вариантов, стабилизатор выбран из буры, глицерина, ионов цинка, ионов кальция и формиата кальция. В некоторых других вариантах изобретения, указанным стабилизатором является по меньшей мере один конкурентный ингибитор, который стабилизирует термолизин в присутствии анионогенного поверхностно-активного вещества.
В некоторых своих вариантах, настоящее изобретение относится к очищающей композиции, содержащей по меньшей мере один вариант термолизина, полученный из рекомбинантной клетки-хозяина Bacillus sp. согласно изобретению. В некоторых вариантах изобретения, очищающая композиция, включающая по меньшей мере один вариант термолизина, дополнительно включает по меньшей мере один ион кальция и/или ион цинка. В некоторых альтернативных вариантах изобретения, очищающая композиция, включающая по меньшей мере один вариант термолизина, дополнительно включает по меньшей мере один стабилизатор. В подварианте этих вариантов изобретения, указанный стабилизатор выбирают из буры, глицерина, ионов цинка, ионов кальция и формиата кальция. В некоторых вариантах изобретения, указанным стабилизатором является по меньшей мере один конкурентный ингибитор, стабилизирующий указанный термолизин в присутствии анионогенного поверхностно-активного вещества. Альтернативно, очищающие композиции, включающие по меньшей мере один вариант термолизина, содержат по меньшей мере один ион кальция и/или ион цинка в комбинации по меньшей мере с одним стабилизатором. Любой один из стабилизаторов, упоминаемых выше, может быть объединен по меньшей мере с одним ионом кальция и/или ионом цинка с получением композиций, содержащих по меньшей мере один вариант термолизина. В некоторых вариантах изобретения, указанным стабилизатором является по меньшей мере конкурентный ингибитор, стабилизирующий термолизин в присутствии анионогенного поверхностно-активного вещества.
В других своих вариантах, настоящее изобретение относится к очищающей композиции, включающей по меньшей мере один вариант термолизина, полученный из рекомбинантной клетки-хозяина Bacillus sp. согласно изобретению, в комбинации по меньшей мере с одним дополнительным ферментом или производным фермента, выбранными из протеаз, амилаз, липаз, маннаназ, пектиназ, кутиназ, оксидоредуктаз, гемицеллюлаз и целлюлаз. В некоторых вариантах изобретения, очищающая композиция, содержащая по меньшей мере один вариант термолизина и по меньшей мере один дополнительный фермент или производное фермента, выбранное из протеаз, амилаз, липаз, маннаназ, пектиназ, кутиназ, оксидоредуктаз, гемицеллюлаз и целлюлаз, также содержит по меньшей мере один стабилизатор. В подварианте этих вариантов, указанный стабилизатор выбран из буры, глицерина, ионов цинка, ионов кальция и формиата кальция. В некоторых вариантах изобретения, указанным стабилизатором является по меньшей мере один конкурентный ингибитор, который стабилизирует термолизин в присутствии анионогенного поверхностно-активного вещества. Альтернативно, очищающие композиции, включающие по меньшей мере один вариант термолизина, содержат по меньшей мере один ион кальция и/или ион цинка в комбинации по меньшей мере с одним стабилизатором. Любой из вышеупомянутых стабилизаторов может быть объединен по меньшей мере с одним ионом кальция и/или ионом цинка с получением композиций, содержащих по меньшей мере один вариант термолизина. В подварианте этих вариантов, стабилизатор выбран из буры, глицерина, ионов цинка, ионов кальция и формиата кальция. В некоторых других вариантах изобретения, указанным стабилизатором является по меньшей мере один конкурентный ингибитор, стабилизирующий термолизин в присутствии анионогенного поверхностно-активного вещества.
В некоторых своих вариантах, настоящее изобретение относится к композициям, содержащим выделенный вариант термолизина, обладающий повышенной стабильностью и/или эффективностью. В некоторых вариантах изобретения, композиция, включающая выделенный вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, также содержит по меньшей мере один ион кальция и/или ион цинка. В некоторых альтернативных вариантах изобретения, композиция, содержащая выделенные варианты термолизина, обладающие повышенной стабильностью и/или эффективностью, также содержит по меньшей мере один стабилизатор. В подварианте этих вариантов изобретения, указанный стабилизатор выбирают из буры, глицерина, ионов цинка, ионов кальция и формиата кальция. В некоторых вариантах изобретения, указанным стабилизатором является по меньшей мере один конкурентный ингибитор, стабилизирующий указанный термолизин в присутствии анионогенного поверхностно-активного вещества. Альтернативно, композиции, включающие выделенный вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, содержат по меньшей мере один ион кальция и/или ион цинка в комбинации по меньшей мере с одним стабилизатором. Любой один из вышеупомянутых стабилизаторов может быть объединен по меньшей мере с одним ионом кальция и/или ионом цинка с получением композиций, содержащих по меньшей мере один вариант термолизина. В подварианте этих вариантов изобретения, указанный стабилизатор выбирают из буры, глицерина, ионов цинка, ионов кальция и формиата кальция. В некоторых других вариантах изобретения, указанным стабилизатором является по меньшей мере конкурентный ингибитор, стабилизирующий термолизин в присутствии анионогенного поверхностно-активного вещества. В некоторых вариантах изобретения, вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, представляет собой вариант термолизина Geobacillus, имеющий аминокислотную последовательность, содержащую одну или несколько замен в положениях, выбранных из положений, эквивалентных положениям 6, 7, 49, 56, 58, 61, 63, 65, 75, 128, 151, 156, 196, 273, 278 и 280 аминокислотной последовательности, представленной в SEQ ID NO:3. В подварианте этих вариантов, одной или несколькими заменами являются одна, две, три, четыре или пять замен в положениях, выбранных из положений, эквивалентных положениям 6, 7, 49, 56, 58, 61, 63, 65, 75, 128, 151, 156, 196, 273, 278 и 280 аминокислотной последовательности, представленной в SEQ ID NO:3. В других своих вариантах, настоящее изобретение относится к выделенному варианту термолизина Geobacillus, имеющему аминокислотную последовательность, содержащую одну или несколько замен в положениях, выбранных из положений, эквивалентных положениям 4, 6, 7, 36, 49, 53, 56, 58, 61, 63, 65, 75, 85, 108, 128, 129, 151, 156, 194, 195, 196, 261, 265, 273, 278, 280 и 297 аминокислотной последовательности, представленной в SEQ ID NO:3, и обладающему повышенной стабильностью и/или эффективностью. В подварианте этих вариантов, одной или несколькими заменами являются одна, две, три, четыре или пять замен в положениях, выбранных из положений, эквивалентных положениям 4, 6, 7, 36, 49, 53, 56, 58, 61, 63, 65, 75, 85, 108, 128, 129, 151, 156, 194, 195, 196, 261, 265, 273, 278, 280 и 297 аминокислотной последовательности, представленной в SEQ ID NO:3. В некоторых других вариантах изобретения, вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, содержит одну или несколько замен, выбранных из группы замен T006G, T006H, T006I, T006K, T006M, T006N, T006P, T006Q, T006R, T006V, T006W, T006Y, V007F, V007H, V007K, V007L, V007M, V007P, V007Q, V007R, V007T, V007Y, T049G, T049H, T049I, T049K, T049L, T049N, T049P, T049Q, T049W, A058I, A058P, A058R, F063I, F063L, F063P, S065K, S065Y, Y075G, Y075M, Y075T, Q128H, Q128I, Q128L, Q128M, Q128V, Q128Y, Y151D, Y151E, Y151H, Y151K, Y151M, Y151N, Y151Q, Y151R, Y151T, Y151V, Y151W, I156M, I156R, I156T, I156W, G196R, Q273I, Q273P, Q273Y, T278K, T278M, T278P, N280K, N280R, T006A, T006C, T049D, T049I, T049L, T049M, T049N, T049S, A056C, A056R, A056Y, A058S, S065C, S065E, S065I, S065T, S065V, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151D, Y151E, Y151H, Y151M, Y151N, Y151Q, Y151R, Y151S, Y151T, Y151V, Y151W, I156E, I156H, I156K, I156M, I156R, I156T, I156W, G196D, G196H, Q273A, Q273N, Q273T, Q273W, Q273Y, T278C, T278H, T278M, T278N, T278S, T278Y, N280E, N280I, N280L, N280M, N280S, T006C, T049D, T049N, T049Q, T049S, A056C, A056E, A058C, A058E, Q061E, Q061M, S065C, S065D, S065E, S065P, S065V, S065W, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151N, Y151S, Y151T и I156E, перечисленных в таблицах 7-1, 8-1 и 8-2. В подварианте этих вариантов, одной или несколькими заменами являются одна, две, три, четыре или пять замен, выбранных из группы замен T006G, T006H, T006I, T006K, T006M, T006N, T006P, T006Q, T006R, T006V, T006W, T006Y, V007F, V007H, V007K, V007L, V007M, V007P, V007Q, V007R, V007T, V007Y, T049G, T049H, T049I, T049K, T049L, T049N, T049P, T049Q, T049W, A058I, A058P, A058R, F063I, F063L, F063P, S065K, S065Y, Y075G, Y075M, Y075T, Q128H, Q128I, Q128L, Q128M, Q128V, Q128Y, Y151D, Y151E, Y151H, Y151K, Y151M, Y151N, Y151Q, Y151R, Y151T, Y151V, Y151W, I156M, I156R, I156T, I156W, G196R, Q273I, Q273P, Q273Y, T278K, T278M, T278P, N280K, N280R, T006A, T006C, T049D, T049I, T049L, T049M, T049N, T049S, A056C, A056R, A056Y, A058S, S065C, S065E, S065I, S065T, S065V, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151D, Y151E, Y151H, Y151M, Y151N, Y151Q, Y151R, Y151S, Y151T, Y151V, Y151W, I156E, I156H, I156K, I156M, I156R, I156T, I156W, G196D, G196H, Q273A, Q273N, Q273T, Q273W, Q273Y, T278C, T278H, T278M, T278N, T278S, T278Y, N280E, N280I, N280L, N280M, N280S, T006C, T049D, T049N, T049Q, T049S, A056C, A056E, A058C, A058E, Q061E, Q061M, S065C, S065D, S065E, S065P, S065V, S065W, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151N, Y151S, Y151T и I156E, перечисленных в таблицах 7-1, 8-1 и 8-2.
В других своих вариантах, настоящее изобретение относится к композиции, включающей выделенный вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, в комбинации по меньшей мере с одним дополнительным ферментом или производным фермента, выбранным из протеаз, амилаз, липаз, маннаназ, пектиназ, кутиназ, оксидоредуктаз, гемицеллюлаз и целлюлаз. В некоторых вариантах изобретения, композиция, содержащая выделенный вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, и по меньшей мере один дополнительный фермент или производное фермента, выбранные из протеаз, амилаз, липаз, маннаназ, пектиназ, кутиназ, оксидоредуктаз, гемицеллюлаз и целлюлаз, также содержит по меньшей мере один стабилизатор. В подварианте этих вариантов, указанный стабилизатор выбран из буры, глицерина, ионов цинка, ионов кальция и формиата кальция. В некоторых вариантах изобретения, стабилизатором является по меньшей мере один конкурентный ингибитор, который стабилизирует термолизин в присутствии анионогенного поверхностно-активного вещества. Альтернативно, композиции, включающие выделенные варианты термолизина, обладающие повышенной стабильностью и/или эффективностью, содержат по меньшей мере один ион кальция и/или ион цинка в комбинации по меньшей мере с одним стабилизатором. Любой из вышеупомянутых стабилизаторов может быть объединен по меньшей мере с одним ионом кальция и/или ионом цинка с получением композиций, содержащих по меньшей мере один вариант термолизина. В подварианте этих вариантов, указанный стабилизатор выбран из буры, глицерина, ионов цинка, ионов кальция и формиата кальция. В некоторых других вариантах изобретения, указанным стабилизатором является по меньшей мере один конкурентный ингибитор, который стабилизирует термолизин в присутствии анионогенного поверхностно-активного вещества. В некоторых вариантах изобретения, вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, представляет собой вариант термолизина Geobacillus, имеющий аминокислотную последовательность, содержащую одну или несколько замен в положениях, выбранных из положений, эквивалентных положениям 6, 7, 49, 56, 58, 61, 63, 65, 75, 128, 151, 156, 196, 273, 278 и 280 аминокислотной последовательности, представленной в SEQ ID NO:3. В подварианте этих вариантов, одной или несколькими заменами являются одна, две, три, четыре или пять замен в положениях, выбранных из положений, эквивалентных положениям 6, 7, 49, 56, 58, 61, 63, 65, 75, 128, 151, 156, 196, 273, 278 и 280 аминокислотной последовательности, представленной в SEQ ID NO:3. В других своих вариантах, настоящее изобретение относится к выделенному варианту термолизина Geobacillus, имеющему аминокислотную последовательность, содержащую одну или несколько замен в положениях, выбранных из положений, эквивалентных положениям 4, 6, 7, 36, 49, 53, 56, 58, 61, 63, 65, 75, 85, 108, 128, 129, 151, 156, 194, 195, 196, 261, 265, 273, 278, 280 и 297 аминокислотной последовательности, представленной в SEQ ID NO:3, и обладающему повышенной стабильностью и/или эффективностью. В подварианте этих вариантов, одной или несколькими заменами являются одна, две, три, четыре или пять замен в положениях, выбранных из положений, эквивалентных положениям 4, 6, 7, 36, 49, 53, 56, 58, 61, 63, 65, 75, 85, 108, 128, 129, 151, 156, 194, 195, 196, 261, 265, 273, 278, 280 и 297 аминокислотной последовательности, представленной в SEQ ID NO:3. В некоторых других вариантах изобретения, вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, содержит одну или несколько замен, выбранных из группы замен T006G, T006H, T006I, T006K, T006M, T006N, T006P, T006Q, T006R, T006V, T006W, T006Y, V007F, V007H, V007K, V007L, V007M, V007P, V007Q, V007R, V007T, V007Y, T049G, T049H, T049I, T049K, T049L, T049N, T049P, T049Q, T049W, A058I, A058P, A058R, F063I, F063L, F063P, S065K, S065Y, Y075G, Y075M, Y075T, Q128H, Q128I, Q128L, Q128M, Q128V, Q128Y, Y151D, Y151E, Y151H, Y151K, Y151M, Y151N, Y151Q, Y151R, Y151T, Y151V, Y151W, I156M, I156R, I156T, I156W, G196R, Q273I, Q273P, Q273Y, T278K, T278M, T278P, N280K, N280R, T006A, T006C, T049D, T049I, T049L, T049M, T049N, T049S, A056C, A056R, A056Y, A058S, S065C, S065E, S065I, S065T, S065V, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151D, Y151E, Y151H, Y151M, Y151N, Y151Q, Y151R, Y151S, Y151T, Y151V, Y151W, I156E, I156H, I156K, I156M, I156R, I156T, I156W, G196D, G196H, Q273A, Q273N, Q273T, Q273W, Q273Y, T278C, T278H, T278M, T278N, T278S, T278Y, N280E, N280I, N280L, N280M, N280S, T006C, T049D, T049N, T049Q, T049S, A056C, A056E, A058C, A058E, Q061E, Q061M, S065C, S065D, S065E, S065P, S065V, S065W, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151N, Y151S, Y151T и I156E, перечисленных в таблицах 7-1, 8-1 и 8-2. В подварианте этих вариантов, одной или несколькими заменами являются одна, две, три, четыре или пять замен, выбранных из группы замен T006G, T006H, T006I, T006K, T006M, T006N, T006P, T006Q, T006R, T006V, T006W, T006Y, V007F, V007H, V007K, V007L, V007M, V007P, V007Q, V007R, V007T, V007Y, T049G, T049H, T049I, T049K, T049L, T049N, T049P, T049Q, T049W, A058I, A058P, A058R, F063I, F063L, F063P, S065K, S065Y, Y075G, Y075M, Y075T, Q128H, Q128I, Q128L, Q128M, Q128V, Q128Y, Y151D, Y151E, Y151H, Y151K, Y151M, Y151N, Y151Q, Y151R, Y151T, Y151V, Y151W, I156M, I156R, I156T, I156W, G196R, Q273I, Q273P, Q273Y, T278K, T278M, T278P, N280K, N280R, T006A, T006C, T049D, T049I, T049L, T049M, T049N, T049S, A056C, A056R, A056Y, A058S, S065C, S065E, S065I, S065T, S065V, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151D, Y151E, Y151H, Y151M, Y151N, Y151Q, Y151R, Y151 S, Y151T, Y151V, Y151W, I156E, I156H, I156K, I156M, I156R, I156T, I156W, G196D, G196H, Q273A, Q273N, Q273T, Q273W, Q273Y, T278C, T278H, T278M, T278N, T278S, T278Y, N280E, N280I, N280L, N280M, N280S, T006C, T049D, T049N, T049Q, T049S, A056C, A056E, A058C, A058E, Q061E, Q061M, S065C, S065D, S065E, S065P, S065V, S065W, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151N, Y151S, Y151T и I156E, перечисленных в таблицах 7-1, 8-1 и 8-2.
В некоторых своих вариантах, настоящее изобретение относится к очищающим композициям, содержащим выделенный вариант термолизина, обладающий повышенной стабильностью и/или эффективностью. В некоторых вариантах изобретения, очищающая композиция, включающая выделенный вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, также содержит по меньшей мере один ион кальция и/или ион цинка. В некоторых альтернативных вариантах изобретения, очищающая композиция, содержащая выделенный вариант термолизина, обладающие повышенной стабильностью и/или эффективностью, также содержит по меньшей мере один стабилизатор. В подварианте этих вариантов изобретения, указанный стабилизатор выбирают из буры, глицерина, ионов цинка, ионов кальция и формиата кальция. В некоторых вариантах изобретения, указанным стабилизатором является по меньшей мере один конкурентный ингибитор, стабилизирующий указанный термолизин в присутствии анионогенного поверхностно-активного вещества. Альтернативно, очищающая композиция, включающая выделенный вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, содержит по меньшей мере один ион кальция и/или ион цинка в комбинации по меньшей мере с одним стабилизатором. Любой один из вышеупомянутых стабилизаторов может быть объединен по меньшей мере с одним ионом кальция и/или ионом цинка с получением композиций, содержащих по меньшей мере один вариант термолизина. В подварианте этих вариантов изобретения, указанный стабилизатор выбирают из буры, глицерина, ионов цинка, ионов кальция и формиата кальция. В некоторых других вариантах изобретения, указанным стабилизатором является по меньшей мере один конкурентный ингибитор, стабилизирующий термолизин в присутствии анионогенного поверхностно-активного вещества. В некоторых вариантах изобретения, вариант термолизина, содержащийся в очищающих композициях и обладающий повышенной стабильностью и/или эффективностью, представляет собой вариант термолизина Geobacillus, имеющий аминокислотную последовательность, содержащую одну или несколько замен в положениях, выбранных из положений, эквивалентных положениям 6, 7, 49, 56, 58, 61, 63, 65, 75, 128, 151, 156, 196, 273, 278 и 280 аминокислотной последовательности, представленной в SEQ ID NO:3. В подварианте этих вариантов, одной или несколькими заменами являются одна, две, три, четыре или пять замен в положениях, выбранных из положений, эквивалентных положениям 6, 7, 49, 56, 58, 61, 63, 65, 75, 128, 151, 156, 196, 273, 278 и 280 аминокислотной последовательности, представленной в SEQ ID NO:3. В других вариантах изобретения, вариант термолизина, содержащийся в очищающих композициях и обладающий повышенной стабильностью и/или эффективностью, представляет собой вариант термолизина Geobacillus, имеющий аминокислотную последовательность, содержащую одну или несколько замен в положениях, выбранных из положений, эквивалентных положениям 4, 6, 7, 36, 49, 53, 56, 58, 61, 63, 65, 75, 85, 108, 128, 129, 151, 156, 194, 195, 196, 261, 265, 273, 278, 280 и 297 аминокислотной последовательности, представленной в SEQ ID NO:3, и обладающий повышенной стабильностью и/или эффективностью. В подварианте этих вариантов, одной или несколькими заменами являются одна, две, три, четыре или пять замен в положениях, выбранных из положений, эквивалентных положениям 4, 6, 7, 36, 49, 53, 56, 58, 61, 63, 65, 75, 85, 108, 128, 129, 151, 156, 194, 195, 196, 261, 265, 273, 278, 280 и 297 аминокислотной последовательности, представленной в SEQ ID NO:3. В некоторых других вариантах изобретения, вариант термолизина, содержащийся в очищающих композициях и обладающий повышенной стабильностью и/или эффективностью, представляет собой вариант термолизина Geobacillus, имеющий аминокислотную последовательность, содержащую одну или несколько замен, выбранных из группы замен T006G, T006H, T006I, T006K, T006M, T006N, T006P, T006Q, T006R, T006V, T006W, T006Y, V007F, V007H, V007K, V007L, V007M, V007P, V007Q, V007R, V007T, V007Y, T049G, T049H, T049I, T049K, T049L, T049N, T049P, T049Q, T049W, A058I, A058P, A058R, F063I, F063L, F063P, S065K, S065Y, Y075G, Y075M, Y075T, Q128H, Q128I, Q128L, Q128M, Q128V, Q128Y, Y151D, Y151E, Y151H, Y151K, Y151M, Y151N, Y151Q, Y151R, Y151T, Y151V, Y151 W, I156M, I156R, I156T, I156W, G196R, Q273I, Q273P, Q273Y, T278K, T278M, T278P, N280K, N280R, T006A, T006C, T049D, T049I, T049L, T049M, T049N, T049S, A056C, A056R, A056Y, A058S, S065C, S065E, S065I, S065T, S065V, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151D, Y151E, Y151H, Y151M, Y151N, Y151Q, Y151R, Y151S, Y151T, Y151V, Y151W, I156E, I156H, I156K, I156M, I156R, I156T, I156W, G196D, G196H, Q273A, Q273N, Q273T, Q273W, Q273Y, T278C, T278H, T278M, T278N, T278S, T278Y, N280E, N280I, N280L, N280M, N280S, T006C, T049D, T049N, T049Q, T049S, A056C, A056E, A058C, A058E, Q061E, Q061M, S065C, S065D, S065E, S065P, S065V, S065W, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151N, Y151S, Y151T и I156E, перечисленных в таблицах 7-1, 8-1 и 8-2. В подварианте этих вариантов, одной или несколькими заменами являются одна, две, три, четыре или пять замен, выбранных из группы замен T006G, T006H, T006I, T006K, T006M, T006N, T006P, T006Q, T006R, T006V, T006W, T006Y, V007F, V007H, V007K, V007L, V007M, V007P, V007Q, V007R, V007T, V007Y, T049G, T049H, T049I, T049K, T049L, T049N, T049P, T049Q, T049W, A058I, A058P, A058R, F063I, F063L, F063P, S065K, S065Y, Y075G, Y075M, Y075T, Q128H, Q128I, Q128L, Q128M, Q128V, Q128Y, Y151D, Y151E, Y151H, Y151K, Y151M, Y151N, Y151Q, Y151R, Y151T, Y151V, Y151W, I156M, I156R, I156T, I156W, G196R, Q273I, Q273P, Q273Y, T278K, T278M, T278P, N280K, N280R, T006A, T006C, T049D, T049I, T049L, T049M, T049N, T049S, A056C, A056R, A056Y, A058S, S065C, S065E, S065I, S065T, S065V, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151D, Y151E, Y151H, Y151M, Y151N, Y151Q, Y151R, Y151 S, Y151T, Y151V, Y151W, I156E, I156H, I156K, I156M, I156R, I156T, I156W, G196D, G196H, Q273A, Q273N, Q273T, Q273W, Q273Y, T278C, T278H, T278M, T278N, T278S, T278Y, N280E, N280I, N280L, N280M, N280S, T006C, T049D, T049N, T049Q, T049S, A056C, A056E, A058C, A058E, Q061E, Q061M, S065C, S065D, S065E, S065P, S065V, S065W, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151N, Y151S, Y151T и I156E, перечисленных в таблицах 7-1, 8-1 и 8-2.
В других своих вариантах, настоящее изобретение относится к очищающей композиции, включающей выделенный вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, в комбинации по меньшей мере с одним дополнительным ферментом или производным фермента, выбранным из протеаз, амилаз, липаз, маннаназ, пектиназ, кутиназ, оксидоредуктаз, гемицеллюлаз и целлюлаз. В некоторых вариантах изобретения, очищающая композиция, содержащая выделенный вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, и по меньшей мере один дополнительный фермент или производное фермента, выбранные из протеаз, амилаз, липаз, маннаназ, пектиназ, кутиназ, оксидоредуктаз, гемицеллюлаз и целлюлаз, также содержит по меньшей мере один стабилизатор. В подварианте этих вариантов, указанный стабилизатор выбран из буры, глицерина, ионов цинка, ионов кальция и формиата кальция. В некоторых вариантах изобретения, стабилизатором является по меньшей мере один конкурентный ингибитор, который стабилизирует термолизин в присутствии анионогенного поверхностно-активного вещества. Альтернативно, очищающие композиции, включающие выделенный вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, содержат по меньшей мере один ион кальция и/или ион цинка в комбинации по меньшей мере с одним стабилизатором. Любой из вышеупомянутых стабилизаторов может быть объединен по меньшей мере с одним ионом кальция и/или ионом цинка с получением композиций, содержащих по меньшей мере один вариант термолизина. В подварианте этих вариантов, указанный стабилизатор выбран из буры, глицерина, ионов цинка, ионов кальция и формиата кальция. В некоторых других вариантах изобретения, указанным стабилизатором является по меньшей мере один конкурентный ингибитор, который стабилизирует термолизин в присутствии анионогенного поверхностно-активного вещества. В некоторых вариантах изобретения, вариант термолизина, содержащийся в очищающих композициях и обладающий повышенной стабильностью и/или эффективностью, представляет собой вариант термолизина Geobacillus, имеющий аминокислотную последовательность, включающую одну или несколько замен в положениях, выбранных из положений, эквивалентных положениям 6, 7, 49, 56, 58, 61, 63, 65, 75, 128, 151, 156, 196, 273, 278 и 280 аминокислотной последовательности, представленной в SEQ ID NO:3. В подварианте этих вариантов, одной или несколькими заменами являются одна, две, три, четыре или пять замен в положениях, выбранных из положений, эквивалентных положениям 6, 7, 49, 56, 58, 61, 63, 65, 75, 128, 151, 156, 196, 273, 278 и 280 аминокислотной последовательности, представленной в SEQ ID NO:3. В других вариантах изобретения, вариант термолизина, содержащийся в очищающих композициях и обладающий повышенной стабильностью и/или эффективностью, представляет собой вариант термолизина Geobacillus, имеющий аминокислотную последовательность, содержащую одну или несколько замен в положениях, выбранных из положений, эквивалентных положениям 4, 6, 7, 36, 49, 53, 56, 58, 61, 63, 65, 75, 85, 108, 128, 129, 151, 156, 194, 195, 196, 261, 265, 273, 278, 280 и 297 аминокислотной последовательности, представленной в SEQ ID NO:3, и обладающий повышенной стабильностью и/или эффективностью. В подварианте этих вариантов, одной или несколькими заменами являются одна, две, три, четыре или пять замен в положениях, выбранных из положений, эквивалентных положениям 4, 6, 7, 36, 49, 53, 56, 58, 61, 63, 65, 75, 85, 108, 128, 129, 151, 156, 194, 195, 196, 261, 265, 273, 278, 280 и 297 аминокислотной последовательности, представленной в SEQ ID NO:3. В некоторых других вариантах изобретения, вариант термолизина, содержащийся в очищающих композициях и обладающий повышенной стабильностью и/или эффективностью, представляет собой вариант термолизина Geobacillus, имеющий аминокислотную последовательность, содержащую одну или несколько замен, выбранных из группы замен T006G, T006H, T006I, T006K, T006M, T006N, T006P, T006Q, T006R, T006V, T006W, T006Y, V007F, V007H, V007K, V007L, V007M, V007P, V007Q, V007R, V007T, V007Y, T049G, T049H, T049I, T049K, T049L, T049N, T049P, T049Q, T049W, A058I, A058P, A058R, F063I, F063L, F063P, S065K, S065Y, Y075G, Y075M, Y075T, Q128H, Q128I, Q128L, Q128M, Q128V, Q128Y, Y151D, Y151E, Y151H, Y151K, Y151M, Y151N, Y151Q, Y151R, Y151T, Y151V, Y151W, I156M, I156R, I156T, I156W, G196R, Q273I, Q273P, Q273Y, T278K, T278M, T278P, N280K, N280R, T006A, T006C, T049D, T049I, T049L, T049M, T049N, T049S, A056C, A056R, A056Y, A058S, S065C, S065E, S065I, S065T, S065V, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151D, Y151E, Y151H, Y151M, Y151N, Y151Q, Y151R, Y151S, Y151T, Y151V, Y151W, I156E, I156H, I156K, I156M, I156R, I156T, I156W, G196D, G196H, Q273A, Q273N, Q273T, Q273W, Q273Y, T278C, T278H, T278M, T278N, T278S, T278Y, N280E, N280I, N280L, N280M, N280S, T006C, T049D, T049N, T049Q, T049S, A056C, A056E, A058C, A058E, Q061E, Q061M, S065C, S065D, S065E, S065P, S065V, S065W, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151N, Y151S, Y151T и I156E, перечисленных в таблицах 7-1, 8-1 и 8-2. В подварианте этих вариантов, одной или несколькими заменами являются одна, две, три, четыре или пять замен, выбранных из группы замен T006G, T006H, T006I, T006K, T006M, T006N, T006P, T006Q, T006R, T006V, T006W, T006Y, V007F, V007H, V007K, V007L, V007M, V007P, V007Q, V007R, V007T, V007Y, T049G, T049H, T049I, T049K, T049L, T049N, T049P, T049Q, T049W, A058I, A058P, A058R, F063I, F063L, F063P, S065K, S065Y, Y075G, Y075M, Y075T, Q128H, Q128I, Q128L, Q128M, Q128V, Q128Y, Y151D, Y151E, Y151H, Y151K, Y151M, Y151N, Y151Q, Y151R, Y151T, Y151V, Y151W, I156M, I156R, I156T, I156W, G196R, Q273I, Q273P, Q273Y, T278K, T278M, T278P, N280K, N280R, T006A, T006C, T049D, T049I, T049L, T049M, T049N, T049S, A056C, A056R, A056Y, A058S, S065C, S065E, S065I, S065T, S065V, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151D, Y151E, Y151H, Y151M, Y151N, Y151Q, Y151R, Y151 S, Y151T, Y151V, Y151W, I156E, I156H, I156K, I156M, I156R, I156T, I156W, G196D, G196H, Q273A, Q273N, Q273T, Q273W, Q273Y, T278C, T278H, T278M, T278N, T278S, T278Y, N280E, N280I, N280L, N280M, N280S, T006C, T049D, T049N, T049Q, T049S, A056C, A056E, A058C, A058E, Q061E, Q061M, S065C, S065D, S065E, S065P, S065V, S065W, S065Y, Q128C, Q128I, Q128M, Q128T, Q128V, Q128Y, Y151A, Y151C, Y151N, Y151S, Y151T и I156E, перечисленных в таблицах 7-1, 8-1 и 8-2.
В некоторых вариантах изобретения, любой одной из очищающих композиций, содержащих вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, указанными в настоящей заявке, является детергент. В некоторых вариантах изобретения, указанными композициями являются моющие композиции. В других вариантах изобретения, такими композициями являются жидкие композиции.
В некоторых своих вариантах, настоящее изобретение относится к композиции, содержащей вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, например, к очищающей композиции, содержащей по меньшей мере примерно 0,0001 масс.% варианта термолизина или примерно от 0,001 до 0,5 масс.% того же самого варианта термолизина. Композиция согласно изобретению, например, очищающая композиция, содержащая вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, также содержит, но необязательно, по меньшей мере один дополнительный ингредиент. Альтернативно, в некоторых других вариантах изобретения, указанная композиция, например, очищающая композиция, также содержит pH-модификатор в количестве, достаточном для получения композиции со значением pH примерно от 3 до 5, причем, указанная композиция, по существу, не содержит материалов, которые гидролизуются при pH примерно от 3 до 5. В некоторых вариантах изобретения, материалы, которые гидролизуются при pH примерно от 3 до 5, содержат по меньшей мере одно поверхностно-активное вещество. В некоторых предпочтительных вариантах изобретения, указанным поверхностно-активным веществом является алкилсульфат натрия, содержащий этиленоксидную группу. В некоторых вариантах изобретения, композицией, например, очищающей композицией, содержащей вариант термолизина, обладающий повышенной стабильностью и/или эффективностью, является детергент.
Кроме того, настоящее изобретение относится к составам корма для животных, содержащим выделенный вариант термолизина, обладающий повышенной стабильностью и/или эффективностью. В других своих вариантах, настоящее изобретение относится к композициям для обработки текстильных изделий, содержащим выделенный вариант термолизина, обладающий повышенной стабильностью и/или эффективностью. В других своих вариантах, настоящее изобретение относится к композициям для обработки кожи, содержащим выделенный вариант термолизина, обладающий повышенной стабильностью и/или эффективностью.
Кроме того, настоящее изобретение относится к способам очистки, включающим стадию контактирования какой-либо поверхности и/или изделия, содержащего ткань, с очищающей композицией, включающей выделенный вариант термолизина, обладающий повышенной стабильностью и/или эффективностью. В некоторых вариантах изобретения, указанные способы очистки также включают стадию промывки какой-либо поверхности и/или материала после контактирования указанной поверхности или материала с очищающей композицией.
Краткое описание фигур
На фигуре 1 представлена аминокислотная последовательность (SEQ ID NO:3) зрелой формы фермента термолизин-подобной нейтральной металлопротеазы (также называемого здесь термолизином, протеиназой-Т или PrT).
На фигуре 2 представлена карта плазмиды pHPLT.
На фигуре 3 представлена карта экспрессионного вектора pHPLT-термолизин.
На фигуре 4A-B представлена нуклеотидная последовательность (SEQ ID NO: 8) экспрессионного вектора pHPLT-термолизин.
На фигуре 5 представлен график сравнения протеазных активностей термолизина и NprE после инкубирования при комнатной температуре в детергенте Unilever ALL Small & Mighty 3X.
На фигуре 5 представлен график сравнения протеазных активностей термолизина и NprE после инкубирования при комнатной температуре в детергенте Proctor & Gamble TIDE® Fresh Breeze IX.
На фигуре 5 представлен график сравнения протеазных активностей термолизина и NprE после инкубирования при комнатной температуре в детергенте Proctor & Gamble TIDE® Fresh Breeze 2X.
На фигуре 8 проиллюстрирован ДСН-ПААГ-анализ стабильности термолизина после продолжительного инкубирования в детергенте Unilever ALL Small & Mighty в присутствии и в отсутствии известных ингибиторов металлопротеиназы.
На фигуре 9 проиллюстрировано выравнивание аминокислотных последовательностей термолизина (T) и NprE. Последовательность термолизина представлена как SEQ ID NO:3, а последовательность NprE представлена как SEQ ID NO:9.
Общее описание изобретения
Настоящее изобретение относится к способам, в которых используются композиции, содержащие по меньшей мере один термолизин-подобный нейтральный фермент протеазу, обладающий повышенной стабильностью при хранении и/или повышенной каталитической активностью, а также к указанным композициям. В некоторых вариантах изобретения, термолизин применяется для очистки и в других целях, требующих использования детергентов. В некоторых своих особенно предпочтительных вариантах, настоящее изобретение относится к способам, в которых используются термолизин-содержащие композиции, полученные или сконструированные в целях предотвращения индуцированной детергентом инактивации, а также к указанным композициям.
Если это не оговорено особо, то настоящее изобретение осуществляют стандартными методами, известными специалистам и обычно применяемыми в молекулярной биологии, микробиологии и в технике рекомбинантных ДНК. Эти методы известны специалистам и описаны во многих руководствах и в научной литературе (см., например, Sambrook et al., «Molecular Cloning: A Laboratory Manual», Second Edition, Cold Spring Harbor, 1989; и Ausubel et al., «Current Protocols in Molecular Biology» 1987). Все выше- и нижеупомянутые здесь патенты, патентные заявки, статьи и публикации во всей своей полноте вводятся в настоящее описание посредством ссылки.
Если это не оговорено особо, то все технические и научные термины, используемые в настоящей заявке, имеют значения, в основном, понятные среднему специалисту в области, к которой относится изобретение. Так, например, в публикациях Singleton & Sainsbury, Dictionary of Microbiology and Molecular Biology, 2d Ed., John Wiley and Sons, NY (1994); и Hale and Marham, The Harper Collins Dictionary of Biology, Harper Perennial, NY (1991) приводится разъяснение специальных терминов, а также приводятся общие словари многих терминов, используемых в настоящем изобретении. Хотя для осуществления настоящего изобретения могут быть использованы любые методы и материалы, аналогичные или эквивалентные описанным здесь методам и материалам, однако предпочтительными являются методы и материалы, описанные в настоящей заявке. В соответствии с этим, термины, определенные непосредственно ниже, более подробно определены путем ссылки на описание изобретения во всей его полноте.
Кроме того, подразумевается, что существительные, используемые в контексте настоящего изобретения, могут присутствовать как в единственном числе, так и во множественном числе, если это явно не противоречит контексту изобретения. Различные интервалы значений включают значения, определяющие этот интервал. Если это не оговорено особо, нуклеиновые кислоты записываются слева направо в ориентации 5'→3', а аминокислотные последовательности записываются слева направо в направлении от амино- до карбокси-конца, соответственно. При этом, следует отметить, что настоящее изобретение не ограничивается конкретно описанными методами, протоколами и реагентами, и эти методы, протоколы и реагенты могут варьироваться в зависимости от цели их использования специалистами.
Кроме того, представленные здесь разделы не ограничиваются различными аспектами или вариантами настоящего изобретения, которые во всей своей совокупности введены в настоящее описание посредством ссылки. В соответствии с этим, термины, определенные непосредственно ниже, более подробно определены путем ссылки на описание изобретения во всей его полноте. Тем не менее, для лучшего понимания настоящего изобретения, определение ряда терминов приводится ниже.
Определения
Если это не оговорено особо, то все технические и научные термины, используемые в настоящей заявке, имеют значения, в основном, понятные среднему специалисту в области, к которой относится изобретение. Хотя для осуществления настоящего изобретения могут быть применены любые методы и материалы, аналогичные или эквивалентные описанным здесь методам и материалам, однако предпочтительными являются методы и материалы, описанные в настоящей заявке. В соответствии с этим, термины, определенные непосредственно ниже, более подробно определены путем ссылки на описание изобретения во всей его полноте. Кроме того, подразумевается, что существительные, используемые в контексте настоящего изобретения, могут присутствовать как в единственном числе, так и во множественном числе, если это явно не противоречит контексту изобретения. Если это не оговорено особо, нуклеиновые кислоты записываются слева направо в направлении 5'→3', а аминокислотные последовательности записываются слева направо в ориентации от амино- до карбокси-конца, соответственно. При этом, следует отметить, что настоящее изобретение не ограничивается конкретно описанными методами, протоколами и реагентами, и эти методы, протоколы и реагенты могут варьироваться в зависимости от цели их использования.
При этом, предусматривается, что каждый максимальный численный предел, указанный в настоящем описании, может включать каждый меньший численный предел так, как если бы такой меньший численный предел был точно определен в настоящей заявке. Каждый минимальный численный предел, указанный в настоящем описании, может включать больший численный предел так, как если бы такой больший численный предел был точно определен в настоящем описании. Каждый численный интервал, указанный в описании настоящей заявки, включает каждый более узкий численный интервал, который входит в такой более широкий численный интервал так, как если бы все указанные более узкие численные интервалы были точно определены в описании изобретения.
Все документы, цитируемые в соответствующей части описания настоящей заявки, включены в настоящее изобретение посредством ссылки, однако цитирование какого-либо документа не должно обязательно означать, что этот документ относится к прототипу настоящего изобретения.
Используемые здесь термины «протеаза» и «протеолитическая активность» относятся к белку или пептиду, обладающему способностью гидролизовать пептиды или субстраты, имеющие пептидные связи. Для определения протеолитической активности существует множество хорошо известных методов (Kalisz, "Microbial Proteinases," In: Fiechter (ed.), Advances in Biochemical Engineering/Biotechnology, 1988). Так, например, протеолитическая активность может быть определена путем проведения сравнительных анализов, которые позволяют проанализировать соответствующую способность протеазы гидролизовать коммерчески доступный субстрат. Репрезентативными субстратами, которые могут быть использованы в таком анализе на протеазную или протеолитическую активность, являются, но не ограничиваются ими, диметилказеин (Sigma C-9801), бычий коллаген (Sigma C-9879), бычий эластин (Sigma E-1625) и бычий кератин (ICN Biomedical 902111). Колориметрические анализы, в которых используются такие субстраты, хорошо известны специалистам (см., например, заявку WO 99/34011; и патент США № 6376450, которые вводятся в настоящее изобретение посредством ссылки). Анализ pNA {см., например, Del Mar et al., Anal Biochem, 99:316-320, 1979) также применяется для определения концентрации активного фермента во фракциях, собранных в процессе градиентного элюирования. В этом анализе измеряют скорость, при которой высвобождается п-нитроанилин, поскольку указанный фермент гидролизует растворимый синтетический субстрат, то есть, сукцинил-аланин-аланин-пролин-фенилаланин-п-нитроанилид (sAAPF-рNA). Скорость продуцирования желтой окраски после реакции гидролиза измеряют на спектрофотометре на длине волны 410 нм и такая скорость пропорциональная концентрации активного фермента. Кроме того, для определения общей концентрации белка, измерение оптической плотности может быть осуществлено на 280 нм. Отношение активного фермента/общего белка определяет чистоту фермента.
Используемые здесь термины «протеаза NprE» и «NprE» означают нейтральные металлопротеазы, описанные в настоящей заявке. В некоторых предпочтительных вариантах изобретения, протеаза NprE представляет собой протеазу, называемую здесь очищенной нейтральной протеазой MULTIFECT® или PMN, выделенной из Bacillus amyloliquefaciens. Таким образом, в некоторых вариантах изобретения, термин «протеаза PMN» означает природную зрелую протеазу, происходящую от Bacillus amyloliquefaciens. В своих альтернативных вариантах, настоящее изобретение относится к частям протеазы NprE.
Термин «гомологи протеазы Bacillus» означает природные протеазы, которые имеют аминокислотные последовательности, по существу, идентичные аминокислотным последовательностям зрелой протеазы, происходящей от термолизина Bacillus thermoproteolyticus, или полинуклеотидные последовательности, кодирующие такие природные протеазы, и которые сохраняют функциональные свойства нейтральной металлопротеазы, кодируемой такими нуклеиновыми кислотами.
Используемый здесь термин «вариант термолизина» означает протеазы, которые являются аналогичными термолизину дикого типа, а в частности, с точки зрения их функций, но, при этом, имеют мутации в аминокислотной последовательности, которые отличают эти протеазы от протеаз дикого типа.
Используемый здесь термин «Bacillus ssp.» относится ко всем видам, принадлежащим к роду «Bacillus», которые представляют собой грамположительные бактерии, классифицированные как члены семейства Bacillaceae, порядка Bacillales, класса Bacilli. Род «Bacillus» включает все виды, принадлежащие к роду «Bacillus», который, как известно специалистам, включает, но не ограничиваются ими, B. subtilis, B. Licheniformis, B. lentus, B. brevis, B. stearothermophilus, B. alkalophilus, B. amyloliquefaciens, B. clausii, B. halodurans, B. megaterium, B. coagulans, B. circulans, B. lautus и B. thuringiensis. Известно, что род Bacillus продолжает претерпевать таксономическую реорганизацию. Таким образом, предусматривается, что этот род включает виды, которые были переклассифицированы, включая, но не ограничиваясь ими, такие микроорганизмы, как B. stearothermophilus, который в настоящее время называется «Geobacillus stearothermophilus». Продуцирование резистентных эндоспор в присутствии кислорода рассматривается как признак, определяющий род Bacillus, хотя такой признак также является характерным для недавно идентифицированных бактерий, таких как Alicyclobacillus, Amphibacillus, Aneurinibacillus, Anoxybacillus, Brevibacillus, Filobacillus, Gracilibacillus, Halobacillus, Paenibacillus, Salibacillus, Thermobacillus, Ureibacillus и Virgibacillus.
Родственные белки (и их производные) представляют собой «варианты белков». В некоторых предпочтительных вариантах изобретения, варианты белков отличаются от родительского белка и друг от друга небольшим числом аминокислотных остатков. Число отличающихся аминокислотных остатков может составлять 1 или более, а предпочтительно 1, 2, 3, 4, 5, 10, 15, 20, 30, 40, 50 или более аминокислотных остатков. В некоторых предпочтительных вариантах изобретения, число отличающихся аминокислот в различных вариантах составляет от 1 до 10. В некоторых особенно предпочтительных вариантах изобретения, родственные белки, а в частности, варианты белков имеют аминокислотные последовательности, которые являются идентичными по меньшей мере на 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99%. Кроме того, используемый здесь термин «родственный белок» или «вариант белка» означает белок, который отличается от другого родственного белка или родительского белка числом выступающих областей. Так, например, в некоторых вариантах изобретения, варианты белков имеют 1, 2, 3, 4, 5 или 10 соответствующих выступающих областей, которые отличаются от областей родительского белка.
Для получения вариантов ферментов согласно изобретению может быть применено несколько методов, известных специалистам, включая, но не ограничиваясь ими, сайт-насыщающий мутагенез, сканирующий мутагенез, инсерционный мутагенез, неспецифический мутагенез, сайт-направленный мутагенез и направленная эволюция, а также различные другие рекомбинаторные методы.
Характеризацию белков дикого типа и мутантных белков осуществляют с применением любых подходящих методов или «тестов», и такую характеризацию предпочтительно осуществляют путем оценки представляющих интерес свойств. Так, например, в некоторых вариантах настоящего изобретения определяют рН и/или температуру, а также стабильность детергента и/или устойчивость к окислению. Действительно, считается, что в данном случае могут быть использованы ферменты, имеющие различную степень стабильности по одному или более из этих свойств (таких как pH, температура, протеолитическая стабильность, стабильность детергента и/или устойчивость к окислению).
Используемые здесь термины «полинуклеотид» и «нуклеиновая кислота» являются взаимозаменяемыми и означают полимерную форму нуклеотидов любой длины, либо рибонуклеотидов, либо дезоксирибонуклеотидов. Эти термины включают, но не ограничиваются ими, одноцепочечную, двухцепочечную или трехцепочечную ДНК, геномную ДНК, кДНК, РНК, гибрид ДНК-РНК или полимер, содержащий пуриновые и пиримидиновые основания, или другие природные, химически модифицированные, биохимически модифицированные, неприродные или дериватизированные нуклеотидные основания. Нижеследующими неограничивающими примерами полинуклеотидов являются гены, генные фрагменты, хромосомные фрагменты, EST, экзоны, интроны, мРНК, тРНК, рРНК, рибозимы, кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенная ДНК, имеющая любую последовательность, выделенная РНК, имеющая любую последовательность, нуклеиново-кислотные зонды и праймеры. В некоторых вариантах изобретения, полинуклеотиды содержат модифицированные нуклеотиды, такие как метилированные нуклеотиды и нуклеотидные аналоги, урацил, другие сахарные и связывающие группы, такие как фторрибоза и тиоат, и нуклеотидные ветви. В альтернативных вариантах изобретения, последовательность нуклеотидов прерывается ненуклеотидными компонентами.
Используемые здесь термины «ДНК-конструкция» и «трансформирующая ДНК» являются синонимами и означают ДНК, используемую для введения последовательностей в клетку-хозяина или в организм. ДНК может быть получена in vitro с помощью ПЦР или любым(и) другим(и) подходящим(и) методом(ами), известным(и) специалистам. В особенно предпочтительных вариантах изобретения, ДНК-конструкция содержит представляющую интерес последовательность (например, в качестве встраивающейся последовательности). В некоторых вариантах изобретения, последовательность функционально присоединяют к дополнительным элементам, таким как регуляторные элементы (например, промоторы и т.п.). ДНК-конструкция может также содержать селективный маркер. Такая конструкция может также содержать встраивающуюся последовательность, фланкированную гомологичными «боксами». В другом варианте изобретения, трансформирующая ДНК содержит другие негомологичные последовательности, присоединенные по концам (например, «лишние» последовательности или «фланги»). В некоторых вариантах изобретения, указанные концы встраивающейся последовательности замыкают так, чтобы трансформирующая ДНК образовывала замкнутый цикл. Трансформирующими последовательностями могут быть последовательности дикого типа, мутантные последовательности или модифицированные последовательности. В некоторых вариантах изобретения, ДНК-конструкция содержит последовательности, гомологичные последовательностям хромосомы клеток-хозяев. В других вариантах изобретения, ДНК-конструкция содержит негомологичные последовательности. После сборки ДНК-конструкции in vitro, она может быть использована для: 1) встраивания гетерологичных последовательностей в нужную последовательность-мишень клеток-хозяев и/или 2) мутагенеза области хромосомы клеток-хозяев (то есть, для замены эндогенной последовательности гетерологичной последовательностью), 3) делеции генов-мишеней и/или введения реплицирующейся плазмиды хозяину.
Используемые здесь термины «экспрессионный кластер» и «экспрессионный вектор» означают конструкции нуклеиновой кислоты, полученные рекомбинантными методами или методами синтеза и имеющие серию конкретных нуклеиновокислотных элементов, которые позволяют осуществлять транскрипцию конкретной нуклеиновой кислоты в клетке-мишени. Рекомбинантный экспрессионный кластер может быть введен в плазмидную ДНК, хромосомную ДНК, митохондриальную ДНК, пластидную ДНК, вирус или во фрагмент нуклеиновой кислоты. Обычно, рекомбинантный экспрессионный кластер, составляющий часть экспрессионного вектора, включает, помимо других последовательностей, транскрибируемую последовательность нуклеиновой кислоты и промотор. В предпочтительных вариантах изобретения, экспрессионные векторы обладают способностью встраивать гетерологичные фрагменты ДНК в клетку-хозяина и экспрессировать эти фрагменты в данной клетке. Многие прокариотические и эукариотические экспрессионные векторы являются коммерчески доступными. Выбор соответствующих экспрессионных векторов может быть осуществлен самим специалистом в данной области. Термин «экспрессионный кластер», используемый в настоящей заявке, является синонимом термина «ДНК-конструкция» и его грамматическим эквивалентом. Выбор подходящих экспрессионных векторов может быть осуществлен самим специалистом в данной области.
Используемый здесь термин «вектор» означает полинуклеотидную конструкцию, сконструированную для встраивания нуклеиновых кислот в клетки одного или нескольких типов. Векторами являются клонирующие векторы, экспрессионные векторы, челночные векторы, плазмиды, кластеры и т.п. В некоторых вариантах изобретения, полинуклеотидная конструкция содержит последовательность ДНК, кодирующую протеазу (например, предшественника или зрелую протеазу), которая функционально присоединена к подходящей про-последовательности (например, секреторной последовательности и т.п.), способной осуществлять экспрессию ДНК в подходящем хозяине.
Используемый здесь термин «плазмида» означает кольцевую двухцепочечную (дц) ДНК-конструкцию, используемую в качестве клонирующего вектора, которая образует внехромосомный самореплицирующийся генетический элемент в некоторых эукариотах или прокариотах, или интегрируется в хромосому хозяина.
Термин «вводимый», используемый здесь при описании введения последовательности нуклеиновой кислоты в клетку, относится к любому методу, подходящему для переноса последовательности нуклеиновой кислоты в клетку. Такими методами введения являются, но не ограничиваются ими, слияние протопластов, трансфекция, трансформация, конъюгирование и трансдукция (см., например, Ferrari et al., «Genetics», Hardwood et al, (eds.), Bacillus, Plenum Publishing Corp., pages 57-72, 1989).
Используемые здесь термины «трансформируемый» и «стабильно трансформируемый» относятся к клетке, которая имеет ненативную (гетерологичную) полинуклеотидную последовательность, интегрированную в ее геном, или существующую в виде эписомной плазмиды, сохраняющейся по меньшей мере в двух генерациях.
Используемый здесь термин «нуклеотидная последовательность, кодирующая селективный маркер» означает нуклеотидную последовательность, которая обладает способностью экспрессироваться в клетках-хозяевах, где экспрессия селективного маркера приводит к сообщению клеткам, содержащим экспрессируемый ген, способности расти в присутствии соответствующего селективного агента или в отсутствии основного питательного вещества.
Используемые здесь термины «селектируемый маркер» и «селективный маркер» означают нуклеиновую кислоту (например, ген), способную экспрессироваться в клетках-хозяевах, что облегчает отбор этих хозяев, содержащих данный вектор. Примерами таких селектируемых маркеров являются, но не ограничиваются ими, противомикробные средства. Таким образом, термин «селектируемый маркер» означает гены, которые указывают на поглощение данной клеткой-хозяином встраивающейся и представляющей интерес ДНК или на осуществление некоторых других реакций.
Обычно, селектируемые маркеры представляют собой гены, которые сообщают клеткам-хозяевам резистентность к микробам или метаболическое преимущество, что позволяет дифференцировать клетки, содержащие экзогенную ДНК, от клеток, которые не приобретали какой-либо экзогенной последовательности в процессе трансформации. Термин «эндогенный селектируемый маркер» означает маркер, локализованный на хромосоме трансформируемого микроорганизма. Эндогенный селектируемый маркер кодирует ген, который отличается от гена селектируемого маркера, присутствующего на трансформирующей ДНК-конструкции. Селективные маркеры хорошо известны специалистам. Как указывалось выше, предпочтительным маркером является маркер резистентности к микробам (например, ampR; phleoR; specR; kanR; eryR; tetR; cmpR и neoR (см., например, Guerot-Fleury, Gene, 167:335- 337, 1995; Palmeros et al, Gene 247:255-264, 2000; и Trieu-Cuot et al, Gene, 23:331-341, 1983). Другими маркерами, которые могут быть использованы в соответствии с настоящим изобретением, являются, но не ограничиваются ими, ауксотрофные маркеры, такие как триптофан, и детектируемые маркеры, такие как β-галактозидаза.
Используемый здесь термин «промотор» означает последовательность нуклеиновой кислоты, которая инициирует транскрипцию расположенного ниже гена. В предпочтительных вариантах изобретения, указанный промотор является подходящим для той клетки-хозяина, в которой осуществляется экспрессия гена-мишени. Промотор, вместе с другими последовательностями нуклеиновой кислоты, регулирующими транскрипцию и трансляцию (также называемыми «регуляторными последовательностями»), являются необходимыми для экспрессии данного гена. В общих чертах, последовательностями регуляции транскрипции и трансляции являются, но не ограничиваются ими, промоторные последовательности, сайты связывания с рибосомой, последовательности инициации и терминации транскрипции, последовательности инициации и терминации трансляции, и энхансеры или активаторы.
Нуклеиновая кислота является «функционально присоединенной», если она находится в функциональной взаимосвязи с другой последовательностью нуклеиновой кислоты. Так, например, ДНК, кодирующая секреторную лидерную последовательность (то есть, сигнальный пептид), является функционально присоединенной к полипептид-кодирующей ДНК, если она экспрессируется в виде пре-белка, который участвует в секреции полипептида; либо промотор или энхансер являются функционально присоединенными к кодирующей последовательности, если они влияют на транскрипцию данной последовательности; либо сайт связывания с рибосомой является функционально присоединенным к кодирующей последовательности, если его локализация облегчает трансляцию. Вообще говоря, термин «функционально присоединенный» означает, что присоединяемые последовательности ДНК являются смежными, а, в случае присутствия секреторной лидерной последовательности, они являются смежными и находятся в одной рамке считывания. Однако энхансеры необязательно должным быть смежными. Присоединение осуществляется посредством лигирования в подходящих рестрикционных сайтах. Если такие сайты отсутствуют, то в соответствии со стандартной практикой могут быть использованы синтетические олигонуклеотидные адаптеры или линкеры.
Используемый здесь термин «ген» означает полинуклеотид (например, ДНК-сегмент), который кодирует полипептид и включает области, расположенные перед кодирующими областями и за кодирующими областями, а также промежуточные последовательности (интроны), расположенные между отдельными кодирующими сегментами (экзонами).
Используемый здесь термин «гомологичные гены» означает пару генов, которые отличаются друг от друга, но обычно являются родственными молекулами, которые соответствуют друг другу и являются идентичными или имеют очень высокую степень сходства. Этот термин охватывает гены, которые были разделены в процессе видообразования (то есть, образования новых видов) (например, ортологичные гены), а также гены, которые были разделены в процессе генетической дупликации (например, паралогичные гены).
Используемый здесь термин «ортолог» и «ортологичные гены» означает гены, присутствующие у различных видов, которые эволюционировали от общего гена-предка (то есть, гомологичного гена) в процессе видообразования. Обычно, ортологи сохраняют свою самую функцию в процессе эволюции. Идентификация ортологов применяется для точного предсказания функции гена в только что секвенированных геномах.
Используемый здесь термин «паралог» и «паралогичные гены» означает гены, которые стали родственными в результате дупликации в геноме. Ортологи сохраняют свои функции в процессе эволюции, а паралоги приобретают новые функции, хотя некоторые функции часто являются родственными их исходным функциям. Примерами генов-паралогов являются, но не ограничиваются ими, гены, кодирующие трипсин, химотрипсин, эластазу и тромбин, и все они являются сериновыми протеиназами и присутствуют вместе у одного и того же вида.
Используемый здесь термин «гомология» означает сходство или идентичность последовательностей, а предпочтительно, идентичность. Гомологию определяют стандартными методами, известными специалистам (см., например, Smith and Waterman, Adv Appl Math, 2:482, 1981; Needleman and Wunsch, J. Mol. Biol, 48:443, 1970; Pearson and Lipman, Proc. Natl. Acad. Sci. USA, 85:2444, 1988; и программы, такие как GAP, BESTFIT, FASTA и TFASTA, входящие в пакет программного обеспечения Wisconsin Genetics Software Package, Genetics Computer Group, Madison, WI; и Devereux et al, Nucl. Acid. Res., 12:387-395, 1984).
Используемый здесь термин «аналогичная последовательность» означает последовательность, в которой функция гена по существу аналогична функции гена на основе термолизина Geobacillus caldoproteolyticus. Кроме того, аналогичными генами являются гены, последовательности которых по меньшей мере на 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% идентичны последовательности термолизина Geobacillus caldoproteolyticus. В дополнительных вариантах изобретения, указанная последовательность обладает более, чем одним из вышеуказанных свойств. Аналогичные последовательности определяют известными методами выравнивания последовательностей. Наиболее распространенным методом выравнивания является BLAST, хотя, как указывается выше и ниже, для выравнивания последовательностей могут быть также применены и другие методы.
Одним из примеров подходящего алгоритма является алгоритм PILEUP. Алгоритм PILEUP позволяет осуществлять выравнивание множества последовательностей из группы родственных последовательностей путем последовательного попарного выравнивания. Для осуществления выравнивания может быть также построена древовидная схема, иллюстрирующая кластерные взаимосвязи. В программе PILEUP используется упрощенный метод последовательного выравнивания, описанный Feng и Doolittle (Feng and Doolittle, J. Mol. Evol., 35:351-360, 1987). Этот метод аналогичен методу, описанному Higgins и Sharp (Higgins and Sharp, CABIOS 5:151-153, 1989). Подходящими параметрами PILEUP являются «цена» пробела по умолчанию 3,00, «цена» длины пробела по умолчанию 0,10, и взвешенные значения концевых пробелов.
Другим примером подходящего алгоритма является алгоритм BLAST, описанный Altschul et al., (Altschul et al, J. Mol. Biol, 215:403-410, 1990; и Karlin et al., Proc. Natl. Acad. Sci. USA, 90:5873-5787, 1993). Особенно подходящей программой BLAST является программа WU-BLAST-2 (см., Altschul et al., Meth. Enzymol., 266:460-480, 1996). В программе WU-BLAST-2 используется несколько параметров поиска, большинство из которых принимаются как величины по умолчанию. Корректируемые параметры установлены со следующими величинами по умолчанию: охват с перекрыванием = 1, перекрывающаяся фракция = 0,125, предельная длина слова (T)=11. Параметрами HSP S и HSP S2 являются динамические величины, и эти параметры устанавливаются самой программой в зависимости от состава конкретной последовательности и состава конкретной базы данных, в которой осуществляется поиск представляющей интерес последовательности. Однако, для повышения чувствительности, эти величины могут быть скорректированы. % идентичности аминокислотных последовательностей определяют по числу соответствующих идентичных остатков, деленному на общее число остатков «более длинной» последовательности в выравниваемой области. «Более длинной» последовательностью является последовательность, имеющая наиболее ценные остатки в выравниваемой области (пробелы, вводимые с помощью программы WU-Blast-2 для максимизации «веса» выравнивания, не учитываются).
Таким образом, «процент (%) идентичности последовательностей нуклеиновой кислоты» определяют как процент нуклеотидных остатков в последовательности-кандидате, которые идентичны нуклеотидным остаткам исходной последовательности (то есть, представляющей интерес последовательности). В предпочтительном методе используется модуль BLASTN программы WU-BLAST-2, установленный по умолчанию, где перекрывание и перекрывающаяся фракция имеют значения 1 и 0,125, соответственно.
Используемый здесь термин «гибридизация» означает способ, с помощью которого цепь нуклеиновой кислоты присоединяется к комплементарной цепи посредством спаривания оснований, как известно специалистам.
Последовательность нуклеиновой кислоты считается «селективно гибридизуемой» с эталонной последовательностью нуклеиновой кислоты, если две последовательности специфически гибридизуются друг с другом в условиях гибридизации и промывки умеренной-высокой жесткости. Условия гибридизации создают исходя из температуры плавления (Tm) комплекса или зонда, связывающегося с нуклеиновой кислотой. Так, например, условия «максимальной жесткости» обычно соответствуют примерно Tm=5°C (на 5° ниже Tm зонда); условия «высокой жесткости» соответствуют температуре, которая примерно на 5-10ºC ниже Tm зонда; условия «промежуточной жесткости» соответствуют температуре, которая примерно на 10-20ºC ниже Tm зонда; а условия «низкой жесткости» соответствуют температуре, которая примерно на 20-25ºC ниже Tm зонда. Фактически, условия максимальной жесткости могут быть использованы для идентификации последовательностей, которые являются полностью идентичными или почти идентичными последовательности гибридизационного зонда, а гибридизация в условиях промежуточной или низкой жесткости может быть использована для идентификации или детектирования гомологов полинуклеотидных последовательностей.
Условия гибридизации умеренной и высокой жесткости хорошо известны специалистам. Примером условий высокой жесткости является гибридизация примерно при 42ºC в 50% формамиде, 5X SSC, 5X растворе Денхардта, 0,5% ДСН и 100 мкг/мл денатурированной ДНК-носителя, с последующей двухкратной промывкой в 2X SSC и 0,5% ДСН при комнатной температуре и двумя дополнительными промывками в 0,1×SSC и 0,5% ДСН при 42ºC. Примерами условий умеренной жесткости являются инкубирование в течение ночи при 37ºC в растворе, содержащем 20% формамид, 5×SSC (150 мМ NaCl, 15 мM тринатрийцитрат), 50 мM фосфат натрия (pH 7,6), 5 x раствор Денхардта, 10% сульфат декстрана и 20 мг/мл денатурированной фрагментированной ДНК спермы лосося, с последующей промывкой фильтров в 1х SSC примерно при 37-50ºC. Метод коррекции температуры, ионной силы и т.п., необходимых для адаптации таких факторов, как длина зонда и т.п., хорошо известен специалистам в данной области.
Используемый здесь термин «рекомбинантный» относится к клетке или вектору, которые были модифицированы путем введения гетерологичной последовательности нуклеиновой кислоты, или к клетке полученной путем такой модификации. Так, например, рекомбинантные клетки экспрессируют гены, которые отсутствуют в идентичной форме в нативной (нерекомбинантной) клетке, или экспрессируют нативные гены, которые по той или другой причине подвергаются аномальной экспрессии, либо вообще не экспрессируются, либо искусственно экспрессируются в результате вмешательства человека. Термины «рекомбинация», «перегруппировка» и генерирование «рекомбинантной» нуклеиновой кислоты обычно означают сборку двух или более фрагментов нуклеиновой кислоты, где такая сборка приводит к образованию химерного гена.
В предпочтительном варианте изобретения, последовательности мутантных ДНК получают путем сайт-насыщающего мутагенеза по меньшей мере в одном кодоне. В другом предпочтительном варианте, сайт-насыщающий мутагенез осуществляют в двух или более кодонах. В другом варианте изобретения, мутантные последовательности ДНК более, чем на 50%, более, чем на 55%, более, чем на 60%, более, чем на 65%, более, чем на 70%, более, чем на 75%, более, чем на 80%, более, чем на 85%, более, чем на 90%, более, чем на 95% или более, чем на 98% гомологичны последовательности дикого типа. В альтернативных вариантах изобретения, мутантную ДНК получают in vivo с применением любой известной процедуры мутагенеза, такой как, например, облучение, введение нитрозогуанидина и т.п. Затем выделяют нужную последовательность ДНК, и эту последовательность используют в описанных здесь методах.
Используемый здесь термин «последовательность-мишень» означает последовательность ДНК в клетке-хозяине, где указанная последовательность кодирует последовательность, необходимую для встраивания последовательности, встраивающейся в геном клетки-хозяина. В некоторых вариантах изобретения, последовательность-мишень кодирует функциональный ген дикого типа или оперон, а в других вариантах изобретения, последовательность-мишень кодирует функциональный мутантный ген или оперон, или нефункциональный ген или оперон.
Используемый здесь термин «фланкирующая последовательность» означает любую последовательность, расположенную выше или ниже обсуждаемой последовательности (например, для генов A-B-C, ген B последовательностями гена А и С). В предпочтительном варианте изобретения, встраивающаяся последовательность с каждой стороны фланкирована гомологичным боксом. В другом варианте изобретения, встраивающаяся последовательность и гомологичные боксы содержат элемент, который с каждой стороны фланкирован «лишней» последовательностью. В некоторых вариантах изобретения, фланкирующая последовательность присутствует только с одной стороны (либо 3'-, либо 5'-конца), однако, в предпочтительных вариантах изобретения, указанная последовательность фланкирована с обеих сторон. В некоторых вариантах изобретения, фланкирующая последовательность присутствует только с одной стороны (либо 3'-, либо 5'-конца), а в предпочтительных вариантах изобретения, такая последовательность фланкирована с обеих сторон.
Используемый здесь термин «лишняя последовательность» означает любую дополнительную ДНК, которая фланкирует гомологичные боксы (обычно, векторные последовательности). Однако, этот термин охватывает любую негомологичную последовательность ДНК. Не ограничиваясь какой-либо конкретной теорией следует лишь отметить, что «лишняя» последовательность представляет собой мишень для клеток, не играющую важной роли для инициации поглощения ДНК.
Используемые здесь термины «амплификация» и «амплификация гена» означают процесс, благодаря которому конкретные последовательности ДНК непропорционально реплицируются, в результате чего амплифицированный ген присутствует в геноме с большим числом копий, чем в исходном состоянии. В некоторых вариантах изобретения, отбор клеток путем их культивирования в присутствии лекарственного средства (например, ингибитора ингибируемого фермента) приводит к амплификации любого эндогенного гена, кодирующего генный продукт, необходимый для роста клеток в присутствии лекарственного средства, или к амплификации экзогенных (то есть, встраиваемых) последовательностей, кодирующих этот генный продукт, или к той и другой амплификации.
«Амплификация» представляет собой частный случай репликации нуклеиновой кислоты, специфичной к данной матрице. Данная репликация отличается от неспецифически зависимой от матрицы репликации (то есть, репликации, которая зависит от матрицы вообще, но не от конкретной матрицы). В данном контексте, специфичность к матрице отличается от точности репликации (то есть, синтеза соответствующей полинуклеотидной последовательности) и от специфичности к нуклеотиду (рибонуклеотиду или дезоксирибонуклеотиду). Специфичность к матрице часто определяется термином «специфичность к мишени». Последовательности-мишени являются «мишенями» в том смысле, что они должны быть дифференцированы от другой нуклеиновой кислоты. Методы амплификации были разработаны, главным образом, для осуществления такого отбора.
Используемый здесь термин «ко-амплификация» означает введение в одиночную клетку амплифицируемого маркера в комбинации с другими генными последовательностями (то есть, последовательностями, содержащими один или несколько неселектируемых генов, таких как гены, содержащиеся в экспрессионном векторе), и создания соответствующего давления отбора так, чтобы клетка амплифицировала амплифицируемый маркер и другие неселектируемые генные последовательности. Амплифицируемый маркер может быть физически присоединен к другим генным последовательностям, либо, альтернативно, два отдельных фрагмента ДНК, один из которых содержит амплифицируемый маркер, а другой содержит неселектируемый маркер, могут быть введены в одну и ту же клетку.
Используемые здесь термины «амплифицируемый маркер», «амплифицируемый ген» и «вектор для амплификации» означают ген или вектор, кодирующий ген, который позволяет этому гену амплифицироваться в соответствующих условиях культивирования.
«Специфичность к матрице» достигается с применением большинства методов амплификации путем выбора фермента. Ферментами для амплификации являются ферменты, которые, при их присутствии в условиях, в которых они используются, будут процессировать только специфические последовательности нуклеиновой кислоты в гетерогенной смеси нуклеиновой кислоты. Так, например, в случае репликазы Qβ, РНК MDV-1 представляет собой матрицу, специфичную для репликазы (см. например, Kacian et al, Proc. Natl. Acad. Sci. USA 69:3038, 1972), а другие нуклеиновые кислоты не реплицируются под действием такого фермента для амплификации. Аналогичным образом, в случае РНК-полимеразы T7, такой фермент для амплификации обладает высокой степенью специфичности к его собственным промоторам (см., Chamberlin et al., Nature 228:227, 1970). В случае ДНК-лигазы T4, фермент не лигирует два олигонуклеотида или полинуклеотида, если имеется несоответствие между олигонуклеотидным или полинуклеотидным субстратом и матрицей в стыке лигирования (см., Wu and Wallace, Genomics 4:560, 1989). И наконец, было обнаружено, что полимеразы Taq и Pfu, благодаря своей способности функционировать при высокой температуре, обладают высокой специфичностью к последовательностям, связанным и, тем самым, ограниченным праймерами, где высокая температура обеспечивает термодинамические условия, которые благоприятствуют гибридизации праймеров с последовательностями-мишенями и не благоприятствуют гибридизации с последовательностями, не являющимися мишенями.
Используемый здесь термин «амплифицируемая нуклеиновая кислота» относится к нуклеиновым кислотам, которые могут быть амплифицированы любым методом амплификации. Следует отметить, что термин «амплифицируемая нуклеиновая кислота» обычно включает «образец-матрицу».
Используемый здесь термин «образец-матрица» означает нуклеиновую кислоту, происходящую от образца, который анализируют на присутствие «мишени» (определенной ниже). В противоположность этому, термин «фоновая матрица» употребляется по отношению к нуклеиновой кислоте, которая не является образцом-матрицей, и может присутствовать, а может и не присутствовать в образце. Фоновая матрица часто образуется самопроизвольно. Она может образовываться в результате переноса нуклеиновых кислот или она может образовываться благодаря присутствию примесных нуклеиновых кислот, которые должны быть удалены из образца. Так, например, нуклеиновые кислоты, происходящие от организмов, которые не были детектированы, могут присутствовать в тест-образце как фоновые.
Используемый здесь термин «праймер» означает олигонуклеотид, который, независимо от того, существует ли он в природе как очищенный гидролизат рестриктирующего фермента, или он был продуцирован путем синтеза, способен действовать как сайт инициации синтеза, осуществляемого в условиях, при которых индуцируется синтез продукта удлинения праймера, являющийся комплементарным цепи нуклеиновой кислоты (то есть, в присутствии нуклеотидов и индуцирующего агента, такого как ДНК-полимераза, и при подходящей температуре и рН). Для достижения максимально эффективной амплификации, предпочтительно, чтобы данный праймер был одноцепочечным, однако, альтернативно, он может быть двухцепочечным. Если праймер является двухцепочечным, то его сначала обрабатывают для разделения цепей, а затем используют для получения продуктов удлинения. Предпочтительным праймером является олигодезоксирибонуклеотид. Праймер должен иметь длину, достаточную для инициации синтеза продуктов удлинения в присутствии индуцирующего агента. Точная длина праймеров зависит от многих факторов, включая температуру, источник происхождения праймера и метод его применения.
Используемый здесь термин «зонд» означает олигонуклеотид (то есть, последовательность нуклеотидов), который независимо от того, существует ли он в природе как очищенный гидролизат рестриктирующего фермента, либо он был продуцирован путем синтеза методами рекомбинантных ДНК или путем ПЦР-амплификации, обладает способностью гибридизоваться с другим представляющим интерес олигонуклеотидом. Такой зонд может быть одноцепочечным или двухцепочечным. Зонды могут быть использованы для детектирования, идентификации и выделения конкретных генных последовательностей. Считается, что любой зонд, используемый в настоящем изобретении, может быть помечен любой «репортерной» молекулой, которая является детектируемой в любой детектирующей системе, включая, но не ограничиваясь ими, ферментная система (например, ELISA, а также гистохимические анализы на основе ферментов), флуоресцентная, радиоактивная и люминесцентная системы. При этом, предусматривается, что настоящее изобретение не ограничивается какой-либо конкретной детектирующей системой или меткой.
Термин «мишень», если он используется здесь по отношению к полимеразной цепной реакции, означает область нуклеиновой кислоты, связанную с праймерами, используемыми для полимеразной цепной реакции. Таким образом, «мишень» выбирают из других последовательностей нуклеиновой кислоты. «Сегмент» определяют как область нуклеиновой кислоты в последовательности-мишени.
Используемый здесь термин «полимеразная цепная реакция» («ПЦР») относится к методам, описанным в патентах США №№ 4683195, 4683202 и 4965188, которые вводятся в настоящее описание посредством ссылки, где указанные методы включают увеличение концентрации сегмента последовательности-мишени в смеси геномной ДНК без проведения клонирования или очистки. Такой способ амплификации последовательности-мишени состоит из введения большого избытка двух олигонуклеотидных праймеров в смесь ДНК, содержащую нужную последовательность-мишень, с последующим проведением конкретного ряда термоциклов в присутствии ДНК-полимеразы. Два праймера являются комплементарными их соответствующим цепям двухцепочечной последовательности-мишени. Для осуществления амплификации, смесь денатурируют, а затем праймеры гибридизуют с комплементарными им последовательностями в молекуле-мишени. После отжига, праймеры удлиняют под действием полимеразы, в результате чего образуется новая пара комплементарных цепей. Стадии денатурации, отжига праймеров и удлинения под действием полимеразы могут быть проведены много раз (то есть, стадии денатурации, отжига и удлинения составляют один «цикл», а могут составлять и множество циклов) с получением высокой концентрации амплифицированного сегмента нужной последовательности-мишени. Длину амплифицированного сегмента нужной последовательности-мишени определяют по положениям праймеров по отношению друг к другу, а поэтому такая длина является регулируемым параметром. Поскольку данный процесс носит повторяющийся характер, то такой метод называется «полимеразной цепной реакцией» (далее обозначаемой «ПЦР»). Поскольку нужные амплифицированные сегменты последовательности-мишени становятся преобладающими последовательностями (с точки зрения их концентрации) в данной смеси, то их принято называть «ПЦР-амплифицированными».
Используемый здесь термин «реагенты для амплификации» означает реагенты (дезоксирибонуклеотид-трифосфаты, буфер и т.п.), необходимые для амплификации, за исключением праймеров, нуклеиновокислотной матрицы и фермента для амплификации. Обычно, реагенты для амплификации, вместе с другими компонентами реакционной смеси, помещают в реакционный сосуд и хранят в таком сосуде (в тест-пробирке, микролунке и т.п.).
С помощью ПЦР можно амплифицировать одну копию специфической последовательности-мишени в геномной ДНК до уровня, который может быть детектирован с применением нескольких различных методов (например, гибридизации с меченным зондом; включения биотинилированных праймеров с последующим детектированием конъюгата «авидин-фермент»; и включения 32P-меченных дезоксинуклеотид-трифосфатов, таких как dCTP или dATP, в амплифицированный сегмент). Помимо геномной ДНК, любая олигонуклеотидная или полинуклеотидная последовательность может быть амплифицирована с использованием соответствующего набора молекул-праймеров. В частности, амплифицированные сегменты, полученные с помощью ПЦР, сами являются матрицами, которые могут быть использованы для последующих ПЦР-амплификаций.
Используемые здесь термины «ПЦР-продукт», «ПЦР-фрагмент» и «продукт амплификации» означают смесь соединений, полученную после проведения двух или более циклов ПЦР-стадий денатурации, отжига и удлинения. Эти термины включают случаи, при которых происходит амплификация одного или нескольких сегментов одной или нескольких последовательностей-мишеней.
Используемый здесь термин «ОТ-ПЦР» означает репликацию и амплификацию последовательностей РНК. В этом методе, обратную транскрипцию совмещают с ПЦР, в основном, с применением одной ферментативной процедуры, в которой используется термостабильная полимераза, как описано в патенте США № 5322770, который вводится в настоящее описание посредством ссылки. В ОТ-ПЦР, РНК-матрицу превращают в кДНК под действием обратной транскриптазной активности полимеразы, а затем амплифицируют с использованием полимеризующей активности полимеразы (то есть, как в других ПЦР-методах).
Используемые здесь термины «рестриктирующие эндонуклеазы» и «рестриктирующие ферменты» означают бактериальные ферменты, каждый из которых разрезает двухцепочечную ДНК в конкретной нуклеотидной последовательности или возле этой последовательности.
Термин «рестрикционный сайт» означает нуклеотидную последовательность, распознаваемую и расщепляемую данной рестриктирующей эндонуклеазой, и в большинстве случаев, таким сайтом является сайт инсерции ДНК-фрагментов. В некоторых вариантах изобретения, рестрикционные сайты встраивают в селективный маркер и присоединяют к 5'- и 3'-концам ДНК-конструкции.
Используемый здесь термин «интеграция в хромосому» означает способ, посредством которого встраивающуюся последовательность вводят в хромосому клетки-хозяина. Гомологичные области трансформирующей ДНК присоединены к гомологичным областям хромосомы. Затем последовательность, расположенную между гомологичными боксами, заменяют встраивающейся последовательностью в двойном кроссинговере (то есть, гомологичной рекомбинации). В некоторых вариантах изобретения, гомологичные сегменты инактивирующего хромосомного сегмента ДНК-конструкции присоединены к фланкирующим гомологичным областям природной области хромосомы Bacillus. Затем природную хромосомную область делетируют под действием ДНК-конструкции при двойном кроссинговере (то есть, гомологичной рекомбинации).
Термин «гомологичная рекомбинация» означает обмен ДНК-фрагментами между двумя молекулами ДНК или спаренными хромосомами в сайте идентичных или почти идентичных нуклеотидных последовательностей. В предпочтительном варианте изобретения, интеграция в хромосому представляет собой гомологичную рекомбинацию.
Используемый здесь термин «гомологичные последовательности» означает последовательность нуклеиновой кислоты или полипептидную последовательность, которые на 100%, 99%, 98%, 97%, 96%, 95%, 94%, 93%, 92%, 91%, 90%, 88%, 85%, 80%, 75% или 70% идентичны другой последовательности нуклеиновой кислоты или полипептидной последовательности при оптимальном выравнивании для сравнения. В некоторых вариантах изобретения, гомологичные последовательности являются идентичными на 85%-100%, в других вариантах изобретения, на 90%-100%, а в более предпочтительных вариантах изобретения, на 95%-100%.
Используемый здесь термин «аминокислота» относится к последовательностям пептидов или белков, или их фрагментов. Используемые здесь термины «белок», «пептид» и «полипептид» являются взаимозаменяемыми.
Используемый здесь термин «гетерологичный белок» означает белок или полипептид, который обычно не присутствует в клетке-хозяине. Примерами гетерологичных белков являются ферменты, такие как гидролазы, включая протеазы. В некоторых вариантах изобретения, гены, кодирующие белки, являются природными генами, а в других вариантах изобретения используются мутированные и/или синтезированные гены.
Используемый здесь термин «гомологичный белок» означает нативный белок или полипептид, либо белок или полипептид, присутствующий в природной клетке. В предпочтительных вариантах изобретения, указанной клеткой является грамположительная клетка, а в особенно предпочтительных вариантах изобретения, указанной клеткой является клетка-хозяин Bacillus. В альтернативных вариантах изобретения, гомологичным белком является нативный белок, продуцируемый другими микроорганизмами, включая, но не ограничиваясь ими, E. coli, Streptomyces, Trichoderma и Aspergillus. Настоящее изобретение охватывает клетки-хозяева, продуцирующие гомологичный белок в результате применения техники рекомбинантных ДНК.
Используемый здесь термин «область оперона» включает группу смежных генов, которые транскрибируются в виде одной транскрипционной единицы от общего промотора, а поэтому подвергаются совместной регуляции. В некоторых вариантах изобретения, оперон включает ген-регулятор. В наиболее предпочтительных вариантах изобретения используются опероны, которые экспрессируются на высоком уровне, как было измерено на уровне РНК, но их функция либо неизвестна, либо не является необходимой.
Используемый здесь термин «антимикробная область» означает область, содержащую по меньшей мере один ген, кодирующий белок, обладающий антимикробными свойствами.
Считается, что полинуклеотид «кодирует» РНК или полипептид, если такой полинуклеотид, присутствующий в своем природном состоянии или модифицированный методами, известными специалистам, может транскрибироваться и/или транслироваться с продуцированием РНК, полипептида или его фрагмента. Также считается, что указанные последовательности кодируются антисмысловой цепью такой нуклеиновой кислоты.
Как известно специалистам, ДНК может транскрибироваться под действием РНК-полимеразы с продуцированием РНК, однако, РНК может подвергаться обратной транскрипции под действием обратной транскриптазы с продуцированием ДНК. Таким образом, ДНК может кодировать РНК и наоборот.
Термин «регуляторный сегмент» или «регуляторная последовательность» или «последовательность регуляции экспрессии» означает полинуклеотидную последовательность ДНК, функционально присоединенную к полинуклеотидной последовательности ДНК, которая кодирует аминокислотную последовательность полипептидной цепи, в результате чего осуществляется экспрессия кодируемой аминокислотной последовательности. Регуляторная последовательность может ингибировать, подавлять или стимулировать экспрессию функционально присоединенной полинуклеотидной последовательности, кодирующей аминокислоту.
Термин «штамм-хозяин» или «клетка-хозяин» означает хозяина, подходящего для встраивания в него экспрессионного вектора, содержащего ДНК согласно изобретению.
Фермент «сверхэкспрессируется» в клетке-хозяине, если такой фермент экспрессируется в клетке на уровне, превышающем уровень его экспрессии в соответствующей клетке дикого типа.
Термины «белок» и «полипептид» являются здесь взаимозаменяемыми. В описании настоящего изобретения, для обозначения аминокислот используется 3-буквенный код, который был определен в соответствии с соглашением Объединенной комиссии по биохимической номенклатуре IUPAC-IUB (JCBN). Также следует отметить, что полипептид, из-за вырожденности генетического кода, может кодироваться более, чем одной нуклеотидной последовательностью.
«Пропоследовательность» представляет собой аминокислотную последовательность, расположенную между сигнальной последовательностью и зрелой протеазой, и необходимую для секреции протеазы. Расщепление пропоследовательности приводит к образованию зрелой активной протеазы.
Термин «сигнальная последовательность» или «сигнальный пептид» означает любые нуклеотидные и/или аминокислотные последовательности, которые участвуют в секреции зрелых форм белка или их предшественников. Такое определение сигнальной последовательности означает, что эта последовательность является функциональной и включает все аминокислотные последовательности, кодируемые геном N-концевой части белка, участвующего в осуществлении секреции белка. Такие последовательности, в большинстве случаев, но не всегда, связаны с N-концевой частью белка или с N-концевой частью белка-предшественника. Сигнальная последовательность может быть эндогенной или экзогенной. Сигнальной последовательностью может быть последовательность, которая обычно ассоциируется с белком (например, с протеазой), либо она может происходить от гена, кодирующего другой секретированный белок. Одна репрезентативная экзогенная сигнальная последовательность содержит первые семь аминокислотных остатков сигнальной последовательности, происходящих от субтилизина Bacillus subtilis, присоединенного к остальной части сигнальной последовательности субтилизина Bacillus lentus (ATCC 21536).
Термин «гибридная сигнальная последовательность» означает сигнальные последовательности, в которых часть последовательности была получена в результате ее экспрессии в хозяине, и которые присоединены к сигнальной последовательности экспрессируемого гена. В некоторых вариантах изобретения используются синтезированные последовательности.
Термин «зрелая» форма белка или пептида означает конечную функциональную форму белка или пептида. Так, например, зрелая форма термолизина включает аминокислотную последовательность SEQ ID NO:3.
Термин «форма-предшественник» белка или пептида означает зрелую форму белка, имеющую пропоследовательность, функционально присоединенную к амино-концу или к карбонильному концу белка. Такой предшественник может также иметь «сигнальную последовательность», функционально присоединенную к амино-концу пропоследовательности. Предшественник может также иметь дополнительные полинуклеотиды, которые участвуют в пост-трансляционной активности (например, полинуклеотиды, отщепленные от этой последовательности, образуют зрелую форму белка или пептида).
Термин «природный фермент» означает фермент, имеющий немодифицированную аминокислотную последовательность, идентичную последовательности, встречающейся в природе. Природными ферментами являются нативные ферменты, то есть, ферменты, которые обычно экспрессируются или которые были обнаружены в конкретном микроорганизме.
Термины «происходит от …» и «получен от …» относятся не только к протеазе, продуцированной или продуцируемой штаммом рассматриваемого микроорганизма, но также и к протеазе, кодируемой последовательностью ДНК, выделенной из такого штамма и продуцируемой в организме-хозяине, содержащем такую последовательность ДНК. Кроме того, этот термин относится к протеазе, которая кодируется последовательностью ДНК, происходящей от синтезированной ДНК и/или кДНК, и которая имеет идентифицирующие свойства рассматриваемой протеазы. Так, например, термин «протеазы, происходящие от Bacillus sp.», означает ферменты, обладающие протеолитической активностью и продуцируемые в природе микроорганизмом Bacillus sp., а также нейтральные металлопротеазы, которые подобны металлопротеазам, продуцируемым источниками Bacillus sp., но которые, после осуществления методов генной инженерии, продуцируются микроорганизмами, не являющимися бактериями Geobacillus caldoproteolyticus, трансформированными нуклеиновой кислотой, кодирующей указанные нейтральные металлопротеазы.
«Производное», входящее в объем данного определения, обычно сохраняет ту же степень протеолитической активности, которая характерна для формы дикого типа, нативной формы или родительской формы и является подходящей для ее использования в тех же целях, в которых используются указанные формы дикого типа, нативные формы или родительские формы. Функциональные производные нейтральной металлопротеазы включают природные, синтезированные или рекомбинантно продуцированные пептиды или пептидные фрагменты, обладающие общими свойствами нейтральной металлопротеазы согласно изобретению.
Термин «функциональное производное» означает производное нуклеиновой кислоты, имеющее функциональные свойства нуклеиновой кислоты, кодирующей нейтральную металлопротеазу. Функциональные производные нуклеиновой кислоты, кодирующие нейтральную металлопротеазу согласно изобретению, включают природные, синтезированные или рекомбинантно продуцированные нуклеиновые кислоты или их фрагменты, кодирующие нейтральную металлопротеазу согласно изобретению. Нуклеиновая кислота дикого типа, кодирующая нейтральную металлопротеазу согласно изобретению, включает природные аллели и гомологи, образуемые вследствие вырожденности генетического кода, известной специалистам.
Термин «идентичный», используемый по отношению к двум последовательностям нуклеиновых кислот или полипептидов, относится к остаткам в двух последовательностях, которые являются одинаковыми при выравнивании на максимальное соответствие, как было определено с помощью одного из указанных ниже алгоритмов сравнения или анализа последовательностей.
Термин «оптимальное выравнивание» означает выравнивание, позволяющее выявить самую высокую величину процента идентичности.
Термины «процент идентичности последовательностей», «процент идентичности аминокислотных последовательностей», «процент идентичности генных последовательностей» и/или «процент идентичности последовательностей нуклеиновых кислот/полинуклеотидов», если они относятся к двум аминокислотным, полинуклеотидным и/или генным последовательностям (если они используются), означают процент остатков, которые являются идентичными в двух последовательностях при их оптимальном выравнивании. Таким образом, 80%-ная идентичность аминокислотных последовательностей означает, что 80% аминокислот в двух оптимально выравниваемых полипептидных последовательностях являются идентичными.
Термин «по существу, идентичный», используемый по отношению к двум нуклеиновым кислотам или полипептидам, относится к полинуклеотидам или полипептидам, имеющим последовательность, которая по меньшей мере на 70%, предпочтительно, по меньшей мере на 75%, предпочтительно, по меньшей мере на 80%, предпочтительно, по меньшей мере на 85%, предпочтительно, по меньшей мере на 90%, предпочтительно, по меньшей мере на 95%, предпочтительно, по меньшей мере на 97%, предпочтительно, по меньшей мере на 98% и предпочтительно, по меньшей мере на 99% идентична эталонной последовательности, как было определено с помощью программ или алгоритмов (например, BLAST, ALIGN, CLUSTAL) с использованием стандартных параметров. Одним из подтверждений, что два полипептида, по существу, идентичны друг другу, является тот факт, что первый полипептид вступает в иммунную перекрестную реакцию со вторым полипептидом. Обычно, полипептиды, которые отличаются по своим консервативным аминокислотным заменам, вступают в перекрестную иммунную реакцию. Таким образом, полипептид является, по существу, идентичным второму полипептиду, например, если два пептида отличаются только консервативными заменами. Другим указанием на то, что две последовательности нуклеиновой кислоты, по существу, идентичны друг другу, является тот факт, что эти две молекулы гибридизуются друг с другом в жестких условиях (например, в условиях умеренной-высокой жесткости).
Термин «выделенный» или «очищенный» относится к материалу, который был удален из его природного окружения (например, из его естественного окружения, если он встречается в таком окружении). Так, например, говорят, что данный материал является «очищенным», если он присутствует в конкретной композиции в более высокой или более низкой концентрации, чем в природном организме или в организме дикого типа, или в комбинации с компонентами, которые обычно не присутствуют после экспрессии из природного организма или организма дикого типа. Так, например, природный полинуклеотид или полипептид, присутствующий у живого животного, не является выделенным, а тот же самый полинуклеотид или полипептид, отделенный от некоторых или всех веществ, присутствующих вместе в природной системе, является выделенным. Такие полинуклеотиды могут быть частью вектора, и/или такие полинуклеотиды или полипептиды могут быть частью композиции, и кроме того, они могут быть изолированными, то есть такой вектор или такая композиция не являются частью своего природного окружения. В предпочтительных вариантах изобретения, нуклеиновая кислота или белок считаются, например, очищенными, если они дают, в основном, одну полосу в электрофоретическом геле или блоте.
Термин «выделенный», используемый по отношению к последовательности ДНК, относится к последовательности ДНК, которая была удалена из ее природной генетической среды и, таким образом, не содержит других чужеродных или нежелательных кодирующих последовательностей, и присутствует в форме, подходящей для применения в генетически сконструированных системах продуцирования белка. Такими выделенными молекулами являются молекулы, отделенные от их природного окружения, которые включают кДНК и геномные клоны. Выделенные молекулы ДНК согласно изобретению не содержат других генов, с которыми они обычно ассоциируются в природе, но они могут включать природные 5'- и 3'-нетранслируемые области, такие как промоторы и терминаторы. Идентификация ассоциированных областей известна среднему специалисту в данной области (см. например, Dynan and Tijan, Nature 316:774-78, 1985). Термин «выделенная последовательность ДНК» альтернативно называется «клонированной последовательностью ДНК».
Термин «выделенный», относящийся к белку, означает, что белок находится в условиях, отличающихся от условий его природной окружающей среды. В своей предпочтительной форме, выделенный белок, по существу, не содержит других белков, а в частности, других гомологичных белков. Выделенный белок имеет чистоту более, чем 10%, предпочтительно, более, чем 20%, а еще более предпочтительно, более, чем 30%, как было определено с помощью электрофореза в ДСН-ПААГ. Другие аспекты изобретения включают белок с высокой степенью чистоты (то есть, более, чем 40%, более, чем 60%, более, чем 80%, более, чем 90%, более, чем 95%, более, чем 97% и даже более, чем 99%), как было определено с помощью электрофореза в ДСН-ПААГ.
Для облегчения конструирования вариантов фермента согласно изобретению может быть применен описанный ниже метод кластерного мутагенеза, хотя могут быть применены и другие методы. Как описано в настоящей заявке, сначала получают природный ген, кодирующий фермент, а затем его секвенируют полностью или частично. Затем, последовательность сканируют для определения положения, в которое желательно введение мутации (делеции, инсерции или замены) одной или более аминокислот в кодируемом ферменте. Последовательности, фланкирующие такое положение, оценивают на присутствие рестрикционных сайтов, подходящих для замены короткого сегмента гена олигонуклеотидным пулом, который, при его экспрессии, будет кодировать различные мутанты. Такими рестрикционными сайтами, предпочтительно, являются уникальные сайты в гене белка, которые облегчают замену генного сегмента. Однако, может быть использован любой удобный рестрикционный сайт, который не является чрезмерно избыточным в гене данного фермента, при условии, что генные фрагменты, полученные посредством гидролиза рестриктирующими ферментами, могут быть подвергнуты повторной сборке с получением «правильной» последовательности. Если рестрикционные сайты отсутствуют в положениях, расположенных на подходящем расстоянии от выбранного положения (от 10 до 15 нуклеотидов), то такие сайты получают путем замены нуклеотидов в гене таким способом, при котором в конечной конструкции не изменяются ни рамка считывания, ни кодируемые аминокислоты. Мутацию гена, осуществляемую в целях изменения его последовательности, для подтверждения нужной последовательности, осуществляют путем удлинения праймера М13 в соответствии с общеизвестными методами. Задача определения локализации подходящих фланкирующих областей и выявления необходимых модификаций для получения двух подходящих последовательностей рестрикционных сайтов была решена рутинным способом благодаря избыточности генетического кода, получению рестрикционной карты гена и большому числу различных рестриктирующих ферментов. Следует отметить, что если стандартный фланкирующий рестрикционный сайт является доступным, то вышеописанный метод должен быть применен только к фланкирующей области, не содержащей какого-либо сайта.
После клонирования природной ДНК и/или синтезированной ДНК, рестрикционные сайты, фланкирующие положения, подвергаемые мутации, гидролизуют когнатными рестриктирующими ферментами, и множество комплементарных по концам олигонуклеотидных кластеров лигируют в ген. Благодаря этому методу, мутагенез может быть упрощен, поскольку все олигонуклеотиды могут быть синтезированы так, чтобы они имели одни и те же рестрикционные сайты, и для создания рестрикционных сайтов необязательно присутствие синтетических линкеров.
Используемый здесь термин «соответствующий …» относится к остатку, присутствующему в пронумерованном положении белка или пептида, или к остатку, который является аналогичным, гомологичным или эквивалентным пронумерованному остатку в белке или пептиде.
Используемый здесь термин «соответствующая область», в основном, относится к аналогичному положению на всей последовательности родственных белков или родительского белка.
Используемый здесь термин «комбинаторный мутагенез» относится к методам получения библиотек вариантов исходной последовательности. В этих библиотеках, варианты содержат одну или несколько мутаций, выбранных из предварительно определенной серии мутаций. Кроме того, такие методы позволяют вводить неспецифические мутации, которые не являются членами предварительно определенной серии мутаций. В некоторых вариантах изобретения, указанными методами являются методы, описанные в заявке на патент США 09/699250, поданной 26 октября 2000, которая вводится в настоящее описание посредством ссылки. В альтернативных вариантах изобретения, методы комбинаторного мутагенеза проводят с помощью коммерчески доступных наборов (например, QUIKCHANGE® Multisite, Stratagene, San Diego, CA).
Используемый здесь термин «библиотека мутантов» относится к популяции клеток, которые являются идентичными в большей части своего генома, но включают различные гомологи одного или нескольких генов. Такие библиотеки могут быть использованы, например, для идентификации генов или оперонов с улучшенными свойствами.
Используемые здесь термины «исходный ген» и «родительский ген» означают представляющий интерес ген, который кодирует представляющий интерес белок с улучшенными и/или измененными свойствами согласно изобретению.
Используемые здесь термины «выравнивание множества последовательностей» и «ВМП» относятся к последовательностям множества гомологов исходного гена, выравнивание которых проводят с помощью алгоритма (например, Clustal W).
Используемые здесь термины «консенсусная последовательность» и «каноническая последовательность» означают архетипическую аминокислотную последовательность, с которой сравнивают все варианты конкретного представляющего интерес белка или конкретной представляющей интерес последовательности. Эти термины также означают последовательность, имеющую нуклеотиды, которые наиболее часто встречаются в представляющей интерес последовательности ДНК. Для каждого положения гена, консенсусная последовательность дает аминокислоту, которая наиболее часто встречается в этом положении при ВМП.
Используемый здесь термин «консенсусная мутация» относится к различию в последовательности исходного гена и консенсусной последовательности. Консенсусные мутации идентифицируют путем сравнения последовательностей исходного гена и консенсусной последовательности, полученной в результате ВМП. В некоторых вариантах изобретения, консенсусные мутации вводят в исходный ген так, чтобы он был более сходным с консенсусной последовательностью. Консенсусными мутациями также являются аминокислотные замены, которые заменяют аминокислоту в исходном гене на аминокислоту, которая более часто встречается при ВМП в этом положении, чем аминокислота в исходном гене. Таким образом, термин «консенсусная мутация» включает все замены одной аминокислоты, которые позволяют заменить аминокислоту исходного гена на аминокислоту, которая встречается более часто, чем аминокислота при ВМП.
Термины «модифицированная последовательность» и «модифицированные гены» являются взаимозаменяемыми и означают последовательность, которая включает делецию, инсерцию или разрыв последовательности природной нуклеиновой кислоты. В некоторых предпочтительных вариантах изобретения, продукт экспрессии модифицированной последовательности представляет собой усеченный белок (например, если указанной модификацией является делеция или разрыв последовательности). В некоторых особенно предпочтительных вариантах изобретения, усеченный белок сохраняет биологическую активность. В альтернативных вариантах изобретения, продуктом экспрессии модифицированной последовательности является удлиненный белок (например, модификации, содержащие вставку в последовательность нуклеиновой кислоты). В некоторых вариантах изобретения, такая инсерция приводит к образованию усеченного белка (например, если инсерция приводит к образованию стоп-кодона). Таким образом, инсерция может приводить к образованию либо усеченного белка, либо удлиненного белка в качестве продукта экспрессии.
Используемые здесь термины «мутантная последовательность» и мутантный ген» являются взаимозаменяемыми и означают последовательность, которая имеет модификацию по меньшей мере в одном кодоне, присутствующую в последовательности дикого типа клетки-хозяина. Продуктом экспрессии мутантной последовательности является белок, имеющий модифицированную аминокислотную последовательность, по сравнению с последовательностью дикого типа. Продукт экспрессии может обладать модифицированной функциональной активностью (например, повышенной ферментативной активностью).
Термины «мутагенный праймер» или «мутагенный олигонуклеотид» (в настоящей заявке эти термины являются взаимозаменяемыми) означают олигонуклеотидные композиции, которые соответствуют части последовательности-матрицы и обладают способностью гибридизоваться с этой последовательностью. Что касается мутагенных праймеров, то такие праймеры не имеют точного соответствия с матричной нуклеиновой кислотой, где такое несоответствие или такие несоответствия в праймере используются для введения нужной мутации в библиотеку нуклеиновых кислот. Используемый здесь термин «немутагенный праймер» или «немутагенный олигонуклеотид» означает олигонуклеотидные композиции, которые точно соответствуют матричной нуклеиновой кислоте. В одном из вариантов изобретения используются только мутагенные праймеры. В другом предпочтительном варианте изобретения, праймеры конструируют так, чтобы по меньшей мере в одной области, в которую включен мутагенный праймер, также присутствовал немутагенный праймер, включенный в олигонуклеотидную смесь. Путем добавления смеси мутагенных праймеров и немутагенных праймеров, соответствующих по меньшей мере одному из мутагенных праймеров, можно получить библиотеку нуклеиновых кислот, в которой присутствует ряд комбинаторных мутационных паттернов. Так, например, если желательно, чтобы некоторые члены библиотеки мутантных нуклеиновых кислот сохраняли свою родительскую последовательность в некоторых положениях, а другие члены были мутантными в таких сайтах, то могут быть получены немутагенные праймеры, обладающие способностью обеспечивать конкретный уровень немутантных членов в библиотеке нуклеиновых кислот для данного остатка. В способах согласно изобретению используются мутагенные и немутагенные олигонуклеотиды, которые обычно имеют длину 10-50 оснований, а более предпочтительно, примерно 15-45 оснований. Однако для достижения желаемого результата мутагенеза может оказаться необходимым использование праймеров, которые имеют длину менее, чем 10 оснований или более, чем 50 оснований. Что касается соответствующих мутагенных и немутагенных праймеров, то необязательно, чтобы соответствующие олигонуклеотиды имели одну и ту же длину, при условии, что они должны перекрываться лишь в области, соответствующей вводимой мутации.
Праймеры могут быть добавлены в отношении, предварительно определенном в соответствии с настоящим изобретением. Так, например, если желательно, чтобы полученная библиотека имела значительный уровень некоторых специфических мутаций и меньшее количество других мутаций в одном и том же сайте или в различных сайтах, то путем коррекции количества добавляемых праймеров можно получить библиотеку с желаемыми несоответствиями. Альтернативно, путем добавления меньшего или большего количества немутагенных праймеров можно скорректировать частоту, с которой соответствующая(ие) мутация(и) будет(ут) продуцироваться в библиотеке мутантных нуклеиновых кислот.
Используемые здесь термины «последовательность дикого типа» или «ген дикого типа» являются взаимозаменяемыми и означают последовательность, которая является нативной или присутствует в природе в клетке-хозяине. В некоторых вариантах изобретения, последовательность дикого типа означает представляющую интерес последовательность, которая является исходной точкой для осуществления проекта конструирования белков. Последовательность дикого типа может кодировать гомологичный или гетерологичный белок. Гомологичным белком является белок, который продуцируется клеткой-хозяином без какого-либо вмешательства. Гетерологичным белком является белок, который не продуцируется клеткой-хозяином, и такое продуцирование может быть достигнуто искусственным путем.
Термин «эквивалент», если он используется по отношению к положению аминокислотного остатка в белке термолизине, означает положение аминокислотного остатка в варианте термолизина, который соответствует положению первичной последовательности немодифицированного предшественника, например, термолизина дикого типа. Для определения положения, эквивалентного положениям аминокислот в термолизине, аминокислотную последовательность термолизина, которая была модифицирована для продуцирования варианта термолизина, непосредственно сравнивают с последовательностью термолизина SEQ ID NO:3. После выравнивания остатков с учетом инсерций и делеций, вводимых для сохранения выравнивания (то есть, для предотвращения элиминации консервативных остатков в результате самопроизвольной делеции или инсерции), определяют остатки в положениях, эквивалентных конкретным положениям аминокислот в последовательности термолизина SEQ ID NO:3.
Термин «устойчивость к окислению» относится к протеазам согласно изобретению, которые сохраняют конкретное количество ферментативной активности в течение определенного периода времени в условиях, преобладающих в процессах протеолиза, гидролиза, очистки или других процессах согласно изобретению, например, при обработке отбеливателями или окислителями, или при контактировании с указанными отбеливателями или окислителями. В некоторых вариантах изобретения, протеазы сохраняют протеолитическую активность по меньшей мере на 50%, 60%, 70%, 75%, 80%, 85%, 90%, 92%, 95%, 96%, 97%, 98% или на 99% после контактирования с отбеливателем или окислителем в течение определенного периода времени, например, по меньшей мере в течение 1 минуты, 3 минут, 5 минут, 8 минут, 12 минут, 16 минут, 20 минут и т.п.
Термин «устойчивость к образованию хелатных комплексов» относится к протеазам согласно изобретению, которые сохраняют конкретное количество ферментативной активности в течение определенного периода времени в условиях, преобладающих в процессах протеолиза, гидролиза, очистки или других процессах согласно изобретению, например, при обработке хелатообразующими агентами или при контактировании с такими агентами. В некоторых вариантах изобретения, протеазы сохраняют протеолитическую активность по меньшей мере на 50%, 60%, 70%, 75%, 80%, 85%, 90%, 92%, 95%, 96%, 97%, 98% или на 99% после контактирования с хелатообразующим агентом в течение определенного периода времени, например, по меньшей мере в течение 10 минут, 20 минут, 40 минут, 60 минут, 100 минут и т.п.
Термины «устойчивый к высоким температурам» и «термостабильный» относятся к протеазам согласно изобретению, которые сохраняют конкретное количество ферментативной активности после воздействия на них определенных температур в течение определенного периода времени в условиях, преобладающих в процессах протеолиза, гидролиза, очистки или других процессах согласно изобретению, например, при изменении температур. Изменение температуры включает повышение или снижение температуры. В некоторых вариантах изобретения, протеазы сохраняют протеолитическую активность по меньшей мере на 50%, 60%, 70%, 75%, 80%, 85%, 90%, 92%, 95%, 96%, 97%, 98% или на 99% после изменения температуры в течение определенного периода времени, например, по меньшей мере в течение 60 минут, 120 минут, 180 минут, 240 минут, 300 минут и т.п.
Используемый здесь термин «устойчивость к действию химических веществ» означает стабильность белка (например, фермента) к действию химических веществ, которые негативно влияют на его активность. В некоторых вариантах изобретения, такими химическими веществами являются, но не ограничиваются ими, пероксид водорода, перкислоты, анионные детергенты, катионные детергенты, неионные детергенты, хелатообразующие вещества и т.п. Однако, предусматривается, что настоящее изобретение не ограничивается ни каким-либо конкретным уровнем устойчивости к действию химических веществ, ни интервалом такой устойчивости. В частности, термины «устойчивость к действию детергента» и «устойчивость к действию LAS» относятся к протеазам согласно изобретению, которые сохраняют конкретное количество ферментативной активности после их обработки моющей композицией в течение определенного периода времени в условиях, преобладающих в процессах протеолиза, гидролиза, очистки или других процессах согласно изобретению. В некоторых вариантах изобретения, протеазы сохраняют протеолитическую активность по меньшей мере на 50%, 60%, 70%, 75%, 80%, 85%, 90%, 92%, 95%, 96%, 97%, 98% или на 99% после обработки детергентом в течение определенного периода времени, например, по меньшей мере в течение 60 минут, 120 минут, 180 минут, 240 минут, 300 минут и т.п.
Термин «повышенная стабильность» относится к устойчивости протеаз к окислению, к образованию хелатных комплексов, к изменению температуры и/или к изменению рН, и означает, что данная протеаза сохраняет свою протеолитическую активность в течение определенного периода времени в большей степени, чем другие нейтральные металлопротеазы и/или ферменты дикого типа.
Термин «пониженная стабильность» относится к устойчивости протеаз к окислению, к образованию хелатных комплексов, к изменению температуры и/или к изменению рН, и означает, что данная протеаза сохраняет свою протеолитическую активность в течение определенного периода времени в меньшей степени, чем другие нейтральные металлопротеазы и/или ферменты дикого типа.
Используемый здесь термин «очищающая композиция» включает, если это не оговорено особо, гранулированные или порошкообразные универсальные моющие средства или моющие средства, используемые для трудоемкого режима работы, в частности, чистящие средства; универсальные моющие средства в виде жидкости, геля или пасты, а более конкретно, так называемые жидкости, используемые для трудоемкого режима работы; жидкие моющие средства для тонких легких тканей; средства для ручного мытья посуды или средства для мытья посуды в облегченных условиях, а в частности, сильно вспенивающие средства; средства для мытья посуды в посудомоечной машине, включая различные таблетки, гранулы, жидкости и ополаскивающие средства, предназначенные для их применения в домашних условиях и на предприятиях; жидкие очищающие и дезинфицирующие средства, включая антибактериальные средства для ручной мойки, очищающее мыло, жидкости для полоскания рта, средства для чистки зубов, шампуни для мойки машин или ковров, средства для очистки ванн; шампуни для волос и ополаскиватели для волос; гели для душа и пенистые очистители ванн и металлических поверхностей, а также очищающие добавки, такие как отбеливающие добавки и «палочки для удаления пятен» или средства для предварительной обработки.
Если это не оговорено особо, все количества компонентов или композиций даны как активное количество данного компонента или данной композиции, исключая примеси, например, остаточные растворители или побочные продукты, которые могут присутствовать в коммерчески доступных источниках.
Массы компонентов-ферментов даны в расчете на общее количество активного белка. Все проценты и отношения вычисляют по массе, если это не оговорено особо. Все проценты и отношения вычисляют из расчета всей массы композиции, если это не оговорено особо.
Термин «очищающая активность» означает эффективность очистки, достигаемая протеазой в условиях, преобладающих в процессах протеолиза, гидролиза, очистки или других процессах согласно изобретению. В некоторых вариантах изобретения, эффективность очистки определяют путем проведения различных анализов на выведение пятен, чувствительных к действию ферментов, например, травы, крови, молока или яичного белка, как было определено с применением различных хроматографических, спектрофотометрических или других количественных методов после обработки пятен в стандартных условиях промывки. Репрезентативными анализами являются, но не ограничиваются ими, анализы, описанные в WO 99/34011 и в патенте США No. 6605458 (которые вводятся в настоящее описание посредством ссылки), а также методы, описанные в примерах.
Термин «эффективное очищающее количество» протеазы означает количество протеазы, описанной выше, которое дает желаемый уровень ферментативной активности в конкретной очищающей композиции. Такое эффективное количество может быть легко определено средним специалистом в данной области с учетом многих факторов, таких как конкретно используемая протеаза, применение очищающей композиции, конкретный состав очищающей композиции и тип композиции, то есть, является ли она жидкой или сухой (например, гранулированной, брикетированной) и т.п.
Используемый здесь термин «вспомогательные вещества для очистки» означает любое жидкое, твердое или газообразное вещество, выбранное для получения нужной очищающей композиции конкретного типа и получения определенной формы продукта (например, композиции в виде жидкости, гранул, порошка, брикета, пасты, спрея, таблетки, геля или пены), где указанные вещества также, предпочтительно, являются совместимыми с протеазным ферментом, используемым в данной композиции. В некоторых вариантах изобретения, гранулированные композиции имеют «компактную» форму, а в других вариантах изобретения, жидкие композиции имеют «концентрированную форму».
Используемый здесь термин «система с низкой концентрацией детергентов» включает детергенты, где в промывочной воде присутствует примерно менее, чем 800 м.д. моющих компонентов. Японские детергенты обычно рассматриваются как системы с низкой концентрацией детергентов, поскольку в их промывочной воде обычно присутствует приблизительно 667 м.д. моющих компонентов.
Используемый здесь термин «система со средней концентрацией детергентов» включает детергенты, где в промывочной воде присутствует примерно от 800 м.д. до 2000 м.д. моющих компонентов. Североамериканские детергенты обычно рассматриваются как системы со средней концентрацией детергентов, поскольку в их промывочной воде обычно присутствует приблизительно 975 м.д. моющих компонентов. Бразильские детергенты обычно содержат в промывочной воде приблизительно 1500 м.д. моющих компонентов.
Используемый здесь термин «система с высокой концентрацией детергентов» включает детергенты, где в промывочной воде присутствует более, чем примерно 2000 м.д. моющих компонентов. Европейские детергенты обычно рассматриваются как системы с высокой концентрацией детергентов, поскольку в их промывочной воде присутствует приблизительно 3000-8000 м.д. моющих компонентов.
Используемый здесь термин «композиции для очистки ткани» означает моющие композиции для ручной и машинной стирки, включая дополнительные композиции для стирки и композиции, подходящие для замачивания и/или предварительной обработки загрязненных тканей (например, одежды, льняных тканей и других текстильных материалов).
Используемый здесь термин «композиции для очистки нетканых изделий» охватывает композиции для очистки поверхности нетекстильных изделий (то есть, не тканей), включая, но не ограничиваясь ими, моющие композиции для мытья посуды, композиции для очистки полости рта, композиции для чистки зубов и композиции для личной гигиены.
Используемый здесь термин «компактная» форма очищающих композиций наиболее точно отражает плотность, и с точки зрения состава, количество неорганической соли-наполнителя. Неорганическими солями-наполнителями являются стандартные ингредиенты моющих композиций в порошкообразной форме. В стандартных моющих композициях, соли-наполнители присутствуют в значительном количестве, обычно, 17-35% масс. всей композиции. В противоположность этому, в компактных композициях, соль-наполнитель присутствует в количестве, не превышающем 15% от всей композиции. В некоторых вариантах изобретения, соль-наполнитель присутствует в количестве, не превышающем 10% или более предпочтительно, 5% масс. композиции. В некоторых вариантах изобретения, неорганические соли-наполнители выбраны из солей щелочных и щелочноземельных металлов, таких как сульфаты и хлориды этих металлов. Предпочтительной солью-наполнителем является сульфат натрия.
Подробное описание изобретения
Нейтральные металлоэндопептидазы (то есть, нейтральные металлопротеазы) (EC 3.4.24.4) принадлежат к классу протеаз, которым, для осуществления своей каталитической активности, обязательно требуется присутствие ионов цинка. Эти ферменты обладают оптимальной активностью при нейтральном рН и имеют размер 30-40 кДа. Нейтральные металлопротеиназы связываются с двумя и четырьмя ионами кальция, что обеспечивает структурную стабильность этого белка. Присутствие связанных ионов металла в активном центре металлопротеаз является основным признаком, обеспечивающим активацию молекулы воды. Затем молекула воды начинает действовать как нуклеофил и расщепляет карбонильную группу пептидной связи.
Семейство нейтральных цинк-связывающих металлопротеаз включает бактериальный фермент термолизин и термолизин-подобные протеазы (TLP), а также карбоксипептидазу A (пищеварительный фермент), и металлопротеазы матрикса, которые катализируют реакции ремоделирования и разложения ткани. Из таких протеаз, хорошо охарактеризованной протеазой, в отношении ее стабильности и функций, является только термолизин, который гидролизует белковые связи с амино-концевой стороны гидрофобных аминокислотных остатков. Термолизин представляет собой термостабильную нейтральную цинк-связывающую металлопротеиназу, впервые идентифицированную в культуральном бульоне Bacillus thermoproteolyticus Rokko. Затем аналогичная нейтральная металлопротеаза была идентифицирована в Geobacillus caldoprotelyticus, и этот фермент также называется здесь термолизином. Природные и синтетические протеазы, такие как термолизин, в основном, экспрессируются в Bacillus subtilis (O'Donohue et al., Biochem J, 300:599-603, 1994), и некоторые из них были использованы в моющих композициях для удаления белковых пятен. В настоящее время, термолизин используется в промышленности, а в частности, для ферментативного синтеза метилового эфира N-карбобензокси-1-Asp-1-Phe, то есть, предшественника искусственного подсластителя аспартама. Однако, в основном, сериновые протеазы более широко применяются в моющих средствах, что по меньшей мере частично обусловлено относительной легкостью стабилизации таких протеаз.
Действительно, по ряду причин, металлопротеазы менее часто используются в промышленности, а в частности, при изготовлении моющих средств. Такие ферменты включают более сложные белковые системы, поскольку абсолютно всем этим ферментам, для их стабильности и нормального функционирования, требуются ионы кальция и цинка. Кроме того, моющий раствор, а также вода, используемые при стирке, часто содержат компоненты, препятствующие связыванию ионов с ферментом, или образующие хелатные комплексы с этими ионами, что приводит к снижению или потере протеолитической функции и к дестабилизации протеазы.
Подробное описание очищающих и моющих композиций согласно изобретению
Если это не оговорено особо, все количества компонентов или композиций даны как активное количество данного компонента или данной композиции, исключая примеси, например, остаточные растворители или побочные продукты, которые могут присутствовать в коммерчески доступных источниках. Массы компонентов-ферментов даны в расчете на общее количество активного белка. Все проценты и отношения вычисляют по массе, если это не оговорено особо. Все проценты и отношения вычисляют из расчета общего состава, если это не оговорено особо.
В репрезентативных моющих композициях, уровни ферментов выражены как чистый фермент по массе всей композиции, и если это не оговорено особо, моющие ингредиенты выражены по массе всей композиции.
Очищающие композиции, содержащие нейтральную металлопротеазу
Нейтральные металлопротеазы согласно изобретению могут быть применены для получения различных моющих композиций. Очищающая композиция согласно изобретению может быть преимущественно использована, например, для стирки, очистки твердых поверхностей, автоматического мытья посуды, а также в косметических целях, например, для зубного протезирования, чистки зубов и для ухода за волосами и кожей. Однако, ферменты согласно изобретению, благодаря их уникальным свойствам, таким как повышенная эффективность в растворах при низкой температуре и превосходный профиль устойчивости к окрашиванию, являются идеальными для их использования при стирке, например, при отбеливании ткани. Кроме того, ферменты согласно изобретению могут быть использованы в гранулированных и жидких композициях.
Ферменты согласно изобретению могут быть также использованы во вспомогательных продуктах для очистки. Вспомогательный продукт для очистки, включающий по меньшей мере один фермент согласно изобретению, является идеальным для его применения в промывке, если необходимо еще больше повысить эффективность отбеливания. Такими случаями являются, но не ограничиваются ими, необходимость очистки в растворах при низких температурах. Вспомогательный продукт, в его простейшей форме, может представлять собой один или несколько ферментов, таких как нейтральная металлопротеаза, описанная в настоящем изобретении. В некоторых вариантах изобретения, такой вспомогательный продукт упаковывают в виде унифицированной формы для добавления в процессе очистки, при котором используется источник перекисного соединения и необходимо еще большее повышение эффективности отбеливания. В некоторых вариантах изобретения, разовая унифицированная форма включает гранулы, таблетки, гелевые колпачки или другую унифицированную форму, включая предварительно определенное количество порошка и/или жидкости. В некоторых вариантах изобретения, в указанную композицию, для увеличения ее объема, включают наполнитель(и) и/или носитель(и). Подходящими наполнителями или носителями являются, но не ограничиваются ими, различные соли, такие как сульфат, карбонат и силикат, а также тальк, глина и т.п. В некоторых вариантах изобретения, наполнителями и/или носителями для жидких композиций являются вода и/или низкомолекулярные первичные и вторичные спирты, включая полиолы и диолы. Примерами таких спиртов являются, но не ограничиваются ими, метанол, этанол, пропанол и изопропанол. В некоторых вариантах изобретения, указанные композиции содержат примерно от 5% до 90% таких веществ. В дополнительных вариантах изобретения, для снижения рН композиции используют кислотные наполнители. В некоторых альтернативных вариантах изобретения, очищающая добавка включает по меньшей мере один активированный источник перекисного соединения, описанного ниже, и/или вспомогательные ингредиенты, более подробно описанные ниже.
Для очищающих композиций и очищающих добавок согласно изобретению требуется эффективное количество фермента нейтральной металлопротеазы, описанной в настоящем изобретении. В некоторых вариантах изобретения, необходимый уровень фермента достигается путем добавления нейтральной металлопротеазы одного или нескольких типов, описанных в настоящем изобретении. Обычно, очищающие композиции согласно изобретению включают по меньшей мере 0,0001 масс.%, примерно от 0,0001 до 1, примерно от 0,001 до 0,5 или даже примерно от 0,01 до 0,1 масс.% по меньшей мере одной нейтральной металлопротеазы, описанной в настоящем изобретении.
В некоторых предпочтительных вариантах изобретения, очищающие композиции согласно изобретению обычно приготавливают так, чтобы при их использовании в процессе водной очистки, промывочная вода имела pH примерно от 5,0 до 11,5, или, в альтернативных вариантах, примерно от 6,0 до 10,5. В некоторых предпочтительных вариантах изобретения, этот продукт приготавливают так, чтобы он имел pH в четком интервале значений примерно от 3,0 до 9,0, а в некоторых альтернативных вариантах изобретения, этот продукт приготавливают так, чтобы он имел pH в четком интервале значений примерно от 3 до 5. В некоторых предпочтительных вариантах изобретения, гранулированные продукты для стирки обычно имеют pH примерно от 8 до 11. Способы регуляции pH на рекомендованном уровне включают использование буферов, щелочей, кислот и т.п., и хорошо известны специалистам.
В некоторых особенно предпочтительных вариантах изобретения, если в гранулированной композиции или в жидкости используется по меньшей мере одна нейтральная металлопротеаза, то эта нейтральная металлопротеаза должна иметь форму инкапсулированной частицы для защиты фермента от других компонентов гранулированной композиции в процессе хранения. Кроме того, инкапсулирование также позволяет регулировать доступность нейтральной(ых) металлопротеазы (металлопротеаз) в процессе очистки и может повышать эффективность нейтральной(ых) металлопротеазы (металлопротеаз). Считается, что инкапсулированные нейтральные металлопротеазы согласно изобретению могут быть использованы в различных режимах работы. Также предусматривается, что нейтральная металлопротеаза может быть инкапсулирована с применением любого(ых) подходящего(их) инкапсулирующего(их) материала(ов) и метода(ов), известных специалистам.
В некоторых предпочтительных вариантах изобретения, в инкапсулирующий материал обычно заключена по меньшей мере часть катализатора нейтральной металлопротеазы. В некоторых вариантах изобретения, инкапсулирующий материал является водорастворимым и/или диспергируемым в воде. В некоторых дополнительных вариантах изобретения, инкапсулирующий материал имеет температуру перехода в стеклообразное состояние (Tg) 0ºC или выше (более подробную информацию о температурах перехода в стеклообразное состояние можно найти, например, в заявке WO 97/11151, а в частности, на стр.6, строка 25 - стр. 7, строка 2).
В некоторых вариантах изобретения, инкапсулирующий материал выбирают из углеводов, природных или синтетических смол, хитина и хитозана, целлюлозы и производных целлюлозы, силикатов, фосфатов, боратов, поливинилового спирта, полиэтиленгликоля, парафиновых восков и их комбинаций. В некоторых вариантах изобретения, в которых инкапсулирующим материалом является углевод, такой углевод выбирают из моносахаридов, олигосахаридов, полисахаридов и их комбинаций. В некоторых предпочтительных вариантах изобретения, инкапсулирующим материалом является крахмал (описание некоторых репрезентативных крахмалов можно найти, например, в EP 0922499; и в заявках на патенты США 4977252, 5354559 и 5935826).
В дополнительных вариантах изобретения, инкапсулирующий материал содержит микросферы, полученные из пластика (например, термопластиков, акрилонитрила, метакрилонитрила, полиакрилонитрила, полиметакрилонитрила и их смесей; коммерчески доступными микросферами, которые могут быть применены в данных целях, являются, но не ограничиваются ими, EXPANCEL® [Casco Products, Stockholm, Sweden], PM 6545, PM 6550, PM 7220, PM 7228, EXTENDOSPHERES® и Q-CEL® [PQ Corp., Valley Forge, PA], LUXSIL® и SPHERICELl® [Potters Industries, Inc., Carlstadt, NJ and Valley Forge, PA]).
Способы получения и применения очищающей композиции авторами настоящего изобретения
В некоторых предпочтительных вариантах изобретения, композиции согласно изобретению приготавливают в любой подходящей форме и получают любым способом, выбранным специалистом в области получения таких композиций (некоторые неограничивающие примеры можно найти, например, в патентах США 5879584, 5691297, 5574005, 5569645, 5565422, 5516448, 5489392 и 5486303). В некоторых вариантах изобретения, в которых желательной является очищающая композиция с низким pH, значение pH такой композиции корректируют путем добавления кислотного вещества, такого как HCl.
Вспомогательные вещества
В некоторых вариантах изобретения приводится неограничивающий список вспомогательных веществ, которые могут быть использованы в очищающих композициях согласно изобретению, однако, это не имеет важного значения для осуществления настоящего изобретения. Действительно, в некоторых вариантах изобретения, в очищающие композиции согласно изобретению вводят вспомогательные вещества. В некоторых вариантах изобретения, вспомогательные вещества придают композициям очищающие свойства и/или улучшают такие свойства, стимулируют и/или улучшают обработку очищаемого субстрата и/или улучшают внешний вид очищающей композиции (например, отдушки, окрашивающие вещества, красители и т.п.). Следует отметить, что такие вспомогательные вещества используются в дополнение к нейтральным металлопротеазам согласно изобретению. Конкретная природа таких дополнительных компонентов и уровни их включения зависят от физической формы композиции и от целей проведения процедуры очистки. Подходящими вспомогательными веществами являются, но не ограничиваются ими, поверхностно-активные вещества, модифицирующие добавки, хелатообразующие агенты; агенты, ингибирующие перенос красителя; средства, стимулирующие образование осадка; диспергирующие вещества, дополнительные ферменты и стабилизаторы ферментов, каталитические вещества, активаторы отбеливания, усилители отбеливания, пероксид водорода, источники пероксида водорода, предварительно полученные перкислоты, полимерные диспергирующие агенты; агенты, удаляющие пятна глины/агенты, препятствующие повторному осаждению, отбеливатели, ингибиторы образования мыльной пены, красители, отдушки, агенты, придающие структуре эластичность, мягчители ткани, носители, гидротропы, стимуляторы обработки и/или пигменты. Помимо агентов, конкретно описанных в настоящем изобретении, имеются и другие примеры агентов, известные специалистам (см., например, патенты США №№ 5576282, 6306812 Bl и 6326348 Bl). В некоторых вариантах изобретения, вышеупомянутые вспомогательные ингредиенты добавляют в количестве, недостающем до общего объема очищающей композиции согласно изобретению.
Поверхностно-активные вещества - В некоторых вариантах изобретения, очищающие композиции согласно изобретению включают по меньшей мере одно поверхностно-активное вещество или систему поверхностно-активных веществ, где указанное поверхностно-активное вещество выбирают из неионогенных поверхностно-активных веществ, анионогенных поверхностно-активных веществ, катионогенных поверхностно-активных веществ, амфолитических поверхностно-активных веществ, цвиттерионных поверхностно-активных веществ, полуполярных неионогенных поверхностно-активных веществ и их смесей. В некоторых вариантах очищающих композиций с низким рН (например, композиций, имеющих рН в четком диапазоне значений примерно от 3 до 5), такая композиция обычно не содержит этоксилированного алкилсульфата, поскольку предполагается, что такое поверхностно-активное вещество может гидролизоваться в кислотных композициях.
В некоторых вариантах изобретения, поверхностно-активное вещество присутствует в количестве примерно от 0,1% до 60%, в альтернативных вариантах изобретения, такое количество составляет примерно от 1% до 50%, а в других вариантах изобретения, это количество составляет примерно от 5% до 40% масс. очищающей композиции.
Модифицирующие добавки - В некоторых вариантах изобретения, очищающие композиции согласно изобретению содержат одну или несколько модифицирующих моющих добавок или систем таких модифицирующих добавок. В некоторых вариантах изобретения, включающих по меньшей мере одну модифицирующую добавку, очищающие композиции содержат по меньшей мере примерно 1%, примерно от 3% до 60% или даже примерно от 5% до 40% модифицирующих добавок по массе очищающей композиции.
Модифицирующими добавками являются, но не ограничиваются ими, полифосфатные соли щелочного металла, аммония и алкиламмония, силикаты щелочного металла, карбонаты щелочноземельных и щелочных металлов, алюмосиликатные модифицирующие добавки, поликарбоксилатные соединения, гидроксиполикарбоксилаты эфиров, сополимеры малеинового ангидрида и этилена или винилметилового эфира, 1,3,5-тригидроксибензол-2,4,6-трисульфоновая кислота и карбоксиметилоксиянтарная кислота, соли различных щелочных металлов, аммония и замещенного аммония и полиуксусных кислот, таких как этилендиаминтетрауксусная кислота и нитрилотриуксусная кислота, а также поликарбоксилаты, такие как меллитовая кислота, янтарная кислота, лимонная кислота, оксидиянтарная кислота, полималеиновая кислота, бензол-1,3,5-трикарбоновая кислота, карбоксиметилоксиянтарная кислота и их растворимые соли. Действительно, считается, что в различных вариантах настоящего изобретения может быть использована любая подходящая модифицирующая добавка.
Хелатообразующие агенты - В некоторых вариантах изобретения, очищающие композиции согласно изобретению содержат по меньшей мере один хелатообразующий агент. Подходящими хелатообразующими агентами являются, но не ограничиваются ими, агенты, образующие хелатный комплекс с медью, железом и/или марганцом, и их смеси. В тех вариантах изобретения, в которых используются по меньшей мере один хелатообразующий агент, очищающие композиции согласно изобретению содержат примерно от 0,1% до 15% или даже примерно от 3,0% до 10% хелатообразующего агента по массе рассматриваемой очищающей композиции.
Стимулятор осаждения - В некоторых вариантах изобретения, очищающие композиции согласно изобретению содержат по меньшей мере один стимулятор осаждения. Подходящими стимуляторами осаждения являются, но не ограничиваются ими, полиэтиленгликоль, полипропиленгликоль, поликарбоксилат, грязеотталкивающие полимеры, такие как политерефталевая кислота, глины, такие как каолинит, монтмориллонит, атапульгит, иллит, бентонит, галлоизит и их смеси.
Агенты, ингибирующие перенос красителя - В некоторых вариантах изобретения, очищающие композиции согласно изобретению включают один или несколько агентов, ингибирующих перенос красителя. Подходящими полимерными агентами, ингибирующими перенос красителя, являются, но не ограничиваются ими, поливинилпирролидоновые полимеры, полимеры N-оксида полиамина, сополимеры N-винилпирролидона и N-винилимидазола, поливинилоксазолидоны и поливинилимидазолы или их смеси.
В тех вариантах, в которых используется по меньшей мере один агент, ингибирующий перенос красителя, очищающие композиции согласно изобретению содержат примерно от 0,0001% до 10%, примерно от 0,01% до 5% или даже примерно от 0,1% до 3% такого агента по массе очищающей композиции.
Диспергирующие агенты - В некоторых вариантах изобретения, очищающие композиции согласно изобретению содержат по меньшей мере один диспергирующий агент. Подходящими водорастворимыми органическими веществами являются, но не ограничиваются ими, гомо- или сополимерные кислоты или их соли, в которых поликарбоновая кислота содержит по меньшей мере два карбоксильных радикала, отделенных друг от друга не более, чем двумя атомами углерода.
Ферменты - В некоторых вариантах изобретения, очищающие композиции согласно изобретению содержат один или несколько ферментов, обладающих детергентными свойствами и придающих данной композиции очищающие свойства и/или свойства, позволяющие осуществлять уход за тканью. Примерами подходящих ферментов являются, но не ограничиваются ими, гемицеллюлазы, пероксидазы, протеазы, целлюлазы, ксиланазы, липазы, фосфолипазы, эстеразы, кутиназы, пектиназы, кератиназы, редуктазы, оксидазы, фенолоксидазы, липоксигеназы, лигниназы, пуллуланазы, танназы, пентозаназы, маланазы, β-глюканазы, арабинозидазы, гиалуронидаза, хондроитиназа, лакказа и амилазы или их смеси. В некоторых вариантах изобретения используется комбинация ферментов (то есть, «коктейль»), содержащая обычно применяемые ферменты, такие как протеаза, липаза, кутиназа и/или целлюлаза в комбинации с амилазой.
Стабилизаторы ферментов - В некоторых вариантах изобретения, ферменты, используемые в моющих композициях согласно изобретению, являются стабилизированными. При этом, предусматривается, что в настоящем изобретении могут быть применены различные методы стабилизации ферментов. Так, например, в некоторых вариантах изобретения, стабилизация используемых ферментов достигается благодаря присутствию в конечных композициях водорастворимых источников ионов цинка (II), кальция (II) и/или марганца (II), которые передают ферментам указанные ионы, а также ионы других металлов (например, бария (II), скандия (II), железа (II), марганца (II), алюминия (III), олова (II), кобальта (II), меди (II), никеля (II) и оксованадия (IV)).
Каталитические комплексы металлов - В некоторых вариантах изобретения, очищающие композиции согласно изобретению содержат один или несколько каталитических комплексов металлов. В некоторых вариантах изобретения может быть использован металл-содержащий катализатор отбеливания. В некоторых предпочтительных вариантах изобретения, металл-содержащий катализатор отбеливания содержит каталитическую систему, включающую катион переходного металла, обладающий определенной каталитической активностью отбеливания (например, катионы меди, железа, титана, рутения, вольфрама, молибдена или марганца), вспомогательный катион металла, обладающий незначительной каталитической активностью отбеливания или вообще не обладающий такой активностью (например, катионы цинка или алюминия), а для каталитических и вспомогательных катионов металлов используется секвестрант, имеющий определенные константы стабильности, а в частности, этилендиаминтетрауксусная кислота, этилендиаминтетра(метиленфосфоновая кислота) и их водорастворимые соли (см., например, патент США 4430243).
В некоторых вариантах изобретения, катализ очищающих композиций согласно изобретению осуществляют с использованием соединений марганца. Такие соединения и используемые их количества хорошо известны специалистам (см., например, патент США 5576282).
В дополнительных вариантах изобретения, в очищающих композициях согласно изобретению могут быть использованы кобальтовые катализаторы отбеливания. Различные кобальтовые катализаторы отбеливания известны специалистам (см., например, патенты США 5597936 и 5595967). Такие кобальтовые катализаторы могут быть легко получены известными методами (см., например, патенты США 5597936 и 5595967).
В дополнительных вариантах изобретения, очищающие композиции согласно изобретению включают комплекс переходного металла и макрополициклического жесткого лиганда («MRL»). В некоторых практических, но не ограничивающих вариантах изобретения, композиции и способы очистки согласно изобретению могут быть скорректированы так, чтобы в водной промывочной среде содержалось примерно по меньшей мере одна часть на сто миллионов активных молекул MRL, а в некоторых предпочтительных вариантах изобретения, в промывочной жидкости должно содержаться примерно от 0,005 м.д. до 25 м.д., более предпочтительно, примерно от 0,05 м.д. до 10 м.д., а наиболее предпочтительно, примерно от 0,1 м.д. до 5 м.д. MRL.
Предпочтительными переходными металлами в катализаторе отбеливания на основе переходного металла согласно изобретению являются, но не ограничиваются ими, марганец, железо и хром. Предпочтительными MRL также являются, но не ограничиваются ими, специальные сверхжесткие лиганды, перекрестно связанные мостиковыми связями (например, 5,12-диэтил-1,5,8,12-тетраазабицикло[6.6.2]гексадекан). Подходящие MRL на основе переходного металла могут быть легко получены известными методами (см., например, WO 00/32601 и патент США 6225464).
Способы получения и применения очищающих композиций
Очищающие композиции согласно изобретению приготавливают в любой подходящей форме и получают любым подходящим способом, выбранным специалистом в данной области (некоторые неограничивающие примеры описаны, например, в патентах США 5879584, 5691297, 5574005, 5569645, 5565422, 5516448, 5489392, 5486303, 4515705, 4537706, 4515707, 4550862, 4561998, 4597898, 4968451, 5565145, 5929022, 6294514 и 6376445, которые вводятся в настоящее описание посредством ссылки).
Метод применения
В предпочтительных вариантах изобретения, очищающие композиции согласно изобретению могут быть использованы для очистки поверхностей и/или тканей. В некоторых вариантах изобретения, по меньшей мере часть поверхности и/или ткани подвергают контактированию по меньшей мере с одним вариантом очищающих композиций согласно изобретению в чистом виде или в форме, разведенной в промывочной жидкости, а затем поверхность и/или ткань необязательно промывают и/или ополаскивают. В соответствии с настоящим изобретением, термин «промывка» включает, но не ограничивается ими, чистку щеткой и механическую обработку. В некоторых вариантах изобретения, термин «ткань» включает любую ткань, подвергаемую стирке в условиях, приемлемых для обычного потребителя. В предпочтительных вариантах изобретения, очищающие композиции согласно изобретению используют в растворе в концентрации примерно от 500 м.д. до 15000 м.д. В некоторых вариантах изобретения, в которых промывочным растворителем является вода, температура воды обычно составляет примерно от 5ºC до 90ºC. В некоторых предпочтительных вариантах очистки ткани, массовое отношение «вода:ткань» обычно составляет примерно от 1:1 до 30:1.
Экспериментальная часть
Нижеследующие примеры представлены в целях описания и дополнительной иллюстрации некоторых предпочтительных вариантов и аспектов настоящего изобретения и не должны рассматриваться как ограничение объема изобретения.
В описании экспериментов приводятся следующие сокращения: °С (градусы Цельсия); об/мин (обороты в минуту); H2O (вода); HCl (соляная кислота); а.к. и A.К. (аминокислота); п.о. или п.н. (пары оснований или пары нуклеотидов); т.п.н. (тысяча пар нуклеотидов); кД (килодальтон); г (граммы); мкг (микрограммы); мг (миллиграммы); нг (нанограммы); мкл (микролитры); мл (миллилитры); мм (миллиметры); нм (нанометры); мкм (микрометры); M (моль); мM (миллимоль); мкM (микромоль); ед. (единицы); В (вольт); MW (молекулярная масса); сек. (секунды); мин. (минута/минуты); ч (час) (час/часы); MgCl2 (хлорид магния); NaCl (хлорид натрия); OD280 (оптическая плотность на 280 нм); OD405 (оптическая плотность на 405 нм); OD600 (оптическая плотность на 600 нм); ПААГ (электрофорез в полиакриламидном геле); EtOH (этанол); PBS (забуференный фосфатом физиологический раствор [150 мМ NaCl, 10 мМ натрийфосфатного буфера, pH 7,2]); LAS (лаурилсульфонат натрия); ДСН (додецилсульфат натрия); трис (трис(гидроксиметил)аминометан); TAED (N,N,N'N'-тетраацетилэтилендиамин); BES (сульфон полиэфиров); MES (моногидрат 2-морфолиноэтансульфоновой кислоты; f.w. (f.w. = полная масса) 195,24; Sigma # M-3671); CaCl2 (хлорид кальция, безводный; f.w. 110,99; Sigma # C-4901); ДМФ (N,N-диметилформамид, f.w. 73,09, d=0,95); Abz-AGLA-Nba (2-аминобензоил-L-аланил-глицил-L-лейцил-L-аланино-4-нитробензиламид, f.w. 583,65; Bachem # H-6675, VWR catalog # 100040-598); SBG1% (сверхконцентрированный бульон с глюкозой; 6 г Soytone [Difco], 3 г дрожжевого экстракта, 6 г NaCl, 6 г глюкозы); pH был скорректирован до 7,1 путем добавления NaOH для стерилизации с применением известных методов; масс/об (масса к объему); об/об (отношение объемов); SEQUEST® (программа поиска в базе данных SEQUEST, Вашингтонский университет); МС (масс-спектроскопия); BMI (кровь, молоко, чернила); SRI (показатель удаления пятен); Npr и npr (ген нейтральной металлопротеазы); Npr и npr (фермент нейтральная металлопротеаза); NprE и nprE (нейтральная металлопротеаза B. amyloliquefaciens); PrT и prt (фермент протеиназа-Т); и TLP (термолизин-подобная протеаза).
Ниже приводятся аббревиатуры для компаний, продукты или оборудование которых могут быть упомянуты в экспериментальных примерах: TIGR (The Institute for Genomic Research, Rockville, MD); AATCC (American Association of Textile and Coloring Chemists); Amersham (Amersham Life Science, Inc. Arlington Heights, IL); Corning (Corning International, Corning, NY); ICN (ICN Pharmaceuticals, Inc., Costa Mesa, CA); Pierce (Pierce Biotechnology, Rockford, IL); Equest (Equest, Warwick International Group, Inc., Flintshire, UK); EMPA (Eidgenossische Material Prufungs und Versuch Anstalt, St. Gallen, Switzerland); CFT (Center for Test Materials, Vlaardingen, The Netherlands); Amicon (Amicon, Inc., Beverly, MA); ATCC (American Type Culture Collection, Manassas, VA); Becton Dickinson (Becton Dickinson Labware, Lincoln Park, NJ); Perkin-Elmer (Perkin-Elmer, Wellesley, MA); Rainin (Rainin Instrument, LLC, Woburn, MA); Eppendorf (Eppendorf AG, Hamburg, Germany); Waters (Waters, Inc., Milford, MA); Perseptive Biosystems (Perseptive Biosystems, Ramsey, MN); Molecular Probes (Molecular Probes, Eugene OR); BioRad (BioRad, Richmond, CA); Clontech (CLONTECH Laboratories, Palo Alto, CA); Cargill (Cargill, Inc., Minneapolis, MN); Difco (Difco Laboratories, Detroit, MI); GIBCO BRL или Gibco BRL (Life Technologies, Inc., Gaithersburg, MD); New Brunswick (New Brunswick Scientific Company, Inc., Edison, NJ); Thermoelectron (Thermoelectron Corp., Waltham, MA); BMG (BMG Labtech, GmbH, Offenburg, Germany); Greiner (Greiner Bio-One, Kremsmuenster, Austria); Novagen (Novagen, Inc., Madison, WI); Novex (Novex, San Diego, CA); Finnzymes (Finnzymes OY, Finland) Qiagen (Qiagen, Inc., Valencia, CA); Invitrogen (Invitrogen Corp., Carlsbad, CA); Sigma (Sigma Chemical Co., St. Louis, MO); DuPont Instruments (Asheville, NY); Global Medical Instrumentation или GMI (Global Medical Instrumentation; Ramsey, MN); MJ Research (MJ Research, Waltham, MA); Infors (Infors AG, Bottmingen, Switzerland); Stratagene (Stratagene Cloning Systems, La Jolla, CA); Roche (Hoffmann La Roche, Inc., Nutley, NJ); Agilent (Agilent Technologies, Palo Alto, CA); S-Matrix (S-Matrix Corp., Eureka, CA); US Testing (United States Testing Co., Hoboken, NY); West Coast Analytical Services (West Coast Analytical Services, Inc., Santa Fe Springs, CA); Ion Beam Analysis Laboratory (Ion Bean Analysis Laboratory, The University of Surrey Ion Beam Centre (Guildford, UK); BaChem (BaChem AG, Bubendorf, Switzerland); Molecular Devices (Molecular Devices, Inc., Sunnyvale, CA); MicroCal (Microcal, Inc., Northhampton, MA); Chemical Computing (Chemical Computing Corp., Montreal, Canada); NCBI (National Center for Biotechnology Information, Bethesda, MD); Argo Bioanalytica (Argo Bioanalytica. Inc, New Jersey); Vydac (Grace Vydac, Hesperia, CA); Minolta (Konica Minolta, Ramsey, NJ); Zeiss (Carl Zeiss, Inc., Thornwood, NY); Sloning BioTechnology GmbH (Puchheim, Germany); и Procter and Gamble (Cincinnati, OH).
ПРИМЕР 1
Анализы
В описанных ниже примерах были осуществлены следующие анализы. Любые отклонения от описанных ниже протоколов указаны в примерах. В этих экспериментах, для измерения оптической плотности продуктов, образующихся после завершения реакций, был использован спектрофотометр.
A. Анализ Брэдфорда для определения содержания белка в 96-луночных планшетах
Для определения концентрации белка в образцах термолизина на микротитрационном планшете (МТП) проводили анализ с использованием реагента-красителя Брэдфорда (Quick Start).
В этой аналитической системе использовали следующие растворы химических веществ и реагентов:
реагент-краситель Брэдфорда (Bradford Quick Start Dye Reagent™) (BIO-RAD Catalogue No. 500-0205)
буфер для разведения (10 мM NaCl, 0,1 мM CaCl2, 0,005% твин®-80).
В данном анализе использовали следующее оборудование: роботизированное устройство Biomek FX Robot (Beckman Coulter) и MTП-ридер SpectraMAX (типа 340; Molecular Devices). МТП были получены от Costar (типа 9017).
В данном анализе, в каждую лунку пипеткой добавляли 200 мкл реагента-красителя Брэдфорда, а затем добавляли 15 мкл буфера для разведения. И наконец, в лунки добавляли 10 мкл отфильтрованных супернатантов культуры, содержащих термолизин. После тщательного смешивания, МТП инкубировали в течение по меньшей мере 10 минут при комнатной температуре. Пузырьки воздуха, которые могут присутствовать, удаляли и оптическую плотность лунок считывали на 595 нм.
Для определения концентрации белка, фоновую величину (то есть, от неинокулированных лунок) вычитали из величины, полученной для образца. Полученные величины OD595 являлись относительными показателями содержания белка в образцах. Результаты анализа Брэдфорда соответствовали концентрации белка термолизина в интервале от 10 до 100 мкг белка на мл.
B. Анализ микрообразцов ткани, проводимый для оценки эффективности протеазы
Эффективность термолизина и его вариантов в удалении пятен определяли с использованием микрообразцов (EMPA 116) на МТП. Образцы, содержащие протеазу термолизин, были получены из отфильтрованного бульона культур, выращенных в микротитрационных планшетах в течение 3 дней при 37°С со встряхиванием при 280 об/мин в условиях аэрации с повышенной влажностью.
В этой аналитической системе использовали следующие растворы химических веществ и реагентов:
супернатанты культуры, содержащей термолизин (~100 - 200 мкг белка на мл).
Детергент TIDE® 2X (без ферментов) (P&G).
Буфер для разведения (10 мM NaCl, 0,1 мM CaCl2, 0,005% твин®-80).
В данном анализе использовали следующее оборудование: роботизированное устройство Biomek FX Robot (Beckman Coulter) и MTП-ридер SpectraMAX (типа 340; Molecular Devices) и инкубатор/шейкер iEMS (Thermo/Labsystems). МТП были получены от Costar (типа 9017).
Получение жидкого детергента TIDE® 2X (условия, применяемые в США)
Воду Milli-Q доводили до значения жесткости воды 6 Грейн/галлон с использованием раствора (Ca/Mg 3:1) для определения жесткости воды по Стоксу (282,3 г/л CaCl2 · 2H20, 130,1 г/л MgCl2 · 6H2O), а затем добавляли 0,78 г/л детергента TIDE® 2X, и раствор детергента интенсивно перемешивали по меньшей мере в течение 15 минут. Затем добавляли 5 мM HEPES и pH доводили до 8,2.
Микрообразцы
Микрообразцы, имеющие круговой диаметр 1/4 дюйма, были получены от CFT (Vlaardingen, The Netherlands). Перед разрезанием образцов, ткань (EMPA 116) предварительно промывали в деионизованной воде в течение 20 минут при температуре окружающей среды, а затем сушили воздухом.
Два микрообразца вертикально помещали в каждую лунку 96-луночного микротитрационного планшета для обработки всей площади поверхности (то есть, не клали на дно лунки в горизонтальном положении).
Тест-метод
Инкубатор устанавливали на температуру 20°C. Отфильтрованные образцы культурального бульона тестировали в соответствующей концентрации путем разведения смесью 10 мМ NaCl, 0,1 мМ CaCl2, 0,005% раствора Твин®-80. Раствор детергента получали как описано выше. Затем в каждую лунку МТП, содержащего микрообразцы, добавляли 190 мкл раствора детергента. К этой смеси в каждую лунку добавляли 10 мкл разведенного раствора фермента (до общего объема 200 мкл/лунку). МTP покрывали материалом для заклеивания планшетов и помещали в инкубатор на 30 минут при 20°C с перемешиванием при 1400 об/мин. (инкубатор iEMS). После инкубирования в соответствующих условиях, из каждой лунки брали 100 мкл раствора и помещали в новый МТП. Затем этот MTP, содержащий l00 мкл раствора/лунку, считывали на 405 нм в MTП-ридере. В этом тесте также использовали контроль-«пустышку», содержащий 2 микрообразца/лунку и детергент, но не содержащий образцов, включающих термолизин.
Определение эффективности удаления BMI (крови/молока/чернил):Наблюдаемая величина оптической плотности была скорректирована на величину, полученную для контроля (величину, полученную после инкубирования микрообразцов без добавления фермента). Полученная оптическая плотность является показателем гидролитической активности. Для каждого образца (термолизина или его варианта) вычисляли показатель эффективности (PI). Показатель эффективности определяли путем сравнения эффективности данного варианта (фактическое значение) и стандартного фермента термолизина (теоретическое значение) при той же самой концентрации белка. Кроме того, были вычислены теоретические значения с использованием параметров лангмюровского уравнения для стандартного фермента.
Показатель эффективности более 1 (PI>1) означает, что данный вариант является более эффективным (по сравнению со стандартом [например, дикого типа]); PI, равный 1 (PI=1), означает, что данный вариант имеет такую же эффективность, как и стандарт; а PI менее 1 (PI<1) означает, что данный вариант является менее эффективным, чем стандарт. Таким образом, PI позволяет идентифицировать предпочтительные варианты, а также варианты, которые, в некоторых случаях, являются менее желательными для их использования.
C. Анализ на стабильность в присутствии детергента
Стабильность термолизина и его вариантов определяли после инкубирования в определенных условиях в присутствии детергента 25% TIDE® 2X. Была определена исходная и остаточная активность.
В этой аналитической системе использовали следующие растворы химических веществ и реагентов:
Супернатанты культуры, содержащей термолизин (~100 - 200 мкг белка на мл);
Жидкий детергент TIDE® 2X, содержащий и не содержащий хелатообразующий агент DTPA (P&G);
Раствор детергента 27,5% TIDE® 2X с DTPA в 5,5 мМ буфера HEPES, pH 8,2 (TIDE® + раствор);
Раствор детергента 27,5% TIDE® 2X в отсутствии DTPA в 5,5 мМ буфера HEPES, pH 8,2 (TIDE®-раствор);
MES-буфер для анализа (55,5 мМ MES/NaOH, 2,6 мМ CaCl2, 0,005% твин®-80, pH 6,5).
В данном эксперименте использовали следующее оборудование: роботизированное устройство Biomek FX Robot (Beckman Coulter), флуоресцентный спектрофотометр (FLUOstar Optima; BMG), инкубатор/шейкер iEMS (Thermo/Labsystems). МТП получали от Costar (типа 9017) и от Greiner (черный планшет, типа 655076).
Тест-метод
Условия в отсутствии стресса
Сначала, 20 мкл термолизин-содержащего супернатанта культуры разводили в 180 мкл аналитического MES-буфера. Затем, 20 мкл разведенного супернатанта снова разводили в 180 мкл аналитического MES-буфера. После этого 10 мкл такого разведения переносили в 190 мкл раствора AGLA-субстрата в предварительно нагретый планшет (Greiner 655076) при 25°C. Все присутствующие пузырьки воздуха удаляли, и планшет анализировали в соответствии с описанным ниже протоколом анализа на AGLA-протеазу.
Условия стресса
Сначала, 20 мкл супернатанта культуры разводили в 180 мкл 27,5% TIDE® + раствор детергента и помещали в шейкер iEMS. Планшет, покрытый материалом для заклеивания планшетов, инкубировали в течение 60 минут при 32°C и при 900 об/мин. Кроме того, 20 мкл супернатанта культуры разводили в 180 мкл 27,5% TIDE® - раствор детергента и помещали в шейкер iEMS. Этот планшет, покрытый материалом для заклеивания планшетов, инкубировали в течение 180 минут при 50°C и при 900 об/мин.
Затем, после соответствующего инкубирования, 20 мкл любого из этих растворов разводили в 180 мкл аналитического MES-буфера, и 10 мкл такого разведения разводили в 190 мкл раствора AGLA-субстрата в предварительно нагретом планшете (Greiner 655076) при 25°C. Все присутствующие пузырьки воздуха удаляли, и планшет анализировали в соответствии с описанным ниже протоколом анализа на AGLA-протеазу.
Оценка стабильности TIDE® 2X
Измерение флуоресценции осуществляли на длине волны возбуждения 350 нм и на длине волны излучения 420 нм. С помощью спектрофотометрической компьютерной программы вычисляли скорости реакции (=наклон кривой) увеличения флуоресценции для каждой лунки по отношению к линии линейной регрессии (милли-)ОЕФ/мин. Отношение остаточной и исходной AGLA-активности использовали для выражения стабильности 25% TIDE® 2X по следующей формуле:
Процент остаточной активности = [кривая в условиях стресса] * 100 /[кривая в отсутствии стресса]
Для каждого образца (термолизина и его вариантов), показатель эффективности вычисляли путем деления величины остаточной активности варианта на величину остаточной активности термолизина. Стабильность варианта и стандартного фермента термолизина (например, дикого типа или родительского фермента) сравнивали по показателям эффективности, определенным в одних и тех же условиях.
Показатель эффективности (PI) более 1 (PI>1) означает, что данный вариант является более стабильным (по сравнению со стандартом [например, дикого типа]); PI, равный 1 (PI=1), означает, что данный вариант обладает такой же стабильностью, как и стандарт; а PI менее 1 (PI<1) означает, что данный вариант является менее стабильным, чем стандарт. Таким образом, PI позволяет идентифицировать предпочтительные варианты, а также варианты, которые, в некоторых случаях, являются менее желательными для их использования.
D. Анализ на 2-аминобензоил-L-аланил-L-глицил-L-лейцил-L-аланино-4-нитробензиламид(Abz-AGLA-Nba)-протеазу
Описанный здесь метод обеспечивает соответствующий уровень технической точности, который позволяет получить воспроизводимые данные анализа на протеазу независимо от времени и места их получения. Хотя такой анализ может быть адаптирован для данных лабораторных условий, однако любые данные, полученные с применением модифицированной процедуры, должны быть приведены в соответствие с результатами, полученными исходным методом. Нейтральные металлопротеазы расщепляют пептидную связь между глицилом и лейцилом 2-аминобензоил-L-аланил-L-глицил-L-лейцил-L-аланино-4-нитробензиламида (Abz-AGLA-Nba). Свободный 2-аминобензоил-L-аланилглицин (Abz-AG) в растворе имеет максимальное флуоресцентное излучение на 415 нм, и максимальное возбуждение флуоресценции на 340 нм. Флуоресценцию Abz-AG гасили добавлением нитробензиламида в интактной молекуле Abz-AGLA-Nba.
В этих экспериментах, мониторинг высвобождения Abz-AG путем расщепления Abz-AGLA-Nba протеазой осуществляли с помощью флуоресцентной спектрометрии (возб. 350/изл. 420). Скорость появления Abz-AG служила показателем протеолитической активности.
В этой аналитической системе использовали следующие растворы химических веществ и реагентов:
буфер для MES-субстрата - 52,5 мМ MES, 2,5 мМ CaCl2, 0,005% твин®-80, pH 6,5;
аналитический MES-буфер - 55,5 мМ MES, 2,6 мМ CaCl2, 0,005% твин®-80, pH 6,5;
маточный раствор Abz-AGLA-Nba - 48 мМ Abz-AGLA-Nba в диметилформамиде (28,2 мг/мл ДМФ).
В данном эксперименте использовали следующее оборудование: роботизированное устройство Biomek FX Robot (Beckman Coulter), спектрофотометр (FLUOstar Optima; BMG), инкубатор/шейкер iEMS (Thermo/Labsystems) и инкубатор Innova (Innova-4230; New Brunswick). МТП получали от Costar (типа 9017) и от Greiner (черный планшет, типа 655076).
Тест-метод
Аналитический раствор Abz-AGLA-Nba получали путем добавления 1 мл маточного раствора Abz-AGLA-Nba к 19 мл буфера для MES-субстрата и тщательно перемешивали в течение по меньшей мере 2 минут. Затем супернатанты культуры, содержащие термолизин или его варианты, разводили аналитическим MES-буфером до концентрации 1-6 мкг белка на мл.
Анализ осуществляли путем добавления в каждую лунку 10 мкл разведенного раствора протеазы, с последующим добавлением 190 мкл аналитического раствора Abz-AGLA-Nba, который был предварительно уравновешен в течение по меньшей мере 15 минут при 25°C. Полученные растворы интенсивно перемешивали, и проводили мониторинг высвобождения Abz-AG, осуществляемого посредством расщепления протеазой, с помощью флуоресцентной спектрометрии при 25°C в кинетическом режиме с возбуждением на длине волны 350 нм и излучением на длине волны 420 нм. Скорость появления Abz-AG служила показателем протеолитической активности в данных образцах. Протеазную активность выражали в ОЕФ (относительных единицах флуоресценции · мин-1).
ПРИМЕР 2
Продуцирование термолизина в B. subtilis
В этом примере описаны эксперименты, которые проводили в целях продуцирования термолизина в B. subtilis. Полноразмерный термолизин Geobacillus caldoproteolyticus более, чем на 99% идентичен термолизину-предшественнику Bacillus thermoproteolyticus Rokko, и бациллолизину-предшественнику (NprS) Bacillus stearothermophilus. Поэтому, термины «термолизин», «бациллолизин», «протеиназа-Т» и «PrT» являются взаимозаменяемыми и означают фермент нейтральную металлопротеазу G. caldoproteolyticus. Ниже представлена последовательность ДНК (лидерная последовательность термолизина, про-последовательность термолизина и зрелая последовательность термолизина Geobacillus caldoproteolyticus), кодирующая белок-предшественник термолизина:
ATGAAAATGAAAATGAAATTAGCATCGTTTGGTCTTGCAGCAGGACTAGCGGCCCA AGTATTTTTACCTTACAATGCGCTGGCTTCAACGGAACACGTTACATGGAACCAACA ATTTCAAACCCCTCAATTCATCTCCGGTGATCTGCTGAAAGTGAATGGCACATCCCC AGAAGAACTCGTCTATCAATATGTTGAAAAAAACGAAAACAAGTTTAAATTTCATG AAAACGCTAAGGATACTCTACAATTGAAAGAAAAGAAAAATGATAACCTTGGTTTT ACGTTTATGCGCTTCCAACAAACGTATAAAGGGATTCCTGTGTTTGGAGCAGTAGTA ACTGCGCACGTGAAAGATGGCACGCTGACGGCGCTATCAGGGACACTGATTCCGAA
TTTGGACACGAAAGGATCCTTAAAAAGCGGGAAGAAATTGAGTGAGAAACAAGCG CGTGACATTGCTGAAAAAGATTTAGTGGCAAATGTAACAAAGGAAGTACCGGAATA TGAACAGGGAAAAGACACCGAGTTTGTTGTTTATGTCAATGGGGACGAGGCTTCTT TAGCGTACGTTGTCAATTTAAACTTTTTAACTCCTGAACCAGGAAACTGGCTGTATA TCATTGATGCCGTAGACGGAAAAATTTTAAATAAATTTAACCAACTTGACGCCGCA AAACCAGGTGATGTGAAGTCG ATAACAGGAACATCAACTGTCGGAGTGGGAAGA GGAGTACTTGGTGATCAAAAAAATATTAATACAACCTACTCTACGTACTACTAT TTACAAGATAATACGCGTGGAAATGGGATTTTCACGTATGATGCGAAATACCG TACGACATTGCCGGGAAGCTTATGGGCAGATGCAGATAACCAATTTTTTGCGA GCTATGATGCTCCAGCGGTTGATGCTCATTATTACGCTGGTGTGACATATGACT ACTATAAAAATGTTCATAACCGTCTCAGTTACGACGGAAATAATGCAGCTATTA GATCATCCGTTCATTATAGCCAAGGCTATAATAACGCATTTTGGAACGGTTCGC AAATGGTGTATGGCGATGGTGATGGTCAAACATTTATTCCACTTTCTGGTGGTA TTGATGTGGTCGCACATGAGTTAACGCATGCGGTAACCGATTATACAGCCGGA CTCATTTATCAAAACGAATCTGGTGCAATTAATGAGGCAATATCTGATATTTTT GGAACGTTAGTCGAATTTTACGCTAACAAAAATCCAGATTGGGAAATTGGAGA GGATGTGTATACACCTGGTATTTCAGGGGATTCGCTCCGTTCGATGTCCGATC CGGCAAAGTATGGTGATCCAGATCACTATTCAAAGCGCTATACAGGCACGCAA GATAATGGCGGGGTTCATATCAATAGCGGAATTATCAACAAAGCCGCTTATTT GATTAGCCAAGGCGGTACGCATTACGGTGTGAGTGTTGTCGGAATCGGACGCG ATAAATTGGGGAAAATTTTCTATCGTGCATTAACGCAATATTTAACACCAACGT CCAACTTTAGCCAACTTCGTGCTGCCGCTGTTCAATCAGCCACTGACTTGTACG GTTCGACAAGCCAGGAAGTCGCTTCTGTGAAGCAGGCCTTTGATGCGGTAGGG
GTGAAATAA (SEQ ID NO:1).
В вышеуказанной последовательности, жирным шрифтом показана ДНК, кодирующая зрелую протеазу термолизин, стандартным шрифтом показана ДНК, кодирующая лидерную последовательность (лидерную последовательность термолизина), а подчеркнутым текстом показана ДНК, кодирующая про-последовательность (про-последовательность термолизина). Аминокислотная последовательность (лидерная последовательность термолизина, про-последовательность термолизина и зрелая последовательность ДНК, кодирующая термолизин), представленная ниже (SEQ ID NO:2), соответствует полноразмерному белку-предшественнику термолизина. В этой последовательности, подчеркнутым текстом показана про-последовательность, а жирным шрифтом показана зрелая протеаза термолизин.
MKMKMKLASFGLAAGLAAOVFLPYNALASTEHVTWNQQFOTPOFISGDLLKVNGTSP EELVYOYVEKNENKFKFHENAKDTLOLKEKKNDNLGFTFMRFOOTYKGIPVFGAVVT AHVKDGTLTALSGTLIPNLDTKGSLKSGKKLSEKOARDIAEKDLVANVTKEVPEYEQG KDTEFVVYVNGDEASLAYVVNLNFLTPEPGNWLYIIDAVDGKILNKFNOLDAAKPGDV KS ITGTSTVGVGRGVLGDQKNINTTYSTYYYLQDNTRGNGIFTYDAKYRTTLPGSL WADADNQFFASYDAPAVDAHYYAGVTYDYYKNVHNRLSYDGNNAAIRSSVHYSQ GYNNAFWNGSQMVYGDGDGQTFIPLSGGIDWAHELTHAVTDYTAGLIYQNESGA INEAISDIFGTLVEFYANKNPDWEIGEDVYTPGISGDSLRSMSDPAKYGDPDHYSKR YTGTQDNGGVHINSGIINKAAYLISQGGTHYGVSWGIGRDKLGKIFYRALTQYLT PTSNFSQLRAAAVQSATDLYGSTSQEVASVKQAFDAVGVK (SEQ ID NO 2).
Зрелая последовательность термолизина представлена как SEQ ID N0:3 и показана на фигуре 1. Эта последовательность была использована в качестве основы для создания описанных здесь библиотек вариантов.
ITGTSTVGVGRGVLGDQKNINTTYSTYYYLQDNTRGNGIFTYDAKYRTTLPGSLWADA DNQFFASYDAPAVDAHYYAGVTYDYYKNVHNRLSYDGNNAAIRSSVHYSQGYNNAF WNGSQMVYGDGDGQTFIPLSGGIDVVAHELTHAVTDYTAGLIYQNESGAΓNEAISDIFG
TLVEFYANKNPDWEIGEDVYTPGISGDSLRSMSDPAKYGDPDHYSKRYTGTQDNGGVH INSGIINKAAYLISQGGTHYGVSVVGIGRDKLGKIFYRALTQYLTPTSNFSQLRAAAVQS ATDLYGSTSQEVASVKQAFDAVGVK (SEQ ID N0:3).
Экспрессионный вектор pHPLT-термолизин конструировали путем амплификации гена термолизина из геномной ДНК Geobacillus caldoproteolyticus (Chen et al., Extremophiles, 8:489-498, 2004) и их плазмидной ДНК pHPLT (van Solingen et al., Extremophiles, 5:333-341, 2001). Карта плазмиды pHPLT представлена на фигуре 2. Эта плазмида содержит промотор термостабильной амилазы LAT (PLAT) Bacillus licheniformis для инициации экспрессии термолизина. Ген термолизина амплифицировали из геномной ДНК с использованием ДНК-полимеразы Finnzymes (Finnzymes OY, Espoo, Finland) Phusion High-Fidelity (Catalog No. F-530L) и нижеследующих праймеров:
pHPLT-ProT-FW:
GAGAGGGTAAAGAATGAAAATGAAAATGAAATTAGCATC (SEQ ID NO:4)
proT-EcoRI-RV:
GTTAACCTGCAGGAATTCTTATTTCACCCCTACCGCATCAAAGGCC (SEQ ID NO:5)
Фрагмент pHPLT амплифицировали из плазмиды pHPLT с использованием ДНК-полимеразы Finnzymes Phusion High-Fidelity и нижеследующих праймеров:
pHPLT-ProT-RV:
CATTTTCATTTTCATTCTTTACCCTCTCCTTTTGCTAGAC (SEQ ID NO:6)
proT-EcoRI-FW:
CCATAAGAATTCCTGCAGGTTAACAGAGGACGGATTTCCTGAAGG
(SEQ ID NO:7)
Амплификацию обоих фрагментов проводили в нижеследующих условиях ПЦР: при 98°C, 30 сек., 30х(98°C 10 сек., 55°C 20 сек. и 72°C 45 сек. (термолизин) или 72°C 80 сек. (pHPLT)), а затем при 72°C 5 мин. Полученные ПЦР-продукты подвергали электрофорезу в E-геле (Invitrogen), вырезали и очищали с помощью набора для гель-экстракции (Qiagen). Кроме того, для присоединения вышеуказанных генных фрагментов друг к другу проводили лигирование с помощью ПЦР с удлинением перекрывающихся фрагментов (Ho, Gene, 15:51-59, 1989), осуществляемой с использованием ДНК-полимеразы (Taq High fidelity platinum, Invitrogen) и нижеследующих праймеров:
proT-EcoRI-FW:
CCATAAGAATTCCTGCAGGTTAACAGAGGACGGATTTCCTGAAGG (SEQ ID NO:7)
proT-EcoRI-RV:
GTTAACCTGCAGGAATTCTTATTTCACCCCTACCGCATCAAAGGCC (SEQ ID NO:5)
Такие реакции проводили в нижеследующих условиях: при 94°C 2 мин., 25х(94°C 30 сек., 55°C 30 сек. и 68°C 5 мин., а затем при 68°C 5 мин. Полученные продукты ПЦР-лигирования подвергали электрофорезу в E-геле (Invitrogen), вырезали и очищали с помощью набора для гель-экстракции (Qiagen). Очищенный лигированный продукт разрезали (Pstl) и подвергали аутолигированию (с помощью ДНК-лигазы T4, Invitrogen). Карта экспрессионного вектора pHPLT-термолизин представлена на фигуре 3, а ДНК-последовательность термолизин-экспрессирующего вектора pHPLT-термолизин (SEQ ID NO: 8) представлена на фигуре 4.
Лигированную смесь использовали для трансформации штамма B. subtilis SC6.1 (фенотип: ΔaprE, ΔnprE, oppA, ΔspoIIE, degUHy32, ΔamyE::(xylR,pxylA-comK). Трансформацию штамма B. subtilis SC6.1 осуществляли как описано в заявке WO 02/14490, которая вводится в настоящее описание посредством ссылки. Селективный рост трансформантов B. subtilis, содержащих вектор pHPLT-термолизин, осуществляли в шейкерных колбах, содержащих 25 мл среды MBD (среда, полученная на основе MOPS) с 20 мг/л неомицина. Культивирование приводило к продуцированию секретированного зрелого фермента термолизина, обладающего протеолитической активностью. Анализ в геле осуществляли с использованием 10% бис-трис-гелей NuPage Novex (Invitrogen, Catalog No. NP030IBOX). В целях приготовления образцов для анализа, 2 объема супернатанта смешивали с 1 объемом 1M HCl, 1 объемом 4X буфера для образцов LDS (Invitrogen, Catalog No. NP0007) и 1% PMSF (20 мг/мл), а затем нагревали в течение 10 минут при 70ºC. После этого 25 мкл каждого образца загружали на гель, в непосредственной близости от 10 мкл SeeBlue плюс 2 предварительно окрашенных белков-стандартов (Invitrogen, Catalog No. LC5925). Полученные результаты явно продемонстрировали, что стратегия клонирования термолизина, описанная в этом примере, является подходящей для продуцирования активного рекомбинантного термолизина в B. subtilis.
ПРИМЕР 3
Создание библиотек для выявления сайтов термолизина (SEL)
В этом примере описаны методы, применяемые для конструирования SEL термолизина. Как указывалось ранее, используемые здесь термины «термолизин», «бациллолизин», «протеиназа-Т» и «PrT» являются взаимозаменяемыми и означают фермент нейтральную металлопротеазу G. caldoproteolyticus. Вектор pHPLT-термолизин (фигура 3) содержит экспрессионный кластер термолизина, который служит в качестве матричной ДНК для создания библиотек в целях выявления сайтов. Каждая библиотека, созданная для выявления сайтов термолизина, содержит набор клонов B. subtilis, каждый из которых экспрессирует конкретный вариант термолизина. Каждая библиотека содержит клоны B. subtilis, включая максимум 20 различных вариантов. Так, например, 27 SEL термолизина содержат варианты, в которых ДНК-триплет, кодирующий тирозин в положении 27 зрелого фермента термолизина, заменен другим ДНК-триплетом, кодирующим аланин, аспарагиновую кислоту, цистеин, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, лейцин, метионин, аспарагин, пролин, глутамин, аргинин, серин, треонин, валин, триптофан или тирозин.
Вкратце, ДНК-триплеты в конкретных положениях в цепи ДНК, кодирующей зрелый термолизин, являются замененными. Затем, мутированные фрагменты термолизина лигировали с pHPLT. Плазмидные варианты pHPLT-термолизин использовали для трансформации штамма B. subtilis SC6.1. Продуцирование вариантов prt осуществляли с использованием продуктов синтеза генов и с применением устройств Sloning BioTechnology GmbH (Puchheim, Germany). Специфическую мутацию каждого варианта подтверждали путем секвенирования ДНК.
ПРИМЕР 4
Получение неочищенных образцов термолизина
Варианты белков термолизина (также называемые протеиназой-T или PrT) были получены путем культивирования трансформантов B. subtilis в 96-луночном MTP при 37ºC в течение 68 часов в среде MBD (среде, полученной на основе MOPS), включающей 10 мг/л неомицина. Среду MBD получали, в основном, методом, известным специалистам (см., Neidhardt et al., J Bacteriol, 1 19: 736-747, 1974), за исключением того, что базальная среда не содержала NH4Cl, FeSO4 и CaCl2, а вместо этого она содержала 3 мМ K2HPO4, и кроме того, в базальную среду были добавлены 60 мМ мочевины, 75 г/л глюкозы и 1% Soytone. Кроме того, 100Х маточный раствор содержал нижеследующие микроэлементы на один литр: 400 мг FeSO4 · 7H2O, 100 мг MnSO4 · H2O, 100 мг ZnSO4 · 7H2O, 50 мг CuCl2 · 2H2O, 100 мг CoCl2 · 6H2O, 100 мг NaMoO4 · 2H2O, 100 мг Na2B4O7 · 10H2O, 10 мл 1М CaCl2 и 10 мл 0,5 M цитрата натрия.
ПРИМЕР 5
Стабильность термолизина в жидком детергенте, применяемом при трудоемком режиме работы (HDL)
Детергенты Unilever ALL Small & Mighty, P&G TIDE® Fresh Breeze, P&G TIDE® 2X Fresh Breeze были закуплены у Walmart. Коммерчески доступные детергенты нагревали при 90ºC в течение 1 часа, а затем охлаждали до комнатной температуры для инактивации протеаз в указанных очищающих композициях. Термолизин (также называемый протеиназой-T или PrT) в лиофилизованном порошке закупали у Sigma и растворяли в 100 мM триса, pH 7, и 50% пропиленгликоля, 20 мг/мл. NprE выделяли из супернатанта Bacillus sp. с помощью ионообменной хроматографии. К 1 мл термообработанного детергента, содержащегося в пробирке Эппендорфа, добавляли 800 мкг термолизина или NprE. Затем содержимое пробирки тщательно перемешивали на шейкере в течение 15 минут при комнатной температуре, после чего инкубировали при 25ºC или 32ºC. Затем в различные периоды времени определяли остаточную протеиназную активность с помощью AGLA-анализа, описанного выше в примере 1. Вкратце, 10 мкл образца 441-кратно разводили в AGLA-буфере (50 мM MES, pH 6,5, 0,005% твин-80, 2,5 мM CaCl2), и 10 мкл разведенного образца добавляли к 200 мкл субстрата AGLA (2,4 мM Abz-AGLA-Nba в AGLA-буфере). В течение первых 100 секунд проводили мониторинг возбуждения на длине волны 350 нм и излучения на длине волны 415 нм, и начальный наклон кривой регистрировали как ферментативную активность. Затем строили кривые зависимости ферментативной активности от времени, и подбирали кривые с экспоненциальным затуханием.
Как показано на фигуре 5, стабильность термолизина в 140 раз превышает стабильность NprE в детергенте Unilever All Small & Mighty при комнатной температуре. Аналогичным образом, как показано на фигуре 6, стабильность термолизина в 68 раз превышает стабильность NprE в детергенте P&G TIDE® при 32ºC, а на фигуре 7 показано, что стабильность термолизина в 98 раз превышает стабильность NprE в детергенте P&G TIDE® 2X при 32ºC. Таким образом, термолизин является гораздо более стабильным, чем NprE в детергентах Unilever detergent ALL (3X), P&G TIDE® IX Fresh Breeze и P&G TIDE® 2X Fresh Breeze.
ПРИМЕР 6
Ингибиторы металлопротеиназы могут повышать стабильность термолизина в жидком детергенте для трудоемкого режима работы (HDL)
Известными ингибиторами металлопротеиназы являются хлорид цинка, фосфорамидон и галардин. Эти ингибиторы закупали у Sigma и растворяли в воде или ДМСО. Различные концентрации ингибиторов предварительно смешивали с термолизином (также называемым протеиназой-Т или PrT) в течение 10 минут при комнатной температуре. Затем ингибиторы добавляли в детергенты Unilever detergent ALL Small & Mighty так, чтобы конечная концентрация термолизина составляла 800 мкг/мл в полном объеме 1 мл. Затем, в различные периоды времени брали образцы и осаждали TCA. Вкратце, 10 мкл образца детергента с ферментом добавляли к 500 мкл 0,2 н. HCl на льду, после чего добавляли 500 мкл 20% TCA. Затем содержимое пробирок смешивали и инкубировали на льду в течение 20 минут. Осадок собирали и промывали 90% ацетоном, охлажденным льдом. Осадок растворяли в буфере для загрузки образцов (Invitrogen) в целях проведения электрофореза в ДСН-ПААГ. Как показано на фигуре 8, 500 мкМ фосфорамидона и 1 мМ галардина в значительной степени стабилизируют термолизин в детергенте.
ПРИМЕР 7
Эффективность вариантов термолизина для удаления пятен в анализе на микрообразцах ткани, обработанной TIDE® 2X
В этом примере проводили эксперименты в целях определения эффективности различных монозамещенных вариантов термолизина (также называемых здесь протеиназой-T или PrT) в отношении удаления пятен. Как описано в примере 1, эффективность вариантов термолизина в отношении удаления пятен оценивали в анализе с использованием микрообразцов, загрязненных кровью/молоком/чернилами (BMI). Вкратце, очищающая эффективность выбранных монозамещенных вариантов термолизина была оценена в анализе с использованием микрообразцов, обработанных TIDE® 2X. В таблицах 7-1 представлены показатели эффективности для тестируемых вариантов (например, указывающие на увеличение эффективности по сравнению с эффективностью фермента термолизина дикого типа). Те варианты, которые имеют показатель эффективности более, чем 1 (PI>1), имеют более высокую эффективность. Как показали результаты, полученные с использованием данной аналитической системы, многие варианты, имеющие одну аминокислотную замену, являются более эффективными, чем фермент дикого типа.
ПРИМЕР 8
Стабильность вариантов термолизина в жидком детергенте TIDE® 2X
В этом примере проводили эксперименты в целях оценки стабильности различных монозамещенных вариантов термолизина (также называемых здесь протеиназой-T или PrT) в присутствии жидкого детергента. Как описано в примере 1, стабильность вариантов термолизина определяли путем измерения AGLA-активности до и после инкубирования в присутствии жидкого детергента для трудоемкого режима работы (HDL) TIDE® 2X при повышенной температуре. В таблице приводятся относительные величины стабильности по сравнению с величинами стабильности термолизина дикого типа, которые представляют собой частное, полученное путем деления остаточной активности варианта на остаточную активность дикого типа. Величина более 1 указывает на более высокую стабильность в присутствии детергента. В таблицах 8-1 и 8-2 представлены данные относительной стабильности монозамещенных вариантов термолизина по отношению к стабильности термолизина дикого типа в детергенте HDL в присутствии и в отсутствии DTPA.
Все публикации и патенты, упомянутые выше в описании изобретения, вводятся в настоящее описание посредством ссылки. Для специалиста в данной области очевидно, что в настоящее изобретение могут быть внесены различные модификации и варианты описанных здесь методов и систем, не выходящие за рамки существа и объема изобретения. Хотя настоящее изобретение описано на конкретных предпочтительных вариантах его осуществления, однако, следует отметить, что заявленное изобретение не должно быть ограничено такими конкретными вариантами. Действительно, предусматривается, что в объем нижеследующей формулы изобретения входят различные модификации описанных способов осуществления изобретения, которые являются очевидными для специалистов в данной области.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОДУЦИРОВАНИЕ ТЕРМОЛИЗИНА И ЕГО ВАРИАНТОВ И ЕГО ИСПОЛЬЗОВАНИЕ В ЖИДКИХ ДЕТЕРГЕНТАХ | 2014 |
|
RU2733541C2 |
| СПОСОБЫ УЛУЧШЕНИЯ ЭФФЕКТИВНОСТИ БЕЛКОВ | 2008 |
|
RU2569106C2 |
| ПРИМЕНЕНИЕ И ПОЛУЧЕНИЕ СТАБИЛЬНОЙ ПРИ ХРАНЕНИИ НЕЙТРАЛЬНОЙ МЕТАЛЛОПРОТЕИНАЗЫ | 2006 |
|
RU2433182C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ УЛУЧШЕННЫХ ВАРИАНТОВ БЕЛКА | 2008 |
|
RU2520808C2 |
| ПРОТЕАЗЫ, СОДЕРЖАЩИЕ ОДНУ ИЛИ НЕСКОЛЬКО КОМБИНИРУЕМЫХ МУТАЦИЙ | 2009 |
|
RU2560978C2 |
| СПОСОБЫ УЛУЧШЕНИЯ МНОЖЕСТВЕННЫХ СВОЙСТВ БЕЛКА | 2008 |
|
RU2553550C2 |
| ВАРИАНТЫ СЕРИНОВОЙ ПРОТЕАЗЫ С МНОЖЕСТВЕННЫМИ МУТАЦИЯМИ | 2007 |
|
RU2558261C2 |
| ПРОТЕАЗА Streptomyces | 2008 |
|
RU2486244C2 |
| МОЮЩАЯ КОМПОЗИЦИЯ | 2015 |
|
RU2737535C2 |
| CПОСОБ МЫТЬЯ ПОСУДЫ | 2007 |
|
RU2509152C2 |


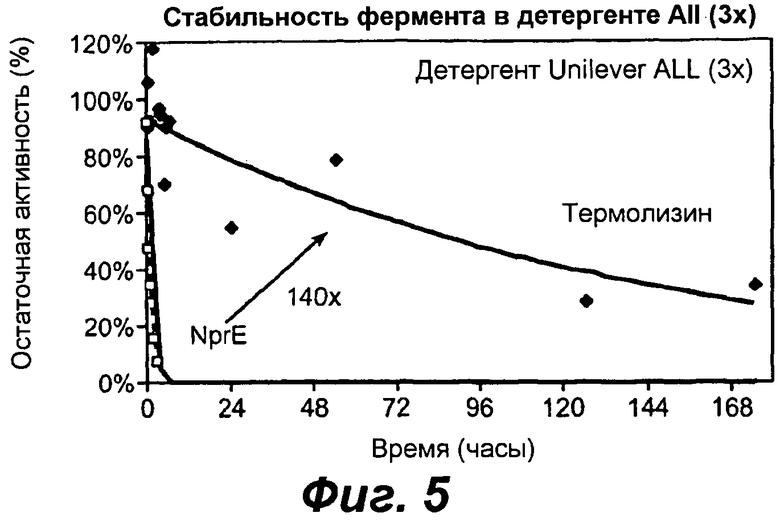
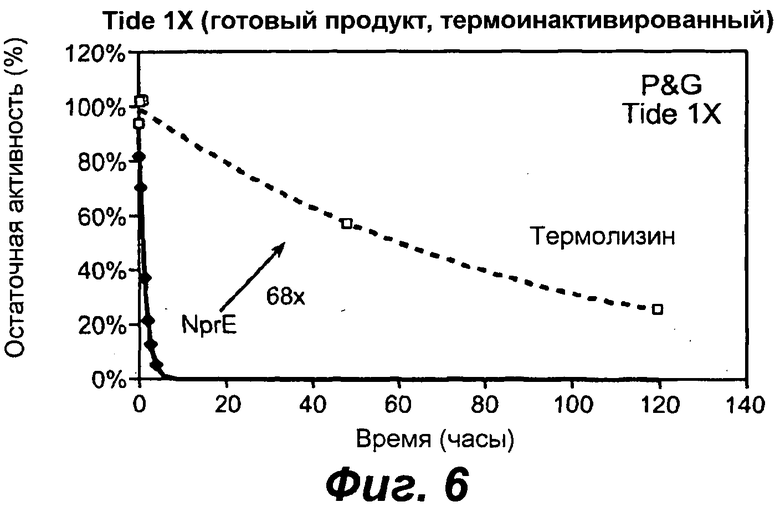

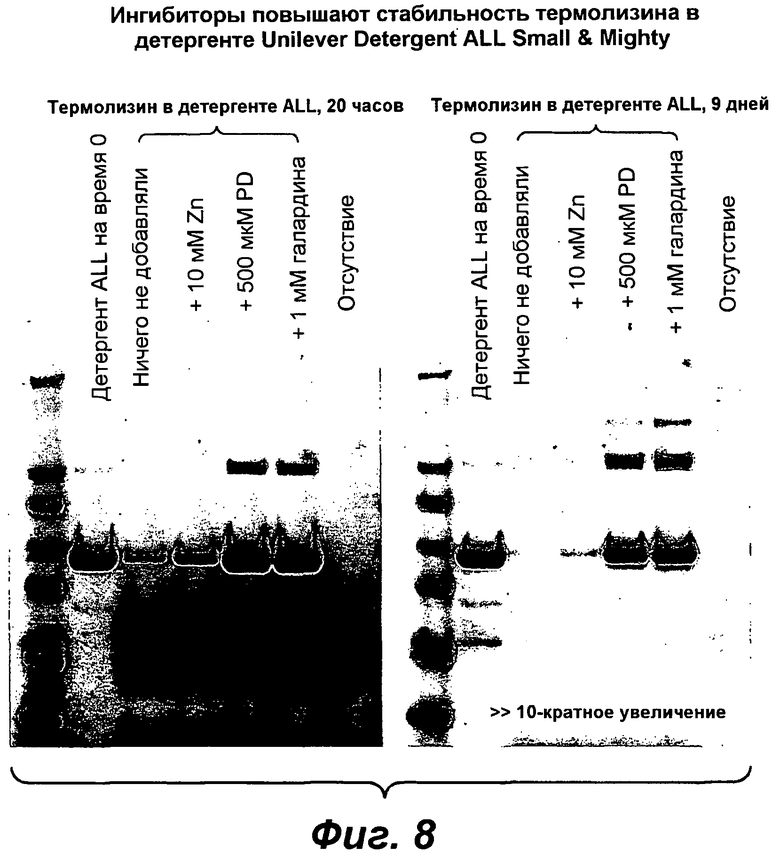
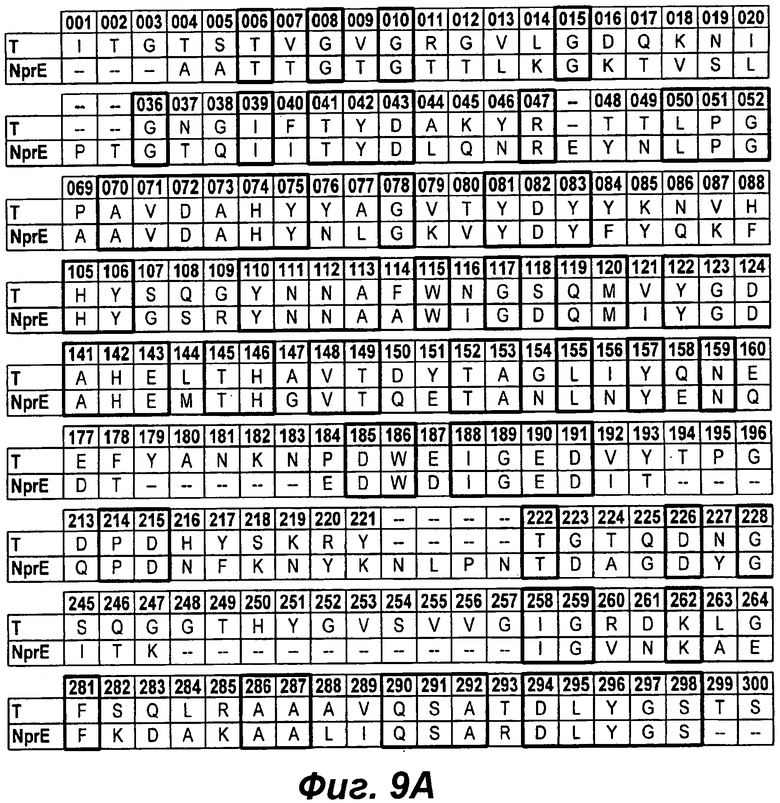

Группа изобретений относится к биотехнологии. Предложен вариант термолизина, обладающий повышенной эффективностью по сравнению с термолизином дикого типа. При этом указанный вариант термолизина содержит замену, выбранную из T006G, F063P, T006H, S065K, T006I, S065Y, T006K, Y075G, T006M, Y075M, T006N, Y075T, T006P, Q128H, T006Q, Q128I, T006R, Q128L, T006V, Q128M, T006W, Q128V, T006Y, Q128Y, V007F, Y151D, V007H, Y151E, V007K, Y151H, V007L, Y151K, V007M, Y151M, V007P, Y151N, V007Q, Y151Q, V007R, Y151R, V007T, Y151T, V007Y, Y151V, T049G, T049H, I156M, T049I, I156R, T049K, I156T, T049L, I156W, T049N, G196R, T049P, Q273I, T049Q, Q273P, T049W, Q273Y, A058I, T278K, A058P, T278M, A058R, T278P, F063I, N280K, F063L, N280R. Термолизин получают трансформацией Bacillus sp. экспрессионным вектором, содержащим полинуклеотидную последовательность, кодирующую вариант термолизина, и культивированием трансформированной клетки-хозяина в условиях, подходящих для продуцирования указанного термолизина. Данный фермент используют в составе чистящей композиции для очистки поверхностей или изделий. Изобретения обеспечивают получение варианта термолизина с повышенной эффективностью. 4 н. и 51 з.п. ф-лы, 9 ил., 3 табл., 8 пр.
1. Выделенный вариант термолизина, где указанный вариант термолизина содержит замену, выбранную из T006G, F063P, T006H, S065K, T006I, S065Y, T006K, Y075G, T006M, Y075M, T006N, Y075T, T006P, Q128H, T006Q, Q128I, T006R, Q128L, T006V, Q128M, T006W, Q128V, T006Y, Q128Y, V007F, Y151D, V007H, Y151E, V007K, Y151H, V007L, Y151K, V007M, Y151M, V007P, Y151N, V007Q, Y151Q, V007R, Y151R, V007T, Y151T, V007Y, Y151V, T049G, T049H, I156M, T049I, I156R, T049K, I156T, T049L, I156W, T049N, G196R, T049P, Q273I, T049Q, Q273P, T049W, Q273Y, A058I, T278K, A058P, T278M, A058R, T278P, F063I, N280K, F063L, N280R аминокислотной последовательности, представленной в SEQ ID NO:3, причем выделенный вариант термолизина обладает повышенной эффективностью по сравнению с термолизином дикого типа.
2. Выделенный вариант термолизина по п.1, где указанный вариант термолизина является вариантом термолизина микроорганизма Geobacillus sp.
3. Выделенный вариант термолизина по п.1, где указанный микроорганизм Geobacillus является G. caldoproteolyticus или G. stearothermophilus.
4. Выделенный вариант термолизина по п.1, где указанный вариант термолизина является вариантом термолизина микроорганизма Geobacillus caldoproteolyticus.
5. Выделенный вариант термолизина по п.1, где указанная замена выбрана из замены, эквивалентной положениям 6, 7, 49, 58, 63, 75, 128, 151, 156, 196, 273, 278 и 280 аминокислотной последовательности, представленной в SEQ ID NO:3.
6. Выделенный вариант термолизина по п.5, где указанная замена выбрана из T006G, F063P, T006H, S065K, T006I, S065Y, T006K, Y075G, T006M, Y075M, T006N, Y075T, T006P, Q128H, T006Q, Q128I, T006R, Q128L, T006V, Q128M, T006W, Q128V, T006Y, Q128Y, V007F, Y151D, V007H, Y151E, V007K, Y151H, V007L, Y151K, V007M, Y151M, V007P, Y151N, V007Q, Y151Q, V007R, Y151R, V007T, Y151T, V007Y, Y151V, T049G, T049H, I156M, T049I, I156R, T049K, I156T, T049L, I156W, T049N, G196R, T049P, Q273I, T049Q, Q273P, T049W, Q273Y, A058I, T278K, A058P, T278M, A058R, T278P, F063I, N280K, F063L, N280R.
7. Выделенный вариант термолизина по п.1, где указанная эффективность выбрана из одного или нескольких таких свойств, как повышенная эффективность при более низком рН, повышенная эффективность при более высоком рН.
8. Чистящая композиция, содержащая выделенный вариант термолизина по п.1 и детергент.
9. Чистящая композиция по п.8, дополнительно содержащая ингибитор нейтральной металлопротеазы.
10. Чистящая композиция по п.8, где указанным ингибитором нейтральной металлопротеазы является галардин.
11. Чистящая композиция по п.8, где галардин стабилизирует или повышает эффективность термолизина.
12. Чистящая композиция по п.8, где указанный вариант термолизина является вариантом термолизина микроорганизма Geobacillus sp.
13. Чистящая композиция по п.8, где указанным микроорганизмом Geobacillus является G. caldoproteolyticus или G. stearothermophilus.
14. Чистящая композиция по п.13, где указанный вариантный термолизин является вариантом термолизина микроорганизма G. caldoproteolyticus.
15. Чистящая композиция по п.8, где указанная замена, выбрана из замены в положениях, выбранных из положений, эквивалентным положениям 6, 7, 49, 58, 63, 75, 128, 151, 156, 196, 273, 278 и 280 аминокислотной последовательности, представленной в SEQ ID NO:3.
16. Чистящая композиция по п.8, где указанный вариант термолизина содержит замену, выбранную из T006G, F063P, T006H, S065K, T006I, S065Y, T006K, Y075G, T006M, Y075M, T006N, Y075T, T006P, Q128H, T006Q, Q128I, T006R, Q128L, T006V, Q128M, T006W, Q128V, T006Y, Q128Y, V007F, Y151D, V007H, Y151E, V007K, Y151H, V007L, Y151K, V007M, Y151M, V007P, Y151N, V007Q, Y151Q, V007R, Y151R, V007T, Y151T, V007Y, Y151V, T049G, T049H, I156M, T049I, I156R, T049K, I156T, T049L, I156W, T049N, G196R, T049P, Q273I, T049Q, Q273P, T049W, Q273Y, A058I, T278K, A058P, T278M, A058R, T278P, F063I, N280K, F063L, N280R.
17. Чистящая композиция по п.16, где указанная замена выбрана из T006G, F063P, T006H, S065K, T006I, S065Y, T006K, Y075G, T006M, Y075M, T006N, Y075T, T006P, Q128H, T006Q, Q128I, T006R, Q128L, T006V, Q128M, T006W, Q128V, T006Y, Q128Y, V007F, Y151D, V007H, Y151E, V007K, Y151H, V007L, Y151K, V007M, Y151M, V007P, Y151N, V007Q, Y151Q, V007R, Y151R, V007T, Y151T, V007Y, Y151V, T049G, T049H, I156M, T049I, I156R, T049K, I156T, T049L, I156W, T049N, G196R, T049P, Q273I, T049Q, Q273P, T049W, Q273Y, A058I, T278K, A058P, T278M, A058R, T278P, F063I, N280K, F063L, N280R.
18. Чистящая композиция по п.8, где указанная улучшенная эффективность выбрана из одного или нескольких таких свойств, как повышенная эффективность при более низком рН, повышенная эффективность при более высоком рН.
19. Чистящая композиция по п.8, где указанная композиция дополнительно включает по меньшей мере один ион кальция и/или ион цинка.
20. Чистящая композиция по п.8, где указанная композиция дополнительно включает по меньшей мере один стабилизатор.
21. Чистящая композиция по п.20, где указанный стабилизатор выбран из буры, глицерина, ионов цинка, ионов кальция и формиата кальция.
22. Чистящая композиция по п.20, где указанным стабилизатором является по меньшей мере один конкурентный ингибитор, который стабилизирует термолизин в присутствии анионогенного поверхностно-активного вещества.
23. Чистящая композиция по п.8, где указанной композицией является очищающая композиция.
24. Чистящая композиция по п.23, где очищающую композицию выбирают из гранулированной формы, порошкообразной формы, жидкости, геля или пастообразной формы, средства для ручного мытья посуды, средства для мытья посуды в облегченных условиях, средства для мытья посуды в посудомоечной машине, жидкого моющего и дезинфицирующего средства, шампуня для волос, ополаскивателя для волос, геля для душа, пенистого очистителя ванн и металлических поверхностей.
25. Чистящая композиция по п.23, где очищающую композицию выбирают из композиции для очистки текстильных изделий и композиции для очистки нетекстильных изделий.
26. Чистящая композиция по п.25, где композицию для очистки текстильных изделий выбирают из моющего средства для ручной стирки, моющего средства машинной стирки, добавки для стирки, композиции, подходящей для использования при замачивании и/или предварительной обработки запятнанных тканей.
27. Чистящая композиция по п.26, где запятнанную ткань выбирают из одежды, белья, текстильных материалов.
28. Чистящая композиция по п.25, где композицию для очистки нетекстильных изделий выбирают из композиции для очистки нетекстильных поверхностей, выбранных из моющих композиций для мытья посуды, композиций чистки ротовой полости, композиции для чистки зубов, композиций личной гигиены.
29. Чистящая композиция по п.23, где очищающей композицией является моющая композиция.
30. Чистящая композиция по п.29, где моющую композицию выбирают из жидкости, геля, пасты, гранулы, порошка, мыла, спрея, таблетки и пенной композиции.
31. Чистящая композиция по п.29, где моющей композицией является моющий агент, жидкое моющее средство для тонкой легкой ткани, средство для ручного мытья посуды, средство для мытья посуды в облегченных условиях, средство для мытья посуды в посудомоечной машине, жидкое моющее и дезинфицирующее средство, очищающее мыло, жидкость для полоскания рта, средства для чистки зубов, шампунь для мойки машин или ковров, средство для очистки ванн, шампунь для волос и ополаскиватели для волос, гель для душа и пенистый очиститель ванны и металлических поверхностей.
32. Чистящая композиция по п.31, где указанное средство для мытья посуды в посудомоечной машине выбрано из таблетки, гранулы, жидкости, вспомогательной формы для ополаскивания.
33. Чистящая композиция по п.32, где указанное средство для мытья посуды в посудомоечной машине используется для домашних целей или на предприятиях.
34. Чистящая композиция по п.31, где указанное жидкое моющее и дезинфицирующее средство выбирают из антибактериального средства для ручной мойки, очищающего мыла, жидкости для полоскания рта, средства для чистки зубов, средства для очистки ванн.
35. Чистящая композиция по п.8, дополнительно содержащая по меньшей мере один дополнительный фермент или производное фермента, выбранные из протеаз, амилаз, липаз, маннаназ, пектиназ, кутиназ, оксидоредуктаз, гемицеллюлаз и целлюлаз, пероксидаз, ксиланаз, фосфолипаз, эстераз, кератиназ, редуктаз, оксидаз, фенолоксидаз, липоксигеназ, лигниназ, пуллуланаз, танназ, пентозаназ, маланаз, β-глюканазы, арабинозидаз, гиалуронидазы, хондроитиназы и лакказы или их смесей.
36. Чистящая композиция по п.8, где указанная композиция содержит по меньшей мере примерно 0,0001 масс.% указанного варианта термолизина.
37. Чистящая композиция по п.8, где указанная композиция содержит примерно от 0,001 до 0,5 масс.% указанного варианта термолизина.
38. Чистящая композиция по п.8, дополнительно содержащая по меньшей мере один вспомогательный ингредиент.
39. Чистящая композиция по п.8, дополнительно содержащая pH-модификатор в количестве, достаточном для получения композиции со значением pH в точном интервале величин примерно от 3 до 5, причем указанная композиция по существу не содержит материалов, которые гидролизуются при pH примерно от 3 до 5.
40. Чистящая композиция по п.39, где указанные вещества, которые гидролизуются при pH примерно от 3 до 5, содержат по меньшей мере одно поверхностно-активное вещество.
41. Чистящая композиция по п.40, где указанное поверхностно-активное вещество является поверхностно-активным веществом на основе алкилсульфата натрия, содержащим этиленоксидную группу.
42. Способ продуцирования фермента по п.1, обладающего активностью термолизина, где указанный способ включает:
(i) трансформацию Bacillus sp. экспрессионным вектором, содержащим полинуклеотидную последовательность, кодирующую вариант термолизина по п.1;
(ii) культивирование указанной трансформированной клетки-хозяина в условиях, подходящих для продуцирования указанного термолизина, и
(iii) сбор полученного варианта термолизина.
43. Способ очистки, включающий стадию контактирования поверхности и/или изделия с очищающей композицией, включающей выделенный ферментативно активный вариант термолизина по п.1.
44. Способ по п.43, где очищающую композицию выбирают из гранулированной формы, порошкообразной формы, жидкости, геля или пастообразной формы, средства для ручного мытья посуды, средства для мытья посуды в облегченных условиях, средства для мытья посуды в посудомоечной машине, жидкого моющего и дезинфицирующего средства, шампуня для волос, ополаскивателя для волос, геля для душа, пенистого очистителя ванн и металлических поверхностей.
45. Способ по п.43, где очищающей композицией является моющая композиция.
46. Способ по п.45, где моющую композицию выбирают из жидкости, геля, пасты, гранулы, порошка, мыла, спрея, таблетки и пенной композиции.
47. Способ по п.46, где моющей композицией является моющий агент, жидкое моющее средство для тонкой легкой ткани, средство для ручного мытья посуды, средство для мытья посуды в облегченных условиях, средство для мытья посуды в посудомоечной машине, жидкое моющее и дезинфицирующее средство, очищающее мыло, жидкость для полоскания рта, средства для чистки зубов, шампунь для мойки машин или ковров, средство для очистки ванн, шампунь для волос и ополаскиватели для волос, гель для душа и пенистый очиститель ванны и металлических поверхностей.
48. Способ по п.47, где указанное средство для мытья посуды в посудомоечной машине выбрано из таблетки, гранулы, жидкости, вспомогательной формы для ополаскивания.
49. Способ по п.48, где указанное средство для мытья посуды в посудомоечной машине используется для домашних целей или на предприятиях.
50. Способ по п.47, где указанное жидкое моющее и дезинфицирующее средство выбирают из антибактериального средства для ручной мойки, очищающего мыла, жидкости для полоскания рта, средства для чистки зубов, средства для очистки ванн.
51. Способ по п.47, где очищающая композиция включает композицию для очистки текстильных или нетекстильных изделий.
52. Способ по п.51, где композицию для очистки текстильных изделий выбирают из моющего средства для ручной стирки, моющего средства машинной стирки, добавки для стирки, композиции, подходящей для использования при замачивании и/или предварительной обработки запятнанных тканей.
53. Способ по п.52, где запятнанную ткань выбирают из одежды, белья, текстильных материалов.
54. Способ по п.51, где композицию для очистки нетекстильных изделий выбирают из композиции для очистки нетекстильных поверхностей, выбранных из моющих композиций для мытья посуды, композиций чистки ротовой полости, композиции для чистки зубов, композиций личной гигиены.
55. Способ по п.43, дополнительно содержащий стадию ополаскивания поверхности и/или материала после контактирования поверхности или материала с очищающей композицией.
| Способ получения изделий типа стаканов с фасонной боковой поверхностью | 1975 |
|
SU616033A1 |
| JPH09220090 A, 26.08.1997 | |||
| YASUKAWA K | |||
| ET AL | |||
| Improving the activity and stability of thermolysin by site-directed mutagenesis // Biochim Biophys Acta | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| O'DONOHUE M.J | |||
| ET AL | |||
| Cloning and expression in Bacillus subtilis of the npr gene from Bacillus thermoproteolyticus Rokko coding for the | |||
Авторы
Даты
2014-12-20—Публикация
2008-10-28—Подача