По настоящей заявке испрашивается приоритет находящейся на рассмотрении предварительной патентной заявки США серийный No. 60/726448, поданной 12 октября 2005 г.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам и композициям, включающим в себя по меньшей мере один фермент - нейтральную металлопротеиназу, обладающий улучшенной стабильностью при хранении. В некоторых вариантах осуществления нейтральную металлопротеиназу используют для очистки и других применений. В некоторых особенно предпочтительных вариантах осуществления настоящее изобретение относится к способам и композициям, содержащим нейтральную металлопротеиназу (металлопротеиназы), полученную из Bacillus sp. В некоторых особенно предпочтительных вариантах осуществления нейтральная металлопротеиназа получена из B. amyloliquefaciens. В дополнительных предпочтительных вариантах осуществления нейтральная металлопротеиназа представляет собой вариант нейтральной металлопротеиназы B. amyloliquefaciens. В дополнительных вариантах осуществления нейтральная металлопротеиназа представляет собой гомолог нейтральной металлопротеиназы B. amyloliquefaciens. Настоящее изобретение находит особенный спрос в применениях, включающих в себя в качестве неограничивающих примеров очистку, отбеливание и дезинфекцию.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Моющие средства и другие очищающие композиции, как правило, включают в себя сложное сочетание активных ингредиентов. Например, большинство очищающих продуктов содержат систему поверхностно-активного вещества, ферменты для очистки, отбеливающие средства, добавки для повышения моющего действия, средства для подавления пенообразования, суспендирующие грязь вещества, грязеотталкивающие средства, оптические отбеливатели, смягчающие средства, диспергирующие вещества, ингибирующие перенос красителя соединения, абразивные вещества, антибактериальные средства и отдушки. Несмотря на комплексность современных существующих в настоящее время моющих средств, существует много загрязнений, которые трудно полностью удалить. Более того, часто присутствует остаточное накопление, приводящее к изменению цвета (например, пожелтению) и снижению эстетики из-за неполного очищения. Эти проблемы усугубляются увеличением использования холодных (например, холодная вода) температур стирки и укороченных циклов стирки. Более того, многие загрязнения состоят из сложных смесей волокнистого материала, в основном содержащего углеводы и производные углеводов, волокна, и компоненты клеточной стенки (например, растительный материал, дерево, землю на основе ила/глины и фрукты). Эти загрязнения представляют сложные задачи для составления и использования очищающих композиций.
Кроме того, окрашенная одежда проявляет тенденцию изнашиваться и проявлять потерю внешнего вида. Часть этой потери окраски происходит из-за способа стирки, в частности, в автоматических стиральных и сушильных машинах. Более того, потеря прочности ткани на разрыв, по-видимому, является неизбежным результатом механического и химического воздействия из-за использования, ношения и/или стирки и сушки. Таким образом, необходимы способы эффективной и действенной стирки окрашенной одежды, так чтобы минимизировать эти потери внешнего вида.
В целом, несмотря на улучшения в мощности очищающих композиций, в данной области остается необходимость в моющих средствах, которые удаляют загрязнения, поддерживают цвет ткани и внешний вид и предотвращают перенос красителя. Кроме того, остается необходимость в композициях моющих средств и/или композициях для ухода за тканью, предоставляющих и/или сохраняющих прочность на разрыв, также как предоставляющих ткани свойства против складок, против скатывания и/или против усадки, также как предоставляющих статический контроль, мягкость ткани, поддерживающих желательный внешний вид окраски, и свойства и преимущества ткани против изнашивания. В частности, остается необходимость включения композиций, способных удалять окрашенные компоненты загрязнений, которые часто остаются прикрепленными к стираемым тканям. Кроме того, остается необходимость улучшенных способов и композиций, подходящих для отбеливания ткани.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам и композициям, содержащим по меньшей мере один фермент - нейтральную металлопротеиназу, обладающий улучшенной стабильностью при хранении. В некоторых вариантах осуществления нейтральная металлопротеиназа находит применение для очистки и других применений. В некоторых особенно предпочтительных вариантах осуществления настоящее изобретение относится к способам и композициям, включающим в себя нейтральную металлопротеиназу (металлопротеиназы), полученную из Bacillus sp. В некоторых более предпочтительных вариантах осуществления нейтральная металлопротеиназа получена из B. amyloliquefaciens. В еще более предпочтительных вариантах осуществления нейтральная металлопротеиназа представляет собой вариант нейтральной металлопротеиназы из B. amyloliquefaciens. В дополнительных вариантах осуществления нейтральная металлопротеиназа представляет собой гомолог нейтральной металлопротеиназы B. amyloliquefaciens. Настоящее изобретение находит практическое использование в применениях, включающих в себя в качестве неограничивающих примеров очистку, отбеливание и дезинфекцию.
Настоящее изобретение относится к новым нейтральным металлопротеиназам, новому генетическому материалу, кодирующему ферменты нейтральные металлопротеиназы, и белкам нейтральным металлопротеиназам, полученным из Bacillus sp., в частности, B. amyloliquefaciens, и вариантам белков, полученным из них. В частности, настоящее изобретение относится к композициям нейтральной металлопротеиназы, полученной из Bacillus sp., в частности, B. amyloliquefaciens, к ДНК, кодирующей протеиназу, к векторам, содержащим ДНК, кодирующую нейтральную металлопротеиназу, к клеткам-хозяевам, трансформированным векторной ДНК, и к ферменту, продуцируемому клетками-хозяевами. Настоящее изобретение также относится к очищающим композициям (например, композициям моющих средств), к композициям для кормления животных и к композициям для обработки ткани и кожи, содержащим нейтральную металлопротеиназу (металлопротеиназы), полученную из видов Bacillus, в частности, B. amyloliquefaciens. В альтернативных вариантах осуществления настоящее изобретение относится к мутантным (т.е. измененным) нейтральным металлопротеиназам, полученным из нейтральных металлопротеиназ дикого типа, описанных здесь. Эти мутантные нейтральные металлопротеиназы также находят использование для многих применений.
Настоящее изобретение относится к выделенным нейтральным металлопротеиназам, полученным из видов Bacillus, в частности, B. amyloliquefaciens. В дополнительных вариантах осуществления нейтральная металлопротеиназа содержит аминокислотную последовательность, указанную в SEQ ID NO:3, 4 или 18. В дополнительных вариантах осуществления настоящее изобретение относится к выделенным нейтральным металлопротеиназам, обладающим по меньшей мере 45% идентичностью аминокислот с нейтральной металлопротеиназой, содержащей SEQ ID NO:3, 4 или 18. В некоторых вариантах осуществления выделенные нейтральные металлопротеиназы обладают по меньшей мере 50% идентичностью, предпочтительно по меньшей мере 55%, более предпочтительно по меньшей мере 60%, еще более предпочтительно по меньшей мере 65%, даже более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 75%, еще более предпочтительно по меньшей мере 80%, более предпочтительно 85%, еще более предпочтительно 90%, даже более предпочтительно по меньшей мере 95% и наиболее предпочтительно 99% идентичностью с нейтральной металлопротеиназой, содержащей SEQ ID NO:3, 4 или 18.
Настоящее изобретение также относится к выделенным нейтральным металлопротеиназам, обладающим иммунологической перекрестной реактивностью с металлопротеиназой, полученной из B. amyloliquefaciens, также как к композициям, содержащим эти нейтральные металлопротеиназы. В альтернативных вариантах осуществления нейтральные металлопротеиназы обладают иммунологической перекрестной реактивностью с нейтральными металлопротеиназами, содержащими аминокислотную последовательность, указанную в SEQ ID NO:3, 4 или 18. В дополнительных вариантах осуществления нейтральные металлопротеиназы обладают перекрестной реактивностью с фрагментами (т.е. частями) нейтральной металлопротеиназы B. amyloliquefaciens и/или нейтральной металлопротеиназы, содержащей аминокислотную последовательность, указанную в SEQ ID NO:3, 4 или 18. Действительно, предполагают, что настоящее изобретение относится к фрагментам (например, эпитопам) металлопротеиназы B. amyloliquefaciens, стимулирующим иммунный ответ у животных (включая в качестве неограничивающих примеров человека), и/или узнаваемым антителами любого класса. Кроме того, настоящее изобретение относится к эпитопам металлопротеиназы, которые являются перекрестно реактивными с эпитопами металлопротеиназы B. amyloliquefaciens. В некоторых вариантах осуществления эпитопы металлопротеиназы являются узнаваемыми антителами, но не стимулируют иммунный ответ у животных (включая в качестве неограничивающих примеров человека), в то время как в других вариантах осуществления, эпитопы металлопротеиназы стимулируют иммунный ответ по меньшей мере у одного вида животных (включая в качестве неограничивающих примеров человека) и являются узнаваемыми антителами любого класса. Настоящее изобретение также относится к способам и композициям для идентификации и оценки перекрестно-реактивных эпитопов.
В некоторых вариантах осуществления настоящее изобретение относится к аминокислотным последовательностям, указанным в SEQ ID NO:3, 4 или 18. В альтернативных вариантах осуществления последовательность содержит замены по меньшей мере в одном положении аминокислоты в SEQ ID NO:3, 4 или 18. В некоторых особенно предпочтительных альтернативных вариантах осуществления последовательность содержит замены по меньшей мере в одном положении аминокислоты в SEQ ID NO:18. В некоторых предпочтительных вариантах осуществления настоящее изобретение относится к вариантам нейтральной металлопротеиназы, обладающим аминокислотной последовательностью, содержащей по меньшей мере одну замену аминокислоты, выполненную в положении, эквивалентном положению в нейтральной металлопротеиназе B. amyloliquefaciens, содержащей аминокислотную последовательность, указанную в SEQ ID NO:3, 4 или 18. В некоторых дополнительных предпочтительных вариантах осуществления настоящее изобретение относится к вариантам нейтральной металлопротеиназы, обладающим аминокислотной последовательностью, содержащей по меньшей мере одну замену аминокислоты, выполненную в положении, эквивалентном положению в нейтральной металлопротеиназе B. amyloliquefaciens, содержащей аминокислотную последовательность, указанную в SEQ ID NO:18. В альтернативных вариантах осуществления настоящее изобретение относится к вариантам нейтральной металлопротеиназы, обладающим аминокислотной последовательностью, содержащей по меньшей мере одну замену аминокислоты, выполненную в положении, эквивалентном положению в нейтральной металлопротеиназе B. amyloliquefaciens, содержащей по меньшей мере часть SEQ ID NO:3, 4 или 18. В некоторых альтернативных предпочтительных вариантах осуществления нейтральные металлопротеиназы содержат множественные мутации по меньшей мере в части SEQ ID NO:3, 4 или 18. В некоторых альтернативных предпочтительных вариантах осуществления нейтральные металлопротеиназы содержат множественные мутации по меньшей мере в части SEQ ID NO:18.
В дополнительных вариантах осуществления настоящее изобретение относится к аминокислотной последовательности, указанной в SEQ ID NO:18. В альтернативных вариантах осуществления последовательность содержит замены по меньшей мере в одном положении аминокислоты в SEQ ID NO:18. В некоторых предпочтительных вариантах осуществления настоящее изобретение относится к вариантам нейтральной металлопротеиназы, обладающим аминокислотной последовательностью, содержащей по меньшей мере одну замену аминокислоты, выполненную в положении, эквивалентном положению в нейтральной металлопротеиназе B. amyloliquefaciens, содержащей аминокислотную последовательность, указанную в SEQ ID NO:18. В альтернативных вариантах осуществления настоящее изобретение относится к вариантам нейтральной металлопротеиназы, обладающим аминокислотной последовательностью, содержащей по меньшей мере одну замену аминокислоты, выполненную в положении, эквивалентном положению в нейтральной металлопротеиназе B. amyloliquefaciens, содержащей по меньшей мере часть SEQ ID NO:18. В некоторых альтернативных предпочтительных вариантах осуществления нейтральные металлопротеиназы содержат множественные мутации по меньшей мере в части SEQ ID NO:18.
В некоторых особенно предпочтительных вариантах осуществления эти варианты обладают улучшенной производительностью по сравнению с нейтральной металлопротеиназой B. amyloliquefaciens дикого типа. Настоящее изобретение также относится к вариантам нейтральной металлопротеиназы, обладающим по меньшей мере одним улучшенным признаком по сравнению с нейтральной металлопротеиназой дикого типа. В некоторых дополнительных особенно предпочтительных вариантах осуществления эти варианты обладают улучшенной стабильностью по сравнению с нейтральной металлопротеиназой B. amyloliquefaciens дикого типа. В некоторых дополнительных предпочтительных вариантах осуществления эти варианты обладают улучшенной термостабильностью по сравнению с нейтральной металлопротеиназой B. amyloliquefaciens дикого типа. В дополнительных предпочтительных вариантах осуществления эти варианты обладают улучшенной производительностью в условиях более низкого или более высокого pH по сравнению с нейтральной металлопротеиназой B. amyloliquefaciens дикого типа.
Настоящее изобретение также относится к нейтральным металлопротеиназам, содержащим по меньшей мере часть аминокислотной последовательности, указанной в SEQ ID NO:3, 4 или 18. В некоторых вариантах осуществления нуклеотидные последовательности, кодирующие эти нейтральные металлопротеиназы, содержат нуклеотидную последовательность, выбранную из SEQ ID NO:1, 2, 12 и/или 13. В некоторых вариантах осуществления нейтральные металлопротеиназы представляют собой варианты, обладающие аминокислотными последовательностями, сходными с последовательностями, указанными в SEQ ID NO:3, 4 или 18. В дополнительных вариантах осуществления нейтральные металлопротеиназы представляют собой варианты и/или гомологи. В дополнительных вариантах осуществления нейтральные металлопротеиназы представляют собой металлопротеиназы, указанные на любой из фиг.3-5. В других вариантах осуществления нейтральные металлопротеиназы представляют собой варианты металлопротеиназ, указанных на фиг.3, 4 и/или 5.
Настоящее изобретение также относится к экспрессирующим векторам, содержащим полинуклеотидную последовательность, кодирующую по меньшей мере часть нейтральной металлопротеиназы, указанной в SEQ ID NO:3, 4 или 18. Кроме того, настоящее изобретение относится к экспрессирующим векторам, содержащим полинуклеотидные последовательности, кодирующие по меньшей мере один вариант нейтральной металлопротеиназы, обладающий аминокислотной последовательностью (последовательностями), содержащей по меньшей мере одну замену аминокислоты, выполненную в положении, эквивалентном положению в нейтральной металлопротеиназе Bacillus, содержащей аминокислотную последовательность, указанную в SEQ ID NO:3, 4 или 18. В дополнительных вариантах осуществления настоящее изобретение относится к клеткам-хозяевам, содержащим эти экспрессирующие векторы. В некоторых особенно предпочтительных вариантах осуществления клетки-хозяева выбраны из группы, состоящей из Bacillus sp. Настоящее изобретение также относится к нейтральным металлопротеиназам, продуцируемым клетками-хозяевами.
Настоящее изобретение также относится к композициям, содержащим по меньшей мере часть выделенной нейтральной металлопротеиназы, полученной из Bacillus sp., в частности, B. amyloliquefaciens, где по меньшей мере часть нейтральной металлопротеиназы кодирует полинуклеотидная последовательность, выбранная из SEQ ID NO:1, 2, 12 и/или 13. В дополнительных вариантах осуществления настоящее изобретение относится к клеткам-хозяевам, содержащим эти экспрессирующие векторы. В некоторых особенно предпочтительных вариантах осуществления клетки-хозяева представляют собой Bacillus sp. Настоящее изобретение также относится к нейтральным металлопротеиназам, продуцируемым клетками-хозяевами.
Настоящее изобретение также относится к вариантам нейтральных металлопротеиназ, где нейтральные металлопротеиназы содержат по меньшей мере одну замену, соответствующую положениям аминокислот в SEQ ID NO:3 и/или SEQ ID NO:18, и где варианты металлопротеиназ обладают улучшенной производительностью по меньшей мере для одного признака по сравнению с металлопротеиназой B. amyloliquefaciens дикого типа. В некоторых особенно предпочтительных вариантах осуществления настоящее изобретение также относится к вариантам нейтральных металлопротеиназ, где нейтральные металлопротеиназы содержат по меньшей мере одну замену, соответствующую положениям аминокислот в SEQ ID NO:18, и где варианты металлопротеиназы обладают улучшенной производительностью по меньшей мере для одного признака по сравнению с металлопротеиназой B. amyloliquefaciens дикого типа.
Настоящее изобретение также относится к вариантам аминокислот, где варианты содержат по меньшей мере одну замену аминокислоты, выполненную в положении, эквивалентном положению в нейтральной металлопротеиназе, содержащей аминокислоту, указанную в SEQ ID NO:18, где положение (положения) представляют собой положения 1, 3, 4, 5, 6, 11, 12, 13, 14, 16, 21, 23, 24, 25, 31, 32, 33, 35, 36, 38, 44, 45, 46, 47, 48, 49, 50, 51, 54, 55, 58, 59, 60, 61, 62, 63, 65, 66, 69, 70, 76, 85, 86, 87, 88, 90, 91, 92, 96, 97, 98, 99, 100, 102, 109, 110, 111, 112, 113, 115, 117, 119, 127, 128, 129, 130, 132, 135, 136, 137, 138, 139, 140, 146, 148, 151, 152, 153, 154, 155, 157, 158, 159, 161, 162, 169, 173, 178, 179, 180, 181, 183, 184, 186, 190, 191, 192, 196, 198, 199, 200, 202, 203, 204, 205, 210, 211, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 228, 229, 237, 239, 240, 243, 244, 245, 248, 252, 253, 260, 261, 263, 264, 265, 267, 269, 270, 273, 277, 280, 282, 283, 284, 285, 286, 288, 289, 290, 292, 293, 296, 297 и 299 или выбраны из них.
Настоящее изобретение также относится к выделенным вариантам нейтральной металлопротеиназы, обладающим аминокислотной последовательностью, содержащей по меньшей мере одну замену аминокислоты, выполненную в положении, эквивалентном положению в нейтральной металлопротеиназе, содержащей аминокислотную последовательность, указанную в SEQ ID NO:18. В некоторых вариантах осуществления выделенные варианты нейтральной металлопротеиназы обладают заменами, выполненными в положениях, эквивалентных положениям 1, 3, 4, 5, 6, 11, 12, 13, 14, 16, 21, 23, 24, 25, 31, 32, 33, 35, 36, 38, 44, 45, 46, 47, 48, 49, 50, 51, 54, 55, 58, 59, 60, 61, 62, 63, 65, 66, 69, 70, 76, 85, 86, 87, 88, 90, 91, 92, 96, 97, 98, 99, 100, 102, 109, 110, 111, 112, 113, 115, 117, 119, 127, 128, 129, 130, 132, 135, 136, 137, 138, 139, 140, 146, 148, 151, 152, 153, 154, 155, 157, 158, 159, 161, 162, 169, 173, 178, 179, 180, 181, 183, 184, 186, 190, 191, 192, 196, 198, 199, 200, 202, 203, 204, 205, 210, 211, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 228, 229, 237, 239, 240, 243, 244, 245, 248, 252, 253, 260, 261, 263, 264, 265, 267, 269, 270, 273, 277, 280, 282, 283, 284, 285, 286, 288, 289, 290, 292, 293, 296, 297 и 299 нейтральной металлопротеиназы, содержащей аминокислотную последовательность, указанную в SEQ ID NO:18.
В дополнительных вариантах осуществления выделенный вариант нейтральной металлопротеиназы содержит по меньшей мере одну мутацию, выбранную из T004C, T004E, T004H, T004I, T004K, T004L, T004M, T004N, T004P, T004R, T004S, T004V, T004W, T004Y, G012D, G012E, G012I, G012K, G012L, G012M, G012Q, G012R, G012T, G012V, G012W, K013A, K013C, K013D, K013E, K013F, K013G, K013H, K013I, K013L, K013M, K013N, K013Q, K013S, K013T, K013V, K013Y, T014F, T014G, T014H, T014I, T014K, T014L, T014M, T014P, T014Q, T014R, T014S, T014V, T014W, T014Y, S023A, S023D, S023F, S023G, S023I, S023K, S023L, S023M, S023N, S023P, S023Q, S023R, S023S, S023T, S023V, S023W, S023Y, G024A, G024D, G024F, G024G, G024H, G024I, G024K, G024L, G024M, G024N, G024P, G024R, G024S, G024T, G024V, G024W, G024Y, K033H, Q045C, Q045D, Q045E, Q045F, Q045H, Q045I, Q045K, Q045L, Q045M, Q045N, Q045P, Q045R, Q045T, Q045W, N046A, N046C, N046E, N046F, N046G, N046H, N046I, N046K, N046L, N046M, N046P, N046Q, N046R, N046S, N046T, N046V, N046W, N046Y, R047E, R047K, R047L, R047M, R47Q, R047S, R047T, Y049A, Y049C, Y049D, Y049E, Y049F, Y049H, Y049I, Y049K, Y049L, Y049N, Y049R, Y049S, Y049T, Y049V, Y049W, N050D, N050F, N050G, N050H, N050I, N050K, N050L, N050M, N050P, N050Q, N050R, N050W, N050Y, T054C, T054D, T054E, T054F, T054G, T054H, T054I, T054K, T054L, T054M, T054N, T054P, T054Q, T054R, T054S, T054V, T054W, T054Y, S058D, S058H, S058I, S058L, S058N, S058P, S058Q, T059A, T059C, T059E, T059G, T059H, T059I, T059K, T059L, T059M, T059N, T059P, T059Q, T059R, T059S, T059V, T059W, T060D, T060F, T060I, T060K, T060L, T060N, T060Q, T060R, T060V, T060W, T060Y, T065C, T065E, T065F, T065H, T065I, T065K, T065L, T065M, T065P, T065Q, T065R, T065V, T065Y, S066C, S066D, S066E, S066F, S066H, S066I, S066K, S066L, S066N, S066P, S066Q, S066R, S066T, S066V, S066W, S066Y, Q087A, Q087D, Q087E, Q087H, Q087I, Q087K, Q087L, Q087M, Q087N, Q087R, Q087S, Q087T, Q087V, Q087W, N090C, N090D, N090E, N090F, N090G, N090H, N090K, N090L, N090R, N090T, N096G, N096H, N096K, N096R, K097H, K097Q, K097W, K100A, K100D, K100E, K100F, K100H, K100N, K100P, K100Q, K100R, K100S, K100V, K100Y, R110A, R110C, R110E, R110H, R110K, R110L, R110M, R110N, R110Q, R110S, R110Y, D119E, D119H, D119I, D119L, D119Q, D119R, D119S, D119T, D119V, D119W, G128C, G128F, G128H, G128K, G128L, G128M, G128N, G128Q, G128R, G128W, G128Y, S129A, S129C, S129D, S129F, S129G, S129H, S129I, S129K, S129L, S129M, S129Q, S129R, S129T, S129V, S129W, S129Y, F130I, F130K, F130L, F130M, F130Q, F130R, F130T, F130V, F130Y, S135P, G136I, G136L, G136P, G136V, G136W, G136Y, S137A, M138I, M138K, M138L, M138Q, M138V, D139A, D139C, D139E, D139G, D139H, D139I, D139K, D139L, D139M, D139P, D139R, D139S, D139V, D139W, D139Y, V140C, Q151I, E152A, E152C, E152D, E152F, E152G, E152H, E152L, E152M, E152N, E152R, E152S, E152W, N155D, N155K, N155Q, N155R, D178A, D178C, D178G, D178H, D178K, D178L, D178M, D178N, D178P, D178Q, D178R, D178S, D178T, D178V, D178W, D178Y, T179A, T179F, T179H, T179I, T179K, T179L, T179M, T179N, T179P, T179Q, T179R, T179S, T179V, T179W, T179Y, E186A, E186C, E186D, E186G, E186H, E186K, E186L, E186M, E186N, E186P, E186Q, E186R, E186S, E186T, E186V, E186W, E186Y, V190H, V190I, V190K, V190L, V190Q, V190R, S191F, S191G, S191H, S191I, S191K, S191L, S191N, S191Q, S191R, S191W, L198M, L198V, S199C, S199D, S199E, S199F, S199I, S199K, S199L, S199N, S199Q, S199R, S199V, Y204H, Y204T, G205F, G205H, G205L, G205M, G205N, G205R, G205S, G205Y, K211A, K211C, K211D, K211G, K211M, K211N, K211Q, K211R, K211S, K211T, K211V, K214A, K214C, K214E, K214I, K214L, K214M, K214N, K214Q, K214R, K214S, K214V, L216A, L216C, L216F, L216H, L216Q, L216R, L216S, L216Y, N218K, N218P, T219D, D220A, D220E, D220H, D220K, D220N, D220P, A221D, A221E, A221F, A221I, A221K, A221L, A221M, A221N, A221S, A221V, A221Y, G222C, G222H, G222N, G222R, Y224F, Y224H, Y224N, Y224R, T243C, T243G, T243H, T243I, T243K, T243L, T243Q, T243R, T243W, T243Y, K244A, K244C, K244D, K244E, K244F, K244G, K244L, K244M, K244N, K244Q, K244S, K244T, K244V, K244W, K244Y, V260A, V260D, V260E, V260G, V260H, V260I, V260K, V260L, V260M, V260P, V260Q, V260R, V260S, V260T, V260W, V260Y, Y261C, Y261F, Y261I, Y261L, T263E, T263F, T263H, T263I, T263L, T263M, T263Q, T263V, T263W, T263Y, S265A, S265C, S265D, S265E, S265K, S265N, S265P, S265Q, S265R, S265T, S265V, S265W, K269E, K269F, K269G, K269H, K269I, K269L, K269M, K269N, K269P, K269Q, K269S, K269T, K269V, K269W, K269Y, A273C, A273D, A273H, A273I, A273K, A273L, A273N, A273Q, A273R, A273Y, R280A, R280C, R280D, R280E, R280F, R280G, R280H, R280K, R280L, R280M, R280S, R280T, R280V, R280W, R280Y, L282F, L282G, L282H, L282I, L282K, L282M, L282N, L282Q, L282R, L282V, L282Y, S285A, S285C, S285D, S285E, S285K, S285P, S285Q, S285R, S285W, Q286A, Q286D, Q286E, Q286K, Q286P, Q286R, A289C, A289D, A289E, A289K, A289L, A289R, A293C, A293R, N296C, N296D, N296E, N296K, N296R, N296V, A297C, A297K, A297N, A297Q, A297R и G299N.
В дополнительных вариантах осуществления настоящее изобретение относится к выделенным вариантам нейтральных металлопротеиназ, где металлопротеиназы содержат множественные мутации, выбранные из S023W/G024M, T004V/S023W/G024W, S023W/G024Y/A288V, T004L/S023W/G024Y, N046Q/N050F/T054L, N050Y/T059R/S129Q, S023W/G024W, A273H/S285P/E292G, S023Y/G024Y, S023Y/G024W, T004S/S023Y/G024W, N046Q/T054K, S023W/G024Y, T004V/S023W, T059K/S066N, N046Q/N050W/T054H/T153A, T004V/S023W/G024Y, L282M/Q286P/A289R, N046Q/R047K/N050Y/T054K, L044Q/T263W/S285R, T004L/S023W/G024W, R047K/N050F/T054K, A273H/S285R, N050Y/T059K/S066Q, T054K/Q192K, N046Q/N050W, L282M/Q286K, T059K/S066Q, T004S/S023W, L282M/Q286R/A289R/K011N, L282M/A289R, N046Q/N050W/T054H, T059K/S129Q, T004S/S023N/G024Y/F210L, T004V/S023W/G024M/A289V, L282M/Q286K/A289R/S132T, N050W/T054H, L282M/Q286R, L282F/Q286K/A289R, T059R/S066Q, R047K/N050W/T054H, S265P/L282M/Q286K/A289R, L282M/Q286R/T229S, L282F/Q286K, T263W/S285R, S265P/L282M/Q286K, T263H/A273H/S285R, T059R/S129V, S032T/T263H/A273H/S285R, T059R/S066Q/S129Q, T004S/G024W, T004V/S023W/G024M, T059K/S066Q/S129Q, L282M/Q286K/A289R/I253V, T004V/S023Y/G024W, T059R/S066N/S129Q, N050F/T054L, T004S/S023N/G024W, T059R/S066N, T059R/S066N/S129V, Q286R/A289R, N046Q/R047K/N050F/T054K, S265P/L282M/Q286P/A289R, S265P/L282M/Q286R/A289R, Q062K/S066Q/S129I, S023N/G024W, N046Q/R047K/N050W/T054H, R047K/T054K, T004L/G024W, T014M/T059R/S129V, T059R/S066Q/N092S/S129I, R047K/N050W/T054K, T004V/G024W, N047K/N050F/T054K, S265P/L282F/Q286K/N061Y, L282F/Q286K/E159V, T004V/S023Y/G024M, S265P/L282F/A289R/T065S, T059K/F063L/S066N/S129V, T004L/S023W, N050F/T054H, T059R/S066Q/S129V, V190I/D220E/S265W/L282F, T004S/S023Y/G024M, T004L/S023N/G024Y, T059K/S066N/S129I, T059R/S066N/S129I, L282M/Q286R/A289R/P162S, N046Q/N050F/T179N, T059K/Y082C/S129V, T059K/S129I, N050Y/T054K, T059K/S066Q/V102A/S129Q, T059R/S066Q/S129I, T059W/S066N/S129V/S290R, T059R/S129I, T059K/S066Q/S129I, T059K/S066Q/S129V, S265P/L282M/Q286R/A289R/T202S/K203N, T004V/S023N/G024W, S265P/Q286K, S265P/L282F/A289R, D220P/S265W, L055F/T059W/S129V, T059R/S129Q/S191R, N050W/T054K, T004S/S023W/G024M, R047K/N050F/T054H, T059K/S066N/K088E, T059K/S066Q/S129I/V291L, L282M/Q286R/A289R, T059R/S066N/F085S/S129I, L282F/Q286P/A289R, L282F/Q286R/A289R, G099D/S265P/L282F/Q286K/A289R, N046Q/N050F, N050Y/T059W/S066N/S129V, T009I/D220P/S265N, V190F/D220P/S265W, N157Y/T263W/A273H/S285R, T263W/A273H/S285R, T263W/S285W, T004V/S023Y, N046Q/R047K/N050W, N050W/T054L, N200Y/S265P/L282F/Q286P/A289R, T059R/S066Q/P264Q, T004V/G024Y, T004L/G024Y, N050Y/S191I, N050Y/T054L, T004L/S023W/G024Y/N155K, F169I/L282F/Q286R/A289R, L282M/Q286K/A289R, F130L/M138L/E152W/D183N, N046Q/R047K/N050Y/T054H, T004V/G024M, N050Y/T059W/S066Q/S129V, S023N/G024Y, T054H/P162Q, T004S/S023W/G024Y, N050Y/T054H, L282F/Q286R/A289R/F169I, R047K/N050W, V190F/D220P, L282M/F173Y, T004L/S023Y, N050W/A288D, V190I/D220P/S265Q, S265P/L282F/Q286P/A289R, S265P/L282F/Q286R/A289R, N046Q/N050Y/T054K, T059W/S066Q, T263W/A273H/S285W, T263W/A273H/S285P, S023Y/G024M, T004L/S023N/G024W, T004V/S023N/G024Y, T059W/S066N/S129Q, T004S/S023Y, T004S/S023N/G024M, T059W/S066N/A070T, T059W/S066Q/S129Q, T263W/A273H, A273H/285P, N046Q/R047K/N050Y/T054L, N046Q/R047K/N050Y, R047K/N050Y, T263H/S285W, R047K/N050F, N046Q/R047K/N050F/T054H, S023N/G024M, T004S/G024Y, R047K/N050Y/T054H, T059W/S066N/S129I, R047K/T054L, T004S/S023W/G024W, M138L/E152F/T146S, D220P/S265N, T004S/G024M, T004V/S023N, N046Q/N050F/T054K, N046Q/N050Y/T054H, Q062H/S066Q/S129Q, T059W/S129Q, T059W/S129V, N050F/T054K, R047K/N050F/T054L, V190I/D220P/S265W, N112I/T263H/A273H/S285R, T059W/S066N/S129V, T059W/S066Q/S129I, T059W/S129I, T263W/S285P, V190I/D220P, A289V/T263H/A273H, T263H/A273H/S285P, N90S/A273H/S285P, R047K/N050Y/T054L, T004S/S023N, T059R/S129Q, N046Q/R047K/T054H, T059W/S066Q/S129V, E152W/T179P, N050Y/S066Q/S129V, T202S/T263W/A273H, T263W/A273H/S285P, M138L/E152W/T179P, N046Q/R047K, N046Q/T054H/F176L, T004L/G024M, T004S/L282M, T263H/A273H, T263H/A273H/S285W, T004L/S023Y/G024M, L282F/Q286P, T004V/S023Y/G024Y, V190F/S265W, M138L/E152F, V190F/D220E/S265W, N046Q/N050F/T054H, N157Y/S285W, T004F/S023Y/G024M, T004V/S023N/G024M, L198I/D220E/S265Q, N046Q/N050Y/T054K/A154T, S016L/D220E/S265W, D220E/S265W, D220E/A237S/S265W, S066Q/S129Q, V190F/D220E/S265Q/T267I, L282M/F173Y/T219S, E152F/T179P, V190I/S265W, M138L/S066Q, M138L/E152W, T059W/S066Q/A070T/S129I, V190F/D220E/S265N, V190F/S265N, N046Q/N050Y и M138L/E152F/T179P.
В дополнительных вариантах осуществления настоящее изобретение относится к выделенным вариантам нейтральных металлопротеиназ, где металлопротеиназы содержат множественные мутации, выбранные из V190I/D220P, V190I/D220P/S265Q, V190L/D220E, V190I/D220E/S265Q, V190I/D220E/S265W/L282F, V190L/D220E/S265Q, V190I/D220E/S265W, V190L/D220E/S265N, T059R/S066Q/S129I, V190I/D220E/S265N, V190L/D220E/S265W, V190I/D220E, T059W/S066N/S129V, T059K/S066Q/S129V, T059K/Y082C/S129V, T059R/S066N/S129I, S066Q/S129V, T059R/S066Q/S129V, T059R/S129I, N050Y/T059W/S066N/S129V, D220P/S265N, S066Q/S129I, T059W/S066Q/S129V, T059K/S066Q/S129I, T059R/S129V, N050Y/S066Q/S129V, T059W/S066Q/S129I, N050Y/T059W/S066Q/S129V, T059K/S129I, D220P/S265W, F130L/M138L/T179P, S066N/S129I, T059R/S066N/S129V, F130I/M138L/T179P, T059R/S066Q/N092S/S129I, S066N/S129V, D220E/S265Q, F130L/M138L/E152W/T179P, T059W/S129V, S265P/L282M/Q286R/A289R, S265P/L282F/Q286R/A289R, T059W/S066N/S129I, V190I/D220P/S265W, F130L/E152W/T179P, F130L/M138L/E152F/T179P, Q062K/S066Q/S129I, T059K/S066N/S129I, E152H/T179P, S265P/L282M/Q286K/A289R, F130L/M138L/E152H/T179P, T263W/A273H/S285R, D220E/S265N, F130I/M138L/E152H/T179P, F130V/M138L/E152W/T179P, F130I/M138L/E152W/T179P, T059W/S129I, D220E/S265W, F130V/M138L/T179P, F130L/E152V/T179P, T059R/S129Q, T263W/S285P, F130I/M138L/E152F/T179P, E152W/T179P, V190L/S265Q, F130L/E152F/T179P, L282M/Q286R/A289R/P162S, D220P/S265Q, M138L/E152F/T179P, F130I/E152H/T179P, M138L/E152W/T179P, F130L/T179P, F130L/M138L/E152W/T179P/Q286H, F130L/M138L/E152H, T263W/A273H/S285W, S265P/Q286K, T059W/S066Q/S129Q, T263W/S285R, T059W/S066N/S129Q, T263W/S285W, T059R/S066N/S129Q, S265P/L282M/Q286R/A289R/T202S/K203N, T059W/S129Q, Q062H/S066Q/S129Q, L282M/Q286R/A289R, V190L/D220E/S265N/V291I, V190L/S265N, F130L/M138L/E152W, N050Y/T059R/S129Q, F130I/T179P, T059K/S066Q/S129Q, T059K/S129Q, S265P/L282M/Q286P/A289R, S265P/L282F/Q286P/A289R, T263W/A273H/S285P, S265P/L282M/Q286K, S016L/D220E/S265W, S066Q/S129Q, S265P/L282M/Q286P, L282F/Q286R/A289R, F130V/E152W/T179P, L044Q/T263W/S285R, L055F/T059W/S129V, V190L/S265W, Q286R/A289R, G99D/S265P/L282F/Q286K/A289R, F130L/M138L/E152F, T059R/S066Q/S129Q, F130L/E152H, S066N/S129Q, T004S/S023N/G024M/K269N, S265P/L282M, E152F/T179P, T059W/S066N/S129V/S290R, L282F/Q286K/A289R, F130L/M138L, F130I/M138L/E152W, S265P/L282F, F130I/M138L/E152H, F130V/M138L/E152H, V190I/S265Q, M138L/E152M, S265P/L282F/Q286P, M138L/E152H, T059K/S066N/K088E, V190I/S265W, F130L/E152W, L282M/Q286K/A289R, L282M/Q286K/A289R/I253V, T263W/A273H, V190I/S265N, M138L/E152W, A273H/S285R, F130I/M138L, F130L/E152F, F130V/M138L/E152W, T059K/S066Q/V102A/S129Q, F130V/E152H/T179P, F130I/M138L/E152F, F130V/M138L/E152F, M138L/E152F, L282M/Q286R, F130I/E152H, S265P/L282F/A289R/T065S, T263H/A273H/S285R, F130V/M138L, T014M/T059R/S129V, L282M/Q286R/A289R/K11N, A273H/S285P, L282M/Q286K/A289R/S132T, T263H/A273H/S285W, F130V/E152W, S265P/L282F/Q286K/N061Y, F130I/E152W, L198I/D220E/S265Q, V190I/S265L, T263H/S285W, S265P/L282F/A289R, M138L/S066Q, F130I/E152F, N90S/A273H/S285P, S032T/T263H/A273H/S285R, L282F/Q286P/A289R, N157Y/T263W/A273H/S285R, V105A/S129V, T263H/A273H/S285P, S129Q/L282H, T059W/S066Q, F130V/E152H, S023W/G024Y, T004V/S023N, T059R/S066Q, N050W/T054L, L282M/Q286P/A289R, A115V/V190L/S265W, L282M/Q286K, T059R/S066N, L282F/Q286P, T004V/S023W/G024M, S265P/L282F/Q286R/L78H, L282F/Q286K, T004V/S023W/G024Y, S023W/G024M, T059R/R256S, F130V/E152F, T004V/G024W, N050W/T054K, S023Y/G024M, T004V/S023Y, T004V/S023Y/G024M, N050Y/T054H, S023W/G024W, T004V/S023Y/G024Y, T004V/S023N/G024W, F130L/M138L/E152F/T179P/V291I, N050Y/T059K/S066Q, T004V/S023Y/G024W, T059K/S066N, T004V/S023N/G024Y, S023Y/G024W, N050F/T054L, R047K/T054K, S023N/G024W, L282M/A289R, S023Y/G024Y, T004V/G024M, R047K/N050F/T054K, N050F/T054K, T059K/S066Q, S023N/G024M, S023N/G024Y, T004L/S023N, R047K/N050W/T054H, T004L/S023W/G024Y, T004S/S023W, N046Q/N050W/T054H/A142T, T004L/S023Y, T004V/S023W, N050W/T054H, T004S/S023N, T004S/L282M, T004L/S023W, N050F/T054H, N050Y/T054L и R047K/N050W/T054K.
В дополнительных вариантах осуществления настоящее изобретение относится к выделенным нейтральным металлопротеиназам, содержащим множественные мутации, выбранные из S066Q/S129V, S066Q/S129I, N050Y/S066Q/S129V, S066N/S129I, T059K/S066Q/S129V, S066N/S129V, F130L/E152W/T179P, S265P/L282M/Q286R/A289R, F130L/E152V/T179P, T059K/S066Q/S129I, T263W/S285P, T059K/S066N/S129I, T263W/A273H/S285P, S265P/L282F/Q286R/A289R, F130V/E152W/T179P, T263W/A273H/S285R, V190I/D220P/S265W, F130L/E152H, S066N/S129Q, S265P/L282M/Q286K/A289R, V190I/D220E, T059R/S066N/S129I, V190I/D220E/S265W, T059K/S129I, T059R/S066Q/S129I, F130I/M138L/E152H/T179P, F130I/T179P, T263W/A273H/S285W, S016L/D220E/S265W, S066Q/S129Q, V190I/D220E/S265Q, T059R/S066Q/S129V, D220E/S265N, V190L/D220E, D220E/S265W, V190I/D220P, V190L/D220E/S265N, L044Q/T263W/S285R, S265P/L282M/Q286P/A289R, F130L/M138L/E152H/T179P, T263W/S285R, L282M/Q286R/A289R, T263W/S285W, F130I/E152H/T179P, V190I/D220E/S265N, V190L/D220E/S265W, V190I/D220P/S265Q, T059R/S066N/S129V, V190L/D220E/S265Q, E152H/T179P, F130L/M138L/E152F/T179P, Q062H/S066Q/S129Q, T059R/S129V, V190I/D220E/S265W/L282F, V190I/S265Q, F130L/E152F/T179P, D220E/S265Q, E152W/T179P, T059K/S066Q/S129Q, F130L/M138L/T179P, F130I/M138L/E152F/T179P, F130L/M138L/E152W/T179P, N050Y/T059W/S066Q/S129V, S265P/L282M/Q286K, T059R/S129I, F130V/E152H/T179P, D220P/S265N, S265P/L282M/Q286P, F130I/E152H, T059R/S066Q/N092S/S129I, F130L/T179P, G99D/S265P/L282F/Q286K/A289R, T263W/A273H, V190I/S265N, D220P/S265W, F130L/E152W, F130L/M138L/E152H, S265P/L282M, V190I/S265Q, F130L/E152F, T059K/S129Q, Q286R/A289R, M138L/E152W/T179P, F130I/M138L/E152H, D220P/S265Q, V190L/S265N, F130I/M138L/E152W, S265P/Q286K, V190L/S265Q, V190I/S265W, F130L/M138L/E152F, F130V/E152H, E152F/T179P, N050Y/T059W/S066N/S129V, T059R/S066N/S129Q, F130I/E152W, F130V/E152W, T059R/S066Q/S129Q, T263H/A273H/S285P, N90S/A273H/S285P, V190L/D220E/S265N/V291I, T059R/S129Q, A273H/S285P, F130I/M138L/E152W/T179P, F130V/M138L/E152F, N050Y/T059R/S129Q, T059W/S066Q/S129I, F130V/M138L/T179P, F130V/M138L/E152W/T179P, V190L/S265W, F130V/M138L/E152W, T059W/S066Q/S129V, V190I/S265Q, F130V/M138L/E152H, F130I/E152F, N157Y/T263W/A273H/S285R, T263H/S285W, M138L/E152F/T179P, A115V/V190L/S265W, M138L/E152M, T263H/A273H/S285W, F130L/M138L/E152W, T059K/S066N/K088E, F130I/M138L/E152F, F130I/M138L/T179P, T004V/S023N, T059K/S066Q/V102A/S129Q, F130L/M138L, N047K/N050F/T054K, T263H/A273H/S285R, F130L/M138L/E152W/T179P/Q286H, M138L/E152H, M138L/S066Q, L282M/Q286R/A289R/P162S, L282F/Q286R/A289R, Q062K/S066Q/S129I, A273H/S285R, S265P/L282F/Q286P, S265P/L282F/Q286P/A289R, S265P/L282M/Q286R/A289R/T202S/K203N, T059W/S066N/S129I, V190I/S265L, T059W/S066N/S129V, F130I/M138L, L282M/Q286K/A289R/I253V, R047K/N050F/T054K, M138L/E152F, N050W/T054K, L198I/D220E/S265Q, L282F/Q286K/A289R, N050F/T054K, L282M/Q286R, M138L/E152W, S265P/L282F, F130V/E152F, T059W/S066N/S129Q, F130V/M138L, T263H/A273H, L282M/Q286K/A289R, N046Q/N050W/T054H/A142T, T059W/S066Q/S129Q, S265P/L282F/A289R/T065S, N050F/T054H, S129Q/L282H, L282M/Q286K/A289R/S132T, L282M/Q286R/A289R/K11N, T059K/S066N, R047K/N050W/T054K, T059K/S066Q, T004V/S023Y, T059W/S066N/S129V/S290R, N050Y/T059K/S066Q и R047K/N050Y.
Настоящее изобретение также относится к выделенным полинуклеотидам, содержащим нуклеотидную последовательность, (i) обладающую по меньшей мере 70% идентичностью с SEQ ID NO:1, 2, 12 и/или 13, или (ii) способную гибридизоваться с зондом, полученным из любой из нуклеотидных последовательностей, указанной здесь, включая последовательности праймеров, приведенные в примерах, в условиях от средней до высокой жесткости, или (iii) комплементарную нуклеотидной последовательности, указанной в SEQ ID NO:1, 2, 12 и/или 13. В некоторых вариантах осуществления настоящее изобретение относится к экспрессирующим векторам, кодирующим по меньшей мере один такой полинуклеотид. В дополнительных вариантах осуществления настоящее изобретение относится к клеткам-хозяевам, содержащим эти экспрессирующие векторы. В некоторых особенно предпочтительных вариантах осуществления клетки-хозяева представляют собой Bacillus sp. Настоящее изобретение также относится к нейтральным металлопротеиназам, продуцируемым клетками-хозяевами. В дополнительных вариантах осуществления настоящее изобретение относится к полинуклеотидам, комплементарным по меньшей мере части последовательности, указанной в SEQ ID NO:1, 2, 12 и/или 13.
Настоящее изобретение также относится к способам получения фермента, обладающего активностью нейтральной металлопротеиназы, включающим в себя трансформацию клетки-хозяина экспрессирующим вектором, содержащим полинуклеотид, обладающий по меньшей мере 70% идентичностью последовательности с SEQ ID NO:1, 2, 12 и/или 13; культивирование трансформированной клетки-хозяина в условиях, подходящих клеткой-хозяином. В некоторых предпочтительных вариантах осуществления клетка-хозяин представляет собой виды Bacillus.
Настоящее изобретение также относится к зондам, содержащим последовательность от 4 до 150 нуклеотидов, в основном идентичных соответствующему фрагменту SEQ ID NO:1, 2, 12 и/или 13, где зонд используют для детекции последовательности нуклеиновой кислоты, кодирующей фермент, обладающий активностью металлопротеиназы. В некоторых вариантах осуществления последовательность нуклеиновой кислоты получена из Bacillus sp.
Настоящее изобретение также относится к очищающим композициям, содержащим по меньшей мере одну нейтральную металлопротеиназу, полученную из Bacillus sp. В некоторых вариантах осуществления по меньшей мере одна нейтральная металлопротеиназа получена из B. amyloliquefaciens. В некоторых особенно предпочтительных вариантах осуществления по меньшей мере одна нейтральная металлопротеиназа содержит аминокислотную последовательность, указанную в SEQ ID NO:3, 4 и/или 18. В некоторых дополнительных вариантах осуществления настоящее изобретение относится к выделенным нейтральным металлопротеиназам, содержащим по меньшей мере 45% аминокислот, идентичных нейтральной металлопротеиназе, содержащей SEQ ID NO:3, 4 и/или 18. В некоторых вариантах осуществления выделенные нейтральные металлопротеиназы обладают по меньшей мере 50% идентичностью, предпочтительно по меньшей мере 55%, более предпочтительно по меньшей мере 60%, еще более предпочтительно по меньшей мере 65%, даже более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 75%, еще более предпочтительно по меньшей мере 80%, более предпочтительно 85%, еще более предпочтительно 90%, даже более предпочтительно по меньшей мере 95% и наиболее предпочтительно 99% идентичностью с SEQ ID NO:3, 4 и/или 18.
Кроме того, настоящее изобретение относится к очищающим композициям, содержащим по меньшей мере одну нейтральную металлопротеиназу, где по меньшей мере одна из нейтральных металлопротеиназ обладает иммунологической перекрестной реактивностью с нейтральной металлопротеиназой, полученной из Bacillus sp. В некоторых предпочтительных вариантах осуществления нейтральные металлопротеиназы обладают иммунологической перекрестной реактивностью с нейтральной металлопротеиназой, полученной из B. amyloliquefaciens. В альтернативных вариантах осуществления нейтральные металлопротеиназы обладают иммунологической перекрестной реактивностью с нейтральной металлопротеиназой, содержащей аминокислотную последовательность, указанную в SEQ ID NO:3, 4 и/или 18. В дополнительных вариантах осуществления нейтральные металлопротеиназы обладают перекрестной реактивностью с фрагментами (т.е. частями) нейтральной металлопротеиназы Bacillus sp. и/или нейтральной металлопротеиназы, содержащей аминокислотную последовательность, указанную в SEQ ID NO:3, 4 и/или 18. Кроме того, настоящее изобретение относится к очищающим композициям, содержащим по меньшей мере одну нейтральную металлопротеиназу, где нейтральная металлопротеиназа представляет собой вариант нейтральной металлопротеиназы, обладающий аминокислотной последовательностью, содержащей по меньшей мере одну замену аминокислоты, выполненную в положении, эквивалентном положению в нейтральной металлопротеиназе Bacillus sp., обладающей аминокислотной последовательностью, указанной в SEQ ID NO:3, 4 и/или 18, в частности, нейтральной металлопротеиназе B. amyloliquefaciens. В некоторых особенно предпочтительных вариантах осуществления настоящее изобретение также относится к очищающим композициям, содержащим по меньшей мере одну нейтральную металлопротеиназу, где нейтральная металлопротеиназа представляет собой вариант нейтральной металлопротеиназы, обладающий аминокислотной последовательностью, содержащей по меньшей мере одну замену аминокислоты, выполненную в положении, эквивалентном положению нейтральной металлопротеиназы Bacillus sp., обладающей аминокислотной последовательностью, указанной в SEQ ID NO:18, в частности, нейтральной металлопротеиназы B. amyloliquefaciens.
В дополнительных вариантах осуществления очищающие композиции содержат по меньшей мере одну нейтральную металлопротеиназу, содержащую набор мутаций в SEQ ID NO:3, 4 и/или 18. В некоторых особенно предпочтительных вариантах осуществления варианты нейтральной металлопротеиназы содержат по меньшей мере одну замену, соответствующую положениям аминокислот в SEQ ID NO:3, 4 и/или 18, где варианты нейтральных металлопротеиназ обладают улучшенной производительностью по меньшей мере по одному признаку по сравнению с нейтральной металлопротеиназой B. amyloliquefaciens дикого типа.
Настоящее изобретение также относится к очищающим композициям, содержащим эффективное для очистки количество по меньшей мере одного металлопротеиназного фермента, где фермент содержит аминокислотную последовательность, обладающую по меньшей мере 70% идентичностью последовательности с SEQ ID NO:3, 4 и/или 18, и подходящий очищающий состав. В некоторых предпочтительных вариантах осуществления очищающие композиции дополнительно содержат один или несколько дополнительных ферментов или производных ферментов, выбранных из группы, состоящей из протеаз, амилаз, липаз, маннаназ, пектиназ, кутиназ, оксидоредуктаз, гемицеллюлаз и целлюлаз.
Настоящее изобретение также относится к композициям, содержащим по меньшей мере одну нейтральную металлопротеиназу, полученную из Bacillus sp., в частности, B. amyloliquefaciens, где композиции дополнительно содержат по меньшей мере один стабилизатор. В некоторых вариантах осуществления стабилизатор выбран из боракса, глицерина, ионов цинка, ионов кальция и формата кальция. В некоторых вариантах осуществления настоящее изобретение относится к конкурентным ингибиторам, подходящим для стабилизации фермента согласно изобретению против анионных поверхностно-активных веществ. В некоторых вариантах осуществления по меньшей мере одна нейтральная металлопротеиназа получена из Bacillus sp. В некоторых особенно предпочтительных вариантах осуществления по меньшей мере одна нейтральная металлопротеиназа получена из B. amyloliquefaciens. В некоторых особенно предпочтительных вариантах осуществления по меньшей мере одна нейтральная металлопротеиназа содержит аминокислотную последовательность, указанную в SEQ ID NO:3, 4 и/или 18.
Кроме того, настоящее изобретение относится к композициям, содержащим по меньшей мере одну нейтральную металлопротеиназу, полученную из Bacillus sp., где нейтральная металлопротеиназа представляет собой устойчивый к автолизу вариант. В некоторых вариантах осуществления по меньшей мере один вариант нейтральной металлопротеиназы получен из B. amyloliquefaciens. В некоторых особенно предпочтительных вариантах осуществления по меньшей мере один вариант нейтральной металлопротеиназы содержит аминокислотную последовательность, указанную в SEQ ID NO:3, 4 и/или 18.
Настоящее изобретение также относится к очищающим композициям, содержащим по меньшей мере 0,0001 массового процента нейтральной металлопротеиназы согласно изобретению и, необязательно, дополнительный ингредиент. В некоторых вариантах осуществления композиция содержит дополнительный ингредиент. В некоторых предпочтительных вариантах осуществления композиция содержит достаточное количество модификатора pH для обеспечения точного pH композиции приблизительно от 3 до приблизительно 5, где композиция является в основном свободной от материалов, гидролизующихся при pH приблизительно от 3 до приблизительно 5. В некоторых особенно предпочтительных вариантах осуществления гидролизующиеся материалы содержат материал поверхностно-активного вещества. В дополнительных вариантах осуществления очищающая композиция представляет собой жидкую композицию, тогда как в других вариантах осуществления очищающая композиция представляет собой твердую композицию, и еще в дополнительных вариантах осуществления очищающая композиция представляет собой гель. Действительно, не подразумевают, что настоящее изобретение ограничено каким-либо конкретным составом и/или композицией, так как различные составы и/или композиции находят применение согласно изобретению. В дополнительных вариантах осуществления материал поверхностно-активного вещества содержит поверхностно-активное вещество алкилсульфат натрия, содержащее группу этиленоксида.
Настоящее изобретение, кроме того, относится к очищающим композициям, которые, в дополнение по меньшей мере к одной нейтральной металлопротеиназе согласно изобретению, дополнительно содержат по меньшей мере один устойчивый к кислоте фермент, где очищающая композиция содержит достаточное количество модификатора pH для обеспечения точного pH композиции приблизительно от 3 до приблизительно 5, где композиция является в основном свободной от материалов, гидролизующихся при pH приблизительно от 3 до приблизительно 5. В дополнительных вариантах осуществления гидролизующиеся материалы содержат материал поверхностно-активного вещества. В некоторых предпочтительных вариантах осуществления очищающая композиция представляет собой жидкую композицию. В дополнительных вариантах осуществления материал поверхностно-активного вещества содержит поверхностно-активное вещество алкилсульфат натрия, содержащее группу этиленоксида. В некоторых вариантах осуществления очищающая композиция содержит подходящий дополнительный ингредиент. В некоторых дополнительных вариантах осуществления композиция содержит подходящий дополнительный ингредиент. В некоторых предпочтительных вариантах осуществления композиция содержит приблизительно от 0,001 до 0,5 массовых % нейтральной металлопротеиназы.
В некоторых альтернативных предпочтительных вариантах осуществления композиция содержит приблизительно от 0,01 до приблизительно 0,1 массовых процентов нейтральной металлопротеиназы.
Настоящее изобретение также относится к способам очистки, включающим в себя стадии: a) контактирования поверхности и/или изделия, содержащего ткань, с очищающей композицией, содержащей нейтральную металлопротеиназу согласно изобретению в соответствующей концентрации; и b) необязательно, стирки и/или ополаскивания поверхности или материала. В альтернативных вариантах осуществления любая подходящая композиция, представленная здесь, находит применение в этих способах. В некоторых вариантах осуществления ткань содержит по меньшей мере одно загрязнение травой. В некоторых особенно предпочтительных вариантах осуществления очищающие композиции согласно изобретению находят применение в удалении травы и других загрязнений с тканей.
Настоящее изобретение также относится к корму для животных, содержащему по меньшей мере одну нейтральную металлопротеиназу, полученную из Bacillus sp. В некоторых вариантах осуществления по меньшей мере одна нейтральная металлопротеиназа получена из B. amyloliquefaciens. В некоторых особенно предпочтительных вариантах осуществления по меньшей мере одна нейтральная металлопротеиназа содержит аминокислотную последовательность, указанную в SEQ ID NO:3, 4 или 18. В некоторых альтернативных особенно предпочтительных вариантах осуществления по меньшей мере одна нейтральная металлопротеиназа содержит аминокислотную последовательность, указанную в SEQ ID NO:18.
Настоящее изобретение относится к выделенному полипептиду, обладающему металлопротеиназной активностью (например, нейтральной металлопротеиназе), обладающей аминокислотной последовательностью, указанной в SEQ ID NO:18. В некоторых вариантах осуществления настоящее изобретение относится к выделенным полипептидам, обладающим приблизительно от 40% до 98% идентичностью с последовательностью, указанной в SEQ ID NO:18. В некоторых предпочтительных вариантах осуществления полипептиды обладают приблизительно от 50% до 95% идентичностью с последовательностью, указанной в SEQ ID NO:18. В некоторых дополнительных предпочтительных вариантах осуществления полипептиды обладают приблизительно от 60% до 90% идентичностью с последовательностью, указанной в SEQ ID NO:18. В дополнительных вариантах осуществления полипептиды обладают приблизительно от 65% до 85% идентичностью с последовательностью, указанной в SEQ ID NO:3, 4 или 18. В некоторых особенно предпочтительных вариантах осуществления полипептиды обладают приблизительно от 90% до 95% идентичностью с последовательностью, указанной в SEQ ID NO:3, 4 или 18.
Кроме того, настоящее изобретение относится к выделенным полинуклеотидам, кодирующим нейтральные металлопротеиназы, содержащие аминокислотную последовательность, обладающую по меньшей мере 40% идентичностью аминокислотной последовательностью с SEQ ID NO:3, 4 или 18. В некоторых вариантах осуществления нейтральные металлопротеиназы обладают по меньшей мере 50% идентичностью аминокислотной последовательности с SEQ ID NO:3, 4 и/или 18. В некоторых вариантах осуществления нейтральные металлопротеиназы обладают по меньшей мере 60% идентичностью аминокислотной последовательности с SEQ ID NO:3, 4 или 18. В некоторых вариантах осуществления нейтральные металлопротеиназы обладают по меньшей мере 70% идентичностью аминокислотной последовательности с SEQ ID NO:3, 4 или 18. В некоторых вариантах осуществления нейтральные металлопротеиназы обладают по меньшей мере 80% идентичностью аминокислотной последовательности с SEQ ID NO:3, 4 или 18. В некоторых вариантах осуществления нейтральные металлопротеиназы обладают по меньшей мере 90% идентичностью аминокислотной последовательности с SEQ ID NO:3, 4 или 18. В некоторых вариантах осуществления нейтральные металлопротеиназы обладают по меньшей мере 95% идентичностью аминокислотной последовательности с SEQ ID NO:3, 4 или 18. Настоящее изобретение также относится к экспрессирующим векторам, содержащим любой из полинуклеотидов, представленных выше.
Кроме того, настоящее изобретение относится к клеткам-хозяевам, трансформированным экспрессирующими векторами согласно изобретению, так что по меньшей мере одну нейтральную металлопротеиназу экспрессируют клетки-хозяева. В некоторых вариантах осуществления клетки-хозяева представляют собой бактерии, тогда как в других вариантах осуществления клетки-хозяева представляют собой грибы.
Настоящее изобретение также относится к выделенным полинуклеотидам, содержащим нуклеотидную последовательность, (i) обладающую по меньшей мере 70% идентичностью с SEQ ID NO:1, 2, 12 и/или 13, или (ii) способную гибридизоваться с зондом, полученным из нуклеотидной последовательности SEQ ID NO:1, 2, 12 и/или 13, в условиях от средней до высокой жесткости, или (iii) комплементарную нуклеотидной последовательности SEQ ID NO:1, 2, 12 и/или 13. В некоторых вариантах осуществления настоящее изобретение относится к векторам, содержащим такой полинуклеотид. В дополнительных вариантах осуществления настоящее изобретение относится к клеткам-хозяевам, трансформированным такими векторами.
Кроме того, настоящее изобретение относится к способам получения по меньшей мере одного фермента, обладающего активностью нейтральной металлопротеиназы, включающим в себя стадии трансформации клетки-хозяина экспрессирующим вектором, содержащим полинуклеотид, обладающий по меньшей мере 70% идентичностью последовательности с SEQ ID NO:1, 2, 12 и/или 13, культивирования трансформированной клетки-хозяина в условиях, подходящих клеткой-хозяином для продукции нейтральной металлопротеиназы; и выделения нейтральной металлопротеиназы. В некоторых предпочтительных вариантах осуществления клетка-хозяин представляет собой Bacillus sp., тогда как в некоторых альтернативных вариантах осуществления клетка-хозяин представляет собой B. amyloliquefaciens.
Настоящее изобретение также относится к фрагментам (т.е. частям) ДНК, кодирующей представленные здесь нейтральные металлопротеиназы. Эти фрагменты находят применение в получении фрагментов ДНК частичной длины, пригодных к использованию для выделения или идентификации полинуклеотидов, кодирующих зрелый фермент - нейтральную металлопротеиназу, описанную здесь из B. amyloliquefaciens, или ее фрагмент, обладающий протеолитической активностью. В некоторых вариантах осуществления части ДНК, представленной в SEQ ID NO:2, находят применение в получении гомологичных фрагментов ДНК из других видов, которые кодируют нейтральную металлопротеиназу или ее часть, обладающую металлопротеиназной активностью.
Кроме того, настоящее изобретение относится по меньшей мере к одному зонду, содержащему полинуклеотид, в основном идентичный фрагменту SEQ ID NO:1, 2, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 и/или любой последовательности праймера, приведенной здесь, где зонд используют для детекции последовательности нуклеиновой кислоты, кодирующей фермент, обладающий металлопротеиназной активностью, и где последовательность нуклеиновой кислоты получена из бактериального источника. В некоторых вариантах осуществления бактериальный источник представляет собой Bacillus sp. В некоторых предпочтительных вариантах осуществления бактериальный источник представляет собой B. amyloliquefaciens.
Кроме того, настоящее изобретение относится к композициям, содержащим по меньшей мере одну из представленных здесь нейтральных металлопротеиназ. В некоторых предпочтительных вариантах осуществления композиции представляют собой очищающие композиции. В некоторых вариантах осуществления настоящее изобретение относится к очищающим композициям, содержащим эффективное для очистки количество по меньшей мере одной нейтральной металлопротеиназы, содержащей аминокислотную последовательность, обладающую по меньшей мере 40% идентичностью последовательности с SEQ ID NO:18, по меньшей мере 90% идентичностью последовательности с SEQ ID NO:18, и/или обладающей аминокислотной последовательностью SEQ ID NO:18. В некоторых вариантах осуществления очищающие композиции дополнительно содержат по меньшей мере одну подходящую очищающую добавку. В некоторых вариантах осуществления нейтральная металлопротеиназа получена из Bacillus sp. В некоторых предпочтительных вариантах осуществления Bacillus sp. представляет собой B. amyloliquefaciens.
В дополнительных вариантах осуществления очищающая композиция дополнительно содержит по меньшей мере один дополнительный фермент или производное фермента, выбранный из группы, состоящей из протеаз, амилаз, липаз, маннаназ и целлюлаз.
Настоящее изобретение также относится к выделенным существующим в природе нейтральным металлопротеиназам, содержащим аминокислотную последовательность, обладающую по меньшей мере 45% идентичностью последовательности с SEQ ID NO:18, по меньшей мере 60% идентичностью последовательности с SEQ ID NO:18, по меньшей мере 75% идентичностью последовательности с SEQ ID NO:18, по меньшей мере 90% идентичностью последовательности с SEQ ID NO:18, по меньшей мере 95% идентичностью последовательности с SEQ ID NO:18, и/или обладающим последовательностью SEQ ID NO:18, где нейтральная металлопротеиназа выделена из Bacillus sp. В некоторых вариантах осуществления нейтральная металлопротеиназа выделена из B. amyloliquefaciens.
В дополнительных вариантах осуществления настоящее изобретение относится к сконструированным вариантам нейтральных металлопротеиназ согласно изобретению. В некоторых вариантах осуществления сконструированные варианты являются генетически модифицированными с использованием способов рекомбинантной ДНК, тогда как в других вариантах осуществления варианты являются встречающимися в природе. Кроме того, настоящее изобретение относится к сконструированным вариантам гомологичных ферментов, также как к выделенным гомологам ферментов. В некоторых вариантах осуществления сконструированные варианты гомологичных нейтральных металлопротеиназ являются генетически модифицированными с использованием способов рекомбинантной ДНК, тогда как в других вариантах осуществления варианты гомологичных нейтральных металлопротеиназ являются встречающимися в природе.
Настоящее изобретение также относится к способам получения нейтральных металлопротеиназ, включающим в себя (a) трансформацию клетки-хозяина экспрессирующим вектором, содержащим полинуклеотид, обладающий по меньшей мере 70% идентичностью последовательности с SEQ ID NO:2, по меньшей мере 95% идентичностью последовательности с SEQ ID NO:2, и/или обладающий полинуклеотидной последовательностью SEQ ID NO:2; (b) культивирования трансформированной клетки-хозяина в условиях, подходящих клеткой-хозяином для продукции нейтральной металлопротеиназы; и (c) выделения нейтральной металлопротеиназы. В некоторых вариантах осуществления клетка-хозяин представляет собой виды Bacillus (например, B. subtilis, B. clausii или B. licheniformis). В альтернативных вариантах осуществления клетка-хозяин представляет собой B. amyloliquefaciens.
В дополнительных вариантах осуществления настоящее изобретение относится к способам получения клеток-хозяев, способных продуцировать нейтральные металлопротеиназы согласно изобретению в относительно больших количествах. В особенно предпочтительных вариантах осуществления настоящее изобретение относится к способам получения нейтральной металлопротеиназы с различными коммерческими применениями, где желательна деградация или синтез полипептидов, включая очищающие композиции, также как компоненты пищи и/или корма, обработку ткани, отделку кожи, переработку зерна, переработку мяса, очистку, получение гидролизатов белка, способствующие пищеварению средства, микробицидные композиции, бактериостатические композиции, фунгистатические композиции, средства личной гигиены (например, для ухода за полостью рта, ухода за волосами и/или ухода за кожей).
Настоящее изобретение также относится к вариантам нейтральных металлопротеиназ, обладающим улучшенной производительностью по сравнению с нейтральной металлопротеиназой B. amyloliquefaciens дикого типа. В некоторых предпочтительных вариантах осуществления улучшенная производительность включает в себя улучшенную термостабильность по сравнению с нейтральной металлопротеиназой B. amyloliquefaciens дикого типа. В альтернативных предпочтительных вариантах осуществления улучшенная производительность включает в себя улучшенную производительность в условиях более низкого или более высокого pH по сравнению с нейтральной металлопротеиназой B. amyloliquefaciens дикого типа. В дополнительных предпочтительных вариантах осуществления улучшенная производительность включает в себя улучшенную устойчивость к автолизу по сравнению с нейтральной металлопротеиназой B. amyloliquefaciens дикого типа. В некоторых особенно предпочтительных вариантах осуществления композиции фермента согласно изобретению обладают сравнимой или улучшенной моющей производительностью по сравнению с применяемыми в настоящее время нейтральными металлопротеиназами. Другие цели и преимущества настоящего изобретения следуют из настоящего документа.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлен график, показывающий результаты определения констант аффинности очищенного нейтрального связывающего белка MULTIFECT® для катионов цинка и кальция с использованием флуоресцентных красителей Fluo-Zn3 и Fluo-3, соответственно.
На фиг.2 представлен график, показывающий ингибирование линейным алкилбензолсульфонатом (LAS) протеазной активности 0,36 мг/мл рекомбинантного nprE B. amyloliquefaciens, которое исследовали с использованием анализа протеазы QuantiCleave™.
На фиг.3 представлено выравнивание последовательности различных гомологов металлопротеиназы (SEQ ID NO:173-181), которые находят применение согласно изобретению.
На фиг.4 представлено выравнивание последовательности различных гомологов металлопротеиназы (SEQ ID NO:182-191), которые находят применение согласно изобретению. На этой фигуре нумерация представляет собой нумерацию для термолизина (B. thermoproteolyticus). Как и на фиг.3, «*» означает консервативные остатки, «:» означает консервативно замещенные остатки, и «.» означает сходные остатки.
На фиг.5 представлено выравнивание последовательности различных гомологов металлопротеиназы (SEQ ID NO:192-195), идентифицированных посредством моделирования по гомологии.
На фиг.6 представлена карта плазмиды pJ4:G01905.
На фиг.7 представлена карта плазмиды pJ4:G01906.
На фиг.8 представлена карта плазмиды pJ4:G01907.
На фиг.9 представлена карта плазмиды pJ4:G01908.
На фиг.10 представлена карта плазмиды pJ4:G01909.
На фиг.11 представлена карта плазмиды pJ4:G01938.
На фиг.12 представлена карта плазмиды pJHT.
На фиг.13 представлена карта плазмиды pAC.
На фиг.14 представлена карта pUBnprE.
На фиг.15 представлена схема, показывающая амплификацию промотора aprE и фрагментов гена nprE B. subtilis.
На фиг.16 представлена карта плазмиды pEL501.
На фиг.17 представлена схема, показывающая амплификацию промотора aprE и фрагментов гена nprB B. subtilis.
На фиг.18 представлена карта плазмиды pEL508.
На фиг.19 представлена схема, показывающая амплификацию промотора aprE и фрагментов гена nprT B. stearothermophilus, используемых при получении штамма EL560.
На фиг.20 представлена схема, показывающая конструирование штамма EL560.
На фиг.21 представлена схема, показывающая амплификацию промотора aprE и фрагментов гена npr B. caldolyticus, используемых при получении штамма EL561.
На фиг.22 представлена схема, показывающая конструирование штамма EL561.
На фиг.23 представлена схема, показывающая амплификацию промотора aprE и фрагментов гена nprB B. thuringiensis.
На фиг.24 представлена карта плазмиды pEL568.
На фиг.25 представлен график, показывающий результаты экспериментов, разработанных для определения долговременного хранения концентрата 0,36 мг/мл UF нейтральной металлопротеиназы (nprE) в основе TIDE®-2005 в присутствии ионов цинка и кальция при 32°C. С целью сравнения представлены результаты, полученные при тестировании в отсутствие соли и при избытке кальция.
На фиг.26 представлены данные тестирования моющей производительности с использованием Terg-O-Tometer (TOM) и различных загрязненных субстратов. На панели A представлены результаты, показывающие дельта удаления загрязнений (%) субтилизином (BPN' Y217L) и субтилизином MULTIFECT® нейтральным для EMPA 116 (фиксированных и не фиксированных на хлопке) после стирки при 15°C в жидком моющем средстве TIDE®-2005. На панели B представлены результаты, показывающие дельта удаления загрязнений (%) субтилизином (BPN' Y217L) и очищенным MULTIFECT® нейтральным для среды травы Equest® при загрязнении хлопка, после стирки при 15°C в жидком моющем средстве TIDE®-2005. На панели C представлены результаты, показывающие дельта удаления загрязнений (%) субтилизином (BPN' Y217L) и очищенным MULTIFECT® нейтральным для CFT C-10 (пигмент, масло, молоко на хлопке) после стирки при 15°C в жидком моющем средстве TIDE®-2005.
На фиг.27 представлен график, показывающий результаты сканирований DSC для 440 м.д. (ppm) NprE и вариантов, полученных с использованием VP-Cap DSC (MicroCal™).
На фиг.28 представлен график, показывающий результаты сканирований DSC для 440 м.д. (ppm) NprE и вариантов в присутствии 130 мМ цитрата, полученных с использованием VP-Cap DSC (MicroCal™).
На фиг.29 представлен график, показывающий термические точки плавления для 440 м.д. (ppm) NprE в присутствии различных добавок, полученные с использованием VP-Cap DSC (MicroCal™). На этой фигуре горизонтальной линией представлена Tm для NprE дикого типа без добавок.
На фиг.30 представлен график, показывающий остаточную активность nprE и гомологов nprE в 25% TIDE® при 25°C спустя 90 минут.
На фиг.31 представлен график, показывающий моющую производительность для BMI nprE и гомологов nprE.
На фиг.32 представлен график, показывающий результаты измерений стабильности NprE в различных составах смесей.
На фиг.33 представлены графики (панели A, B и C), показывающие скорость инактивации NprE при различной % концентрации DTPA при фиксированной концентрации формата кальция.
На фиг.34 представлены графики (панели A, B и C), показывающие предсказанные профили, полученные с помощью программного обеспечения анализа DOE для композиции DTPA и формата кальция на основании целевой реакции (скорости разложения).
На фиг.35 представлены аминокислотные последовательности (SEQ ID NO:222-226) для фрагментов индуцированного цитратом автолиза NprE с выделением участков автолиза. Фрагменты 1 и 2 представляют собой первое расщепление, фрагменты 3-5 представляют собой второе расщепление. Курсивными буквами представлены секвенированные N-концы, а жирными буквами выделены пептиды, идентифицированные по расщеплению в геле соответствующих фрагментов.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам и композициям, включающим в себя по меньшей мере один фермент - нейтральную металлопротеиназу, обладающий улучшенной стабильностью при хранении. В некоторых вариантах осуществления нейтральная металлопротеиназа находит использование для очистки и других применений. В некоторых особенно предпочтительных вариантах осуществления настоящее изобретение относится к способам и композициям, включающим в себя нейтральную металлопротеиназу (металлопротеиназы), полученные из Bacillus sp. В некоторых особенно предпочтительных вариантах осуществления нейтральная металлопротеиназа получена из B. amyloliquefaciens. В дополнительных предпочтительных вариантах осуществления нейтральная металлопротеиназа представляет собой вариант нейтральной металлопротеиназы B. amyloliquefaciens. В дополнительных вариантах осуществления нейтральная металлопротеиназа представляет собой гомолог нейтральной металлопротеиназы B. amyloliquefaciens. Настоящее изобретение находит особенный спрос для применений, включающих в себя в качестве неограничивающих примеров очистку, отбеливание и дезинфекцию.
Если нет иных указаний, практика настоящего изобретения предусматривает общепринятые способы, общепринятые в областях молекулярной биологии, микробиологии, очистки белка, конструирования белка, секвенирования белка и ДНК, и рекомбинантной ДНК, которые находятся в компетенции специалистов в данной области. Такие способы известны специалистам в данной области и описаны в различных текстах и справочных изданиях (см., например, Sambrook et al., "Molecular Cloning: A Laboratory Manual", Second Edition (Cold Spring Harbor), [1989]); и Ausubel et al., "Current Protocols in Molecular Biology" [1987]). Все патенты, патентные заявки, статьи и публикации, упомянутые здесь, как выше, так и ниже, таким образом приведены в настоящем описании в качестве ссылки в полном объеме.
Более того, заголовки, представленные здесь, не являются ограничивающими для различных аспектов или вариантов осуществления изобретения, которые можно получить по ссылкам на описание в целом. Соответственно, термины, определяемые непосредственно ниже, являются более полно определенными посредством ссылки на описание в целом. Тем не менее, чтобы облегчить понимание изобретения, ряд терминов определен ниже.
Определения
Если здесь не указано иначе, все технические и научные термины, применяемые здесь, обладают таким же значением, какое является общепринятым у специалистов в области, к которой относится это изобретение. Например, Singleton and Sainsbury, Dictionary of Microbiology and Molecular Biology, 2d Ed., John Wiley and Sons, NY (1994); и Hale and Marham, The Harper Collins Dictionary of Biology, Harper Perennial, NY (1991) обеспечивают специалистов в данной области общими словарями многих из терминов, применяемых здесь. Хотя любые способы и материалы, подобные или эквивалентные материалам, описанным здесь, находят применение в практике настоящего изобретения, предпочтительные способы и материалы описаны здесь. Соответственно, термины, определяемые непосредственно ниже, более полно описаны посредством ссылки на описание в целом. Также, здесь термины единственного числа включают в себя ссылку на множественное число, если в контексте явно не указано иначе. Если нет иных указаний, нуклеиновые кислоты написаны слева направо в направлении от 5' к 3'; аминокислотные последовательности написаны слева направо в направлении от N-конца к C-концу, соответственно. Следует понимать, что это изобретение не ограничено конкретными описанными способами, протоколами и реагентами, так как их можно изменять в зависимости от контекста, в котором их используют специалисты в данной области.
Предусмотрено, что каждое максимальное количественное ограничение, приведенное в данном описании, включает в себя любое более низкое количественное ограничение, как если бы такие более низкие количественные ограничения являлись явно указанными здесь. Каждое минимальное количественное ограничение, приведенное в данном описании, будет включать в себя любое более высокое количественное ограничение, как если бы такие более высокие количественные ограничения являлись явно указанными здесь. Каждый количественный диапазон, приведенный в данном описании, будет включать в себя любой более узкий количественный диапазон, как если бы все такие более узкие количественные диапазоны являлись явно указанными здесь.
Все цитируемые документы, в части релевантности, приведены здесь в качестве ссылки; цитирование любого документа не следует рассматривать как признание того, что он представляет собой известный уровень техники по отношению к настоящему изобретению.
Здесь термин «отбеливание» относится к обработке материала (например, ткани, белья, пульпы и т.д.) или поверхности в течение достаточного промежутка времени и при соответствующих условиях pH и температуры, чтобы вызвать осветление (т.е. побеление) и/или очистку материала. Химические вещества, пригодные для отбеливания, включают в себя в качестве неограничивающих примеров ClO2, H2O2, перкислоты, NO2 и т.д.
Здесь термин «дезинфекция» относится к удалению загрязнений с поверхностей, также как к подавлению или уничтожению микроорганизмов на поверхностях предметов. Не подразумевается, что настоящее изобретение ограничено какой-либо конкретной поверхностью, предметом или загрязнением (загрязнениями), или микроорганизмами, подлежащими удалению.
Здесь термин «мультимер» относится к двум или более белкам или пептидам, которые ковалентно или нековалентно связаны и существуют в растворе в виде комплекса. «Димер» представляет собой мультимер, содержащий два белка или пептида; «тример» содержит три белка или пептида и т.д. Здесь «октамер» относится к мультимеру из восьми белков или пептидов.
Здесь «продукты личной гигиены» означают продукты, применяемые для очистки, отбеливания и/или дезинфекции волос, кожи, волосистой части кожи головы и зубов, включая в качестве неограничивающих примеров шампуни, лосьоны для тела, гели для душа, средства для местного увлажнения, зубную пасту и/или другие средства для местной очистки. В некоторых особенно предпочтительных вариантах осуществления эти продукты используют для применения человеком, тогда как в других вариантах осуществления эти продукты находят применение для не относящихся к человеку животных (например, для применений в ветеринарии).
Здесь «очищающие композиции» и «очищающие составы», если нет иных указаний, относятся к композициям, которые находят применение для удаления нежелательных соединений с подлежащих очистке предметов, таких как ткани, посуда, контактные линзы, другие твердые субстраты, волосы (шампуни), кожа (мыло и кремы), зубы (средства для полоскания рта, зубные пасты) и т.д. Термин включает в себя любые материалы/соединения, выбранные для конкретного типа желательной очищающей композиции и формы продукта (например, композиция в виде жидкости, геля, гранул или спрея), при условии, что композиция является совместимой с нейтральной металлопротеиназой и другим ферментом (ферментами), применяемым в композиции. Конкретный выбор материалов очищающей композиции легко сделать, принимая во внимание поверхность, предмет или ткань, подлежащие очистке, и форму композиции, желательную для условий очистки при использовании.
Кроме того, термины относятся к любой композиции, подходящей для очистки, отбеливания, дезинфекции и/или стерилизации любого объекта и/или поверхности. Предусмотрено, что термины включают в себя в качестве неограничивающих примеров композиции моющих средств (например, жидких и/или твердых моющих средств для стирки белья и моющих средств для тонких тканей; очищающие составы для твердой поверхности, такой как стеклянные, деревянные, керамические и металлические столешницы и окна; очищающие средства для ковров; очищающие средства для духовок; освежители ткани; смягчители ткани и средства для предварительного удаления пятен на текстиле и белье, также как моющие средства для посуды).
Действительно, здесь термин «очищающая композиция» включает в себя, если нет иных указаний, гранулированные или порошкообразные универсальные или интенсивные моющие средства, особенно моющие средства для очистки; жидкие, гелеобразные или пастообразные универсальные моющие средства, особенно так называемые интенсивные средства жидкого типа (HDL); жидкие моющие средства для тонких тканей; средства для ручного мытья посуды или облегченные средства для мытья посуды, особенно типы средств с повышенным пенообразованием; средства для автоматического мытья посуды, включая различные таблетированные, гранулированные, жидкие и ополаскивающие типы для использования дома и на предприятиях; жидкие моющие и дезинфицирующие средства, включая антибактериальные типы для мытья рук, очищающие бруски, средства для полоскания рта, очищающие средства для зубов и полости рта, шампуни для автомобилей или ковров, средства для очистки уборной; шампуни для волос и ополаскиватели для волос; гели для душа и пена для ванн, и средства для очистки металла; также как вспомогательные средства для очистки, такие как отбеливающие добавки и «пятновыводители» или типы для предварительной обработки.
Здесь термины «композиция моющего средства» и «состав моющего средства» используют в ссылках на смеси, предназначенные для использования в моющей среде для очистки загрязненных объектов. В некоторых предпочтительных вариантах осуществления термин используют по отношению к стирке тканей и/или одежды (например, «моющие средства для стирки»). В альтернативных вариантах осуществления термин относится к другим моющим средствам, таким как средства, применяемые для очистки посуды, столовых приборов и т.д. (например, «средства для мытья посуды»). Не подразумевается, что настоящее изобретение ограничено каким-либо конкретным составом или композицией моющего средства. Действительно, предусмотрено, что, в дополнение к нейтральной металлопротеиназе, термин охватывает моющие средства, содержащие поверхностно-активные вещества, трансферазу (трансферазы), гидролитические ферменты, оксидоредуктазы, добавки для повышения моющего действия, отбеливающие средства, активаторы отбеливания, подсинивающие средства и флуоресцентные красители, ингибиторы слеживания, маскирующие средства, активаторы ферментов, антиоксиданты и солюбилизаторы.
Здесь «фермент заявителя» относится к нейтральным металлопротеиназам согласно изобретению.
Здесь «улучшенную производительность» моющего средства определяют как увеличенную очистку чувствительных к отбеливанию загрязнений (например, травой, чаем, вином, кровью, сажей и т.д.), как определяют посредством общепринятой оценки после обычного цикла стирки. В конкретных вариантах осуществления нейтральная металлопротеиназа согласно изобретению обеспечивает улучшенную производительность для удаления окрашенных пятен и загрязнений. В дополнительных вариантах осуществления фермент согласно изобретению обеспечивает улучшенную производительность для удаления и/или обесцвечивания пятен.
Здесь термин «очищающая композиция для твердой поверхности» относится к композиции моющего средства для очистки твердых поверхностей, таких как полы, стены, плитки, оборудование ванной и кухни и т.п. Такие композиции предоставляют в любой форме, включая в качестве неограничивающих примеров твердые, жидкие, эмульсии и т.д.
Здесь «композиция для мытья посуды» относится ко всем формам композиций для очистки посуды, включая в качестве неограничивающих примеров гранулированные и жидкие формы.
Здесь «очищающая композиция для ткани» относится ко всем формам композиций моющих средств для очистки тканей, включая в качестве неограничивающих примеров гранулированные, жидкие формы и формы бруска.
Здесь «текстиль» относится к тканым материалам, также как к штапельному волокну и волокнам, подходящим для использования в качестве пряжи, трикотажной ткани, трикотажа и нетканой ткани или для переработки в них. Термин охватывает пряжу, выполненную из натуральных, также как из синтетических волокон (например, промышленного производства).
Здесь «текстильные материалы» представляет собой общий термин для волокон, полуфабрикатов пряжи, ткани и продуктов, изготовленных из тканей (например, одежды и других изделий).
Здесь «ткань» относится к любому текстильному материалу. Таким образом, предусматривается, что этот термин относится к одежде, также как к ткани, пряже, волокнам, нетканым материалам, натуральным материалам, синтетическим материалам и любому другому текстильному материалу.
Здесь термин «совместимый» означает, что материалы очищающей композиции не снижают ферментативной активности нейтральной металлопротеиназы до такой степени, что нейтральная металлопротеиназа не является эффективной, как желательно в ситуациях обычного применения. Конкретные материалы очищающей композиции подробно приведены в примерах здесь.
Здесь «эффективное количество фермента» относится к количеству фермента, необходимому для достижения ферментативной активности, требуемой для конкретного применения (например, в продукте личной гигиены, очищающей композиции и т.д.). Такие эффективные количества легко устанавливает обычный специалист в данной области, и они основаны на многих факторах, таких как конкретный используемый вариант фермента, применение для очистки, конкретный состав очищающей композиции, и на том, жидкая или сухая (например, гранулированная, брусок) композиция требуется, и т.п.
Здесь «очищающие композиции не для ткани» относятся к очищающим композициям для твердой поверхности, композициям для мытья посуды, очищающим композициям для личной гигиены (например, очищающим композициям для полости рта, очищающим композициям для зубных протезов, очищающим композициям для личной гигиены и т.д.) и композициям, пригодным для использования в производстве пульпы и бумаги.
Здесь «очищающие композиции для полости рта» относятся к средствам для ухода за зубами, зубным пастам, зубным гелям, зубным порошкам, ополаскивателям для рта, спреям для полости рта, гелям для полости рта, жевательным резинкам, пастилкам, саше, таблеткам, биогелям, профилактическим пастам, растворам для лечебно-профилактического ухода за зубами и т.п.
Здесь термин «трансфераза» относится к ферменту, катализирующему перенос функциональных соединений на ряд субстратов.
Здесь «уходящая группа» относится к нуклеофилу, который отщепляют от ацильного донора при замещении другим нуклеофилом.
Здесь термин «ферментативное превращение» относится к модификации субстрата до промежуточного соединения или к модификации промежуточного соединения до конечного продукта посредством контактирования субстрата или промежуточного соединения с ферментом. В некоторых вариантах осуществления контакт осуществляют, подвергая субстрат или промежуточное соединение непосредственному воздействию подходящего фермента. В других вариантах осуществления контактирование включает в себя подвергание субстрата или промежуточного соединения воздействию организма, экспрессирующего и/или экскретирующего фермент, и/или метаболизирующего желательный субстрат и/или промежуточное соединение до желательного промежуточного соединения и/или конечного продукта, соответственно.
Здесь фраза «стабильность моющего средства» относится к стабильности композиции моющего средства. В некоторых вариантах осуществления достигают стабильности во время использования моющего средства, тогда как в других вариантах осуществления термин относится к стабильности композиции моющего средства во время хранения.
Здесь фраза «устойчивость к протеолизу» относится к способности белка (например, фермента) являться устойчивым к протеолизу. Не предусматривается, что этот термин ограничен применением какой-либо конкретной протеазы для оценки стабильности белка.
Здесь «устойчивость к окислению» относится к способности белка функционировать в окислительных условиях. В частности, термин относится к способности белка функционировать в присутствии различных концентраций H2O2 и/или перкислоты. Стабильность в различных окислительных условиях можно измерять или посредством общепринятых способов, известных специалистам в данной области, и/или посредством способов, описанных здесь. Существенное изменение устойчивости к окислению показывают по меньшей мере приблизительно по 5% или большему увеличению или уменьшению (в большинстве вариантов осуществления - это предпочтительно увеличение) времени полужизни ферментативной активности по сравнению с ферментативной активностью, присутствующей в отсутствие окислительных соединений.
Здесь «устойчивость к pH» относится к способности белка функционировать при конкретном pH. Как правило, большинство ферментов обладает ограниченным диапазоном pH, при котором они будут функционировать. Помимо ферментов, функционирующих при средних pH (т.е. около pH 7), существуют ферменты, способные работать в условиях очень высоких или очень низких pH. Стабильность при различных pH можно измерять или посредством общепринятых способов, известных специалистам в данной области, и/или посредством способов, описанных здесь. Существенное изменение устойчивости к pH показывают по меньшей мере приблизительно по 5% или большему увеличению или уменьшению (в большинстве вариантов осуществления - это предпочтительно увеличение) времени полужизни ферментативной активности по сравнению с ферментативной активностью при оптимальном для фермента pH. Однако подразумевают, что настоящее изобретение не ограничено ни каким-либо уровнем устойчивости к pH, ни каким-либо диапазоном pH.
Здесь «термостабильность» относится к способности белка функционировать при конкретной температуре. Как правило, большинство ферментов обладает ограниченным диапазоном температур, при которых они будут функционировать. Помимо ферментов, функционирующих при средних температурах (например, комнатная температура), существуют ферменты, способные работать при очень высоких или очень низких температурах. Термостабильность можно измерять или посредством известных способов, или посредством способов, описанных здесь. Существенное изменение термостабильности показывают по меньшей мере приблизительно по 5% или большему увеличению или уменьшению (в большинстве вариантов осуществления - это предпочтительно увеличение) времени полужизни каталитической активности мутанта при воздействии температуры, отличной (т.е. более высокой или более низкой) от температуры, оптимальной для ферментативной активности. Однако подразумевают, что настоящее изобретение не ограничено ни каким-либо уровнем температурной стабильности, ни каким-либо диапазоном температур.
Здесь термин «химическая стабильность» относится к стабильности белка (например, фермента) по отношению к химическим веществам, оказывающим неблагоприятное воздействие на его активность. В некоторых вариантах осуществления такие химические вещества включают в себя в качестве неограничивающих примеров перекись водорода, перкислоты, анионные детергенты, катионные детергенты, неионные детергенты, хелатообразующие вещества и т.д. Однако подразумевают, что настоящее изобретение не ограничено ни каким-либо конкретным уровнем химической стабильности, ни каким-либо диапазоном химической стабильности.
Здесь фраза «улучшение активности нейтральной металлопротеиназы» относится к относительному улучшению активности нейтральной металлопротеиназы по сравнению с общепринятым ферментом. В некоторых вариантах осуществления термин относится к улучшенной скорости образования продукта, тогда как в других вариантах осуществления термин относится к композициям, с которыми в результате получают меньше продукта гидролиза. В дополнительных вариантах осуществления термин относится к композициям нейтральной металлопротеиназы с измененной субстратной специфичностью.
Здесь фраза «изменение в субстратной специфичности» относится к изменениям в субстратной специфичности фермента. В некоторых вариантах осуществления изменение в субстратной специфичности определяют как разницу между соотношением Kcat/Km, наблюдаемым для фермента, по сравнению с вариантами фермента или другими композициями фермента. Субстратные специфичности фермента изменяются в зависимости от тестируемого субстрата. Субстратную специфичность фермента определяют сравнением каталитических эффективностей, показанных для него с различными субстратами. Эти определения находят особенное применение для оценки эффективности мутантных ферментов, так как обычно является желательным получить варианты ферментов, обладающие более высокими соотношениями для конкретных интересующих субстратов. Однако подразумевают, что настоящее изобретение не ограничено ни какой-либо конкретной композицией субстрата, ни какой-либо конкретной субстратной специфичностью.
Здесь «свойство поверхности» используют по отношению к электростатическому заряду, также как к таким свойствам, как гидрофобность и/или гидрофильность, показанным для поверхности белка.
Здесь фраза «независимо выбран из группы, состоящей из …» означает, что группы или элементы, выбранные из упомянутой группы Маркуша, могут являться одинаковыми, могут являться различными или могут представлять собой любую смесь элементов, как указано в следующем примере:
Молекула, обладающая 3 группами R, где каждая группа R независимо представляет собой выбранную из группы, состоящей из A, B и C. Здесь три группы R могут представлять собой: AAA, BBB, CCC, AAB, AAC, BBA, BBC, CCA, CCB или ABC.
По отношению к химической композиции, термин «замещенный» здесь означает, что органическая композиция или радикал, к которым применяют термин:
(a) выполнен ненасыщенным посредством удаления по меньшей мере одного элемента или радикала; или
(b) по меньшей мере один водород в соединении или радикале заменен на группу, содержащую один или несколько атомов (i) углерода, (ii) кислорода, (iii) серы, (iv) азота или (v) галогена; или
(c) как (a), так и (b).
Группы, которыми можно заменять водород, как описано в (b) непосредственно выше, которые содержат только атомы углерода и водорода, представляют собой группы углеводорода, включая в качестве неограничивающих примеров группы алкила, алкенила, алкинила, алкилдиенила, циклоалкила, фенила, алкилфенила, нафтила, антрила, фенантрила, фторила, стероида и сочетания этих групп друг с другом и с поливалентными углеводородными группами, такими как группы алкилена, алкилидена и алкилидина. Группы, содержащие атомы кислорода, которыми можно заменять водород, как описано в (b) непосредственно выше, включают в себя в качестве неограничивающих примеров группы, содержащие гидроксигруппы, ацильные группы или кетогруппы, простой эфир, эпоксигруппы, карбоксигруппы и сложный эфир. Группы, содержащие атомы серы, которыми можно заменять водород, как описано в (b) непосредственно выше, включают в себя в качестве неограничивающих примеров серосодержащие кислоты и группы сложных эфиров кислот, группы тиоэфиров, меркаптогруппы и тиокетогруппы. Группы, содержащие атомы азота, которыми можно заменять водород, как описано в (b) непосредственно выше, включают в себя в качестве неограничивающих примеров аминогруппы, нитрогруппы, азогруппы, группы аммония, амидогруппы, азидогруппы, группы изоцианата, цианогруппы и нитрильные группы. Группы, содержащие атомы галогена, которыми можно заменять водород, как описано в (b) непосредственно выше, включают в себя группы хлора, брома, фтора, йода и любые из групп, описанных выше, где группу водорода или боковую алкильную группу заменяют галогеновой группой для формирования стабильной замещенной группы.
Понятно, что любые из вышеуказанных групп (b)(i)-(b)(v) можно заменять друг другом либо моновалентным замещением, либо с потерей водорода в поливалентном замещении для формирования другой моновалентной группы, которой можно заменять водород в органическом соединении или радикале.
Здесь термины «очищенный» и «выделенный» относятся к удалению загрязнений из образца. Например, нейтральную металлопротеиназу очищают посредством удаления загрязняющих белков и других соединений в растворе или препарате, которые не относятся к нейтральной металлопротеиназе. В некоторых вариантах осуществления рекомбинантную нейтральную металлопротеиназу экспрессируют в клетках-хозяевах бактерий или грибов, и эти рекомбинантные нейтральные металлопротеиназы очищают посредством удаления других компонентов клетки-хозяина; таким образом в образце увеличивают процентное соотношение полипептидов рекомбинантной нейтральной металлопротеиназы. В особенно предпочтительных вариантах осуществления металлопротеиназа согласно изобретению является в основном очищенной до уровня по меньшей мере приблизительно 99% белкового компонента, как определяют посредством SDS-PAGE или других общепринятых способов, известных в данной области. В альтернативных предпочтительных вариантах осуществления металлопротеиназа согласно изобретению содержит по меньшей мере приблизительно 99% протеазного компонента композиций. В альтернативных вариантах осуществления металлопротеиназа присутствует в диапазоне приблизительно по меньшей мере 90-95% из тотального белка и/или протеазы.
Здесь «представляющий интерес белок» относится к белку (например, ферменту или «представляющему интерес ферменту»), который анализируют, идентифицируют и/или модифицируют. Встречающиеся в природе, также как рекомбинантные белки, находят применение согласно изобретению.
Здесь «белок» относится к любой композиции, состоящей из аминокислот и распознаваемой как белок специалистами в данной области. Термины «белок», «пептид» и полипептид используют здесь как взаимозаменяемые. Когда пептид представляет собой часть белка, специалистам в данной области понятно использование термина в контексте.
Здесь функционально и/или структурно сходные белки считают «родственными белками». В некоторых вариантах осуществления эти белки получены из различных родов и/или видов, включая различия между классами организмов (например, бактериальный белок и белок грибов). В некоторых вариантах осуществления эти белки получены из различных родов и/или видов, включая различия между классами организмов (например, бактериальный фермент и фермент грибов). В дополнительных вариантах осуществления родственные белки происходят из одного и того же вида. Действительно, не подразумевают, что настоящее изобретение ограничено родственными белками из какого-либо конкретного источника (источников). Кроме того, термин «родственные белки» относится к гомологам по третичной структуре и к гомологам по первичной последовательности (например, нейтральная металлопротеиназа согласно изобретению). Например, настоящее изобретение относится к таким гомологам, как гомологи, представленные на фиг.3-5. Предусматривают дополнительные гомологи, включая в качестве неограничивающих примеров ферменты металлопротеиназы, полученные из B. cereus, B. cereus E33L, B. caldolyticus, B. pumulis, B. megaterium, B. subtilis amylosacchariticus, Brevibacillus brevis, Paenibacillus polymyxa (Bacillus polymyxa), B. stearothermophilus, B. thuringiensis, B. subtilis и S. aureus, также как ауреолизин, внеклеточную эластазу и нейтральную протеазу B. В дополнительных вариантах осуществления термин относится к белкам, которые являются иммунологически перекрестно-реактивными.
Здесь термин «производное» относится к белку, полученному из белка посредством добавления одной или нескольких аминокислот к любому из C- или N-конца (концов), или к обоим, замены одной или нескольких аминокислот в одном участке или в ряде различных участков в аминокислотной последовательности, и/или делеции одной или нескольких аминокислот на любом из концов белка или на обоих концах, или в одном или нескольких участках в аминокислотной последовательности, и/или вставки одной или нескольких аминокислот в одном или нескольких участках в аминокислотной последовательности. Получения производного белка предпочтительно достигают посредством модификации последовательности ДНК, кодирующей природный белок, трансформации подходящего хозяина этой последовательностью ДНК и экспрессии модифицированной последовательности ДНК для формирования производного белка.
Родственные (и производные) белки включают в себя «варианты белков». В некоторых предпочтительных вариантах осуществления варианты белков отличаются от исходного белка и друг от друга небольшим числом аминокислотных остатков. Число отличающихся аминокислотных остатков может составлять один или несколько, предпочтительно 1, 2, 3, 4, 5, 10, 15, 20, 30, 40, 50 или более аминокислотных остатков. В некоторых предпочтительных вариантах осуществления число отличающихся аминокислот между вариантами составляет между 1 и 10. В некоторых особенно предпочтительных вариантах осуществления родственные белки и, в частности, варианты белков обладают по меньшей мере 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичностью аминокислотной последовательности. Кроме того, родственный белок или вариант белка здесь относится к белку, который отличается от другого родственного белка или исходного белка числом выступающих областей. Например, в некоторых вариантах осуществления варианты белков обладают 1, 2, 3, 4, 5 или 10 соответствующих выступающих областей, что отличается от исходного белка.
В данной области известно несколько способов для получения вариантов ферментов согласно изобретению, включая в качестве неограничивающих примеров сайт-насыщающий мутагенез, сканирующий мутагенез, инсерционный мутагенез, случайный мутагенез, сайт-направленный мутагенез и направленную эволюцию, также как различные другие рекомбинантные способы.
Характеризацию белков дикого типа и мутантных белков осуществляют любыми подходящими способами, и она предпочтительно основана на оценке интересующих свойств. Например, в некоторых вариантах осуществления настоящего изобретения определяют pH и/или температуру, также как устойчивость к моющему средству и/или окислению. Действительно, предусматривают, что будут находить применение ферменты, обладающие различными степенями стабильности по одной или нескольким характеристикам (pH, температура, устойчивость к протеолизу, устойчивость к моющим средствам, и/или устойчивость к окислению).
Здесь «экспрессирующий вектор» относится к конструкции ДНК, содержащей последовательность ДНК, функционально связанную с подходящей контрольной последовательностью, способной воздействовать на экспрессию ДНК в подходящем хозяине. Такие контрольные последовательности включают в себя промотор, вызывающий транскрипцию, необязательную последовательность оператора для контроля такой транскрипции, последовательность, кодирующую соответствующие участки связывания рибосомы в мРНК, и последовательности, контролирующие терминацию транскрипции и трансляции. Вектор может представлять собой плазмиду, фаговую частицу или просто потенциальную геномную вставку. После трансформации подходящего хозяина вектор может реплицироваться и функционировать независимо от генома хозяина или может, в некоторых случаях, сам интегрировать в геном. В настоящем описании «плазмиду», «экспрессирующую плазмиду» и «вектор» часто используют как взаимозаменяемые, так как плазмида в настоящее время является наиболее общепринятой формой вектора. Однако изобретение предназначено для включения таких других форм экспрессирующих векторов, которые выполняют эквивалентные функции и которые являются или становятся известными в данной области.
В некоторых предпочтительных вариантах осуществления ген нейтральной металлопротеиназы лигируют в подходящую экспрессирующую плазмиду. Затем клонированный ген нейтральной металлопротеиназы используют для трансформации или трансфекции клетки-хозяина, чтобы экспрессировать ген нейтральной металлопротеиназы. Эта плазмида может реплицироваться в хозяевах, в том смысле, что она содержит хорошо известные элементы, необходимые для репликации плазмиды, или можно сконструировать плазмиду для интеграции в хромосому хозяина. Предоставлены необходимые элементы для эффективной экспрессии гена (например, промотор, функционально связанный с интересующим геном). В некоторых вариантах осуществления эти необходимые элементы предоставлены как собственный гомологичный промотор гена, если он является узнаваемым (т.е. транскрибируемым, хозяином), терминатор транскрипции (область полиаденилирования для эукариотических клеток-хозяев), который является экзогенным или представлен эндогенной областью терминатора в гене нейтральной металлопротеиназы. В некоторых вариантах осуществления включают также селективный ген, такой как ген устойчивости к антибиотику, позволяющий продолжительное поддержание в культуре инфицированных плазмидой клеток-хозяев посредством выращивания на среде, содержащей антимикробное средство.
Можно использовать следующий способ кассетного мутагенеза для облегчения конструирования вариантов нейтральной металлопротеиназы согласно изобретению, хотя можно использовать другие способы. Во-первых, как описано в настоящем описании, существующий в природе ген, кодирующий нейтральную металлопротеиназу, получают и секвенируют полностью или частично. Затем последовательность сканируют для получения точки, в которой желательно выполнить мутацию (делецию, вставку или замену) одной или нескольких аминокислот в кодируемой нейтральной металлопротеиназе. Последовательности, фланкирующие эту точку, оценивают на присутствие участков рестрикции для замены короткого фрагмента гена пулом олигонуклеотидов, которые затем при экспрессии будут кодировать различные мутанты. Такие участки рестрикции предпочтительно представляют собой уникальные участки в гене белка, так чтобы облегчать замену фрагмента гена. Однако можно использовать любой удобный участок рестрикции, который встречается не в избыточном количестве в гене нейтральной металлопротеиназы, при условии, что фрагменты гена, полученные посредством расщепления рестриктазами, можно собрать заново в подходящей последовательности. Если участки рестрикции не присутствуют в положениях внутри удобного расстояния от выбранной точки (от 10 до 15 нуклеотидов), такие участки получают посредством замены нуклеотидов в гене таким образом, что в конечной конструкции не изменяются ни рамка считывания, ни аминокислоты. Мутации в гене, для изменения его последовательности, чтобы привести ее в соответствие с желательной последовательностью, осуществляют посредством удлинения праймера M13 в соответствии с общеизвестными способами. Задача локализации подходящих фланкирующих областей и определения необходимых изменений для получения двух удобных последовательностей участков рестрикции сделана общепринятой благодаря вырожденности генетического кода, картирования гена ферментами рестрикции и большого числа различных ферментов рестрикции. Следует отметить, что если доступен удобный фланкирующий участок рестрикции, вышеуказанный способ необходимо использовать только по отношению к фланкирующей области, не содержащей участка.
После клонирования природной ДНК и/или синтетической ДНК участки рестрикции, фланкирующие положения, подлежащие введению мутаций, расщепляют узнающими ферментами рестрикции, и множество комплементарных по концам олигонуклеотидных кассет лигируют в ген. Мутагенез по этому способу является упрощенным, поскольку все олигонуклеотиды можно синтезировать так, чтобы они обладали одинаковыми участками рестрикции и нет необходимости в синтетических линкерах для создания участков рестрикции.
Здесь «соответствующий» относится к остатку в пронумерованном положении в белке или пептиде, или остатку, который является аналогичным, гомологичным или эквивалентным пронумерованному остатку в белке или пептиде.
Здесь «соответствующая область» в основном относится к аналогичному положению в родственных белках или в исходном белке.
Термины «молекула нуклеиновой кислоты, кодирующая», «последовательность нуклеиновой кислоты, кодирующая», «последовательность ДНК, кодирующая» и «ДНК, кодирующая» относятся к порядку или последовательности дезоксирибонуклеотидов в цепи дезоксирибонуклеиновой кислоты. Порядок этих дезоксирибонуклеотидов определяет порядок аминокислот в полипептидной (белковой) цепи. Таким образом, последовательность ДНК кодирует аминокислотную последовательность.
Здесь термин «аналогичная последовательность» относится к последовательности в белке, которая обеспечивает такую же функцию, третичную структуру, и/или консервативные остатки, как у интересующего белка (т.е., как правило, исходного интересующего белка). Например, в областях эпитопов, содержащих структуру альфа-спирали или бета-листа, замененные аминокислоты в аналогичной последовательности предпочтительно поддерживают ту же самую специфическую структуру. Термин также относится к нуклеотидной последовательности, также как к аминокислотной последовательности. В некоторых вариантах осуществления аналогичные последовательности развивают так, что замененные аминокислоты приводят к варианту фермента, обладающего сходной или улучшенной функцией. В некоторых предпочтительных вариантах осуществления третичная структура и/или консервативные остатки аминокислот в представляющим интерес белке локализованы в интересующем отрезке или фрагменте, или около него. Таким образом, когда интересующий отрезок или фрагмент содержит, например, структуру альфа-спирали или бета-листа, замененные аминокислоты в аналогичной последовательности предпочтительно поддерживают эту специфическую структуру.
Здесь «гомологичный белок» относится к белку (например, нейтральной металлопротеиназе), обладающему таким же действием и/или структурой, что и представляющий интерес белок (например, нейтральная металлопротеиназа из другого источника). Не подразумевают, что гомологи (обозначаемые здесь также как «гомологи») обязательно являются эволюционно родственными. Таким образом, подразумевают, что термин относится к тому же самому или сходному ферменту (ферментам) (т.е. в терминах структуры и функции), полученному из различных видов. В некоторых предпочтительных вариантах осуществления является желательным идентифицировать гомолог, обладающий четвертичной, третичной и/или первичной структурой, сходной с представляющим интерес белком, так как замена отрезка или фрагмента представляющего интерес белка аналогичным отрезком из гомолога будет уменьшать деструктивность изменения.
Здесь термин «гомологичные гены» относится по меньшей мере к паре генов из различных видов, где гены соответствуют друг другу и являются идентичными или очень похожими друг с другом. Термин охватывает гены, разделенные посредством видообразования (т.е. развития новых видов) (например, ортологичные гены), также как гены, разделенные посредством генетической дупликации (например, паралогичные гены). Эти гены кодируют «гомологичные белки».
Здесь «ортолог» и «ортологичные гены» относятся к генам в различных видах, которые эволюционировали из общего предкового гена (т.е. гомологичного гена) посредством видообразования. Как правило, ортологи сохраняют ту же самую функцию в ходе эволюции. Идентификация ортологов находит применение для достоверного прогнозирования функции гена во вновь секвенированных геномах.
Здесь «паралог» и «паралогичные гены» относятся к генам, которые связаны посредством дупликации в геноме. В то время как ортологи сохраняют ту же самую функцию в ходе эволюции, у паралогов эволюционируют новые функции, даже несмотря на то, что некоторые функции часто являются связанными с исходной функцией. Примеры паралогичных генов включают в себя в качестве неограничивающих примеров гены, кодирующие трипсин, химотрипсин, эластазу и тромбин, все из которых являются сериновыми протеазами и присутствуют вместе в одних и тех же видах.
Здесь белки «дикого типа» и «нативные» белки представляют собой белки, обнаруживаемые в природе. Термины «последовательность дикого типа» и «ген дикого типа» используют здесь как взаимозаменяемые для обозначения последовательности, которая является нативной или встречается в природе в клетке-хозяине. В некоторых вариантах осуществления последовательность дикого типа относится к представляющей интерес последовательности, которая является исходной точкой проекта конструирования белка. Гены, кодирующие встречающийся в природе белок, можно получить согласно общим способам, известным специалистам в данной области. Способы, как правило, включают в себя синтез меченых зондов, обладающих предполагаемыми последовательностями кодирующих областей для представляющего интерес белка, получение геномных библиотек из организмов, экспрессирующих белок, и скрининг библиотек по представляющему интерес гену гибридизацией с зондами. Затем положительно гибридизующиеся клоны картируют и секвенируют.
Здесь термин «рекомбинантная молекула ДНК» относится к молекуле ДНК, состоящей из отрезков ДНК, соединенных вместе средствами молекулярно-биологических способов.
Здесь термин «рекомбинантный олигонуклеотид» относится к олигонуклеотиду, полученному с использованием молекулярно-биологических способов, включая в качестве неограничивающих примеров лигирование двух или более олигонуклеотидных последовательностей, полученных посредством расщепления полинуклеотидной последовательности ферментами рестрикции, синтеза олигонуклеотидов (например, синтеза праймеров или олигонуклеотидов) и т.п.
Степень гомологии между последовательностями можно определить с использованием любого подходящего способа, известного в данной области (см., например, Smith and Waterman, Adv. Appl. Math., 2:482 [1981]; Needleman and Wunsch, J. Mol. Biol., 48:443 [1970]; Pearson and Lipman, Proc. Natl. Acad. Sci. USA 85:2444 [1988]; программы, такие как GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics (Genetics Computer Group, Madison, WI); и Devereux et al., Nucl. Acid Res., 12:387-395 [1984]).
Например, PILEUP представляет собой полезную программу для определения уровней гомологии последовательности. PILEUP создает множественное выравнивание последовательностей из группы родственных последовательностей с использованием прогрессивных попарных выравниваний. Можно также построить дерево, показывающее кластерные взаимодействия, использованные для получения выравнивания. В PILEUP используют упрощение способа прогрессивного выравнивания Feng и Doolittle (Feng and Doolittle, J. Mol. Evol., 35:351-360 [1987]). Способ является сходным со способом, описанным Higgins и Sharp (Higgins and Sharp, CABIOS 5:151-153 [1989]). Применимые параметры PILEUP включают цену за пропуск по умолчанию 3,00, цену за продление пропуска по умолчанию 0,10 и учитываемые концевые пропуски. Другим примером применимого алгоритма является алгоритм BLAST, описанный Altschul et al. (Altschul et al., J. Mol. Biol., 215:403-410, [1990]; и Karlin et al., Proc. Natl. Acad. Sci. USA 90:5873-5787 [1993]). Одной из особенно полезных программ BLAST является программа WU-BLAST-2 (см. Altschul et al., Meth. Enzymol., 266:460-480 [1996]). Параметры «W», «T» и «X» определяют чувствительность и скорость выравнивания. В программе BLAST по умолчанию используют длину слова (W) 11, матрицу баллов BLOSUM62 (см. Henikoff and Henikoff, Proc. Natl. Acad. Sci. USA 89:10915 [1989]) выравнивания (B) 50, ожидание (E) 10, M'5, N'-4 и сравнение по обеим цепям.
Здесь «процентную (%) идентичность последовательности нуклеиновой кислоты» определяют как процентное содержание нуклеотидных остатков в последовательности-кандидате, являющихся идентичными нуклеотидным остаткам в последовательности.
Здесь термин «гибридизация» относится к процессу, посредством которого цепь нуклеиновой кислоты соединяется с комплементарной цепью посредством спаривания оснований, как известно в данной области.
Здесь фраза «условия гибридизации» относится к условиям, при которых проводят реакции гибридизации. Эти условия, как правило, классифицируют по степени «жесткости» условий, при которых измеряют гибридизацию. Степень жесткости может быть основана, например, на температуре плавления (Tm) комплекса связывающейся нуклеиновой кислоты или зонда. Например, «максимальная жесткость», как правило, присутствует приблизительно при Tm-5°C (5° ниже Tm зонда); «высокая жесткость» приблизительно при 5-10° ниже Tm; «средняя жесткость» приблизительно при 10-20° ниже Tm; и «низкая жесткость» приблизительно при 20-25° ниже Tm. Альтернативно или дополнительно, условия гибридизации могут быть основаны на условиях солевой или ионной силы при гибридизации и/или одной или нескольких жестких отмывках. Например, 6×SSC = очень низкая жесткость; 3×SSC = от низкой до средней жесткости; 1×SSC = средняя жесткость и 0,5×SSC = высокая жесткость. Функционально условия максимальной жесткости можно использовать для идентификации последовательностей нуклеиновой кислоты, обладающих строгой идентичностью или почти строгой идентичностью с зондом для гибридизации; тогда как условия высокой жесткости используют для идентификации последовательностей нуклеиновой кислоты, обладающей приблизительно 80% или большей идентичностью последовательности с зондом.
Для применений, требующих высокой избирательности, как правило, желательно использовать относительно жесткие условия для формирования гибридов (например, используют условия относительно низкой концентрации соли и/или высокой температуры).
Фразы «в основном сходный» и «в основном идентичный» в контексте по меньшей мере двух нуклеиновых кислот или полипептидов, как правило, означает, что полинуклеотид или полипептид содержит последовательность, обладающую по меньшей мере приблизительно 40% идентичностью, более предпочтительно по меньшей мере приблизительно 50% идентичностью, еще более предпочтительно по меньшей мере приблизительно 60% идентичностью, предпочтительно по меньшей мере приблизительно 75% идентичностью, более предпочтительно по меньшей мере приблизительно 80% идентичностью, еще более предпочтительно по меньшей мере приблизительно 90%, еще более предпочтительно приблизительно 95%, наиболее предпочтительно приблизительно 97% идентичностью, иногда приблизительно 98% и приблизительно 99% идентичностью последовательности по сравнению с контрольной (т.е. дикого типа) последовательностью. Идентичность последовательности можно определять с использованием известных программ, таких как BLAST, ALIGN и CLUSTAL, с использованием стандартных параметров. (См., например, Altschul, et al., J. Mol. Biol. 215:403-410 [1990]; Henikoff et al., Proc. Natl. Acad. Sci. USA 89:10915 [1989]; Karin et al., Proc. Natl. Acad. Sci USA 90:5873 [1993]; и Higgins et al., Gene 73:237-244 [1988]). Программное обеспечение для проведения анализов BLAST является общедоступным через национальный центр биотехнологической информации. Также можно проводить поиск в базах данных с использованием FASTA (Pearson et al., Proc. Natl. Acad. Sci. USA 85:2444-2448 [1988]). Одним из признаков того, что два полипептида являются в основном идентичными, является то, что первый полипептид является иммунологически перекрестно-реактивным со вторым полипептидом. Как правило, полипептиды, которые отличаются консервативными аминокислотными заменами, являются иммунологически перекрестно-реактивными. Таким образом, полипептид является в основном идентичным второму полипептиду, например, когда два пептида отличаются только консервативной заменой. Другим признаком того, что две последовательности нуклеиновой кислоты являются в основном идентичными, является то, что две молекулы гибридизуются друг с другом в жестких условиях (например, в диапазоне от средней до высокой жесткости).
Здесь термин «эквивалентные остатки» относится к белкам, разделяющим конкретные аминокислотные остатки. Например, эквивалентные остатки можно идентифицировать посредством определения гомологии на уровне третичной структуры белка (например, нейтральной металлопротеиназы), третичную структуру которого определяют рентгеновской кристаллографией. Эквивалентные остатки определяют как те остатки, для которых атомные координаты двух или более атомов главной цепи конкретного аминокислотного остатка белка, обладающего предположительными эквивалентными остатками, и интересующего белка (N на N, CA на CA, C на C и O на O) лежат внутри 0,13 нм и предпочтительно внутри 0,1 нм после выравнивания. Выравнивания достигают после того, как лучшую модель ориентируют и располагают так, чтобы получить максимальное перекрывание атомных координат не относящихся к водороду атомов белка из анализируемых белков. Предпочтительной моделью является кристаллографическая модель, для которой получают самый низкий R-фактор по экспериментальным данным дифракции при наивысшем доступном разрешении, определенный с использованием способов, известных специалистам в области кристаллографии и характеризации/анализа белка.
Здесь термины «гибридные нейтральные металлопротеиназы» и «слитые нейтральные металлопротеиназы» относятся к белкам, сконструированным по меньшей мере из двух различных или «исходных» белков. В предпочтительных вариантах осуществления эти исходные белки являются гомологичными друг другу. Например, в некоторых вариантах осуществления предпочтительная гибридная нейтральная металлопротеиназа или слитый белок содержит N-конец белка и C-конец гомолога белка. В одном из предпочтительных вариантов осуществления два конца объединяют, чтобы они соответствовали полноразмерному активному белку.
Термин «регуляторный элемент» относится здесь к генетическому элементу, контролирующему некоторые аспекты экспрессии последовательностей нуклеиновой кислоты. Например, промотор представляет собой регуляторный элемент, облегчающий инициацию транскрипции функционально связанной кодирующей области. Дополнительные регуляторные элементы включают в себя сигналы сплайсинга, сигналы полиаденилирования и сигналы терминации.
Здесь «клетки-хозяева», как правило, представляют собой прокариотических или эукариотических хозяев, которые трансформируют или трансфицируют векторами, сконструированными с использованием способов рекомбинантной ДНК, известных в данной области. Трансформированные клетки-хозяева способны либо реплицировать векторы, кодирующие варианты белка, либо экспрессировать желательные варианты белка. В случае векторов, кодирующих вариант пре- или препро-формы белка, такие варианты при экспрессии, как правило, секретируются из клетки-хозяина в культуральную среду клетки-хозяина.
Термин «введенный» в контексте введения последовательности нуклеиновой кислоты в клетку означает трансформацию, трансдукцию или трансфекцию. Способы трансформации включают в себя трансформацию протопластов, преципитацию хлоридом кальция, электропорацию, трансформацию голой ДНК и т.п., как известно в данной области (см. Chang and Cohen, Mol. Gen. Genet., 168:111-115 [1979]; Smith et al., Appl. Env. Microbiol., 51:634 [1986]; и обзорную статью Ferrari et al., in Harwood, Bacillus, Plenum Publishing Corporation, pp. 57-72 [1989]).
Термин «промотор/энхансер» означает отрезок ДНК, который содержит последовательности, способные обеспечивать как промоторные, так и энхансерные функции (например, длинные концевые повторы ретровирусов обладают как промоторной, так и энхансерной функциями). Энхансер/промотор может являться «эндогенным» или «экзогенным», или «гетерологичным». Эндогенный энхансер/промотор представляет собой энхансер/промотор, естественно связанный с данным геном в геноме. Экзогенный (гетерологичный) энхансер/промотор представляет собой энхансер/промотор, помещенный в непосредственной близости к гену способами генетических манипуляций (т.е. молекулярно-биологическими способами).
Присутствие «сигналов сплайсинга» в экспрессирующем векторе часто приводит к более высоким уровням экспрессии рекомбинантного транскрипта. Сигналы сплайсинга опосредуют удаление интронов из первичного транскрипта РНК и состоят из участка донора и акцептора сплайсированного фрагмента (Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory Press, New York [1989], pp. 16.7-16.8). Общеупотребительным участком донора и акцептора сплайсированного фрагмента является граница сплайсинга 16S РНК из SV40.
Термин «стабильная трансфекция» или «стабильно трансфицированный» относится к введению и интеграции чужеродной ДНК в геном трансфицированной клетки. Термин «стабильный трансфектант» относится к клетке, обладающей чужеродной или экзогенной ДНК, стабильно интегрированной в геномную ДНК трансфицированной клетки.
Термины «селективный маркер» или «продукт селективного гена» относятся здесь к использованию гена, кодирующего фермент с активностью, обеспечивающей устойчивость к антибиотику или лекарственному средству клетке, в которой экспрессирован селективный маркер.
Здесь термины «амплификация» и «амплификация гена» относятся к способу, посредством которого специфические последовательности ДНК диспропорционально реплицируют, так что амплифицированный ген становится присутствующим в более высоком числе копий, чем исходно присутствовал в геноме. В некоторых вариантах осуществления отбор клеток посредством выращивания в присутствии лекарственного средства (например, ингибитора поддающегося ингибированию фермента) приводит либо к амплификации эндогенного гена, кодирующего продукт гена, необходимый для роста в присутствии лекарственного средства, либо к амплификации экзогенной (т.е. введенной) последовательности, кодирующей этот продукт гена, либо к обеим. Отбор клеток посредством выращивания в присутствии лекарственного средства (например, ингибитора поддающегося ингибированию фермента) может приводить либо к амплификации эндогенного гена, кодирующего продукт гена, необходимый для роста в присутствии лекарственного средства, либо к амплификации экзогенной (т.е. введенной) последовательности, кодирующей этот продукт гена, либо к обеим.
«Амплификация» представляет собой частный случай репликации нуклеиновой кислоты, предусматривающей специфичность к матрице. Ее противопоставляют репликации неспецифической матрицы (т.е. репликации, которая является зависимой от матрицы, но не зависит от специфической матрицы). Специфичность к матрице здесь отличают от точности репликации (т.е. синтеза правильной полинуклеотидной последовательности) и нуклеотидной (рибо- или дезоксирибо-) специфичности. Специфичность к матрице часто описывают в терминах специфичности к «мишени». Последовательности-мишени представляют собой «мишени» в том смысле, что, как считают, их отделяют от другой нуклеиновой кислоты. Способы амплификации разработаны в первую очередь для этого отделения.
Здесь термин «коамплификация» относится к введению в одну клетку поддающегося амплификации маркера совместно с другими последовательностями генов (т.е. включая один или несколько неселективных генов, таких как гены, содержащиеся в экспрессирующем векторе) и применению соответствующего давления отбора, так что в клетке амплифицируются как поддающийся амплификации маркер, так и другие, неселективные последовательности генов. Поддающийся амплификации маркер может являться физически связанным с другими последовательностями генов, или, альтернативно, два отдельных фрагмента ДНК - один, содержащий поддающийся амплификации маркер, и другой, содержащий неселективный маркер, можно вводить в одну и ту же клетку.
Здесь термины «поддающийся амплификации маркер», «поддающийся амплификации ген» и «амплифицирующий вектор» относятся к маркеру, гену или вектору, кодирующему ген, позволяющему амплификацию этого гена в соответствующих условиях выращивания.
Здесь термин «поддающаяся амплификации нуклеиновая кислота» относится к нуклеиновым кислотам, которые можно амплифицировать любым способом амплификации. Предусматривают, что эта «поддающаяся амплификации нуклеиновая кислота» будет обычно содержать «матрицу образца».
Здесь термин «матрица образца» относится к нуклеиновой кислоте, происходящей из образца, который анализируют на присутствие «мишени» (определена ниже). В отличие от этого, «матрицу фона» используют по отношению к нуклеиновой кислоте, отличной от матрицы образца, которая может присутствовать или не присутствовать в образце. Матрица фона наиболее часто является случайной. Это может являться результатом примесей или может быть обусловлено присутствием загрязнений нуклеиновой кислотой, которые, как считали, являлись очищенными от образца. Например, нуклеиновые кислоты из организмов, отличные от нуклеиновых кислот, подлежащих детекции, могут присутствовать в виде фона в тестируемом образце.
«Специфичности к матрице» в большинстве способов амплификации достигают посредством выбора фермента. Ферменты для амплификации представляют собой ферменты, которые в тех условиях, при которых их используют, будут перерабатывать только специфические последовательности нуклеиновой кислоты в гетерогенной смеси нуклеиновых кислот. Например, в случае Qв-репликазы, РНК MDV-I является специфической матрицей для репликазы (см., например, Kacian et al., Proc. Natl. Acad. Sci. USA 69:3038 [1972]). Этот фермент для амплификации не реплицирует другие нуклеиновые кислоты. Подобным образом, в случае T7 РНК полимеразы, этот фермент для амплификации обладает строгой специфичностью для его собственных промоторов (см. Chamberlin et al., Nature 228:227 [1970]). В случае T4 ДНК-лигазы, фермент не будет лигировать два олигонуклеотида или полинуклеотида, где присутствует несоответствие между олигонуклеотидным или полинуклеотидным субстратом и матрицей в точке лигирования (см. Wu and Wallace, Genomics 4:560 [1989]). Наконец, обнаружено, что полимеразы Taq и Pfu благодаря их способности функционировать при высокой температуре обладают высокой специфичностью к последовательностям, ограниченным и, таким образом, определенным праймерами; высокая температура приводит к термодинамическим условиям, благоприятствующим гибридизации праймера с последовательностями-мишенями и отсутствию гибридизации с не относящимися к мишеням последовательностями.
Здесь термин «праймер» относится к олигонуклеотиду, либо существующему в природе, в форме очищенного продукта рестрикционного расщепления, либо полученному синтетически, способному действовать в качестве точки инициации синтеза при помещении в условия, при которых индуцирован синтез продукта удлинения праймера, комплементарного цепи нуклеиновой кислоты (т.е. в присутствии нуклеотидов и индуцирующего средства, такого как ДНК-полимераза, и при соответствующей температуре и pH). Праймер предпочтительно является одноцепочечным для максимальной эффективности амплификации, однако, альтернативно может являться двухцепочечным. Если праймер двухцепочечный, его сначала обрабатывают для разделения его цепей перед использованием для получения продуктов удлинения. Предпочтительно, праймер представляет собой олигодезоксирибонуклеотид. Праймер должен являться достаточно длинным для праймирования синтеза продуктов удлинения в присутствии индуцирующего средства. Точная длина праймеров будет зависеть от многих факторов, включая температуру, источник праймера и использование способа.
Здесь термин «зонд» относится к олигонуклеотиду (т.е. к последовательности нуклеотидов), либо существующему в природе, в форме очищенного продукта рестрикционного расщепления, либо полученному синтетически, рекомбинантно или посредством амплификации ПЦР, способному гибридизоваться с другим интересующим олигонуклеотидом. Зонд может являться одноцепочечным или двухцепочечным. Зонды являются применимыми для детекции, идентификации и выделения конкретных последовательностей генов. Предусматривается, что любой зонд, используемый согласно изобретению, будет являться меченным любой «репортерной молекулой», так что его можно детектировать в любой системе детекции, включая в качестве неограничивающих примеров ферментные (например, ELISA, также как гистохимические анализы на основе ферментов), флуоресцентные, радиоактивные и люминесцентные системы. Подразумевается, что настоящее изобретение не ограничено какой-либо конкретной системой детекции или меткой.
Здесь термин «мишень», при использовании по отношению к способам амплификации (например, полимеразной цепной реакции), относится к области нуклеиновой кислоты, ограниченной праймерами, используемыми для полимеразной цепной реакции. Таким образом, считают, что «мишень» отделяют от других последовательностей нуклеиновой кислоты. «Отрезок» определяют как область нуклеиновой кислоты внутри последовательности-мишени.
Здесь термин «полимеразная цепная реакция» («ПЦР») относится к способам из патентов США No. 4683195, 4683202 и 4965188, приведенных здесь в качестве ссылки, которые включают в себя способы для увеличения концентрации отрезка последовательности-мишени в смеси геномной ДНК без клонирования или очистки. Этот способ для амплификации последовательности-мишени состоит во введении большого избытка двух олигонуклеотидных праймеров в смесь ДНК, содержащую желательную последовательность-мишень, с последующей точной последовательностью термоциклирования в присутствии ДНК-полимеразы. Два праймера являются комплементарными соответствующим им цепям двухцепочечной последовательности-мишени. Чтобы вызвать амплификацию, смесь денатурируют и затем праймеры отжигают с комплементарными им последовательностями в молекуле-мишени. После отжига праймеры удлиняют с помощью полимеразы, так что образуется новая пара комплементарных цепей. Стадии денатурации, отжига и удлинения полимеразой можно повторять многократно (т.е. денатурация, отжиг и удлинение составляют один «цикл»; может присутствовать множество «циклов») для получения высокой концентрации амплифицированного отрезка желательной последовательности-мишени. Длину амплифицированного отрезка желательной последовательности-мишени определяют по относительным положениям праймеров по отношению друг к другу, и, таким образом, эта длина представляет собой контролируемый параметр. Благодаря аспекту повторения процесса способ обозначают «полимеразная цепная реакция» (далее в этом документе «ПЦР»). Поскольку желательные амплифицированные отрезки последовательности-мишени становятся преобладающими последовательностями (в терминах концентрации) в смеси, говорят, что они являются «амплифицированными ПЦР».
Здесь термин «реагенты для амплификации» относится к таким реагентам (дезоксирибонуклеотидтрифосфатам, буферу и т.д.), необходимым для амплификации, помимо праймеров, нуклеиновой кислоты-матрицы и фермента для амплификации. Как правило, реагенты для амплификации вместе с другими компонентами помещают в реакционный сосуд (пробирку, микролунку и т.д.) и содержат там.
С помощью ПЦР возможно амплифицировать отдельную копию специфической последовательности-мишени в геномной ДНК до уровня, который можно детектировать несколькими различными способами (например, гибридизацией с меченым зондом; включением биотинилированных праймеров с последующей детекцией конъюгата авидин-фермент; включением 32P-меченных дезоксинуклеотидтрифосфатов, таких как dCTP или dATP, в амплифицированный отрезок). Помимо геномной ДНК, любую олигонуклеотидную или полинуклеотидную последовательность можно амплифицировать с помощью подходящего набора молекул праймеров. В частности, амплифицированные фрагменты, сами полученные посредством способа ПЦР, сами по себе являются эффективными матрицами для последующих амплификаций ПЦР.
Здесь термины «продукт ПЦР», «фрагмент ПЦР» и «продукт амплификации» относятся к полученной смеси соединений после завершения двух или более циклов стадий ПЦР денатурации, отжига и удлинения. Эти термины относятся к случаю, где присутствовала амплификация одного или нескольких отрезков одной или нескольких последовательностей-мишеней.
Здесь термины «эндонуклеазы рестрикции» и «ферменты рестрикции» относятся к бактериальным ферментам, каждый из которых расщепляет двухцепочечную ДНК в специфической нуклеотидной последовательности или около нее.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам и композициям, включающим в себя по меньшей мере один фермент - нейтральную металлопротеиназу, обладающую улучшенной стабильностью при хранении. В некоторых вариантах осуществления нейтральная металлопротеиназа находит использование для очистки и других применений. В некоторых особенно предпочтительных вариантах осуществления настоящее изобретение относится к способам и композициям, содержащим нейтральную металлопротеиназу (металлопротеиназы), полученную из Bacillus sp. В некоторых особенно предпочтительных вариантах осуществления нейтральную металлопротеиназу получают из B. amyloliquefaciens. В дополнительных предпочтительных вариантах осуществления нейтральная металлопротеиназа представляет собой вариант нейтральной металлопротеиназы B. amyloliquefaciens. В дополнительных вариантах осуществления нейтральная металлопротеиназа представляет собой гомолог нейтральной металлопротеиназы B. amyloliquefaciens. Настоящее изобретение находит особенное использование для применений, включающих в себя в качестве неограничивающих примеров очистку, отбеливание и дезинфекцию.
Также, как более подробно описано в примерах ниже, настоящее изобретение предоставляет много преимуществ для очистки широкого ряда объектов, включая в качестве неограничивающих примеров одежду, ткани, медицинские инструменты и т.д. Кроме того, настоящее изобретение относится к композициям, которые являются эффективными для очистки, отбеливания и дезинфекции в диапазоне температур и pH отмывки.
Как правило, протеазы гидролизуют амидные связи белков посредством добавления молекулы воды к пептидной связи (связям). Расщепление происходит по карбонильной группе пептидной связи. В видах бактерий, таких как Bacillus, существует два основных класса внеклеточных протеаз, а именно щелочные, или сериновые, протеазы и нейтральные металлопротеиназы.
Нейтральные металлоэндопептидазы (т.е. нейтральные металлопротеиназы) (EC 3.4.24.4) принадлежат к классу протеаз, обладающих абсолютной необходимостью в ионах цинка для каталитической активности. Эти ферменты являются оптимально активными при нейтральном pH и лежат в диапазоне от 30 до 40 кДа. Нейтральные металлопротеиназы связывают от двух до четырех ионов кальция, которые вносят вклад в структурную стабильность белка. Связанный ион металла в активном сайте металлопротеиназ является существенным признаком, позволяющим активацию молекулы воды. Затем молекула воды функционирует как нуклеофил и отщепляет карбонильную группу из пептидной связи.
Семейство нейтральной цинк-связывающей металлопротеиназы включает в себя бактериальный фермент термолизин и термолизин-подобные протеазы («TLP»), также как карбоксипептидазу A (пищеварительный фермент) и матриксные металлопротеиназы, которые катализируют реакции ремоделирования и деградации ткани. Единственной, хорошо охарактеризованной из этих протеаз по отношению к стабильности и функции является термолизин и его варианты (TLP). Действительно, большинство исследований фокусировали на модификации нейтральных протеаз Bacillus subtilis для увеличения термостабильности фермента (см., например, Vriend et al., In, Tweel et al. (eds), Stability and Stabilization of enzymes, Elsevier, pp. 93-99 [1993]).
Большинство усилий фокусировали на увеличении стабильности протеазы посредством изменения структурных детерминант, идентифицированных посредством использования молекулярного моделирования, предполагая предупреждать локальные процессы разворачивания, приводящие к автолизу белка и вызывающие денатурацию нейтральной протеазы при высоких температурах (см., например, van den Burg et al., in Hopsu-Havu et al., (eds), Proteolysis in Cell Functions Manipulating the Autolytic Pathway of a Bacillus Protease. Biomedical and Health Research Vol. 13, IOS Press p. 576).
Композиции и способы для конструирования нейтральных металлопротеиназ с улучшенными характеристиками представлены здесь. Как указано здесь, опубликовано, что ионы кальция предупреждают автолиз других протеаз, таких как термолизин. Нейтральную протеазу B. stearothermophilus стабилизировали против автолиза и протеолитической деградации посредством добавления кальция (см. Dürrschmidt et al., FEBS J., 272:1523-1534 [2005]).
Действительно, настоящее изобретение относится к композициям и способам, подходящим для конструирования нейтральных металлопротеиназ, являющихся независимыми от кальция для поддержания их структурной стабильности. В некоторых вариантах осуществления конструирование предупреждает локальное разворачивание в определенном элементе вторичной структуры, что может предупреждать протеолиз.
Природные и сконструированные протеазы, такие как субтилизин, часто экспрессируют в Bacillus subtilis, и некоторые заявлены в составе моющих средств для удаления белковых загрязнений. Другие заявлены, например, в хлебопекарной промышленности (например, термолизин из Bacillus thermoproteolyticus; см., например, Galante and Formantici, Curr. Organic Chem., 7, 1399-1422 [2003]). Как правило, сериновые протеазы более широко используют в моющих средствах, по меньшей мере частично из-за относительной простоты, с которой эти протеазы можно стабилизировать.
Действительно, металлопротеиназы менее часто используют в промышленности и, в частности, в производстве моющих средств по ряду причин. Эти ферменты подразумевают более сложные белковые системы, так как ферменты обладают абсолютной необходимостью в ионах кальция и цинка для стабильности и функции, соответственно. Далее, раствор моющего средства, также как вода, используемая в процессе стирки, часто содержит компоненты, которые часто мешают связыванию ионов с ферментом или хелатируют эти ионы, приводя к снижению или потере протеолитической функции и дестабилизации протеазы.
В отличие от используемых в настоящее время систем ферментов металлопротеиназ, настоящее изобретение относится к нейтральным металлопротеиназам, являющимся существенно стабилизированными для облегчения долговременного хранения на складе в жидких композициях моющих средств для стирки. В особенно предпочтительных вариантах осуществления стабильность и активность металлопротеиназы сохраняют посредством образования комплекса фермента с необходимой ему в активном участке молекулой цинка. Важно, что сочетание ионов кальция и цинка не оказывает неблагоприятного эффекта на функцию фермента. В некоторых вариантах осуществления стабилизированная нейтральная металлопротеиназа представляет собой металлопротеиназу дикого типа из Bacillus amyloliquefaciens (например, очищенный нейтральный MULTIFECT®; «PMN»). В альтернативных предпочтительных вариантах осуществления рекомбинантную нейтральную металлопротеиназу (например, нейтральную металлопротеиназу Bacillus amyloliquefaciens) клонируют в Bacillus subtilis («nprE»). В дополнительных вариантах осуществления металлопротеиназы с улучшенной стабильностью охватывают ферменты с увеличенной аффинностью для одного или нескольких из участков связывания кальция ферментом. В предпочтительных вариантах осуществления нейтральные металлопротеиназы согласно изобретению находят использование для общего применения в моющих средствах, включая в качестве неограничивающих примеров холодные температуры воды, загрязнения травой и/или условия низкого pH.
Настоящее изобретение относится к условиям, стабилизирующим цинк-связывающую нейтральную металлопротеиназу для увеличения стабильности при хранении в основах и/или композициях моющих средств. В предпочтительных вариантах осуществления композиции моющих средств содержат по меньшей мере одну металлопротеиназу (например, любую нейтральную металлопротеиназу Bacillus), являющуюся стабилизированной против автолиза и разворачивания посредством включения в состав моющего средства необходимых ионов цинка и/или кальция. В некоторых особенно предпочтительных вариантах осуществления нейтральная металлопротеиназа из Bacillus amyloliquefaciens (PMN) и рекомбинантная форма, экспрессированная в Bacillus subtilis (nprE), которая связывает ион цинка с аффинностью, в 10 раз превышающей аффинность для иона кальция, находят применение согласно изобретению. Стабилизированная протеаза в присутствии необходимых ионов цинка обладает улучшенной стабильностью против протеолиза по сравнению с теми же протеазами в отсутствие ионов.
Хотя некоторые экспериментальные результаты показывают, что nprE теряет некоторую протеолитическую активность (~20%) спустя один час после добавления основы моющего средства, для nprE, инкубированного при 32°C в присутствии ионов цинка, показали существенную стабилизацию по сравнению с условиями тестирования без добавления дополнительных солей или ионов кальция. Для присутствия ионов и кальция, и цинка не показали аддитивного эффекта. При концентрациях ионов цинка ниже чем 15 мМ нейтральная металлопротеиназа является достаточно стабильной в течение приблизительно 4 недель. Таким образом, настоящее изобретение относится к композициям, включающим добавление цинка для увеличения срока хранения нейтральной металлопротеиназы в присутствии компонентов моющего средства.
Более того, в альтернативных вариантах осуществления катион цинка заменяют на Co2+, Mn2+ или Fe2+, так как показано, что все эти ионы связываются с нейтральными металлопротеиназами и сохраняют их протеазную активность. Однако определили, что Mn2+ и Fe2+ не сохраняют нативную активность полностью. В то время как Co2+ сохраняет наивысший процент активности, он, по-видимому, связывается менее прочно, чем Zn2+. Катион цинка является необходимым признаком активного участка всех нейтральных металлопротеиназ, так как известно, что он играет роль в связывании субстрата и катализе фермента (см., например, Holmquist and Vallee, J. Biol. Chem., 249:4601-4607 [1974]). Относительно сильная аффинность нейтральной металлопротеиназы для катиона цинка (в ~ мкМ диапазоне) и приблизительно в 10 раз большая аффинность для этого иона относительно кальция позволяет предполагать, что цинк функционирует как стабилизатор, таким образом, предупреждая автолиз, протеолиз и разворачивание. Однако не подразумевают, что настоящее изобретение является ограниченным каким-либо конкретным механизмом.
Настоящее изобретение предоставляет необычайно выгодные возможности для применения в получении и разработке промышленных моющих средств. Доступны многие моющие средства с высокой специфичностью по отношению к удалению загрязнений белком, крахмалом и жиром. В частности, лучшая моющая производительность PMN или нейтральной металлопротеиназы из B. amyloliquefaciens для Equest Grass (Warwick) показывает, что нейтральные металлопротеиназы согласно изобретению в основе моющего средства, которая также содержит цинк, находят применение в улучшенных композициях моющего средства.
Подробное описание очищающих составов и составов моющих средств согласно изобретению
Если нет иных указаний, все уровни компонента или композиции, представленные здесь, приведены по отношению к активному уровню этого компонента или композиции и без учета примесей, например, остаточных растворителей или побочных продуктов, которые могут присутствовать в коммерчески доступных источниках.
Массы ферментных компонентов основаны на тотальном активном белке.
Все проценты и соотношения рассчитывают по массе, если нет иных указаний. Все проценты и соотношения рассчитывают на основании общей композиции, если нет иных указаний.
В приведенных примерах композиций моющего средства уровни ферментов выражены для чистого фермента по массе общих композиций, и если не указано иначе, ингредиенты моющих средств выражены по массе общих композиций.
Очищающие композиции, содержащие нейтральную металлопротеиназу
Стабилизированные нейтральные металлопротеиназы согласно изобретению являются применимыми для составления различных композиций моющих средств. Очищающую композицию согласно изобретению можно преимущественно использовать, например, в применениях для стирки, для очистки твердой поверхности, в применениях для автоматического мытья посуды, также как в косметических применениях, например, для зубных протезов, зубов, волос и кожи. Однако из-за уникальных преимуществ увеличенной эффективности в растворах низкой температуры и превосходных показателей безопасности для окраски, ферменты согласно изобретению идеально подходят для применений для стирки, таких как отбеливание тканей. Более того, ферменты согласно изобретению находят применение как в гранулированных, так и в жидких композициях.
Ферменты согласно изобретению также находят применение в дополнительных продуктах для очистки. Дополнительный продукт для очистки, содержащий по меньшей мере один фермент согласно изобретению, идеально подходит для включения в способ стирки, когда желательна дополнительная отбеливающая эффективность. Такие случаи включают в себя в качестве неограничивающих примеров применения для очистки в растворе низкой температуры. Дополнительный продукт может представлять собой, в его простейшей форме, один или несколько ферментов нейтральных металлопротеиназ, как представлено согласно изобретению. В некоторых вариантах осуществления добавка упакована в форме дозирования для включения в способ очистки, где применяют источник пероксида и желательна увеличенная отбеливающая эффективность. В некоторых вариантах осуществления форма однократного дозирования содержит пилюлю, таблетку, желатиновую капсулу или другую единицу однократного дозирования, содержащую предварительно отмеренные порошки и/или жидкости. В некоторых вариантах осуществления включают материал(ы) наполнителя и/или носителя для увеличения объема такой композиции. Подходящие материалы наполнителя или носителя включают в себя в качестве неограничивающих примеров различные соли сульфата, карбоната и силиката, также как тальк, глину и т.п. В некоторых вариантах осуществления материалы наполнителя и/или носителя для жидких композиций включают в себя воду и/или низкомолекулярные первичные и вторичные спирты, включая полиолы и диолы. Такие спирты включают в себя в качестве неограничивающих примеров метанол, этанол, пропанол и изопропанол. В некоторых вариантах осуществления композиции содержат приблизительно от 5% до приблизительно 90% таких материалов. В дополнительных вариантах осуществления используют кислые наполнители для уменьшения pH композиции. В некоторых альтернативных вариантах осуществления очищающие добавки включают в себя по меньшей мере один источник активированного пероксида, как описано ниже, и/или вспомогательные ингредиенты, как более подробно описано ниже.
В очищающих композициях и очищающих добавках согласно изобретению необходимо эффективное количество фермента нейтральной металлопротеиназы, как представлено согласно изобретению. В некоторых вариантах осуществления требуемого уровня фермента достигают добавлением одного или нескольких видов нейтральной металлопротеиназы, предоставленной согласно изобретению. Как правило, очищающие композиции согласно изобретению содержат по меньшей мере 0,0001 массовый процент, приблизительно от 0,0001 до приблизительно 1, приблизительно от 0,001 до приблизительно 0,5 или даже приблизительно от 0,01 до приблизительно 0,1 массового процента по меньшей мере одной нейтральной металлопротеиназы, представленной согласно изобретению.
В некоторых предпочтительных вариантах осуществления очищающие композиции, представленные здесь, как правило, составлены так, что во время использования для операций очистки в воде вода для мытья обладает pH приблизительно от 5,0 до приблизительно 11,5 или даже, в альтернативных вариантах осуществления, приблизительно от 6,0 до приблизительно 10,5. В некоторых предпочтительных вариантах осуществления составы жидких продуктов, как правило, составлены так, чтобы обладать точным pH приблизительно от 3,0 до приблизительно 9,0, тогда как в некоторых альтернативных вариантах осуществления состав обладает точным pH приблизительно от 3 до приблизительно 5. В некоторых предпочтительных вариантах осуществления гранулированные продукты для стирки, как правило, составлены так, чтобы обладать pH приблизительно от 8 до приблизительно 11. Способы контроля pH на рекомендованных для использования уровнях включают в себя использование буферов, щелочей, кислот и т.д., и хорошо известны специалистам в данной области.
В некоторых особенно предпочтительных вариантах осуществления, когда по меньшей мере одну нейтральную металлопротеиназу применяют в гранулированной композиции или в жидкости, нейтральная металлопротеиназа присутствует в форме инкапсулированной частицы для защиты фермента от других компонентов гранулированной композиции во время хранения. Кроме того, инкапсуляция предоставляет также способы контроля доступности нейтральной металлопротеиназы (металлопротеиназ) во время процесса очистки и может улучшать производительность нейтральной металлопротеиназы (металлопротеиназ). Предусматривают, что инкапсулированные нейтральные металлопротеиназы согласно изобретению будут находить применение при различных параметрах. Подразумевают также, что нейтральная металлопротеиназа является инкапсулированной с использованием любого подходящего материала (материалов) и способа (способов), известных в данной области.
В некоторых предпочтительных вариантах осуществления в инкапсулированный материал, как правило, инкапсулируют по меньшей мере часть катализатора нейтральной металлопротеиназы. В некоторых вариантах осуществления инкапсулированный материал является водорастворимым и/или диспергируемым в воде. В некоторых дополнительных вариантах осуществления инкапсулированный материал обладает температурой перехода в стеклообразное состояние (Tg) 0°C или выше (см., например, WO 97/11151, в частности, от страницы 6, строка 25, до страницы 7, строка 2, для дополнительной информации относительно температур перехода в стеклообразное состояние).
В некоторых вариантах осуществления инкапсулирующий материал выбран из группы, состоящей из углеводов, природных или синтетических камедей, хитина и хитозана, целлюлозы и производных целлюлозы, силикатов, фосфатов, боратов, поливинилового спирта, полиэтиленгликоля, парафиновых восков и их сочетаний. В некоторых вариантах осуществления, в которых инкапсулирующий материал представляет собой углевод, его выбирают из группы, состоящей из моносахаридов, олигосахаридов, полисахаридов и их сочетаний. В некоторых предпочтительных вариантах осуществления инкапсулирующий материал представляет собой крахмал (см., например, описания некоторых примеров подходящих крахмалов в EP 0922499; US 4977252, US 5354559 и US 5935826).
В дополнительных вариантах осуществления инкапсулирующий материал содержит микросферу, изготовленную из пластика (например, термопластиков, акрилонитрила, метакрилонитрила, полиакрилонитрила, полиметакрилонитрила и их смесей; коммерчески доступные микросферы, находящие применение, включают в себя в качестве неограничивающих примеров EXPANCEL® [Casco Products, Stockholm, Sweden], PM 6545, PM 6550, PM 7220, PM 7228, EXTENDOSPHERES® и Q-CEL® [PQ Corp., Valley Forge, PA], LUXSIL® и SPHERICELl® [Potters Industries, Inc., Carlstadt, NJ and Valley Forge, PA]).
Способы получения и использования очищающей композиции заявителя
В некоторых предпочтительных вариантах осуществления моющие композиции согласно изобретению составляют в любой подходящей форме и получают любым способом, выбранным составителем (см., например, некоторые неограничивающие примеры в U.S. 5879584, U.S. 5691297, U.S. 5574005, U.S. 5569645, U.S. 5565422, U.S. 5516448, U.S. 5489392 и U.S. 5486303). В некоторых вариантах осуществления, в которых является желательным низкий pH очищающей композиции, pH такой композиции регулируют добавлением кислого вещества, такого как HCl.
Вспомогательные вещества
В то время как они не являются необходимыми для целей настоящего изобретения, в некоторых вариантах осуществления неограничивающий список вспомогательных средств, описанных здесь, пригоден для использования в очищающих композициях согласно изобретению. Действительно, в некоторых вариантах осуществления вспомогательные средства включены в очищающие композиции согласно изобретению. В некоторых вариантах осуществления вспомогательные вещества поддерживают и/или усиливают очищающую производительность, обрабатывают субстрат, подлежащий очистке, и/или модифицируют эстетические свойства очищающей композиции (например, отдушки, окрашивающие вещества, красители и т.д.). Понятно, что такие вспомогательные средства являются дополнением к нейтральным металлопротеиназам согласно изобретению. Конкретный характер этих дополнительных компонентов и уровни их включения зависят от физической формы композиции и характера очищающей операции, где они подлежат применению. Пригодные вспомогательные вещества включают в себя в качестве неограничивающих примеров поверхностно-активные вещества, добавки для повышения моющего действия, хелатирующие агенты, ингибирующие перенос красителя средства, вспомогательные средства для хранения, диспергирующие средства, дополнительные ферменты и стабилизаторы ферментов, каталитические вещества, активаторы отбеливания, усилители отбеливания, перекись водорода, источники перекиси водорода, предварительно полученные перкислоты, полимерные диспергирующие средства, средства для удаления глинистой почвы/против повторного отложения, осветлители, средства для подавления пенообразования, красители, отдушки, средства для придания эластичной структуры, смягчающие средства для ткани, носители, гидротропные вещества, технологические добавки и/или пигменты. Помимо явно представленных здесь, дополнительные примеры известны в данной области (см., например, патенты США No. 5576282, 6306812 B1 и 6326348 B1). В некоторых вариантах осуществления вышеупомянутые вспомогательные ингредиенты уравновешивают очищающие композиции согласно изобретению.
Поверхностно-активные вещества - В некоторых вариантах осуществления очищающие композиции согласно изобретению содержат по меньшей мере одно поверхностно-активное вещество или систему поверхностно-активного вещества, где поверхностно-активное вещество выбрано из неионных поверхностно-активных веществ, анионных поверхностно-активных веществ, катионных поверхностно-активных веществ, амфолитических поверхностно-активных веществ, цвиттер-ионных поверхностно-активных веществ, семиполярных неионных поверхностно-активных веществ и их смесей. При некоторых вариантах осуществления очищающих композиций с низкими pH (например, композиций, обладающих точным pH приблизительно от 3 до приблизительно 5) композиция, как правило, не содержит этоксилированный алкилсульфат, так как считают, что такое поверхностно-активное вещество может быть гидролизовано кислым содержанием таких композиций.
В некоторых вариантах осуществления поверхностно-активное вещество присутствует на уровне приблизительно от 0,1% до приблизительно 60%, тогда как в альтернативных вариантах осуществления уровень составляет приблизительно от 1% до приблизительно 50%, тогда как в дополнительных вариантах осуществления уровень составляет приблизительно от 5% до приблизительно 40% по массе очищающей композиции.
Добавки для повышения моющего действия - в некоторых вариантах осуществления очищающие композиции согласно изобретению содержат одну или несколько добавок для повышения моющего действия моющего средства или систем добавок для повышения моющего действия. В некоторых вариантах осуществления, включающих по меньшей мере одну добавку для повышения моющего действия, очищающие композиции содержат по меньшей мере приблизительно 1%, приблизительно от 3% до приблизительно 60% или даже приблизительно от 5% до приблизительно 40% добавки для повышения моющего действия по массе очищающей композиции.
Добавки для повышения моющего действия включают в себя в качестве неограничивающих примеров щелочной металл, аммоний и соли алканоламмония и полифосфатов, силикаты щелочных металлов, карбонаты щелочноземельных и щелочных металлов, алюминосиликатные поликарбоксилатные соединения для повышения моющего действия, простые эфиры гидроксиполикарбоксилатов, сополимеры малеинового ангидрида с этиленом или винилметиловым эфиром, 1,3,5-тригидроксибензол-2,4,6-трисульфокислоту и карбоксиметилоксиянтарную кислоту, различные щелочные металлы, аммоний и замещенные соли аммония и полиуксусных кислот, таких как этилендиаминтетрауксусная кислота и нитрилотриуксусная кислота, также как поликарбоксилаты, такие как меллитовая кислота, янтарная кислота, лимонная кислота, оксидиянтарная кислота, полималеиновая кислота, бензол-1,3,5-трикарбоновая кислота, карбоксиметилоксиянтарная кислота, и их растворимые соли. Действительно, предусматривают, что любая подходящая добавка для повышения моющего действия будет находить применение в различных вариантах осуществления настоящего изобретения.
Хелатирующие агенты - В некоторых вариантах осуществления очищающие композиции согласно изобретению содержат по меньшей мере один хелатирующий агент. Подходящие хелатирующие агенты включают в себя в качестве неограничивающих примеров хелатирующие агенты для меди, железа и/или марганца и их смеси. В вариантах осуществления, в которых используют по меньшей мере один хелатирующий агент, очищающие композиции согласно изобретению содержат приблизительно от 0,1% до приблизительно 15% или даже приблизительно от 3,0% до приблизительно 10% хелатирующего агента по массе рассматриваемой очищающей композиции.
Вспомогательное средство для хранения - В некоторых вариантах осуществления очищающие композиции согласно изобретению включают в себя по меньшей мере одно вспомогательное средство для хранения. Подходящие вспомогательные средства для хранения включают в себя в качестве неограничивающих примеров полиэтиленгликоль, полипропиленгликоль, поликарбоксилат, удаляющие загрязнения полимеры, такие как политерефталевая кислота, глины, такие как каолинит, монтмориллонит, атапульгит, иллит, бентонит, галлуазит и их смеси.
Ингибирующие перенос красителя средства - В некоторых вариантах осуществления очищающие композиции согласно изобретению включают в себя одно или несколько ингибирующих перенос красителя средств. Подходящие полимерные ингибирующие перенос красителя средства включают в себя в качестве неограничивающих примеров поливинилпирролидоновые полимеры, полиамин N-оксидные полимеры, сополимеры N-винилпирролидона и N-винилимидазола, поливинилоксазолидоны и поливинилимидазолы или их смеси.
В вариантах осуществления, в которых используют по меньшей мере одно ингибирующее перенос красителя средство, очищающие композиции согласно изобретению содержат их приблизительно от 0,0001% до приблизительно 10%, приблизительно от 0,01% до приблизительно 5% или даже приблизительно от 0,1% до приблизительно 3% по массе очищающей композиции.
Диспергирующие средства - В некоторых вариантах осуществления очищающие композиции согласно изобретению содержат по меньшей мере одно диспергирующее средство. Подходящие водорастворимые органические вещества включают в себя в качестве неограничивающих примеров гомо- или сополимерные кислоты или их соли, в которых поликарбоновая кислота содержит по меньшей мере два карбоксильных радикала, отделенных друг от друга не более чем двумя атомами углерода.
Ферменты - В некоторых вариантах осуществления очищающие композиции согласно изобретению содержат один или несколько моющих ферментов, обеспечивающих преимущества для очищающей производительности и/или для ухода за тканью. Подходящие ферменты включают в себя в качестве неограничивающих примеров гемицеллюлазы, пероксидазы, протеазы, целлюлазы, ксиланазы, липазы, фосфолипазы, эстеразы, кутиназы, пектиназы, кератиназы, редуктазы, оксидазы, фенолоксидазы, липоксигеназы, лигниназы, пуллуланазы, танназы, пентозаназы, маннаназы, в-глюканазы, арабинозидазы, гиалуронидазу, хондроитиназу, лакказу и амилазы или их смеси. В некоторых вариантах осуществления используют сочетание ферментов (т.е. «коктейль»), содержащее общепринятые применимые ферменты, подобные протеазе, липазе, кутиназе и/или целлюлазе в сочетании с амилазой.
Стабилизаторы ферментов - В некоторых вариантах осуществления настоящего изобретения ферменты, применяемые в составах моющих средств согласно изобретению, являются стабилизированными. Предусматривают, что различные способы стабилизации фермента будут находить применение согласно изобретению. Например, в некоторых вариантах осуществления применяемые здесь ферменты являются стабилизированными благодаря присутствию водорастворимых источников ионов цинка(II), кальция(II) и/или магния(II) в конечных композициях, предоставляющих для ферментов такие ионы, также как другие ионы металла (например, барий(II), скандий(II), железо(II), марганец(II), алюминий(III), олово(II), кобальт(II), медь(II), никель(II) и оксованадий(IV)).
Каталитические комплексы металлов - В некоторых вариантах осуществления очищающие композиции согласно изобретению содержат один или несколько каталитических комплексов металлов. В некоторых вариантах осуществления находит применение металлосодержащий катализатор отбеливания. В некоторых предпочтительных вариантах осуществления металлический катализатор отбеливания содержит систему катализатора, содержащую катион переходного металла с определенной активностью катализатора отбеливания (например, катионы меди, железа, титана, рутения, вольфрама, молибдена или марганца), дополнительный катион металла, обладающий небольшой каталитической активностью для отбеливания или не обладающий каталитической активностью для отбеливания (например, катионы цинка или алюминия), и секвестрант, обладающий определенными константами стабильности для каталитических и дополнительных катионов металла, в частности, используют этилендиаминтетрауксусную кислоту, этилендиаминтетра(метилфосфоновую кислоту) и их водорастворимые соли (см., например, U.S. 4430243).
В некоторых вариантах осуществления в очищающих композициях согласно изобретению осуществляют катализ посредством соединения марганца. Такие соединения и уровни использования хорошо известны в данной области (см., например, U.S. 5576282).
В дополнительных вариантах осуществления кобальтовые катализаторы отбеливания находят применение в очищающих композициях согласно изобретению. Различные кобальтовые катализаторы отбеливания известны в данной области (см., например, U.S. 5597936 и U.S. 5595967). Такие кобальтовые катализаторы легко получить посредством известных способов (см., например, U.S. 5597936 и U.S. 5595967).
В дополнительных вариантах осуществления очищающие композиции согласно изобретению содержат комплекс переходного металла с макрополициклическим жестким лигандом («MRL»). На практике и не с целью ограничения, в некоторых вариантах осуществления композиции и способы очистки, представленные согласно изобретению, корректируют для обеспечения порядка по меньшей мере одной частицы активных молекул MRL на сто миллионов в водной моющей среде, и в некоторых предпочтительных вариантах осуществления обеспечивают приблизительно от 0,005 м.д. (ppm) до приблизительно 25 ppm, более предпочтительно приблизительно от 0,05 ppm до приблизительно 10 ppm и наиболее предпочтительно приблизительно от 0,1 ppm до приблизительно 5 ppm MRL в моющей жидкости.
Предпочтительные переходные металлы в быстродействующем катализаторе отбеливания с переходным металлом включают в себя в качестве неограничивающих примеров марганец, железо и хром. Предпочтительные MRL также включают в себя в качестве неограничивающих примеров специальные сверхжесткие лиганды, которые являются перекрестно-связанными (например, 5,12-диэтил-1,5,8,12-тетраазабицикло[6,6,2]гексадекан). Подходящие MRL с переходными металлами легко получить известными способами (см., например, WO 00/32601 и U.S. 6225464).
Способы получения и использования очищающих композиций
Очищающие композиции согласно изобретению составляют в любой подходящей форме и получают любым подходящим способом, выбранным составителем (см., например, U.S. 5879584, U.S. 5691297, U.S. 5574005, U.S. 5569645, U.S. 5565422, U.S. 5516448, U.S. 5489392, U.S. 5486303, U.S. 4515705, U.S. 4537706, U.S. 4515707, U.S. 4550862, U.S. 4561998, U.S. 4597898, U.S. 4968451, U.S. 5565145, U.S. 5929022, U.S. 6294514 и U.S. 6376445, все из которых приведены здесь в качестве ссылок для некоторых неограничивающих примеров).
Способ использования
В предпочтительных вариантах осуществления очищающие композиции согласно изобретению находят применение для очистки поверхностей и/или тканей. В некоторых вариантах осуществления по меньшей мере часть поверхности и/или ткани приводят в контакт по меньшей мере с одним вариантом осуществления очищающих композиций согласно изобретению, в чистой форме или растворенным в моющей жидкости, и затем поверхность и/или ткань необязательно промывают и/или ополаскивают. Для целей настоящего изобретения «промывка» включает в себя в качестве неограничивающих примеров чистку щеткой и механическое перемешивание. В некоторых вариантах осуществления ткань включает в себя любую ткань, пригодную для стирки в нормальных для использования потребителем условиях. В предпочтительных вариантах осуществления очищающие композиции согласно изобретению используют в концентрации приблизительно от 500 ppm до приблизительно 15000 ppm в растворе. В некоторых вариантах осуществления, в которых моющий растворитель представляет собой воду, температура воды, как правило, лежит в диапазоне приблизительно от 5°C до приблизительно 90°C. В некоторых предпочтительных вариантах осуществления для очистки тканей соотношение масс воды и ткани, как правило, составляет приблизительно от 1:1 до приблизительно 30:1.
ЭКСПЕРИМЕНТЫ
Следующие примеры представлены для демонстрации и дополнительной иллюстрации конкретных предпочтительных вариантов осуществления и аспектов настоящего изобретения, и их не следует истолковывать как ограничивающие его объем.
В следующем ниже описании экспериментов применяют следующие сокращения: °C (градусов Цельсия); об/мин (оборотов в минуту); H2O (вода); HCl (соляная кислота); aa и AA (аминокислота); п.н. (пары нуклеотидов); т.п.н. (тысячи пар нуклеотидов); кДа (килодальтоны); г (граммы); мкг (микрограммы); мг (миллиграммы); нг (нанограммы); мкл (микролитры); мл (миллилитры); мм (миллиметры); нм (нанометры); мкм (микрометр); M (молярный); мМ (миллимолярный); мкМ (микромолярный); ед. (единиц); В (вольт); MW (молекулярная масса); сек (секунд); мин (минута/минуты); час (час/часы); MgCl2 (хлорид магния); NaCl (хлорид натрия); OD280 (оптическая плотность при 280 нм); OD405 (оптическая плотность при 405 нм); OD600 (оптическая плотность при 600 нм); PAGE (электрофорез в полиакриламидном геле); EtOH (этанол); PBS (фосфатно-солевой буфер [150 мМ NaCl, 10 мМ натрий-фосфатный буфер, pH 7,2]); LAS (лаурилсульфонат натрия); SDS (додецилсульфат натрия); Трис (трис(гидроксиметил)аминометан); TAED (N,N,N'N'-тетраацетилэтилендиамин); BES (полиэфирсульфон); MES (2-морфолиноэтансульфоновая кислота, моногидрат; f.w. 195,24; Sigma # M-3671); CaCl2 (хлорид кальция, безводный; f.w. 110,99; Sigma # C-4901); DMF (N,N-диметилформамид, f.w. 73,09, d=0,95); Abz-AGLA-Nba (2-аминобензоил-L-аланилглицил-L-лейцил-L-аланино-4-нитробензиламид, f.w. 583,65; Bachem # H-6675, VWR каталожный # 100040-598); SBGl% («Суперсреда с глюкозой»; 6 г Soytone [Difco], 3 г дрожжевого экстракта, 6 г NaCl, 6 г глюкозы); pH доводят до 7,1 с помощью NaOH перед стерилизацией с использованием способов, известных в данной области; мас./об. (масса к объему); об./об. (объем к объему); Npr и npr (нейтральная металлопротеиназа); SEQUEST® (программа поиска в базах данных SEQUEST, University of Washington); Npr и npr (ген нейтральной металлопротеиназы); nprE и NprE (нейтральная металлопротеиназа B. amyloliquefaciens); PMN (очищенная металлопротеиназа MULTIFECT®); MS (масс-спектроскопия); SRI (показатель удаления загрязнений); TIGR (The Institute for Genomic Research, Rockville, MD); AATCC (American Association of Textile and Coloring Chemists); Amersham (Amersham Life Science, Inc. Arlington Heights, IL); Corning (Corning International, Corning, NY); ICN (ICN Pharmaceuticals, Inc., Costa Mesa, CA); Pierce (Pierce Biotechnology, Rockford, IL); Equest (Equest, Warwick International Group, Inc., Flintshire, UK); EMPA (Eidgenossische Material Prufungs und Versuch Anstalt, St. Gallen, Switzerland); CFT (Center for Test Materials, Vlaardingen, The Netherlands); Amicon (Amicon, Inc., Beverly, MA); ATCC (Американская коллекция типовых культур, Manassas, VA); Becton Dickinson (Becton Dickinson Labware, Lincoln Park, NJ); Perkin-Elmer (Perkin-Elmer, Wellesley, MA); Rainin (Rainin Instrument, LLC, Wobura, MA); Eppendorf (Eppendorf AG, Hamburg, Germany); Waters (Waters, Inc., Milford, MA); Geneart (Geneart GmbH, Regensburg, Germany); Perseptive Biosystems (Perseptive Biosystems, Ramsey, MN); Molecular Probes (Molecular Probes, Eugene, OR); BioRad (BioRad, Richmond, CA); Clontech (CLONTECH Laboratories, Palo Alto, CA); Cargill (Cargill, Inc., Minneapolis, MN); Difco (Difco Laboratories, Detroit, MI); GIBCO BRL или Gibco BRL (Life Technologies, Inc., Gaithersburg, MD); New Brunswick (New Brunswick Scientific Company, Inc., Edison, NJ); Thermoelectron (Thermoelectron Corp., Waltham, MA); BMG (BMG Labtech, GmbH, Offenburg, Germany); Greiner (Greiner Bio-One, Kremsmuenster, Austria); Novagen (Novagen, Inc., Madison, WI); Novex (Novex, San Diego, CA); Finnzymes (Finnzymes OY, Finland); Qiagen (Qiagen, Inc., Valencia, CA); Invitrogen (Invitrogen Corp., Carlsbad, CA); Sigma (Sigma Chemical Co., St. Louis, MO); DuPont Instruments (Asheville, NY); Global Medical Instrumentation или GMI (Global Medical Instrumentation; Ramsey, MN); MJ Research (MJ Research, Waltham, MA); Infors (Infors AG, Bottmingen, Switzerland); Stratagene (Stratagene Cloning Systems, La Jolla, CA); Roche (Hoffmann La Roche, Inc., Nutley, NJ); Agilent (Agilent Technologies, Palo Alto, CA); S-Matrix (S-Matrix Corp., Eureka, CA); US Testing (United States Testing Co., Hoboken, NY); West Coast Analytical Services (West Coast Analytical Services, Inc., Santa Fe Springs, CA); Ion Beam Analysis Laboratory (Ion Bean Analysis Laboratory, The University of Surrey Ion Beam Centre (Guildford, UK); TOM (Terg-o-Meter); BMI (кровь, молоко, чернила); BaChem (BaChem AG, Bubendorf, Switzerland); Molecular Devices (Molecular Devices, Inc., Sunnyvale, CA); Corning (Corning International, Corning, NY); MicroCal (Microcal, Inc., Northhampton, MA); Chemical Computing (Chemical Computing Corp., Montreal, Canada); NCBI (Национальный центр биотехнологической информации); Argo Bioanalytica (Argo Bioanalytica. Inc, New Jersey); Vydac (Grace Vydac, Hesperia, CA); Minolta (Konica Minolta, Ramsey, NJ) и Zeiss (Carl Zeiss, Inc., Thornwood, NY).
В этих экспериментах использовали спектрофлуориметр для измерения поглощения продуктов, полученных после завершения реакций. Рефлектометр использовали для измерения отражающей способности образцов. Если нет иных указаний, концентрации белка определяли по Кумасси плюс (Pierce), с использованием БСА в качестве стандарта.
Следующие анализы использовали в примерах, описанных ниже.
A. Анализ Брэдфорд для определения содержания белка в 96-луночных микропланшетах для титрования (MTP)
В этих анализах использовали анализ с реагентом красителем Брэдфорд (Quick Start) для определения концентрации белка в образцах протеазы NprE в масштабе MTP. В этой системе анализа используемые растворы химикатов и реагентов представляли собой:
Реагент краситель Брэдфорд Quick Start BIO-RAD, #500-0205
Буфер для разведения 10 мМ NaCl, 0,1 мМ CaCl2, 0,005% TWEEN®-80
Используемое оборудование представляло собой Biomek FX Robot (Beckman) и считыватель для MTP SpectraMAX (тип 340); MTP из Costar (тип 9017).
В тесте в каждую лунку вносили пипеткой 200 мкл реагента красителя Брэдфорд, затем 15 мкл буфера для разведения. Наконец, в лунки добавляли 10 мкл профильтрованной культуральной жидкости. После интенсивного перемешивания MTP инкубировали по меньшей мере 10 минут при комнатной температуре. Сдували возможные пузырьки воздуха и OD лунок считывали при 595 нм.
Для определения концентрации белка фоновое показание (т.е. из лунок без инокуляции) вычитали из показаний для образцов. Полученные значения OD595 представляют собой относительные измерения содержания белка в образцах. Линейность калибровочных кривых для NprE между 0 и 5 мкг позволяет использовать значения OD595 нм в качестве относительного измерения содержания белка. Так как ожидаемое содержание NprE в супернатанте составляло 200-300 мкг/мл, объем образца 10 мкл, применяемый в тесте, содержал менее 5 мкг белка, обеспечивая значения в линейном диапазоне.
B. Анализ микрообразцов для тестирования производительности протеазы
Моющие средства, применяемые в этом анализе, не содержали ферментов. Используемое оборудование представляло собой Biomek FX Robot (Beckman) и считыватель для MTP SpectraMAX (тип 340); MTP из Costar (тип 9017).
Получение моющего средства (жидкое моющее средство в холодной воде; условия США):
воду Milli-Q доводили до жесткости воды 6 gpg (Ca/Mg=3/1) и добавляли 0,78 г/л моющего средства TIDE® 2007-2x. Раствор моющего средства энергично перемешивали по меньшей мере 15 минут. Затем добавляли 5 мМ HEPES (свободная кислота) и доводили pH до 8,2.
Микрообразцы
Микрообразцы с диаметром окружности 1/4” получали из CFT. Перед вырезанием микрообразцов ткань (EMPA 116) промывали водой. По два микрообразца помещали в каждую лунку 96-луночного микропланшета для титрования вертикально, чтобы воздействовать на полную площадь поверхности (т.е. не плоско на дно лунки).
Способ тестирования
Инкубатор устанавливали на 20°C. Профильтрованные образцы культуральной среды тестировали при соответствующей концентрации посредством разведения смесью 10 мМ NaCl, 0,1 мМ CaCl2 и 0,005% раствора TWEEN®-80. Желаемый раствор моющего средства получали, как описано выше. Затем 190 мкл раствора моющего средства добавляли к каждой лунке MTP, содержащей микрообразцы. К этой смеси добавляли 10 мкл раствора разведенного фермента (для получения общего объема 200 мкл/лунку). MTP герметизировали скотчем и помещали в инкубатор на 30 минут со встряхиванием при 1400 об/мин. После инкубации в соответствующих условиях 100 мкл раствора из каждой лунки удаляли и помещали в свежий MTP. Новый MTP, содержащий 100 мкл раствора/лунку, считывали при 405 нм в считывателе для MTP. Включали также пустые контроли, также как контроли, содержащие два микрообразца и моющее средство, но без фермента.
Вычисление производительности для BMI:
Полученное значение поглощения корректировали по пустому значению (т.е. полученного после инкубации микрообразцов в отсутствие фермента). Полученное поглощение представляет собой показатель гидролитической активности. Для каждого образца (например, nprE или варианта) вычисляли показатель производительности. Показатель производительности сравнивали с производительностью варианта (действительное значение) и стандартного фермента (теоретическое значение) при одной и той же концентрации белка. Кроме того, вычисляли теоретические значения с использованием параметров уравнения Ленгмюра для стандартного фермента. По показателю производительности (PI) больше 1 (PI>1) идентифицировали лучший вариант (по сравнению со стандартным [например, дикого типа]), тогда как по PI 1 (PI=1) идентифицировали вариант с такой же производительностью, как у стандарта, и по PI менее 1 (PI<1) идентифицировали вариант с производительностью хуже, чем у стандарта. Таким образом, по PI идентифицируют лучшие варианты, также как варианты, менее желательные для использования в конкретных условиях.
C. Анализ устойчивости к цитрату для протеазы NprE.
Устойчивость к цитрату измеряли после инкубации дикого типа и вариантов NprE в присутствии 50 мМ цитрата. Исходную и остаточную активность определяли с использованием анализа гидролиза DMC. В этой системе анализа используемые растворы химикатов и реагентов представляли собой:
Концентрации этих буферов для разбавления указаны как конечные концентрации. Начальная концентрация была пропорционально выше и зависела от степени разведения. В альтернативных экспериментах HEPES находит применение для замены Триса. Используемое оборудование представляло собой Biomek FX Robot (Beckman) и инкубатор/встряхиватель (Innova, тип 4230; New Brunswick). Буфер PIPES доводили до pH 5,8 с помощью 4н. HCl (конечная концентрация 55 мМ). Буфер Трис доводили до pH 8,2 с помощью 4н. HCl (конечная концентрация 25 мМ). Буфер 50 мМ цитрат/25 мМ Трис доводили до pH 8,2 с помощью 4н. NaOH. Буфер HEPES доводили до pH 8,2 с помощью 4н. NaOH (конечная концентрация 25 мМ). Буфер 50 мМ цитрат/25 мМ HEPES доводили до pH 8,2 с помощью 4н. NaOH.
Определение белка
Для определения желаемой степени разведения для анализа устойчивости к цитрату концентрацию протеазы для контролей NprE дикого типа для каждого планшета определяли анализом с TCA. По этому способу 25 мкл профильтрованной культуральной среды добавляли к 200 мкл 16,875% (мас./об.) TCA. После инкубации в течение 10-15 минут при температуре окружающей среды определяли рассеяние/поглощение света при 405 нм. Концентрацию белка определяли с использованием калибровочной кривой, построенной для очищенного NprE.
Способ тестирования
Степень разведения профильтрованной культуральной жидкости определяли с использованием анализа с TCA, как описано выше.
Условия испытания:
Профильтрованную культуральную жидкость разводили буфером для разбавления 2. MTP покрывали скотчем, встряхивали несколько секунд и помещали в инкубатор при 25°C на 60 минут при 200 об/мин. После инкубации 20 мкл смеси отбирали из каждой лунки и переносили в новый MTP, содержащий 180 мкл предварительно нагретого 1% раствора субстрата DMC (субстрат предварительно нагревали до 25°C). MTP помещали непосредственно в инкубатор/встряхиватель и инкубировали при 25°C в течение 30 минут при встряхивании при 200 об/мин. Остаточную активность протеазы определяли с использованием анализа гидролиза диметилказеина, описанного ниже.
Условия без испытания
Профильтрованную культуральную жидкость разводили буфером для разбавления 1. 20 мкл смеси немедленно отбирали из каждой лунки и переносили в новый MTP, содержащий 180 мкл предварительно нагретого 1% раствора субстрата DMC (субстрат предварительно нагревали до 25°C). MTP помещали непосредственно в инкубатор/встряхиватель и инкубировали при 25°C в течение 30 минут при встряхивании при 200 об/мин. Исходная активность протеазы, как определили с TNBS, с использованием анализа гидролиза диметилказеина, описана ниже.
Все значения остаточной активности (определенные с помощью анализа гидролиза диметилказеина) рассчитывали с использованием следующего уравнения.
% Остаточной активности = значение OD60 мин · 100/значение OD00 мин
D. Анализ гидролиза диметилказеина
В этой системе анализа используемые растворы химикатов и реагентов представляли собой:
Диметилказеин (DMC) - Sigma C-9801
TWEEN®-80 - Sigma P-8074
Буфер PIPES (свободная кислота) - Sigma P-1851; 15,1 г растворено приблизительно в 960 мл воды; pH доводили до 6,0 с помощью 4н. NaOH, добавляли 1 мл 5% TWEEN®-80 и объем доводили до 1000 мл. Конечная концентрация PIPES и TWEEN®-80: 50 мМ и 0,005% соответственно.
Пикрилсульфоновая кислота (TNBS) - Sigma P-2297 (5% раствор в воде)
Реагент A - 45,4 г Na2B4O7.10 H2O (Merck 6308) и 15 мл 4н. NaOH, растворенные вместе до конечного объема 1000 мл (посредством нагревания, если необходимо)
Реагент B - 35,2 г NaH2PO4.1H2O (Merck 6346) и 0,6 г Na2SO3 (Merck 6657), растворенные вместе до конечного объема 1000 мл.
Способ
Для получения субстрата 4 г диметилказеина растворяли в 400 мл буфера PIPES. Профильтрованные культуральные супернатанты разводили буфером PIPES. Затем 10 мкл каждого разведенного супернатанта добавляли к 200 мкл субстрата в лунки MTP. MTP покрывали скотчем, встряхивали несколько секунд и помещали в термостат при 25°C на 30 минут без покачивания. Приблизительно за 15 минут перед удалением 1го планшета из термостата получали реагент TNBS посредством смешивания 1 мл раствора TNBS с 50 мл реагента A. MTP заполняли 60 мкл TNBS с реагентом A на лунку. Инкубируемые планшеты встряхивали несколько секунд, после чего 10 мкл переносили в MTP с TNBS с реагентом A. Планшеты закрывали скотчем и встряхивали в течение 20 минут в настольном встряхивателе (BMG Thermostar) при комнатной температуре и 500 об/мин. Наконец, в лунки добавляли 200 мкл реагента B, смешивали в течение 1 минуты на встряхивателе и определяли поглощение при 405 нм с использованием считывателя MTP.
Полученное значение поглощения корректировали по пустому значению (т.е. субстрат без фермента). Полученное поглощение являлось показателем гидролитической активности. (Любую) специфическую активность в образце рассчитывали делением поглощения на определенную концентрацию белка.
E. Анализ устойчивости к TIDE®
Стабильность NprE и вариантов измеряли после стадии инкубации в присутствии 25% прессованного моющего средства TIDE®. Исходную и остаточную активность определяли с использованием AGLA-анализа, описанного ниже. Используемое оборудование представляло собой Biomek FX Robot (Beckman), измеритель флуоресценции (FLUOstar Optima; BMG), инкубатор/встряхиватель (iEMS; Thermoelectron) и инкубатор/встряхиватель (Innova; New Brunswick (тип 4230)); MTP из Costar (тип 9017) и из Greiner (черные планшеты, тип 655076).
Химикаты и реагенты:
В этой системе анализа используемые растворы химикатов и реагентов представляли собой:
TIDE®-прессованное моющее средство - с DTPA и без
Раствор TIDE®-прессованного моющего средства - 125 г TIDE®-прессованного растворено в смеси из 50 г 50 мМ HEPES pH 8,2 и 275 мл воды; концентрация TIDE® составляла 27,7%, после разведения супернатантом 25%
Буфер для разбавления MES - 52,6 мМ MES/NaOH, 2,6 мМ CaCl2, 0,005% TWEEN®-80, pH 6,5
Субстрат AGLA - BaChem, кат. № H-6675, или American Peptide Company, кат. № 81-0-31
Раствор субстрата AGLA - 451 мг AGLA растворено в 16 мл N,N-диметилформамида; этот раствор при перемешивании выливали в 304 мл буфера MES (52,6 мМ MES/NaOH, 2,6 мМ CaCl2, 0,005% TWEEN®-80, pH 6,5)
Способ тестирования:
Условия без испытания:
Сначала 20 мкл профильтрованной культуральной среды разводили 180 мкл буфера для разбавления MES. Затем 20 мкл этой разведенной среды разводили 180 мкл буфера для разбавления MES. Затем 10 мкл этого разведения разводили 190 мкл раствора AGLA-субстрата в предварительно нагретом планшете при 25°C. Сдували все присутствующие пузырьки воздуха, и планшет измеряли согласно способу анализа протеазы с AGLA.
Условия испытания:
Сначала 20 мкл профильтрованной культуральной среды разводили 180 мкл раствора TIDE®-прессованного моющего средства без DTPA и после предварительного перемешивания во встряхивателе iEMS в течение 5 минут далее инкубировали во встряхивателе Innova. Планшет инкубировали всего 60 минут при 32°C, при 200 об/мин. Кроме того, 20 мкл профильтрованной культуральной среды разводили 180 мкл раствора TIDE®-прессованного моющего средства с DTPA и после предварительного перемешивания во встряхивателе iEMS в течение 5 минут далее инкубировали во встряхивателе Innova. Планшет инкубировали всего 40 минут при 20°C, при 200 об/мин. Затем 20 мкл любого из этих растворов разводили 180 мкл буфера для разбавления MES, и 10 мкл этого разведения разводили 190 мкл раствора AGLA-субстрата в предварительно нагретом планшете при 25°C. Сдували все присутствующие пузырьки воздуха, и планшет измеряли согласно способу анализа протеазы AGLA.
Вычисления:
Измерения флуоресценции проводили при возбуждении 350 нм и испускании 415 нм. Программным обеспечением спектрофлуориметра рассчитывали скорости реакции по увеличению флуоресценции для каждой лунки по линейно убывающей кривой милли-RFU/мин:
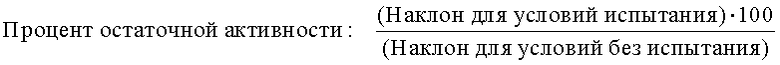
F. Анализ протеазы с 2-аминобензоил-L-аланилглицил-L-лейцил-L-аланино-4-нитробензиламидом (Abz-AGLA-Nba)
В способе, представленном ниже, представлены показатели технических деталей для получения воспроизводимых данных анализа протеазы независимо от времени и места. В то время как анализ можно адаптировать для данных лабораторных условий, любые данные, полученные посредством модифицированного способа, следует согласовывать с результатами, полученными исходным способом. Нейтральные металлопротеиназы расщепляют пептидную связь между глицином и лейцином 2-аминобензоил-L-аланилглицил-L-лейцил-L-аланино-4-нитробензиламида (Abz-AGLA-Nba). Свободный 2-аминобензоил-L-аланилглицин (Abz-AG) в растворе обладает максимумом испускания флуоресценции при 415 нм с максимумом возбуждения 340 нм. Флуоресценция Abz-AG в интактной молекуле Abz-AGLA-Nba погашена нитробензиламидом.
В этих экспериментах высвобождение Abz-AG посредством расщепления Abz-AGLA-Nba протеазой мониторировали флуоресцентной спектроскопией (возбуждение 340/испускание 415). Скорость появления Abz-AG являлась показателем протеолитической активности. Анализы проводили в условиях начальной скорости, не лимитированной субстратом.
Для воспроизводимых результатов анализа требуется встряхиватель для планшетов с контролем температуры (например, Eppendorf Thermomixer). Растворы для анализа инкубировали до желаемой температуры (например, 25°C) во встряхивателе для микропланшетов перед добавлением фермента. Растворы фермента наносили в планшет во встряхивателе, энергично встряхивали и быстро переносили в считыватель для планшетов.
Требовался спектрофлуориметр с возможностью непрерывного считывания данных, линейного регрессионного анализа и с контролем температуры (например, SpectraMax M5, Gemini EM, Molecular Devices). Считыватель всегда поддерживали при желаемой температуре (например, 25°C). Считыватель устанавливали на детекцию флуоресценции считыванием сверху, и устанавливали возбуждение 350 нм, а испускание 415 нм без использования отсекающего фильтра. PMT устанавливали на среднюю чувствительность и 5 считываний на лунку. Включали автокалибровку, но только для калибровки перед первым считыванием. Результаты анализа измеряли в течение 3 минут с интервалами считывания, минимизированными согласно числу лунок, выбранных для мониторирования. Считыватель устанавливали для вычисления скорости милли-RFU/мин (тысячные относительных единиц флуоресценции в минуту). Число считываний, используемых для вычисления скорости (точек Vmax), устанавливали на число, эквивалентное 2 минутам, как определяли по интервалу считывания (например, для считывания каждые 10 секунд будут использовать 12 точек для вычисления скорости). Максимум RFU устанавливали на 50000.
Все пипетирование исходных растворов фермента и субстрата проводили с помощью пипеток с положительным вытеснением (Rainin Microman). Рабочие растворы буфера, рабочие растворы для анализа и рабочие растворы фермента отбирали посредством одноканальных или многоканальных пипеток с вытеснением воздухом (Rainin LTS) из пробирок, резервуаров для реагента или исходных микропланшетов. Пипетка с повторением дозирования (Eppendorf) находит применение для переноса раствора для анализа в лунки микропланшета при использовании небольшого числа лунок для минимизации потери реагента. Инструменты для автоматического пипетирования, такие как Beckman FX или Cybio Cybi-well, также находят применение для переноса растворов фермента из рабочего исходного микропланшета в микропланшет для анализа для запуска реакции сразу во всем микропланшете.
Реагенты и растворы:
52,6 мМ MES/NaOH, 2,6 мМ CaCl 2 , pH 6,5 - буфер MES
MES кислоту (10,28 г) и 292 мг безводного CaCl2 растворяли приблизительно в 900 мл очищенной воды. Раствор титровали NaOH до pH 6,5 (при 25°C или с пробой pH с поправкой на температуру). Буфер с доведенным pH доводили до общего объема 1 л. Конечный раствор фильтровали через стерильный фильтр 0,22 мкм и хранили при комнатной температуре.
48 мМ Abz-AGLA-Nba в DMF - исходный раствор Abz-AGLA-Nba
Приблизительно 28 мг Abz-AGLA-Nba помещали в небольшую пробирку. Его растворяли в мл DMF (объем будет меняться в зависимости от взвешенного Abz-AGLA-Nba) и встряхивали несколько минут. Раствор хранили при комнатной температуре, укрытым от света.
50 мМ MES, 2,5 мМ CaCl 2 , 5% DMF, 2,4 мМ Abz-AGLA-Nba pH 6,5 - раствор для анализа
Один мл исходного раствора Abz-AGLA-Nba добавляли к 19 мл буфера MES и встряхивали. Раствор хранили при комнатной температуре, укрытым от света.
50 мМ MES, 2,5 мМ CaCl 2 , pH 6,5 - буфер для разбавления фермента
Этот буфер получали добавлением 5 мл очищенной воды к 95 мл буфера MES.
50 мМ MES, 2,5 мМ CaCl 2 , 5% DMF, pH 6,5 - буфер для разбавления субстрата
Пять мл чистого DMF добавляли к 95 мл буфера MES. Этот буфер использовали для определения кинетических параметров.
Растворы фермента
Исходные растворы фермента разводили буфером для разбавления фермента до концентрации приблизительно 1 ppm (м.д.) (1 мкг/мл). Нейтральную протеазу MULTIFECT® (NprE дикого типа) разводили до концентрации ниже 6 ppm (6 мкг/мл). Предпочитали серийные разведения. Растворы являлись стабильными при комнатной температуре в течение 1 часа, но для более долговременного хранения растворы сохраняли во льду.
Способ
Сначала получали все буферы, исходные и рабочие растворы. Каждое разведение фермента исследовали в трех параллелях, если нет иных указаний. Если микропланшет с рабочим раствором фермента не являлся заполненным полностью, раствор располагали в полных вертикальных колонках, начиная с левой стороны планшета (для соответствия со считывателем планшетов). Соответствующий планшет для анализа организовывали таким же образом. Спектрофотометр для микропланшетов устанавливали, как описано ранее.
Сначала аликвоты по 200 мкл раствора для анализа помещали в лунки 96-луночного микропланшета. Планшет инкубировали в течение 10 мин при 25°C в мешалке для микропланшетов с контролем температуры, укрывая от света. Анализ запускали переносом 10 мкл рабочих растворов фермента из исходного микропланшета в микропланшет для анализа на мешалке. Оптимально применяли 96-луночную пипетирующую головку или использовали многоканальную пипетку для 8 лунок для переноса сначала из самой левой колонки. Растворы энергично перемешивали в течение 15 секунд (900 об/мин в Eppendorf Thermomixer). Микропланшет для анализа немедленно переносили в спектрофлуориметр для микропланшетов и начинали считывать измерения флуоресценции при возбуждении 350 нм и испускании 415 нм. Программным обеспечением спектрофлуориметра рассчитывали скорости реакции по увеличению флуоресценции для каждой лунки по линейно убывающей кривой милли-RFU/мин. В некоторых экспериментах второй планшет помещали в мешалку для микропланшетов для уравновешивания температуры во время считывания первого планшета.
Уровни начальных скоростей являлись линейными по отношению к концентрации продукта (т.е. высвобождающейся флуоресценции 2-аминобензоила) вплоть до 0,3 мМ продукта, что соответствует приблизительно 50000 RFU в растворе, начиная с 2,3 мМ Abz-AGLA-Nba с фоновой флуоресценцией приблизительно 22000 RFU. Abz-AGLA-Nba растворяли в DMF и использовали в день приготовления.
КОМПОЗИЦИИ МОЮЩЕГО СРЕДСТВА:
В приведенных в качестве примера композициях моющего средства уровни ферментов выражены для чистого фермента по массе общей композиции, и, если не указано иначе, ингредиенты моющего средства выражены по массе общей композиции. Сокращенные обозначения здесь обладают следующими значениями:
ПРИМЕР 1
Клонирование гена нейтральной металлопротеиназы из B. amyloliquefaciens.
В этом примере описаны способы, применяемые для клонирования гена нейтральной металлопротеиназы B. amyloliquefaciens. Ген, кодирующий нейтральную металлопротеиназу, клонировали из B. amyloliquefaciens с использованием общепринятых в данной области способов. Несвободный (т.е. штамм, несущий дополнительную, не свойственную данному виду ДНК (помимо селективного маркера хлорамфеникола, допустимого в свободном штамме), конкретно, последовательности плазмиды pJM102) штамм BC91504 (aprE/nprE-pJM102 в BG3594::comK) несет промотор и сигнальную последовательность aprE B. subtilis, слитые с геном пропептида/зрелого nprE B. amyloliquefaciens в интегративной плазмиде pJM102.
Следующие две последовательности (SEQ ID NO:1 и SEQ ID NO:2) B. subtilis и B. amyloliquefaciens получены посредством ПЦР с олигонуклеотидными праймерами, соответствующими подчеркнутым последовательностям.
Участок рестрикции EcoRI в хромосоме B subtilis (GAATTC), инициирующий кодон aprE (GTG) и стоп-кодон nprE B. Amyloliquefaciens, показаны в следующих последовательностях жирным шрифтом, также как введенный синтетически участок рестрикции HindIII (AAGCTT), сконструированный в праймере # 4.
Последовательность выше 5' aprE B. amyloliquefaciens, промотор и кодирующая область сигнальной последовательности показаны в следующей последовательности (SEQ ID NO:1). Праймер 1 (apr-f; GAGCTGGGTAAAGCCTATGAAT; SEQ ID NO:5) показан подчеркнутым в начале последовательности, тогда как часть aprE праймеров 2 и 3 (npr-f и npr-r; GTTCAGCAACATGTCTGCGCAGGCT; SEQ ID NO:6) показаны дважды подчеркнутыми в конце последовательности.

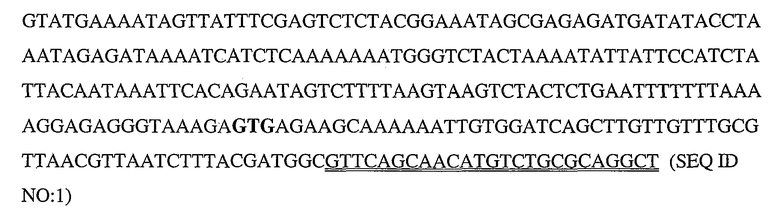
Последовательность пропептида и зрелой кодирующей последовательности nprE B. amyloliquefaciens и терминатор транскрипции представлены в последовательности ниже. В этой последовательности часть nprE праймеров 2 и 3 подчеркнута (GCTGAGAATCCTCAGCTTAAAGAAAACCTG; SEQ ID NO:7), тогда как часть npr-r праймера 4 (GGCTTCACCATGATCATATATGTCAAGCTTGGGGGG; SEQ ID NO:8) показана дважды подчеркнутой.


Аминокислотная последовательность полноразмерного NprE (пре-, про- и зрелая последовательность) представлена ниже:

В некоторых альтернативных вариантах осуществления следующая последовательность NprE находит применение согласно изобретению.

Последовательности праймеров, используемых в этих экспериментах ПЦР, представлены ниже:

Праймеры 2 и 3 являются обратно комплементарными друг другу и соответствуют либо некодирующей (#2), либо кодирующей (#3) цепям хромосомных ДНК. В случае кодирующей цепи, они соответствуют последним 25 парам оснований сигнальной последовательности aprE и первым 30 парам оснований пропептида nprE. Праймер #4 является обратно комплементарным подчеркнутой последовательности, содержащей 24 пары нуклеотидов на 3' от стоп-кодона и терминатора nprE с введенным участком HindIII с предшествующими шестью остатками dCTP для получения так называемого «зажима», что позволяет более эффективное расщепление рестрикционной эндонуклеазой HindIII, так как некоторые рестрикционные ферменты расщепляют неэффективно, если их последовательность узнавания локализована на самом конце фрагментов ДНК.
Два фрагмента ПЦР получены с помощью следующего способа и реагентов (за исключением ДНК-матрицы и олигонуклеотидных праймеров) из набора XL Applied Biosystems с ДНК-полимеразой rTTH:
40,6 мкл H2O
30 мкл 3,3x буфера для ПЦР rTth
10 мкл смеси 2 мМ dNTP
4,4 мкл 25 мМ ацетата Mg
5 мкл 50 мкМ праймера # 1 или # 3 (прямые праймеры)
5 мкл 50 мкМ праймера # 2 или # 4 (обратные праймеры)
2 мкл хромосомной ДНК B. subtilis или B. amyloliquefaciens
2 мкл полимеразы rTth
1 мкл полимеразы Pfu Turbo
100 мкл общий объем реакционной смеси
Условия ПЦР, используемые в этих экспериментах, представляли собой (95°C, 30 сек/58°C, 30 сек/68°C, 1 мин) × 30 циклов с последующим быстрым охлаждением до 4°C. Продукты реакции разделяли в 1,2% препаративных агарозных/TBE гелях, фрагменты соответствующего размера вырезали и очищали с использованием набора для выделения из геля QIAGEN®. Для второго слитого белка проводили реакции ПЦР, в которых хромосомные ДНК заменяли 1 мкл каждого из двух отдельных фрагментов и использовали только внешние праймеры #1 и #2. Использовали такие же условия ПЦР, как описано выше. Благодаря комплементарным концам, сформированным на двух фрагментах из-за использования комплементарных праймеров 2 и 3 в первых ПЦР, два фрагмента являлись точно слитыми.
Слитый фрагмент расщепляли EcoRI и HindIII и очищали в геле, как описано выше. Интегративную плазмиду pJM102 также расщепляли EcoRI и HindIII, затем линейную плазмиду очищали в геле и лигировали посредством общепринятых способов с расщепленным фрагментом слитого apr/npr. Затем эту реакционную смесь после лигирования использовали для прямой трансформации индуцированного ксилозой штамма B. subtilis.
После очистки получали два фрагмента посредством ПЦР с праймерами 1 и 2 с хромосомной ДНК B. subtilis дикого типа и с праймерами 3 и 4 с хромосомной ДНК из штамма B. amyloliquefaciens. Этот фрагмент снова очищали, как описано выше, с последующим расщеплением EcoRI и HindIII, с таким же расщеплением интегративной плазмиды pJM102 и последующим лигированием слитого фрагмента в плазмиду. Несколько трансформантов обладали слитым фрагментом, секвенированным с хромосомы для верификации отсутствия каких-либо введенных ПЦР мутаций. Один из них затем амплифицировали в несколько стадий с 5-25 мг/мл хлорамфеникола, селективного маркера для pJM102, чтобы совместно амплифицировать сцепленную экспрессирующую кассету.
Выбранный трансформант с верифицированной последовательностью получили селекцией по маркеру устойчивости к хлорамфениколу (CMP) из pJM102 на чашках с LB/агаром, содержащих 5 мг/мл CMP. Затем его инокулировали в среду LB с 10 мг/мл CMP на ночь при 37°C, с покачиванием при 250 об/мин. Затем эту культуру рассевали штрихом на чашки с LB/агаром с 10 мг/мл CMP для выделения отдельных колоний. Затем одну колонию инокулировали в среду LB с 25 мг/мл CMP на ночь при 37°C, с покачиванием при 250 об/мин. Затем эту культуру рассевали штрихом на чашки с LB/агаром с 25 мг/мл CMP для выделения отдельных колоний. Эти колонии собирали и хранили в глицерине при -70°C до использования, как известно в данной области.
Удалением двух, не являющихся необходимыми протеаз, присутствующих в B. subtilis (aprE и nprE), также как амилаз, уменьшали общий уровень внеклеточных протеаз во время получения металлопротеиназы. ДНК, кодирующую нейтральную металлопротеиназу, клонировали в хозяина с делетированной амилазой. Индуцибельный comK для развития компетенции вставляли в середину локуса амилазы, получая штамм «amy». Секрецию экспрессированного белка обеспечивали, вставляя нуклеотиды, кодирующие сигнальную последовательность, перед кодирующей последовательностью гена.
ПРИМЕР 2
Экспрессия и ферментация очищенной нейтральной MULTIFECT® и рекомбинантной нейтральной металлопротеиназы (nprE).
Рекомбинантный Bacillus subtilis, полученный, как описано в примере 1, культивировали общепринятой периодической ферментацией в питательной среде, как описано ниже. Одну ампулу с глицерином (полученную, как описано в примере 1) культуры B. subtilis, содержащую нейтральную металлопротеиназу B. amyloliquefaciens, использовали для инокуляции 600 мл среды SBG1%, содержащей 200 мг/л хлорамфеникола. Культуры выращивали в течение 48 часов при 37°C, после этого времени культуральную жидкость получали центрифугированием при 12000 об/мин, как известно в данной области. Эту процедуру повторяли в двух повторах. Полученные конечные концентрации фермента лежали в диапазоне приблизительно 1,4 и 2 г/л.
ПРИМЕР 3
Очистка и характеризация нейтральной металлопротеиназы
В этом примере описаны способы, используемые для очистки нейтральной металлопротеиназы, экспрессируемой организмами, описанными в примере 2. После 36 часов инкубации при 37°C, ферментационную жидкость собирали и центрифугировали при 12000 об/мин (центрифуга SORVALL® модель RC5B). Секретированные нейтральные металлопротеиназы выделяли из культуральной жидкости и концентрировали приблизительно в 10 раз с использованием фильтровальной системы Amicon 8400 с BES (полиэфирсульфоном) с отсечением 10 кДа.
Концентрированный супернатант диализовали в течение ночи при 4°C против 25 мМ буфера MES, pH 5,4, содержащего 10 мМ NaCl. Затем диализат наносили на катионообменную колонку Porous HS20 (общий объем ~83 мл; связывающая способность ~4,5 г белка/мл колонки; Waters), как описано ниже. Колонку предварительно уравновешивали 25 мМ буфером MES, pH 5,4, содержащим 10 мМ NaCl. Затем приблизительно 200-300 мл образца наносили на колонку. Связанный белок элюировали с использованием градиента pH от 5,4 до 6,2 в более чем 10 объемах колонки буфера MES. Элюция белка происходила между pH 5,82 и 6,0, и ее оценивали с использованием протеолитической активности, как описано в настоящем описании, и в 10% (мас./об.) NUPAGE® SDS-PAGE (Novex). Затем объединяли фракции, содержащие нейтральную протеазу. Перед доведением pH до 5,8 добавляли соли хлорид кальция и цинка в соотношении 3:1. Для очистки белка использовали Perceptive Biosystems BIOCAD® Vision (GMI).
Очищенный белок, оцененный с использованием 10% (мас./об.) NUPAGE® SDS-PAGE, определяли как гомогенный, с чистотой более 95%. Как правило, менее чем 1% очищенных препаратов обладал активностью сериновой протеазы при оценке с использованием общепринятого анализа протеазы с малым субстратом, suc-p-AAPF-pNA (N-сукцинил-L-Ala-L-Ala-L-Pro-L-Phe-p-нитроанилид) (Sigma). Этот анализ проводили в формате микропланшетов для титрования (96-луночных) с использованием 100 мМ буфера Трис-HCl, pH 8,5, содержащего 10 мМ CaCl2 и 0,005% TWEEN®-80. Субстрат (p-AAPF NA) получали приготовлением 160 мМ исходного раствора в DMSO (диметилсульфоксид) (100 мг/мл) и разведением исходного раствора в 100 раз буфером Трис-HCl, содержащим CaCl2 и 0,005% TWEEN®-80. Затем 10 мкл разведенного раствора протеазы (разведения получали с использованием 100 мМ буфера Трис-HCl, pH 8,5, содержащего 10 мМ CaCl2 и 0,005% TWEEN-80), добавляли к 190 мкл раствора p-AAPF 1 мг/мл. Смесь для анализа перемешивали в течение 5 минут и считывали кинетические изменения при 410 нм в течение 2-5 минут. Измеряли угол наклона кривой ответа и использовали как показатель количества сериновой протеазы по активности. Белок составляли для хранения с использованием 25 мМ буфера MES, pH 5,8, содержащего 1 мМ хлорид цинка, 4 мМ хлорид кальция и 40% пропиленгликоль.
ПРИМЕР 4
Аффинность очищенной нейтральной металлопротеиназы MULTIFECT® (PMN) для катионов кальция и цинка
В этом примере описаны способы определения аффинности нейтральной металлопротеиназы (PMN), полученной, как описано в вышеуказанных примерах. Определения аффинностей PMN для ионов кальция и цинка проводили с использованием флуоресцентных индикаторов Fluo-3 и FluoZin-3, соответственно, полученных из Molecular Probes. Все измерения флуоресценции считывали на люминесцентном спектрофотометре LS50B (Perkin-Elmer). Связывание Fluo-3 мониторировали при возбуждении при 500 нм и записывали спектры испускания от 505 до 550 нм. Сходным образом, связывание FluoZin-3 мониторировали при возбуждении при 495 нм, и собирали спектры испускания от 500 до 550 нм. Ширину щели возбуждения и испускания устанавливали на 2,5 нм.
В этих определениях 100 мкМ нейтральную металлопротеиназу в 50 мМ буфере Трис-HCl, pH 8,4, титровали увеличивающимися количествами соответствующего индикатора. Кривые титрования показаны на фиг.1. На этой фигуре треугольниками представлены данные кривой связывания, полученные для Zn2+ с использованием красителя Fluo-Zin3, измеряемые при 516 нм, тогда как кругами представлены данные, полученные для Ca2+ с использованием красителя Fluo-3, измеряемые при 522 нм. Константы связывания (Ka) для цинка и кальция (предполагая одиночный участок связывания) определили как 0,401 нМ и 0,037 нМ, соответственно. Эти результаты показывают, что очищенная нейтральная металлопротеиназа MULTIFECT® связывает ион цинка с аффинностью, приблизительно в 10 раз превышающей аффинность для иона кальция. На основании более слабого связывания кальция осуществляли дизайн исходных экспериментов конструирования белка, включающий в себя либо (i) конструирование участка (участков) с более сильным связыванием кальция, и/или (ii) исключение необходимости кальция для стабильности структуры (например, чтобы стабилизировать белок более чем на 80%).
ПРИМЕР 5
Стабильность при хранении
В этом примере описаны эксперименты, проведенные для оценки стабильности при хранении PMN и рекомбинантной нейтральной металлопротеиназы B. amyloliquefaciens, экспрессированной в B. subtilis. Оценивали протеолиз этих препаратов нейтральной металлопротеиназы в присутствии растворов с увеличивающимися концентрациями LAS (лаурилсульфат натрия; Sigma) (от 0% выше до 10% включительно). Протеолитические фрагменты, полученные из очищенной нейтральной металлопротеиназы MULTIFECT® (PMN), наблюдали с использованием 10% (мас./об.) NUPAGE® SDS-PAGE.
Стабильность при хранении рекомбинантной нейтральной металлопротеиназы из B. amyloliquefaciens, экспрессированной в B. subtilis, полученной, как описано выше, определяли в одном буфере (50 мМ Трис-HCl буфер, pH 8,4) и в присутствии основы моющего средства, полученной из Procter & Gamble. Буфер и/или основа моющего средства содержали ионы цинка, ионы кальция или их сочетание. Концентрация ионов как цинка, так и кальция менялась от 0 до 25 мМ. Эти результаты всегда сравнивали с результатами для нейтральной металлопротеиназы, инкубированной в одном буфере.
Анализы протеазы
Анализ с азоказеином:
Анализ конечных точек с азоказеином использовали для оценки степени протеолиза, происходящего в конкретных условиях. В этих анализах 75 мкл фермента инкубировали с избытком кальция или цинка, или обоих ионов, добавленных к 250 мкл 1% (мас./об.) азоказеина (Sigma). Реакцию проводили при 30°C в течение 15 минут, после чего добавляли 10% (мас./об.) трихлоруксусной кислоты для остановки реакции. Преципитированный белок и непрореагировавший азоказеин удаляли центрифугированием в течение 10 минут при 14000 об/мин. Окраску азогруппы проявляли добавлением 750 мкл 1 M гидроксида натрия. Развитие окраски проводили в течение 5 минут, после чего реакцию останавливали и измеряли поглощение при 440 нм.
Анализ с сукцинилированным казеином и TNBSA:
Активность нейтральной металлопротеиназы определяли с использованием набора для анализа протеазы QuantiCleave™ (Pierce). Этот анализ основан на расщеплении ферментом сукцинилированного казеина. Затем сформированные первичные аминогруппы вступали в реакцию с тринитробензолсульфоновой кислотой (TNBSA) и формировали окрашенный комплекс с максимальным поглощением при 450 нм. Анализ проводили в формате 96-луночного микропланшета. Для анализа необходима 15-минутная инкубация с сукцинилированным казеином и 15-минутная реакция с TNBSA. Во время обеих инкубаций образцы помещали во встряхиватель. TPCK-трипсин (Pierce) представляет собой общий стандарт для определений общей активности протеазы. Однако оптимальные условия для активности конкретных протеаз требуют использования интересующей протеазы. В случае анализов, проводимых в этих экспериментах, использовали как трипсин, так и интересующую протеазу для калибровки анализа. Для точности анализа необходимо, чтобы для стандартных разведений, сделанных для 0,5 мг/мл трипсина, всегда получали значения поглощения (при 450 нм) ниже 0,5.
Каждый образец измеряли относительно контроля, не содержащего казеин. Записанное изменение поглощения (ДAbs(450 нм)) приписывали влиянию аминогрупп казеина. Далее, таким же образом вводили коррекцию на любое/любые возможное влияние первичных аминогрупп в буфере и/или в других компонентах моющего средства. Активность всех образцов определяли относительно моющего средства без добавления нейтральной металлопротеиназы, также как для фермента, инкубированного в боратном буфере BupH™, поставленном с набором, в течение такого же отрезка времени и при такой же температуре.
Этот тест представляет собой анализ конечных точек, в котором использовали 50 мМ боратный буфер, pH 8,5, при 32°C. Анализ протеазы, как правило, проводили в двух параллелях. В большинстве экспериментов для определения показателей стабильности белок и моющее средство разводили с использованием вышеупомянутого буфера до 1:1000, хотя в некоторых экспериментах разведения также составляли 1:500 или 1:200, чтобы получать показания, когда поглощение для пустых контролей составляло менее чем 0,5. Спектрофотометр для микропланшетов, используемый в этих экспериментах, представлял собой SpectraMax250® (Molecular Devices), и все анализы проводили в 96-луночных планшетах со средним связыванием белка (Corning).
Результаты для стандартных образцов белка (например, трипсина и очищенной металлопротеиназы), полученные в этих анализах, показывают присутствие нелинейного ответа (линейная шкала может являться адекватной только в узком диапазоне анализа). Таким образом, кривая подходила для квадратичной функции, где f=y0+ax2+bx; f соответствует y (SigmaPlot® v. 9; SPSS, Inc.). Таким образом, если использовали линейное уравнение для определения количества белка, получали неправильные данные; обнаружили, что для получения точных результатов необходимо квадратичное уравнение. Следует отметить, что на вкладке производителя (Pierce) в набор отмечено, что к результатам можно подбирать кривую с «x», представляющим собой логарифмическую шкалу.
ПРИМЕР 6
Эффект pH и LAS на активность нейтральной металлопротеиназы
Определяли также оптимум pH для активности nprE, составленного при 0,36 мг/мл. Буферы, изучаемые в этом исследовании, представляли собой 50 мМ ацетат натрия в диапазоне pH 3,5-5,5 (pKa=4,76), 50 мМ буфер MES в диапазоне pH от 5,5 до 7,0 (pKa=6,10) и 50 мМ буфер Трис-HCl при pH 8,4. Определили, что оптимум pH для составленного nprE составляет между 5,5 и 6,0.
Эффект компонента моющего средства LAS на активность nprE, составленного при 0,36 мг/мл, исследовали посредством инкубации с 0-1% (мас./об.) LAS. Результаты показаны на графике, представленном на фиг.2. Как показывают эти результаты, компонент моющего средства значительно инактивирует протеазу, таким образом вызывая необходимость в средствах стабилизации протеазы против этого вредного воздействия.
В некоторых экспериментах использовали композицию жидкого моющего средства высокой плотности (HDL), названного «TIDE® 2005», поставляемого Procter & Gamble. При поставке это моющее средство содержало все необходимые компоненты, за исключением нейтральной металлопротеиназы согласно изобретению.
Стабильность при хранении в основе жидкого моющего средства как функция от времени
Тест на стабильность проводили способом мини-хранилищ. Условия, подлежащие изменению, и различные концентрации солей хлоридов кальция и цинка, подлежащие добавлению, оценивали с использованием матрицы, сконструированной с использованием программного обеспечения FusionPro™ (S-Matrix). В следующей таблице суммированы условия, тестированные для обеспечения стабильности при долговременном хранении нейтральной металлопротеиназы из B. amyloliquefaciens.
Условия теста долговременного хранения
Конечный объем для каждого тестируемого условия составлял 1 мл. TIDE® 2005 дозировали с 0,36 мг фермента/мл. Составленную смесь культуральной жидкости и очищенной рекомбинантной металлопротеиназы инкубировали в основе TIDE® 2005 при 32°C в течение периода приблизительно 4 недель. Стабильность при хранении металлопротеиназы в моющем средстве сравнивали со стабильностью нейтральной металлопротеиназы в 50 мМ буфере MES, pH 5,8.
Перед тестированием образцы разводили 5 к 1000 с использованием буфера для анализа (50 мМ боратный буфер, pH 8,5). Определяли остаточную активность и сравнивали с активностью нейтральной металлопротеиназы в буфере для анализа. Все измерения проводили в двух параллелях. Каждый образец тестировали параллельно с соответствующими пустыми контролями (т.е. моющим средством, буфером и любыми необходимыми добавками, подлежащими тестированию). Затем образцы анализировали, как описано в инструкциях, предоставленных с набором для анализа протеазы QuantiCleave™ (Pierce).
Результаты этих тестов стабильности, проведенных в течение периода 3-4 недель, показаны на фиг.22. В TIDE® 2005 нейтральная металлопротеиназа в отсутствие ионов (т.е. без добавления соли) быстро теряла всю ее протеолитическую/гидролитическую активность против казеина. Действительно, определили, что менее 20% активности остается менее чем через 1 час инкубации. В отличие от этого, инкубацией nprE в TIDE® 2005, содержащем ионы цинка (вплоть до 15 мМ, включительно), стабилизировали протеазу и предотвращали протеолиз в течение периода 7 суток. Таким образом, присутствие ионов цинка в этом составе хорошо функционировало для поддержания по меньшей мере 60% активности протеазы. Подобным образом, концентрация ионов цинка 7,5 мМ приводит к подобному стабилизирующему эффекту. Эта концентрация ионов цинка является чрезвычайно низкой, и предусматривают, что она будет находить применение во множестве составов моющих средств. В этих экспериментах включение ионов кальция не обеспечивало дополнительного эффекта. Более того, добавление ионов кальция в избытке до 15 мМ и вплоть до 25 мМ включительно индуцировало преципитацию при добавлении к основе TIDE® 2005. Хотя не подразумевают, что настоящее изобретение является ограниченным каким-либо конкретным механизмом, предположили, что отсутствие эффекта добавленных ионов кальция на стабилизацию протеазы в этих экспериментах являлось результатом состава моющего средства.
В случае термолизина, обладающего 55% идентичностью аминокислотной последовательности с нейтральной металлопротеиназой из B. amyloliquefaciens (выравнивание последовательности проводили с использованием CLUSTAL W, v. 1.82), явно показали, что ионы цинка являются необходимыми для активности, тогда как показано, что ионы кальция и конструирование участков связывания кальция играют роль для стабилизации (см., например, Mansfield., et al., J. Biol. Chem., 272:11152-11156 [1997]; и Van den Berg et al., Biotechnol. Appl. Biochem., 30:35-40 [1999]).
В альтернативных вариантах осуществления другие катионы (например, Co2+, Mn2+ и Fe2+) находят применение согласно изобретению для стабилизации нейтральной металлопротеиназы из B. amyloliquefaciens. Это противоречит предшествующим данным, показывающим, что ни один из этих ионов не приводит к 100% восстановлению специфической активности (Holmquist. and Vallee, J. Biol. Chem., 249:4601-4607 [1974]). Предполагают, что эти ионы будут влиять на стабильность посредством предотвращения разворачивания и последующей протеолитической деградации металлопротеиназы. Однако не подразумевают, что настоящее изобретение является ограниченным каким-либо конкретным механизмом действия.
ПРИМЕР 7
Получение протеазы NprE в B. subtilis с использованием экспрессирующего nprE вектора pUBnprE
В этом примере проводили эксперименты для получения протеазы NprE в B. subtilis, в частности, описаны способы, используемые для трансформации B. subtilis плазмидой pUBnprE. Трансформацию проводили, как известно в данной области (см., например, WO 02/14490, приведенный здесь в качестве ссылки). Последовательность ДНК (последовательность ДНК лидера nprE, про-nprE и зрелого nprE из B. amyloliquefaciens), представленная ниже, кодирует белок-предшественник NprE:


В вышеуказанной последовательности жирным показана ДНК, кодирующая зрелую протеазу NprE, обычным шрифтом показана лидерная последовательность (лидер nprE), и подчеркнутым показаны пропоследовательности (про-nprE). Аминокислотная последовательность (последовательность ДНК лидера NprE, про-NprE и зрелого NprE) (SEQ ID NO:13), представленная ниже, кодирует белок-предшественник NprE. В этой последовательности подчеркнутым показана пропоследовательность, жирным показана зрелая протеаза NprE. В SEQ ID NO:17 представлена пропоследовательность NprE отдельно от последовательности зрелого NprE, а в SEQ ID NO:18 представлена последовательность зрелого NprE. Эту последовательность использовали как основу для получения библиотек вариантов, описанных здесь.



Экспрессирующий вектор pUBnprE конструировали амплификацией гена nprE из хромосомной ДНК B. amyloliquefaciens посредством ПЦР с использованием двух специфических праймеров:
Олигонуклеотид AB1740: CTGCAGGAATTCAGATCTTAACATTTTTCCCCTATCATTTTTCCCG (SEQ ID NO:19)
Олигонуклеотид AB1741: GGATCCAAGCTTCCCGGGAAAAGACATATATGATCATGGTGAAGCC (SEQ ID NO:20)
ПЦР проводили в термоциклере с ДНК-полимеразой с высокой точностью Phusion (Finnzymes). Смесь для ПЦР содержала 10 мкл 5x буфера (Finnzymes Phusion), 1 мкл 10 мМ dNTP, 1,5 мкл DMSO, 1 мкл каждого праймера, 1 мкл ДНК-полимеразы Finnzymes Phusion, 1 мкл раствора хромосомной ДНК 50 нг/мкл, 34,5 мкл воды MilliQ. Использовали следующий протокол:
Протокол ПЦР:
1) 30 сек 98°C;
2) 10 сек 98°C;
3) 20 сек 55°C;
4) 1 мин 72°C;
5) 25 циклов стадий 2-4 и
6) 5 мин 72°C.
В результате этого получили фрагмент ДНК 1,9 т.п.н., который расщепляли с использованием ферментов рестрикции ДНК BglII и BclI. Мультикопийный вектор для Bacillus pUB110 (см., например, Gryczan, J. Bacteriol., 134:318-329 [1978]) расщепляли BamHI. Затем фрагмент ПЦР x BglII x BclI лигировали в вектор pUB110 x BamHI для получения экспрессирующего вектора pUBnprE (см. фиг.14).
Штамм B. subtilis (ДaprE, ДnprE, oppA, ДspoIIE, degUHy32, ΔamyE::(xylR,pxylA-comK) трансформировали pUBnprE. Трансформацию B. subtilis проводили, как описано в WO 02/14490, приведенном здесь в качестве ссылки. Селективный рост трансформантов B. subtilis, несущих вектор pUBnprE, проводили во встряхиваемых колбах, содержащих 25 мл среды MBD (среда определенного состава на основе MOPS) с 20 мг/л неомицина. Среду MBD в основном получали, как известно в данной области (см. Neidhardt et al., J. Bacteriol., 119:736-747 [1974]), за исключением того, что NH4Cl2, FeSO4 и CaCl2 исключали из основной среды, использовали 3 мМ K2HPO4, и основную среду дополняли 60 мМ мочевиной, 75 г/л глюкозы и 1% soytone. Составляли также смесь микроэлементов в форме 100X исходного раствора, содержащего в одном литре 400 мг FeSO4.7H20, 100 мг MnSO4.H2O, 100 мг ZnSO4.7H2O, 50 мг CuCl2.2H2O, 100 мг CoCl2.6H2O, 100 мг NaMoO4.2H2O, 100 мг Na2B4O7.10H2O, 10 мл 1M CaCl2 и 10 мл 0,5 M цитрата натрия. Культуру инкубировали в течение трех суток при 37°C в инкубаторе/встряхивателе (Infors). В этой культуре в результате получили продукцию секретированной протеазы NprE с протеолитической активностью, как показано по анализам протеазы. Анализ в геле проводили с использованием 10% бис-Трис гелей NuPage Novex (Invitrogen, Cat.No. NP0301BOX). Для подготовки образцов для анализа 2 объема супернатанта смешивали с 1 объемом 1М HCl, 1 объемом 4x буфера для образцов LDS (Invitrogen, Cat. № NP0007) и 1% PMSF (20 мг/мл) и затем нагревали в течение 10 минут при 70°C. Затем 25 мкл каждого образца наносили на гель, вместе с 10 мкл предварительно окрашенных белковых стандартов SeeBlue plus 2 (Invitrogen, Cat.No.LC5925). Результаты ясно показывают, что способом клонирования nprE, описанным в этом примере, получили в результате активную NprE, продуцируемую B. subtilis.
ПРИМЕР 8
Получение библиотек для анализа сайтов (SEL) nprE
В этом примере описаны способы, используемые для конструирования SEL nprE. Вектор pUBnprE, содержащий описанную выше экспрессирующую кассету nprE, служил ДНК-матрицей. Этот вектор содержит уникальный участок рестрикции BglII, который использовали для конструирования библиотеки для анализа сайтов.
Экспрессирующий вектор pUBnprE, праймеры, синтезированные в Invitrogen (обессоленные, порядка 50 нмоль), использовали для получения библиотек. Последовательности праймеров представлены в таблице 8-1.
Для конструирования библиотеки для анализа сайтов nprE проводили три реакции ПЦР, включая две ПЦР с мутагенезом для введения интересующего мутантного кодона в последовательность ДНК и третью ПЦР, использованную для слияния продуктов двух ПЦР с мутагенезом для конструирования экспрессирующего вектора pUBnprE, включающего желательный мутантный кодон в зрелой последовательности nprE.
Способ мутагенеза основан на подходе кодон-специфических мутаций, в котором проводят получение всех возможных мутаций одновременно в специфическом триплете ДНК с использованием прямого и обратного олигонуклеотидных праймеров длиной 25-45 нуклеотидов, содержащих специфическую сконструированную последовательность триплета ДНК NNS ((A,C,T или G), (A,C,T или G), (C или G)), соответствующую последовательности кодона, подлежащего мутагенезу, и обеспечивающих случайное включение нуклеотидов в этот специфический кодон зрелого nprE. Номер, указанный в названиях праймеров (см. таблицу 8-1), соответствует положению специфического кодона в зрелом nprE.
Два дополнительных праймера, используемых для конструирования библиотеки для анализа сайтов, содержали участок рестрикции BglII вместе с частью последовательности ДНК pUBnprE, фланкирующей участок рестрикции BglII. Эти праймеры получены в Invitrogen (порядка 50 нмоль, обессоленные) и перечислены в таблице 8-1.
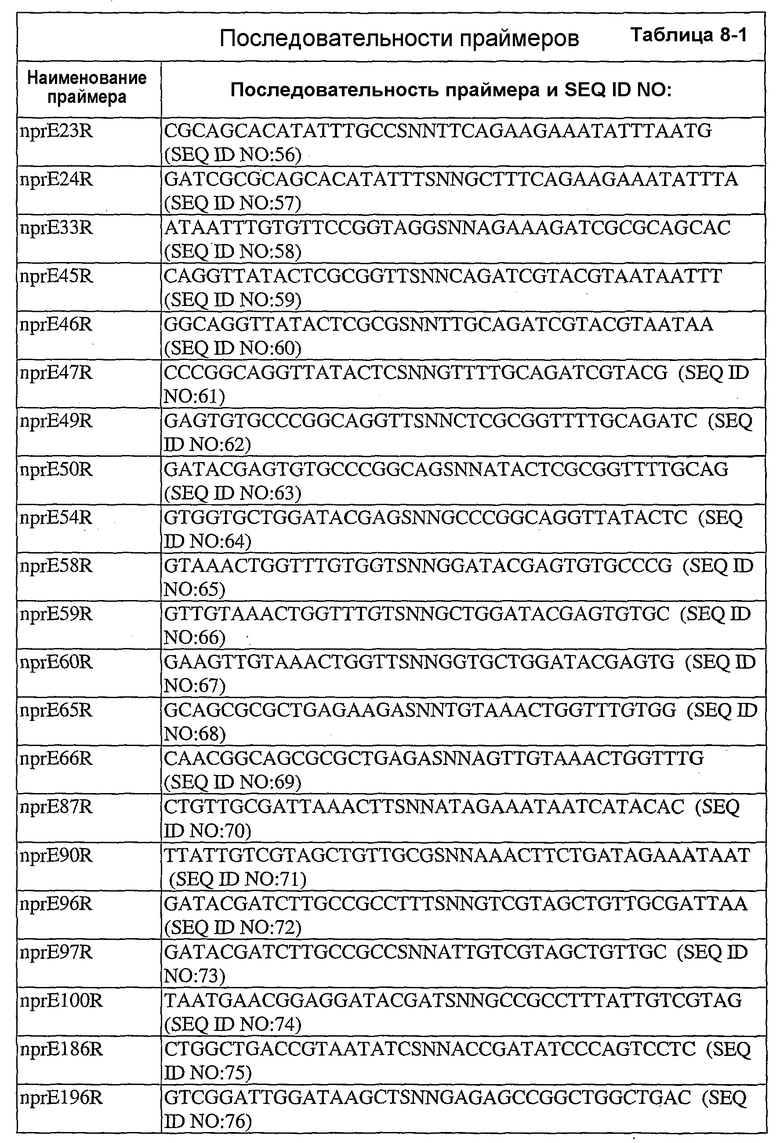

Конструирование каждой библиотеки для анализа сайтов начинали с двух первичных амплификаций ПЦР с использованием праймера pUB-BglII-FW и специфического обратного праймера для мутагенеза nprE. Для второй ПЦР использовали праймер pUB-BglII-RV и специфический прямой праймер для мутагенеза nprE (для прямого и обратного праймеров для мутагенеза использовали одинаковые положения кодонов зрелого nprE).
Введение мутаций в последовательность зрелого nprE проводили с использованием ДНК-полимеразы с высокой точностью Phusion (Finnzymes; кат. № F-530L). Все ПЦР проводили согласно протоколу Finnzymes, поставляемому с полимеразой. Условия ПЦР для первичных ПЦР представляли собой:
Для первичной ПЦР 1: праймер pUB-BglII-FW и специфический обратный праймер для мутагенеза NPRE - 1 мкл обоих (10 мкМ).
Для первичной ПЦР 2: праймер pUB-BglII-RV и специфический прямой праймер для мутагенеза NPRE - 1 мкл обоих (10 мкМ); вместе с
Программа ПЦР представляла собой: 30 секунд 98°C, 30x (10 секунд 98°C, 20 секунд 55°C, 1,5 минуты 72°C) и 5 мин 72°C, выполнена в термоциклере PTC-200 Peltier (MJ Research). В результате экспериментов ПЦР получили два фрагмента приблизительно 2-3 т.п.н., обладающие перекрыванием приблизительно 30 нуклеотидных оснований около интересующего кодона зрелого NPRE. Фрагменты сливали в третьей реакции ПЦР с использованием этих двух вышеупомянутых фрагментов, а также прямого и обратного праймеров BglII. Реакцию ПЦР для слияния проводили в следующем растворе:
праймер pUB-BglII-FW и праймер pUB-BglII-RV - 1 мкл обоих (10 мкМ)
Программа ПЦР для слияния являлась следующей: 30 секунд 98°C, 30x (10 секунд 98°C, 20 секунд 55°C, 2:40 минут 72°C) и 5 мин 72°C, в термоциклере PTC-200 Peltier (MJ Research).
Амплифицированный линейный фрагмент 6,5 т.п.н. очищали с использованием набора для очистки ПЦР Qiaquick (Qiagen, кат. № 28106) и расщепляли ферментом рестрикции BglII для получения липких концов на обеих сторонах слитого фрагмента:
- 35 мкл очищенного линейного фрагмента ДНК
- 4 мкл буфера REACT® 3 (Invitrogen)
- 1 мкл BglII, 10 единиц/мл (Invitrogen)
Условия реакции: 1 час, 30°C.
Лигированием расщепленного BglII и очищенного с использованием набора для очистки ПЦР Qiaquick (Qiagen, кат. № 28106) фрагмента получили кольцевую и мультимерную ДНК, содержащую желаемую мутацию:
- 30 мкл очищенного расщепленного BglII фрагмента ДНК
- 8 мкл буфера для ДНК-лигазы T4 (Invitrogen® кат. № 46300-018)
- 1 мкл ДНК-лигазы T4, 1 единица/мкл (Invitrogen® кат. № 15224-017)
Условия реакции: 16-20 часов, 16°C
Затем лигированной смесью трансформировали штамм B. subtilis (ДaprE, ДnprE, oppA, ДspoIIE, degUHy32, ДamyE::(xylR,pxylA-comK). Трансформацию B. subtilis проводили, как описано в WO 02/14490, приведенном здесь в качестве ссылки. Для каждой библиотеки отбирали 96 отдельных колоний и выращивали в среде MOPS с неомицином и 1,25 г/л дрожжевого экстракта для анализа последовательности (BaseClear) и целей скрининга. Каждая библиотека содержала максимум 19 сайт-специфических вариантов nprE.
Варианты продуцировали выращиванием трансформантов SEL B. subtilis в 96-луночном MTP при 37°C в течение 68 часов в среде MBD с 20 мг/л неомицина и 1,25 г/л дрожжевого экстракта (см. выше).
ПРИМЕР 9
Получение комбинаторных библиотек (RCL) nprE
В этом примере описаны способы, используемые для получения комбинаторных библиотек nprE. Для этого фермента выбирали один признак в качестве признака, нуждающегося в наибольшем изменении. Этот признак определяют здесь как «первичный признак». Все остальные признаки являлись «вторичными признаками» для цели дизайна комбинаторной библиотеки. Основным способом улучшения белка здесь являлось сочетание мутаций, улучшающих первичный признак, а также поддерживающих или улучшающих вторичные признаки. Данные анализа сайтов использовали для идентификации тех мутаций, которые улучшают первичный признак при поддержании или улучшении вторичных признаков. Мутации, подлежащие сочетанию, идентифицировали по их показателю производительности (PI или Pi) и связанным значениям ДДGapp.
«Кажущееся изменение свободной энергии» (ДДGapp) здесь определяют как:
ДДGapp = -RT Ln (Рварианта/Pисходного),
где Рварианта представляет собой показатель производительности для варианта, а Рисходного представляет собой показатель производительности для исходного фермента в тех же самых условиях. Соотношение Рварианта/Рисходного определяют как показатель производительности (Pi) для признака. Ожидают, что значения ДДGapp будут вести себя таким же образом, как действительные значения ДДG для распределения и аддитивности данных. Однако поскольку ДДG представляет собой максимальное количество работы, которое может производить вариант по сравнению с исходным ферментом, количество ДДGapp, как правило, занижает ДДG и может приводить к результатам, кажущимся синергическими, в том отношении, что признаки двух аддитивных положений могут превышать значение, предсказанное по сложению их значений ДДGapp.
Например, когда устойчивость к TIDE® является первичным признаком, а активность для BMI является вторичным признаком, можно выбирать для сочетания мутации, обладающие значениями ДДGapp <0(Pi>1) и значениями ДДGapp для BMI <0,06(Pi>0,9). Действительно, эти взаимосвязи исследовали в этих экспериментах.
Для получения вариантов, используемых в этих экспериментах, библиотеку синтетических фрагментов nprE, содержащих множественные мутации во множественных положениях ДНК зрелого nprE, получали посредством GeneArt (Geneart). Эти фрагменты nprE 1,5 т.п.н. из библиотеки расщепляли ферментами рестрикции ДНК PvuI и AvaI, очищали и лигировали во фрагмент вектора pUB 5 т.п.н. (также расщепленный ферментами рестрикции ДНК PvuI и AvaI) посредством реакции лигирования с использованием ДНК-лигазы T4 (Invitrogen® кат. № 15224-017).
Для трансформации клеток Bacillus непосредственно реакционной смесью после лигирования библиотеку ДНК (смесь фрагментов nprE из библиотеки, лигированную с фрагментом вектора pUB) амплифицировали с использованием набора TempliPhi (Amersham кат. #25-6400). Для этой цели 1мкл реакционной смеси после лигирования смешивали с 5 мкл буфера для образцов из набора TempliPhi и нагревали в течение 3 минут при 95°C для денатурации ДНК. Реакционную смесь помещали в лед для охлаждения в течение 2 минут и затем быстро осаждали центрифугированием. Затем добавляли 5 мкл реакционного буфера и 0,2 мкл полимеразы phi29 из набора TempliPhi, и реакционные смеси инкубировали при 30°C в приборе для ПЦР MJ Research в течение 4 часов. Затем фермент phi29 в реакционных смесях инактивировали посредством инкубации при 65°C в течение 10 мин в приборе для ПЦР.
Для трансформации Bacillus библиотеками 0,1 мкл продукта реакции амплификации TempliPhi смешивали с 500 мкл компетентных клеток B. subtilis (ДaprE, ДnprE, oppA, ДspoIIE, degUHy32, ДamyE::(xylR,pxylA-comK) с последующим энергичным встряхиванием при 37°C в течение 1 часа. Затем по 100 и 500 мкл рассевали на чашки с HI-агаром, содержащим 20 мг/л неомицина и 0,5% обезжиренного молока. Как правило, трансформацию B. subtilis проводили, как описано в WO 02/14490, приведенном здесь в качестве ссылки. Предусматривают, что комбинаторные библиотеки nprE в B. subtilis, сконструированные этим способом, содержат аминокислоты дикого типа в одном или нескольких положениях, намеченных для мутагенеза.
Затем варианты, полученные в этих библиотеках, тестировали по их стабильности в TIDE® и их производительности в тестах моющей производительности для BMI, как описано в настоящем описании. В таблице 9 представлены показатели производительности для вариантов, тестированных в анализе BMI. В этой таблице «Пол.» обозначает положение в аминокислотной последовательности NprE, которое заменили, а «АК» обозначает замену аминокислоты, выполненную для каждого варианта.
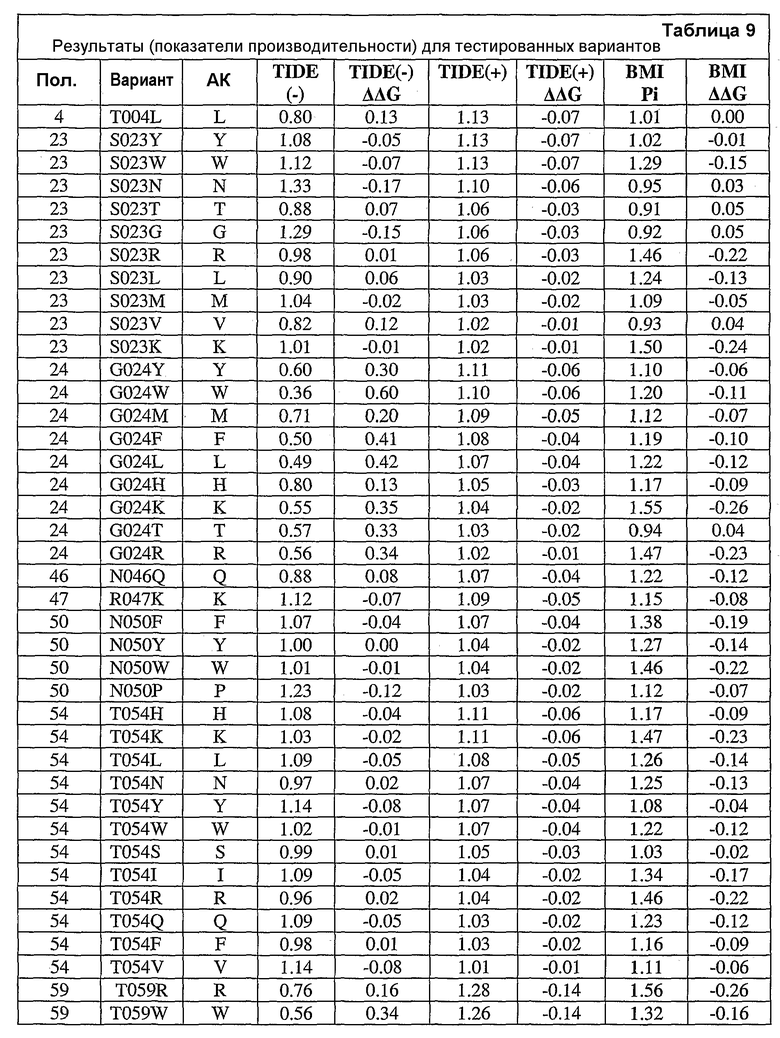
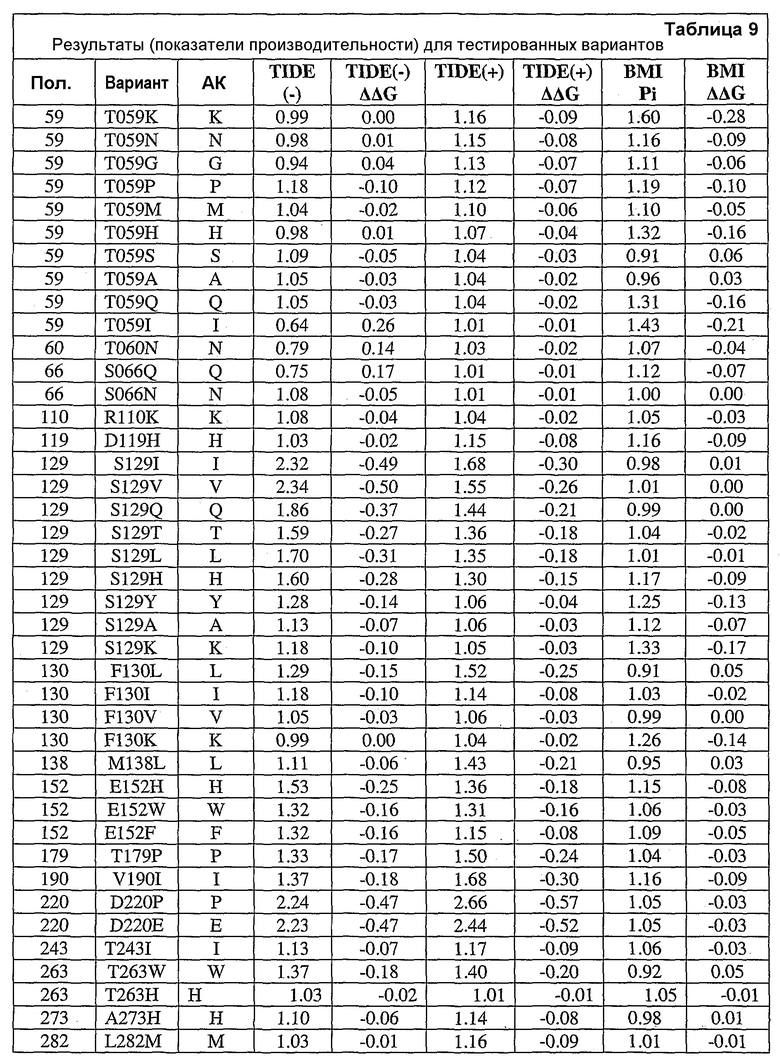
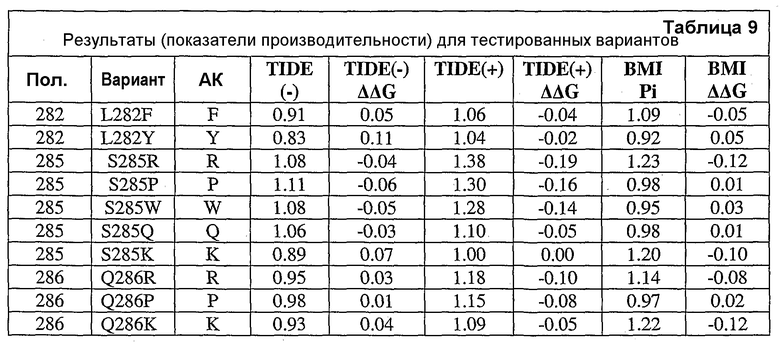
Пример 10
Альтернативный способ получения библиотек для анализа сайтов (SEL) nprE посредством мутагенеза QuikChange®
В этом примере описаны альтернативные способы для получения SEL nprE. Как в примере 8 выше, вектор pUBnprE служил источником ДНК-матрицы для получения SEL nprE. Основным различием между двумя способами является то, что для этого способа необходима амплификация целого вектора с использованием комплементарных праймеров для сайт-направленного мутагенеза.
Материалы:
штамм Bacillus, содержащий вектор pUBnprE
набор Qiagen Plasmid Midi (Qiagen кат # 12143)
лизоцим Ready-Lyse (Epicentre кат # Rl802M)
набор для метилазы dam (New England Biolabs кат # M0222L)
набор для выделения ДНК из геля Zymoclean (Zymo Research кат # D4001)
праймеры для сайт-направленного мутагенеза nprE, порядка 100 нмоль, 5'-фосфорилированные, очищенные в PAGE (Integrated DNA Technologies, Inc.)
набор для множественного сайт-направленного мутагенеза QuikChange Multi (Stratagene кат. # 200514)
термоциклер MJ Research PTC-200 Peltier (Bio-Rad Laboratories)
E-гели из 1,2% агарозы (Invitrogen кат. # G5018-01)
набор для амплификации TempliPhi (GE Healthcare кат # 25-6400-10)
компетентные клетки B. subtilis (ДaprE, ДnprE, oppA, ДspoIIE, degUHy32, ДamyE::(xylR,pxylA-comK)
Методы:
Для получения вектора pUBnprE отдельную колонию штамма Bacillus, содержащего вектор pUBnprE, использовали для инокуляции пробирки с 5 мл LB+10 ppm (м.д.) неомицина. Это представляло собой стартовую культуру, используемую в этих способах. Культуру выращивали при 37°C с покачиванием при 225 об/мин в течение 6 часов. Затем 100 мл свежей LB+10 ppm неомицина инокулировали 1 мл стартовой культуры. Эту культуру выращивали в течение ночи при 37°C с покачиванием при 225 об/мин. После этой инкубации осадок клеток собирали центрифугированием, достаточным для получения осадка клеток. Осадок клеток ресуспендировали в 10 мл буфера P1 (набор Qiagen Plasmid Midi). Затем к ресуспендированному осадку клеток добавляли 10 мкл лизоцима Ready-Lyse и инкубировали при 37°C в течение 30 мин. Затем продолжали протокол для набора Qiagen Plasmid Midi (с использованием 10 мл буфера P2 и P3 для учета увеличенного объема культуры клеток). После выделения вектора pUBnprE из Bacillus концентрацию вектора pUBnprE оценивали количественно. Затем вектор метилировали dam с использованием набора для метилазы dam (New England Biolabs), с использованием способов, указанных в протоколах для набора, для метилирования приблизительно 2 мкг вектора pUBnprE на пробирку. Набор для выделения ДНК из геля Zymoclean использовали для очистки и концентрирования dam-метилированного вектора pUBnprE. Определяли количество dam-метилированного вектора pUBnprE и затем разводили до рабочей концентрации 50 нг/мкл. Комплементарные праймеры для сайт-направленного мутагенеза (1 мкл каждого праймера при 10 мкМ) (см. таблицу 10-1) использовали для реакции ПЦР с набором для множественного сайт-направленного мутагенеза QuikChange Multi (Stratagene), следуя протоколу производителя (например, 1 мкл dam-метилированного вектора pUBnprE (50 нг/мкл), 1 мкл прямого праймера для сайт-направленного мутагенеза nprE (10 мкМ), 1 мкл прямого праймера для сайт-направленного мутагенеза nprE (10 мкМ), 2,5 мкл 10x буфера для реакции QuikChange Multi, 1 мкл смеси dNTP, 1 мкл смеси ферментов QuikChange Multi (2,5 ед./мкл) и 17,5 мкл дистиллированной, автоклавированной воды для получения 25 мкл общего объема реакционной смеси). Библиотеки для анализа сайтов nprE амплифицировали с использованием следующих условий: 95°C в течение 1 мин (только 1-й цикл), затем 95°C в течение 1 мин, 55°C в течение 1 мин, 65°C в течение 13Ѕ мин, и повторение циклов 23 раза. Продукт реакции сохраняли при 4°C в течение ночи. Затем реакционную смесь подвергали обработке расщеплением DpnI (поставлена с набором для множественного сайт-направленного мутагенеза QuikChange Multi) для расщепления исходного вектора pUBnprE с использованием протокола производителя (т.е. 1,5 мкл фермента рестрикции DpnI добавляли в каждую пробирку и инкубировали при 37°C в течение 3 часов; затем 2 мкл расщепленного DpnI продукта реакции ПЦР для каждой SEL nprE анализировали в 1,2% E-геле, чтобы убедиться, что реакция ПЦР сработала и что исходная матрица деградирована). Затем использовали амплификацию по принципу катящегося кольца с TempliPhi для получения больших количеств ДНК для увеличения размера библиотеки для каждой SEL nprE с использованием протокола производителя, т.е. 1 мкл обработанного DpnI продукта реакции ПЦР для множественного сайт-направленного мутагенеза QuikChange Multi, 5 мкл буфера для образцов TempliPhi, 5 мкл реакционного буфера TempliPhi и 0,2 мкл смеси ферментов TempliPhi для ~11 мкл общей реакционной смеси; инкубировали при 30°C в течение 3 часов; реакционную смесь с TempliPhi разводили добавлением 200 мкл дистиллированной, автоклавированной воды и быстро встряхивали. Затем компетентные клетки B. subtilis трансформировали 1,5 мкл разведенного материала после TempliPhi и проводили селекцию SEL nprE с использованием чашек с LA+10 ppm неомицина+1,6% обезжиренного молока. В таблице 10-1 представлены названия, последовательности и SEQ ID NO для праймеров, используемых в этих экспериментах. Все праймеры синтезированы в Integrated DNA Technologies, порядка 100 нмоль, 5'-фосфорилированы и очищены в PAGE.

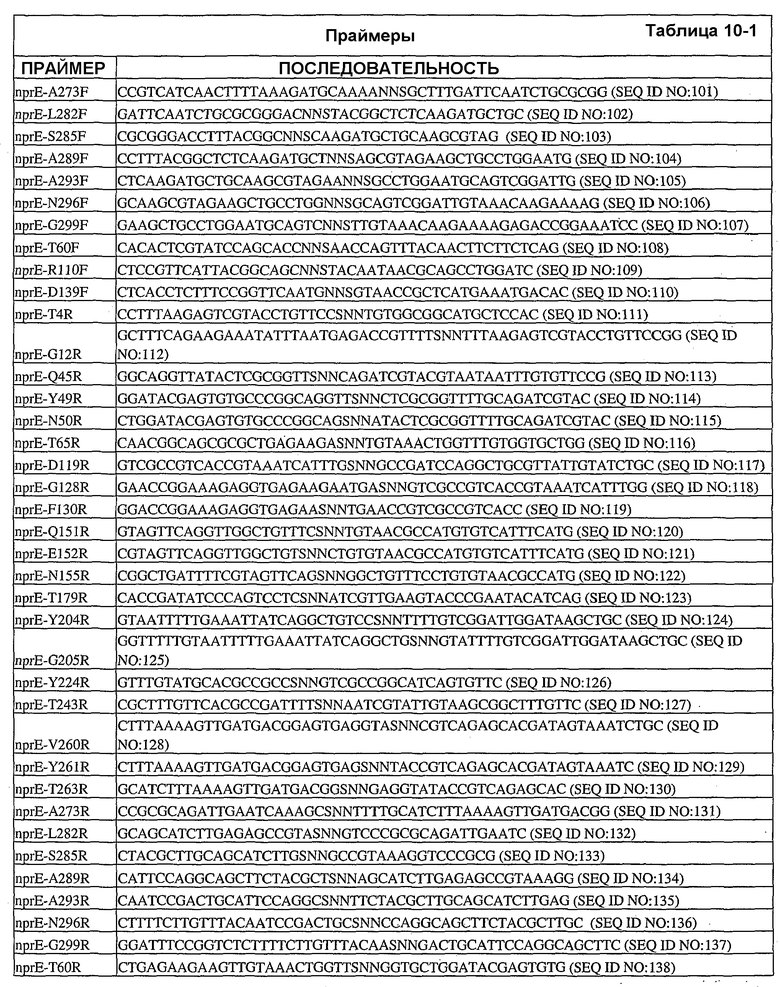
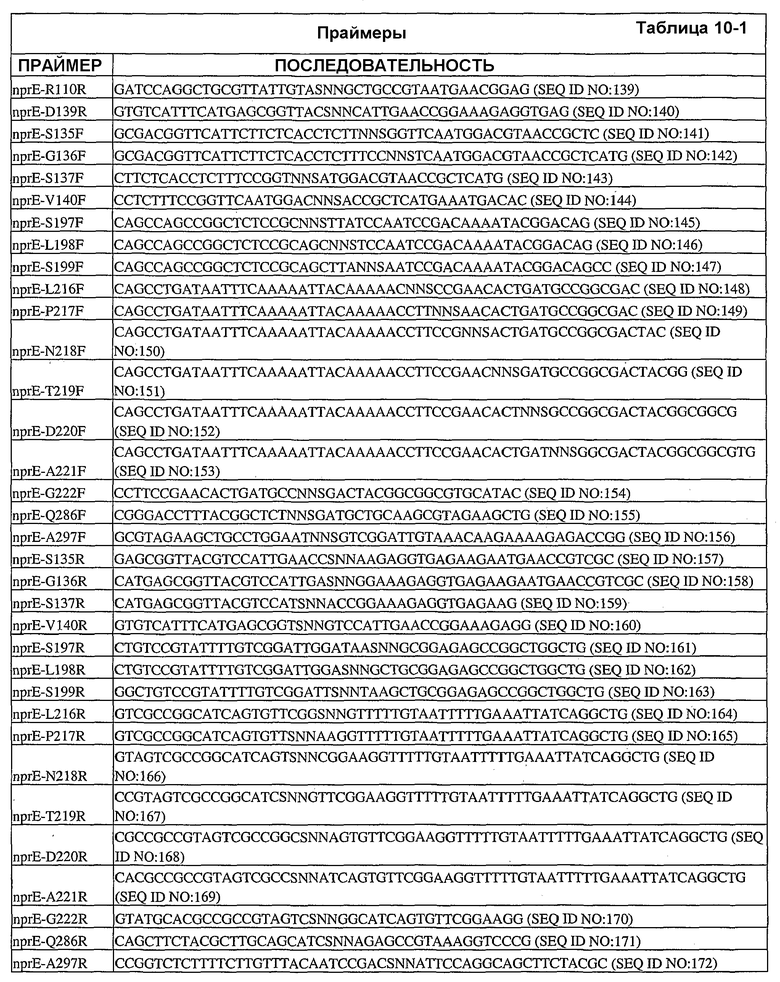
ПРИМЕР 11
Идентификация гомологов nprE
В этом примере описаны эксперименты, проводимые для идентификации гомологов npr. В частности, в этом примере проводили эксперименты для клонирования гомологов нейтральной протеазы (npr) из различных и близкородственных видов Bacillus. Выбирали различные виды, чтобы исследовать различия и свойства, по которым выделяют эти различные виды.
Различные исследованные гомологи npr включают в себя:
npr B. caldolyticus (P23384)
nprC B. cereus (P05806)
npr B. cereus E33L (AAY60523)
nprT B. stearothermophilus
nprB B. subtilis
nprE B. subtilis
nprB B. thuringiensis (AAK00602)
aur S. aureus (P81177)
На фиг.3 переставлено выравнивание последовательности этих гомологов (SEQ ID NO:173-181), а на фиг.4 (SEQ ID NO:182-191) представлено другое выравнивание последовательности различных других гомологов.
В этих экспериментах материалы включают в себя:
Хромосомную ДНК штамма 1168 B. subtilis
Следующие плазмидные ДНК синтезировали в DNA2.0 с оптимизацией кодонов для B. subtilis:
pJ4:G01905 (nprB B. thuringiensis) (см. фиг.6)
pJ4:G01906 (npr B. cereus E33L) (см. фиг.7)
pJ4:G01907 (nprC B. cereus) (см. фиг.8)
pJ4:G01908 (npr B. caldolyticus) (см. фиг.9)
pJ4:G01909 (aur S. aureus) (см. фиг.10)
pJ4:G01938 (nprT S. stearothermophilus) (см. фиг.11)
Вектор pJHT (см. фиг.12)
Вектор pAC (см. фиг.13)
Термоциклер MJ Research PTC-200 Peltier (Bio-Rad Laboratories)
Праймеры (Operon Inc)
ДНК-полимераза PfuUltra II Fusion HS (Stratagene)
Эндонуклеазы рестрикции (Roche)
Химически компетентные клетки E. coli TOP10 (Invitrogen)
Компетентные клетки B. subtilis ((ДaprE, ДnprE, oppA, ДspoIIE, degUHy32, ДamyE::(xylR,pxylA-comK)

A. Клонирование nprE B. subtilis
Для конструирования плазмиды с nprE B. subtilis отдельно получали амплифицированный фрагмент промотора aprE (из вектора pJHT) и гена nprE B. subtilis с терминаторным фрагментом (из штамма I168 B. subtilis). На фиг.15 представлена схема, иллюстрирующая амплификацию отдельных фрагментов ДНК.
Реакцию ПЦР для удлинения перекрывающегося места стыковки (SOE) использовали для соединения 2 отдельных фрагментов ДНК вместе. В этой реакции объединяли следующие реагенты: 1 мкл фрагмента ДНК промотора aprE, 1 мкл гена nprE B. subtilis+терминаторный фрагмент, 1 мкл праймера EL-689 (25 мкМ), 1 мкл праймера EL-695 (25 мкМ), 5 мкл 10x буфера для ДНК-полимеразы PfuUltra II Fusion HS, 1 мкл dNTP (10 мМ), 1 мкл ДНК-полимеразы PfuUltra II Fusion HS и 39 мкл дистиллированной, автоклавированной воды для получения общего объема реакционной смеси 50 мкл. Циклы ПЦР представляли собой: 95°C в течение 2 минут (только 1-й цикл), затем 28 циклов из 95°C в течение 30 секунд, 54°C в течение 30 секунд и 72°C в течение 0:45 секунд.
Слитый фрагмент ПЦР промотор aprE-ген nprE B. subtilis+терминатор расщепляли эндонуклеазами рестрикции MfeI и BamHI. Вектор pJHT расщепляли эндонуклеазами рестрикции EcoRI и BamHI. Затем расщепленный эндонуклеазами рестрикции фрагмент промотор aprE-ген nprE B. subtilis+терминатор лигировали с расщепленным эндонуклеазами рестрикции вектором pJHT. Затем химически компетентные клетки E. coli TOP10 трансформировали смесью после лигирования для селекции на LA+50 ppm карбенициллина. После идентификации плазмид, содержащих правильную последовательность конструкции ДНК для плазмиды pEL501 (см. фиг.16), ими трансформировали компетентные клетки B. subtilis для интеграции в локус промотора aprE. Трансформанты отбирали по активности протеазы (т.е. просветлению обезжиренного молока) на чашках с LA+5 ppm хлорамфеникола+1,6% обезжиренного молока. Затем амплифицированные штаммы переносили на чашки с LA+25 ppm хлорамфеникола+1,6% обезжиренного молока. Затем штаммы переносили на чашки с LA+25 ppm хлорамфеникола+1,6% обезжиренного молока для амплификации.
B. Клонирование nprB B. subtilis
Для конструирования плазмиды с nprB B. subtilis отдельно получали амплифицированный фрагмент промотора aprE (из вектора pJHT), фрагмент гена B. subtilis nprB (из штамма I168 B. subtilis) и фрагмент терминатора (из вектора pJHT). На фиг.17 представлена схематическая диаграмма амплификации отдельных фрагментов ДНК.
Реакцию ПЦР для удлинения перекрывающегося места стыковки (SOE) использовали для соединения трех отдельных фрагментов ДНК вместе. В этой реакции объединяли следующие реагенты: 1 мкл фрагмента ДНК промотора aprE, 1 мкл гена B. subtilis nprB+терминаторный фрагмент, 1 мкл терминаторного фрагмента ДНК, 1 мкл праймера EL-689 (25 мкМ), 1 мкл праймера EL-700 (25 мкМ), 5 мкл 10× буфера для ДНК-полимеразы PfuUltra II Fusion HS, 1 мкл dNTP (10 мМ), 1 мкл ДНК-полимеразы PfuUltra II Fusion HS и 38 мкл дистиллированной, автоклавированной воды для получения общего объема реакционной смеси 50 мкл. Циклы ПЦР представляли собой: 95°C в течение 2 минут (только 1-й цикл), затем 28 циклов из 95°C в течение 30 секунд, 54°C в течение 30 секунд и 72°C в течение 0:45 секунд.
Слитый фрагмент ПЦР промотор aprE-ген nprB B. subtilis+терминатор расщепляли эндонуклеазами рестрикции MfeI и SphI эндонуклеазы. Вектор pJHT расщепляли эндонуклеазами рестрикции EcoRI и SphI. Затем расщепленный эндонуклеазами рестрикции фрагмент промотор aprE-ген nprB B. subtilis+терминаторный фрагмент ДНК лигировали с расщепленным эндонуклеазами рестрикции вектором pJHT. Затем химически компетентные клетки E. coli TOP10 трансформировали смесью после лигирования для селекции на LA+50 ppm карбенициллина. После идентификации плазмид, содержащих правильную последовательность конструкции ДНК для плазмиды pEL508 (см. фиг.18), ими трансформировали компетентные клетки B. subtilis для интеграции в локус промотора aprE. Трансформанты отбирали по активности протеазы (т.е. просветлению обезжиренного молока) на чашках с LA+5 ppm хлорамфеникола+1,6% обезжиренного молока. Затем амплифицированные штаммы переносили на чашки с LA+25 ppm хлорамфеникола+1,6% обезжиренного молока. Затем штаммы переносили на чашки с LA+25 ppm хлорамфеникола+1,6% обезжиренного молока для амплификации.
C. Клонирование nprT B. stearothermophilus
Для конструирования плазмиды с nprT B. stearothermophilus отдельно получали амплифицированный фрагмент промотора aprE (из вектора pJHT) и фрагмент nprT B. stearothermophilus (из плазмиды pJ4:G01938). На фиг.19 представлена схема, иллюстрирующая амплификацию отдельных фрагментов ДНК.
Реакцию ПЦР для удлинения перекрывающегося места стыковки (SOE) использовали для соединения 2 отдельных фрагментов ДНК вместе. В этой реакции объединяли следующие реагенты: 1 мкл фрагмента ДНК промотора aprE, 1 мкл фрагмента гена nprT B. stearothermophilus, 1 мкл праймера EL-755 (25 мкМ), 1 мкл праймера EL-735 (25 мкМ), 5 мкл 10× буфера для ДНК-полимеразы PfuUltra II Fusion, 1 мкл dNTP (10 мМ), 1 мкл ДНК-Полимеразы PfuUltra II Fusion HS и 39 мкл дистиллированной, автоклавированной воды для получения общего объема реакционной смеси 50 мкл. Циклы ПЦР представляли собой: 95°C в течение 2 минут (только 1-й цикл), затем 28 циклов из 95°C в течение 30 секунд, 54°C в течение 30 секунд и 72°C в течение 0:45 секунд.
Слитый фрагмент ПЦР промотор aprE-ген nprT B. stearothermophilus+терминатор расщепляли эндонуклеазами рестрикции EcoRI и HindIII. Вектор pAC расщепляли эндонуклеазами рестрикции EcoRI и HindIII. Затем расщепленный эндонуклеазами рестрикции фрагмент промотор aprE-фрагмент ДНК гена nprT B. stearothermophilus лигировали с расщепленным эндонуклеазами рестрикции вектором pAC. Затем использовали амплификацию по принципу катящегося кольца с TempliPhi для получения больших количеств лигированной молекулы ДНК: промотор aprE-nprT B. stearothermophilus-pAC, с использованием протокола производителя (т.е. 1 мкл продукта реакции лигирования промотор aprE-nprT B. stearothermophilus-pAC, 5 мкл буфера для образцов TempliPhi, 5 мкл реакционного буфера TempliPhi и 0,2 мкл смеси ферментов TempliPhi для ~11 мкл общей реакционной смеси; инкубировали при 30°C в течение 3 часов). Затем компетентные клетки B. subtilis трансформировали непосредственно продуктами реакции с TempliPhi для интеграции в промоторный локус aprE, таким образом получая штамм EL560 Bacillus, подтвержденный анализом ДНК секвенированием (см. фиг.20). Трансформанты отбирали по активности протеазы (т.е. просветлению обезжиренного молока) на чашках с LA+5 ppm хлорамфеникола+1,6% обезжиренного молока. Затем штаммы переносили на чашки с LA+25 ppm хлорамфеникола+1,6% обезжиренного молока для амплификации.
D. Клонирование npr B. caldolyticus
Для конструирования плазмиды с npr B. caldolyticus отдельно получали амплифицированный фрагмент промотора aprE (из вектора pJHT) и фрагмент npr B. caldolyticus (из плазмиды pJ4:G01908). На фиг.21 представлена схематическая диаграмма амплификации отдельных фрагментов ДНК.
Реакцию ПЦР для удлинения перекрывающегося места стыковки (SOE) использовали для соединения 2 отдельных фрагментов ДНК вместе. В этой реакции объединяли следующие реагенты: 1 мкл фрагмента ДНК промотора aprE, 1 мкл фрагмента гена npr B. caldolyticus, 1 мкл праймера EL-755 (25 мкМ), 1 мкл праймера EL-741 (25 мкМ), 5 мкл 10x буфера для ДНК-полимеразы PfuUltra II Fusion, 1 мкл dNTP (10 мМ), 1 мкл ДНК-полимеразы PfuUltra II Fusion HS и 39 мкл дистиллированной, автоклавированной воды для получения общего объема реакционной смеси 50 мкл. Циклы ПЦР представляли собой: 95°C в течение 2 минут (только 1-й цикл), затем 28 циклов из 95°C в течение 30 секунд, 54°C в течение 30 секунд и 72°C в течение 0:45 секунд.
Слитый фрагмент ПЦР промотор aprE-ген npr B. caldolyticus+терминатор расщепляли эндонуклеазами рестрикции EcoRI и HindIII. Вектор pAC расщепляли эндонуклеазами рестрикции EcoRI и HindIII. Затем расщепленный эндонуклеазами рестрикции фрагмент промотор aprE-фрагмент ДНК npr B. caldolyticus лигировали с расщепленным эндонуклеазами рестрикции вектором pAC. Затем использовали амплификацию по принципу катящегося кольца с TempliPhi для получения больших количеств лигированной молекулы ДНК: промотор aprE-npr B. caldolyticus-pAC, с использованием протокола производителя (т.е. 1 мкл продукта реакции лигирования промотор aprE-npr S. caldolyticus-pAC, 5 мкл буфера для образцов TempliPhi, 5 мкл реакционного буфера TempliPhi и 0,2 мкл смеси ферментов TempliPhi для ~11 мкл общей реакционной смеси; инкубировали при 30°C в течение 3 часов). Затем компетентные клетки B. subtilis трансформировали непосредственно продуктами реакции с TempliPhi для интеграции в промоторный локус aprE, таким образом получая штамм EL561 Bacillus (см. фиг.22), подтвержденный анализом ДНК секвенированием. Трансформанты отбирали по активности протеазы (т.е. просветлению обезжиренного молока) на чашках с LA+5 ppm хлорамфеникола+1,6% обезжиренного молока. Затем штаммы переносили на чашки с LA+25 ppm хлорамфеникола+1,6% обезжиренного молока для амплификации.
E. Клонирование nprB B. thuringiensis
Для конструирования плазмиды с nprB B. thuringiensis отдельно получали амплифицированный фрагмент промотора aprE (из вектора pJHT) и фрагмент nprB B. thuringiensis (из плазмиды pJ4:G01905). На фиг.23 представлена схематическая диаграмма амплификации отдельных фрагментов ДНК.
Реакцию ПЦР для удлинения перекрывающегося места стыковки (SOE) использовали для соединения 2 отдельных фрагментов ДНК вместе. В этой реакции объединяли следующие реагенты: 1 мкл фрагмента ДНК промотора aprE, 1 мкл фрагмента гена nprB B. thuringiensis, 1 мкл праймера EL-755 (25 мкМ), 1 мкл праймера EL-744 (25 мкМ), 5 мкл 10x буфера для ДНК-полимеразы PfuUltra II Fusion, 1 мкл dNTP (10 мМ), 1 мкл ДНК-полимеразы PfuUltra II Fusion HS и 39 мкл дистиллированной, автоклавированной воды для получения общего объема реакционной смеси 50 мкл. Циклы ПЦР представляли собой: 95°C в течение 2 минут (только 1-й цикл), затем 28 циклов из 95°C в течение 30 секунд, 54°C в течение 30 секунд и 72°C в течение 0:45 секунд.
Слитый фрагмент ПЦР промотор aprE-ген nprB B. thuringiensis+терминатор расщепляли эндонуклеазами рестрикции EcoRI и HindIII. Вектор pAC расщепляли эндонуклеазами рестрикции EcoRI и HindIII. Затем расщепленный эндонуклеазами рестрикции фрагмент промотор aprE-фрагмент ДНК nprB B. thuringiensis лигировали с расщепленным эндонуклеазами рестрикции вектором pAC. Затем смесью после лигирования трансформировали химически компетентные клетки E. coli TOP10. После идентификации плазмид, содержащих правильную последовательность конструкции ДНК для плазмиды pEL568, ими трансформировали компетентные клетки B. subtilis. Затем трансформанты отбирали по активности протеазы (т.е. просветлению обезжиренного молока) на чашках с LA+5 ppm хлорамфеникола+1,6% обезжиренного молока. Получением плазмидной ДНК показали, что плазмида pEL568 является стабильной в B. subtilis и не интегрирует в промоторный локус aprE. На фиг.24 представлена карта плазмиды pEL568.
E. Моделирование по гомологии
В дополнительных вариантах осуществления представлена модель гомологии зрелого домена NprE из Bacillus amyloliquefaciens. В этих экспериментах белковую последовательность зрелого домена последовательности NprE (SEQ ID NO:192) обрабатывали программой BlastP (NCBI). Эта программа сравнивает последовательность с другими известными последовательностями с различной идентичностью последовательности. Из выходных данных идентифицировали последовательности, для которых известны рентгеновские кристаллические структуры. Эти последовательности включали в себя Npr S. aureus (pdb id 1 BQB) Npr P. aeruginosa (pdb id 1 EZM), термолизин B. thermolyticus (pdb id 1 KEI) и Npr B. cereus (pdb id 1 NPC). На фиг.5 представлено выравнивание последовательности различных анализируемых последовательностей (SEQ ID NO:192-195).
Обнаружено, что последовательность Npr B. cereus является наиболее идентичной с NprE. Термолизин B. thermolyticus (pdb id 1 KEI) исключили из последующих стадий, так как он очень похож на Npr B. cereus. Затем получили модель гомологии, как подробно описано ниже, и все вычисления выполняли с использованием программы MOE (Chemical Computing). Сначала последовательности Npr S. aureus (pdb id 1 BQB; SEQ ID NO:193), Npr P. aeruginosa (pdb id 1 EZM)(SEQ ID NO:194) и Npr B. cereus (pdb id 1 NPC)(SEQ ID NO:195) выравнивали с использованием известной структуры, чтобы получить наиболее точное выравнивание последовательности (т.е. получили выравнивание последовательности на основе структуры). Затем зрелую последовательность NprE выравнивали с этим выравниванием последовательности на основе структуры. Затем получили начальную модель гомологии NprE с использованием структуры Npr B. cereus (pdb id 1 NPC) в качестве матрицы и с использованием выравнивания последовательности NprE с Npr B. cereus, полученного выше. Из рассмотрения этого выравнивания понятно, что в то время как Npr B. cereus содержит четыре участка связывания ионов Ca2+, NprE содержит только два участка связывания ионов Ca2+.
Наконец, после построения начальной модели гомологии путем вычислений фиксировали ионы металла (т.е. Zn2+ и два Ca2+), также как соответствующие им белковые лиганды. Остальную структуру модели минимизировали путем вычислений с использованием набора параметров CHARMM22, получив окончательную модель гомологии.
ПРИМЕР 12
Тесты моющей производительности
В этом примере проводили эксперименты для определения моющей производительности металлопротеиназы согласно изобретению. Все тесты моющей производительности проводили для американских условий стирки, как указано ниже:
% удаления загрязнения = (значение L после стирки - значение L до стирки)/(L0 белого хлопка - значение L до стирки) × 100%
Все эксперименты проводили в четырех параллелях.
Протеазы тестировали в специально разработанном тесте стирки с использованием трех различных образцов хлопка, загрязненных:
(a) кровью, молоком и чернилами (10,0×7,5 см; EMPA), обозначенный номерами 116, не фиксированный и фиксированный (загрязнения фиксировали при 20°C);
(b) средой травы (10,0×7,5 см; Equest); и
(c) пигментом, маслом и молоком (10,0×7,5 см, обозначенный номерами C-10 CFT).
Эти эксперименты более подробно описаны ниже. Тесты стирки проводили в настольной модели Terg-O-Tometer (US Testing), оборудованной шестью емкостями из нержавеющей стали. Каждая емкость из нержавеющей стали содержала 1,6 г жидкой основы моющего средства TIDE® 2005, растворенной в 1000 мл воды при 105 ppm/6 частицах на галлон, и в каждую загружали шесть одинаковых загрязненных образцов хлопка и два дополнительных образца хлопка для балласта (EMPA 221). Выбранную протеазу (например, нейтральную металлопротеиназу или другую протеазу) добавляли в каждую емкость в концентрации от 0,00 до 5,50 мг активного белка на литр мыльного раствора.
Тесты проводили в течение 12 минут при 15°C/60°F с перемешиванием при 100 об/мин. После стирки образцы прополаскивали в течение 3 минут холодной водой из-под крана и помещали в центробежную сушилку для белья. Образцы с травой высушивали на воздухе и покрывали темной тканью для ограничения чувствительности загрязнений травой к свету. Все другие образцы утюжили. Все эксперименты проводили в четырех параллелях.
Отражающую способность тестированных образцов измеряли на трехцветном измерителе Minolta CR-300 с использованием уравнения L(L*a*b). Значения моющей производительности вычисляли с использованием следующего соотношения:
% удаления загрязнения = (значение L после стирки - значение L до стирки)/(L0 белого хлопка - значение L до стирки) × 100%
Результаты анализа в Terg-OTometer (TOM) для очищенной MULTIFECT® показаны на фиг.26, и их сравнивали с результатами для субтилизина (BPN' Y217L), щелочной сериновой протеазы. TOM обеспечивает полностью готовые и обоснованные средства для разделения различной моющей производительности различных протеаз (например, сериновых протеаз, нейтральной металлопротеиназы и ее вариантов). Тесты TOM проводили для BMI и среднезагрязненной травой поверхности Equest с TIDE® 2005 в качестве основы моющего средства.
Как показано на фиг.26, очевидно, что очищенная нейтральная металлопротеиназа обладает явно лучшей производительностью в тестах стирки, чем сериновая протеаза (BPN' Y217L). В частности, необходимо 2,75 ppm (м.д.) очищенной нейтральной металлопротеиназы для получения дельта удаления загрязнений ~10% по сравнению только с 0,55 ppm сериновой протеазы (BPN' Y217L) для загрязнения травой Equest. Тестировали также моющую производительность нейтральной металлопротеиназы при низкой температуре и обнаружили очень хорошую производительность для среднезагрязненной травой ткани Equest. Сходные результаты получили для очищенной коммерчески доступной нейтральной протеиназы MULTIFECT®, также как для рекомбинантного nprE, полученного, как описано выше.
ПРИМЕР 13
Производительность вариантов nprE в BMI-TIDE® 2X
В этом примере описаны эксперименты, проводимые для оценки производительности различных вариантов nprE в анализе для BMI, описанном выше. Использовали способы, приведенные выше перед примером 1 (см. «Анализ микрообразцов для тестирования производительности протеазы»). Результаты для вариантов с множественным замещением с показателями производительности больше одного (PI>1) и результаты с показателями производительности меньше одного (PI<1) представлены в таблицах ниже.
В таблице 13.1 представлены данные, полученные для избранных вариантов с одиночным замещением в анализе производительности BMI-TIDE® 2X. В таблице представлены показатели производительности, которые рассчитывали, как описано выше для вариантов, обладающих улучшенной производительностью по сравнению с ферментом дикого типа. Те варианты, которые обладают показателем производительности более 1, обладают улучшенной производительностью.
В таблице 13.2 представлены данные, полученные для избранных вариантов с множественным замещением в анализе производительности BMI-TIDE® 2X. В таблице представлены показатели производительности, которые рассчитывали, как описано выше для вариантов, обладающих улучшенной производительностью по сравнению с ферментом дикого типа. Те варианты, которые обладают показателем производительности более 1, обладают улучшенной производительностью.
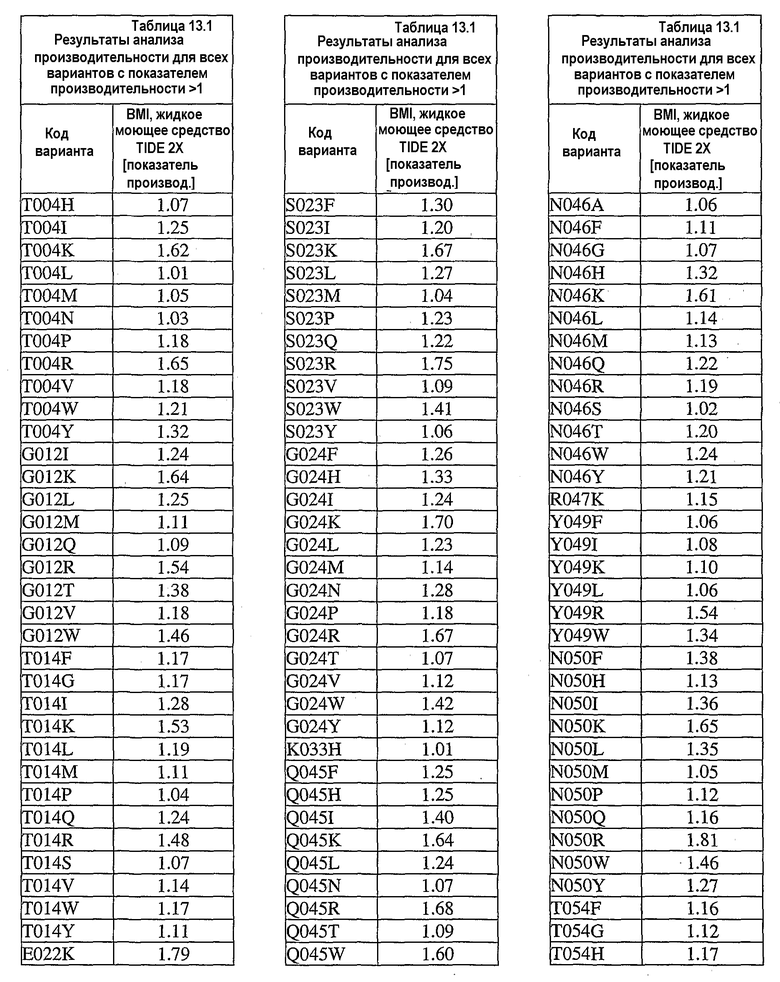
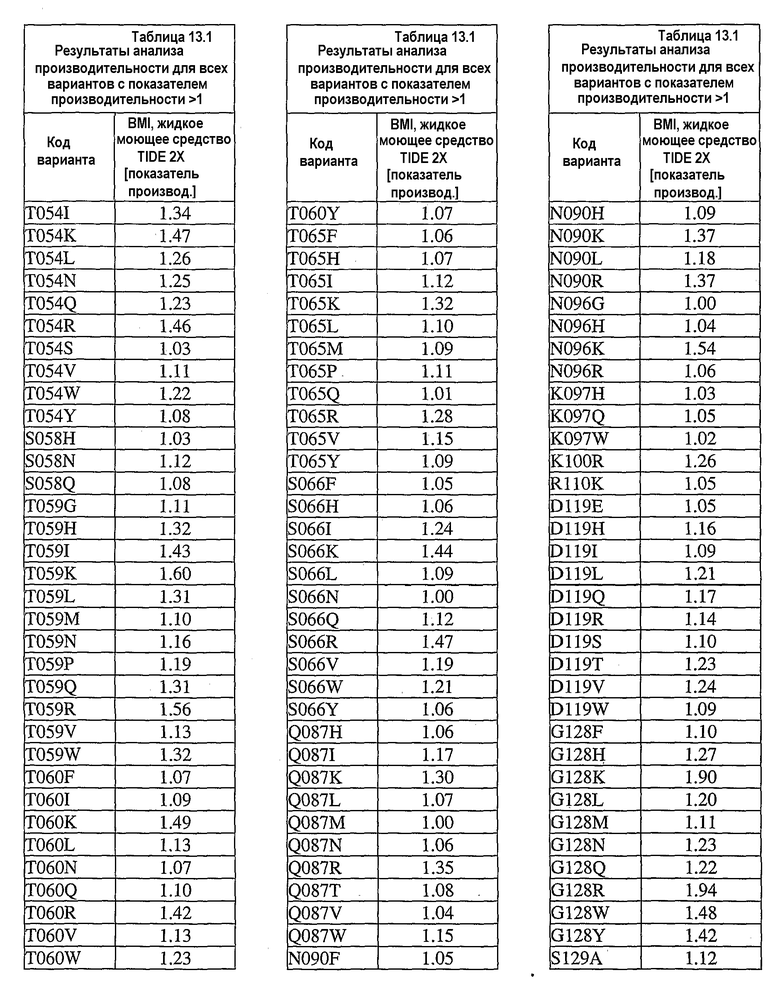
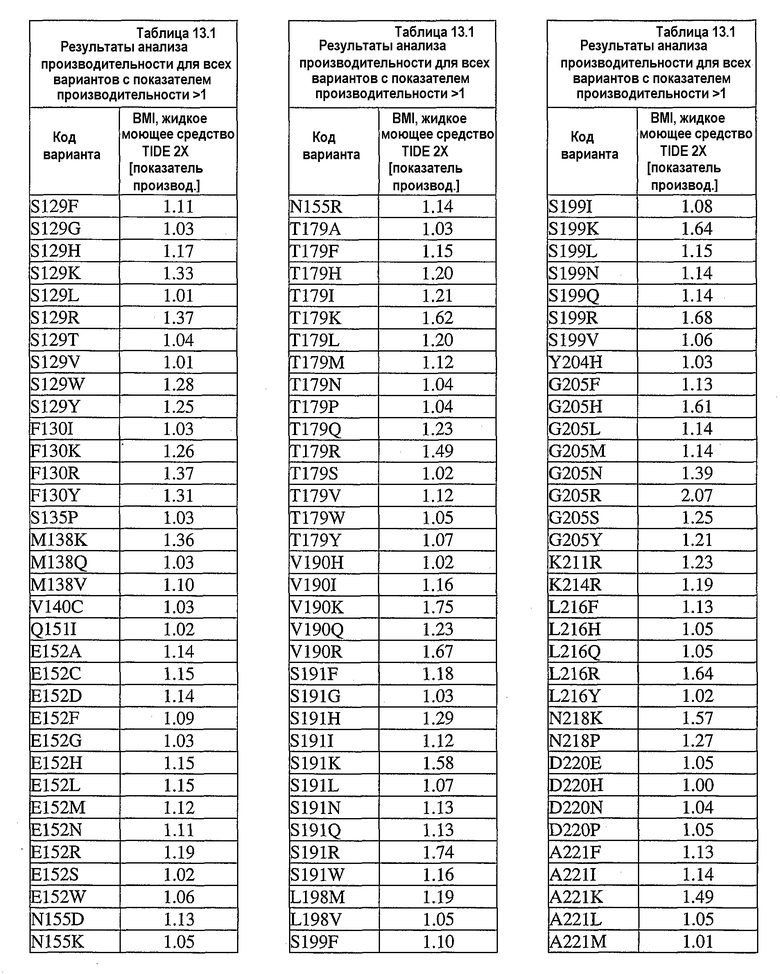
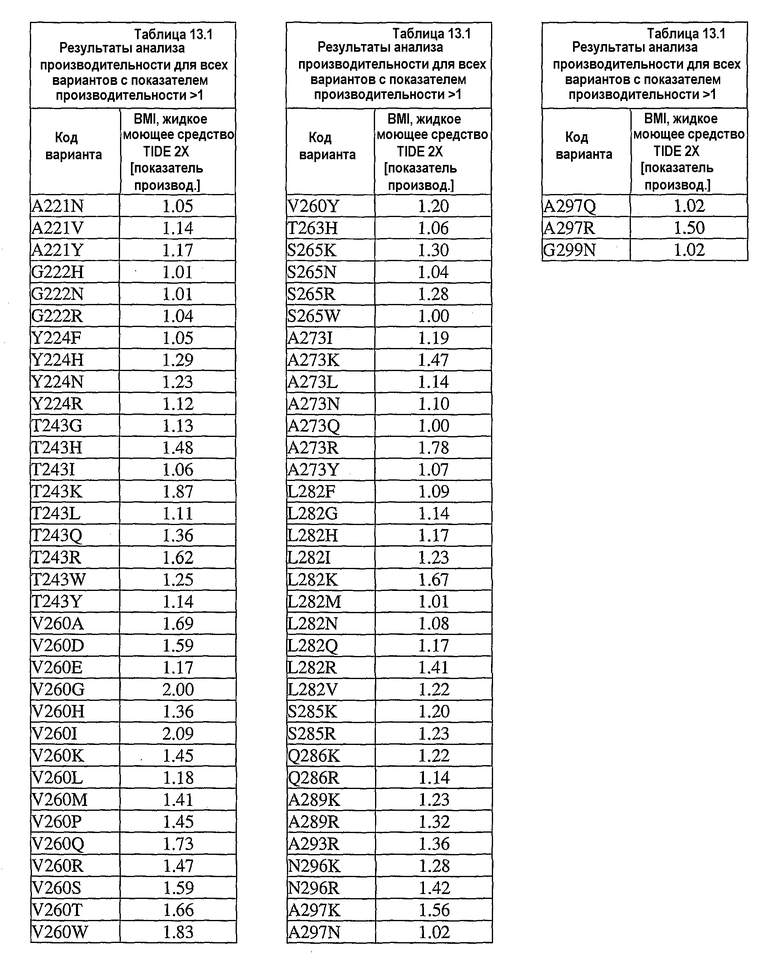
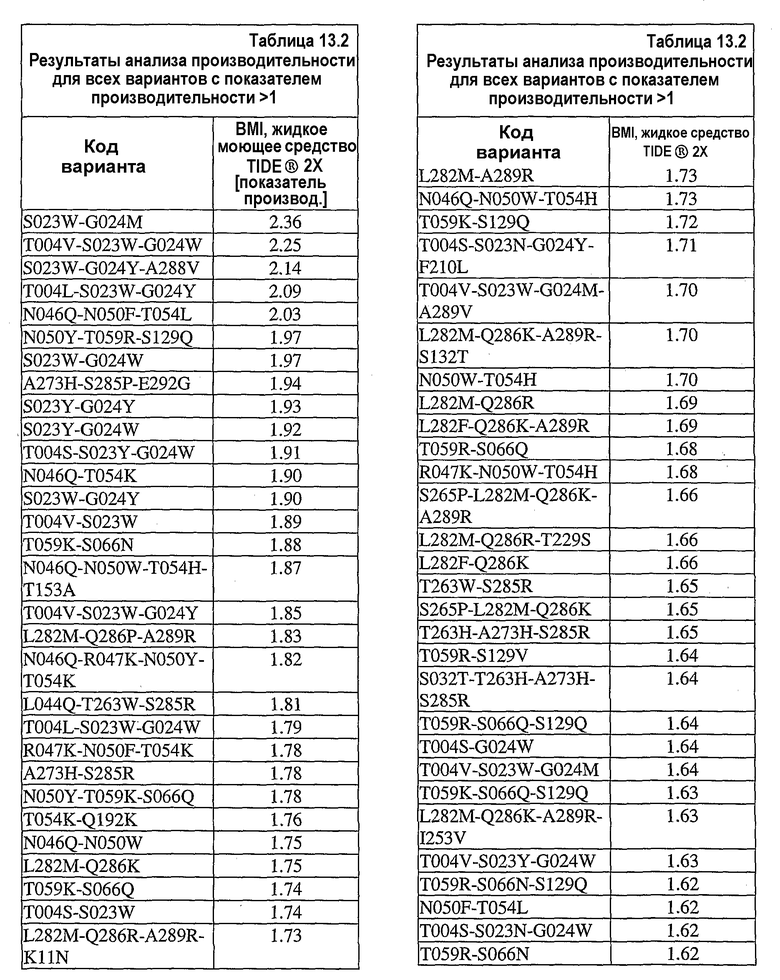
ПРИМЕР 14
Стабильность вариантов nprE
В этом примере описаны эксперименты, проводимые для определения стабильности вариантов nprE. В этих экспериментах способы, описанные перед примером 1, использовали для определения показателей производительности (см. «Анализы стабильности NprE в присутствии моющего средства» выше). В следующих таблицах представлены результаты для вариантов с показателями производительности более одного (PI>1), тестированных с и без DTPA.
Стабильность измеряли посредством определения активности для AGLA до и после инкубации при повышенной температуре. Таблица содержит значения относительной стабильности по сравнению с диким типом при данных условиях. Они представляют собой соотношение (остаточная активность варианта/ остаточная активность дикого типа). Значение больше одного указывает на более высокую стабильность в присутствии моющего средства. В таблицах 14.1 и 14.2 представлены данные, показывающие данные относительной стабильности для вариантов NprE с одиночным замещением относительно стабильности NprE дикого типа в данных условиях с и без DTPA.
В таблицах 14.3 и 14.4 представлены данные, показывающие данные относительной стабильности для вариантов NprE с множественным замещением относительно стабильности NprE дикого типа в данных условиях с и без DTPA.
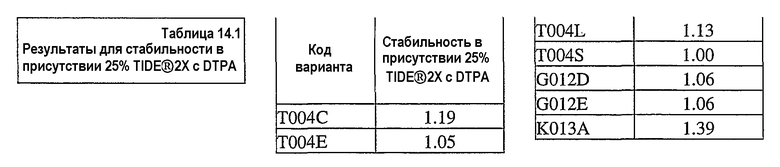
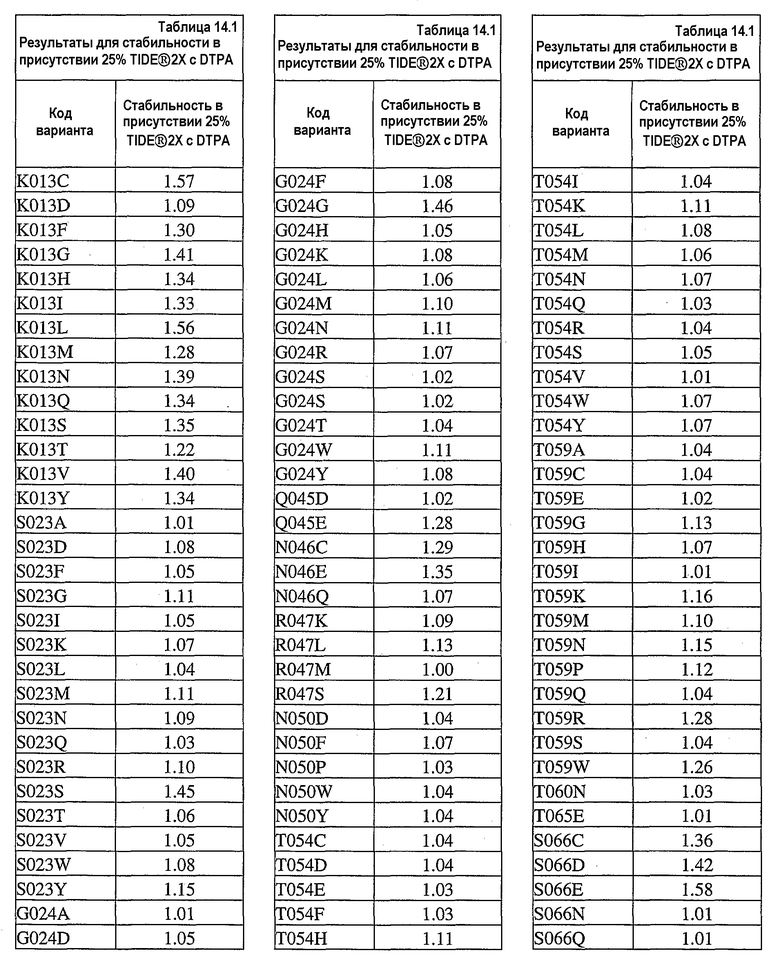
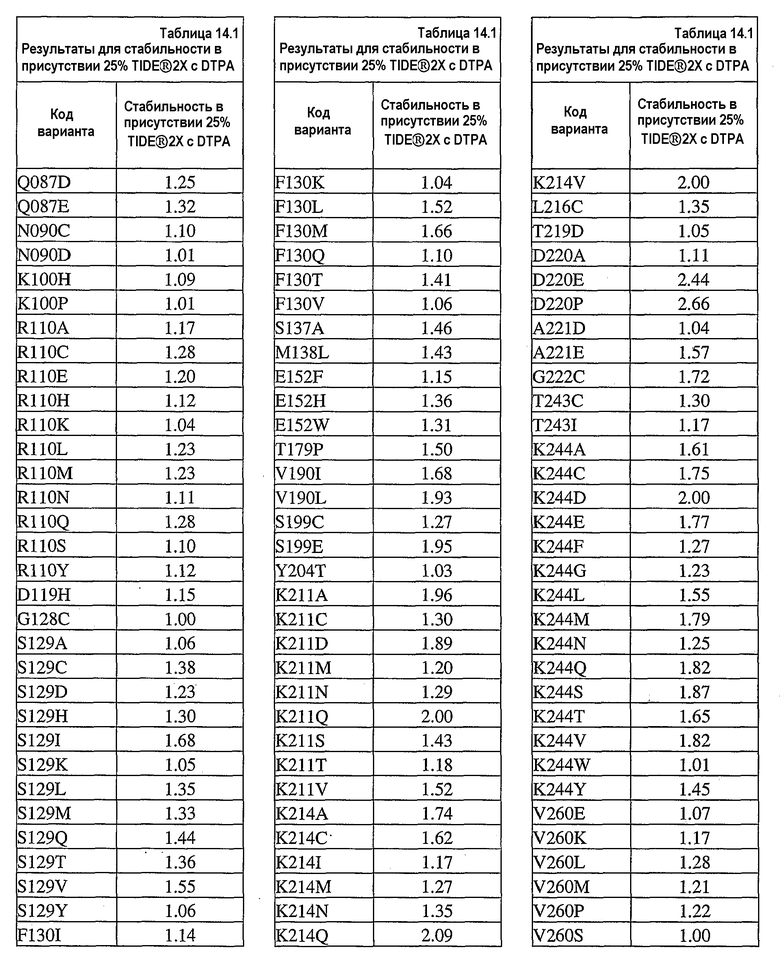
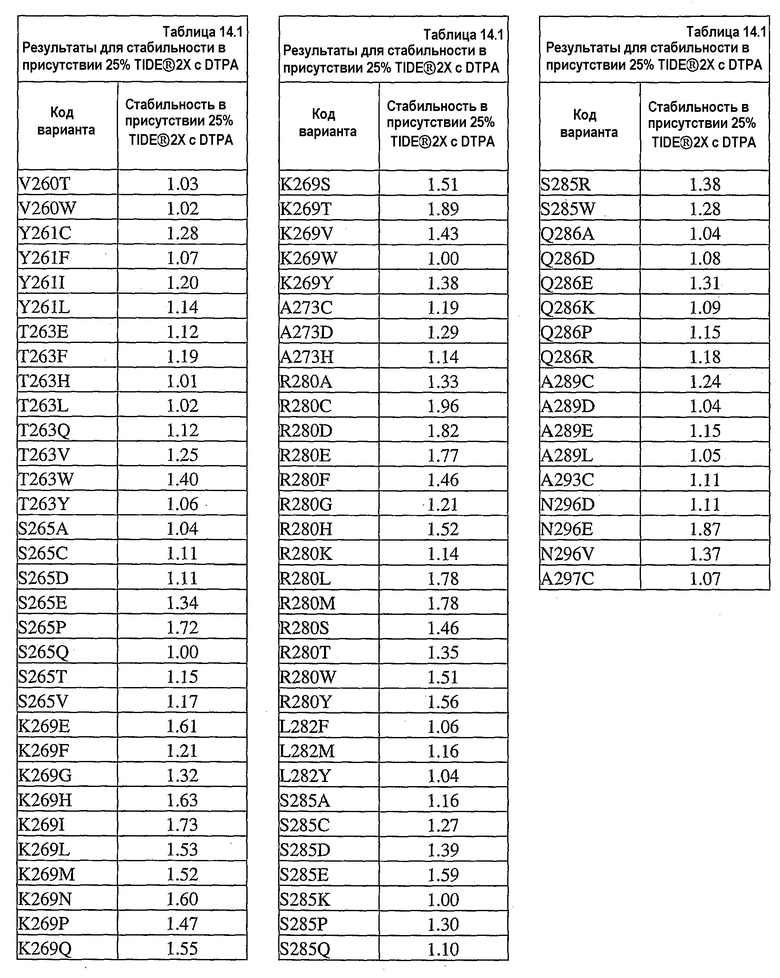
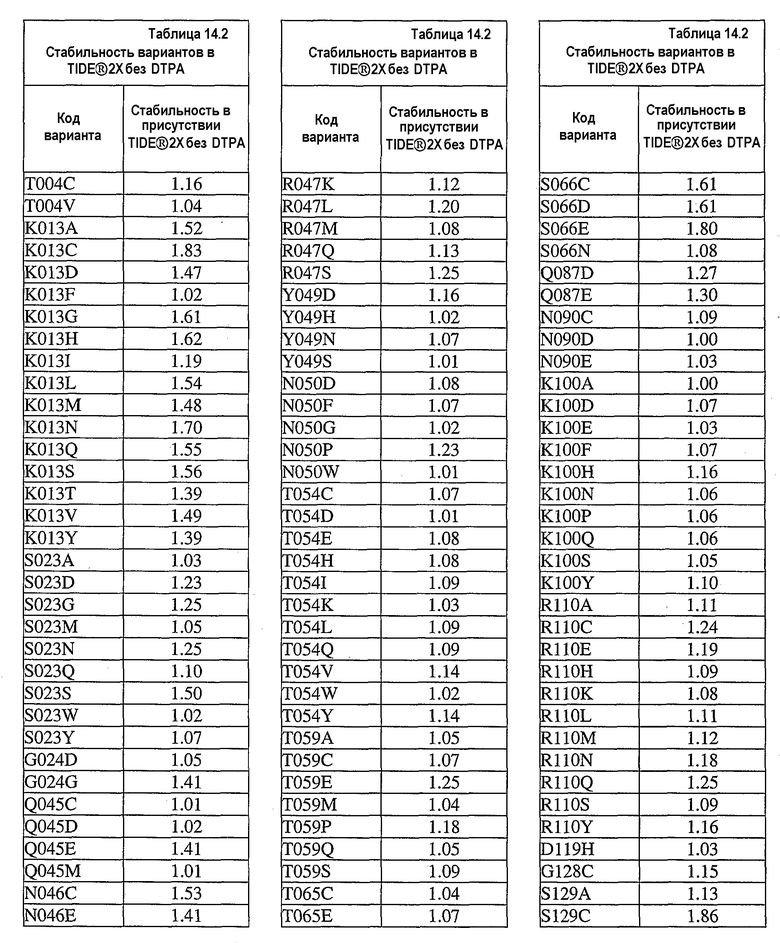
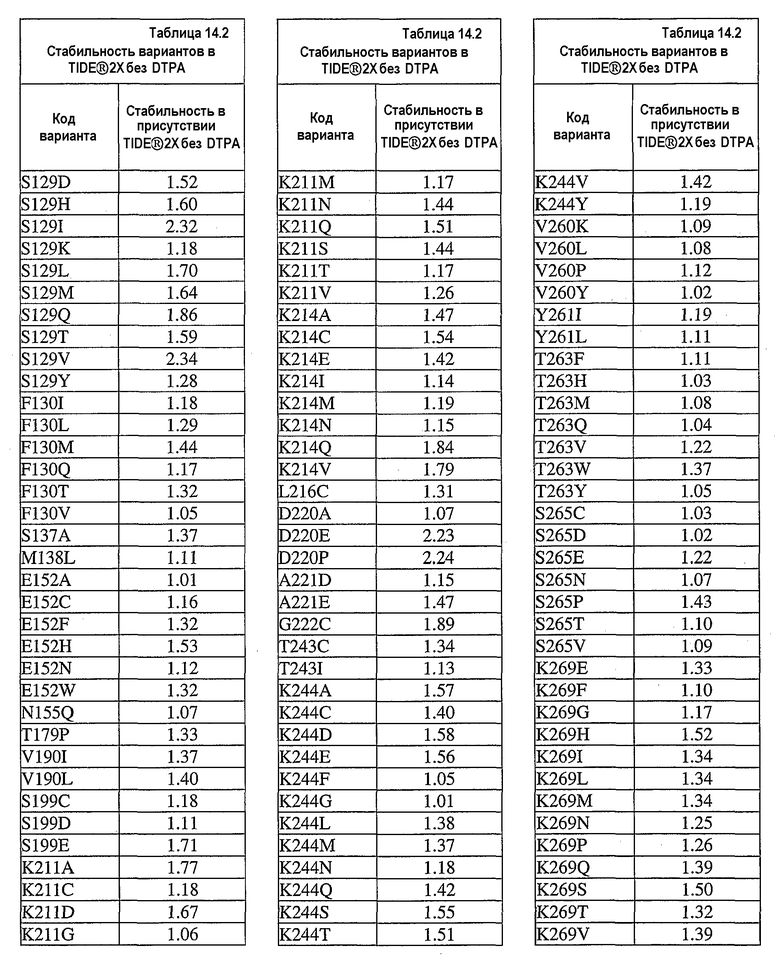
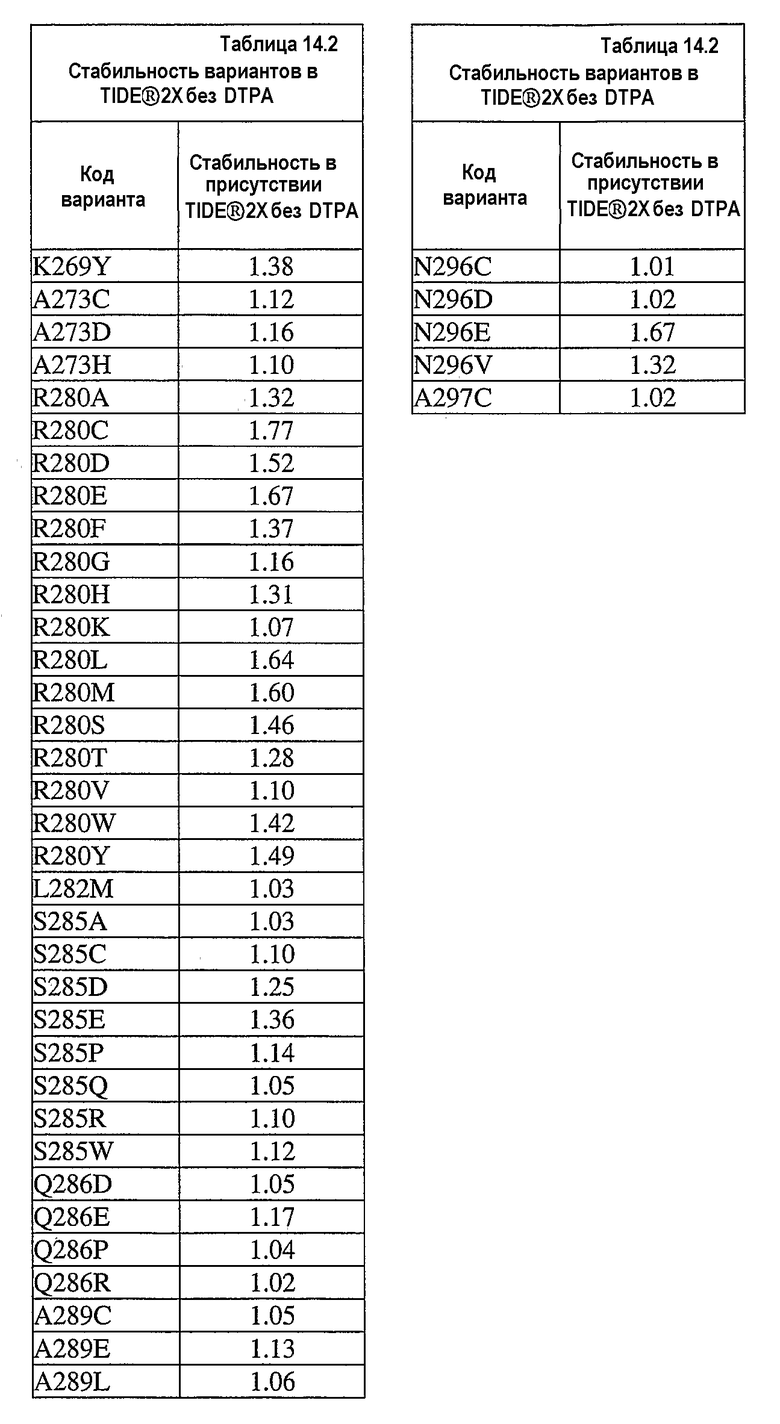
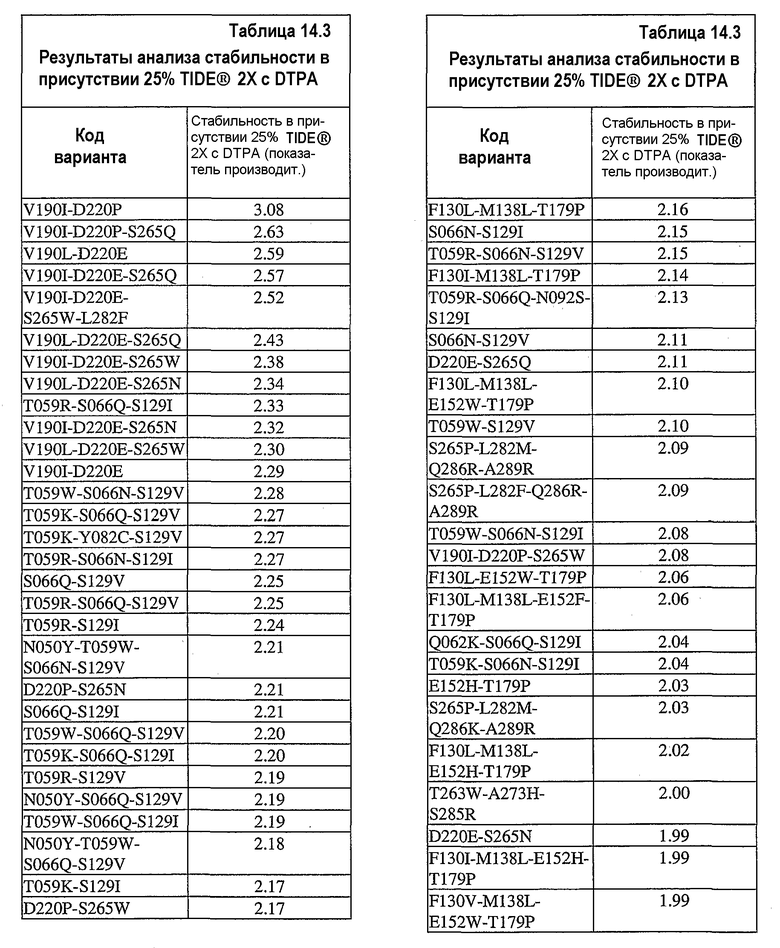
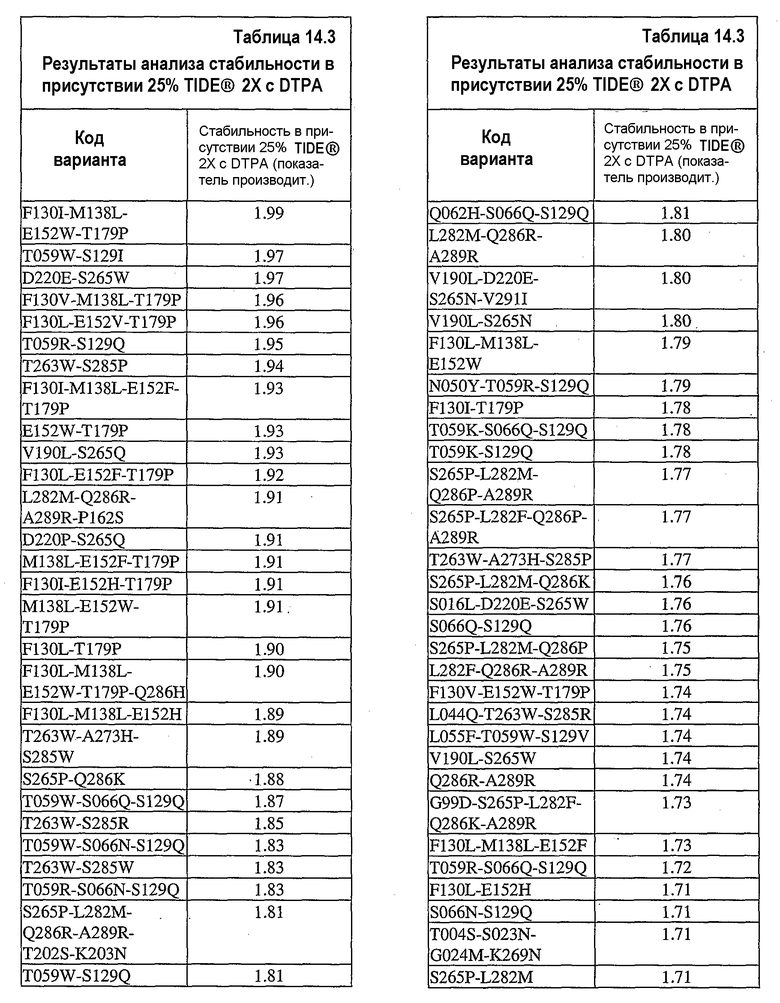
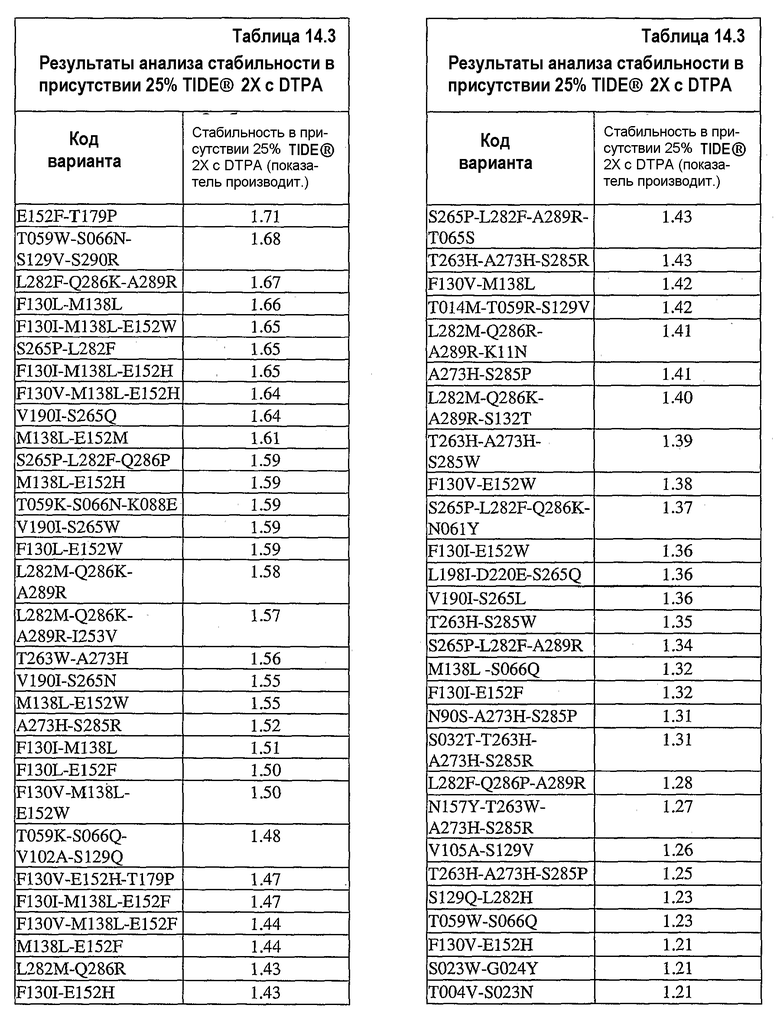
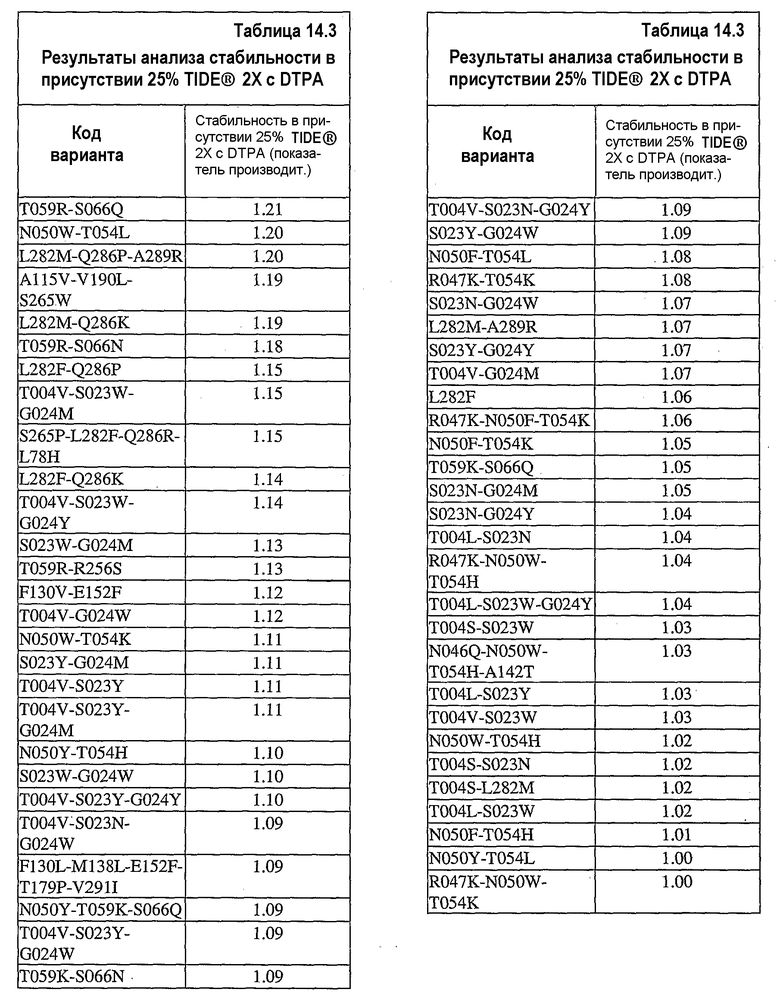
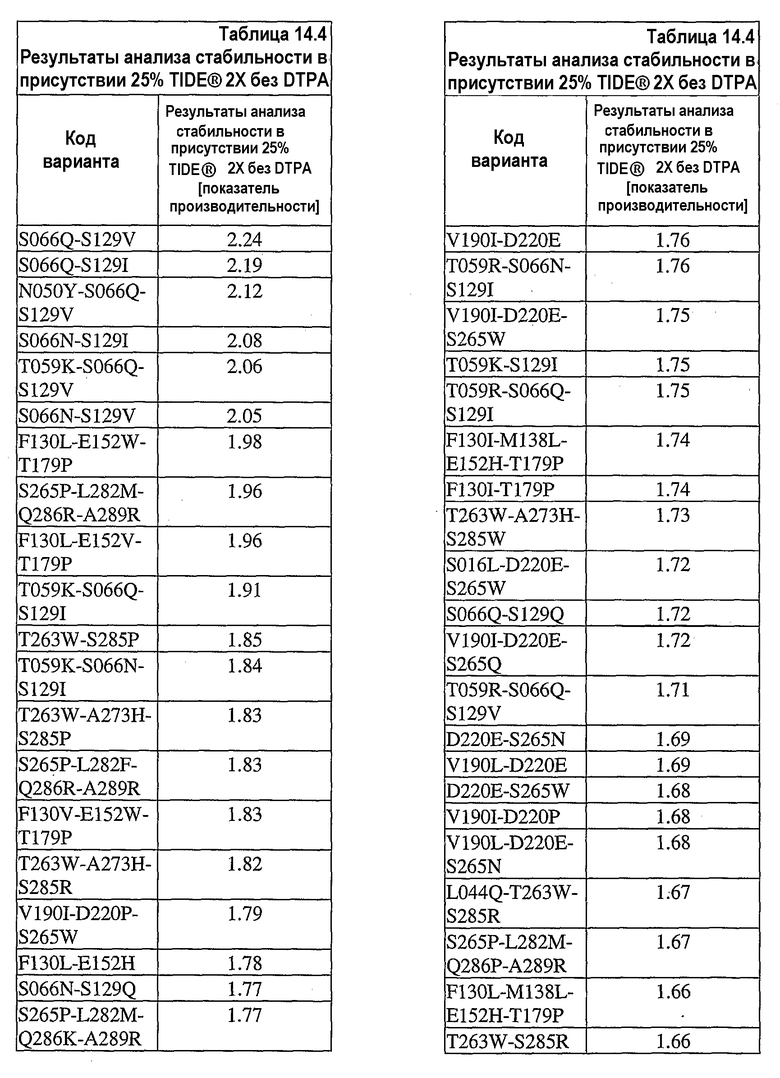
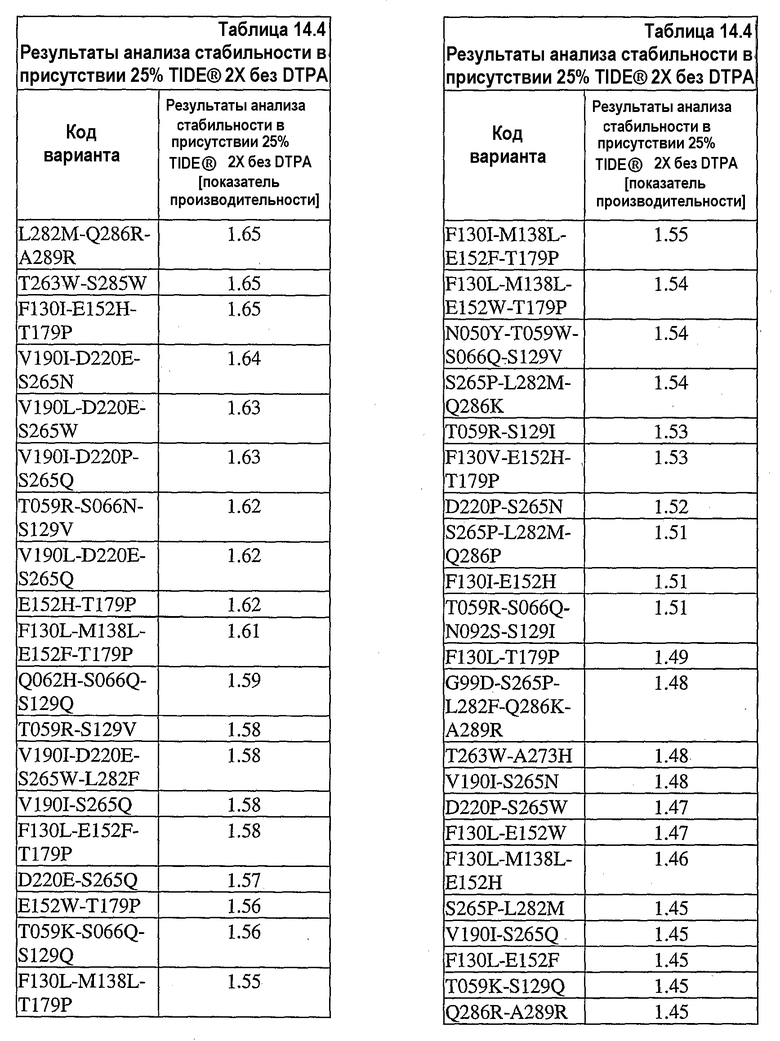
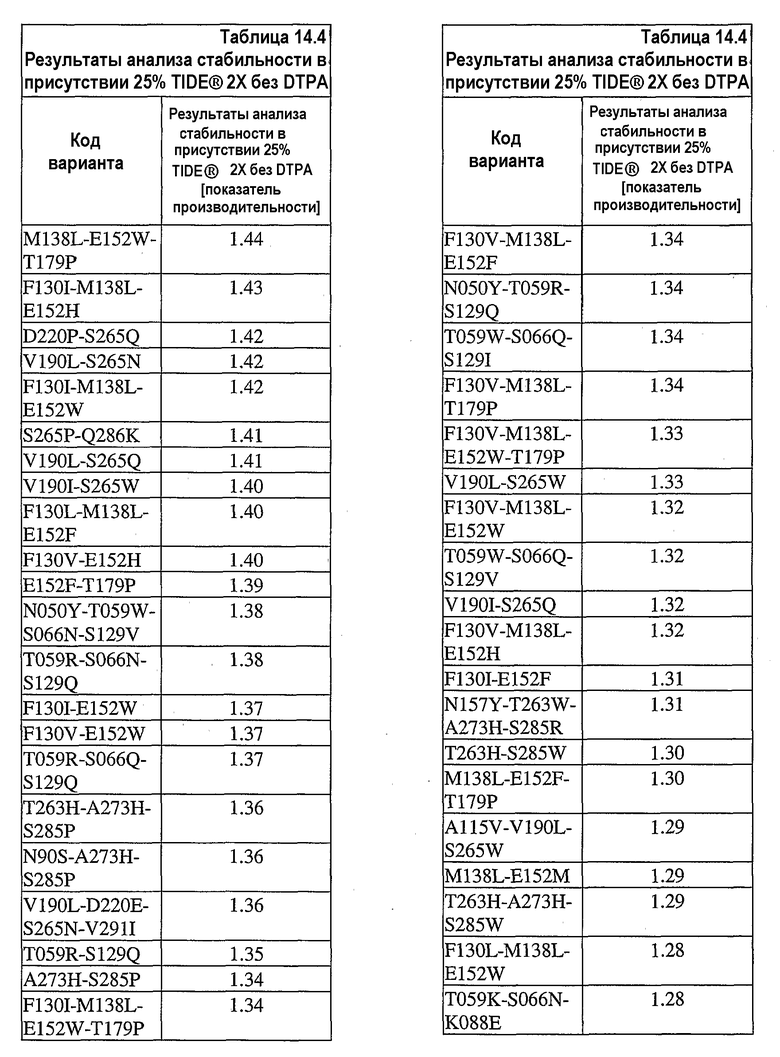
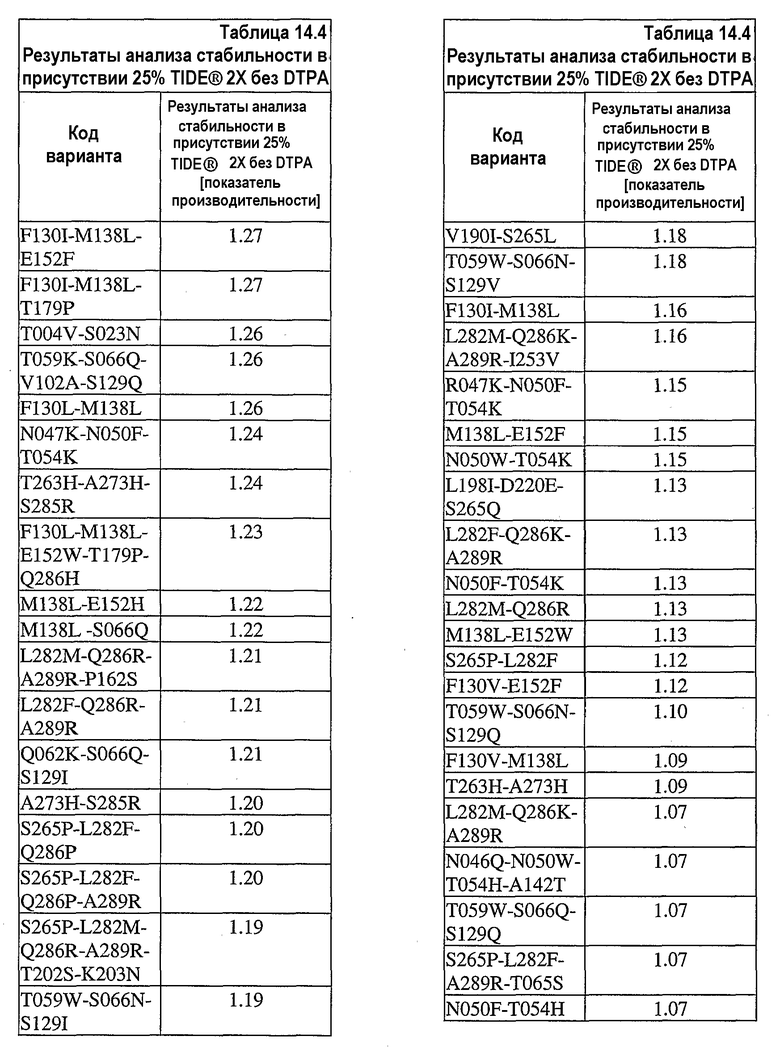
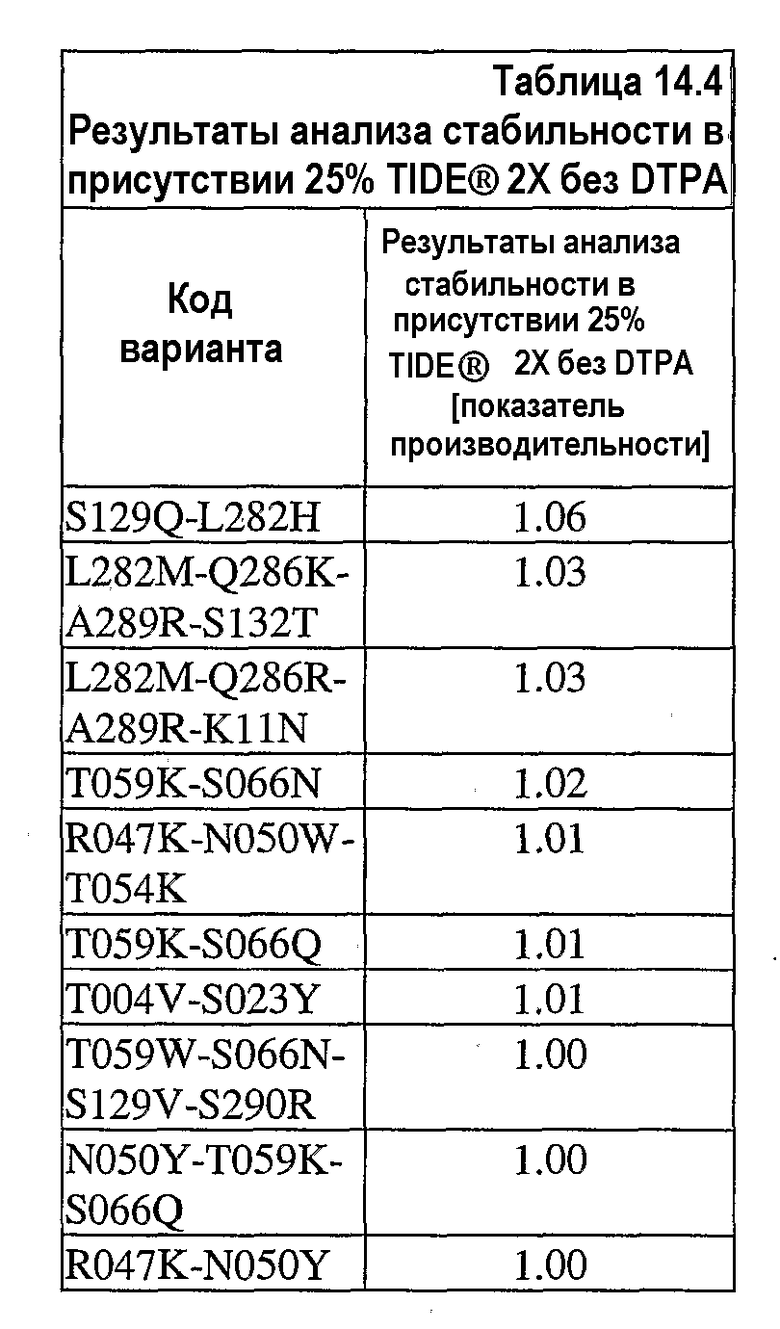
Данные в следующей таблице (таблица 14.5) представляют собой данные относительной стабильности вариантов NprE относительно стабильности NprE дикого типа при анализе устойчивости к цитрату. Стабильность измеряли посредством определения активности для казеина посредством определения активности для AGLA до и после инкубации при повышенной температуре (см. «Анализ устойчивости к цитрату» выше). Таблица содержит значения относительной устойчивости по сравнению с диким типом при данных условиях. Они представляют собой соотношение (остаточная активность варианта/остаточная активность дикого типа). Значение больше одного указывает на более высокую стабильность в присутствии цитрата.
ПРИМЕР 15
Профиль производительности в зависимости от pH для nprE по сравнению с BPN' 217L
В этом примере описаны эксперименты, проводимые для оценки сравнительной производительности nprE и BPN' Y217L. В этих экспериментах использовали EMPA 116 (BMI) и загрязнения травой Equest.
Материалы:
NprE, 8 мг/мл
BPN' Y217L, 25,6 мг/мл
Загрязненная ткань EMPA 116, 3"×4,5" (Testfabrics)
Загрязнения травой (средн.) Equest, 3"×4" (Warwick Equest)
Образцы белого хлопка EMPA 221, 3"×4,5"
Колориметр Minolta CR200
TIDE® 2005 (предоставленный Procter & Gamble)
Концентрат для жесткости воды: 15000 частиц на галлон (gpg), 3:1 Ca:Mg
1 М бис-ТРИС-пропановый буфер
Концентрированная серная кислота
50-л чан-смеситель с краном и мешалкой
Terg-O-Tometer
DI вода
Получали образцы для обработки. Проводили три повтора на обработку, с 18 образцами, использованными на обработку. Образцы с травой получали в темной комнате для предупреждения выгорания. Значения отражения для приблизительно 18 загрязненных образцов получали с использованием колориметра Minolta. Получали три считывания на образец. Записывали значения L, среднее значение L и стандартное отклонение. Это представляет собой значение Lначальное.
Раствор моющего средства получали следующим образом (всего для 40 л). Предпочтительным является приготовление этого раствора за ночь до тестирования. Раствор сохраняли на холоде в течение ночи. Для получения раствора добавляли 39,724 кг DI воды в 50-л чан-смеситель, запускали мешалку, подмешивали 60 г жидкого моющего средства TIDE®, подмешивали 16 мл раствора для жесткости воды и 200 мл 1 M бис-ТРИС-пропана. pH регулировали с использованием концентрированной серной кислоты (доводили до 0,2 единицы pH ниже желаемого pH, если раствор хранили в течение ночи), так как pH в течение ночи увеличивается). Конечные концентрации составляли: TIDE®=1,5 г/л; жесткость воды=6 gpg; и бис-ТРИС-пропан=5 мМ.
Для тестирования в Terg-O-Tometer 1 л раствора моющего средства добавляли в каждую емкость Terg и доводили температуру. Фермент добавляли в емкости в различных концентрациях. Для тестов с BMI используемые концентрации фермента составляли 0 мг/л, 0,275 мг/л, 0,55 мг/мл, 1,65 мг/л, 2,65 мг/л и 5,50 мг/л. Для загрязнений травой использованные концентрации nprE составляли 0 мг/л, 0,1925 мг/л, 0,385 мг/л, 1,155 мг/л, 1,925 мг/л и 3,85 мг/л (концентрации BPN' Y217L являлись такими же, как использовали в тестах с BMI). Начинали перемешивание и добавляли образцы. Все повторы обрабатывали рядом в одном и том же Terg-O-Tometer (например, OX и 1/2X в 1-ом прогоне, 1X и 3X во 2ом прогон, и 5X и 10X в 3ем прогоне). Температура составляла 15°C, скорость перемешивания составляла 100 об/мин, и время стирки составляло 12 минут. Обработанные образцы прополаскивали три раза в 4 л воды из-под крана (~6 gpg). Образцы высушивали на воздухе в течение ночи на бумажных полотенцах. Образцы с травой покрывали бумажными полотенцами и позволяли высохнуть в затемненной комнате. Значения отражения для высушенных образцов определяли, как описано выше. Получали три считывания на образец. Записывали значения L, среднее значение L и стандартное отклонение. Это представляет собой значение Lконечное.
Процент удаления загрязнений (%SR) определяли для каждого тестируемого условия и обоих ферментов с использованием уравнения
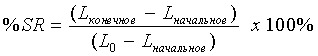
где Lo = отражение незагрязненных образцов
Lначальное = отражение загрязненных образцов
Lконечное = отражение выстиранных образцов
Дельта %SR по сравнению с контролем без фермента определяли с использованием следующей формулы:
Д%SR=%SRобработанный-%SRконтроль без фермента
BPN' Y217L сравнивали с nprE на EMPA 116 (BMI) при значениях pH 6,7, 7,5, 8,5 и 9,5. Производительность nprE на EMPA 116, по-видимому, достигала пика приблизительно при pH 8, тогда как производительность BPN' Y217L достигала пика приблизительно при pH 8,8. Результаты показывают, что nprE действует лучше, чем BPN' Y217L при pH 7,5 и 8,5, хотя он не действует также хорошо, как BPN' Y217L при pH 6,7. Производительность этих ферментов являлась одинаковой при pH 9,5. Кроме того, не существовало разницы в производительности этих ферментов для травы Equest (средн.) при pH 7,8-8,4.
ПРИМЕР 16
Сравнение ферментов PMN и nprE в жидком моющем средстве
В этом примере описаны эксперименты по очистке для определения очищающей производительности PMN и nprE. Очищающую производительность ферментов PMN и nprE тестировали в жидком моющем средстве TIDE® по сравнению с контрольной сериновой протеазой (протеаза A) на чувствительных к протеазе загрязнениях. Как показано в таблице ниже, PMN и nprE удаляют загрязнения намного лучше, чем протеаза A, даже при низких уровнях ферментов. В следующих таблицах более высокие значения SRI указывают на лучшую очищающую производительность.
Сравнение очищающей производительности PMN по сравнению с протеазой A в жидком TIDE® (в полноразмерной стиральной машине)
PMN
Сравнение очищающей производительности PMP по сравнению с протеазой A в жидком TIDE® (в стиральной машине малого размера)
Сравнение очищающей производительности nprE по сравнению с протеазой A в жидком TIDE® (в стиральной машине малого размера
ПРИМЕР 17
Термостабильность NprE и вариантов NprE
В этом примере описаны эксперименты, проводимые для определения термостабильности NprE и вариантов NprE. Ферменты получали и очищали, как описано выше. Очищенные белки оценивали как достаточно гомогенные, с более чем 95% частотой, как определяли с использованием 10% SDS-PAGE, так как в геле наблюдали только один главный белок. Этот белок составлял приблизительно 32 кДа, что представляет собой молекулярную массу последовательности зрелого nprE. Белок составляли для хранения с использованием 25 мМ буфера MES, pH 5,8, содержащего 1 мМ хлорида цинка, 4 мМ хлорида кальция и 40% пропиленгликоль. Анализы, используемые в этих экспериментах, представляли собой анализ протеазы с использованием активности для флуоресцентного AGLA и дифференциальную сканирующую калориметрию (DSC), описанную ниже.
Дифференциальная сканирующая калориметрия (DSC)
Кривые избыточной теплоемкости измеряли с использованием высокопроизводительного микрокалориметра сверхчувствительного сканирования VP-Cap DSC (Microcal). Общепринятый способ измерений DSC и теория способа хорошо известны специалистам в данной области (см., например, Freire, 1995) Meth. Mol. Biol., 41, 191-218 [1995]). Коротко, необходимо приблизительно 500 мкл 200-400 ppm чистых или ультрафильтрованных концентрированных (UFC) образцов белка. Как правило, 400 ppm NprE и вариантов белков (в отсутствие и в присутствии 130 мМ цитрата) сканировали в диапазоне температур 20-100°C с использованием скорости сканирования 200°C/час в буфере 5 мМ HEPES, pH 8,0. Затем тот же самый образец сканировали повторно для проверки возможности обратимости процесса. В случае NprE процесс термического разворачивания являлся необратимым. Данные зависимости скорости сканирования термического плавления NprE оценивали для скорости сканирования от 25 до 200°C/час. Оценивали также эффект различных добавок (например, первичных и вторичных спиртов, солей, циклодекстрина, PEG, сорбита, глицерина) на термическую точку плавления NprE.
Результаты
Термостабильность NprE дикого типа определяли при двух различных концентрациях, чтобы показать эффект концентрации белка на термическую точку плавления. Значения Tm для 220 ppm и 440 ppm определяли как 67,6±0,5 и 69,2±0,5°C, соответственно. Концентрация белка влияет на проявления событий второго порядка. Предусматривают, что это - либо агрегация, либо автолиз. Однако не подразумевают, что настоящее изобретение является ограниченным каким-либо конкретным механизмом. Тем не менее, эти результаты показывают, что для точного определения и любого сравнения термических точек плавления для NprE необходимо, чтобы концентрации белка хорошо совпадали. Показали также зависимость для влияния скорости сканирования на термическую точку плавления, где Tm зависит от скорости сканирования вплоть до 150°C/час и затем сглаживается между 150-200°C/час. На основании этих результатов 200°C/час выбрали в качестве верхней скорости сканирования для всех исследований, чтобы минимизировать зависимость Tm от скорости сканирования.
Все данные, собранные для NprE и вариантов, показаны в таблице 4. В таблицу 4 включены также термические точки плавления при DSC, полученные для NprE и вариантов в присутствии 130 мМ цитрата. В большинстве случаев сканировали две концентрации белка. Как показано в этой таблице, в случае сканирований в присутствии 130 мМ цитрата не для всех белков показали профиль термического разворачивания.
Результаты DSC
Концентрация
Белок
Белок
Белок c 130 мМ цитратом
Типичная картина профилей термического разворачивания (сканирований DSC) для дикого типа и различных мутантов NprE показана на фиг.27. Для профилей разворачивания показана средняя точка для дикого типа, и показаны селективные мутанты, обладающие повышенными термическими точками плавления относительно дикого типа, и мутанты, обладающие пониженными температурами плавления относительно дикого типа. На этой фигуре ясно показано, что DSC различает между стабильными и менее стабильными вариантами NprE и является применимым в качестве вторичного скрининга. Наблюдали общую тенденцию между термическими точками плавления вариантов и их стабильностью в детергенте. Например, варианты S66E, S199E, D220P/E, S129I/V все являлись самыми лучшими в TIDE® и обладали повышением термической точки плавления приблизительно на 1°C относительно NprE дикого типа. Это повышение термической точки плавления на 1°C является еще небольшим по значимости, так как для термостабильности, как правило, необходимы множественные замены аминокислот.
На фиг.28 показано термическое разворачивание вариантов NprE, показывающее профиль термического разворачивания в присутствии 130 мМ цитрата. Цитрат является компонентом моющего средства, быстро вызывающим автолиз NprE в отсутствие кальция. Для NprE дикого типа не присутствует профиля термического разворачивания в присутствии цитрата, что соответствует белку, который уже является развернутым, или у которого отсутствует хорошо сформированный гидрофобный кор. Мутанты, для которых показан профиль термического разворачивания в присутствии цитрата, включены в таблицу 17. Эти варианты обладали термическими точками плавления в диапазоне 47-56°C. Сканированиями DSC в присутствии 130 мМ цитрата показали варианты, которые являются более устойчивыми к цитрату, чем NprE дикого типа. Например, показано, что устойчивые к цитрату варианты содержат либо S129I, либо S129V, и для комбинаций, содержащих любую из этих замен, показали увеличение термической точки плавления на +5°C.
Эффект добавок на термические точки плавления NprE:
На фиг.29 показаны результаты экспериментов, включающих различные добавки. Буфер представлял собой 5 мМ HEPES, pH 8,0. Образцы сканировали при 20-100°C с использованием скорости сканирования 200°C/час. На этой фигуре горизонтальной линией представлена Tm для NprE дикого типа без добавок. По данным этих экспериментов показали малый эффект или отсутствие эффекта на термическую точку плавления (Tm) NprE в присутствии этих реагентов. Показали, что включение ингибитора активности NprE, а именно фосфорамидона, увеличивает Tm приблизительно на 1°C, что позволяет предполагать, что ингибитор может придавать некоторую стабилизацию NprE против процесса термического разворачивания. Ни одно из вышеуказанных условий не помогало сделать процесс термического разворачивания обратимым. Однако не подразумевают, что настоящее изобретение является ограниченным каким-либо конкретным механизмом.
ПРИМЕР 18
Стабильность гомологов NprE в TIDE® и моющая производительность гомологов для BMI
В этом примере описаны эксперименты, проводимые для оценки стабильности гомологов nprE в TIDE®, также как моющей производительности этих гомологов. Очищенные NprE («NprE»), NprE Bacillus subtilis (B.S. NprE), NprB Bacillus thuringiensis (B.T. NprB) и термолизин Bacillus thermoproteolyticus (TLN) инкубировали в 200 мкл 25% tide в 10 мМ HEPES, pH 8, при 10 мкг/мл при 25°C в течение 90 минут. Начальные активности и остаточные активности измеряли с использованием анализа с AGLA, как описано выше. Коротко, 10 мкл образца добавляли в 200 мкл буфера для AGLA (50 мМ MES, pH 6,5, 0,005% TWEEN®-80, 2,5 мМ CaCl2), затем 10 мкл растворенного образца добавляли к 200 мкл субстрата AGLA (2,4 мМ Abz-AGLA-Nba в буфере для AGLA). Мониторировали возбуждение при 350 нм и испускание при 415 нм в течение первых 100 секунд, начальный угол наклона кривой записывали как активность фермента. Процент остаточной активности рассчитывали посредством деления остаточной активности на начальную активность. На фиг.30 представлен график, показывающий остаточную активность после 90 минут.
Для определения моющей производительности этих гомологов в TIDE® сначала в каждую лунку 96-луночного планшета добавляли один микрообразец BMI после предварительной промывки. Затем добавляли 190 мкл 1x прессованного TIDE® (780 мкг/мл прессованного TIDE®, 5 мМ HEPES, pH 8, жесткость воды 6 gpg). Затем 10 мкл очищенных NprE, NprE Bacillus subtilis, NprB Bacillus thuringiensis и термолизина Bacillus thermoproteolyticus добавляли в лунки для получения конечной концентрации фермента 0,25 мкг/мл. Планшет инкубировали при 25°C в течение 30 мин с покачиванием при 1400 об/мин в Thermomixer. В конце инкубации 100 мкл супернатанта переносили в новый 96-луночный планшет. Затем измеряли OD супернатанта при 405 нм. Из OD супернатанта вычитали OD пустого контроля без добавления фермента. Показатель производительности вычисляли посредством деления OD каждого гомолога на OD NprE. На фиг.31 представлен график, показывающий моющую производительность для BMI NprE, также как гомологов nprE, описанных здесь.
ПРИМЕР 19
Анализ металла для дикого типа и вариантов nprE
В этом примере описаны эксперименты, проводимые для определения содержания цинка и кальция в nprE и вариантах nprE. В этих экспериментах проводили общий анализ следов металла посредством масс-спектроскопии с индуктивно-связанной плазмой (ICPMS) и индуцированного частицами испускания рентгеновских лучей с микрофокусированным потоком (микро-PIXE) для подтверждения содержания цинка и кальция в NprE. В общем, один ион цинка и два иона кальция тесно связаны.
Все образцы ICPMS и микро-PIXE получали в свободном от металлов буфере для удаления любых экзогенных загрязнений металлами. Как правило, для 250 мкл образцов с 40 мг/мл NprE три раза проводили смену буфера на 20 мМ HEPES, pH 8,2 с использованием аппарата для микродиализа YM-10. Свободный от металлов буфер получали пропусканием буфера через колонку, набитую смолой Chelax 100. Конечную концентрацию белка определяли с использованием набора для анализа белка с бицинхониновой кислотой (анализ BCA) из Sigma. Образцы ICPMS анализировали в West Coast Analytical Services, Inc. Образцы для микро-PIXE анализировали в Ion Beam Analysis Laboratory.
В таблице 19-1 показаны результаты анализа металла ICPMS для ионов кальция и цинка из NprE дикого типа. Обнаружили, что относительно концентрации белка в образце присутствуют два иона кальция и два иона цинка.
Анализ металла ICPMS для ионов кальция и цинка из NprE дикого типа
Анализом элементарного состава микро-PIXE измеряли содержание металла относительно внутреннего стандарта белка. Все пики, детектированные с использованием микро-PIXE, рассчитывали относительно пика серы, возникающего из-за трех остатков метионина в случае NprE. Наблюдаемый большой пик иона хлорида обусловлен присутствием соли в буфере.
В таблице 19-2 показано содержание металла, определенное посредством микро-PIXE, что указывает на то, что NprE, как правило, содержит два тесно связанных иона кальция и один ион цинка на молекулу белка. Для NprE дикого типа показали 1 ион цинка с 2 ионами кальция. Предусматривают, что для ионов кальция может быть получен низкий показатель заполнения из-за подготовки образца. Для S58D и T60D показали около двух ионов цинка на белок, что указывает на возможное связывание с участком дополнительного иона цинка. Двойной вариант обладает двумя дополнительными остатками цистеина, что добавляет точность способу. Однако не подразумевают, что настоящее изобретение является ограниченным каким-либо конкретным вариантом осуществления с конкретным числом ионов.
Определение металла микро-PIXE, показывающее содержание Ca и Zn для нативного и вариантов NprE
В соответствии с другими хорошо охарактеризованными зависимыми от кальция и цинка нейтральными протеазами, такими как термолизин или подобные термолизину протеазы (TLP) (см., например, Dahlquist et al., Biochem., 15:1103-1111 [1976]; Srpingman et al., (1995) Biochemistry 34, 15713-15720 [1995]; и Willenbrock et al., (1995) FEBS Lett. 358:189-192 [1995]), обнаружили, что NprE содержит по меньшей мере два тесно связанных иона кальция и один ион цинка на молекулу. Предположили потенциальный третий участок связывания кальция, но ожидают, что он является очень слабым. Поскольку все образцы являлись обессоленными для удаления любых экзогенных металлов, ожидают, что эти слабо связывающие кальций участки являются незанятыми.
ПРИМЕР 20
Стабилизация NprE форматом кальция в прессованном моющем средстве TIDE® HDL
В этом примере описаны эксперименты, проводимые для разработки способов стабилизации NprE в прессованном TIDE® HDL. В этих экспериментах исследовали способы стабилизации NprE посредством увеличения уровня формата кальция при фиксированной концентрации цитрата при понижении содержания DTPA в экспериментальном составе прессованного TIDE® («TIDE® 2x»). Использовали методологию статистического дизайна экспериментов (DOE) для упрощения экспериментов, также как для анализа данных. Показали, что DTPA, присутствующая в TIDE®, оказывает неблагоприятное действие на стабильность NprE, в то время как добавление формата кальция помогает преодолеть неблагоприятный эффект состава прессованного TIDE® полной силы.
Полную центральную композитную модель поверхности ответа с двойными центральными точками использовали в качестве способа DOE. Всего предварительно получали 16 уникальных составов четырех меняющихся компонентов согласно вариантам составов, перечисленных в таблице 19.1. Изменяли LAS от 0-6% (мас./мас.) с DTPA (0-0,25%) и форматом кальция (0-0,2%) при фиксированной концентрации лимонной кислоты (1,9%). Все другие компоненты моющего средства TIDE® поддерживали постоянными. Условия границ концентрации компонентов определяли на основе фазовой стабильности различных смесей. Тесты стабильности белка проводили с 780 ppm nprE в смесях составов полной силы (~100%) и инкубировали при 32°C. Инактивацию измеряли вплоть до 24 часов. Все анализы выполняли с использованием набора для анализа с красным флуоресцентно меченным казеином (Invitrogen) с концентрацией белка 0,5 ppm. Скорости инактивации NprE измеряли в трех независимых экспериментах. Данные DOE анализировали с использованием DOE Fusion Pro (S-матрицы).
Композиция 16 составов TIDE®, используемых для исследований DOE
В таблице 20.2 и на фиг.31 показаны результаты измерений стабильности NprE в различных смесях составов. Средние скорости и стандартные отклонения представляли собой среднюю скорость инактивации NprE (час-1) из трех независимых измерений. Количественно, составы с низким содержанием DTPA с высокой нагрузкой кальция проявляют тенденцию являться более стабильными в прессованном TIDE® полной силы. В качестве примера, для состава #5, без добавления DTPA и с высоким уровнем формата кальция, показали самую низкую скорость инактивации, что указывает на высокую стабильность NprE. В отличие от этого, для состава #9 с высокой концентрацией DTPA без добавления формата кальция показали самую низкую стабильность. В таблице 20.2 ранжирование основано на измеренной стабильности (т.е. средних скоростях). Присутствуют прогоны из трех независимых экспериментов для стабильности.
Скорости инактивации NprE в 16 смесях составов
На фиг.33 показаны эффекты инактивации NprE посредством DTPA при различных уровнях фиксированной концентрации формата кальция. На панели A показана скорость инактивации NprE посредством DTPA без какого-либо добавления формата кальция. По корреляции показали, что DTPA обладает значительным неблагоприятным эффектом. На панели B показан несколько уменьшенный эффект DTPA с 0,1% форматом кальция. На панели C показан значительно уменьшенный эффект DTPA с 0,2% форматом кальция.
На фиг.34 показан полученный программным обеспечением для анализа DOE (Fusion Pro) предсказанный профиль для композиции DTPA и формата кальция на основании целевой реакции (скорости разложения) менее чем 0,5 час-1 (панель A), 0,25 час-1 (панель B) и 0,05 час-1 (панель C). Заштрихованной областью показаны соотношения в композиции DTPA и формата кальция, которые, как предсказано, обеспечивают стабильность со скоростью разложения ниже целевой установки. Например, для 0,16% формата кальция в присутствии 0,04% DTPA будут получать стабильность NprE со скоростью разложения менее чем 0,25 час-1, как показано на панели B фиг.34. С другой стороны, 0,08% формат кальция не может поддерживать стабильность NprE со скоростью разложения по меньшей мере 0,25 час-1 в присутствии 0,16% DTPA.
ПРИМЕР 21
Идентификация участков индуцированного цитратом автолиза для нейтральной металлопротеиназы NprE B. amyloliquefaciens
В этом примере описаны способы, используемые для оценки индуцированного цитратом автолиза дикого типа и рекомбинантного варианта nprE (например, вариант B. subtilis). В этих экспериментах автолиз нейтральной металлопротеиназы из B. amyloliquefaciens (природный и рекомбинантный вариант, экпрессированный в B. subtilis) индуцировали с использованием цитрата натрия (Sigma). Процесс автолиза контролировали посредством проведения реакции при 4°C в буфере 25 мМ MES, pH 6,5. В этих экспериментах автолиз 0,4 мг/мл NprE оптимизировали посредством изменения либо: (a) времени инкубации (10-100 минут) в 10 мМ цитрате; либо (b) концентрации цитрата (10-100 мМ) в течение 100 минут. Контрольную нейтральную металлопротеиназу, растворенную в одном буфере (т.е. без цитрата), инкубировали в таких же условиях. Реакции автолиза останавливали добавлением равного объема 1Н HCl, образцы осаждали с использованием TCA, и осадок промывали и высушивали с использованием ацетона. Полученный осадок ресуспендировали в 20 мкл буфера, pH 6,5 и 4X буфере LDS для образцов (NuPage, Invitrogen).
Фрагменты автолиза разделяли посредством 10% (мас./об.) SDS-PAGE и осуществляли перенос на мембрану PVDF. Первые 10 аминокислотных остатков секвенировали посредством деградации по Эдману (Argo Bioanalytica). Частичные аминокислотные последовательности фрагментов автолиза определяли с использованием расщепления трипсином в геле и анализа с использованием LCQ-MS (Agilent). Способ расщепления в геле включает в себя извлечение куска геля, содержащего белок, удаление окраски Кумасси синим с последующей регидратацией кусков геля в 25 мМ NH4CO3, содержащем 2 M мочевину. Трипсин добавляли к кускам регидратированного геля приблизительно на 6 часов при 37°C. После расщепления пептиды экстрагировали с использованием ацетонитрила и TCA. Пептиды разделяли на C4-гидрофобной колонке (Vydac) с использованием градиента ацетонитрил-вода. Для полученных пептидных карт проводили поиск с помощью программы поиска в базах данных SEQUEST® по сравнению с базой данных, содержащей ферменты Genencor.
Аминокислотные последовательности первых 10 аминокислот каждого фрагмента сравнивали с известной аминокислотной последовательностью для NprE B. amyloliquefaciens. Это позволяет проводить идентификацию аминокислоты на N-концах и, таким образом, участка (участков) расщепления.
Получение индуцированных цитратом фрагментов и их разделение показали в 10% SDS-PAGE. Размеры фрагментов идентифицировали с использованием стандартного маркера молекулярной массы из Invitrogen. В присутствии 10 мМ цитрата два фрагмента в дополнение к оставшемуся интактным NprE наблюдали на протяжении диапазона времени 100 минут. Обнаружили, что два фрагмента, образованные при низкой концентрации цитрата, обладают размером 24 кДа и 9 кДа. Интактный nprE составлялет 32 кДа. Для 100-минутного диапазона времени в результате получили хорошее соотношение расщепленного белка (т.е. фрагментов первичного автолиза). В этих условиях не обнаружили или не детектировали никаких дополнительных фрагментов. Исследование в течение более 100 минут в присутствии увеличивающейся концентрации цитрата проводили для получения фрагментов вторичного автолиза. В этом эксперименте при использовании концентраций цитрата между 10-30 мМ наблюдали два описанных выше фрагмента. Для 40 мМ цитрата наблюдали меньше более крупных фрагментов 24-кДа, однако наблюдали также фрагмент 15-кДа. Для 50-100 мМ цитрата фрагмент 24 кДа и фрагменты 9 кДа больше не обнаруживали, однако наблюдали три других фрагмента, размером 21 кДа, 15 кДа и 11 кДа.
Идентичность N-концов 24 кДа, 9 кДа (два первых фрагмента) и 21 кДа, 15 кДа и 11 кДа (следующие фрагменты автолиза) определяли с использованием деградации по Эдману (Argo Bioanalytica).
N-концевая последовательность фрагментов
Полосы A1, A3 и A4 обладали нативной N-концевой последовательностью, совпадающей с N-концом интактного NprE. По данным секвенирования полосы A2 показали три фрагмента, где наименее интенсивные последовательности, по-видимому, являлись идентичными с более интенсивной последовательностью, за исключением того, что они были на два остатка и на один остаток короче более интенсивной последовательности, соответственно. Это согласуется с деградацией этого конкретного фрагмента белка. Характер и размеры фрагментов в геле позволяют предполагать, что 15 кДа (полосу A4) можно получить из фрагмента 21-кДа (полосы A3), и таким образом заключили, что C-конец находится в положении 198 или рядом с ним. Однако не подразумевают, что настоящее изобретение является ограниченным этим конкретным вариантом осуществления.
На фиг.35 представлены аминокислотные последовательности для различных фрагментов (1-5 или A1-5 для целей секвенирования N-конца). Фрагмент 1 (A1) обладает N-концевыми остатками, эквивалентными остаткам для интактного нативного белка (SEQ ID NO:222), N-конец фрагмента 2 (Ad2) начинается на D220 или рядом с ним (SEQ ID NO:223). Следующие два аминокислотных остатка (A221 и G222) также выделены, поскольку выявили, что этот фрагмент подвержен деградации. Фрагмент 3 (A3) (SEQ ID NO:224) и фрагмент 4 (A4) (SEQ ID NO:225) обладают N-концом интактного белка, и фрагмент 5 (A5) (SEQ ID NO:226) начинается на L198. C-конец фрагмента 4, по-видимому, находится на M138 или рядом с ним (на основании разницы размеров между A3 и A4). Соответствующий фрагмент для A3 не обнаружили.
Расщеплением трипсином с последующей LCQ-MS при пептидном картировании для фрагментов 1-5 положительно идентифицировали пептиды из нескольких аминокислот внутри соответствующих фрагментов. Они выделены на фиг.35. LCQ-MS обеспечивает положительный контроль для идентичности фрагментов.
На основании анализа N-конца и анализа LCQ-MS для фрагментов расщепления участки первичного расщепления идентифицировали в положениях аминокислот D220, A221, G222, M138 и L198. Эти участки наметили для сайт-направленного мутагенеза, и получили библиотеки для анализа сайтов D220, A221, G222, L198 и M138, D139. Проводили скрининг этих мутантных белков по увеличенной стабильности в моющем средстве и по моющей производительности для BMI, как указано здесь. В некоторых случаях аминокислоты рядом с этими участками также выбирали для белковой инженерии, чтобы убедиться, что мишенью действительно является участок расщепления.
Результаты белковой инженерии ясно показали, что при заменах аминокислот либо на Pro, либо на Glu для D220 получают молекулу NprE, которая является более стабильной в моющем средстве. Кроме того, добивались дополнительной стабильности молекулы NprE посредством замены G222 на Cys, а M138 либо на Ile, либо на Leu. Как правило, эти конкретные замены аминокислот обеспечивают преимущества для стабильности NprE в моющем средстве без угрозы для моющей производительности для BMI. Таким образом, в этих экспериментах получили важные данные картирования для участков индуцированного цитратом автолиза, облегчающие идентификацию ключевых аминокислотных остатков, которые влияют на общую стабильность NprE и изменяют ее. Цитрат (добавка для повышения моющего действия, добавленная в основу моющих средств) приводит к дестабилизации и автолизу NprE и, как предполагают, осуществляют это посредством хелатообразования с необходимыми для связывания кальция атомами. Для применения NprE в экстремальных условиях моющего средства необходимо использовать в этих условиях более стабильную молекулу NprE. В этих экспериментах в результате замен в одном или нескольких участках автолиза NprE получали более устойчивую к моющему средству молекулу nprE для применения в этих экстремальных моющих средствах.
ПРИМЕР 22
Жидкие композиции моющего средства для стирки
В этом примере представлены различные составы жидких композиций моющего средства для стирки. Получили следующие жидкие композиции моющего средства для стирки согласно изобретению:
pH в примерах выше 22(I)-(II) составляет приблизительно от 5 до приблизительно 7, и в 22(III)-(V) составляет приблизительно от 7,5 до приблизительно 8,5.
ПРИМЕР 23
Жидкие композиции моющего средства для мытья посуды вручную
В этом примере представлены различные жидкие композиции моющего средства для мытья посуды вручную. Следующие жидкие композиции моющего средства для мытья посуды вручную согласно изобретению:
pH в примерах 23(I)-(VI) составляет приблизительно от 8 до приблизительно 11.
ПРИМЕР 24
Жидкие композиции моющего средства для автоматического мытья посуды
В этом примере представлены различные жидкие композиции моющего средства для автоматического мытья посуды. Следующие жидкие композиции моющего средства для автоматического мытья посуды согласно изобретению:
ПРИМЕР 25
Гранулированные и/или таблетированные композиции для стирки
В этом примере представлены различные составы гранулированных и/или таблетированных моющих средств для стирки. Получены следующие композиции для стирки согласно изобретению, которые могут существовать в форме гранул или таблеток.
ПРИМЕР 26
Жидкие моющие средства для стирки
В этом примере представлены различные составы жидких моющих средств для стирки. Получили следующие составы жидких моющих средств для стирки согласно изобретению:
ПРИМЕР 27
Моющие средства высокой плотности для мытья посуды
В этом примере представлены различные составы моющих средств высокой плотности для мытья посуды. Получены следующие прессованные моющие средства высокой плотности для мытья посуды согласно изобретению:
pH в примерах 27(I)-(VI) составляет приблизительно от 9,6 до приблизительно 11,3.
ПРИМЕР 28
Таблетированные композиции моющего средства
В этом примере представлены различные составы таблетированных моющих средств. Следующие таблетированные композиции моющего средства согласно изобретению получены прессованием гранулированной композиции моющего средства для мытья посуды под давлением 13 кН/см2 с использованием общепринятого 12-головочного ротационного пресса:
pH в примерах 28(I)-28(VII) составляет приблизительно от 10 до приблизительно 11,5; pH в 15(VIII) составляет 8-10. Масса таблетки из примеров 28(I)-28(VIII) составляет приблизительно от 20 г до приблизительно 30 г.
ПРИМЕР 29
Жидкие очищающие средства для твердой поверхности
В этом примере представлены различные составы жидких очищающих средств для твердой поверхности. Получены следующие композиции жидких очищающих средств для твердой поверхности согласно изобретению:
pH в примерах 29(I)-(VII) составляет приблизительно от 7,4 до приблизительно 9,5.
В то время как проиллюстрированы и описаны конкретные варианты осуществления настоящего изобретения, специалистам в данной области будет очевидно, что можно выполнять различные другие изменения и модификации без отклонения от сущности и объема изобретения. Таким образом, предполагают, что прилагаемая формула изобретения покрывает все такие изменения и модификации, входящие в объем этого изобретения.
Все патенты и публикации, упомянутые в описании, являются показательными по уровню для специалистов в области, к которой относится изобретение. Содержание всех патентов и публикаций приведено здесь в качестве ссылки в той же степени, как если бы конкретно и отдельно было указано, что содержание каждой публикации приведено в качестве ссылки.
При наличии описания предпочтительных вариантов осуществления настоящего изобретения обычному специалисту в данной области очевидно, что можно выполнять различные модификации описанных вариантов осуществления, и подразумевают, что такие модификации входят в объем настоящего изобретения.
Специалистам в данной области ясно очевидно, что настоящее изобретение хорошо адаптировано для выполнения упомянутых целей и получения упомянутых результатов и преимуществ, также как вытекающих из них. Композиции и способы, описанные здесь, являются представительными для предпочтительных вариантов осуществления, являются примерными и не предназначены для ограничений объема изобретения. Специалистам в данной области ясно очевидно, что для описанного здесь изобретения можно выполнять различные изменения и модификации без отклонения от объема и сущности изобретения.
Изобретение, иллюстративно описанное здесь, можно соответствующим образом осуществлять на практике в отсутствие любого элемента или элементов, при ограничении или ограничениях, которые конкретно не описаны здесь. Термины и выражения, применяемые здесь, использованы как термины для описания, а не ограничения, и при использовании таких терминов и выражений нет намерения исключить какие-либо эквиваленты показанных и описанных признаков или их частей, но понятно, что возможны различные модификации в объеме заявленного изобретения. Таким образом, следует понимать, что хотя настоящее изобретение конкретно описано посредством предпочтительных вариантов осуществления и необязательных признаков, специалисты в данной области могут прибегать к модификациям и вариантам описанных здесь идей, и такие модификации и варианты рассматривают как входящие в объем этого изобретения, как определено в прилагаемой формуле изобретения. Изобретение описано здесь широко и в общем смысле. Каждый из более узких признаков и менее общих групп, попадающих в общее описание, также составляет часть изобретения. Это относится к общему описанию изобретения с исключением или отрицательным ограничением удаления любого объекта из рода, независимо от того, перечислен здесь конкретно исключаемый материал или нет.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ УЛУЧШЕНИЯ ЭФФЕКТИВНОСТИ БЕЛКОВ | 2008 |
|
RU2569106C2 |
| ПРОДУЦИРОВАНИЕ ТЕРМОЛИЗИНА И ЕГО ВАРИАНТОВ И ЕГО ИСПОЛЬЗОВАНИЕ В ЖИДКИХ ДЕТЕРГЕНТАХ | 2008 |
|
RU2536255C2 |
| ПРОДУЦИРОВАНИЕ ТЕРМОЛИЗИНА И ЕГО ВАРИАНТОВ И ЕГО ИСПОЛЬЗОВАНИЕ В ЖИДКИХ ДЕТЕРГЕНТАХ | 2014 |
|
RU2733541C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ УЛУЧШЕННЫХ ВАРИАНТОВ БЕЛКА | 2008 |
|
RU2520808C2 |
| СПОСОБЫ УЛУЧШЕНИЯ МНОЖЕСТВЕННЫХ СВОЙСТВ БЕЛКА | 2008 |
|
RU2553550C2 |
| МОЮЩАЯ КОМПОЗИЦИЯ | 2015 |
|
RU2737535C2 |
| КОМПОЗИЦИИ И СПОСОБЫ, ВКЛЮЧАЮЩИЕ ВАРИАНТЫ МИКРОБНЫХ ПРОТЕАЗ | 2009 |
|
RU2541786C2 |
| КОМПОЗИЦИИ И СПОСОБЫ, ВКЛЮЧАЮЩИЕ ВАРИАНТЫ СУБТИЛИЗИНА | 2009 |
|
RU2575602C2 |
| ВАРИАНТЫ СЕРИНОВОЙ ПРОТЕАЗЫ С МНОЖЕСТВЕННЫМИ МУТАЦИЯМИ | 2007 |
|
RU2558261C2 |
| Способы и композиции, содержащие варианты сериновой протеазы | 2012 |
|
RU2663114C2 |

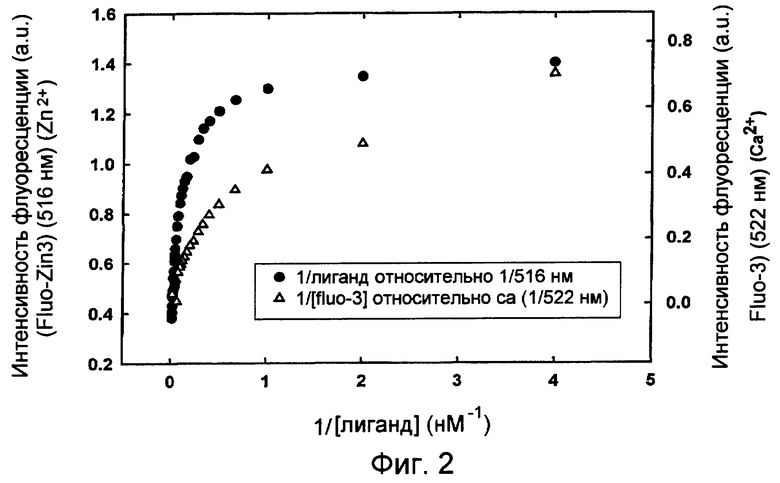






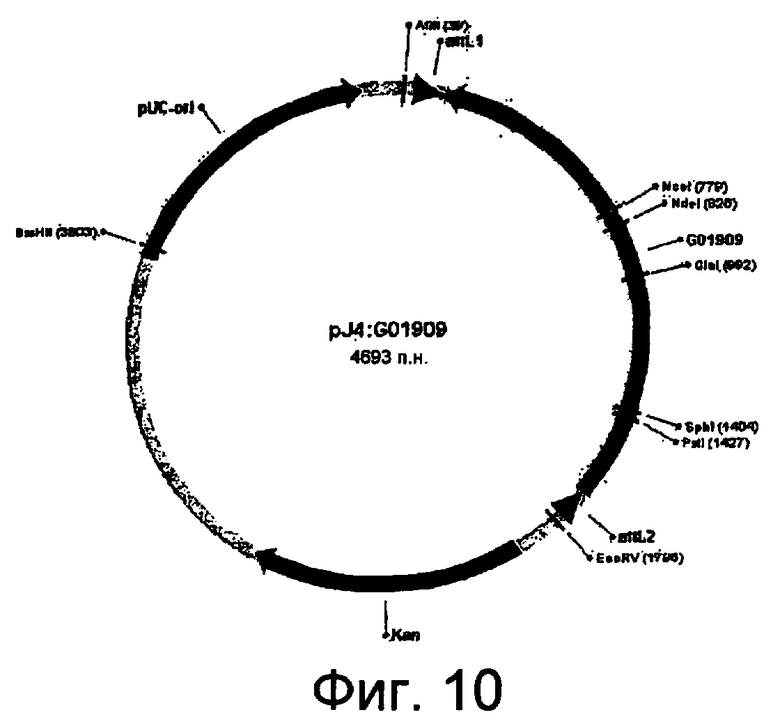
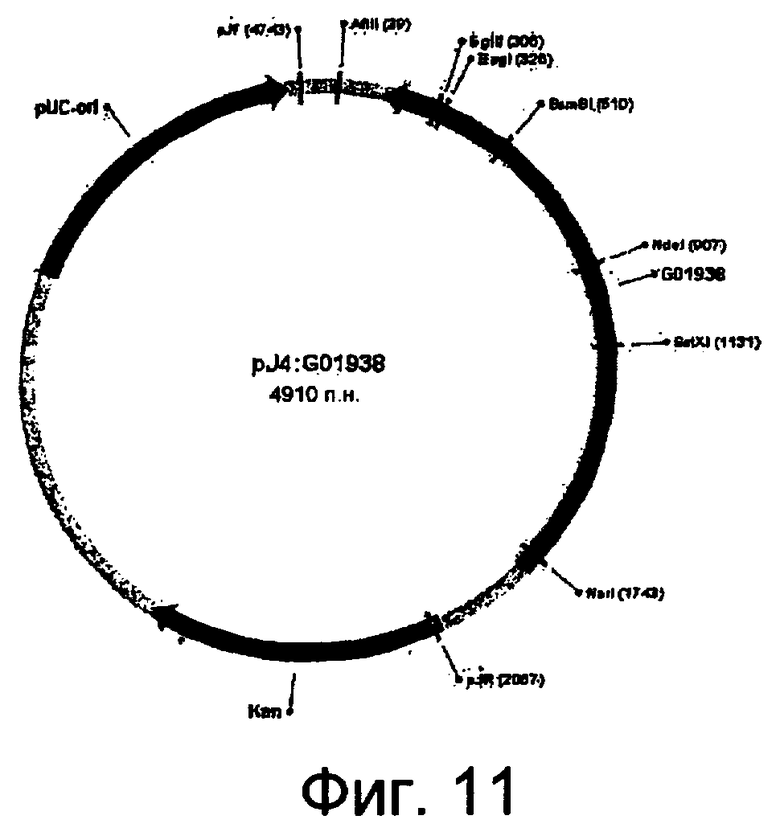
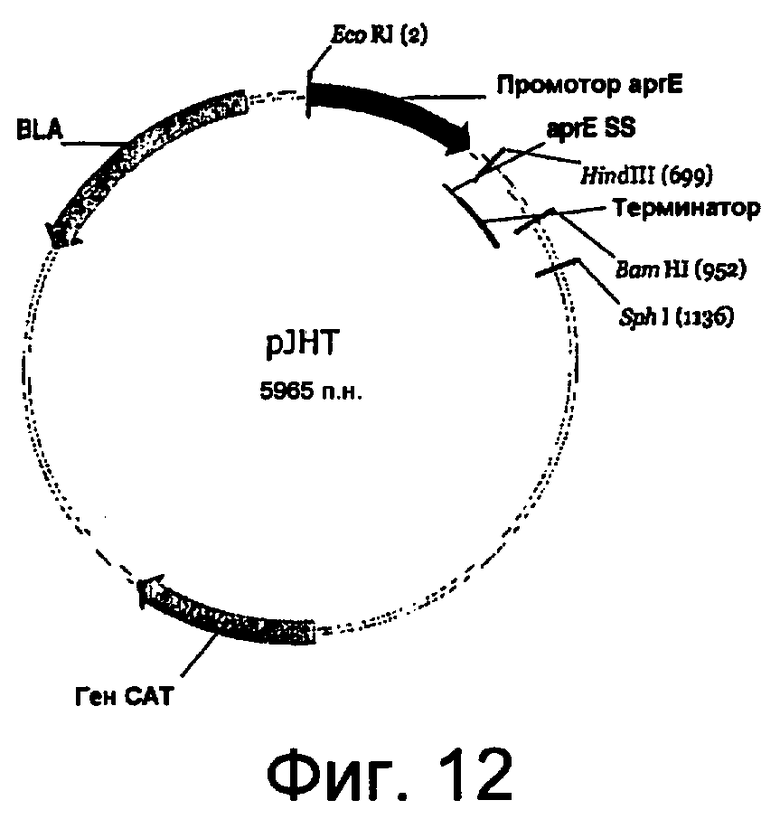
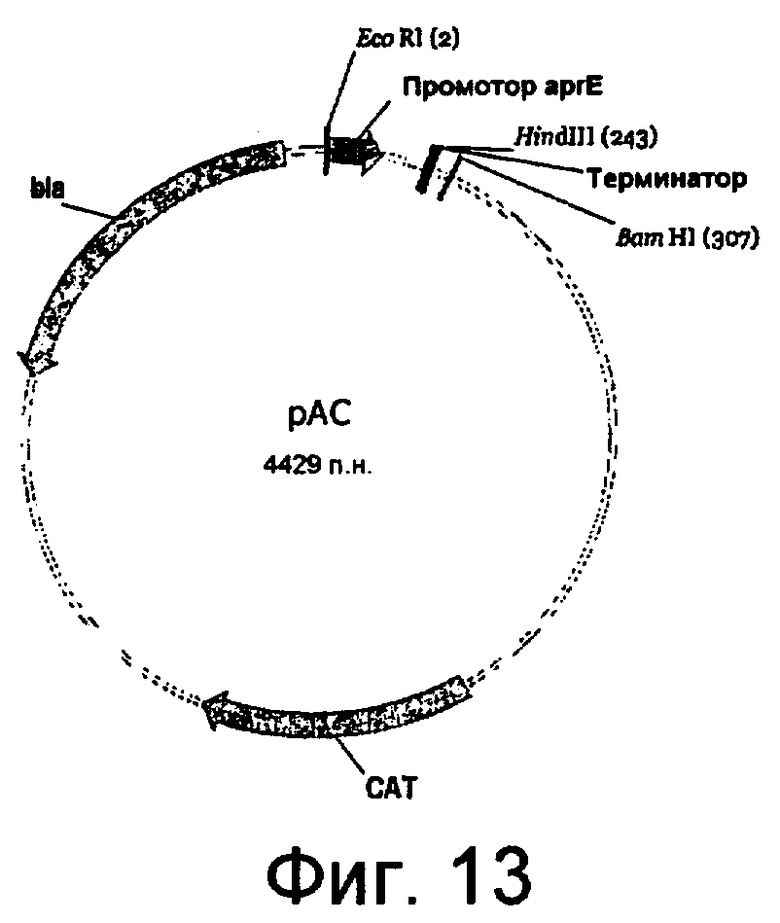
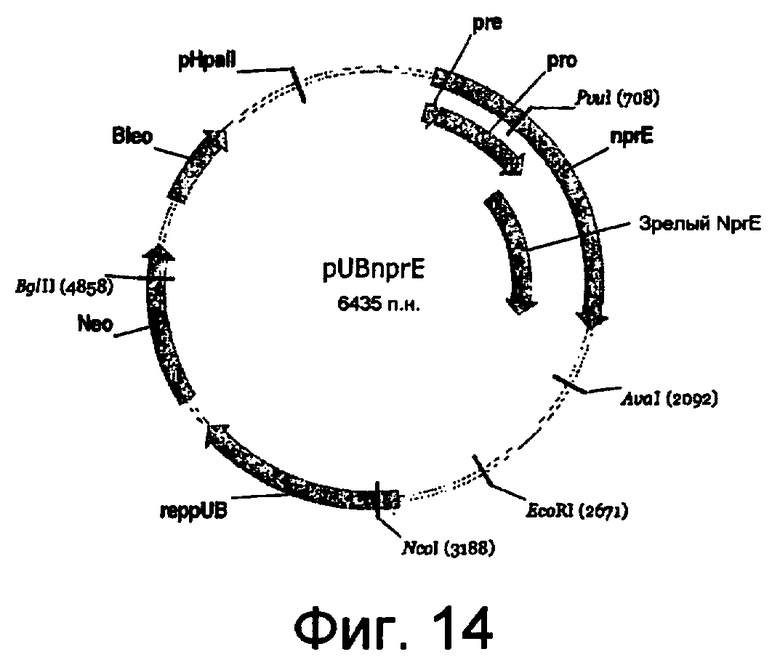
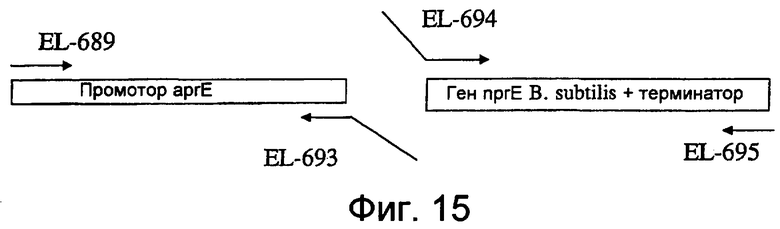
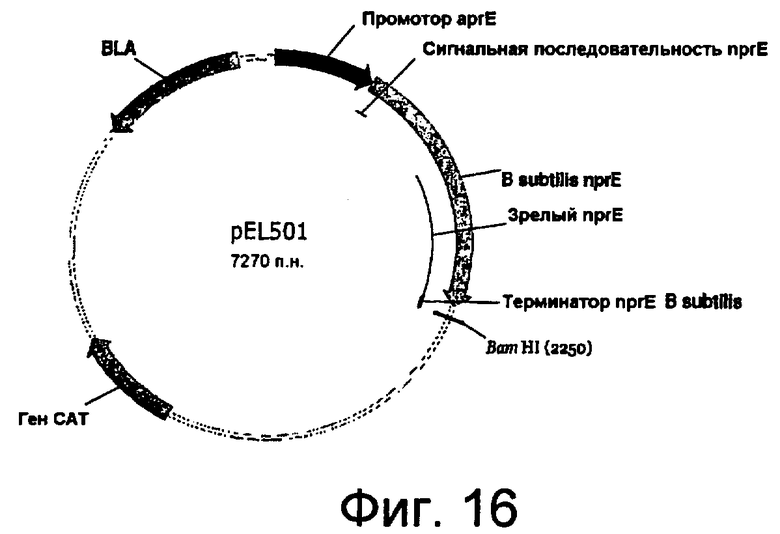
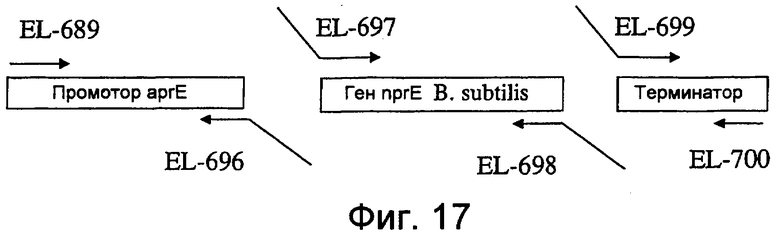
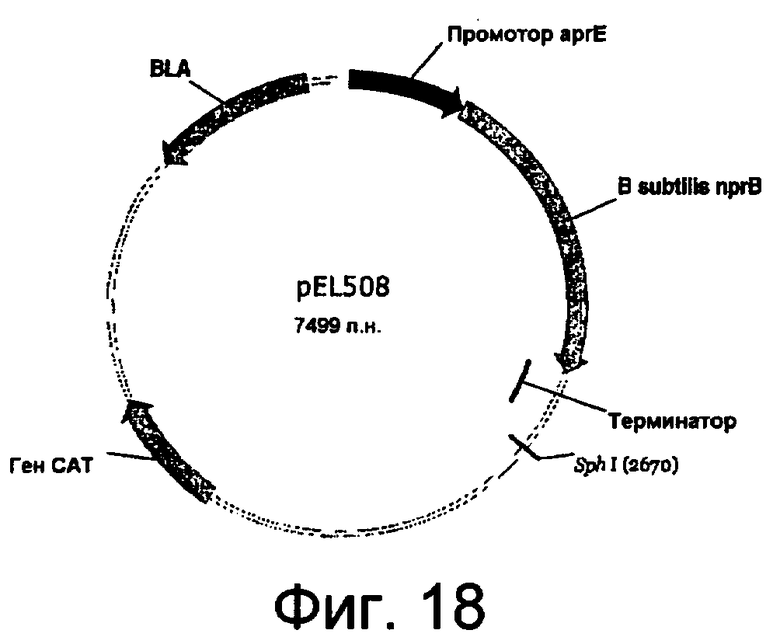
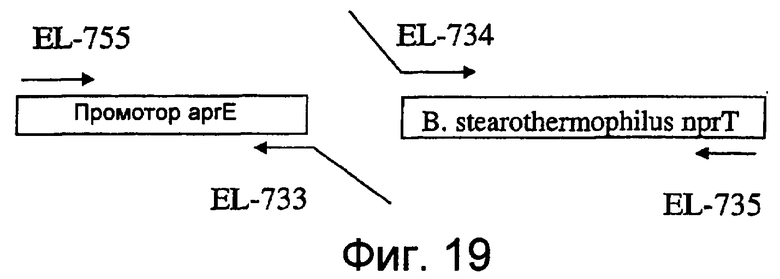

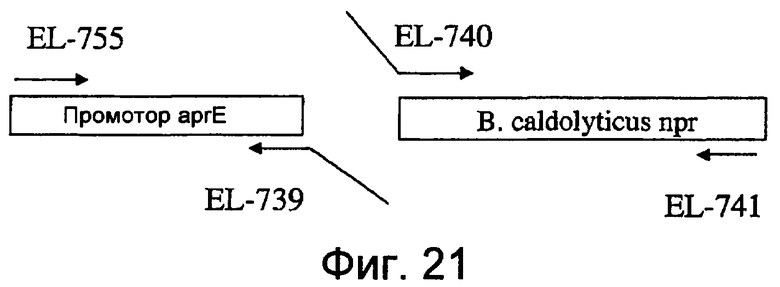

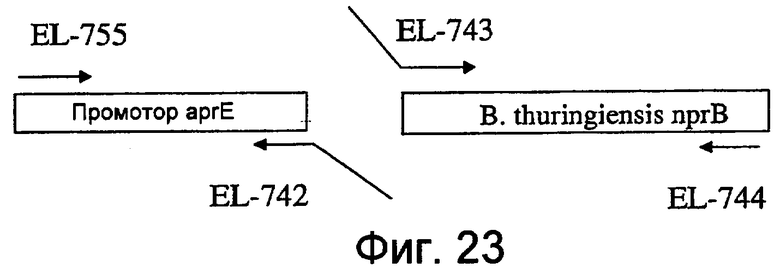
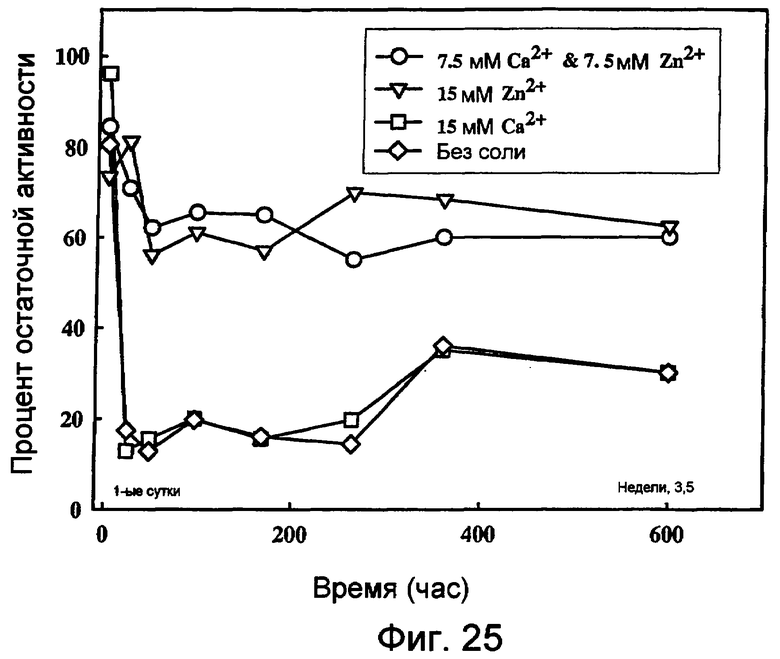
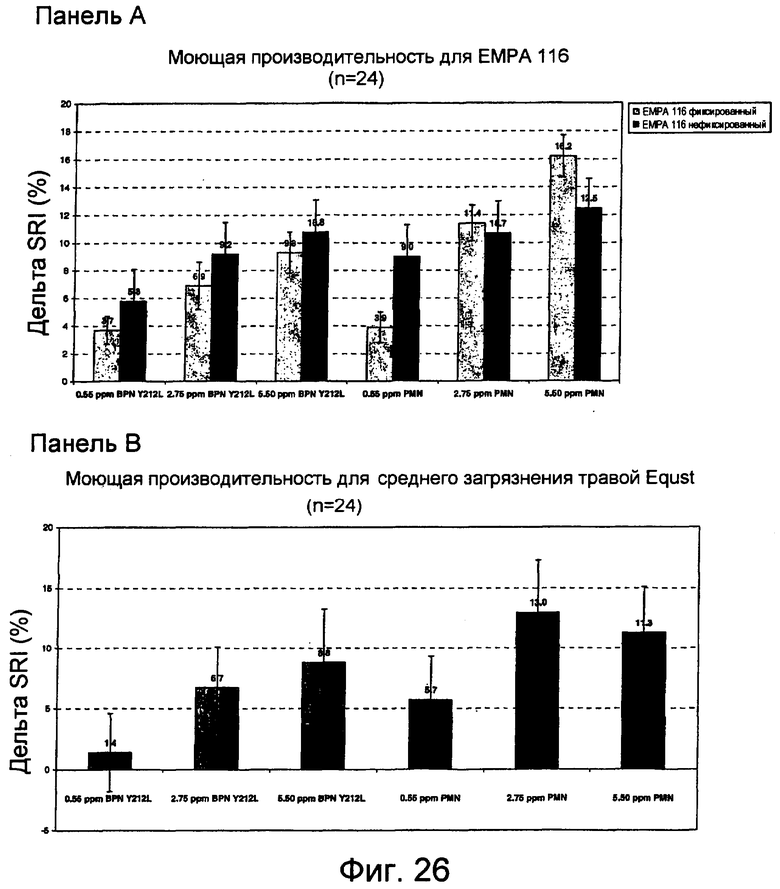
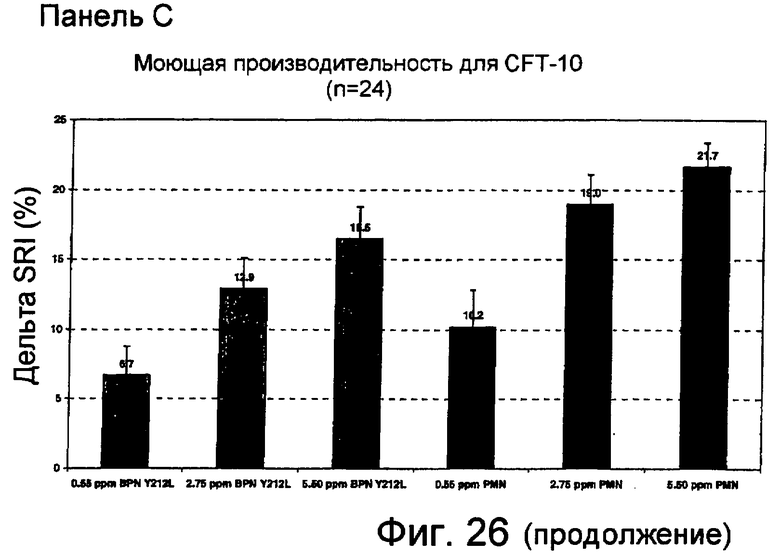
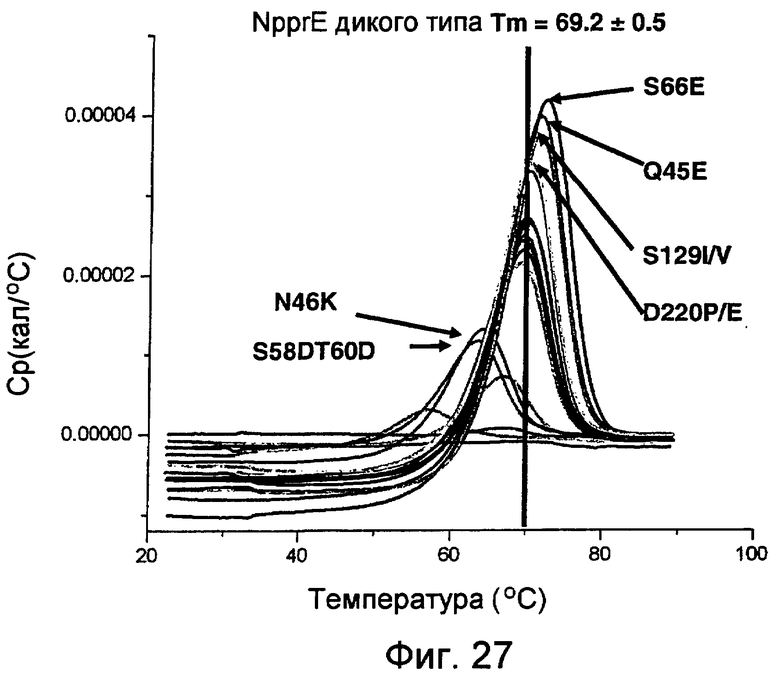
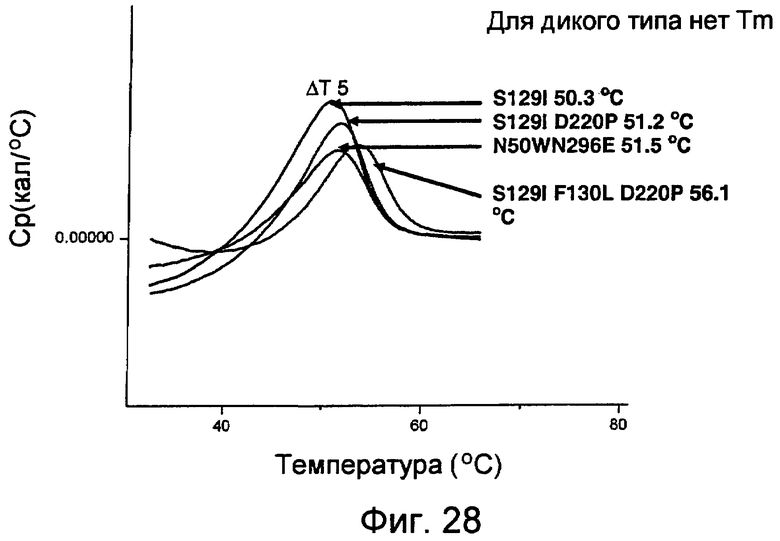
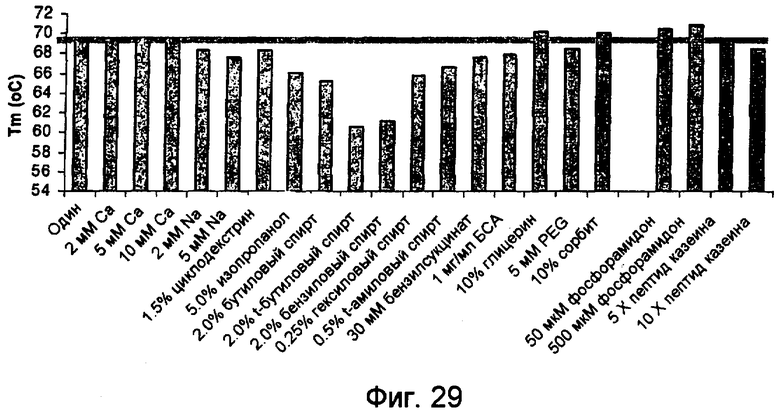
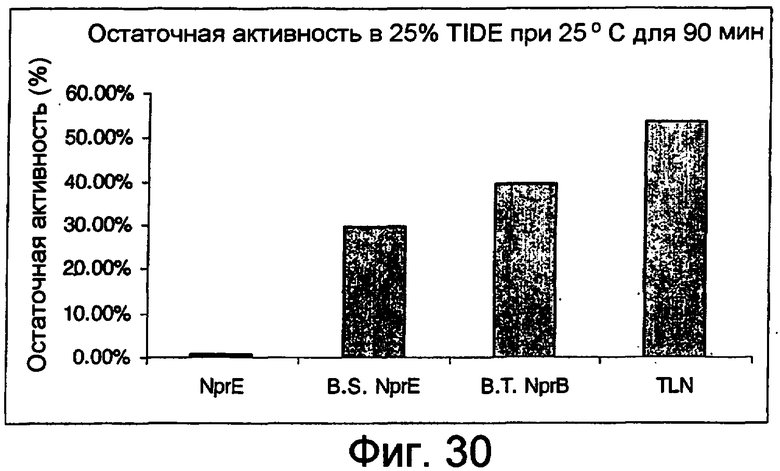
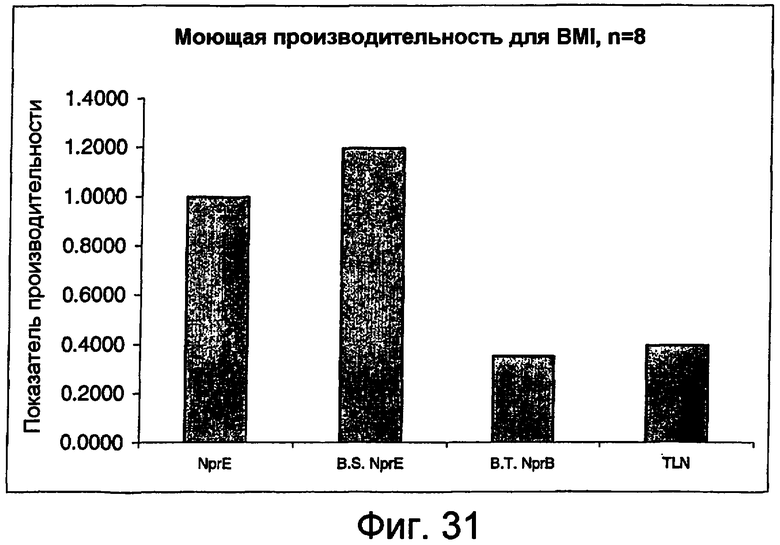
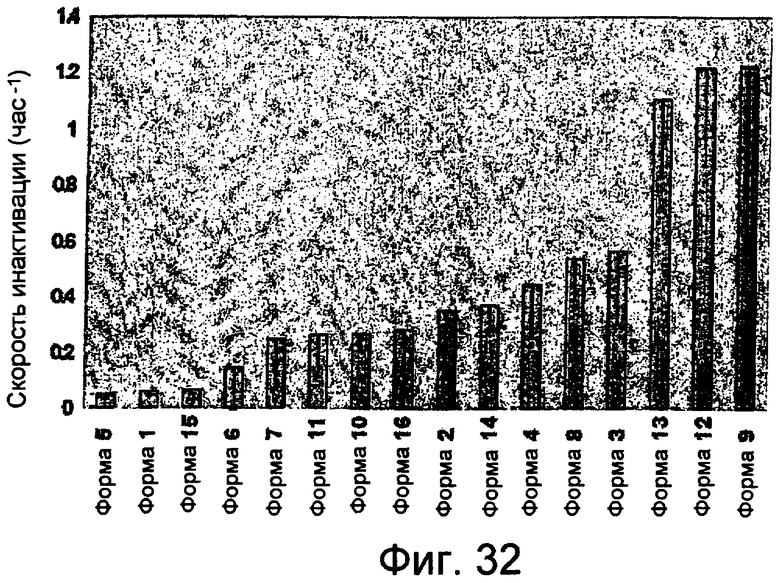
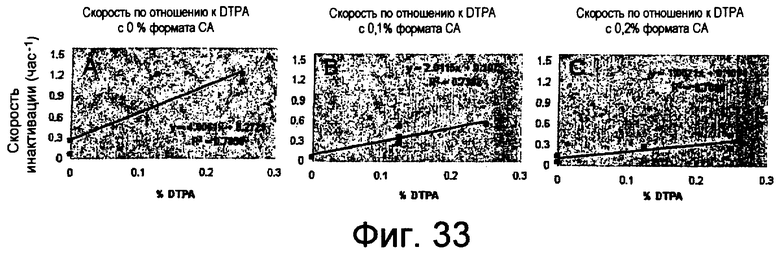
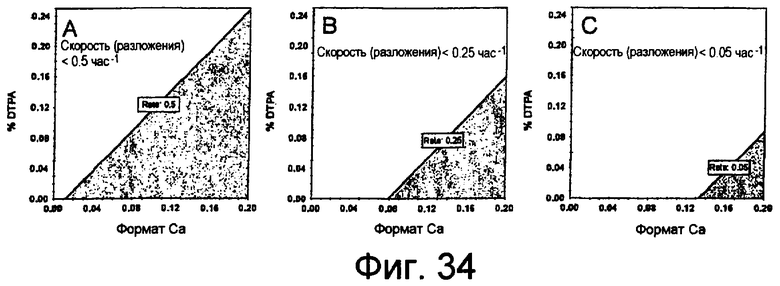

Изобретение относится к области биотехнологии. Представлен вариант нейтральной металлопротеиназы дикого типа Bacillus, обладающий, по меньшей мере, 80% идентичностью с последовательностью, представленной в описании, и имеющий мутации в аминокислотной последовательности в положениях, также раскрытых в описании. Раскрыт способ получения фермента, включающий трансформирование клетки-хозяина вектором, содержащим полинуклеотид, кодирующий один из вариантов металлопротеиназы, и культивирование трансформированной клетки в подходящих условиях. Описаны очищающая композиция, содержащая указанный фермент, и способ очистки ткани и текстиля, включающий стадию приведения поверхности и/или изделия из ткани или текстиля в контакт с очищающей композицией. Представленное изобретение позволяет расширить спектр средств, используемых для очистки поверхностей, изделий из тканей или текстиля. 8 н. и 20 з.п. ф-лы, 21 табл., 35 ил.
1. Выделенный вариант нейтральной металлопротеиназы дикого типа Bacillus, обладающий, по меньшей мере, 80% идентичностью последовательности SEQ ID NO:18 и имеющий:
(a) мутацию на аминокислотный остаток, отличный от аминокислотного остатка, встречающегося в природе, в положении, выбранном из группы, состоящей из Т4, G12, К13, Т14, S23, G24, К33, Q45, N46, R47, Y49, N50, Т54, S58, Т59, Т60, Т65, S66, Q87, N96, К97, К100, D119, G128, S129, F130I, F130K, F130L, S135, G136, S137, М138, D139, V140, Q151, Е152, N155, D178, T179, E186, V190, S191, L198, S199, Y204, G205, K211, L216, N218, T219, D220, A221, G222, Y224, T243, K244, V260, Y261, T263, S265, K269, A273, R280, L282, S285, Q286, A289, A293, N296, A297 и G299;
(b) мутацию, выбранную из группы, состоящей из Т4С, Т4Е, Т4Н, T4I, Т4К, T4L, Т4М, T4N, Т4Р, T4R, T4S, T4V, T4W, T4Y, G12D, G12E, G12I, G12K, G12L, G12M, G12Q, G12R, G12T, G12V, G12W, К13А, К13С, K13D, К13Е, K13F, K13G, К13Н, K13I, K13L, К13М, K13N, K13Q, K13S, К13Т, K13V, K13Y, T14F, T14G, Т14Н, T14I, Т14К, T14L, Т14М, Т14Р, T14Q, T14R, T14S, T14V, T14W, T14Y, S23A, S23D, S23F, S23G, S23I, S23K, S23L, S23M, S23N, S23P, S23Q, S23R, S23T, S23V, S23W, S23Y, G24A, G24D, G24F, G24G, G24H, G24I, G24K, G24L, G24M, G24N, G24P, G24R, G24S, G24T, G24V, G24W, G24Y, К33Н, Q45C, Q45D, Q45E, Q45F, Q45H, Q45I, Q45K, Q45L, Q45M, Q45N, Q45P, Q45R, Q45T, Q45W, N46A, N46C, N46E, N46F, N46G, N46H, N46I, N46K, N46L, N46M, N46P, N46Q, N46R, N46S, N46T, N46V, N46W, N46Y, R47E, R47K, R47L, R47M, R47Q, R47S, R47T, Y49A, Y49C, Y49D, Y49E, Y49F, Y49H, Y49I, Y49K, Y49L, Y49N, Y49R, Y49S, Y49T, Y49V, Y49W, N50D, N50F, N50G, N50H, N50I, N50K, N50L, N50M, N50P, N50Q, N50R, N50W, N50Y, T54C, T54D, T54E, T54F, T54G, T54H, T54I, T54K, T54L, T54M, T54N, T54P, T54Q, T54R, T54S, T54V, T54W, T54Y, S58D, S58H, S58I, S58L, S58N, S58P, S58Q, T59A, T59C, T59E, T59G, T59H, T59I, T59K, T59L, T59M, T59N, T59P, T59Q, T59R, T59S, T59V, T59W, T60D, T60F, T60I, T60K, T60L, T60N, T60Q, T60R, T60V, T60W, T60Y, T65C, T65E, T65F, T65H, T65I, T65K, T65L, T65M, T65P, T65Q, T65R, T65V, T65Y, S66C, S66D, S66E, S66F, S66H, S66I, S66K, S66L, S66N, S66P, S66Q, S66R, S66T, S66V, S66W, S66Y, Q87A, Q87D, Q87E, Q87H, Q87I, Q87K, Q87L, Q87M, Q87N, Q87R, Q87S, Q87T, Q87V, Q87W, N90C, N90D, N90E, N90F, N90G, N90H, N90L, N90R, N90T, N96G, N96H, N96K, N96R, K97H, K97Q, K97W, K100A, K100D, K100E, K100F, K100H, K100N, K100P, K100Q, K100R, K100S, K100V, K100Y, R110A, R110C, R110E, R110H, R110L, R110M, R110N, R110Q, R110S, R110Y, D119E, D119H, D119I, D119L, D119Q, D119R, D119S, D119T, D119V, D119W, G128C, G128F, G128H, G128K, G128L, G128M, G128N, G128Q, G128R, G128W, G128Y, S129A, S129C, S129D, S129F, S129G, S129H, S129I, S129K, S129L, S129M, S129Q, S129R, S129T, S129V, S129W, S129Y, F130I, F130K, F130L, F130M, F130Q, F130R, F130T, F130V, F130Y, S135P, G136I, G136L, G136P, G136V, G136W, G136Y, S137A, M138I, M138K, M138L, M138Q, M138V, D139A, D139C, D139E, D139G, D139H, D139I, D139K, D139L, D139M, D139P, D139R, D139S, D139V, D139W, D139Y, V140C, Q151I, E152A, E152C, E152D, E152F, E152G, E152H, E152L, E152M, E152N, E152R, E152S, E152W, N155D, N155K, N155Q, N155R, D178A, D178C, D178G, D178H, D178K, D178L, D178M, D178N, D178P, D178Q, D178R, D178S, D178T, D178V, D178W, D178Y, T179A, T179F, T179H, T179I, T179K, T179L, T179M, T179N, T179P, T179Q, T179R, T179S, T179V, T179W, T179Y, E186A, E186C, E186D, E186G, E186H, E186K, E186L, E186M, E186N, E186P, E186Q, E186R, E186S, E186T, E186V, E186W, E186Y, V190H, V190I, V190K, V190L, V190Q, V190R, S191F, S191G, S191H, S191I, S191K, S191L, S191N, S191Q, S191R, S191W, L198M, L198V, S199C, S199D, S199E, S199F, S199I, S199K, S199L, S199N, S199Q, S199R, S199V, Y204H, Y204T, G205F, G205H, G205L, G205M, G205N, G205R, G205S, G205Y, K211A, K211C, K211D, K211G, K211M, K211N, K211Q, K211R, K211S, K211T, K211V, K214A, K214C, K214E, K214I, K214L, K214M, K214N, K214Q, K214S, K214V, L216A, L216C, L216F, L216H, L216Q, L216R, L216S, L216Y, N218K, N218P, T219D, D220A, D220E, D220H, D220K, D220N, D220P, A221D, A221E, A221F, A221I, A221K, A221L, A221M, A221N, A221S, A221V, А221Y, G222C, G222H, G222N, G222R, Y224F, Y224H, Y224N, Y224R, T243C, T243G, T243H, T243I, T243K, T243L, T243Q, T243R, T243W, T243Y, K244A, K244C, K244D, K244E, K244F, K244G, K244L, K244M, K244N, K244Q, K244S, K244T, K244V, K244W, K244Y, V260A, V260D, V260E, V260G, V260H, V260I, V260K, V260L, V260M, V260P, V260Q, V260R V260S, V260T, V260W, V260Y, Y261C, Y261F, Y261I, Y261L, T263E, T263F, T263H, T263I, T263L, T263M, T263Q, T263V, T263W, T263Y, S265A, S265C, S265D, S265E, S265K, S265N, S265P, S265Q, S265R, S265T, S265V, S265W, K269E, K269F, K269G, K269H, K269I, K269L, K269M, K269N, K269P, K269Q, K269S, K269T, K269V, K269W, К269Y, A273C, A273D, A273H, A273I, A273K, A273L, A273N, A273Q, A273R, A273Y, R280A, R280C, R280D, R280E, R280F, R280G, R280H, R280K, R280L, R280M, R280S, R280T, R280V, R280W, R280Y, L282F, L282G, L282H, L282I, L282K, L282M, L282N, L282Q, L282R, L282V, L282Y, S285A, S285C, S285D, S285E, S285K, S285P, S285Q, S285R, S285W, Q286A, Q286D, Q286E, Q286K, Q286P, Q286R, A289C, A289D, A289E, A289K, A289L, A289R, A293C, A293R, N296C, N296D, N296E, N296K, N296R, N296V, A297C, A297K, A297N, A297Q, A297R и G299N;
(с) множественную мутацию, выбранную из группы, состоящей из S23W/G24M, T4V/S23W/G24W, S23W/G24Y/A288V, T4L/S23W/G24Y, N46Q/N50F/T54L, N50Y/T59R/S129Q, S23W/G24W, A273H/S285P/E292G, S23Y/G24Y, S23Y/G24W, T4S/S23Y/G24W, N46Q/T54K, S23W/G24Y, T4V/S23W, T59K/S66N. N46Q/N50W/T54H/T153A, T4V/S23W/G24Y, L282M/Q286P/A289R, N46Q/R47K/N50Y/T54K, L44Q/T263W/S285R, T4L/S23W/G24W, R47K/N50F/T54K, A273H/S285R, N50Y/T59K/S66Q, T54K/Q192K, N46Q/N50W, L282M/Q286K, T59K/S66Q, T4S/S23W, L282M/Q286R/A289R/K011N, L282M/A289R, N46Q/N50W/T54H, T59K/S129Q, T4S/S23N/G24Y/F210L, T4V/S23W/G24M/A289V, L282M/Q286K/A289R/S132T, N50W/T54H, L282M/Q286R, L282F/Q286K/A289R, T59R/S66Q, R47K/N50W/T54H, S265P/L282M/Q286K/A289R, L282M/Q286R/T229S, L282F/Q286K, T263W/S285R, S265P/L282M/Q286K, T263H/A273H/S285R, T059R/S129V, S32T/T263H/A273H/S285R, T59R/S66Q/S129Q, T4S/G24W, T4V/S23W/G24M/ T59K/S66Q/S129Q, L282M/Q286K/A289R/I253V, T4V/S23Y/G24W, T59R/S66N/S129Q, N50F/T54L, T4S/S23N/G24W, T59R/S66N, T59R/S66N/S129V, Q286R/A289R, N46Q/R47K/N50F/T54K, S265P/L282M/Q286P/A289R, S265P/L282M/Q286R/A289R Q62K/S66Q/S129I, S23N/G24W, N46Q/R47K/N50W/T54H, R47K/T54K, T4L/G2-4W, T14M/T59R/S129V, T59R/S66Q/N92S/S129I, R47K/N50W/T54K, T4V/G24W, N47K/N50F/T54K, S265P/L282F/Q286K/N61Y, L282F/Q286K/E159V, T4V/S23Y/G24M, S265P/L282F/A289R/T65S, T59K/F63L/S66N/S129V, T4L/S23W, N50F/T54H, T59R/S66Q/S129V, V190I/D220E/S265W/L282F, T4S/S23Y/G24M, T4L/S23N/G24Y, T59K/S66N/S129I, T59R/S66N/S129I, L282M/Q286R/A289R/P162S, N46Q/N50F/T179N, T59K/Y82C/S129V, T59K/S129I, N50Y/T54K, T59K/S66Q/V102A/S129Q, T59R/S66Q/S129I, T59W/S66N/S129V/S290R, T59R/S129I, T59K7S66Q/S129I, T59K7S66Q/S129V, S265P/L282M/Q286R/A289R/T202S/K203N, T4V/S23N/G24W, S265P/Q286K, S265P/L282F/A289R, D220P/S265W, L55F/T59W/S129V, T59R/S129Q/S191R, N50W/T54K, T4S/S23W/G24M, R47K/N50F/T54H, T59K7S66N/K88E, T59K/S66Q/S129I/V291L, L282M/Q286R/A289R, T59R/S66N/F85S/S129I, L282F/Q286P/A289R, L282F/Q286R/A289R, G99D/S265P/L282F/Q286K/A289R, N46Q/N50F, N50Y/T59W/S66N/S129V, T9I/D220P/S265N, V190F/D220P/S265W, N157Y/T263W/A273H/S285R, T263W/A273H/S285R, T263W/S285W, T4V/S23Y, N46Q/R47K/N50W, N50W/T54L, N200Y/S265P/L282F/Q286P/A289R, T59R/S66Q/P264Q, T4V/G024Y, T4L/G24Y, N50Y/S191I, N50Y/T54L, T4L/S23W/G24Y/N155K, F 169I/L282F/Q286R/A289R, L282M/Q286K/A289R, F130L/M138L/E152W/D183N, N46Q/R47K/N50Y/T54H, T4V/G24M, N50Y/T59W/S66Q/S129V, S23N/G24Y, T54H/P162Q, T4S/S23W/G24Y, N50Y/T54H, L282F/Q286R/A289R/F169I, R47K/N50W, V190F/D220P, L282M/F173Y, T4L/S23Y, N50W/A288D, V190I/D220P/S265Q, S265P/L282F/Q286P/A289R, S265P/L282F/Q286R/A289R, N46Q/N50Y/T54K, T59W/S66Q, T263W/A273H/S285W T263W/A273H/S285P, S23Y/G24M, T4L/S23N/G24W, T4V/S23N/G24Y, T59W/S66N/S129Q, T4S/S23Y, T4S/S23N/G24M, T59W/S66N/A70T, T59W/S66Q/S129Q, T263W/A273H, A273H/285P, N46Q/R47K/N50Y/T54L, N46Q/R47K/N50Y, R47K/N50Y, T263H/S285W, R47K/N50F, N46Q/R47K/N50F/T54H, S23N/G24M, T4S/G24Y, R47K/N50Y/T54H, T59W/S66N/S129I, R47K/T54L, T4S/S23W/G24W, M138L/E152F/T146S, D220P/S265N, T4S/G24M, T4V/S23N, N46Q/N50F/T54K, N46Q/N50Y/T54H, Q62H/S66Q/S129Q, T59W/S129Q, T59W/S129V, N50F/T54K, R47K/N50F/T54L, V190I/D220P/S265W, N112I/T263H/A273H/S285R, T59W/S66N/S129V, T59W/S66Q/S129I, T59W/S129I, T263W/S285P, V190I/D220P, A289V/T263H/A273H, T263H/A273H/S285P, N90S/A273H/S285P, R47K/N50Y/T54L, T4S/S23N, T59R/S129Q, N46Q/R47K/T54H, T59W/S66Q/S129V, E152W/T179P, N50Y/S66Q/S129V, T202S/T263W/A273H, T263W/A273H/S285P, M138L/E152W/T179Р, N46Q/R47K, N46Q/T54H/F176L, T4L/G24M, T4S/L282M, Т263Н/А273Н, T263H/A273H/S285W, T4L/S23Y/G24M, L282F/Q286P, T4V/S23Y/G24Y, V190F/S265W, M138L/E152F, V190F/D220E/S265W, N46Q/N50F/T54H, N157Y/S285W, T4F/S23Y/G24M, T4V/S23N/G24M, L198I/D220E/S265Q, N46Q/N50Y/T54K/A154T, S16L/D220E/S265W, D220E/S265W, D220E/A237S/S265W, S66Q/S129Q, V190F/D220E/S265Q/T267I, L282M/F173Y/T219S, E152F/T179P, V190I/S265W, M138L/S66Q, M138L/E152W, T59W/S66Q/A70T/S129I, V190F/D220E/S265N, V190F/S265N, N46Q/N50Y и M138L/E152F/T179P;
(d) множественную мутацию, выбранную из группы, состоящей из V190I/D220P, V190I/D220P/S265Q, V190L/D220E, V190I/D220E/S265Q, V190I/D220E/S265W/L282F, V190L/D220E/S265Q, V190I/D220E/S265W, V190L/D220E/S265N, T59R/S66Q/S129I, V190I/D220E/S265N, V190L/D220E/S265W, V190I/D220E, T59W/S66N/S129V, T59K/S66Q/S129V, T59K/Y82C/S129V, T59R/S66N/S129I, S66Q/S129V, T59R/S66Q/S129V, T59R/S129I, N50Y/T59W/S66N/S129V, D220P/S265N, S66Q/S129I, T59W/S66Q/S129V, T59K/S66Q/S1291, T59R/S129V, N50Y/S66Q/S129V, T59W/S66Q/S1291, N50Y/T59W/S66Q/S129V, T59K/S129I, D220P/S265W, F130L/M138L/T179P, S66N/S129I, T59R/S66N/S129V, F130I/M138L/T179P, T59R/S66Q/N92S/S129I, S66N/S129V, D220E/S265Q, F130L/M138L/E152W/T179P, T59W/S129V, S265P/L282M/Q286R/A289R, S265P/L282F/Q286R/A289R, T59W/S66N/S129I, V190I/D220P/S265W, F130L/E152W/T179P, F130L/M138L/E152F/T179P, Q62K/S66Q/S129I, T59K/S66N/S129I, E152H/T179P, S265P/L282M/Q286K/A289R, F130L/M138L/E152H/T179P, T263W/A273H/S285R, D220E/S265N, F130I/M138L/E152H/T179P, F130V/M138L/E152W/T179P, F130I/M138L/E152W/T179P, T59W/S129I, D220E/S265W, F130V/M138L/T179P, F130L/E152V/T179P, T59R/S129Q, T263W/S285P, F130I/M138L/E152F/T179P, E152W/T179P, V190L/S265Q, F130L/E152F/T179P, L282M/Q286R/A289R/P162S, D220P/S265Q, M138L/E152F/T179P, F130I/E152H/T179P, M138L/E152W/T179P, F130L/T179P, F130L/M138L/E152W/T179P/Q286H, F130L/M138L/E152H, T263W/A273H/S285W, S265P/Q286K, T59W/S66Q/S129Q, T263W/S285R, T59W/S66N/S129Q, T263W/S285W, T59R/S66N/S129Q, S265P/L282M/Q286R/A289R/T202S/K203N, T59W/S129Q, Q62H/S66Q/S129Q, L282M/Q286R/A289R, V190L/D220E/S265N/V2911, V190L/S265N, F130L/M138L/E152W, N50Y/T59R/S129Q, F130I/T179P, T59K/S66Q/S129Q, T59K/S129Q, S265P/L282M/Q286P/A289R, S265P/L282F/Q286P/A289R, T263W/A273H/S285P, S265P/L282M/Q286K, S16L/D220E/S265W, S66Q/S129Q, S265P/L282M/Q286P, L282F/Q286R/A289R, F130V/E152W/T179P, L44Q/T263W/S285R L55F/T59W/S129V, V190L/S265W, Q286R/A289R, G99D/S265P/L282F/Q286K/A289R, F130L/M138L/E152F, T59R/S66Q/S129Q, F130L/E152H, S66N/S129Q, T4S/S23N/G24M/K269N, S265P/L282M, E152F/T179P, T59W/S66N/S129V/S290R, L282F/Q286K/A289R, F130L/M138L, F130I/M138L/E152W, S265P/L282F, F130I/M138L/E152H, F130V/M138L/E152H, V190I/S265Q, M138L/E152M, S265P/L282F/Q286P, M138L/E152H, T59K/S66N/K88E, V190I/S265W, F130L/E152W, L282M/Q286K/A289R, L282M/Q286K/A289R/I253V, T263W/A273H, V190I/S265N, M138L/E152W, A273H/S285R, F130I/M138L, F130L/E152F, F130V/M138L/E152W, T59K/S66Q/V102A/S129Q, F130V/E152H/T179P, F130I/M138L/E152F, F130V/M138L/E152F, M138L/E152F, L282M/Q286R, F130I/E152H, S265P/L282F/A289R/T65S, T263H/A273H/S285R, F130V/M138L, T14M/T59R/S129V, L282M/Q286R/A289R/K11N, A273H/S285P, L282M/Q286K/A289R/S132T, T263H/A273H/S285W, F130V/E152W, S265P/L282F/Q286K/N61Y, F130I/E152W, L198I/D220E/S265Q, V190I/S265L, T263H/S285W, S265P/L282F/A289R, M138L/S66Q, F130I/E152F, N90S/A273H/S285P, S32T/T263H/A273H/S285R, L282F/Q286P/A289R, N157Y/T263W/A273H/S285R, V105A/S129V, T263H/A273H/S285P, S129Q/L282H, T59W/S066Q, F130V/E152H, S23W/G024Y, T4V/S23N, T59R/S66Q, N50W/T54L, L282M/Q286P/A289R, A115V/V190L/S265W, L282M/Q286K, T59R/S66N, L282F/Q286P, T4V/S23W/G24M, S265P/L282F/Q286R/L78H, L282F/Q286K, T4V/S23W/G24Y, S23W/G24M, T59R/R256S, F130V/E152F, T4V/G24W, N50W/T54K, S23Y/G24M, T4V/S23Y, T4V/S23Y/G24M, N50Y/T54H, S23W/G24W, T4V/S23Y/G24Y, T4V/S23N/G24W, F130L/M138L/E152F/T179P/V291I, N50Y/T59K/S66Q, T4V/S23Y/G24W, T59K/S66N, T4V/S23N/G24Y, S23Y/G24W, N50F/T54L, R47K/T54K, S23N/G24W, L282M/A289R, S23Y/G24Y, T4V/G24M, R47K/N50F/T54K, N50F/T54K, T59K/S66Q, S23N/G24M, S23N/G24Y, T4L/S23N, R47K/N50W/T54H, T4L/S23W/G24Y, T4S/S23W, N46Q/N50W/T54H/A142T, T4L/S23Y, T4V/S23W, N50W/T54H, T4S/S23N, T4S/L282M, T4L/S23W, N50F/T54H, N50Y/T54L и R47K/N50W/T54K; или
(е) множественную мутацию, выбранную из группы, состоящей из S66Q/S129V, S66Q/S129I, N50Y/S66Q/S129V, S66N/S129I, T59K/S66Q/S129V, S66N/S129V, F130L/E152W/T179P, S265P/L282M/Q286R/A289R, F130L/E152V/T179P, T59K/S66Q/S129I, T263W/S285P, T59K/S66N/S129I, T263W/A273H/S285P, S265P/L282F/Q286R/A289R, F130V/E152W/T179P, T263W/A273H/S285R, V190I/D220P/S265W, F130L/E152H, S66N/S129Q, S265P/L282M/Q286K/A289R, V190I/D220E, T59R/S66N/S129I, V190I/D220E/S265W, T59K/S129I, T59R/S66Q/S129I, F130I/M138L/E152H/T179P, F130I/T179P, T263W/A273H/S285W, S16L/D220E/S265W, S66Q/S129Q, V190I/D220E/S265Q, T59R/S66Q/S129V, D220E/S265N, V190L/D220E, D220E/S265W, V190I/D220P, V190L/D220E/S265N, L44Q/T263W/S285R, S265P/L282M/Q286P/A289R, F130L/M138L/E152H/T179P, T263W/S285R, L282M/Q286R/A289R, T263W/S285W, F130I/E152H/T179P, V190I/D220E/S265N, V190L/D220E/S265W, V190I/D220P/S265Q, T59R/S66N/S129V, V190L/D220E/S265Q, Е152Н/Т179Р, F130L/M138L/E152F/T179P, Q62H/S66Q/S129Q, T59R/S129V, V190I/D220E/S265W/L282F, V190I/S265Q, F130L/E152F/T179P, D220E/S265Q, E152W/T179P, T59K/S66Q/S129Q, F130L/M138L/T179P, F130I/M138L/E152F/T179P, F130L/M138L/E152W/T179P, N50Y/T59W/S66Q/S129V, S265P/L282M/Q286K, T59R/S129I, F130V/E152H/T179P, D220P/S265N, S265P/L282M/Q286P, F130I/E152H, T59R/S66Q/N92S/S129I, F130L/T179P, G99D/S265P/L282F/Q286K/A289R, T263W/A273H, V190I/S265N, D220P/S265W, F130L/E152W, F130L/M138L/E152H, S265P/L282M, V190I/S265Q, F130L/E152F, T59K/S129Q, Q286R/A289R, M138L/E152W/T179P, F130I/M138L/E152H, D220P/S265Q, V190L/S265N, F130I/M138L/E152W, S265P/Q286K, V190L/S265Q, V190I/S265W, F130L/M138L/E152F, F130V/E152H, E152F/T179P, N50Y/T59W/S66N/S129V, T59R/S66N/S129Q, F130I/E152W, F130V/E152W, T59R/S66Q/S129Q, T263H/A273H/S285P, N90S/A273H/S285P, V190L/D220E/S265N/V291I, T59R/S129Q, A273H/S285P, F130I/M138L/E152W/T179P, F130V/M138L/E152F, N50Y/T59R/S129Q, T59W/S66Q/S129I, F130V/M138L/T179P, F130V/M138L/E152W/T179P, V190L/S265W, F130V/M138L/E152W, T59W/S66Q/S129V, V190I/S265Q, F130V/M138L/E152H, F130I/E152F, N157Y/T263W/A273H/S285R, T263H/S285W, M138L/E152F/T179P, A115V/V190L/S265W, M138L/E152M, T263H/A273H/S285W, F130L/M138L/E152W, T59K/S66N/K88E, F130I/M138L/E152F, F130I/M138L/T179P, T4V/S23N, T59K/S66Q/V102A/S129Q, F130L/M138L, N47K/N50F/T54K, T263H/A273H/S285R, F130L/M138L/E152W/T179P/Q286H, M138L/E152H, M138L/S66Q, L282M/Q286R/A289R/P162S, L282F/Q286R/A289R, Q62K/S66Q/S129I, A273H/S285R, S265P/L282F/Q286P, S265P/L282F/Q286P/A289R, S265P/L282M/Q286R/A289R/T202S/K203N, T59W/S66N/S129I, V190I/S265L, T59W/S66N/S129V, F130I/M138L, L282M/Q286K/A289R/I253V, R47K/N50F/T54K, M138L/E152F, N50W/T54K, L198I/D220E/S265Q, L282F/Q286K/A289R, N50F/T54K, L282M/Q286R, M138L/E152W, S265P/L282F, F130V/E152F, T59W/S66N/S129Q, F130V/M138L, Т263Н/А273Н, L282M/Q286K/A289R, N46Q/N50W/T54H/A142T, T59W/S66Q/S129Q, S265P/L282F/A289R/T065S, N50F/T54H, S129Q/L282H, L282M/Q286K/A289R/S132T, L282M/Q286R/A289R/K11N, T59K/S66N, R47K/N50W/T54K, T59K/S66Q, T4V/S23Y, T59W/S66N/S129V/S290R, N50Y/T59K/S66Q и R47K/N50Y;
где вариант металлопротеиназы обладает, по меньшей мере, одним улучшенным свойством по сравнению с металлопротеиназой дикого типа, выбранным из улучшенной стабильности и улучшенной производительности,
где номера аминокислот относятся к SEQ ID NO:18.
2. Вариант металлопротеиназы по п.1, где указанный Bacillus представляет собой В. amyloliquefaciens.
3. Нейтральная металлопротеиназа, имеющая аминокислотную последовательность, указанную в SEQ ID NO:18.
4. Вариант нейтральной металлопротеиназы по п.1, где улучшенная производительность представляет собой улучшенную термостабильность по сравнению с металлопротеиназой дикого типа.
5. Вариант нейтральной металлопротеиназы по п.1, где улучшенная производительность представляет собой улучшенную производительность в условиях более низкого или более высокого рН по сравнению с нейтральной металлопротеиназой дикого типа.
6. Вариант нейтральной металлопротеиназы по п.1, где улучшенная производительность представляет собой улучшенную устойчивость к автолизу по сравнению с металлопротеиназой дикого типа.
7. Способ получения фермента, обладающего активностью нейтральной металлопротеиназы, включающий
трансформирование клетки-хозяина экспрессионным вектором, содержащим полинуклеотид, кодирующий вариант металлопротеиназы по п.1, и
культивирование указанной трансформированной клетки-хозяина в условиях, подходящих для продуцирования указанной нейтральной металлопротеиназы.
8. Способ по п.7, дополнительно включающий стадию сбора указанной продуцированной нейтральной металлопротеиназы.
9. Способ по п.7, где указанная клетка-хозяин представляет собой разновидность Bacillus.
10. Очищающая композиция, содержащая, по меньшей мере, один вариант металлопротеиназы по п.2, где указанная композиция дополнительно содержит, по меньшей мере, один ион кальция и/или ион цинка.
11. Очищающая композиция, содержащая вариант металлопротеиназы по п.1 и, по меньшей мере, один стабилизатор.
12. Композиция по п.11, где указанный стабилизатор выбран из группы, состоящей из боракса, глицерина, ионов цинка, ионов кальция и формата кальция.
13. Композиция по п.11, где указанный стабилизатор представляет собой, по меньшей мере, один конкурентный ингибитор, стабилизирующий, по меньшей мере, один вариант металлопротеиназы в присутствии анионного поверхностно-активного вещества.
14. Композиция для очистки ткани или текстиля, содержащая эффективное количество варианта металлопротеиназы по п.1.
15. Очищающая композиция по п.14, где указанная очищающая композиция представляет собой моющее средство.
16. Очищающая композиция по п.14, дополнительно содержащая, по меньшей мере, один дополнительный фермент или производное фермента, выбранные из протеазы, амилазы, липазы, маннаназы, пектиназы, кутиназы, оксидоредуктазы, гемицеллюлазы и целлюлазы.
17. Очищающая композиция по п.15, где указанная композиция содержит, по меньшей мере, приблизительно 0,0001 мас.% указанного варианта металлопротеиназы.
18. Очищающая композиция по п.17, где указанная композиция содержит от приблизительно 0,001 до приблизительно 0,5 мас.% указанного варианта металлопротеиназы.
19. Очищающая композиция по п.17, где указанная композиция дополнительно содержит, по меньшей мере, один вспомогательный ингредиент.
20. Очищающая композиция по п.12, дополнительно содержащая достаточное количество модификатора рН для обеспечения точного рН композиции от приблизительно 3 до приблизительно 5, где композиция является, по существу, свободной от материалов, гидролизующихся при рН от приблизительно 3 до приблизительно 5.
21. Очищающая композиция по п.20, где указанные материалы, гидролизующиеся при рН от приблизительно 3 до приблизительно 5, содержат, по меньшей мере, одно поверхностно-активное вещество.
22. Очищающая композиция по п.21, где указанное поверхностно-активное вещество представляет собой поверхностно-активное вещество алкилсульфат натрия, содержащее группу этиленоксида.
23. Очищающая композиция по п.22, где указанная композиция представляет собой жидкость.
24. Очищающая композиция по п.23, дополнительно содержащая, по меньшей мере, один устойчивый к кислоте фермент.
25. Способ очистки ткани или текстиля, включающий в себя стадию приведения поверхности и/или изделия, содержащего ткань или текстиль, в контакт с очищающей композицией по п.24.
26. Способ по п.25, дополнительно включающий в себя стадию ополаскивания указанной поверхности и/или материала после контакта указанной поверхности или материала с указанной очищающей композицией.
27. Способ по п.25, где указанная поверхность и/или изделие, содержащее ткань или текстиль, содержит загрязнение травой, и указанная стадия приведения в контакт включает в себя приведение указанного загрязнения травой в контакт с указанной очищающей композицией.
28. Композиция для обработки текстиля, содержащая эффективное количество варианта металлопротеиназы по п.1.
| DATABASE: GenBank, AAA01639.1, 21.05.1993 | |||
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛ(АРИЛ) ГАЛОИДСИЛАНОВ, СОДЕРЖАЩИХ АДАМАНТИЛЬНЫЙ РАДИКАЛ | 0 |
|
SU405901A1 |
| Расширяющееся вяжущее | 1980 |
|
SU958368A1 |
| Устройство для измерения параметров движения нити | 1981 |
|
SU970225A1 |
| ВАРИАНТ СУБТИЛИЗИНА BACILLUS (ВАРИАНТЫ), КОДИРУЮЩАЯ ЕГО ДНК, ЭКСПРЕССИРУЮЩИЙ ВЕКТОР И ОЧИЩАЮЩАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2252254C2 |
Авторы
Даты
2011-11-10—Публикация
2006-10-12—Подача