Область изобретения
Настоящее изобретение относится к новым соединениям с антибиотической активностью.
Предшествующий уровень техники
Группу близкородственных пептидных антибиотиков, продуцируемых в естественных условиях Bacillus subtilis и Bacillus licheniformis, называют бацитрацинами. Бацитрацины активны в основном в отношении многих видов грамположительных бактерий и некоторых из грамотрицательных бактерий.
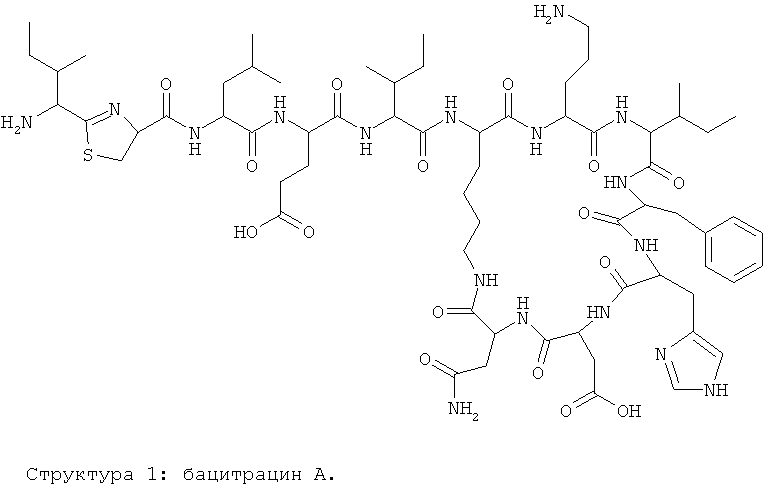
Идентифицированы различные бацитрацины, среди которых бацитрацин А имеет первостепенное значение и является высокоактивным (Epperson and Ming, Biochemistry, vol.39, №14, 2000, page 4037-45). Бацитрацин А представляет собой разветвленный циклический додекапептидолактамный антибиотик, который синтезируется посредством протекающего с образованием тиоэфирной связи матричного механизма нерибосомального пептидного синтеза (Wagner et al., J. Am. Chem. Soc. vol.128, 2006, page 10513-10520 и Kleinkauf and von Döhren, Eur. J. Biochem., vol.192, №1, 1990, page 1-15).
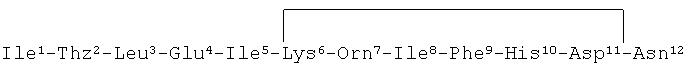
Первичная структура бацитрацина А представляет собой последовательность NH2-L-Ile1-L-тиазолин2-L-Leu3-D-Glu4-L-Ile5-L-Lys6-D-Orn7-L-Ile8-D-Phe9-L-His10-D-Asp11-L-Asn12-COOH, которая циклизуется через ε-аминогруппу L-Lys6 и R-карбоксильную группу L-Asn12 (Wagner et al., J. Am. Chem. Soc., vol.128, page 10513-10520, 2006).
Ming и соавт. (Journal of Inorganic Biochemistry, vol.91, 2002) описали бацитрацины как пептидные соединения следующей формулы:
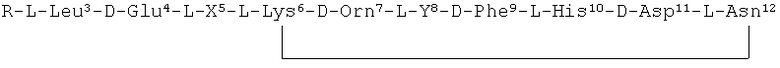
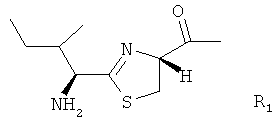
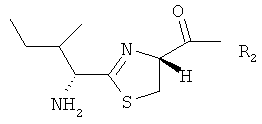
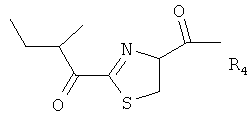
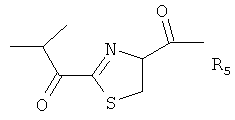 ,
,
где
X представляет собой Ile или Val,
и
Y представляет Ile или Val.
В частности, R1 и R3 представляют собой N-концевые группировки активных бацитрацинов, в то время как R4 и R5 представляют собой окисленные N-концевые группировки менее активных бацитрацинов. Вместе с тем R2 соответствует неактивному стереоизомеру.
Предшествующий уровень техники
Ikai и соавт. предположили, что активность бацитрацинов может зависеть от гидрофобности:
"Сравнение величин MIC (минимальных ингибирующих концентраций) и предполагаемых структур минорных компонентов подтверждает, что местоположение валина влияет на активность каждого компонента в следующем порядке убывания: N-конец, семичленное пептидное кольцо и б группировка боковой цепи пептида. Поскольку этот порядок связан с порядком элюирования минорных компонентов при HPLC, активность может зависеть от гидрофобности соответствующего компонента" (см. Ikai et al., Journal of Antibiotics, vol.48, №3, 1995. page 233-242).
Wagner и соавт. предложили введение новых гетероциклов в бацитрацин А для преодоления существующих ограничений, связанных с применением бацитрацина (Journal of the American Chemical Society, vol.128, №32, 2006, page 10513-10520).
Некоторые нерибосомально синтезируемые пептиды содержат необычные аминокислоты. Например, циклоспорин А содержит 2(S)-амино-3(R)-гидрокси-4(R)-метил-6(E)-октановую кислоту, которая важна для связывания с внутриклеточным рецептором циклофилина и ввиду этого для его иммуносупрессорной активности (Offenzeller et al., Journal of Biological Chemistry, vol.268, №35, 1993).
Некоторые редко встречающиеся аминокислоты похожи по структуре на изолейцин:
- 2-амино-5-метил-5-гексеновая кислота, новый аналог метионина, была выделена из ферментационного бульона стрептомицетов (Takeuchi et al., Journal of Antibiotics, vol.32, №11, page 1118-1124, 1979);
- 4-метилен-норлейцин и 2-аминогепт-6-еновая кислота представляют собой соединения формулы: C7H13NO2;
- 4-метил-норлейцин представляет собой производное изолейцина, которое может быть введено в рекомбинантный белок (Muramatsu et al., J. Pharm. Biomed. Anal., vol.31, №5, 2003, page 979-987);
- 2-амино-3-метил-4-пентеновая кислота представляет собой ненасыщенный аналог изолейцина, который может быть введен в белки (Mock et al., Chembiochem., vol.7, №1, 2006, page 83-87);
- ненасыщенные норлейцины Amanita solitaria (мухомор одинокий). В результате химических и фармакологических исследований открыта 2-амино-гекс-5-еновая кислота (Chilton et al., Lloydia, vol.36, №2, 1973, page 69-73);
- бета-метилнорлейцин, антиметаболит, продуцируемый Serratia marcescens (Sugiura et al., J. Antibiot., vol.34, №10, 1981, page 1278-82).
Сущность изобретения
В одном из аспектов данное изобретение относится к новым бацитрациновым соединениям. Более конкретно оно относится к новым бацитрациновым соединениям, содержащим аминокислоту с прежде неизвестной боковой цепью.
Без привязки к теории авторы изобретения предполагают, что в Bacillus subtilis и Bacillus licheniformis эта боковая цепь образуется в результате химической модификации бацитрацина или в результате встраивания прежде неизвестной природной аминокислоты.
Систематическим названием представляющего собой α-аминокислоту соединения, содержащего новую боковую цепь, является 2-амино-3-метил-5-гексеновая кислота, и ее молекулярная формула соответствует C7H13NO2.
Авторы изобретения предлагают и используют название 5-метилен-изолейцин для 2-амино-3-метил-5-гексеновой кислоты. Соответственно, боковая цепь 5-метилен-изолейцина имеет структуру -CH(CH3)CH2CH=CH2.
Таким образом, данное изобретение относится к новым бацитрациновым соединениям с антибактериальной активностью, содержащим по меньшей мере один остаток 5-метилен-изолейцина. Такие бацитрацины содержат по меньшей мере одну боковую цепь 5-метилен-изолейцина. Боковая цепь 5-метилен-изолейцина может быть представлена как:
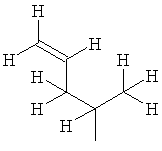 или
или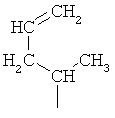 .
.
Данное изобретение относится к бацитрациновым соединениям с антибактериальной активностью, содержащим одну или более боковых цепей 5-метилен-изолейцина.
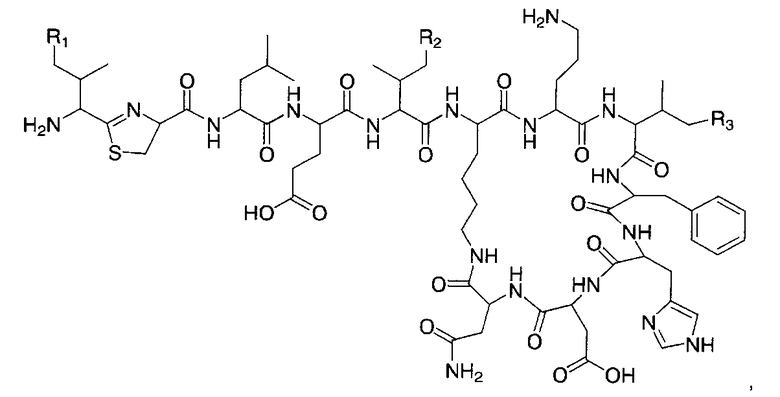
Бацитрацины по изобретению содержат по меньшей мере один остаток 5-метилен-изолейцина в положении 1, и/или 5, и/или 8. Такие соединения имеют следующую структуру:
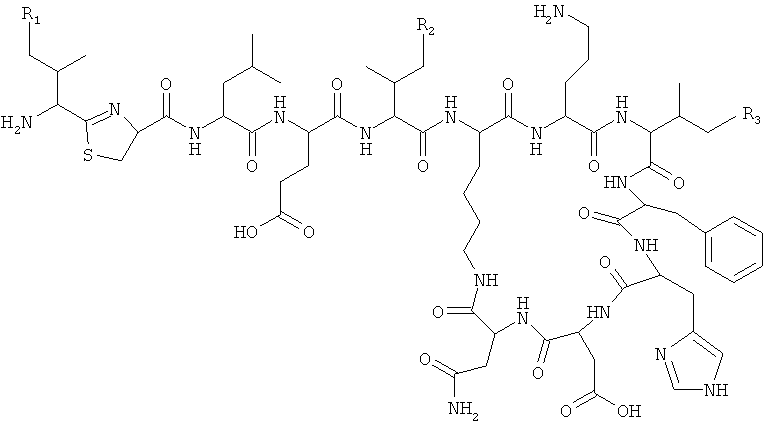 ,
,
где
по меньшей мере один из R1, R2 и R3 представляет собой -CH=CH2
и где
R1, R2 и R3 независимо представляют собой -H, -CH3 или -CH=CH2.
Приведенную выше структуру следует интерпретировать как охватывающую бацитрацин А в случае, если R1, R2 и R3 все представляли собой -CH3.
Соответственно, бацитрацин А будет представлен как:
 .
.
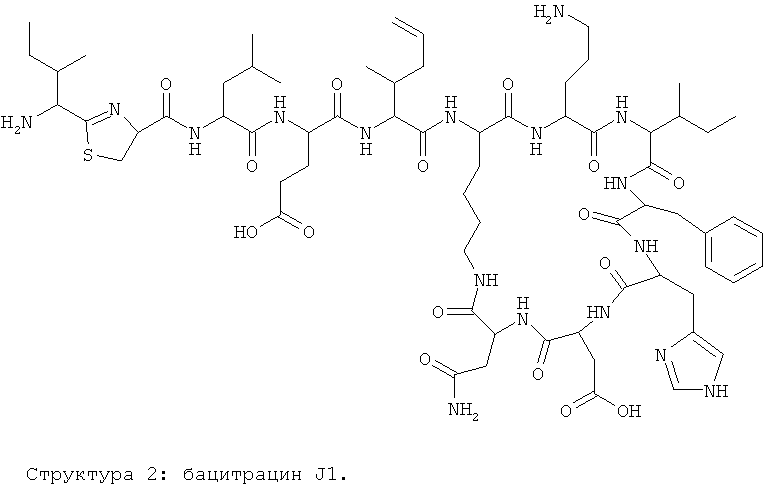
Авторы изобретения предлагают и используют название бацитрацин J1 для бацитрацинов по изобретению, содержащих остаток 5-метилен-изолейцина в положении 5. Эта номенклатура основывается на порядке элюирования с C18-колонки.
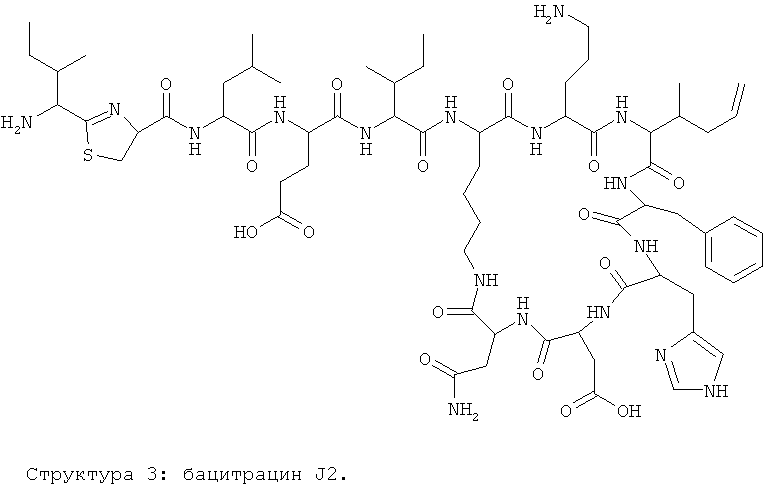
Авторы изобретения предлагают и используют название бацитрацин J2 для бацитрацинов по изобретению, содержащих остаток 5-метилен-изолейцина в положении 8. Эта номенклатура основывается на порядке элюирования с C18-колонки.
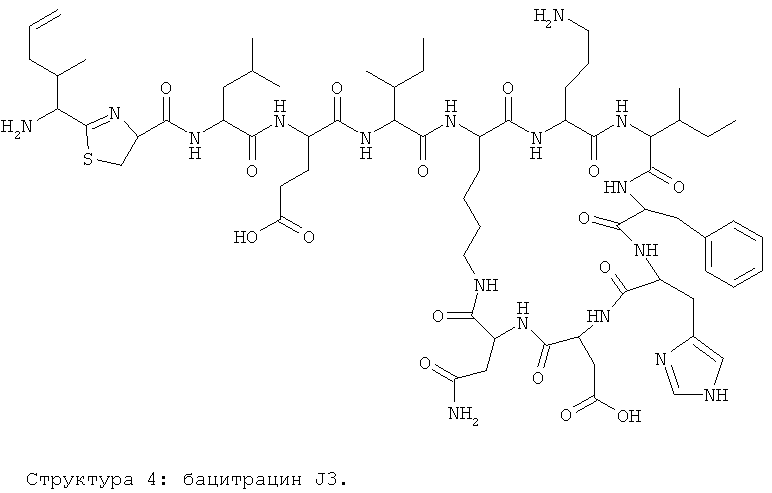
Авторы изобретения предлагают и используют название бацитрацин J3 для бацитрацинов по изобретению, содержащих остаток 5-метилен-изолейцина в положении 1. Эта номенклатура основывается на порядке элюирования с С18-колонки.
Авторы изобретения предлагают и используют название бацитрацин K1 для бацитрацинов по изобретению, содержащих остатки 5-метилен-изолейцина в положениях 5 и 8. Эта номенклатура основывается на порядке элюирования с С18-колонки.
Авторы изобретения предлагают и используют название бацитрацин K2 для бацитрацинов по изобретению, содержащих остатки 5-метилен-изолейцина в положениях 1 и 5. Эта номенклатура основывается на порядке элюирования с С18-колонки.
Авторы изобретения предлагают и используют название бацитрацин K3 для бацитрацинов по изобретению, содержащих остатки 5-метилен-изолейцина в положениях 1 и 8. Эта номенклатура основывается на порядке элюирования с С18-колонки.
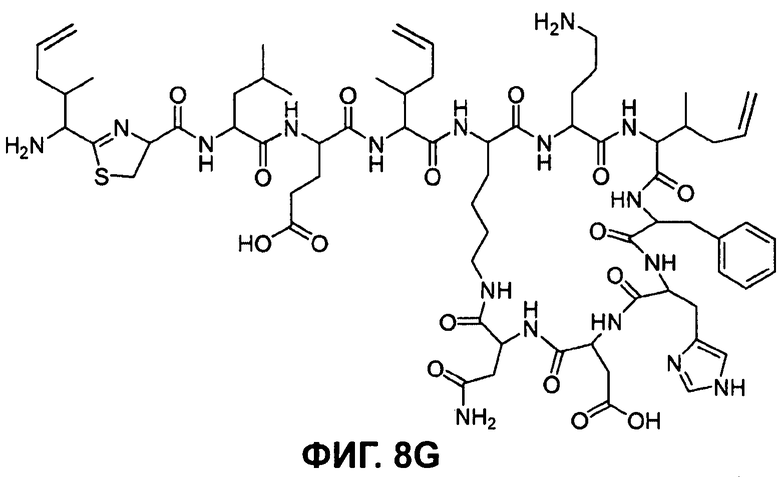
Авторы изобретения предлагают и используют название бацитрацин L для бацитрацинов по изобретению, содержащих остатки 5-метилен-изолейцина в положениях 1, 5 и 8. Эта номенклатура основывается на порядке элюирования с C18-колонки.
Эти аспекты изобретения могут быть обеспечены признаками, изложенными в следующем далее описании изобретения и/или в прилагаемой формуле изобретения.
Подробное описание изобретения
Определения
"Бацитрацины" представляют собой пептидные соединения, содержащие следующую структуру (с нумерацией аминокислотных остатков в виде верхнего индекса):
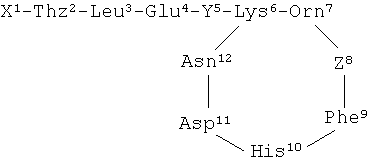
где X представляет собой 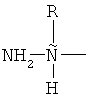 ;
;
и где R представляет собой боковую цепь остатка аминокислоты изолейцина, валина или 5-метилен-изолейцина;
и где
Y и Z независимо представляют собой остаток аминокислоты изолейцина, валина или 5-метилен-изолейцина;
и где
Thz представляет собой тиазолиновое кольцо, соединенное через положение 2′ с X и через положение 4′ с α-углеродным атомом в Leu;
и где
Leu представляет собой остаток аминокислоты лейцина, Glu представляет собой остаток глутаминовой аминокислоты, Lys представляет собой остаток аминокислоты лизина, образующий пептидную связь с Y и Orn, в то время как его е-аминогруппа соединена с α-карбоксильной группой аспарагина пептидной связью,
Orn представляет собой остаток аминокислоты орнитина,
Phe представляет собой остаток аминокислоты фенилаланина,
His представляет собой остаток аминокислоты гистидина,
Asp представляет собой остаток аспарагиновой аминокислоты,
Asn представляет собой остаток аминокислоты аспарагина, образующий пептидную связь с Asp, в то время как его α-карбоксильная группа соединена с ε-аминогруппой лизина пептидной связью.
Когда термин "бацитрацины" используется в данной заявке, это означает, что он охватывает любое соединение, имеющее приведенную выше структуру, независимо от способа получения. Таким образом, термин "бацитрацины" включает в себя антибиотические соединения, продуцируемые в естественных условиях Bacillus licheniformis, но также продуцируемые in vitro (синтетические) соединения и полусинтетические соединения, имеющие приведенную выше первичную структуру. Также подразумевается, что термин "бацитрацины" охватывает любое соединение, имеющее приведенную выше структуру, независимо от заряда, который изменяется с рН. Также подразумевается, что термин "бацитрацины" охватывает любое соединение, имеющее приведенную выше первичную структуру, независимо от стереохимии. Также подразумевается, что термин "бацитрацины" охватывает соли и гидраты соединений, имеющих приведенную выше первичную структуру.
Подразумевается, что фраза "бацитрацины, содержащие по меньшей мере один остаток 5-метилен-изолейцина", охватывает любой бацитрацин, содержащий структуру, которая могла бы образоваться, если остаток(ки) изолейцина или валина был(и) замещен(ы) остатком(ами) 5-метилен-изолейцина в положении 1, и/или 5, и/или 8.
Подразумевается, что фраза "бацитрацины, содержащие остаток 5-метилен-изолейцина", охватывает любой бацитрацин, демонстрирующий структуру, которая могла бы образоваться, если остаток изолейцина или валина был замещен остатком 5-метилен-изолейцина в положении 1, или 5, или 8.
Подразумевается, что фраза "бацитрацины, содержащие боковую цепь по меньшей мере одного 5-метилен-изолейцина", охватывает "бацитрацины, содержащие по меньшей мере один остаток 5-метилен-изолейцина".
Когда N-концевая аминогруппа и/или тиазолиновое кольцо бацитрацинов находится в окисленном состоянии, значительная доля антибактериальной активности теряется. Например, низкоактивное соединение бацитрацин F содержит кето-тиазольную группировку вместо амино-тиазолиновой группировки (Craig et al., J. Org. Chem., vol.22, 1957, page 1345-1353).
Аминокислоты в D-конфигурации часто встречаются в нерибосомально синтезируемых бактериальных пептидах и редко в рибосомально синтезируемых белках. Например, аминокислотные остатки в положениях 4, 7, 9 и 11 в бацитрацинах обычно находятся в D-конфигурации (Glu, Orn, Phe и Asp).
5-Метилен-изолейцин содержит два хиральных атома углерода, которые могут независимо находиться в R- или S-конфигурации.
Термин "аминокислотный остаток" относится к звену в пептиде и включает в себя:
-NH-CHR-COOH (C-концевой остаток),
или
NH2-CHR-CO- (N-концевой остаток),
или
-NH-CHR-CO- (внутренний остаток),
где R представляет собой
-H в глицине,
-CH3 в аланине,
-OH в серине,
-CH2SH в цистеине,
-CH(CH3)CH2CH3 в изолейцине,
-CH2CH(CH3)2 в лейцине,
-CH(CH3)2 в валине
и т.д.
"Аминокислотная боковая цепь" представляет собой группу R "аминокислотного остатка". Например, группа R представляет собой
-CH(CH3)CH2CH=CH2 в 5-метилен-изолейцине,
-CH(CH3)CH2CH3 в изолейцине,
-CH2CH(CH3)2 в лейцине,
-CH(CH3)2 в валине.
"Антибактериальная активность" представляет собой любой вид активности, которая:
- ингибирует рост, метаболизм или размножение бактерий, или
- повышает смертность бактерий, или
- снижает патогенность бактерий.
Эффективность представляет собой антибактериальную активность in vitro. Она может быть измерена и выражена в МЕ (международные единицы)/мг.
Нумерация "положений" аминокислотных остатков в бацитрацинах начинается от N-концевого остатка, которым может быть изолейцин, валин или 5-метилен-изолейцин в положении 1 (левый конец на всех рисунках, изображающих бацитрацины в этой заявке). Следовательно, Lys находится в положении номер 6, a Asn находится в положении номер 12.
В бацитрацинах "положение 1" является особенным, потому что этот аминокислотный остаток частично входит в состав тиазолинового кольца. Таким образом, аминокислотный остаток в положении 1 в бацитрацинах не содержит обычной N-концевой единицы:
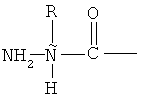 ,
,
но вместо этого содержит:
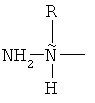 , соединенную с тиазолином или его окисленными производными.
, соединенную с тиазолином или его окисленными производными.
"Композиция" представляет собой любую смесь, содержащую больше двух разных соединений. Например, смесь двух активных фармацевтических ингредиентов или смесь активного фармацевтического ингредиента и одного или более фармацевтических эксципиентов.
Термин "компонент" или "компоненты", используемый в этой заявке, относится к конкретному соединению в композиции. Соответственно, "минорные компоненты" представляют собой соединения, входящие в композицию в относительно малых количествах.
"Фармацевтическая композиция" представляет собой любую композицию, подходящую для применения in vivo. Следовательно, такие композиции могут быть нанесены на кожу, введены подкожно, внутривенно, парентерально, перорально и т.д.
Изобретение относится к новым бацитрациновым соединениям, содержащим боковую цепь по меньшей мере одного остатка 5-метилен-изолейцина.
Более конкретно, изобретение относится к новым бацитрациновым соединениям с антибактериальной активностью, содержащим по меньшей мере один остаток 5-метилен-изолейцина.
Еще более конкретно, оно относится к новым бацитрациновым соединениям с улучшенной антибактериальной активностью, содержащим по меньшей мере один остаток(ки) 5-метилен-изолейцина в положении 1, или 5, или 8.
Еще более конкретно, оно относится к новым бацитрациновым соединениям с антибактериальной активностью, содержащим один остаток 5-метилен-изолейцина в положении 1, или 5, или 8.
Изобретение также относится к новым бацитрациновым соединениям с антибактериальной активностью, содержащим два остатка 5-метилен-изолейцина остатки в положениях 1 и 5.
Изобретение также относится к новым бацитрациновым соединениям с антибактериальной активностью, содержащим два остатка 5-метилен-изолейцина в положениях 1 и 8.
Изобретение также относится к новым бацитрациновым соединениям с антибактериальной активностью, содержащим два остатка 5-метилен-изолейцина в положениях 5 и 8.
Изобретение также относится к новым бацитрациновым соединениям с антибактериальной активностью, содержащим три остатка 5-метилен-изолейцина в положениях 1, и 5, и 8.
Бацитрацины, содержащие по меньшей мере один остаток 5-метилен-изолейцина в положении 1, 5 или 8, могут быть использованы для ингибирования нежелательного бактериального роста как in vitro, так и in vivo. Таким образом, эти соединения могут обладать терапевтическим эффектом при введении животному или человеку, имеющему бактериальную инфекцию.
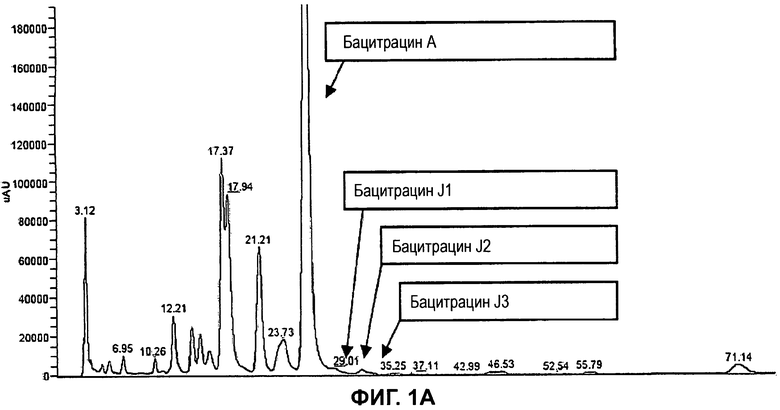
Когда 5-метилен-изолейцин встроен в бацитрацины в положении 1, 5 или 8, получающаяся в результате этого аминокислотная боковая цепь является ненасыщенной и содержит 5 атомов углерода. Боковые цепи остатков изолейцина и валина содержат 4 или 3 атома углерода, соответственно. Порядок элюирования с С18-колонки является следующим: бацитрацин А, бацитрацин J1, бацитрацин J2 и бацитрацин J3 (см. хроматограммы на Фиг.1). Таким образом, логично, что замена боковой цепи изолейцина на боковую цепь 5-метилен-изолейцина приводит к получению более гидрофобных бацитрацинов.
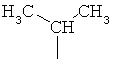
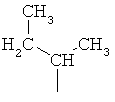

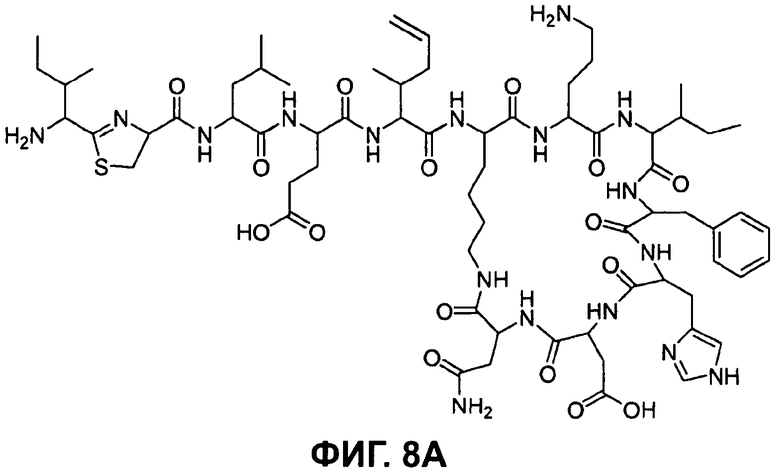
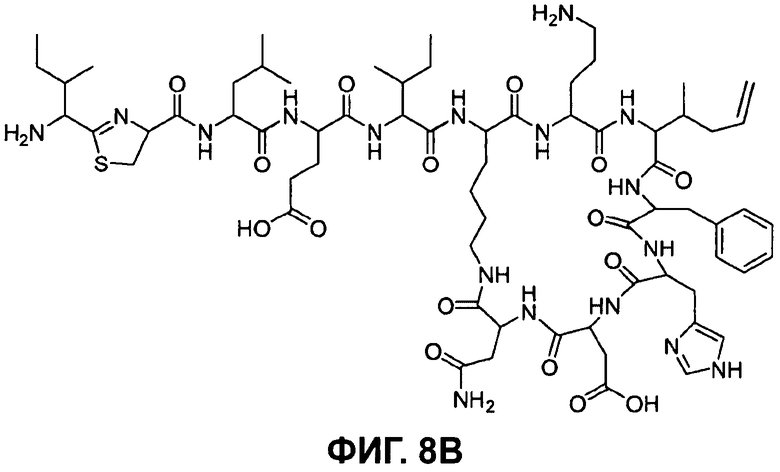
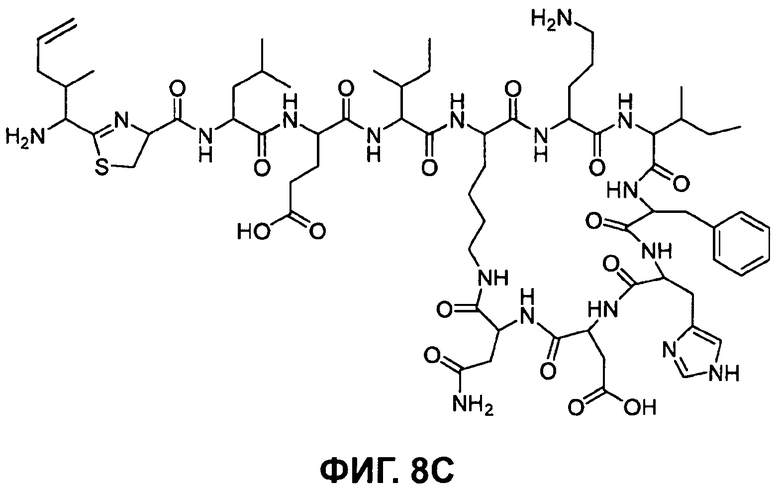
Предпочтительными соединениями по данному изобретению являются бацитрацины J1-3, продуцируемые в естественных условиях Bacillus licheniformis; например бацитрацин J1, бацитрацин J2 и бацитрацин J3, которые показаны на Фиг.8А-8С.
Предпочтительными соединениями по данному изобретению являются бацитрацины J1-3, имеющие ту же стереохимию, что и продукт природной ферментации бацитрацин А.
Предпочтительными соединениями по данному изобретению являются бацитрацины J1-3, бацитрацины K1-3 или бацитрацин L, при этом аминокислотные остатки в положениях 4, 7, 9 и 11 находятся в D-конфигурации (Glu, Orn, Phe и Asp).
Сокращения:
Получение бацитрацинов, описанных в этой заявке, может быть осуществлено твердофазным синтезом, как описано Lee и соавт. в J. Org. Chem., vol.61, №12, 1996, page 3983-3986.
В WO 199747313 описывается синтез бацитрациновых пептидов, который может быть использован для получения новых бацитрацинов по данному изобретению.
Альтернативно, новые бацитрацины могут быть получены путем очистки из бацитрацин-продуцирующих штаммов Bacillus licheniformis.
Краткое описание графических материалов
На Фиг.1А показана хроматограмма с УФ-детекцией при 254 нм коммерческой партии от Axellia (BANN 211412), полученная с использованием С18-колонки YMC-Pack Pro (5 мкм, 250×2,0 мм) при 30°C. Подвижная фаза состояла из смеси метанол/ацетонитрил/0,1М ацетат аммония, рН 6,0/вода (58:5:10:27 об./об./об./об.). Использовали условия изократического элюирования при скорости потока 0,2 мл/мин. Объем вводимой пробы составлял 10 мкл. Помимо бацитрацина А отмечены три минорных компонента, обозначенные как бацитрацин J1, бацитрацин J2 и бацитрацин J3, все с молекулярной массой, на 12 Да превышающей молекулярную массу бацитрацина А.
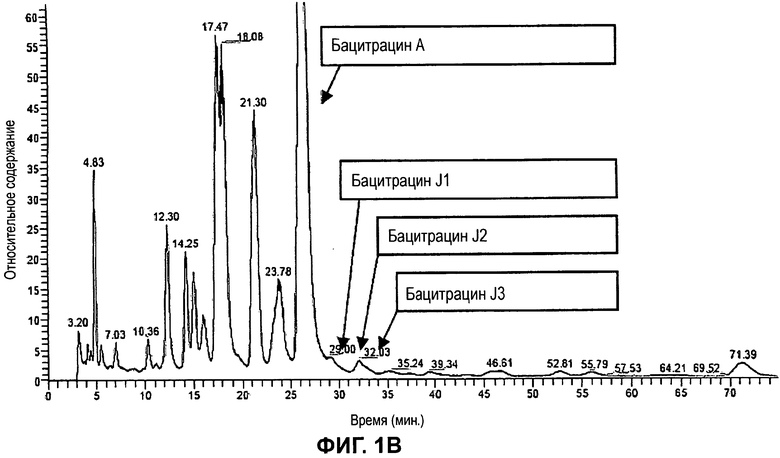
На Фиг.1В показана соответствующая MS TIC-хроматограмма (в режиме регистрации полного ионного тока при масс-спектрометрии) с обозначениями как на Фиг.1А.
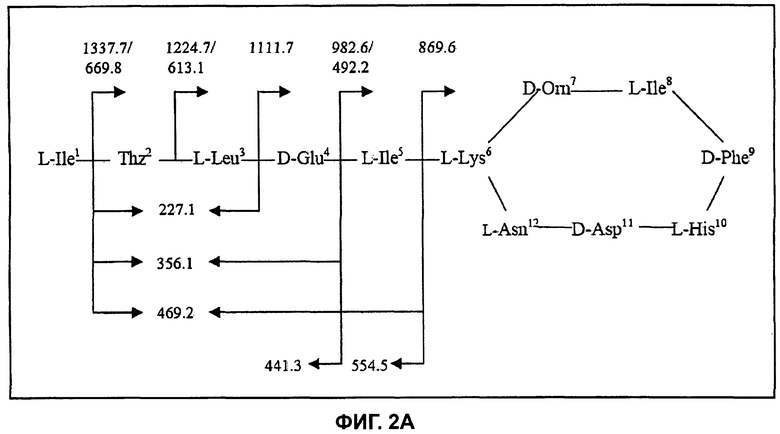
На Фиг.2А показана структура бацитрацина А, при этом расположение фрагментных ионов приведено для характерных ионов ниже на спектре ионов-продуктов.
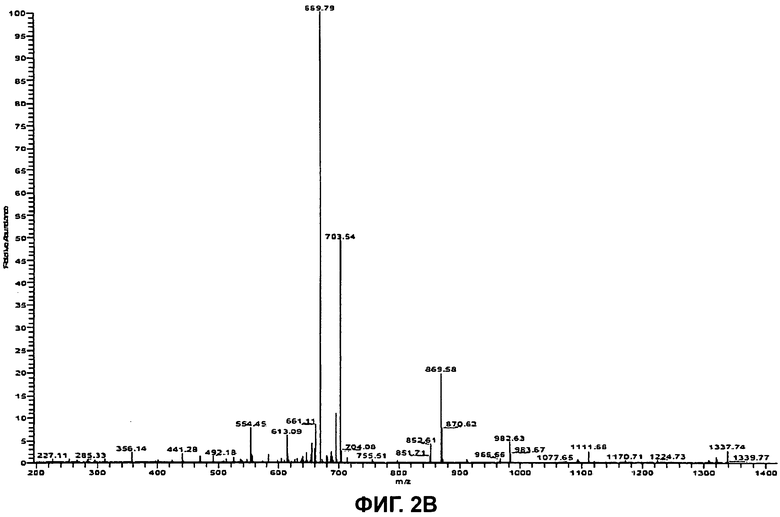
На Фиг.2В показан (MS/MS) спектр ионов-продуктов бацитрацина А, при этом ион-предшественник с m/z 712,0 ([M+2H]2+) был изолирован и фрагментирован.
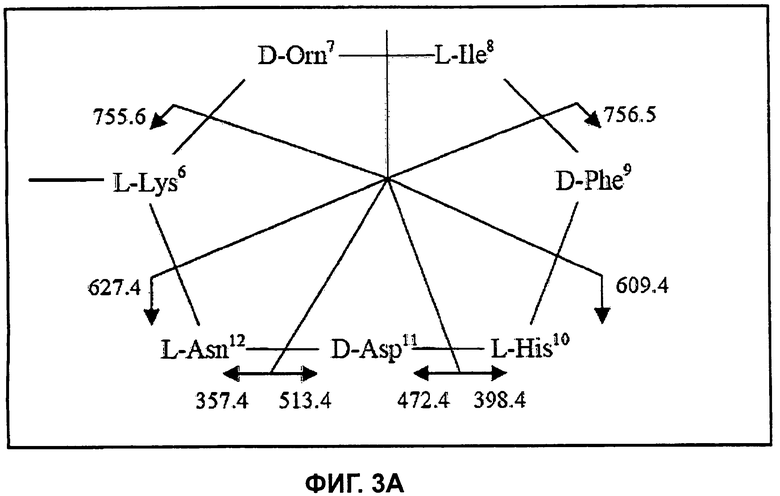
На Фиг.3А показана структура циклической части бацитрацина А, при этом расположение фрагментных ионов приведено для характерных ионов ниже на спектре ионов-продуктов второй генерации.
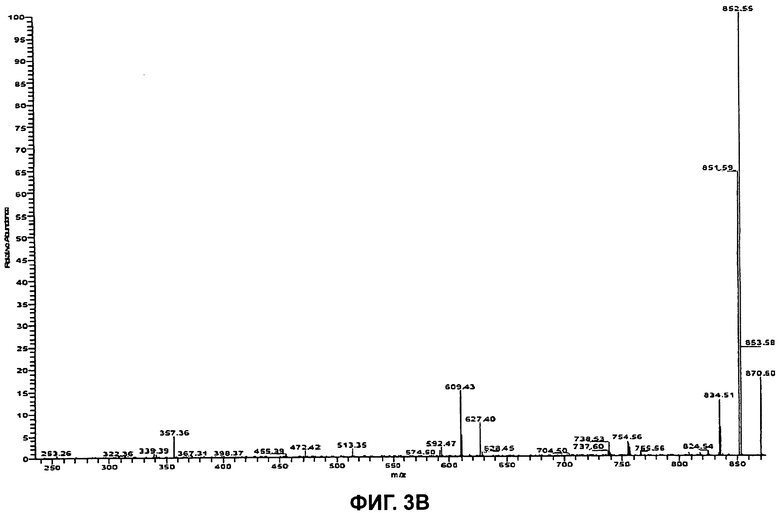
На Фиг.3В показан спектр относящихся ко второй генерации ионов-продуктов (MS3) бацитрацина А, при этом следующими один за другим ионами-предшественниками были ионы с m/z 712,0 ([M+2H]2+) и m/z 869,6 ([M+H]+).
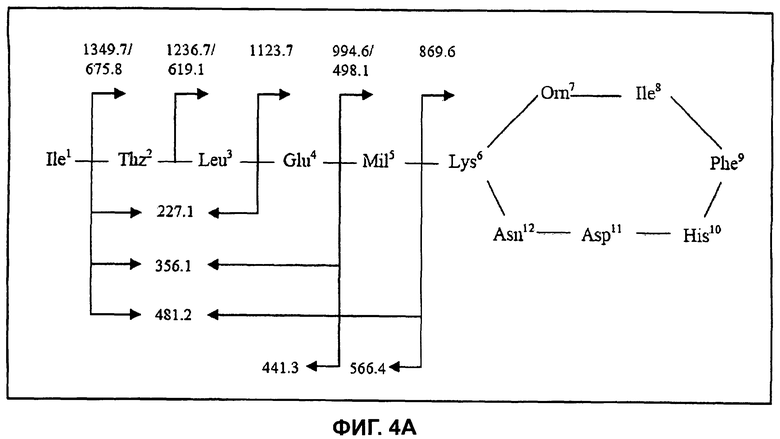
На Фиг.4А показана структура бацитрацина J1, при этом расположение фрагментных ионов приведено для характерных ионов ниже на спектре ионов-продуктов.
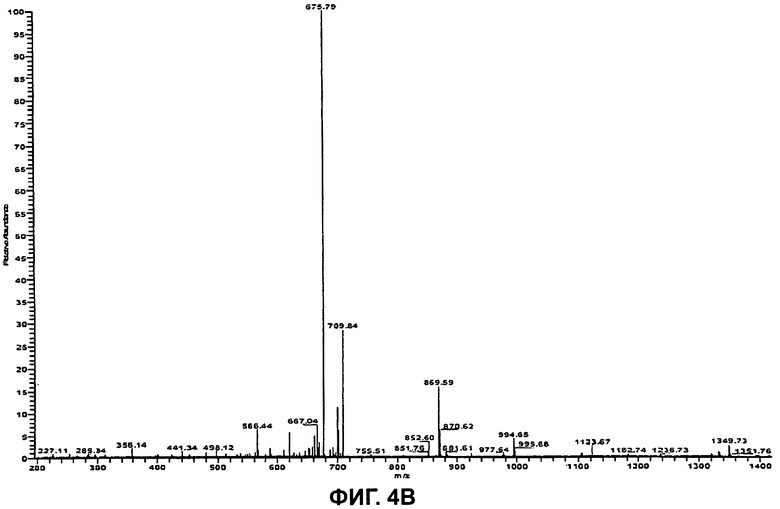
На Фиг.4В показан (MS/MS) спектр ионов-продуктов бацитрацина J1, при этом ион-предшественник с m/z 718,0 ([M+2H]2+) был изолирован и фрагментирован.
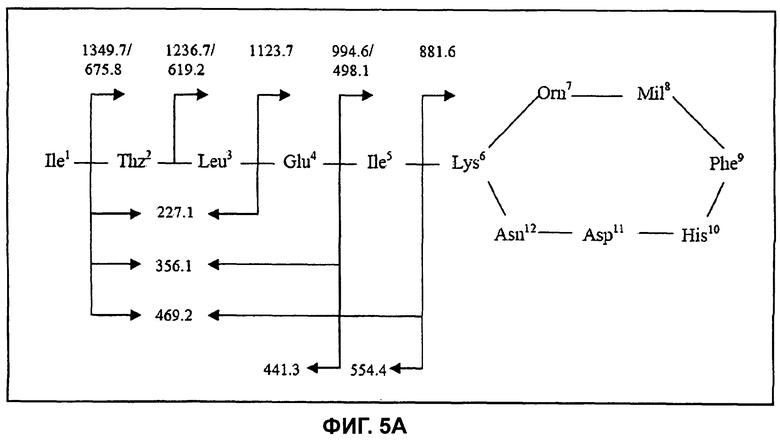
На Фиг.5А показана структура бацитрацина J2, при этом расположение фрагментных ионов приведено для характерных ионов ниже на спектре ионов-продуктов.
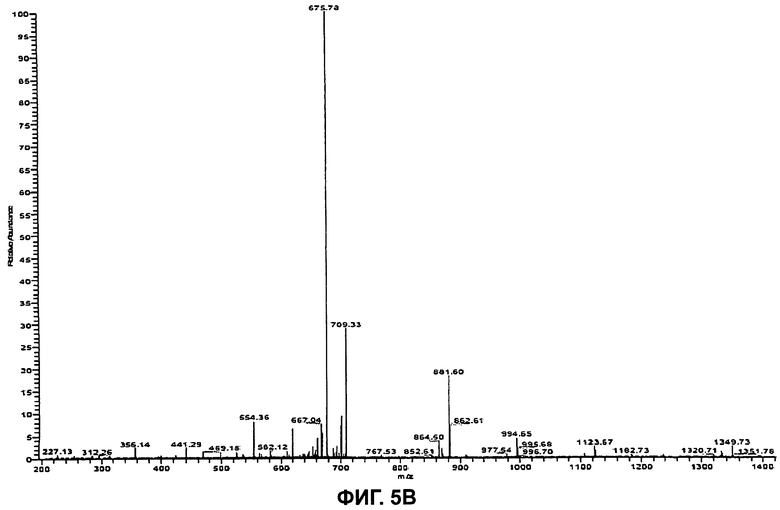
На Фиг.5В показан (MS/MS) спектр ионов-продуктов бацитрацина J2, при этом ион-предшественник с m/z 718,0 ([M+2H]2+) был изолирован и фрагментирован.
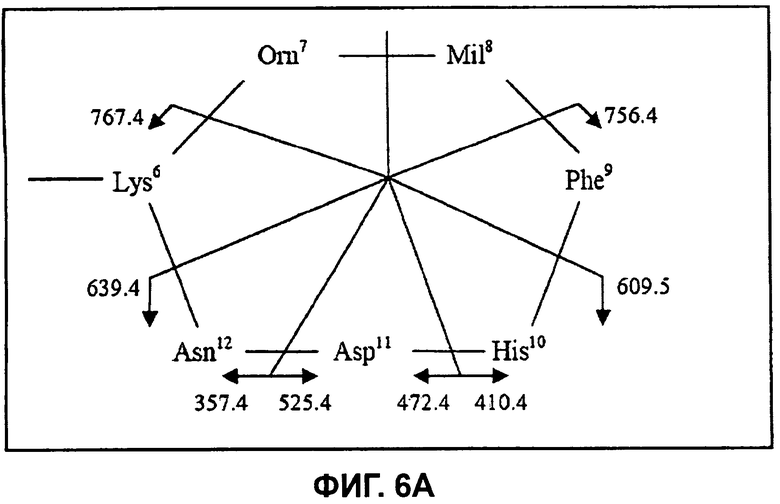
На Фиг.6А показана структура циклической части бацитрацина J2, при этом расположение фрагментных ионов приведено для характерных ионов ниже на спектре ионов-продуктов второй генерации.
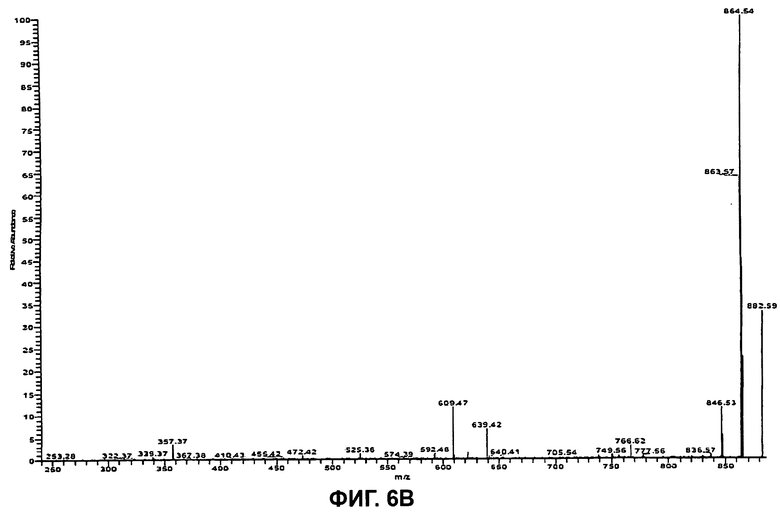
На Фиг.6В показан спектр ионов-продуктов второй генерации (MS3) бацитрацина J2, при этом следующими один за другим ионами-предшественниками были ионы с m/z 718,0 ([M+2H]2+) и m/z 881,6 ([M+H]+).
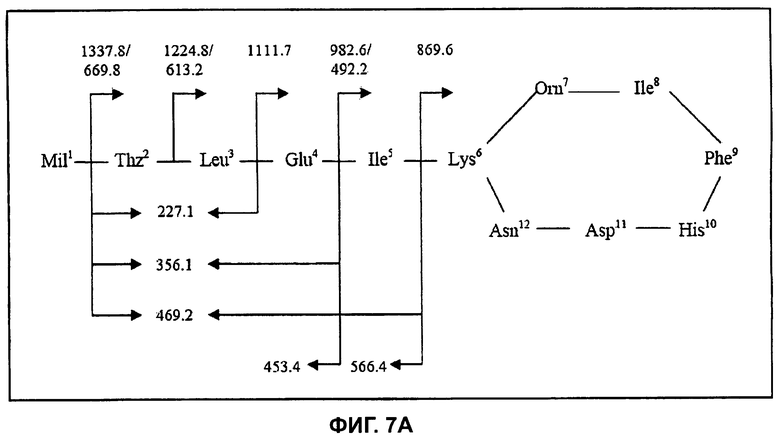
На Фиг.7А показана структура бацитрацина J3, при этом расположение фрагментных ионов приведено для характерных ионов ниже на спектре ионов-продуктов.
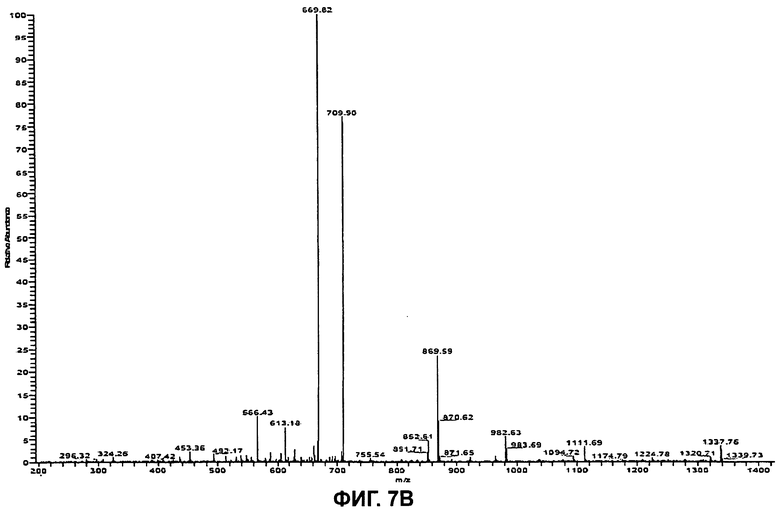
На Фиг.7В показан (MS/MS) спектр ионов-продуктов бацитрацина J3, при этом ион-предшественник с m/z 718,0 ([M+2H]2+) был изолирован и фрагментирован.
На Фиг.8А показана структура бацитрацина с остатком 5-метилен-изолейцина в положении 5 (соответствует бацитрацину J1).
На Фиг.8В показана структура бацитрацина с остатком 5-метилен-изолейцина в положении 8 (соответствует бацитрацину J2).
На Фиг.8С показана структура бацитрацина с остатком 5-метилен-изолейцина в положении 1 (соответствует бацитрацину J3).
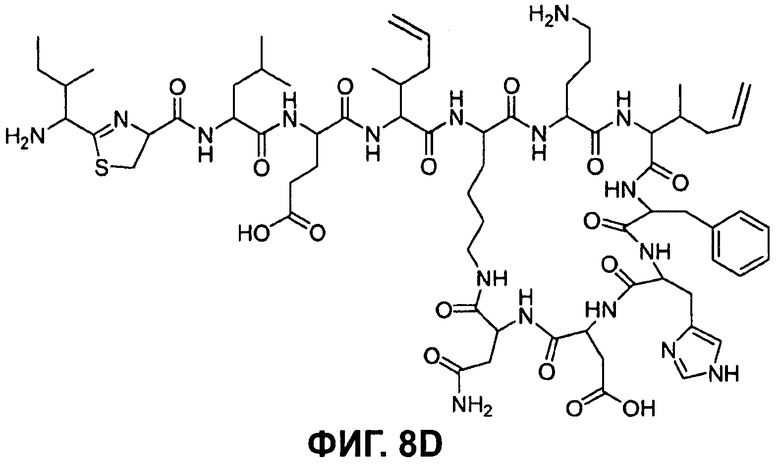
На Фиг.8D показана структура бацитрацина с остатками 5-метилен-изолейцина в положениях 5 и 8 (соответствует бацитрацину K1).
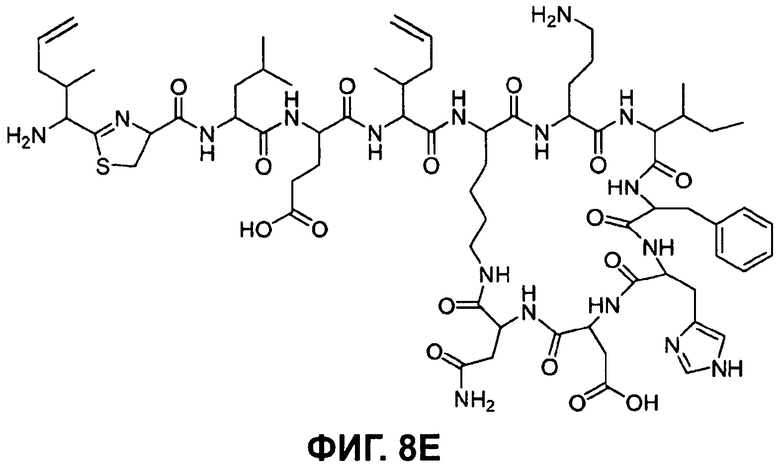
На Фиг.8Е показана структура бацитрацина с остатками 5-метилен-изолейцина в положениях 1 и 5 (соответствует бацитрацину K2).
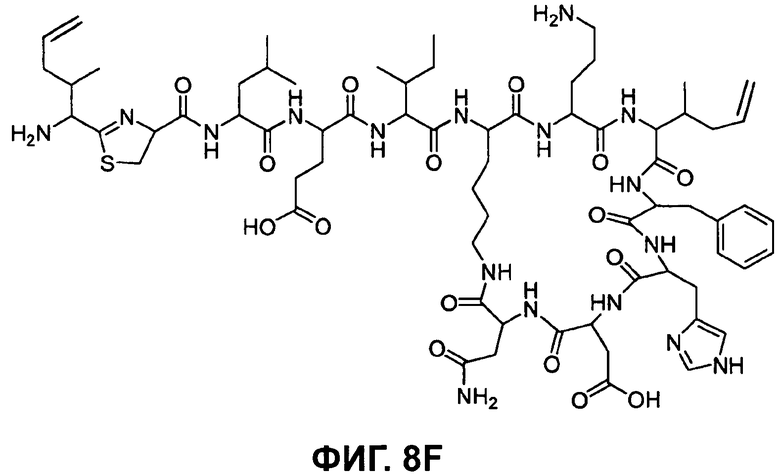
На Фиг.8F показана структура бацитрацина с остатками 5-метилен-изолейцина в положениях 1 и 8 (соответствует бацитрацину K3).
На Фиг.8G показана структура бацитрацина с остатками 5-метилен-изолейцина в положениях 1, 5 и 8 (соответствует бацитрацину L).
Объем притязаний изобретения определяется формулой изобретения, а не приведенными далее иллюстративными примерами.
Примеры
Эксперимент 1. LC-MSn
Использовали образцы из коммерческих партий от Axellia Pharmaceuticals. Образцы растворяли в воде в концентрации 2 мг/мл и затем перед проведением 1С-MSn-анализов фильтровали через 0,45 мкм фильтры (от VWR).
Использовали HPLC-систему Surveyor (Thermo Fisher), состоящую из четвертичного насоса, дегазатора, термостатируемого автосэмплера (с установкой при 5°C), отсека с термостатируемой колонкой (с установкой при 30°C) и диодного матричного детектора (с установкой при 254 нм). Условия проведения HPLC были аналогичны описанным Govaerts и соавт.(Rapid Communications in Mass Spectrometry, vol.17, №12, page 1366-1379). Использовали C18-колонку YMC-Pack Pro (5 мкм, 250×2,0 мм). Подвижная фаза состояла из смеси метанол/ацетонитрил/0,1М ацетат аммония, рН 6,0/вода (58:5:10:27, об./об./об./об.). Величину рН 0,1М раствора ацетата аммония подводили до рН 6,0, добавляя 0,1М уксусную кислоту. Использовали изократические условия при скорости потока 0,2 мл/мин. Впрыскиваемый объем составлял 10 мкл. К HPLC-системе был присоединен масс-спектрометр на базе линейной ионной ловушки LXQ (Thermo Fisher), оборудованный ESI (ионизация электрораспылением)-интерфейсом. Проводили настройку на дважды протонированный молекулярный ион ([M+2H]2+) бацитрацина А. Устанавливали параметры ESI, как приведено ниже: осушающий газ 35 (относительных единиц); вспомогательный газ 10 (относительных единиц); напряжение при распылении 5,0 кВ; температура капилляра 320°C; напряжение на капилляре 9,0 В; напряжение на линзах камеры 95 В. Параметры MS устанавливали, как приведено ниже: смещение на RF (радиочастотной) линзе -4,25 В; напряжение на линзе 0-3,0 В; смещение на мультиполе 0-4,5 В; напряжение на линзе 1-8,0 В; напряжение на фокусирующей линзе -56 В; смещение на мультиполе 1-9,5 В; амплитуда RF мультиполя 400 В; напряжение на передней линзе -6,5 В. LC-MS/MS- и LC-MS3-анализы проводили, используя величины диапазона выделения 3 и энергии столкновения 16%.
Результаты
УФ- и MS-хроматограммы для типичной партии (BANN 211412) от Axellia Pharmaceuticals показаны на Фиг.1А-В. УФ-хроматограмма очень похожа на соответствующую хроматограмму для этой партии, полученную с использованием несочетаемого с LC-MS HPLC-метода из Европейской фармакопеи. Помимо бацитрацина А на Фиг.1 отмечены три минорных компонента, обозначенные как бацитрацин J1, бацитрацин J2 и бацитрацин J3, все с молекулярной массой, на 12 Да превышающей молекулярную массу бацитрацина А. Установление структуры этих трех компонентов будет описано в этой заявке, и их структура даст обоснования для их обозначения.
Бацитрацин А
Дважды протонированный молекулярный ион ([M+2H]2+, m/z 712,0) был изолирован и фрагментирован, и (MS/MS) спектр полученных ионов-продуктов показан на Фиг.2В. Спектр содержит полный набор ионов у″ с m/z 1337,7/669,82+ (потеря Ile), m/z 1224,7/613,12+ (потеря IleThz), m/z 1111,7 (потеря IleThzLeu), m/z 982,6/492,22+ (потеря IleThzLeuGlu) и m/z 869,6 (потеря IleThzLeuGluIle). Расположение этих фрагментов представлено на Фиг.2А. В дополнение к ионам b с m/z 554,5 (IleThzLeuGluIle) и m/z 441,3 (IleThzLeuGlu) можно наблюдать фрагментные ионы при m/z 227,1 (ThzLeu), m/z 356,1 (ThzLeuGlu) и при m/z 469,2 (ThzLeuGluIle), образовавшиеся в результате расщепления связей в двух местах.
Секвенирование циклической части бацитрацина А осуществляли посредством дальнейшего изолирования и фрагментации фрагментного иона кольцевой части при m/z 869,6 в MS3-эксперименте (712,0→869,6), см. Фиг.3В. Преимущественное раскрытие кольца между Orn и Ile приводит к образованию двух наборов фрагментных ионов, показанных на Фиг.3А. Один набор содержит ионы-продукты при m/z 756,5 (потеря Ile), m/z 609,4 (потеря IlePhe), m/z 472,4 (потеря IlePheHis) и при m/z 357,4 (потеря IlePheHisAsp). В другом наборе обнаружены ионы-продукты при m/z 755,6 (потеря Orn), m/z 627,4 (потеря OrnLys), m/z 513,4 (потеря OrnLysAsn) и при m/z 398,4 (потеря OrnLysAsnAsp). Таким образом, наличие всех этих фрагментных ионов подтверждает хорошо установленную последовательность бацитрацина А и предоставляет возможность для установления последовательности неизвестных аналогов бацитрацина путем сравнения картин фрагментации.
Бацитрацин J1
Используя ту же методологию, что и для бацитрацина А, можно определить местоположение модификации, ответственной за отличие от бацитрацина А, составляющее +12 Да. Дважды протонированный молекулярный ион ([M+2H]2+, m/z 718,0) был изолирован и фрагментирован, и (MS/MS) спектр полученных ионов-продуктов показан на Фиг.4В. Спектр содержит полный набор ионов y″ с m/z 1349,7/675,82+ (потеря Ile), m/z 1236,7/619,12+ (потеря IleThz), m/z 1123,7 (потеря IleThzLeu), m/z 994,6/498.12+ (потеря IleThzLeuGlu) и m/z 869,6 (потеря IleThzLeuGluMil). Расположение этих фрагментов представлено на Фиг.4А. В дополнение к ионам b с m/z 566,4 (IleThzLeuGluMil) и m/z 441,3 (IleThzLeuGlu) можно наблюдать фрагментные ионы при m/z 227,1 (ThzLeu), m/z 356,1 (ThzLeuGlu) и при m/z 481,2 (ThzLeuGluMil), образовавшиеся в результате расщепления связей в двух местах.
В LC-MS3-эксперименте (718,0→869,6) были получены те же характерные фрагментные ионы, что и в соответствующем эксперименте с циклической частью бацитрацина А. Таким образом, наличие всех этих фрагментных ионов согласуется с тем, что в положении 5 в этом компоненте присутствует остаток с массой, на 12 Да превышающей массу остатка Не, тогда как остальная последовательность по-видимому идентична бацитрацину A:s.
Бацитрацин J2
Используя ту же методологию, что и для бацитрацина А, можно определить местоположение модификации, ответственной за отличие от бацитрацина А, составляющее +12 Да. Дважды протонированный молекулярный ион ([M+2H]2+, m/z 718,0) был изолирован и фрагментирован, и (MS/MS) спектр полученных ионов-продуктов показан на Фиг.5В. Спектр содержит полный набор ионов y″ с m/z 1349,7/675,82+ (потеря Ile), m/z 1236,7/619,22+ (потеря IleThz), m/z 1123,7 (потеря IleThzLeu), m/z 994,6/498,12+ (потеря IleThzLeuGlu) и m/z 881,6 (потеря IleThzLeuGluIle). Расположение этих фрагментов представлено на Фиг.5А. В дополнение к ионам b с m/z 554,4 (IleThzLeuGluIle) и m/z 441,3 (IleThzLeuGlu) можно наблюдать фрагментные ионы при m/z 227,1 (ThzLeu), m/z 356,1 (ThzLeuGlu) и при m/z 469,2 (ThzLeuGluIle), образовавшиеся в результате расщепления связей в двух местах. По этим фрагментам очевидно, что модификация в +12 Да по сравнению с бацитрацином А располагается в кольцевой части молекулы.
Секвенирование циклической части бацитрацина J2 осуществляли посредством дальнейшего изолирования и фрагментации фрагментного иона кольцевой части при m/z 881,6 в MS3-эксперименте (718,0→881,6), см. Фиг.6В. Преимущественное раскрытие кольца между Orn и Ile приводит к образованию двух наборов фрагментных ионов, показанных на Фиг.6А. Один набор содержит ионы-продукты при m/z 756,4 (потеря Mil), m/z 609,5 (потеря MilPhe), m/z 472,4 (потеря MilPheHis) и при m/z 357,4 (потеря MilPheHisAsp). В другом наборе обнаружены ионы-продукты при m/z 767,4 (потеря Orn), m/z 639,4 (потеря OrnLys), m/z 525,4 (потеря OrnLysAsn) и при m/z 410,4 (потеря OrnLysAsnAsp). Таким образом, наличие всех этих фрагментных ионов согласуется с тем, что в положении 8 в этом компоненте присутствует остаток с массой, на 12 Да превышающей массу остатка Ile, тогда как остальная последовательность по-видимому идентична бацитрацину А.
Бацитрацин J3
Используя ту же методологию, что и для бацитрацина А, можно определить местоположение модификации, ответственной за отличие от бацитрацина А, составляющее +12 Да. Дважды протонированный молекулярный ион ([M+2H]2+, m/z 718,0) был изолирован и фрагментирован, и (MS/MS) спектр полученных ионов-продуктов показан на Фиг.7В. Спектр содержит полный набор ионов y″ с m/z 1337,8/669,82+ (потеря Mil), m/z 1224,8/613,22+ (потеря (MilThz), m/z 1111,7 (потеря MilThzLeu), m/z 982,6/492,22+ (потеря MilThzLeuGlu) и m/z 869,6 (потеря MilThzLeuGluIle). Расположение этих фрагментов представлено на Фиг.7А. В дополнение к ионам b с m/z 566,4 (MilThzLeuGluIle) и m/z 453,4 (MilThzLeuGlu) можно наблюдать фрагментные ионы при m/z 227,1 (ThzLeu), m/z 356,1 (ThzLeuGlu) и при m/z 469,2 (ThzLeuGluIle), образовавшиеся в результате расщепления связей в двух местах.
В LC-MS3эксперименте (718,0→869,6) были получены те же характерные фрагментные ионы, что и в соответствующем эксперименте с циклической частью бацитрацина А. Таким образом, наличие всех этих фрагментных ионов согласуется с тем, что в положении 1 в этом компоненте присутствует остаток с массой, на 12 Да превышающей массу остатка Ile, тогда как остальная последовательность по-видимому идентична бацитрацину A:s.
Эксперимент 2. Выделение компонентов
Для установления структуры этих трех компонентов с использованием ЯМР-спектроскопии необходимо было приготовить обогащенные образцы. В идеальном случае каждый из трех компонентов должен быть выделен с чистотой примерно 90% для получения "чистых" ЯМР-спектров, свободных от мешающих сигналов, исходящих от других компонентов. Выделение осуществляли в две стадии. На первой стадии для удаления компонентов, элюирующихся до и после этих трех компонентов, использовали обращенно-фазовую RP-18-колонку LiChroprep (25-40 мкм, 35×5 см). Подвижная фаза состояла из смеси 3,5:31,5:65 метанол/ацетонитрил/0,03 М формиат аммония, рН 6,0 (об./об./об.). Таким образом получали очищенный материал с общей чистотой примерно 25% для трех компонентов. На второй стадии для отделения этих трех компонентов друг от друга использовали ODS-A-колонку YMC-Pack (5 мкм, 250×10 мм). Подвижная фаза состояла из смеси 58:5:37 метанол/ацетонитрил/0,025М ацетат аммония, рН 6,0 (об./об./об.). Конечным результатом этой 2-стадийной очистки было получение 4 образцов (обозначенных как образцы B, B′, C и C′), при этом образцы В и В′ были похожими и содержали главным образом бацитрацин J1 и бацитрацин А, и при этом образцы C и C′ были похожими и содержали главным образом бацитрацин J2 и бацитрацин J3 (Таблица 1).
LC-MSn-анализ проводили для всех образцов, чтобы подтвердить выделение правильных компонентов. Чистота образцов B и C была значительно ниже той, которая обычно считается необходимой для полной ЯМР-идентификации. Однако поскольку другим основным компонентом в образце B был бацитрацин А, было решено попытаться провести ЯМР-исследование без дальнейшей очистки. Беря за основу результаты первого ЯМР-исследования, выполненного на образце, обогащенном бацитрацином А (обозначенном как образец А, приготовленном ранее), ожидали, что сигналы от бацитрацина А, помимо того, что он служит в качестве эталонного соединения, можно будет исключить из спектров образца В. Поскольку образец С содержал смесь бацитрацина J2 и бацитрацина J3, невозможно было ожидать полного установления структуры в связи с ожидаемой высокой степенью перекрывания сигналов. Однако поскольку ожидалось, что модификации этих компонентов будут теми же, что и в бацитрацине J1 (на основании LC-MSn-измерений, см. эксперимент 1), по-прежнему оставалась надежда, что в результате ЯМР-экспериментов в сочетании с LC-MSn будут получены достаточные для определения структуры данные.
Эксперимент 3. Точное определение массы
Образцы A, B′ и C анализировали с целью точного определения массы (см. Таблицу 2). Разница в молекулярных массах между бацитрацином J1 и бацитрацином А составила 11,9998 Да. Разница в молекулярных массах как между бацитрацином J2 и бацитрацином А, так и между бацитрацином J3 и бацитрацином А составила 12,0000 Да, соответственно. Это является дополнительным доказательством того, что в элементный состав компонентов бацитрацина J1, бацитрацина J2 и бацитрацина J3 входило на один атом углерода (точная масса 12,0000 Да) больше, чем у бацитрацина А.
Эксперимент 4. ЯМР
ЯМР-спектры регистрировали для 10 мМ растворов образцов А, В и С в смеси 95% фосфатного буфера, рН 6,5/5% D2O при 303 K. Эксперименты проводили на спектрометре Bruker 600 МГц, используя стандартные последовательности импульсов для экспериментов с двумерной гомоядерной протонной корреляцией химических сдвигов (DQF-COSY (корреляционная спектроскопия с двухквантовым фильтром; от англ. Double-Quantum Filtered-COrrelated SpectroscopY), TOCSY (полная корреляционная спектроскопия; от англ. TOtal Correlated SpectroscopY), NOESY (спектроскопия ядерного эффекта Оверхаузера; от англ. Nuclear Overhauser Effect SpectroscopY)), гетероядерной 1H-13C корреляцией (HSQC (гетероядерная одноквантовая корреляция; от англ. Heteronuclear Single Quantum Coherence), HMBC (гетероядерная корреляция дальних взаимодействий; от англ. Heteronuclear Multiple Bond Correlation)) и гетероядерной 1H-15N корреляцией (HSQC). Для TOCSY-экспериментов использовали времена смешивания 20 мс и 60 мс, а в NOESY-экспериментах использовали времена смешивания 100 мс, 200 мс, 400 мс и 600 мс. Для образца С проводили ОЕРТ(135)-эксперимент (недеформирующее усиление путем переноса поляризации, от англ. Distortionless Enhancement by Polarization Transfer). Химические сдвиги выражают в млн-1, используя 2,2-диметил-2-силапентан-5-сульфоновую кислоту (0,5 мМ) в качестве эталона.
Результаты
Образец A(бацитрацин A)
Идентификацию аминокислотных спиновых систем осуществляли в экспериментах с использованием 2D 1H-1Н корреляции химических сдвигов (DQF-COSY и TOCSY) и гетероядерной 1H-13С и 1H-15N корреляции химических сдвигов (HSQC) в режиме детекции 1Н, и данные суммированы в Таблице 3. Данные по химическим сдвигам согласуются с наличием остатков Ile, Thz, Leu, Glu, He, Lys, Orn, Ile, Phe, His, Asp и Asn, что соответствует как данным по 1H химическим сдвигам от Kobayashi и соавт. (1992) (см. Таблицу 3), так и статистическим данным по химическим сдвигам, найденным в базе данных BMRB (база данных по спектрам магнитного резонанса биологических веществ; от англ. Biological Magnetic Resonance Bank) (см. Таблицу 3).
Последовательность аминокислотных остатков была установлена на основании экспериментов по 2D 1Н (NOESY, Таблица 4) и 1H-13С (НМВС, Таблица 5) корреляции. Диполь-дипольное взаимодействие (через пространство, NOESY) и дальнее скалярное взаимодействие (НМВС) соответствовали общепризнанной последовательности бацитрацина А:
атома a
наблюдаемый сдвиг
наблюдаемый сдвиг
статистические данные c
b Kobayashi et al. (1992) FE6S Lett. 2, 105-09.
с База данных BMRB: статистические данные, рассчитанные для отдельных химических сдвигов, http://www.bmrb.wisc.edu/ref_info/statsel.htm
углерод
остатка
остатка
b Данные НМВС, имеющиеся только для бацитрацина J1.
Образец В (бацитрацин J1)
Идентификацию аминокислотных спиновых систем осуществляли в экспериментах с использованием 2D 1H-1Н корреляции химических сдвигов (DQF-COSY и TOCSY) и гетероядерной 1H-13С и 1H-15N корреляции химических сдвигов (HSQC) в режиме детекции 1H и данные суммированы в Таблице 3. Данные по химическим сдвигам для остатков Ile, Thz, Leu, Glu, Lys, Orn, Ile, Phe, His, Asp и Asn почти идентичны соответствующим данным для бацитрацина A, что указывает на то, что в главном компоненте образца B те же самые остатки обнаружены в немодифицированном состоянии. Примечательно, что спиновая система, соответствующая Ile5 в бацитрацине A, была значительно слабее в этом образце по сравнению с образцом A (напомним, что образец В содержал примерно 20% бацитрацина A).
Помимо этих сигналов была обнаружена 3JH.Н-связанная спиновая система, соответствующая резонансу при δ 8,19 (амидный протон остова), 5,72; 5,06; 4,11; 2,10; 1,98; 1,90 и 0,82. Кросс-пики HSQC-спектров при δ 5,72/138,2; δ 5,06/120,1; δ 4,11/60,8; δ 2,10/38,8; δ 1,90/38,8; δ 1,98/36,7 и при δ 0,82/17,9 указывали по меньшей мере на шесть групп CHx.
Кросс-пики COSY-спектров при δ 8,19/4,11; δ 4,11/1,98; δ 1,98/0,82 и кросс-пики НМВС-спектров при δ 8,19/60,8; δ 4,11/175,7; δ 4,11/36,7; δ 4,11/17,9; δ 0,82/60,8 и при δ 0,82/36,7 свидетельствовали о наличии следующей группировки -NHCH(CO)CHCH3, что также было подтверждено ожидаемыми NOE-корреляциями.
Кросс-пики COSY-спектров при δ 2,10/1,90 и кросс-пики НМВС-спектров при δ 4,11/38,8; δ 0,82/38,8; δ 1,90/36,7 и при δ 1,90/17,9 свидетельствовали о наличии следующей группировки -NHCH(CO)CH(CH3)CH2, что также было подтверждено ожидаемыми NOE-корреляциями.
Кросс-пики COSY-спектров при δ 5,72/2,10, δ 5,72/1,90; δ 5,72/5,06 и кросс-пики HMBC-спектров при δ 5,72/38,8; δ 1,90/138,2; δ 5,06/38,8 и при δ 1,90/120,1 свидетельствовали о наличии следующей группировки -NHCH(CO)CH(CH3)CH2CH=CH2, что также было подтверждено ожидаемыми NOE-корреляциями. Все данные по химическим сдвигам для этого необычного аминокислотного аналога Ile аналогичны прогнозируемым данным, полученным с использованием ChemDraw (данные не показаны).
Последовательность аминокислотных остатков была установлена на основании экспериментов по 2D 1Н-1H (NOESY, Таблица 4) и 1H-13С (HMBC, Таблица 5) корреляции. Было обнаружено, что аминокислотная последовательность является такой же, как и у бацитрацина A, причем необычный аналог Ile (названный 5-метилен-изолейцином) заменяет Ile в положении 5. Таким образом, данные ЯМР согласуются с результатами LC-MSn и точного определения массы, при этом все данные указывают на наличие следующего аналога бацитрацина A в образце A:

Образец С (бацитрацин J2 и бацитрацин J3)
Данные ЯМР свидетельствуют о наличии двух остатков одного и того же необычного аналога Ile, который присутствовал в образце B (см. Таблицу 6). Помимо 2D-экспериментов, проведенных для образцов A и B, также выполняли OEPT(135)-эксперимент на образце C (Таблица 6). В этом эксперименте была дополнительно подтверждена структура двух необычных и идентичных аминокислотных аналогов Ile в образце С. Один из этих аналогов Ile располагался на N-конце (на что указывает отсутствие у него видимого амидного протона остова) и соответственно был обозначен как 5-метилен-изолейцин1. Другой аналог Ile располагался в положении 8, что было подтверждено с использованием NOESY- и HMBC-корреляций, и поэтому обозначен как 5-метилен-изолейцин8. Таким образом, данные ЯМР согласуются с результатами LC-MSn и точного определения массы. Все данные указывают на наличие следующего аналога бацитрацина A в образце A:


атомаа
наблюдаемый сдвиг
J3,
наблюдаемый сдвиг
с рекомендациями IUPAC для представления кислот.
Эксперимент 5. Эффективность
Измеряли антибактериальную активность образцов A, B′ и C′ (см. Таблицу 1). Удельную антибактериальную активность (выраженную в данном описании в виде МЕ/мг), часто называемую эффективностью, измеряли, сравнивая антибактериальную активность образца с неизвестной активностью с известными (стандартными) образцами. В частности, в качестве стандарта растворяли цинковую соль бацитрацина и разбавляли до концентрации 2,0, 1,0 и 0,5 ME бацитрацина/мл в 0,07 М фосфатном буфере, рН 6,0. Эти три стандартных раствора добавляли к чашкам с агаром, инокулированным тестируемым микроорганизмом Micrococcus luteus. Образцы с неизвестной активностью растворяли, разбавляли и добавляли в те же чашки, что и стандарты. Через 16-24 часа инкубации при 32-37°C измеряли зоны ингибирования и образцы с неизвестной активностью сравнивали со стандартами. Результаты (выраженные в виде МЕ/мг) для каждого образца приведены в Таблице 7.
Образец A содержал, как приведено в Таблице 1, 93% (что измерено с использованием HPLC при 254 нм) бацитрацина А (и не содержал бацитрацина J1, J2 или J3). Тогда удельная антибактериальная активность бацитрацина А может быть рассчитана как 77,4 МЕ/мг. Это ниже, чем сообщалось ранее. В качестве возможных объяснений может выступать содержание воды или соли, а также возможные антагонистические эффекты минорных компонентов. Поскольку образцы B′ и C′ содержат смеси нескольких бацитрацинов, невозможно представить данные о точной удельной антимикробной активности (МЕ/мг) бацитрацина J1, J2 или J3. Тем не менее, имеющиеся данные убедительно свидетельствуют о том, что эффективность бацитрацина J1, J2 и J3 аналогична эффективности или превышает эффективность бацитрацина A. Кроме этого образцы B′ и C′ могли содержать воду, соль и/или компоненты, оказывающие синергический или антагонистический эффект.
| название | год | авторы | номер документа |
|---|---|---|---|
| 2-АМИНО-3-МЕТИЛ-ГЕКС-5-ЕНОВАЯ КИСЛОТА И ЕЕ ПРИМЕНЕНИЕ В ПРОИЗВОДСТВЕ ПЕПТИДОВ, ТАКИХ КАК БАЦИТРАЦИНЫ | 2010 |
|
RU2611006C2 |
| ПРОИЗВОДНЫЕ ГЛИКОЗИДОВ ИНДОЛО[2,3-А]ПИРРОЛО[3,4-С]КАРБАЗОЛ-5,7-ДИОНОВ, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ И ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2003 |
|
RU2255089C1 |
| НУКЛЕОЗИДЫ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ ПРОТИВ ВИРУСА ГЕПАТИТА В | 1999 |
|
RU2237479C2 |
| АНАЛОГИ ТАМАНДАРИНА И ДИДЕМНИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2001 |
|
RU2323000C2 |
| Способ получения кладрибина методом ферментативного трансгликозилирования 2-хлор-6-азидопурина с последовательной двухстадийной конверсией азидогруппы | 2023 |
|
RU2836333C1 |
| Гибридные амиды на основе триазола и тиазолидина, обладающие антимикробной активностью | 2018 |
|
RU2703997C1 |
| ЗАМЕЩЕННЫЕ ГИДРИРОВАННЫЕ ТИЕНО-ПИРРОЛО [3,2-c] ПИРИДИНЫ, ЛИГАНДЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2451686C1 |
| Способ получения 2,3,16,17,18,19-гексагидроолигомицина А и его применение для ингибирования роста дрожжей рода Candida | 2016 |
|
RU2623087C1 |
| Анелированные 9-гидрокси-1,8-диоксо-1,3,4,8-тетрагидро-2Н-пиридо[1,2-a]пиразин-7-карбоксамиды - ингибиторы интегразы ВИЧ, способы их получения и применения | 2019 |
|
RU2717101C1 |
| ЗАЩИТНОЕ СРЕДСТВО ДЛЯ НЕЙРОННЫХ КЛЕТОК СЕТЧАТКИ, СОДЕРЖАЩЕЕ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА ПРОИЗВОДНЫЕ ИНДАЗОЛА | 2006 |
|
RU2392938C2 |
Изобретение относится к новым бацитрациновым соединениям с антибиотической активностью, в которых по меньшей мере один из R1, R2 и R3 представляет собой -СН=СН2 и где R1, R2 и R3 независимо представляют собой -Н, -СН3 или -СН=СН2. 4 н. и 9 з.п. ф-лы, 8 ил., 7 табл., 5 пр.
1. Соединение, представленное формулой

где
по меньшей мере один из R1, R2 и R3 представляет собой -СН=СН2 и
где R1, R2 и R3 независимо представляют собой -Н, -СН3 или -СН=СН2, и его соли.
2. Соединение по п.1, где один из R1, R2 и R3 представляет собой -СН3.
3. Соединение по п.1, где два из R1 R2 и R3 представляют собой -СН3.
4. Соединение по п.1, где R1 представляет собой -СН=СН2.
5. Соединение по п.1, где R2 представляет собой -СН=СН2.
6. Соединение по п.1, где R3 представляет собой -СН=СН2.
7. Соединение по п.1, где R1 и R2 представляют собой -СН=СН2.
8. Соединение по п.1, где R2 и R3 представляют собой -СН=СН2.
9. Соединение по п.1, где R1 и R3 представляют собой -СН=СН2.
10. Соединение по п.1, где R1, и R2, и R3 представляют собой -СН=СН2.
11. Антибактериальная композиция, содержащая соединение по п.1 в эффективном количестве и один или несколько эксципиентов.
12. Применение соединения по п. 1 для изготовления лекарственного средства для лечения бактериальных инфекций.
13. Способ получения соединений по п. 1 путем замещения изолейцина или валина на 5-метилен-изолейцин при синтезе in vitro бацитрацина.
| WO 1997047313 A1, 18.12.1997 | |||
| WO 1993008822 A1, 13.05.1993 | |||
| СПОСОБ ВЫДЕЛЕНИЯ КОМПЛЕКСА БАЦИТРАЦИНА | 0 |
|
SU381227A1 |
| US 0004101539 A1, 18.07.1978 | |||
| SABERWAL G ET AL: "Cell-lytic and antibacterial peptides that act by perturbing the barrier function of membranes: facets of their conformational features, structure-function correlations and membrane-perturbing abilities", BIOCHIMICA ET BIOPHYSICA ACTA., 1994, vol | |||
| Паровой котел с перегревателем | 1925 |
|
SU1197A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2014-12-27—Публикация
2010-09-30—Подача