ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается преимущество и приоритет по предварительной заявке U.S. № 62/318929, поданной 6 апреля 2016 г., содержание которой включено в настоящее изобретение в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Настоящее изобретение относится к замещенному пиразоло[1,5-a]пиримидинилкарбоксамиду и родственным органическим соединениям, композициям, включающим такие соединения, наборам лекарств и способам применения таких соединений и композиций для лечения патологических состояний у пациентов.
УРОВЕНЬ ТЕХНИКИ
[0003] Болезнь Гоше является генетическим нарушением, связанным с недостатком лизосомного фермента, глюкоцереброзидазы. Сообщали, что болезнь Гоше у общей популяции живых птиц встречается 1 раз на 20000 и является обычной лизосомной болезнью накопления. Современные средства лечения пациентов, страдающих от этого заболевания, включают ферментную заместительную терапию, которая обычно бывает дорогостоящей, анальгетики для снятия боли костей и медицинские процедуры, такие как переливание крови и тромбоцитов, спленэктомия и замена сустава у пациентов, у которых происходит эрозия кости. Однако необходимы новые методики лечения, обладающие улучшенной эффективностью для более широкого диапазона пациентов и/или уменьшенными неблагоприятными побочными эффектами.
[0004] Мутации гена, кодирующего глюкоцереброзидазу, также являются фактором риска для болезни Паркинсона и болезни диффузных телец Леви. Болезнь Паркинсона является дегенеративным нарушением центральной нервной системы, связанным с гибелью содержащих допамин клеток в области среднего мозга. Болезнь Паркинсона поражает миллионы людей и распространенность этого заболевания увеличивается с возрастом. Лечение болезни Паркинсона часто включает использование леводопа и агонистов допамина. Однако эти лекарственные средства могут приводить к существенным побочным эффектам, таким как галлюцинации, инсомния, тошнота и констипация. Кроме того, у пациентов часто развивается устойчивость к этим лекарственным средствам, так что эти лекарственные средства становятся неэффективными при лечении симптомов заболевания и иногда также приводят к побочному эффекту - нарушению движений, называющемуся дискинезией. Болезнь диффузных телец Леви представляет собой слабоумие, которое иногда путают с болезнью Альцгеймера.
[0005] Соответственно, необходимы новые терапевтические средства для лечения болезни Гоше, болезни Паркинсона и родственных патологических нарушений. Настоящее изобретение направлено на решение этой задачи и обеспечивает другие связанные с этим преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] Настоящее изобретение относится к замещенному пиразоло[1,5-a]пиримидинилкарбоксамиду и родственным органическим соединениям, композициям, включающим такие соединения, наборам лекарств и способам применения таких соединений и композиций для лечения у пациентов патологических состояний, таких как болезнь Гоше, болезнь Паркинсона, болезнь телец Леви, слабоумие, мультисистемная атрофия, эпилепсия, биполярное расстройство, шизофрения, тревожное нарушение, большая депрессия, поликистозное заболевание почек, диабет типа 2, открытоугольная глаукома, рассеянный склероз, эндометриоз и множественная миелома. Разные объекты и варианты осуществления настоящего изобретения дополнительно подробно описаны ниже.
[0007] Соответственно, одним объектом настоящего изобретения является группа замещенных пиразоло[1,5-a]пиримидинилкарбоксамидов и родственных органических соединений, описывающихся формулой I, которые можно использовать в способах, композициях и наборах, описанных в настоящем изобретении, где формула I имеет вид:
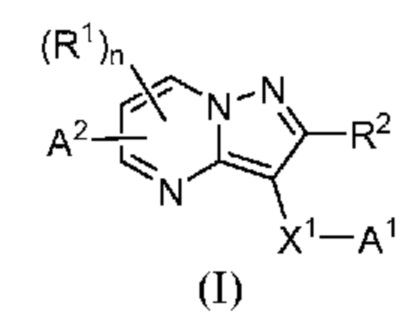
или их фармацевтически приемлемая соль, в которой переменные являются такими, как определено в подробном описании изобретения. Дополнительное описание дополнительных групп замещенных пиразоло[1,5-a]пиримидинилкарбоксамидов и родственных органических соединений, описывающихся формулой I, приведено в подробном описании изобретения.
[0008] Другим объектом настоящего изобретения является группа замещенных пиразоло[1,5-a]пиримидинилкарбоксамидов и родственных органических соединений, описывающихся формулой II, которые можно использовать в способах, композициях и наборах, описанных в настоящем изобретении, где формула II имеет вид:
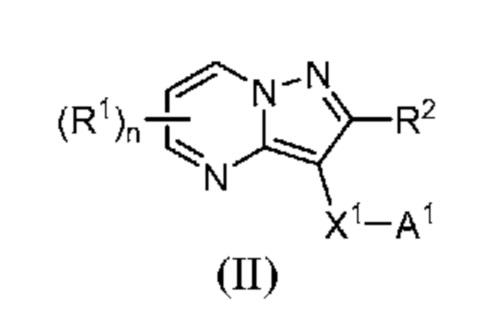
или их фармацевтически приемлемая соль, в которой переменные являются такими, как определено в подробном описании изобретения. Дополнительное описание дополнительных групп замещенных пиразоло[1,5-a]пиримидинилкарбоксамидов и родственных органических соединений, описывающихся формулой II, приведено в подробном описании изобретения.
[0009] Другим объектом настоящего изобретения является группа замещенных пиразоло[1,5-a]пиримидинилкарбоксамидов и родственных органических соединений, описывающихся формулой III, которые можно использовать в способах, композициях и наборах, описанных в настоящем изобретении, где формула III имеет вид:
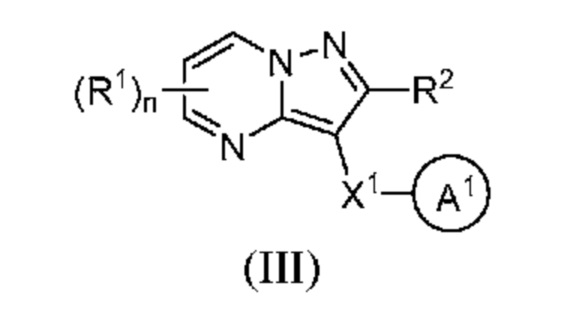
или их фармацевтически приемлемая соль, в которой переменные являются такими, как определено в подробном описании изобретения. Дополнительное описание дополнительных групп замещенных пиразоло[1,5-a]пиримидинилкарбоксамидов и родственных органических соединений, описывающихся формулой III, приведено в подробном описании изобретения.
[0010] Другим объектом настоящего изобретения является группа замещенных пиразоло[1,5-a]пиримидинилкарбоксамидов и родственных органических соединений, описывающихся формулой IV, которые можно использовать в способах, композициях и наборах, описанных в настоящем изобретении, где формула IV имеет вид:
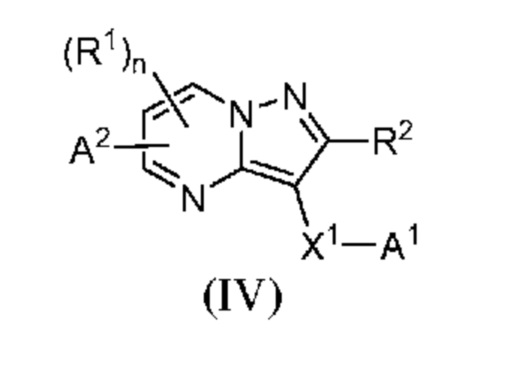
или их фармацевтически приемлемая соль, в которой переменные являются такими, как определено в подробном описании изобретения. Дополнительное описание дополнительных групп замещенных пиразоло[1,5-a]пиримидинилкарбоксамидов и родственных органических соединений, описывающихся формулой IV, приведено в подробном описании изобретения.
[0011] Другим объектом настоящего изобретения является фармацевтическая композиция, включающая фармацевтически приемлемый носитель и замещенный пиразоло[1,5-a]пиримидинилкарбоксамид или родственное органическое соединение, описанное в настоящем изобретении, такое как соединение формулы I, I-1, I-A, II, II-A, III или IV.
[0012] Другим объектом настоящего изобретения является способ лечения у пациента нарушения, такого как болезнь Гоше, болезнь Паркинсона, болезнь телец Леви, слабоумие, мультисистемная атрофия, эпилепсия, биполярное расстройство, шизофрения, тревожное нарушение, большая депрессия, поликистозное заболевание почек, диабет типа 2, открытоугольная глаукома, рассеянный склероз, эндометриоз и множественная миелома. Способ включает введение нуждающемуся в нем пациенту терапевтически эффективного количества замещенного пиразоло[1,5-a]пиримидинилкарбоксамида или родственного органического соединения, описанного в настоящем изобретении, такого как соединение формулы I, I-1, I-A, II, II-A, III или IV, для лечения нарушения, такого как болезнь Гоше, болезнь Паркинсона, болезнь телец Леви, слабоумие, мультисистемная атрофия, эпилепсия, биполярное расстройство, шизофрения, тревожное нарушение, большая депрессия, поликистозное заболевание почек, диабет типа 2, открытоугольная глаукома, рассеянный склероз или множественная миелома.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0013] Настоящее изобретение относится к замещенному пиразоло[1,5-a]пиримидинилкарбоксамиду и родственным органическим соединениям, композициям, включающим такие соединения, наборам лекарств и способам применения таких соединений и композиций для лечения патологических состояний у пациентов. При практическом осуществлении настоящего изобретения используются, если не указано иное, обычные методики органической химии, фармакологии, клеточной биологии и биохимии. Такие методики описаны в литературе, например, в публикациях "Comprehensive Organic Synthesis" (B.M. Trost & I. Fleming, eds., 1991-1992); "Current protocols in molecular biology" (F.M. Ausubel et al., eds., 1987, and periodic updates); и "Current protocols in immunology" (J.E. Coligan et al., eds., 1991), каждая из которых во всей своей полноте включена в настоящее изобретение в качестве ссылки. Разные объекты настоящего изобретения указаны ниже в разделах; однако объекты настоящего изобретения, описанные в одном конкретном разделе, не ограничиваются любым конкретным разделом.
I. Определения
[0014] Для облегчения понимания настоящего изобретения ниже определены ряд терминов и выражений.
[0015] Термины в единственном числе при использовании в настоящем изобретении означают "один или большее количество" и включают термины во множественном числе, если это соответствует контексту.
[0016] Термин "алкил" при использовании в настоящем изобретении означает насыщенный линейный или разветвленный углеводород, такой как линейная или разветвленная группа, включающая 1-12, 1-10 или 1-6 атомов углерода, называющийся в настоящем изобретении, как C1-C12 алкил, C1-C10 алкил и C1-C6 алкил соответственно. Типичные алкильные группы включают, но не ограничиваются только ими, метил, этил, пропил, изопропил, 2-метил-1-пропил, 2-метил-2-пропил, 2-метил-1-бутил, 3-метил-1-бутил, 2-метил-3-бутил, 2,2-диметил-1-пропил, 2-метил-1-пентил, 3-метил-1-пентил, 4-метил-1-пентил, 2-метил-2-пентил, 3-метил-2-пентил, 4-метил-2-пентил, 2,2-диметил-1-бутил, 3,3-диметил-1-бутил, 2-этил-1-бутил, бутил, изобутил, трет-бутил, пентил, изопентил, неопентил, гексил, гептил, октил и т. п.
[0017] Термин "алкилен" означает дирадикал алкильной группы. Типичной алкиленовой группой является -CH2CH2-.
[0018] Термин "галогеналкил" означает алкильную группу, которая замещена по меньшей мере одним галогеном. Например, -CH2F, -CHF2, -CF3, -CH2CF3, -CF2CF3 и т. п.
[0019] Термин "гидроксиалкил" означает алкильную группу, которая замещена по меньшей мере одной гидроксигруппой. Например, типичные гидроксиалкильные группы включают -CH2OH, -C(H)(OH)CH3 и т. п. В некоторых вариантах осуществления гидроксиалкил означает алкильную группу, которая замещена только одной гидроксигруппой.
[0020] Термин "цианоалкил" означает алкильную группу, которая замещена одной цианогруппой.
[0021] Термин "гетероалкил" при использовании в настоящем изобретении означает "алкильную" группу, в которой по меньшей мере один атом углерода заменен гетероатомом (например, атомом O, N или S). Гетероалкил может представлять собой, например, группу -O-C1-C10 алкил, группу -C1-C6 алкилен-O-C1-C6 алкил или группу C1-C6 алкилен-OH. В некоторых вариантах осуществления "гетероалкил" может представлять собой 2-8-членный гетероалкил и это показывает, что гетероалкил содержит от 2 до 8 атомов, выбранных из группы, включающей углерод, кислород, азот и серу. В других вариантах осуществления гетероалкил может представлять собой 2-6-членную, 4-8-членную или 5-8-членную гетероалкильную группу (которая может содержать, например, 1 или 2 гетероатома, выбранных из группы, включающей кислород и азот). Одним типом гетероалкильной группы является "алкоксильная" группа.
[0022] Термин "алкенил" при использовании в настоящем изобретении означает ненасыщенный линейный или разветвленный углеводород, содержащий по меньшей мере одну углерод-углеродную двойную связь, такой как линейная или разветвленная группа, содержащая 2-12, 2-10 или 2-6 атомов углерода, называющийся в настоящем изобретении, как C2-C12 алкенил, C2-C10 алкенил и C2-C6 алкенил соответственно. Типичные алкенильные группы включают винил, аллил, бутенил, пентенил, гексенил, бутадиенил, пентадиенил, гексадиенил, 2-этилгексенил, 2-пропил-2-бутенил, 4-(2-метил-3-бутен)-пентенил и т. п.
[0023] Термин "алкинил" при использовании в настоящем изобретении означает ненасыщенный линейный или разветвленный углеводород, содержащий по меньшей мере одну углерод-углеродную тройную связь, такой как линейная или разветвленная группа, содержащая 2-12, 2-10 или 2-6 атомов углерода, называющийся в настоящем изобретении, как C2-C12 алкинил, C2-C10 алкинил и C2-C6 алкинил соответственно. Типичные алкинильные группы включают этинил, проп-1-ин-1-ил, и бут-1-ин-1-ил.
[0024] Термин "циклоалкил" означает одновалентную насыщенную циклическую, бициклическую, мостиковую циклическую (например, адамантил), или спироциклическую углеводородную группу, содержащую 3-12, 3-8, 4-8 или 4-6 атомов углерода, называющуюся в настоящем изобретении, например, как "C4-8 циклоалкил", образованный из циклоалкана. Типичные циклоалкильные группы включают, но не ограничиваются только ими, циклогексаны, циклопентаны, циклобутаны и циклопропаны. Если не указано иное, циклоалкильные группы необязательно содержат в одном или большем количестве положений кольца, например, следующие заместители: алканоил, алкоксигруппу, алкил, галогеналкил, алкенил, алкинил, амидную группу, амидиновую группу, аминогруппу, арил, арилалкил, азидную группу, карбамат, карбонат, карбоксигруппу, цианогруппу, циклоалкил, сложноэфирную группу, простую эфирную группу, формил, галоген, галогеналкил, гетероарил, гетероциклил, гидроксигруппу, иминогруппу, кетогруппу, нитрогруппу, фосфат, фосфонатную группу, фосфинатную группу, сульфат, сульфид, сульфонамидную группу, сульфонил или тиокарбонил. В некоторых вариантах осуществления циклоалкильная группа не замещена, т. е. она является незамещенной.
[0025] Термин "циклоалкилен" означает дирадикал циклоалкильной группы. Типичной циклоалкиленовой группой является 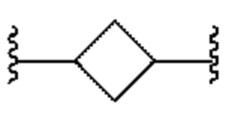 .
.
[0026] Термин "циклоалкенил" при использовании в настоящем изобретении означает одновалентную ненасыщенную циклическую, бициклическую или мостиковую циклическую (например, адамантил) углеводородную группу, содержащую 3-12, 3-8, 4-8, или 4-6 атомов углерода, содержащую по меньшей мере одну углерод-углеродную двойную связь, называющуюся в настоящем изобретении, например, как "C4-8-циклоалкенил", образованный из циклоалкана. Типичные циклоалкенильные группы включают, но не ограничиваются только ими, циклогексены, циклопентены и циклобутены. Если не указано иное, циклоалкенильные группы необязательно содержат в одном или большем количестве положений кольца, например, следующие заместители: алканоил, алкоксигруппу, алкил, алкенил, алкинил, амидную группу, амидиновую группу, аминогруппу, арил, арилалкил, азидную группу, карбамат, карбонат, карбоксигруппу, цианогруппу, циклоалкил, сложноэфирную группу, простую эфирную группу, формил, галоген, галогеналкил, гетероарил, гетероциклил, гидроксигруппу, иминогруппу, кетогруппу, нитрогруппу, фосфат, фосфонатную группу, фосфинатную группу, сульфат, сульфид, сульфонамидную группу, сульфонил или тиокарбонил. В некоторых вариантах осуществления циклоалкенильная группа не замещена, т. е. она является незамещенной.
[0027] Термин "арил" известен в данной области техники и означает карбоциклическую ароматическую группу. Типичные арильные группы включают фенил, нафтил, антраценил и т. п. Термин "арил" включает полициклические кольцевые системы, содержащие два или большее количество карбоциклических колец, в которых два или большее количество атомов углерода являются общими для двух соседних колец (кольца являются "конденсированными кольцами"), где по меньшей мере одно из колец является ароматическим и, например, другое кольцо (кольца) может представлять собой циклоалкилы, циклоалкенилы, циклоалкинилы, и/или арилы. Если не указано иное, ароматическое кольцо необязательно может содержать в одном или большем количестве положений кольца, например, следующие заместители: галоген, азидную группу, алкил, арилалкил, алкенил, алкинил, циклоалкил, гидроксигруппу, алкоксил, аминогруппу, нитрогруппу, сульфгидрил, иминогруппу, амидную группу, карбоксигруппу, -C(O)алкил, -CO2 алкил, карбонил, карбоксил, алкилтиогруппу, сульфонил, сульфонамидо, сульфонамидную группу, кетогруппу, альдегидную группу, сложноэфирную группу, гетероциклильные, арильные или гетероарильные фрагменты -CF3, -CN и т. п. В некоторых вариантах осуществления ароматическое кольцо содержит в одном или большем количестве положений кольца следующие заместители: галоген, алкил, гидроксигруппу или алкоксил. В некоторых других вариантах осуществления ароматическое кольцо не замещено, т. е. оно является незамещенным. В некоторых вариантах осуществления арильная группа представляет собой 6-10-членную кольцевую структуру.
[0028] Термин "арилалкил" означает алкильную группу, замещенную арильной группой.
[0029] Термин "бициклический карбоциклил, который является частично ненасыщенным", означает бициклическую карбоциклическую группу, содержащую по меньшей мере одну двойную связь между кольцевыми атомами и по меньшей мере одно кольцо в бициклической карбоциклической группе не является ароматическим. Типичные примеры бициклического карбоциклила, который является частично ненасыщенным, включают, например:
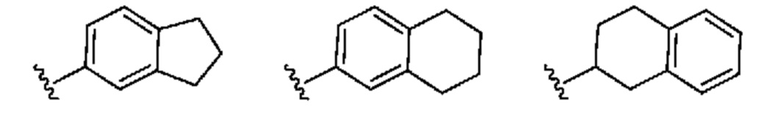
[0030] Термины орто, мета и пара известны в данной области техники и означают 1,2-, 1,3- и 1,4-дизамещенные бензолы соответственно. Например, названия 1,2-диметилбензол и орто-диметилбензол являются синонимами.
[0031] Термины "гетероциклил" и "гетероциклическая группа" известны в данной области техники и означают насыщенные, частично ненасыщенные, или ароматические 3- - 10-членные кольцевые структуры, альтернативно 3- - 7-членные кольца, кольцевые структуры которых включают от 1 до 4 гетероатомов, таких как азот, кислород и сера. Количество кольцевых атомов в гетероциклильной группе можно задать с помощью обозначения Cx-Cx, где x является целым числом, задающим количество кольцевых атомов. Например, C3-C7 гетероциклильная группа означает насыщенную или частично ненасыщенную 3- - 7-членную кольцевую структуру, содержащую от 1 до 4 гетероатомов, таких как азот, кислород и сера. Обозначение "C3-C7" показывает, что гетероциклическое кольцо содержит всего от 3 до 7 кольцевых атомов, включая любые гетероатомы, которые занимают положение кольцевого атома. Одним примером C3 гетероциклила является азиридинил. Гетероциклы также могут представлять собой моно-, би- или другие полициклические кольцевые системы. Гетероцикл может быть сконденсирован с одним или большим количеством арильных, частично ненасыщенных или насыщенных колец. Гетероциклильные группы включают, например, биотинил, хроменил, дигидрофурил, дигидроиндолил, дигидропиранил, дигидротиенил, дитиазолил, гомопиперидинил, имидазолидинил, изохинолил, изотиазолидинил, изооксазолидинил, морфолинил, оксоланил, оксазолидинил, феноксантенил, пиперазинил, пиперидинил, пиранил, пиразолидинил, пиразолинил, пиридил, пиримидинил, пирролидинил, пирролидин-2-онил, пирролинил, тетрагидрофурил, тетрагидризохинолил, тетрагидропиранил, тетрагидрохинолил, тиазолидинил, тиоланил, тиоморфолинил, тиопиранил, ксантенил, лактоны, лактамы, такие как азетидиноны и пирролидиноны, сультамы, сультоны и т. п., если не указано иное, гетероциклическое кольцо необязательно содержит в одном или большем количестве положений такие заместители, как алканоил, алкоксигруппу, алкил, алкенил, алкинил, амидную группу, амидиновую группу, аминогруппу, арил, арилалкил, азидную группу, карбамат, карбонат, карбоксигруппу, цианогруппу, циклоалкил, сложноэфирную группу, простую эфирную группу, формил, галоген, галогеналкил, гетероарил, гетероциклил, гидроксигруппу, иминогруппу, кетогруппу, нитрогруппу, оксогруппу, фосфат, фосфонатную группу, фосфинатную группу, сульфат, сульфид, сульфонамидную группу, сульфонил и тиокарбонил. В некоторых вариантах осуществления гетероциклильная группа не замещена, т. е. она является незамещенной.
[0032] Термин "бициклический гетероциклил" означает гетероциклильную группу, которая содержит 2 кольца, которые сконденсированы друг с другом. Типичные примеры бициклического гетероциклила включают, например:
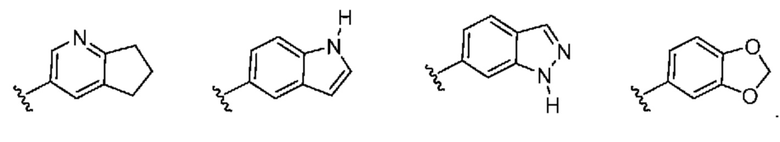
В некоторых вариантах осуществления бициклический гетероциклил представляет собой карбоциклическое кольцо, сконденсированное с частично ненасыщенным гетероциклическим кольцом, которые вместе образуют бициклическую кольцевую структуру, содержащую 8-10 кольцевых атомов (например, в которой содержатся 1, 2, 3 или 4 гетероатома, выбранных из группы, включающей азот, кислород и серу).
[0033] Термин "оксогетероциклил" означает гетероциклильную группу, которая замещена по меньшей мере одной оксогруппой (т. е. =O). В некоторых вариантах осуществления оксогетероциклил замещен с помощью 1 или 2 оксогрупп. В некоторых вариантах осуществления оксогетероциклил представляет собой 5-6-членный насыщенный гетероциклил, замещенный с помощью 1 или 2 оксогрупп.
[0034] Термин "гетероциклоалкил" известен в данной области техники и означает насыщенную гетероциклильную группу, определенную выше. В некоторых вариантах осуществления "гетероциклоалкил" представляет собой 3- - 10-членные кольцевые структуры, альтернативно 3- - 7-членные кольца, кольцевые структуры которых включают от 1 до 4 гетероатомов, таких как азот, кислород и сера.
[0035] Термин "гетероциклоалкилен" означает дирадикал гетероциклоалкильной группы. Типичной гетероциклоалкиленовой группой является 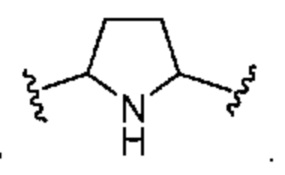 . Гетероциклоалкилен может содержать, например, 3-6 кольцевых атомов (т. е. 3-6-членный гетероциклоалкилен). В некоторых вариантах осуществления гетероциклоалкилен представляет собой 3-6-членный гетероциклоалкилен, содержащий 1, 2 или 3 гетероатома, выбранных из группы, включающей кислород, азот и серу.
. Гетероциклоалкилен может содержать, например, 3-6 кольцевых атомов (т. е. 3-6-членный гетероциклоалкилен). В некоторых вариантах осуществления гетероциклоалкилен представляет собой 3-6-членный гетероциклоалкилен, содержащий 1, 2 или 3 гетероатома, выбранных из группы, включающей кислород, азот и серу.
[0036] Термин "гетероарил" известен в данной области техники и означает ароматические группы, которые включают по меньшей мере один кольцевой гетероатом. В некоторых случаях гетероарильная группа содержит 1, 2, 3 или 4 кольцевых гетероатома. Типичные примеры гетероарильных групп включают пирролил, фуранил, тиофенил, имидазолил, оксазолил, тиазолил, триазолил, пиразолил, пиридинил, пиразинил, пиридазинил и пиримидинил и т. п., если не указано иное, гетероарильное кольцо необязательно может содержать в одном или большем количестве положений кольца, например, следующие заместители: галоген, азидную группу, алкил, арилалкил, алкенил, алкинил, циклоалкил, гидроксигруппу, алкоксил, аминогруппу, нитрогруппу, сульфгидрил, иминогруппу, амидную группу, карбоксигруппу, -C(O)алкил, -CO2 алкил, карбонил, карбоксил, алкилтиогруппу, сульфонил, сульфонамидо, сульфонамидную группу, кетогруппу, альдегидную группу, сложноэфирную группу, гетероциклильные, арильные или гетероарильные фрагменты -CF3, -CN и т. п. Термин "гетероарил" также включает полициклические кольцевые системы, содержащие два или большее количество колец, в которых два или большее количество атомов углерода являются общими для двух соседних колец (кольца являются "конденсированными кольцами"), где по меньшей мере одно из колец является гетероароматическим, например, другие циклические кольца могут представлять собой циклоалкилы, циклоалкенилы, циклоалкинилы и/или арилы. В некоторых вариантах осуществления гетероарильное кольцо содержит в одном или большем количестве положений кольца следующие заместители: галоген, алкил, гидроксигруппу, или алкоксил. В некоторых других вариантах осуществления, гетероарильное кольцо не замещено, т. е. оно является незамещенным. В некоторых вариантах осуществления гетероарильная группа представляет собой 5- - 10-членную кольцевую структуру, альтернативно 5- - 6-членную кольцевую структуру, где кольцевая структура включает 1, 2, 3 или 4 гетероатома, таких как азот, кислород и сера.
[0037] Термин "гетероарилалкил" означает алкильную группу, замещенную гетероарильной группой.
[0038] Термины "амин" и "аминогруппа" известны в данной области техники и означают и незамещенные, и замещенные амины, например, фрагмент, описывающийся общей формулой -N(R50)(R51), в которой R50 и R51 все независимо означают водород, алкил, циклоалкил, гетероциклил, алкенил, арил, арилалкил или -(CH2)m-R61; или R50 и R51 вместе с атомом N, к которму они присоединены, образуют гетероцикл, содержащий от 4 до 8 атомов в кольцевой структуре; R61 означает арил, циклоалкил, циклоалкенил, гетероцикл или полицикл; и m равно 0 или является целым числом в диапазоне от 1 до 8. В некоторых вариантах осуществления R50 и R51 все независимо означают водород, алкил, алкенил или -(CH2)m-R61.
[0039] Термины "алкоксил" или "алкоксигруппа" известны в данной области техники и означают алкильную группу, определенную выше, содержащую присоединенный к ней кислородный радикал. Типичные алкоксильные группы включают метоксигруппу, этоксигруппу, пропилоксигруппу, трет-бутоксигруппу и т. п. "Простой эфир" представляет собой 2 углеводорода, ковалентно связанные кислородом. Соответственно, заместитель алкила, который превращает этот алкил в простой эфир, представляет собой или сходен с алкоксилом, таким как который можно описать одной из следующих формул -O-алкил, -O-алкенил, -O-алкинил, -O-(CH2)m-R61, где m и R61 описаны выше. Термин "галогеналкоксил" означает алкоксильную группу, которая замещена по меньшей мере одним галогеном. Например, -O-CH2F, -O-CHF2, -O-CF3 и т. п. В некоторых вариантах осуществления галогеналкоксил представляет собой алкоксильную группу, которая замещена по меньшей мере одной фторидной группой. В некоторых вариантах осуществления галогеналкоксил представляет собой алкоксильную группу, которая замещена 1-6, 1-5, 1-4, 2-4 или 3 фторидными группами.
[0040] Термин "карбамат" при использовании в настоящем изобретении означает радикал вида -RgOC(O)N(Rh)-, -RgOC(O)N(Rh)Ri-, или -OC(O)NRhRi, где Rg, Rh и Ri все независимо означают алкоксигруппу, арилоксигруппу, алкил, алкенил, алкинил, амид, аминогруппу, арил, арилалкил, карбоксигруппу, цианогруппу, циклоалкил, сложноэфирную группу, простую эфирную группу, формил, галоген, галогеналкил, гетероарил, гетероциклил, гидроксигруппу, кетогруппу, нитрогруппу, сульфид, сульфонил или сульфонамид. Типичные карбаматы включают арилкарбаматы и гетероарилкарбаматы, например, в которых по меньшей мере один из Rg, Rh и Ri независимо означает арил или гетероарил, такой как фенил и пиридинил.
[0041] Термин "карбонил" при использовании в настоящем изобретении означает радикал -C(O)-.
[0042] Термин "карбоксамидная группа" при использовании в настоящем изобретении означает радикал -C(O)NRR', где R и R' могут быть одинаковыми или разными. R и R' могут независимо означать алкил, арил, арилалкил, циклоалкил, формил, галогеналкил, гетероарил или гетероциклил.
[0043] Термин "карбоксигруппа" при использовании в настоящем изобретении означает радикал -COOH или или соответствующие его соли, например, -COONa и т. п.
[0044] Термин "амид" или "амидная группа" при использовании в настоящем изобретении означает радикал вида -Рац(O)N(Rb)-, -Рац(O)N(Rb)Rc-, -C(O)NRbRc, или -C(O)NH2, где Ra, Rb и Rc все независимо означают алкоксигруппу, алкил, алкенил, алкинил, амид, аминогруппу, арил, арилалкил, карбамат, циклоалкил, сложноэфирную группу, простую эфирную группу, формил, галоген, галогеналкил, гетероарил, гетероциклил, водород, гидроксигруппу, кетогруппу или нитрогруппу. Амид может быть присоединен к другой группе через углерод, азот, Rb, Rc или Ra. Амид также может быть циклическим, например, Rb и Rc, Ra и Rb или Ra и Rc могут объединяться с образованием 3- - 12-членного кольца, такого как 3- - 10-членное кольцо или 5- - 6-членное кольцо.
[0045] Термин "амидиновая группа" при использовании в настоящем изобретении означает радикал вида -C(=NR)NR'R'', где R, R', и R'' все независимо означают алкил, алкенил, алкинил, амид, арил, арилалкил, цианогруппу, циклоалкил, галогеналкил, гетероарил, гетероциклил, гидроксигруппу, кетогруппу или нитрогруппу.
[0046] Термин "алканоил" при использовании в настоящем изобретении означает радикал -O-CO-алкил.
[0047] Термин "оксогруппа" известен в данной области техники и означает заместитель "=O". Например, циклопентан, замещенный оксогруппой представляет собой циклопентанон.
[0048] Термин "сульфонамид" или "сульфонамидная группа" при использовании в настоящем изобретении означает радикал, содержащий структуру -N(Rr)-S(O)2-Rs- или -S(O)2-N(Rr)Rs, где Rr, и Rs могут означать, например, водород, алкил, арил, циклоалкил и гетероциклил. Типичные сульфонамиды включают алкилсульфонамиды (например, где Rs означает алкил), арилсульфонамиды (например, где Rs означает арил), циклоалкилсульфонамиды (например, где Rs означает циклоалкил) и гетероциклилсульфонамиды (например, где Rs означает гетероциклил) и т. п.
[0049] Термин "сульфонил" при использовании в настоящем изобретении означает радикал, содержащий структуру RuSO2-, где Ru может означать алкил, арил, циклоалкил и гетероциклил, например, алкилсульфонил. Термин "алкилсульфонил" при использовании в настоящем изобретении означает алкильную группу, присоединенную к сульфонильной группе.
[0050] Символ " " указывает на положение присоединения.
" указывает на положение присоединения.
[0051] Соединения, предлагаемые в настоящем изобретении, могут содержать один или большее количество хиральных центров и/или двойных связей и поэтому существуют в виде стереоизомеров, таких как геометрические изомеры, энантиомеры или диастереоизомеры. Термин "стереоизомеры" при использовании в настоящем изобретении включает все геометрические изомеры, энантиомеры или диастереоизомеры. Эти соединения можно обозначить символами "R" или "S" в зависимости от конфигурации заместителей у стереогенного атома водорода. В объем настоящего изобретения входят разные стереоизомеры этих соединений и их смеси. Стереоизомеры включают энантиомеры и диастереоизомеры. Смеси энантиомеров или диастереоизомеров при использовании номенклатуры можно обозначить с помощью "(±)", но специалист в данной области техники должен понимать, какя структура может явно обозначить хиральный центр. Следует понимать, что графические изображения химических структур, например, родовых химических структур, включают все стереоизомерные формы указываемых соединений, если не указано иное.
[0052] Отдельные стереоизомеры соединений, предлагаемых в настоящем изобретении, можно получить путем синтеза их имеющихся в продаже исходных веществ, которые содержат асимметрические или стереогенные центры, или путем получения рацемических смесей с последующим разделением по методикам, хорошо известным специалистам с общей подготовкой в данной области техники. Примерами этих методик разделения являются (1) присоединение смеси энантиомеров к хиральному вспомогательному веществу, разделение полученной смеси диастереоизомеров с помощью перекристаллизации или хроматографии и отделение оптически чистого продукта от вспомогательного вещества, (2) образование соли с использованием оптически активного разделяющего реагента или (3) прямое разделение смеси оптических энантиомеров на хиральных хроматографических колонках. Стереоизомерные смеси также можно разделить на составляющие их стереоизомеры по хорошо известным методикам, таким как газовая хроматография на хиральной фазе, высокоэффективная жидкостная хроматография на хиральной фазе, кристаллизация соединения в виде комплекса хиральной соли или кристаллизация соединения в хиральном растворителе. Кроме того, энантиомеры можно разделить по методикам надкритической жидкостной хроматографии (SFC), описанным в литературе. Кроме того, стереоизомеры можно получить из стереохимически чистых промежуточных продуктов, реагентов и катализаторов по хорошо известным методикам асимметрического синтеза.
[0053] Геометрические изомеры также существовать у соединений, предлагаемых в настоящем изобретении. Символ 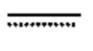 обозначает связь, которая может представлять собой ординарную, двойную или тройную связь, описанную в настоящем изобретении. В объем настоящего изобретения входят разные геометрические изомеры и их смеси, образованные вследствие разного расположения заместителей у углерод-углеродной двойной связи или разного расположения заместителей у карбоциклического кольца. Заместители у углерод-углеродной двойной связи обозначаются, как находящиеся в "Z" или "E" конфигурации, где обозначения "Z" и "E" используются в соответствии с правилами IUPAC. Если не указано иное, структуры, на которых изображены двойные связи, включают и "E", и "Z" изомеры.
обозначает связь, которая может представлять собой ординарную, двойную или тройную связь, описанную в настоящем изобретении. В объем настоящего изобретения входят разные геометрические изомеры и их смеси, образованные вследствие разного расположения заместителей у углерод-углеродной двойной связи или разного расположения заместителей у карбоциклического кольца. Заместители у углерод-углеродной двойной связи обозначаются, как находящиеся в "Z" или "E" конфигурации, где обозначения "Z" и "E" используются в соответствии с правилами IUPAC. Если не указано иное, структуры, на которых изображены двойные связи, включают и "E", и "Z" изомеры.
[0054] Заместители у углерод-углеродной двойной связи альтернативно можно обозначить, как "цис" или "транс", где "цис" означает заместители с одной стороны от двойной связи и "транс" означает заместители с противоположных сторон от двойной связи. Расположение заместителей у карбоциклического кольца обозначаются, как "цис" или "транс". Термин "цис" означает заместители с одной стороны от плоскости кольца и термин "транс" означает заместители с противоположных сторон от плоскости кольца. Смеси соединений, в которых заместители расположены с одной и с противоположных сторон от плоскости кольца обозначаются, как "цис/транс".
[0055] Настоящее изобретение также включает изотопно-меченые соединения, предлагаемые в настоящем изобретении, которые идентичны указанным в настоящем изобретении с тем отличием, что один или большее количество атомов заменены атомом, обладающим атомной массой или массовым числом, отличающимся от атомной массы или массового числа, обычно обнаруживающихся в природе. Примеры изотопов, которые можно включить в соединения, предлагаемые в настоящем изобретении, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36Cl соответственно.
[0056] Некоторые изотопно-меченые раскрытые соединения (например, меченые с помощью 3H и 14C) применимы для исследований распределения лекарственного средства и/или субстрата в ткани. Изотопы трития (т. е. 3H) и углерод-14 (т. е. 14C) являются особенно предпочтительными вследствие легкости получения и пригодности для детектирования. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, (т. е. 2H) может привести к терапевтическим преимуществам, обусловленным большей метаболической стабильностью (например, увеличенным периодом полувыведения in vivo или возможностью использования меньших доз) и следовательно, при некоторых обстоятельствах может быть предпочтительным. Изотопно-меченые соединения, предлагаемые в настоящем изобретении, обычно можно получить по методикам, аналогичных раскрытым, например, в примерах в настоящем изобретении путем замены изотопно-немеченого реагента на изотопно-меченый реагент.
[0057] При использовании в настоящем изобретении термины "субъект" и "пациент" означают организмы, которые лечат способами, предлагаемыми в настоящем изобретении. Такими организмами предпочтительно являются млекопитающие (например, крысиные, обезьяны, лошади, бычьи, свиньй, собачьи, кошачьи и т. п.) и более предпочтительно люди.
[0058] При использовании в настоящем изобретении термин "эффективное количество" означает количество соединения (например, соединения, предлагаемого в настоящем изобретении), достаточное для обеспечения благоприятных или желательных результатов. Эффективное количество можно вводить с помощью одного или большего количества введений, нанесений или доз и оно не ограничивается конкретным препаратом или путем введения. При использовании в настоящем изобретении термин "лечение" включает любой эффект, например, ослабление, уменьшение, модулирование, улучшение или устранение, который приводит к улучшению протекания патологического состояния, заболевания, нарушения и т. п. или улучшению его симптомов.
[0059] При использовании в настоящем изобретении термин "фармацевтическая композиция" означает комбинацию активного средства с носителем, инертным или активным, делающим композицию особенно подходящей для диагностического или терапевтического применения in vivo или ex vivo.
[0060] При использовании в настоящем изобретении термин "фармацевтически приемлемый носитель" означает стандартные фармацевтические носители, такие как забуференный фосфатом физиологический раствор, вода, эмульсии (например, такие как эмульсии масло/вода или вода/масло) и различные типы смачивающих агентов. Композиции также могут включать стабилизаторы и консерванты. Примеры носителей, стабилизаторов и вспомогательных веществ см. Martin, Remington's Pharmaceutical Sciences, 15th Ed., Mack Publ. Co., Easton, PA [1975].
[0061] При использовании в настоящем изобретении термин "фармацевтически приемлемая соль" означает фармацевтически приемлемую соль (например, с кислотой или основанием) соединения, предлагаемого в настоящем изобретении, которая после введения способна образовать соединение, предлагаемое в настоящем изобретении, или его активный метаболит или остаток. Как известно специалистам в данной области техники, "соли" соединений, предлагаемых в настоящем изобретении, можно образовать из неорганических или органических кислот и оснований. Примеры кислот включают, но не ограничиваются только ими, хлористоводородную, бромистоводородную, серную, азотную, хлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, п-толуолсульфоновую, винную, уксусную, лимонную, метансульфоновую, этансульфоновую, муравьиную, бензойную, малоновую, нафталин-2-сульфоновую, бензолсульфоновую кислоту и т. п. Другие кислоты, такие как щавелевая кислота, хотя сами по себе не являются фармацевтически приемлемыми, могут быть использованы для получения солей, пригодных в качестве промежуточных продуктов при получении соединений, предлагаемых в настоящем изобретении, и их фармацевтически приемлемых солей присоединения с кислотами.
[0062] Примеры оснований включают, но не ограничиваются только ими, гидроксиды щелочных металлов (например, натрия), гидроксиды щелочноземельных металлов (например, магния), аммония и соединения формулы NW4+, в которой W означает C1-4 алкил и т. п.
[0063] Примеры солей включают, но не ограничиваются только ими: ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, флюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, пальмоат, пектинат, персульфат, фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат, ундеканоат и т. п. Другие примеры солей включают анионы соединений, предлагаемых в настоящем изобретении, объединенные с подходящим катионом, таким как Na+, NH4+, и NW4+ (где W означает C1-4 алкильную группу) и т. п.
[0064] Для применения в терапии соли соединений, предлагаемых в настоящем изобретении, предполагаются фармацевтически приемлемыми. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут использоваться, например, для получения или очистки фармацевтически приемлемых соединений.
[0065] Аббревиатуры при использовании в настоящем изобретении включают O-(7-азабензотриазол-1-ил)-N,N,N′,N′- тетраметилуронийгексафторфосфат (HATU); диизопропилэтиламин (DIPEA); диметилформамид (DMF); метиленхлорид (DCM); трет-бутоксикарбонил (Boc); тетрагидрофуран (THF); трифторуксусную кислоту (TFA); N-метилморфолин (NMM); триэтиламин (TEA); Boc ангидрид ((Boc)2O); диметилсульфоксид (DMSO); диизопропилэтиламин (DIEA); этилацетат (EA); колоночная флэш-хроматография (FCC); и надкритическая жидкостная хроматография (SFC).
[0066] В настоящем описании, когда композиции и наборы описаны, как имеющие, включающие или содержащие конкретные компоненты, или когда способы и методики описаны, как имеющие, включающие или содержащие конкретные стадии, подразумевается, что дополнительно имеются композиции и наборы, предлагаемые в настоящем изобретении, которые в основном состоят или состоят из указанных компонентов, и что имеются способы и методики, предлагаемые в настоящем изобретении, которые в основном состоят или состоят из указанных стадий обработки.
[0067] Как правило, указанные в процентах содержания являются массовыми, если не указано иное. Кроме того, если для переменной не приведено определение, то дейтсвует предыдущее определение переменной.
II. Замещенный пиразоло[1,5-a]пиримидинилкарбоксамид и родственные органические соединения
[0068] Одним объектом настоящего изобретения является замещенный пиразоло[1,5-a]пиримидинилкарбоксамид и родственные органические соединения. Замещенный пиразоло[1,5-a]пиримидинилкарбоксамид и родственные органические соединения предполагаются применимыми в способах, композициях и наборах, описанных в настоящем изобретении. В некоторых вариантах осуществления замещенный пиразоло[1,5-a]пиримидинилкарбоксамид или родственное органическое соединение является соединением, описывающимся формулой I:
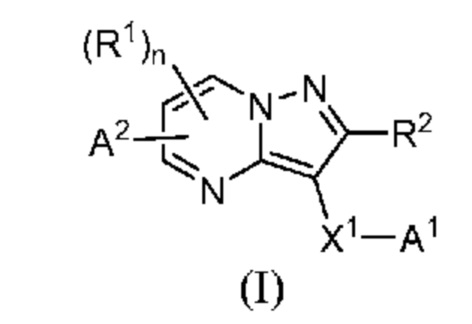
или его фармацевтически приемлемая соль, в которой:
R1 и R2 каждый в каждом случае независимо означает водород, C1-4 алкил, C1-4 галогеналкил, C1-4 гидроксиалкил, C1-4 цианоалкил, C1-4 алкоксил, C1-4 галогеналкоксил, циклопропил, цианогруппу, галоген, гидроксигруппу, -N(R4)2, -O-(C1-4 алкилен)-C1-6 алкоксил или -(C1-4 алкилен)-(2-6-членный гетероалкил, необязательно замещенный одним или большим количеством галогенов);
R3 в каждом случае независимо означает водород, C1-6 алкил или C3-6 циклоалкил;
R4 в каждом случае независимо означает водород, C1-4 алкил, циклопропил или -C(O)R3;
R5 в каждом случае независимо означает C1-4 алкил или C3-6 циклоалкил;
R6 в каждом случае независимо означает C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, цианогруппу, галоген, гидроксигруппу, или -N(R4)2;
R7 в каждом случае независимо означает галоген, гидроксигруппу, цианогруппу, C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C1-4 галогеналкоксил, C3-6 циклоалкил, -O-(C3-6 циклоалкил), -O-(C1-6 алкилен)-C1-6 алкоксил, -(C1-6 алкилен)-CN, -N(R4)2, -C(O)N(R4)2 или гетероарил;
R8 означает связь или C1-6 алкилен;
R9 означает водород или C1-6 алкил;
X1-A1 означает одно из следующих:
X1 означает карбонилсодержащий мостик, выбранный из группы, включающей-C(O)N(H)(C1-6 галогеналкилен)-ψ, -C(O)N(H)(C1-6 алкилен, замещенный C1-4 алкоксилом или C3-6 циклоалкилом)-ψ, -C(O)N(H)(C3-6 циклоалкилен)-ψ, -C(O)N(H)(3-6-членный гетероциклоалкилен)-ψ и -C(O)-(3-6-членный гетероциклоалкилен, содержащий по меньшей мере одну кольцевую группу -N(H)-)-ψ, где ψ означает связь с A1; где A1 означает одно из следующих:
(i) циклическую группу, выбранную из группы, включающей 3-14-членный насыщенный карбоциклил, 5-14-членный частично ненасыщенный карбоциклил, 3-16-членный гетероциклил или фенил; каждый из которых 0, 1 или 2 раза замещен с помощью Y1 и 0, 1, 2 или 3 раза замещен с помощью Y2; или
(ii) C1-8 алкил или C2-6 алкинил;
X1 означает -C(O)N(H)(C1-6 алкилен)-ψ, где ψ означает связь с A1, и A1 означает (i) циклическую группу, выбранную из группы, включающей 5-14-членный частично ненасыщенный карбоциклил, 3-16-членный гетероциклил или фенил; каждый из которых 0, 1 или 2 раза замещен с помощью Y1 и 0, 1, 2 или 3 раза замещен с помощью Y2; или (ii) C2-6 алкинил;
X1 означает -C(O)N(H)-ψ, где ψ означает связь с A1, и A1 означает циклическую группу, выбранную из группы, включающей 5-14-членный частично ненасыщенный карбоциклил, 3-16-членный гетероциклил или фенил; каждый из которых 0, 1 или 2 раза замещен с помощью Y1 и 0, 1, 2 или 3 раза замещен с помощью Y2; и при условии, что R1 не означает водород;
X1 означает -C(O)N(H)-ψ, где ψ означает связь с A1, и A1 означает C2-6 алкинил;
X1 означает -C(O)N(H)(C1-6 алкилен)-ψ или -C(O)N(H)-ψ, где ψ означает связь с A1, и A1 означает 6-14-членный насыщенный карбоциклил, 0, 1 или 2 раза замещенный с помощью Y1 и 0, 1, 2 или 3 раза замещенный с помощью Y2; при условии, что A2 не означает 5-членный гетероарил, необязательно 1, 2 или 3 раза замещенный с помощью R7;
X1 означает -C(O)N(H)(C1-6 алкилен)-ψ или -C(O)N(H)-ψ, где ψ означает связь с A1, и A1 означает 6-14-членный насыщенный спироциклический карбоциклил, 0, 1 или 2 раза замещенный с помощью Y1 и 0, 1, 2 или 3 раза замещенный с помощью Y2;
X1 означает -C(O)N(H)C(C1-6 алкил)2-R8-ψ или -C(O)N(H)C(C1-6 алкил)(R9)-R8-ψ, где ψ означает связь с A1, и A1 означает 3-5-членный насыщенный карбоциклил, 0, 1 или 2 раза замещенный с помощью Y1 и 0, 1, 2 или 3 раза замещенный с помощью Y2; или
X1 означает -C(O)N(H)C(O)-ψ или -C(O)N(H)C(O)(C1-6 алкилен)-ψ, где ψ означает связь с A1; и A1 означает (i) циклическую группу, выбранную из группы, включающей 3-14-членный насыщенный карбоциклил, 5-14-членный частично ненасыщенный карбоциклил, 3-16-членный гетероциклил или фенил; каждый из которых 0, 1 или 2 раза замещен с помощью Y1 и 0, 1, 2 или 3 раза замещен с помощью Y2; или (ii) C1-8 алкил или C2-6 алкинил;
A2 означает одно из следующих:
фенил, 1, 2 или 3 раза замещенный с помощью R7;
циклическую группу, выбранную из группы, включающей 3-12-членный гетероциклил, 4-12-членный оксогетероциклил или 4-10-членный циклоалкил; каждый из которых необязательно 1, 2 или 3 раза замещен с помощью R7; или
-N(R4)(3-10-членный гетероциклил, C3-10 циклоалкил или фенил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6) или -O-(3-10-членный гетероциклил, C3-10 циклоалкил или фенил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6);
Y1 в каждом случае независимо означает одно из следующих:
2-8-членный гетероалкил, необязательно замещенный 6-10-членным арилом, 3-10-членным гетероциклилом или C3-6 галогенциклоалкилом;
3-10-членный гетероциклил, 6-10-членный арил, C3-7 циклоалкил, -O-C3-6 циклоалкил, -O-(3-6-членный гетероциклил), -O-(6-10-членный арил), или -O-(C2-6 алкинил); или
C2-6 алкинил, -C≡C-(C1-6 алкилен)-OR4, -C≡C-(C1-6 алкилен)-N(R3)2, -(C2-4 алкинилен)-(5-6-членный гетероарил) или C2-6 алкенил;
Y2 в каждом случае независимо означает C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, -O-(C1-8 галогеналкил), цианогруппу, азидную группу, -N(R3)2, -(C1-6 алкилен)-(5-6-членный гетероциклил), -(C1-6 алкилен)-CO2R3, -CO2R3, -C(O)R5, -S(O)2R5, -C(O)N(R5)2, -C(O)N(R3)2 или C1-6 галогеналкилзамещенный C3-6 циклоалкил; и
n равно 1, 2 или 3;
при условии, что, если A2 означает 5-6-членный гетероциклоалкил и X1 означает -C(O)N(H)-ψ, то A1 не означает -фенил-(C1-6 алкил).
[0069] Определения переменных в приведенной выше формуле I охватывают множество химических групп. В объем заявки входят варианты осуществления, в которых, например, i) определением переменной является одна химическая группа, выбранная из числа химических групп, указанных выше, ii) определением переменной является набор двух или большего количества химических групп, выбранных из числа указанных выше, и iii) соединение определяется комбинацией переменных, в которой переменные определены в (i) или (ii), например, так что X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ, R1 и R2 каждый в каждом случае независимо означает водород или C1-4 алкил и A2 означает фенил, замещенный с помощью 1 или 2 R7.
[0070] Соответственно, в некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)C(H)(CF3)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 алкилен)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C(CH3)2)-ψ или -C(O)N(H)(C(H)(CH3))-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 алкилен, замещенный C1-4 алкоксилом)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 алкилен, замещенный C3-6 циклоалкилом)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C3-6 циклоалкилен)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(3-6-членный гетероциклоалкилен)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)-ψ.
[0071] В некоторых вариантах осуществления A2 означает фенил, содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает фенил, содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу и галоген, где содержится по меньшей мере один заместитель в мета-положении в фенильной группе. В некоторых вариантах осуществления A2 означает фенил, замещенный в одном мета-положении C1-4 алкоксилом, цианогруппой или галогеном и необязательно замещенный где-либо в фенильной группе C1-4 алкилом, C1-4 галогеналкилом, C1-4 алкоксилом, C3-5 циклоалкилом или галогеном. В некоторых вариантах осуществления A2 означает фенил, фенил, замещенный C1-4 алкоксилом, цианогруппой или галогеном В некоторых вариантах осуществления A2 означает фенил, замещенный в одном мета-положении C1-4 алкоксилом, цианогруппой или галогеном.
[0072] В некоторых вариантах осуществления A2 означает 5-12-членный гетероциклил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает 5-6-членный гетероарил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает 5-6-членный гетероарил, выбранный из группы, включающей пиридинил, пиримидинил, пиразинил, фуранил, пирролил, тиофенил, имидазолил, оксазолил, изоксазолил, изотиазолил и тиазолил, каждый из которых необязательно содержит 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает 5-6-членный гетероарил, выбранный из группы, включающей пиридинил, пиримидинил, пиразинил, фуранил, пирролил, тиофенил, оксазолил, изоксазолил и тиазолил, каждый из которых необязательно содержит 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает пиридинил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает 3-пиридинил, необязательно содержащий 1 или 2 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу и галоген.
[0073] В некоторых вариантах осуществления A2 означает 5-6-членный гетероарил, выбранный из группы, включающей пиридинил, пиримидинил, пиразинил, фуранил, пирролил, тиофенил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, и оксадиазолил каждый из которых необязательно содержит 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2.
[0074] В некоторых вариантах осуществления A2 означает бициклический гетероарил, выбранный из группы, включающей бензимидазолил, бензоксазолил, бензодиоксолил, и бензотиазолил, каждый из которых необязательно содержит 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2.
[0075] В некоторых вариантах осуществления A2 означает 5-6-членный гетероциклоалкил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает 5-6-членный гетероциклоалкил, выбранный из группы, включающей морфолинил, пиперидинил, пирролидинил, тетрагидропиранил и тетрагидрофуранил, каждый из которых необязательно содержит 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2.
[0076] В некоторых вариантах осуществления A2 означает 4-12-членный оксогетероциклил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает 5-6-членный оксогетероциклил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает 5-6-членный оксогетероциклил, выбранный из группы, включающей оксоимидазолидинил, оксотетрагидропиримидинил, оксооксазолидинил, оксопирролидинил и оксотетрагидрофуранил, каждый из которых необязательно содержит 1, 2 или 3 заместителя, выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает 5-6-членный оксогетероциклил, выбранный из группы, включающей оксоимидазолидинил, оксотетрагидропиримидин-1(2H)-ил, оксооксазолидинил и оксопирролидинил, каждый из которых необязательно содержит 1, 2 или 3 заместителя, выбранных из группы, включающей C1-4 алкил и C1-4 галогеналкил.
[0077] В некоторых вариантах осуществления A2 означает 5-10-членный циклоалкил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает 5-6-членный циклоалкил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2.
[0078] В некоторых вариантах осуществления A2 означает -N(R4)(3-10-членный гетероциклил, C3-10 циклоалкил или фенил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6) или -O-(3-10-членный гетероциклил, C3-10 циклоалкил или фенил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6). В некоторых вариантах осуществления A2 означает -N(R4)(3-10-членный гетероциклоалкил или C3-10 циклоалкил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6) или -O-(3-10-членный гетероциклоалкил или C3-10 циклоалкил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6). В некоторых вариантах осуществления A2 означает -N(R4)(тетрагидропиранил, морфолинил или пиперидинил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6), -N(R4)(C4-6 циклоалкил, необязательно 1, 2 или 3 раза замещенный с помощью R6), -O-(тетрагидропиранил, морфолинил или пиперидинил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6), или -O-(C4-6 циклоалкил, необязательно 1, 2 или 3 раза замещенный с помощью R6).
[0079] В некоторых вариантах осуществления A2 расположен в положении 5 пиразоло[1,5-a]пиримидинила. В некоторых вариантах осуществления n равно 1. В некоторых вариантах осуществления A2 расположен в положении 5 пиразоло[1,5-a]пиримидинила, n равно 1 и группа R1 расположена в положении 7 пиразоло[1,5-a]пиримидинила.
[0080] В некоторых вариантах осуществления A2 расположен в положении 7 пиразоло[1,5-a]пиримидинила. В некоторых вариантах осуществления n равно 1. В некоторых вариантах осуществления A2 расположен в положении 7 пиразоло[1,5-a]пиримидинила, n равно 1 и группа R1 расположена в положении пиразоло[1,5-a]пиримидинила.
[0081] В некоторых вариантах осуществления R1 в каждом случае независимо означает C1-4 алкил, C1-4 галогеналкил, -(C1-4 алкилен)-(2-6-членный гетероалкил), циклопропил, галоген или -N(R4)2. В некоторых вариантах осуществления R1 в каждом случае независимо означает C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, циклопропил, цианогруппу, хлор или фтор. В некоторых вариантах осуществления R1 означает метил.
[0082] В некоторых вариантах осуществления R2 означает водород. В некоторых вариантах осуществления R1 и R2 каждый в каждом случае независимо означает водород или C1-4 алкил.
[0083] В некоторых вариантах осуществления R3 и R4 каждый в каждом случае независимо означает водород, метил или этил.
[0084] В некоторых вариантах осуществления A1 означает (i) 3-5-членный насыщенный карбоциклил или (ii) 6-14-членный насыщенный спироциклический карбоциклил, каждый необязательно замещен с помощью 1 или 2 C1-4 алкильных групп. В некоторых вариантах осуществления A1 означает 3-14-членный насыщенный карбоциклил, 0, 1 или 2 раза замещенный с помощью Y1 и 0, 1, 2 или 3 раза замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает C3-7 циклоалкил, один раз замещенный с помощью Y1 и 0-1 раз замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает 5-14-членный частично ненасыщенный карбоциклил, 0, 1 или 2 раза замещенный с помощью Y1 и 0, 1, 2 или 3 раза замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает 8-12-членный бициклический карбоциклил, который является частично ненасыщенным, или 8-12-членный бициклический гетероциклил, каждый из которых 0 или 1 раз замещен с помощью Y1 и 0, 1 или 2 раза замещен с помощью Y2. В некоторых вариантах осуществления A1 означает фенил, один раз замещенный с помощью Y1 и 0-1 раз замещенный с помощью Y2.
[0085] В некоторых вариантах осуществления A1 означает 5-6-членный гетероарил, один раз замещенный с помощью Y1 и 0-1 раз замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает пиридинил, один раз замещенный с помощью Y1 и 0-1 раз замещенный с помощью Y2.
[0086] В некоторых вариантах осуществления A1 означает C3-7 циклоалкил, замещенный C1-6 алкоксилом. В некоторых вариантах осуществления A1 означает циклогексил, замещенный C1-6 алкоксилом. В некоторых вариантах осуществления A1 означает C3-7 циклоалкил, который не является замещенным. В некоторых вариантах осуществления A1 означает C7-10 циклоалкил, который является спироциклическим и не замещен. В некоторых вариантах осуществления A1 означает циклопропил.
[0087] В некоторых вариантах осуществления A1 означает фенил, замещенный C2 алкинилом.
[0088] В некоторых вариантах осуществления A1 означает 8-12-членный бициклический карбоциклил, который является частично ненасыщенным, или 8-12-членный бициклический гетероциклил, каждый из которых 0 или 1 раз замещен с помощью Y2, выбранного из группы, включающей C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, гидроксигруппу и C1-6 алкоксил. В некоторых вариантах осуществления A1 означает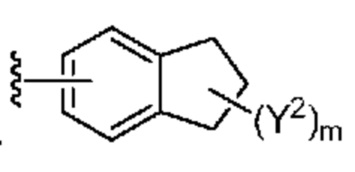 или
или 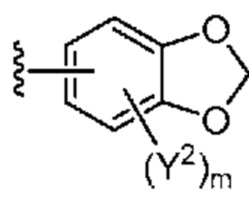 ; где m равно 0, 1 или 2; и Y2 в каждом случае независимо означает C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, гидроксигруппу, или C1-6 алкоксил.
; где m равно 0, 1 или 2; и Y2 в каждом случае независимо означает C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, гидроксигруппу, или C1-6 алкоксил.
[0089] В некоторых вариантах осуществления в любом случае Y2 независимо означает C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил или гидроксигруппу. В некоторых вариантах осуществления в любом случае Y2 независимо означает C1-3 алкил. В некоторых вариантах осуществления Y2 означает C1-6 галогеналкилзамещенный C3-6 циклоалкил.
[0090] В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил, необязательно замещенный 6-10-членным арилом или 3-10-членным гетероциклилом. В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил, замещенный 6-10-членным арилом или 3-10-членным гетероциклилом. В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил, замещенный 3-10-членным гетероциклилом. В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил, замещенный 5-6-членным гетероарилом, таким как пирролил, фуранил или пиридинил. В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил.
[0091] В некоторых вариантах осуществления Y1 означает -O-(C1-7 алкил). В некоторых вариантах осуществления Y1 означает -O-бутил, -O-пентил или -O-гексил. В некоторых вариантах осуществления Y1 означает -(C1-3 алкилен)-O-(5-6-членный гетероарил). В некоторых вариантах осуществления Y1 означает -CH2-O-(5-6-членный гетероарил). В некоторых вариантах осуществления Y1 означает -CH2-O-(5-6-членный гетероарил), где 5-6-членный гетероарил представляет собой фуранил, пирролил, тиофенил, имидазолил, пиразолил, оксазолил, тиазолил, пиридинил, пиримидинил, пиразинил, изооксазолил, изотиазолил, оксадиазолил, тиадиазолил, имидазолинил, оксазолинил, пиразолинил, тиазолинил или триазолинил, каждый из которых содержит 1 или 2 заместителя, независимо выбранных из группы, включающей C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, цианогруппу, -N(R4)2, амид и -CO2H.
[0092] В некоторых вариантах осуществления Y1 означает 3-10-членный гетероциклил, 6-10-членный арил, C3-7 циклоалкил, -O-(3-6-членный гетероциклил), -O-(6-10-членный арил), или -O-(C2-6 алкинил). В некоторых вариантах осуществления Y1 означает 3-10-членный гетероциклил, выбранный из группы, включающей 5-6-членный гетероарил и 5-6-членный гетероциклоалкил. В некоторых вариантах осуществления Y1 означает 5-членный гетероарил. В некоторых вариантах осуществления Y1 означает 5-членный гетероарил, содержащий 1 или 2 заместителя, независимо выбранных из группы, включающей C1-6 алкил, C3-7 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, цианогруппу, -N(R4)2, амид и -CO2H. В некоторых вариантах осуществления Y1 означает 5-членный гетероарил, содержащий 1 или 2 заместителя, независимо выбранных из группы, включающей C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, гидроксигруппу и C1-6 алкоксил.
[0093] В некоторых вариантах осуществления Y1 означает фуранил, пирролил, тиофенил, имидазолил, пиразолил, оксазолил или тиазолил. В некоторых вариантах осуществления Y1 означает фуранил, пирролил, тиофенил, имидазолил, пиразолил, оксазолил или тиазолил, каждый из которых содержит 1 или 2 заместителя, независимо выбранных из группы, включающей C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, цианогруппу, -N(R4)2, амид и -CO2H.
[0094] В некоторых вариантах осуществления Y1 означает пиридинил, пиримидинил, пиразинил, изооксазолил, изотиазолил, имидазолил, оксадиазолил, тиадиазолил, имидазолинил, оксазолинил, пиразолинил, тиазолинил или триазолинил. В некоторых вариантах осуществления Y1 означает пиридинил, пиримидинил, пиразинил, изооксазолил, изотиазолил, имидазолил, оксадиазолил, тиадиазолил, имидазолинил, оксазолинил, пиразолинил, тиазолинил или триазолинил, каждый из которых содержит 1 или 2 заместителя, независимо выбранных из группы, включающей C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, цианогруппу, -N(R4)2, амид и -CO2H.
[0095] В некоторых вариантах осуществления Y1 означает C2-6 алкинил, -C≡C-(C1-6 алкилен)-OR4, -C≡C-(C1-6 алкилен)-N(R3)2, -(C2-4 алкинилен)-(5-6-членный гетероарил) или C2-6 алкенил. В некоторых вариантах осуществления Y1 означает C2-6 алкинил. В некоторых вариантах осуществления Y1 означает -C≡CH. В некоторых вариантах осуществления Y1 означает -C≡C-(C1-6 алкилен)-OR4. В некоторых вариантах осуществления Y1 означает -C≡C-(C1-6 алкилен)-O-(C1-2 алкил). В некоторых вариантах осуществления Y1 означает -C≡C-CH2-O-CH3.
[0096] В некоторых вариантах осуществления Y1 означает -O-(C1-7 алкил). В некоторых вариантах осуществления Y1 означает -O-бутил, -O-пентил или -O-гексил. В некоторых вариантах осуществления Y1 означает C2-6 алкинил, -C≡C-(C1-6 алкилен)-OR4, -C≡C-(C1-6 алкилен)-N(R3)2, -(C2-4 алкинилен)-(5-6-членный гетероарил) или C2-6 алкенил. В некоторых вариантах осуществления Y1 означает -C≡CH. В некоторых вариантах осуществления Y1 означает -C≡C-(C1-6 алкилен)-OR4. В некоторых вариантах осуществления Y1 означает -C≡C-CH2-O-CH3. В некоторых вариантах осуществления Y1 означает C2-6 алкинил.
[0097] В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил, необязательно замещенный 6-10-членным арилом или 3-10-членным гетероциклилом. В некоторых вариантах осуществления Y1 означает -(C1-3 алкилен)-O-(5-6-членный гетероарил). В некоторых вариантах осуществления Y1 означает 3-10-членный гетероциклил, 6-10-членный арил, C3-7 циклоалкил, -O-(3-6-членный гетероциклил), -O-(6-10-членный арил), или -O-(C2-6 алкинил). В некоторых вариантах осуществления Y1 означает 3-10-членный гетероциклил, выбранный из группы, включающей 5-6-членный гетероарил и 5-6-членный гетероциклоалкил. В некоторых вариантах осуществления Y1 означает 5-членный гетероарил. В некоторых вариантах осуществления Y1 означает фуранил, пирролил, тиофенил, имидазолил, пиразолил, оксазолил или тиазолил.
[0098] В приведенном выше описании представлены многочисленные варианты осуществления, относящиеся к соединениям формулы I. В объем настоящей заявки на патент специально включены все комбинации вариантов осуществления. Например, настоящее изобретение включает соединение формулы I, в которой X1 означает -C(O)N(H)C(H)(CF3)-ψ, R1 и R2 каждый в каждом случае независимо означает водород или C1-4 алкил и A2 означает фенил, содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2.
[0099] В некоторых вариантах осуществления соединением является соединение формулы I-1:
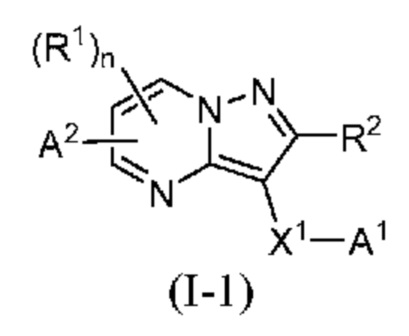
или его фармацевтически приемлемая соль, в которой:
R1 и R2 каждый в каждом случае независимо означает водород, C1-4 алкил, C1-4 галогеналкил, C1-4 гидроксиалкил, C1-4 цианоалкил, C1-4 алкоксил, C1-4 галогеналкоксил, циклопропил, цианогруппу, галоген, гидроксигруппу, -N(R4)2, -O-(C1-4 алкилен)-C1-6 алкоксил или -(C1-4 алкилен)-(2-6-членный гетероалкил, необязательно замещенный одним или большим количеством галогенов);
R3 в каждом случае независимо означает водород, C1-6 алкил или C3-6 циклоалкил;
R4 в каждом случае независимо означает водород, C1-4 алкил, циклопропил или -C(O)R3;
R5 в каждом случае независимо означает C1-4 алкил или C3-6 циклоалкил;
R6 в каждом случае независимо означает C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, цианогруппу, галоген, гидроксигруппу, или -N(R4)2;
R7 в каждом случае независимо означает галоген, гидроксигруппу, цианогруппу, C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C1-4 галогеналкоксил, C3-6 циклоалкил, -O-(C3-6 циклоалкил), -O-(C1-6 алкилен)-C1-6 алкоксил, -(C1-6 алкилен)-CN, -N(R4)2, -C(O)N(R4)2 или гетероарил;
X1 означает карбонилсодержащий мостик, выбранный из группы, включающей -C(O)N(H)(C1-6 галогеналкилен)-ψ, -C(O)N(H)(C1-6 алкилен необязательно, замещенный C1-4 алкоксилом или C3-6 циклоалкил)-ψ, -C(O)N(H)(C3-6 циклоалкилен)-ψ, -C(O)N(H)(3-6-членный гетероциклоалкилен)-ψ, -C(O)-(3-6-членный гетероциклоалкилен, содержащий по меньшей мере одну кольцевую группу -N(H)-)-ψ, и -C(O)N(H)-ψ, где ψ означает связь с A1;
A1 означает одно из следующих:
циклическую группу, выбранную из группы, включающей 3-14-членный насыщенный карбоциклил, 5-14-членный частично ненасыщенный карбоциклил, 3-16-членный гетероциклил или фенил; каждый из которых 0, 1 или 2 раза замещен с помощью Y1 и 0, 1, 2 или 3 раза замещен с помощью Y2; или
C1-8 алкил или C2-6 алкинил;
A2 означает одно из следующих:
фенил, 1, 2 или 3 раза замещенный с помощью R7;
циклическую группу, выбранную из группы, включающей 3-12-членный гетероциклил, 4-12-членный оксогетероциклил или 4-10-членный циклоалкил; каждый из которых необязательно 1, 2 или 3 раза замещен с помощью R7; или
-N(R4)(3-10-членный гетероциклил, C3-10 циклоалкил или фенил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6) или -O-(3-10-членный гетероциклил, C3-10 циклоалкил или фенил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6);
Y1 в каждом случае независимо означает одно из следующих:
2-8-членный гетероалкил, необязательно замещенный 6-10-членным арилом, 3-10-членным гетероциклилом или C3-6 галогенциклоалкилом;
3-10-членный гетероциклил, 6-10-членный арил, C3-7 циклоалкил, -O-C3-6 циклоалкил, -O-(3-6-членный гетероциклил), -O-(6-10-членный арил), или -O-(C2-6 алкинил); или
C2-6 алкинил, -C≡C-(C1-6 алкилен)-OR4, -C≡C-(C1-6 алкилен)-N(R3)2, -(C2-4 алкинилен)-(5-6-членный гетероарил) или C2-6 алкенил;
Y2 в каждом случае независимо означает C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, -O-(C1-8 галогеналкил), цианогруппу, азидную группу, -N(R3)2, -(C1-6 алкилен)-(5-6-членный гетероциклил), -(C1-6 алкилен)-CO2R3, -CO2R3, -C(O)R5, -S(O)2R5, -C(O)N(R5)2, -C(O)N(R3)2 или C1-6 галогеналкилзамещенный C3-6 циклоалкил; и
n равно 1, 2 или 3;
при условии, что, если A2 означает 5-6-членный гетероциклоалкил и X1 означает -C(O)N(H)-ψ, то A1 не означает -фенил-(C1-6 алкил).
[00100] Определения переменных в приведенной выше формуле I-1 охватывают множество химических групп. В объем заявки входят варианты осуществления, в которых, например, i) определением переменной является одна химическая группа, выбранная из числа химических групп, указанных выше, ii) определением переменной является набор двух или большего количества химических групп, выбранных из числа указанных выше, и iii) соединение определяется комбинацией переменных, в которой переменные определены в (i) или (ii), например, так что X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ, R1 и R2 каждый в каждом случае независимо означает водород или C1-4 алкил и A2 означает фенил, замещенный с помощью 1 или 2 R7.
[00101] Соответственно, в некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)C(H)(CF3)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 алкилен)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C(CH3)2)-ψ или -C(O)N(H)(C(H)(CH3))-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 алкилен, замещенный C1-4 алкоксилом)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 алкилен, замещенный C3-6 циклоалкилом)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C3-6 циклоалкилен)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(3-6-членный гетероциклоалкилен)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)-ψ.
[00102] В некоторых вариантах осуществления A2 означает фенил, содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает фенил, содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу и галоген, где содержится по меньшей мере один заместитель в мета-положении в фенильной группе. В некоторых вариантах осуществления A2 означает фенил, замещенный в одном мета-положении C1-4 алкоксилом, цианогруппой или галогеном и необязательно замещенный где-либо в фенильной группе C1-4 алкилом, C1-4 галогеналкилом, C1-4 алкоксилом, C3-5 циклоалкилом или галогеном. В некоторых вариантах осуществления A2 означает фенил, фенил, замещенный C1-4 алкоксилом, цианогруппой или галогеном В некоторых вариантах осуществления A2 означает фенил, замещенный в одном мета-положении C1-4 алкоксилом, цианогруппой или галогеном.
[00103] В некоторых вариантах осуществления A2 означает 5-12-членный гетероциклил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает 5-6-членный гетероарил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает 5-6-членный гетероарил, выбранный из группы, включающей пиридинил, пиримидинил, пиразинил, фуранил, пирролил, тиофенил, оксазолил, изоксазолил и тиазолил, каждый из которых необязательно содержит 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает пиридинил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает 3-пиридинил, необязательно содержащий 1 или 2 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу и галоген.
[00104] В некоторых вариантах осуществления A2 означает 5-6-членный гетероциклоалкил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает 5-6-членный гетероциклоалкил, выбранный из группы, включающей морфолинил, пиперидинил, пирролидинил, тетрагидропиранил и тетрагидрофуранил, каждый из которых необязательно содержит 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2.
[00105] В некоторых вариантах осуществления A2 означает 5-10-членный циклоалкил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2. В некоторых вариантах осуществления A2 означает 5-6-членный циклоалкил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2.
[00106] В некоторых вариантах осуществления A2 означает -N(R4)(3-10-членный гетероциклил, C3-10 циклоалкил или фенил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6) или -O-(3-10-членный гетероциклил, C3-10 циклоалкил или фенил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6). В некоторых вариантах осуществления A2 означает -N(R4)(3-10-членный гетероциклоалкил или C3-10 циклоалкил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6) или -O-(3-10-членный гетероциклоалкил или C3-10 циклоалкил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6). В некоторых вариантах осуществления A2 означает -N(R4)(тетрагидропиранил, морфолинил или пиперидинил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6), -N(R4)(C4-6 циклоалкил, необязательно 1, 2 или 3 раза замещенный с помощью R6), -O-(тетрагидропиранил, морфолинил или пиперидинил, каждый необязательно 1, 2 или 3 раза замещен с помощью R6), или -O-(C4-6 циклоалкил, необязательно 1, 2 или 3 раза замещенный с помощью R6).
[00107] В некоторых вариантах осуществления A2 расположен в положении 5 пиразоло[1,5-a]пиримидинила. В некоторых вариантах осуществления n равно 1. В некоторых вариантах осуществления A2 расположен в положении 5 пиразоло[1,5-a]пиримидинила, n равно 1 и группа R1 расположена в положении 7 пиразоло[1,5-a]пиримидинила.
[00108] В некоторых вариантах осуществления A2 расположен в положении 7 пиразоло[1,5-a]пиримидинила. В некоторых вариантах осуществления n равно 1. В некоторых вариантах осуществления A2 расположен в положении 7 пиразоло[1,5-a]пиримидинила, n равно 1 и группа R1 расположена в положении 5 пиразоло[1,5-a]пиримидинила.
[00109] В некоторых вариантах осуществления R1 в каждом случае независимо означает C1-4 алкил, C1-4 галогеналкил, -(C1-4 алкилен)-(2-6-членный гетероалкил), циклопропил, галоген или -N(R4)2. В некоторых вариантах осуществления R1 в каждом случае независимо означает C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, циклопропил, цианогруппу, хлор или фтор. В некоторых вариантах осуществления R1 означает метил.
[00110] В некоторых вариантах осуществления R2 означает водород. В некоторых вариантах осуществления R1 и R2 каждый в каждом случае независимо означает водород или C1-4 алкил.
[00111] В некоторых вариантах осуществления R3 и R4 каждый в каждом случае независимо означает водород, метил или этил.
[00112] В некоторых вариантах осуществления A1 означает 3-14-членный насыщенный карбоциклил, 0, 1 или 2 раза замещенный с помощью Y1 и 0, 1, 2 или 3 раза замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает C3-7 циклоалкил, один раз замещенный с помощью Y1 и 0-1 раз замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает 5-14-членный частично ненасыщенный карбоциклил, 0, 1 или 2 раза замещенный с помощью Y1 и 0, 1, 2 или 3 раза замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает 8-12-членный бициклический карбоциклил, который является частично ненасыщенным, или 8-12-членный бициклический гетероциклил, каждый из которых 0 или 1 раз замещен с помощью Y1 и 0, 1 или 2 раза замещен с помощью Y2. В некоторых вариантах осуществления A1 означает фенил, один раз замещенный с помощью Y1 и 0-1 раз замещенный с помощью Y2.
[00113] В некоторых вариантах осуществления A1 означает 5-6-членный гетероарил, один раз замещенный с помощью Y1 и 0-1 раз замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает пиридинил, один раз замещенный с помощью Y1 и 0-1 раз замещенный с помощью Y2.
[00114] В некоторых вариантах осуществления A1 означает C3-7 циклоалкил, замещенный C1-6 алкоксилом. В некоторых вариантах осуществления A1 означает циклогексил, замещенный C1-6 алкоксилом. В некоторых вариантах осуществления A1 означает C3-7 циклоалкил, который не является замещенным. В некоторых вариантах осуществления A1 означает C7-10 циклоалкил, который является спироциклическим и не замещен. В некоторых вариантах осуществления A1 означает циклопропил.
[00115] В некоторых вариантах осуществления A1 означает фенил, замещенный C2 алкинилом.
[00116] В некоторых вариантах осуществления A1 означает 8-12-членный бициклический карбоциклил, который является частично ненасыщенным, или 8-12-членный бициклический гетероциклил, каждый из которых 0 или 1 раз замещен с помощью Y2, выбранного из группы, включающей C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, гидроксигруппу и C1-6 алкоксил. В некоторых вариантах осуществления A1 означает или
или  ; где m равно 0, 1 или 2; и Y2 в каждом случае независимо означает C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, гидроксигруппу или C1-6 алкоксил.
; где m равно 0, 1 или 2; и Y2 в каждом случае независимо означает C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, гидроксигруппу или C1-6 алкоксил.
[00117] В некоторых вариантах осуществления в любом случае Y2 независимо означает C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил или гидроксигруппу. В некоторых вариантах осуществления в любом случае Y2 независимо означает C1-3 алкил. В некоторых вариантах осуществления Y2 означает C1-6 галогеналкилзамещенный C3-6 циклоалкил.
[00118] В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил, необязательно замещенный 6-10-членным арилом или 3-10-членным гетероциклилом. В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил, замещенный 6-10-членным арилом или 3-10-членным гетероциклилом. В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил, замещенный 3-10-членным гетероциклилом. В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил, замещенный 5-6-членным гетероарилом, таким как пирролил, фуранил или пиридинил. В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил.
[00119] В некоторых вариантах осуществления Y1 означает -O-(C1-7 алкил). В некоторых вариантах осуществления Y1 означает -O-бутил, -O-пентил или -O-гексил. В некоторых вариантах осуществления Y1 означает -(C1-3 алкилен)-O-(5-6-членный гетероарил). В некоторых вариантах осуществления Y1 означает -CH2-O-(5-6-членный гетероарил). В некоторых вариантах осуществления Y1 означает -CH2-O-(5-6-членный гетероарил), где 5-6-членный гетероарил представляет собой фуранил, пирролил, тиофенил, имидазолил, пиразолил, оксазолил, тиазолил, пиридинил, пиримидинил, пиразинил, изооксазолил, изотиазолил, оксадиазолил, тиадиазолил, имидазолинил, оксазолинил, пиразолинил, тиазолинил или триазолинил, каждый из которых содержит 1 или 2 заместителя, независимо выбранных из группы, включающей C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, цианогруппу, -N(R4)2, амид и -CO2H.
[00120] В некоторых вариантах осуществления Y1 означает 3-10-членный гетероциклил, 6-10-членный арил, C3-7 циклоалкил, -O-(3-6-членный гетероциклил), -O-(6-10-членный арил), или -O-(C2-6 алкинил). В некоторых вариантах осуществления Y1 означает 3-10-членный гетероциклил, выбранный из группы, включающей 5-6-членный гетероарил и 5-6-членный гетероциклоалкил. В некоторых вариантах осуществления Y1 означает 5-членный гетероарил. В некоторых вариантах осуществления Y1 означает 5-членный гетероарил, содержащий 1 или 2 заместителя, независимо выбранных из группы, включающей C1-6 алкил, C3-7 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, цианогруппу, -N(R4)2, амид и -CO2H. В некоторых вариантах осуществления Y1 означает 5-членный гетероарил, содержащий 1 или 2 заместителя, независимо выбранных из группы, включающей C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, гидроксигруппу и C1-6 алкоксил.
[00121] В некоторых вариантах осуществления Y1 означает фуранил, пирролил, тиофенил, имидазолил, пиразолил, оксазолил или тиазолил. В некоторых вариантах осуществления Y1 означает фуранил, пирролил, тиофенил, имидазолил, пиразолил, оксазолил или тиазолил, каждый из которых содержит 1 или 2 заместителя, независимо выбранных из группы, включающей C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, цианогруппу, -N(R4)2, амид и -CO2H.
[00122] В некоторых вариантах осуществления Y1 означает пиридинил, пиримидинил, пиразинил, изооксазолил, изотиазолил, имидазолил, оксадиазолил, тиадиазолил, имидазолинил, оксазолинил, пиразолинил, тиазолинил или триазолинил. В некоторых вариантах осуществления Y1 означает пиридинил, пиримидинил, пиразинил, изооксазолил, изотиазолил, имидазолил, оксадиазолил, тиадиазолил, имидазолинил, оксазолинил, пиразолинил, тиазолинил или триазолинил, каждый из которых содержит 1 или 2 заместителя, независимо выбранных из группы, включающей C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, цианогруппу, -N(R4)2, амид и -CO2H.
[00123] В некоторых вариантах осуществления Y1 означает C2-6 алкинил, -C≡C-(C1-6 алкилен)-OR4, -C≡C-(C1-6 алкилен)-N(R3)2, -(C2-4 алкинилен)-(5-6-членный гетероарил) или C2-6 алкенил. В некоторых вариантах осуществления Y1 означает C2-6 алкинил. В некоторых вариантах осуществления Y1 означает -C≡CH. В некоторых вариантах осуществления Y1 означает -C≡C-(C1-6 алкилен)-OR4. В некоторых вариантах осуществления Y1 означает -C≡C-(C1-6 алкилен)-O-(C1-2 алкил). В некоторых вариантах осуществления Y1 означает -C≡C-CH2-O-CH3.
[00124] В некоторых вариантах осуществления Y1 означает -O-(C1-7 алкил). В некоторых вариантах осуществления Y1 означает -O-бутил, -O-пентил или -O-гексил. В некоторых вариантах осуществления Y1 означает C2-6 алкинил, -C≡C-(C1-6 алкилен)-OR4, -C≡C-(C1-6 алкилен)-N(R3)2, -(C2-4 алкинилен)-(5-6-членный гетероарил) или C2-6 алкенил. В некоторых вариантах осуществления Y1 означает -C≡CH. В некоторых вариантах осуществления Y1 означает -C≡C-(C1-6 алкилен)-OR4. В некоторых вариантах осуществления Y1 означает -C≡C-CH2-O-CH3. В некоторых вариантах осуществления Y1 означает C2-6 алкинил.
[00125] В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил, необязательно замещенный 6-10-членным арилом или 3-10-членным гетероциклилом. В некоторых вариантах осуществления Y1 означает -(C1-3 алкилен)-O-(5-6-членный гетероарил). В некоторых вариантах осуществления Y1 означает 3-10-членный гетероциклил, 6-10-членный арил, C3-7 циклоалкил, -O-(3-6-членный гетероциклил), -O-(6-10-членный арил), или -O-(C2-6 алкинил). В некоторых вариантах осуществления Y1 означает 3-10-членный гетероциклил, выбранный из группы, включающей 5-6-членный гетероарил и 5-6-членный гетероциклоалкил. В некоторых вариантах осуществления Y1 означает 5-членный гетероарил. В некоторых вариантах осуществления Y1 означает фуранил, пирролил, тиофенил, имидазолил, пиразолил, оксазолил или тиазолил.
[00126] В приведенном выше описании представлены многочисленные варианты осуществления, относящиеся к соединениям формулы I-1. В объем настоящей заявки на патент специально включены все комбинации вариантов осуществления. Например, настоящее изобретение включает соединение формулы I-1, в которой X1 означает -C(O)N(H)C(H)(CF3)-ψ, R1 и R2 каждый в каждом случае независимо означает водород или C1-4 алкил и A2 означает фенил, содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, гидроксигруппу и -N(R4)2.
[00127] В некоторых вариантах осуществления соединением является соединение формулы I-A:
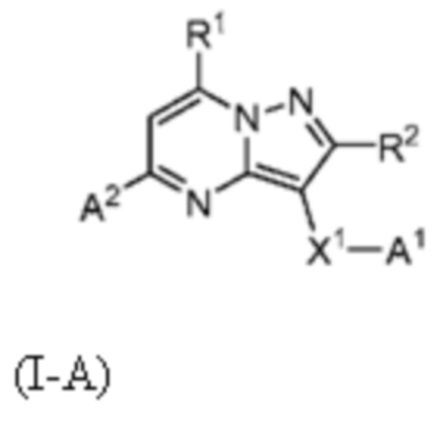
или его фармацевтически приемлемая соль, в которой:
R1 означает C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, -(C1-4 алкилен)-(C1-4 алкоксил), циклопропил, хлор или фтор;
R2 означает водород;
R3 и R4 каждый в каждом случае независимо означает водород или C1-4 алкил;
X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ или -C(O)N(H)(C1-6 алкилен)-ψ, где ψ означает связь с A1;
A1 означает циклическую группу, выбранную из группы, включающей:
C3-10 циклоалкил, 0 или 1 раз замещенный с помощью Y1 и 0, 1 или 2 раза замещенный с помощью Y2; и
фенил, 0 или 1 раз замещенный с помощью Y1 и 0, 1 или 2 раза замещенный с помощью Y2;
A2 означает циклическую группу, выбранную из группы, включающей:
фенил, содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, и гидроксигруппу; и
5-12-членный гетероциклил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, и гидроксигруппу;
Y1 в каждом случае независимо означает одно из следующих:
2-8-членный гетероалкил или -O-(C2-6 алкинил); или
C2-6 алкинил или -C≡C-(C1-6 алкилен)-OR4; и
Y2 в каждом случае независимо означает C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, цианогруппу или -N(R3)2;
при условии, что, если X1-A1 означает -C(O)N(H)(C1-6 алкилен)-(незамещенный C5-8 циклоалкил), A2 не означает 5-членный гетероарил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, и гидроксигруппу.
[00128] Определения переменных в приведенной выше формуле I-A охватывают множество химических групп. В объем заявки входят варианты осуществления, в которых, например, i) определением переменной является одна химическая группа, выбранная из числа химических групп, указанных выше, ii) определением переменной является набор двух или большего количества химических групп, выбранных из числа указанных выше, и iii) соединение определяется комбинацией переменных, в которой переменные определены в (i) или (ii), например, так что -C(O)N(H)(C1-6 галогеналкилен)-ψ, R1 означает C1-4 алкил или C1-4 галогеналкил и A2 означает фенил, содержащий 1 или 2 заместителя, независимо выбранных из группы, включающей C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу и галоген.
[00129] Соответственно, в некоторых вариантах осуществления R1 в каждом случае независимо означает метил, галогенметил, -(CH2)1-2-O-(C1-3 алкил), циклопропил, хлор или фтор. В некоторых вариантах осуществления R1 означает C1-4 алкил или C1-4 галогеналкил. В некоторых вариантах осуществления R1 означает метил.
[00130] В некоторых вариантах осуществления A1 означает C3-7 циклоалкил, один раз замещенный с помощью Y1 и 0-1 раз замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает циклогексил, один раз замещенный с помощью Y1. В некоторых вариантах осуществления A1 означает C3-7 циклоалкил, который не является замещенным. В некоторых вариантах осуществления A1 означает C7-10 циклоалкил, который является спироциклическим и не замещен. В некоторых вариантах осуществления A1 означает циклопропил.
[00131] В некоторых вариантах осуществления A1 означает циклогексил или 8-членный бициклический циклоалкил, каждый из которых один раз замещен с помощью Y1 и 0-1 раз замещен с помощью Y2.
[00132] В некоторых вариантах осуществления A1 означает фенил, 0 или 1 раз замещенный с помощью Y1 и 0, 1 или 2 раза замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает фенил, 1 раз замещенный с помощью Y1.
[00133] В некоторых вариантах осуществления Y2 означает независимо C1-3 алкил, галоген, или C1-3 галогеналкил.
[00134] В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил. В некоторых вариантах осуществления Y1 означает -O-(C1-7 алкил). В некоторых вариантах осуществления Y1 означает -O-бутил, -O-пентил или -O-гексил.
[00135] В некоторых вариантах осуществления A2 означает фенил, содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу и галоген. В некоторых вариантах осуществления A2 означает фенил, содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу и галоген, где содержится по меньшей мере один заместитель в мета-положении в фенильной группе. В некоторых вариантах осуществления A2 означает фенил, замещенный в одном мета-положении C1-4 алкоксилом, цианогруппой или галогеном и необязательно замещенный где-либо в фенильной группе C1-4 алкилом, C1-4 галогеналкилом, C1-4 алкоксилом, C3-5 циклоалкилом или галогеном. В некоторых вариантах осуществления A2 означает фенил, фенил, замещенный C1-4 алкоксилом, цианогруппой или галогеном В некоторых вариантах осуществления A2 означает фенил, замещенный в одном мета-положении C1-4 алкоксилом, цианогруппой или галогеном.
[00136] В некоторых вариантах осуществления A2 означает 5-12-членный гетероциклил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, и гидроксигруппу. В некоторых вариантах осуществления A2 означает 5-6-членный гетероарил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген, и гидроксигруппу. В некоторых вариантах осуществления A2 означает 5-6-членный гетероарил, выбранный из группы, включающей пиридинил, пиримидинил, пиразинил, фуранил, пирролил, тиофенил, имидазолил, оксазолил, изоксазолил, изотиазолил и тиазолил, каждый из которых необязательно содержит 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген и гидроксигруппу. В некоторых вариантах осуществления A2 означает 5-6-членный гетероарил, выбранный из группы, включающей пиридинил, пиримидинил, пиразинил, фуранил, пирролил, тиофенил, оксазолил, изоксазолил и тиазолил, каждый из которых необязательно содержит 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген и гидроксигруппу. В некоторых вариантах осуществления A2 означает пиридинил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген и гидроксигруппу. В некоторых вариантах осуществления A2 означает 3-пиридинил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу и галоген.
[00137] В некоторых вариантах осуществления A2 означает 5-6-членный гетероциклоалкил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген и гидроксигруппу. В некоторых вариантах осуществления A2 означает 5-6-членный гетероциклоалкил, выбранный из группы, включающей морфолинил, пиперидинил, пирролидинил, тетрагидропиранил и тетрагидрофуранил, каждый из которых необязательно содержит 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C3-5 циклоалкил, цианогруппу, галоген и гидроксигруппу.
[00138] В некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)C(H)(CF3)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 алкилен)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C(CH3)2)-ψ или -C(O)N(H)(C(H)(CH3))-ψ.
[00139] В приведенном выше описании представлены многочисленные варианты осуществления, относящиеся к соединениям формулы I-A. В объем настоящей заявки на патент специально включены все комбинации вариантов осуществления. Например, настоящее изобретение включает соединение формулы I-A, в которой X1 означает -C(O)N(H)C(H)(CF3)-ψ, R1 означает C1-4 алкил или C1-4 галогеналкил и A2 означает фенил, замещенный в одном мета-положении C1-4 алкоксилом, цианогруппой или галогеном и необязательно замещенный где-либо в фенильной группе C1-4 алкилом, C1-4 галогеналкилом, C1-4 алкоксилом, C3-5 циклоалкилом или галогеном.
[00140] В некоторых вариантах осуществления замещенный пиразоло[1,5-a]пиримидинилкарбоксамид или родственное органическое соединение является соединением, описывающимся формулой II:
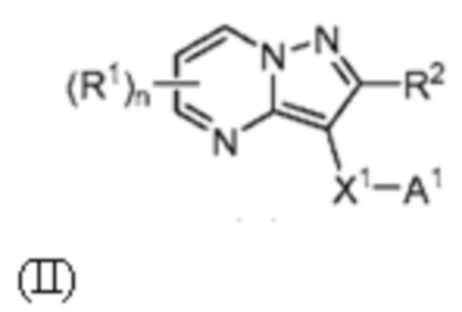
или его фармацевтически приемлемая соль, в которой:
R1 и R2 каждый в каждом случае независимо означает водород, C1-4 алкил, C1-4 галогеналкил, C1-4 гидроксиалкил, C1-4 цианоалкил, C1-4 алкоксил, C1-4 галогеналкоксил, циклопропил, цианогруппу, галоген, гидроксигруппу, -N(R4)2, -O-(C1-4 алкилен)-C1-6 алкоксил или -(C1-4 алкилен)-(2-6-членный гетероалкил, необязательно замещенный одним или большим количеством галогенов);
R3 в каждом случае независимо означает водород, C1-6 алкил или C3-6 циклоалкил;
R4 в каждом случае независимо означает водород, C1-4 алкил, циклопропил или -C(O)R3;
R5 в каждом случае независимо означает C1-4 алкил или C3-6 циклоалкил;
X1 означает карбонилсодержащий мостик, выбранный из группы, включающей -C(O)N(H)(C1-6 галогеналкилен)-ψ, -C(O)N(H)(C1-6 алкилен, замещенный C1-4 алкоксилом или C3-6 циклоалкилом)-ψ, -C(O)N(H)(C3-6 циклоалкилен)-ψ, -C(O)N(H)(3-6-членный гетероциклоалкилен)-ψ, -C(O)N(H)C(O)-ψ, и -C(O)N(H)C(O)(C1-6 алкилен)-ψ; где ψ означает связь с A1;
A1 означает одно из следующих:
циклическую группу, выбранную из группы, включающей 3-14-членный насыщенный карбоциклил, 5-14-членный частично ненасыщенный карбоциклил, 3-16-членный гетероциклил или фенил; каждый из которых 0, 1 или 2 раза замещен с помощью Y1 и 0, 1, 2 или 3 раза замещен с помощью Y2; или
C1-8 алкил или C2-6 алкинил;
Y1 в каждом случае независимо означает одно из следующих:
2-8-членный гетероалкил, необязательно замещенный 6-10-членным арилом, 3-10-членным гетероциклилом или C3-6 галогенциклоалкилом;
3-10-членный гетероциклил, 6-10-членный арил, C3-7 циклоалкил, -O-C3-6 циклоалкил, -O-(3-6-членный гетероциклил), -O-(6-10-членный арил), или -O-(C2-6 алкинил); или
C2-6 алкинил, -C≡C-(C1-6 алкилен)-OR4, -C≡C-(C1-6 алкилен)-N(R3)2, -(C2-4 алкинилен)-(5-6-членный гетероарил) или C2-6 алкенил;
Y2 в каждом случае независимо означает C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, -O-(C1-8 галогеналкил), цианогруппу, азидную группу, -N(R3)2, -(C1-6 алкилен)-(5-6-членный гетероциклил), -(C1-6 алкилен)-CO2R3, -CO2R3, -C(O)R5, -S(O)2R5, -C(O)N(R5)2, -C(O)N(R3)2 или C1-6 галогеналкилзамещенный C3-6 циклоалкил;
m равно 1 или 2; и
n равно 1, 2 или 3;
при условии, что, если X1 означает -C(O)N(H)(C3-6 циклоалкилен)-ψ или -C(O)N(H)(3-6-членный гетероциклоалкилен)-ψ, то A1 не означает 5-членный гетероциклил, C1-8 алкил или C2 алкинил.
[00141] Определения переменных в приведенной выше формуле II охватывают множество химических групп. В объем заявки входят варианты осуществления, в которых, например, i) определением переменной является одна химическая группа, выбранная из числа химических групп, указанных выше, ii) определением переменной является набор двух или большего количества химических групп, выбранных из числа указанных выше, и iii) соединение определяется комбинацией переменных, в которой переменные определены в (i) или (ii), например, так что X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ, R1 и R2 каждый в каждом случае независимо означает водород или C1-4 алкил и A1 означает 3-14-членный насыщенный карбоциклил.
[00142] Соответственно, в некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)C(H)(CF3)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 алкилен, замещенный C1-4 алкоксилом)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)C(H)(CH2OCH3)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 алкилен, замещенный C3-6 циклоалкилом)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C3-6 циклоалкилен)-ψ.
[00143] В некоторых вариантах осуществления n равно 2. В некоторых вариантах осуществления группы R1 расположены в положениях 5 и 7 пиразоло[1,5-a]пиримидинила.
[00144] В некоторых вариантах осуществления R1 в каждом случае независимо означает C1-4 алкил, C1-4 галогеналкил, -(C1-4 алкилен)-(2-6-членный гетероалкил), циклопропил, галоген или -N(R4)2. В некоторых вариантах осуществления R1 в каждом случае независимо означает C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, циклопропил, цианогруппу, хлор или фтор. В некоторых вариантах осуществления R1 означает метил.
[00145] В некоторых вариантах осуществления R2 означает водород. В некоторых вариантах осуществления R1 и R2 каждый в каждом случае независимо означает водород или C1-4 алкил.
[00146] В некоторых вариантах осуществления R3 и R4 каждый в каждом случае независимо означает водород, метил или этил.
[00147] В некоторых вариантах осуществления A1 означает 3-14-членный насыщенный карбоциклил, 0, 1 или 2 раза замещенный с помощью Y1 и 0, 1, 2 или 3 раза замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает 3-14-членный насыщенный карбоциклил. В некоторых вариантах осуществления A1 означает C3-7 циклоалкил, один раз замещенный с помощью Y1 и 0-1 раз замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает 5-14-членный частично ненасыщенный карбоциклил, 0, 1 или 2 раза замещенный с помощью Y1 и 0, 1, 2 или 3 раза замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает 8-12-членный бициклический карбоциклил, который является частично ненасыщенным, или 8-12-членный бициклический гетероциклил, каждый из которых 0 или 1 раз замещен с помощью Y1 и 0, 1 или 2 раза замещен с помощью Y2. В некоторых вариантах осуществления A1 означает фенил, один раз замещенный с помощью Y1 и 0-1 раз замещенный с помощью Y2.
[00148] В некоторых вариантах осуществления A1 означает 5-6-членный гетероарил, один раз замещенный с помощью Y1 и 0-1 раз замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает пиридинил, один раз замещенный с помощью Y1 и 0-1 раз замещенный с помощью Y2.
[00149] В некоторых вариантах осуществления A1 означает C3-7 циклоалкил, замещенный C1-6 алкоксилом. В некоторых вариантах осуществления A1 означает циклогексил, замещенный C1-6 алкоксилом. В некоторых вариантах осуществления A1 означает C3-7 циклоалкил, который не является замещенным. В некоторых вариантах осуществления A1 означает C7-10 циклоалкил, который является спироциклическим и не замещен. В некоторых вариантах осуществления A1 означает циклопропил.
[00150] В некоторых вариантах осуществления A1 означает фенил, замещенный C2 алкинилом.
[00151] В некоторых вариантах осуществления A1 означает 8-12-членный бициклический карбоциклил, который является частично ненасыщенным, или 8-12-членный бициклический гетероциклил, каждый из которых 0 или 1 раз замещен с помощью Y2, выбранного из группы, включающей C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, гидроксигруппу и C1-6 алкоксил. В некоторых вариантах осуществления A1 означает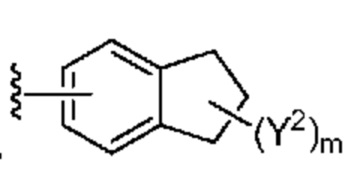 или
или 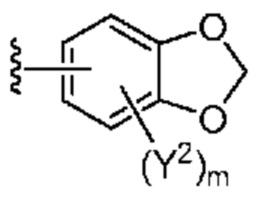 ; где m равно 0, 1 или 2; и Y2 в каждом случае независимо означает C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, гидроксигруппу, или C1-6 алкоксил.
; где m равно 0, 1 или 2; и Y2 в каждом случае независимо означает C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, гидроксигруппу, или C1-6 алкоксил.
[00152] В некоторых вариантах осуществления в любом случае Y2 независимо означает C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил или гидроксигруппу. В некоторых вариантах осуществления в любом случае Y2 независимо означает C1-3 алкил. В некоторых вариантах осуществления Y2 означает C1-6 галогеналкилзамещенный C3-6 циклоалкил.
[00153] В некоторых вариантах осуществления Y1 означает -O-(C1-7 алкил). В некоторых вариантах осуществления Y1 означает -O-бутил, -O-пентил или -O-гексил. В некоторых вариантах осуществления Y1 означает C2-6 алкинил, -C≡C-(C1-6 алкилен)-OR4, -C≡C-(C1-6 алкилен)-N(R3)2, -(C2-4 алкинилен)-(5-6-членный гетероарил) или C2-6 алкенил. В некоторых вариантах осуществления Y1 означает -C≡CH. В некоторых вариантах осуществления Y1 означает -C≡C-(C1-6 алкилен)-OR4. В некоторых вариантах осуществления Y1 означает -C≡C-CH2-O-CH3. В некоторых вариантах осуществления Y1 означает C2-6 алкинил.
[00154] В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил, необязательно замещенный 6-10-членным арилом или 3-10-членным гетероциклилом. В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил, замещенный 6-10-членным арилом или 3-10-членным гетероциклилом. В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил, замещенный 3-10-членным гетероциклилом. В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил, замещенный 5-6-членным гетероарилом, таким как пирролил, фуранил или пиридинил. В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил.
[00155] В некоторых вариантах осуществления Y1 означает -O-(C1-7 алкил). В некоторых вариантах осуществления Y1 означает -O-бутил, -O-пентил или -O-гексил. В некоторых вариантах осуществления Y1 означает -(C1-3 алкилен)-O-(5-6-членный гетероарил). В некоторых вариантах осуществления Y1 означает -CH2-O-(5-6-членный гетероарил). В некоторых вариантах осуществления Y1 означает -CH2-O-(5-6-членный гетероарил), где 5-6-членный гетероарил представляет собой фуранил, пирролил, тиофенил, имидазолил, пиразолил, оксазолил, тиазолил, пиридинил, пиримидинил, пиразинил, изооксазолил, изотиазолил, оксадиазолил, тиадиазолил, имидазолинил, оксазолинил, пиразолинил, тиазолинил или триазолинил, каждый из которых содержит 1 или 2 заместителя, независимо выбранных из группы, включающей C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, цианогруппу, -N(R4)2, амид и -CO2H.
[00156] В некоторых вариантах осуществления Y1 означает 3-10-членный гетероциклил, 6-10-членный арил, C3-7 циклоалкил, -O-(3-6-членный гетероциклил), -O-(6-10-членный арил), или -O-(C2-6 алкинил). В некоторых вариантах осуществления Y1 означает 3-10-членный гетероциклил, выбранный из группы, включающей 5-6-членный гетероарил и 5-6-членный гетероциклоалкил. В некоторых вариантах осуществления Y1 означает 5-членный гетероарил. В некоторых вариантах осуществления Y1 означает 5-членный гетероарил, содержащий 1 или 2 заместителя, независимо выбранных из группы, включающей C1-6 алкил, C3-7 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, цианогруппу, -N(R4)2, амид и -CO2H. В некоторых вариантах осуществления Y1 означает 5-членный гетероарил, содержащий 1 или 2 заместителя, независимо выбранных из группы, включающей C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, гидроксигруппу и C1-6 алкоксил.
[00157] В некоторых вариантах осуществления Y1 означает фуранил, пирролил, тиофенил, имидазолил, пиразолил, оксазолил или тиазолил. В некоторых вариантах осуществления Y1 означает фуранил, пирролил, тиофенил, имидазолил, пиразолил, оксазолил или тиазолил, каждый из которых содержит 1 или 2 заместителя, независимо выбранных из группы, включающей C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, цианогруппу, -N(R4)2, амид и -CO2H.
[00158] В некоторых вариантах осуществления Y1 означает пиридинил, пиримидинил, пиразинил, изооксазолил, изотиазолил, имидазолил, оксадиазолил, тиадиазолил, имидазолинил, оксазолинил, пиразолинил, тиазолинил или триазолинил. В некоторых вариантах осуществления Y1 означает пиридинил, пиримидинил, пиразинил, изооксазолил, изотиазолил, имидазолил, оксадиазолил, тиадиазолил, имидазолинил, оксазолинил, пиразолинил, тиазолинил или триазолинил, каждый из которых содержит 1 или 2 заместителя, независимо выбранных из группы, включающей C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, цианогруппу, -N(R4)2, амид и -CO2H.
[00159] В некоторых вариантах осуществления Y1 означает C2-6 алкинил, -C≡C-(C1-6 алкилен)-OR4, -C≡C-(C1-6 алкилен)-N(R3)2, -(C2-4 алкинилен)-(5-6-членный гетероарил) или C2-6 алкенил. В некоторых вариантах осуществления Y1 означает C2-6 алкинил. В некоторых вариантах осуществления Y1 означает -C≡CH. В некоторых вариантах осуществления Y1 означает -C≡C-(C1-6 алкилен)-OR4. В некоторых вариантах осуществления Y1 означает -C≡C-(C1-6 алкилен)-O-(C1-2 алкил). В некоторых вариантах осуществления Y1 означает -C≡C-CH2-O-CH3.
[00160] В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил, необязательно замещенный 6-10-членным арилом или 3-10-членным гетероциклилом. В некоторых вариантах осуществления Y1 означает -(C1-3 алкилен)-O-(5-6-членный гетероарил). В некоторых вариантах осуществления Y1 означает 3-10-членный гетероциклил, 6-10-членный арил, C3-7 циклоалкил, -O-(3-6-членный гетероциклил), -O-(6-10-членный арил), или -O-(C2-6 алкинил). В некоторых вариантах осуществления Y1 означает 3-10-членный гетероциклил, выбранный из группы, включающей 5-6-членный гетероарил и 5-6-членный гетероциклоалкил. В некоторых вариантах осуществления Y1 означает 5-членный гетероарил. В некоторых вариантах осуществления Y1 означает фуранил, пирролил, тиофенил, имидазолил, пиразолил, оксазолил или тиазолил.
[00161] В приведенном выше описании представлены многочисленные варианты осуществления, относящиеся к соединениям формулы II. В объем настоящей заявки на патент специально включены все комбинации вариантов осуществления. Например, настоящее изобретение включает соединение формулы II, в которой X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ, R1 и R2 каждый в каждом случае независимо означает водород или C1-4 алкил и A1 означает 3-14-членный насыщенный карбоциклил.
[00162] В некоторых вариантах осуществления замещенный пиразоло[1,5-a]пиримидинилкарбоксамид или родственное органическое соединение является соединением, описывающимся формулой II-A:
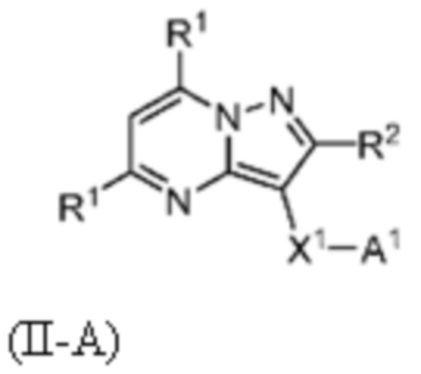
или его фармацевтически приемлемая соль, в которой:
R1 в каждом случае независимо означает C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, -(C1-4 алкилен)-(C1-4 алкоксил), циклопропил, хлор или фтор;
R2 означает водород;
R3 и R4 каждый в каждом случае независимо означает водород или C1-4 алкил;
X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ или -C(O)N(H)(C1-6 алкилен, замещенный C1-4 алкоксилом или C3-6 циклоалкилом)-ψ, где ψ означает связь с A1;
A1 означает циклическую группу, выбранную из группы, включающей:
C3-10 циклоалкил, 0 или 1 раз замещенный с помощью Y1 и 0, 1 или 2 раза замещенный с помощью Y2; и
фенил, 0 или 1 раз замещенный с помощью Y1 и 0, 1 или 2 раза замещенный с помощью Y2;
Y1 в каждом случае независимо означает одно из следующих:
2-8-членный гетероалкил или -O-(C2-6 алкинил); или
C2-6 алкинил или -C≡C-(C1-6 алкилен)-OR4; и
Y2 в каждом случае независимо означает C1-6 алкил, C3-6 циклоалкил, галоген, C1-6 галогеналкил, C1-6 гидроксиалкил, гидроксигруппу, C1-6 алкоксил, цианогруппу или -N(R3)2.
[00163] Определения переменных в приведенной выше формуле II-A охватывают множество химических групп. В объем заявки входят варианты осуществления, в которых, например, i) определением переменной является одна химическая группа, выбранная из числа химических групп, указанных выше, ii) определением переменной является набор двух или большего количества химических групп, выбранных из числа указанных выше, и iii) соединение определяется комбинацией переменных, в которой переменные определены в (i) или (ii), например, так что X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ, R1 означает C1-4 алкил или C1-4 галогеналкил и A1 означает C3-10 циклоалкил, 0 или 1 раз замещенный с помощью Y1 и 0, 1 или 2 раза замещенный с помощью Y2.
[00164] Соответственно, в некоторых вариантах осуществления R1 в каждом случае независимо означает метил, галогенметил, -(CH2)1-2-O-(C1-3 алкил), циклопропил, хлор или фтор. В некоторых вариантах осуществления R1 означает C1-4 алкил или C1-4 галогеналкил. В некоторых вариантах осуществления R1 означает метил.
[00165] В некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)C(H)(CF3)-ψ.
[00166] В некоторых вариантах осуществления A1 означает C3-10 циклоалкил, 0 или 1 раз замещенный с помощью Y1 и 0, 1 или 2 раза замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает C3-7 циклоалкил, один раз замещенный с помощью Y1 и 0-1 раз замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает циклогексил, один раз замещенный с помощью Y1. В некоторых вариантах осуществления A1 означает C3-7 циклоалкил, который не является замещенным. В некоторых вариантах осуществления A1 означает C7-10 циклоалкил, который является спироциклическим и не замещен. В некоторых вариантах осуществления A1 означает циклопропил.
[00167] В некоторых вариантах осуществления A1 означает фенил, 0 или 1 раз замещенный с помощью Y1 и 0, 1 или 2 раза замещенный с помощью Y2. В некоторых вариантах осуществления A1 означает фенил, 1 раз замещенный с помощью Y1.
[00168] В некоторых вариантах осуществления Y1 означает 2-8-членный гетероалкил. В некоторых вариантах осуществления Y1 означает -O-(C1-7 алкил). В некоторых вариантах осуществления Y1 означает -O-бутил, -O-пентил или -O-гексил.
[00169] В приведенном выше описании представлены многочисленные варианты осуществления, относящиеся к соединениям формулы II-A. В объем настоящей заявки на патент специально включены все комбинации вариантов осуществления. Например, настоящее изобретение включает соединение формулы II-A, в которой X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ, R1 означает C1-4 алкил или C1-4 галогеналкил и A1 означает C3-10 циклоалкил, 0 или 1 раз замещенный с помощью Y1 и 0, 1 или 2 раза замещенный с помощью Y2.
[00170] В некоторых вариантах осуществления замещенный пиразоло[1,5-a]пиримидинилкарбоксамид или родственное органическое соединение является соединением, описывающимся формулой III:
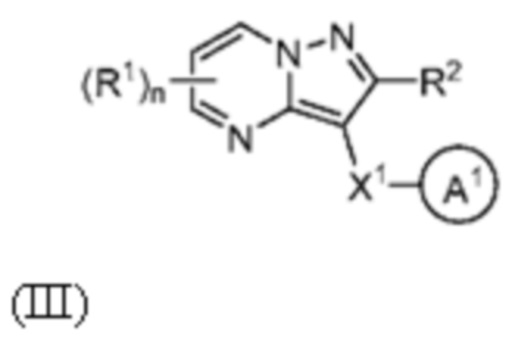
или его фармацевтически приемлемая соль, в которой:
R1 и R2 каждый в каждом случае независимо означает водород, C1-4 алкил, C1-4 галогеналкил, C1-4 гидроксиалкил, C1-4 цианоалкил, C1-4 алкоксил, C1-4 галогеналкоксил, циклопропил, цианогруппу, галоген, гидроксигруппу, -N(R4)2, -O-(C1-4 алкилен)-C1-6 алкоксил или -(C1-4 алкилен)-(2-6-членный гетероалкил, необязательно замещенный одним или большим количеством галогенов);
R3 в каждом случае независимо означает водород, C1-6 алкил или C3-6 циклоалкил;
R4 в каждом случае независимо означает водород, C1-4 алкил, циклопропил или -C(O)R3;
R5 означает водород или C1-6 алкил;
R6 означает связь или C1-6 алкилен;
X1-A1 означает одно из следующих:
-C(O)N(H)(C1-6 галогеналкилен)-A1, -C(O)N(H)(C1-6 алкилен, замещенный C1-4 алкоксилом)-A1, -C(O)N(H)(C3-6 циклоалкилен)-A1, -C(O)N(H)(3-6-членный гетероциклоалкилен)-A1, -C(O)-(3-6-членный гетероциклоалкилен, содержащий по меньшей мере одну кольцевую группу -N(H)-)-A1 или -C(O)N(H)-A1, где A1 означает C3-10 циклоалкил, необязательно замещенный с помощью 1 или 2 C1-4 алкильных групп;
-C(O)N(H)C(C1-6 алкил)2-R6-A1 или -C(O)N(H)C(C3-6 алкил)(R5)-R6-A1, где A1 означает C3-10 циклоалкил, необязательно замещенный с помощью 1 или 2 C1-4 алкильных групп;
-C(O)N(H)(C1-6 алкилен)-A1 или -C(O)N(H)(C1-6 алкилен, замещенный C3-6 циклоалкилом)-A1, где A1 означает C6-10 моноциклический или спироциклический циклоалкил, необязательно замещенный с помощью 1 или 2 C1-4 алкильных групп;
-C(O)N(H)C(O)- A1 или -C(O)N(H)C(O)(C1-6 алкилен)- A1, где A1 означает C6-10 моноциклический или спироциклический циклоалкил, необязательно замещенный с помощью 1 или 2 C1-4 алкильных групп;
m равно 1 или 2; и
n равно 1, 2 или 3;
при условии, что, если X означает -C(O)N(H)-ψ и A1 означает C5-7 циклоалкил, необязательно замещенный с помощью 1 или 2 C1-4 алкильных групп; то R1 не означает C1-4 алкил и C1-4 галогеналкил.
[00171] Определения переменных в приведенной выше формуле III охватывают множество химических групп. В объем заявки входят варианты осуществления, в которых, например, i) определением переменной является одна химическая группа, выбранная из числа химических групп, указанных выше, ii) определением переменной является набор двух или большего количества химических групп, выбранных из числа указанных выше, и iii) соединение определяется комбинацией переменных, в которой переменные определены в (i) или (ii), например, так что X1 означает -C(O)N(H)(C1-6 алкилен)-ψ, и R1 и R2 каждый в каждом случае независимо означает водород или C1-4 алкил.
[00172] Соответственно, в некоторых вариантах осуществления R1 в каждом случае независимо означает C1-4 алкил, C1-4 галогеналкил, -(C1-4 алкилен)-(2-6-членный гетероалкил), циклопропил, галоген или -N(R4)2. В некоторых вариантах осуществления R1 в каждом случае независимо означает C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, циклопропил, цианогруппу, хлор или фтор. В некоторых вариантах осуществления R1 означает метил.
[00173] В некоторых вариантах осуществления n равно 2. В некоторых вариантах осуществления группы R1 расположены в положениях 5 и 7 пиразоло[1,5-a]пиримидинила.
[00174] В некоторых вариантах осуществления R2 означает водород. В некоторых вариантах осуществления R1 и R2 каждый в каждом случае независимо означает водород или C1-4 алкил.
[00175] В некоторых вариантах осуществления R3 и R4 каждый в каждом случае независимо означает водород, метил или этил.
[00176] В некоторых вариантах осуществления В приведенном выше описании представлены многочисленные варианты осуществления, относящиеся к соединениям формулы III. В объем настоящей заявки на патент специально включены все комбинации вариантов осуществления.
[00177] В некоторых вариантах осуществления X1-A1 означает -C(O)N(H)(C1-6 галогеналкилен)-A1, где A1 означает C3-10 циклоалкил, необязательно замещенный с помощью 1 или 2 C1-4 алкильных групп. В некоторых вариантах осуществления X1-A1 означает -C(O)N(H)C(H)(CF3)-A1, где A1 означает C3-10 циклоалкил, необязательно замещенный с помощью 1 или 2 C1-4 алкильных групп. В некоторых вариантах осуществления X1-A1 означает -C(O)N(H)C(C1-6 алкил)2-R6-A1, где A1 означает C3-10 циклоалкил, необязательно замещенный с помощью 1 или 2 C1-4 алкильных групп. В некоторых вариантах осуществления X1-A1 означает -C(O)N(H)C(CH3)2-A1; где A1 означает C3-10 циклоалкил, необязательно замещенный с помощью 1 или 2 C1-4 алкильных групп. В некоторых вариантах осуществления A1 означает циклопропил. В некоторых вариантах осуществления A1 означает 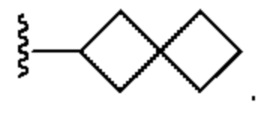 .
.
[00178] В приведенном выше описании представлены многочисленные варианты осуществления, относящиеся к соединениям формулы III. В объем настоящей заявки на патент специально включены все комбинации вариантов осуществления.
[00179] В некоторых вариантах осуществления замещенный пиразоло[1,5-a]пиримидинилкарбоксамид или родственное органическое соединение является соединением, описывающимся формулой III-1:
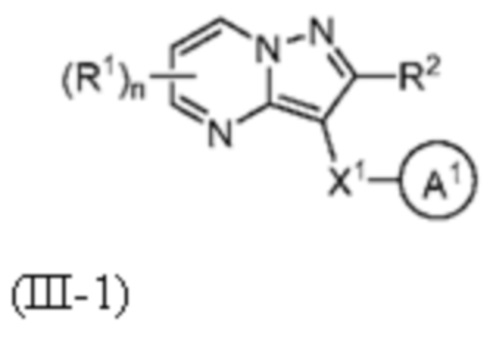
или его фармацевтически приемлемая соль, в которой:
R1 и R2 каждый в каждом случае независимо означает водород, C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C1-4 галогеналкоксил, циклопропил, цианогруппу, галоген, гидроксигруппу, -N(R4)2, -O-(C1-4 алкилен)-C1-6 алкоксил или -(C1-4 алкилен)-(2-6-членный гетероалкил, необязательно замещенный одним или большим количеством галогенов);
R3 в каждом случае независимо означает водород, C1-6 алкил или C3-6 циклоалкил;
R4 в каждом случае независимо означает водород, C1-4 алкил, циклопропил или -C(O)R3;
X1 означает карбонилсодержащий мостик, выбранный из группы, включающей -C(O)N(H)(C1-6 алкилен необязательно, замещенный C1-4 алкоксилом или C3-6 циклоалкил)-ψ, -C(O)N(H)(C1-6 галогеналкилен)-ψ, -C(O)N(H)(C3-6 циклоалкилен)-ψ, -C(O)N(H)(3-6-членный гетероциклоалкилен)-ψ, -C(O)-(3-6-членный гетероциклоалкилен, содержащий по меньшей мере одну кольцевую группу -N(H)-)-ψ, и -C(O)N(H)-ψ; где ψ означает связь с A1;
A1 означает C3-10 циклоалкил, необязательно замещенный с помощью 1 или 2 C1-4 алкильных групп;
m равно 1 или 2; и
n равно 1, 2 или 3;
при условии, что, если X1 означает -C(O)N(H)-ψ и A1 означает C5-7 циклоалкил, необязательно замещенный с помощью 1 или 2 C1-4 алкильных групп; то R1 не означает C1-4 алкил и C1-4 галогеналкил.
[00180] Определения переменных в приведенной выше формуле III-1 охватывают множество химических групп. В объем заявки входят варианты осуществления, в которых, например, i) определением переменной является одна химическая группа, выбранная из числа химических групп, указанных выше, ii) определением переменной является набор двух или большего количества химических групп, выбранных из числа указанных выше, и iii) соединение определяется комбинацией переменных, в которой переменные определены в (i) или (ii), например, так что X1 означает -C(O)N(H)(C1-6 алкилен)-ψ, и R1 и R2 каждый в каждом случае независимо означает водород или C1-4 алкил.
[00181] Соответственно, в некоторых вариантах осуществления R1 в каждом случае независимо означает C1-4 алкил, C1-4 галогеналкил, -(C1-4 алкилен)-(2-6-членный гетероалкил), циклопропил, галоген или -N(R4)2. В некоторых вариантах осуществления R1 в каждом случае независимо означает C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, циклопропил, цианогруппу, хлор или фтор. В некоторых вариантах осуществления R1 означает метил.
[00182] В некоторых вариантах осуществления n равно 2. В некоторых вариантах осуществления группы R1 расположены в положениях 5 и 7 пиразоло[1,5-a]пиримидинила.
[00183] В некоторых вариантах осуществления R2 означает водород. В некоторых вариантах осуществления R1 и R2 каждый в каждом случае независимо означает водород или C1-4 алкил.
[00184] В некоторых вариантах осуществления R3 и R4 каждый в каждом случае независимо означает водород, метил или этил.
[00185] В некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 алкилен)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)C(H)(CH3)-ψ или -C(O)N(H)C(CH3)2-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)C(H)(CF3)-ψ. В некоторых вариантах осуществления X1 означает -C(O)N(H)-ψ.
[00186] В некоторых вариантах осуществления A1 означает C3-10 циклоалкил, необязательно замещенный с помощью 1 или 2 C1-4 алкильных групп. В некоторых вариантах осуществления A1 означает C3-10 циклоалкил, который не является замещенным. В некоторых вариантах осуществления A1 означает циклопропил. В некоторых вариантах осуществления A1 означает циклопропил, циклобутил, циклопентил или циклогексил.
[00187] В приведенном выше описании представлены многочисленные варианты осуществления, относящиеся к соединениям формулы III-1. В объем настоящей заявки на патент специально включены все комбинации вариантов осуществления. Например, настоящее изобретение включает соединение формулы III-1, в которой X1 означает -C(O)N(H)(C1-6 алкилен)-ψ, и R1 и R2 каждый в каждом случае независимо означает водород или C1-4 алкил.
[00188] В некоторых вариантах осуществления замещенный пиразоло[1,5-a]пиримидинилкарбоксамид или родственное органическое соединение является соединением, описывающимся формулой IV:
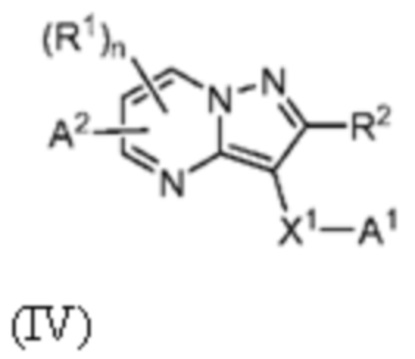
или его фармацевтически приемлемая соль, в которой:
R1 и R2 каждый в каждом случае независимо означает водород, C1-4 алкил, C1-4 галогеналкил, C1-4 гидроксиалкил или C1-4 цианоалкил;
R3 в каждом случае независимо означает водород, C1-6 алкил или C3-6 циклоалкил;
R4 в каждом случае независимо означает водород, C1-4 алкил, циклопропил или -C(O)R3;
R7 в каждом случае независимо означает галоген, гидроксигруппу, цианогруппу, C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C1-4 галогеналкоксил, C3-6 циклоалкил, -O-(C3-6 циклоалкил), -O-(C1-6 алкилен)-C1-6 алкоксил, -O-(гетероарил), -(C1-6 алкилен)-CN, -N(R4)2, -C(O)N(R4)2, 3-8-членный гетероциклоалкил, фенил или гетероарил;
A2 означает одно из следующих:
фенил;
4-12-членный оксогетероциклил, необязательно 1, 2 или 3 раза замещенный с помощью R7; или
6-членный гетероарил, который (i) замещен C2-4 алкинилом и (ii) необязательно 1, 2 или 3 раза замещен с помощью R7;
X1-A1 означает следующее:
(i) если A2 означает фенил, то X1-A1 означает -C(O)N(H)C(H)(C1-2 алкил)-циклопропил или X1-A1 означает -C(O)N(H)(C1-6 галогеналкилен)-циклопропил;
(ii) если A2 означает 4-12-членный оксогетероциклил, необязательно 1, 2 или 3 раза замещенный с помощью R7, то X1-A1 означает -C(O)N(H)(C1-6 алкил), -C(O)N(H)(C1-6 галогеналкилен)-(C3-6 циклоалкил), -C(O)N(H)(C1-6 галогеналкилен)-(C1-6 алкил), -C(O)N(H)(C1-6 алкилен)-(C3-6 циклоалкил), или -C(O)N(H)-(C3-6 циклоалкил); или
(iii) если A2 означает 6-членный гетероарил, который (i) замещен C2-4 алкинилом и (ii) необязательно 1, 2 или 3 раза замещен с помощью R7, то X1-A1 означает -C(O)N(H)(C1-6 галогеналкилен)-(C3-6 циклоалкил), -C(O)N(H)(C1-6 галогеналкилен)-(C1-6 алкил), или -C(O)N(H)(C1-6 алкилен)-(C3-6 циклоалкил); и
n равно 1, 2 или 3.
[00189] Определения переменных в приведенной выше формуле IV охватывают множество химических групп. В объем заявки входят варианты осуществления, в которых, например, i) определением переменной является одна химическая группа, выбранная из числа химических групп, указанных выше, ii) определением переменной является набор двух или большего количества химических групп, выбранных из числа указанных выше, и iii) соединение определяется комбинацией переменных, в которой переменные определены в (i) или (ii).
[00190] В некоторых вариантах осуществления замещенный пиразоло[1,5-a]пиримидинилкарбоксамид или родственное органическое соединение является соединением, описывающимся формулой IV-A:
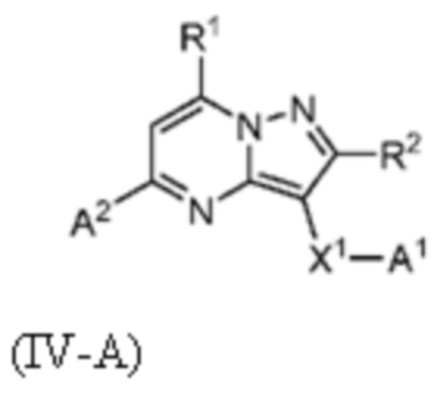
или его фармацевтически приемлемая соль, в которой:
R1 и R2 все независимо означают водород, C1-4 алкил или C1-4 галогеналкил;
R3 в каждом случае независимо означает водород, C1-6 алкил или C3-6 циклоалкил;
R4 в каждом случае независимо означает водород, C1-4 алкил, циклопропил или -C(O)R3;
R7 в каждом случае независимо означает галоген, гидроксигруппу, цианогруппу, C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, C1-4 галогеналкоксил, C3-6 циклоалкил, -O-(C3-6 циклоалкил), -O-(C1-6 алкилен)-C1-6 алкоксил, -O-(гетероарил), -(C1-6 алкилен)-CN, -N(R4)2, -C(O)N(R4)2, 3-8-членный гетероциклоалкил, фенил или гетероарил;
A2 означает одно из следующих:
фенил;
4-12-членный оксогетероциклил, необязательно 1, 2 или 3 раза замещенный с помощью R7; или
6-членный гетероарил, который (i) замещен C2-4 алкинилом и (ii) необязательно 1, 2 или 3 раза замещен с помощью R7; и
X1-A1 означает следующее:
(i) если A2 означает фенил, то X1-A1 означает -C(O)N(H)C(H)(C1-2 алкил)-циклопропил или X1-A1 означает -C(O)N(H)(C1-6 галогеналкилен)-циклопропил;
(ii) если A2 означает 4-12-членный оксогетероциклил, необязательно 1, 2 или 3 раза замещенный с помощью R7, то X1-A1 означает -C(O)N(H)(C1-6 алкил), -C(O)N(H)(C1-6 галогеналкилен)-(C3-6 циклоалкил), -C(O)N(H)(C1-6 галогеналкилен)-(C1-6 алкил), -C(O)N(H)(C1-6 алкилен)-(C3-6 циклоалкил), или -C(O)N(H)-(C3-6 циклоалкил); или
(iii) если A2 означает 6-членный гетероарил, который (i) замещен C2-4 алкинилом и (ii) необязательно 1, 2 или 3 раза замещен с помощью R7, то X1-A1 означает -C(O)N(H)(C1-6 галогеналкилен)-(C3-6 циклоалкил), -C(O)N(H)(C1-6 галогеналкилен)-(C1-6 алкил), или -C(O)N(H)(C1-6 алкилен)-(C3-6 циклоалкил).
[00191] Определения переменных в приведенной выше формуле IV-A охватывают множество химических групп. В объем заявки входят варианты осуществления, в которых, например, i) определением переменной является одна химическая группа, выбранная из числа химических групп, указанных выше, ii) определением переменной является набор двух или большего количества химических групп, выбранных из числа указанных выше, и iii) соединение определяется комбинацией переменных, в которой переменные определены в (i) или (ii).
[00192] В некоторых других вариантах осуществления соединением является соединение, описанное в примерах, или его фармацевтически приемлемая соль. В некоторых других вариантах осуществления соединением является одно из соединений, приведенных ниже в таблице 1, 2 или 3A, или его фармацевтически приемлемая соль. В некоторых других вариантах осуществления соединением является одно из соединений, приведенных ниже в таблице 3B, или его фармацевтически приемлемая соль. В некоторых других вариантах осуществления соединением является одно из соединений, приведенных ниже в таблице 1 или 2, или его фармацевтически приемлемая соль.
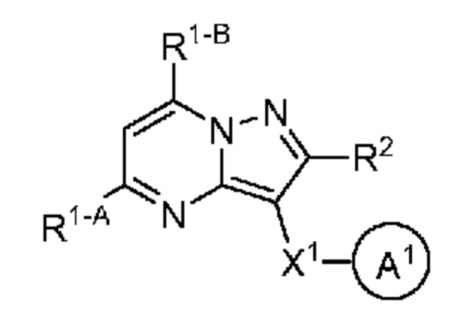

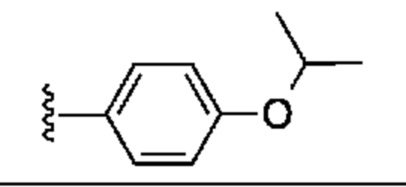
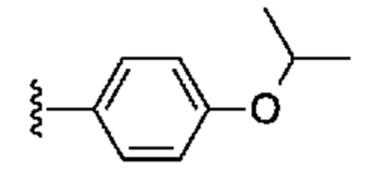
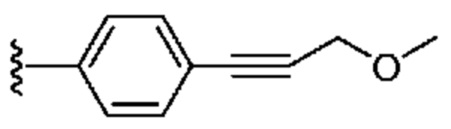
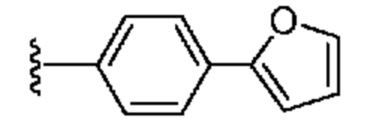
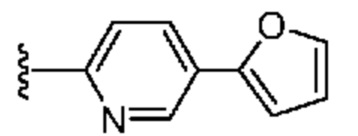
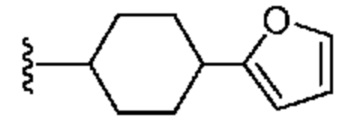
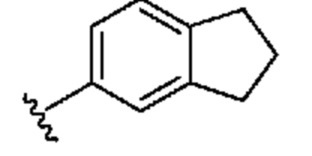
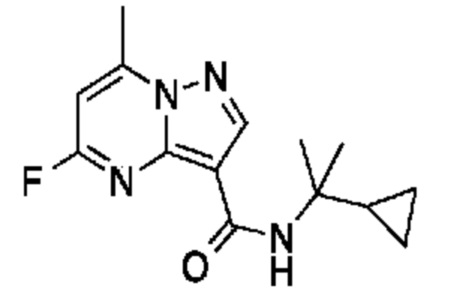
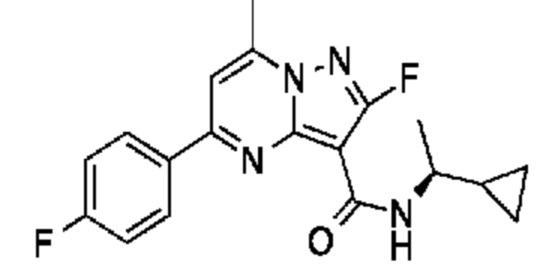
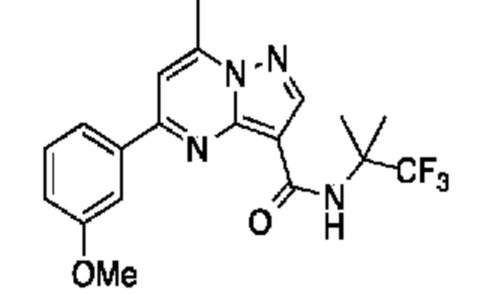
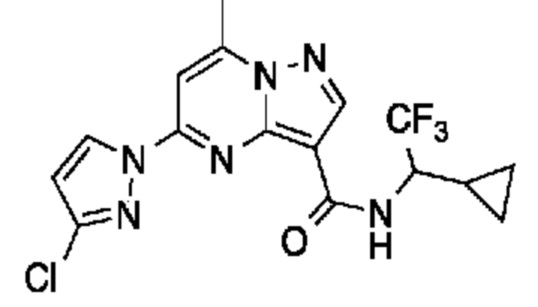
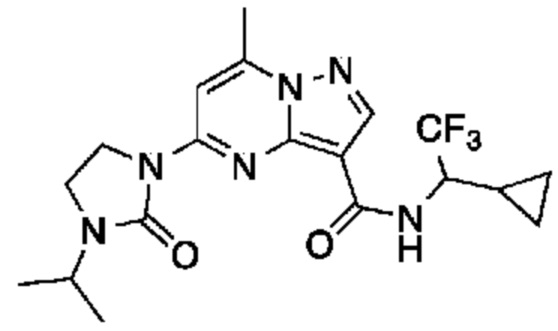
[00193] Методики получения соединений, описанные в настоящем изобретении, проиллюстрированы на приведенных ниже схемах синтеза. Эти схемы приведены для иллюстрации настоящего изобретения и их не следует рассматривать в качестве каким-либо образом ограничивающих объем или сущность настоящего изобретения. Исходные вещества, указанные на схемах, можно приобрести или можно получить по методикам, описанным в литературе.
[00194] Путь синтеза, представленный на схеме 1, описывает типичную методику получения замещенных пиразоло[1,5-a]пиримидинов. На первой стадии этил-5-амино-1H-пиразол-4-карбоксилат (Ri=H) A конденсируют с этил-(E)-3-этоксибут-2-еноатом (Rii=H, Riii=Me) в DMF с Cs2CO3 и получают этил-5-гидрокси-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат B. Нагревание карбоксилата B с фосфорилтрихлоридом дает промежуточный продукт этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат C. Гидролиз хлорида эфира карбоновой кислоты C в щелочной среде дает этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту D.
[00195] Карбоновую кислоту D можно обработать разными замещенными ароматическими или алифатическими аминами по стандартным методикам сочетания с образованием пептида, такими как HATU и/или HOBT в DMF в присутствии DIPEA с получением хлорида амида карбоновой кислоты G. На конечной стадии катализируемое Pd сочетание хлорида амида карбоновой кислоты G с множеством ароматических или гетероароматических бороновых кислот или их эфиров или с триалкилстаннильными реагентами можно провести по стандартным методикам катализируемого Pd сочетания, таким как сочетание по Судзуки и Бухвальду. Например, использование сочетания по Судзки (с применением, например, Pd(dppf)2Cl2•CH2Cl2 в DME в присутствии K3PO4) дает замещенный амид H. В некоторых случаях замена хлорида амида карбоновой кислоты G на первичный или вторичный амин дает замещенный амид H.
[00196] Альтернативно, хлорид эфира карбоновой кислоты C можно ввести в катализируемое Pd сочетание со множеством ароматических/гетероароматических бороновых кислот или их эфиров или с триалкилстаннильными реагентами по стандартным методикам катализируемого Pd сочетания, таким как сочетание по Судзуки и Бухвальду. Например, использование сочетания по Судзки (с применением, например, Pd(dppf)2Cl2•CH2Cl2 в DME в присутствии K3PO4) дает замещенный эфир карбоновой кислоты E. Альтернативно, замена хлорида эфира карбоновой кислоты C на первичный или вторичный амин дает замещенный эфир карбоновой кислоты E. Гидролиз эфира карбоновой кислоты E в щелочной или нейтральной среде дает карбоновую кислоту F. На конечной стадии сочетание карбоновой кислоты F с множеством замещенных ароматических или алифатических аминов можно провести по стандартным методикам сочетания с образованием пептида, таким как HATU и/или HOBT в DMF в присутствии DIPEA и получить амид H.
СХЕМА 1
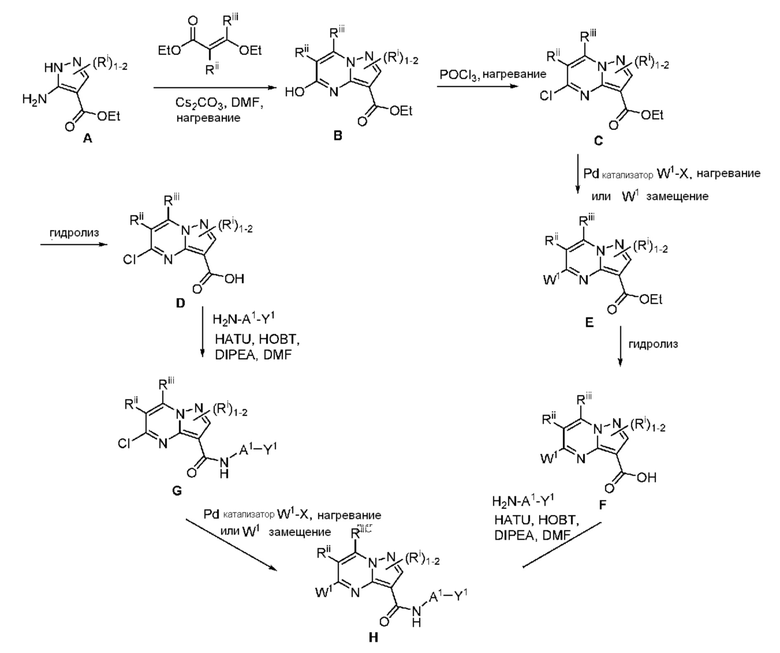
[00197] Методики реакций, представленные на схеме 1 предположительно применимы для получения самых различных замещенных пиразоло[1,5-a]пиримидинкарбоксамидов, содержащих разные заместители в положениях A1 и Y1. Кроме того, если функциональная группа, которая является частью A1 и/или Y1, не пригодна для реакции при условиях, указанных на схеме 1, предполагается, что эту функциональную группу сначала можно защитить по стандартным методологиям введения защитных групп и затем, после завершения желательного синтетического превращения, удалить защитную группу. См., например, Greene, T.W.; Wuts, P.G.M. Protective Groups in Organic Synthesis, 2nd ed.; Wiley: New York, 1991, где дополнительно описаны химизм и стратегии использования защитных групп. В некоторых других вариантах осуществления, функциональную группу в заместителе A1 и Y1 можно превратить в другую функциональную группу по стандартным методикам преобразования функциональных групп, известным в данной области техники. См., например, "Comprehensive Organic Synthesis" (B.M. Trost & I. Fleming, eds., 1991-1992).
III. Применение в терапии
[00198] Настоящее изобретение относится к способам лечения патологических нарушений, таких как болезнь Гоше, болезнь Паркинсона, болезнь телец Леви, слабоумие, мультисистемная атрофия, эпилепсия, биполярное расстройство, шизофрения, тревожное нарушение, большая депрессия, поликистозное заболевание почек, диабет типа 2, открытоугольная глаукома, рассеянный склероз, эндометриоз и множественная миелома, с использованием замещенного пиразоло[1,5-a]пиримидинилкарбоксамида, родственных соединений, и фармацевтические композиции, описанных в настоящем изобретении. Способы лечения включают применение замещенного пиразоло[1,5-a]пиримидинилкарбоксамида или родственных органических соединений, описанных в настоящем изобретении, в качестве отдельных терапевтических средств и/или в качестве части комбинированной терапии вместе с другим терапевтическим средством. Если не ограничиваться конкретной теорией, то следует понимать, что замещенный пиразоло[1,5-a]пиримидинилкарбоксамид и родственные органические соединения, описанные в настоящем изобретении, могут активировать глюкоцереброзидазу (Gcase).
Способы лечения патологических нарушений
[00199] Одним объектом настоящего изобретения является способ лечения нарушения, выбранного из группы, включающей болезнь Гоше, болезнь Паркинсона, болезнь телец Леви, слабоумие, мультисистемную атрофию, эпилепсию, биполярное расстройство, шизофрению, тревожное нарушение, большую депрессию, поликистозное заболевание почек, диабет типа 2, открытоугольную глаукому, рассеянный склероз, эндометриоз и множественную миелому. Способ включает введение нуждающемуся в нем пациенту терапевтически эффективного количества замещенного пиразоло[1,5-a]пиримидинилкарбоксамида или родственного органического соединения, описанного в настоящем изобретении, для лечения нарушения. Соединение может представлять собой соединение формулы I, I-1, I-A, II, II-A, III, III-1 или IV, описанное выше в разделе II.
[00200] В некоторых вариантах осуществления соединением является соединение формулы I. В некоторых вариантах осуществления соединением является соединение формулы II. В некоторых вариантах осуществления соединением является соединение формулы III.
[00201] В некоторых вариантах осуществления нарушением является болезнь Гоше, болезнь Паркинсона, болезнь телец Леви, слабоумие или мультисистемная атрофия. В некоторых вариантах осуществления нарушением является болезнь Гоше, болезнь Паркинсона, болезнь телец Леви, слабоумие или мультисистемная атрофия. В некоторых других вариантах осуществления, нарушением является болезнь Гоше. В некоторых вариантах осуществления нарушением является болезнь Паркинсона. В некоторых вариантах осуществления нарушением является болезнь телец Леви. В некоторых вариантах осуществления нарушением является слабоумие. В некоторых вариантах осуществления нарушением является слабоумие, выбранное из группы, включающей болезнь Альцгеймера, дегенерация лобной и височной долей и вариант болезни Альцгеймера с тельцами Леви. В некоторых вариантах осуществления нарушением является мультисистемная атрофия.
[00202] В некоторых вариантах осуществления нарушением является тревожное нарушение, такое как паническое расстройство, состояние социальной тревоги, или генерализованное тревожное нарушение.
[00203] Эффективность соединений для лечения болезни Гоше, болезни Паркинсона, болезни телец Леви, слабоумия, мультисистемной атрофии, эпилепсии, биполярного расстройства, шизофрении, тревожного нарушения, большой депрессии, поликистозного заболевания почек, диабета типа 2, открытоугольной глаукомы, рассеянного склероз, эндометриоза и множественной миеломы можно оценить путем изучения соединений в исследованиях, известных в данной области техники для оценки эффективности по отношению к этим заболеваниям и/или, например, для активации глюкоцереброзидазы (Gcase), как это рассмотрено в приведенных ниже примерах.
[00204] В некоторых вариантах осуществления пациентом является человек.
[00205] В некоторых вариантах осуществления соединением является одно из родовых или конкретных соединений, описанных в разделе II, такое как соединение формулы I, соединение, входящее в один из дополнительных вариантов осуществления, в которых приведены определения некоторых переменных для формулы I, соединение формулы I-A или соединение, входящее в один из дополнительных вариантов осуществления, в которых приведены определения некоторых переменных для формулы I-A. В некоторых других вариантах осуществления соединением является соединение формулы II или II-A или соединение, входящее в один из дополнительных вариантов осуществления, в которых приведены определения некоторых переменных для формулы II или II-A.
[00206] В приведенном выше описании описаны многие варианты осуществления, относящиеся к способам лечения различных нарушений с использованием определенного замещенного пиразоло[1,5-a]пиримидинилкарбоксамида или родственных органических соединений. В объем настоящей заявки на патент специально включены все комбинации вариантов осуществления. Например, настоящее изобретение включает способы лечения болезни Гоше, болезни Паркинсона, болезни телец Леви, слабоумия или мультисистемной атрофии путем введения терапевтически эффективного количества соединения формулы I-A.
Применение в медицине и приготовление лекарственного средства
[00207] Другим объектом настоящего изобретения являются соединения и композиции, описанные в настоящем изобретении, для применения для лечения нарушения, описанного в настоящем изобретении. Другим объектом настоящего изобретения является применение соединения или композиции, описанной в настоящем изобретении, для приготовления лекарственного средства для лечения нарушения, описанного в настоящем изобретении.
Комбинированная терапия
[00208] Настоящее изобретение включает комбинированную терапию, которая включает введение замещенного пиразоло[1,5-a]пиримидинилкарбоксамида или родственного соединения, описанного в настоящем изобретении (такого как соединение формулы I, I-1, I-A, II, II-A, III, III-1 или IV) и второго средства в качестве части назначенного конкретного режима лечения с обеспечением благоприятного эффекта вследствие совместного воздействия этих терапевтических средств. Благоприятный эффект комбинации может включать фармакокинетическое или фармакодинамическое совместное воздействие, обусловленное комбинацией терапевтических средств.
[00209] Типичные вторые средства для применения для лечения болезни Гоше включают, например, талиглюцеразу альфа, велаглюцеразу альфа, элиглустат и миглустат. Типичные вторые средства для применения для лечения болезни Паркинсона включают, например, ингибитор глюкозилкерамидсинтазы (например, ибиглустат), ингибитор кислотной керамидазы (например, кармофур), активатор кислотной сфингомиелиназы, леводопу, прамипексол, ропинирол, ротиготин, апоморфин или его соль. Дополнительные ингибиторы глюкозилкерамидсинтазы для использования в комбинированной терапии включают, например, описанные в Публикациях заявок на международные патенты WO 2015/089067, WO 2014/151291, WO 2014/043068, WO 2008/150486, WO 2010/014554, WO 2012/129084, WO 2011/133915 и WO 2010/091164; патентах U.S. №№ US 9126993, US 8961959, US 8940776, US 8729075 и US 8309593; и Публикациях заявок на патенты US 2014/0255381 и US 2014/0336174; каждая из которых включена в настоящее изобретение в качестве ссылки. Дополнительные ингибиторы кислотной керамидазы для применения в комбинированной терапии включают, например, описанные в Публикациях заявок на международные патенты WO 2015/173168 и WO 2015/173169, каждая из которых включена в настоящее изобретение в качестве ссылки.
IV. Фармацевтические композиции
[00210] Настоящее изобретение относится к фармацевтическим композициям, включающим замещенный пиразоло[1,5-a]пиримидинилкарбоксамид или родственное органическое соединение, описанное в настоящем изобретении, такое как соединение формулы I, I-1, I-A, II, II-A, III, III-1 или IV. В некоторых вариантах осуществления фармацевтические композиции предпочтительно включают терапевтически эффективное количество одного или большего количества замещенных пиразоло[1,5-a]пиримидинилкарбоксамидов или родственных органических соединений, описанных выше, приготовленных вместе с одним или большим количеством фармацевтически приемлемых носителей (добавок) и/или разбавителей. Как подробно описано ниже, фармацевтические композиции, предлагаемые в настоящем изобретении, можно специально приготовить для введения в твердой или жидкой форме, включая формы, приспособленные для следующего: (1) перорального введения, например, кисели (водные или неводные растворы или суспензии), таблетки (например, предназначенные для буккального, сублингвального и/или системного всасывания), болюсы, порошки, гранулы, пасты для нанесения на язык; (2) парентерального введения путем, например, подкожной, внутримышечной, внутривенной или эпидуральной инъекции с помощью, например, стерильного раствора или суспензии, или препарата замедленного высвобождения; (3) местного нанесения, например, с помощью крема, мази или пластыря регулируемого высвобождения или спрея, наносимого на кожу; (4) внутривагинального или внутриректального введения, например, с помощью пессария, крема или пенки; (5) сублингвального введения; (6) глазного введения; (7) чрескожного введения; или (8) назального введения.
[00211] Выражение "терапевтически эффективное количество" при использовании в настоящем изобретении означает количество соединения, материала или композиции, включающей соединение, предлагаемое в настоящем изобретении, которое эффективно для обеспечения некоторого желательного терапевтического эффекта по меньшей мере в субпопуляции клеток животного при разумном отношении польза/риск, применимое для любого лечения.
[00212] Выражение "фармацевтически приемлемые" используется в настоящем изобретении для обозначения таких соединений, материалов, композиций и/или дозированных форм, которые с точки зрения медицины являются подходящими для взаимодействия с тканями человека или животных без чрезмерной токсичности, раздражающего воздействия, аллергической реакции или других затруднений и осложнений при разумном отношении польза/риск.
[00213] Смачивающие агенты, эмульгаторы и смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также окрашивающие агенты, разделительные агенты, агенты для нанесения покрытий, подсластители, ароматизаторы и отдушки, консерванты и антиоксиданты также могут содержаться в композициях.
[00214] Примеры фармацевтически приемлемых антиоксидантов включают: (1) растворимые в воде антиоксиданты, такие как аскорбиновая кислота, цистеингидрохлорид, бисульфат натрия, метабисульфит натрия, сульфит натрия и т. п.; (2) растворимые в масле антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), лецитин, пропилгаллат, альфа-токоферол и т. п.; и (3) хелатные агенты для металлов, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, винная кислота, фосфорная кислота и т. п.
[00215] Препараты, предлагаемые в настоящем изобретении, включают подходящие для перорального, назального, местного (включая буккальное и сублингвальное), ректального, вагинального и/или парентерального введения. Препараты удобно использовать в разовой дозированной формы и их можно получить по любым методикам, хорошо известным в области фармацевтики. Количество активного ингредиента, которое можно объединять с материалом носителя для приготовления одной дозированной формы, меняется в зависимости от хозяина, подвергающегося лечению, конкретного пути введения.
[00216] Количество активного ингредиента, которое можно объединять с материалом носителя для приготовления одной дозированной формы, обычно представляет собой количество соединения, которое обеспечивает терапевтический эффект. Обычно в пределах 100% это количество находится в диапазоне от примерно 0,1% до примерно 99% активного ингредиента, предпочтительно от примерно 5% до примерно 70%, наиболее предпочтительно от примерно 10% до примерно 30%.
[00217] В некоторых вариантах осуществления препарат, предлагаемый в настоящем изобретении, включает инертный наполнитель, выбранный из группы, включающей циклодекстрины, целлюлозы, липосомы, образующие мицеллы агенты, например, желчные кислоты, и полимерные носители, например, сложные полиэфиры и полиангидриды; и соединение, предлагаемое в настоящем изобретении. В некоторых вариантах осуществления указанный выше препарат делает перорально биологически доступным соединение, предлагаемое в настоящем изобретении.
[00218] Методики приготовления этих препаратов или композиций включают стадию объединения соединения, предлагаемого в настоящем изобретении, с носителем и необязательно с одним или большим количеством вспомогательных ингредиентов. Обычно препараты готовят путем однородного и тщательного объединения соединения, предлагаемого в настоящем изобретении, с жидкими носителями или тонкоизмельченными твердыми носителями, или с ними обоими и затем при необходимости формования продукта.
[00219] Препараты, предлагаемые в настоящем изобретении, подходящие для перорального введения могут находиться в форме капсул, облаток, пилюль, таблеток, лепешек (с использованием ароматизированной основы, обычно сахарозы и камеди акации или трагакантовой камеди), порошков, гранул или в виде раствора или суспензии в водной или неводной жидкости, или в виде жидкой эмульсии масло-в-воде или вода-в-масле, или в виде эликсира или сиропа, или в виде пастилок (с использованием инертной основы, такой как желатин и глицерин, или сахароза и камедь акации) и/или в виде жидкости для полоскания рта и т. п., каждая из которых содержит заранее заданное количество соединения, предлагаемого в настоящем изобретении, в качестве активного ингредиента. Соединение, предлагаемое в настоящем изобретении, также можно вводить в виде болюса, электуария или пасты.
[00220] В твердых дозированных формах, предлагаемых в настоящем изобретении для перорального введения (капсулы, таблетки, пилюли, драже, порошки, гранулы, пастилки и т. п.), активный ингредиент смешан с одним или большим количеством фармацевтически приемлемых носителей, таких как цитрат натрия или дикальцийфосфат, и/или с любым из следующих: (1) наполнители или средства, увеличивающие объем, такие как крахмалы, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; (2) связующие, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или камедь акации; (3) влагоудерживающие средства, такие как глицерин; (4) разрыхляющие агенты, такие как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия; (5) замедляющие растворение агенты, такие как парафин; (6) ускорители всасывания, такие как четвертичные аммониевые соединения и поверхностно-активные вещества, такие как полоксамер и лаурилсульфат натрия; (7) смачивающие агенты, такие как, например, цетиловый спирт, глицеринмоностеарат и неионогенные поверхностно-активные вещества; (8) абсорбенты, такие как каолин и бентонитовая глина; (9) смазывающие вещества, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, стеарат цинка, стеарат натрия, стеариновая кислота и их смеси; (10) окрашивающие агенты; и (11) агенты для регулируемого высвобождения, такие как кросповидон или этилцеллюлоза. В случае капсул, таблеток и пилюль фармацевтические композиции также могут включать буферные реагенты. Твердые композиции аналогичного типа также можно использовать для заполнения капсул из мягкого и твердого желатина с использованием таких инертных наполнителей, как лактоза или молочные сахара, а также обладающие большой молекулярной массой полиэтиленгликоли и т. п.
[00221] Таблетку можно изготовить прессованием или формованием, необязательно с одним или большим количеством вспомогательных ингредиентов. Прессованные таблетки можно изготовить с использованием связующего (например, желатина или гидроксипропилметилцеллюлозы), смазывающего вещества, инертного разбавителя, консерванта, разрыхлителя (например, натриевой соли гликолята крахмала или сшитой натриевой соли карбоксиметилцеллюлозы), поверхностно-активного или диспергирующего агента. Формованные таблетки можно изготовить путем проводимого в подходящей формования смеси порошкообразного соединения, увлажненного инертным жидким разбавителем.
[00222] Таблетки и другие твердые дозированные формы фармацевтических композиций, предлагаемых в настоящем изобретении, такие как драже, капсулы, пилюли и гранулы, необязательно можно снабдить насечками или изготовить с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области приготовления фармацевтических средств. Их также можно изготовить так, чтобы обеспечить медленное или регулируемое высвобождение из них активного ингредиента, используя, например, гидроксипропилметилцеллюлозу в разных концентрациях, обеспечивающую желательный профиль высвобождения, других полимерные матрицы, липосомы и/или микросферы. Их можно изготовить для быстрого высвобождения, например, с помощью сушки вымораживанием. Их можно стерилизовать путем, например, фильтрования через удерживающий бактерии фильтр или путем включения стерилизующих агентов и получить стерильную твердую композицию, которую можно растворить в стерильной воде или какой-либо другой стерильной среде для инъекций непосредственно перед использованием. Эти композиции также необязательно могут содержать замутняющие агенты и могут обладать таким составом, что высвобождают только активный ингредиент(ы), или предпочтительно, на некотором участке желудочно-кишечного тракта, необязательно в замедленном режиме. Примеры средств для включения композиций, которые можно использовать, включают полимерные вещества и воска. Активный ингредиент также может находиться в микрокапсулированной форме, если это целесообразно, с одним или большим количеством описанных выше инертных наполнителей.
[00223] Жидкие дозированные формы для перорального введения соединений, предлагаемых в настоящем изобретении, включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активному ингредиенту жидкие дозированные формы могут содержать инертные разбавители, обычно использующиеся в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое, арахисовое, кукурузное, из зародышей, оливковое, касторовое и кунжутное масло), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и эфиры жирных кислот и сорбита и их смеси.
[00224] Кроме инертных разбавителей пероральные композиции также могут включать вспомогательные вещества, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подсластители, ароматизаторы, красители, отдушки и консервирующие агенты.
[00225] Суспензии в дополнение к активным соединениям могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и эфиры сорбита, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакантовая камедь и их смеси.
[00226] Препараты фармацевтических композиций, предлагаемые в настоящем изобретении для ректального или вагинального введения можно представить в виде суппозитория, который можно приготовить путем смешивания одного или большего количества соединений, предлагаемых в настоящем изобретении, с одним или большим количеством подходящих нераздражающих инертных наполнителей или носителей, включающих, например, масло какао, полиэтиленгликоль, воск для суппозиториев или салицилат, и который является твердым при комнатной температуре, но жидким при температуре тела и поэтому плавится в прямой кишке или полости влагалища и высвобождает активное соединение.
[00227] Препараты, предлагаемые в настоящем изобретении, которые являются подходящими для вагинального введения также включают пессарии, тампоны, кремы, гели, пасты, пенки или спреи препаратов, содержащие такие носители, которые известны в данной области техники, как подходящие.
[00228] Дозированные формы для местного или чрескожного введения соединения, предлагаемого в настоящем изобретении, включают порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и средства для ингаляции. Активное соединение можно в стерильных условиях смешать с приемлемым носителем и с любыми консервантами, буферами или пропеллентами, которые могут потребоваться.
[00229] Мази, пасты, кремы и гели в дополнение к активному соединению, предлагаемому в настоящем изобретении, могут содержать инертные наполнители, такие как животные и растительные жиры, масла, воска, парафины, крахмал, трагакантовую камедь, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевую кислоту, тальк и оксид цинка или их смеси.
[00230] Порошки и спреи в дополнение к соединению, предлагаемому в настоящем изобретении, могут содержать инертные наполнители, такие как лактоза, тальк, кремниевая кислота, гидроксид алюминия, силикаты кальция и порошкообразный полиамид, или смеси эти веществ. Спреи дополнительно могут содержать обычные пропелленты, такие как хлорфторуглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан.
[00231] Чрескожные пластыри обладают тем дополнительным преимуществом, что обеспечивают регулируемую доставку в организм соединения, предлагаемого в настоящем изобретении. Такие дозированные формы можно изготовить путем растворения или диспергирования соединения в надлежащей среде. Для увеличения потока соединения через кожу также можно использовать усилители всасывания. Скорость такого потока можно регулировать путем использования регулирующей скорость мембраны или диспергирования соединения в полимерной матрице или геле.
[00232] Офтальмологические препараты, глазные мази, порошки, растворы и т. п. также считаются входящими в объем настоящего изобретения.
[00233] Фармацевтические композиции, предлагаемые в настоящем изобретении, подходящие для парентерального введения, включают одно или большее количество соединений, предлагаемы в настоящем изобретении, в комбинации с одним или большим количеством фармацевтически приемлемых стерильных изотонических водных или неводных растворов, дисперсий, суспензий или эмульсий, или стерильных порошки, которые можно восстановить с получением стерильных растворов или дисперсий для инъекции непосредственно перед использованием, которые могут содержать сахара, спирты, антиоксиданты, буферы, бактериостатики, растворенные вещества, которые делают препарат изотоническим с кровью подвергающегося лечению реципиента, или суспендирующие или загущающие агенты.
[00234] Примеры подходящих водных и неводных носителей, которые можно использовать в фармацевтических композициях, предлагаемых в настоящем изобретении, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т. п.) и подходящие их смеси, растительные масла, такие как оливковое масло, органические сложные эфиры для инъекции, такие как этилолеат. Надлежащую сыпучесть можно обеспечить, например, путем использования материалов покрытия, таких как лецитин, путем обеспечения необходимого размера частиц в случае дисперсии и путем использования поверхностно-активные веществ.
[00235] Эти композиции также могут содержать вспомогательные вещества, такие как консерванты, смачивающие агенты, эмульгирующие агенты и диспергирующие агенты. Предупреждение воздействия микроорганизмов на использующиеся соединения можно обеспечить путем включения различных антибактериальных и фунгицидных агентов, таких как парабен, хлорбутанол, фенол, сорбиновая кислота и т. п. Также может быть желательно включать в композиции изотонические агенты, такие как сахара, хлорид натрия и т. п. Кроме того, пролонгированное всасывание фармацевтической формы для инъекции можно обеспечить путем включения агентов, которые задерживают всасывание, таких как моностеарат алюминия и желатин.
[00236] В некоторых случаях для пролонгирования действия лекарственного средства желательно замедлить всасывание лекарственного средства при подкожной или внутримышечной инъекции. Это можно выполнить путем использования жидкой суспензии кристаллического или аморфного материала, обладающего плохой растворимостью в воде. Таким образом, скорость всасывания лекарственного средства зависит от скорости растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленное всасывание парентерально введенной лекарственного средства осуществляется путем растворения или суспендирования лекарственного средства в масляном разбавителе.
[00237] Формы депо для инъекции готовят путем формирования микрокапсулирующих матриц рассматриваемого соединений в биологически разлагающихся полимерах, таких как полилактид-полигликолид. Путем изменения отношения количества лекарственного средства к количеству полимера и природы конкретного использующегося полимера можно регулировать скорость лекарственного средства высвобождения. Примеры других биологически разлагающихся полимеров включают поли(ортоэфиры) и поли(ангидриды). Препараты депо для инъекции также готовят путем включения лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканью организма.
[00238] Когда соединения, предлагаемые в настоящем изобретении, вводят в качестве лекарственных средств людям и животным, их можно вводить по отдельности или в виде фармацевтической композиции, содержащей, например, от 0,1 до 99% (более предпочтительно, от 10 до 30%) активного ингредиента в комбинации с фармацевтически приемлемым носителем.
[00239] Препараты, предлагаемые в настоящем изобретении, можно вводить перорально, парентерально, местно или ректально. Разумеется, их вводят в формах, подходящих для каждого пути введения. Например, их вводят в форме таблетки или капсулы, с помощью инъекции, ингаляции, глазной примочки, мази, суппозитория и т. п. вводят путем инъекции, инфузии или ингаляции; местно в виде лосьона или мази; и ректально в виде суппозитория. Пероральное введение является предпочтительным.
[00240] Выражения "парентеральное введение" и "введение парентерально" при использовании в настоящем изобретении означает пути введения кроме энтерального и местного введение, обычно путем инъекции, и включает без наложения ограничений внутривенную, внутримышечную, внутриартериальную, внутриоболочечную, внутрикапсульную, внутриорбитальную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, подкутикулярную, внутрисуставную, подкапсулярную, субарахноидальную, интраспинальную и надчревную инъекцию и инфузию.
[00241] Выражения "системное введение", "введение системно", "периферическое введение" и "введение периферически" при использовании в настоящем изобретении означает введение соединения, лекарственного средства или другого материала не непосредственно в центральную нервную систему, так что оно попадает в систему пациента и, таким образом, подвергается метаболизму и участвует в других аналогичных процессах, например, подкожное введение.
[00242] Эти соединения можно вводить для лечения людям и другим животным любым подходящим путем введения, включая пероральное, назальное, с помощью, например, спрея, ректальное, внутривагинальное, парентеральное, интрацистернальное и местное, с помощью порошков, мази или капель, включая буккальное и сублингвальное.
[00243] Независимо от выбранного пути введения, соединения, предлагаемые в настоящем изобретении, которые можно использовать в подходящей гидратированной форме, и/или фармацевтические композиции, предлагаемые в настоящем изобретении, готовят в виде фармацевтически приемлемых дозированных форм по обычным методикам, известным специалистам в данной области техники.
[00244] Реальные дозы активных ингредиентов в фармацевтических композициях, предлагаемых в настоящем изобретении, могут меняться для обеспечения количества активного ингредиента, которое эффективно для обеспечения желательного терапевтического ответа для конкретного пациента, композиции и пути введения без проявления токсичности для пациента.
[00245] Выбранная доза зависит от различных факторов, включая активность конкретного использующегося соединения, предлагаемого в настоящем изобретении, или его сложного эфира, соли или амида, пути введения, времени введения, скорости выведения или метаболизма конкретного использующегося соединения, скорости и степени всасывания, длительности лечения, других лекарственных средств, соединений и/или материалов, использующихся в комбинации с конкретным использующимся соединением, возраста, пола, массы, состояния, общего состояния здоровья и анамнеза пациента, подвергающегося лечению, и аналогичных факторов, хорошо известных в медицине.
[00246] Врач или ветеринар с общей подготовкой в данной области техники может легко определить и назначить эффективное количество необходимой фармацевтической композиции. Например, врач или ветеринар может начать с доз соединений, предлагаемых в настоящем изобретении, использующихся в фармацевтической композиции, меньших, чем необходимые для обеспечения желательного терапевтического эффекта, и постепенно увеличивать дозу, пока не будет обеспечен желательный эффект.
[00247] Обычно подходящая суточная доза соединения, предлагаемого в настоящем изобретении, будет содержать такое количество соединения, которое соответствует наименьшей дозе, эффективной для обеспечения терапевтического эффекта. Такая эффективная доза обычно зависит от факторов, описанных выше. Предпочтительно, если соединения вводят в дозе, равной от примерно 0,01 мг/кг до примерно 200 мг/кг, более предпочтительно от примерно 0,1 мг/кг до примерно 100 мг/кг, еще более предпочтительно от примерно 0,5 мг/кг до примерно 50 мг/кг. Если соединения, описанные в настоящем изобретении, вводят совместно с другим агентом (например, сенсибилизирующими агентами), эффективное количество может быть меньше, чем при использовании его отдельно.
[00248] При желании эффективную суточную дозу активного соединения можно вводить в виде двух, трех, четырех, пяти, шести или большего количества разделенных доз, вводимых в течение дня через подходящие интервалы, необязательно, в виде разовых дозированных форм. Предпочтительным является одно введение в день.
V. Наборы для применения в медицинских целях
[00249] Другим объектом настоящего изобретения является набор для лечения нарушения. Набор включает: i) инструкции для лечения патологического нарушения, такого как болезнь Гоше, болезнь Паркинсона, болезнь телец Леви, слабоумие или мультисистемная атрофия; и ii) замещенный пиразоло[1,5-a]пиримидинилкарбоксамид или родственное органическое соединение, описанное в настоящем изобретении, такое как соединение формулы I, I-1, I-A, II, II-A, III, III-1 или IV. Набор может включать одну или большее количество разовых дозированных форм, содержащих количество замещенного пиразоло[1,5-a]пиримидинилкарбоксамида или родственного органического соединения, описанного в настоящем изобретении, такого как соединение формулы I, которое эффективно для лечения указанного патологического нарушения, такого как болезнь Гоше, болезнь Паркинсона, болезнь телец Леви, слабоумие или мультисистемная атрофия.
[00250] В приведенном выше описании представлены многие объекты и варианты осуществления настоящего изобретения, включающие замещенный пиразоло[1,5-a]пиримидинилкарбоксамид и родственные органические соединения, композиции, включающие замещенный пиразоло[1,5-a]пиримидинилкарбоксамид или родственные органические соединения, способы применения замещенного пиразоло[1,5-a]пиримидинилкарбоксамида или родственных органических соединений и наборов. В объем настоящей заявки на патент специально включены все комбинации и преобразования объектов и вариантов осуществления. Например, настоящее изобретение включает лечение болезни Гоше, болезни Паркинсона, болезни телец Леви, слабоумия или мультисистемной атрофии у человека путем введения терапевтически эффективного количества соединения формулы I-A. Кроме того, например, настоящее изобретение включает набор для лечения болезни Гоше, болезни Паркинсона, болезни телец Леви, слабоумия или мультисистемной атрофии, набор включает i) инструкции для лечения болезни Гоше, болезни Паркинсона, болезни телец Леви, слабоумия или мультисистемной атрофии и ii) замещенный пиразоло[1,5-a]пиримидинилкарбоксамид или родственное органическое соединение, описанное в настоящем изобретении, такое как соединение формулы I-A.
ПРИМЕРЫ
[00251] Настоящее изобретение, в целом описанное, будет легче понять со ссылкой на приведенные ниже примеры, которые включены просто для иллюстрации некоторых объектов и вариантов осуществления настоящего изобретения и не предназначены для ограничения настоящего изобретения.
Пример 1 - Получение пиразоло[1,5-a]пиримидинилкарбоксамидов
[00252] Пиразоло[1,5-a]пиримидин-3-карбоксамиды получали на основе общих методик, описанных ниже в части I. Типичные методики получения конкретных аминов, применимых в качестве синтетических промежуточных продуктов для получения некоторых пиразоло[1,5-a]пиримидин-3-карбоксамидов, приведены ниже в части II. Типичные методики получения конкретных карбоновых кислот, применимых в качестве синтетических промежуточных продуктов для получения некоторых пиразоло[1,5-a]пиримидин-3-карбоксамидов, приведены ниже в части III. Конкретные пиразоло[1,5-a]пиримидин-3-карбоксамиды, полученные по общим методикам, приведены ниже в части IV.
Часть I - Общие методики
Общая методика A: Получение амида путем сочетания карбоновой кислоты с амином
[00253] При перемешивании к раствору карбоновой кислоты (1,0 экв.), HATU (1,5 экв.) и DIPEA (3,75 экв.) в DCM или DMF (~4 мл/0,2 ммоля) добавляли амин (1,25-2,0 экв.). Реакционную смесь перемешивали при RT в течение 4-16 ч и затем промывали насыщенным водным раствором NaHCO3 (5 мл/0,2 ммоля), водным раствором лимонной кислоты (5 мл/0,2 ммоля) и рассолом (5 мл/0,2 ммоля). Объединенные экстракты сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле или препаративной HPLC и получали амид.
Общая методика B: Превращение эфира карбоновой кислоты в карбоновую кислоту
[00254] К раствору эфира карбоновой кислоты (1,0 экв.) в EtOH (5,0 мл/1,0 ммоля) и воде (0-3,0 мл/1,0 ммоля) добавляли NaOH (2,0-5,0 экв.) и смесь нагревали при 80°C в течение 2 ч и затем концентрировали. К концентрату добавляли 6 н. раствор HCl для установления pH, равного 5~6 и затем смесь перемешивали в течение 10 мин и затем фильтровали. Полученное твердое вещество собирали и сушили и получали карбоновую кислоту.
Общая методика B*: Превращение эфира карбоновой кислоты в карбоновую кислоту
[00255] К раствору эфира карбоновой кислоты (1,0 экв.) в EtOH (5,0 мл/1,0 ммоля) и воды (0-3,0 мл/1,0 ммоля) добавляли NaOH (2,0-5,0 экв.) и смесь нагревали при 80°C в течение 2 ч и затем концентрировали. К концентрату добавляли 6 н. раствор HCl для установления pH, равного 5~6 и затем смесь перемешивали в течение 10 мин и затем фильтровали. Полученное твердое вещество собирали и сушили и получали карбоновую кислоту.
[00256] Альтернативно, к раствору эфира карбоновой кислоты (1,0 экв.) в THF (5,0 мл/1,0 ммоля) добавляли LiOH (1M раствор, 3 экв.) и смесь перемешивали при 60°C в течение 1-2 ч и затем значение pH устанавливали равным ~7 с помощью 1 н. HCl. Полученный раствор лиофилизировали и получали неочищенную карбоновую кислоту.
Общая методика C: Получение амида из карбоновой кислоты и амина
[00257] К раствору карбоновой кислоты (1,0 экв.) в DCM (3 мл/0,5 ммоля) добавляли DMF (1 каплю) и оксалилхлорид (2,0 экв.). Раствор перемешивали при RT в течение 30 мин и затем концентрировали в вакууме. Полученный остаток растворяли в DCM (1 мл/0,5 ммоля), затем добавляли амин (5,0 экв.) и триэтиламин (2,0 экв.). Реакционную смесь перемешивали при RT в течение 2 ч и затем разбавляли с помощью DCM (10 мл/0,5 ммоля). Органический раствор последовательно промывали с помощью H2O (10 мл/0,5 ммоля) и рассолом (10 мл/0,5 ммоля), затем сушили над безводным Na2SO4 и затем фильтровали. Фильтрат концентрировали в вакууме и полученный остаток очищали с помощью препаративной HPLC или хроматографии на силикагеле и получали амид.
Общая методика D: Получение связанных арильных и гетероарильных групп по катализируемой реакции сочетания Судзуки борорганической кислоты или ее эфира с арилгалогенидом или гетероарилгалогенидом
[00258] Суспензию гетероарилхлорида (1 экв.), борорганической кислоты или эфира борорганической кислоты (1,2 экв.), K3PO4 (3,0 экв.) и Pd(dppf)Cl2•DCM (5 мол.%) или Pd2(dba)3 (10 мол.%) в DME или 1,4-диоксане (40 мл/ммоль) перемешивали при 70-100°C в течение 2-6 ч в атмосфере N2. Затем реакционную смесь концентрировали в вакууме и полученный остаток очищали с помощью колоночной хроматографии на силикагеле и получали связанную кольцевую систему.
Общая методика E: Получение связанных арильных и гетероарильных групп по катализируемой реакции сочетания Бухвальда галогенида органического соединения в присутствии содержащего олово реагента [00259] Раствор бромида органического соединения (1,0 экв.), хлорида органического соединения (1,0 экв.), гексабутилдиолова (1,0 экв.) и Pd(dppf)Cl2•DCM (10 мол.%) в безводном 1,4-диоксане (10 мл/ммоль) перемешивали при 100(C в атмосфере N2 в течение ночи, затем охлаждали и реакцию останавливали водой (20 мл/ммоль). Полученную смесь экстрагировали с помощью EtOAc (20 мл/ммоль(3), органические фазы разделяли и сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и полученный остаток очищали с помощью колоночной хроматографии на силикагеле или препаративной TLC и получали связанную кольцевую систему.
Общая методика E*: Получение связанных арильных и гетероарильных групп по катализируемой реакции сочетания Бухвальда галогенида органического соединения в присутствии содержащего олово реагента
[00260] Раствор бромида органического соединения (1,0 экв.), хлорида органического соединения (1,0 экв.), гексабутилдиолова (1,0 экв.) и Pd(dppf)Cl2•DCM или Pd(t-Bu3P)2 (10 мол.%) в безводном 1,4-диоксан (10 мл/ммоль) перемешивали при 100°C в атмосфере N2 в течение ночи, затем охлаждали и реакцию останавливали водой (20 мл/ммоль). Полученную смесь экстрагировали с помощью EtOAc (20 мл/ммоль×3), затем органические фазы разделяли и сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и полученный остаток очищали с помощью колоночной хроматографии на силикагеле или препаративной TLC и получали связанную кольцевую систему.
Общая методика F: Получение связанных арильных и гетероарильных групп по катализируемой реакции сочетания Бухвальда галогенида органического соединения и содержащего олово реагента
[00261] Раствор хлорида органического соединения (1,0 экв.) и оловоорганического реагента (1,0 экв.) в 1,4-диоксане (20 мл/ммоль) перемешивали и трижды продували с помощью N2 при RT. Затем Pd(dppf)Cl2•DCM (10 мол.%) быстро добавляли в атмосфере N2 к реакционной смеси, затем дополнительно продували с помощью N2 (×3) и затем смесь перемешивали при 120°C в течение ночи. Затем реакционную смесь охлаждали до RT и затем реакцию останавливали водой (20 мл/ммоль). Полученную смесь экстрагировали с помощью EA (20 мл/ммоль×3) и органические фазы сушили над безводным Na2SO4 и фильтровали и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле или препаративной TLC и получали связанную кольцевую систему.
Общая методика G: Получение гетероариламина по реакции замещения между галогенидом органического соединения и алифатическим амином
[00262] Раствор хлорида органического соединения (1,0 экв.), амингидрохлорид (1,3 экв.) и DIEA (3,0 экв.) в DMF (5 мл/1 ммоля) перемешивали при 60(C в течение 5 ч, затем охлаждали до RT и разбавляли с помощью EA (30 мл/ммоль). Полученную смесь промывали с помощью H2O (10 мл/ммоль(3) и органические фазы сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и полученный остаток очищали с помощью колоночной хроматографии на силикагеле и получали амин.
[00263] Общая методика H: Получение связанных имидазолидинильных групп по катализируемой реакции сочетания Бухвальда галогенида органического соединения и имидазолидинильного реагента
[00264] Раствор хлорида органического соединения (1,0 экв.), имидазолидинильного реагента (1,0 -2,0 экв.), Pd2(dba)3 (10 мол.%), x-antphos (20 мол.%) и Cs2CO3 (2,1 экв.) в диоксане (0. 3 ммоль/5 мл) перемешивали при 110°C в течение 2-16 ч в атмосфере N2. Затем реакционную смесь охлаждали до RT, реакцию останавливали насыщенным раствором NH4Cl (20 мл) и экстрагировали с помощью EA (30 мл×3). Объединенные органические слои промывали рассолом (30 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и полученный остаток очищали с помощью колоночной хроматографии на силикагеле и получали связанную кольцевую систему.
Часть II - Получение конкретных аминов
[00265] Типичные методики получения конкретных аминов, применимые для получения некоторых пиразоло[1,5-a]пиримидин-3-карбоксамидов, приведены ниже.
2-Циклопропилпропан-2-амин
[00266] К раствору 1-циклопропилэтан-1-она (1,0 г, 11,2 ммоля) в безводном Et2O (5 мл) добавляли раствор MgMeBr (4,4 мл, 13,2 ммоля) со скоростью, обеспечивающей поддержание слабого кипения растворителя, и получали искомый алкоголят в виде белого осадка. Реакционную смесь поддерживали в кипящем состоянии в течение еще 30 мин, затем перемешивали при RT в течение ночи и реакцию останавливали насыщенным раствором NH4Cl (5 мл). Полученную смесь экстрагировали с помощью Et2O (5 мл) и объединенные органические слои промывали рассолом (5 мл), сушили над Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 2-циклопропилпропан-2-ол в виде бледно-желтого масла (1,1 г, 92%). 1H ЯМР (500 МГц, CDCl3) δ 1,18 (s, 6H), 0,97-0,94 (m, 1H), 0,39-0,30 (m, 4H).
[00267] При перемешивании к раствору 2-циклопропилпропан-2-ола (1,1 г, 11,2 ммоля) в CHCl3 (10 мл) последовательно при RT добавляли NaN3 (1,08 г, 15,8 ммоля) и Cl3CO2H (2,8 г, 17,2 ммоля). Смесь перемешивали при RT в течение 2 ч, промывали двумя порциями 10% водного раствора NaHCO3 (5 мл), рассолом (10 мл), сушили над Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали (2-азидопропан-2-ил)циклопропан в виде прозрачного масла (1,2 г, 85%).
[00268] К суспензии LiAlH4 (670 мг, 17,7 ммоля) в безводном диэтиловом эфире (6 мл) добавляли раствор (2-азидопропан-2-ил)циклопропана (1,2 г, 11,2 ммоля) в 4 мл безводного диэтилового эфира со скоростью, обеспечивающей поддержание кипения. После кипячения с обратным холодильником в течение 2 ч, реакционную смесь охлаждали до 0°C, реакцию останавливали путем осторожного добавления 0,67 мл H2O, 0,67 мл 15% раствора NaOH и 2,0 мл H2O, проводимого последовательно. Твердое вещество отфильтровывали и фильтрат концентрировали в вакууме и получали 2-циклопропилпропан-2-амин в виде прозрачного масла (1,0 г, 90%).
[1,1'-Би(циклопропан)]-1-амин
[00269] К раствору циклопропанкарбонитрила (1,0 г, 15 ммоля) в диэтиловом эфире (15 мл) добавляли Ti(OiPr)4 (4,66 г, 16,4 ммоля) и раствор охлаждали до -78°C и медленно добавляли раствор EtMgBr (3 M в эфире, 30 ммоля). Через 10 мин при -78° C суспензии давали нагреться до RT и перемешивали в течение 1 ч. Добавляли BF3.OEt2 (4,26 г, 30 ммоля) и смесь перемешивали при RT в течение 18 ч. К этой смеси при 0°C медленно добавляли 2 н. NaOH (30 мл). Органическую фазу отделяли и экстрагировали с помощью 2 н. HCl (30 мл). Водную фазу концентрировали в вакууме и полученный остаток растирали с диэтиловым эфиром и получали [1,1'-би(циклопропан)]-1-амин (0,5 г, 34%) в виде гидрохлорида.
1-Циклопропил-3-метилбутан-1-амин
[00270] Смесь циклопропанкарбонитрила (5,0 г, 74,6 ммоля) и iBuMgBr (326 мг, 2,4 ммоля) в диэтиловом эфире (10 мл) перемешивали при кипячении с обратным холодильником в течение 5 ч, реакцию останавливали насыщенным раствором NH4Cl (10 мл) и экстрагировали с помощью EtOAc (10 мл×3). Объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали неочищенный имин (7,5 г, 80%), который без обработки использовали на следующей стадии. Смесь имина (7,5 г, 60 ммоля) и NaBH4 (2,28 г, 60 ммоля) в MeOH (50 мл) перемешивали при RT в течение 3 ч, реакцию останавливали водой (50 мл) и экстрагировали с помощью EtOAc (50 мл×3). Органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и полученный остаток растворяли в HCl/диоксан (50 мл, 4M). Полученную смесь перемешивали при RT в течение 30 мин и концентрировали в вакууме. Добавляли диэтиловый эфир (50 мл), что приводило к образованию осадка, который отфильтровывали и сушили и получали 1-циклопропил-3-метилбутан-1-амин (1,5 г, 16%) в виде бледно-желтого твердого вещества.
2-(Спиро[3.3]гептан-2-ил)пропан-2-амин
[00271] Концентрированную H2SO4 (0,5 мл) по каплям добавляли к раствору спиро[3.3]гептан-2-карбоновой кислоты (1 г, 7,14 ммоля) в EtOH (30 мл) при 0°C и реакционную смесь кипятили с обратным холодильником в течение 20 ч. После завершения реакции, растворитель удаляли и реакционную смесь растворяли в EtOAc (150 мл). Органический слой промывали насыщенным раствором NaHCO3 (100 мл), сушили над безводным MgSO4 и фильтровали. Фильтрат концентрировали в вакууме и получали этилспиро[3.3]гептан-2-карбоксилат (1,2 г, 100%) в виде бесцветного масла, которое без обработки использовали на следующей стадии. 1H ЯМР (500 МГц, CDCl3) δ 4,04 (q, J=7,0 Гц, 2H), 2,94-2,78 (m, 1H), 2,14 (p, J=11,0 Гц, 4H), 1,95 (t, J=7,5 Гц, 2H), 1,85 (t, J=7,4 Гц, 2H), 1,73 (dd, J=15,0 Гц, 7,5 Гц, 2H), 1,17 (t, J=7,5 Гц, 3H).
[00272] К раствору этилспиро[3.3]гептан-2-карбоксилата (1,2 г, 7,14 ммоля) в безводном THF (20 мл) при -78°C по каплям добавляли раствор MeMgBr (3,0 M в Et2O; 9,52 мл, 28,56 ммоля). Затем реакционную смесь перемешивали при RT в течение 18 ч, осторожно выливали в насыщенный раствор NH4Cl (20 мл) и экстрагировали с помощью EtOAc (30 мл×3). Объединенные органические слои промывали рассолом (40 мл), сушили над Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 2-(спиро[3.3]гептан-2-ил)пропан-2-ол (1,0 г, 96%) в виде бесцветного масла, которое использовали на следующей стадии без дополнительной очистки. 1H ЯМР (500 МГц, DMSO-d6) δ 3,94 (s, 1H), 2,02-2,04 (m, 1H), 1,96 (t, J=7,0 Гц, 2H), 1,87-1,80 (m, 2H), 1,78-1,73 (m, 6H), 0,93 (s, 6H).
[00273] При перемешивании смесь 2-(спиро[3.3]гептан-2-ил)пропан-2-ола (1,0 г, 6,49 ммоля), TMSN3 (2,95 г, 25,96 ммоля) и молекулярного сита (100 мг) в сухом CH2Cl2 (40 мл) при RT в атмосфере аргона обрабатывали с помощью BF3·Et2O (1,8 г, 12,98 ммоля). После перемешивания в течение 24 ч реакцию останавливали водой (100 мл). Органический слой отделяли, промывали насыщенным раствором NaHCO3 (30 мл), водой (30 мл) и рассолом (30 мл), сушили над безводным MgSO4 и фильтровали. Фильтрат концентрировали в вакууме. Полученный остаток очищали на колонке с силикагелем (PE/EtOAc; 3:1) и получали 2-(2-азидопропан-2-ил)спиро[3.3]гептан (1,1 г) в виде бесцветного масла.
[00274] Смесь 2-(2-азидопропан-2-ил)спиро[3.3]гептана (1,1 г, 6,14 ммоля) и Pd/C (100 мг, 10% мас./мас.) в MeOH (5 мл) перемешивали в атмосфере H2 при комнатной температуре в течение 20 ч. Катализатор удаляли фильтрованием через слой целита и фильтраты концентрировали и получали 2-(спиро[3.3]гептан-2-ил)пропан-2-амин (580 мг, 52%) в виде бесцветного масла. LC-MS m/z: 157,2 [M+H]+.
1-Циклопропил-2,2,2-трифторэтан-1-амин
[00275] Суспензию циклопропанкарбальдегида (7,0 г, 100 ммоля), бензиламина (11,2 г, 105 ммоля) и MgSO4 (62 г, 500 ммоля) в DCM (200 мл) перемешивали в течение 48 ч при RT. После завершения реакции раствор фильтровали через целит и фильтрат концентрировали в вакууме и получали N-бензил-1-циклопропилметанимин в виде светло-желтого масла (16 г, 100%). LC-MS слабый сигнал MS: m/z: 159,1 [M+H]+.
[00276] К раствору N-бензил-1-циклопропилметанимина (6,0 г, 37,7 ммоля) в MeCN (70 мл) добавляли KHF2 (2,35 г, 30,2 ммоля), CF3COOH (5,54 г, 48,6 ммоля) и DMF (5 мл) и смесь перемешивали при RT. Реакционную смесь охлаждали до 0°C в течение 5 мин и затем добавляли TMSCF3 (8,4 мл, 56,6 ммоля). После добавления реакционную смесь перемешивали в течение 12 ч при RT до полного израсходования исходного вещества (LCMS). Добавляли насыщенный раствор Na2CO3 (20 мл), перемешивали в течение 5 мин и затем добавляли 150 мл воды и смесь экстрагировали с помощью EtOAc (150 мл×3). Органические фазы объединяли, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Полученный остаток очищали с помощью флэш-хроматографии на силикагеле (DCM:MeOH; от 30:1 до 5:1) и получали N-бензил-1-циклопропил-2,2,2-трифторэтан-1-амин в виде бесцветного масла (3,5 г, выход: 41%). LC-MS m/z: 230,1 [M+H]+. Чистота по данным LC-MS (214 нм): 97%; tR=1,82 мин.
[00277] К раствору N-бензил-1-циклопропил-2,2,2-трифторэтан-1-амина (3,5 г, 15,3 ммоля) в MeOH (50 мл) добавляли 6 н. HCl (4 мл) при RT. Смесь трижды продували с помощью N2 и затем быстро добавляли Pd/C (350 мг, 10%, мас./мас.) в потоке N2. Смесь еще три раза продували с помощью H2 и перемешивали в течение 16 ч при комнатной температуре. Pd/C удаляли фильтрованием и фильтрат концентрировали в вакууме и получали 1-циклопропил-2,2,2-трифторэтан-1-амин в виде белого твердого вещества (3,5 г, 100%). 1H ЯМР (500 МГц, DMSO-d6) δ 9,35 (s, 3H), 3,63-3,58 (m, 1H), 1,11-1,06 (m, 1H), 0,72-0,66 (m, 4H). LC-MS m/z: 140,2 [M+H]+.
1-(4,4-Дифторциклогексил)этан-1-амин
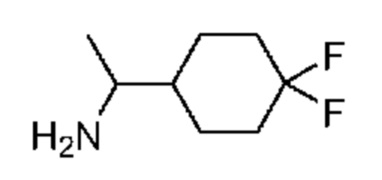
[00278] К раствору 4,4-дифторциклогексан-1-карбоновой кислоты (1,64 г, 10 ммоля) и DIPEA (2,58 г, 20 ммоля) в DMF (10 мл) при 0°C добавляли HATU (5,7 г, 15 ммоля) и реакционную смесь перемешивали при 0°C в течение 30 мин, затем добавляли N,O-диметилгидроксиламингидрохлорид (970 мг, 10 ммоля). Реакционной смеси давали нагреться до RT и перемешивали в течение ночи, затем реакцию останавливали насыщенным раствором NaHCO3 и разделяли. Водную фазу экстрагировали с помощью EtOAc (100 мл×3) и объединенные органические фазы сушили над Na2SO4, фильтровали и концентрировали в вакууме. Полученный остаток очищали с помощью хроматографии на силикагеле (PE/EtOAc; 4:1) и получали 4,4-дифтор-N-метокси-N-метилциклогексан-1-карбоксамид (880 мг, 42%) в виде бесцветного масла. LC-MS m/z: 208,0 [M+H]+. LCMS: tR=1,58 мин.
[00279] К раствору 4,4-дифтор-N-метокси-N-метилциклогексан-1-карбоксамида (880 мг, 4,25 ммоля) в THF (12 мл) при 0°C по каплям добавляли раствор MeLi в 1,2-диэтоксиэтане (3 моль/л, 2 мл). После завершения добавления реакционной смеси давали нагреться до RT и перемешивали в течение ночи, затем реакцию останавливали насыщенным раствором NH4Cl и реакционную смесь разделяли. Водную фазу экстрагировали с помощью EtOAc (120 мл×3) и объединенные органические фазы сушили над Na2SO4, фильтровали и концентрировали в вакууме. Полученный остаток очищали с помощью хроматографии на силикагеле (PE/EA=4:1) и получали 1-(4,4-дифторциклогексил)этан-1-он (400 мг, 43%) в виде светло-желтого масла. 1H ЯМР (500 МГц, CDCl3) δ 2,44 (m, 1H), 2,19 (s, 3H), 2,13-2,16 (m, 2H), 1,96-1,98 (m, 2H), 1,74-1,83 (m, 4H).
[00280] Смесь 1-(4,4-дифторциклогексил)этан-1-она ( (200 мг, 1,23 ммоля), NH4OAc (1,9 г, 24,6 ммоля) и NaBH3CN (388 мг, 6,15 ммоля) в i-PrOH (15 мл) перемешивали при RT в течение 4 ч и затем при 90°C в течение 2 ч. Затем реакционную смесь выливали в воду (15 мл), экстрагировали с помощью CH2Cl2 (30 мл, ×3) и сушили над Na2SO4, фильтровали и концентрировали в вакууме. Полученный остаток очищали с помощью хроматографии на силикагеле (EtOAc/MeOH; 10:1) и получали 1-(4,4-дифторциклогексил)этан-1-амин в виде бесцветного масла. LC-MS m/z: 164,1 [M+H]+. LCMS: tR=1,13 мин.
2-(4-Хлорфенил)пропан-2-амин
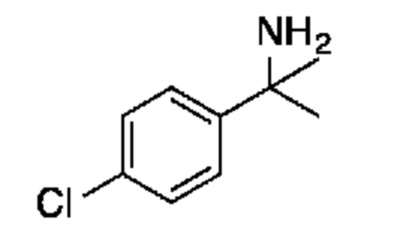
[00281] MgBrMe (3M в THF, 5 мл, 15 ммоля) при RT по каплям добавляли к раствору 1-(4-хлорфенил)этан-1-она (1,54 г, 10 моля) в Et2O (60 мл). После завершения добавления реакционную смесь перемешивали при RT в течение 12 ч и затем реакцию останавливали путем осторожного добавления насыщенного раствора NH4Cl (30 мл). Полученную смесь перемешивали в течение 1 ч и затем экстрагировали с помощью EtOAc (100 мл×3). Объединенные органические слои сушили над Na2SO4, фильтровали, концентрировали в вакууме и очищали с помощью хроматографии на силикагеле (PE/EtOAc; 5:1) и получали 2-(4-хлорфенил)пропан-2-ол (1,365 г, 80%) в виде бесцветного масла. 1H ЯМР (400 МГц, CDCl3) δ 7,42 (dd, J=6,8 Гц, 2,0 Гц, 2H). 7,29 (dd, J=6,8 Гц, 2,0 Гц, 2H), 1,78 (s, 1H), 1,56 (s, 6H).
[00282] Смесь 2-(4-хлорфенил)пропан-2-ола (1,36 г, 8 ммоля), TMSN3 (2,4 г, 16 ммоля) и BF3·Et2O (16 мл) в CH2Cl2 (20 мл) перемешивали при RT в течение 2 ч и реакцию останавливали насыщенным раствором NaHCO3. Полученную смесь отделяли и водную фазу экстрагировали с помощью CH2Cl2 (30 мл×3). Объединенные органические фазы сушили над Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали искомое соединение 1-(2-азидопропан-2-ил)-4-хлорбензол в виде бесцветного масла, которое использовали на следующей стадии без дополнительной очистки. LC-MS m/z: 153,0 [M - N3]+. LCMS: Чистота (254 нм): 44%; tR=1,44 мин.
[00283] Неочищенный азид, полученный на предыдущей стадии, растворяли в THF (15 мл) при RT и триметилфосфин (16 мл, 1,0 M в THF) добавляли. Через 15 мин добавляли 3 мл воды и полученную смесь перемешивали при RT в течение 2 ч до завершения реакции (следили с помощью LC/MS.) Растворитель удаляли в вакууме и полученный остаток разбавляли водой (75 мл), экстрагировали с помощью CH2Cl2, сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме и полученный остаток очищали с помощью хроматографии с обращенной фазой (0,05%TFA/MeCN) и получали искомый продукт 2-(4-хлорфенил)пропан-2-амин (200 мг, 57% за две стадии) в виде светлого масла. LC-MS m/z: 153,0 [M - NH2]+. LCMS: Чистота (214 нм): 98%; tR=1,71 мин.
(R)-1-Циклопропил-2,2,2-трифторэтан-1-амингидрохлорид
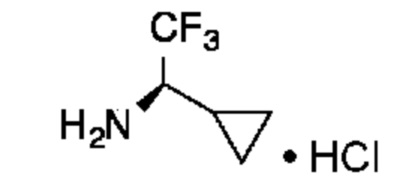
[00284] К смеси 1-этокси-2,2,2-трифторэтан-1-ола (10 г, 69,4 ммоля) и (R)-2-метилпропан-2-сульфинамида (9,3 г, 76,7 ммоля) добавляли Ti(OEt)4 (24 г, 105,3 ммоля) и смесь перемешивали при 70(C в течение 2 дней, охлаждали, разбавляли с помощью EA (200 мл) и выливали в рассол (700 мл). Полученную смесь энергично перемешивали в течение нескольких минут и фильтровали через целит. Осадок на фильтре промывали с помощью EA и фильтрат экстрагировали с помощью EA (200 мл×3). Объединенные органические слои промывали рассолом (400 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (20-50% EA/PE) и получали стереоизомер A (8 г, 47%) и стереоизомер B (4 г, 23%), стереохимические конфигурации которых не установлены. Стереоизомер A (менее полярный): 1H ЯМР (500 МГц, CDCl3) δ 4,75-4,70 (m, 1H), 4,09-4,03 (m, 1H), 3,9 (d, J=6,0 Гц, 1H), 3,68-3,62 (m, 1H), 1,3-1,25 (m, 12H). LC-MS: m/z: сигнал в MS отсутствует, tR=1,655 мин. Стереоизомер B (менее полярный): 1H ЯМР (500 МГц, CDCl3) δ 4,81-4,76 (m, 1H), 4,3 (d, J=9,0 Гц, 1H), 3,94-3,88 (m, 1H), 3,66-3,60 (m, 1H), 1,28-1,14 (m, 12H). m/z: сигнал в MS отсутствует, tR=1,614 мин.
[00285] К раствору стереоизомера A (5 г, 20,2 ммоля) в 75 мл DCM при -60°C по каплям добавляли cPrMgBr в THF (1M, 61 мл, 61 ммоля) и смесь перемешивали в течение 10 мин и затем ей давали медленно нагреться до -20°C в течение 2 ч, за это время реакция завершалась. Реакцию останавливали насыщенным раствором NH4Cl (120 мл) и экстрагировали с помощью DCM (120 мл×3). Объединенные органические экстракты промывали рассолом (160 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью препаративной ВЭЖХ и получали (R)-N-((R)-1-циклопропил-2,2,2-трифторэтил)-2-метилпропан-2-сульфинамид (1,8 г, 37%). LC-MS m/z: 244,1 [M+H]+, tR=1,74 мин.
[00286] К раствору (R)-N-((R)-1-циклопропил-2,2,2-трифторэтил)-2-метилпропан-2-сульфинамида (2,4 г, 9,9 ммоля) в MeOH (5 мл) добавляли 4M HCl в диоксане (5 мл, 20 ммоля). Реакционную смесь перемешивали в течение 2 ч при RT и концентрировали в вакууме. Остаток растирали с Et2O (10 мл×2) и получали искомое соединение (1,2 г, 71%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,46-9,26 (s, 3H), 3,63-3,56 (m, 1H), 1,12-1,05 (m, 1H), 0,73-0,58 (m, 4H).
(S)-1-Циклопропил-2,2,2-трифторэтан-1-амингидрохлорид
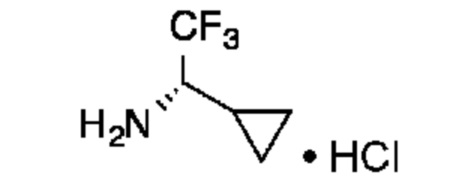
[00287] К смеси 1-этокси-2,2,2-трифторэтан-1-ола (20 г, 138,9 ммоля) и (S)-2-метилпропан-2-сульфинамида (18,4 г, 152,8 ммоля) добавляли Ti(OEt)4 (48 г, 208,3 ммоля). Смесь перемешивали при 70°C в течение 2 дней, затем охлаждали, разбавляли с помощью EA (200 мл) и выливали в рассол (1,4 л) Полученную смесь энергично перемешивали в течение нескольких минут и фильтровали через целит. Осадок на фильтре промывали с помощью EA и фильтрат экстрагировали с помощью EA (400 мл×3). Объединенные органические фазы промывали рассолом (800 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (20-50% EA/PE) и получали стереоизомер C (11 г, 32%) и стереоизомер D (5,1 г, 15%), стереохимические конфигурации которых не установлены. Стереоизомер C (менее полярный): LC-MS m/z: сигнал в MS отсутствует, tR=1,669 мин. Стереоизомер C (более полярный): LC-MS m/z: сигнал в MS отсутствует, tR=1,626 мин.
[00288] К раствору стереоизомера C (9 г, 36,4 ммоля) в 150 мл DCM при -60°C по каплям добавляли cPrMgBr в THF (1M, 109,3 мл, 109,3 ммоля) и смесь перемешивали в течение 10 мин и ей давали медленно нагреться до -20(C в течение 2 ч, за это время реакция завершалась. Реакцию останавливали насыщенным раствором NH4Cl (80 мл) и экстрагировали с помощью DCM (120 мл×3). Объединенные органические экстракты промывали рассолом (160 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью препаративной ВЭЖХ и получали (S)-N-((S)-1-циклопропил-2,2,2-трифторэтил)-2-метилпропан-2-сульфинамид (3,5 г, 40%). LC-MS m/z: 244,1 [M+H]+, tR=1,19 мин.
[00289] К раствору (S)-N-((S)-1-циклопропил-2,2,2-трифторэтил)-2-метилпропан-2-сульфинамида (1,16 г, 4,8 ммоля) в MeOH (5 мл) добавляли 4M HCl в диоксане (5 мл, 20 ммоля). Реакционную смесь перемешивали в течение 30 мин при RT и концентрировали до половины объема. К смеси добавляли Et2O и полученный осадок отфильтровывали и получали искомое соединение (725 мг, 40%) в виде белого твердого вещества. 1H ЯМР: (500 МГц, DMSO-d6) δ 9,30-9,00 (m, 3H), 3,62-3,57 (m, 1H), 1,12-1,03 (m, 1H), 0,74-0,59 (m, 4H).
Часть III - Получение конкретных карбоновых кислот
[00290] Типичные методики получения конкретных карбоновых кислот, применимые для получения некоторых замещенных пиразоло[1,5-a]пиримидинилкарбоксамидов, приведены ниже.
7-Хлор-5-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота
[00291] К раствору этил-3-амино-1H-пиразол-4-карбоксилат (10 г, 64,5 ммоля) в HOAc (50 мл) добавляли 4-метиленоксетан-2-он (27 г, 322,5 ммоля). Смесь перемешивали при 110(C в течение 2 ч, затем охлаждали и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA; 10:3) и получали этил-7-гидрокси-5-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (8,0 г, 57%) и этил-5-гидрокси-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (3,1 г, 21%) в виде белых твердых веществ. 7-Гидроксипродукт: LC-MS m/z: 221,0 [M+H]+, Чистота (214 нм): >90%, tR=1,26 мин; 5-Гидроксипродукт: LC-MS m/z: 221,0 [M+H]+, Чистота (214 нм): >92%, tR=1,46 мин.
[00292] Раствор этил-7-гидрокси-5-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (4,4 г, 20 ммоля) в POCl3 (30 мл) перемешивали при 95°C в течение 1 ч и затем концентрировали в вакууме. Остаток растворяли в EtOAc (20 мл) и подщелачивали насыщенным раствором NaHCO3 (20 мл) до pH~7. Полученную смесь разделяли и водную фазу экстрагировали с помощью EtOAc (15 мл×3). Объединенные органические фазы сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA; 1:1) и получали этил-7-хлор-5-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (1,0 г, 21%) в виде белого твердого вещества. LC-MS m/z: 239,0 [M+H]+, Чистота (254 нм): >82%, tR=1,55 мин.
[00293] К раствору этил-7-хлор-5-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (1,0 г, 4,18 ммоля) в толуоле (10 мл) добавляли (Bu3Sn)2O (5,0 г, 8,36 ммоля). Реакционную смесь перемешивали при 120°C в течение 2 дней и затем концентрировали в вакууме. Полученный остаток растворяли в EtOAc (10 мл) и подщелачивали насыщенным раствором NaHCO3 (10 мл) до pH~8-9. Водную фазу отделяли и подкисляли с помощью 6 н. HCl (10 мл) до pH~5. Раствор экстрагировали с помощью EtOAc (10 мл×3). Органические фазы сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA; 1:1) и получали 7-хлор-5-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (230 мг, 26%) в виде белого твердого вещества. LC-MS m/z: 211,0 [M+H]+, Чистота (214 нм): >97%, tR=1,23 мин.
5-Хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота
[00294] Раствор этил-5-гидрокси-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (2,8 г, 12,6 ммоля) в POCl3 (30 мл) перемешивали при 70°C в течение 2 ч и затем концентрировали в вакууме. Полученный остаток растворяли в EtOAc (20 мл) и подщелачивали насыщенным раствором NaHCO3 (15 мл) до pH~7. Полученную смесь разделяли и водную фазу экстрагировали с помощью EtOAc (10 мл×3). Объединенные органические фазы сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA; 1:1) и получали этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (2,7 г, 90%) в виде белого твердого вещества. LC-MS m/z: 239,0 [M+H]+, Чистота (214 нм): >99%, tR=1,74 мин.
[00295] К раствору этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (1,0 г, 4,18 ммоля) в толуоле (10 мл) добавляли (Bu3Sn)2O (5,0 г, 8,36 ммоля). Реакционную смесь перемешивали при 120°C в течение 2 дней и затем концентрировали в вакууме. Полученный остаток растворяли в EtOAc (10 мл) и подщелачивали насыщенным раствором NaHCO3 (10 мл) до pH~8-9. Водную фазу отделяли и подкисляли с помощью 6 н. HCl (10 мл) до pH~5. Раствор экстрагировали с помощью EtOAc (10 мл×3). Органические фазы сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA; 1:1) и получали 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (330 мг, 37%) в виде белого твердого вещества. LC-MS m/z: 211,0 [M+H]+, Чистота (214 нм): >97%, tR=1,28 мин.
7-Метил-5-(метиламино)пиразоло[1,5-a]пиримидин-3-карбоновая кислота
[00296] Раствор ацетона (0,96 мл, 13,1 ммоля) в дисульфиде углерода (1 г, 13,1 ммоля) добавляли к суспензии трет-бутоксида натрия (2,5 г, 26,2 ммоля) в THF (30 мл), не допуская повышение температуры выше 10°C. Реакционную смесь перемешивали при RT в течение 3 ч и при 10(C добавляли MeI (1,6 мл, 26,2 ммоля) и полученный раствор перемешивали в течение ночи при RT. Реакционную смесь разбавляли с помощью EtOAc (100 мл), промывали водой (30 мл×2) и органический слой сушили над MgSO4 и фильтровали. Фильтрат концентрировали в вакууме и неочищенное вещество очищали путем растирания с PE (30 мл) и получали 4,4-бис(метилтио)бут-3-ен-2-он (500 мг, 61%) в виде желтого твердого вещества.
[00297] К раствору 4,4-бис(метилтио)бут-3-ен-2-она (0,5 г, 3,08 ммоля) в смеси уксусная кислота/вода (3:1, 48 мл) добавляли этил-3-амино-1H-пиразол-4-карбоксилат (0,36 г, 2,37 ммоля) и каталитическое количество пиперидина (2 капли). Полученный раствор кипятили с обратным холодильником в течение 20 ч, затем после охлаждения добавляли воду (10 мл). Осадившееся твердое вещество собирали фильтрованием и перекристаллизовывали из смеси PE/эфир (3:1) и получали этил-7-метил-5-(метилтио)пиразоло[1,5-a]пиримидин-3-карбоксилат (500 мг, 62%) в виде желтого твердого вещества.
[00298] Суспензию м-CPBA (823 мг, 4,7 ммоля) в DCM (5 мл) при перемешивании добавляли к раствору этил-7-метил-5-(метилтио)пиразоло[1,5-a]пиримидин-3-карбоксилата (400 мг, 1,59 ммоля) в DCM (5 мл). Полученный раствор перемешивали при RT в течение ночи, растворитель удаляли в вакууме и к остатку добавляли EtOH (15 мл). Твердое вещество собирали фильтрованием, промывали холодным EtOH и сушили и получали этил-7-метил-5-(метилсульфонил)пиразоло[1,5-a]пиримидин-3-карбоксилат (400 мг, 89%) в виде белого твердого вещества.
[00299] Смесь этил-7-метил-5-(метилсульфонил)пиразоло[1,5-a]пиримидин-3-карбоксилата (400 мг, 1,4 ммоля) и MeNH2 в MeOH (15 мл) перемешивали при RT в течение 2 ч. Реакционную смесь разбавляли водой (30 мл) и экстрагировали с помощью EtOAc (3×25 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали путем растирания с PE (10 мл) и получали этил-7-метил-5-(метиламино)пиразоло[1,5-a]пиримидин-3-карбоксилат (272 мг, 61%) в виде белого твердого вещества.
[00300] Суспензию этил-7-метил-5-(метиламино)пиразоло[1,5-a]пиримидин-3-карбоксилата (273 мг, 1,15 ммоля) в MeOH/H2O (2 мл/2 мл) обрабатывали с помощью LiOH.H2O (97 мг, 2,31 ммоля). Реакционную смесь нагревали при 60°C и перемешивали в течение 5 ч. Реакционную смесь охлаждали и нейтрализовывали до pH 6-7 разбавленной HCl. Суспензию фильтровали, промывали водой и диэтиловым эфиром и получали 7-метил-5-(метиламино)пиразоло[1,5-a]пиримидин-3-карбоновую кислоту (154 мг, 65%). LC-MS m/z: 207,0 [M+H]+: Чистота (214 нм): >99%; tR=0,46 мин.
Часть IV - Пиразоло[1,5-a]пиримидин-3-карбоксамиды, полученные по общим методикам
[00301] Следующие соединения получали на основе общих методик, описанных выше в части I.
(S)-N-(1-Циклопропилэтил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид
[00302] По общей методике A 5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,15 ммоля) и (S)-1-циклопропилэтан-1-амин давали искомое соединение (19,0 мг, 49%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,48 (s, 1H), 8,03 (d, J=7,5 Гц, 1H), 7,13 (s, 1H), 3,64-3,59 (m, 1H), 2,74 (s, 3H), 2,63 (s, 3H), 1,25 (d, J=6,5 Гц, 3H), 1,04-0,99 (m, 1H), 0,51-0,41 (m, 2H), 0,37-0,32 (m, 1H), 0,28-0,25 (m, 1H). LC-MS m/z: 259,2 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=9,31 мин.
N-(2-Циклопропилпропан-2-ил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид
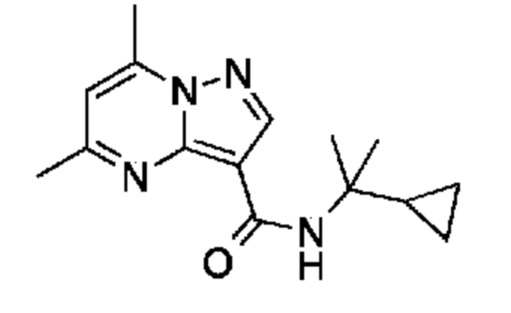
[00303] По общей методике A 5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (25 мг, 0,13 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (8,0 мг, 22%) в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3) δ 8,58 (s, 1H), 8,13 (s, 1H), 6,68 (s, 1H), 2,78 (s, 3H), 2,62 (s, 3H), 1,44 (s, 6H), 1,39-1,33 (m, 1H), 0,49 (d, J=6,5 Гц, 4H). LC-MS m/z: 272,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=9,99 мин.
(R)-N-(1-Циклогексилэтил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид
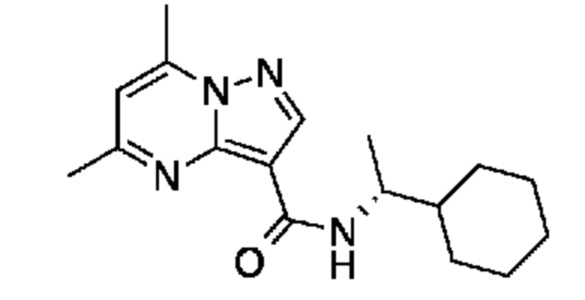
[00304] По общей методике A 5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (38 мг, 0,20 ммоля) и (R)-1-циклогексилэтан-1-амин давали искомое соединение в виде белого твердого вещества (10 мг, 15%). 1H ЯМР (500 МГц, DMSO-d6): δ 8,47 (s, 1H), 8,07 (d, J=8,5 Гц, 1H), 7,12 (s, 1H), 3,95-3,91 (m, 1H), 2,73 (s, 1H), 2,61 (s, 1H), 1,82-1,62 (m, 5H), 1,47-1,41 (m, 1H), 1,27-1,03 (m, 2H), 1,14 (d, J=6,5 Гц, 3H). LC-MS m/z: 301,3 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=10,81 мин.
(S)-N-(1-Циклогексилэтил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид
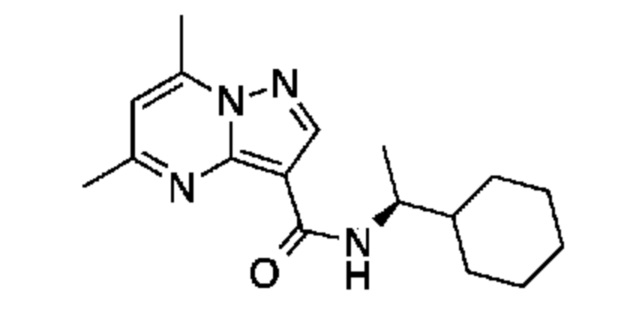
[00305] По общей методике A 5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (25 мг, 0,13 ммоля) и (S)-1-циклогексилэтан-1-амин давали искомое соединение в виде желтого твердого вещества (21,4 мг, 55%),1H ЯМР (500 МГц, CDCl3): δ 8,61 (s, 1H), 8,11 (d, J=8,5 Гц,1H), 6,70 (s, 1H), 4,15-4,11 (m, 1H), 2,78 (s, 3H), 2,64 (s, 3H), 1,89-1,87 (m, 1H), 1,79-1,77 (m, 4H), 1,69-1,66 (m, 1H), 1,30-1,25 (m, 2H), 1,23 (d, J=6,5 Гц, 3H), 1,19-1,10 (m, 3H). LC-MS m/z: 301,0 [M+H]+. HPLC: Чистота (214 нм): > 98%; tR=10,82 мин.
N-(1-Циклопропил-3-метилбутил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид
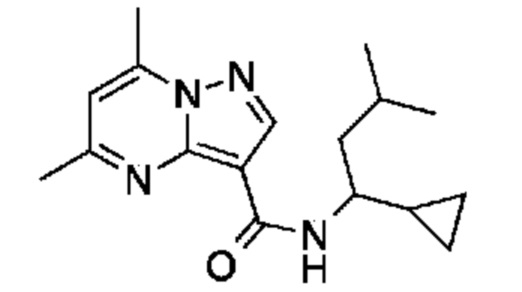
[00306] По общей методике A 5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,21 ммоля) и 1-циклопропил-3-метилбутан-1-амин давали искомое соединение (15 мг, 23%) в виде бледно-желтого твердого вещества. 1H ЯМР (500 МГц, CDCl3) δ 8,63 (s, 1H), 7,95 (d, J=9,0 Гц, 1H), 6,68 (s, 1H), 3,85-3,81 (m, 1H), 2,79 (s, 3H), 2,65 (s, 3H), 1,84-1,78 (m, 1H), 1,64-1,52 (m, 2H), 0,96 (d, J=6,5 Гц, 3H), 0,95 (d, J=6,5 Гц, 3H), 0,94-0,91 (m, 1H), 0,54-0,47 (m, 2H), 0,46-0,40 (m, 1H), 0,33-0,28 (m, 1H). LC-MS m/z: 301,2 [M+H]+. HPLC: Чистота (214 нм): >96%; tR=10,70 мин.
(S)-N-(1-Циклопропилэтил)-7-метил-5-(метиламино)пиразоло[1,5-a]пиримидин-3-карбоксамид
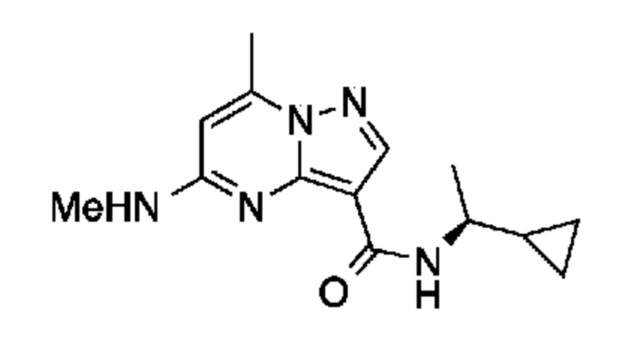
[00307] По общей методике A 7-метил-5-(метиламино)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (41 мг, 0,2 ммоля) и (S)-1-циклопропилэтан-1-амин давали искомое соединение (18 мг, 33%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,36 (s, 1H), 8,17 (s, 1H), 6,04 (s, 1H), 5,59 (s, 1H), 3,79-3,75 (m, 1H), 3,08 (d, J=5,0 Гц, 3H), 2,64 (s, 3H), 1,34 (d, J=6,5 Гц, 3H), 0,98-0,95 (m, 1H), 0,53-0,44 (m, 3H), 0,35-0,29 (m, 1H). LC-MS m/z: 274,0 [M+H]+. HPLC: Чистота (254 нм): >96%; tR=8,54 мин.
(S)-N-(1-Циклопропилэтил)-5-(4-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
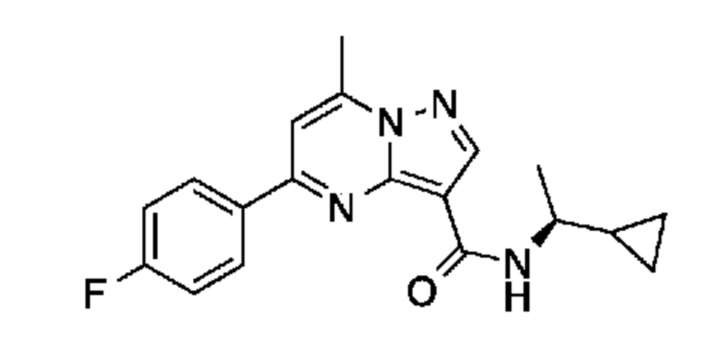
[00308] К 60% суспензии гидрида натрия (36 г, 0,905 моля) в THF (700 мл) при 0°C добавляли 1-(4-фторфенил)этан-1-он (25,0 г, 0,184 моля) и смесь перемешивали при RT в течение 30 мин. К смеси при 0°C добавляли EtOAc (63,7 г, 0,724 моля). Смесь перемешивали при 40°C в течение 3 ч и затем выливали в 6 н. HCl (20 мл). Органический растворитель удаляли в вакууме. Оставшуюся смесь экстрагировали с помощью EtOAc (20 мл×3), промывали 6 н. раствором HCl (15 мл) и рассолом (20 мл), сушили над безводным MgSO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 1-(4-фторфенил)бутан-1,3-дион (20 г, 60%) в виде коричневого масла LC-MS m/z: 180,0 [M+H]+, Чистота (214 нм): >90%, tR=1,88 мин.
[00309] Раствор этил-3-амино-1H-пиразол-4-карбоксилата (6,0 г, 38,7 ммоля) и 1-(4-фторфенил)бутан-1,3-диона (7,62 г, 42,6 ммоля) в уксусной кислоте (10 0 мл) нагревали при 110°C в течение ночи до завершения реакции (LC-MS). Уксусную кислоту удаляли продуванием воздухом при нагревании колбы при 75°C. Остаток растирали с MeOH (20 мл×2) и фильтровали и получали этил-7-(4-фторфенил)-5-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (2,88 г, 29%) в виде желтого твердого вещества. LC-MS m/z: 299,1 [M+H]+. Чистота по данным LC-MS (214 нм): > 96%; tR=1,82 мин.
[00310] Фильтрат концентрировали в вакууме и остаток очищали на колонке с силикагелем, элюировали с помощью PE/EA (от 1:0 до 3:1) и получали этил-5-(4-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (360 мг, 4%) в виде желтого твердого вещества (360 мг, 4%). LC-MS m/z: 299,1 [M+H]+. Чистота по данным LC-MS (214 нм): > 66%; tR=1,89 мин.
[00311] По общей методике B этил-5-(4-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (150 мг, 0,5 ммоля) давал 5-(4-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (140 мг, 99%). LC-MS m/z: 271,0 [M+H]+. Чистота по данным LC-MS (214 нм): > 76%, tR=1,59 мин.
[00312] По общей методике A 5-(4-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (43 мг, 0,16 ммоля) и (S)-1-циклопропилэтан-1-амин давали искомое соединение (38 мг, 71%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,54 (s, 1H), 8,33-8,30 (m, 2H), 8,14 (d, J=7,5 Гц, 1H), 7,87 (s, 1H), 7,48 (t, J=9,0 Гц, 2H), 3,63-3,59 (m, 1H), 2,84 (s, 3H), 1,30 (d, J=6,5 Гц, 3H), 1,12-1,08 (m, 1H), 0,54-0,49 (m, 2H), 0,39-0,32 (m, 2H). LC-MS m/z: 339,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,66 мин.
(S)-N-(1-Циклопропилэтил)-7-(4-фторфенил)-5-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
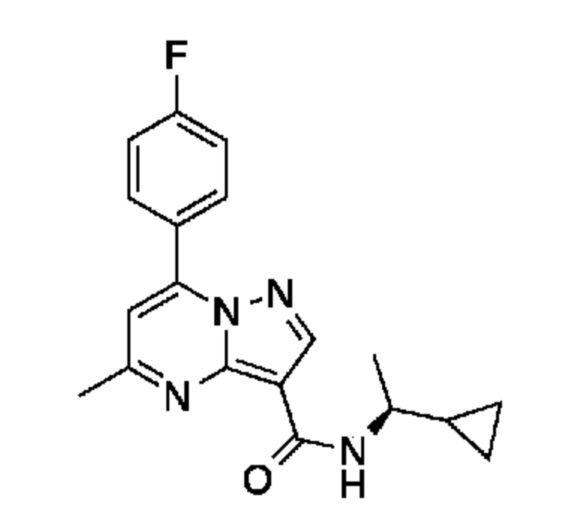
[00313] По общей методике B этил-7-(4-фторфенил)-5-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (750 мг, 2,5 ммоля) давал 7-(4-фторфенил)-5-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (600 мг, 88%). LC-MS m/z: 271,0 [M+H]+. Чистота по данным LC-MS (214 нм): > 99%, tR=1,57 мин.
[00314] По общей методике A 7-(4-фторфенил)-5-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (54 мг, 0,2 ммоля) и S)-1-циклопропилэтан-1-амин давали искомое соединение (19,8 мг, 29%) в виде белесого твердого вещества. 1H ЯМР (500 МГц, CDCl3) δ 8,64 (s, 1H), 8,16 (d, J=8,5 Гц, 1H), 8,05 (dd, J=8,5 Гц, 5,0 Гц, 2H), 7,27 (t, J=8,5 Гц, 2H), 6,89 (s, 1H), 3,81-3,76 (m, 1H), 2,73 (s, 3H), 1,37 (d, J=6,5 Гц, 3H), 1,02-1,00 (m, 1H), 0,55-0,45 (m, 3H), 0,34-0,31 (m, 1H). LC-MS m/z: 339,0 [M+H]+. HPLC: Чистота (254 нм): >99%; tR=10,63 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид
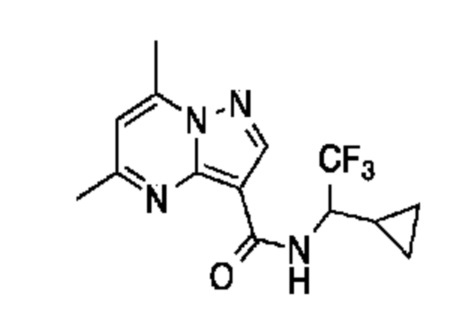
[00315] По общей методике A 5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,21 ммоля) и 1-циклопропил-2,2,2-трифторэтан-1-амин давали искомое соединение (30,7 мг, 47%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,57 (s, 1H), 8,44 (d, J=9,0 Гц, 1H), 7,18 (s, 1H), 4,48-4,43 (m, 1H), 2,76 (s, 3H), 2,63 (s, 3H), 1,27-1,23 (m, 1H), 0,69-0,64 (m, 1H), 0,62-0,57 (m, 1H), 0,55-0,52 (m, 1H), 0,41-0,37 (m, 1H). LC-MS m/z: 313,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,14 мин.
N-([1,1'-би(Циклопропан)]-1-ил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид
[00316] По общей методике A 5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (37 мг, 0,19 ммоля) и [1,1'-би(циклопропан)]-1-амин давали искомое соединение (21,2 мг, 41%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,26 (s, 1H), 8,05 (s, 1H), 6,89 (s, 1H), 2,51 (s, 3H), 2,29 (s, 3H), 1,24-1,19 (m, 1H), 0,52-0,50 (m, 2H), 0,43-0,41 (m, 2H), 0,17-0,14 (m, 2H), 0,01-0,00 (m, 2H). LC-MS m/z: 270,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=7,45 мин.
5,7-Диметил-N-(2-(спиро[3.3]гептан-2-ил)пропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
[00317] По общей методике A 5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (50 мг, 0,26 ммоля) и 2-(спиро[3.3]гептан-2-ил)пропан-2-амин давали искомое соединение (18,4 мг, 22%) в виде бледно-желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,46 (s, 1H), 8,33 (s, 1H), 7,02 (s, 1H), 2,80 (s, 3H), 2,69 (s, 3H), 2,61-2,57 (m, 1H), 2,14 (t, J=7,0 Гц, 2H), 2,08-1,86 (m, 8H), 1,43 (s, 6H). LC-MS m/z: 327,2 [M+H]+. HPLC: Чистота (214 нм): >95%; tR=11,86 мин.
7-Хлор-N-(2-циклопропилпропан-2-ил)-5-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
[00318] По общей методике C 7-хлор-5-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (100 мг, 0,47 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (40 мг, 29%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,52 (s, 1H), 7,96 (s, 1H), 7,57 (s, 1H), 2,63 (s, 3H), 1,34 (s, 7H), 0,45-0,44 (m, 4H). LC-MS m/z: 292,7 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,25 мин.
5-Хлор-N-(2-циклопропилпропан-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
[00319] По общей методике C 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (100 мг, 0,47 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (60 мг, 43%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,55 (s, 1H), 7,51 (s, 1H), 7,38(s, 1H), 2,76 (s, 3H), 1,34-1,31 (m, 7H), 0,44-0,42 (m, 4H). LC-MS m/z: 292,7 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,65 мин.
N-((R)-1-((1S,4S)-4-Метоксициклогексил)этил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид и N-((R)-1-((1R,4R)-4-Метоксициклогексил)этил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид
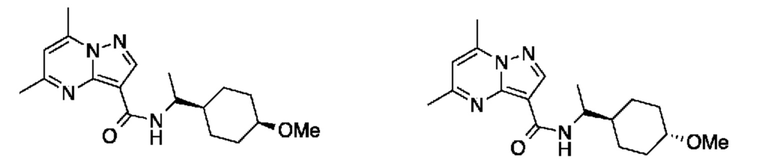
[00320] По общей методике A 5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (50 мг, 0,26 ммоля), HATU (100 мг, 0,26 ммоля) и 1-(4-метоксициклогексил)этан-1-амин давали N-((R)-1-((1S,4S)-4-метоксициклогексил)этил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид (7,2 мг) и N-((R)-1-((1R,4R)-4-метоксициклогексил)этил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид (8,4 мг).
[00321] N-((R)-1-((1S,4S)-4-Метоксициклогексил)этил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид: 1H ЯМР (500 МГц, MeOD-d4) δ 8,46 (s, 1H), 8,43 (s, 1H), 7,02 (s, 1H), 3,37 (s, 3H), 3,22-3,17 (m, 1H), 2,80 (s, 3H), 2,67 (s, 3H), 2,20-2,18 (m, 2H), 2,00-1,98 (m, 3H), 1,48 (s, 6H), 1,31-1,21 (m, 4H). LC-MS m/z: 345,2 [M+H]+. HPLC: Чистота (214 нм): 99,52%; tR=8,08 мин.
[00322] N-((R)-1-((1R,4R)-4-Метоксициклогексил)этил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид: 1H ЯМР (500 МГц, DMSO-d6) δ 8,46 (s, 1H), 8,44 (s, 1H), 7,02 (s, 1H), 3,51-3,50 (m, 1H),,3,35 (s, 3H), 2,80 (s, 3H), 2,69 (s, 3H), 2,10-2,07 (m, 2H), 1,99-1,96 (m, 1H), 1,87-1,66 (m, 2H), 1,54-1,48 (m, 6H), 1,48 (s, 6H), 0,87 (d, J=7,0 Гц, 1H). LC-MS m/z: 345,2 [M+H]+. HPLC: Чистота (214 нм): 95,63%; tR=8,46 мин.
N-(2-Циклопропилпропан-2-ил)-7-метил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид и N-(2-Циклопропилпропан-2-ил)-5-метил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
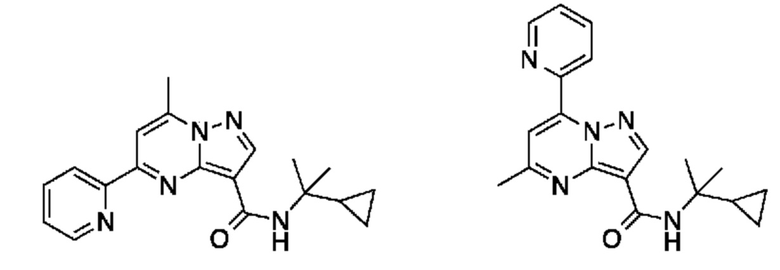
[00323] К раствору метилпиколината (4,0 г, 29,20 ммоля) в THF (60 мл) при 0°C добавляли ацетон (10 мл). Через 5 мин по каплям добавляли MeONa/MeOH (28%, 20 мл) и смесь перемешивали при RT в течение 2 ч. Растворитель удаляли путем концентрирования и остаток подкисляли с помощью 10% HCl до pH 5~6. Водный раствор экстрагировали с помощью EtOAc (100 мл×3). Органическую фазу сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме и остаток очищали с помощью хроматографии на силикагеле (PE/EA= 10:1) и получали (Z)-4-гидрокси-4-(пиридин-2-ил)бут-3-ен-2-он (3,0 г, 84%).
[00324] К смеси (Z)-4-гидрокси-4-(пиридин-2-ил)бут-3-ен-2-она (1,43 г, 9,20 ммоля) с AcOH (20 мл) добавляли этил-3-амино-1H-пиразол-4-карбоксилат (1,5 г, 9,20 ммоля) и смесь перемешивали при 110°C в течение 2 ч и затем концентрировали в вакууме. Остаток растирали в смешанном растворителе, включающем петролейный эфир и EtOAc (10:1, 30 мл), и собирали фильтрованием и получали смесь этил-5-метил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксилата и этил-7-метил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксилата (2,5 г, 87%) в виде белого твердого вещества. LC-MS m/z: 283,1 [M+H]+. tR=1,74 мин и 1,86 мин.
[00325] По общей методике B смесь этил-5-метил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксилата и этил-7-метил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксилата (суммарно 1,0 г, 3,54 ммоля) давала смесь 5-метил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты и 7-метил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (800 мг, 89%) в виде белого твердого вещества. LC-MS m/z: 255,1 [M+H]+. tR=1,15 мин и 1,20 мин.
[00326] По общей методике A смесь 5-метил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты и 7-метил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (100 мг, 0,4 ммоля) и 2-циклопропилпропан-2-амина давала N-(2-циклопропилпропан-2-ил)-7-метил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (8,1 мг, 25,6%) и N-(2-циклопропилпропан-2-ил)-5-метил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (26,1 мг, 25,6%) в виде белесых твердых веществ.
[00327] N-(2-Циклопропилпропан-2-ил)-7-метил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид: 1H ЯМР (500 МГц, DMSO-d6) δ 8,81 (d, J=4,0 Гц, 1H), 8,57 (s, 1H), 8,48 (d, J=8,0 Гц, 1H), 8,14 (d, J=7,0 Гц, 1H), 8,13 (s, 1H), 8,10 (dd, J=8,0 Гц, 1,5 Гц, 1H), 7,62 (ddd, J=8,0 Гц, 5,0 Гц, 1,0 Гц, 1H), 2,89 (s, 3H), 1,47-1,44 (m, 1H), 1,40 (s, 6H), 0,52-0,50 (m, 4H). LC-MS m/z: 336,1 [M+H]+. HPLC: Чистота (254 нм): 96,71%; tR=10,58 мин.
[00328] N-(2-Циклопропилпропан-2-ил)-5-метил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид: 1H ЯМР (500 МГц, DMSO-d6) δ 8,93 (d, J=8,0 Гц, 1H), 8,87 (d, J=3,5 Гц, 1H), 8,55 (s, 1H), 8,17 (s, 1H), 8,12 (td, J=8,0 Гц, 1,5 Гц, 1H), 7,82 (s, 1H), 7,68 (ddd, J=8,0 Гц, 5,0 Гц, 1,0 Гц, 1H), 2,74 (s, 3H), 1,38 (s, 6H), 1,36-1,34 (m, 1H), 0,48 (d, J=7,5 Гц, 4H). LC-MS m/z: 336,1 [M+H]+. HPLC: Чистота (254 нм): 98,73%; tR=10,77 мин.
N-(2-Циклопропилпропан-2-ил)-7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
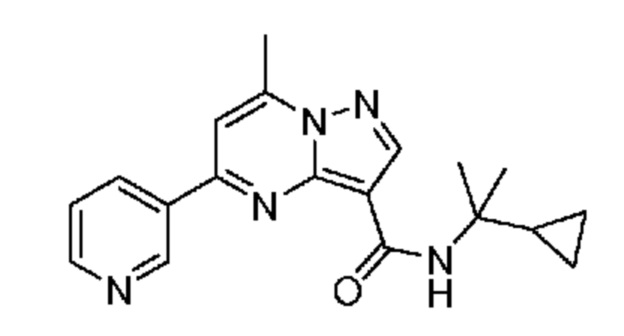
[00329] По общей методике D этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (500 мг, 2,1 ммоля) и пиридин-3-илбороновая кислота давали этил-7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (425 мг, 71%) в виде желтого твердого вещества. LC-MS m/z: 283,1 [M+H]+. Чистота (214 нм): > 90%; tR=1,51 мин.
[00330] По общей методике B этил-7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (425 мг, 1,5 ммоля) давал 7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновую кислоту (362 мг, 95%). LC-MS m/z: 255,0 [M+H]+, Чистота (254 нм): > 95%; tR=1,24 мин.
[00331] По общей методике A 7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (36 мг, 0,14 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (15 мг, 32%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 9,43 (s, 1H), 8,75 (d, J=4,8 Гц, 1 H), 8,56 (d, J=9,6 Гц, 1 H), 8,54 (s, 1 H), 8,13 (s, 1 H), 7,94 (s, 1 H), 7,64 (dd, J=8,0 Гц, 4,0 Гц, 1 H), 2,84 (s, 3H), 1,39-1,36 (m, 1H), 1,36 (s, 6H), 0,48-0,46 (m, 4H). LC-MS m/z: 336,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,37 мин.
N-(2-Циклопропилпропан-2-ил)-7-метил-5-(пиридин-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
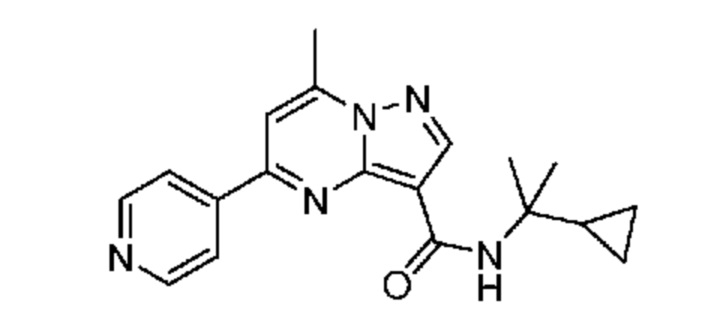
[00332] По общей методике D этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (200 мг, 0,84 ммоля) и пиридин-4-илбороновая кислота давали этил-7-метил-5-(пиридин-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (170 мг, 72%) в виде белого твердого вещества. LC-MS m/z: 283,1 [M+H]+.
[00333] По общей методике B этил-7-метил-5-(пиридин-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (170 мг, 0,6 ммоля) давал 7-метил-5-(пиридин-4-ил)пиразоло[1,5-a]пиримидин-3-карбоновую кислоту (140 мг, 92%) в виде белого твердого вещества. LC-MS m/z: 255,1 [M+H]+.
[00334] По общей методике A 7-метил-5-(пиридин-4-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,16 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (17 мг, 31%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,85 (d, J=6,0 Гц, 2H), 8,60 (s, 1H), 8,17 (d, J=5,5 Гц, 2H), 8,11 (s, 1H), 8,00 (s, 1H), 2,88 (s, 3H), 1,45-1,40 (m, 1H), 1,39 (s, 6H), 0,50-0,49 (m, 4H). LC-MS m/z: 336,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,23 мин.
N-(2-Циклопропилпропан-2-ил)-7-метил-5-(пиперидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
[00335] По общей методике G этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (118 мг, 0,49 ммоля) и пиперидин давали этил-7-метил-5-(пиперидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (120 мг, 85%) в виде желтого твердого вещества. LC-MS m/z: 289,1 [M+H]+.
[00336] По общей методике B этил-7-метил-5-(пиперидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (120 мг, 0,4 ммоля) давал 7-метил-5-(пиперидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоновую кислоту (98 мг, 92%) в виде белого твердого вещества. LC-MS m/z: 261,2 [M+H]+.
[00337] По общей методике A 7-метил-5-(пиперидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (35 мг, 0,13 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (12 мг, 27%). 1H ЯМР (500 МГц, DMSO-d6): δ 8,10 (s, 1H), 7,88 (s, 1H), 6,84 (s, 1H), 3,72 (t, J=5,0 Гц, 4H), 2,59 (s, 3H), 1,70-1,66 (m, 2H), 1,60-1,58 (m, 4H), 1,30 (s, 6H), 1,29-1,27 (m, 1H), 0,39-0,36 (m, 4H). LC-MS m/z: 342,3 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,73 мин.
(S)-N-(1-Циклопропилэтил)-7-метил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид и (S)-N-(1-циклопропилэтил)-5-метил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
[00338] По общей методике A смесь 5-метил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты и 7-метил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (100 мг, 0,39 ммоля) и (S)-1-циклопропилэтан-1-амина давала (S)-N-(1-циклопропилэтил)-7-метил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (21,6 мг, 17%) и (S)-N-(1-циклопропилэтил)-5-метил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (57,5 мг, 46%) в виде белых твердых веществ.
[00339] (S)-N-(1-Циклопропилэтил)-7-метил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид: 1H ЯМР (400 МГц, MeOD-d4) δ 8,77 (d, J=5,2 Гц, 1H), 8,60 (s, 1H), 8,51 (d, J=7,6 Гц, 1H), 8,15 (s, 1H), 8,05 (td, J=8,0 Гц, 1,6 Гц, 1H), 7,57 (ddd, J=7,6 Гц, 4,8 Гц, 0,8 Гц, 1H), 3,72-3,65 (m, 1H), 2,93 (s, 3H), 1,41 (d, J=6,8 Гц, 3H), 1,21-1,12 (m, 1H), 0,68-0,55 (m, 2H), 0,52-0,46 (m, 1H), 0,43-0,37 (m, 1H). LC-MS m/z: 322,1 [M+H]+. HPLC: Чистота (214 нм): 95,44%; tR=7,95 мин.
[00340] (S)-N-(1-Циклопропилэтил)-5-метил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид: 1H ЯМР (400 МГц, DMSO-d6) δ 8,92 (d, J=8,0 Гц, 1H), 8,87 (d, J=4,8 Гц, 1H), 8,60 (s, 1H), 8,15 (d, J=8,0 Гц, 1H), 8,11 (dd, J=8,0 Гц, 2,0 Гц, 1H), 7,68 (ddd, J=7,6 Гц, 4,8 Гц, 0,8 Гц, 1H), 3,67-3,59 (m, 1H), 2,76 (s, 3H), 1,27 (d, J=6,0 Гц, 3H), 1,08-1,01 (m, 1H), 0,53-0,42 (m, 2H), 0,39-0,34 (m, 1H), 0,31-0,25 (m, 1H). LC-MS m/z: 322,2 [M+H]+. HPLC: Чистота (254 нм): 98,89%; tR=8,09 мин.
(S)-N-(1-Циклопропилэтил)-7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
[00341] По общей методике A 7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (36 мг, 0,14 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (18 мг, 40%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 9,43 (s, 1H), 8,76 (d, J=4,0 Гц, 1 H), 8,59-8,58 (m, 2 H), 8,11 (d, J=6,7 Гц, 1 H), 7,96 (s, 1 H), 7,66 (dd, J=8,0 Гц, 4,8 Гц, 1 H), 3,60 (m, J=6,8 Гц, 1 H), 2,85 (s, 3H), 1,28 (d, J=6,4 Гц, 3H), 1,11-1,07 (m, 1H), 0,52-0,29 (m, 4H). LC-MS m/z: 322,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=6,78 мин.
(S)-N-(1-Циклопропилэтил)-7-метил-5-(пиридин-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
[00342] По общей методике A 7-метил-5-(пиридин-4-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,16 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (6,7 мг, 13%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,86 (dd, J=4,5 Гц, 1,5 Гц, 2H), 8,64 (s, 1H), 8,19 (dd, J=4,5 Гц, 1,5 Гц, 2H), 8,12 (d, J=4,0 Гц, 1H), 8,02 (s, 1H), 3,64-3,59 (m, 1H), 2,88 (s, 3H), 1,30 (d, J=6,5 Гц, 3H), 1,15-1,12 (m, 1H), 0,54-0,48 (m, 2H), 0,40-0,33 (m, 2H). LC-MS m/z: 322,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=6,67 мин.
(S)-N-(1-Циклопропилэтил)-5-метил-7-(пиперидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
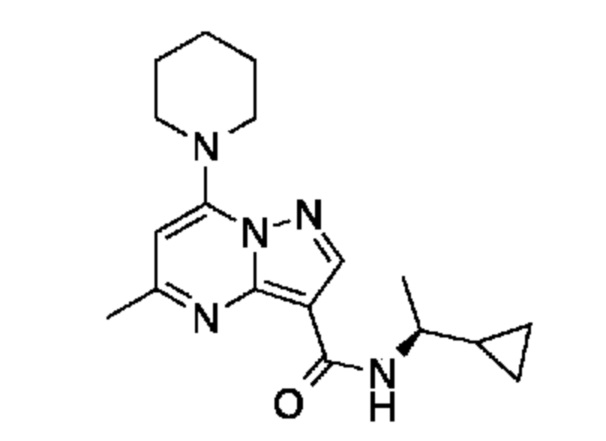
[00343] По общей методике A 5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (50 мг, 0,19 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (13 мг, 21%) в виде белесого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,38 (s, 1H), 6,40 (s, 1H), 3,83-3,82 (m, 4H), 3,72-3,68 (m, 1H), 2,58 (s, 3H), 1,82-1,78 (m, 6H), 1,36 (d, J=7,0 Гц, 3H), 1,05-1,03 (m, 1H), 0,58-0,52 (m, 2H), 0,44-0,42 (m, 1H),0,32-0,30 (m, 1H). LC-MS m/z: 328,3 [M+H]+. HPLC: Чистота (254 нм): >99%; tR=10,18 мин.
(S)-N-(1-Циклопропилэтил)-7-метил-5-(пиперидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
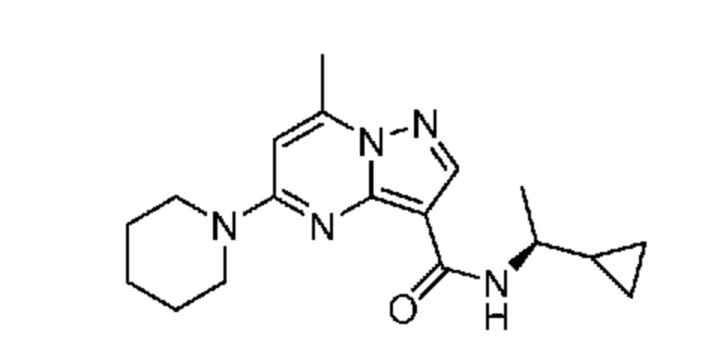
[00344] По общей методике A 7-метил-5-(пиперидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (35 мг, 0,13 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (17 мг, 39%). 1H ЯМР (500 МГц, DMSO-d6): δ 8,13 (s, 1H), 7,96 (d, J=5,0 Гц, 1H), 6,86 (s, 1H), 3,73 (t, J=5,0 Гц, 4H), 3,57-5,36 (m, 1H), 2,60 (s, 3H), 1,70-1,67 (m, 2H), 1,61-1,58 (m, 4H), 1,19 (d, J=6,5 Гц, 3H), 0,95-0,94 (m, 1H), 0,46-0,39 (m, 2H) 0,30-0,23 (m, 2H). LC-MS m/z: 328,3 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,18 мин.
(S)-2-Хлор-N-(1-циклопропилэтил)-5-(4-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
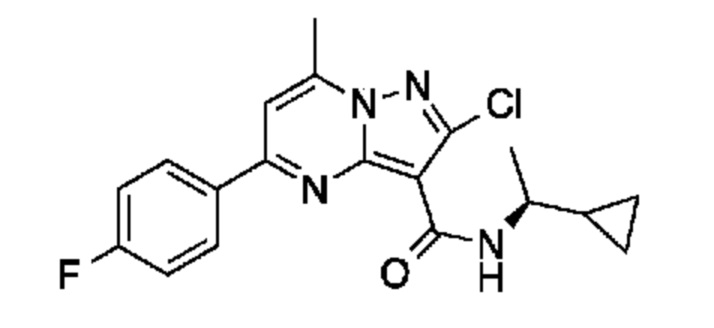
[00345] При перемешивании к раствору этил-5-амино-3-хлор-1H-пиразол-4-карбоксилата (200 мг, 1,05 ммоля) в HOAc (5 мл) добавляли 1-(4-фторфенил)бутан-1,3-дион (380 мг, 2,11 ммоля) при 110°C. Раствор перемешивали в течение примерно 4 ч при этой температуре, охлаждали и концентрировали в вакууме. Полученный остаток растворяли в MeOH (2 мл) и очищали с помощью хроматографии с обращенной фазой (MeCN\1% TFA) и получали этил-2-хлор-5-(4-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (80 мг, 22%) и этил-2-хлор-7-(4-фторфенил)-5-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (200 мг, 57%) в виде белых твердых веществ. 7-Me-продукт: LC-MS: m/z: 333,0 [M+H]+; Чистота (214 нм): >92%; tR=1,99 мин. 5-Me-продукт: LC-MS: m/z: 333,0 [M+H]+; Чистота (214 нм): >99%; tR=1,91 мин.
[00346] По общей методике B этил-2-хлор-7-(4-фторфенил)-5-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (80 мг, 0,24 ммоля) давал 2-хлор-7-(4-фторфенил)-5-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (60 мг, 82%) в виде белого твердого вещества. LC-MS: m/z: 305,0 [M+H]+; Чистота (214 нм): > 92%; tR=1,69 мин.
[00347] По общей методике A 2-хлор-7-(4-фторфенил)-5-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,1 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (15,6 мг, 43%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,34-8,30 (m, 3H), 7,97 (s, 1H), 7,49 (t, J=8,5 Гц, 2H), 3,61-3,33 (m, 1H), 2,80 (s, 3H), 1,28 (d, J=6,5 Гц, 3H), 1,12-1,07 (m, 1H), 0,54-0,47 (m, 2H), 0,39-0,31 (m, 2H). LC-MS m/z: 372,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=9,21 мин.
(S)-2-Хлор-N-(1-циклопропилэтил)-7-(4-фторфенил)-5-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
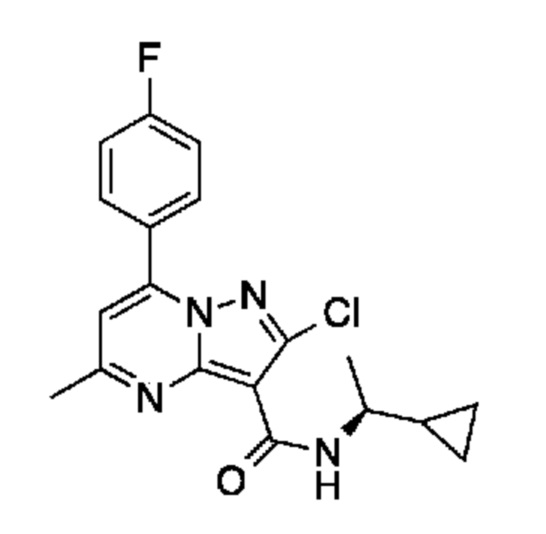
[00348] По общей методике B этил-2-хлор-7-(4-фторфенил)-5-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (75 мг, 0,23 ммоля) давал 2-хлор-7-(4-фторфенил)-5-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (47 мг, 69%) в виде белого твердого вещества. LC-MS: m/z: 305,0 [M+H]+; Чистота (214 нм): > 92%; tR=1,67 мин.
[00349] По общей методике A 2-хлор-7-(4-фторфенил)-5-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (37 мг, 0,12 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (26 мг, 59%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,31 (d, J=8,0 Гц, 1H), 8,15-8,12 (m, 2H), 7,52-7,49 (m, 2H), 7,48 (s, 1H), 3,66-3,59 (m, 1H), 2,70 (s, 3H), 1,26 (d, J=7,0 Гц, 3H), 1,05-1,07 (m, 1H), 0,50-0,44 (m, 2H), 0,38-0,25 (m, 2H). LC-MS m/z: 372,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=9,19 мин.
(S)-2-Хлор-N-(1-циклопропилэтил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид
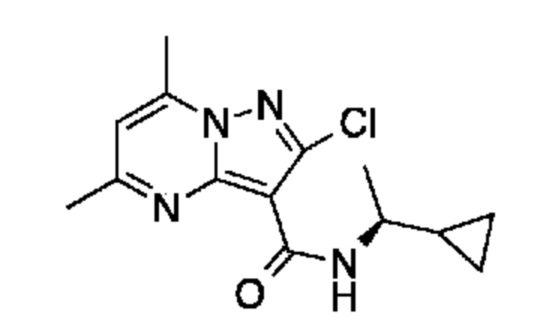
[00350] Раствор этил-5-амино-3-хлор-1H-пиразол-4-карбоксилата (80 мг, 0,84 ммоля) и пентан-2,4-диона (84 мг, 0,84 ммоля) в AcOH (1 мл) перемешивали при 100°C в течение 2 ч до завершения реакции (LC-MS). Уксусную кислоту удаляли в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA: 2/1) и получали этил-2-хлор-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 94%) в виде белого твердого вещества. LC-MS m/z: 253,9 [M+H]+. LC-MS: Чистота (214 нм): 95%; tR=1,66 мин.
[00351] По общей методике B этил-2-хлор-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,4 ммоля) давал 2-хлор-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту в виде белого твердого вещества (70 мг, 78,7%). LC-MS m/z: 226,1 [M+H]+. LCMS: Чистота (214 нм): 93,51%; tR=0,65 мин.
[00352] По общей методике A 2-хлор-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,13 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (22,6 мг, 57,9%) в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 8,24 (d, J =7,0 Гц, 1H), 6,74 (s, 1H), 3,78-3,74 (m, 1H), 2,76 (s, 3H), 2,65 (s, 3H), 1,34 (d, J =6,5 Гц, 3H), 1,00-0,97 (m, 1H), 0,54-0,44 (m, 3H), 0,32-0,29 (m, 1H). LC-MS m/z: 293,1 [M+H]+. LCMS: Чистота (214 нм): >99%; tR=1,88 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
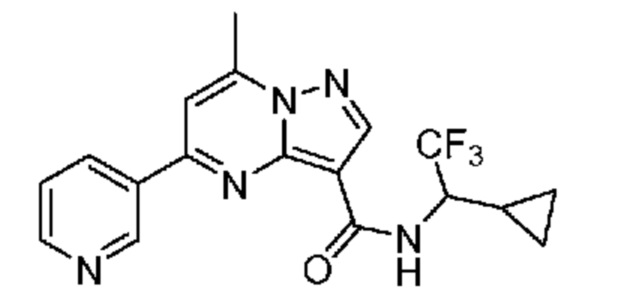
[00353] По общей методике A 7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,16 ммоля) и 1-циклопропил-2,2,2-трифторэтанамин давали искомое соединение (14 мг, 23%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 9,42 (d, J=1,5 Гц, 1H), 8,77 (dd, J=5,0 Гц, 1,5 Гц, 1H), 8,67 (s, 1H), 8,65 (tt, J=8,5 Гц, 2,0 Гц, 1H), 7,84 (s, 1H), 7,70 (ddd, J=8,0 Гц, 5,0 Гц, 0,5 Гц, 1H), 4,48-4,41 (m, 1H), 2,98 (s, 3H), 1,37-1,30 (m, 1H), 0,82-0,77 (m, 1H), 0,70-0,65 (m, 1H), 0,63-0,58 (m, 1H), 0,54-0,49 (m, 1H). LC-MS m/z: 376,2 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=9,23 мин
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
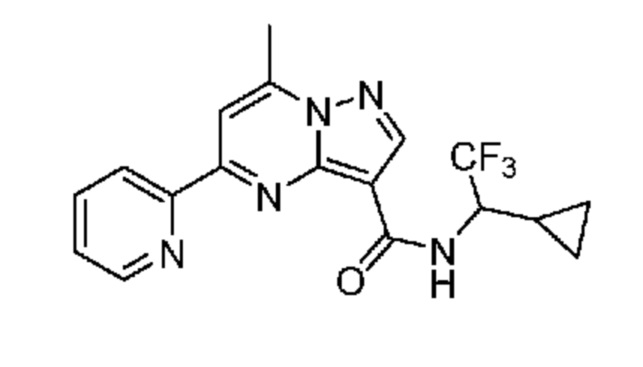
[00354] По общей методике A 7-метил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (50 мг, 0,20 ммоля) и 1-циклопропил-2,2,2-трифторэтанамин давали искомое соединение (36 мг, 48%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,80 (d, J=4,0 Гц, 1H), 8,66 (s, 1H), 8,48 (d, J=7,5 Гц, 1H), 8,21 (s, 1H), 8,06 (td, J=7,5 Гц, 1,5 Гц, 1H), 7,59 (ddd, J=7,5 Гц, 5,0 Гц, 1,0 Гц, 1H), 4,49-4,42 (m, 1H), 2,97 (s, 3H), 1,41-1,34 (m, 1H), 0,83-0,78 (m, 1H), 0,71-0,66 (m, 1H), 0,64-0,59 (m, 1H), 0,57-0,52 (m, 1H). LC-MS m/z: 376,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=10,51 мин.
(R)-N-(1-(4-Хлорфенил)этил)-7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
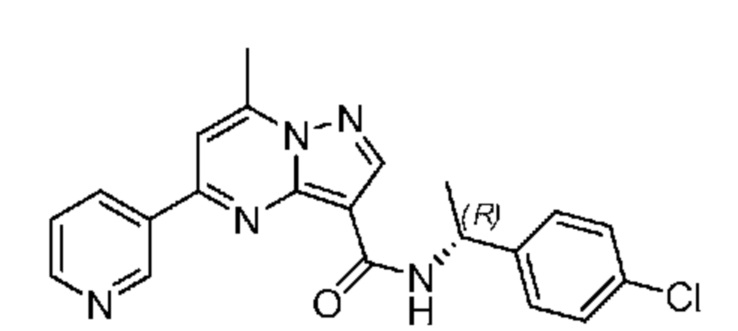
[00355] По общей методике A 7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (25 мг, 0,18 ммоля) и (R)-1-(4-хлорфенил)этанамин давали искомое соединение (8,7 мг, 22%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 9,37 (dd, J=2,5 Гц, 1,0 Гц, 1H), 8,75 (dd, J=10,0 Гц, 2,0 Гц, 1H), 8,62 (s, 1H), 8,51 (ddd, J=8,0 Гц, 2,5 Гц, 1,5 Гц, 1H), 7,79 (d, J=1,0 Гц, 1H), 7,65 (ddd, J=8,0 Гц, 5,0 Гц, 1,0 Гц, 1H), 7,50 (d, J=8,0 Гц, 2H), 7,41 (d, J=8,0 Гц, 2H), 5,28 (q, J=6,5 Гц, 1H), 2,95 (d, J=0,5 Гц, 3H), 1,69 (d, J=7,0 Гц, 3H). LC-MS m/z: 392,0 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=7,80 мин.
N-((1R,4R)-4-трет-Бутоксициклогексил)-7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
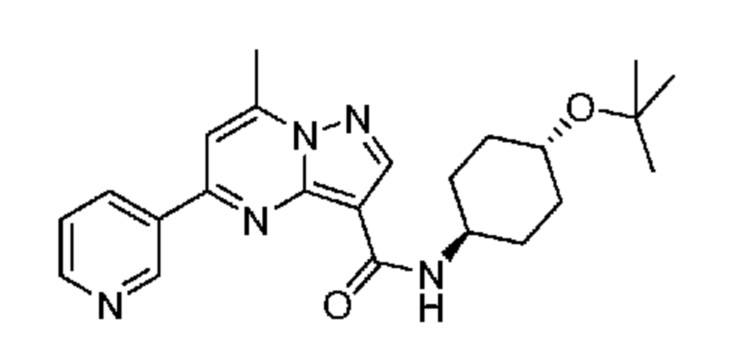
[00356] По общей методике A 7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,15 ммоля) и (1R,4R)-4-трет-бутоксициклогексанамин давали искомое соединение (20 мг, 33%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, CDCl3) δ 9,38 (d, J=2,0 Гц, 1H), 8,82 (dd, J=4,5 Гц, 2,0 Гц, 1H), 8,73 (s, 1H), 8,34 (tt, J=7,5 Гц, 2,0 Гц, 1H), 7,95 (d, J=8,0 Гц, 1H), 7,56 (dd, J=7,5 Гц, 4,5 Гц, 1H), 7,30 (s, 1H), 4,04-3,98 (m, 1H), 3,50-3,46 (m, 1H), 2,96 (s, 3H), 2,24-2,21 (d, 2H), 1,92-1,90 (m, 2H), 1,56-1,53 (m, 2H), 1,44-1,40 (m, 2H), 1,24 (s, 9H). LC-MS m/z: 408,3 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=7,44 мин.
N-((1R,4R)-4-Изобутоксициклогексил)-7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
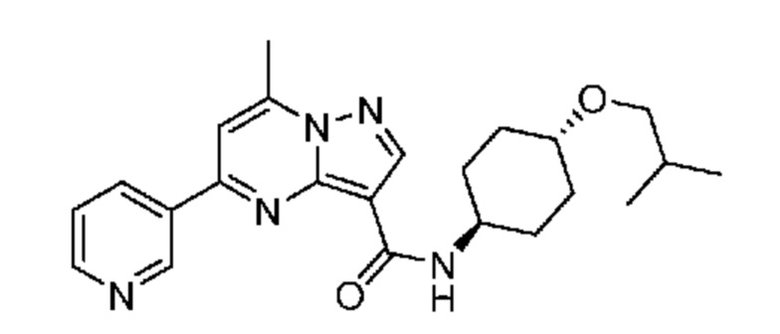
[00357] По общей методике A 7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,15 ммоля) и (1R,4R)-4-изобутоксициклогексанамин давали искомое соединение (16 мг, 26%) в виде желтого твердого вещества. 1H ЯМР (500 МГц,CDCl3) δ 9,36 (t, J=1,0 Гц, 1H), 8,82 (dd, J=4,5 Гц, 1,0 Гц, 1H), 8,74 (s, 1H), 8,35 (tt, J=7,5 Гц, 2,0 Гц, 1H), 8,03 (d, J=7,0 Гц, 1H), 7,55 (ddd, J=8,0 Гц, 5,0 Гц, 0,5 Гц, 1H), 7,31 (d, J=1,0 Гц, 1H), 4,12-4,06 (m, 1H), 3,38-3,28 (m, 1H), 3,25 (d, J=6,0 Гц, 2H), 2,96 (d, J=0,5 Гц, 3H), 2,26-2,23 (d, 2H), 2,12-2,08 (m, 2H), 1,54-1,50 (m, 2H), 1,44-1,40 (m, 2H), 0,94 (d, J=6,5 Гц, 6H). LC-MS m/z: 408,3 [M+H]+. HPLC: Чистота (254 нм): >99%; tR=8,07 мин.
7-Метил-N-((1R,4R)-4-пропоксициклогексил)-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
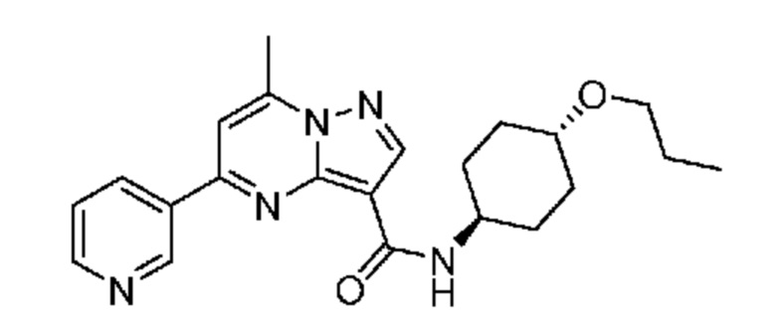
[00358] По общей методике A 7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (25 мг, 0,18 ммоля) и (1R,4R)-4-пропоксициклогексанамин давали искомое соединение (9 мг, 22%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 9,42 (dd, J=2,5 Гц, 1,0 Гц, 1H), 8,77 (dd, J=5,0 Гц, 1,5 Гц, 1H), 8,65 (ddd, J=7,5 Гц, 2,0 Гц, 1,5 Гц, 1H), 8,63 (s, 1H), 7,80 (d, J=0,5 Гц, 1H), 7,70 (ddd, J=7,5 Гц, 5,0 Гц, 1,0 Гц, 1H), 4,01-3,97 (m,1H), 3,51 (t, J=6,5 Гц, 2H), 3,45-3,41 (m, 1H), 2,95 (d, J=0,5 Гц, 3H), 2,22-2,13 (m,4H), 1,65-1,59 (m, 2H), 1,57-1,47 (m, 4H), 0,97 (t, J=7,5 Гц, 3H). LC-MS m/z: 394,2 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=7,35 мин.
7-Метил-5-(пиридин-3-ил)-N-(1,1,1-трифтор-3-метилбутан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
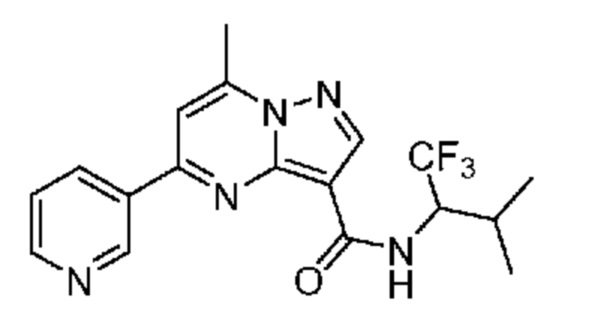
[00359] По общей методике A 7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,16 ммоля) и 1,1,1-трифтор-3-метилбутан-2-амин давали искомое соединение (8 мг, 13%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 9,40 (dd, J=2,5 Гц, 0,5 Гц, 1H), 8,76 (dd, J=5,0 Гц, 2,0 Гц, 1H), 8,69 (s, 1H), 8,63 (ddd, J=8,0 Гц, 2,5 Гц, 2,0 Гц, 1H), 7,84 (d, J=1,0 Гц, 1H), 7,68 (ddd, J=8,0 Гц, 5,0 Гц, 1,0 Гц, 1H), 4,92-4,85 (m, 1H), 2,98 (d, J=0,5 Гц, 3H), 2,424-2,37 (m, 1H), 1,17 (d, J=6,5 Гц, 3H), 1,09 (d, J=6,5 Гц, 3H). LC-MS m/z: 377,9 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=7,79 мин.
7-Метил-5-(пиридин-3-ил)-N-(1,1,1-трифторбутан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
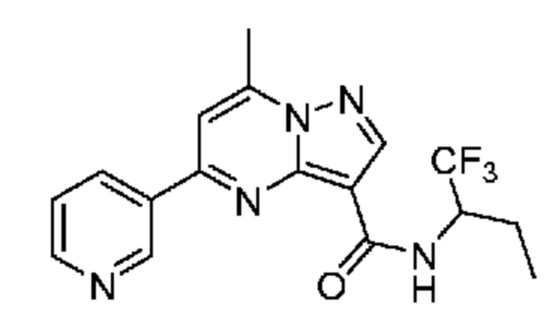
[00360] По общей методике A 7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (50 мг, 0,20 ммоля) и 1,1,1-трифторбутан-2-амин давали искомое соединение (20 мг, 28%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 9,40 (dd, J=2,0 Гц, 1H), 8,76 (dd, J=5,0 Гц, 1,5 Гц, 1H), 8,68 (s, 1H), 8,64 (ddd, J=8,0 Гц, 2,0 Гц, 1,5 Гц, 1H), 7,84 (d, J=1,5 Гц, 1H), 7,69 (ddd, J=8,0 Гц, 5,0 Гц, 0,5 Гц, 1H), 4,87-4,80 (m, 1H), 2,98 (s, 3H), 2,12-2,04 (m, 1H), 1,86-1,76 (m, 1H), 1,12 (t, J=7,5 Гц, 3H). LC-MS m/z: 364,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=9,11 мин.
7-Метил-5-(пиридин-3-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
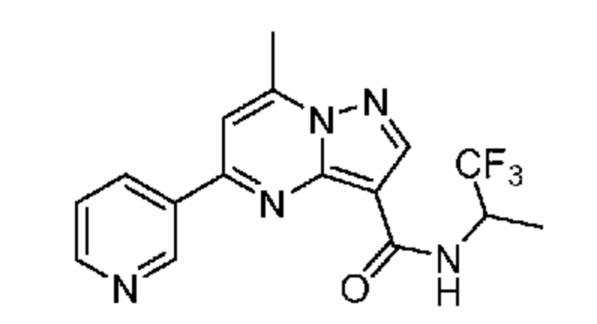
[00361] По общей методике A 7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,16 ммоля) и 1,1,1-трифторпропан-2-амин давали искомое соединение (14 мг, 26%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 9,41 (d, J=2,0 Гц, 1H), 8,77 (dd, J=5,0 Гц, 1,5 Гц, 1H), 8,68 (s, 1H), 8,65 (tt, J=8,5 Гц, 2,0 Гц, 1H), 7,84 (s, 1H), 7,70 (dd, J=8,0 Гц, 5,0 Гц, 1H), 5,03-4,97 (m, 1H), 2,97 (s, 3H), 1,55 (d, J=7,5 Гц, 3H). LC-MS m/z: 350,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=8,73 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(циклопропиламино)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
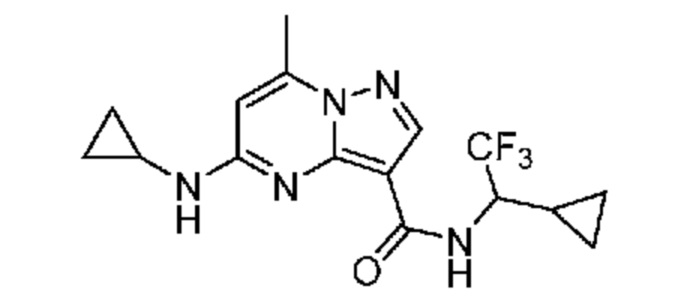
[00362] Раствор этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (98 мг, 0,41 ммоля) в 5 мл циклопропанамина перемешивали при 50°C в течение 2 ч, затем охлаждали и концентрировали в вакууме. Полученный остаток очищали с помощью препаративной TLC (PE/EA=1/1) и получали этил-5-(циклопропиламино)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (90 мг, 84%) в виде желтого твердого вещества. LC-MS m/z: 261,1 [M+H]+.
[00363] По общей методике B этил-5-(циклопропиламино)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (90 мг, 0,35 ммоля) давал 5-(циклопропиламино)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (40 мг, 49%) в виде белого твердого вещества. LC-MS m/z: 233,0 [M+H]+.
[00364] По общей методике A 5-(циклопропиламино)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,13 ммоля) и 1-циклопропил-2,2,2-трифторэтанамин давали искомое соединение (27 мг, 45%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,66 (s, 1H), 8,26 (s, 1H), 8,18 (s, 1H), 6,22 (s, 1H), 4,41-4,36 (m, 1H), 2,72-2,66 (m, 1H), 2,56 (s, 3H), 1,19-1,11 (m, 1H), 0,78 (d, J=6,0 Гц, 2H), 0,67-0,61 (m, 1H), 0,58-0,46 (m, 4H), 0,39-0,32 (m, 1H). LC-MS m/z: 354,1 [M+H]+. HPLC: Чистота (214 нм): 92%; tR=7,07 мин.
5-Хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
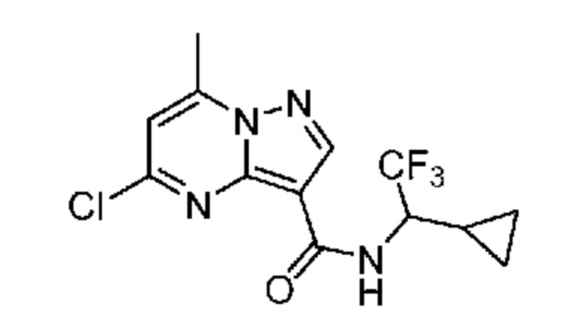
[00365] По общей методике A 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (50 мг, 0,23 ммоля) и 1-циклопропил-2,2,2-трифторэтанамин давали искомое соединение (15,7 мг, 20%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,71 (s, 1H), 8,07 (d, J=9,6 Гц, 1H), 7,44 (s, 1H), 4,42-4,32 (m, 1H), 2,78 (s, 3H), 1,26-1,20 (m, 1H), 0,69-0,65 (m, 1H), 0,60-0,54 (m, 2H), 0,38-0,33 (m, 1H). LC-MS m/z: 333,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,41 мин.
(S)-N-(1-Циклопропилэтил)-5-(4-фторфенил)-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксамид
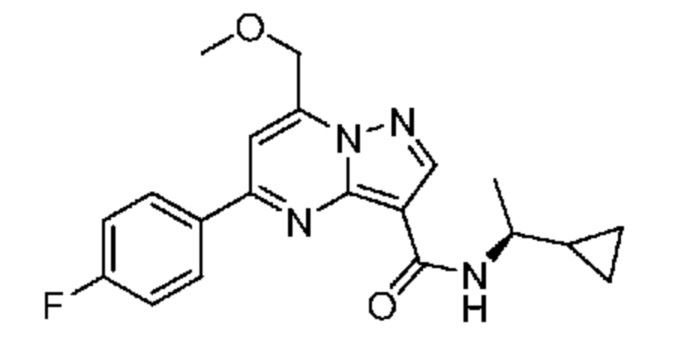
[00366] Смесь этил-5-гидрокси-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилата (1,2 г, 4,8 ммоля) с 15 мл PhPOCl2 перемешивали при 80°C в течение 4 ч в атмосфере N2, охлаждали до RT и выливали в 250 мл воды со льдом. Полученную смесь подщелачивали до pH 8 и экстрагировали с помощью EA (200 мл×3). Органические фазы сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью пластины для препаративной TLC и получали этил-5-хлор-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (40 мг, 3%). LC-MS m/z: 270,3 [M+H]+.
[00367] По общей методике D этил-7-хлор-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (150 мг, 0,56 ммоля) и 4-фторфенилбороновая кислота давали этил-5-(4-фторфенил)-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (168 мг, 75%) в виде желтого твердого вещества. LC-MS m/z: 330,1 [M+H]+. tR=1,56 мин.
[00368] По общей методике B этил-5-(4-фторфенил)-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (80 мг, 0,24 ммоля) при 30°C давал натриевую соль 5-(4-фторфенил)-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (72 мг, 99%) в виде оранжевого твердого вещества. LC-MS m/z: 302,0 [M+H]+. tR=1,76 мин.
[00369] По общей методике A 7-(4-фторфенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (35 мг, 0,12 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (16,4 мг, 34%) в виде бледно-желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,58 (s, 1H), 8,36 (dd, J=9,0 Гц, 5,5 Гц, 2H), 8,14 (d, J=7,5 Гц, 1H), 7,76 (s, 1H), 7,49 (t, J=9,0 Гц, 2H), 5,04 (s, 2H), 3,62-3,59 (m, 1H), 3,56 (s, 3H), 1,29 (d, J=6,5 Гц, 3H), 1,11-1,10 (m, 1H), 0,54-0,48 (m, 2H), 0,38-0,32 (m, 2H). LC-MS m/z: 369,1 [M+H]+. HPLC: Чистота (254 нм): 96%; tR=9,74 мин.
(S)-N-(1-Циклопропилэтил)-7-(4-фторфенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксамид
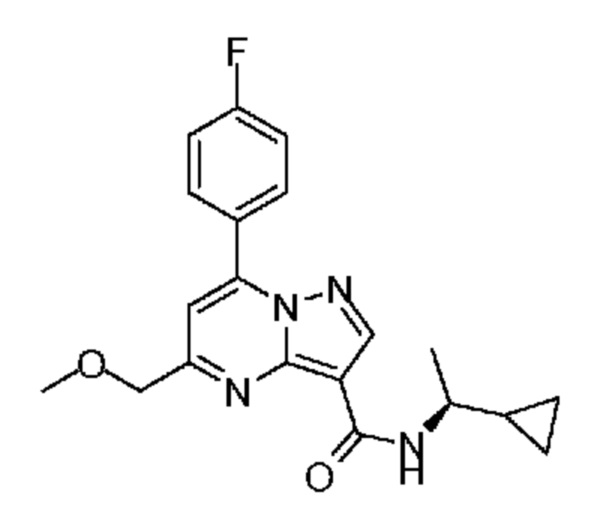
[00370] К раствору метил-4-метокси-3-оксобутаноата (15,0 г, 100 ммоля) в EtOH (20 мл) при RT в атмосфере N2 добавляли концентрированную H2SO4 (1 каплю, катализатор). Смесь нагревали при 80°C, затем по каплям добавляли CH(OEt)3 (15,2 г, 100 ммоля), перемешивали при 80°C в течение 1 ч и концентрировали в вакууме и получали метил-3-этокси-4-метоксибут-2-еноат (21 г, неочищенный) в виде желтого масла. LC-MS m/z: 175,1 [M+H]+. LCMS: tR=1,72 мин.
[00371] К раствору метил-3-этокси-4-метоксибут-2-еноата (3,5 г, 18,60 ммоля) в DMF (15 мл) добавляли этил-5-амино-1H-пиразол-4-карбоксилат (3,0 г, 19,40 ммоля) и Cs2CO3 (7,3 г, 22,30 ммоля). Смесь перемешивали при 110°C в течение 4 ч и фильтровали. Фильтрат очищали с помощью препаративной ВЭЖХ (10 мМ NH4HCO3, CH3CN: H2O=5% - 95%) и получали этил-7-гидрокси-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (3,3 г, 68%) и этил-5-гидрокси-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (0,83 г, 17%) в виде желтых твердых веществ.
[00372] Этил-7-гидрокси-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат: LC-MS m/z: 252,1 [M+H]+. LCMS: tR=1,45 мин.
[00373] Этил-5-гидрокси-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат: LC-MS m/z: 252,1 [M+H]+. LCMS: tR=1,37 мин.
[00374] Смесь этил-7-гидрокси-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилата (200 мг, 0,80 ммоля) с дихлорангидридом фенилфосфоновой кислоты (2,5 мл) перемешивали при 110°C в течение 3 ч, выливали на лед и экстрагировали с помощью EA (50 мл×3). Органические фазы промывали водным раствором NaHCO3 (100 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали этил-7-хлор-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (200 мг, 94%) в виде коричневого твердого вещества. LC-MS m/z: 270,1 [M+H]+. LCMS: tR=1,75 мин.
[00375] По общей методике D этил-7-хлор-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (200 мг, 0,74 ммоля) и 4-фторфенилбороновая кислота давали этил-7-(4-фторфенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (80 мг, 33%) в виде желтого твердого вещества. LC-MS m/z: 330,1 [M+H]+. tR=1,58 мин.
[00376] По общей методике B этил-7-(4-фторфенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (80 мг, 0,24 ммоля) давал натриевую соль 7-(4-фторфенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (72 мг, 98%) в виде желтого твердого вещества. LC-MS m/z: 302,1 [M+H]+. LCMS: tR=1,64 мин.
[00377] По общей методике A 7-(4-фторфенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (24 мг, 0,08 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение в виде желтого твердого вещества (10,3 мг, 35%). 1H ЯМР (500 МГц, MeOD-d4) δ 8,57 (s, 1H), 8,38 (dd, J=8,5 Гц, 5,5 Гц, 2H), 8,13 (d, J=8,0 Гц, 1H), 7,75 (s, 1H), 7,48 (t, J=8,5 Гц, 2H), 5,04 (s, 2H), 3,62-3,59 (m, 1H), 3,56 (s, 3H), 1,29 (d, J=6,5 Гц, 3H), 1,11-1,10 (m, 1H), 0,54-0,48 (m, 2H), 0,38-0,32 (m, 2H). LC-MS m/z: 369,1 [M+H]+. HPLC: Чистота (254 нм): 99%; tR=9,61 мин.
N-(2-Циклопропилпропан-2-ил)-5-(4-фторфенил)-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксамид
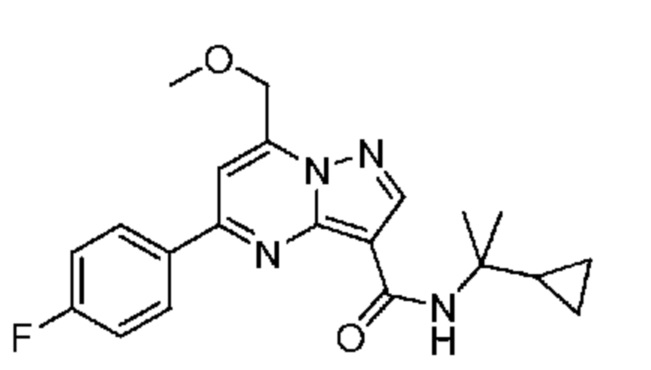
[00378] По общей методике A 5-(4-фторфенил)-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (36 мг, 0,12 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (9 мг, 20%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,52 (s, 1H), 8,46 (brs, 1H), 8,30 (dd, J=9,0 Гц, 5,5 Гц, 1H), 7,71 (s, 1H), 7,33 (t, J=9,0 Гц, 1H), 5,05 (s, 2H), 3,67 (s, 3H) 1,48 (s, 6H), 1,48-1,42 (m, 1H), 0,60-0,56 (m, 4H). LC-MS m/z: 383,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=10,29 мин.
N-(2-Циклопропилпропан-2-ил)-7-(4-фторфенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксамид
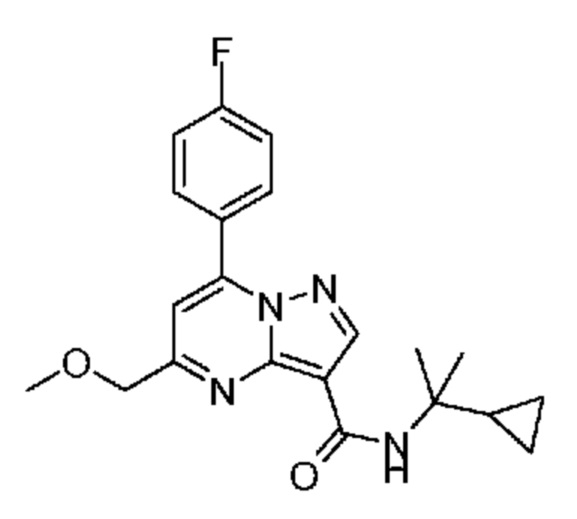
[00379] По общей методике A 7-(4-фторфенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (24 мг, 0,08 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (12,7 мг, 42%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,52 (s, 1H), 8,46 (s, 1H), 8,30 (dd, J=8,5 Гц, 5,5 Гц, 2H), 7,72 (s, 1H), 7,35 (t, J=8,5 Гц, 2H), 5,06 (s, 2H), 3,68 (s, 3H), 1,48 (s, 6H), 1,46-1,41 (m, 1H), 0,59-0,56 (m, 4H). LC-MS m/z: 383,1 [M+H]+. HPLC: Чистота (254 нм): 97%; tR=10,13 мин.
(S)-N-(1-Циклопропилэтил)-5-этил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
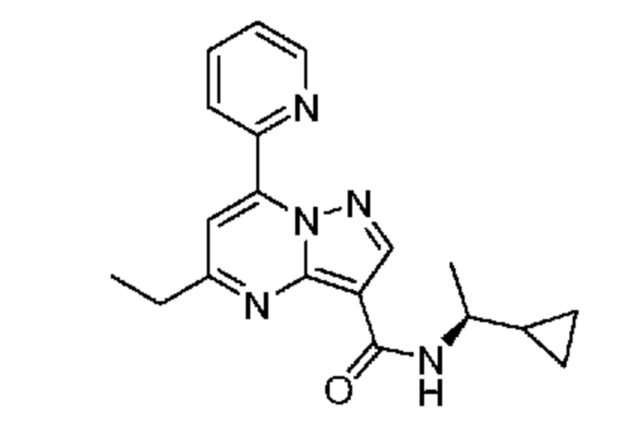
[00380] При перемешивании к раствору метил-3-этоксипент-2-еноата (10,0 г, 63,3 ммоля) и этил-5-амино-1H-пиразол-4-карбоксилата (9,8 г, 63,3 ммоля) в DMF (200 мл) добавляли Cs2CO3 (61,7 г, 189,9 ммоля). Смесь перемешивали при 100°C в течение 24 ч и концентрировали в вакууме. Остаток обрабатывали с помощью MeOH (400 мл). Твердое вещество отфильтровывали и фильтрат концентрировали в вакууме. Остатки очищали с помощью препаративной TLC (PE: EA=1:1) и получали этил-5-этил-7-гидроксипиразоло[1,5-a]пиримидин-3-карбоксилат (0,8 г, 5,7%) и этил-7-этил-5-гидроксипиразоло[1,5-a]пиримидин-3-карбоксилат (1,2 г, 8,1%) в виде белых твердых веществ.
[00381] Этил-5-этил-7-гидроксипиразоло[1,5-a]пиримидин-3-карбоксилат: LC-MS m/z: 236,1 [M+H]+. LCMS: tR=0,93 мин.
[00382] Этил-7-этил-5-гидроксипиразоло[1,5-a]пиримидин-3-карбоксилат: LC-MS m/z: 236,1 [M+H]+. LCMS: tR=1,11 мин.
[00383] Смесь этил-5-этил-7-гидроксипиразоло[1,5-a]пиримидин-3-карбоксилата (0,8 г, 3,4 ммоля) с дихлорангидридом фенилфосфоновой кислоты (4 мл) перемешивали при 100°C в течение 24 ч, охлаждали и реакцию останавливали с помощью H2O (100 мл). Смесь экстрагировали с помощью EtOAc (100 мл×3). Объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остатки очищали с помощью препаративной TLC (PE: EA=1:1) и получали этил-7-хлор-5-этилпиразоло[1,5-a]пиримидин-3-карбоксилат (450 мг, 52%) в виде белого твердого вещества, LC-MS m/z: 254,0 [M+H]+. LCMS: tR=1,50 мин.
[00384] По общей методике F этил-7-хлор-5-этилпиразоло[1,5-a]пиримидин-3-карбоксилат (450 мг, 1,8 ммоля) и 2-(трибутилстаннил)пиридин давали этил-5-этил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (250 мг, 47%) в виде желтого твердого вещества. LC-MS m/z: 297,1 [M+H]+. LCMS: tR=1,26 мин.
[00385] По общей методике B этил-5-этил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (250 мг, 0,84 ммоля) давал неочищенную натриевую соль 5-этил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (400 мг). LC-MS m/z: 269,1 [M+H]+. LCMS: tR=1,44 мин.
[00386] По общей методике A натриевая соль 5-этил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (200 мг, 0,70 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (15 мг, 6% за 2 стадии) в виде желтого твердого вещества 1H ЯМР (400 МГц, MeOD-d4): δ 8,76 (d, J=4,0 Гц, 1H), 8,58 (d, J=8,0 Гц, 1H), 8,49 (s, 1H), 8,04 (td, J=8,0 Гц, 1,2 Гц, 1H), 7,97 (s, 1H), 7,56 (ddd, J=7,6 Гц, 4,8 Гц, 0,8 Гц, 1H), 3,74-3,67 (m, 1H), 3,21 (q, J=7,2 Гц, 2H), 1,56 (t, J=7,2 Гц, 3H), 1,42 (d, J=6,8 Гц, 3H), 1,20-1,10 (m, 1H), 0,67-0,54 (m, 2H), 0,52-0,45 (m, 1H), 0,42-0,35 (m, 1H). LC-MS m/z: 336,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,46 мин.
(S)-N-(1-Циклопропилэтил)-7-этил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
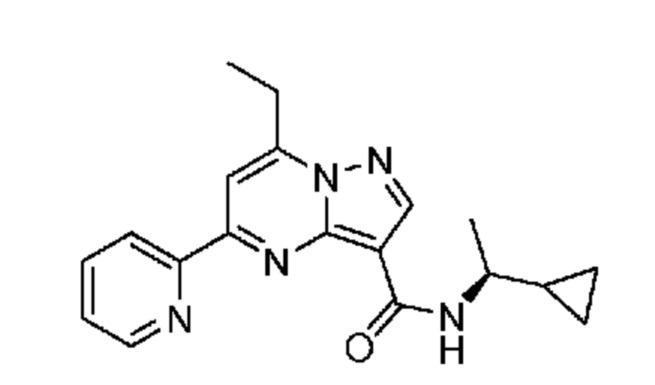
[00387] Смесь этил-7-этил-5-гидроксипиразоло[1,5-a]пиримидин-3-карбоксилата (1,2 г, 5,1 ммоля) с дихлорангидридом фенилфосфоновой кислоты (4 мл) перемешивали при 100°C в течение 24 ч, охлаждали и реакцию останавливали с помощью H2O (100 мл). Смесь экстрагировали с помощью EtOAc (100 мл×3). Объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остатки очищали с помощью препаративной TLC (PE: EA=1:1) и получали этил-5-хлор-7-этилпиразоло[1,5-a]пиримидин-3-карбоксилат (400 мг, 31%) в виде белого твердого вещества. LC-MS m/z: 254,0 [M+H]+. LCMS: tR=1,51 мин.
[00388] По общей методике F этил-5-хлор-7-этилпиразоло[1,5-a]пиримидин-3-карбоксилат (400 мг, 1,6 ммоля) и 2-(трибутилстаннил)пиридин давали этил-7-этил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (200 мг, 43%) в виде белого твердого вещества. LC-MS m/z: 297,1 [M+H]+. LCMS: tR=1,26 мин.
[00389] По общей методике B этил-7-этил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (200 мг, 0,67 ммоля) давал 7-этил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновую кислоту (350 мг, содержала соли), которую использовали без дополнительной очистки. LC-MS m/z: 269,1 [M+H]+. LCMS: tR=1,18 мин.
[00390] По общей методике A натриевая соль 7-этил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (150 мг, 0,60 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (13 мг, 7% за 2 стадии) в виде белого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4): δ 8,79 (d, J=4,8 Гц, 1H), 8,60 (s, 1H), 8,54 (d, J=8,0 Гц, 1H), 8,17 (s, 1H), 8,07 (td, J=8,0 Гц, 1,6 Гц, 1H), 7,58 (ddd, J=7,6 Гц, 4,8 Гц, 0,8 Гц, 1H), 3,74-3,67 (m, 1H), 3,36 (q, J=7,2 Гц, 2H), 1,55 (t, J=7,2 Гц, 3H), 1,42 (d, J=6,8 Гц, 3H), 1,20-1,13 (m, 1H), 0,67-0,54 (m, 2H), 0,52-0,45 (m, 1H), 0,42-0,35 (m, 1H). LC-MS m/z: 336,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,46 мин.
7-Метил-5-(пиридин-2-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
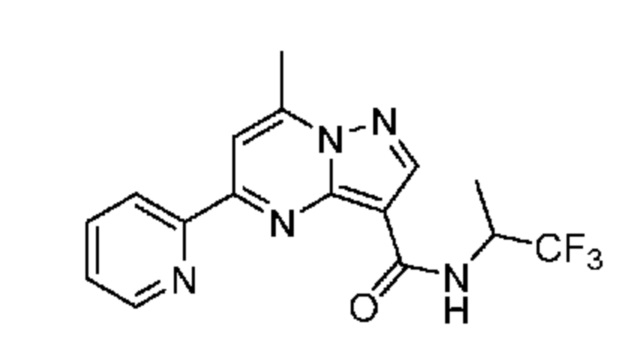
[00391] По общей методике A 7-метил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (35 мг, 0,14 ммоля) и 1,1,1-трифторпропан-2-амин давали искомое соединение искомое соединение (17 мг, 35%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,82 (d, J=4,5 Гц, 1H), 8,71 (s, 1H), 8,44 (d, J= 9,0 Гц, 1H), 8,42 (d, J=8,0 Гц, 1H), 8,20 (s, 1H), 8,14 (td, J=8,0 Гц, 2,0 Гц, 1H), 7,64 (dd, J=7,0 Гц, 5,0 Гц, 1H), 5,01-4,96 (m, 1H), 2,91 (s, 3H), 1,48 (d, J=6,5 Гц, 3H). LC-MS m/z: 350,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,05 мин.
5-Этил-7-(пиридин-2-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
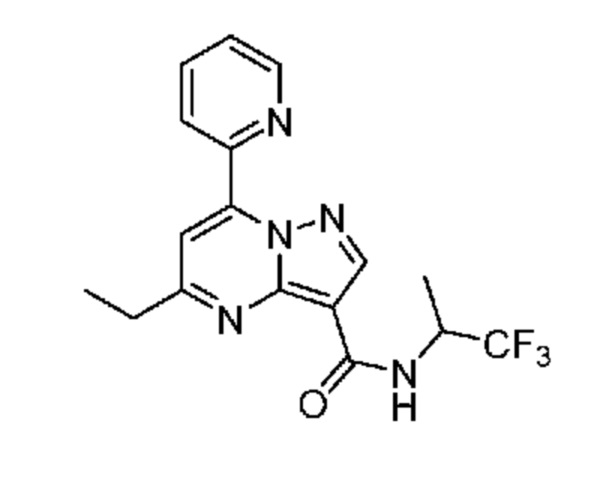
[00392] По общей методике A натриевая соль 5-этил-7-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (200 мг, 0,70 ммоля) и 1,1,1-трифторпропан-2-амингидрохлорид давали искомое соединение (12 мг, 5% за 2 стадии) в виде желтого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4): δ 8,77 (d, J=4,0 Гц, 1H), 8,54 (d, J=8,0 Гц, 1H), 8,53 (s, 1H), 8,04 (td, J=8,0 Гц, 1,6 Гц, 1H), 8,01 (s, 1H), 7,57 (ddd, J=7,6 Гц, 4,8 Гц, 0,8 Гц, 1H), 5,05-4,98 (m, 1H), 3,22 (q, J=7,6 Гц, 2H), 1,58 (t, J=7,6 Гц, 3H), 1,54 (d, J=6,8 Гц, 3H). LC-MS m/z: 364,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,59 мин.
7-Этил-5-(пиридин-2-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
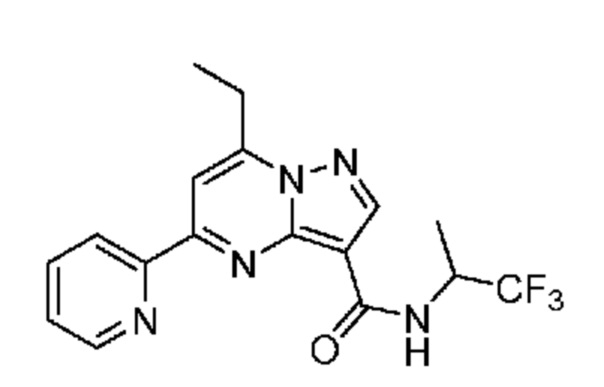
[00393] По общей методике A натриевая соль 7-этил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (150 мг, 0,60 ммоля) и 1,1,1-трифторпропан-2-амингидрохлорид давали искомое соединение (5 мг, 3% за 2 стадии) в виде белого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4): δ 8,80 (d, J=4,4 Гц, 1H), 8,65 (s, 1H), 8,48 (d, J=8,0 Гц, 1H), 8,20 (s, 1H), 8,07 (td, J=8,0 Гц, 1,6 Гц, 1H), 7,59 (ddd, J=7,6 Гц, 4,8 Гц, 0,8 Гц, 1H), 5,02-4,95 (m, 1H), 3,37 (q, J=7,2 Гц, 2H), 1,56 (t, J=7,2 Гц, 3H), 1,54 (d, J=7,6 Гц, 3H). LC-MS m/z: 364,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,65 мин.
5-(3-Метоксифенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
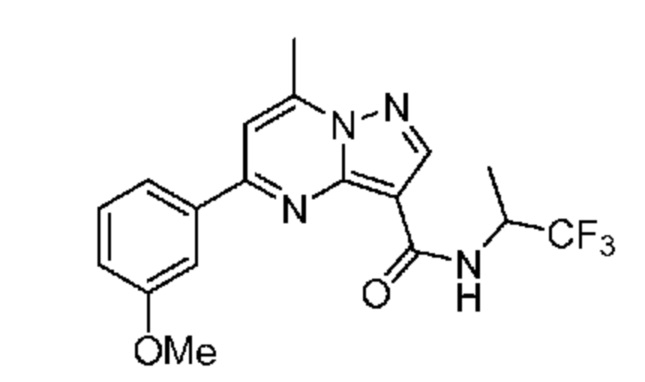
[00394] По общей методике D этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,42 ммоля) и 3-метоксифенилбороновая кислота давали этил-5-(3-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (98 мг, 75%) в виде желтого твердого вещества. LC-MS m/z: 312,1 [M+H]+.
[00395] По общей методике B этил-5-(3-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (90 мг, 0,29 ммоля) давал 5-(3-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (71 мг, 87%) в виде белого твердого вещества. LC-MS m/z: 284,1 [M+H]+.
[00396] По общей методике A 5-(3-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,10 ммоля) и 1,1,1-трифторпропан-2-амин давали искомое соединение (18 мг, 47%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,66 (s, 1H), 8,49 (d, J=9,5 Гц, 1H), 7,97 (s, 1H), 7,82 (d, J=8,0 Гц, 1H), 7,79 (s, 1H), 7,54 (t, J=8,0 Гц, 1H), 7,19 (dd, J=8,0 Гц, 2,0Hz, 1H), 5,01-4,96 (m, 1H), 3,89 (s, 3H), 2,86 (s, 3H), 1,45 (d, J=6,5 Гц, 3H). LC-MS m/z: 379,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,58 мин.
(S)-N-(1-Циклопропилэтил)-5-(3-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
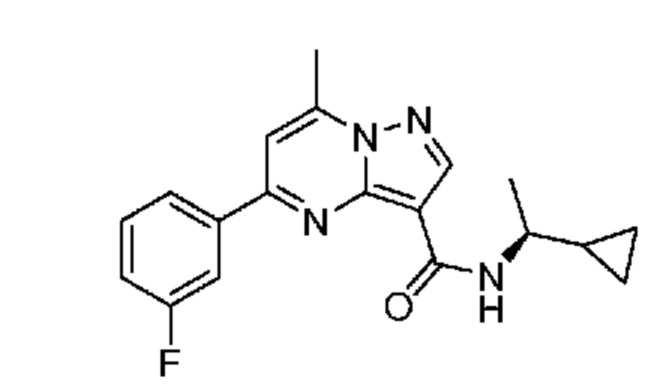
[00397] По общей методике D этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,42 ммоля) и 3-фторфенилбороновая кислота давали этил-5-(3-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (90 мг, 72%) в виде коричневого твердого вещества. LC-MS m/z: 300,1 [M+H]+. Чистота (214 нм): > 90%; tR=2,00 мин.
[00398] По общей методике B этил-5-(3-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (90 мг, 0,3 ммоля) давал 5-(3-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (70 мг, 98%) в виде коричневого твердого вещества. LC-MS m/z: 272,0 [M+H]+. Чистота по данным LC-MS (214 нм): > 99%; tR=1,66 мин.
[00399] По общей методике A 5-(3-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,11 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (21 мг, 56%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,59 (s, 1H), 8,14 (t, J=8,0 Гц, 2H), 8,09 (dt, J=10,0 Гц, 2,5 Гц, 1H), 7,96 (s, 1H), 7,69 (ddd, J=14,0 Гц, 8,0 Гц, 2,0 Гц, 1 H), 7,47 (td, J=8,0 Гц, 2,5 Гц, 1H), 3,65-3,61(m, 1H), 2,86 (s, 3H), 1,28 (d, J=6,5 Гц, 3H), 1,14-1,07 (m, 1H), 0,56-0,45 (m, 2H), 0,42-0,31 (m, 2H). LC-MS m/z: 339,2 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,56 мин.
(S)-N-(1-Циклопропилэтил)-5-(3-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
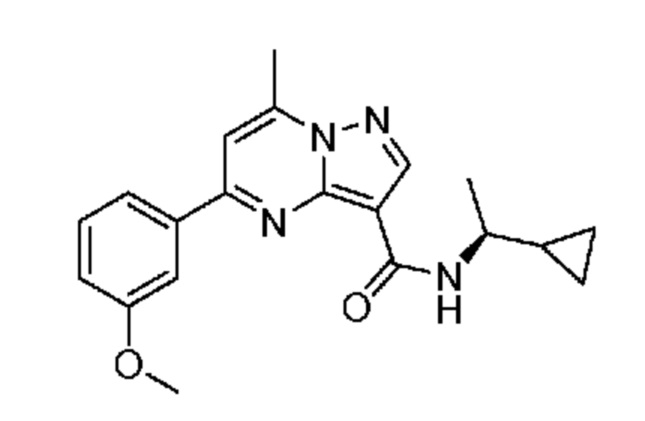
[00400] По общей методике A 5-(3-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,10 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (10 мг, 29%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,55 (s, 1H), 8,15 (d, J=7,5 Гц, 1H), 7,88 (s, 1H), 7,82 (d, J=7,5 Гц, 1H), 7,78 (s, 1H), 7,52 (t, J=8,0 Гц, 1H), 7,16 (dd, J=8,0 Гц, 2,0 Гц, 1H), 3,88 (s, 3H), 3,67-3,63 (m, 1H), 2,84 (s, 3H), 1,30 (d, J=5,0 Гц, 3H), 1,08-1,05 (m, 1H), 0,53-0,47 (m, 2H), 0,41-0,38 (m, 1H), 0,34-0,30 (m, 1H). LC-MS m/z: 351,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,46 мин.
(S)-N-(1-Циклопропилэтил)-7-метил-5-морфолинопиразоло[1,5-a]пиримидин-3-карбоксамид
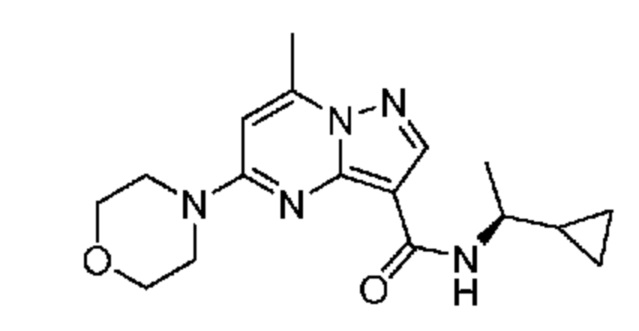
[00401] По общей методике G этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,41 ммоля) и морфолин давали этил-7-метил-5-морфолинопиразоло[1,5-a]пиримидин-3-карбоксилат (105 мг, 88%) в виде белого твердого вещества. LC-MS m/z: 291,1 [M+H]+.
[00402] По общей методике B этил-7-метил-5-морфолинопиразоло[1,5-a]пиримидин-3-карбоксилат (105 мг, 0,36 ммоля) давал 7-метил-5-морфолинопиразоло[1,5-a]пиримидин-3-карбоновую кислоту (90 мг, 96%) в виде белого твердого вещества. LC-MS m/z: 263,0 [M+H]+.
[00403] По общей методике A 7-метил-5-морфолинопиразоло[1,5-a]пиримидин-3-карбоновая кислота (35 мг, 0,13 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (31 мг, 70%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,17 (s, 1H), 7,88 (d, J=7,6 Гц, 1H), 6,88 (s, 1H), 3,74 (t, J=4,0 Гц, 4H), 3,70 (t, J=4,0 Гц, 4H), 3,54-3,48 (m, 1H), 2,62 (s, 3H), 1,20 (d, J=6,8 Гц, 3H), 1,00-0,95 (m, 1H), 0,46-0,38 (m, 2H), 0,30-0,23 (m, 2H). LC-MS m/z: 330,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=6,68 мин.
N-(2-Циклопропилпропан-2-ил)-7-метил-5-морфолинопиразоло[1,5-a]пиримидин-3-карбоксамид
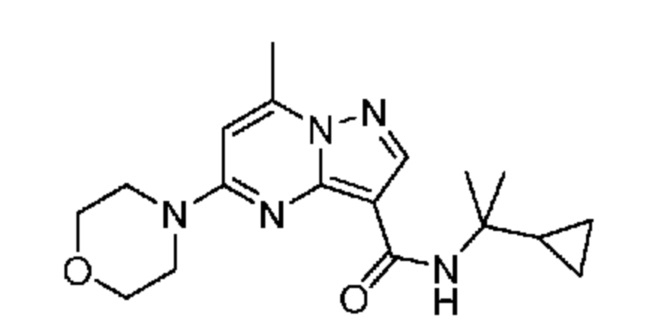
[00404] По общей методике A 7-метил-5-морфолинопиразоло[1,5-a]пиримидин-3-карбоновая кислота (35 мг, 0,13 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (16 мг, 35%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,14 (s, 1H), 7,83 (s, 1H), 6,89 (s, 1H), 3,71 (d, J=5,2 Гц, 8H), 2,61 (s, 3H), 1,30 (s, 6H), 1,30-1,28 (m, 1H), 0,39-0,35 (m, 4H). LC-MS m/z: 344,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,20 мин.
(S)-N-(1-Циклопропилэтил)-5-(4,4-дифторпиперидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
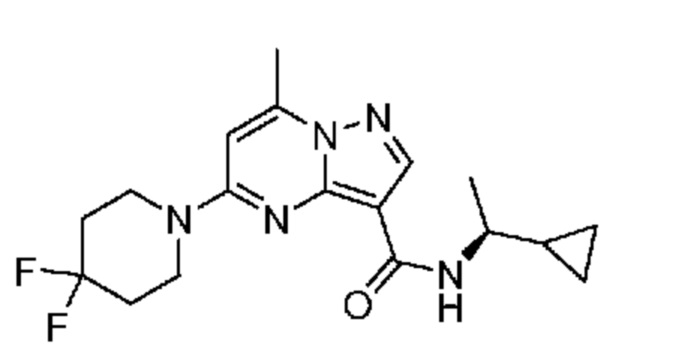
[00405] По общей методике G этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,42 ммоля), 4,4-дифторпиперидингидрохлорид (79 мг, 0,50 ммоля) и Et3N давали этил-5-(4,4-дифторпиперидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 70%) в виде желтого твердого вещества. LC-MS m/z: 325,2 [M+H]+. HPLC: Чистота (254 нм): > 80%; tR=1,41 мин.
[00406] По общей методике B этил-5-(4,4-дифторпиперидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,31 ммоля) давал 5-(4,4-дифторпиперидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (70 мг, 70%) в виде желтого твердого вещества. LC-MS m/z: 297,1 [M+H]+. Чистота (254 нм): > 80%; tR=0,86 мин.
[00407] По общей методике A 5-(4,4-дифторпиперидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (60 мг, 0,20 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (30 мг, 40%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,18 (s, 1H), 7,86 (d, J=7,5 Гц, 1H), 6,99 (s, 1H), 3,87(brs, 4H), 3,54-3,49 (m, 1H), 2,62 (s, 3H), 2,15-2,06 (m, 4H), 1,20 (d, J=6,5 Гц, 3H), 1,01-0,96 (m, 1H), 0,48-0,39 (m, 2H), 0,31-0,23 (m, 2H). LC-MS m/z: 364,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,72 мин.
(S)-N-(1-Циклопропилэтил)-5-(3,3-дифторпиперидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
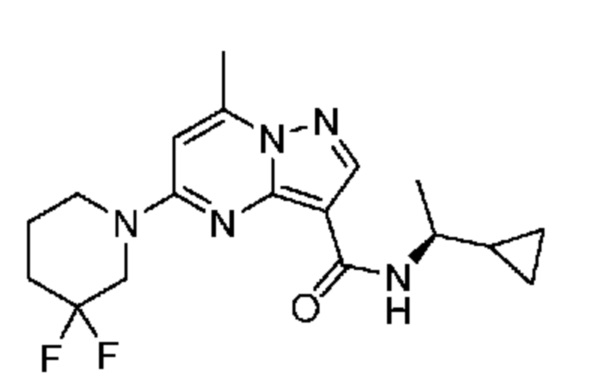
[00408] По общей методике G этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,42 ммоля) и 3,3-дифторпиперидингидрохлорид давали этил-5-(3,3-дифторпиперидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 70%) в виде желтого твердого вещества. LC-MS m/z: 325,2 [M+H]+. Чистота (254 нм): > 80%; tR=1,39 мин.
[00409] По общей методике B этил-5-(3,3-дифторпиперидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (90 мг, 0,28 ммоля) давал 5-(3,3-дифторпиперидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (70 мг, 85%) в виде желтого твердого вещества. LC-MS m/z: 297,1 [M+H]+. Чистота (254 нм): > 80%; tR=0,86 мин.
[00410] По общей методике A 5-(3,3-дифторпиперидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (60 мг, 0,20 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (20 мг, 25%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,18 (s, 1H), 7,86 (d, J=7,5 Гц, 1H), 7,00 (s, 1H), 4,18-4,10 (m, 2H), 3,80 (brs, 1H), 2,62 (s, 3H), 3,58-3,52 (m, 1H), 2,62 (s,1H), 2,20-2,12 (m, 2H), 1,79 (brs, 2H), 1,20 (d, J=6,5 Гц, 3H), 0,99-0,94 (m, 1H), 0,49-0,39 (m, 2H), 0,33-0,24 (m, 2H). LC-MS m/z: 364,1 [M+H]+, HPLC: Чистота (214 нм): > 99%; tR=7,50 мин.
5-(3-Хлор-2-пиридинил)-N-(2-циклопропилпропан-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
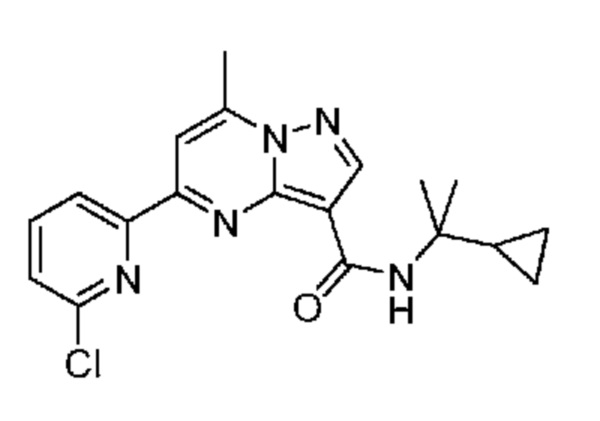
[00411] По общей методике D этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (300 мг, 1,25 ммоля) и 6-хлорпиридин-2-илбороновая кислота давали этил-5-(6-хлорпиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (240 мг, 60%) в виде желтого твердого вещества. LC-MS m/z: 317,2 [M+H]+.
[00412] Смесь этил-5-(6-хлорпиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (240 мг, 0,76 ммоля) и (Bu3Sn)2O (2,3 г, 3,80 ммоля) в толуоле (10 мл) перемешивали при 110°C в течение 3 дней, охлаждали и выливали в насыщенный раствор NaHCO3 (20 мл). Водную фазу промывали с помощью EA (5 мл×3), подкисляли до pH 6 с помощью 6 н. HCl и экстрагировали с помощью EA (50 мл×3). Органические фазы сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 5-(6-хлорпиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (46 мг, 23%) в виде желтого твердого вещества. LC-MS m/z: 289,1 [M+H]+.
[00413] По общей методике A 5-(6-хлорпиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (50 мг, 0,14 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (15,8 мг, 25%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,58 (s, 1H), 8,44 (d, J=7,5 Гц, 1H), 8,37 (brs, 1H), 8,07 (s, 1H), 8,01 (t, J=7,5 Гц, 1H), 7,61 (d, J=8,0 Гц, 1H), 2,93 (s, 3H), 1,50 (s, 6H), 1,50-1,47 (m, 1H), 0,62-0,59 (m, 4H). LC-MS m/z: 370,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=11,43 мин.
5-(6-Хлорпиридин-2-ил)-7-метил-N-(2-метилбут-3-ин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
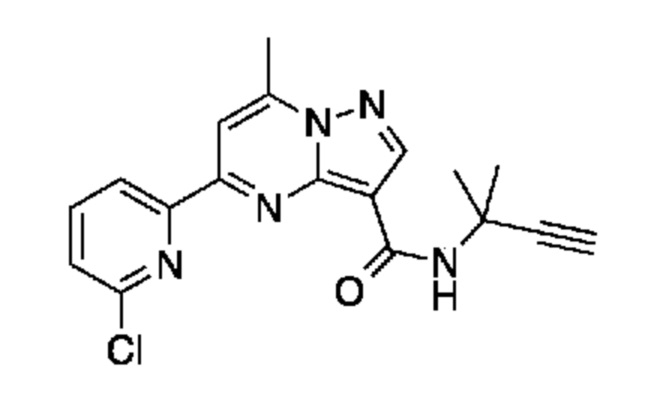
[00414] По общей методике A 5-(6-хлорпиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (50 мг, 0,14 ммоля) и 2-метилбут-3-ин-2-амин давали искомое соединение (18 мг, 30%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,72 (brs, 1H), 8,62 (s, 1H), 8,51 (d, J=8,0 Гц, 1H), 8,13 (s, 1H), 8,05 (t, J=8,0 Гц, 1H), 7,63 (d, J=8,0 Гц, 1H), 2,97 (s, 1H), 2,96 (s, 3H), 1,88 (s, 6H). LC-MS m/z: 354,1 [M+H]+. Чистота по данным LC-MS (214 нм): > 99%; tR=10,66 мин.
5-(3-Хлорфенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
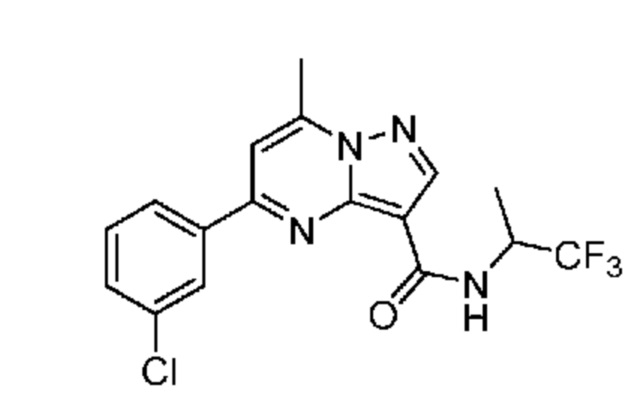
[00415] По общей методике D этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (300 мг, 1,25 ммоля) и 3-хлорфенилбороновая кислота давали этил-5-(3-хлорфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (390 мг, 98%) в виде белого твердого вещества. LC-MS m/z: 315,0 [M+H]+. Чистота (214 нм): > 72%; tR=2,00 мин.
[00416] По общей методике B этил-5-(3-хлорфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (390 мг, 1,24 ммоля) давал 5-(3-хлорфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (250 мг, 70%) в виде белого твердого вещества. LC-MS m/z: 287,0 [M+H]+. Чистота по данным LC-MS (214 нм): > 80%; tR=1,68 мин.
[00417] По общей методике A 5-(3-хлорфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (60 мг, 0,21 ммоля) и 1,1,1-трифторпропан-2-амин давали искомое соединение (41,8 мг, 52%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,68 (s, 1H), 8,49 (d, J=9,0 Гц, 1H), 8,31(t, J=2,0 Гц, 1H), 8,21 (dt, J=7,5 Гц, 1,5 Гц, 1H), 8,03 (s, 1H), 7,70-7,65 (m, 2H), 4,97 (m, J=8,0 Гц, 1H), 2,87 (s, 3H), 1,45 (d, J=6,5 Гц, 3H). LC-MS m/z: 382,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,07 мин.
(S)-5-(3-Хлорфенил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
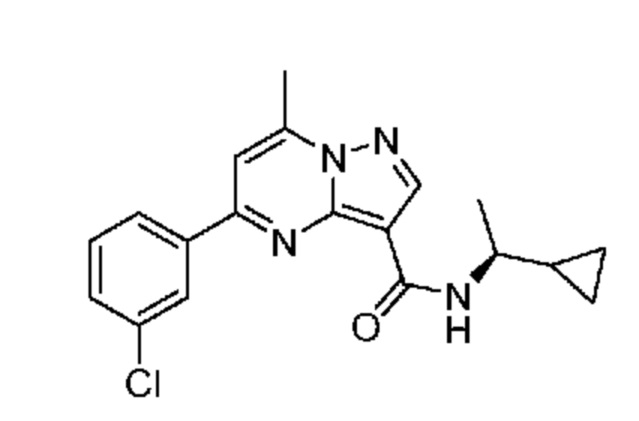
[00418] По общей методике A 5-(3-хлорфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (60 мг, 0,21 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (38,2 мг, 51%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,58 (s, 1H), 8,33 (s, 1H), 8,23 (dd, J=8,5 Гц, 2,0 Гц, 1H), 8,15 (d, J=7,5 Гц, 1H), 7,97 (s, 1H), 7,68-7,65 (m, 2H), 3,63 (m, J=7,5 Гц, 1H), 2,85 (s, 3H), 1,28 (d, J=6,5 Гц, 3H), 1,13-1,08 (m, 1H), 0,55-0,50 (m, 2H), 0,40-0,33 (m, 2H). LC-MS m/z: 354,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,10 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3,3-дифторпиперидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
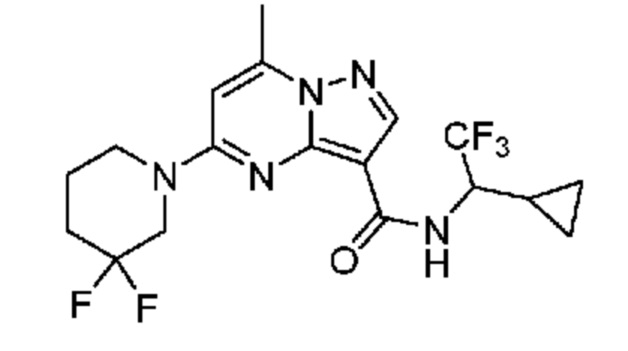
[00419] По общей методике A 5-(3,3-дифторпиперидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,10 ммоля) и 1-циклопропил-2,2,2-трифторэтанамин давали искомое соединение в виде желтого твердого вещества (17 мг, 30%). 1H ЯМР (500 МГц, MeOD-d4): δ 8,30 (s, 1H), 6,85 (s, 1H), 4,39 (p, J=7,5 Гц, 1H), 4,20-4,18 (m, 1H), 4,09-4,05 (m, 1H), 3,92-3,88 (m, 1H), 3,85-3,81 (m, 1H), 2,72 (s, 3H), 2,24-2,17 (m, 2H), 1,93-1,88 (m, 2H), 1,24-1,20 (m, 1H), 0,77-0,73 (m, 1H), 0,65-0,63 (m, 1H), 0,55-0,47 (m, 2H). LC-MS m/z: 418,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,10 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3,3-дифторпирролидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
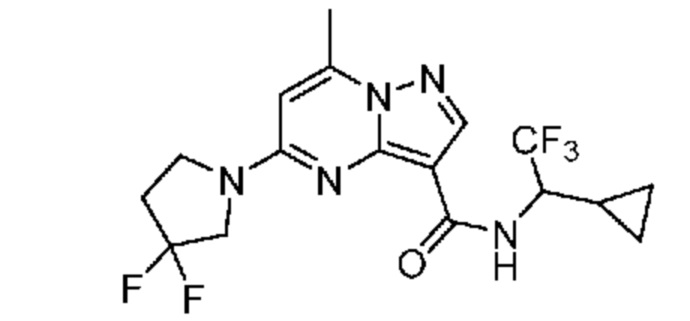
[00420] По общей методике G этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,42 ммоля) и 3,3-дифторпирролидингидрохлорид (72 мг, 0,50 ммоля) давали этил-5-(3,3-дифторпирролидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (72 мг, 55%) в виде желтого твердого вещества. LC-MS m/z: 311,2 [M+H]+, tR=1,35 мин.
[00421] По общей методике B этил-5-(3,3-дифторпирролидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (50 мг, 0,16 ммоля) давал 5-(3,3-дифторпирролидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (32 мг, 71%) в виде белого твердого вещества. LC-MS m/z: 283,0 [M+H]+. tR=0,82 мин.
[00422] По общей методике A 5-(3,3-дифторпирролидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (32 мг, 0,11 ммоля) и 1-циклопропил-2,2,2-трифторэтанамин давали искомое соединение (4,7 мг, 10%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,30 (s, 1H), 6,52 (d, J=3,0 Гц, 1H), 4,42-4,38 (m, 1H), 4,02 (t, J=12,5 Гц, 2H), 3,89 (t, J=7,5 Гц, 2H), 2,72 (s, 3H), 2,67-2,62 (m, 2H), 1,28-1,20 (m, 1H), 0,78-0,74 (m, 1H), 0,68-0,60 (m, 1H), 0,58-0,42 (m, 2H). LC-MS m/z: 404,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=8,13 мин.
N-(2-Циклопропилпропан-2-ил)-7-метил-5-(трифторметил)пиразоло[1,5-a]пиримидин-3-карбоксамид
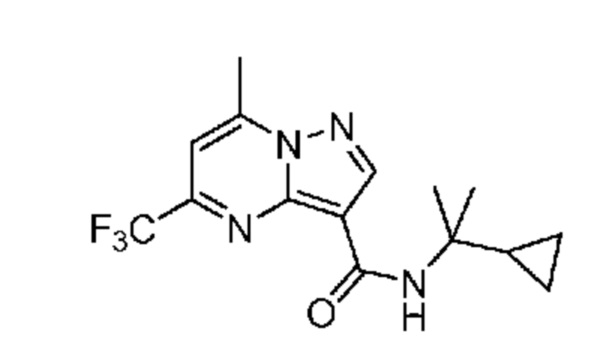
[00423] К смеси этил-5-амино-1H-пиразол-4-карбоксилата (1,0 г, 6,493 ммоля) с AcOH (15 мл) при 110°C добавляли 1,1,1-трифторпентан-2,4-дион (1,0 г, 6,493 ммоля). Смесь перемешивали в течение 2 ч и концентрировали в вакууме. Остаток растворяли в EA (100 мл). Органический раствор промывали 10% раствором NaHCO3 (50 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали этил-7-метил-5-(трифторметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (1,8 г, 100%) в виде желтого твердого вещества. LC-MS m/z: 274,0 [M+H]+. tR=1,71 мин.
[00424] К смеси этил-7-метил-5-(трифторметил)пиразоло[1,5-a]пиримидин-3-карбоксилата (100 мг, 0,366 ммоля) с толуолом (10 мл) добавляли (Bu3Sn)2O (440 мг, 0,732 ммоля). Смесь перемешивали при 120°C в течение 2 дней и концентрировали в вакууме. Остаток подвергали распределению между 10% раствором NaHCO3 (20 мл) и EA (30 мл×2). Водную фазу подкисляли 10% раствором HCl до pH 5~6 и экстрагировали с помощью EA (30 мл×2). Органические фазы сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 7-метил-5-(трифторметил)пиразоло[1,5-a]пиримидин-3-карбоновую кислоту (75 мг, 83%) в виде желтого твердого вещества. LC-MS m/z: 246,1 [M+H]+. tR=1,53 мин.
[00425] По общей методике A 7-метил-5-(трифторметил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (75 мг, 0,31 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (35 мг, 35%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,56 (s, 1H), 8,26 (s, 1H), 7,60 (s, 1H), 2,98 (s, 3H), 1,45 (s, 6H), 1,40-1,37 (m, 1H), 0,56-0,54 (m, 4H). LC-MS m/z: 327,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,58 мин.
5-(3-Метоксифенил)-7-метил-N-(2-метилбут-3-ин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
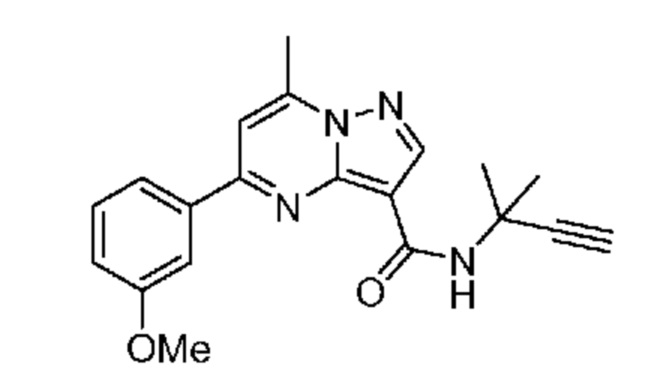
[00426] По общей методике A 5-(3-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,14 ммоля) и 2-метилбут-3-ин-2-амин давали искомое соединение (36 мг, 74%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,56 (s, 1H), 8,43 (s, 1H), 7,95 (s, 1H), 7,87 (d, J=8,0 Гц, 1H), 7,81 (s, 1H), 7,54 (t, J=8,0 Гц, 1H), 7,18 (dd, J=8,5 Гц, 2,5 Гц, 1H), 3,88 (s, 3H), 3,31 (s, 1H), 2,86 (s, 3H), 1,75 (s, 6H). LC-MS m/z: 349,2 [M+H]+. LC-MS HPLC: Чистота (214 нм): > 99%; tR=8,32 мин.
(S)-5-(3-Цианофенил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
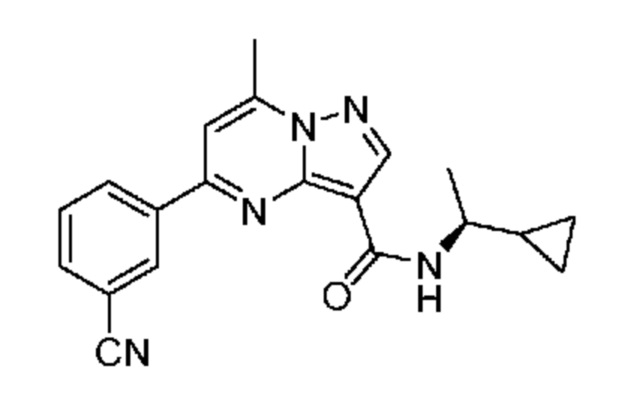
[00427] По общей методике C 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (80 мг, 0,38 ммоля) и (S)-1-циклопропилэтанамингидрохлорид давали (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид в виде желтого твердого вещества (30 мг, 28%). LC-MS m/z: 279,1 [M+H]+. Чистота по данным LC-MS (214 нм): 99%.
[00428] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,18 ммоля) и 3-цианофенилбороновая кислота давали искомое соединение (33,4 мг, 54%) в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 8,72 (s, 1H), 8,44 (s, 1H), 8,33 (d, J=8,0 Гц, 1H), 8,11 (d, J=7,5 Гц, 1H), 7,84 (d, J=7,5 Гц, 1H), 7,70 (t, J=8,0 Гц, 1H), 7,29 (s, 1H), 3,80-3,76 (m, 1H), 2,95 (s, 3H), 1,38 (d, J=6,5 Гц, 3H), 1,08-1,04 (m, 1H), 0,63-0,57 (m, 2H), 0,50-0,48 (m, 1H), 0,41-0,37 (m, 1H). LC-MS m/z: 346,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,90 мин.
5-(3-Цианофенил)-N-(2-циклопропилпропан-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
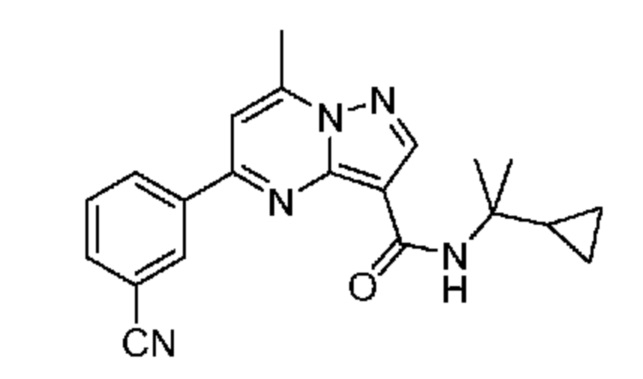
[00429] По общей методике C 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (80 мг, 0,38 ммоля) и 2-циклопропилпропан-2-амин давали 5-хлор-N-(2-циклопропилпропан-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (20 мг, 18%) в виде желтого твердого вещества. LC-MS m/z: 293,1 [M+H]+. Чистота по данным LC-MS (214 нм): 91%.
[00430] По общей методике D 5-хлор-N-(2-циклопропилпропан-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (40 мг, 0,14 ммоля) и 3-цианофенилбороновая кислота давали искомое соединение (26,6 мг, 53%) в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 8,71 (s, 1H), 8,47 (s, 1H), 8,34 (d, J=8,0 Гц, 1H), 8,10 (s, 1H), 7,83 (d, J=8,0 Гц, 1H), 7,68 (t, J=8,0 Гц, 1H), 7,28 (s, 1H), 2,94 (s, 3H), 1,58 (s, 6H), 1,43-1,39 (m, 1H), 0,60-0,57 (m, 2H), 0,55-0,53 (m, 2H). LC-MS m/z: 360,1 [M+H]+. LC-MS HPLC: Чистота (214 нм): > 99%; tR=8,42 мин.
5-(3-Цианофенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
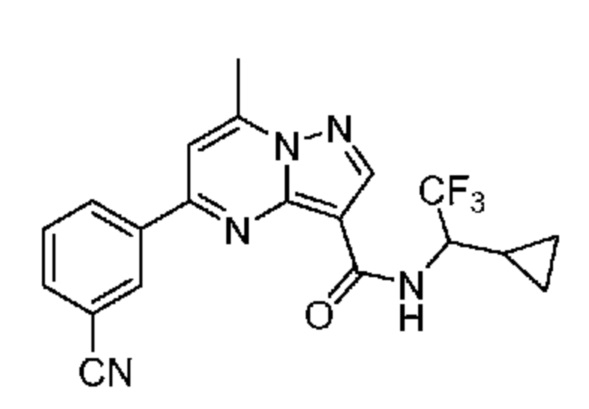
[00431] По общей методике C 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (90 мг, 0,43 ммоля) и 1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (30 мг, 21%) в виде желтого твердого вещества. LC-MS m/z: 333,0 [M+H]+. Чистота по данным LC-MS (214 нм): 89%.
[00432] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (30 мг, 0,09 ммоля) и 3-цианофенилбороновая кислота давали (10,6 мг, 29%) в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 8,73 (s, 1H), 8,46 (d, J=8,5 Гц, 1H), 8,37 (s, 1H), 8,33 (d, J=8,5 Гц, 1H), 7,85 (d, J=8,0 Гц, 1H), 7,72 (t, J=7,5 Гц, 1H), 7,33 (s, 1H), 4,53-4,48 (m, 1H), 2,96 (s, 3H), 1,25-1,20 (m, 1H), 0,77-0,72 (m, 1H), 0,64-0,52 (m, 3H). LC-MS m/z: 400,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,39 мин.
5-(3-Карбамоилфенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
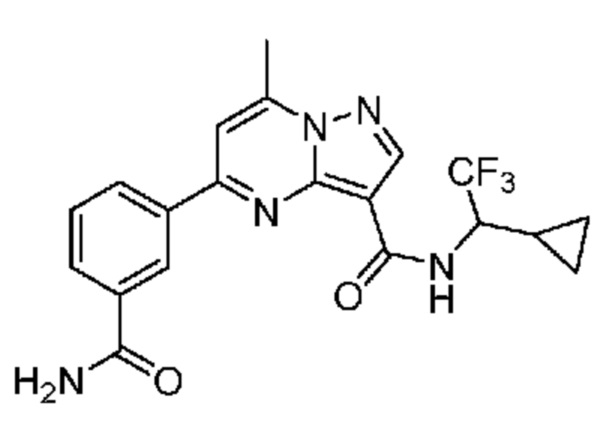
[00433] По общей методике D этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (80 мг, 0,3 ммоля) и 3-цианофенилбороновая кислота давали этил-5-(3-цианофенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (82 мг, 89%) в виде белого твердого вещества. LC-MS m/z: 307,1 [M+H]+.
[00434] По общей методике B этил-5-(3-цианофенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (82 мг, 0,27 ммоля) давал 5-(3-карбамоилфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (51 мг, 64%) в виде желтого твердого вещества. LC-MS m/z: 279,0 [M+H]+.
[00435] По общей методике A 5-(3-карбамоилфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (25 мг, 0,08 ммоля) и 1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (10,6 мг, 32%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 8,71 (s, 1H), 8,60 (s, 1H), 8,57 (d, J=8,5 Гц, 1H), 8,28 (d, J=7,5 Гц, 1H), 8,00 (d, J=8,0 Гц, 1H), 7,68 (t, J=8,0 Гц, 1H), 7,42 (s, 1H), 4,56-4,50 (m, 1H), 3,49 (s, 2H), 2,94 (s, 3H), 1,26-1,22 (m, 1H), 0,75-0,71 (m, 1H), 0,61-0,53 (m, 3H). LC-MS m/z: 418,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=6,97 мин.
N-(2-Циклопропилпропан-2-ил)-5-(3-фторфенил)-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксамид
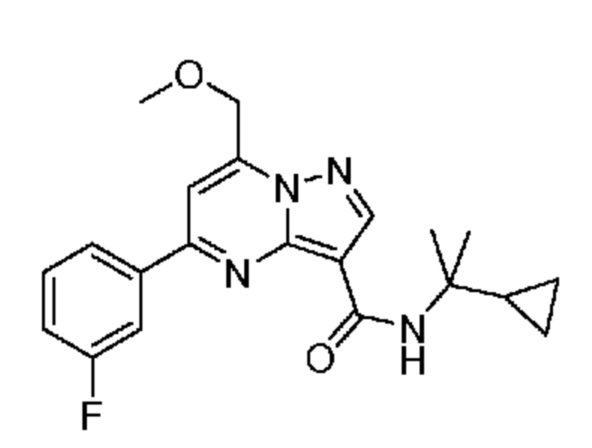
[00436] По общей методике D этил-5-хлор-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (40 мг, 0,15 ммоля) и 3-фторфенилбороновая кислота давали этил-5-(3-фторфенил)-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (33 мг, 67%) в виде желтого твердого вещества. LC-MS m/z: 330,1 [M+H]+. tR=2,07 мин.
[00437] По общей методике B этил-5-(3-фторфенил)-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (33 мг, 0,10 ммоля) давал натриевую соль 5-(3-фторфенил)-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (30 мг, 92%) в виде желтого твердого вещества. LC-MS m/z: 302,2 [M+H]+. tR=1,76 мин.
[00438] По общей методике A 5-(3-фторфенил)-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,10 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (1 мг, 4%) в виде бледно-желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,57 (s, 1H), 8,14 (d, J=8,5 Гц, 1H), 8,13-8,10 (m, 2H), 7,80 (s, 1H), 7,69-7,65 (m, 1H), 7,47 (td, J=7,5 Гц, 2,0 Гц, 1H), 5,05 (s, 2H), 3,56 (s, 3H), 1,41 (s, 6H), 1,42-1,40 (m, 1H), 0,52-0,48 (m, 4H). LC-MS m/z: 383,1 [M+H]+. Чистота по данным LC-MS (214 нм): > 99%; tR=10,35 мин.
N-(2-Циклопропилпропан-2-ил)-7-(3-фторфенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксамид
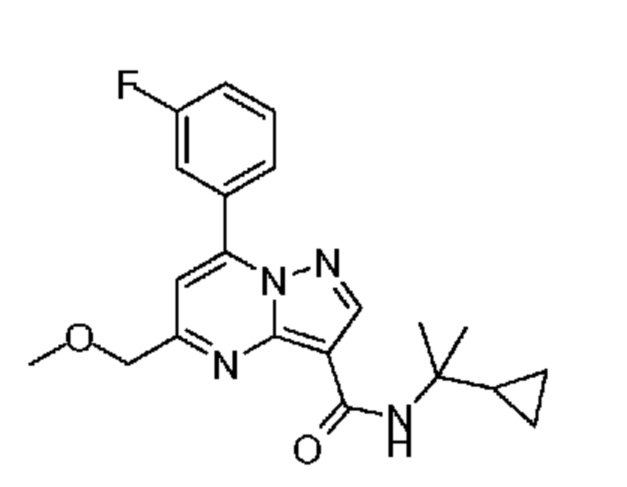
[00439] По общей методике D этил-7-хлор-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (50 мг, 0,19 ммоля) и 3-фторфенилбороновая кислота давали этил-7-(3-фторфенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (44 мг, 72%) в виде желтого твердого вещества. LC-MS m/z: 330,1 [M+H]+. tR=1,96 мин.
[00440] По общей методике B этил-7-(3-фторфенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (44 мг, 0,13 ммоля) давал натриевую соль 7-(3-фторфенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (40 мг, 95%) в виде желтого твердого вещества. LC-MS m/z: 302,0 [M+H]+. LCMS: tR=1,76 мин.
[00441] По общей методике A 7-(3-фторфенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,13 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (10 мг, 20%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,52 (s, 1H), 8,41 (s, 1H), 8,02 (d, J=8,0 Гц, 1H), 7,99 (dd, J=10,5 Гц, 2,5 Гц, 1H), 7,71 (s, 1H), 7,59 (ddd, J=15,0 Гц, 7,0 Гц, 2,0 Гц, 1H), 7,33 (td, J=8,5 Гц, 2,5 Гц, 1H), 5,04 (s, 2H), 3,67 (s, 3H), 1,49 (s, 6H), 1,45-1,37 (m, 1H), 0,63-0,55 (m, 4H). LC-MS m/z: 383,2 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=10,34 мин.
5-(3-Фторфенил)-7-метил-N-(2-метилбут-3-ин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
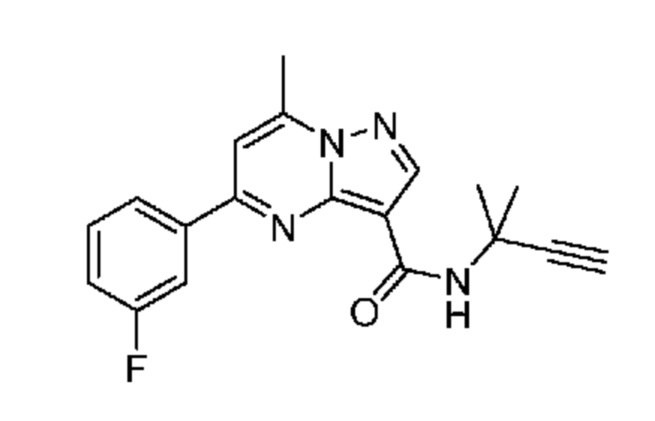
[00442] По общей методике A 5-(3-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,15 ммоля) и 2-метилбут-3-ин-2-амин давали искомое соединение (24,5 мг, 50%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,58 (s, 1H), 8,46 (s, 1H), 8,15 (d, J=8,0 Гц, 1H), 8,09 (td, J=12,0 Гц, 2,0 Гц, 1H), 7,98 (s, 1H), 7,71-7,66 (m, 1H), 7,46 (td, J=8,5 Гц, 2,0 Гц, 1H), 3,35 (s, 1H), 2,86 (s, 3H), 1,75 (s, 6H). LC-MS m/z: 336,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,42 мин.
5-(3-Этоксифенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
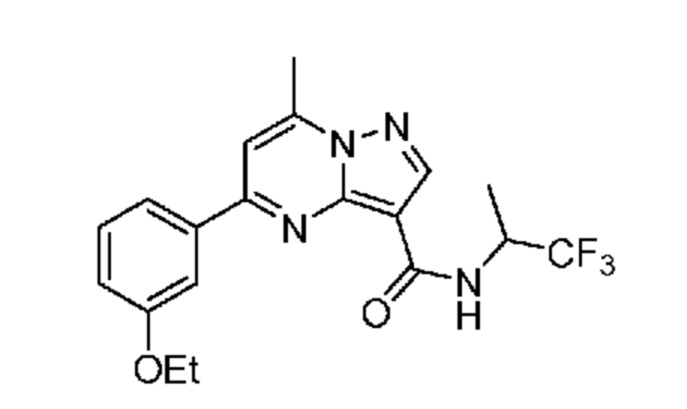
[00443] По общей методике D этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (150 мг, 1,25 ммоля) и 2-(3-этоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан давали этил-5-(3-этоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 50%) в виде белого твердого вещества. LC-MS m/z: 326,2 [M+1]+. Чистота по данным LC-MS (214 нм): > 96%; tR=1,59 мин.
[00444] По общей методике B этил-5-(3-этоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,31 ммоля) давал 5-(3-этоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (60 мг, 50%) в виде желтого твердого вещества. LC-MS m/z: 298,1 [M+1]+. Чистота по данным LC-MS (214 нм): > 98%; tR=0,97 мин.
[00445] По общей методике A 5-(3-этоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (50 мг, 0,17 ммоля) и 1,1,1-трифторпропан-2-амингидрохлорид давали искомое соединение (30 мг, 45%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,60 (s, 1H), 7,75 (d, J=9,0 Гц, 1H), 7,73 (s, 1H), 7,70 (s, 1H), 7,47 (t, J=8,0 Гц, 1H), 7,14 (dd, J=8,5 Гц, 2,5 Гц, 1H), 5,00 (p, J=7,5 Гц, 1H), 4,17 (qd, J=13,5 Гц, 1,5 Гц, 2H), 2,91 (s, 3H), 1,53 (d, J=6,5 Гц, 3H), 1,46 (t, J=7,0 Гц, 3H). LC-MS m/z: 393,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,09 мин.
5-(3-Циклопропоксифенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
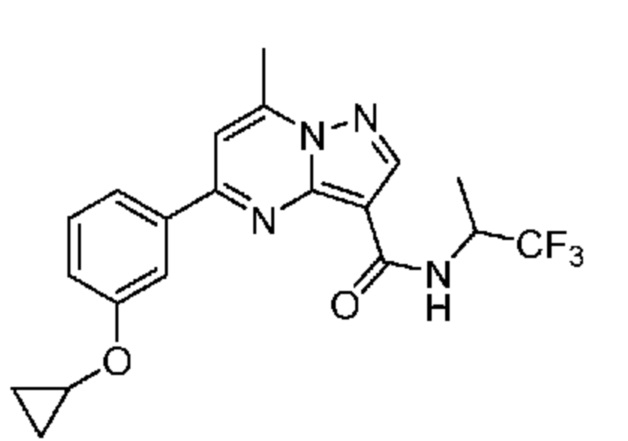
[00446] По общей методике D этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (200 мг, 0,84 ммоля) и 2-(3-циклопропоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан давали этил-5-(3-циклопропоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (150 мг, 53%) в виде желтого твердого вещества. LC-MS m/z: 338,1 [M+H]+. tR=1,99 мин.
[00447] По общей методике B этил-5-(3-циклопропоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (150 мг, 0,44 ммоля) давал 5-(3-циклопропоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (100 мг, 72,9%) в виде желтовато-коричневого твердого вещества. LC-MS m/z: 310,1 [M+H]+. LCMS: tR=1,83 мин.
[00448] По общей методике A 5-(3-циклопропоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,13 ммоля) и 1,1,1-трифторпропан-2-амингидрохлорид давали искомое соединение (26 мг, 50%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,61 (s, 1H), 7,83 (s, 1H), 7,78 (d, J=7,5 Гц, 1H), 7,69 (s, 1H), 7,50 (t, J=8,0 Гц, 1H), 7,31 (dd, J=8,0 Гц, 2,5 Гц, 1H), 5,00-4,97 (m, 1H), 3,93-3,91 (m, 1H), 2,92 (s, 3H), 1,52 (d, J=6,0 Гц, 3H), 0,88-0,85 (m, 2H), 0,78-0,76 (m, 2H). LC-MS m/z: 405,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=9,18 мин.
5-(Циклопропиламино)-N-(дициклопропилметил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
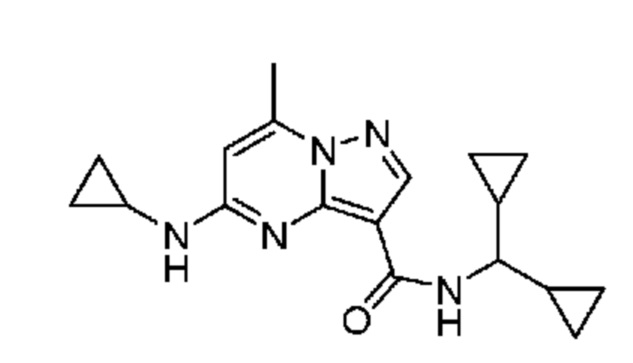
[00449] По общей методике G этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (300 мг, 1,26 ммоля) и циклопропанамин давали этил-5-(циклопропиламино)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат в виде светло-желтого масла (215 мг, 67%). LC-MS m/z: 261,1 [M+H]+. tR=1,59 мин.
[00450] По общей методике B этил-5-(циклопропиламино)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (215 мг, 0,83 ммоля) давал 5-(циклопропиламино)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (146 мг, 76%) в виде белого твердого вещества. LC-MS m/z: 233,1 [M+H]+. tR=0,74 мин.
[00451] По общей методике A 5-(циклопропиламино)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (47 мг, 0,20 ммоля) и дициклопропилметанамин давали искомое соединение (23 мг, 35%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,19 (s, 1H), 8,16 (s, 1H), 8,11 (s, 1H), 6,20 (s, 1H), 3,40 (brs, 1H), 2,76 (brs, 1H), 2,55 (s, 3H), 0,99 (d, J=6,5 Гц, 2H), 0,81 (d, J=5,5 Гц, 2H), 0,56 (brs, 2H), 0,47-0,42 (m, 2H), 0,39-0,34 (m, 2H), 0,33-0,25 (m, 4H). LC-MS m/z: 326,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,47 мин.
N-(2-Циклопропилпропан-2-ил)-7-(метоксиметил)-5-(3-метоксифенил)пиразоло[1,5-a]пиримидин-3-карбоксамид
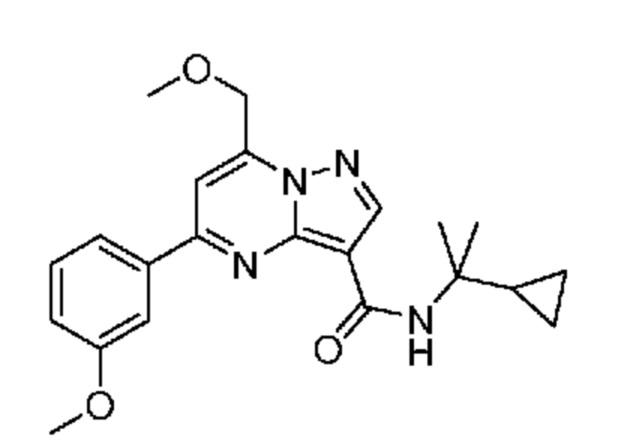
[00452] По общей методике D этил-5-хлор-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (65 мг, 0,24 ммоля) и 3-метоксифенилбороновая кислота давали 5-(3-метоксифенил)-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (57 мг, 70%) в виде желтого твердого вещества. LC-MS m/z: 342,1 [M+H]+. tR=1,01 мин.
[00453] По общей методике B этил-5-(3-метоксифенил)-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (57 мг, 0,17 ммоля) при 30°C давал натриевую соль 5-(3-метоксифенил)-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (46 мг, 88%) в виде красного твердого вещества. LC-MS m/z: 314,1 [M+H]+. LCMS: tR=1,65 мин.
[00454] По общей методике A 5-(3-метоксифенил)-7-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (46 мг, 0,15 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (18,5 мг, 34%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,54 (s, 1H), 8,13 (s, 1H), 7,84 (d, J=7,5 Гц, 1H), 7,78 (d, J=2,0 Гц, 1H), 7,74 (s, 1H), 7,54 (t, J=8,0 Гц, 1H), 7,20 (dd, J=8,0 Гц, 2,0 Гц, 1H), 5,04 (s, 3H), 3,87 (s, 3H), 3,56 (s, 3H), 1,42-1,37 (m, 1H), 1,38 (s, 6H), 0,50-0,42 (m, 4H). LC-MS m/z: 395,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=10,23 мин.
N-(2-Циклопропилпропан-2-ил)-5-(метоксиметил)-7-(3-метоксифенил)пиразоло[1,5-a]пиримидин-3-карбоксамид
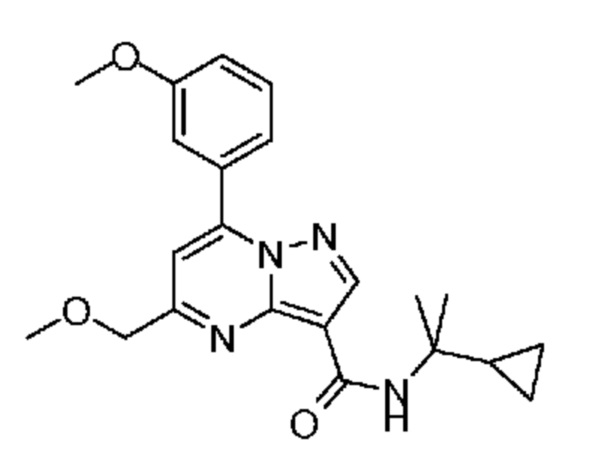
[00455] По общей методике D этил-7-хлор-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,37 ммоля) и 3-метоксифенилбороновая кислота давали этил-7-(3-метоксифенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (44 мг, 35%) в виде желтого твердого вещества. LC-MS m/z: 342,1 [M+H]+. tR=2,05 мин.
[00456] По общей методике B этил-7-(3-метоксифенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоксилат (44 мг, 0,13 ммоля) давал натриевую соль 7-(3-метоксифенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (30 мг, 75%) в виде оранжевого твердого вещества. LC-MS m/z: 314,1 [M+H]+. LCMS: tR=0,95 мин.
[00457] По общей методике A 7-(3-метоксифенил)-5-(метоксиметил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,10 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (1,6 мг, 4%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,39 (s, 1H), 8,37 (s, 1H), 7,65 (d, J=8,0 Гц, 1H), 7,64 (d, J=2,0 Гц, 1H), 7,58 (s, 1H), 7,37 (t, J=8,0 Гц, 1H), 7,04 (dd, J=8,0 Гц, 2,0 Гц, 1H), 4,93 (s, 2H), 3,78 (s, 3H), 3,56 (s, 3H), 1,36 (s, 6H),1,33-1,30 (m,1H), 0,49-0,42 (m, 4H). LC-MS m/z: 395,2 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=10,24 мин.
5-(3-Метоксифенил)-7-метил-N-(1,1,1-трифтор-2-метилпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
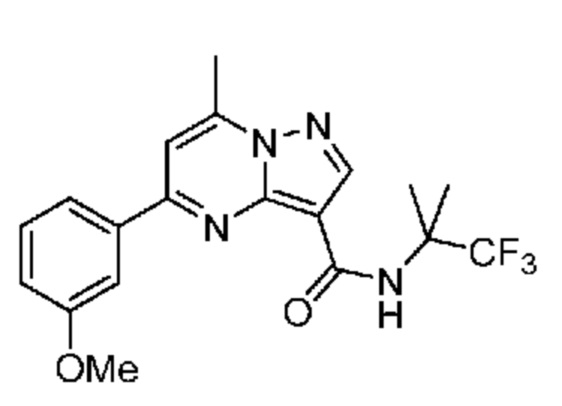
[00458] По общей методике A 5-(3-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,11 ммоля) и 1,1,1-трифтор-2-метилпропан-2-амин давали искомое соединение (11 мг, 26%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,60 (s, 1H), 8,40 (s, 1H), 7,96 (s, 1H), 7,81 (d, J=7,2 Гц, 1H), 7,75 (s, 1H), 7,54 (t, J=8,0 Гц, 1H), 7,20 (dd, J=7,6 Гц, 1,6 Гц, 1H), 3,88 (s, 3H), 2,86 (s, 3H), 1,73 (s, 6H). LC-MS m/z: 393,1 [M+H]+. LC-MS HPLC: Чистота (214 нм): 96%; tR=8,99 мин.
5-(3-Хлорфенил)-7-метил-N-(1,1,1-трифтор-2-метилпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
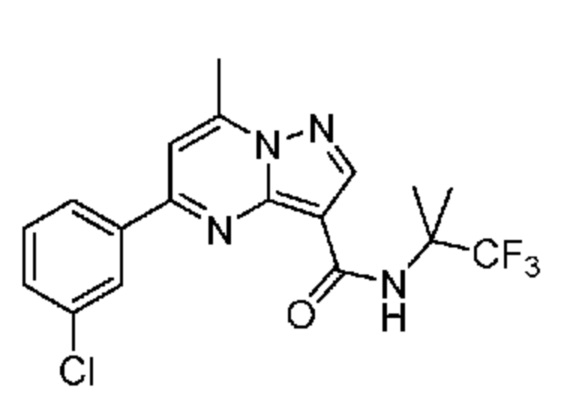
[00459] По общей методике A 5-(3-хлорфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,11 ммоля) и 1,1,1-трифтор-2-метилпропан-2-амин давали искомое соединение (9 мг, 21%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,62 (s, 1H), 8,42 (s, 1H), 8,30 (s, 1H), 8,19 (d, J=6,8 Гц, 1H), 8,02 (s, 1H), 7,69-7,66 (m, 2H), 2,86 (s, 3H), 1,73 (s, 6H). LC-MS m/z: 397,0 [M+H]+. Чистота по данным LC-MS (254 нм): 98%; tR=9,56 мин.
5-(3-Фторфенил)-7-метил-N-(1,1,1-трифтор-2-метилпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
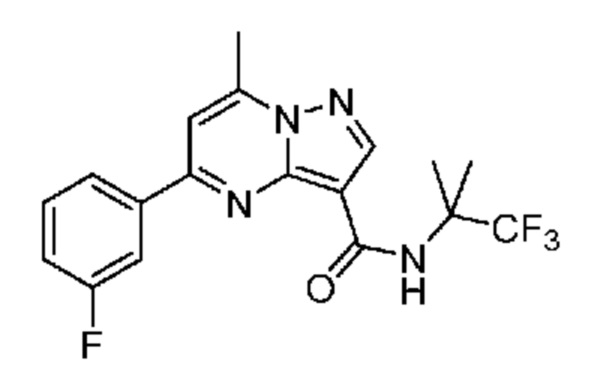
[00460] По общей методике A 5-(3-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (24 мг, 0,09 ммоля) и 1,1,1-трифтор-2-метилпропан-2-амин давали искомое соединение (2,6 мг, 8% за две стадии) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,62 (s, 1H), 8,41 (s, 1H), 8,08 (d, J=7,6 Гц, 1H), 8,03 (dt, J=10,0 Гц, 2,4 Гц, 1H), 8,00 (s, 1H), 7,69 (ddd, J=15,6 Гц, 7,6 Гц, 2,0 Гц, 1H), 7,48 (td, J=8,4 Гц, 2,4 Гц, 1H), 2,86 (s, 3H), 1,72 (s, 6H). LC-MS m/z: 381,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,10 мин.
7-Этил-5-(пиридин-2-ил)-N-(1,1,1-трифтор-2-метилпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
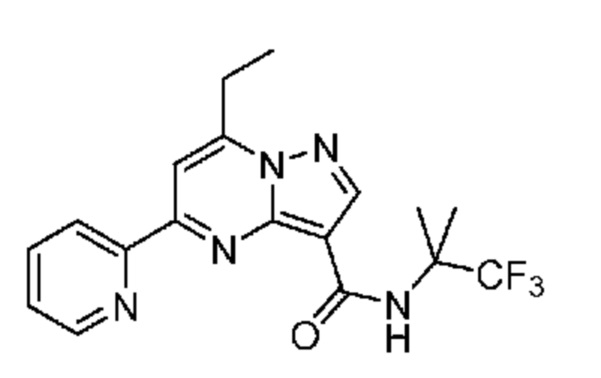
[00461] По общей методике A 7-этил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (100 мг, 0,40 ммоля) и 1,1,1-трифтор-2-метилпропан-2-амин давали искомое соединение (16 мг, 13%) в виде белого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4): δ 8,80 (d, J=4,4 Гц, 1H), 8,60 (s, 1H), 8,49 (d, J=8,0 Гц, 1H), 8,19 (s, 1H), 8,05 (td, J=8,0 Гц, 1,6 Гц, 1H), 7,59 (dd, J=7,2 Гц, 5,6 Гц, 1H), 3,37 (q, J=7,6 Гц, 2H), 1,82 (s, 6H), 1,55 (t, J=7,6 Гц, 3H). LC-MS m/z: 378,1 [M+H]+. HPLC: Чистота (214 нм): 93%; tR=9,35 мин.
7-Метил-5-(пиридин-2-ил)-N-(1,1,1-трифтор-2-метилпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
[00462] По общей методике A 7-метил-5-(пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (38 мг, 0,15 ммоля) и 1,1,1-трифтор-2-метилпропан-2-амин давали искомое соединение (18,0 мг, 33%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,82 (d, J=4,5 Гц, 1H), 8,65 (s, 1H), 8,37 (d, J=8,5 Гц, 1H), 8,37 (s, 1H), 8,19 (s, 1H), 8,14 (t, J=8,0 Гц, 1H), 8,64 (dd, J=7,0 Гц, 4,0 Гц, 1H), 2,90 (s, 3H), 1,75 (s, 6H). LC-MS m/z: 364,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,77 мин.
5-(2-Фтор-5-метоксифенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
[00463] По общей методике D этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,42 ммоля) и 2-фтор-5-метоксифенилбороновая кислота давали этил-5-(2-фтор-5-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 72%) в виде белого твердого вещества. LCMS m/z: 330,0 [M+H]+. Чистота (254 нм): > 96%.
[00464] По общей методике B этил-5-(2-фтор-5-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,30 ммоля) давал 5-(2-фтор-5-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (80 мг, 89%) в виде белого твердого вещества. LC-MS m/z: 302,1 [M+H]+. Чистота (254 нм): > 99%.
[00465] По общей методике A 5-(2-фтор-5-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,10 ммоля) и 1,1,1-трифторпропан-2-амингидрохлорид давали искомое соединение (23,4 мг, 64%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,71 (s, 1H), 8,44 (d, J=9,2 Гц, 1H), 7,74 (s, 1H), 7,58 (dd, J=6,0 Гц, 2,8 Гц, 1H), 7,41 (dd, J=10,8 Гц, 8,8 Гц, 1H), 7,20 (dt, J=8,8Hz, 4,0 Гц, 1H), 5,00-4,93 (m, 1H), 3,85 (s, 3H), 2,88 (s, 3H), 1,40 (d, J=6,8 Гц, 3H). LC-MS m/z: 397,1 [M+H]+. Чистота по данным LC-MS (214 нм): > 99%; tR=8,71 мин.
5-(3-Фтор-5-метоксифенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
[00466] По общей методике D этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,42 ммоля) и 3-фтор-5-метоксифенилбороновая кислота давали этил-5-(3-фтор-5-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (130 мг, 94%) в виде белого твердого вещества. LCMS m/z: 330,1 [M+H]+. Чистота (254 нм): > 96%.
[00467] По общей методике B этил-5-(3-фтор-5-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (85 мг, 0,26 ммоля) давал 5-(3-фтор-5-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (48 мг, 62%) в виде белого твердого вещества. LC-MS m/z: 302,1 [M+H]+. Чистота (254 нм): > 96%.
[00468] По общей методике A 5-(3-фтор-5-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (25 мг, 0,08 ммоля) и 1,1,1-трифторпропан-2-амингидрохлорид давали искомое соединение (14,2 мг, 44%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,68 (s, 1H), 8,44 (d, J=9,2 Гц, 1H), 7,67-7,63 (m, 2H), 7,11 (dt, J=10,8 Гц, 2,0 Гц, 1H), 5,01-4,94 (m, 1H), 3,90 (s, 3H), 2,86 (s, 3H), 1,44 (d, J=6,8 Гц, 3H). LC-MS m/z: 397,1 [M+H]+. Чистота по данным LC-MS (214 нм): > 99%; tR=8,81 мин.
5-(3-Хлорфенил)-7-метил-N-(2-метилбут-3-ин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
[00469] По общей методике A 5-(3-хлорфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,10 ммоля) и 2-метилбут-3-ин-2-амин давали искомое соединение (15,5 мг, 44%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,59 (s, 1H), 8,45 (s, 1H), 8,35 (s, 1H), 8,26 (d, J=5,2 Гц, 1H), 8,02 (s, 1H), 7,683 (s, 1H), 7,676 (d, J=5,2 Гц, 1H), 3,36 (s, 1H), 2,86 (s, 3H), 1,76 (s, 6H). LC-MS m/z: 353,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,94 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(изотиазол-5-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
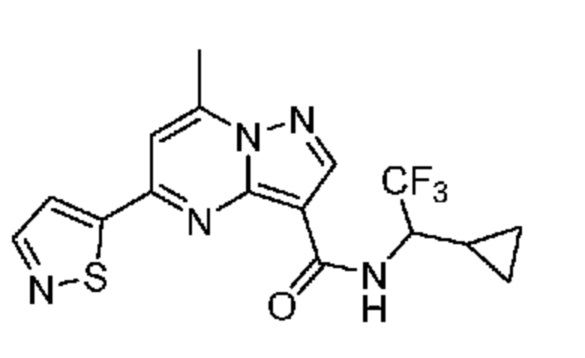
[00470] По общей методике E этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (300 мг, 0,83 ммоля) и 5-бромизотиазол (137 мг, 0,83 ммоля) давали этил-5-(изотиазол-5-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (200 мг, 57%) в виде желтого твердого вещества. LC-MS m/z: 289,0 [M+H]+. tR=1,69 мин.
[00471] По общей методике B этил-5-(изотиазол-5-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (200 мг, 0,69 ммоля) давал 5-(изотиазол-5-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (150 мг, 83%) в виде желтого твердого вещества. LC-MS m/z: 302,1 [M+H]+. tR=0,91 мин.
[00472] По общей методике A 5-(изотиазол-5-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (80 мг, 0,31 ммоля) и 1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (18 мг, 25%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,68 (s, 1H), 8,66 (s, 1H), 8,13 (s, 1H), 7,77 (s, 1H), 4,48-4,42 (m, 1H), 2,96 (s, 3H), 1,40-1,31 (m, 1H), 0,85-0,78 (m, 1H), 0,72-0,65 (m, 1H), 0,62-0,50 (m, 2H). LC-MS m/z: 382,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=10,13 мин.
5-(Изотиазол-5-ил)-7-метил-N-(2-метилбут-3-ин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
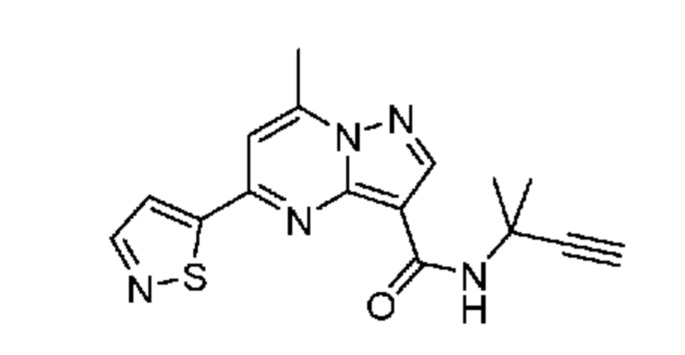
[00473] По общей методике A 5-(изотиазол-5-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (70 мг, 0,27 ммоля) и 2-метилбут-3-ин-2-амин давали искомое соединение (18,6 мг, 30%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,67 (d, J=2,0 Гц, 1H), 8,60 (s, 1H), 8,10 (d, J=2,0 Гц, 1H), 7,72 (s, 1H), 2,94 (s, 3H), 2,86 (s, 1H), 1,86 (s, 6H). LC-MS m/z: 326,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,40 мин.
5-(3-Циклопропоксифенил)-7-метил-N-(2-метилбут-3-ин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
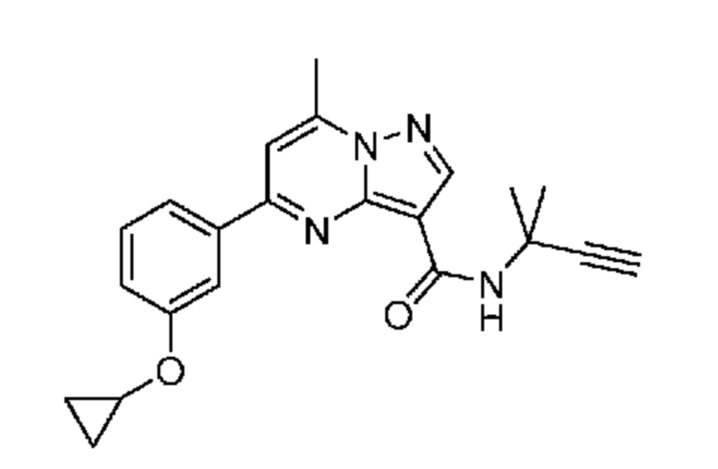
[00474] По общей методике A 5-(3-циклопропоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,10 ммоля) и 2-метилбут-3-ин-2-амин давали искомое соединение (22,2 мг, 61%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,56 (s, 1H), 8,45 (s, 1H), 7,93 (s, 1H), 7,90-7,88 (m, 2H), 7,56 (t, J=8,0 Гц, 1H), 7,32 (dd, J=8,0 Гц, 2,5 Гц, 1H), 4,01-3,98 (m, 1H), 3,31 (s, 1H), 2,85 (s, 3H), 1,74 (s, 6H), 0,87-0,83 (m, 2H), 0,73-0,70 (m, 2H). LC-MS m/z: 375,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,95 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3-(диметилкарбамоил)фенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
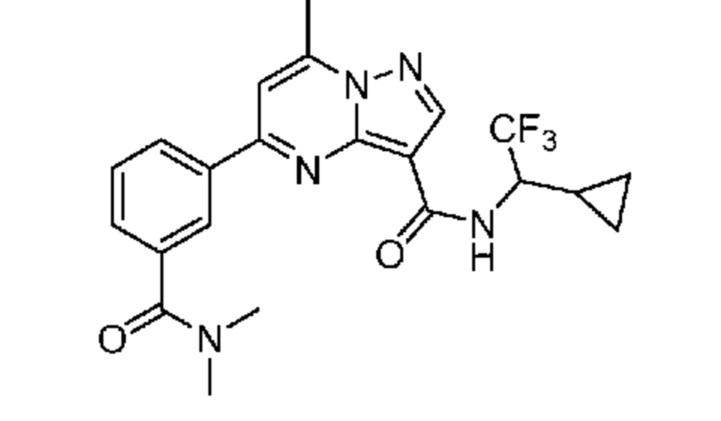
[00475] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,15 ммоля) и 3-(диметилкарбамоил)фенилбороновая кислота давали искомое соединение (36 мг, 45%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,68 (s, 1H), 8,58 (d, J=9,5 Гц, 1H), 8,31 (d, J=8,0 Гц, 1H), 8,27 (s, 1H), 8,05 (s, 1H), 7,74 (t, J=7,5 Гц, 1H), 7,64 (d, J=7,5 Гц, 1H), 4,51-4,46 (m, 1H), 3,04 (s, 3H), 2,95 (s, 3H), 2,87 (s, 3H), 1,28-1,24 (m, 1H), 0,71-0,67 (m, 1H), 0,60-0,56 (m, 2H), 0,41-0,38 (m, 1H). LC-MS m/z: 446,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,54 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(3-(метилкарбамоил)фенил)пиразоло[1,5-a]пиримидин-3-карбоксамид
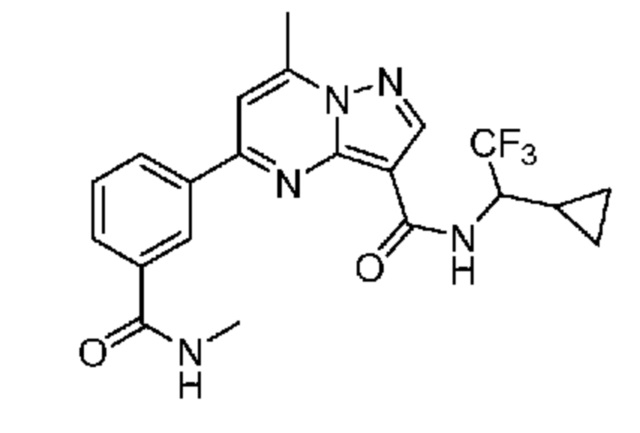
[00476] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,15 ммоля) и 3-(метилкарбамоил)фенилбороновая кислота давали искомое соединение (13 мг, 15%) в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 8,71 (s, 1H), 8,68 (s, 1H), 8,64-8,61 (m, 2H), 8,37 (d, J=7,5 Гц, 1H), 8,02 (d, J=7,5 Гц, 1H), 8,017 (s, 1H), 7,72 (t, J=7,5 Гц, 1H), 4,43-4,38 (m, 1H), 2,89 (s, 3H), 2,83 (d, J=4,5 Гц, 3H), 1,39-1,35 (m, 1H), 0,72-0,68 (m, 1H), 0,63-0,59 (m, 2H), 0,41-0,38 (m, 1H). LC-MS m/z: 432,2 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=7,28 мин.
5-(3-(1H-Пиразол-1-ил)фенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
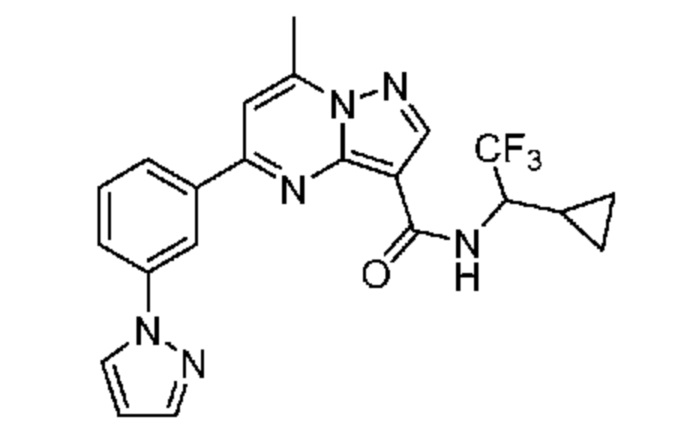
[00477] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,15 ммоля) и 3-(1H-пиразол-1-ил)фенилбороновая кислота давали искомое соединение (17 мг, 20%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,78 (s, 1H), 8,69 (s, 1H), 8,67-8,64 (m, 2H), 8,18 (d, J=8,0 Гц, 1H), 8,09-8,08 (m, 2H), 7,78-7,75 (m, 2H), 6,62 (t, J=2,5 Гц, 1H), 4,41-4,36 (m, 1H), 2,90 (s, 3H), 1,48-1,42 (m, 1H), 0,77-0,72 (m, 1H), 0,66-0,60 (m, 2H), 0,42-0,37 (m, 1H). LC-MS m/z: 441,1 [M+H]+. HPLC: Чистота (254 нм): 99%; tR=8,73 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(3-(оксазол-2-ил)фенил)пиразоло[1,5-a]пиримидин-3-карбоксамид
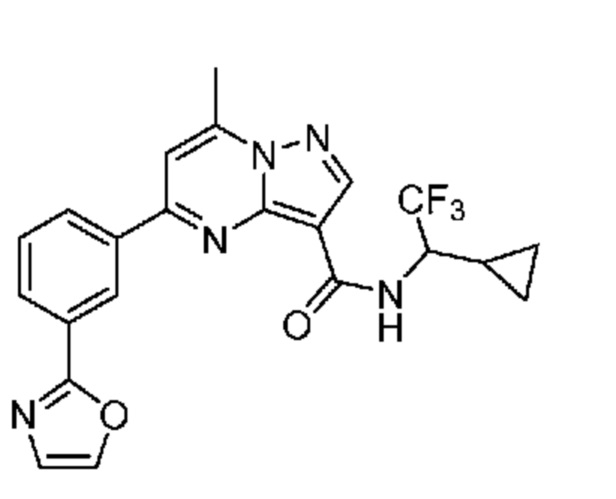
[00478] По общей методике D этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (1,98 г, 8,27 ммоля) и 3-бромфенилбороновая кислота давали этил-5-(3-бромфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (108 мг, 4%) в виде коричневого твердого вещества. LC-MS m/z: 360,0 [M+H]+. tR=1,63 мин.
[00479] По общей методике B этил-5-(3-бромфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (108 мг, 0,3 ммоля) давал 5-(3-бромфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (75 мг, 75%) в виде светло-коричневого твердого вещества. LC-MS m/z: 332,0 [M+H]+. tR=0,98 мин.
[00480] По общей методике A 5-(3-бромфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (75 мг, 0,23 ммоля) и 1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали 5-(3-бромфенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (91 мг, 89%) в виде светло-желтого твердого вещества. LC-MS m/z: 453,1 [M+H]+. tR=1,70 мин.
[00481] По общей методике F 5-(3-бромфенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (34 мг, 0,08 ммоля) и 2-(трибутилстаннил)оксазол давали искомое соединение (11,2 мг, 34%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,89 (s, 1H), 8,68 (s, 1H), 8,65 (d, J=9,6 Гц, 1H), 8,38 (d, J=8,0 Гц, 1H), 8,27 (s, 1H), 8,20 (d, J=8,0 Гц, 1H), 8,07 (s, 1H), 7,80 (d, J=8,0 Гц, 1H), 7,44 (s, 1H), 4,46-4,36 (m, 1H), 2,89 (s, 3H), 1,45-1,37 (m, 1H), 0,79-0,70 (m, 1H), 0,68-0,60 (m, 2H), 0,45-0,36 (m, 1H). LC-MS m/z: 442,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=8,88 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(3-(пиримидин-2-ил)фенил)пиразоло[1,5-a]пиримидин-3-карбоксамид
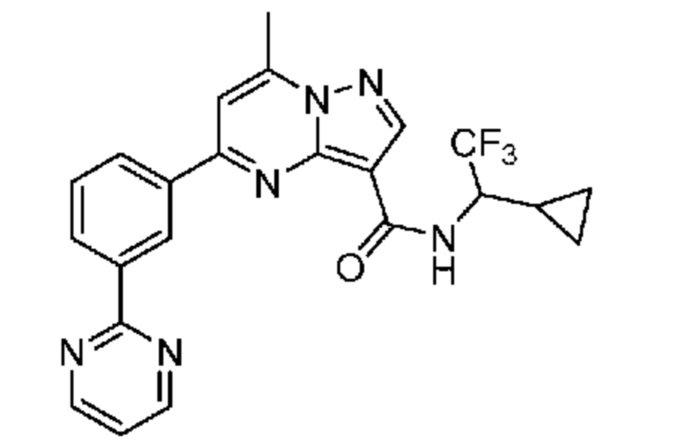
[00482] По общей методике F 5-(3-бромфенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (72 мг, 0,16 ммоля) и 2-(трибутилстаннил)пиримидин давали искомое соединение (2,1 мг, 3%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 9,40 (s, 1H), 8,90 (d, J=4,8 Гц, 2H), 8,75 (d, J=9,6 Гц, 1H), 8,68 (s, 1H), 8,61 (d, J=8,0 Гц, 1H), 8,41 (d, J=8,0 Гц, 1H), 8,06 (s, 1H), 7,79 (t, J=8,0 Гц, 1H), 7,52 (t, J=4,8 Гц, 1H), 4,45-4,34 (m, 1H), 2,90 (s, 3H), 1,53-1,45 (m, 1H), 0,80-0,73 (m, 1H), 0,69-0,58 (m, 2H), 0,46-0,37 (m, 1H). LC-MS m/z: 453,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,08 мин.
5-(Бензо[d]оксазол-4-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
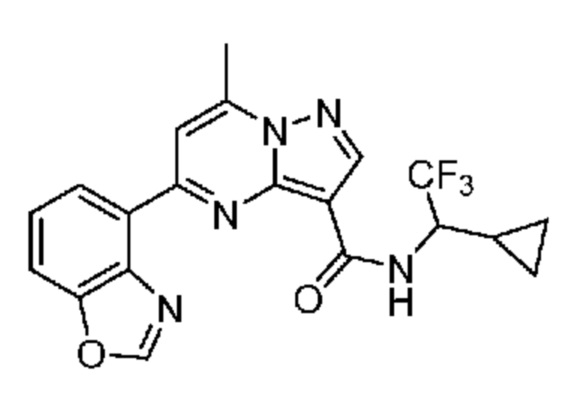
[00483] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (110 мг, 0,45 ммоля) и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол давали искомое соединение (1,5 мг, 1,1%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,04 (s, 1H), 8,86 (d, J=9,5 Гц, 1H), 8,70 (s, 1H), 8,44 (s, 1H), 8,31 (d, J=8,0 Гц, 1H), 8,07 (d, J=8,0 Гц, 1H), 7,72 (t, J=8,0 Гц, 1H), 4,48-4,40 (m, 1H), 2,93 (s, 3H), 1,39-1,35 (m, 1H), 0,72-0,68 (m, 1H), 0,63-0,55 (m, 2H), 0,41-0,38 (m, 1H). LC-MS m/z: 416,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,83 мин.
5-(Бензо[d]оксазол-5-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
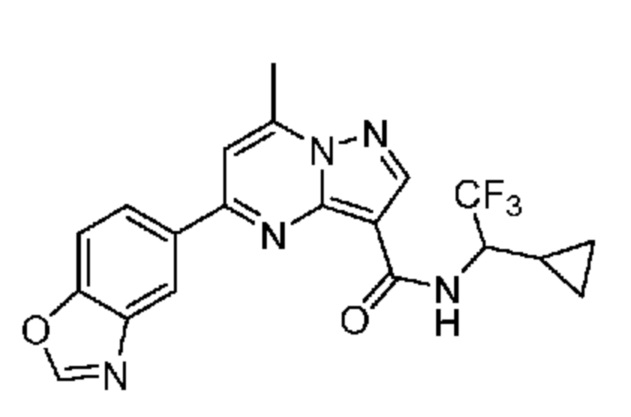
[00484] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (210 мг, 35% чистота, 0,23 ммоля) и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол давали искомое соединение (37 мг, 28%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,65 (s, 1H), 8,638 (s, 1H), 8,636 (s, 1H), 8,38 (d, J=9,0 Гц, 1H), 7,92 (d, J=9,0 Гц, 1H), 7,87 (s, 1H), 4,49-4,43 (m, 1H), 2,97 (s, 3H), 1,39-1,33 (m, 1H), 0,83-0,78 (m, 1H), 0,72-0,66 (m, 1H), 0,64-0,58 (m, 1H), 0,56-0,50 (m, 1H). LC-MS m/z: 416,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=9,07 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(6-фторпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
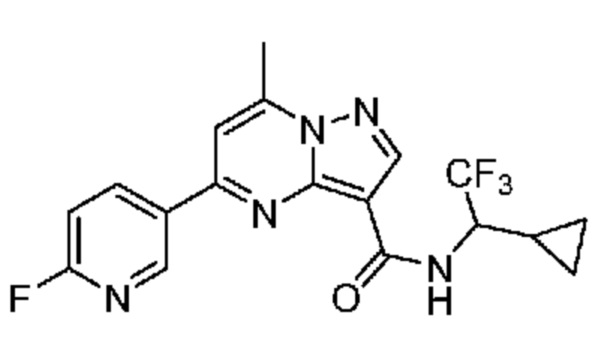
[00485] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 6-фторпиридин-3-илбороновая кислота давали искомое соединение (26 мг, 27%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,11 (d, J=2,5 Гц, 1H), 8,76 (td, J=8,0 Гц, 2,5 Гц, 1H), 8,70 (s, 1H), 8,48 (d, J=9,5 Гц, 1H), 8,04 (s, 1H), 7,53 (dd, J=9,0 Гц, 2,5 Гц, 1H), 4,46-4,40 (m, 1H), 2,88 (s, 3H), 1,34-1,29 (m, 1H), 0,71-0,67 (m, 1H), 0,62-0,57 (m, 2H), 0,38-0,36 (m, 1H). LC-MS m/z: 394,1 [M+H]+. HPLC: Чистота (254 нм): 98%; tR=8,39 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(2-фторпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
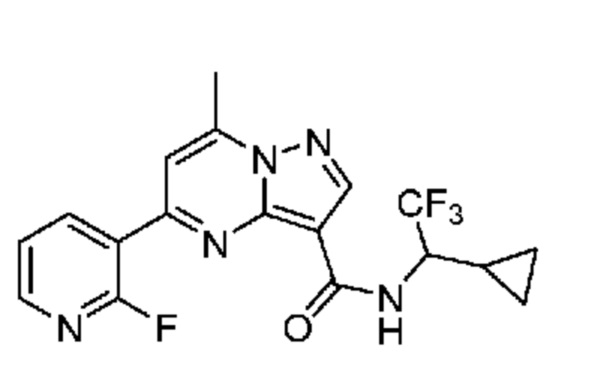
[00486] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,3 ммоля) и 2-фторпиридин-3-илбороновая кислота давали искомое соединение (13 мг, 11%) в виде почти белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,74 (s, 1H), 8,60 (t, J=8,8 Гц, 1H), 8,51-8,47 (m, 2H), 7,81 (s, 1H), 7,67 (d, J=6,0 Гц, 1H), 4,49-4,38 (m, 1H), 2,90 (s, 3H), 1,29-1,20 (m, 1H), 0,71-0,64 (m, 1H), 0,60-0,52 (m, 2H), 0,40-0,31 (m, 1H). LC-MS m/z: 394,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=8,26 мин.
(R)-N-(1-Циклопропилэтил)-5-(4-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
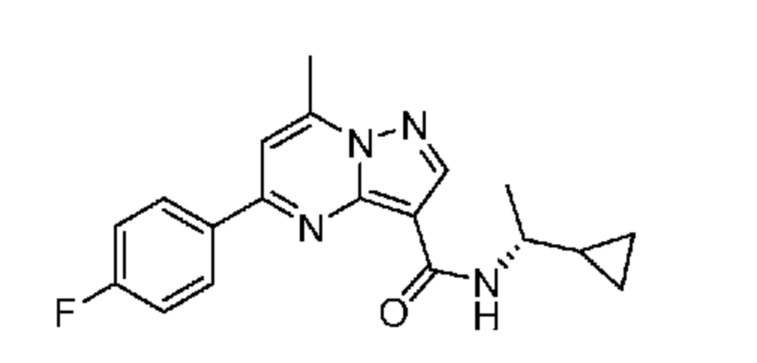
[00487] По общей методике D (R)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,29 ммоля) и 4-фторфенилбороновая кислота давали искомое соединение (42,6 мг, 43%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,56 (s, 1H), 8,33 (dd, J=8,5 Гц, 2,0 Гц, 2H), 8,16 (d, J=7,5 Гц, 1H), 7,90 (d, J=1,0 Гц, 1H), 7,49 (td, J=9,0 Гц, 2,5 Гц, 2H), 3,63-3,59 (m, 1H), 2,85 (s, 3H), 1,29 (d, J=6,5 Гц, 3H), 1,12-1,09 (m, 1H), 0,54-0,48 (m, 2H), 0,39-0,31(m, 2H). LC-MS m/z: 339,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,76 мин.
(R)-N-(1-Циклопропилэтил)-7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
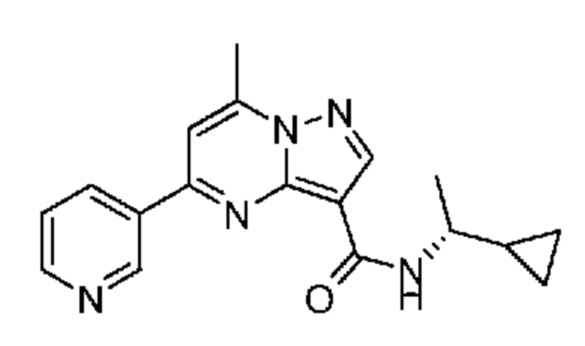
[00488] По общей методике D (R)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,36 ммоля) и пиридин-3-илбороновая кислота давали искомое соединение (31 мг, 27%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,45 (d, J=2,5 Гц, 1H), 8,78 (dd, J=4,0 Гц, 1,0 Гц, 1H), 8,60 (t, J=2,0 Гц, 1H), 8,59 (s, 1H), 8,12 (d, J=7,5 Гц, 1H), 7,98 (s, 1H), 7,67 (dd, J=8,0 Гц, 5,0 Гц, 1H), 3,63-3,59 (m, 1H), 2,86 (s, 3H), 1,29 (d, J=6,5 Гц, 3H), 1,28-1,08 (m, 1H), 0,54 -0,45 (m, 2H), 0,39-0,20 (m, 2H). LC-MS m/z: 322,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=6,93 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
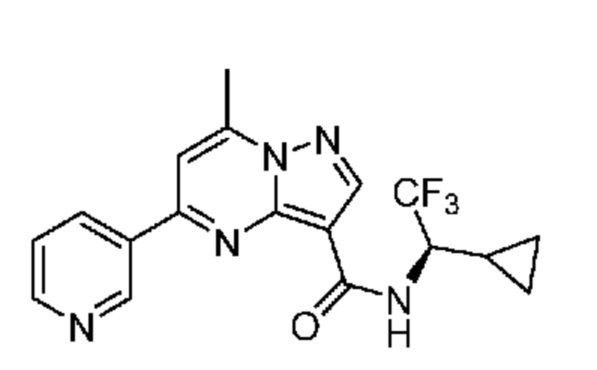
[00489] По общей методике A 7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (100 мг, 0,39 ммоля) и (R)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (47 мг, 32%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 9,30 (d, J=2,0 Гц, 1H), 8,65 (dd, J=4,5 Гц, 1,0 Гц, 1H), 8,55 (s, 1H), 8,53 (d, J=8,5 Гц, 1H), 7,72 (s, 1H), 7,58 (dd, J=8,0 Гц, 4,5 Гц, 1H), 4,35-4,28 (m, 1H), 2,86 (s, 3H), 1,24-1,18 (m, 1H), 0,70-0,64 (m, 1H), 0,58-0,46 (m, 2H), 0,42-0,37 (m, 1H). LC-MS m/z: 376,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,69 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
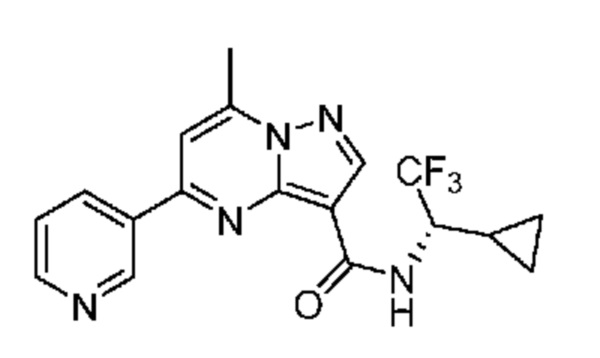
[00490] По общей методике A 7-метил-5-(пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (100 мг, 0,39 ммоля) и (S)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (27 мг, 19%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 9,30 (d, J=2,0 Гц, 1H), 8,65 (dd, J=4,5 Гц, 1,0 Гц, 1H), 8,55 (s, 1H), 8,53 (d, J=8,5 Гц, 1H), 7,72 (s, 1H), 7,58 (dd, J=8,0 Гц, 4,5 Гц, 1H), 4,35-4,28 (m, 1H), 2,86 (s, 3H), 1,24-1,18 (m, 1H), 0,70-0,64 (m, 1H), 0,58-0,46 (m, 2H), 0,42-0,37 (m, 1H). LC-MS m/z: 376,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,69 мин.
(R)-5-(3-Метоксифенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
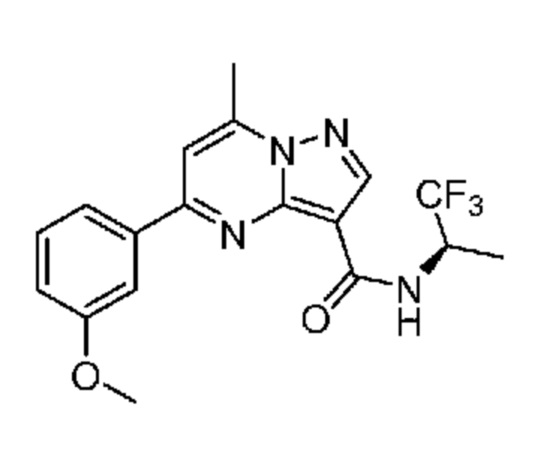
[00491] По общей методике A 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (422 мг, 2 ммоля) и (R)-1,1,1-трифторпропан-2-амингидрохлорид давали (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (489 мг, 80%) в виде бледно-желтого твердого вещества. LC-MS m/z: 307,0 [M+H]+. Чистота (254 нм): 98,7%; tR=1,78 мин.
[00492] По общей методике D (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (45 мг, 0,15 ммоля) и 3-метоксифенилбороновая кислота давали искомое соединение (15 мг, 26%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,66 (s, 1 H), 8,49 (d, J=9,0 Гц, 1H), 7,98 (s, 1 H), 7,83 (d, J=7,5 Гц, 1H), 7,80 (s, 1 H), 7,55 (t, J=8,0 Гц, 1H), 7,19 (dd, J=8,0 Гц, 2,5 Гц, 1H), 5,01-4,96 (m, 1 H), 3,89 (s, 3H), 2,87 (s, 3H), 1,44 (d, J=7,0 Гц, 3H). LC-MS m/z: 379,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,81 мин.
(S)-5-(3-Метоксифенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
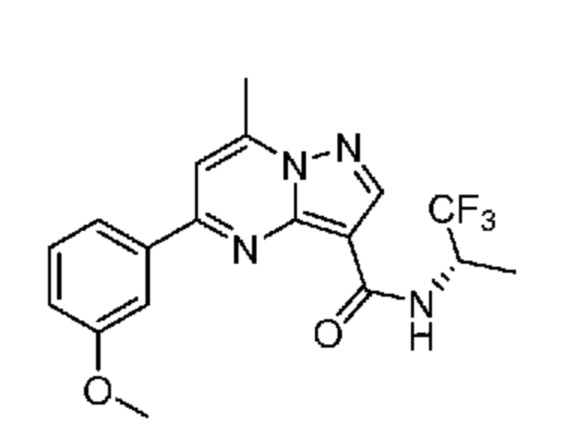
[00493] По общей методике A 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (515 мг, 2,43 ммоля) и (S)-1,1,1-трифторпропан-2-амингидрохлорид давали (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (371 мг, 50%) в виде белого твердого вещества. LC-MS m/z: 307,0 [M+H]+. tR=1,79 мин.
[00494] По общей методике D (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,2 ммоля) и 3-метоксифенилбороновая кислота давали искомое соединение (53 мг, 72%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,67 (s, 1H), 8,50 (d, J=9,5 Гц, 1H), 7,98 (s, 1H), 7,83 (d, J=7,5 Гц, 1H), 7,80 (s, 1H), 7,55 (t, J=8,0 Гц, 1H), 7,20 (dd, J=8,0 Гц, 2,0 Гц, 1H), 5,00-4,97 (m, 1H), 3,89 (s, 3H), 2,87 (s, 3H), 1,45 (d, J=7,0 Гц, 3H). LC-MS m/z: 379,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,81 мин.
(R)-N-(1-Циклопропилэтил)-5-(3-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
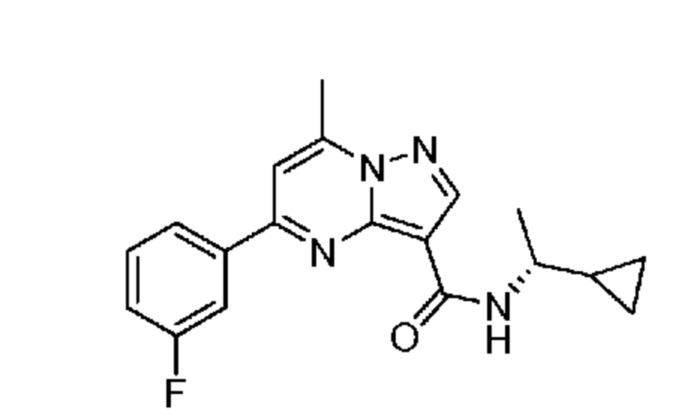
[00495] По общей методике D (R)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,29 ммоля) и 3-фторфенилбороновая кислота давали искомое соединение (53 мг, 54%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,59 (s, 1H), 8,14 (t, J=9,0 Гц, 2H), 8,09 (dt, J=10,5 Гц, 1,5 Гц, 1H), 7,96 (s, 1H), 7,69 (dd, J=14,5 Гц, 8,0Hz, 1H), 7,47 (td, J=8,5 Гц, 2,5 Гц, 1H), 3,66-3,61 (m, 1H), 2,86 (s, 3H), 1,28 (d, J=6,0 Гц, 3H), 1,11-1,09 (m, 1H), 0,55-0,48 (m, 2H), 0,41-0,38 (m, 1H), 0,36-0,33 (m, 1H). LC-MS m/z: 339,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,79 мин.
(R)-5-(3-Цианофенил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
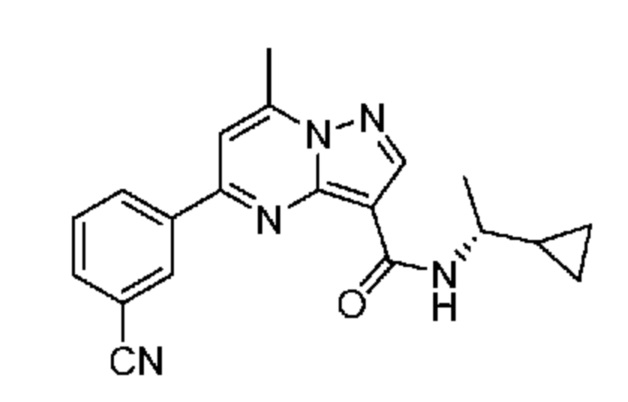
[00496] По общей методике D (R)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,21 ммоля) и 3-цианофенилбороновая кислота давали искомое соединение (44 мг, 60%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,71 (t, J=1,5 Гц, 1H), 8,61 (s, 1H), 8,59 (dt, J=8,0 Гц, 1,0 Гц, 1H), 8,13 (d, J=7,5 Гц, 1H), 8,08 (dt, J=7,5 Гц, 1,0 Гц, 1H), 8,04 (s, 1H), 7,86 (t, J=7,5 Гц, 1H), 3,64-3,60 (m, 1H), 2,87 (s, 3H), 1,29 (d, J=6,5 Гц, 3H), 1,16-1,11 (m, 1H), 0,55-0,50 (m, 2H), 0,41-0,34 (m, 2H). LC-MS m/z: 346,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,11 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3,3-дифторпиперидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
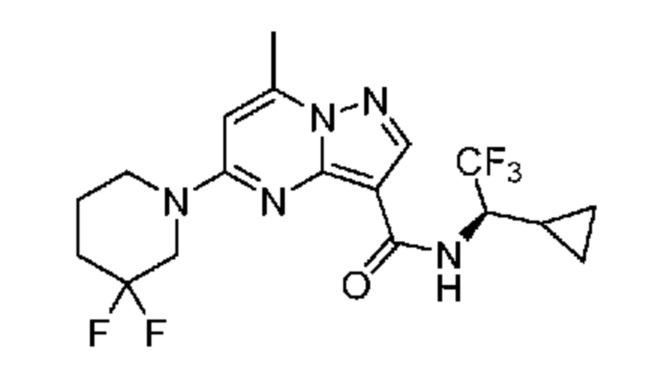
[00497] По общей методике G (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (20 мг, 0,06 ммоля) и 3,3-дифторпиперидингидрохлорид давали искомое соединение (12 мг, 48%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,26 (s, 1H), 8,25 (d, J=9,5 Гц, 1H), 7,05 (s, 1H), 4,45-4,40 (m, 1H), 4,16-4,10 (m, 2H), 3,82-3,77 (m, 2H), 2,63 (s, 3H), 2,20-2,11 (m, 2H), 1,81-1,74 (m, 2H), 1,89-1,12 (m, 1H), 0,68-0,62 (m, 1H), 0,57-0,47 (m, 2H), 0,36-0,32 (m, 1H). LC-MS m/z: 418,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,32 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3,3-дифторпиперидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
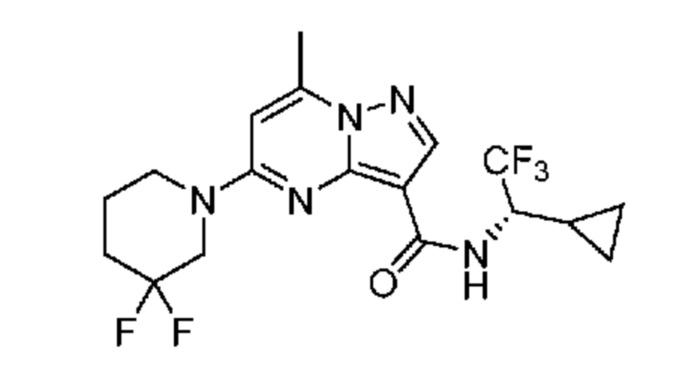
[00498] По общей методике G (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (25 мг, 0,06 ммоля) и 3,3-дифторпиперидингидрохлорид давали искомое соединение (28 мг, 89%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,27 (s, 1H), 8,25 (s, 1H), 7,05 (s, 1H), 4,43 (q, J=8,0 Гц, 1H), 4,13 (td, J=12,0 Гц, 2,5 Гц, 2H), 3,79 (s, 2H), 2,63 (s, 3H), 2,20-2,12 (m, 2H), 1,80-1,76 (m, 2H), 1,18-1,13 (m, 1H), 0,68-0,62 (m, 1H), 0,57-0,48 (m, 2H), 0,37-0,32 (m, 1H). LC-MS m/z: 418,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,33 мин.
5-(3-Метоксифенил)-7-метил-N-(1,1,1-трифторбут-3-ин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
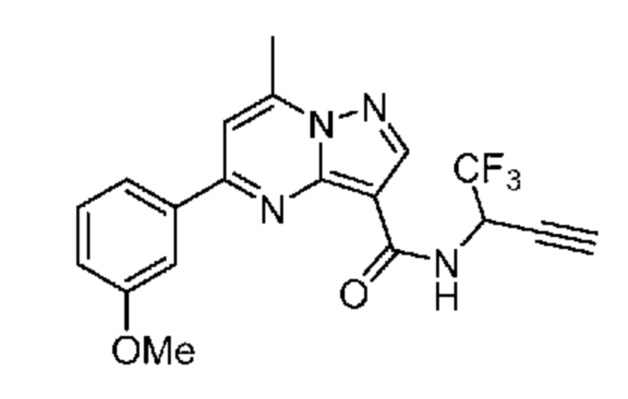
[00499] По общей методике A 5-(3-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,14 ммоля) и 1,1,1-трифторбут-3-ин-2-амин давали искомое соединение (7,0 мг, 9%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,94 (d, J=11,2 Гц, 1H), 8,70 (s, 1H), 8,01 (s, 1H), 7,84 (d, J=8,0 Гц, 1H), 7,82-7,80 (m, 1H), 7,54 (t, J=8,0 Гц, 1H), 7,20 (dd, J=8,0 Гц, 1,2 Гц, 1H), 6,05-5,95 (m, 1H), 3,88 (s, 3H), 3,87 (d, J=3,0 Гц, 1H), 2,86 (s, 3H). LC-MS m/z: 389,1 [M+H]+. HPLC: Чистота (214 нм): 98%; tR=8,86 мин.
(R)-5-(2-Фтор-5-метоксифенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
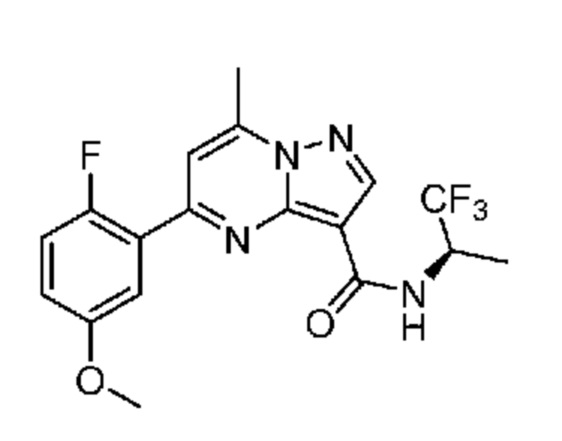
[00500] По общей методике D (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (62 мг, 0,2 ммоля) и 2-фтор-5-метоксифенилбороновая кислота давали искомое соединение (50 мг, 63%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,70 (s, 1 H), 8,44 (d, J=9,5 Гц, 1H), 7,73 (s, 1 H), 7,58 (q, J=3,0 Гц, 1H), 7,41 (dd, J=11,5 Гц, 9,5 Гц, 1H), 7,20 (dt, J=9,0 Гц, 3,5 Гц, 1H), 4,98-4,94 (m, 1H), 3,85 (s, 3H), 2,88 (s, 3H), 1,40 (d, J=7,0 Гц, 3H). LC-MS m/z: 397,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,93 мин.
(S)-5-(2-Фтор-5-метоксифенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
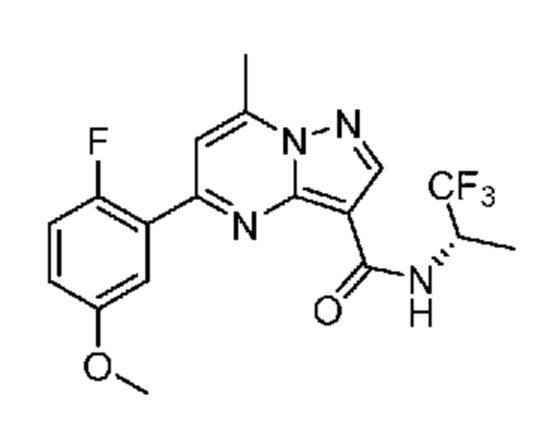
[00501] По общей методике D (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (90 мг, 0,29 ммоля) и 2-фтор-5-метоксифенилбороновая кислота давали искомое соединение (67 мг, 58%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,71 (s, 1H), 8,44 (d, J=9,5 Гц, 1H), 7,74 (s, 1H), 7,58 (q, J=3,0 Гц, 1H), 7,41 (dd, J=11,5 Гц, 9,5 Гц, 1H), 7,20 (dt, J=9,0 Гц, 3,5 Гц, 1H), 5,00-4,93 (m, 1H), 3,85 (s, 3H), 2,88 (s, 3H), 1,41 (d, J=7,5 Гц, 3H). LC-MS m/z: 397,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,96 мин.
5-(3-Хлорфенил)-7-метил-N-(1,1,1-трифторбут-3-ин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
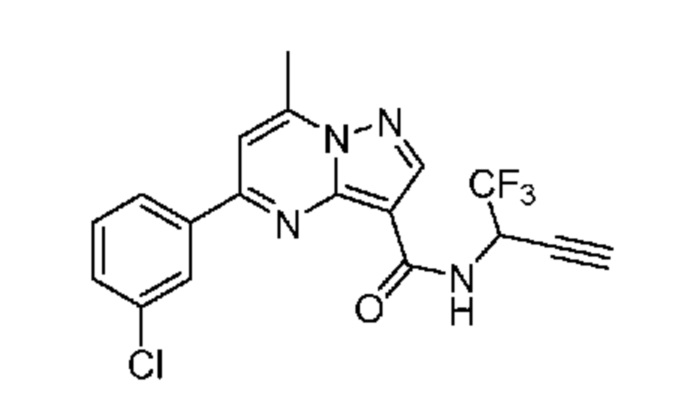
[00502] По общей методике A 5-(3-хлорфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (100 мг, 0,35 ммоля) и 1,1,1-трифторбут-3-ин-2-амин давали искомое соединение (44,3 мг, 27%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,94 (d, J=9,0 Гц, 1H), 8,74 (s, 1H), 8,31 (s, 1H), 8,22 (d, J=8,0 Гц, 1H), 8,06 (s, 1H), 7,70 (d, J=8,0 Гц, 1H), 7,67 (t, J=8,0 Гц, 1H), 6,02-5,97 (m, 1H), 3,87 (t, J=2,5 Гц, 1H), 2,87 (s, 3H). LC-MS m/z: 393,1 [M+H]+. Чистота по данным LC-MS (214 нм): > 99%; tR=9,24 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(изотиазол-5-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
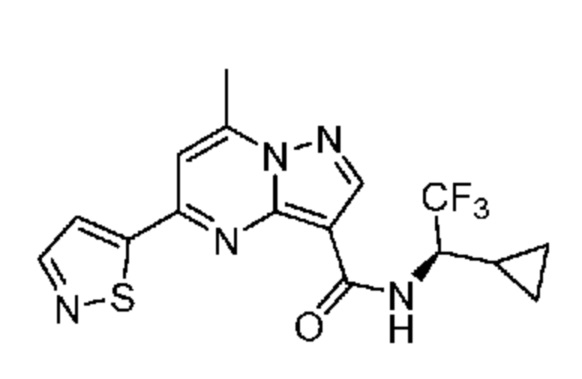
[00503] По общей методике E* (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (75 мг, 0,226 ммоля) и 5-бромизотиазол давали искомое соединение (4,3 мг, 5%) в виде светло-желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,81 (s, 1H), 8,71 (s, 1H), 8,28 (s, 1H), 8,26 (d, J=10,0 Гц, 1H), 7,98 (s, 1H), 4,50-4,45 (m, 1H), 2,87 (s, 3H), 1,31-1,29 (m, 1H), 0,71-0,57 (m, 3H), 0,43-0,41 (m, 1H). LC-MS m/z: 382,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,34 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(изотиазол-5-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
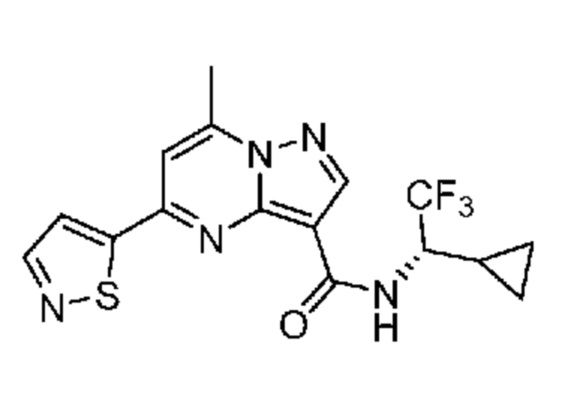
[00504] По общей методике E* (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и 5-бромизотиазол давали искомое соединение (35 мг, 31%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,81 (d, J=1,5 Гц, 1H), 8,72 (s, 1H), 8,28 (d, J=1,5 Гц, 1H), 8,27 (d, J=9,5 Гц, 1H), 7,98 (s, 1H), 4,50-4,47 (m, 1H), 2,87 (s, 3H), 1,32-1,27 (m, 1H), 1,07-1,03 (m, 1H), 0,73-0,56 (m, 3H), 0,45-0,40 (m, 1H). LC-MS m/z: 382,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,33 мин.
5-(3-(1H-Имидазол-2-ил)фенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
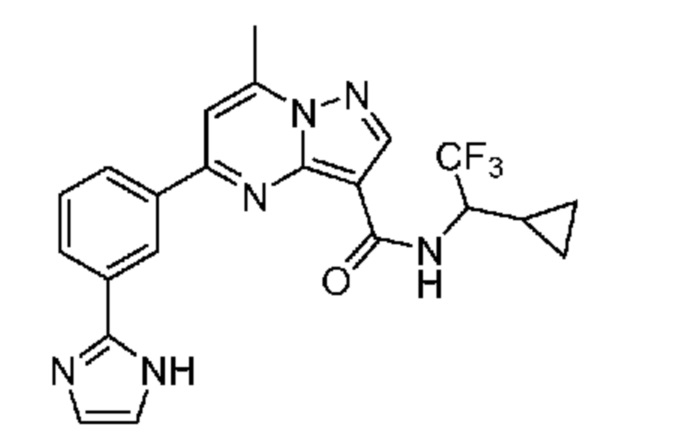
[00505] Смесь 5-(3-цианофенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамида (70 мг, 0,18 ммоля), NaOMe (28 мг, 0,53 ммоля) в MeOH (15 мл) перемешивали при 40°C в течение 16 ч, затем добавляли 2,2-диметоксиэтанамин (21 мг, 0,21 ммоля) и AcOH (420 мг, 7 ммоля) и смесь перемешивали при 65°C в течение 2 ч. Затем добавляли 6 н. HCl (1,4 мл) и смесь перемешивали при 80°C в течение 16 ч, охлаждали и полученную суспензию фильтровали и фильтрат концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ (MeCN/NH4HCO3) и получали искомое соединение (2,5 мг, 2%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,91 (s, 1H), 8,71 (d, J=9,6 Гц, 1H), 8,68 (s, 1H), 8,19 (d, J=7,2 Гц, 1H), 8,11 (d, J=7,2 Гц, 1H), 7,98 (s, 1H), 7,71 (t, J=7,2 Гц, 1H), 7,34 (s, 1H), 7,04 (s, 1H), 4,38-4,30 (m, 1H), 2,90 (s, 3H), 1,570-1,48 (m, 1H), 0,78-0,60 (m, 3H), 0,43-0,35 (m, 1H). LC-MS m/z: 441,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,53 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(3-(пиримидин-2-илокси)фенил)пиразоло[1,5-a]пиримидин-3-карбоксамид
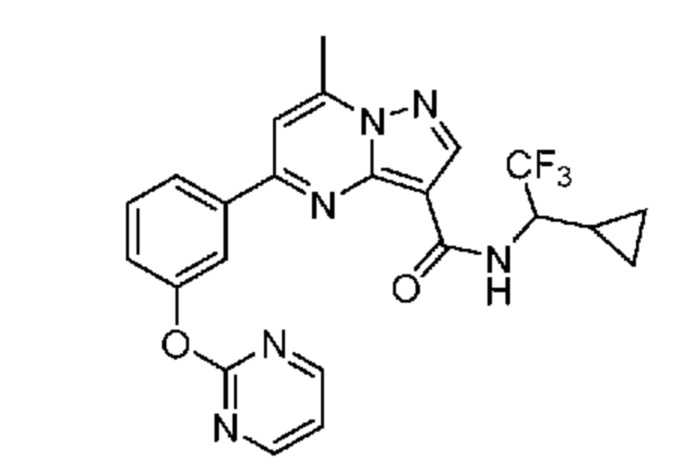
[00506] По общей методике E* этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (572 мг, 2,39 ммоля) и 2-(3-бромфенокси)пиримидин давали этил-7-метил-5-(3-(пиримидин-2-илокси)фенил)пиразоло[1,5-a]пиримидин-3-карбоксилат (101 мг, 22%) в виде желтого твердого вещества. LC-MS m/z: 376,1 [M+H]+. Чистота по данным LC-MS (214 нм): > 96%; tR=1,71 мин.
[00507] К раствору этил-7-метил-5-(3-(пиримидин-2-илокси)фенил)пиразоло[1,5-a]пиримидин-3-карбоксилата (86 мг, 0,23 ммоля) в толуоле (2 мл) добавляли бис(три-н-бутилолово)оксид (273 мг, 0,46 ммоля). Смесь нагревали при 100°C в течение 10 дней и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле (от 0 до 10% MeOH/EA) и получали 7-метил-5-(3-(пиримидин-2-илокси)фенил)пиразоло[1,5-a]пиримидин-3-карбоновую кислоту (39 мг, 49%) в виде желтого твердого вещества. LC-MS m/z: 343,1 [M+H]+. Чистота по данным LC-MS (214 нм): > 93%; tR=1,46 мин.
[00508] По общей методике A 7-метил-5-(3-(пиримидин-2-илокси)фенил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (36 мг, 0,10 ммоля) и 1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (1,5 мг, 3%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,65 (d, J=4,5 Гц, 2H), 8,62 (s, 1H), 8,17 (d, J=8,0 Гц, 1H), 8,11 (s, 1H), 7,82 (s, 1H), 7,71 (t, J=8,0 Гц, 1H), 7,46 (dd, J=8,5 Гц, 2,0 Гц, 1H), 7,28 (t, J=4,5 Гц, 1H), 4,43-4,38 (m, 1H), 2,95 (s, 3H), 1,13-1,06 (m, 1H), 0,71-0,67 (m, 1H), 0,62-0,51 (m, 2H), 0,49-0,44 (m, 1H). LC-MS m/z: 469,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,17 мин.
5-(Бензо[d]оксазол-7-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
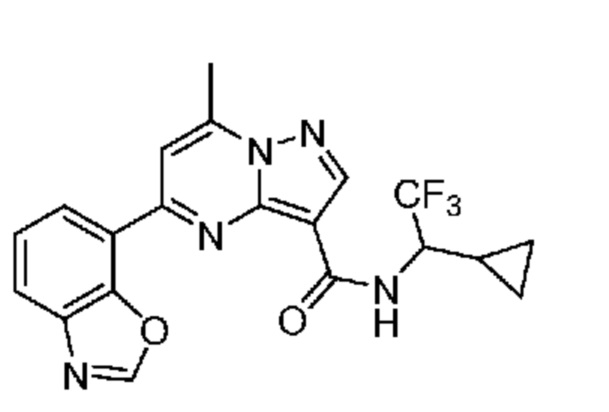
[00509] Смесь 7-бромбензо[d]оксазола (500 мг, 2,53 ммоля), 2-этилгексаноата натрия (1,05 г, 6,325 ммоля), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) (771 мг, 3,1 ммоля) и Pd(dppf)Cl2•CH2Cl2 (206 мг, 0,253 ммоля) в толуоле (15 мл) перемешивали при 110(C в течение 16 ч и концентрировали в вакууме и получали неочищенный 7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол (2,5 г) в виде желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC-MS m/z: 255,1 [M+H]+; tR=0,74 мин.
[00510] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,3 ммоля) и неочищенный 7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол (800 мг) давали искомое соединение (33,6 мг, 10%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,92 (s, 1H), 8,72 (s, 1H), 8,71 (d, J=8,0 Гц, 1H), 8,28 (d, J=8,0 Гц, 1H), 8,08 (d, J=8,0 Гц, 1H), 8,07 (s, 1H), 7,67 (t, J=8,0 Гц, 1H), 4,48-4,43 (m, 1H), 2,92 (s, 3H), 1,34-1,32 (m, 1H) 0,72-0,70 (m, 1H), 0,62-0,58 (m, 2H), 0,38-0,36 (m, 1H). LC-MS m/z: 416,1 [M+H]+. Чистота по данным LC-MS (214 нм): 98%; tR=8,34 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(6-метоксипиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
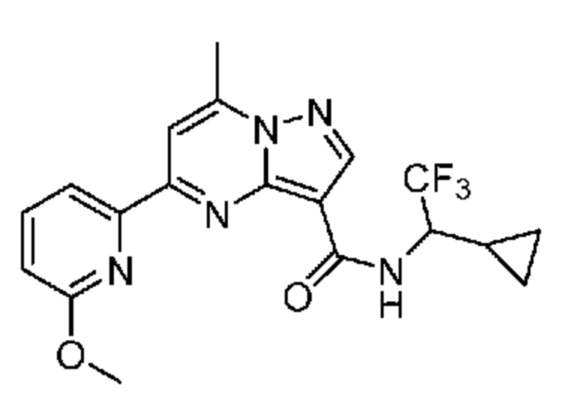
[00511] По общей методике F этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (200 мг, 0,84 ммоля) и 2-метокси-6-(трибутилстаннил)пиридин давали этил-5-(6-метоксипиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (220 мг, 84%) в виде желтого твердого вещества. LC-MS m/z: 313,1 [M+H]+. Чистота (214 нм): 79,4%; tR=1,87 мин.
[00512] По общей методике B* этил-5-(6-метоксипиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (200 мг, 0,64 ммоля) давал 5-(6-метоксипиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (154 мг, 84%). LC-MS m/z: 285,1 [M+H]+. Чистота (214 нм): 54,51%; tR=1,26 мин.
[00513] По общей методике A 5-(6-метоксипиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (120 мг, 0,53 ммоля) и 1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (94 мг, 47%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,71 (s, 1H), 8,56 (d, J=9,5 Гц, 1H), 8,18 (s, 1H), 8,04-8,04 (m, 2H), 7,08 (dd, J=7,0 Гц, 2,0 Гц, 1H), 4,48-4,42 (m, 1H), 4,07 (s, 3H), 2,92 (s, 3H), 1,40-1,31 (m, 1H), 0,72-0,65 (m, 1H), 0,63-0,58 (m, 2H), 0,42-0,38 (m, 1H). LC-MS m/z: 406,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,46 мин.
5-(3-Хлор-1H-пиразол-1-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
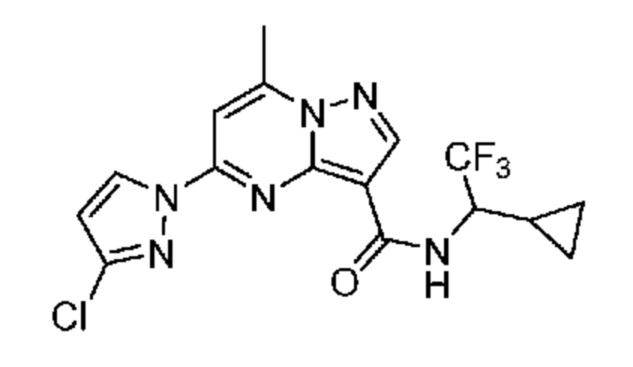
[00514] По общей методике G 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (166 мг, 0,5 ммоля) и 3-хлор-1H-пиразол давали искомое соединение (45 мг, 19%) в виде почти белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,72 (d, J=3,0 Гц, 1H), 4,33-4,28 (m, 1H), 2,88 (s, 3H), 1,46-1,40 (m, 1H), 0,73-0,68 (m, 1H), 0,62-0,52 (m, 2H), 0,40-0,35 (m, 1H). LC-MS m/z: 399,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,16 мин.
(R)-5-(Бензо[d]оксазол-5-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
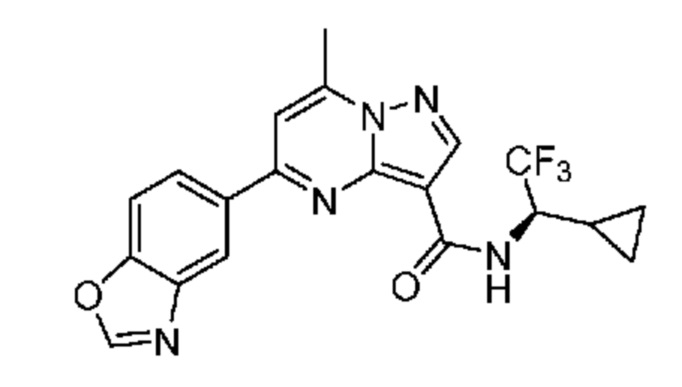
[00515] По общей методике D (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,22 ммоля) и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол давали искомое соединение (63 мг, 67%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,92 (s, 1H), 8,70 (d, J=1,6 Гц, 1H), 8,67 (s, 1H), 8,64 (d, J=5,6 Гц, 1H), 8,36 (dd, J=8,8 Гц, 1,6 Гц, 1H), 8,11 (s, 1H), 8,05 (d, J=8,8 Гц, 1H), 4,52-4,46 (m, 1H), 2,88 (s, 3H), 1,33-1,27 (m, 1H), 0,73-0,67 (m, 1H), 0,63-0,56 (m, 2H), 0,45-0,40 (m, 1H). LC-MS m/z: 416,1 [M+H]+. HPLC: Чистота (214 нм): 97,37%; tR=8,33 мин.
(S)-5-(Бензо[d]оксазол-5-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
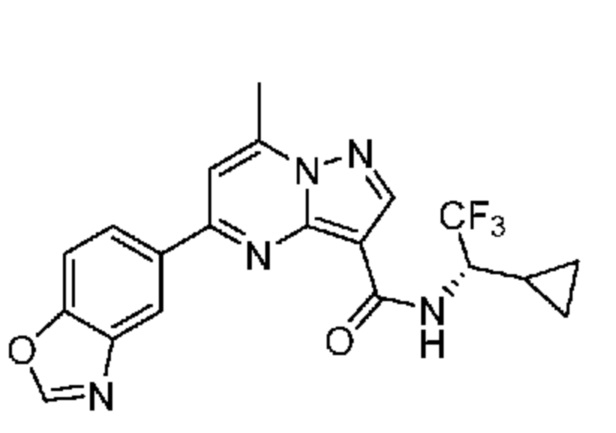
[00516] По общей методике D (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,22 ммоля) и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол давали искомое соединение (63 мг, 67%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,91 (s, 1H), 8,70 (d, J=1,5 Гц, 1H), 8,67 (s, 1H), 8,62 (d, J=9,0 Гц, 1H), 8,36 (dd, J=8,5 Гц, 2,0 Гц, 1H), 8,10 (s, 1H), 8,05 (d, J=8,0 Гц, 1H), 4,52-4,46 (m, 1H), 2,88 (s, 3H), 1,33-1,27 (m, 1H), 0,73-0,67 (m, 1H), 0,63-0,56 (m, 2H), 0,45-0,40 (m, 1H). LC-MS m/z: 416,1 [M+H]+. HPLC: Чистота (214 нм): 97,37%; tR=8,33 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
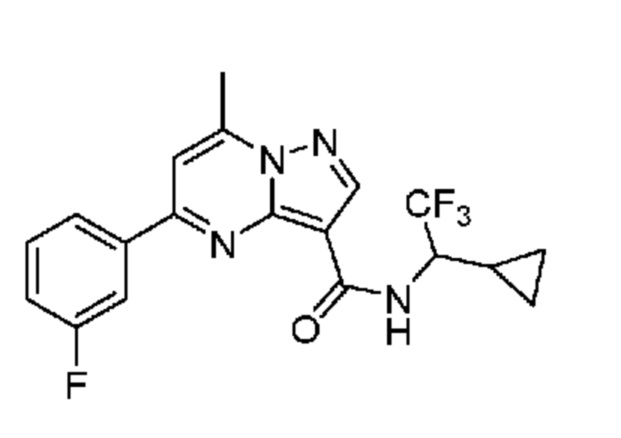
[00517] По общей методике A 5-(3-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (55 мг, 0,20 ммоля) и 1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (5,4 мг, 7%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,69 (s, 1H), 8,56 (d, J=9,5 Гц, 1H), 8,10 (d, J=8,0 Гц, 1H), 8,05 (d, J=10,5 Гц, 1H), 8,02 (s, 1H), 7,79 (dd, J=14,0 Гц, 8,0 Гц, 1H), 7,49 (td, J=8,5 Гц, 2,5 Гц, 1H),4,53-4,45 (m, 1H), 2,87 (s, 3H), 1,31-1,26 (m, 1H), 0,71-0,66 (m, 1H), 0,61-0,55 (m, 2H), 0,42-0,38 (m, 1H). LC-MS m/z: 393,2 [M+H]+. HPLC: Чистота (214 нм): 95%; tR=9,17 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(6-фторпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
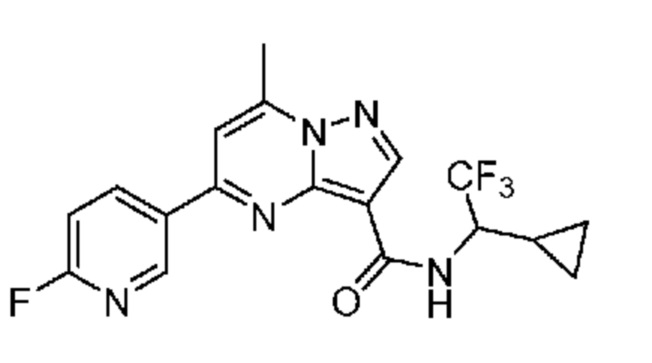
[00518] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 6-фторпиридин-3-илбороновая кислота давали искомое соединение (25,7 мг, 27%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,11 (d, J=2,5 Гц, 1H), 8,76 (td, J=8,0 Гц, 2,5 Гц, 1H), 8,70 (s, 1H), 8,48 (d, J=9,5 Гц, 1H), 8,04 (s, 1H), 7,53 (dd, J=9,0 Гц, 2,5 Гц, 1H), 4,46-4,40 (m, 1H), 2,88 (s, 3H), 1,34-1,29 (m, 1H), 0,71-0,67 (m, 1H), 0,62-0,57 (m, 2H), 0,38-0,36 (m, 1H). LC-MS m/z: 394,1 [M+H]+. HPLC: Чистота (254 нм): 98%; tR=8,39 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(2-фторпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
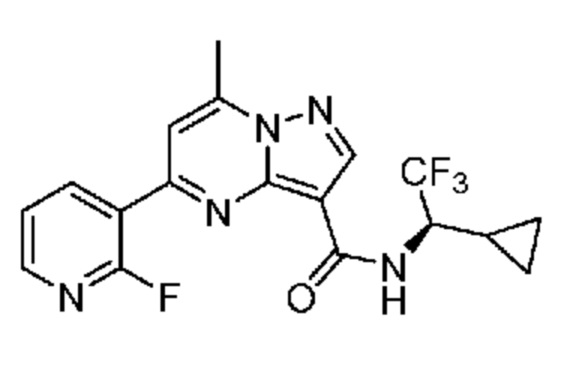
[00519] По общей методике A 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (300 мг, 1,42 ммоля) и (R)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (300 мг, 67%) в виде белого твердого вещества. LC-MS m/z: 333,1 [M+H]+. HPLC: Чистота (214 нм): > 95%; tR=1,84 мин.
[00520] По общей методике D (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 2-фторпиридин-3-илбороновая кислота давали искомое соединение (15 мг, 16%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,73 (s, 1H), 8,60 (t, J=8,0 Гц, 1H), 8,50-8,47 (m, 2H), 7,80 (s, 1H), 7,67 (t, J=6,0 Гц, 1H), 4,46-4,40 (m, 1H), 2,89 (s, 3H), 1,27-1,19 (m, 1H), 0,70-0,64 (m, 1H), 0,60-0,52 (m, 2H), 0,39-0,33 (m, 1H). LC-MS m/z: 394,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,37 мин.
(S)-N-(1-циклопропил-2,2,2-трифторэтил)-5-(2-фторпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
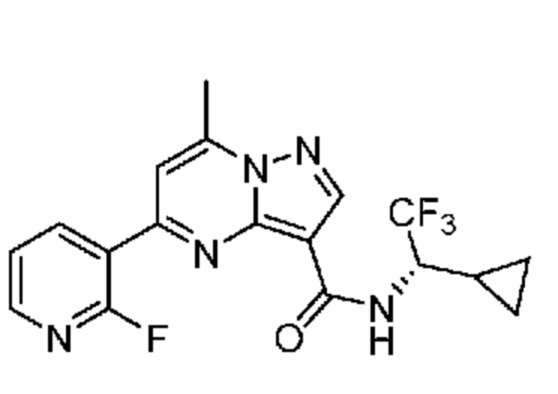
[00521] По общей методике A 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (844 мг, 4,0 ммоля) и (S)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (940 мг, 71%) в виде белого твердого вещества. LC-MS m/z: 333,1 [M+H]+. tR=1,83 мин.
[00522] По общей методике D (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (1,8 г, 5,4 ммоля) и 2-фторпиридин-3-илбороновая кислота давали искомое соединение (1,5 г, 69%) в виде белого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4) δ 8,68 (s, 1H), 8,63 (tt, J=10,0 Гц, 2,0 Гц, 1H), 8,44 (dd, J=2,8 Гц, 1,2 Гц, 1H), 7,71 (s, 1H), 7,59 (tt, J=10,0 Гц, 2,0 Гц, 1H), 4,42-4,39 (m, 1H), 2,97 (s, 3H), 1,31-1,26 (m, 1H), 0,79-0,74 (m, 1H), 0,65-0,57 (m, 2H), 0,51-0,48 (m, 1H). LC-MS m/z: 394,1[M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,40 мин.
(R)-5-(6-Хлорпиридин-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
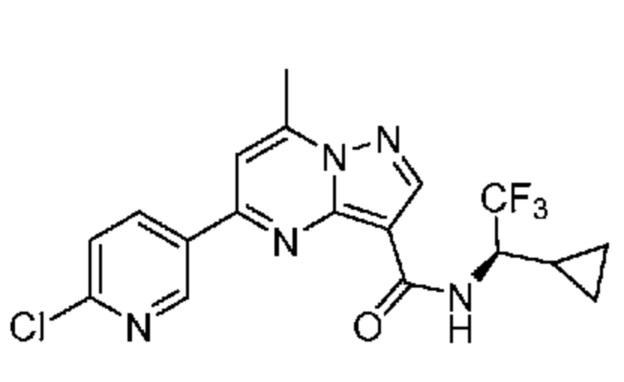
[00523] По общей методике A 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (550 мг, 2,48 ммоля) и (R)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (735 мг, 88%) в виде белого твердого вещества. LC-MS m/z: 333,0 [M+H]+. Чистота (214 нм): > 99%; tR=1,86 мин.
[00524] По общей методике D (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,21 ммоля) и 6-хлорпиридин-3-илбороновая кислота давали искомое соединение (18 мг, 20%) в виде почти белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,25 (d, J=2,0 Гц, 1H), 8,71 (s, 1H), 8,61 (dd, J=8,0 Гц, 1,5 Гц, 1H), 8,46 (d, J=9,5 Гц, 1H), 8,04 (s, 1H), 7,85 (d, J=8,0 Гц, 1H), 4,46-4,38 (m, 1H), 2,88 (s, 3H), 1,34-1,31 (m, 1H), 0,73-0,68 (m, 1H), 0,62-0,57 (m, 2H), 0,40-0,35 (m, 1H). LC-MS m/z: 410,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,80 мин.
(S)-5-(6-Хлорпиридин-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
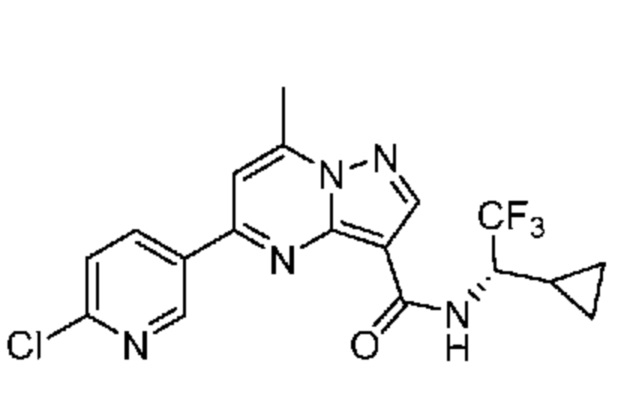
[00525] По общей методике A 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (300 мг, 1,42 ммоля) и (S)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (355 мг, 75%) в виде белого твердого вещества. LC-MS m/z: 333,0 [M+H]+. Чистота (214 нм): > 99%; tR=1,86 мин.
[00526] По общей методике D (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и 6-хлорпиридин-3-илбороновая кислота давали искомое соединение (17,5 мг, 24%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,24 (d, J=2,0 Гц, 1H), 8,71 (s, 1H), 8,61 (dd, J=8,5 Гц, 2,5 Гц, 1H), 8,45 (d, J=9,5 Гц, 1H), 8,04 (s, 1H), 7,84 (d, J=8,0 Гц, 1H), 4,46-4,38 (m, 1H), 2,88 (s, 3H), 1,34-1,31 (m, 1H), 0,72-0,67 (m, 1H), 0,61-0,59 (m, 2H), 0,40-0,36 (m, 1H). LC-MS m/z: 410,0 [M+H]+. HPLC: Чистота (214 нм): > 98%; tR=8,79 мин.
(R)-5-(5-Хлорпиридин-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
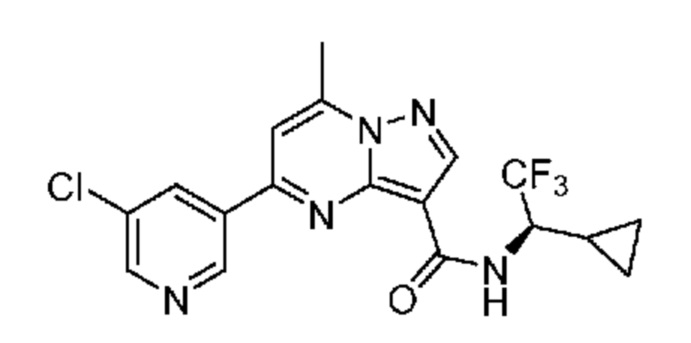
[00527] По общей методике D (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 5-хлорпиридин-3-илбороновая кислота давали искомое соединение (5,5 мг, 6%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 9,38 (d, J=2,0Hz, 1H), 8,86 (d, J=2,4 Гц, 1H), 8,72 (s, 1H), 8,70 (t, J=2,0 Гц, 1H), 8,48 (d, J=12,8 Гц, 1H), 8,12 (s, 1H), 4,50-4,46 (m, 1H), 2,88 (s, 3H), 1,32-1,26 (m, 1H), 0,72-0,67 (m, 1H), 0,61-0,56 (m, 2H), 0,43-0,37 (m, 1H). LC-MS m/z: 410,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,73 мин.
(S)-5-(5-Хлорпиридин-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
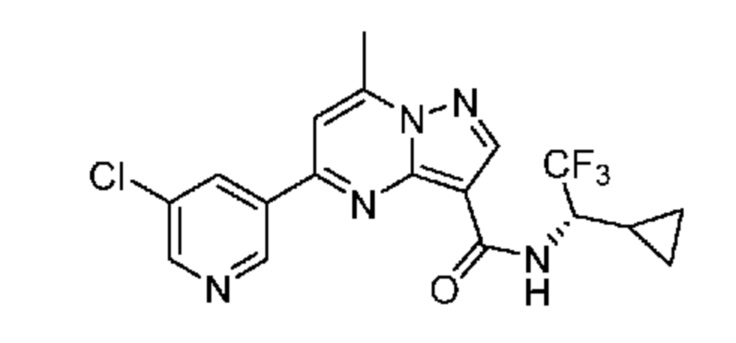
[00528] По общей методике D (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и 5-хлорпиридин-3-илбороновая кислота давали искомое соединение (33 мг, 44%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,39 (d, J=1,5 Гц, 1H), 8,87 (d, J=2,0 Гц, 1H), 8,73 (s, 1H), 8,71 (s, 1H), 8,48 (d, J=9,5 Гц, 1H), 8,12 (s, 1H), 4,53-4,44 (m, 1H), 2,89 (s, 3H), 1,33-1,26 (m, 1H), 0,74-0,67 (m, 1H), 0,62-0,57 (m, 2H), 0,45-0,39 (m, 1H). LC-MS m/z: 410,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,71 мин.
5-(4-Хлорпиридин-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
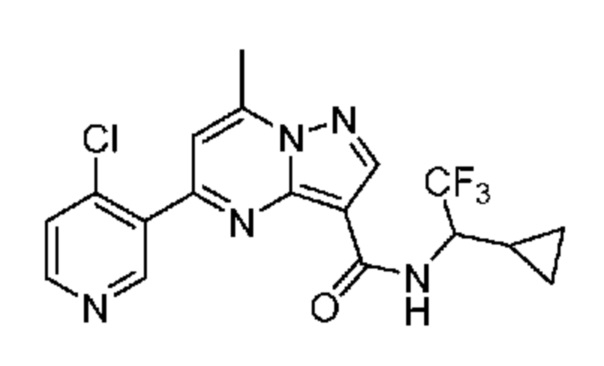
[00529] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 4-хлорпиридин-3-илбороновая кислота давали искомое соединение (5,5 мг, 6%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,97 (s, 1H), 8,76 (s, 1H), 8,72 (d, J=4,5 Гц, 1H), 8,40 (d, J=9,5 Гц, 1H), 7,83 (d, J=5,5 Гц, 1H), 7,75 (s, 1H), 4,45-4,36 (m, 1H), 2,89 (s, 3H), 1,20-1,12 (m, 1H), 0,68-0,62 (m, 1H), 0,59-0,48 (m, 2H), 0,34-0,28 (m, 1H). LC-MS m/z: 410,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,10 мин.
5-(2-Хлорпиридин-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
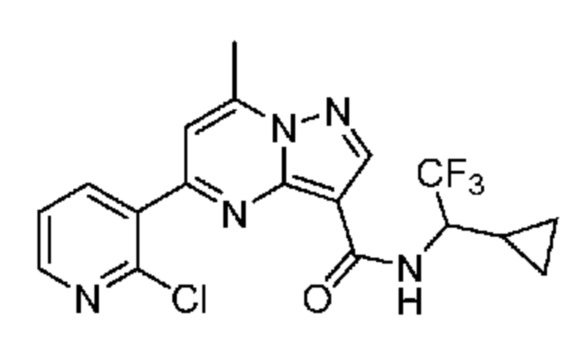
[00530] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,21 ммоля) и 2-хлорпиридин-3-илбороновая кислота давали искомое соединение (12 мг, 15%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,75 (s, 1H), 8,62 (dd, J=4,8 Гц, 1,6 Гц, 1H), 8,41 (d, J=9,6 Гц, 1H), 8,26 (dd, J=7,6 Гц, 1,6 Гц, 1H), 7,71 (t, J=6,0 Гц, 1H), 4,44-4,36 (m, 1H), 2,89 (s, 3H), 1,21-1,12 (m, 1H), 0,69-0,61 (m, 1H), 0,59-0,47 (m, 2H), 0,34-0,27 (m, 1H). LC-MS m/z: 410,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,24 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(4-фторпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
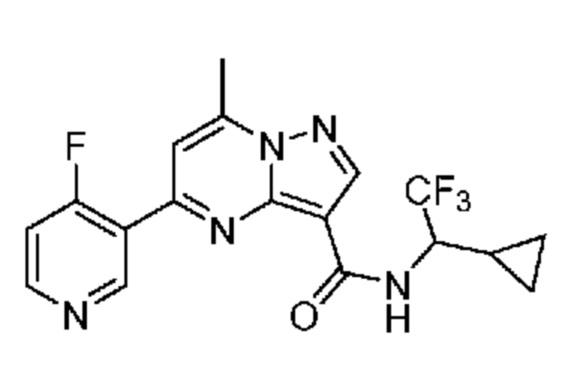
[00531] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и 4-фторпиридин-3-илбороновая кислота давали искомое соединение (7,7 мг, 11%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 9,21 (d, J=10,8 Гц, 1H), 8,80 (dd, J=8,0 Гц, 6,0 Гц, 1H), 8,74 (s, 1H), 8,47 (d, J=9,6 Гц, 1H), 7,81 (s, 1H), 7,64 (dd, J=7,6 Гц, 6,0 Гц, 1H), 4,49-4,42 (m, 1H), 2,89 (s, 3H), 1,23-1,18 (m, 1H), 0,68-0,64 (m, 1H), 0,59-0,54 (m, 2H), 0,39-0,34 (m, 1H). LC-MS m/z: 394,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,81 мин.
(R)-5-(5-Фторпиридин-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
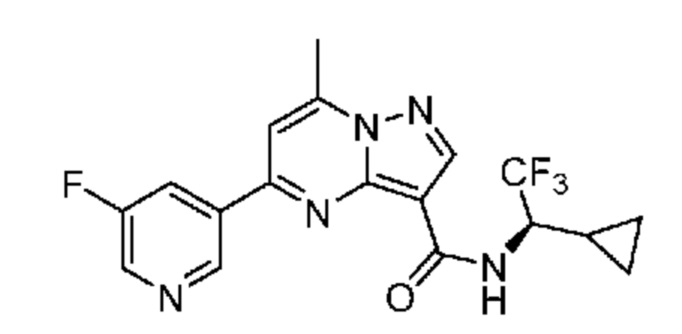
[00532] По общей методике D (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 5-фторпиридин-3-илбороновая кислота давали искомое соединение (4,2 мг, 5%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 9,38 (d, J=1,6 Гц, 1H), 8,87 (d, J=1,6 Гц, 1H), 8,72 (s, 1H), 8,70 (t, J=2,4 Гц, 1H), 8,48 (d, J=10,0 Гц, 1H), 8,12 (s, 1H), 4,51-4,45 (m, 1H), 2,88 (s, 3H), 1,32-1,24 (m, 1H), 0,72-0,66 (m, 1H), 0,62-0,55 (m, 2H), 0,43-0,37 (m, 1H). LC-MS m/z: 394,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,25 мин.
(S)-5-(5-Фторпиридин-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
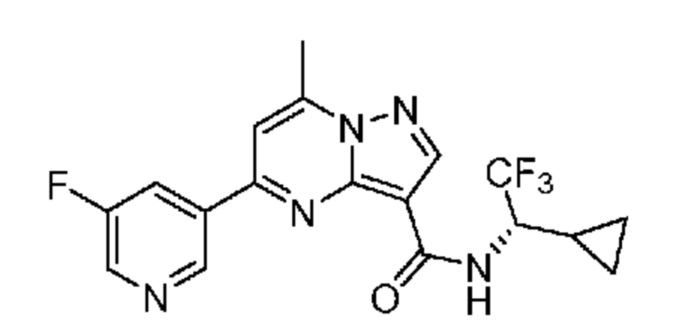
[00533] По общей методике D (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и 5-фторпиридин-3-илбороновая кислота давали искомое соединение (25 мг, 35%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,32 (s, 1H), 8,84 (d, J=2,0 Гц, 1H), 8,73 (s, 1H), 8,49-8,48 (m, 2H), 8,09 (s, 1H), 4,51-4,43 (m, 1H), 2,89 (s, 3H), 1,35-1,28 (m, 1H), 0,73-0,67 (m, 1H), 0,63-0,56 (m, 2H), 0,44-0,37 (m, 1H). LC-MS m/z: 394,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,34 мин.
(S)-5-(3-Циано-5-фторфенил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
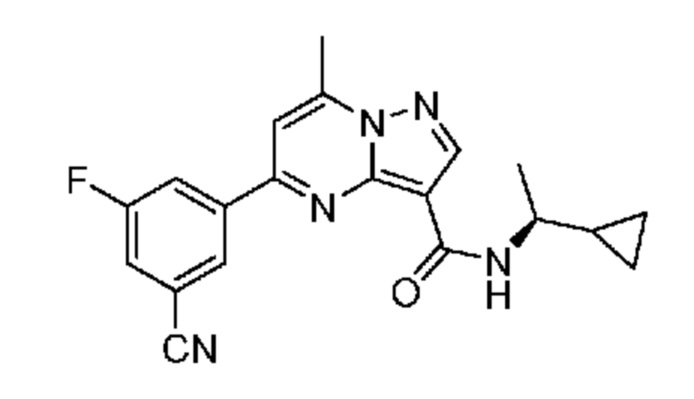
[00534] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,29 ммоля) и 3-циано-5-фторфенилбороновая кислота давали искомое соединение (25 мг, 25%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,63 (s, 1H), 8,61 (s, 1H), 8,46 (d, J=9,6 Гц, 1H), 8,13 (d, J=8,0 Гц, 1H), 8,08 (d, J=8,0 Гц, 1H), 8,07 (s, 1H), 3,66-3,60 (m, 1H), 2,87 (s, 3H), 1,28 (d, J=6,4 Гц, 3H), 1,16-1,12 (m, 1H), 0,55-0,48 (m, 2H), 0,43-0,34 (m, 2H). LC-MS m/z: 364,1 [M+H]+. HPLC: Чистота (214 нм): > 98%; tR=8,36 мин.
(S)-5-(3-Циано-5-метоксифенил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
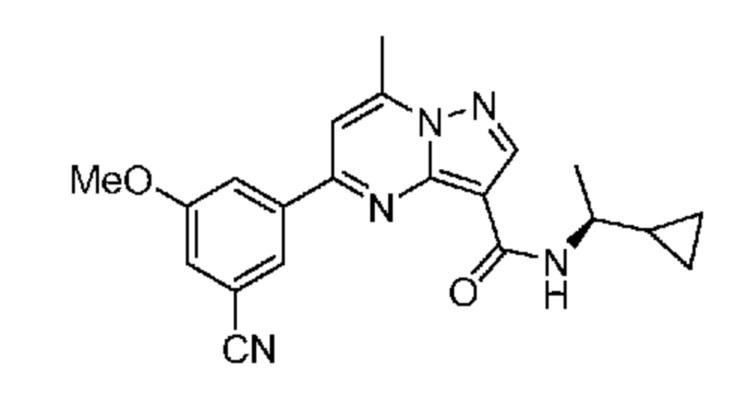
[00535] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (78 мг, 0,28 ммоля) и 3-метокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил давали искомое соединение (54 мг, 51%) в виде почти белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,60 (s, 1H), 8,27 (s, 1H), 8,11-7,98 (m, 3H), 7,69 (s, 1H), 3,95 (s, 3H), 3,64-3,60 (m, 1H), 2,85 (s, 3H), 1,29 (d, J=6,4 Гц, 3H), 1,11-1,07 (m, 1H), 0,59-0,42 (m, 2H), 0,42-0,36 (m, 1H), 0,36-0,29 (m, 1H). LC-MS m/z: 376,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,38 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(6-фторпиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
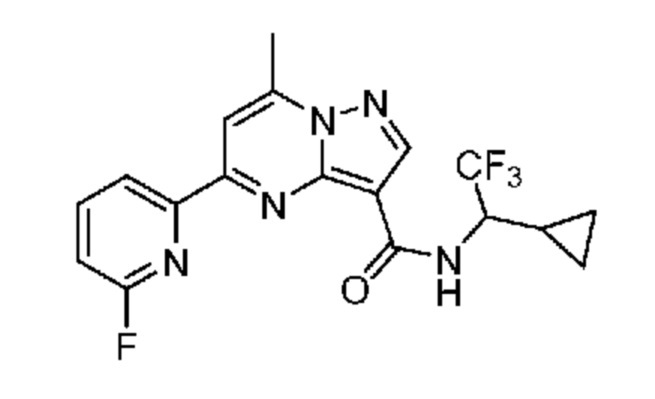
[00536] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 2-фтор-6-(трибутилстаннил)пиридин давали искомое соединение (37 мг, 39%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,73 (s, 1H), 8,50 (d, J=9,5 Гц, 1H), 8,34-8,30 (m, 2H), 8,04 (s, 1H), 7,45 (dd, J=8,5 Гц, 4,5 Гц, 1H), 4,46-4,40 (m, 1H), 2,91 (s, 3H), 1,40-1,35 (m, 1H), 0,74-0,68 (m, 1H), 0,64-0,58 (m, 2H), 0,45-0,40 (m, 1H). LC-MS m/z: 394,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=9,00 мин.
(S)-5-(6-Хлорпиридин-2-ил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
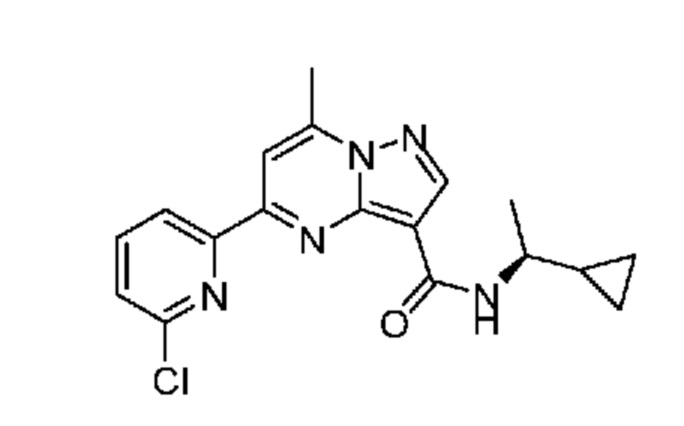
[00537] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (150 мг, 0,54 ммоля) и 2-хлор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин давали искомое соединение (73 мг, 37%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4): δ 8,61 (s, 1H), 8,46 (d, J=8,0 Гц, 1H), 8,11 (s, 1H), 8,05 (t, J=8,0 Гц, 1H), 7,62 (d, J=8,0 Гц, 1H), 3,70-3,65 (m, 1H), 2,94 (s, 3H), 1,42 (d, J=8,0 Гц, 3H), 1,19-1,14 (m, 1H), 0,66-0,58 (m, 2H), 0,50-0,46 (m, 1H), 0,41-0,36 (m, 1H). LC-MS m/z: 369,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,62 мин.
(R)-5-(6-Хлорпиридин-2-ил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
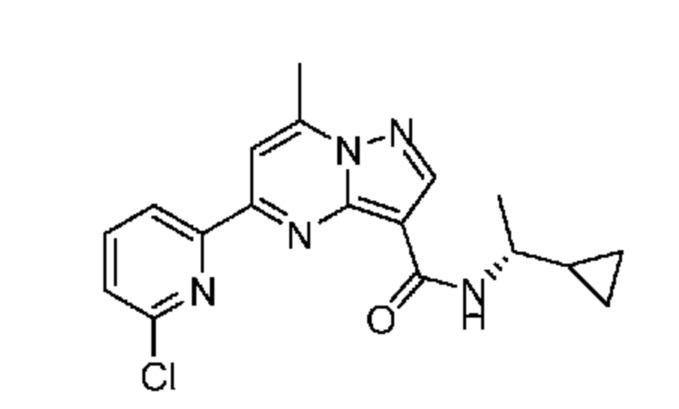
[00538] По общей методике D (R)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,21 ммоля) и 2-хлор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин давали искомое соединение (31 мг, 60%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,63 (s, 1H), 8,45 (d, J=7,5 Гц, 1H), 8,20 (t, J=8,0 Гц, 1H), 8,07 (d, J=8,0 Гц, 1H), 8,02 (s, 1H), 7,76 (d, J=8,0 Гц, 1H), 3,62-3,58 (m, 1H), 2,91 (s, 3H), 1,32 (d, J=6,5 Гц, 3H), 1,16-1,14 (m, 1H), 0,54-0,48 (m, 2H), 0,40-0,32 (m, 2H). LC-MS m/z: 356,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,03 мин.
5-(6-Цианопиридин-2-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
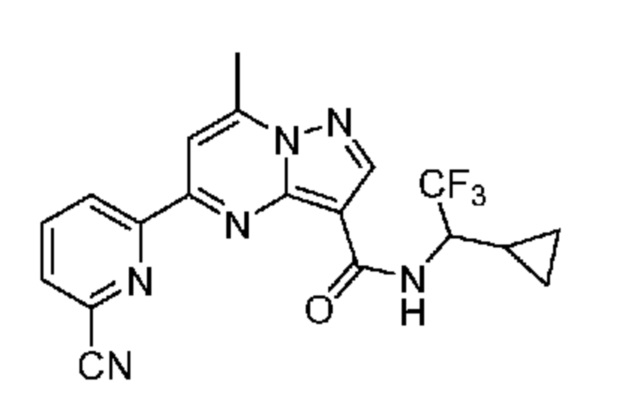
[00539] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 6-цианопиридин-2-илбороновая кислота давали искомое соединение (42 мг, 44%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,74 (s, 1H), 8,65 (d, J=8,0 Гц, 1H), 8,47 (d, J=9,2 Гц, 1H), 8,39 (t, J=8,0 Гц, 1H), 8,27 (d, J=8,0 Гц, 1H), 8,14 (s, 1H), 4,41-4,37 (m, 1H), 2,92 (s, 3H), 1,40-1,36 (m, 1H), 0,72-0,67 (m, 1H), 0,64-0,57 (m, 2H), 0,40-0,37 (m, 1H). LC-MS m/z: 401,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,65 мин.
(S)-N-(1-Циклопропилэтил)-5-(6-фторпиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
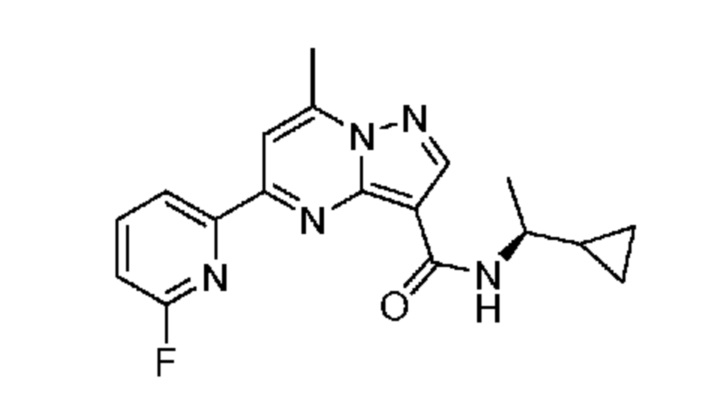
[00540] По общей методике F (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,28 ммоля) и 2-фтор-6-(трибутилстаннил)пиридин давали искомое соединение (55 мг, 56%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,62 (s, 1H), 8,40 (dd, J=7,5 Гц, 2,0 Гц, 1H), 8,32 (dd, J=16,0 Гц, 8,0 Гц, 1H), 8,07 (d, J=7,5 Гц, 1H), 7,99 (s, 1H), 7,44 (dd, J=8,0 Гц, 2,0 Гц, 1H), 3,64-3,58 (m, 1H), 2,89 (s, 3H), 1,33 (d, J=6,5 Гц, 3H), 1,18-1,12 (m, 1H), 0,58-0,49 (m, 2H), 0,41-0,36 (m, 1H), 0,36-0,31 (m, 1H). LC-MS m/z: 340,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,45 мин.
(R)-N-(1-Циклопропилэтил)-5-(6-фторпиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
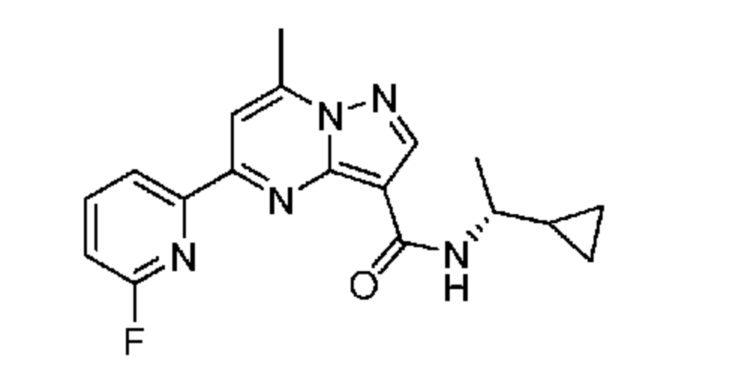
[00541] По общей методике A 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (1,0 г, 4,74 ммоля) и (R)-1-циклопропилэтанамин давали (R)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (1,2 г, 90%) в виде белого твердого вещества.
[00542] По общей методике F (R)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,29 ммоля) и 2-фтор-6-(трибутилстаннил)пиридин давали искомое соединение (24,3 мг, 25%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,64 (s, 1H), 8,42 (dd, J=7,6 Гц, 2,0 Гц, 1H), 8,32 (q, J=8,0 Гц, 1H), 8,09 (d, J=7,2 Гц, 1H), 8,01 (s, 1H), 7,45 (dd, J=8,0 Гц, 2,0 Гц, 1H), 3,63-3,57 (m, 1H), 2,90 (s, 3H), 1,32 (d, J=6,4 Гц, 3H), 1,19-1,13 (m, 1H), 0,55-0,48 (m, 2H), 0,41-0,32 (m, 2H). LC-MS m/z: 340,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,51 мин.
(S)-N-(1-Циклопропилэтил)-7-метил-5-фенилпиразоло[1,5-a]пиримидин-3-карбоксамид
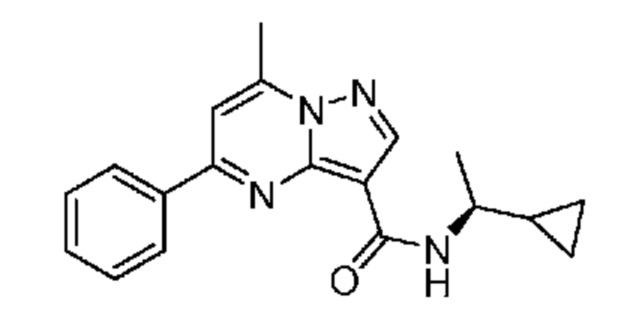
[00543] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,22 ммоля) и фенилбороновая кислота давали искомое соединение (30 мг, 57%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,56 (s, 1H), 8,27 (dd, J=7,6 Гц, 2,0 Гц, 1H), 8,22 (d, J=8,0 Гц, 1H), 7,91 (s, 1H), 7,65-7,61 (m, 3H), 3,66-3,61 (m, 1H), 2,86 (s, 3H), 1,29 (d, J=6,4 Гц, 3H), 1,12-1,07 (m, 1H), 0,54-0,47 (m, 2H), 0,40-0,33 (m, 2H). LC-MS m/z: 321,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,66 мин.
(S)-N-(1-Циклопропилэтил)-5-(3-фтор-5-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
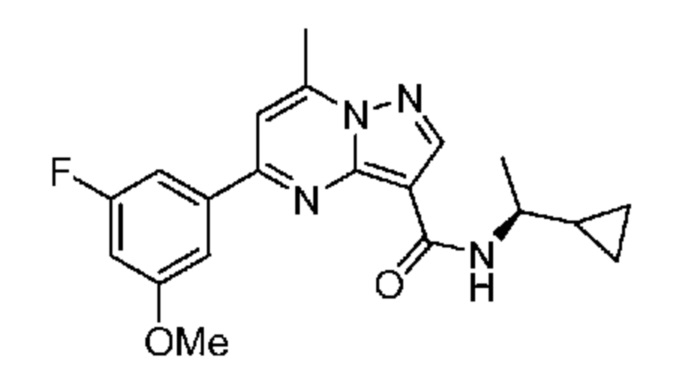
[00544] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (61 мг, 0,36 ммоля) и 3-фтор-5-метоксифенилбороновая кислота давали искомое соединение (80 мг, 60%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,58 (s, 1H), 7,70 (s, 1H), 7,62 (s, 1H), 7,57 (d, J=10,0 Гц, 1H), 6,94 (dd, J=11,0 Гц, 2,5 Гц, 1H), 3,93 (s, 3H), 3,73-3,68 (m, 1H), 2,92 (s, 3H), 1,40 (d, J=6,5 Гц, 3H), 1,12-1,08 (m, 1H), 0,66-0,58 (m, 2H), 0,50-0,47 (m, 1H), 0,40-0,37 (m, 1H). LC-MS m/z: 369,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,62 мин.
(S)-N-(1-Циклопропилэтил)-5-(3-фтор-2-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
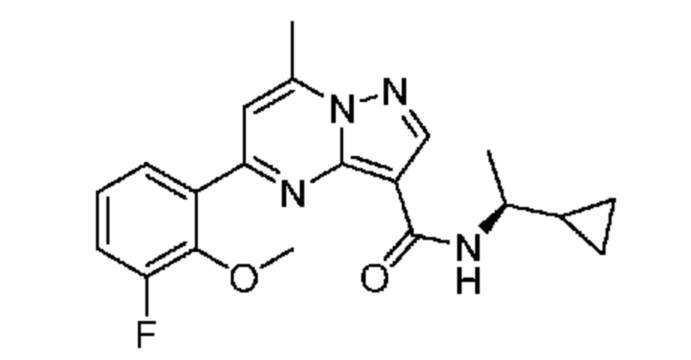
[00545] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (78 мг, 0,28 ммоля) и 3-фтор-2-метоксифенилбороновая кислота давали искомое соединение (55 мг, 54%) в виде серого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,61 (s, 1H), 8,08 (d, J=8,0 Гц, 1H), 7,72 (d, J=8,0 Гц, 1H), 7,63 (s, 1H), 7,52 (ddd, J=8,0 Гц, 3,0 Гц, 1,0 Гц, 1H), 7,37-7,32 (m, 1H), 3,91 (d, J=1,5 Гц, 3H), 3,62-3,58 (m, 1H), 2,86 (s, 3H), 1,24 (d, J=6,5 Гц, 3H), 1,00-0,98 (m, 1H), 0,48-0,38 (m, 2H), 0,37-0,31 (m, 1H), 0,30-0,24 (m, 1H). LC-MS m/z: 369,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,88 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3-фтор-2-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
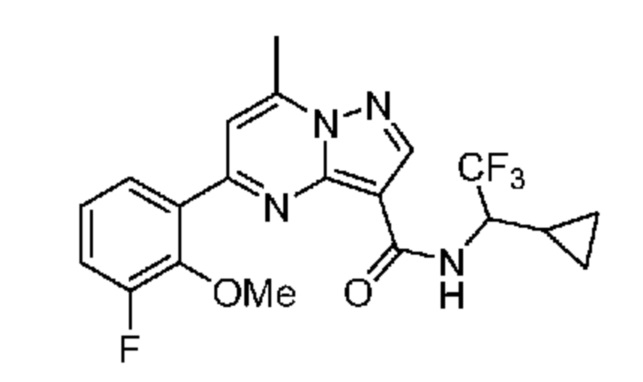
[00546] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (72 мг, 0,22 ммоля) и 3-фтор-2-метоксифенилбороновая кислота давали искомое соединение (55 мг, 59%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,70 (s, 1H), 8,47 (d, J=10,0 Гц, 1H), 7,67 (s, 1H), 7,66 (d, J=10,0 Гц, 1H), 7,52 (ddd, J=11,5 Гц, 8,0 Гц, 1,0 Гц, 1H), 7,36-7,31 (m, 1H), 4,48-4,41 (m, 1H), 3,90 (d, J=1,0 Гц, 3H), 2,88 (s, 3H), 1,22-1,18 (m, 1H), 0,68-0,65 (m, 1H), 0,58-0,54 (m, 2H), 0,37-0,34 (m, 1H). LC-MS m/z: 423,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,32 мин.
5-(3-Фтор-2-метоксифенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
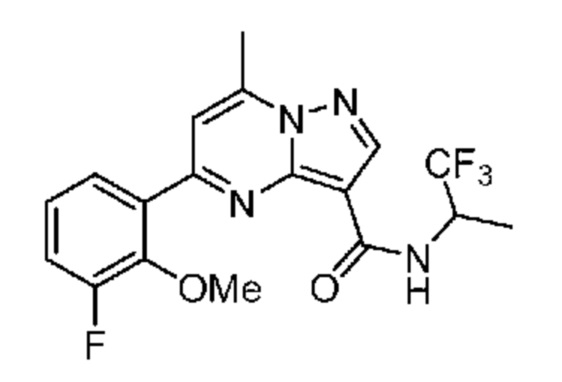
[00547] По общей методике A 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (1,5 г, 7,1 ммоля) и 1,1,1-трифторпропан-2-амингидрохлорид давали 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (1,5 г, 69%) в виде желто-зеленого твердого вещества. LC-MS m/z: 307,1/309,0 [M+H]+. tR=1,74 мин.
[00548] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,15 ммоля) и 3-фтор-2-метоксифенилбороновая кислота давали искомое соединение (38 мг, 49%) в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 8,71 (s, 1H), 8,50 (d, J=9,5 Гц, 1H), 7,65 (d, J=7,5 Гц, 1H), 7,52 (s, 1H), 7,31-7,27 (m, 1H), 7,22-7,18 (m, 1H), 5,04-4,95 (m, 1H), 3,96 (d, J=2,0 Гц, 3H), 2,90 (s, 3H), 1,44 (d, J=7,0 Гц, 1H). LC-MS m/z: 397,0 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,97 мин.
5-(3-Циано-2-метоксифенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
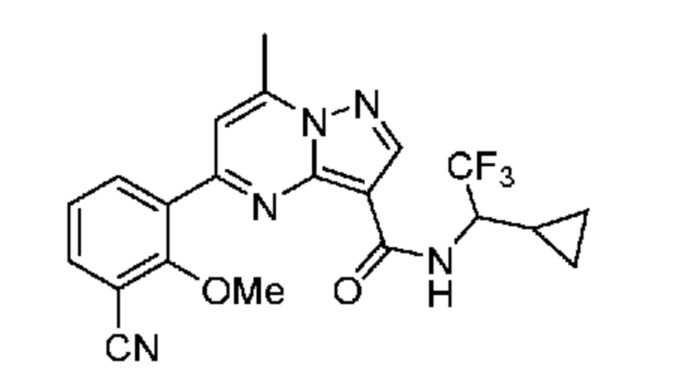
[00549] Смесь 3-бром-2-метоксибензонитрила (2,12 г, 10 ммоля), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) (3,04 г, 12 ммоля), KOAc (2,44 г, 25 ммоля), PdCl2(dppf)•CH2Cl2 (860 мг, 1 ммоля) продували с помощью N2 (×3). Затем добавляли 1,4-диоксан (20 мл) и реакционную смесь перемешивали при 90°C в течение 1 ч, фильтровали и концентрировали в вакууме. Остаток растворяли в изопропиловом эфире (60 мл), фильтровали и повторно концентрировали в вакууме и получали неочищенный 2-метокси-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил (2 г) в виде черного масла.
[00550] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и 2-метокси-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил давали искомое соединение (20 мг, 26%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,73 (s, 1 H), 8,43 (d, J=9,5 Гц, 1H), 8,14 (d, J=6,5 Гц, 1H), 8,05 (d, J=8,0 Гц, 1H), 7,72 (s, 1 H), 7,54 (t, J=8,0 Гц, 1H), 4,43-4,41 (m, 1H), 3,88 (s, 3H), 2,88 (s, 3H), 1,22-1,20 (m, 1H), 0,66-0,64 (m, 1H), 0,58-0,54 (m, 2H), 0,36-0,34 (m, 1H). LC-MS m/z: 430,1 [M+H]+. HPLC: Чистота (214 нм): 98,5%; tR=8,65 мин.
5-(3-Циано-2-метоксифенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
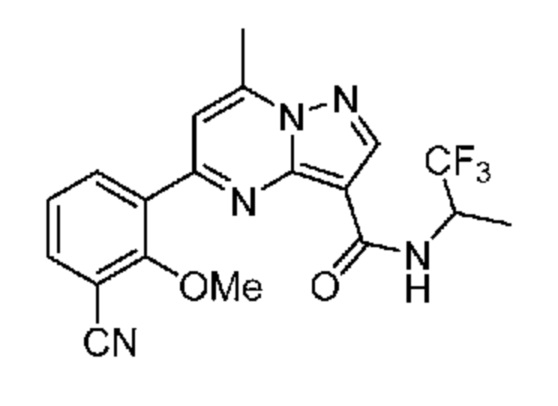
[00551] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,20 ммоля) и 2-метокси-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил давали искомое соединение (55 мг, 69%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,73 (s, 1 H), 8,37 (d, J=9,5 Гц, 1H), 8,17 (dd, J=8,0 Гц, 2,0 Гц, 1H), 8,04 (dd, J=7,5 Гц, 2,0 Гц, 1H), 7,72 (s, 1H), 7,54 (t, J=8,0 Гц, 1H), 4,96-4,91 (m, 1H), 3,87 (s, 3H), 2,88 (s, 3H), 1,39 (d, J=7,0 Гц, 3H). LC-MS m/z: 404,1 [M+H]+. HPLC: Чистота (214 нм): 98,5%; tR=8,30 мин.
(S)-5-(3-Циано-2-метоксифенил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
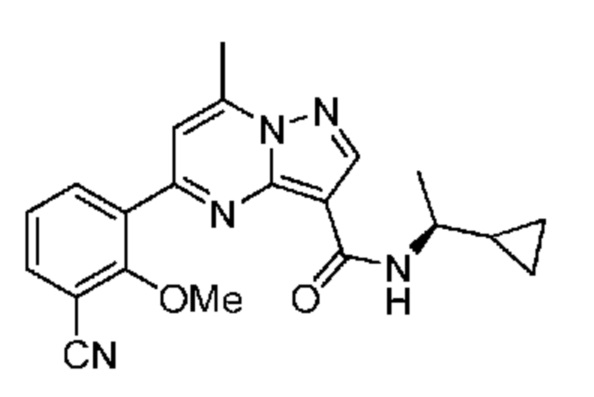
[00552] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,22 ммоля) и 2-метокси-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил давали искомое соединение (8 мг, 10%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,63 (s, 1 H), 8,21 (dd, J=7,5 Гц, 1,5 Гц, 1H), 8,04 (dd, J=7,5 Гц, 1,5 Гц, 2H), 7,68 (s, 1 H), 7,55 (t, J=7,5 Гц, 1H), 3,88 (s, 3H), 3,60-3,58 (m, 1H), 2,87 (s, 3H), 1,23 (d, J=6,5 Гц, 3H), 1,02-0,99 (m, 1H), 0,46-0,27 (m, 4H). LC-MS m/z: 376,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,14 мин.
(R)-5-(3-Циано-2-метоксифенил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
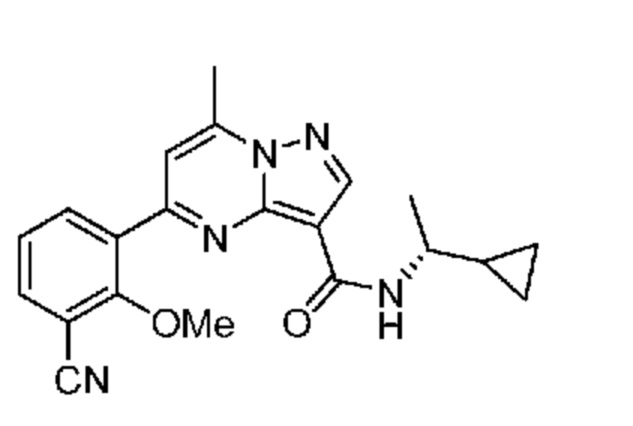
[00553] По общей методике D (R)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (140 мг, 0,50 ммоля) и 2-метокси-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил давали искомое соединение (22 мг, 12%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,62 (s, 1H), 8,21 (d, J=8,0 Гц, 1H), 8,03 (d, J=7,5 Гц, 2H), 7,67 (s, 1H), 7,55 (d, J=8,5 Гц, 1H), 3,89 (s, 3H), 3,63-3,59 (m, 1H), 2,87 (s, 3H), 1,24 (d, J=6,5 Гц, 3H), 1,04-1,01 (m, 1H), 0,48-0,40 (m, 2H), 0,36-0,26 (m, 2H). LC-MS m/z: 376,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,29 мин.
(S)-N-(1-Циклопропилэтил)-5-(4-фтор-3-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
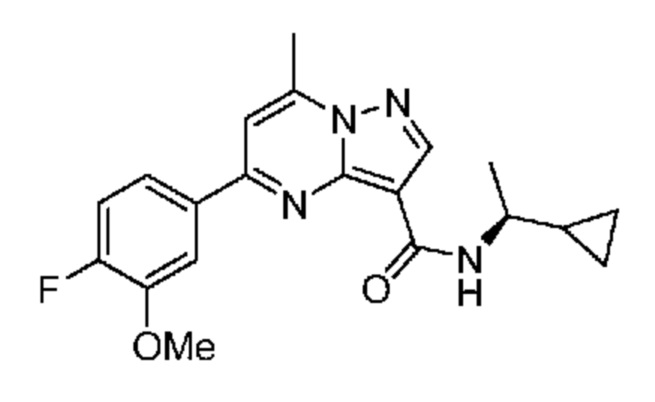
[00554] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (78 мг, 0,28 ммоля) и 4-фтор-3-метоксифенилбороновая кислота давали искомое соединение (50 мг, 48%) в виде серого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,55 (s, 1H), 8,08 (d, J=7,6 Гц, 1H), 8,00 (dd, J=8,4 Гц, 2,0 Гц, 1H), 7,94 (s, 1H), 7,87 (ddd, J=8,4 Гц, 4,4 Гц, 2,0 Гц, 1H), 7,42 (dd, J=11,2 Гц, 8,8 Гц, 1H), 3,99 (s, 3H), 3,62-3,58 (m, 1H), 2,84 (s, 3H), 1,29 (d, J=6,4 Гц, 3H), 1,11-1,00 (m, 1H), 0,51-0,40 (m, 2H), 0,40-0,30 (m, 1H), 0,30-0,21 (m, 1H). LC-MS m/z: 369,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,62 мин.
(S)-N-(1-Циклопропилэтил)-5-(4-фтор-2-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
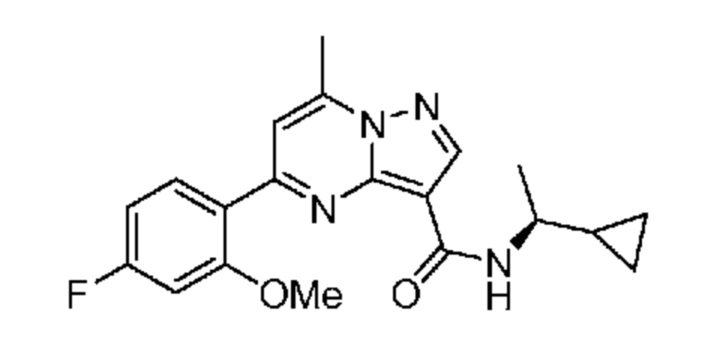
[00555] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,18 ммоля) и 4-фтор-2-метоксифенилбороновая кислота давали искомое соединение (8 мг, 16%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,55 (s, 1H), 8,12 (d, J=7,5 Гц, 1H), 7,95 (dd, J=8,0 Гц, 6,0 Гц, 1H), 7,67 (s, 1H), 7,20 (dd, J=11,5 Гц, 7,5 Гц, 1H), 7,05 (td, J=8,5 Гц, 2,0 Гц, 1H), 3,95 (s, 3H), 3,65-3,58 (m, 1H), 2,83 (s, 3H), 1,24 (d, J=6,5 Гц, 3H), 1,02-0,98 (m, 1H), 0,49-0,41 (m, 2H), 0,37-0,30 (m, 1H), 0,30-0,21 (m, 1H). LC-MS m/z: 369,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,81 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(4-фтор-3-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
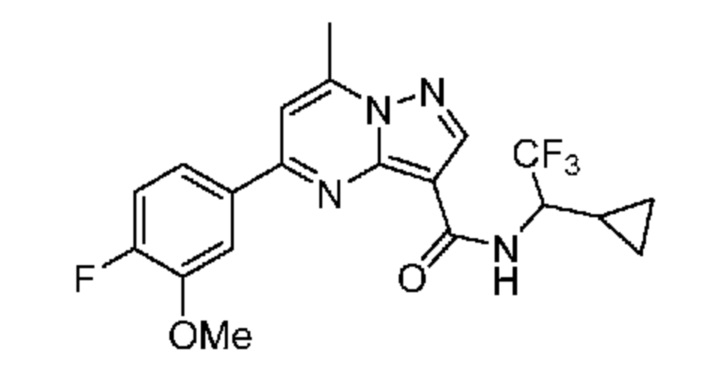
[00556] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,21 ммоля) и 4-фтор-3-метоксифенилбороновая кислота давали искомое соединение (55,5 мг, 62%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,66 (s, 1H), 8,51 (d, J=9,2 Гц, 1H), 8,00 (s, 1H), 7,98 (dd, J=8,0 Гц, 1,6 Гц, 1H), 7,85 (ddd, J=8,4 Гц, 4,0 Гц, 2,0 Гц, 1H), 7,50 (dd, J=11,2 Гц, 8,8 Гц, 1H), 4,51-4,44 (m, 1H), 3,98 (s, 3H), 2,87 (s, 3H), 1,30-1,26 (m, 1H), 0,71-0,67 (m, 1H), 0,60-0,56 (m, 2H), 0,40-0,36 (m, 1H). LC-MS m/z: 423,2 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=9,14 мин.
5-(4-Фтор-3-метоксифенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
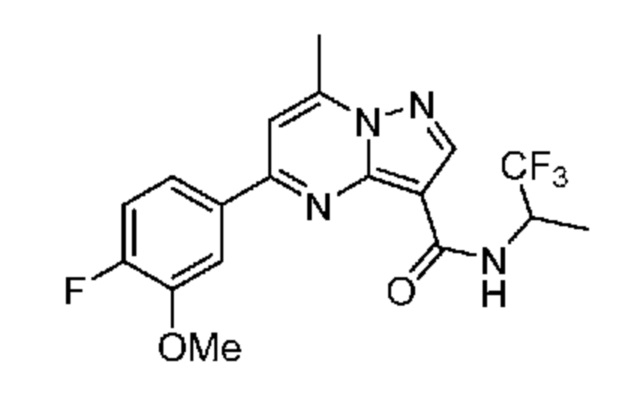
[00557] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,15 ммоля) и 4-фтор-3-метоксифенилбороновая кислота давали искомое соединение (38 мг, 49%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,63 (s, 1H), 7,97 (dd, J=8,0 Гц, 2,5 Гц, 1H), 7,81 (ddd, J=8,5 Гц, 4,0 Гц, 2,0 Гц, 1H), 7,76 (s, 1H), 7,33 (dd, J=10,5 Гц, 8,5 Гц, 1H), 5,05-4,98 (m, 1H), 4,04 (s, 3H), 2,94 (s, 3H), 1,53 (d, J=6,5 Гц, 2H). LC-MS m/z: 397,1 [M+H]+. HPLC: Чистота (214 нм): 96%; tR=8,75 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(4-фтор-2-метоксифенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
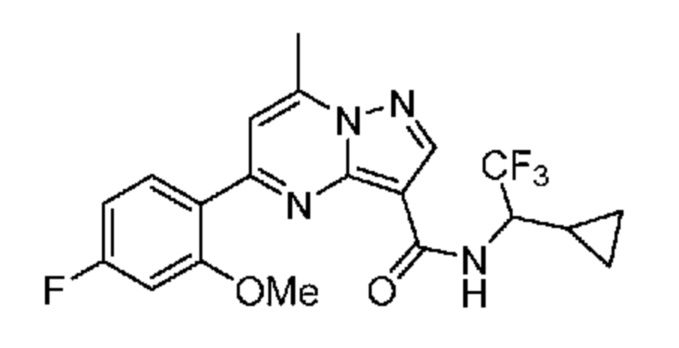
[00558] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 4-фтор-2-метоксифенилбороновая кислота давали искомое соединение (44 мг, 30%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,65 (s, 1H), 8,51 (d, J=9,6 Гц, 1H), 7,88 (dd, J=8,4 Гц, 7,2 Гц, 1H), 7,70 (s, 1H), 7,21 (dd, J=11,2 Гц, 2,0 Гц, 1H), 7,04 (td, J=8,4 Гц, 2,4 Гц, 1H), 4,49-4,43 (m, 1H), 3,94 (s, 3H), 2,84 (s, 3H), 1,24-1,16 (m, 1H), 0,67-0,62 (m, 1H), 0,58-0,51 (m, 2H), 0,38-0,32 (m, 1H). LC-MS m/z: 423,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=9,32 мин.
5-(4-Фтор-2-метоксифенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
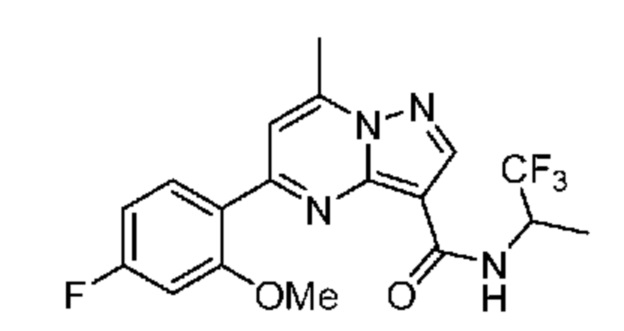
[00559] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,26 ммоля) и 4-фтор-2-метоксифенилбороновая кислота давали искомое соединение (50 мг, 48%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,65 (s, 1H), 8,46 (d, J=9,5 Гц, 1H), 7,89 (dd, J=8,5 Гц, 7,5 Гц, 1H), 7,70 (s, 1H), 7,21 (dd, J=11,5 Гц, 2,0 Гц, 1H), 7,04 (td, J=8,0 Гц, 2,0 Гц 1H), 4,98-4,92 (m, 1H), 3,94 (s, 3H), 2,84 (s, 3H), 1,39 (d, J=6,5 Гц, 3H). LC-MS m/z: 397,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,91 мин.
5-(2-Циано-4-фторфенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
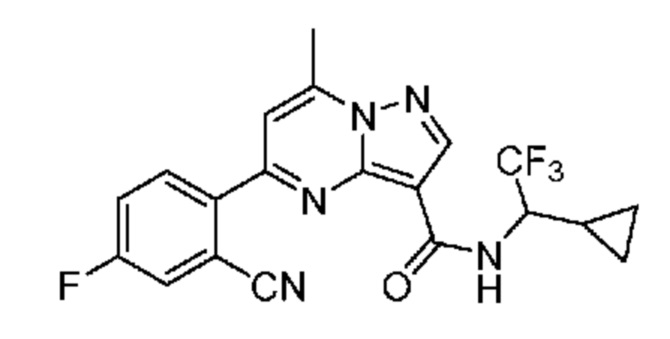
[00560] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (40 мг, 0,12 ммоля) и 2-циано-4-фторфенилбороновая кислота давали искомое соединение (28 мг, 55%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,74 (s, 1H), 8,27 (d, J=9,0 Гц, 1H), 8,22-8,19 (m, 2H), 7,89 (td, J=8,5 Гц, 3,0 Гц, 1H), 7,83 (s, 1H), 4,30-4,25 (m, 1H), 2,89 (s, 3H), 1,37-1,33 (m, 1H), 0,71-0,68 (m, 1H), 0,64-0,61 (m, 1H), 0,52-0,49 (m, 1H), 0,34-0,31 (m, 1H). LC-MS m/z: 418,1 [M+H]+. HPLC: Чистота (214 нм): 98%; tR=8,63 мин.
5-(2-Карбамоил-4-фторфенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
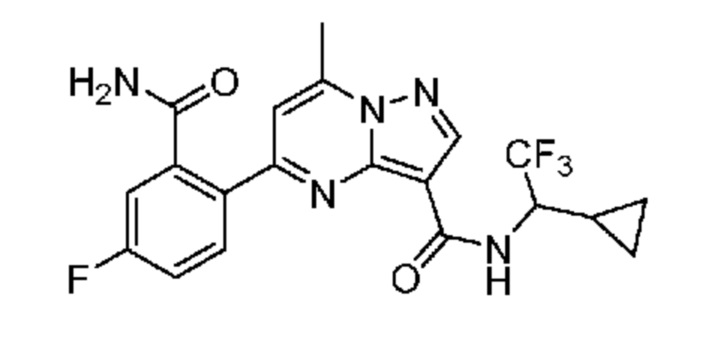
[00561] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,15 ммоля), 2-циано-4-фторфенилбороновая кислота и Na2CO3 (0,3 ммоля) давали искомое соединение (44 мг, 68%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,67 (s, 1H), 8,25 (d, J=9,2 Гц, 1H), 8,06 (s, 1H), 7,83 (dd, J=8,8 Гц, 5,2 Гц, 1H), 7,55-7,46 (m, 3H), 7,40 (s, 1H), 4,27-4,20 (m, 1H), 2,85 (s, 3H), 1,42-1,37 (m, 1H), 0,67-0,58 (m, 3H), 0,30-0,25 (m, 1H). LC-MS m/z: 436,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,80 мин.
(S)-5-(2-Циано-4-фторфенил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
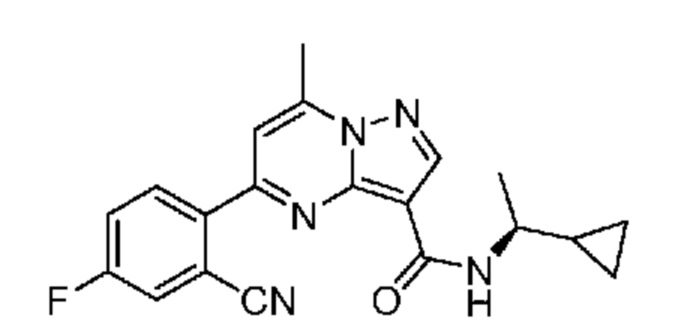
[00562] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (300 мг, 1,079 ммоля) и 2-циано-4-фторфенилбороновая кислота давали искомое соединение (350 мг, 90%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,65 (s, 1H), 8,23 (dd, J=8,5 Гц, 5,5 Гц, 1H), 8,19 (dd, J=8,5 Гц, 2,5 Гц, 1H), 7,94 (s, 1H), 8,00 (d, J=8,5 Гц, 1H), 7,88 (td, J=9,0 Гц, 3,0 Гц, 1H), 7,78 (s, 1H), 3,58-3,51 (m, 1H), 2,88 (s, 3H), 1,28 (d, J=6,5 Гц, 3H), 1,11-1,06 (m, 1H), 0,48-0,42 (m, 1H), 0,40-0,30 (m, 2H), 0,27-0,22 (m, 1H). LC-MS m/z: 364,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,14 мин.
(R)-5-(2-Циано-4-фторфенил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
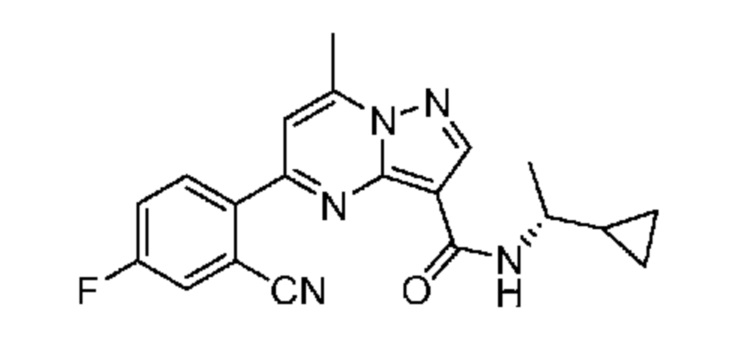
[00563] По общей методике D (R)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,36 ммоля) и 2-циано-4-фторфенилбороновая кислота давали искомое соединение (54 мг, 42%) в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 8,76 (s, 1H), 8,00 (d, J=8,0 Гц, 1H), 7,92 (dd, J=8,5 Гц, 4,5 Гц, 1H), 7,62 (dd, J=8,0 Гц, 2,5 Гц, 1H), 7,49 (td, J=8,5 Гц, 2,5 Гц, 1H), 7,19 (s, 1H), 3,72-3,68 (m, 1H), 2,94 (s, 3H), 1,35 (d, J=6,5 Гц, 3H), 1,10-1,07 (m, 1H), 0,53-0,49 (m, 1H), 0,47-0,42 (m, 2H), 0,30-0,28 (m, 1H). LC-MS m/z: 364,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,21 мин.
(R)-5-(2-Циано-4-фторфенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
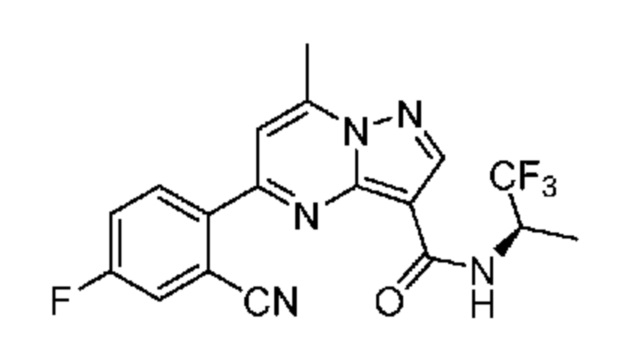
[00564] По общей методике D (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 2-циано-4-фторфенилбороновая кислота давали искомое соединение (40 мг, 38%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): 8,75 (s, 1H), 8,23-8,20 (m, 2H), 8,12 (d, J=9,5 Гц, 1H), 7,89 (td, J=8,5 Гц, 2,0 Гц, 1H), 7,82 (s, 1H), 5,03-4,97 (m, 1H), 2,89 (s, 3H), 1,43 (d, J=7,0 Гц, 3H). LC-MS m/z: 392,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,37 мин.
(S)-5-(2-Циано-4-фторфенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
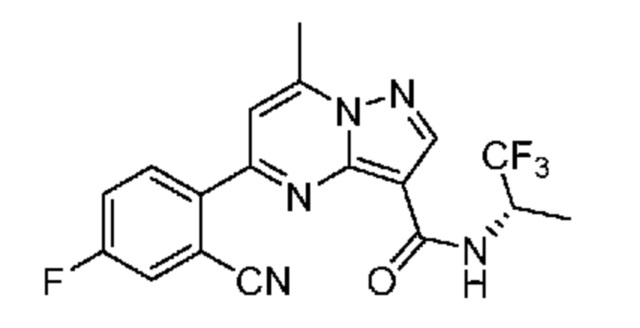
[00565] По общей методике D (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 2-циано-4-фторфенилбороновая кислота давали искомое соединение (42 мг, 42%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): 8,75 (s, 1H), 8,23-8,20 (m, 2H), 8,12 (d, J=9,5 Гц, 1H), 7,89 (td, J=8,5 Гц, 2,0 Гц, 1H), 7,82 (s, 1H), 5,03-4,97 (m, 1H), 2,89 (s, 3H), 1,43 (d, J=7,0 Гц, 3H). LC-MS m/z: 392,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,38 мин.
(S)-5-(3-Циано-4-фторфенил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
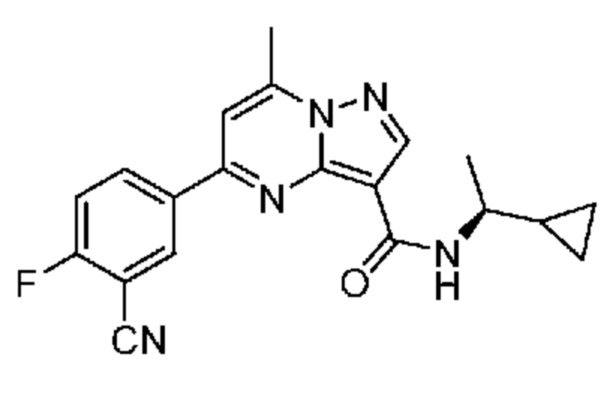
[00566] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,25 ммоля) и 3-циано-4-фторфенилбороновая кислота давали искомое соединение (47 мг, 40%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,84 (dd, J=6,0 Гц, 2,0 Гц, 1H), 8,68-8,64 (m, 1H), 8,61 (s, 1H), 8,09 (d, J=7,6 Гц, 1H), 8,02 (s, 1H), 7,82 (t, J=9,2 Гц, 1H), 3,62-3,58 (m, 1H), 2,86 (s, 3H), 1,29 (d, J=6,4 Гц, 3H), 1,16-1,10 (m, 1H), 0,55-0,48 (m, 2H), 0,41-0,32 (m, 2H). LC-MS m/z: 364,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,31 мин.
5-(3-Циано-4-фторфенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
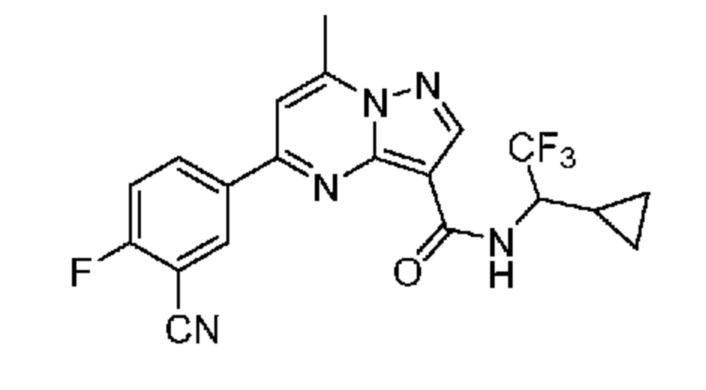
[00567] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и 3-циано-4-фторфенилбороновая кислота давали искомое соединение (36 мг, 47%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,77 (dd, J=6,5 Гц, 2,0 Гц, 1H), 8,70 (s, 1H), 8,63-8,59 (m, 1H), 8,48 (d, J=9,5 Гц, 1H), 8,05 (s, 1H), 7,86 (d, J=9,5 Гц, 1H), 4,46-4,41 (m, 1H), 2,87 (s, 3H), 1,36-1,31 (m, 1H), 0,71-0,67 (m, 1H), 0,62-0,56 (m, 2H), 0,42-0,38 (m, 1H). LC-MS m/z: 418,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,74 мин.
5-(3-Циано-4-фторфенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
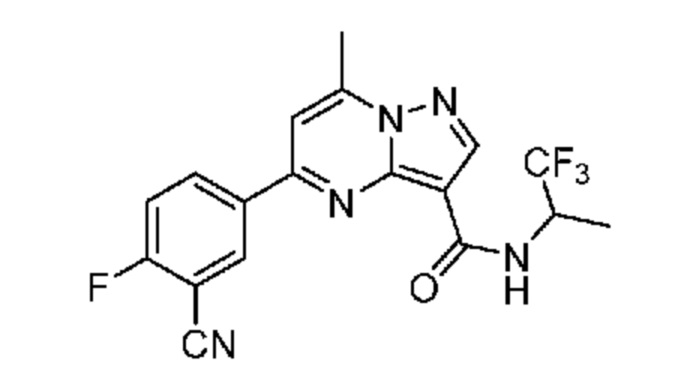
[00568] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,20 ммоля) и 3-циано-4-фторфенилбороновая кислота давали искомое соединение (8 мг, 11%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,79 (dd, J=6,0 Гц, 2,4 Гц, 1H), 8,71 (s, 1H), 8,65-8,60 (m 1H), 8,41 (d, J=9,2 Гц, 1H), 8,06 (s, 1H), 7,86 (t, J=8,0 Гц, 1H), 5,00-4,94 (m, 1H), 2,87 (s, 3H), 1,46 (d, J=6,8 Гц, 3H). LC-MS m/z: 392,0 [M+H]+. HPLC: Чистота (214 нм): 97%; tR=8,37 мин.
(S)-5-(3-Карбамоил-4-фторфенил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
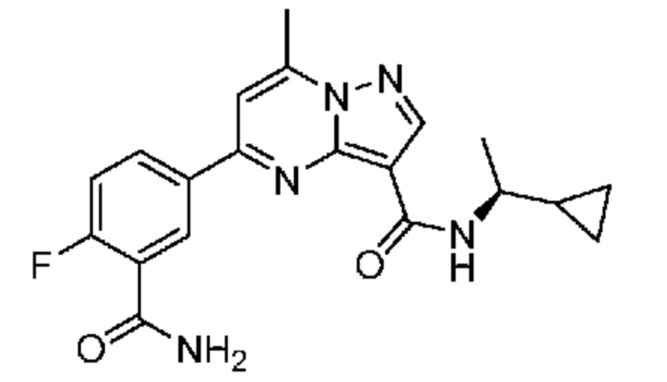
[00569] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (110 мг, 0,35 ммоля) и 3-карбамоил-4-фторфенилбороновая кислота давали искомое соединение (75 мг, 55%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,62 (d, J=6,0 Гц, 1H), 8,57 (s, 1H), 8,41 (brs, 1H), 8,21 (d, J=7,5 Гц, 1H), 7,98 (s, 1H), 7,92 (s, 1H), 7,84 (s, 1H), 7,57 (t, J=9,0 Гц, 1H), 3,60-3,56 (m, 1H), 2,86 (s, 3H), 1,30 (d, J=6,0 Гц, 3H), 1,13-1,10 (m, 1H), 0,53-0,50 (m, 2H), 0,35-0,32 (m, 2H). LC-MS m/z: 382,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=6,69 мин.
5-(6-Карбамоилпиридин-2-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
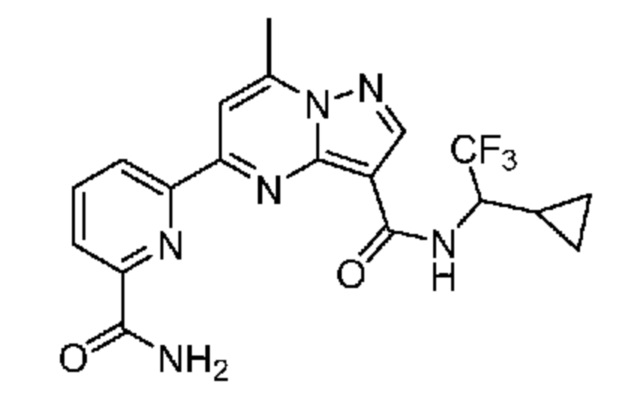
[00570] К смеси 5-(6-цианопиридин-2-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамида (38 мг, 0,095 ммоля) в DMSO (2 мл) при 25°C добавляли K2CO3 (2 мг, 0,014 ммоля) и H2O2 (4 мг, 0,014 ммоля) и смесь перемешивали в течение 15 ч и очищали с помощью препаративной ВЭЖХ (10 мМ NH4HCO3/MeCN) и получали искомое соединение (7,0 мг, 18%) в виде бледно-желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,78 (s, 1H), 8,72 (s, 1H), 8,66 (s, 1H), 8,57 (d, J=8,0 Гц, 1H), 8,53 (d, J=9,5 Гц, 1H), 8,29 (t, J=7,5 Гц, 1H), 8,23 (d, J=7,5 Гц, 1H), 7,95 (s, 1H), 4,45-4,41 (m, 1H), 2,93 (s, 3H), 1,42-1,38 (m, 1H), 0,74-0,70 (m, 1H), 0,66-0,60 (m, 2H), 0,43-0,39 (m, 1H). LC-MS m/z: 419,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,40 мин.
5-(3-Карбамоил-4-фторфенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
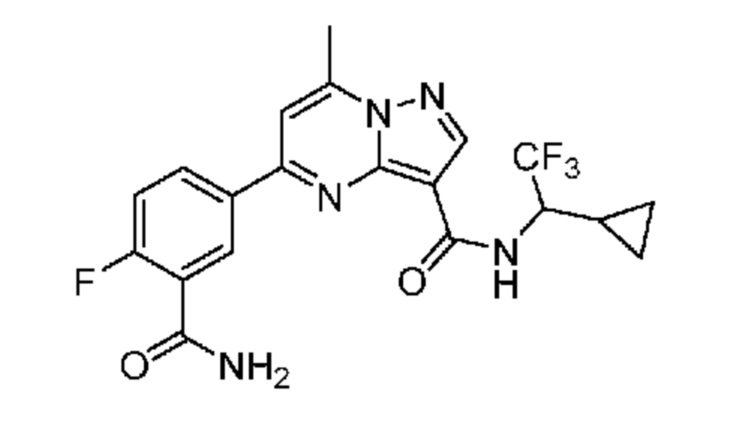
[00571] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и 3-карбамоил-4-фторфенилбороновая кислота давали искомое соединение (27,4 мг, 35%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,67 (s, 1H), 8,60-8,58 (m, 2H), 8,40-8,37 (m, 1H), 8,03 (s, 1H), 7,90 (s, 1H), 7,84 (s, 1H), 7,58 (t, J=9,0 Гц, 1H), 4,40-4,36 (m, 1H), 2,87 (s, 3H), 1,37-1,34 (m, 1H), 0,71-0,66 (m, 1H), 0,62-0,60 (m, 2H), 0,39-0,36 (m, 1H). LC-MS m/z: 436,0 [M+H]+. HPLC: Чистота (214 нм): 97,8%; tR=7,33 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(4-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
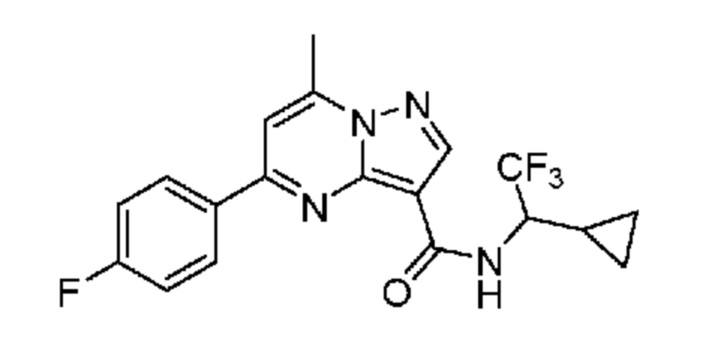
[00572] По общей методике A 5-(4-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,11 ммоля) и 1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (14 мг, 31%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,66 (s, 1H), 8,56 (d, J=9,5 Гц, 1H), 8,30 (dd, J=8,5 Гц, 5,0 Гц, 1H), 7,95 (s, 1H), 7,50 (t, J=9,0 Гц, 1H), 4,48-4,42 (m, 1H), 2,51 (s, 3H), 1,34-1,27 (m, 1H), 0,71-0,64 (m, 1H), 0,61-0,55 (m, 2H), 0,41-0,36 (m, 1H). LC-MS m/z: 393,0 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=9,19 мин.
5-(4-Фторфенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
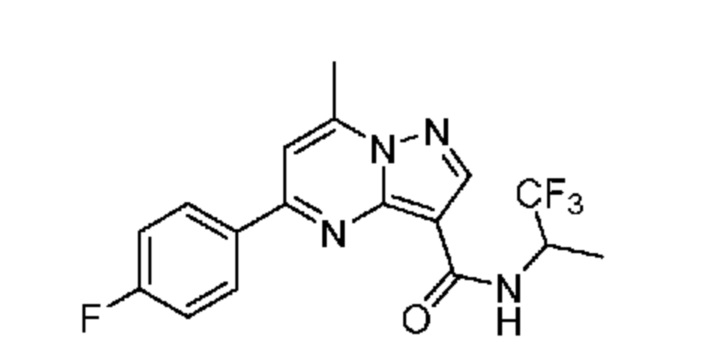
[00573] По общей методике A 5-(4-фторфенил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,11 ммоля) и 1,1,1-трифторпропан-2-амингидрохлорид давали искомое соединение (14 мг, 33%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,66 (s, 1H), 8,46 (d, J=9,5 Гц, 1H), 8,30 (dd, J=9,0 Гц, 6,0 Гц, 1H), 7,95 (s, 1H), 7,50 (t, J=9,0 Гц, 1H), 5,00-4,94 (m, 1H), 2,86 (s, 3H), 1,46 (d, J=6,5 Гц, 1H). LC-MS m/z: 367,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,86 мин.
5-(Циклопропиламино)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
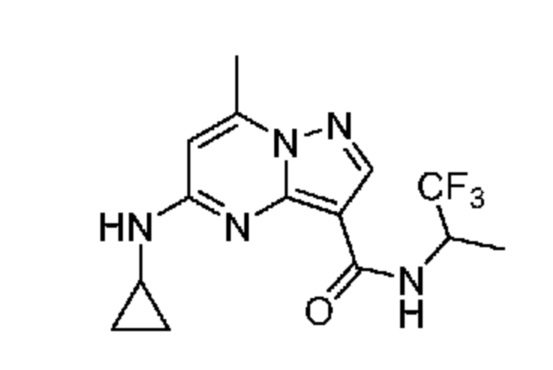
[00574] По общей методике A 5-(циклопропиламино)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,13 ммоля) и 1,1,1-трифторпропан-2-амингидрохлорид давали искомое соединение (24 мг, 57%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,64 (d, J=9,0 Гц, 1H), 8,28 (s, 1H), 8,19 (s, 1H), 6,22 (s, 1H), 4,90-4,84 (m, 1H), 2,70-2,66 (m, 1H), 2,56 (s, 3H), 1,36 (d, J=7,0 Гц, 3H), 0,80-0,76 (m, 2H), 0,56-0,52 (m, 2H). LC-MS m/z: 328,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,44 мин.
(S)-5-(Циклопропиламино)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
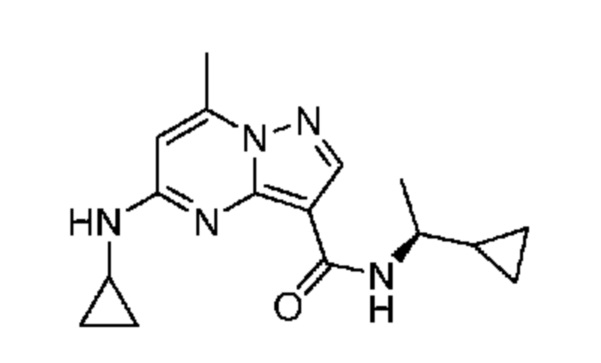
[00575] По общей методике A 5-(циклопропиламино)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,13 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (13 мг, 31%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,00 (s, 1H), 7,93 (s, 1H), 7,90 (s, 1H), 5,98 (s, 1H), 3,40-3,34 (m, 1H), 2,58-2,51 (m, 1H), 2,34 (s, 3H), 1,01 (d, J=6,5 Гц, 3H), 0,74-0,69 (m, 1H), 0,60-0,56 (m, 2H), 0,36-0,31 (m, 2H), 0,25-0,12 (m, 2H), 0,12-0,08 (m, 1H), 0,00- -0,05 (m, 1H). LC-MS m/z: 300,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,18 мин.
(R)-5-(Бензо[d]оксазол-5-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
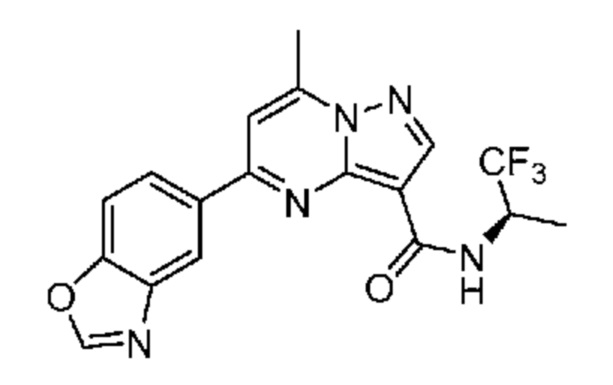
[00576] По общей методике D (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,26 ммоля) и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол давали искомое соединение (88 мг, 75%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,90 (s, 1H), 8,69 (d, J=2,0 Гц, 1H), 8,66 (s, 1H), 8,53 (d, J=9,0 Гц, 1H), 8,35 (dd, J=8,5 Гц, 1,5 Гц, 1H), 8,08 (s, 1H), 8,04 (d, J=8,5 Гц, 1H), 5,00-4,96 (m, 1H), 2,88 (s, 3H), 1,48 (d, J=7,0 Гц, 3H). LC-MS m/z: 390,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,90 мин.
(S)-5-(Бензо[d]оксазол-5-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
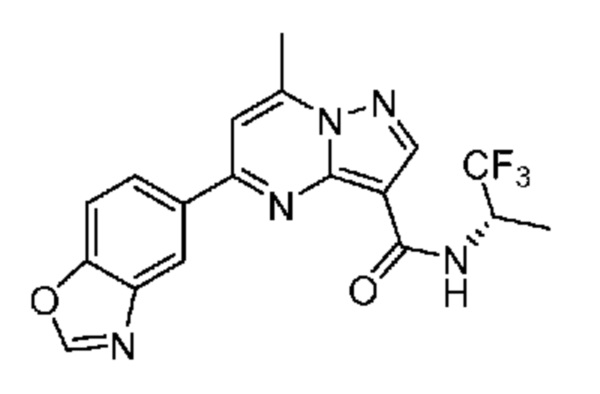
[00577] По общей методике D (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,32 ммоля) и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол давали искомое соединение (18 мг, 18%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,64 (s, 2H), 8,63 (s, 1H), 8,38 (d, J=8,5 Гц, 1H), 7,92 (d, J=8,5 Гц, 1H), 7,86 (s, 1H), 5,02-5,49 (m, 1H), 2,97 (s, 3H), 1,57 (d, J=7,0 Гц, 3H). LC-MS m/z: 390,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=7,90 мин.
5-(3-Хлор-1H-пиразол-1-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
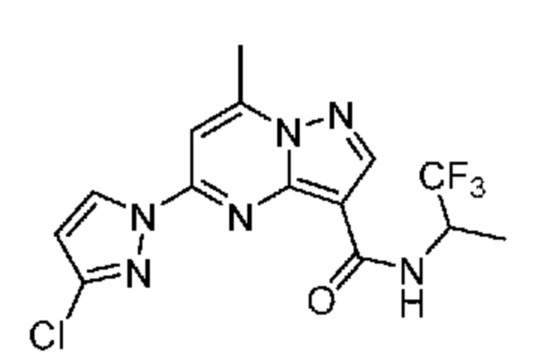
[00578] По общей методике G 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,23 ммоля) и 3-хлор-1H-пиразол давали искомое соединение (17 мг, 20%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,72 (d, J=2,0 Гц, 1H), 8,66 (s, 1H), 8,02 (d, J=9,0 Гц, 1H), 7,77 (s, 1H), 6,93 (d, J=3,0 Гц, 1H), 4,96-4,92 (m, 1H), 2,87 (s, 3H), 1,46 (d, J=7,0 Гц, 3H). LC-MS m/z: 373,0 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,79 мин.
5-(Бензо[d]оксазол-5-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
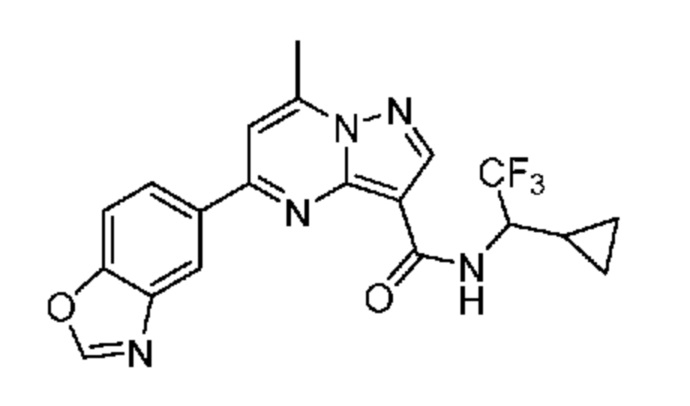
[00579] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол давали искомое соединение (45 мг, 36%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,91 (s, 1H), 8,70 (s, 1H), 8,67 (s, 1H), 8,62 (d, J=9,0 Гц, 1H), 8,36 (d, J=9,0 Гц, 1H), 8,10 (s, 1H), 8,05 (d, J=8,0 Гц, 1H), 4,53-4,48 (m, 1H), 2,88 (s, 3H), 1,32-1,28 (m, 1H), 0,73-0,69 (m, 1H), 0,62-0,57 (m, 2H), 0,43-0,40 (m, 1H). LC-MS m/z: 416,1 [M+H]+. HPLC: Чистота (214 нм): 98%; tR=9,09 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3-фтор-1H-пиразол-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
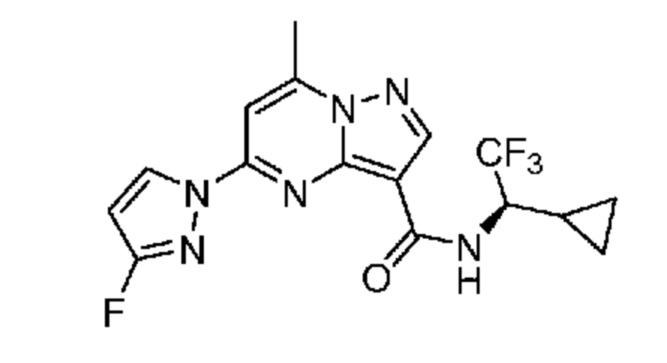
[00580] К раствору (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамида (80 мг, 0,24 ммоля) в безводном THF (3 мл) добавляли 3-фтор-1H-пиразол (25 мг, 0,288 ммоля) и K2CO3 (100 мг, 0,72 ммоля). Смесь перемешивали при 70°C в течение 8 ч, выливали в H2O (20 мл) и экстрагировали с помощью EA (20 мл×2). Органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью препаративной ТСХ (PE/EA=2/1) и получали искомое соединение (30 мг, 33%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,65 (s, 1H), 8,62 (t, J=3,0 Гц, 1H), 8,14 (d, J=9,5 Гц, 1H), 7,67 (s, 1H), 6,67 (q, J=3,0 Гц, 1H), 4,33-4,27 (m, 1H), 2,86 (s, 3H), 1,47-1,23 (m, 1H), 0,73-0,56 (m, 3H), 0,39-0,36 (m, 1H). LC-MS m/z: 383,1 [M+H]+. HPLC: Чистота (214 нм): 96,46%; tR=8,82 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3-фтор-1H-пиразол-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
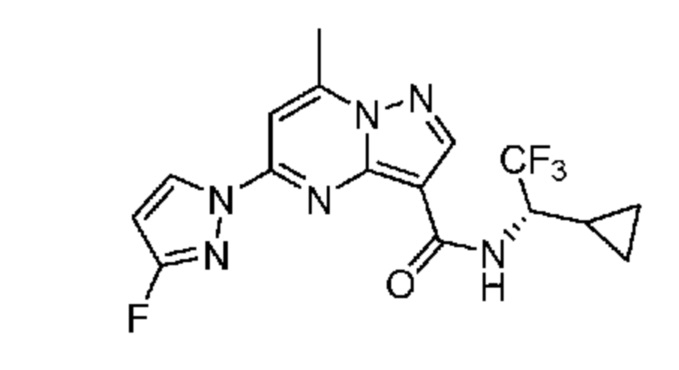
[00581] Смесь (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамида (70 мг, 0,21 ммоля), 3-фтор-1H-пиразола (18 мг, 0,21 ммоля) и K2CO3 (58 мг, 0,42 ммоля) в DMF (2 мл) перемешивали при 60°C в течение 2 ч, выливали в H2O (10 мл) и экстрагировали с помощью EA (30 мл×3). Объединенные органические фазы промывали с помощью H2O (50 мл) и рассолом (50 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA=2/1) и препаративной HPLC (10 мМ NH4HCO3/MeCN) и получали искомое соединение (14 мг, 24%) в виде белого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4): δ 8,59 (s, 1H), 8,55 (t, J=2,4 Гц, 1H), 7,65 (s, 1H), 7,44 (q, J=2,8 Гц, 1H), 4,36-4,30 (m, 1H), 2,92 (s, 3H), 1,40-1,34 (m, 1H), 0,82-0,75 (m, 1H), 0,70-0,58 (m, 2H), 0,52-0,46 (m, 1H). LC-MS m/z: 383,1 [M+H]+. HPLC: Чистота (214 нм): 93%; tR=8,83 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(6-(пиримидин-2-ил)пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
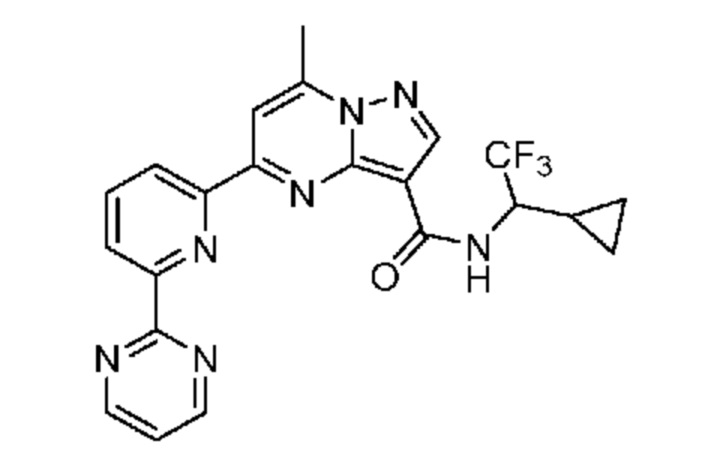
[00582] По общей методике F 2,6-дибромпиридин (2,0 г, 8,44 ммоля) и 2-(трибутилстаннил)пиримидин давали 2-(6-бромпиридин-2-ил)пиримидин (600 мг, 40%) в виде желтого твердого вещества. LC-MS m/z: 237,1 [M+H]+. Чистота по данным LC-MS (214 нм): > 89%; tR=1,45 мин.
[00583] По общей методике E* этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (200 мг, 0,83 ммоля) и 2-(6-бромпиридин-2-ил)пиримидин давали этил-7-метил-5-(6-(пиримидин-2-ил)пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (68 мг, 22%) в виде желтого твердого вещества. LC-MS m/z: 361,1 [M+H]+. Чистота по данным LC-MS (214 нм): > 96%; tR=1,67 мин.
[00584] По общей методике B* этил-7-метил-5-(6-(пиримидин-2-ил)пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (60 мг, 0,16 ммоля) давал 7-метил-5-(6-(пиримидин-2-ил)пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновую кислоту (43 мг, 83%) в виде желтого твердого вещества. LC-MS m/z: 333,1 [M+H]+. Чистота по данным LC-MS (214 нм): > 83%; tR=1,13 мин.
[00585] По общей методике A 7-метил-5-(6-(пиримидин-2-ил)пиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,12 ммоля) и 1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (10 мг, 18%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 9,08 (d, J=5,2 Гц, 1H), 8,74 (s, 1H), 8,60-8,54 (m, 3H), 8,32 (d, J=7,6 Гц, 1H), 8,26 (s, 1H), 7,66 (t, J=4,8 Гц, 1H), 4,48-4,41 (m, 1H), 2,96 (s, 3H), 1,45-1,37 (m, 1H), 0,75-0,70 (m, 1H), 0,66-0,60 (m, 2H), 0,46-0,40 (m, 1H). LC-MS m/z: 454,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,23 мин.
5-(3-(1,2,4-Оксадиазол-3-ил)фенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
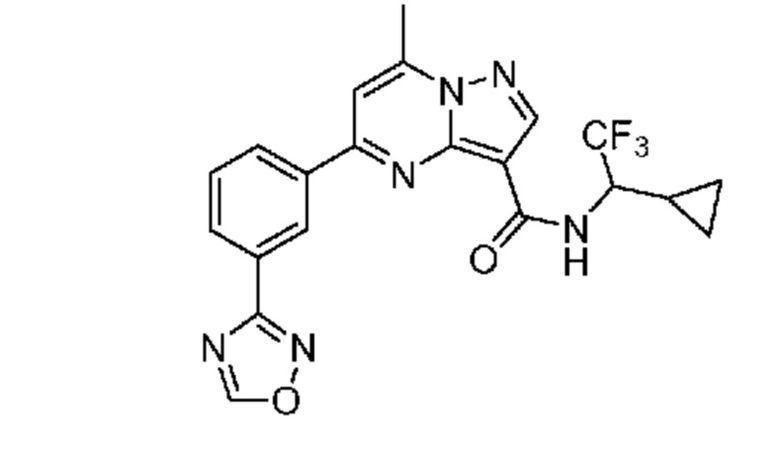
[00586] К раствору гидроксиламингидрохлорида (1,15 г, 16,5 ммоля) и Na2CO3 (1,0 г, 9,9 ммоля) в 16 мл H2O и 8 мл EtOH добавляли 3-бромбензонитрил (1,2 г, 6,6 ммоля). Реакционную смесь кипятили с обратным холодильником в течение 6 ч и экстрагировали с помощью EA (3×40 мл). Объединенные органические слои промывали рассолом (100 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 3-бром-N-гидроксибензимидамид (800 мг, 56%) в виде белого твердого вещества. LC-MS m/z: 215,0 [M+H]+.
[00587] К раствору 3-бром-N-гидроксибензимидамида (1,5 г, 7,0 ммоля) в триэтоксиметане (5,0 мл) добавляли p-TsOH•H2O (133 мг, 0,7 ммоля). Реакционную смесь перемешивали при 90°C в течение 16 ч и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии и получали 3-(3-бромфенил)-1,2,4-оксадиазол в виде белого твердого вещества (900 мг, 57%). LC-MS m/z: 225,1 [M+H]+.
[00588] По общей методике D 3-(3-бромфенил)-1,2,4-оксадиазол (100 мг, 0,45 ммоля) и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) давали 3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1,2,4-оксадиазол, который использовали на следующей стадии без дополнительной очистки. LC-MS m/z: 273,1 [M+H]+.
[00589] По общей методике D 3-(3-бромфенил)-1,2,4-оксадиазол (100 мг, 0,45 ммоля) и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) давали 3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1,2,4-оксадиазол, который использовали на следующей стадии без дополнительной очистки. LC-MS m/z: 273,1 [M+H]+.
[00590] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (66 мг, 0,19 ммоля) и 3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1,2,4-оксадиазол давали искомое соединение (10 мг, 20%) в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 8,88 (s, 1H), 8,82 (s, 1H), 8,72 (s, 1H), 8,64 (d, J=9,0 Гц, 1H), 8,33 (d, J=7,5 Гц, 1H), 8,29 (d, J=7,5 Гц, 1H), 7,73 (t, J=7,5 Гц, 1H), 7,44 (s, 1H), 4,45-4,42 (m, 1H), 2,96 (s, 3H), 1,36-1,30 (m, 1H), 0,76-0,73 (m, 1H), 0,65-0,52 (m, 3H). LC-MS m/z: 443,1 [M+H]+. HPLC: Чистота (254 нм): 99%; tR=8,80 мин.
5-(3-(1,3,5-Триазин-2-ил)фенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
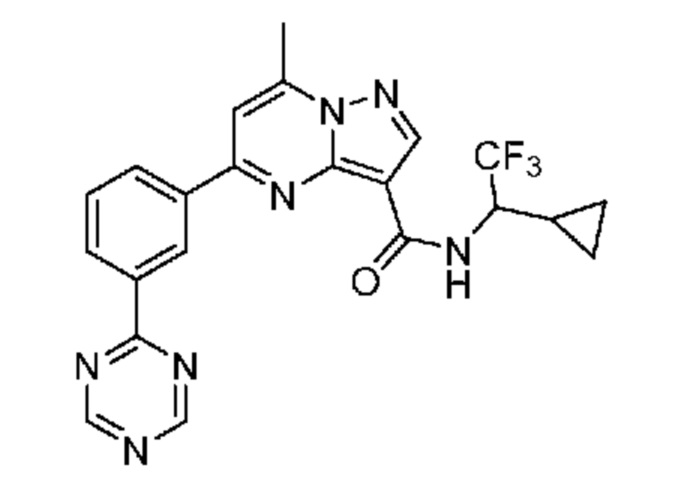
[00591] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (93 мг, 0,28 ммоля) и 2-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1,3,5-триазин давали искомое соединение (64,5 мг, 51%) в виде серого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,39 (s, 3H), 8,70 (s, 1H), 8,68 (d, J=10,0 Гц, 1H), 8,66 (d, J=8,0 Гц, 1H), 8,53 (d, J=8,0 Гц, 1H), 8,07 (s, 1H), 7,87 (t, J=8,0 Гц, 1H), 4,46-4,37 (m, 1H), 2,91 (s, 3H), 1,49-1,43 (m, 1H), 0,82-0,76 (m, 1H), 0,70-0,61 (m, 2H), 0,46-0,40 (m, 1H). LC-MS m/z: 454,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,85 мин.
5-(Изотиазол-5-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
[00592] По общей методике A 5-(изотиазол-5-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (35 мг, 0,13 ммоля) и 1,1,1-трифторпропан-2-амингидрохлорид давали искомое соединение (13,5 мг, 28%) в виде белого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4) δ 8,67 (d, J=2,0 Гц, 1H), 8,64 (s, 1H), 8,10 (d, J=2,0 Гц, 1H), 7,74 (s, 1H), 5,00-4,93 (m, 1H), 2,94 (s, 3H), 1,55 (d, J=7,2 Гц, 3H). LC-MS m/z: 356,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,69 мин.
5-(3,3-Дифторпиперидин-1-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
[00593] По общей методике G 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,26 ммоля) и 3,3-дифторпиперидингидрохлорид давали искомое соединение (67 мг, 66%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,27 (s, 1H), 8,23 (d, J=9,5 Гц, 1H), 7,05 (s, 1H), 4,89-4,85 (m, 1H), 4,13 (t, J=12,5 Гц, 2H), 3,80 (brs, 2H), 2,63 (s, 3H), 2,20-2,12 (m, 2H), 1,78 (brs, 2H), 1,36 (d, J=7,0 Гц, 3H). LC-MS m/z: 392,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,94 мин.
5-(3,3-Дифторпирролидин-1-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
[00594] По общей методике G 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,26 ммоля) и 3,3-дифторпирролидингидрохлорид давали искомое соединение (68 мг, 68%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,27 (s, 2H), 6,64 (brs, 1H), 4,89-4,84 (m, 1H), 4,08-4,00 (m, 2H), 3,85-3,80 (m, 2H), 2,65 (s, 3H), 2,66-2,64 (m, 2H), 1,38 (d, J=7,0 Гц, 3H). LC-MS m/z: 378,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,91 мин.
5-(4,4-Дифторпиперидин-1-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
[00595] По общей методике G 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,26 ммоля) и 4,4-дифторпиперидингидрохлорид давали искомое соединение (60 мг, 59%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,27 (s, 1H), 8,22 (d, J=9,5 Гц, 1H), 7,03 (s, 1H), 4,89-4,84 (m, 1H), 3,86 (brs, 4H), 2,63 (s, 3H), 2,13-2,06 (m, 4H), 1,37 (d, J=7,0 Гц, 3H). LC-MS m/z: 392,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,14 мин.
(S)-5-(Бензо[d][1,3]диоксол-4-ил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
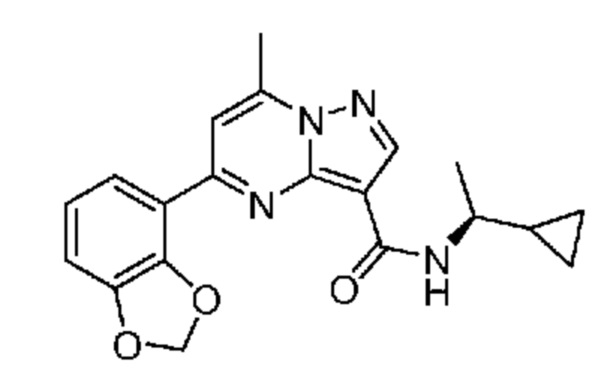
[00596] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,28 ммоля) и бензо[d][1,3]диоксол-4-илбороновая кислота давали искомое соединение (77 мг, 77%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,57 (s, 1H), 8,21 (d, J=8,0 Гц, 1H), 7,80 (s, 1H), 7,72 (d, J=8,0 Гц, 1H), 7,15 (d, J=7,0 Гц, 1H), 7,09 (t, J=8,0 Гц, 1H), 6,26 (s, 1H), 6,25 (s, 1H), 3,65-3,61 (m, 1H), 2,85 (s, 3H), 1,28 (d, J=6,5 Гц, 3H), 1,05-1,01 (m, 1H), 0,54-0,42 (m, 2H), 0,38-0,26 (m, 2H). LC-MS m/z: 365,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,58 мин.
5-(Бензо[d][1,3]диоксол-4-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
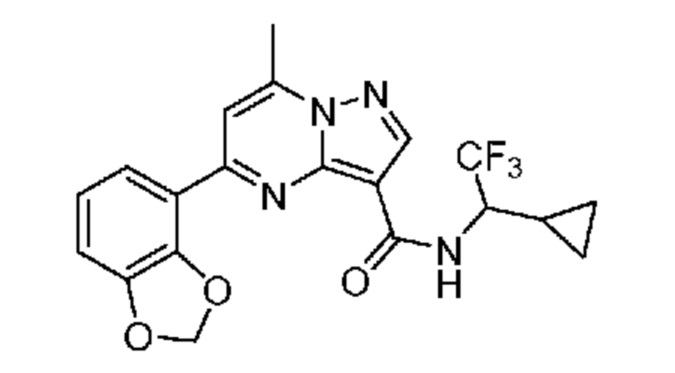
[00597] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и бензо[d][1,3]диоксол-4-илбороновая кислота давали искомое соединение (29 мг, 39%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,66 (s, 1 H), 8,64 (d, J=10,0 Гц, 1H), 7,86 (s, 1 H), 7,67 (d, J=8,5 Гц, 1H), 7,17 (d, J=8,0 Гц, 1H), 7,08 (t, J=8,0 Гц, 1H), 6,26 (s, 1H), 6,20 (s, 1H), 4,47-4,42 (m, 1H), 2,87 (s, 3H), 1,25-1,22 (m, 1H), 0,72-0,68 (m, 1H), 0,60-0,56 (m, 2H), 0,38-0,35 (m, 1H). LC-MS m/z: 419,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,08 мин.
5,7-Диметил-N-(2,2,2-трифтор-1-(4-фторфенил)этил)пиразоло[1,5-a]пиримидин-3-карбоксамид
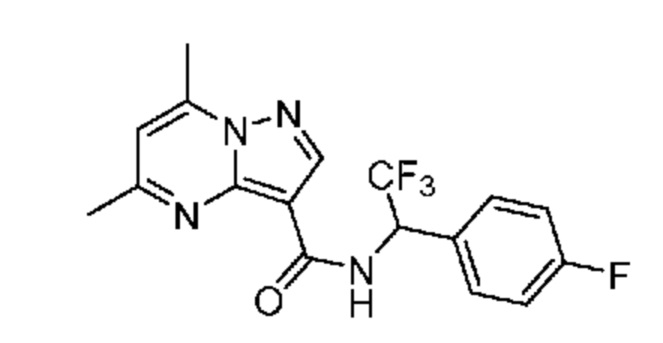
[00598] По общей методике A 5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (50 мг, 0,52 ммоля) и 2,2,2-трифтор-1-(4-фторфенил)этанамин давали искомое соединение (36 мг, 38%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,54 (s, 1H), 7,64 (dd, J=8,5 Гц, 5,5 Гц, 2H), 7,23 (t, J=8,5 Гц, 2H), 7,08 (s, 1H), 5,99 (q, J=8,0 Гц, 1H), 2,81 (s, 3H), 2,76 (s, 3H). LC-MS m/z: 367,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=9,77 мин.
5-(5-Цианофуран-2-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
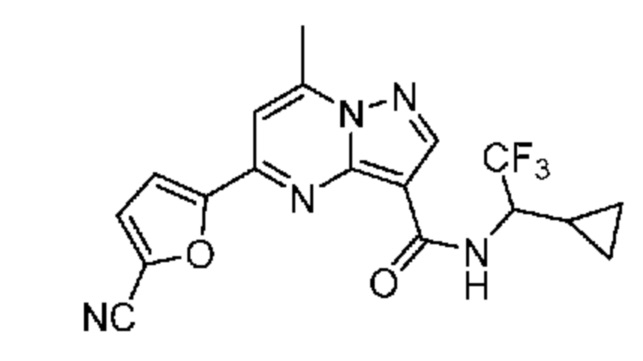
[00599] По общей методике E* 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 5-бромфуран-2-карбонитрил давали искомое соединение (3 мг, 3%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,71 (s, 1H), 8,43 (d, J=9,5 Гц, 1H), 7,90 (d, J=4,0 Гц, 1H), 7,84 (s, 1H), 7,68 (d, J=4,0 Гц, 1H), 4,55-4,48 (m, 1H), 2,86 (s, 3H), 1,36-1,29 (m, 1H), 0,70-0,64 (m, 1H), 0,62-0,52 (m, 2H), 0,51-0,45 (m, 1H). LC-MS m/z: 390,0 [M+H]+. HPLC: Чистота (214 нм): 97%; tR=9,17 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(фуран-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
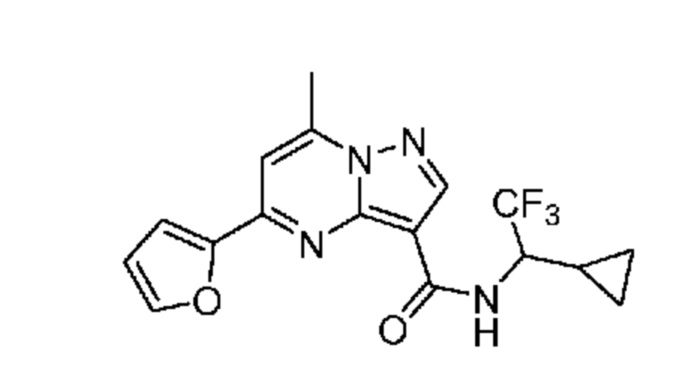
[00600] По общей методике F 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и трибутил(фуран-2-ил)станнан давали искомое соединение (23 мг, 30%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,61 (s, 1H), 8,52 (d, J=9,6 Гц, 1H), 8,10 (d, J=1,6 Гц, 1H), 7,67 (s, 1H), 7,49 (d, J=3,2 Гц, 1H), 6,85 (dd, J=3,2 Гц, 1,6 Гц, 1H), 4,54-4,45 (m, 1H), 2,83 (s, 3H), 1,34-1,26 (m, 1H), 0,70-0,44 (m, 4H). LC-MS m/z: 365,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,73 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(фуран-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
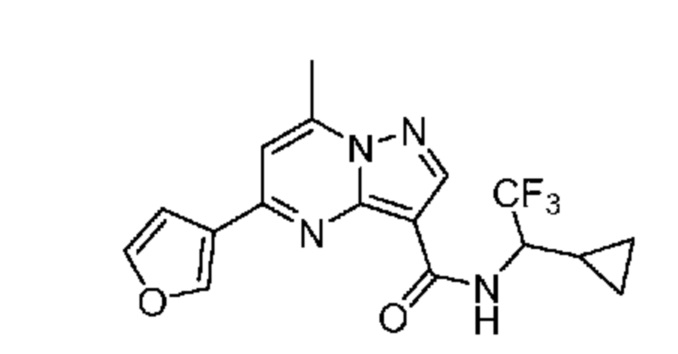
[00601] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и фуран-3-илбороновая кислота давали искомое соединение (75 мг, 79%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4) δ 8,54 (s, 1H), 8,44 (s, 1H), 7,74 (t, J=1,6 Гц, 1H), 7,48 (s, 1H), 7,06 (d, J=1,6 Гц, 1H), 4,46-4,42 (m, 1H), 2,86 (s, 3H), 1,33-1,31 (m, 1H), 0,78-0,76 (m, 1H), 0,67-0,64 (m, 1H), 0,57-0,52 (m, 2H). LC-MS m/z: 365,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=10,32 мин.
5-(4-Цианотиофен-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
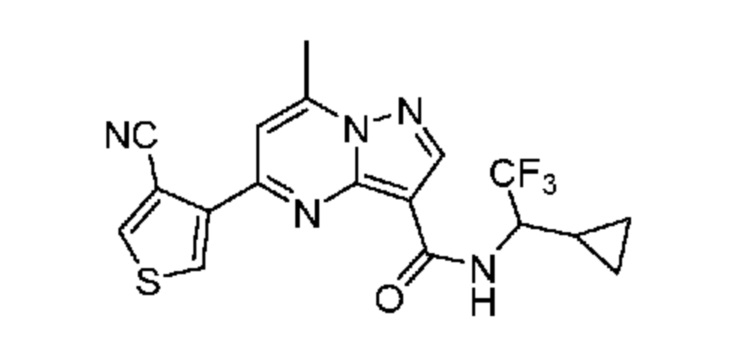
[00602] По общей методике E* 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 4-бромтиофен-3-карбонитрил давали искомое соединение (12 мг, 12%) в виде белого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4): δ 8,66 (s, 1H), 8,55 (d, J=3,0 Гц, 1H), 8,53 (d, J=3,0 Гц, 1H), 7,68 (s, 1H), 4,16-4,12 (m, 1H), 2,94 (s, 3H), 1,68-1,65 (m, 1H), 0,80-0,76 (m, 1H), 0,63-0,58 (m, 2H), 0,39-0,34 (m, 1H). LC-MS m/z: 406,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,93 мин.
5-(3-Цианотиофен-2-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
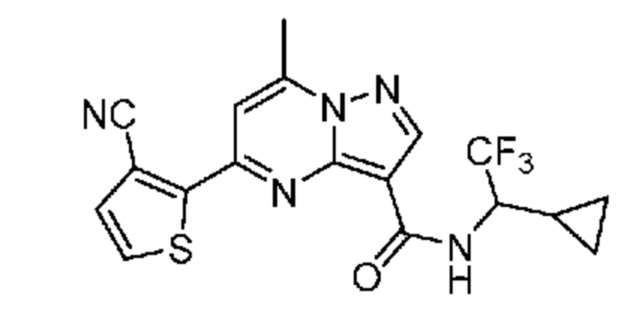
[00603] По общей методике E* 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,301 ммоля) и 2-бромтиофен-3-карбонитрил давали искомое соединение (2,3 мг, 2%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,69 (s, 1H), 7,97 (d, J=5,5 Гц, 1H), 7,80 (s, 1H), 7,60 (d, J=5,0 Гц, 1H), 4,30-4,26 (m, 1H), 2,97 (s, 1H), 1,53-1,50 (m, 1H), 0,81-0,78 (m, 1H), 0,64-0,60 (m, 2H), 0,46-0,44 (m, 1H). LC-MS m/z: 406,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=10,13 мин.
N-((1R,4R)-4-трет-бутоксициклогексил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид
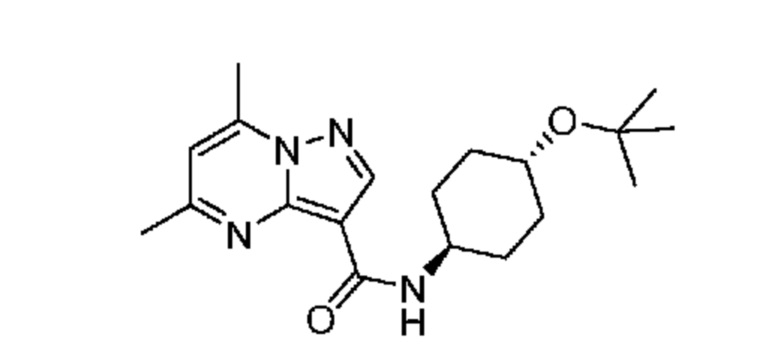
[00604] По общей методике A 5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (50 мг, 0,26 ммоля) и (1R,4R)-4-трет-бутоксициклогексанамин давали искомое соединение (22 мг, 38%) в виде светло-коричневого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4):δ 8,48 (s, 1H), 7,01 (s, 1H), 3,90-3,88 (m, 1H), 3,63-3,60 (m, 1H), 2,78 (s, 3H), 2,67 (s, 3H), 2,13-2,10 (m, 2H), 1,93-1,91 (m, 2H), 1,52-1,46 (m, 4H), 1,24 (s, 9H). LC-MS m/z: 345,2 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=8,55 мин.
N-((1R,4R)-4-изо-Бутоксициклогексил)-5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоксамид
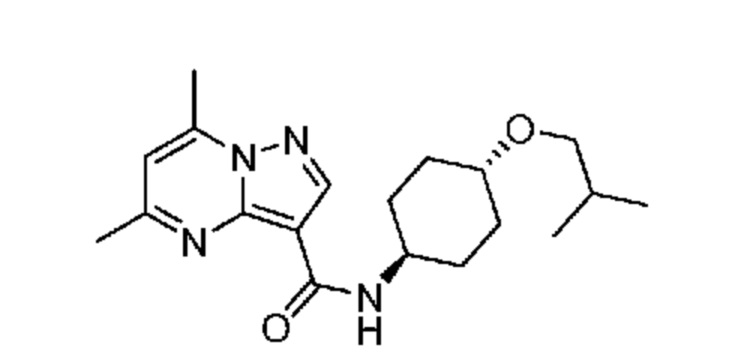
[00605] По общей методике A 5,7-диметилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (100 мг, 0,52 ммоля) и (1R,4R)-4-изо-бутоксициклогексанамин давали искомое соединение (56 мг, 31%) в виде светло-коричневого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,31 (s, 1H), 6,85 (s, 1H), 3,82-3,78 (m, 1H), 3,26-3,20 (m, 1H), 3,15 (d, J=6,5 Гц, 2H), 2,64 (s, 3H), 2,53 (s, 3H), 2,02-1,94 (m, 4H), 1,72-1,66 (m, 1H), 1,38-1,30 (m, 4H), 0,81 (d, J=6,5 Гц, 6H). LC-MS m/z: 345,2 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=9,65 мин.
(S)-5-(Бензо[d]тиазол-5-ил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
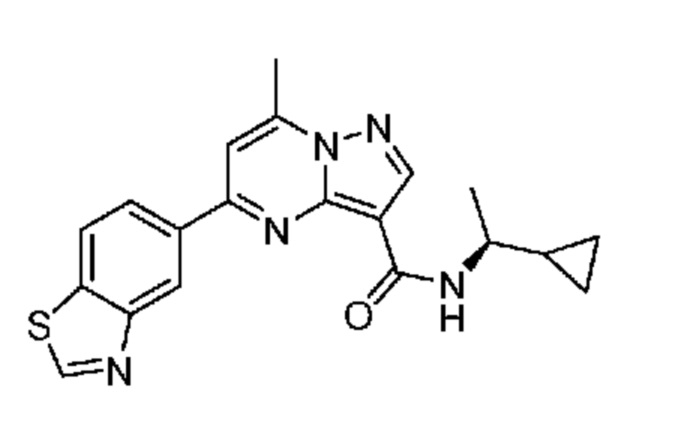
[00606] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и бензо[d]тиазол-5-илбороновая кислота давали искомое соединение (72 мг, 64%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,53 (s, 1H), 8,98 (s, 1H), 8,56 (s, 1H), 8,41 (d, J=8,5 Гц, 1H), 8,38 (d, J=8,5 Гц, 1H), 8,26 (d, J=6,0 Гц, 1H), 8,08 (s, 1H), 3,68-3,63 (m, 1H), 2,87 (s, 3H), 1,31 (d, J=6,0 Гц, 3H), 1,15-1,11 (m, 1H), 0,60-0,51 (m, 2H), 0,44-0,40 (m, 1H), 0,40-0,32 (m, 1H). LC-MS m/z: 378,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,08 мин.
(R)-5-(Бензо[d]тиазол-5-ил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
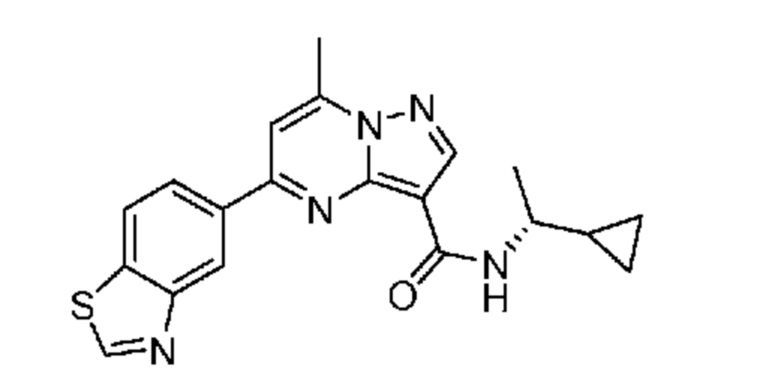
[00607] По общей методике D (R)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и бензо[d]тиазол-5-илбороновая кислота давали искомое соединение (38 мг, 34%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 9,55 (s, 1H), 9,02 (s, 1H), 8,59 (s, 1H), 8,46-8,40 (m, 2H), 8,29 (d, J=7,6 Гц, 1H), 8,12 (s, 1H), 3,68-3,61 (m, 1H), 2,89 (s, 3H), 1,31 (d, J=6,4 Гц, 1H), 1,17-1,10 (m, 1H), 0,60-0,52 (m, 2H), 0,46-0,32 (m, 2H). LC-MS m/z: 378,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,07 мин.
(R)-5-(5-Фтор-2-метоксифенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
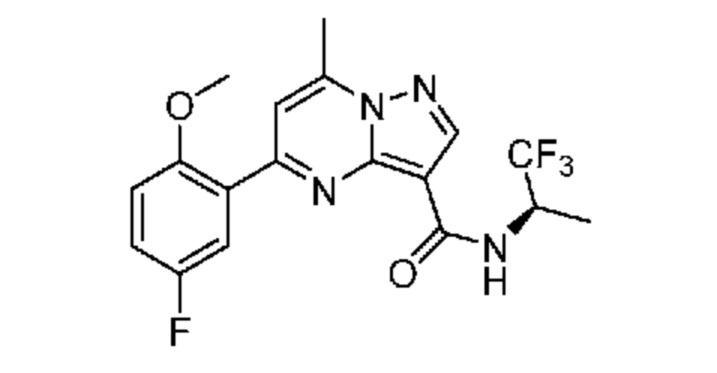
[00608] По общей методике D (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,23 ммоля) и 5-фтор-2-метоксифенилбороновая кислота давали искомое соединение (36 мг, 39%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,67 (s, 1H), 8,45 (d, J=9,5 Гц, 1H), 7,79 (d, J=1,0 Гц, 1H), 7,69 (dd, J=9,5 Гц, 3,0 Гц, 1H), 7,43 (td, J=9,0 Гц, 3,0 Гц, 1H), 7,30 (dd, J=9,5 Гц, 4,5 Гц, 1H), 4,96-4,90 (m, 1H), 3,92 (s, 3H), 2,86 (s, 3H), 1,39 (d, J=7,0 Гц, 3H). LC-MS m/z: 397,1 [M+H]+. HPLC: Чистота (214 нм): 99,15%; tR=8,83 мин.
(S)-5-(5-Фтор-2-метоксифенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
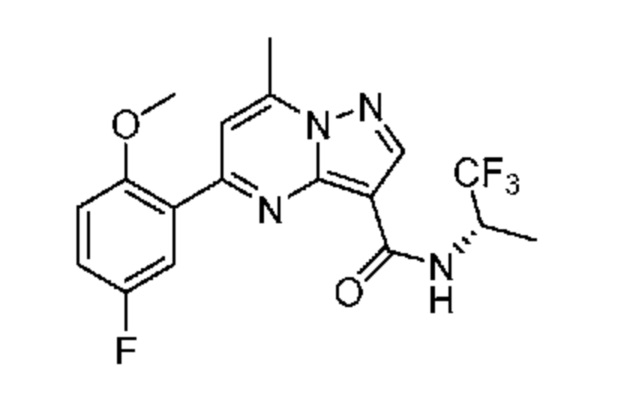
[00609] По общей методике D (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,32 ммоля) и 5-фтор-2-метоксифенилбороновая кислота давали искомое соединение (18 мг, 14%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,68 (s, 1H), 8,46 (d, J=9,2 Гц, 1H), 7,79 (s, 1H), 7,69 (dd, J=9,6 Гц, 3,2 Гц, 1H), 7,44 (td, J=8,0 Гц, 3,2 Гц, 1H), 7,30 (dd, J=8,8 Гц, 4,4 Гц, 1H), 4,97-4,91 (m, 1H), 3,92 (s, 3H), 2,85 (s, 3H), 1,40 (d, J=6,4 Гц, 3H). LC-MS m/z: 397,1 [M+H]+. HPLC: Чистота (254 нм): 98%; tR=8,84 мин.
(S)-N-(1-Циклопропилэтил)-5-(изотиазол-5-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
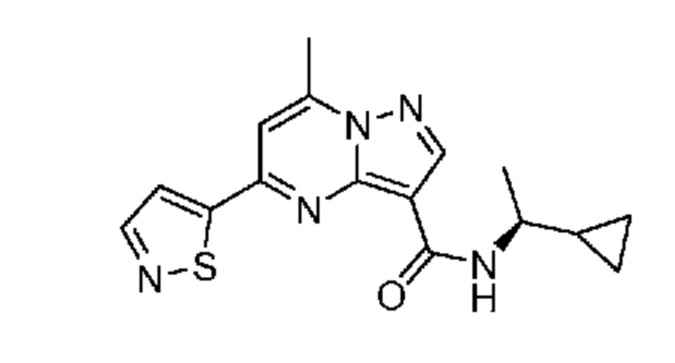
[00610] По общей методике A 5-(изотиазол-5-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (35 мг, 0,13 ммоля) и (S)-1-циклопропилэтанамин давали искомое соединение (18,6 мг, 42%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4) δ 8,66 (d, J=2,0 Гц, 1H), 8,60 (s, 1H), 8,24 (d, J=7,6 Гц, 1H), 8,09 (d, J=2,0 Гц, 1H), 7,70 (s, 1H), 3,70-3,65 (m, 1H), 2,93 (s, 3H), 1,41 (d, J=6,4 Гц, 3H), 1,13-1,10 (m, 1H), 0,66-0,58 (m, 2H), 0,49-0,44 (m, 1H), 0,39-0,35 (m, 1H). LC-MS m/z: 328,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=9,64 мин.
(R)-N-(1-Циклопропилэтил)-5-(изотиазол-5-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
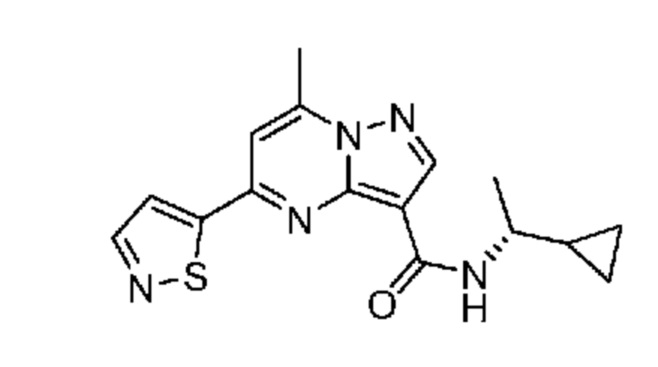
[00611] К раствору 5-бромизотиазола (325 мг, 2,0 ммоля) в безводном THF (10 мл) при -78°C в атмосфере N2 добавляли n-BuLi (1,0 мл, 2,5 ммоля, 2,5M раствор в гексане). Смесь перемешивали при -78°C в течение 0,5 ч, затем при -78°C добавляли Bu3SnCl (750 мг, 2,0 ммоля) и перемешивали при -78°C в течение еще 1 ч, затем давали нагреться до RT. После концентрирования в вакууме остаток очищали с помощью препаративной ТСХ и получали 5-(трибутилстаннил)изотиазол (500 мг) в виде бесцветного масла. LC-MS m/z: 276,0 [M+H]+, tR=2,87 мин.
[00612] По общей методике F (R)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (55 мг, 0,2 ммоля) и 5-(трибутилстаннил)изотиазол давали искомое соединение (4 мг, 12%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4) δ 8,68 (d, J=1,2 Гц, 1H), 8,62 (s, 1H), 8,11 (s, 1H), 7,72 (s, 1H), 3,73-3,66 (m, 1H), 2,94 (s, 3H), 8,43 (d, J=5,2 Гц, 3H), 1,16-1,12 (m, 1H), 0,67-0,58 (m, 2H), 0,51-0,46 (m, 1H), 0,41-0,36 (m, 1H). LC-MS m/z: 328,1 [M+H]+. HPLC: Чистота (254 нм): > 99%, tR=7,81 мин.
5-(4-Фторпиридин-3-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
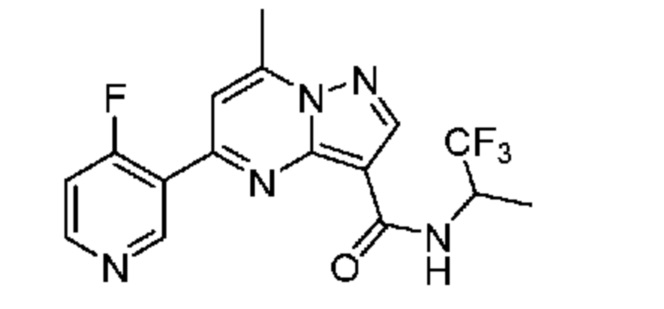
[00613] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,326 ммоля) и 4-фторпиридин-3-илбороновая кислота давали искомое соединение (32 мг, 27%) в виде серовато-желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,25 (d, J=10,0 Гц, 1H), 8,80 (t, J=7,0 Гц, 1H), 8,74 (s, 1H), 8,41 (d, J=9,0 Гц, 1H), 7,82 (s, 1H), 7,64 (dd, J=11,5 Гц, 6,0 Гц, 1H), 4,98-4,93 (m, 1H), 2,89 (s, 3H), 1,41 (d, J=7,0 Гц, 1H). LC-MS m/z: 368,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,37 мин.
(R)-5-(5-Хлорпиридин-3-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
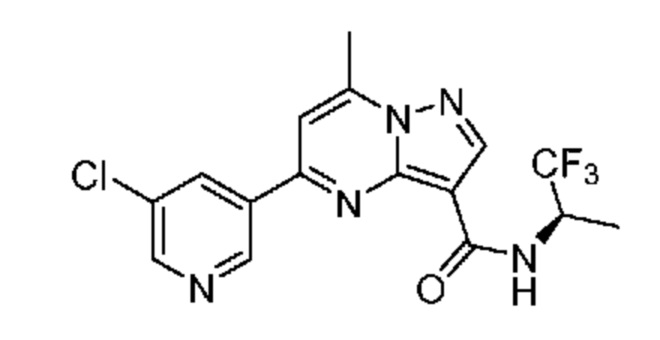
[00614] По общей методике D (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,23 ммоля) и 5-хлорпиридин-3-илбороновая кислота давали искомое соединение (22,6 мг, 28%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,38 (d, J=2,0 Гц, 1H), 8,86 (d, J=2,5 Гц, 1H), 8,71 (s, 1H), 8,70 (t, J=2,5 Гц, 1H), 8,40 (d, J=9,0 Гц, 1H), 8,10 (s, 1H), 4,99-4,95 (m, 1H), 2,88 (s, 3H), 1,45 (d, J=7,0 Гц, 3H). LC-MS m/z: 384,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,25 мин.
(S)-5-(5-Хлорпиридин-3-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
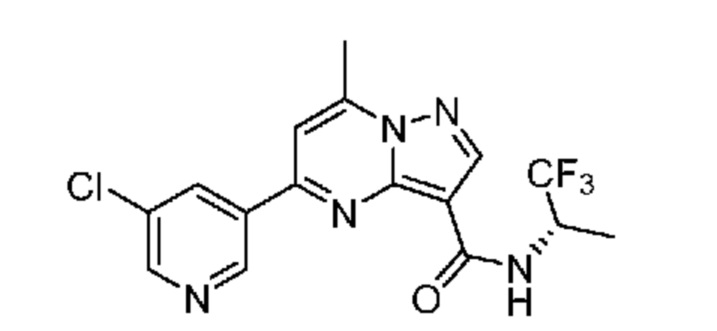
[00615] По общей методике D (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (110 мг, 0,35 ммоля) и 5-хлорпиридин-3-илбороновая кислота давали искомое соединение (55 мг, 41%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,39 (d, J=1,5 Гц, 1H), 8,87 (d, J=2,0 Гц, 1H), 8,73 (s, 1H), 8,71 (t, J=2,0 Гц, 1H), 8,40 (d, J=9,5 Гц, 1H), 8,11 (s, 1H), 5,00-4,96 (m, 1H), 2,89 (s, 3H), 1,45 (d, J=7,0 Гц, 3H). LC-MS m/z: 384,1 [M+H]+. HPLC: Чистота (214 нм): 98%; tR=8,25 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3-фторпиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
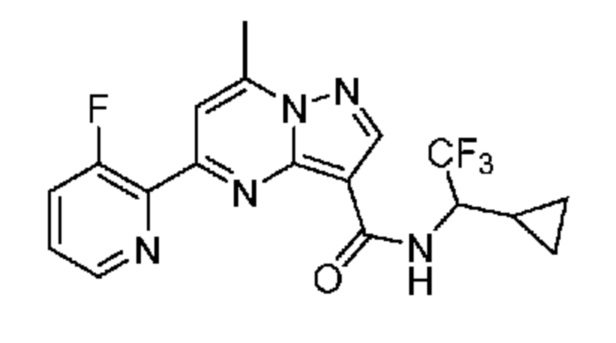
[00616] По общей методике E* 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 2-бром-3-фторпиридин давали искомое соединение (5,2 мг, 6%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,72 (s, 1H), 8,69 (d, J=2,5 Гц, 1H), 8,64 (d, J=9,5 Гц, 1H), 8,09 (s, 1H), 8,04 (dd, J=12,5 Гц, 9,0 Гц, 1H), 7,76-7,73 (m, 1H), 4,42 (m, 1H), 2,91 (s, 3H), 1,23-1,19 (m, 1H), 0,72-0,68 (m, 1H), 0,59-0,57 (m, 2H), 0,39-0,37 (m, 1H). LC-MS m/z: 394,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,61 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(5-фторпиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
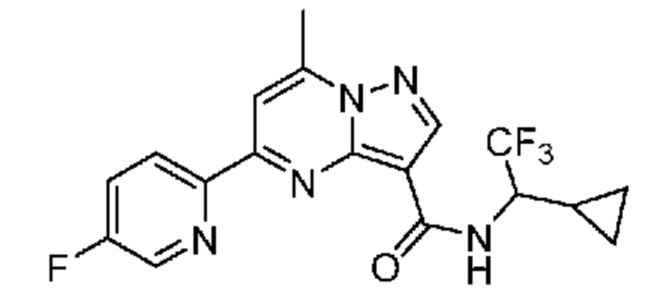
[00617] По общей методике E* 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 2-бром-5-фторпиридин давали искомое соединение (14 мг, 15%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,83(d, J=2,5 Гц, 1H), 8,71 (s, 1H), 8,50 (d, J=10,5 Гц, 1H), 8,49-8,46 (m, 1H), 8,14 (s, 1H), 8,10 (td, J=9,0 Гц, 3,0 Гц, 1H), 4,44-4,39 (m, 1H), 2,91 (s, 3H), 1,38-1,35 (m, 1H), 0,72-0,69 (m, 1H), 0,63-0,59 (m, 2H), 0,40-0,47 (m, 1H). LC-MS m/z: 394,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,11 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(4-фторпиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
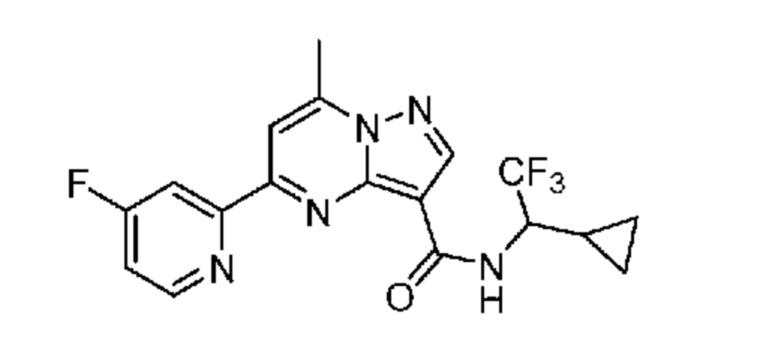
[00618] По общей методике E* 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 2-бром-4-фторпиридин давали искомое соединение (4,3 мг, 2%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,87 (dd, J=8,4 Гц, 5,2 Гц, 1H), 8,74 (s, 1H), 8,50 (d, J=9,6 Гц, 1H), 8,20 (s, 1H), 8,18 (dd, J=9,6 Гц, 2,4 Гц, 1H), 7,64-7,60 (m, 1H), 4,50-4,42 (m, 1H), 2,92 (s, 3H), 1,37-1,30 (m, 1H), 0,74-0,67 (m, 1H), 0,64-0,55 (m, 2H), 0,45-0,39 (m, 1H). LC-MS m/z: 394,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,94 мин.
5-(3-Хлорпиридин-2-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
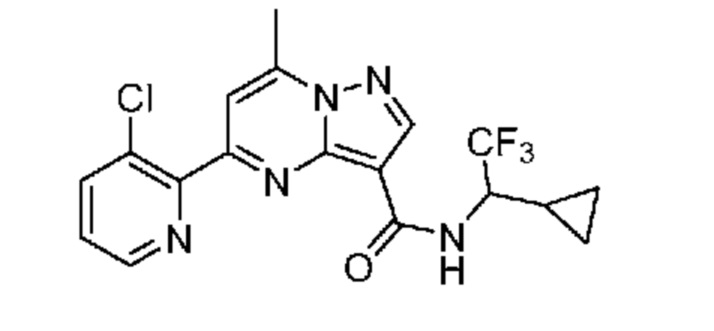
[00619] К раствору 2-бром-3-хлорпиридина (576 мг, 3 ммоля) в толуоле (20 мл) в атмосфере N2 при -78°C по каплям добавляли n-BuLi (2,5 M, 1,32 мл, 3,3 ммоля). Реакционную смесь перемешивали в течение 2 ч, затем добавляли SnBu3Cl (1,07 г, 3,3 ммоля). Реакционную смесь перемешивали в течение 2 ч при -78°C, нагревали до RT и перемешивали в течение еще 2 ч и затем реакцию останавливали насыщенным раствором NH4Cl (10 мл). Смесь экстрагировали с помощью EA (30 мл×3) и объединенные органические слои промывали рассолом (15 мл), сушили (Na2SO4) и фильтровали. Фильтрат концентрировали в вакууме и получали 3-хлор-2-(трибутилстаннил)пиридин (1,0 г, 83%) в виде бесцветного масла. LC-MS m/z: 404,1 [M+H]+. tR=2,04 мин.
[00620] По общей методике F 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и 3-хлор-2-(трибутилстаннил)пиридин давали искомое соединение (42 мг, 52%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,79 (d, J=4,0 Гц, 1H), 8,74 (s, 1H), 8,48 (d J=9,5 Гц, 1H), 8,23 (d, J=8,0 Гц, 1H), 7,90 (s, 1H), 7,67 (dd, J=8,0 Гц, 4,5 Гц, 1H), 4,40-4,32 (m, 1H), 2,91 (s, 3H), 1,20-1,15 (m, 1H), 0,70-0,67 (m, 1H), 0,63-0,60 (m, 1H), 0,58-0,51 (m, 1H), 0,35-0,31 (m, 1H). LC-MS m/z: 410,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,78 мин.
5-(4-Хлорпиридин-2-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
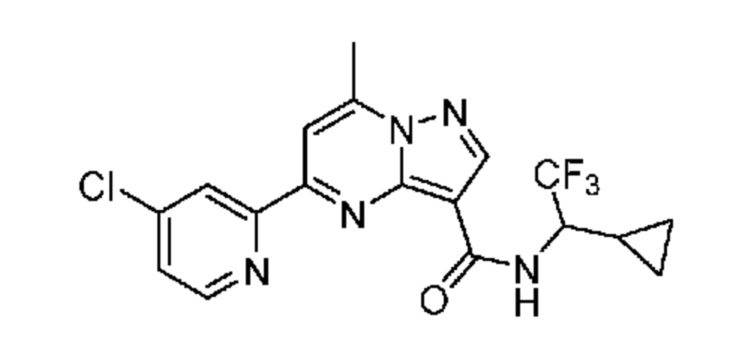
[00621] По общей методике F 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,21 ммоля) и 4-хлор-2-(трибутилстаннил)пиридин давали искомое соединение (22 мг, 24%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,75 (d, J=5,0 Гц, 1H), 8,68 (s, 1H), 8,54 (d, J=2,5 Гц, 1H), 8,23 (s, 1H), 8,67 (dd, J=5,0 Гц, 2,0 Гц, 1H), 4,52-4,46 (m, 1H), 2,98 (s, 3H), 1,37-1,32 (m, 1H), 0,83-0,78 (m, 1H), 0,72-0,68 (m, 1H), 0,64-0,55 (m, 1H). LC-MS m/z: 410,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,54 мин.
5-(5-Хлорпиридин-2-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
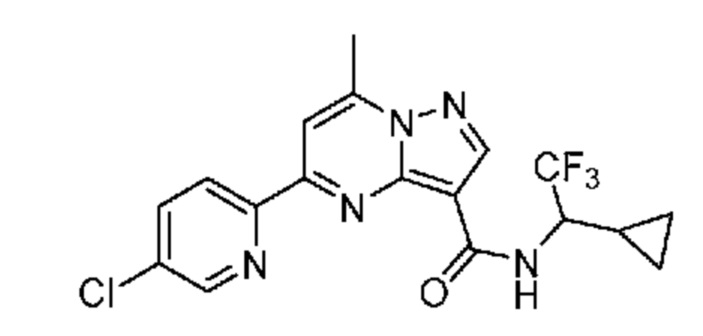
[00622] По общей методике F 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и 5-хлор-2-(трибутилстаннил)пиридин давали искомое соединение (36 мг, 29%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,88 (d, J=2,0 Гц, 1H), 8,72 (s, 1H), 8,49 (d, J=9,5 Гц, 1H), 8,41 (d, J=9,0 Гц, 1H), 8,30 (dd, J=8,5 Гц, 3,0 Гц, 1H), 8,15 (s, 1H), 4,44-4,38 (m, 1H), 2,91 (s, 3H), 1,39-1,35 (m, 1H), 0,71-0,69 (m, 1H), 0,64-0,61 (m, 2H), 0,41-0,39 (m, 1H). LC-MS m/z: 410,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,73 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(тиазол-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
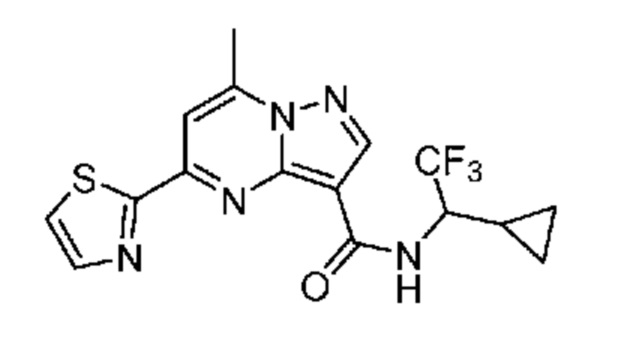
[00623] По общей методике F 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (90 мг, 0,27 ммоля) и 2-(трибутилстаннил)тиазол давали искомое соединение (80 мг, 70%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,72 (s, 1H), 8,36 (d, J=9,5 Гц, 1H), 8,18 (d, J=3,0 Гц, 1H), 8,15 (d, J=3,0 Гц, 1H), 7,95 (s, 1H), 4,49-4,42 (m, 1H), 2,90 (s, 3H), 1,30-1,25 (m, 1H), 0,72-0,67 (m, 1H), 0,66-0,56 (m, 2H), 0,48-0,41 (m, 1H). LC-MS m/z: 382,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,55 мин.
(S)-5-(Бензо[d][1,3]диоксол-5-ил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
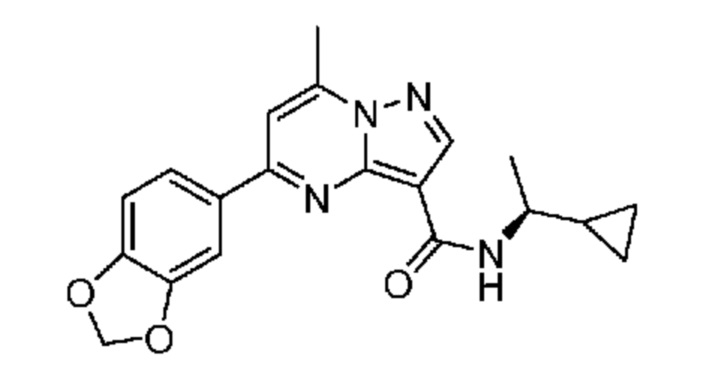
[00624] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (120 мг, 0,43 ммоля) и 2-(бензо[d][1,3]диоксол-5-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан давали искомое соединение (7,7 мг, 5%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4): δ 8,61 (d, J=7,2 Гц, 1H), 8,52 (s, 1H), 7,81 (d, J=8,0 Гц, 1H), 7,77 (s, 1H), 7,62 (s, 1H), 7,02 (d, J=8,0 Гц, 1H), 6,10 (s, 2H), 3,73-3,66 (m, 1H), 2,88 (s, 3H), 1,38 (d, J=6,8 Гц, 3H), 1,15-1,07 (m, 1H), 0,68-0,55 (m, 2H), 0,51-0,45 (m, 1H), 0,42-0,36 (m, 1H). LC-MS m/z: 365,1 [M+H]+. HPLC: Чистота (214 нм): 96%; tR=10,21 мин.
5-(2-Цианофенил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
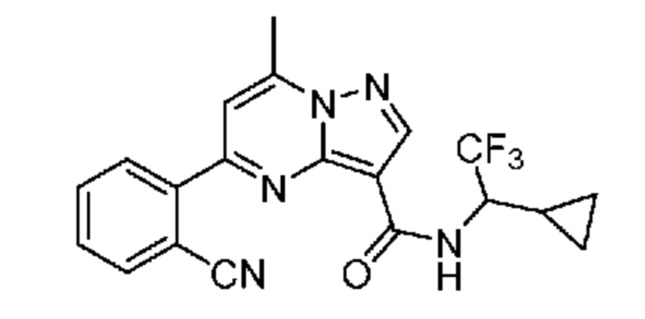
[00625] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,15 ммоля) и 2-цианофенилбороновая кислота давали искомое соединение (14 мг, 23%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,74 (s, 1H), 8,32 (d, J=9,5 Гц, 1H), 8,16-8,13 (m, 2H), 7,96 (d, J=7,5 Гц, 1H), 7,83 (s, 1H), 7,80 (d, J=7,5 Гц, 1H), 4,30-4,25 (m, 1H), 2,90 (s, 3H), 1,38-1,35 (m, 1H), 0,71-0,68 (m, 1H), 0,64-0,60 (m, 1H), 0,51-0,48 (m, 1H), 0,34-0,31 (m, 1H). LC-MS m/z: 400,1 [M+H]+. HPLC: Чистота (214 нм): 98%; tR=8,46 мин.
(R)-5-(2-цианофенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
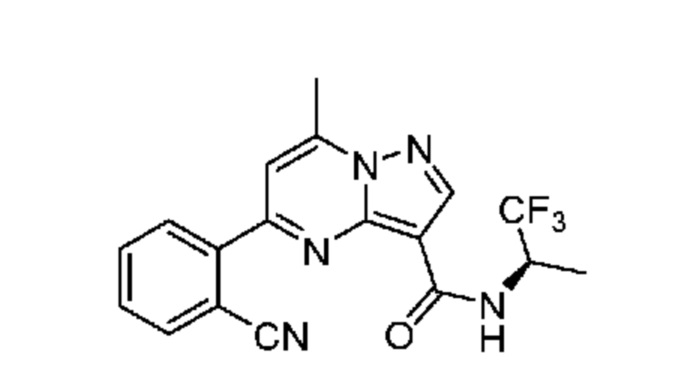
[00626] По общей методике D (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (62 мг, 0,2 ммоля) и 2-цианофенилбороновая кислота давали искомое соединение (25 мг, 33%) в виде белесого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,74 (s, 1H), 8,17-8,14 (m, 3H), 7,96 (t, J=8,0 Гц, 1H), 7,82 (s, 1H), 7,80 (t, J=8,0 Гц, 1H), 5,01-4,97 (m, 1H), 2,89 (s, 3H), 1,43 (d, J=7,5 Гц, 3H). LC-MS m/z: 374,1 [M+H]+. HPLC: Чистота (214 нм): 97%; tR=8,09 мин.
(S)-5-(2-Цианофенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
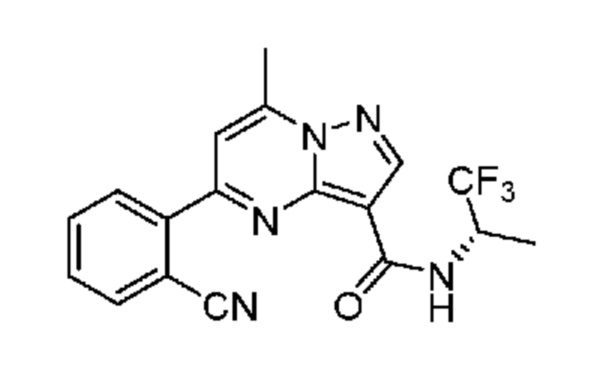
[00627] По общей методике D (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,20 ммоля) и 2-цианофенилбороновая кислота давали искомое соединение (18,8 мг, 26%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,75 (s, 1H), 8,17-8,14 (m, 3H), 7,96 (t, J=8,0 Гц, 1H), 7,82 (s, 1H), 7,80 (t, J=8,0 Гц, 1H), 5,01-4,97 (m, 1H), 2,89 (s, 3H), 1,43 (d, J=7,5 Гц, 3H). LC-MS m/z: 374,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,11 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(3-метилизотиазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
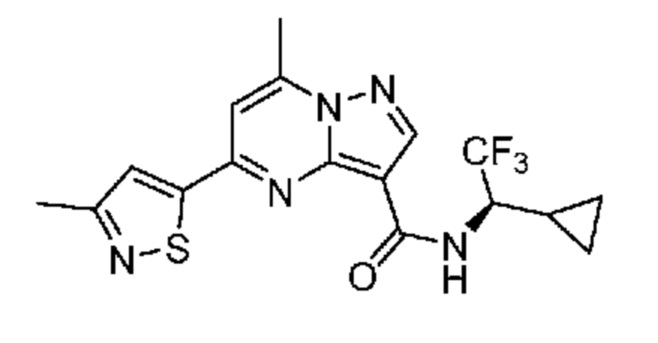
[00628] По общей методике E* (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (99 мг, 0,30 ммоля) и 5-бром-3-метилизотиазол давали искомое соединение (7,6 мг, 7%) в виде светло-коричневого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,71 (s, 1H), 8,26 (d, J=9,5 Гц, 1H), 8,08 (s, 1H), 7,91 (s, 1H), 4,53-4,45 (m, 1H), 2,86 (s, 3H), 2,55 (s, 3H), 1,31-1,25 (m, 1H), 0,74-0,69 (m, 1H), 0,65-0,55(m, 2H), 0,45-0,40 (m, 1H). LC-MS m/z: 396,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,78 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(3-метилизотиазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
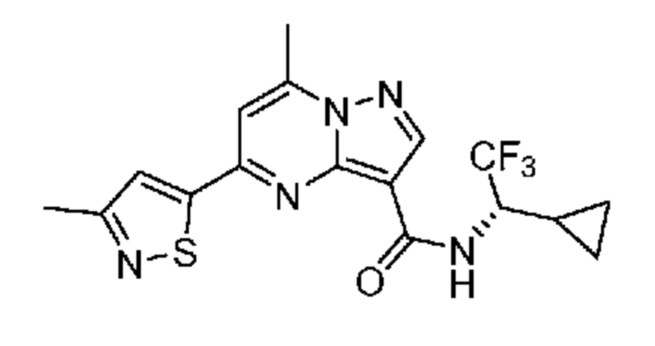
[00629] По общей методике E* (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (101 мг, 0,30 ммоля) и 5-бром-3-метилизотиазол давали искомое соединение (15 мг, 12%) в виде светло-коричневого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,71 (s, 1H), 8,26 (d, J=9,5 Гц, 1H), 8,08 (s, 1H), 7,91 (s, 1H), 4,53-4,45 (m, 1H), 2,86 (s, 3H), 2,55 (s, 3H), 1,31-1,25 (m, 1H), 0,74-0,69 (m, 1H), 0,65-0,55(m, 2H), 0,45-0,40 (m, 1H). LC-MS m/z: 396,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,78 мин.
(S)-5-(Бензо[d]оксазол-7-ил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
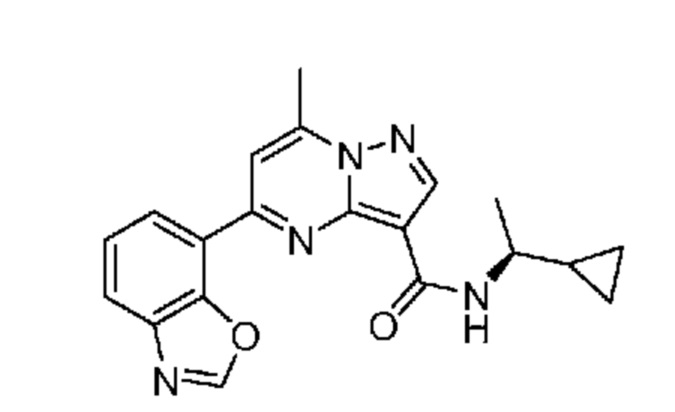
[00630] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,25 ммоля) и 7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол давали искомое соединение (28,3 мг, 20%) в виде серого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,98 (s, 1H), 8,61 (s, 1H), 8,28 (d, J=7,5 Гц, 1H), 8,26 (s, 1H), 8,05 (d, J=7,5 Гц, 1H), 7,98 (s, 1H), 7,65 (t, J=7,5 Гц, 1H), 3,68-3,63 (m, 1H), 2,89 (s, 3H), 1,33 (d, J=6,5 Гц, 3H), 1,12-1,08 (m, 1H), 0,52-0,49 (m, 1H), 0,48-0,40 (m, 1H), 0,40-0,32 (m, 1H), 0,32-0,28 (m, 1H). LC-MS m/z: 362,1 [M+H]+. HPLC: Чистота (214 нм): 98%; tR=7,75 мин.
(R)-5-(Бензо[d]оксазол-7-ил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
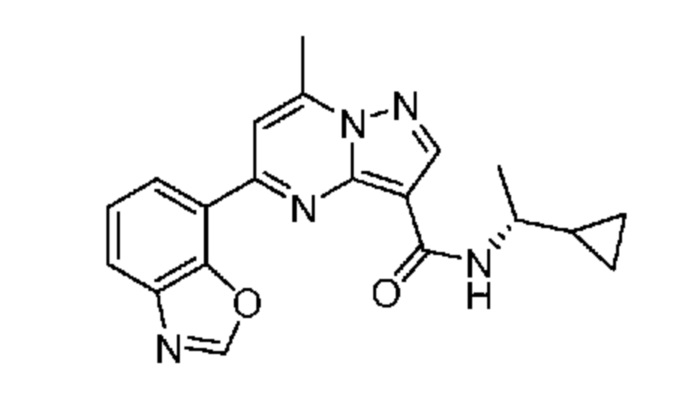
[00631] По общей методике D (R)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и 7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол давали искомое соединение (67 мг, 62%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,99 (s, 1H), 8,62 (s, 1H), 8,28 (t, J=7,5 Гц, 1H), 8,26 (s, 1H), 8,06 (d, J=7,5 Гц, 1H), 8,00 (s, 1H), 7,65 (t, J=7,5 Гц, 1H), 3,68-3,63 (m, 1H), 2,90 (s, 3H), 1,33 (d, J=6,5 Гц, 3H), 1,12-1,08 (m, 1H), 0,52-0,49 (m, 1H), 0,48-0,40 (m, 1H), 0,40-0,32 (m, 1H), 0,32-0,28 (m, 1H). LC-MS m/z: 362,1 [M+H]+. HPLC: Чистота (214 нм): 98%; tR=7,72 мин.
5-(Бензо[d]оксазол-7-ил)-7-метил-N-(1,1,1-трифтор-2-метилпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
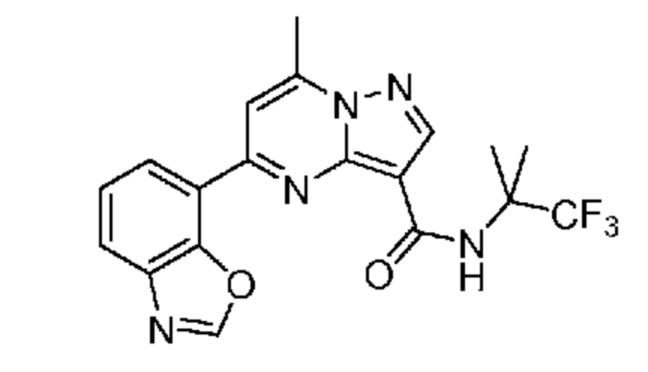
[00632] По общей методике A 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (500 мг, 2,37 ммоля) и 1,1,1-трифтор-2-метилпропан-2-амингидрохлорид давали 5-хлор-7-метил-N-(1,1,1-трифтор-2-метилпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (310 мг, 41%) в виде желтого твердого вещества. LC-MS m/z: 321,1 [M+H]+. Чистота (214 нм): > 99%; tR=1,95 мин.
[00633] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифтор-2-метилпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,25 ммоля) и 7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол давали искомое соединение (80 мг, 80%) в виде коричневого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,97 (s, 1H), 8,66 (s, 1H), 8,37 (s, 1H), 8,21 (d, J=7,5 Гц, 1H), 8,06 (d, J=7,5 Гц, 1H), 8,01 (s, 1H), 7,66 (t, J=8,0 Гц, 1H), 2,92 (s, 3H), 1,73 (s, 6H). LC-MS m/z: 404,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,48 мин.
5-(Бензо[d]тиазол-5-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
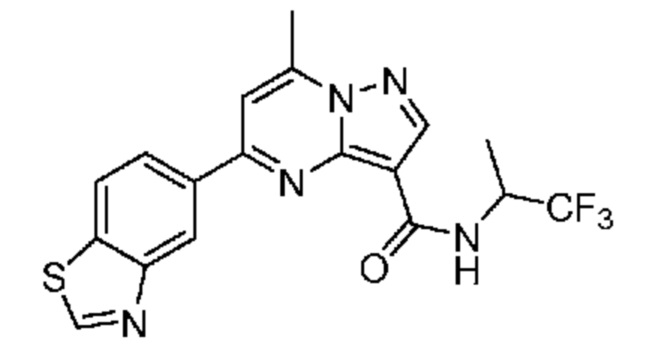
[00634] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,32 ммоля) и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]тиазол давали искомое соединение (55 мг, 42%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,54 (s, 1H), 8,97 (s, 1H), 8,68 (s, 1H), 8,58 (d, J=9,5 Гц, 1H), 8,43 (d, J=8,5 Гц, 1H), 8,35 (dd, J=8,5 Гц, 1,0 Гц, 1H), 8,16 (s, 1H), 5,02-4,98 (m, 1H), 2,89 (s, 3H), 1,49 (d, J=7,0 Гц, 3H). LC-MS m/z: 406,0 [M+H]+. HPLC: Чистота (254 нм): 98%; tR=8,22 мин.
5-(Бензо[d]тиазол-7-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
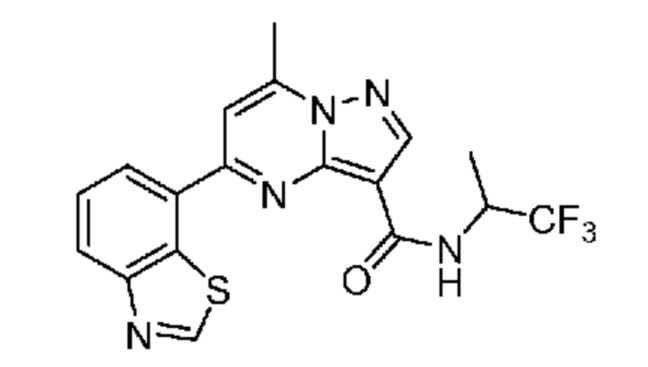
[00635] По общей методике E* 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,26 ммоля) и 7-бромбензо[d]тиазол (111 мг, 0,52 ммоля) давали искомое соединение (19 мг, 18%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,69 (s, 1H), 8,75 (s, 1H), 8,48 (d, J=7,5 Гц, 1H), 8,38 (d, J=8,0 Гц, 1H), 8,19 (s, 1H), 8,15 (d, J=10,0 Гц, 1H), 7,85 (t, J=8,0 Гц, 1H), 5,13-5,09 (m, 1H), 2,90 (s, 3H), 1,52 (d, J=7,5 Гц, 3H). LC-MS m/z: 406,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,38 мин.
(S)-5-(Бензо[d]тиазол-7-ил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
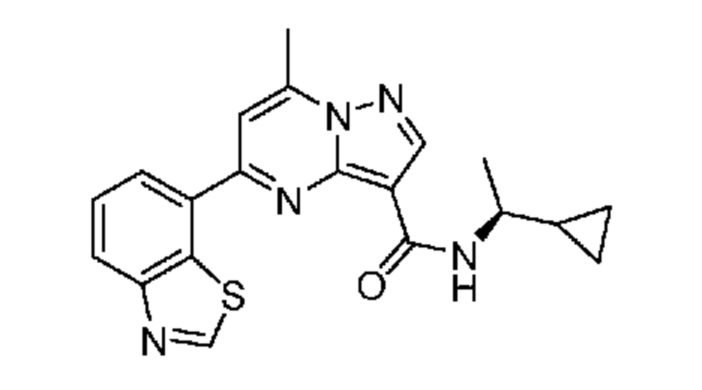
[00636] По общей методике E* (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,36 ммоля) и 7-бромбензо[d]тиазол давали искомое соединение (24,6 мг, 18%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,72 (s, 1H), 8,64 (s, 1H), 8,47 (d, J=7,5 Гц, 1H), 8,36 (d, J=8,0 Гц, 1H), 8,14 (s, 1H), 7,96 (d, J=8,5 Гц, 1H), 7,84 (t, J=7,5 Гц, 1H), 3,65-3,61 (m, 1H), 2,89 (s, 3H), 1,38 (d, J=6,0 Гц, 3H), 1,18-1,14 (m, 1H), 0,57-0,53 (m, 1H), 0,50-0,45 (m, 1H), 0,39-0,33 (m, 2H). LC-MS m/z: 378,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,36 мин.
5-(Бензо[d]оксазол-7-ил)-7-метил-N-(2-циклопропилпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
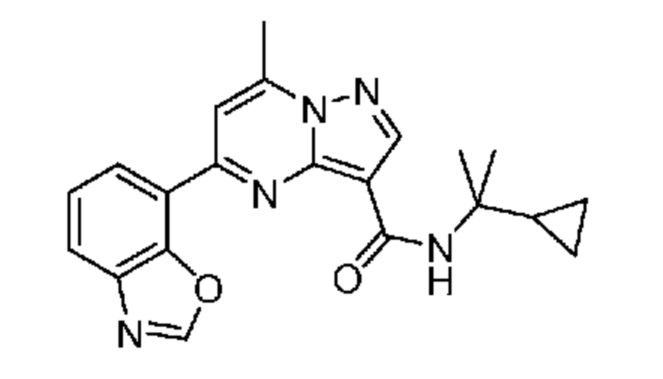
[00637] По общей методике A 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (500 мг, 2,37 ммоля) и 2-циклопропилпропан-2-амин давали 5-хлор-N-(2-циклопропилпропан-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (600 мг, 87%) в виде желтого твердого вещества. LC-MS m/z: 293,2 [M+H]+. Чистота (214 нм): > 98%; tR=1,98 мин.
[00638] По общей методике D 5-хлор-N-(2-циклопропилпропан-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,34 ммоля) и 7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол давали искомое соединение (77 мг, 60%) в виде серого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,98 (s, 1H), 8,59 (s, 1H), 8,28 (d, J=8,0 Гц, 1H), 8,15 (s, 1H), 8,06 (d, J=8,0 Гц, 1H), 7,97 (s, 1H), 7,65 (t, J=8,0 Гц, 1H), 2,91 (s, 3H), 1,48-1,44 (m, 1H), 1,38 (s, 6H), 0,47-0,40 (m, 4H). LC-MS m/z: 376,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,40 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-этил-5-(3-изопропил-2-оксоимидазолидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
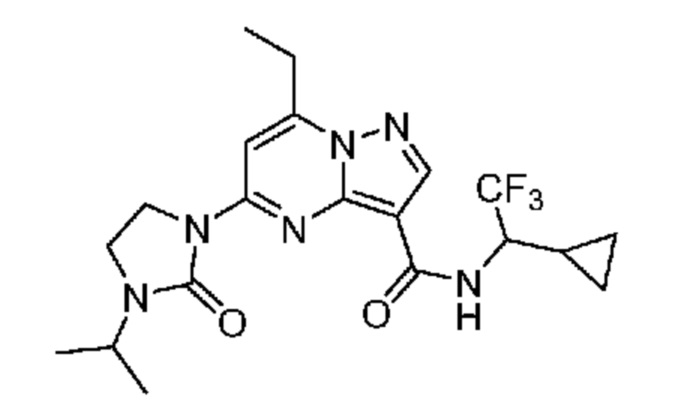
[00639] По общей методике H этил-5-хлор-7-этилпиразоло[1,5-a]пиримидин-3-карбоксилат (800 мг, 3,1 ммоля) и 1-изопропилимидазолидин-2-он давали этил-7-этил-5-(3-изопропил-2-оксоимидазолидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (500 мг, 47%) в виде коричневого твердого вещества. LC-MS m/z: 346,2 [M+H]+, tR=1,82 мин.
[00640] По общей методике B* этил-7-этил-5-(3-изопропил-2-оксоимидазолидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (500 мг, 1,4 ммоля) давал натриевую соль 7-этил-5-(3-изопропил-2-оксоимидазолидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (470 мг, 100%) в виде желтого твердого вещества, которое без обработки использовали на следующей стадии. LC-MS m/z: 318,1 [M+H]+, tR=1,24 мин.
[00641] По общей методике A 7-этил-5-(3-изопропил-2-оксоимидазолидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (100 мг, 0,29 ммоля) и 1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (33 мг, 26%) в виде белого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4) δ 8,41 (s, 1H), 8,22 (s, 1H), 4,36-4,30 (m, 1H), 4,29-4,20 (m, 1H), 4,19-4,09 (m, 2H), 3,64(t, J=8,0 Гц, 2H), 3,20 (q, J=7,6 Гц, 2H), 1,45 (t, J=7,6 Гц, 3H), 1,27 (d, J=6,4 Гц, 6H), 1,29-1,26 (m, 1H), 0,77-0,74 (m, 1H), 0,66-0,55 (m, 2H), 0,48-0,45 (m, 1H). LC-MS m/z: 439,2 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=10,74 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
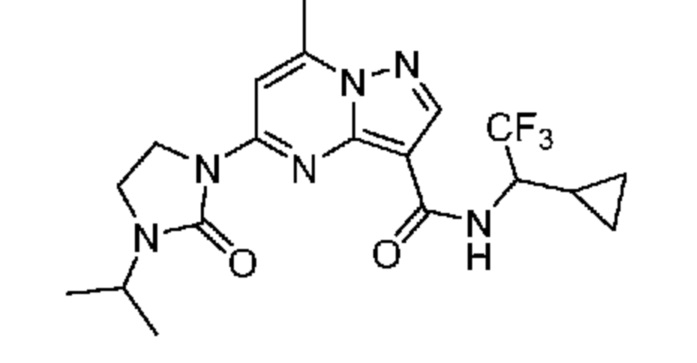
[00642] По общей методике H этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (717 мг, 3 ммоля) и 1-изопропилимидазолидин-2-он давали этил-5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (780 мг, 78%) в виде палевого твердого вещества. LC-MS m/z: 332,2 [M+H]+. LCMS: Чистота (214 нм): 97,9%; tR=1,27 мин.
[00643] По общей методике B* этил-5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (331 мг, 1,0 ммоля) давал 5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (270 мг, 88%) в виде твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,98 (s, 1H), 7,75 (s, 1H), 6,68 (s, 1H), 2,45 (s, 3H), 2,43 (s, 3H). LC-MS m/z: 304,1 [M+H]+. LCMS: Чистота (254 нм): 81,9%; tR=1,57 мин.
[00644] По общей методике A 5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (55 мг, 0,18 ммоля) и 1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (28 мг, 44%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,42 (s, 1H), 8,22 (d, J=9,5 Гц, 1H), 8,10 (s, 1H), 4,38-4,30 (m, 1H), 4,13-4,03 (m, 2H), 4,00-3,95 (m, 1H), 3,57-3,50 (m, 2H), 2,73 (s, 3H), 1,28-1,23 (m, 1H), 1,17 (d, J=7,0 Гц, 6H), 0,68-0,64 (m, 1H), 0,57-0,54 (m, 2H), 0,35-0,32 (m, 1H). LC-MS m/z: 425,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,85 мин.
7-Этил-5-(3-изопропил-2-оксоимидазолидин-1-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
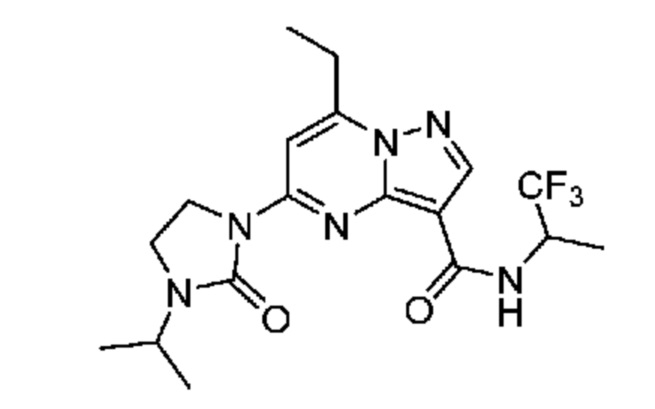
[00645] По общей методике A 7-этил-5-(3-изопропил-2-оксоимидазолидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (100 мг, 0,29 ммоля) и 1,1,1-трифторпропан-2-амингидрохлорид давали искомое соединение (20 мг, 17%) в виде белого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4) δ 8,42 (s, 1H), 8,21 (s, 1H), 4,93-4,90 (m, 1H), 4,25-4,12 (m, 3H), 3,65 (t, J=8,0 Гц, 2H), 3,20 (q, J=7,2 Гц, 2H), 1,49 (d, J=7,2 Гц, 3H), 1,46 (d, J=7,2 Гц, 3H), 3,65 (d, J=6,8 Гц, 6H). LC-MS m/z: 413,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,90 мин.
5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
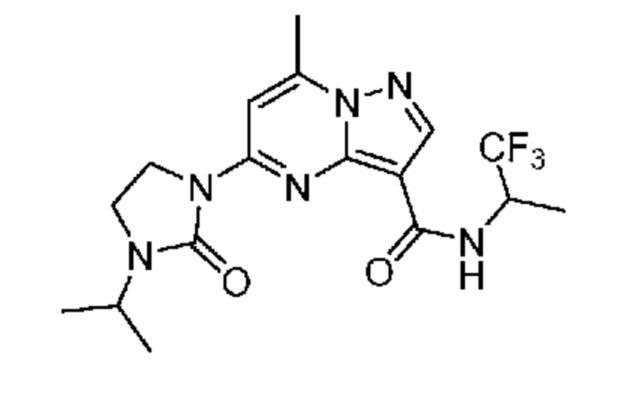
[00646] По общей методике A 5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (50 мг, 0,15 ммоля) и 1,1,1-трифторпропан-2-амингидрохлорид давали искомое соединение (15,6 мг, 24%) в виде белого твердого вещества. 1H ЯМР (500MHz, DMSO-d6), δ 8,43 (s, 1H), 8,13 (d, J=9,5 Гц, 1H), 8,09 (s, 1H), 4,93-4,86 (m, 1H), 4,13-4,06 (m, 2H), 3,99-3,93 (m, 1H), 3,58-3,50 (m, 2H), 2,73 (s, 3H), 1,40 (d, J=7,0 Гц, 3H), 1,17 (d, J=6,5 Гц, 6H). LC-MS m/z: 399,1 [M+H]+. HPLC: Чистота (214 нм): 98%; tR=8,13min.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(2-оксоимидазолидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
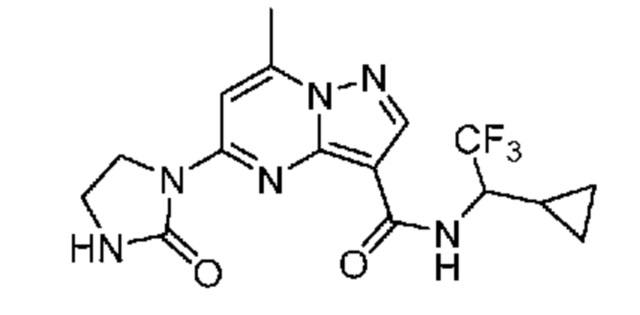
[00647] По общей методике H 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и имидазолидин-2-он давали искомое соединение (15 мг, 13%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,43 (s, 1H), 8,23 (d, J=10,0 Гц, 1H), 8,11 (s, 1H), 7,88 (s, 1H), 4,39-4,32 (m, 1H), 4,18-4,10 (m, 1H), 4,08-4,02 (m, 1H), 3,54-3,50 (m, 2H), 2,74 (s, 3H), 1,26-1,21 (m, 1H), 0,68-0,64 (m, 1H), 0,59-0,54 (m, 2H), 0,39-0,34 (m, 1H). LC-MS m/z: 383,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,63 мин.
N-трет-Бутил-7-этил-5-(3-изопропил-2-оксоимидазолидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
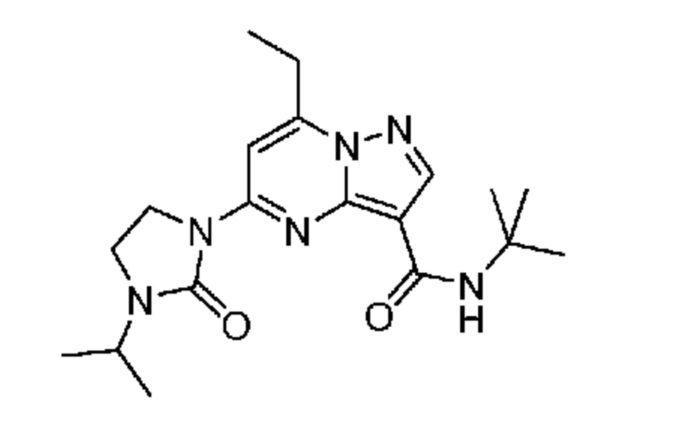
[00648] По общей методике A 7-этил-5-(3-изопропил-2-оксоимидазолидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (100 мг, 0,29 ммоля) и 2-метилпропан-2-амин давали искомое соединение (32 мг, 28%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4) δ 8,34 (s, 1H), 8,16 (s, 1H), 4,28-4,20 (m, 1H), 4,14 (t, J=8,0 Гц, 2H), 3,69 (t, J=8,0 Гц, 2H), 3,17 (q, J=7,6 Гц, 2H), 1,51 (s, 9H), 1,44 (t, J=7,2 Гц, 3H), 1,26 (d, J=8,0 Гц, 6H). LC-MS m/z: 373,2 [M+H]+. HPLC: Чистота (214 нм): > 99%, tR=8,80 мин.
N-(2-Циклопропилпропан-2-ил)-5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
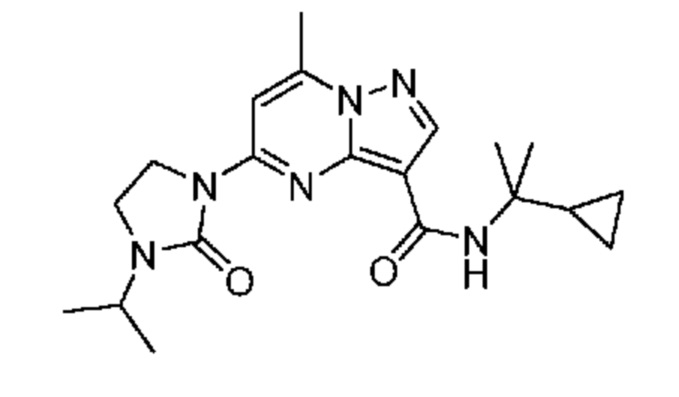
[00649] По общей методике A 5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (50 мг, 0,16 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (1,5 мг, 3%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,35 (s, 1H), 8,11 (s, 1H), 4,25-4,22 (m,1H), 4,12 (t, J=7,5 Гц, 2H), 3,61 (t, J=8,0 Гц, 2H), 2,75 (s, 3H), 1,42 (s, 6H), 1,44-1,41 (m, 1H), 1,27 (d, J=6,5 Гц, 6H), 0,50-0,49 (m, 4H). LC-MS m/z: 385,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,74 мин.
5-(3-Изопропил-2-оксоимидазолидин-1-ил)-7-метил-N-(1,1,1-трифтор-2-метилпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
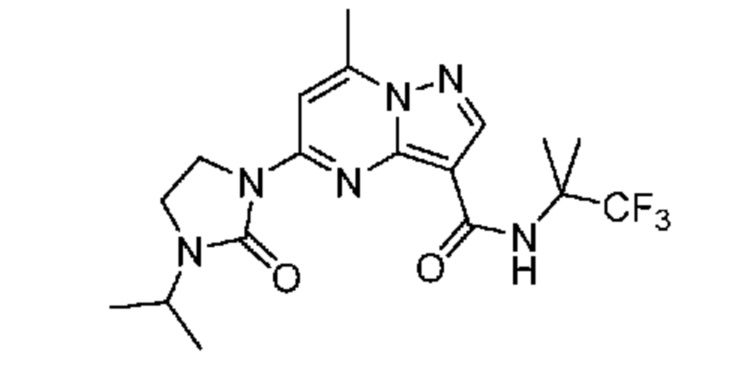
[00650] По общей методике A 5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (50 мг, 0,16 ммоля) и 1,1,1-трифтор-2-метилпропан-2-амингидрохлорид давали искомое соединение (32 мг, 47%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,37 (s, 1H), 8,10 (s, 1H), 7,99 (s, 1H), 4,13-4,08 (m, 1H), 4,01 (t, J=7,5 Гц, 2H), 3,55 (t, J=8,0 Гц, 2H), 2,73 (s, 3H), 1,67 (s, 6H), 1,16 (d, J=10,0 Гц, 6H). LC-MS m/z: 413,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,89 мин.
N-трет-Бутил-5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
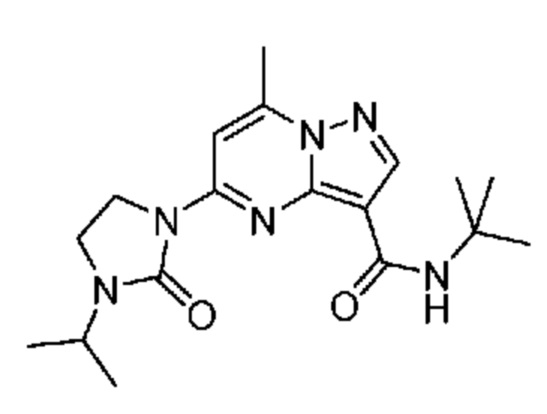
[00651] По общей методике A 5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,14 ммоля) и 2-метилпропан-2-амин давали искомое соединение (28 мг, 59%) в виде белого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4): δ 8,33 (s, 1H), 8,08 (s, 1H), 8,03 (s, 1H), 4,27-4,21 (m, 1H), 4,07 (t, J=8,0 Гц, 2H), 3,61 (t, J=8,0 Гц, 2H), 2,73 (d, J=0,4 Гц, 3H), 1,52 (s, 9H), 1,27 (d, J=6,8 Гц, 6H). LC-MS m/z: 359,1 [M+H]+, 381,2[M+Na]+. HPLC: Чистота (214 нм): > 99%; tR=8,32 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(2-оксо-3-(2,2,2-трифторэтил)имидазолидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
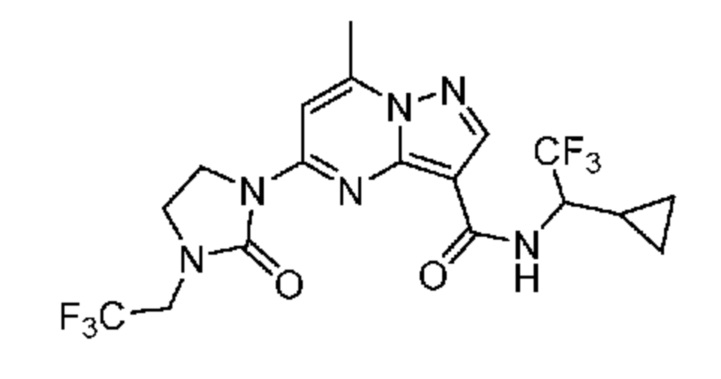
[00652] К раствору 2,2,2-трифторэтанамина (6,0 г, 60,6 ммоля) в MeCN (30 мл) добавляли 1-хлор-2-изоцианатоэтан (7,0 г, 66,7 ммоля). Реакционную смесь перемешивали при RT в течение 4 ч и фильтровали для сбора 1-(2-хлорэтил)-3-(2,2,2-трифторэтил)мочевины (2,6 г, 22%) в виде белого твердого вещества. LC-MS m/z: 191,1 [M+H]+.
[00653] К раствору 1-(2-хлорэтил)-3-(2,2,2-трифторэтил)мочевины (1,3 г, 6,4 ммоля) в THF (4 мл) при 0°C добавляли NaH (305 мг, 7,6 ммоля). Реакционную смесь нагревали при RT и перемешивали в течение 16 ч и реакцию останавливали насыщенным раствором NH4Cl (20 мл). Смесь экстрагировали с помощью EA (10 мл×3) и объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 1-(2,2,2-трифторэтил)имидазолидин-2-он (500 мг, 47%) в виде белого твердого вещества. LC-MS m/z: 169,2 [M+H]+.
[00654] По общей методике H 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 1-(2,2,2-трифторэтил)имидазолидин-2-он давали искомое соединение (50 мг, 40%) в виде почти белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,47 (s, 1H), 8,18 (d, J=9,6 Гц, 1H), 8,05 (s, 1H), 4,34-4,28 (m, 1H), 4,19-4,02 (m, 3H), 3,72 (t, J=8,0 Гц, 2H), 2,76 (s, 3H), 1,30-1,23 (m, 1H), 0,69-0,65 (m, 1H), 0,59-0,55 (m, 2H), 0,35-0,30 (m, 1H). LC-MS m/z: 465,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,76 мин.
(R)-5-(6-Хлорпиридин-2-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
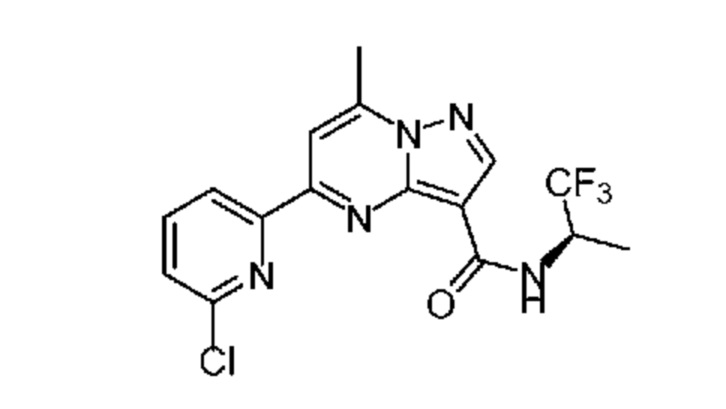
[00655] По общей методике D (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (62 мг, 0,2 ммоля) и 2-хлор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин давали искомое соединение (28 мг, 37%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,73 (s, 1H), 8,40-8,38 (m, 1H), 8,20 (t, J=8,0 Гц, 1H), 8,05 (s, 1 H), 7,61 (dd, J=8,0 Гц, 1,0 Гц, 1H), 5,01-4,96 (m, 1H), 2,92 (s, 3H), 1,49 (d, J=7,5 Гц, 3H). LC-MS m/z: 384,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,13 мин.
(S)-5-(6-Хлорпиридин-2-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
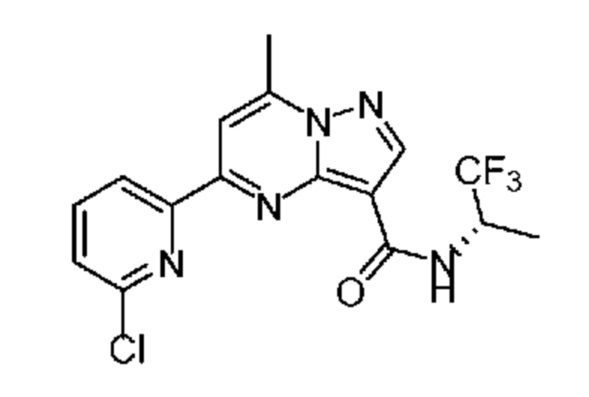
[00656] По общей методике D (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (90 мг, 0,29 ммоля) и 2-хлор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин давали искомое соединение (9,2 мг, 8%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,73 (s, 1H), 8,40-8,38 (m, 1H), 8,20 (t, J=8,0 Гц, 1H), 8,05 (s, 1 H), 7,61 (dd, J=8,0 Гц, 1,0 Гц, 1H), 5,01-4,96 (m, 1H), 2,92 (s, 3H), 1,49 (d, J=7,5 Гц, 3H). LC-MS m/z: 384,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,13 мин.
5-(6-Хлорпиридин-2-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
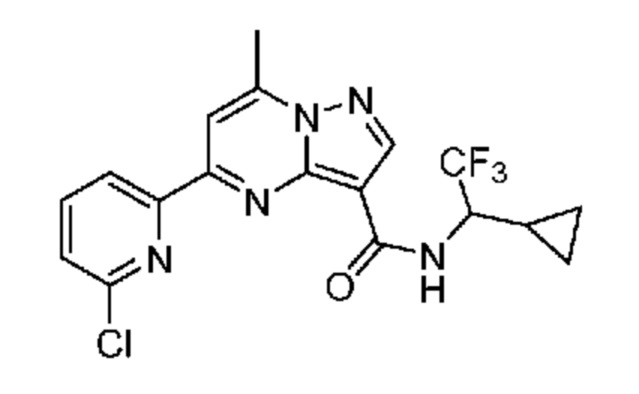
[00657] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 2-хлор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин давали искомое соединение (29 мг, 30%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,74 (s, 1H), 8,50 (d, J=9,5 Гц, 1H), 8,39 (d, J=7,5 Гц, 1H), 8,21 (d, J=8,0 Гц, 1H), 8,08 (s, 1H), 7,78 (d, J=8,0 Гц, 1H), 4,44-4,40 (m, 1H), 2,93 (s, 3H), 1,40-1,36 (m, 1H), 0,72-0,67 (m, 1H), 0,65-0,58 (m, 2H), 0,43-0,38 (m, 1H). LC-MS m/z: 410,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=10,05 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-этил-5-морфолинопиразоло[1,5-a]пиримидин-3-карбоксамид
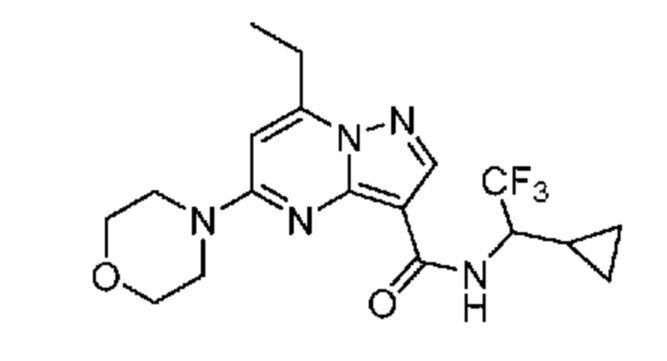
[00658] При перемешивании к раствору этил-5-хлор-7-этилпиразоло[1,5-a]пиримидин-3-карбоксилата (0,2 г, 0,8 ммоля) и Cs2CO3 (1,3 г, 4,0 ммоля) в DMF добавляли морфолин (87 мг, 1,0 ммоля). Смесь перемешивали при 100°C в течение 24 ч и концентрировали в вакууме. Остаток очищали с помощью препаративной ТСХ (PE: EA=1:1) и получали этил-7-этил-5-морфолинопиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 38%) в виде коричневого твердого вещества. LC-MS m/z: 259,1 [M+H]+, tR=1,21 мин.
[00659] По общей методике B* этил-7-этил-5-морфолинопиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,39 ммоля) давал натриевую соль 7-этил-5-морфолинопиразоло[1,5-a]пиримидин-3-карбоновой кислоты (117 мг, 100%) в виде желтого твердого вещества, которое без обработки использовали на следующей стадии. LC-MS m/z: 277,2 [M+H]+, tR=1,07 мин.
[00660] По общей методике A 7-этил-5-морфолинопиразоло[1,5-a]пиримидин-3-карбоновая кислота (117 мг, 0,39 ммоля) и 1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (21 мг, 13%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4) δ 8,27 (s, 1H), 6,68 (s, 1H), 4,38-4,35 (m, 1H), 3,84-3,76 (m, 8H), 3,14-3,08 (m, 2H), 1,42 (t, J=8,0 Гц, 3H), 1,22-1,19 (m, 1H), 0,74-0,72 (m, 1H), 0,63-0,59 (m, 1H), 0,52-0,43 (m, 2H). LC-MS m/z: 397,8 [M+H]+. HPLC: Чистота (254 нм): > 99%, tR=8,19 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(изоксазол-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
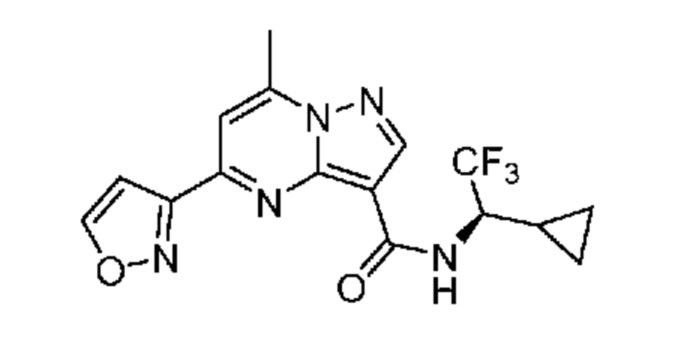
[00661] Смесь трибутил(винил)станнана (1,142 г, 3,6 ммоля), этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (717 мг, 3 ммоля) и Pd(PPh3)4 (347 мг, 0,3 ммоля) в диоксане (5 мл) нагревали при 100°C в атмосфере азота в течение 2 ч, охлаждали до комнатной температуры и после добавления гидрохинона (10 мг) концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA: 1/1) и получали этил-7-метил-5-винилпиразоло[1,5-a]пиримидин-3-карбоксилат (478 мг, 69%) в виде твердого вещества. 1H ЯМР (500 МГц, CDCl3) δ 8,54 (s, 1H), 7,01 (s, 1H), 6,94 (dd, J=17,5 Гц, 11,0 Гц 1H), 6,38 (d, J=17,5 Гц, 1H), 5,79 (d, J=11,0 Гц, 1H), 4,42 (q, J=7,0 Гц, 2H), 2,83 (s, 3H), 1,43 (t, J=7,0 Гц, 3H). LC-MS m/z: 232,1 [M+H]+. LCMS: Чистота (214 нм): 98,3%; tR=1,72 мин.
[00662] К раствору этил-7-метил-5-винилпиразоло[1,5-a]пиримидин-3-карбоксилата (167 мг, 0,72 ммоля) и OsO4 (2 мг, 0,007 ммоля) в THF/H2O (10 мл/3 мл) добавляли NaIO4 (616 мг, 2,89 ммоля). Полученную смесь перемешивали при RT в течение 12 ч и разбавляли с помощью H2O (50 мл). Смесь экстрагировали с помощью EA (20 мл×3) и органические слои промывали рассолом (15 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали этил-5-формил-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (150 мг), который без обработки использовали на следующей стадии. LC-MS m/z: 234,1 [M+H]+. LCMS: Чистота (254 нм): 30%; tR=1,65 мин.
[00663] К раствору этил-5-формил-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (150 мг) в MeOH (5 мл) добавляли гидросиламингидрохлорид (108 мг, 1,45 ммоля) и Et3N (219 мг, 2,17 ммоля). Смесь перемешивали при RT в течение 2 ч и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA: 1/2) и получали этил-5-((гидроксимино)метил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 55% за две стадии) в виде желтого твердого вещества. LC-MS m/z: 271,0 [M+Na]+. LCMS: Чистота (254 нм): 78%; tR=1,08 мин.
[00664] К раствору этил-5-((гидроксимино)метил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (100 мг, 0,40 ммоля) и этинилтриметилсилана (78 мг, 0,8 ммоля) в MeCN (5 мл) добавляли CrO2 (332 мг, 4,0 ммоля). Реакционную смесь перемешивали при 80°C в течение 2 ч и фильтровали через целит. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA: 5/1) и получали этил-7-метил-5-(5-(триметилсилил)изоксазол-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (63 мг, 45%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,71 (s, 1H), 7,83 (s, 1H), 7,29 (s, 1H), 4,32 (q, J=7,0 Гц, 2H), 2,87 (s, 3H), 1,36 (t, J=7,0 Гц, 3H), 0,41 (s, 9H). LC-MS m/z: 345,1 [M+H]+. LCMS: Чистота (254 нм): 88%; tR=2,14 мин.
[00665] По общей методике A 5-(изоксазол-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,16 ммоля) и (R)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (5,8 мг, 11%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,25 (d, J=1,5 Гц, 1H), 8,74 (s, 1H), 8,39 (d, J=10,0 Гц, 1H), 7,88 (s, 1H), 7,13 (d, J=2,0 Гц, 1H), 4,45-4,40 (m, 1H), 2,90 (s, 3H), 1,38-1,35 (m, 1H), 0,70-0,67 (m, 1H), 0,60-0,58 (m, 2H), 0,42-0,39 (m, 1H). LC-MS m/z: 366,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,34 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(изоксазол-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
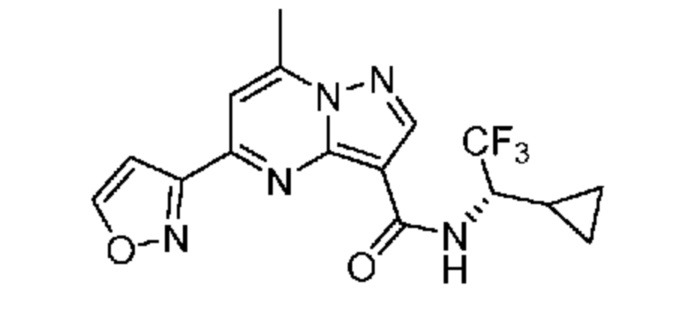
[00666] По общей методике A 5-(изоксазол-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,16 ммоля) и (S)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (10 мг, 18%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,25 (d, J=1,5 Гц, 1H), 8,74 (s, 1H), 8,39 (d, J=10,0 Гц, 1H), 7,88 (s, 1H), 7,13 (d, J=2,0 Гц, 1H), 4,45-4,40 (m, 1H), 2,90 (s, 3H), 1,38-1,35 (m, 1H), 0,70-0,67 (m, 1H), 0,60-0,58 (m, 2H), 0,42-0,39 (m, 1H). LC-MS m/z: 366,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,62 мин.
(R)-5-(5-Циано-2-метилфуран-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
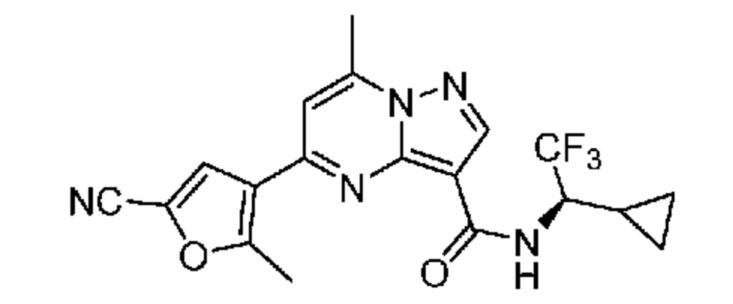
[00667] Раствор метил-5-метилфуран-2-карбоксилата (1,5 г, 10,71 ммоля) и AlCl3 (2,14 г, 16,07 ммоля) в 20 мл хлороформа перемешивали при 0°C в течение 30 мин и затем при 0°C добавляли Br2 (0,77 мл). Реакционную смесь перемешивали при 0°C в течение 12 ч, выливали на кубики льда (100 г) и экстрагировали с помощью DCM (50 мл×3). Органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали метил-4-бром-5-метилфуран-2-карбоксилат (2,0 г, 86%).
[00668] По общей методике E* (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и 4-бром-5-метилфуран-2-карбонитрил давали искомое соединение (3,5 мг, 5%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,62 (s, 1H), 7,94 (s, 1H), 7,47 (s, 1H), 4,32-4,27 (m, 1H), 2,91 (s, 3H), 2,89 (s, 3H), 1,28-1,24 (m, 1H), 0,84-0,80 (m, 1H), 0,68-0,62 (m, 2H), 0,47-0,43 (m, 1H). LC-MS m/z: 404,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,06 мин.
(S)-5-(5-Циано-2-метилфуран-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
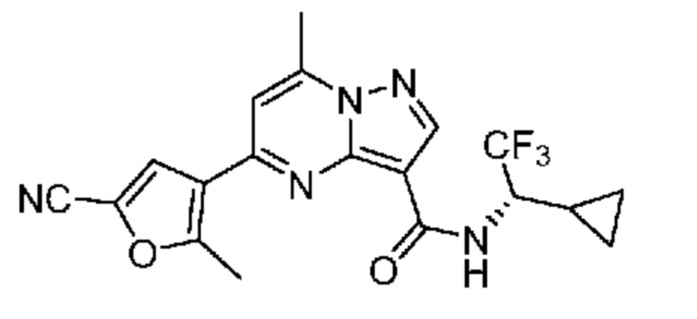
[00669] По общей методике E* (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 4-бром-5-метилфуран-2-карбонитрил давали искомое соединение (12 мг, 13%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,62 (s, 1H), 8,43 (d, J=9,5 Гц, 1H), 7,95 (s, 1H), 7,48 (s, 1H), 4,33-4,28 (m, 1H), 2,91 (s, 3H), 2,89 (s, 3H), 1,28-1,23 (m, 1H), 0,85-0,80 (m, 1H), 0,65-0,62 (m, 2H), 0,47-0,43 (m, 1H). LC-MS m/z: 404,1 [M+H]+. HPLC: Чистота (214 нм): 94,6%; tR=9,05 мин.
5-(3-Циано-5-метилфуран-2-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
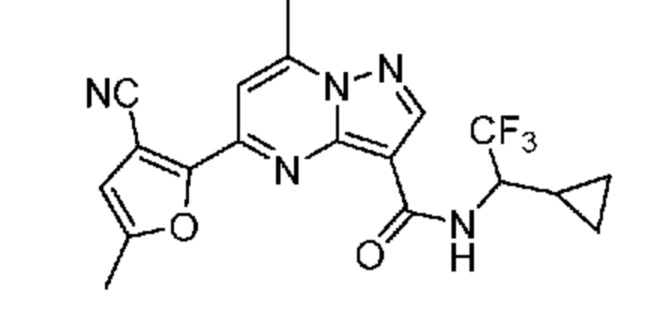
[00670] По общей методике A 5-метилфуран-3-карбоновая кислота (1,26 г, 10 ммоля) и NH4Cl давали 5-метилфуран-3-карбоксамид (700 мг, 56%) в виде белого твердого вещества. LC-MS m/z: 126,1 [M+H]+. LCMS: Чистота (214 нм): 85,2%; tR=1,28 мин.
[00671] К раствору 5-метилфуран-3-карбоксамида (400 мг, 2,10 ммоля) и Et3N (1,7 г, 16,8 ммоля) в DCM (20 мл) при 0°C в атмосфере N2 по каплям добавляли POCl3 (964 мг, 6,3 ммоля). Смесь перемешивали при RT в течение 2 ч, концентрировали в вакууме и остаток растворяли в EA (20 мл) и промывали насыщенным раствором NaHCO3 (20 мл). Объединенные органические слои сушили (Na2SO4) и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA: 4/1) и получали 5-метилфуран-3-карбонитрил (270 мг, 75%) в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3) δ 7,79 (s, 1H), 6,20 (s, 1H), 2,33 (s, 3H). LCMS: Чистота (254 нм): 95%; tR=1,68 мин.
[00672] К раствору 5-метилфуран-3-карбонитрила (321 мг, 3 ммоля) в THF (10 мл) в атмосфере N2 при -78°C по каплям добавляли n-BuLi (1,14 мл, 2,5 M в гептанах, 2,85 ммоля). Реакционную смесь перемешивали при -78°C в течение 0,5 ч, затем добавляли Bu3SnCl (1,2 г, 3,6 ммоля). Реакционную смесь перемешивали при -78°C в течение 2 ч, перемешивали при RT в течение еще 2 ч и реакцию останавливали с помощью NH4Cl (10 мл). Реакционную смесь экстрагировали с помощью EA (50 мл×3) и объединенные органические слои промывали рассолом (30 мл), сушили (Na2SO4) и фильтровали. Фильтрат концентрировали в вакууме и получали 5-метил-2-(трибутилстаннил)фуран-3-карбонитрил (1,25 г, неочищенный), который использовали на следующей стадии без очистки. LC-MS m/z: 420,1 [M+H]+. LCMS: tR=2,17 мин.
[00673] По общей методике F 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и 5-метил-2-(трибутилстаннил)фуран-3-карбонитрил давали искомое соединение (90 мг, 75%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,73 (s, 1H), 7,99 (d, J=9,5 Гц, 1H), 7,68 (s, 1H), 6,97 (s, 1H), 4,19-4,16 (m, 1 H), 2,88 (s, 3H), 2,45 (s, 3H), 1,60-1,53 (m, 1H), 0,71-0,63 (m, 2H), 0,54-0,53 (m, 1H), 0,26-0,24 (m, 1H). LC-MS m/z: 404,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,16 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(2-метилоксазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
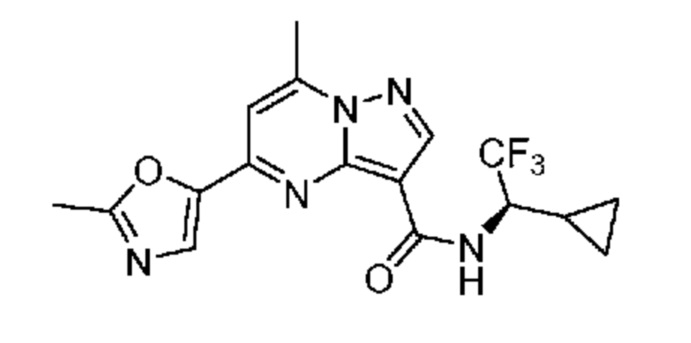
[00674] К раствору 2-метилоксазола (1,0 г, 12,0 ммоля) в Et2O (20 мл) по каплям при -78°C добавляли n-BuLi (6,24 мл, 2,5M, 15,6 ммоля). После перемешивания в течение 2 ч по каплям при -78(C добавляли раствор Bu3SnCl (3,59 г, 11,0 ммоля) в Et2O (10 мл). Реакционной смеси давали нагреться до RT и перемешивали в течение ночи. Затем реакцию останавливали насыщенным раствором NH4Cl (25 мл) и затем экстрагировали с помощью Et2O (50 мл×2). Объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 2-метил-5-(трибутилстаннил)оксазол (3,5 г, 77%) в виде желтого масла, которое без обработки использовали на следующей стадии.
[00675] По общей методике A 7-метил-5-(2-метилоксазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,12 ммоля) и (R)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (15 мг, 32%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4): δ 8,56 (s, 1H), 7,90 (s, 1H), 7,53 (s, 1H), 4,52-4,48 (m, 1H), 2,90 (s, 3H), 2,63 (s, 3H), 1,36-1,30 (m, 1H), 0,77-0,73 (m, 1H), 0,69-0,65 (m, 1H), 0,61-0,53 (m, 2H). LC-MS m/z: 380,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,78 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(2-метилоксазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
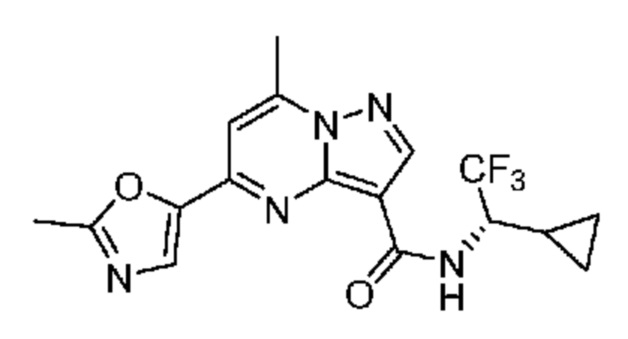
[00676] По общей методике A 7-метил-5-(2-метилоксазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,12 ммоля) и (S)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (21 мг, 46%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4): δ 8,56 (s, 1H), 7,90 (s, 1H), 7,53 (s, 1H), 4,52-4,48 (m, 1H), 2,90 (s, 3H), 2,63 (s, 3H), 1,36-1,30 (m, 1H), 0,77-0,73 (m, 1H), 0,69-0,65 (m, 1H), 0,61-0,53 (m, 2H). LC-MS m/z: 380,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,78 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(2-метилоксазол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
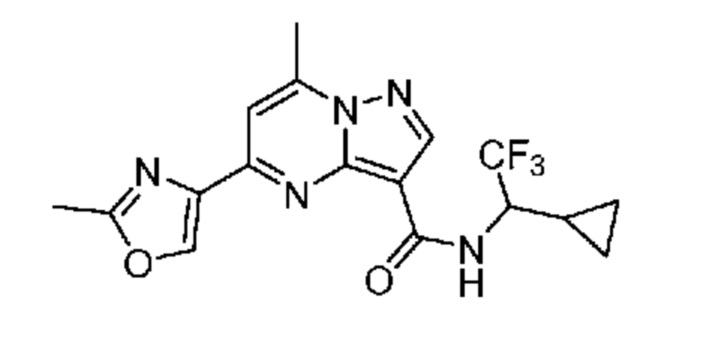
[00677] При перемешивании к раствору этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (1,0 г, 3,6 ммоля) и трибутил(1-этоксивинил)станнана (2,1 г, 5,4 ммоля) в диоксане (10 мл) добавляли Pd(PPh3)2Cl2 (253 мг, 0,36 ммоля). Реакционную смесь перемешивали в течение 3 ч при 110°C в атмосфере N2. Продукт очищали с помощью колоночной хроматографии на силикагеле (PE/EA=3/1) и получали этил-5-(1-этоксивинил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (891 мг, 90%) в виде белого твердого вещества. LC-MS m/z: 276,1 [M+H]+.
[00678] При перемешивании к раствору этил-5-(1-этоксивинил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (880 мг, 3,2 ммоля) в THF/H2O (10 мл/1 мл) добавляли NBS (627 мг, 3,5 ммоля). Реакционную смесь перемешивали в течение 3 ч при RT и фильтровали для удаления твердого вещества. Осадок на фильтре промывали с помощью CH3CN (10 мл) и фильтраты концентрировали в вакууме и получали этил-5-(2-бромацетил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (800 мг, 77%) в виде желтого твердого вещества. LC-MS m/z: 328,0 [M+H]+.
[00679] Раствор этил-5-(2-бромацетил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (800 мг, 2,5 ммоля) и ацетамида (1,5 г, 25 ммоля) в DMF (5 мл) перемешивали в течение 4 ч при 110°C. Продукт очищали с помощью колоночной хроматографии на силикагеле (PE/EA=3/1) и получали этил-7-метил-5-(2-метилоксазол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (140 мг, 20%) в виде желтого твердого вещества. LC-MS m/z: 287,1 [M+H]+.
[00680] По общей методике B* этил-7-метил-5-(2-метилоксазол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (140 мг, 0,49 ммоля) давал 7-метил-5-(2-метилоксазол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоновую кислоту (115 мг, 91%) в виде желтого твердого вещества. LC-MS m/z: 259,1 [M+H]+.
[00681] По общей методике A 7-метил-5-(2-метилоксазол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,16 ммоля) и 1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (14 мг, 23%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,74 (s, 1H), 8,64 (s, 1H), 8,43 (d, J=9,5 Гц, 1H), 7,68 (s, 1H), 4,40-4,34 (m, 1H), 2,85 (s, 3H), 2,55 (s, 3H), 1,46-1,41 (m, 1H), 0,70-0,60 (m, 1H), 0,59-0,56 (m, 2H), 0,45-0,42 (m, 1H). LC-MS m/z: 380,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,40 мин.
5-(3-Цианофуран-2-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
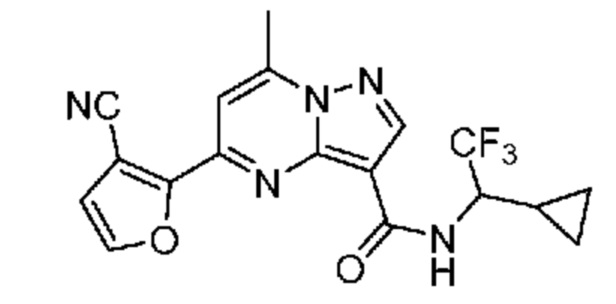
[00682] К охлажденному льдом раствору 2,2,6,6-тетраметилпиперидина (1,9 г, 13,5 ммоля) в THF (15 мл) медленно добавляли BuLi (2,5M в гексанах, 4,8 мл, 12,0 ммоля). Раствор перемешивали при 0°C в течение 30 мин и охлаждали до -78°C. Раствор фуран-3-карбонитрил (1,4 г, 15,0 ммоля) в THF (10 мл) по каплям добавляли в течение 30 мин и смесь перемешивали в течение 2 ч при -78°C. Раствор SnBu3Cl в THF (5 мл, 18 ммоля) по каплям добавляли в течение 30 мин и смесь перемешивали в течение ночи и за это время температура повышалась до RT. Реакцию останавливали насыщенным раствором NH4Cl (20 мл) и экстрагировали с помощью DCM (30 мл×3). Органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA=100:1) и получали 2-(трибутилстаннил)фуран-3-карбонитрил (3,7 г, 63%) в виде бесцветного масла. LC-MS m/z: сигнал в MS отсутствует. tR=2,65 мин.
[00683] По общей методике F 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (111 мг, 0,33 ммоля) и 2-(трибутилстаннил)фуран-3-карбонитрил давали искомое соединение (34 мг, 26%) в виде светло-желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,73 (s, 1H), 8,31 (d, J=1,5 Гц, 1H), 7,98 (d, J=11,5 Гц, 1H), 7,73 (s, 1H), 7,34 (d, J=2,0 Гц, 1H), 4,23-4,12 (m, 1H), 2,88 (s, 3H), 1,61-1,52 (m, 1H), 0,75-0,63 (m, 2H), 0,56-0,49 (m, 1H), 0,28-0,22 (m, 1H). LC-MS m/z: 390,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,49 мин.
N-(2-Циклопропилпропан-2-ил)-7-метил-5-(2-метилоксазол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
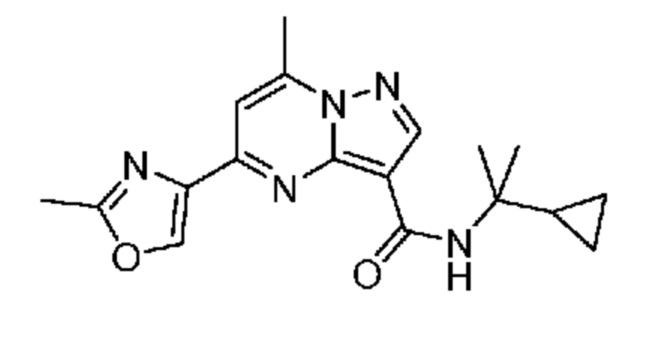
[00684] По общей методике A 7-метил-5-(2-метилоксазол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,16 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (19 мг, 35%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,64 (s, 1H), 8,51 (s, 1H), 7,98 (s, 1H), 7,61 (s, 1H), 2,83 (s, 3H), 2,54 (s, 3H), 1,44-1,42 (m, 1H), 1,37 (s, 6H), 0,48-0,46 (m, 4H). LC-MS m/z: 340,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,39 мин.
N-(2-Циклопропилпропан-2-ил)-7-метил-5-(2-метилоксазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
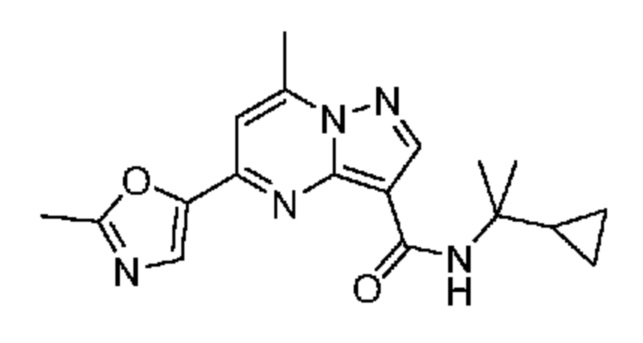
[00685] По общей методике A 7-метил-5-(2-метилоксазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (127 мг, 0,49 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (20 мг, 15%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,50 (s, 1H), 8,000 (s, 1H), 7,997 (d, J=2,4 Гц, 1H), 7,59 (s, 1H), 2,80 (s, 3H), 2,56 (s, 3H), 1,37 (s, 6H), 1,36-1,33 (m, 1H), 0,49 (d, J=6,8 Гц, 4H). LC-MS m/z: 340,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,80 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(5-метилоксазол-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
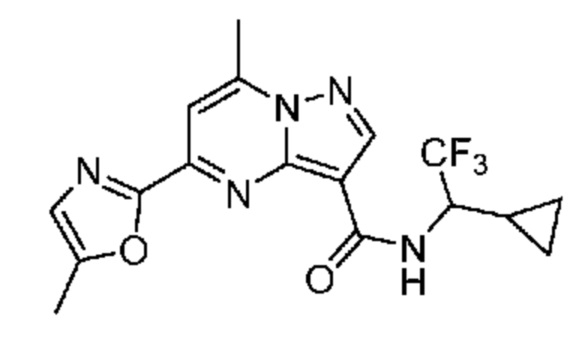
[00686] К раствору 5-метилоксазола (160 мг, 2,0 ммоля) в THF (10 мл) при -78°C в атмосфере N2 добавляли n-BuLi (2,5 ммоля, 1,0 мл, 2,5 M) и смесь перемешивали в течение 20 мин, затем добавляли ZnCl2 (2,0 ммоля, 2 мл раствора в эфире, 1M). Затем раствор перемешивали при -78°C в атмосфере N2 в течение еще 30 мин, нагревали до RT и добавляли 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (166 мг, 0,5 ммоля) и Pd(PPh3)2Cl2 (70 мг, 0,1 ммоля). Смесь перемешивали при 60°C в атмосфере N2 в течение 5 ч, концентрировали в вакууме и очищали с помощью препаративной ВЭЖХ (10 мМ NH4HCO3/MeCN)) и получали искомое соединение (24 мг, 13%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,66 (s, 1H), 7,78 (s, 1H), 7,18 (d, J=0,8 Гц, 1H), 4,56-4,51 (m, 1H), 2,94 (s, 3H), 2,52 (d, J=0,8 Гц, 3H), 1,40-1,35 (m, 1H), 0,77-0,71 (m, 1H), 0,70-0,64 (m, 2H), 0,52-0,52 (m, 1H). LC-MS m/z: 380,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,48 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(4-метилоксазол-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
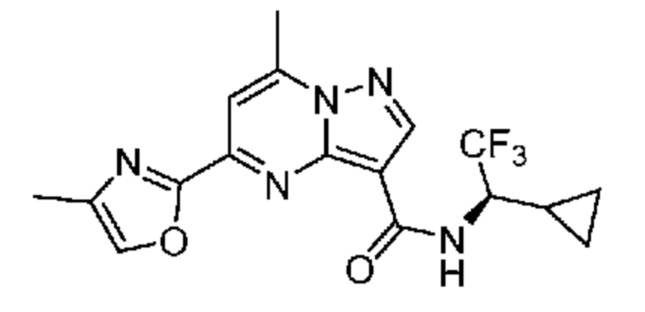
[00687] К раствору 4-метилоксазола (160 мг, 2,0 ммоля) в безводном THF (10 мл) при -78°C в атмосфере N2 по каплям добавляли BuLi (2,5 ммоля, 1,0 мл, 2,5M раствора в гексане). Смесь перемешивали при -78°C в течение 0,5 ч, затем при -78°C по каплям добавление ZnCl2 (2,5 ммоля, 2,5 мл, 1M раствор в эфире). После перемешивания при -78°C в течение 2 ч реакционной смеси давали нагреться до RT и к ней добавляли (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (330 мг, 1,0 ммоля) и Pd(PPh3)2Cl2 (30 мг, 0,05 ммоля). Полученную смесь перемешивали при 70°C в атмосфере N2 в течение 24 ч и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ (10 мМ NH3/MeCN) и получали искомое соединение (5 мг, 3%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,73 (s, 1H), 8,46 (d, J=10,0 Гц, 1H), 8,23 (d, J=1,2 Гц, 1H), 7,88 (s, 1H), 4,61-4,52 (m, 1H), 2,87 (s, 3H), 2,52 (s, 3H), 1,28-1,18 (m, 1H), 0,70-0,48 (m, 4H). LC-MS m/z: 380,1 [M+H]+. HPLC: Чистота (214 нм): 92%, tR=8,40 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(4-метилоксазол-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
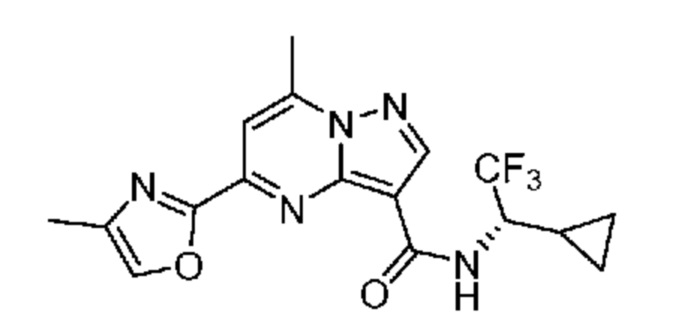
[00688] К раствору 4-метилоксазола (85 мг, 1,0 ммоля) в THF (5 мл) по каплям добавляли n-BuLi (2,5M в н-гексане, 0,44 мл, 1,1 ммоля) при -78°C. Полученный раствор перемешивали в течение 0,5 ч при -78°C, затем добавляли ZnCl2 (1,0M в Et2O, 4,4 мл, 4,4 ммоля) и нагревали до RT. К реакционной смеси добавляли (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (99 мг, 0,30 ммоля) и Pd(PPh3)2Cl2 (25 мг, 0,03 ммоля). Затем смесь перемешивали в течение 2 ч при 60°C, реакцию останавливали насыщенным раствором NH4Cl (50 мл) и экстрагировали с помощью EA (30 мл×3). Органические слои промывали с помощью H2O (50 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (10/1 EA/MeOH) и получали искомое соединение (9 мг, 8%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,72 (s, 1H), 8,46 (d, J=9,5 Гц, 1H), 8,23 (d, J=1,0 Гц, 1H), 7,88 (s, 1H), 4,60-4,53 (m, 1H), 2,88 (s, 3H), 2,25 (d, J=0,5 Гц, 3H), 1,26-1,21 (m, 1H), 0,69-0,52 (m, 4H). LC-MS m/z: 380,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,47 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3-изопропил-2-оксотетрагидропиримидин-1(2H)-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
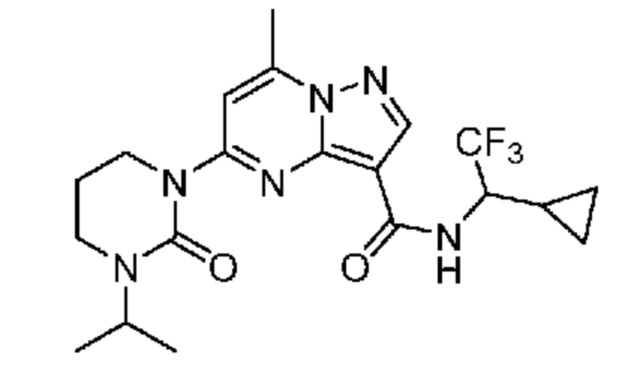
[00689] По общей методике H этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (1,7 г, 7,04 ммоля) и 1-изопропилтетрагидропиримидин-2(1H)-он давали этил-5-(3-изопропил-2-оксотетрагидропиримидин-1(2H)-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (600 мг, 25%) в виде серого масла. LC-MS m/z: 346,2 [M+H]+, tR=1,74 мин.
[00690] По общей методике B* этил-5-(3-изопропил-2-оксотетрагидропиримидин-1(2H)-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (600 мг, 1,74 ммоля) давал натриевую соль 5-(3-изопропил-2-оксотетрагидропиримидин-1(2H)-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновой кислоты (590 мг, 99%) в виде светло-зеленого твердого вещества, которое без обработки использовали на следующей стадии. LC-MS m/z: 318,1[M+H]+, tR=1,19 мин.
[00691] По общей методике A натриевая соль 5-(3-изопропил-2-оксотетрагидропиримидин-1(2H)-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновой кислоты (200 мг, 0,59 ммоля) и 1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (42 мг, 16%) в виде розового твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,45 (s, 1H), 8,23 (d, J=10,0 Гц, 1H), 8,80 (s, 1H), 4,65-4,60 (m, 1H), 4,39-4,34 (m, 1H), 3,98-3,91 (m, 2H), 3,29 (t, J=6,0 Гц, 2H), 2,72 (s, 3H), 2,07-2,02 (m, 2H), 1,23-1,21 (m, 1H), 1,14 (d, J=6,5 Гц, 6H), 0,69-0,65 (m, 1H), 0,58-0,55 (m, 2H), 0,37-0,33 (m, 1H). LC-MS m/z: 438,8 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,72min.
N-трет-Бутил-5-(3-изопропил-2-оксотетрагидропиримидин-1(2H)-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
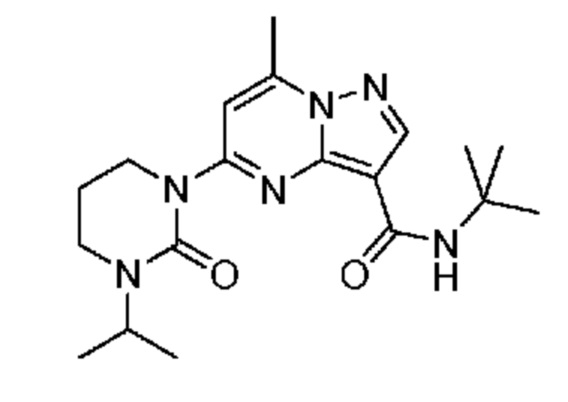
[00692] По общей методике A 5-(3-изопропил-2-оксотетрагидропиримидин-1(2H)-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (63 мг, 0,11 ммоля) и 2-метилпропан-2-амин давали искомое соединение (3,0 мг, 4%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,33 (s, 1H), 7,79 (s, 1H), 7,75 (d, J=0,5 Гц, 1H), 4,65-4,61 (m, 1H), 3,96 (t, J=6,0 Гц, 2H), 3,28 (t, J=6,0 Гц, 2H), 2,70 (s, 3H), 2,06-2,02 (m, 1H), 1,42 (s, 9H), 1,15 (d, J=7,0 Гц, 6H). LC-MS m/z: 372,9 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,20 мин.
5-(3-Изопропил-2-оксотетрагидропиримидин-1(2H)-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
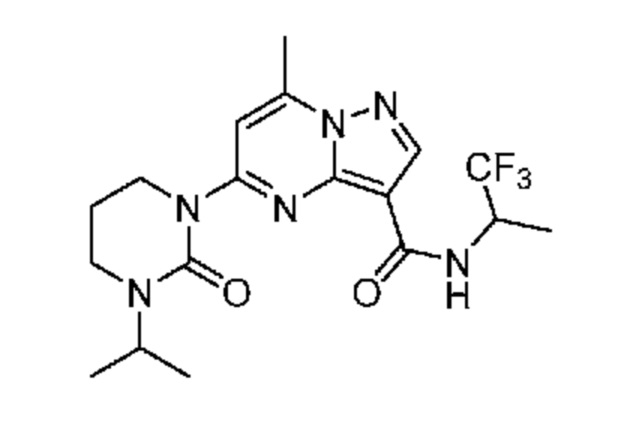
[00693] По общей методике A 5-(3-изопропил-2-оксотетрагидропиримидин-1(2H)-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,09 ммоля) и 1,1,1-трифторпропан-2-амингидрохлорид давали искомое соединение (7,2 мг, 19%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,45 (s, 1H), 8,15 (d, J=9,0 Гц, 1H), 7,79 (s, 1H), 4,93-4,87 (m, 1H), 4,65-4,60 (m, 1H), 4,01-3,97 (m, 1H), 3,93-3,88 (m, 1H), 3,29 (t, J=6,0 Гц, 2H). LC-MS m/z: 413,2 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,30 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(2-оксо-3-(2,2,2-трифторэтил)тетрагидропиримидин-1(2H)-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
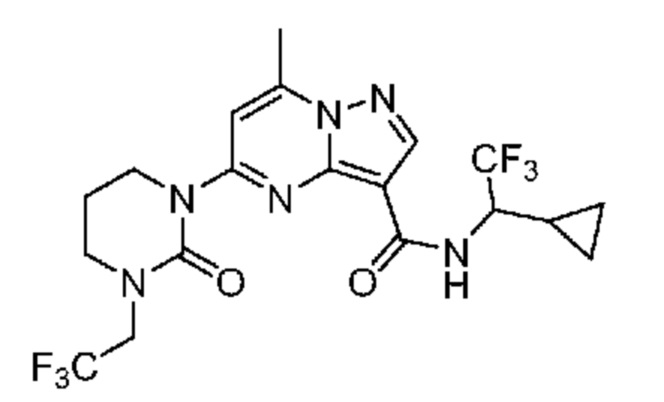
[00694] К раствору 2,2,2-трифторэтанамина (1,5 г, 15 ммоля) в MeCN (10 мл) добавляли 1-хлор-3-изоцианатопропан (2,2 г, 18 ммоля). Реакционную смесь перемешивали при RT в течение 4 ч и фильтровали и получали 1-(3-хлорпропил)-3-(2,2,2-трифторэтил)мочевину (1,3 г, 39%) в виде белого твердого вещества.
[00695] К раствору 1-(3-хлорпропил)-3-(2,2,2-трифторэтил)мочевины (1,3 г, 5,9 ммоля) в THF (4 мл) при 0°C добавляли NaH (477 мг, 11,9 ммоля). Реакционную смесь нагревали при RT и перемешивали в течение 16 ч и реакцию останавливали насыщенным раствором NH4Cl (20 мл). Смесь экстрагировали с помощью EA (10 мл×3) и объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 1-(2,2,2-трифторэтил)тетрагидропиримидин-2(1H)-он (600 мг, 56%) в виде белого твердого вещества.
[00696] По общей методике H 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и 1-(2,2,2-трифторэтил)тетрагидропиримидин-2(1H)-он давали искомое соединение (60 мг, 27%) в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 8,55 (s, 1H), 8,11 (d, J=10,0 Гц, 1H), 7,80 (d, J=1,0 Гц, 1H), 4,50-4,44 (m, 1H), 4,18-4,05 (m, 4H), 3,64-3,61 (m, 2H), 2,78 (s, 3H), 2,26-2,19 (m, 2H), 1,12-1,10 (m, 1H), 0,71-0,69 (m, 1H), 0,56-0,52 (m, 3H). LC-MS m/z: 478,7 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,62 мин.
N-(2-Циклопропилпропан-2-ил)-5-(3-изопропил-2-оксотетрагидропиримидин-1(2H)-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
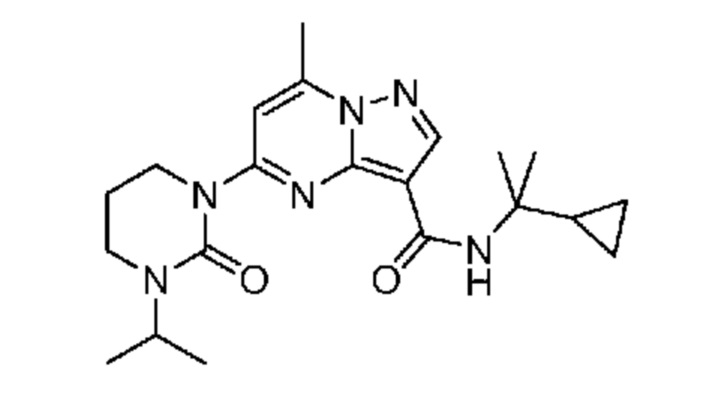
[00697] По общей методике A 5-(3-изопропил-2-оксотетрагидропиримидин-1(2H)-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,09 ммоля) и 2-циклопропилпропан-2-амин давали искомое соединение (11,5 мг, 32%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,32 (s, 1H), 7,76 (d, J=8,0 Гц, 1H), 7,75 (s, 1H), 4,62-4,58 (m, 1H), 3,97 (t, J=6,0 Гц, 2H), 3,28 (t, J=6,0 Гц, 2H), 2,69 (s, 3H), 2,06-2,00 (m, 2H), 1,39-1,33 (m, 1H), 1,32 (s, 6H), 1,14 (d, J=6,8 Гц, 6H), 0,42-0,37 (m, 4H). LC-MS m/z: 399,2 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,53 мин.
5-(3-Изопропил-2-оксотетрагидропиримидин-1(2H)-ил)-7-метил-N-(1,1,1-трифтор-2-метилпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
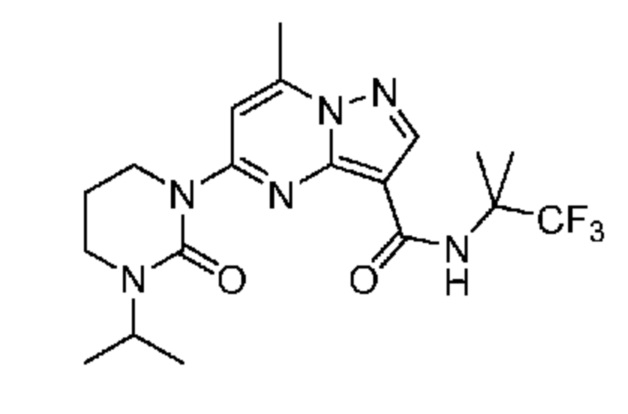
[00698] По общей методике A 5-(3-изопропил-2-оксотетрагидропиримидин-1(2H)-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,09 ммоля) и 1,1,1-трифтор-2-метилпропан-2-амингидрохлорид давали искомое соединение (4,5 мг, 12%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,38 (s, 1H), 8,00 (s, 1H), 7,77 (s, 1H), 4,63-4,60 (m, 2H), 3,92 (t, J=5,5 Гц, 2H), 3,30-3,27 (m, 2H), 2,70 (s, 3H), 2,06-2,01 (m, 2H), 1,66 (s, 6H), 1,14 (d, J=7,0 Гц, 6H). LC-MS m/z: 427,1 [M+H]+. HPLC: Чистота (214 нм): 97%; tR=8,73 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(4-метоксипиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
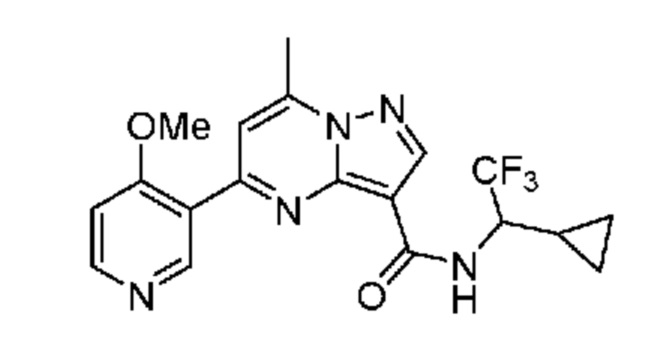
[00699] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и 4-метоксипиридин-3-илбороновая кислота давали искомое соединение (29 мг, 24%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,87 (s, 1H), 8,68 (s, 1H), 8,61 (d, J=6,0 Гц, 1H), 8,46 (d, J=9,5 Гц, 1H), 7,73 (d, J=1,0 Гц, 1H), 7,33 (d, J=6,0 Гц, 1H), 4,52-4,47 (m, 1H), 4,00 (s, 3H), 2,86 (d, J=0,5 Гц, 3H), 1,20-1,16 (m, 1H), 0,68-0,65(m, 1H), 0,57-0,54 (m, 2H), 0,38-0,34 (m, 1H). LC-MS m/z: 406,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,57 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(5-фторфуран-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
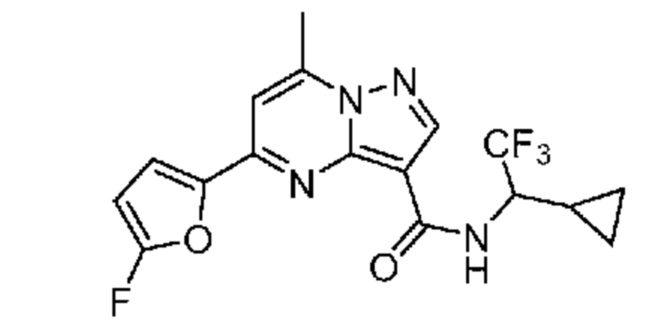
[00700] Смесь 5-бромфуран-2-карбоновой кислоты (3 г, 15,8 ммоля) и бикарбонат натрия (3,3 г, 39,5 ммоля) перемешивали в 135 мл смеси пентан/вода (2/5) при комнатной температуре в течение 30 мин, затем добавляли 1-хлорметил-4-фтор-1,4-диазониабицикло[2.2.2]октанбистетрафторборат (5,6 г, 15,8 ммоля). Смесь перемешивали в течение еще ч при комнатной температуре и разделяли и получали раствор 5-бром-2-фторфурана в пентане, который сушили (MgSO4), разбавляли с помощью 20 мл безводного THF и охлаждали до -78°C в атмосфере азота. К нему добавляли н-бутиллитий (2,6M, 3,2 мл, 7,9 ммоля). Смесь перемешивали при-78°C в течение 30 мин, затем добавляли три-н-бутилстаннилхлорид (2,6 г, 7,9 ммоля). Затем смесь перемешивали при комнатной температуре в течение еще 20 мин, реакцию останавливали насыщенным раствором NH4Cl (100 мл) и разделяли. Органическую фазу сушили над безводным MgSO4 и фильтровали. Фильтрат концентрировали в вакууме и получали трибутил(5-фторфуран-2-ил)станнан (3,0 г) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки.
[00701] По общей методике F 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,33 ммоля) и трибутил(5-фторфуран-2-ил)станнан давали искомое соединение (58,3 мг, 49%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,60 (s, 1H), 8,46 (d, J=9,6 Гц, 1H), 7,61 (s, 1H), 7,56(t, J=3,6 Гц, 1H), 6,24 (dd, J=6,8 Гц, 3,6 Гц, 1H), 4,57-4,46 (m, 1H), 2,81 (s, 3H), 1,31-1,26 (m, 1H), 0,70-0,41 (m, 4H). LC-MS m/z: 383,1 [M+H]+. HPLC: Чистота (214 нм): 98%; tR=9,02 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(5-метоксипиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
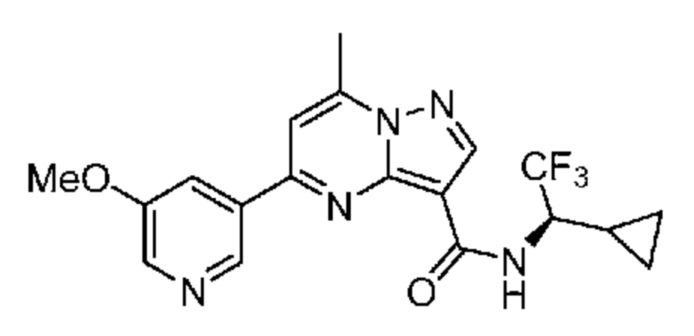
[00702] По общей методике D (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,15 ммоля) и 3-метокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин давали искомое соединение (18 мг, 29%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,03 (d, J=1,5 Гц, 1H), 8,70 (s, 1H), 8,51 (d, J=2,5 Гц, 1H), 8,50 (d, J=9,5 Гц, 1H), 8,11 (dd, J=2,5 Гц, 2,0 Гц, 1H), 8,08 (s, 1H), 4,50-4,48 (m, 1H), 3,96 (s, 3H), 2,88 (s, 3H), 1,29-1,22 (m, 1H), 0,70-0,67 (m, 1H), 0,60-0,56 (m, 2H), 0,40-0,38 (m, 1H). LC-MS m/z: 406,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=7,99 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(5-метоксипиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
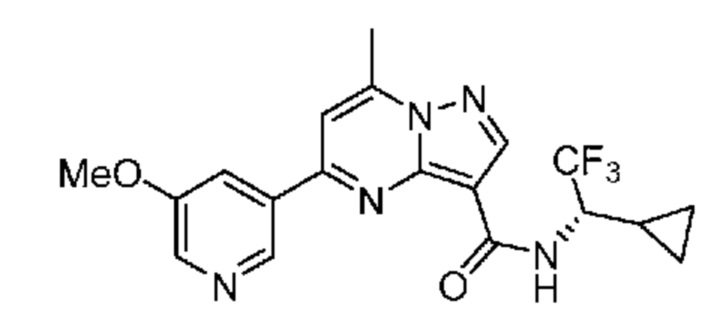
[00703] По общей методике D (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,15 ммоля) и 3-метокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин давали искомое соединение (16 мг, 26%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,03 (d, J=1,5 Гц, 1H), 8,70 (s, 1H), 8,51 (d, J=2,5 Гц, 1H), 8,50 (d, J=9,5 Гц, 1H), 8,11 (dd, J=2,5 Гц, 2,0 Гц, 1H), 8,08 (s, 1H), 4,50-4,48 (m, 1H), 3,96 (s, 3H), 2,88 (s, 3H), 1,29-1,22 (m, 1H), 0,70-0,67 (m, 1H), 0,60-0,56 (m, 2H), 0,40-0,38 (m, 1H). LC-MS m/z: 406,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,00 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(6-метоксипиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
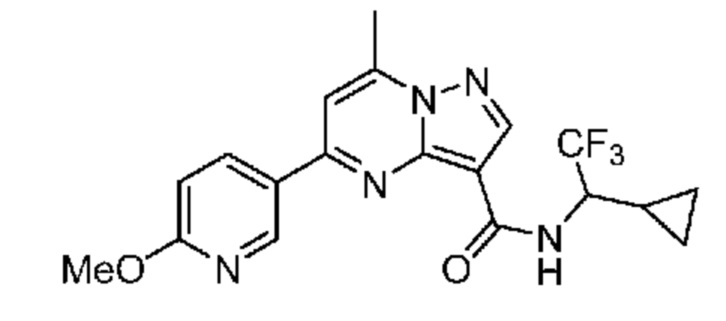
[00704] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 6-метоксипиридин-3-илбороновая кислота давали искомое соединение (74 мг, 76%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,07 (d, J=2,5 Гц, 1H), 8,64 (s, 1H), 8,52 (d, J=9,5 Гц, 1H), 8,49 (dd, J=8,5 Гц, 3,0 Гц, 1H), 7,95 (s, 1H), 7,09 (d, J=9,0 Гц, 1H), 4,46-4,43 (m, 1H), 3,98 (s, 3H), 2,85 (s, 3H), 1,31-1,28 (m, 1H), 0,70-0,68 (m, 1H), 0,60-0,58 (m, 2H), 0,40-0,37 (m, 1H). LC-MS m/z: 406,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,87 мин.
5-(4-Метоксипиридин-3-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
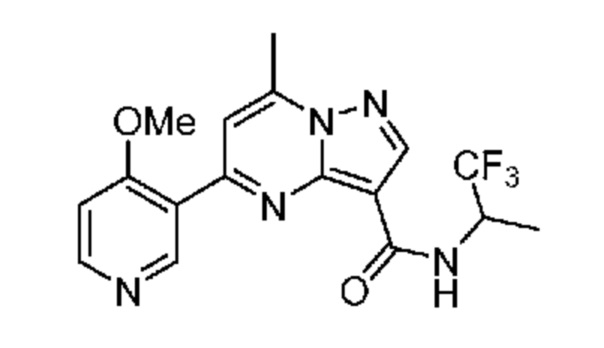
[00705] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,33 ммоля) и 4-метоксипиридин-3-илбороновая кислота давали искомое соединение (42,5 мг, 34%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,88 (s, 1H), 8,68 (s, 1H), 8,61 (d, J=6,0 Гц, 1H), 8,42 (d, J=9,0 Гц, 1H), 7,73 (s, 1H), 7,32 (d, J=5,5 Гц, 1H), 4,97-4,92 (m, 1H), 4,00 (s, 3H), 2,86 (s, 3H), 1,39 (d, J=7,0 Гц, 3H). LC-MS m/z: 380,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,12 мин.
5-(5-Метоксипиридин-3-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
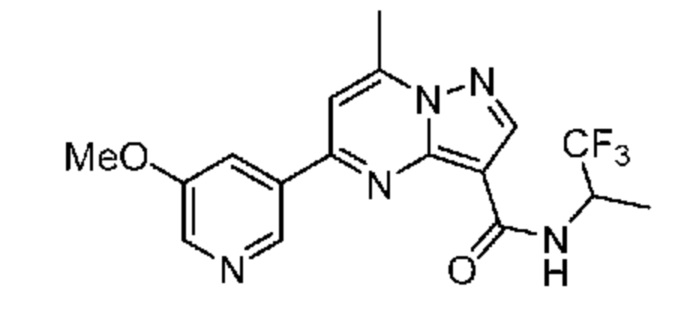
[00706] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (90 мг, 0,29 ммоля) и 3-метокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин давали искомое соединение (64 мг, 65%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,03 (s, 1H), 8,69 (s, 1H), 8,50 (d, J=3,0 Гц, 1H), 8,41 (d, J=9,0 Гц, 1H), 8,12 (s, 1H), 8,07 (s, 1H), 5,01-4,95 (m, 1H), 3,96 (s, 3H), 2,88 (s, 3H), 1,45 (d, J=7,0 Гц, 3H). LC-MS m/z: 380,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,61 мин.
(R)-5-(6-Метоксипиридин-3-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
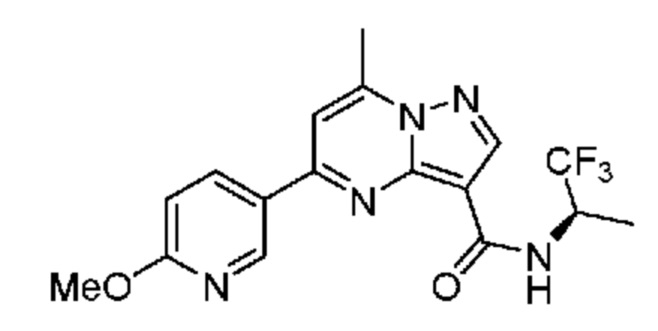
[00707] По общей методике D (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,23 ммоля) и 6-метоксипиридин-3-илбороновая кислота давали искомое соединение (43 мг, 49%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,05 (d, J=2,0 Гц, 1H), 8,63 (s, 1H), 8,46 (dd, J=9,0 Гц, 2,5 Гц, 1H), 8,41 (d, J=9,5 Гц, 1H), 7,91 (s, 1H), 7,07 (d, J=8,5 Гц, 1H), 4,99-4,94 (m,1H), 3,97 (s, 3H), 2,84 (s, 3H), 1,46 (d, J=6,5 Гц, 3H). LC-MS m/z: 380,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,40 мин.
(S)-5-(6-Метоксипиридин-3-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
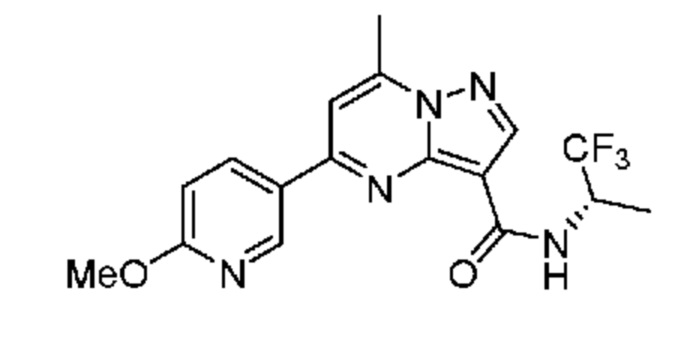
[00708] По общей методике D (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (110 мг, 0,35 ммоля) и 6-метоксипиридин-3-илбороновая кислота давали искомое соединение (55 мг, 40%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,07 (d, J=2,0 Гц, 1H), 8,64 (s, 1H), 8,49 (dd, J=8,5 Гц, 2,5 Гц, 1H), 8,42 (d, J=9,5 Гц, 1H), 7,94 (s, 1H), 7,10 (d, J=8,5 Гц, 1H), 5,00-4,94 (m, 1H), 3,98 (s, 3H), 2,85 (s, 3H), 1,46 (d, J=6,5 Гц, 3H). LC-MS m/z: 380,1 [M+H]+. HPLC: Чистота (214 нм): 99,39%; tR=8,93 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(4-метилпиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
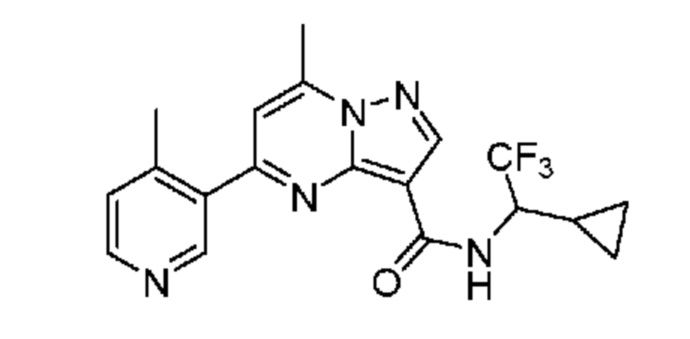
[00709] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 4-метилпиридин-3-илбороновая кислота давали искомое соединение (3,6 мг, 4%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,80 (s, 1H), 8,72 (s, 1H), 8,59 (d, J=5,0 Гц, 1H), 8,34 (d, J=9,0 Гц, 1H), 7,66 (s, 1H), 7,47 (d, J=5,0 Гц, 1H), 4,41-4,38 (m, 1H), 2,88 (s, 3H), 2,57 (s, 3H), 1,17-1,15 (m, 1H), 0,66-0,51 (m, 3H), 0,32-0,29 (m, 1H). LC-MS m/z: 390,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=7,78 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(5-метилпиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
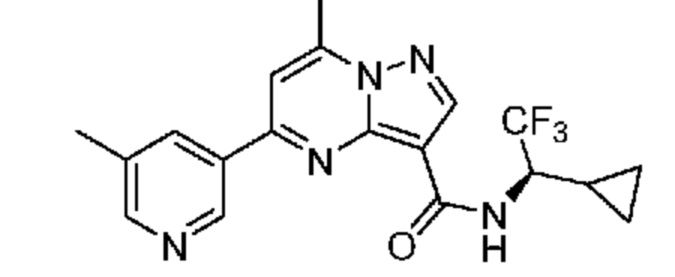
[00710] По общей методике D (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (75 мг, 0,23 ммоля) и 5-метилпиридин-3-илбороновая кислота давали искомое соединение (25 мг, 28%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,23 (d, J=2,0 Гц, 1H), 8,68 (s, 1H), 8,64 (d, J=1,0 Гц, 1H), 8,54 (d, J=9,5 Гц, 1H), 8,40 (s, 1H), 8,03 (s, 1H), 4,55-4,51 (m, 1H), 2,88 (s, 3H), 2,43 (s, 3H), 1,31-1,26 (m, 1H), 0,71-0,67 (m, 1H), 0,62-0,55 (m, 2H), 0,43-0,40 (m, 1H). LC-MS m/z: 390,1 [M+H]+. HPLC: Чистота (214 нм): > 98%; tR=8,11 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(5-метилпиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
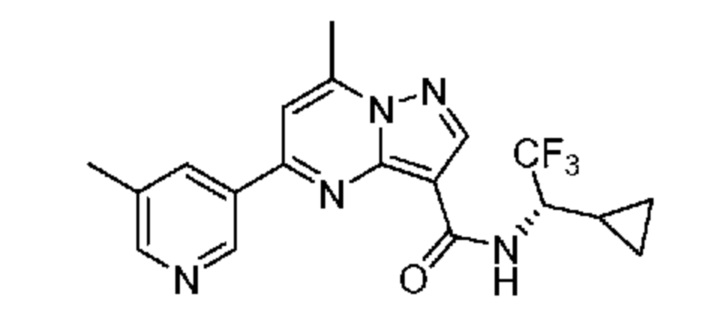
[00711] По общей методике D (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (67 мг, 0,20 ммоля) и 5-метилпиридин-3-илбороновая кислота давали искомое соединение (35 мг, 45%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 9,23 (d, J=2,0 Гц, 1H), 8,69(s, 1H), 8,64 (d, J=1,2 Гц, 1H), 8,55 (d, J=9,6 Гц, 1H), 8,41 (s, 1H), 8,04 (s, 1H), 4,52 (q, J=8,0 Гц, 1H), 2,88 (s, 3H), 2,43 (s, 3H), 1,31-1,27 (m, 1H), 0,71-0,67 (m, 1H), 0,61-0,57 (m, 2H), 0,43-0,39 (m, 1H). LC-MS m/z: 390,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,12 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(6-метилпиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
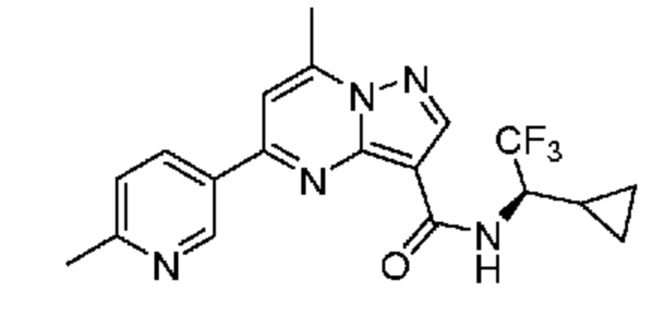
[00712] По общей методике D этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (239 мг, 1,0 ммоля) и 6-метилпиридин-3-илбороновая кислота давали этил-7-метил-5-(6-метилпиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (150 мг, 50%) в виде желтого твердого вещества. LC-MS m/z: 297,1 [M+H]+. tR=1,65 мин.
[00713] По общей методике B* этил-7-метил-5-(6-метилпиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (150 мг, 0,506) давал 7-метил-5-(6-метилпиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновую кислоту (110 мг, 81%) в виде желтого твердого вещества. LC-MS m/z: 269,1 [M+H]+. tR=1,14 мин.
[00714] По общей методике A 7-метил-5-(6-метилпиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (60 мг, 0,22 ммоля) и (R)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (44 мг, 38%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,30 (d, J=2,5 Гц, 1H), 8,67 (s, 1H), 8,53 (d, J=9,5 Гц, 1H), 8,46 (dd, J=8,0 Гц, 2,0 Гц, 1H), 8,00 (s, 1H), 7,53 (d, J=8,0 Гц, 1H), 4,56-4,40 (m, 1H), 2,87 (s, 3H), 2,59 (s, 3H), 1,36-1,23 (m, 1H), 0,77-0,54 (m, 3H), 0,42-0,35 (m, 1H). LC-MS m/z: 390,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,05 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(6-метилпиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
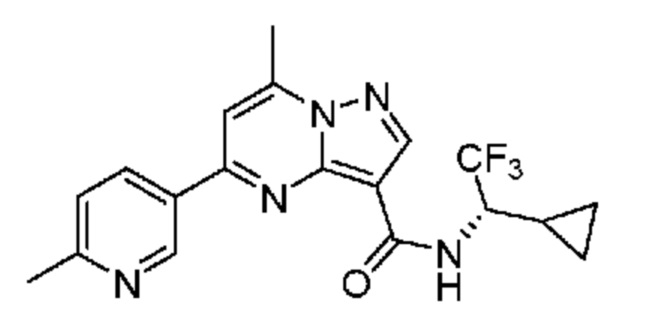
[00715] По общей методике A 7-метил-5-(6-метилпиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (55 мг, 0,205 ммоля) и (S)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (24 мг, 30%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 9,28 (d, J=2,5 Гц, 1H), 8,65 (s, 1H), 8,52 (dd, J=8,5 Гц, 2,0 Гц, 1H), 7,81 (d, J=0,5 Гц, 1H), 7,56 (d, J=8,0 Гц, 1H), 4,46-4,42 (m, 1H), 2,96 (s, 3H), 2,67 (s, 3H), 1,35-1,31 (m, 1H), 0,81-0,76 (m, 1H), 0,72-0,62 (m, 1H), 0,61-0,58 (m, 1H), 0,52-0,49 (m, 4H). LC-MS m/z: 390,1 [M+H]+. HPLC: Чистота (214 нм): 97,01%; tR=8,05 мин.
7-Метил-5-(4-метилпиридин-3-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
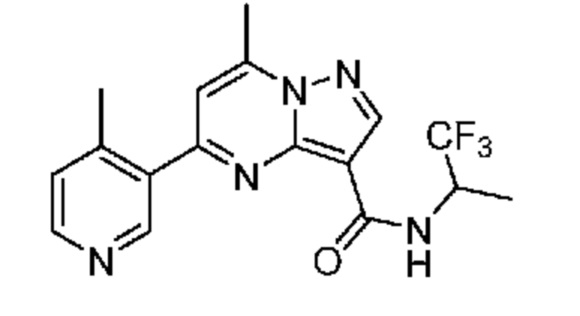
[00716] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,26 ммоля) и 4-метилпиридин-3-илбороновая кислота давали искомое соединение (18,2 мг, 19%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,81 (s, 1H), 8,72 (s, 1H), 8,59 (d, J=5,0 Гц, 1H), 8,24 (d, J=9,5 Гц, 1H), 7,67 (s, 1H), 7,48 (d, J=5,0 Гц, 1H), 4,98-4,94 (m, 1H), 2,87 (s, 3H), 2,56 (s, 3H), 1,36 (d, J=7,0 Гц, 3H). LC-MS m/z: 364,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,35 мин
7-Метил-5-(5-метилпиридин-3-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
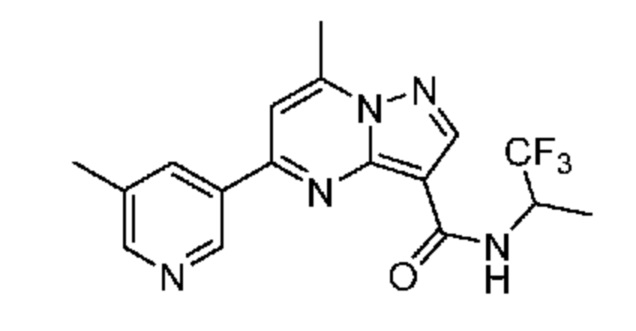
[00717] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,26 ммоля) и 5-метилпиридин-3-илбороновая кислота давали искомое соединение (11,2 мг, 12%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,24 (d, J=2,0 Гц, 1H), 8,69 (s, 1H), 8,64 (s, 1H), 8,49 (d, J=9,0 Гц, 1H), 8,42 (s, 1H), 8,04 (s, 1H), 5,02-4,95 (m, 1H), 2,88 (s, 3H), 2,44 (s, 3H), 1,46 (d, J=7,0 Гц, 3H). LC-MS m/z: 364,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,67 мин.
7-Метил-5-(6-метилпиридин-3-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
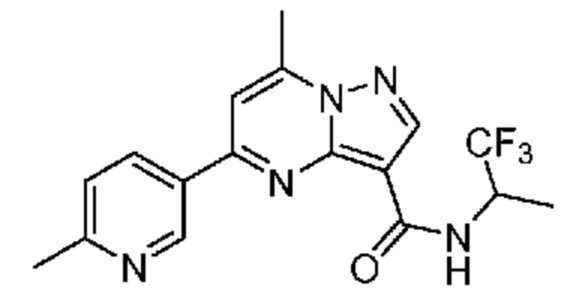
[00718] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,327 ммоля) и 6-метилпиридин-3-илбороновая кислота давали искомое соединение (8,2 мг, 7%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 9,27 (d, J=2,0 Гц, 1H), 8,64 (s, 1H), 8,52 (dd, J=8,5 Гц, 2,5 Гц, 1H), 7,79 (s, 1H), 7,55 (d, J=8,0 Гц, 1H), 5,00-4,97 (m, 1H), 2,95 (s, 3H), 2,67 (s, 3H), 1,54 (d, J=7,0 Гц, 3H). LC-MS m/z: 364,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=6,46 мин.
7-Метил-5-(4-(трифторметил)пиридин-3-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
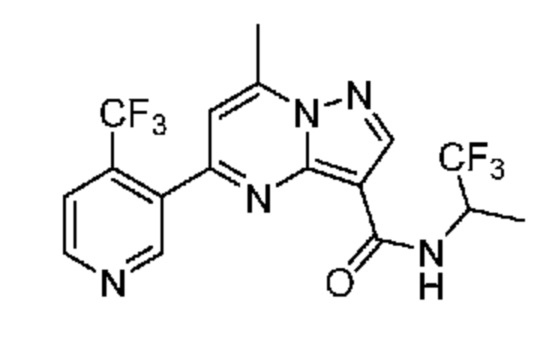
[00719] По общей методике E* 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (90 мг, 0,29 ммоля) и 3-бром-4-(трифторметил)пиридин давали искомое соединение (10 мг, 8%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,10 (s, 1H), 9,07 (d, J=5,0 Гц, 1H), 8,78 (s, 1H), 8,05 (d, J=5,0 Гц, 1H), 7,99 (d, J=9,0 Гц, 1H), 7,72 (s, 1H), 5,01-4,94 (m, 1H), 2,91 (s, 3H), 1,31 (d, J=7,0 Гц, 3H). LC-MS m/z: 418,0 [M+H]+. HPLC: Чистота (214 нм): 98%; tR=7,79 мин.
(R)-7-Метил-5-(5-(трифторметил)пиридин-3-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
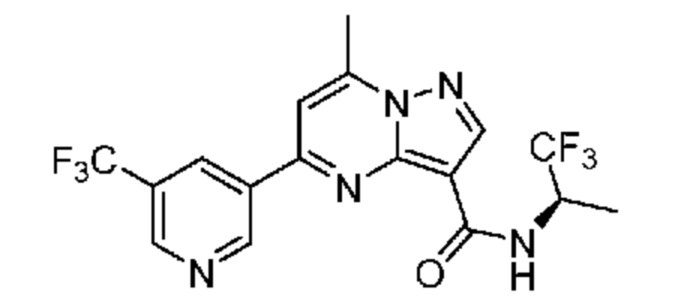
[00720] По общей методике D (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,23 ммоля) и 5-(трифторметил)пиридин-3-илбороновая кислота давали искомое соединение (59 мг, 61%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 9,72 (d, J=1,6 Гц, 1H), 9,21 (d, J=3,2 Гц, 1H), 8,95 (s, 1H), 8,73 (s, 1H), 8,42 (d, J=9,2 Гц, 1H), 8,21 (s, 1H), 5,02-4,96 (m, 1H), 2,90 (s, 3H), 1,44 (d, J=7,2 Гц, 3H). LC-MS m/z: 418,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,49 мин.
(S)-7-Метил-5-(5-(трифторметил)пиридин-3-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
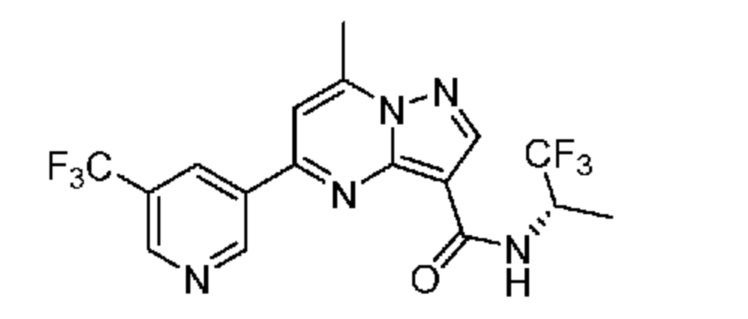
[00721] По общей методике D (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,23 ммоля) и 5-(трифторметил)пиридин-3-илбороновая кислота давали искомое соединение (33,4 мг, 34%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 9,72 (d, J=1,6 Гц, 1H), 9,21 (d, J=3,2 Гц, 1H), 8,95 (s, 1H), 8,73 (s, 1H), 8,42 (d, J=9,2 Гц, 1H), 8,21 (s, 1H), 5,02-4,96 (m, 1H), 2,90 (s, 3H), 1,44 (d, J=7,2 Гц, 3H). LC-MS m/z: 418,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,48 мин.
7-Метил-5-(6-(трифторметил)пиридин-3-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
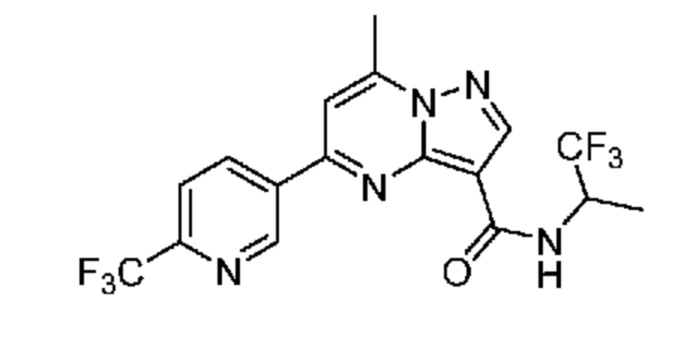
[00722] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,26 ммоля) и 6-(трифторметил)пиридин-3-илбороновая кислота давали искомое соединение (18 мг, 19%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,57 (s, 1H), 8,85 (dd, J=8,5 Гц, 1,5 Гц, 1H), 8,75 (s, 1H), 8,36 (d, J=9,0 Гц, 1H), 8,23 (d, J=8,0 Гц, 1H), 8,12 (s, 1H), 5,02-4,94 (m, 1H), 2,90 (s, 3H), 1,47 (d, J=7,0 Гц, 3H). LC-MS m/z: 418,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,66 мин.
5-(Бензо[d][1,3]диоксол-5-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
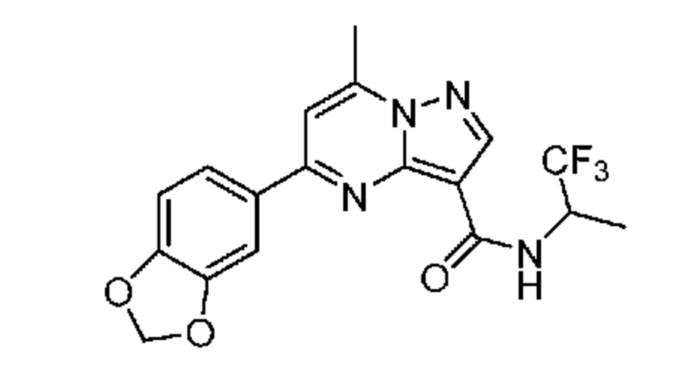
[00723] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (140 мг, 0,46 ммоля) и 2-(бензо[d][1,3]диоксол-5-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан давали искомое соединение (35 мг, 19%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,58 (s, 1H), 7,82 (dd, J=8,0 Гц, 1,5 Гц 1H), 7,20 (d, J=1,5 Гц, 1H), 7,66 (s, 1H), 7,04 (d, J=8,0 Гц, 1H), 6,12 (s, 1H), 4,99-4,96 (m, 1H), 2,90 (s, 3H), 1,54 (d, J=7,0 Гц, 3H). LC-MS m/z: 393,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=8,49 мин.
(S)-5-(5-Хлорпиридин-3-ил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
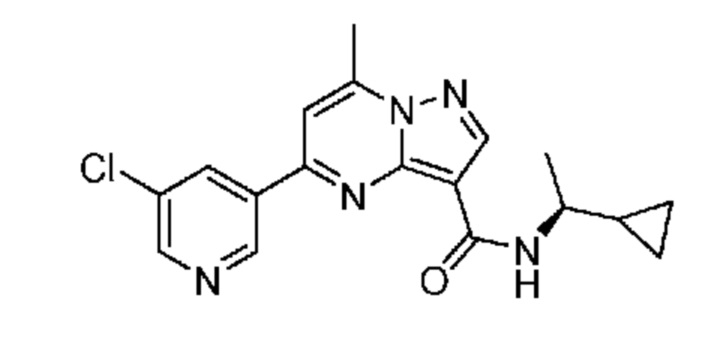
[00724] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (150 мг, 0,54 ммоля) и 5-хлорпиридин-3-илбороновая кислота давали искомое соединение (37 мг, 19%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,41 (s, 1H), 8,85 (s, 1H), 8,72 (s, 1H), 8,62 (s, 1H), 8,07 (d, J=8,0 Гц, 1H), 8,06 (s, 1H), 3,65-3,60 (m, 1H), 2,86 (s, 3H), 1,28 (d, J=6,5 Гц, 3H), 1,14-1,10 (m, 1H), 0,56-0,46 (m, 2H), 0,42-0,32 (m, 2H). LC-MS m/z: 356,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,16 мин.
(R)-5-(5-Хлорпиридин-3-ил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
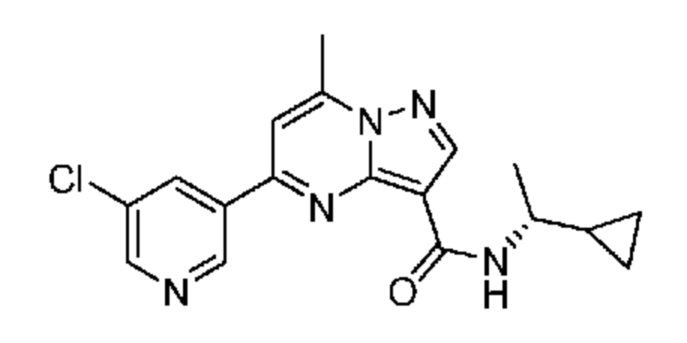
[00725] По общей методике D (R)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,25 ммоля) и 5-хлорпиридин-3-илбороновая кислота давали искомое соединение (21 мг, 22%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 9,42 (d, J=1,6 Гц, 1H), 8,85 (d, J=2,0 Гц, 1H), 8,73 (s, 1H) 8,62 (s, 1H), 8,09 (s, 1H), 8,08 (d, J=7,6 Гц, 1H), 4,66-4,58 (m, 1H), 2,87 (s, 3H), 1,28 (d, J=6,4 Гц, 3H), 1,16-1,07 (m, 1H), 0,58-0,46 (m, 2H), 0,44-0,29 (m, 2H). LC-MS m/z: 356,1 [M+H]+. HPLC: Чистота (214 нм): 95%; tR=8,21 мин.
5-(5-Хлорпиридин-3-ил)-N-(2-циклопропилпропан-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
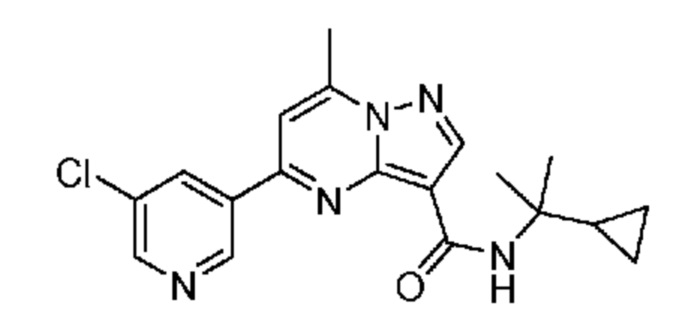
[00726] По общей методике D 5-хлор-N-(2-циклопропилпропан-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (150 мг, 0,54 ммоля) и 5-хлорпиридин-3-илбороновая кислота давали искомое соединение (37 мг, 19%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,39 (d, J=2,0 Гц, 1H), 8,84 (d, J=2,5 Гц, 1H), 8,69 (t, J=2,0 Гц, 1H), 8,58 (s, 1H), 8,07 (s, 1H), 8,04 (s, 1H), 2,86 (s, 3H), 1,40-1,38 (m, 1H), 1,38 (s, 6H), 0,53-0,48 (m, 4H).
N-((1R,4R)-4-Бутоксициклогексил)-5-(5-хлорпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
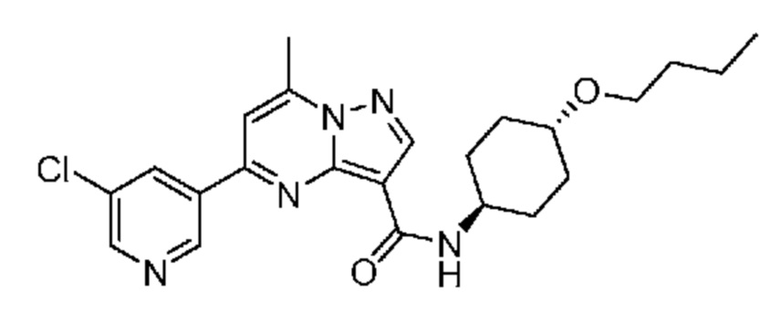
[00727] По общей методике A 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (600 мг, 2,84 мг) и (1R,4R)-4-бутоксициклогексанамин давали N-((1R,4R)-4-бутоксициклогексил)-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (820 мг, 80%) в виде желтого твердого вещества. LC-MS m/z: 365,2 [M+H]+. Чистота (214 нм): 63,1%; tR=1,96 мин.
[00728] По общей методике D N-((1R,4R)-4-бутоксициклогексил)-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (150 мг, 0,41 ммоля) и 5-хлорпиридин-3-илбороновая кислота давали искомое соединение (35 мг, 19%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,36 (s, 1H), 8,85 (s, 1H), 8,69 (s, 1H), 8,62 (s, 1H), 8,03 (s, 1H), 7,99 (d, J=6,5 Гц, 1H), 3,85-3,83 (m, 1H), 3,44-3,41 (m, 1H), 3,41 (t, J=6,0 Гц, 2H), 2,85 (s, 3H), 2,02-1,97 (m, 4H), 1,48-1,32 (m, 8H), 0,89 (t, J=6,0 Гц, 3H). LC-MS m/z: 442,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,42 мин.
5-(7-Фторбензо[d][1,3]диоксол-5-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
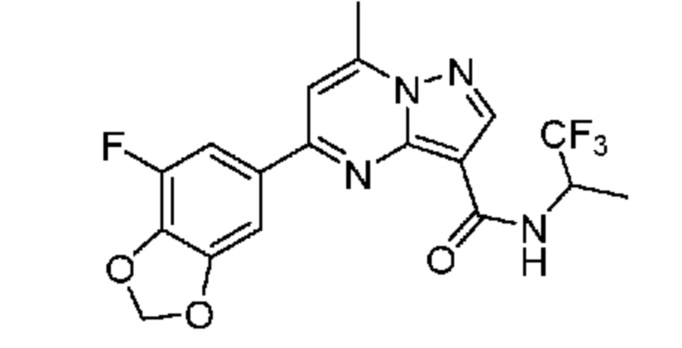
[00729] К раствору 3-фтор-2-гидроксибензальдегида (5 г, 35,6 ммоля) в MeCN (40 мл) при RT добавляли NBS (6,008 г, 36 ммоля) и CH3CO2NH4 (270 мг, 3,56 ммоля) и смесь перемешивали при RT в течение 2 ч, выливали в H2O (30 мл) и экстрагировали с помощью EA (20 мл×2). Органические слои сушили над безводным Na2SO4, фильтровали, концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA=от 8/1 до 4/1) и получали 5-бром-3-фтор-2-гидроксибензальдегид (6,6 г, 85%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 11,24 (s, 1H), 10,22 (s, 1H), 7,84 (dd, J=10,4 Гц, 2,4 Гц, 1H), 7,59 (dd, J=2,4 Гц, 1,6 Гц, 1H). LC-MS: tR=1,284 мин.
[00730] К раствору 5-бром-3-фтор-2-гидроксибензальдегида (6,6 г, 30,13 ммоля) в THF (43 мл) при 0°C по каплям добавляли водный раствор NaOH (0,05 н., 119 мл, 6 ммоля), затем добавляли 30% раствор H2O2 (16,5 мл). Смесь перемешивали в течение 2 ч при RT, затем добавляли вторую порцию 30% раствора H2O2 (16,5 мл). После перемешивания в течение 4 ч ее охлаждали до 0(C и водный раствор NaOH (2 н., 18,5 мл) добавляли до установления pH 10~11 и затем смесь перемешивали в течение 0,5 ч и реакционную смесь подкисляли концентрированной HCl при 0(C до pH 2~3. Ее экстрагировали с помощью DCM (40 мл(3) и органические фазы промывали рассолом (50 мл(2), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 5-бром-3-фторбензол-1,2-диол (5,1 г, 82%) в виде желтого масла. LC-MS m/z: 205 [M-H]-. tR=1,469 мин.
[00731] К раствору 5-бром-3-фторбензол-1,2-диола (5,0 г, 18,5 ммоля) и BrClCH2 (3,6 г, 27,75 ммоля) в безводном DMF (100 мл) добавляли Cs2CO3 (12,1 г, 37 ммоля). Смесь перемешивали при 60(C в течение 3 ч, выливали в H2O (200 мл) и экстрагировали с помощью EA (80 мл(3). Объединенные экстракты промывали рассолом (100 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA=от 50/1 до 10/1) и получали 6-бром-4-фторбензо[d][1,3]диоксол (1,8 г, 43%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 6,13 (s, 1H), 6,08 (s, 1H), 5,26 (s, 2H). LC-MS m/z: tR=1,89 мин.
[00732] К раствору 6-бром-4-фторбензо[d][1,3]диоксола (1,6 г, 7,3 ммоля) в диоксане (20 мл) в атмосфере N2 добавляли 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (2,04 г, 8,03 ммоля), AcOK (1,43 г, 14,6 ммоля) и Pd(dppf)Cl2•DCM (534 мг, 0,73 ммоля). Смесь перемешивали при 110(C в течение 14 ч, выливали в H2O (60 мл) и экстрагировали с помощью EA (50 мл(2). Органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA=от 30/1 до 10/1) и получали 2-(7-фторбензо[d][1,3]диоксол-5-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (1,6 г, 82%) в виде желтого масла. LC-MS: tR=2,03 мин.
[00733] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,37 ммоля) и 2-(7-фторбензо[d][1,3]диоксол-5-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан давали искомое соединение (5,8 мг, 4%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,64 (s, 1H), 8,44 (d, J=9,0 Гц, 1H), 7,94 (s, 1H), 7,82 (dd, J=11,5 Гц, 1,0 Гц, 1H), 7,70 (d, J=1,0 Гц, 1H), 6,29 (s, 2H), 5,00-4,92 (m, 1H), 2,83 (s, 3H), 1,44 (d, J=7,0 Гц, 3H). LC-MS m/z: 411,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,71 мин.
(R)-5-(7-Фторбензо[d]оксазол-5-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
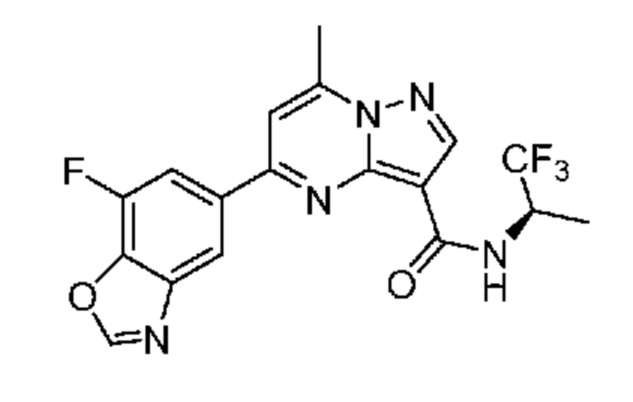
[00734] К смеси 2-амино-4-бром-6-фторфенола (500 мг, 2,4 ммоля) с метилортоформиатом (5 мл) добавляли p-TsOH•H2O (41,6 мг, 0,24 ммоля). Смесь перемешивали в течение 2 ч при 85°C в атмосфере N2 и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле (PE/EA=20/1~10/1) и получали 5-бром-7-фторбензо[d]оксазол (370 мг, 67%) в виде желтого масла. 1H ЯМР (500 МГц, DMSO-d6): δ 8,93(s, 1H), 7,96(s, 1H), 8,78(d, J=10,0 Гц, 1H).
[00735] Смесь 5-бром-7-фторбензо[d]оксазола (90 мг, 0,41 ммоля), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) (157 мг, 0,62 ммоля), Pd(PPh3)2Cl2 (33 мг, 0,04 ммоля) и KOAc (81 мг, 0,83 ммоля) в 1,4-диоксане (5 мл) перемешивали в течение 2 ч при 90°C в атмосфере N2 и затем охлаждали до RT. К этой смеси добавляли (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (78 мг, 0,25 ммоля), Na2CO3 (88 мг, 0,83 ммоля) и H2O (1 мл) и перемешивали в течение 3 ч при 90°C в атмосфере N2. Смесь разбавляли с помощью H2O (10 мл), экстрагировали с помощью EA (15 мл×3), промывали рассолом (10 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE:EA=10:1~1:1) и препаративной HPLC (MeCN/NH4HCO3) и получали искомое соединение (25 мг, 38%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 9,02 (s, 1H), 8,68 (s, 1H), 8,60 (d, J=1,6 Гц, 1H), 8,49 (d, J=9,6 Гц, 1H), 8,27 (d, J=12,4 Гц, 1H), 8,14 (s, 1H), 5,00~4,98 (m, 1H), 2,87 (s, 3H), 1,47 (d, J=7,2 Гц, 3H). LC-MS m/z: 408,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,34 мин.
(S)-5-(7-Фторбензо[d]оксазол-5-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
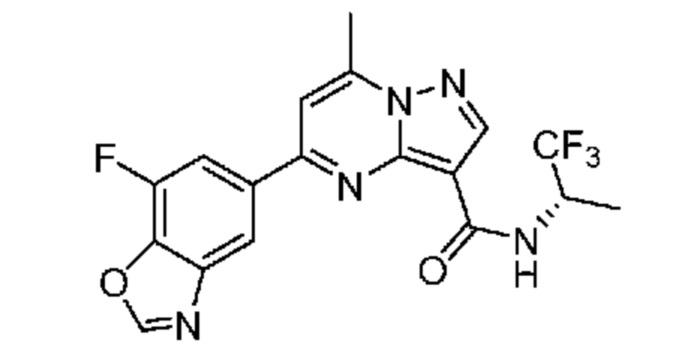
[00736] Смесь 5-бром-7-фторбензо[d]оксазола (90 мг, 0,41 ммоля), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) (157 мг, 0,62 ммоля), Pd(PPh3)2Cl2 (33 мг, 0,04 ммоля) и KOAc (81 мг, 0,83 ммоля) в 1,4-диоксане (5 мл) перемешивали в течение 2 ч при 90°C в атмосфере N2 и затем охлаждали до RT. К этой смеси добавляли (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (78 мг, 0,25 ммоля), Na2CO3 (88 мг, 0,83 ммоля) и воду (1 мл) и перемешивали в течение 3 ч при 90°C в атмосфере N2. Смесь разбавляли с помощью H2O (10 мл), экстрагировали с помощью EA (15 мл×3), промывали рассолом (10 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE: EA=10:1~1:1) и препаративной HPLC (MeCN/NH4HCO3) и получали искомое соединение (50 мг, 75%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 9,02 (s, 1H), 8,68 (s, 1H), 8,60 (d, J=1,6 Гц, 1H), 8,49 (d, J=9,6 Гц, 1H), 8,27 (d, J=12,4 Гц, 1H), 8,14 (s, 1H), 5,00~4,98 (m, 1H), 2,87 (s, 3H), 1,47 (d, J=7,2 Гц, 3H). LC-MS m/z: 408,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,34 мин.
5-(3-Фтор-4-(2-метоксиэтокси)фенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
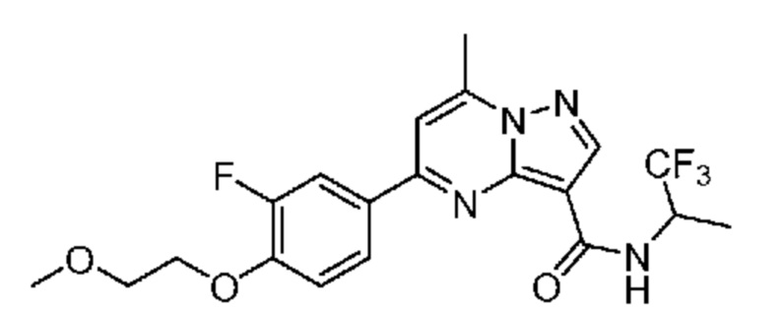
[00737] По общей методике D 4-бром-2-фтор-1-(2-метоксиэтокси)бензол (4,0 г, 16,0 ммоля) и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) давали 2-(3-фтор-4-(2-метоксиэтокси)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (4,0 г, 83%) в виде желтого твердого вещества. LC-MS m/z: 314,3 [M+H]+. Чистота (214 нм): 73%; tR=1,98 мин.
[00738] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (174 мг, 0,81 ммоля) и 2-(3-фтор-4-(2-метоксиэтокси)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан давали искомое соединение (96 мг, 43%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,62 (s, 1H), 8,47 (d, J=9,2 Гц, 1H), 8,08 (d, J=10,8 Гц, 1H), 8,06 (d, J=8,0 Гц, 1H), 7,93 (s, 1H), 7,44 (t, J=8,8 Гц, 1H), 5,01-4,96 (m, 1H), 4,32 (t, J=3,6 Гц, 2H), 3,73 (t, J=3,6 Гц, 2H), 2,84 (s, 3H), 1,46 (d, J=6,8 Гц, 3H). LC-MS m/z: 441,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,58 мин.
5-(3-Фтор-4-морфолинофенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
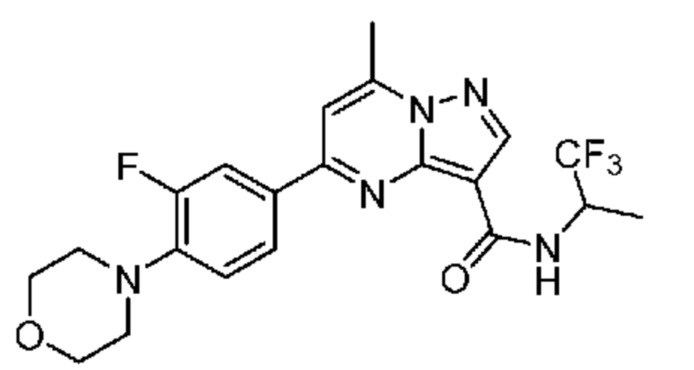
[00739] По общей методике D 5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,23 ммоля) и 3-фтор-4-морфолинофенилбороновая кислота давали искомое соединение (48 мг, 47%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,59 (s, 1H), 8,01 (d, J=8,5 Гц, 1H), 7,96 (dd, J=14,5 Гц, 1,5 Гц, 1H), 7,70 (s, 1H), 7,21 (t, J=8,0 Гц, 1H), 4,99-4,95 (m, 1H), 3,89 (t, J=5,0 Гц, 4H), 3,26 (dd, J=9,5 Гц, 4,5 Гц, 4H), 2,91 (s, 3H) 1,54 (d, J=6,5 Гц, 3H). LC-MS m/z: 452,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,72 мин.
(S)-5-(3-Цианотиофен-2-ил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
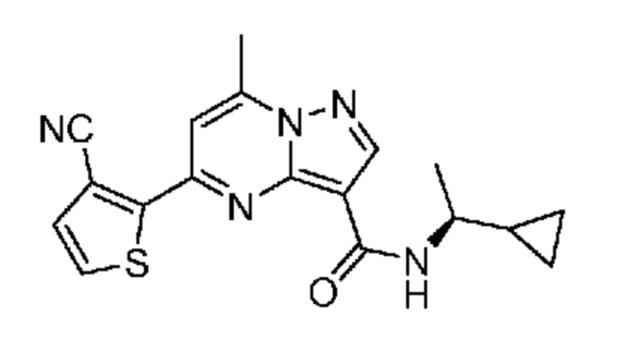
[00740] По общей методике E* (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,29 ммоля) и 2-бромтиофен-3-карбонитрил давали искомое соединение (5,5 мг, 5%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,64 (s, 1H), 8,13 (d, J=5,2 Гц, 1H), 7,89 (d, J=8,0 Гц, 1H), 7,75 (d, J=4,4 Гц, 1H), 7,70 (s, 1H), 3,55-3,53 (m, 1H), 2,87 (s, 3H), 1,30 (d, J=6,4 Гц, 3H), 1,20-1,11 (m, 1H), 0,49-0,48 (m, 1H), 0,43-0,41 (m, 1H), 0,31-0,23 (m, 2H). LC-MS m/z: 352,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,17 мин.
(R)-5-(3-Цианотиофен-2-ил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
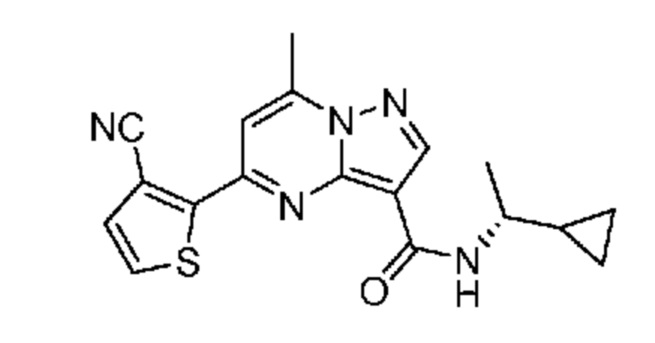
[00741] По общей методике E* (R)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (160 мг, 0,58 ммоля) и 2-бромтиофен-3-карбонитрил давали искомое соединение (53 мг, 26%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,62 (s, 1H), 8,24 (d, J=6,5 Гц, 1H), 7,93 (d, J=5,0 Гц, 1H), 7,66 (s, 1H), 7,58 (d, J=5,0 Гц, 1H), 3,63-3,58 (m, 1H), 2,93 (s, 3H), 1,43 (d, J=7,0 Гц, 3H), 1,27-1,24 (m, 1H), 0,60-0,56 (m, 1H), 0,52-0,47 (m, 1H), 0,44-0,41 (m, 1H), 0,33-0,28 (m, 1H). LC-MS m/z: 352,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,51 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(1-метил-1H-бензо[d]имидазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
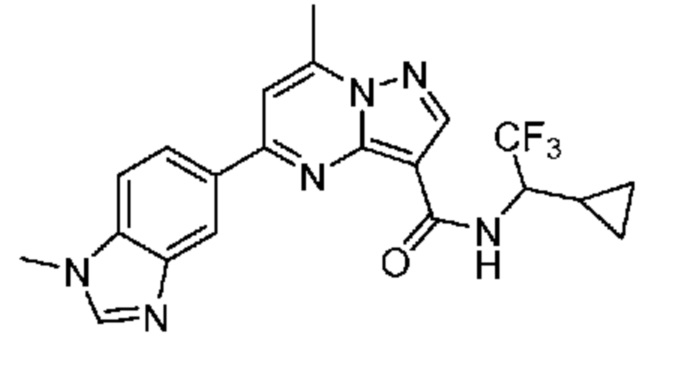
[00742] Смесь 4-бром-1-фтор-2-нитробензола (2,0 г, 9,1 ммоля) с CH3NH2/MeOH (10 мл) нагревали при 80°C в течение 2 ч в герметизированной пробирке, выливали в H2O (60 мл) и экстрагировали с помощью EA (40 мл×2). Органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме и получали 4-бром-N-метил-2-нитроанилин (2,1 г, 100%) в виде желтого твердого вещества. LC-MS m/z: 232,9 [M+H]+. tR=1,90 мин.
[00743] К раствору 4-бром-N-метил-2-нитроанилина (2,1 г, 9 ммоля) в MeOH (50 мл) добавляли порошкообразное Fe (2,5 г, 45 ммоля) и NH4Cl (4,8 г, 90 ммоля). Смесь перемешивали при 80°C в течение 4 ч, выливали в H2O (60 мл) и экстрагировали с помощью EA (40 мл×2). Органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме и получали 4-бром-N1-метилбензол-1,2-диамин (2,0 г, 99%) в виде желтого твердого вещества. LC-MS m/z: 203,1 [M+H]+. tR=1,64 мин.
[00744] К раствору 4-бром-N1-метилбензол-1,2-диамина (1,7 г, 8 ммоля) в триэтилортоформиате (10 мл) добавляли PTSA•H2O (152 мг, 0,8 ммоля). Смесь перемешивали при 85°C в течение 2 ч, выливали в H2O (50 мл) и экстрагировали с помощью EA (40 мл×2). Органические слои сушили над безводным Na2SO4, фильтровали, концентрировали в вакууме и очищали с помощью колоночной хроматографии на силикагеле (PE/EA=от 50/1 до 10/1) и получали 5-бром-1-метил-1H-бензо[d]имидазол (1,5 г, 89%) в виде желтого твердого вещества. LC-MS m/z: 211,1 [M+H]+. tR=1,90 мин.
[00745] К раствору 5-бром-1-метил-1H-бензо[d]имидазола (1,0 г, 4,74 ммоля) в диоксане (10 мл) в атмосфере N2 добавляли 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (1,5 г, 5,68 ммоля), 2-этилгексаноат натрия (1,968 г, 11,86 ммоля) и Pd(dppf)Cl2•DCM (247 мг, 0,474 ммоля). Смесь перемешивали при 110°C в течение 4 ч, выливали в H2O (60 мл) и экстрагировали с помощью EA (50 мл×2). Органические слои сушили над безводным Na2SO4, фильтровали, концентрировали в вакууме и очищали с помощью колоночной хроматографии на силикагеле (PE/EA=1/1) и получали 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол (1,0 г, 82%) в виде желтого твердого вещества. LC-MS m/z: 259,1 [M+H]+. tR=1,67 мин.
[00746] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (150 мг, 0,45 ммоля) и 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол давали искомое соединение (19 мг, 10%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,72 (d, J=9,5 Гц, 1H), 8,62 (s, 1H), 8,61 (d, J=9,0 Гц, 1H), 8,34 (s, 1H), 8,23 (d, J=8,5 Гц, 1H), 8,08 (s, 1H), 7,83 (d, J=8,5 Гц, 1H), 4,55-4,51 (m, 1H), 3,92 (s, 3H), 2,86 (s, 3H), 1,31-1,27 (m, 1H), 0,72-0,62 (m, 1H), 0,61-0,58 (m, 2H), 0,44-0,40 (m, 1H). LC-MS m/z: 429,1 [M+H]+. HPLC: Чистота (214 нм): 93,56%; tR=7,55 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(1-метил-1H-бензо[d]имидазол-6-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
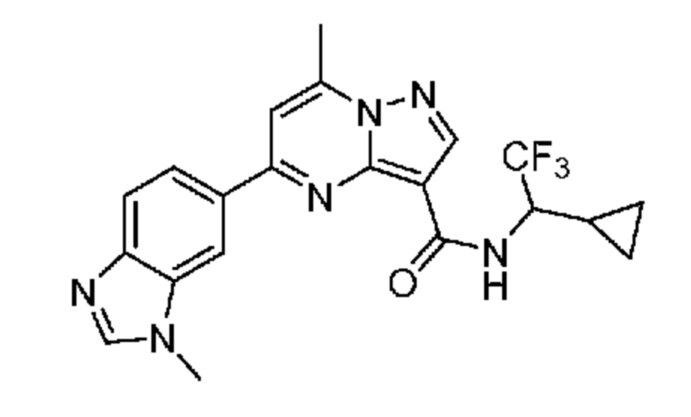
[00747] Смесь 4-бром-2-фтор-1-нитробензола (4,0 г, 18,26 ммоля) с 30 мл MeNH2/MeOH перемешивали при 80(C в течение 15 ч и выливали в H2O (100 мл). Смесь экстрагировали с помощью EA (30 мл×3), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 5-бром-N-метил-2-нитроанилин (3,8 г, 90%) в виде желтого твердого вещества. LC-MS m/z: 232,9 [M+H]+. Чистота (214 нм): 88,0%; tR=1,89 мин.
[00748] К смеси 5-бром-N-метил-2-нитроанилина (3,6 г, 16 ммоля) в 100 мл MeOH при RT добавляли порошкообразное Fe (4,38 г, 78 ммоля) и NH4Cl (16,53 г, 311,8 ммоля) и смесь перемешивали при 75°C в течение 15 ч, охлаждали и фильтровали. Фильтрат концентрировали в вакууме и остаток промывали с помощью H2O (50 мл). Водную фазу экстрагировали с помощью EA (30 мл×3) и органические фазы сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 5-бром-N1-метилбензол-1,2-диамин в виде черного твердого вещества (3,1 г, 90%). LC-MS m/z: 201,1 [M+H]+. Чистота (214 нм): 73%; tR=1,66 мин.
[00749] К смеси 5-бром-N1-метилбензол-1,2-диамин (2,0 г, 10,0 ммоля) в 15 мл триметоксиметана добавляли p-TsOH•H2O (0,172 г, 0,02 ммоля) при RT и смесь перемешивали при 105°C в течение 1 ч, охлаждали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (20,0 г, PE/EA: 10/1-5/1) и получали 6-бром-1-метил-1H-бензо[d]имидазол в виде желтого твердого вещества (1,6 г, 76%). LC-MS m/z: 213,0 [M+H]+. Чистота (214 нм): 99%; tR=1,57 мин.
[00750] По общей методике E* 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (160 мг, 0,48 ммоля) и 6-бром-1-метил-1H-бензо[d]имидазол давали искомое соединение (22 мг, 11%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 8,70 (d, J=9,0 Гц, 1H), 8,64 (s, 1H), 8,50 (s, 1H), 8,39 (s, 1H), 8,16 (dd, J=8,5 Гц, 1,5 Гц, 1H), 8,07 (s, 1H), 7,85 (d, J=8,5 Гц, 1H), 4,56-4,52 (m, 1H), 3,94 (s, 3H), 2,89 (s, 3H), 1,36-1,32 (m, 1H), 0,73-0,68 (m, 1H), 0,64-0,56 (m, 2H), 0,46-0,42 (m, 1H). LC-MS m/z: 429,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,44 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(1-метил-1H-бензо[d]имидазол-6-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
[00751] По общей методике D 6-бром-1-метил-1H-бензо[d]имидазол (500 мг, 2,38 ммоля) и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) давали 1-метил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол (300 мг, 49%) в виде желтого твердого вещества. LC-MS m/z: 441,0 [M+H]+; Чистота (214 нм): 86,74%; tR=1,68 мин.
[00752] По общей методике D (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 1-метил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол давали искомое соединение (45 мг, 46%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6): δ 8,70 (d, J=9,6 Гц, 1H), 8,63 (s, 1H), 8,49 (d, J=1,2 Гц, 1H), 8,38 (s, 1H), 8,15 (dd, J=8,8 Гц, 2,0 Гц, 1H), 8,06 (s, 1H), 7,85 (d, J=8,8 Гц, 1H), 4,54-4,48 (m, 1H), 3,93 (s, 3H), 2,87 (s, 3H), 1,35-1,30 (m, 1H), 0,72-0,65 (m, 1H), 0,63-0,55 (m, 2H), 0,44-0,40 (m, 1H). LC-MS m/z: 429,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,42 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(1-метил-1H-бензо[d]имидазол-6-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
[00753] По общей методике E (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,33 ммоля) и 6-бром-1-метил-1H-бензо[d]имидазол давали искомое соединение (6 мг, 5%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,70 (d, J=9,5 Гц, 1H), 8,64 (s, 1H), 8,50 (d, J=1,5 Гц, 1H), 8,40 (s, 1H), 8,16 (dd, J=8,5 Гц, 1,5 Гц, 1H), 8,07 (s, 1H), 7,85 (d, J=8,5 Гц, 1H), 4,54-4,48 (m, 1H), 3,93 (s, 3H), 2,87 (s, 3H), 1,35-1,30 (m, 1H), 0,72-0,65 (m, 1H), 0,63-0,55 (m, 2H), 0,44-0,40 (m, 1H). LC-MS m/z: 429,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,46 мин.
5-(1H-Бензо[d]имидазол-6-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
[00754] Смесь 6-бром-1H-бензо[d]имидазола (1 г, 5,08 ммоля), Boc2O (1,56 г, 4,22 ммоля) и DIPEA (1,54 г, 15,23 ммоля) в DCM (20 мл) перемешивали при 20°C в течение 16 ч в атмосфере N2 и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле (EA:PE; от 0 до 10%) и получали трет-бутил-6-бром-1H-бензо[d]имидазол-1-карбоксилат (1,4 г, 92%) в виде желтого твердого вещества. LC-MS m/z: 241,0 [M-56]+. Чистота по данным LC-MS (214 нм): > 98%; tR=1,98 мин.
[00755] Смесь трет-бутил-6-бром-1H-бензо[d]имидазол-1-карбоксилата (1,4 г, 4,74 ммоля), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) (1,44 г, 5,65 ммоля), Pd(dppf)Cl2•DCM (383 мг, 0,47 ммоля) и CH3COOK (1,16 г, 11,78 ммоля) в 1,4-диоксане (10 мл) перемешивали в атмосфере N2 при 70°C в течение 16 ч. Смесь фильтровали и органические слои сушили над безводным MgSO4, фильтровали и концентрировали в вакууме и получали неочищенный трет-бутил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол-1-карбоксилат, который использовали на следующей стадии без обработки (4 г). LC-MS m/z: 289,1 [M-56]+. Чистота по данным LC-MS (214 нм): > 47%; tR=2,07 мин.
[00756] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и трет-бутил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол-1-карбоксилат давали искомое соединение (6 мг, 5%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 12,79 (s, 1H), 8,70 (d, J=9,5 Гц, 1H), 8,61 (s, 1H), 8,47 (s, 1H), 8,12 (d, J=9 Гц, 1H), 8,03 (s, 1H), 7,76 (s, 1H), 4,50-4,45 (m,1H), 2,97 (s, 3H), 1,32-1,28 (m, 1H), 0,73-0,68 (m, 1H), 0,64-0,60 (m, 2H), 0,45-0,40 (m, 1H). LC-MS m/z: 415,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,03 мин.
5-(1H-Бензо[d]имидазол-7-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
[00757] Смесь 7-бром-1H-бензо[d]имидазола (1 г, 5,08 ммоля), Boc2O (1,56 г, 4,22 ммоля) и DIPEA (1,54 г, 15,23 ммоля) в DCM (20 мл) перемешивали при 20°C в течение 16 ч в атмосфере N2 и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле (EA:PE; от 0 до 10%) и получали трет-бутил 7-бром-1H-бензо[d]имидазол-1-карбоксилат (1,2 г, 79%) в виде желтого твердого вещества. LC-MS m/z: 241,0 [M-56]+. Чистота по данным LC-MS (214 нм): > 98%; tR=1,93 мин.
[00758] Смесь трет-бутил 7-бром-1H-бензо[d]имидазол-1-карбоксилата (1,2 г, 4,04 ммоля), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) (1,23 г, 4,85 ммоля), Pd(dppf)Cl2•DCM (329 мг, 0,40 ммоля) и CH3COOK (0,99 г, 10,10 ммоля) в 1,4-диоксане (10 мл) перемешивали при 70°C в течение 16 ч в атмосфере N2. Смесь фильтровали и органические слои сушили над безводным MgSO4, фильтровали и концентрировали в вакууме и получали неочищенный трет-бутил 7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол-1-карбоксилат, который использовали на следующей стадии без обработки (3 г). LC-MS m/z: 289,1 [M-56]+. Чистота по данным LC-MS (214 нм): > 42%; tR=2,07 мин.
[00759] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и трет-бутил 7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол-1-карбоксилат давали искомое соединение (6 мг, 5%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 12,89 (s, 1H), 8,82 (d, J=9,5 Гц, 1H), 8,70 (s, 1H), 8,48 (s, 1H), 8,16 (d, J=5,5 Гц, 1H), 7,84 (s, 1H), 7,44 (d, J=8,0 Гц, 1H), 4,50-4,42 (m, 1H), 2,90 (s, 3H), 1,34-1,27 (m, 1H), 0,72-0,67 (m, 1H), 0,60-0,58 (m, 2H), 0,44-0,38 (m, 1H). LC-MS m/z: 415,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=7,54 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(1-метил-1H-бензо[d]имидазол-7-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
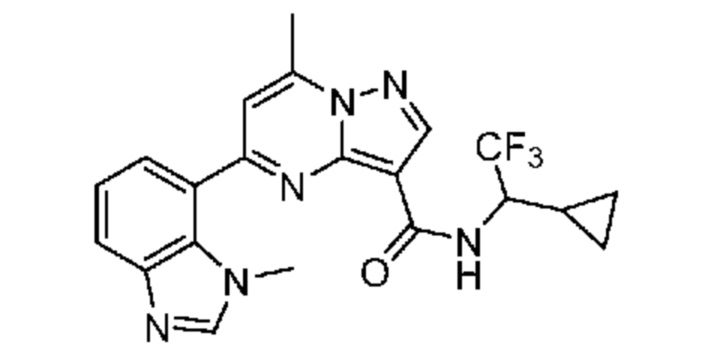
[00760] Смесь 1-бром-2-фтор-3-нитробензола (2,19 г, 10,0 ммоля) с MeNH2 (раствор в MeOH, 40 мл) перемешивали при кипячении с обратным холодильником в течение 3 ч, выливали в насыщенный водный раствор NaHCO3 (100 мл) и экстрагировали с помощью EA (80 мл×3). Объединенные органические фазы сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 2-бром-N-метил-6-нитроанилин (1,9 г, 82,6% выход) в виде красного масла. LC-MS m/z: 231,0 [M+H]+. tR=1,82 мин.
[00761] Смесь 2-бром-N-метил-6-нитроанилина (1,9 г, 8,26 ммоля), порошкообразного Fe (2,8 г) и NH4Cl (8,84 г, 165,2 ммоля) в MeOH (100 мл) перемешивали при кипячении с обратным холодильником в течение 8 ч и фильтровали. Фильтрат концентрировали в вакууме и остаток растворяли в насыщенном растворе NaHCO3 (200 мл). Смесь экстрагировали с помощью EA (150 мл×3). Объединенные экстракты сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали смесь 6-бром-N1-метилбензол-1,2-диамин и 7-бром-1-метил-1H-бензо[d]имидазолов (1,8 г) в виде зеленого масла. LC-MS m/z: 211,0 [M+H]+. tR=1,56 мин. 201,0 [M+H]+. tR=1,64 мин.
[00762] Смесь 6-бром-N1-метилбензол-1,2-диамина и 7-бром-1-метил-1H-бензо[d]имидазола (1,8 г, неочищенный), триметоксиметана (10 мл) и 4-метибензолсульфоновой кислоты (172 мг, 1,0 ммоля) перемешивали при 85°C в течение 1 ч и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (EA/PE=4/1) и получали 7-бром-1-метил-1H-бензо[d]имидазол (1,6 г, 92% выход за 2 стадии) в виде зеленого твердого вещества. LC-MS m/z: 213,1 [M+H]+. tR=1,58 мин.
[00763] По общей методике D 7-бром-1-метил-1H-бензо[d]имидазол (105 мг, 0,5 ммоля) и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) давали неочищенный 1-метил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол (650 мг) в виде черного масла, которое использовали на следующей стадии без дополнительной очистки. LC-MS m/z: 259,2 [M+H]+. tR=1,74 мин.
[00764] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,21 ммоля) и 1-метил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол давали искомое соединение (68 мг, 59%) в виде серого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,74 (s, 1H), 8,34 (d, J=9,5 Гц, 1H), 8,33 (s, 1H), 7,88 (d, J=8,0 Гц, 1H), 7,70 (s, 1H), 7,54 (d, J=7,5 Гц, 1H), 7,40 (t, J=7,5 Гц, 1H), 4,38-4,33 (m, 1H), 3,67 (s, 3H), 2,90 (s, 3H), 1,05-1,00 (m, 1H), 0,63-0,44 (m, 3H), 0,26-0,21 (m, 1H). LC-MS m/z: 429,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,43 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(1-метил-1H-бензо[d]имидазол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
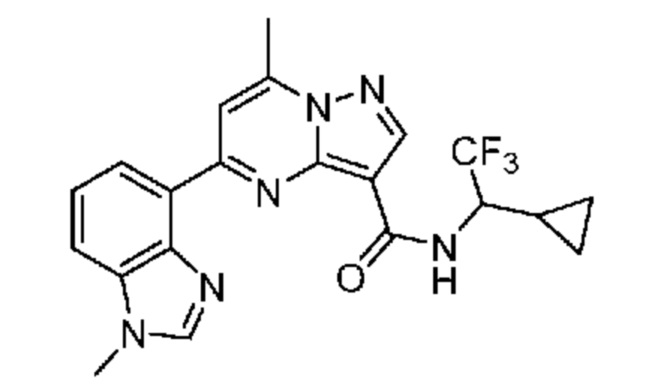
[00765] По общей методике E* 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и 4-бром-1-метил-1H-бензо[d]имидазол давали искомое соединение (60 мг, 29%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, CDCl3): δ 8,84 (d, J=10,0 Гц, 1H), 8,75 (s, 1H), 8,70 (s, 1H), 8,30 (d, J=7,5 Гц, 1H), 8,05 (s, 1H), 7,63 (d, J=8,0 Гц, 1H), 7,55 (t, J=7,5 Гц, 1H), 4,60-4,56 (m, 1H), 3,97 (s, 3H), 2,97 (s, 3H), 1,28-1,25 (m, 1H), 0,74-0,70 (m, 1H), 0,63-0,56 (m, 3H). LC-MS m/z: 429,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,27 мин.
5-(1H-Бензо[d]имидазол-2-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
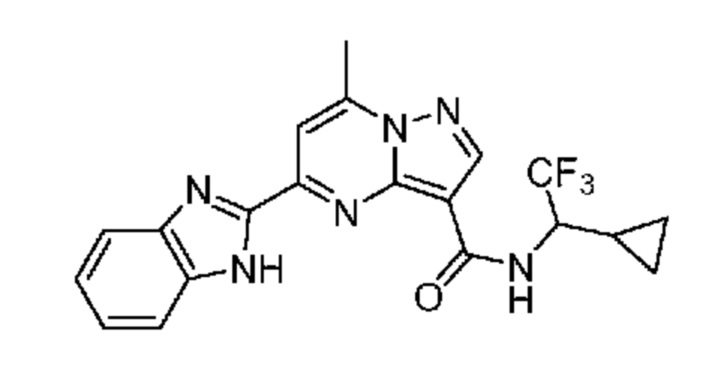
[00766] К смеси этил-5-формил-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (235 мг, 1,01 ммоля) и бензол-1,2-диамина (109 мг, 1,01 ммоля) в MeCN (6 мл) добавляли 30% (мас./мас.) H2O2 (241 мг, 7,09 ммоля) и 37% (мас./мас.) HCl (130 мг, 3,61 ммоля). Смесь перемешивали при RT в течение 2 ч, разбавляли с помощью H2O (100 мл) и экстрагировали с помощью DCM (30 мл×3). Органические фазы сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (40 г, при элюировании с помощью PE/EA=от 1/0 до 1/4) и получали этил-5-(1H-бензо[d]имидазол-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат в виде серого твердого вещества (102 мг, 31%). LC-MS m/z: 322,1 [M+H]+. tR=1,71 мин.
[00767] По общей методике B* этил-5-(1H-бензо[d]имидазол-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (97 мг, 0,3 ммоля) давал 5-(1H-бензо[d]имидазол-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (86 мг, 92%) в виде светло-желтого твердого вещества. LC-MS m/z: 294,1 [M+H]+. tR=1,25 мин.
[00768] По общей методике A 5-(1H-бензо[d]имидазол-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (81 мг, 0,28 ммоля) и 1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (20 мг, 18%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 13,43 (s, 1H), 8,75 (s, 1H), 8,41 (d, J=9,0 Гц, 1H), 8,12 (s, 1H), 7,86-7,68 (m, 2H), 7,42-7,29 (m, 2H), 4,26-4,17 (m, 1H), 2,91 (s, 3H), 1,71-1,63 (m, 1H), 0,81-0,76 (m, 1H), 0,70-0,59 (m, 2H), 0,43-0,38 (m, 1H). LC-MS m/z: 415,1 [M+H]+. HPLC: Чистота (214 нм): 97%; tR=8,15 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(1-метил-1H-бензо[d]имидазол-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
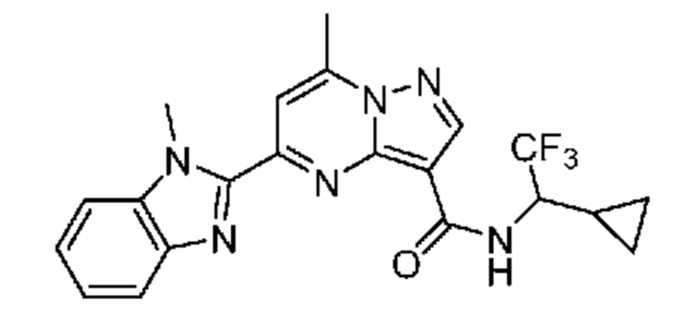
[00769] По общей методике E* 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,178 ммоля) и 2-бром-1-метил-1H-бензо[d]имидазол давали искомое соединение (19 мг, 25%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,75 (s, 1H), 8,28 (d, J=9,0 Гц, 1H), 8,18 (s, 1H), 7,81 (d, J=7,5 Гц, 1H), 7,78 (d, J=8,0 Гц, 1H), 7,43 (t, J=7,5 Гц, 1H), 7,35 (t, J=7,5 Гц, 1H), 4,39 (s, 3H), 4,33-4,27 (m, 1H), 2,91 (s, 3H), 1,30-1,25 (m, 1H), 0,76-0,67 (m, 2H), 0,62-0,57 (m, 1H), 0,39-0,32 (m, 1H). LC-MS m/z: 429,1 [M+H]+. HPLC: Чистота (214 нм): 93,8%; tR=8,79 мин.
5-(5-i-Пропил-2-оксооксазилидин-3-ил)-7-метил-N-(2,2,2-трифтор-1-фенилэтил)пиразоло[1,5-a]пиримидин-3-карбоксамид
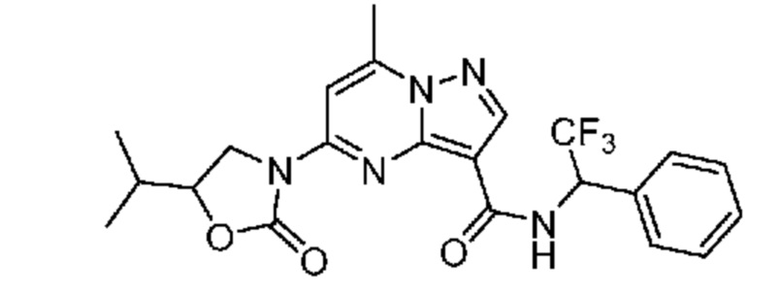
[00770] По общей методике A 5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (400 мг, 1,89 ммоля) и 2,2,2-трифтор-1-фенилэтанамин давали 5-хлор-7-метил-N-(2,2,2-трифтор-1-фенилэтил)пиразоло[1,5-a]пиримидин-3-карбоксамид (558 мг, 80%) в виде белого твердого вещества. LC-MS m/z: 369,0 [M+H]+. LCMS: tR=1,92 мин.
[00771] По общей методике H 5-хлор-7-метил-N-(2,2,2-трифтор-1-фенилэтил)пиразоло[1,5-a]пиримидин-3-карбоксамид (200 мг, 0,54 ммоля) и 5-изопропилоксазолидин-2-он давали искомое соединение (15 мг, 6%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,50 (s, 1H), 8,09 (dd, J=5,5 Гц, 1,0 Гц, 1H), 7,60-7,54 (m, 2H), 7,49-7,44 (m, 3H), 6,00-5,98 (m, 1H), 4,60-4,55 (m, 1H), 4,50-4,44 (m, 1H), 4,09 (dd, J=10,0 Гц, 8,0 Гц, 1H), 2,84 (s, 3H), 2,11-2,03 (m, 1H), 1,12 (dd, J=6,5 Гц, 6,0 Гц, 3H), 1,04 (dd, J=6,5 Гц, 2,5 Гц, 3H). LC-MS m/z: 462,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=9,12 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-((S)-2-оксо-5-фенилоксазолидин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид и N-(1-циклопропил-2,2,2-трифторэтил)-7-метил-5-((R)-2-оксо-5-фенилоксазолидин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
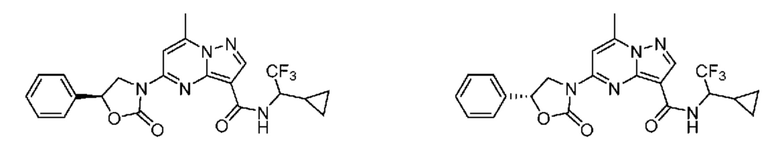
[00772] Раствор 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамида (200 мг, 0,6 ммоля), 2-амино-1-фенилэтанола (495 мг, 3,61 ммоля) и TEA (60 мг, 0,60 ммоля) в MeCN (2 мл) перемешивали при 80°C в течение 2 ч и охлаждали. Раствор концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (EA) и получали N-(1-циклопропил-2,2,2-трифторэтил)-5-(2-гидрокси-2-фенилэтиламино)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (250 мг, 96%) в виде белого твердого вещества. LC-MS m/z: 434,1 [M+H]+. Чистота (214 нм): >97%; tR=1,71 мин.
[00773] Раствор N-(1-циклопропил-2,2,2-трифторэтил)-5-(2-гидрокси-2-фенилэтиламино)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамида (200 мг, 0,46 ммоля), CDI (1,12 г, 6,32 ммоля) и TEA (93 мг, 0,92 ммоля) в THF (8 мл) перемешивали при 70°C в течение 16 ч и охлаждали. Раствор концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (50% EA в PE) и растирали с Et2O и получали N-(1-циклопропил-2,2,2-трифторэтил)-7-метил-5-((S)-2-оксо-5-фенилоксазолидин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (48 мг, 23%) в виде белого твердого вещества и N-(1-циклопропил-2,2,2-трифторэтил)-7-метил-5-((R)-2-оксо-5-фенилоксазолидин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (56 мг, 26%) в виде белого твердого вещества.
[00774] N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-((S)-2-оксо-5-фенилоксазолидин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид: 1H ЯМР (500 МГц, DMSO-d6) δ 8,54 (s, 1H), 8,05 (d, J=9,5 Гц, 1H), 7,97 (s, 1H), 7,56-7,55 (m, 2H), 7,49-7,42 (m, 3H), 5,92 (t, J=8,0 Гц, 1H), 4,68 (t, J=9,0 Гц, 1H), 4,37-4,33 (m, 1H), 4,24-4,20 (m, 1H), 2,82 (s, 3H), 1,19-1,12 (m, 1H), 0,62-0,57 (m, 1H), 0,52-0,47 (m, 1H), 0,41-0,32 (m, 1H), 0,31-0,27 (m, 1H). LC-MS m/z: 460,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,76 мин.
[00775] N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-((R)-2-оксо-5-фенилоксазолидин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид: 1H ЯМР (500 МГц, DMSO-d6) δ 8,54 (s, 1H), 8,12 (d, J=9,0 Гц, 1H), 7,98 (s, 1H), 7,56-7,55 (m, 2H), 7,50-7,43 (m, 3H), 5,90 (t, J=8,5 Гц, 1H), 4,78 (t, J=10,0 Гц, 1H), 4,34-4,31 (m, 1H), 4,14-4,11 (m, 1H), 2,82 (s, 3H), 1,25-1,17 (m, 1H), 0,67-0,62 (m, 1H), 0,56-0,52 (m, 2H), 0,36-0,32 (m, 1H). LC-MS m/z: 460,1 [M+H]+. HPLC: Чистота (214 нм): > 97%; tR=8,72 мин.
N-((R)-1-Циклопропил-2,2,2-трифторэтил)-5-(5-изопропил-2-оксооксазилидин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
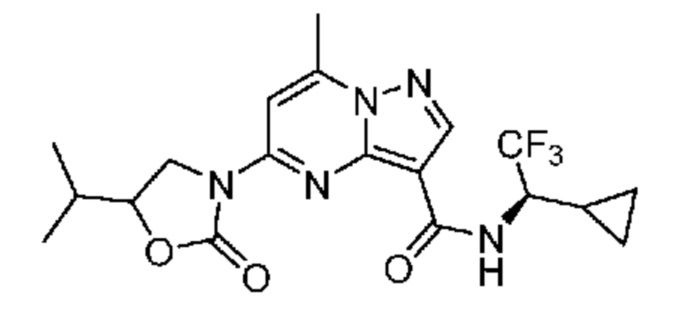
[00776] По общей методике H (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,21 ммоля) и 5-изопропилоксазолидин-2-он давали искомое соединение (13 мг, 14%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,51 (s, 1H), 8,07 (d, J=6,5 Гц, 1H), 4,56-4,52 (m, 1H), 4,47-4,37 (m, 2H), 4,09-4,01 (m, 1H), 2,86 (s, 3H), 1,27-1,25 (m, 1H), 1,12 (dd, J=6,5 Гц, 3,0 Гц, 3H), 1,04 (dd, J=6,5 Гц, 2,0 Гц, 3H), 0,78-0,75 (m, 1H), 0,65-0,60 (m, 1H), 0,59-0,50 (m, 2H). LC-MS m/z: 426,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=8,91 мин.
N-((S)-1-Циклопропил-2,2,2-трифторэтил)-5-(5-изопропил-2-оксооксазилидин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
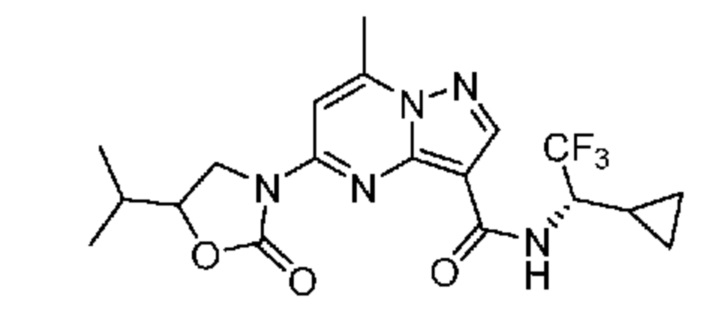
[00777] По общей методике H (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,21 ммоля) и 5-изопропилоксазолидин-2-он давали искомое соединение (5,6 мг, 6%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,51 (s, 1H), 8,07 (d, J=6,5 Гц, 1H), 4,56-4,52 (m, 1H), 4,47-4,37 (m, 2H), 4,09-4,01 (m, 1H), 2,86 (s, 3H), 1,27-1,25 (m, 1H), 1,12 (dd, J=6,5 Гц, 3,0 Гц, 3H), 1,04 (dd, J=6,5 Гц, 2,0 Гц, 3H), 0,78-0,75 (m, 1H), 0,65-0,60 (m, 1H), 0,59-0,50 (m, 2H). LC-MS m/z: 426,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=8,91 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(4,4-диметил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
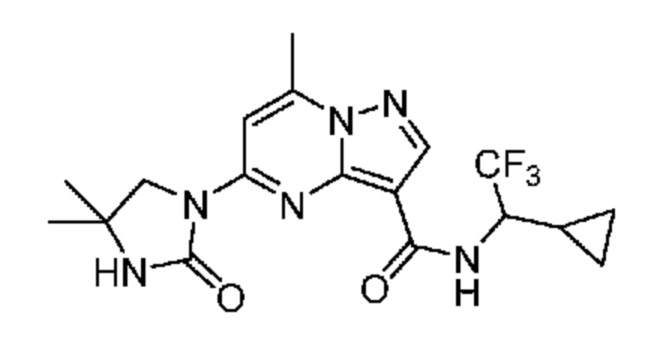
[00778] По общей методике H 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и 4,4-диметилимидазолидин-2-он давали искомое соединение (32 мг, 26%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,43 (s, 1H), 8,16 (s, 1H), 4,42-4,39 (m, 1H), 3,97 (d, J=10,5 Гц, 1H), 3,92 (d, J=10,5 Гц, 1H), 2,80 (s, 3H), 1,443 (s, 3H), 1,435 (s, 3H), 1,29-1,25 (m, 1H), 0,79-0,75 (m, 1H), 0,67-0,63 (m, 1H), 0,59-0,54 (m, 1H), 0,53-0,49 (m, 1H). LC-MS m/z: 411,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,70 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(4-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
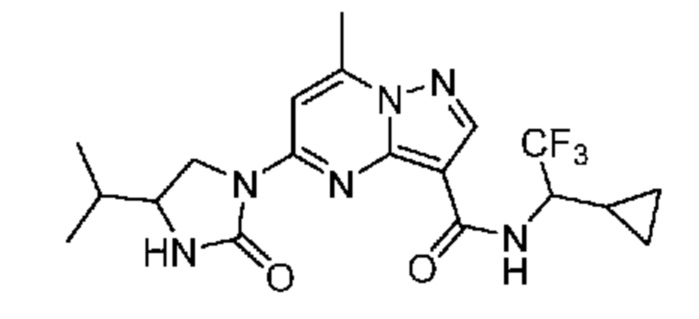
[00779] К смеси 2-амино-3-метибутановой кислоты (15 г, 128 ммоля) и NaBH4 (19,5 г, 512 ммоля) в THF (200 мл) при 0°C по каплям добавляли I2 (32 г, 128 ммоля, раствор в 100 мл THF). Реакционную смесь перемешивали при 65°C в течение 16 ч, реакцию останавливали с помощью MeOH (100 мл) и концентрировали в вакууме. Белый остаток растворяли в 225 мл 20% водного раствора KOH и перемешивали в течение 3 ч при RT, экстрагировали с помощью EA (100 мл×3) и органические фазы сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 2-амино-3-метилбутан-1-ол (7 г, 50%) в виде масла. LC-MS m/z: 118,1 [M+H]+. Чистота (214 нм): 90%; tR=0,34 мин.
[00780] К смеси 2-амино-3-метилбутан-1-ола (7 г, 60 ммоля) и Na2CO3 (22 г, 180 ммоля) в H2O (100 мл) добавляли бензилхлорформиат (12 г, 66 ммоля). Смесь перемешивали при RT в течение 16 ч и экстрагировали с помощью EA (50 мл×3) и сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (EA:PE=1:3) и получали бензил-1-гидрокси-3-метилбутан-2-илкарбамат (9 г, 65%) в виде белого твердого вещества. LC-MS m/z: 238,1 [M+H]+. Чистота (214 нм): 90%; tR=1,62 мин.
[00781] К смеси бензил-1-гидрокси-3-метилбутан-2-илкарбамата (1 г, 4,2 ммоля) и Et3N (850 мг, 8,4 ммоля) в толуоле (15 мл) добавляли MsCl (480 мг, 4,2 ммоля). Смесь перемешивали при RT в течение 15 мин, затем добавляли раствор NaN3 (2,7 г, 42 ммоля) в 20 мл воды, и Bu4NBr (680 мг, 2,1 ммоля). Полученную смесь перемешивали при 90°C в течение 16 ч, экстрагировали с помощью DCM (30 мл×3), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали бензил-1-азидо-3-метилбутан-2-илкарбамат (1,1 г, 90%) в виде белого масла, которое без обработки использовали на следующей стадии. LC-MS m/z: 263,1 [M+H]+. Чистота (214 нм): 90%; tR=1,86 мин.
[00782] Смесь бензил-1-азидо-3-метилбутан-2-илкарбамата (1,1 г, 4,2 ммоля), трифенилфосфина (1,6 г, 6,3 ммоля) и H2O (1 г, 42 ммоля) в THF (20 мл) перемешивали при RT в течение 16 ч и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (EA:PE=1:3) и получали бензил-1-амино-3-метилбутан-2-илкарбамат (900 мг, 90%) в виде белого твердого вещества. LC-MS m/z: 237,1 [M+H]+. Чистота (214 нм): 90%; tR=1,50 мин.
[00783] Смесь бензил-1-амино-3-метилбутан-2-илкарбамата (100 мг, 0,42 моля), 10% Pd/C (100 мг, 0,47 ммоля) и 4M HCl/диоксан (2 мл) в MeOH (10 мл) перемешивали в течение 3 ч при 30°C в атмосфере H2 и фильтровали. Фильтрат концентрировали в вакууме и получали 3-метилбутан-1,2-диамин (40 мг, неочищенный) в виде бесцветного масла.
[00784] Смесь 3-метилбутан-1,2-диамина (40 мг, неочищенный), CDI (129 мг, 0,78 ммоля), Et3N (88 мг, 0,87 ммоля) в DCM (10 мл) перемешивали в течение 18 ч при 30°C и концентрировали в вакууме. Остаток растворяли в H2O (5 мл) и значение pH устанавливали=6~7 и экстрагировали с помощью DCM (20 мл×3). Органические фазы сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 4-изопропилимидазолидин-2-он (23 мг, неочищенный) в виде светло-желтого твердого вещества.
[00785] По общей методике H 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (59,7 мг, 0,18 ммоля) и 4-изопропилимидазолидин-2-он давали искомое соединение (8 мг, 4% за три стадии) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,43 (s, 1H), 8,24 (dd, J=23,5 Гц, 8,0 Гц, 1H), 8,18 (d, J=5,0 Гц, 1H), 8,08 (s, 1H), 4,48-4,42 (m, 1H), 4,18 (dd, J=10,5 Гц, 9,0 Гц, 1H), 4,09 (t, J=10,0 Гц, 1H), 3,75 (dd, J=9,5 Гц, 6,5 Гц, 1H), 3,68 (dd, J=11,0 Гц, 6,5 Гц, 1H), 3,57-3,32 (m, 1H), 2,73 (s, 3H), 1,73-1,67 (m, 1H), 1,21-1,16 (m, 1H), 0,91 (dd, J=7,0 Гц, 1,5 Гц, 3H), 0,87 (dd, J=6,5 Гц, 4,0 Гц, 3H), 0,67-0,62 (m, 1H). 0,56-0,49 (m, 2H), 0,40-0,35 (m, 1H). LC-MS m/z: 425,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,14 мин.
(S)-N-(1-Циклопропилэтил)-7-метил-5-(2-метилбензо[d]оксазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
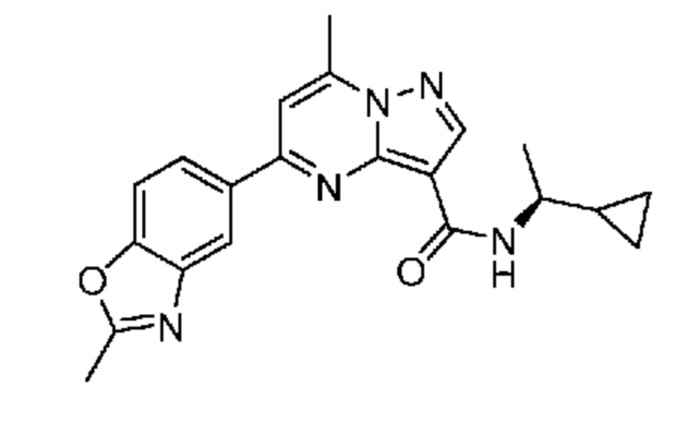
[00786] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,29 ммоля) и 2-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол давали искомое соединение (3,1 мг, 3%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,57 (d, J=1,5 Гц, 1H), 8,55 (s, 1H), 8,30 (dd, J=8,5 Гц, 1,5 Гц, 1H), 8,22 (d, J=7,5 Гц, 1H), 8,00 (s, 1H), 7,91 (d, J=8,5 Гц, 1H), 3,67-3,63 (m, 1H), 2,86 (s, 3H), 2,68 (s, 3H), 1,30 (d, J=6,5 Гц, 3H), 1,13-1,09 (m, 1H), 0,57-0,50 (m, 2H), 0,42-0,39 (m, 1H), 0,37-0,34 (m, 1H). LC-MS m/z: 376,1 [M+H]+. HPLC: Чистота (214 нм): 97,4%; tR=8,09 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(4,4-диметил-3,4-дигидро-2H-пиран-6-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
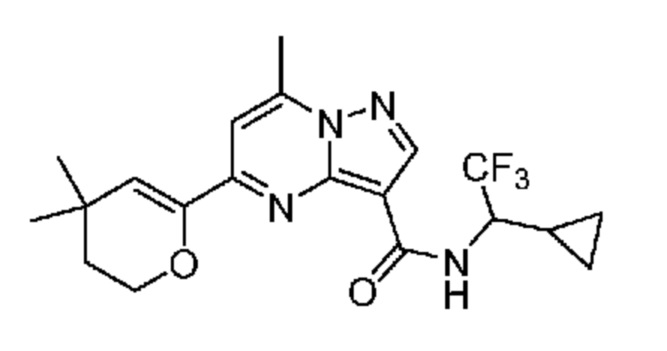
[00787] При перемешивании к раствору 4,4-диметилтетрагидро-2H-пиран-2-она (4,3 г, 33,5 ммоля) в DCM (150 мл) при -78°C в течение 1 ч добавляли раствор DIBAL-H (36,9 мл, 36,9 ммоля) в толуоле. Полученный раствор перемешивали в течение еще 30 мин, реакцию останавливали с помощью MeOH (25 мл) и давали медленно нагреться до RT в течение ночи. Полученную суспензию разбавляли 30% водным раствором тартрата калия-натрия (200 мл) и перемешивали в течение 30 мин, органический слой отделяли и промывали 30% водным раствором тартрата калия-натрия (100 мл×2). Объединенные водные слои затем экстрагировали с помощью DCM (100 мл×3). Объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали неочищенный 4,4-диметилтетрагидро-2H-пиран-2-ол (4,3 г, 100%) в виде прозрачной жидкости. 1H ЯМР (400 МГц, DMSO-d6) δ 6,20 (d, J=6,0 Гц, 1H), 4,72-4,68 (m,1H), 3,75-3,70 (m, 1H), 3,51 (td, J=10,8 Гц, 2,8 Гц, 1H), 1,39-1,36 (m, 1H), 1,31-1,24 (m, 1H), 1,18-1,09 (m, 2H), 0,94 (s, 6H).
[00788] 4,4-Диметилтетрагидро-2H-пиран-2-ол (0,62 г, 4,76 ммоля) по каплям добавляли к раствору p-TsOH (80 мг) в хинолине (5 мл), предварительно нагретому до 190°C, присоединенному к аппарату для молекулярной перегонки, снабженному холодной ловушкой твердый диоксид углерода/ацетон. После завершения добавления температуру повышали до 220°C и проводили перегонку и получали 4,4-диметил-3,4-дигидро-2H-пиран (220 мг, 40%) в виде прозрачной жидкости. 1H ЯМР (400 МГц, DMSO-d6) δ 6,25 (d, J=6,4 Гц, 1H), 4,50 (d, J=6,4 Гц, 1H), 3,89 (t, J=5,2 Гц, 2H), 1,58 (t, J=5,2 Гц, 2H), 0,99 (s, 6H).
[00789] К раствору 4,4-диметил-3,4-дигидро-2H-пирана (1,0 г, 8,93 ммоля) в гексане (40 мл) добавляли 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (2,27 г, 8,93 ммоля), [Ir(OMe)(cod)]2 (298 мг, 0,45 ммоля) и 4,4'-ди-трет-бутил-2,2'-бипиридил (238 мг, 0,89 ммоля). Смесь перемешивали в течение 20 ч при кипячении с обратным холодильником в атмосфере N2, охлаждали до RT и концентрировали и получали остаток, который очищали с помощью колоночной хроматографии на силикагеле (PE:EA=5:1), и получали 2-(4,4-диметил-3,4-дигидро-2H-пиран-6-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (900 мг, 42%) в виде бесцветного масла. LC-MS m/z: 239,2 [M+H]+. Чистота (214 нм): 26%; tR=1,67 мин.
[00790] По общей методике D 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (348 мг, 1,05 ммоля) и 2-(4,4-диметил-3,4-дигидро-2H-пиран-6-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан давали искомое соединение (170 мг, 39%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 8,63 (s, 1H), 8,59 (d, J=9,6 Гц, 1H), 7,21 (s, 1H), 6,12 (s, 1H), 4,63-4,57 (m, 1H), 4,24 (dd, J=6,0 Гц, 4,0 Гц, 2H), 2,84 (s, 3H), 1,79 (t, J=4,8 Гц, 2H), 1,26-1,19 (m, 1H), 1,15 (s, 6H), 0,70-0,65 (m, 1H), 0,61-0,49 (m, 3H). LC-MS m/z: 409,0 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=10,15 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(4,4-диметилтетрагидро-2H-пиран-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
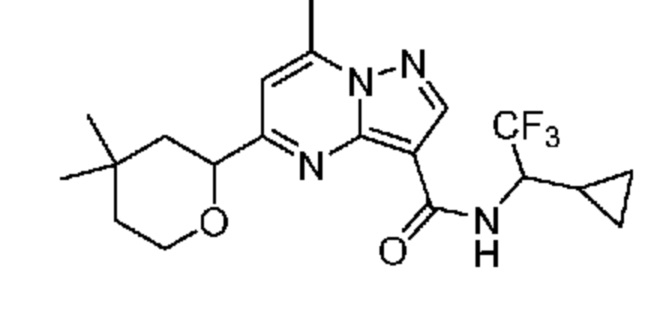
[00791] При перемешивании к раствору N-(1-циклопропил-2,2,2-трифторэтил)-5-(4,4-диметил-3,4-дигидро-2H-пиран-6-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамида (80 мг, 0,20 ммоля) в THF (20 мл) при RT в атмосфере H2 добавляли 5% Pd/C (10 мг) и смесь перемешивали при RT в течение 2 ч. Неочищенную реакционную смесь элюировали через тонкий слой целита (EA, затем DCM) и органический слой концентрировали в вакууме и получали остаток, который очищали с помощью препаративной ВЭЖХ, и получали искомое соединение (47 мг, 60%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,62 (s, 1H), 8,47 (d, J=10,0 Гц, 1H), 7,34 (s, 1H), 4,72 (dd, J=12,0 Гц, 2,5 Гц, 1H), 4,59-4,53 (m,1H), 3,98-3,95 (m,1H), 3,83-3,80 (m,1H), 2,81 (s, 3H), 1,79-1,76 (m,1H),1,50-1,34 (m, 3H),1,21-1,20 (m, 1H), 1,13 (s, 3H), 0,97 (s, 3H),0,65-0,64 (m, 1H), 0,58-0,57 (m, 1H), 0,49-0,48 (m, 1H), 0,43-0,41 (m, 1H). LC-MS m/z: 411,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=10,12 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(пиридазин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
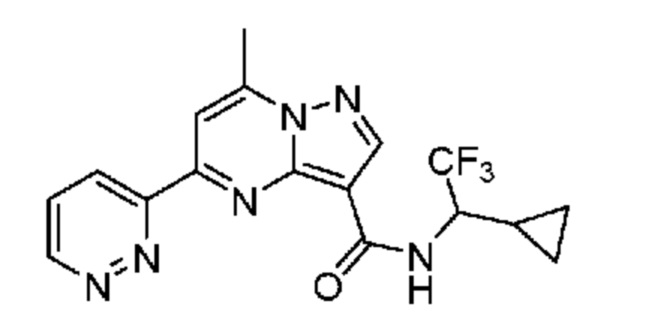
[00792] По общей методике F 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,3 ммоля) и 3-(трибутилстаннил)пиридазин давали искомое соединение (10 мг, 9%) в виде светло-желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,99 (dd, J=2,5 Гц, 1,5 Гц, 1H), 9,57 (dd, J=5,5 Гц, 1,5 Гц, 1H), 8,78 (s, 1H), 8,46 (d, J=9,5 Гц, 1H), 8,39 (dd, J=5,5 Гц, 3,0 Гц, 1H), 8,16 (s, 1H), 4,45-4,40 (m, 1H), 2,92 (s, 3H), 1,39-1,35 (m, 1H), 0,73-0,70 (m, 1H), 0,63-0,59 (m, 2H), 0,41-0,39 (m, 1H). LC-MS m/z: 377,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=6,92 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(пиридазин-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
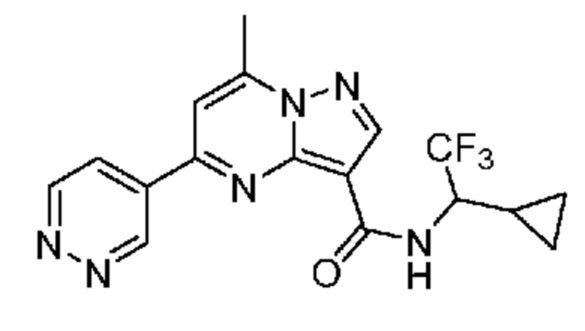
[00793] По общей методике F 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 4-(трибутилстаннил)пиридазин давали искомое соединение (33 мг, 37%) в виде серого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,99 (s, 1H), 9,57 (d, J=5,5 Гц, 1H), 8,78 (s, 1H), 8,46 (d, J=9,5 Гц, 1H), 8,39 (dd, J=5,5 Гц, 3,0 Гц, 1H), 8,17 (s, 1H), 4,45-4,40 (m, 1H), 2,91 (s, 3H), 1,39-1,34 (m, 1H), 0,74-0,71 (m, 1H), 0,64-0,57 (m, 2H), 0,40-0,37 (m, 1H). LC-MS m/z: 377,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=6,92 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
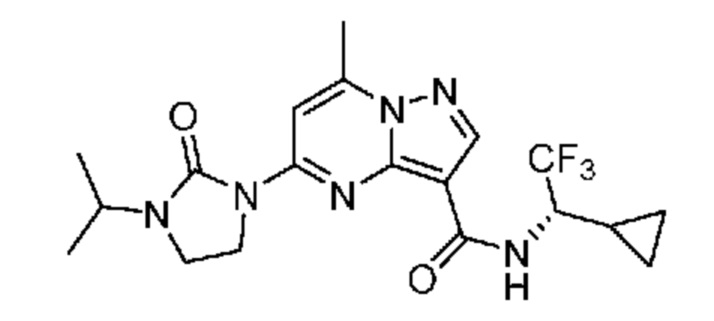
[00794] По общей методике A 5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (65 мг, 0,21 ммоля) и (S)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (12,4 мг, 14%) в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 8,51 (s, 1H), 8,17 (d, J=9,5 Гц, 1H), 8,15 (s, 1H), 4,52-4,47 (m, 1H), 4,33-4,27 (m, 1H), 4,12-4,06 (m, 2H), 3,57 (t, J=7,0 Гц, 2H), 2,78 (s, 3H), 1,25 (d, J=7,0 Гц, 6H), 1,14-1,10 (m, 1H), 0,71-0,67 (m, 1H), 0,57-0,50 (m, 3H). LC-MS m/z: 425,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,60 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
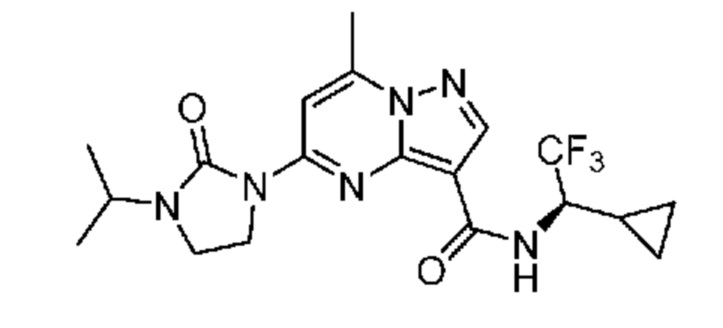
[00795] По общей методике A 5-(3-изопропил-2-оксоимидазолидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (65 мг, 0,21 ммоля) и (R)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (5,6 мг, 6%) в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3): δ 8,50 (s, 1H), 8,17 (d, J=9,5Hz, 1H), 8,15 (s, 1H), 4,52-4,47 (m, 1H), 4,33-4,27 (m, 1H), 4,12-4,06 (m, 2H), 3,57 (t, J=7,0 Гц, 2H), 2,78 (s, 3H), 1,25 (d, J=7,0Hz, 6H), 1,14-1,10 (m, 1H), 0,71-0,67 (m, 1H), 0,57-0,50 (m, 3H). LC-MS m/z: 425,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,60 мин.
N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3,3-диметил-2-оксопирролидин-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
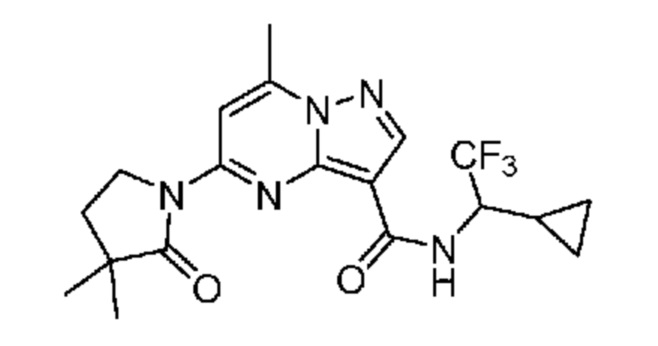
[00796] По общей методике H 5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и 3,3-диметилпирролидин-2-он давали искомое соединение (20 мг, 16%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,53 (s, 1H), 8,19 (d, J=9,0 Гц, 1H), 8,18 (s, 1H), 4,38-4,31 (m, 1H), 4,11-4,01 (m, 1H), 3,41-3,31 (m, 1H), 2,78 (s, 3H), 2,04 (t, J=7,0 Гц, 2H), 1,30-1,24 (m, 1H), 1,24 (s, 6H), 0,71-0,65 (m, 1H), 0,68-0,55 (m, 2H), 0,42-0,32 (m, 1H). LC-MS m/z: 410,2 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,94 мин.
(R)-7-Метил-5-(2-оксо-3-фенилимидазолидин-1-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
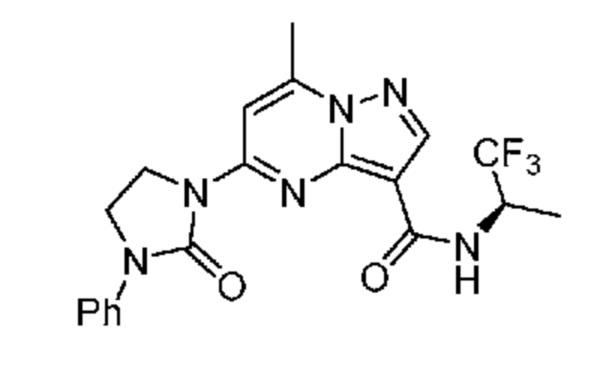
[00797] По общей методике H (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,326 ммоля) и 1-фенилимидазолидин-2-он давали искомое соединение (18,3 мг, 13%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,49 (s, 1H), 8,17 (s, 1H), 8,12 (d, J=9,0 Гц, 1H), 7,69 (d, J=7,5 Гц, 2H), 7,44 (t, J=8,0 Гц, 2H), 7,17 (t, J=7,5 Гц, 1H), 4,94-4,92 (m, 1H), 4,26-4,07 (m, 4H), 2,79 (s, 3H), 1,44 (d, J=6,5 Гц, 3H). LC-MS m/z: 433,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=8,75 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(2-оксо-3-фенилимидазолидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
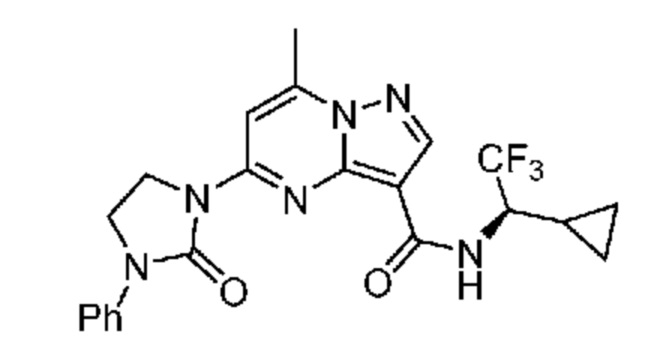
[00798] По общей методике H (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (94 мг, 0,28 ммоля) и 1-фенилимидазолидин-2-он давали искомое соединение (30 мг, 23%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 8,54 (s, 1H), 8,20 (d, J=0,8 Гц, 1H), 8,15 (d, J=6,0 Гц, 1H), 7,62 (dd, J=8,8 Гц, 1,2 Гц, 2H), 7,44 (td, J=8,4 Гц, 2,0 Гц, 2H), 7,21 (t, J=7,6 Гц, 1H), 4,51-4,49 (m, 1H), 4,28-4,23 (m, 2H), 4,13-4,08 (m, 2H), 2,82 (s, 3H), 1,15-1,13 (m, 1H), 0,73-0,70 (m, 1H), 0,58-0,52 (m, 3H). LC-MS m/z: 459,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=9,22 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(4,5-диметилоксазол-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
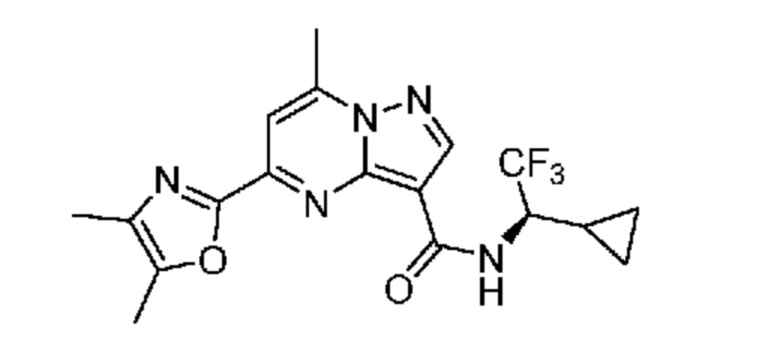
[00799] При перемешивании к раствору 4,5-диметилоксазола (150 мг, 1,55 ммоля) в безводном THF (10 мл) при -78°C по каплям добавляли n-BuLi (0,62 мл, 1,55 ммоля). Смесь перемешивали в течение 30 мин и затем при -78°C добавляли 1M ZnCl2 (3,87 мл, 3,87 моля), перемешивали еще 30 мин и нагревали до RT. Добавляли (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (90 мг, 0,27 ммоля), затем Pd(PPh3)2Cl2 (18,9 мг, 0,027) и смесь перемешивали при 60°C в течение 3 ч в атмосфере N2 и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (EA/PE=80%) и получали искомое соединение (18 мг, 17%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,71 (s, 1H), 8,51 (d, J=9,6 Гц, 1H), 7,82 (s, 1H), 4,64-4,60 (m, 1H), 2,86 (s, 3H), 2,43 (s, 3H), 2,19 (s, 3H), 1,27-1,23 (m, 1H), 0,68-0,58 (m, 3H), 0,54-0,48 (m, 1H). LC-MS m/z: 394,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=11,36 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(2-изопропил-5-метилоксазол-4-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
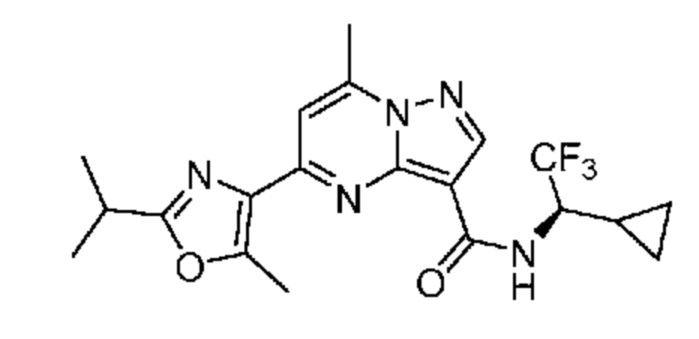
[00800] При перемешивании к раствору этил-5-формил-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (0,3 г, 1,29 ммоля) в THF (3 мл) при -78°C добавляли EtMgBr2 (1,42 мл, 1,42 ммоля) и раствор перемешивали при -78°C в течение 1,5 ч и затем реакцию останавливали насыщенным раствором NH4Cl (10 мл). Смесь экстрагировали с помощью EA (20 мл) органический слой промывали с помощью H2O (10 мл) и рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме и очищали с помощью хроматографии на силикагеле (PE/EA=2:3) и получали этил-5-(1-гидроксипропил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (70 мг, 20%) в виде желтого масла. LC-MS m/z: 264,2 [M+H]+. Чистота (214 нм): 93%; tR=1,09 мин.
[00801] При перемешивании к раствору этил-5-(1-гидроксипропил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (70 мг, 0,27 ммоля) в DCM (3 мл) при 0°C в атмосфере N2 добавляли реагент Десса-Мартина (223 мг, 0,54 ммоля) и раствор перемешивали при RT в течение ночи. Реакцию останавливали насыщенным раствором NaHCO3 (10 мл), экстрагировали с помощью DCM (20 мл), промывали с помощью H2O (10 мл) и рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме и очищали с помощью хроматографии на силикагеле (PE/EA=2:1) и получали этил-7-метил-5-пропионилпиразоло[1,5-a]пиримидин-3-карбоксилат (50 мг, 72%) в виде желтого твердого вещества. LC-MS m/z: 262,1 [M+H]+. Чистота (254 нм): 96%; tR=1,88 мин.
[00802] К раствору этил-7-метил-5-пропионилпиразоло[1,5-a]пиримидин-3-карбоксилата (70 мг, 0,27 ммоля) в MeOH (5 мл) добавляли HONH2•HCl (186 мг, 2,68 ммоля) и TEA (183 мг, 1,34 ммоля) и смесь перемешивали при RT в течение 3 ч. Затем ее выливали в H2O (20 мл) и экстрагировали с помощью EA (15 мл×2). Объединенные экстракты промывали рассолом (20 мл), сушили над Na2SO4, фильтровали и концентрировали и получали этил-5-(1-(гидроксимино)пропил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (70 мг, 95%) в виде белого твердого вещества. LC-MS (m/z): 277,2 [M+H]+, Чистота (214 нм): 95%, tR=1,24 мин.
[00803] К раствору этил-5-(1-(гидроксимино)пропил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (100 мг, 0,36 ммоля) и DMAP (3,0 мг, 0,023 ммоля) в 1,2-дихлорбензоле (1 мл) при 0°C по каплям добавляли изобутирилхлорид (385 мг, 3,6 ммоля). Реакционную смесь нагревали микроволновым излучением при 180°C в течение 1 ч, охлаждали, концентрировали и затем очищали с помощью хроматографии на силикагеле (EA) и получали этил-5-(2-изопропил-5-метилоксазол-4-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (70 мг, 59%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,61 (s, 1H), 7,64 (s, 1H), 4,30 (q, J=7,0 Гц, 2H), 2,89 (s, 3H), 2,81 (s, 3H), 2,48 (s, 3H), 1,34 (t, J=7,0 Гц, 3H). LC-MS (m/z): 300,1 [M+H]+, tR=1,32 мин.
[00804] По общей методике B* этил-5-(2-изопропил-5-метилоксазол-4-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (70 мг, 0,21 ммоля) давал 5-(2-изопропил-5-метилоксазол-4-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (69 мг, 100%). LC-MS (m/z): 301,1 [M+H]+, Чистота (214 нм): 79%, tR=1,17 мин.
[00805] По общей методике A 5-(2-изопропил-5-метилоксазол-4-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (70 мг, 0,21 ммоля) и (R)-1-циклопропил-2,2,2-трифторэтан-1-амин давали искомое соединение (29 мг, 33%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,64 (s, 1H), 8,18 (d, J=9,5 Гц, 1H), 7,67 (s, 1H), 4,34-4,28 (m, 1H), 3,18-3,12 (m, 1H), 2,85 (s, 3H), 2,79 (s, 3H), 1,35 (s, 3H), 1,33 (s, 3H), 1,23-1,15 (m, 1H), 0,75-0,55 (m, 3H), 0,35-0,3 (m, 1H). LC-MS m/z: 422,2 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=10,16 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(2,5-диметилоксазол-4-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
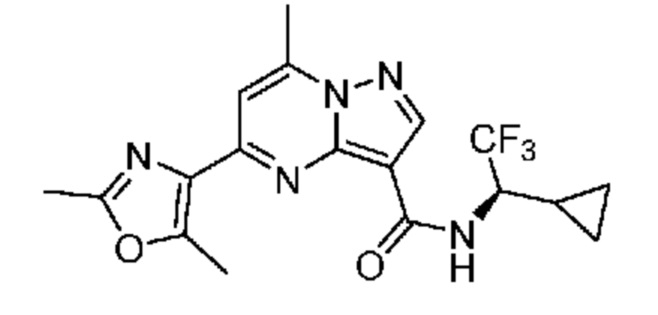
[00806] К раствору этил-5-(1-(гидроксимино)пропил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (70 мг, 0,25 ммоля) и DMAP (2,0 мг, 0,016 ммоля) в 1,2-дихлорбензоле (0,5 мл) при 0°C по каплям добавляли ацетилхлорид (40 мг, 0,51 ммоля). Реакционную смесь нагревали микроволновым излучением при 180°C в течение 45 мин, охлаждали, концентрировали и затем очищали с помощью хроматографии на силикагеле (PE/EA=1:5) и получали этил-5-(2,5-диметилоксазол-4-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (30 мг, 40%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,61 (s, 1H), 7,64 (s, 1H), 4,30 (q, J=7,0 Гц, 2H), 2,89 (s, 3H), 2,81 (s, 3H), 2,48 (s, 3H), 1,34 (t, J=7,0 Гц, 3H). LC-MS (m/z): 300,1 [M+H]+, tR=1,32 мин.
[00807] По общей методике B* этил-5-(2,5-диметилоксазол-4-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (30 мг, 0,1 ммоля) давал неочищенную 5-(2,5-диметилоксазол-4-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (30 мг, 100% ) в виде коричневого твердого вещества. LC-MS (m/z): 273,1 [M+H]+, Чистота (214 нм): 74%, tR=1,04 мин.
[00808] По общей методике A 5-(2,5-диметилоксазол-4-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,1 ммоля) и (R)-1-циклопропил-2,2,2-трифторэтан-1-амин давали искомое соединение (6,4 мг, 16%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,64 (s, 1H), 8,18 (d, J=9,5 Гц, 1H), 7,69 (s, 1H), 4,33-4,26 (m, 1H), 2,84 (s, 3H), 2,78 (s, 3H), 2,49 (s, 3H), 1,20-1,16 (m, 1H), 0,77-0,62 (m, 2H), 0,60-0,55 (m, 1H), 0,35-0,25 (m, 1H). LC-MS m/z: 394,0 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,88 мин.
(R)-5-(5-Фторфуран-2-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
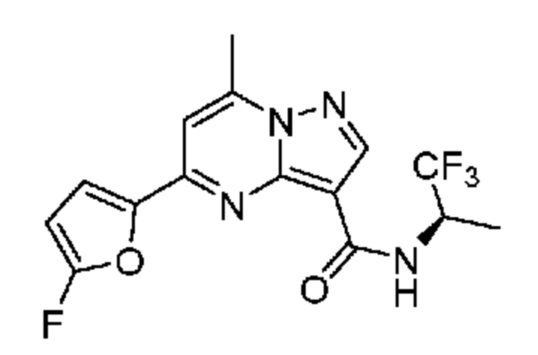
[00809] По общей методике F (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,16 ммоля) и трибутил(5-фторфуран-2-ил)станнан давали искомое соединение (37 мг, 64%) в виде белого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4) δ 8,55 (s, 1H), 7,42 (s, 1H), 7,39 (d, J=4,5 Гц, 1H), 5,98 (dd, J=8,5 Гц, 4,5 Гц, 1H), 4,95-4,93 (m, 1H), 2,86 (s, 3H), 1,52 (d, J=8,5 Гц, 3H). LC-MS m/z: 357,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=8,62 мин.
(R)-5-(2-Фторфуран-3-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
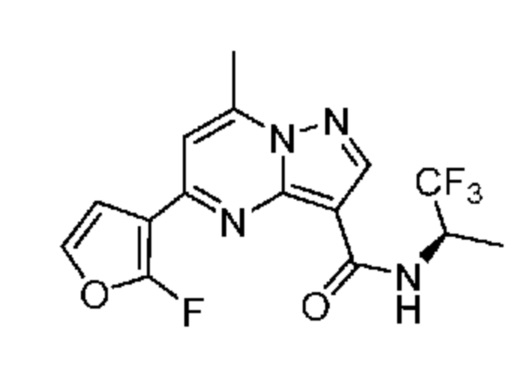
[00810] Смесь 3-бромфуран-2-карбоновой кислоты (300 мг, 1,57 ммоля) и NaHCO3 (316 мг, 3,76 ммоля) при RT в течение 5 мин перемешивали в 3,5 мл смеси пентан/вода (2/5), затем добавляли 1-хлорметил-4-фтор-1,4-диазониабицикло[2.2.2]октанбистетрафторборат (668 мг, 1. 88 ммоля). Смесь перемешивали в течение 1 ч при RT и разделяли и получали раствор 3-бром-2-фторфурана в пентане, который сушили (MgSO4), разбавляли с помощью 3 мл безводного Et2O и охлаждали до -78°C в атмосфере N2. К нему добавляли n-BuLi (1,6M, 0,25 мл, 0,39 ммоля) и смесь перемешивали при -78°C в течение 10 мин, затем добавляли n-Bu3SnCl (127 мг, 0. 39 ммоля). Затем смесь перемешивали при RT в течение еще 20 мин, реакцию останавливали насыщенным раствором NH4Cl (50 мл) и разделяли. Органическую фазу сушили над безводным MgSO4, фильтровали и концентрировали в вакууме и получали трибутил(2-фторфуран-3-ил)станнан (155 мг) в виде коричневого масла, которое без обработки использовали на следующей стадии.
[00811] По общей методике F (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,15 ммоля) и трибутил(2-фторфуран-3-ил)станнан давали искомое соединение (6,8 мг, 13%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,63 (s, 1H), 8,41 (d, J=9,0 Гц, 1H), 7,57 (d, J=2,5 Гц, 1H), 7,56 (s, 1H), 7,21 (t, J=2,5 Гц, 1H), 4,98-4,92 (m, 1H), 2,82 (s, 3H), 1,42 (d, J=7,5 Гц, 3H). LC-MS m/z: 357,0 [M+H]+. HPLC: Чистота (214 нм): 97%; tR=8,52 мин.
(R)-7-Метил-5-(4-метилфуран-3-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
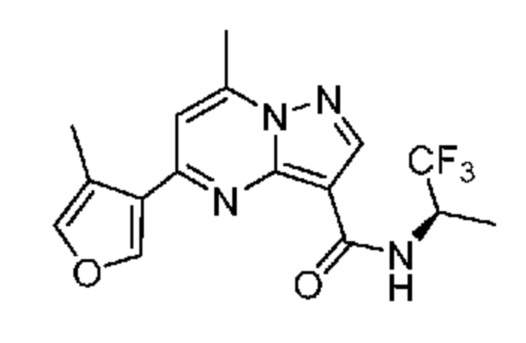
[00812] Смесь (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамида (700 мг, 2,29 ммоля), Pd(PPh3)2Cl2 (160 мг, 0,23 ммоля) и Sn2Bu6 ( 2,6 г, 4,58 ммоля) в диоксане (40 мл) перемешивали при 80°C в течение 16 ч в атмосфере N2. Реакционную смесь фильтровали и концентрировали в вакууме и очищали с помощью хроматографии на силикагеле (PE:EA=4:1) и получали (R)-7-метил-5-(трибутилстаннил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (400 мг, 32%) в виде белого твердого вещества. LC-MS m/z: 562,0 [M+H]+, Чистота (214 нм): 95%; tR=2,22 мин.
[00813] По общей методике F (R)-7-метил-5-(трибутилстаннил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (400 мг, 0,71 ммоля) и 3,4-дибромфуран давали (R)-5-(4-бромфуран-3-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 34%) в виде белого твердого вещества. LC-MS m/z: 417,0 [M+H]+, Чистота (214 нм): 95%; tR=1,47 мин.
[00814] Смесь (R)-5-(4-бромфуран-3-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамида (100 мг, 0,24 ммоля), (P(o-Tol)3)2PdCl2 (17 мг, 0,024 ммоля), SnMe4 (86 мг, 0,48 ммоля) в диоксане (3 мл)/DMF (1 мл) в течение 30 мин перемешивали при нагревании микроволновым излучением при 120°C в атмосфере N2. Реакционную смесь фильтровали и концентрировали в вакууме и получали остаток, который очищали с помощью препаративной ВЭЖХ, и получали искомое соединение (5 мг, 6%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,65 (d, J=1,5 Гц, 1H), 8,59 (s, 1H), 8,04 (d, J=9,0 Гц, 1H), 7,72 (s, 1H), 7,63 (s, 1H), 4,07-4,00 (m, 1H), 2,78 (s, 3H), 2,40 (s, 3H), 1,40 (d, J=7,5 Гц, 3H). LC-MS m/z: 353,0 [M+H]+, HPLC: Чистота (214 нм): >99%; tR=8,74 мин.
(R)-5-(Фуран-3-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
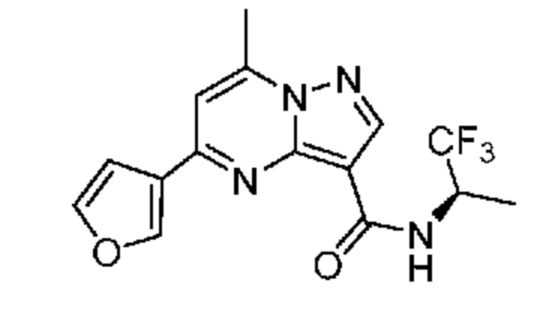
[00815] По общей методике E* (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и 3-бромфуран давали искомое соединение (5 мг, 5%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,67 (s, 1H), 8,59 (s, 1H), 8,41 (d, J=9,5 Гц, 1H), 7,95 (d, J=1,5 Гц, 1H), 7,67 (s, 1H), 7,06 (d, J=1,0 Гц, 1H), 4,99-4,9 (m, 1H), 2,80 (s, 3H), 1,46 (d, J=6,5 Гц, 3H). LC-MS m/z: 339,0 [M+H]+, HPLC: Чистота (214 нм): >99%; tR=8,28 мин.
(R)-7-Метил-5-(5-метилфуран-3-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
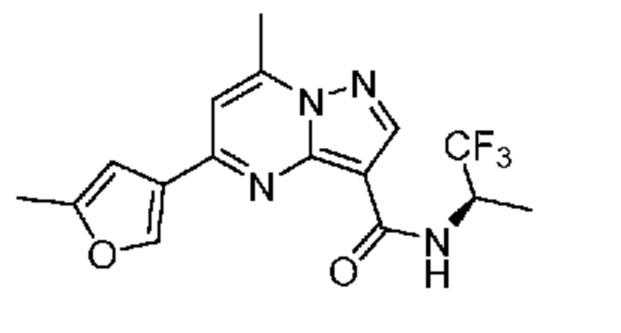
[00816] По общей методике E* (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (120 мг, 0,40 ммоля) и 4-бром-2-метилфуран давали искомое соединение (5,7 мг, 4%) в виде серого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,58 (s, 1H), 8,51 (s, 1H), 8,41 (d, J=9,5 Гц, 1H), 7,61 (s, 1H), 6,65 (s, 1H), 4,96-4,92 (m, 1H), 2,78 (s, 3H), 2,38 (s, 3H), 1,46 (d, J=7,0 Гц, 3H). LC-MS m/z: 353,1 [M+H]+. HPLC: Чистота (214 нм): 97%; tR=8,77 мин.
(S)-7-Метил-5-(5-метилфуран-3-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
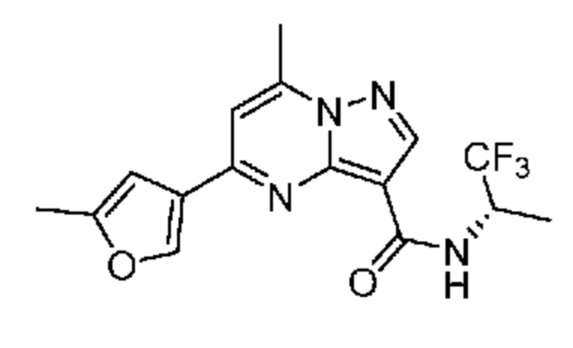
[00817] По общей методике E* (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (110 мг, 0,36 ммоля) и 4-бром-2-метилфуран давали искомое соединение (10,4 мг, 8%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,58 (s, 1H), 8,51 (s, 1H), 8,41 (d, J=10,0 Гц, 1H), 7,61 (s, 1H), 6,65 (s, 1H), 4,99-4,90 (m, 1H), 2,78 (s, 3H), 2,38 (s, 3H), 1,46 (d, J=7,0 Гц, 3H). LC-MS m/z: 353,2 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,81 мин.
(R)-7-Метил-5-(2-метилфуран-3-ил)-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
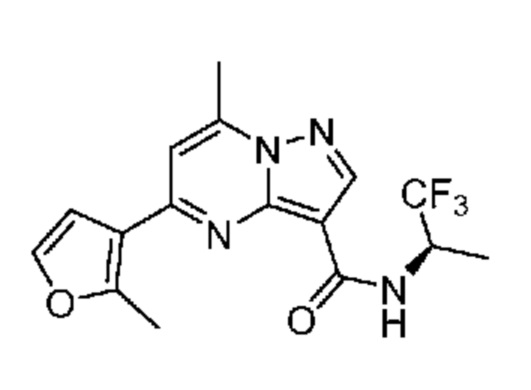
[00818] По общей методике D (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (40 мг, 0,130 ммоля) и 4,4,5,5-тетраметил-2-(2-метилфуран-3-ил)-1,3,2-диоксаборолан давали искомое соединение (10 мг, 17%) в виде белого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4) δ 8,61 (s, 1H), 8,11 (d, J=9,6 Гц, 1H), 7,75 (d, J=2,0 Гц, 1H), 7,58 (s, 1H), 7,14 (d, J=1,6 Гц, 1H), 5,02-4,97 (m, 1H), 2,81 (s, 3H), 2,75 (s 3H), 1,42 (d, J=6,8 Гц, 3H). LC-MS m/z: 353,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,61 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(5-метилизоксазол-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
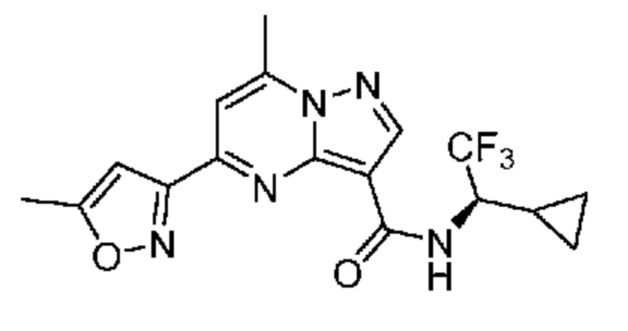
[00819] Смесь этил-5-формил-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (300 мг, 1,28 ммоля) и 1-(тритилфосфанилиден)пропан-2-она (389 мг, 1,28 ммоля) в THF (20 мл) кипятили с обратным холодильником в течение 0,5 ч. Реакционную смесь концентрировали и затем растирали с Et2O (20 мл) и получали этил-(E)-7-метил-5-(3-оксобут-1-ен-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (295 мг, 85%) в виде белого твердого вещества. LC-MS m/z: 274,1[M+H]+. Чистота (214 нм): 96%; tR=1,13 мин.
[00820] К раствору N-гидрокси-4-метилбензолсульфонамида (500 мг, 2,59 ммоля) в 1,8 мл смеси MeOH/H2O (6/1) порциями добавляли K2CO3 (408 мг, 2,96 ммоля), затем добавляли этил-(E)-7-метил-5-(3-оксобут-1-ен-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,37 ммоля) в MeOH (3 мл) и реакционную смесь перемешивали в течение 3 ч при 40°C. Дополнительно добавляли K2CO3 (200 мг) и смесь перемешивали в течение 8 ч при 60°C. Реакционную смесь разбавляли с помощью EA (80 мл), промывали с помощью H2O (15 мл) и рассолом (15 мл), сушили над Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью хроматографии на силикагеле (PE:EA=1:1) и получали этил-7-метил-5-(5-метилизоксазол-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (86 мг, 86%) в виде желтого твердого вещества. LC-MS m/z: 273,1[M+H]+. Чистота (214 нм): 65%; tR=1,19 мин.
[00821] По общей методике B* этил-7-метил-5-(5-метилизоксазол-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (86 мг, 0,32 ммоля) давал 7-метил-5-(5-метилизоксазол-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновую кислоту (72 мг, 90%) в виде желтого твердого вещества. LC-MS m/z: 259,1 [M+H]+. LCMS: Чистота (214 нм): 95%; tR=0,75 мин.
[00822] По общей методике A 7-метил-5-(5-метилизоксазол-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (65 мг, 0,25 ммоля) и (R)-1-циклопропил-2,2,2-трифторэтан-1-амин давали искомое соединение (39 мг, 41%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,72 (s, 1H), 8,39 (d, J=10,0 Гц, 1H), 7,83 (s, 1H), 6,78 (s, 1H), 4,29-4,37 (m, 1H), 2,88 (s, 3H), 2,57 (s, 3H), 1,38-1,35 (m, 1H), 0,70-0,68 (m, 1H), 0,61-0,58 (m, 2H), 0,40-0,37 (m, 1H). LC-MS m/z: 380,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,93 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(4-метилизоксазол-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
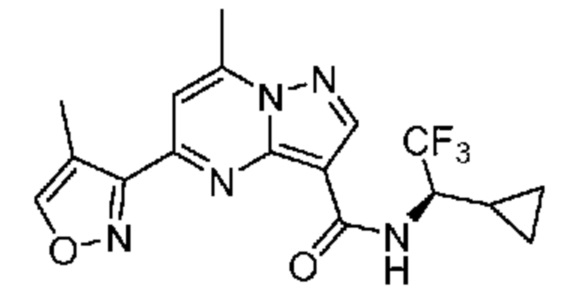
[00823] Смесь этил-5-формил-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (320 мг, 1,37 ммоля) и 2-(тритилфосфанилиден)пропаналя (436 мг, 1,37 ммоля) в THF (20 мл) кипятили с обратным холодильником в течение 0,5 ч. Реакционную смесь концентрировали и затем растирали с Et2O (20 мл) и получали этил-(E)-7-метил-5-(2-метил-3-оксопроп-1-ен-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (310 мг, 83%) в виде желтого твердого вещества. LC-MS m/z: 274,1[M+H]+. Чистота (214 нм): 96%; tR=1,77 мин.
[00824] К раствору N-гидрокси-4-метилбензолсульфонамида (277 мг, 1,48 ммоля) в 1,8 мл смеси MeOH/H2O (6/1) порциями добавляли K2CO3 (255 мг, 1,48 ммоля), затем добавляли этил-(E)-7-метил-5-(2-метил-3-оксопроп-1-ен-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 0,37 ммоля) в MeOH (5 мл) и реакционную смесь перемешивали в течение 18 ч при RT. Дополнительно добавляли K2CO3 (100 мг) и смесь перемешивали в течение 4 ч при 60°C. Реакционную смесь разбавляли с помощью EA (80 мл), промывали с помощью H2O (15 мл) и рассолом (15 мл) и сушили над Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью хроматографии на силикагеле (PE:EA=1:1) и получали этил-7-метил-5-(4-метилизоксазол-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (62 мг, 61%) в виде желтого твердого вещества. LC-MS m/z: 273,0[M+H]+. Чистота (214 нм): 83%; tR=1,72 мин.
[00825] По общей методике B* этил-7-метил-5-(4-метилизоксазол-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (62 мг, 0,23 ммоля) давал 7-метил-5-(4-метилизоксазол-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновую кислоту (25 мг, 42%) в виде желтого твердого вещества. LC-MS m/z: 259,0[M+H]+. LCMS: Чистота (214 нм): 80%; tR=1,17 мин.
[00826] По общей методике A 7-метил-5-(4-метилизоксазол-3-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (25 мг, 0,10 ммоля) и (R)-1-циклопропил-2,2,2-трифторэтан-1-амин давали искомое соединение (14,0 мг, 27%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 9,01 (s, 1H), 8,74 (s, 1H), 8,15 (d, J=9,5 Гц, 1H), 7,84 (s, 1H), 4,31-4,28 (m, 1H), 2,88 (s, 3H), 2,41 (s, 3H), 1,18-1,15 (m, 1H), 0,73-0,66 (m, 2H), 0,58-0,55 (m, 1H), 0,33-0,31 (m, 1H). LC-MS m/z: 380,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,83 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(3-метилизоксазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
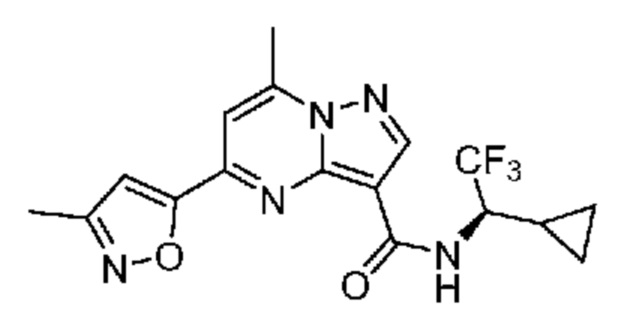
[00827] Суспензию этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (480 мг, 2 ммоля), этинилтриметилсилана (392 мг, 2 ммоля), Pd(PPh3)Cl2 (140 мг, 0,2 ммоля), CuI (38 мг, 0,2 ммоля) и Et3N (404 мг, 4 ммоля) в THF (5 мл) перемешивали при RT в течение 0,5 ч в атмосфере N2 и затем при 50°C в течение 2 ч. Реакционную смесь охлаждали до RT, реакцию останавливали насыщенным раствором NH4Cl (20 мл) и экстрагировали с помощью EA (30 мл×3). Объединенные органические слои промывали рассолом (30 мл), сушили (Na2SO4) и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA: 2/1) и получали этил-7-метил-5-((триметилсилил)этинил)пиразоло[1,5-a]пиримидин-3-карбоксилат (540 мг, 89%) в виде бледно-желтого твердого вещества. LC-MS m/z: 302,1 [M+H]+. LCMS: Чистота (214 нм): 95,6%; tR=1,56 мин.
[00828] К раствору этил-7-метил-5-((триметилсилил)этинил)пиразоло[1,5-a]пиримидин-3-карбоксилата (150 мг, 0,5 ммоля) в MeOH (10 мл) добавляли KF (58 мг, 1 ммоля). Реакционную смесь перемешивали при RT в течение 10 мин и после добавления силикагеля концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA: 1/2) и получали этил-5-этинил-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (89 мг, 79%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,69 (s, 1H), 7,40 (s, 1H), 4,84 (s, 1H), 4,31 (q, J=7,0 Гц, 2H), 2,76 (s, 3H), 1,32 (t, J=7,0 Гц, 3H). LC-MS m/z: 230,1 [M+H]+. LCMS: Чистота (254 нм): 99%; tR=1,15 мин.
[00829] К раствору этил-5-этинил-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (46 мг, 0,2 ммоля) и оксима ацетальдегида (89 мг, 1,5 ммоля) в MeOH/H2O (5/1, 2 мл) добавляли бис-[(трифторацетокси) йод]бензол (130 мг, 0,3 ммоля). Реакционную смесь перемешивали при RT в течение 12 ч, концентрировали в вакууме и очищали с помощью колоночной хроматографии на силикагеле (PE/EA: 2/1) и получали этил-7-метил-5-(3-метилизоксазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (50 мг, 84%) в виде бледно-желтого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 8,63 (s, 1H), 7,49 (s, 1H), 7,10 (s, 1H), 4,44 (q, J=7,2 Гц, 2H), 2,92 (s, 3H), 2,43 (s, 3H), 1,46 (t, J=6,8 Гц, 3H). LC-MS m/z: 287,1 [M+Na]+. LCMS: Чистота (214 нм): 79%; tR=1,68 мин.
[00830] По общей методике B* этил-7-метил-5-(3-метилизоксазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (40 мг, 0,17 ммоля) давал 7-метил-5-(3-метилизоксазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоновую кислоту (40 мг, 80%) в виде желтого твердого вещества. LC-MS m/z: 258,1 [M+H]+. LCMS: Чистота (254 нм): 75%; tR=0,99 мин.
[00831] По общей методике A 7-метил-5-(3-метилизоксазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоновая кислота (40 мг, 0,16 ммоля) и (R)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (10 мг, 17%) в виде бледно-желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,74 (s, 1H), 8,38 (d, J=9,5 Гц, 1H), 8,84 (s, 1H), 7,25 (s, 1H), 7,14 (d, J=1,5 Гц, 1H), 4,47-4,44 (m, 1H), 2,88 (s, 3H), 2,40 (s, 3H), 1,36-1,32 (m, 1H), 0,70-0,67 (m, 1H), 0,62-0,56 (m, 2H), 0,45-0,40 (m, 1H). LC-MS m/z: 380,1 [M+H]+. HPLC: Чистота (214 нм): 97,9%; tR=8,49 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(4-метилизоксазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
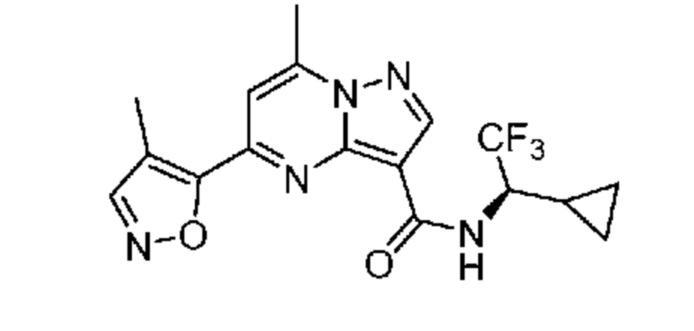
[00832] Смесь (E)-7-метил-5-(2-метил-3-оксопроп-1-ен-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксилата (782 мг, 2,86 ммоля), гидрохлорида HONH2 (296 мг, 4,29 ммоля) и KOAc (420 мг, 4,29 ммоля) в MeOH (10 мл) перемешивали при RT в течение ночи. Смесь фильтровали и получали этил-5-((1E,3Z)-3-(гидроксимино)-2-метилпроп-1-ен-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (608 мг, 73%) в виде желтого твердого вещества, которое без обработки использовали на следующей стадии. LC-MS m/z: 289,1[M+H]+. Чистота (214 нм): 84%; tR=1,15 мин.
[00833] Смесь этил-5-((1E,3Z)-3-(гидроксимино)-2-метилпроп-1-ен-1-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (500 мг, 1,74 ммоля) и MnO2 (1,5 г, 17,4 ммоля) в CHCl3 (30 мл) перемешивали при 65°C в течение ночи., затем смесь фильтровали и фильтрат концентрировали в вакууме. Полученный остаток очищали с помощью хроматографии на силикагеле (PE:EA=1:1) и получали этил-7-метил-5-(4-метилизоксазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (120 мг, 24%) в виде желтого твердого вещества. LC-MS m/z: 287,1[M+H]+. Чистота (214 нм): 80%; tR=1,28 мин.
[00834] При перемешивании к раствору (R)-1-циклопропил-2,2,2-трифторэтан-1-амингидрохлорида (293 мг, 1,67 ммоля) в толуоле (2 мл) при 0°C добавляли AlMe3 (0,98 мл, 1,96 ммоля) и раствор перемешивали при RT в течение 1 ч. Затем добавляли раствор этил-7-метил-5-(4-метилизоксазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксилата (40 мг, 0,14 ммоля) в THF (2 мл) и реакционную смесь перемешивали при 110°C в течение 40 мин. Добавляли насыщенный раствор NH4Cl (10 мл) и смесь экстрагировали с помощью EA (20 мл), промывали с помощью H2O (5 мл) и рассолом (5 мл), концентрировали в вакууме и очищали с помощью хроматографии на силикагеле (PE:EA=2:3) и препаративной HPLC и получали искомое соединение (12,7 мг, 23%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,80 (s, 1H), 8,75 (s, 1H), 8,16 (d, J=9,5 Гц, 1H), 7,80 (s, 1H), 4,35-4,30 (m, 1H), 2,90 (s, 3H), 2,51 (s, 3H), 1,19-1,17 (m, 1H), 0,73-0,68 (m,1H), 0,67-0,66 (m, 1H), 0,59-0,56 (m, 1H), 0,34-0,33 (m, 1H). LC-MS m/z: 379,8 [M+H]+. HPLC: Чистота (214 нм): 95%; tR=8,65 мин.
(R)-5-(4,5-Диметилоксазол-2-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
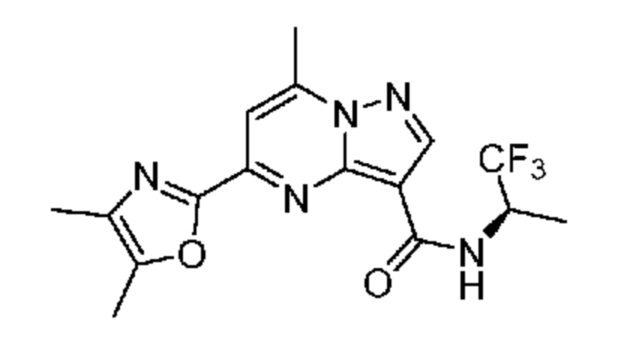
[00835] К смеси 4,5-диметилоксазола (92 мг, 0,66 ммоля) в THF (5 мл) при -78(C добавляли n-BuLi (0,3 мл, 0,80 ммоля) и смесь перемешивали при -78(C в течение 30 мин, затем добавляли ZnCl2 (1,8 мл, 2,0 ммоля). Полученную смесь перемешивали при -78(C в течение 30 мин, затем добавляли (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,33 ммоля) и Pd(PPh3)2Cl2 (28 мг, 0,03 ммоля) и перемешивали при 65°C в течение 16 ч в атмосфере N2. Реакционную смесь фильтровали и фильтрат концентрировали в вакууме и остаток очищали с помощью препаративной ВЭЖХ (MeCN/NH4HCO3) и получали искомое соединение (7 мг, 5%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,71 (s, 1H), 8,52 (d, J=8,8 Гц, 1H), 7,81 (s, 1H), 4,97-4,91 (m, 1H), 2,86 (s, 3H), 2,41 (s, 3H), 2,19 (s, 3H), 1,43 (d, J=7,2 Гц, 3H). LC-MS m/z: 368,1 [M+H]+. HPLC: Чистота (214 нм): 99%; tR=8,36 мин.
(S)-N-(1-Циклопропилэтил)-7-метил-5-(3-метилизотиазол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
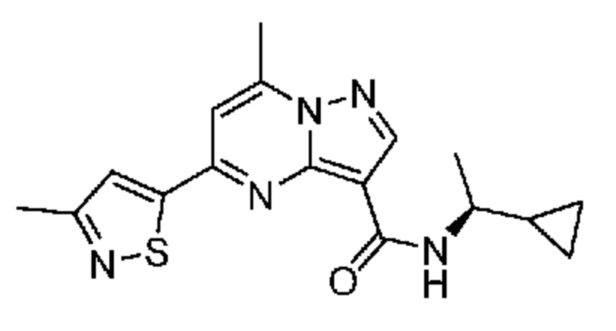
[00836] По общей методике E* (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (130 мг, 0,47 ммоля) и 5-бром-3-метилизотиазол давали искомое соединение (31 мг, 19%) в виде светло-желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,61 (s, 1H), 8,06 (s, 1H), 7,87 (d, J=9,5 Гц, 1H), 7,86 (s, 1H), 3,67-3,60 (m, 1H), 2,85 (s, 3H), 2,54 (s, 3H), 1,30 (d, J=7,0 Гц, 3H), 1,11-1,04 (m, 1H), 0,57-0,47 (m, 2H), 0,41-0,36 (m, 1H), 0,34-0,29 (m, 1H). LC-MS m/z: 342,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,14 мин.
(R)-5-(3-Циано-5-метилтиофен-2-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
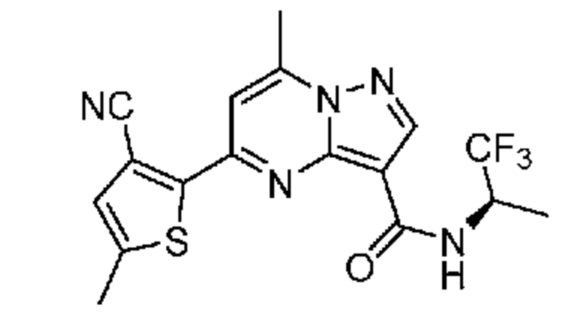
[00837] По общей методике B* метил-5-метилтиофен-3-карбоксилат (5,0 г, 32,0 ммоля) давал 5-метилтиофен-3-карбоновую кислоту в виде белого твердого вещества (4,2 г, 92%), которое без обработки использовали на следующей стадии. LC-MS m/z: сигнал отсутствует; tR=0,75 мин.
[00838] К раствору 5-метилтиофен-3-карбоновой кислоты (1,42 г, 10,0 ммоля) в HOAc (15 мл) по каплям добавляли раствор Br2 (1,6 г, 10,0 ммоля) в HOAc (10 мл). Реакционную смесь перемешивали при RT в течение 1 ч и реакцию останавливали водой (100 мл). Полученный осадок отфильтровывали и сушили в вакууме и получали 2-бром-5-метилтиофен-3-карбоновую кислоту (2,0 г, 90%) в виде белого твердого вещества. LC-MS m/z: сигнал отсутствует; tR=1,15 мин.
[00839] По общей методике A 2-бром-5-метилтиофен-3-карбоновая кислота (2,0 г, 9,05 ммоля) и NH4Cl давали 2-бром-5-метилтиофен-3-карбоксамид в виде серого твердого вещества (1,2 г, 59%). LC-MS m/z: 220,1 [M+H]+. tR=1,45 мин.
[00840] Смесь 2-бром-5-метилтиофен-3-карбоксамида (1,17 г, 5,3 ммоля), TFAA (1,45 г, 6,9 ммоля) и TEA (1,34 г, 13,25 ммоля) в DCM (15 мл) перемешивали при RT в течение 1 ч и подвергали распределению между CH2Cl2 (50 мл) и насыщенным раствором NaHCO3 (20 мл). Органический слой сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 2-бром-5-метилтиофен-3-карбонитрил (1,25 г, 100%) в виде коричневого твердого вещества. LC-MS m/z: сигнал отсутствует; tR=1,80 мин.
[00841] По общей методике E* (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,23 ммоля) и 2-бром-5-метилтиофен-3-карбонитрил давали искомое соединение (10 мг, 10%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,72 (s, 1H), 7,98 (d, J=9,6 Гц, 1H), 7,66 (s, 1H), 7,49 (s, 1H), 5,04-4,99 (m, 1H), 2,87 (s, 3H), 2,59 (s, 3H), 1,46 (d, J=7,2 Гц, 3H). LC-MS m/z: 394,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,94 мин.
(S)-5-(3-Циано-5-метилтиофен-2-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
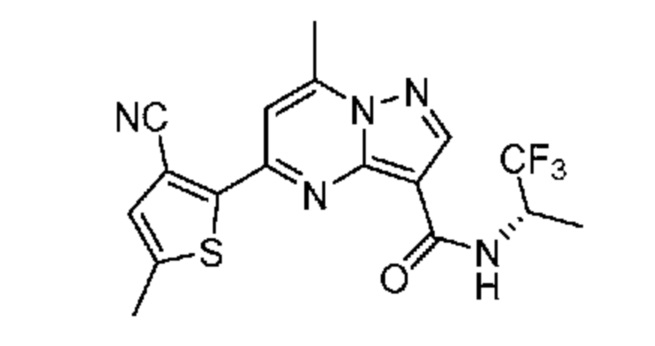
[00842] По общей методике E* (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (113 мг, 0,37 ммоля) и 2-бром-5-метилтиофен-3-карбонитрил давали искомое соединение (35 мг, 28%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,72 (s, 1H), 7,98 (d, J=9,0 Гц, 1H), 7,65 (s, 1H), 7,49 (d, J=1,0 Гц, 1H), 5,05-4,98 (m, 1H), 2,87 (s, 3H), 2,59 (d, J=1,0 Гц, 3H), 1,46 (d, J=7,0 Гц, 3H). LC-MS m/z: 394,1 [M+H]+. HPLC: Чистота (214 нм): 97%; tR=8,92 мин.
(R)-5-(2-Циано-5-фторфенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
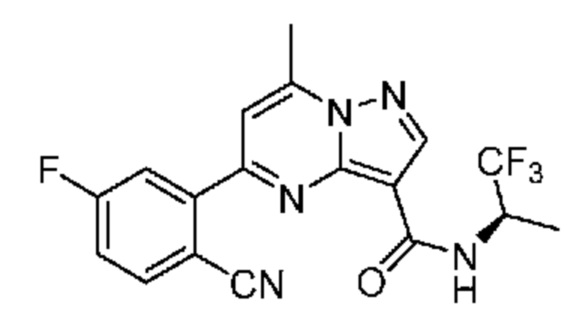
[00843] По общей методике D (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,26 ммоля) и 4-фтор-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил давали искомое соединение (33 мг, 32%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,77 (s, 1H), 8,26 (dd, J=8,5 Гц, 5,5 Гц, 1H), 8,11 (d, J =9,5 Гц, 1H), 8,08 (dd, J=9,5 Гц, 2,5 Гц, 1H), 7,88 (s, 1H), 7,70 (td, J=8,0 Гц, 2,5 Гц, 1H), 5,03-4,98 (m, 1H), 2,89 (s, 3H), 1,44 (d, J=7,0 Гц, 3H). LC-MS m/z: 392,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,33 мин.
(S)-5-(2-Циано-5-фторфенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
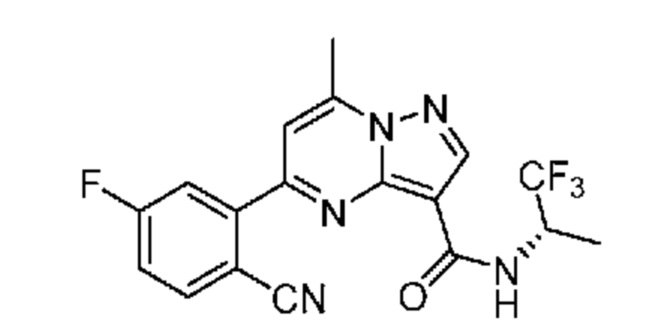
[00844] По общей методике D (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,26 ммоля) и 4-фтор-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил давали искомое соединение (37 мг, 37%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,77 (s, 1H), 8,26 (dd, J=8,5 Гц, 5,5 Гц, 1H), 8,11 (d, J =9,5 Гц, 1H), 8,08 (dd, J=9,5 Гц, 2,5 Гц, 1H), 7,88 (s, 1H), 7,70 (td, J=8,0 Гц, 2,5 Гц, 1H), 5,03-4,98 (m, 1H), 2,89 (s, 3H), 1,44 (d, J=7,0 Гц, 3H). LC-MS m/z: 392,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,33 мин.
(R)-5-(5-Циано-2-фторфенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
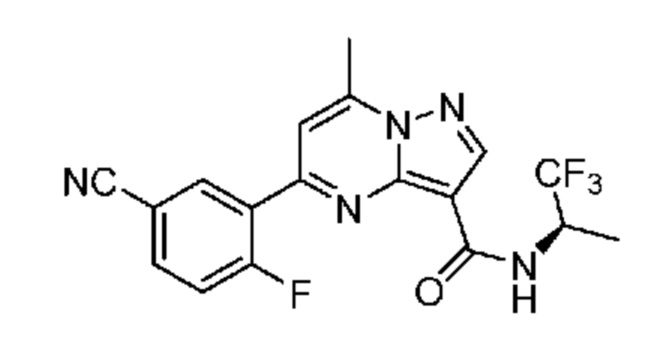
[00845] По общей методике D (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,26 ммоля) и 4-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил давали искомое соединение (35,4 мг, 35%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,74 (s, 1H), 8,58 (dd, J=7,5 Гц, 2,0 Гц, 1H), 8,42 (d, J=9,5 Гц, 1H), 8,18 (ddd, J=9,0 Гц, 4,5 Гц, 2,0 Гц, 1H), 7,82 (s, 1H), 7,75 (dd, J=11,0 Гц, 8,5 Гц, 1H), 5,00-4,92 (m, 1H), 2,89 (s, 3H), 1,41 (d, J=7,0 Гц, 3H). LC-MS m/z: 392,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,30 мин.
(S)-5-(5-Циано-2-фторфенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
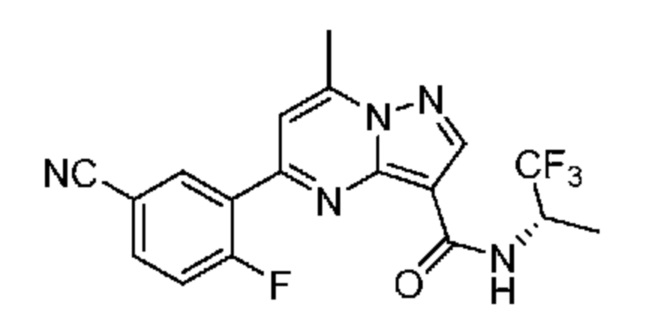
[00846] По общей методике D (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,26 ммоля) и 4-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил давали искомое соединение (41 мг, 40%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,74 (s, 1H), 8,58 (dd, J=7,5 Гц, 2,0 Гц, 1H), 8,42 (d, J=9,5 Гц, 1H), 8,18 (ddd, J=9,0 Гц, 4,5 Гц, 2,0 Гц, 1H), 7,82 (s, 1H), 7,75 (dd, J=11,0 Гц, 8,5 Гц, 1H), 5,00-4,92 (m, 1H), 2,89 (s, 3H), 1,41 (d, J=7,0 Гц, 3H). LC-MS m/z: 392,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,26 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(4-(трифторметил)пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
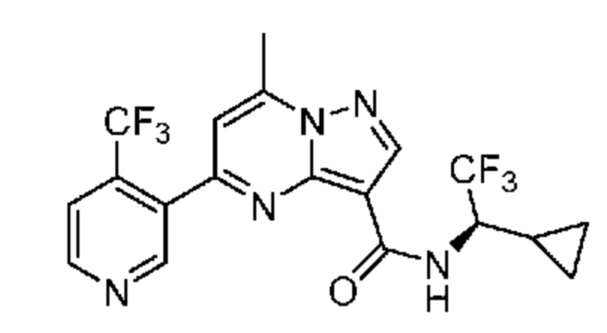
[00847] По общей методике E* (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 3-бром-4-(трифторметил)пиридин давали искомое соединение (5,7 мг, 5%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,85 (s, 1H), 8,82 (d, J=5,0 Гц, 1H), 8,52 (s, 1H), 8,19 (d, J=9,5 Гц, 1H), 7,78 (d, J=5,5 Гц, 1H), 7,30 (s, 1H), 4,10-4,05 (m, 1H), 2,78 (s, 3H), 0,97-0,91 (m, 1H), 0,57-0,51 (m, 1H), 0,39-0,33 (m, 2H), 0,21-0,16 (m, 1H). LC-MS m/z: 444,1 [M+H]+. HPLC: Чистота (214 нм): 96,4%; tR=8,44 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(4-(трифторметил)пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
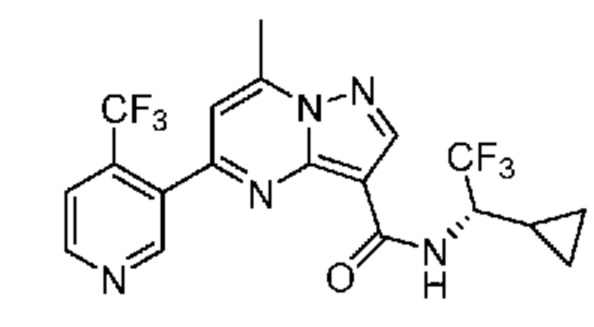
[00848] По общей методике E* (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 3-бром-4-(трифторметил)пиридин давали искомое соединение (2,1 мг, 2%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,85 (s, 1H), 8,82 (d, J=5,0 Гц, 1H), 8,52 (s, 1H), 8,19 (d, J=9,5 Гц, 1H), 7,78 (d, J=5,5 Гц, 1H), 7,30 (s, 1H), 4,10-4,05 (m, 1H), 2,78 (s, 3H), 0,97-0,91 (m, 1H), 0,57-0,51 (m, 1H), 0,39-0,33 (m, 2H), 0,21-0,16 (m, 1H). LC-MS m/z: 444,1 [M+H]+. HPLC: Чистота (214 нм): 96,4%; tR=8,44 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(2-(трифторметил)пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
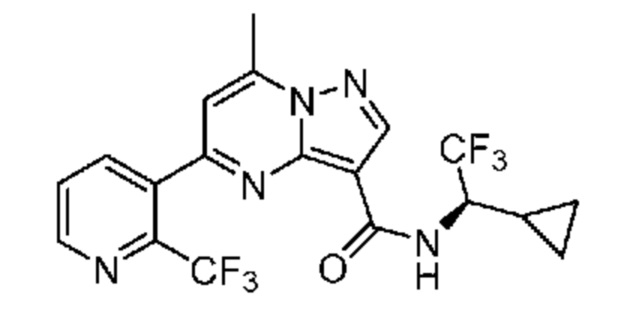
[00849] По общей методике D (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,150 ммоля) и 2-(трифторметил) пиридин-3-илбороновая кислота давали искомое соединение (22 мг, 33%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,72 (d, J=8,0 Гц, 1H), 8,70 (s, 1H), 8,32 (t, J=8,0 Гц, 1H), 8,23 (d, J=0,5 Гц, 1H), 8,03 (d, J=8,0 Гц, 1H), 4,45-4,42 (m, 1H), 3,00 (d, J=0,5 Гц, 3H), 1,41-1,37 (m, 1H), 0,84-0,80 (m, 1H), 0,70-0,61 (m, 2H), 0,57-0,51 (m, 1H). LC-MS m/z: 444,1 [M+H]+. HPLC: Чистота (214 нм): 98,97%; tR=9,70 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(2-(трифторметил)пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
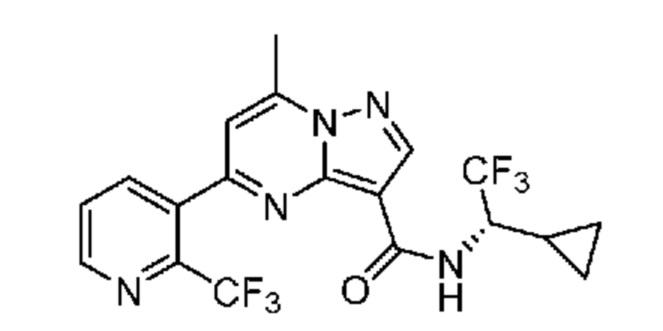
[00850] По общей методике D (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,150 ммоля) и 2-(трифторметил) пиридин-3-илбороновая кислота давали искомое соединение (21 мг, 31%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,72 (d, J=8,0 Гц, 1H), 8,70 (s, 1H), 8,32 (t, J=8,0 Гц, 1H), 8,23 (d, J=0,5 Гц, 1H), 8,03 (d, J=8,0 Гц, 1H), 4,45-4,42 (m, 1H), 3,00 (d, J=0,5 Гц, 3H), 1,41-1,37 (m, 1H), 0,84-0,80 (m, 1H), 0,70-0,61 (m, 2H), 0,57-0,51 (m, 1H). LC-MS m/z: 444,1 [M+H]+. HPLC: Чистота (214 нм): 98,97%; tR=9,70 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(3,4,4-триметил-2-оксоимидазолидин-1-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
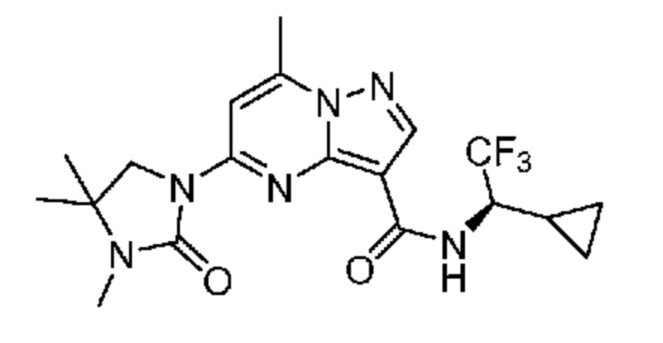
[00851] По общей методике H (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (33 мг, 0,1 ммоля) и 1,5,5-триметилимидазолидин-2-он давали искомое соединение (8,9 мг, 21%) в виде белесого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,43 (s, 1H), 8,21 (d, J=10,0 Гц, 1H), 8,08 (s, 1H), 4,39-4,35 (m, 1H), 3,85 (d, J=10,8 Гц, 1H), 3,75 (d, J=10,8 Гц, 1H), 2,78 (s, 3H), 2,74 (s, 3H), 1,34 (s, 3H), 1,33 (s, 3H), 1,28-1,24 (m, 1H), 0,69-0,65 (m, 1H), 0,59-0,55 (m, 2H), 0,38-0,36 (m, 1H). LC-MS m/z: 425,1 [M+H]+. HPLC: Чистота (214 нм): 97,06%; tR=8,44 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(5,5-диметил-2-оксооксазилидин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
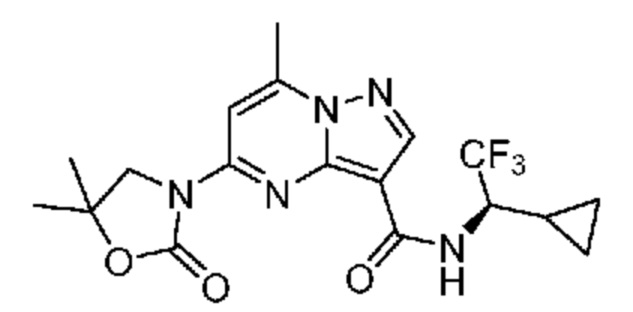
[00852] По общей методике H (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (73 мг, 0,219 ммоля) и 5,5-диметилоксазолидин-2-он давали искомое соединение (22 мг, 25%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,54 (s, 1H), 8,13 (d, J=9,5 Гц, 1H), 7,94 (s, 1H), 4,36-4,31 (m, 1H), 4,08 (d, J=10,0 Гц, 1H), 3,98 (d, J=10,0 Гц, 1H), 2,80 (s, 3H), 1,54 (s, 6H), 1,31-1,28 (m, 1H), 0,70-0,66 (m, 1H), 0,61-0,55 (m, 2H), 0,38-0,34 (m, 1H). LC-MS m/z: 412,2 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=8,42 мин.
(R)-5-(4-Фторфенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
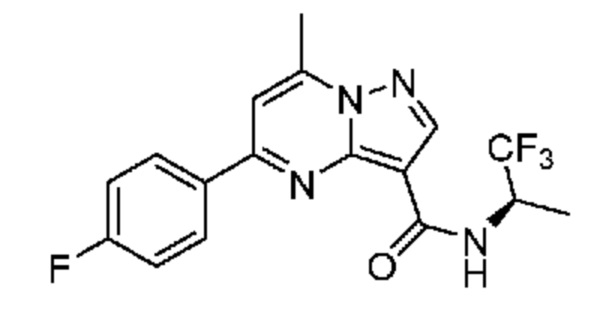
[00853] По общей методике D (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,16 ммоля) и 4-фторфенилбороновая кислота давали искомое соединение (18 мг, 30%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,66 (s, 1H), 8,46 (d, J=9,2 Гц, 1H), 8,30 (dd, J=8,8 Гц, 5,2Hz, 1H), 7,96 (s, 1H), 7,50 (t, J=8,8 Гц, 1H), 5,01-4,94 (m, 1H), 2,86 (s, 3H), 1,46 (d, J=6,8 Гц, 3H). LC-MS m/z: 367,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,98 мин.
(S)-5-(4-Фторфенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
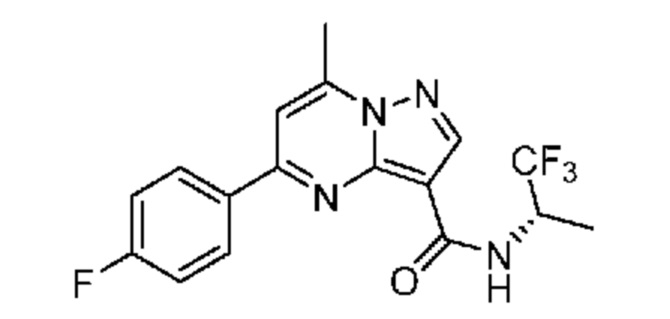
[00854] По общей методике D (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,21 ммоля) и 4-фторфенилбороновая кислота давали искомое соединение (61 мг, 70%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,66 (s, 1H), 8,46 (d, J=9,2 Гц, 1H), 8,30 (dd, J=8,8 Гц, 5,2 Гц, 1H), 7,96 (s, 1H), 7,50 (t, J=8,8 Гц, 1H), 5,01-4,94 (m, 1H), 2,86 (s, 3H), 1,46 (d, J=6,8 Гц, 3H). LC-MS m/z: 367,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,98 мин.
(R)-5-(3-Фторфенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
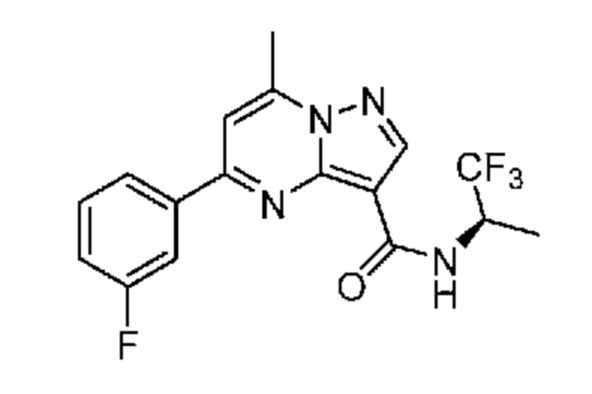
[00855] По общей методике D (R)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,16 ммоля) и 3-фторфенилбороновая кислота давали искомое соединение (28 мг, 47%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,69 (s, 1H), 8,48 (d, J=10,0 Гц, 1H), 8,10 (d, J=8,5 Гц, 1H), 8,06 (dt, J=10,0 Гц, 1,5 Гц, 1H), 8,01 (s, 1H), 7,72-7,67 (m, 1H), 7,48 (td, J=8,5 Гц, 2,5 Гц, 1H), 5,01-4,94 (m, 1H), 2,87 (s, 3H), 1,46 (d, J=6,8 Гц, 3H). LC-MS m/z: 367,1 [M+H]+. HPLC: Чистота (214 нм): 95%; tR=8,96 мин.
(S)-5-(3-Фторфенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
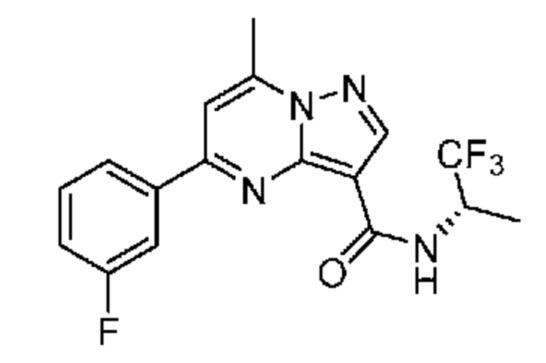
[00856] По общей методике D (S)-5-хлор-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,21 ммоля) и 3-фторфенилбороновая кислота давали искомое соединение (36 мг, 40%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 8,69 (s, 1H), 8,48 (d, J=9,2 Гц, 1H), 8,10 (d, J=8,4 Гц, 1H), 8,06 (dt, J=10,8 Гц, 1,2 Гц, 1H), 8,01 (s, 1H), 7,72-7,67 (m, 1H), 7,48 (td, J=8,4 Гц, 2,4 Гц, 1H), 5,01-4,94 (m, 1H), 2,87 (s, 3H), 1,46 (d, J=6,8 Гц, 3H). LC-MS m/z: 367,1 [M+H]+. HPLC: Чистота (214 нм): 95%; tR=8,96 мин.
(R)-5-(5-Цианопиридин-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
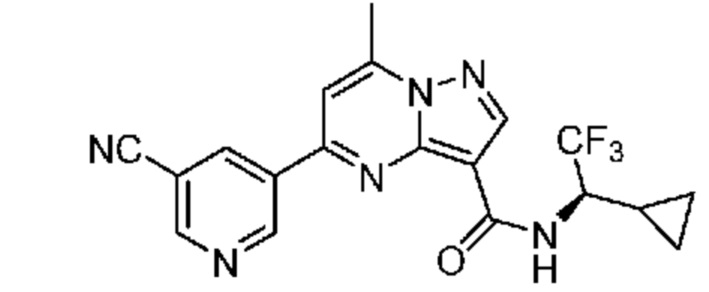
[00857] По общей методике D (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и 5-цианопиридин-3-илбороновая кислота давали искомое соединение (24 мг, 33%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 9,66 (d, J=2,0 Гц, 1H), 9,24 (d, J=2,0 Гц, 1H), 9,06 (t, J=2,4 Гц, 1H), 8,74 (s, 1H), 8,46 (d, J=9,6 Гц, 1H), 8,12 (s, 1H), 4,47-4,43 (m, 1H), 2,89 (s, 3H), 1,36-1,30 (m, 1H), 0,73-0,67 (m, 1H), 0,62-0,55 (m, 2H), 0,42-0,38 (m, 1H). LC-MS m/z: 401,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,03 мин.
(S)-5-(5-Цианопиридин-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
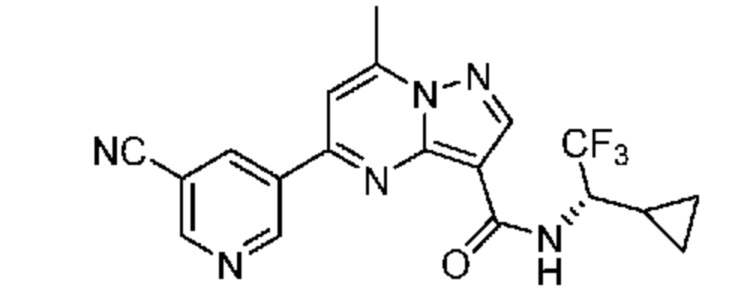
[00858] По общей методике D (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 5-цианопиридин-3-илбороновая кислота давали искомое соединение (12 мг, 13%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): 9,56 (d, J=2,0 Гц, 1H), 8,81 (dd, J=8,0 Гц, 2,0 Гц, 1H), 8,76 (s, 1H), 8,46 (d, J=9,5 Гц, 1H), 8,37 (d, J=8,5 Гц, 1H), 8,13 (s, 1H), 4,45-4,40 (m, 1H), 2,91 (s, 3H), 1,35-1,30 (m, 1H), 0,72-0,67 (m, 1H), 0,65-0,56 (m, 2H), 0,42-0,35 (m, 1H). LC-MS m/z: 401,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,29 мин.
(R)-5-(2-Цианопиридин-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
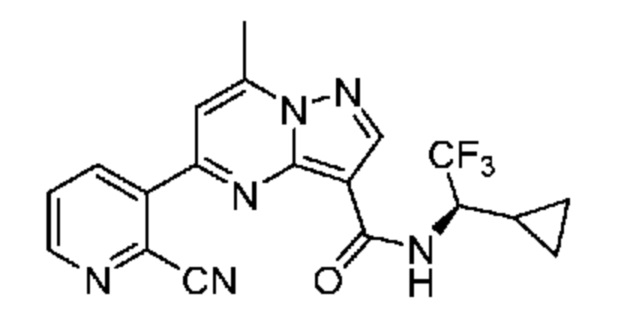
[00859] По общей методике D (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и 2-цианопиридин-3-илбороновая кислота давали искомое соединение (2 мг, 3,0%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,90 (dd, J=5,0 Гц, 2,0 Гц, 1H), 8,74 (s, 1H), 8,54 (dd, J=8,0 Гц, 1,5 Гц, 1H), 7,91 (dd, J=8,0 Гц, 4,5 Гц, 1H), 7,70 (d, J=0,5 Гц, 1H), 4,27-4,20 (m, 1H), 3,00 (s, 3H), 1,47-1,42 (m, 1H), 0,82-0,76 (m, 1H), 0,63-0,58 (m, 2H), 0,46-0,41 (m, 1H). LC-MS m/z: 401,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,97 мин.
(S)-5-(2-Цианопиридин-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
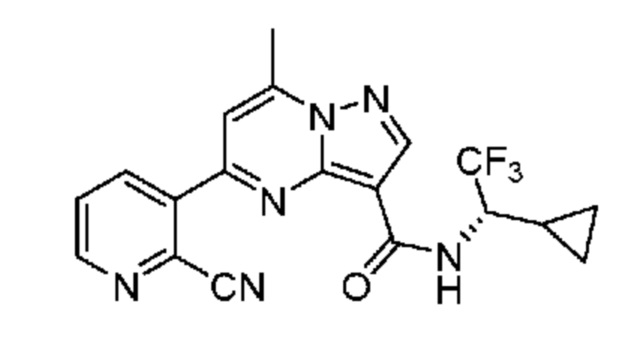
[00860] По общей методике D (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и 2-цианопиридин-3-илбороновая кислота давали искомое соединение (2 мг, 3%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 8,90 (dd, J=5,0 Гц, 2,0 Гц, 1H), 8,74 (s, 1H), 8,54 (dd, J=8,0 Гц, 1,5 Гц, 1H), 7,91 (dd, J=8,0 Гц, 4,5 Гц, 1H), 7,70 (d, J=0,5 Гц, 1H), 4,27-4,20 (m, 1H), 3,00 (s, 3H), 1,47-1,42 (m, 1H), 0,82-0,76 (m, 1H), 0,63-0,58 (m, 2H), 0,46-0,41 (m, 1H). LC-MS m/z: 401,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,97 мин.
(R)-5-(6-Цианопиридин-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
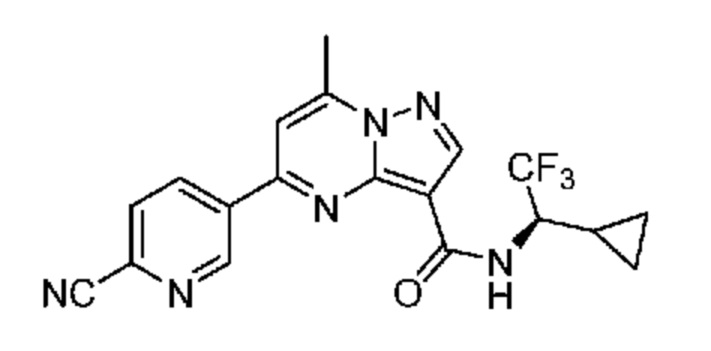
[00861] По общей методике D (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 6-цианопиридин-3-илбороновая кислота давали искомое соединение (12,2 мг, 13%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 10,37 (d, J=1,5 Гц, 1H), 9,62 (dd, J=8,0 Гц, 2,0 Гц, 1H), 9,57 (s, 1H), 9,26 (d, J=9,5 Гц, 1H), 9,17 (d, J=8,5 Гц, 1H), 8,94 (s, 1H), 5,24-5,20 (m, 1H), 3,72 (s, 3H), 2,15-2,13 (m, 1H), 1,53-1,50 (m, 1H), 1,43-1,38 (m, 2H), 1,20-1,18 (m, 1H). LC-MS m/z: 401,1 [M+H]+. HPLC: Чистота (254 нм): > 99%; tR=8,28 мин.
(S)-5-(6-Цианопиридин-3-ил)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
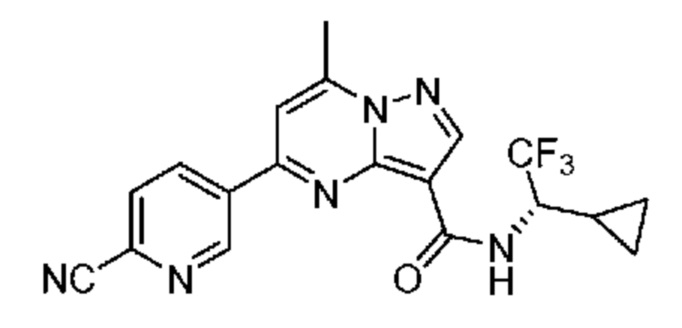
[00862] По общей методике D (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,15 ммоля) и 6-цианопиридин-3-илбороновая кислота давали искомое соединение (16 мг, 27%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 9,54 (d, J=1,5 Гц, 1H), 8,76 (dd, J=8,5 Гц, 2,5 Гц, 1H), 8,70 (s, 1H), 8,13 (d, J=8,0 Гц, 1H), 7,89 (s, 1H), 4,43-4,39 (m, 1H), 2,99 (s, 3H), 1,35-1,33 (m, 1H), 0,82-0,77 (m, 1H), 0,68-0,61(m, 2H), 0,51-0,48 (m, 1H). LC-MS m/z: 401,1 [M+H]+. HPLC: Чистота (254 нм): 99,48%; tR=8,30 мин.
5-(5-Цианопиридин-3-ил)-N-(2-циклопропилпропан-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
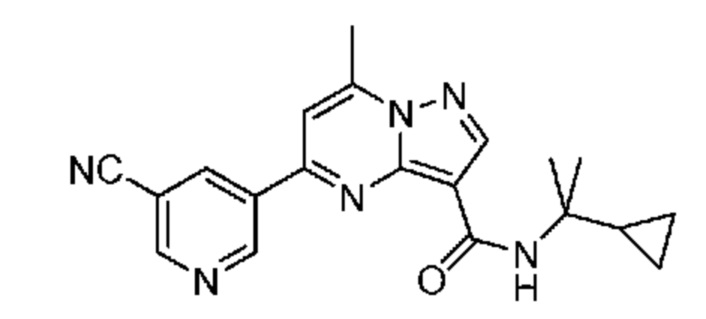
[00863] По общей методике D 5-хлор-N-(2-циклопропилпропан-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,17 ммоля) и 5-цианопиридин-3-илбороновая кислота давали искомое соединение (9 мг, 8%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DSMO-d6): δ 9,68 (d, J=2,0 Гц, 1H), 9,23 (d, J=2,0 Гц, 1H), 9,06 (t, J=2,0 Гц, 1H), 8,61 (s, 1H), 8,07 (s, 1H), 8,06 (s, 1H), 2,87 (s,3H), 1,43-1,39 (m, 1H), 1,38 (s, 6H), 0,51-0,50 (m, 4H). LC-MS m/z: 362,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,93 мин.
5-(6-Цианопиридин-3-ил)-N-(2-циклопропилпропан-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
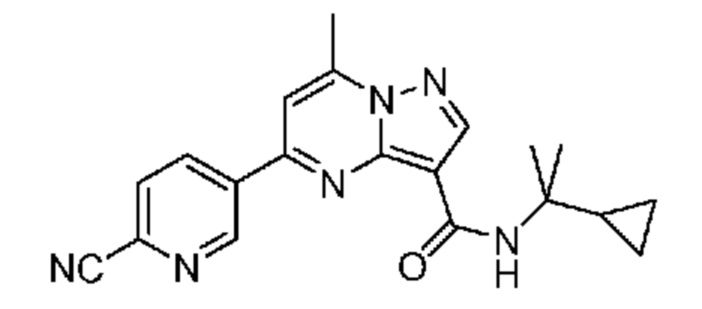
[00864] По общей методике D 5-хлор-N-(2-циклопропилпропан-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,17 ммоля) и 6-цианопиридин-3-илбороновая кислота давали искомое соединение (8 мг, 8%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,56 (d, J=1,5 Гц, 1H), 8,79 (dd, J=8,0 Гц, 2,0 Гц, 1H), 8,60 (s, 1H), 8,34 (d, J=8,0 Гц, 1H), 8,05 (s, 1H), 8,04 (s, 1H), 2,87 (s,3H), 1,43-1,40 (m, 1H), 1,37 (s, 6H), 0,49-0,48 (m, 4H). LC-MS m/z: 362,1 [M+H]+. HPLC: Чистота (214 нм): 97%; tR=8,26 мин.
5-(2-Цианопиридин-3-ил)-N-(2-циклопропилпропан-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
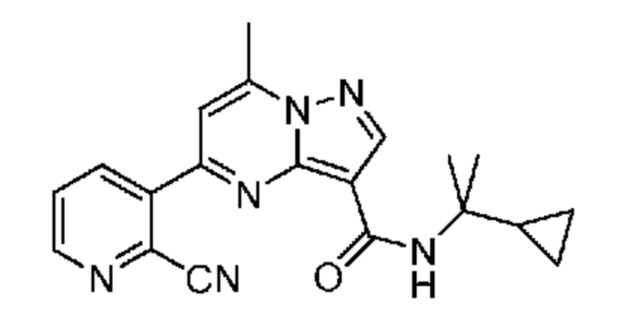
[00865] По общей методике D 5-хлор-N-(2-циклопропилпропан-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,24 ммоля) и 2-цианопиридин-3-илбороновая кислота давали искомое соединение (10 мг, 9%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,93 (dd, J=5,0 Гц 1,5Hz, 1H), 8,66 (s, 1H), 8,51 (dd, J=8,0 Гц, 1,0 Гц, 1H), 7,99 (dd, J=8,0 Гц, 4,5 Гц, 1H), 7,97 (s, 1H), 7,76 (s, 1H), 3,34 (s, 3H), 2,89 (s, 3H), 1,50-1,44 (m, 1H), 0,42-0,37 (m, 2H), 0,36-0,31 (m, 2H). LC-MS m/z: 361,1 [M+H]+. HPLC: Чистота (214 нм): 98%; tR=8,26 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(2-фтор-6-метилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
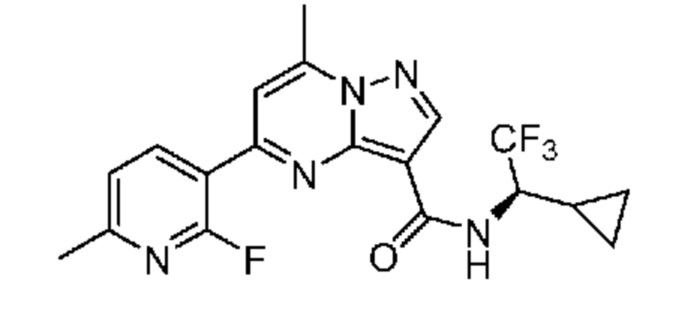
[00866] По общей методике D (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и 2-фтор-6-метилпиридин-3-илбороновая кислота давали искомое соединение (35 мг, 48%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,71 (s, 1H), 8,48-8,53 (m, 2H), 7,77 (s, 1H), 7,53 (dd, J=7,5 Гц, 1,0 Гц, 1H), 4,46-4,40 (m, 1H), 2,88 (s, 3H), 2,55 (s, 3H), 1,26-1,22 (m, 1H), 0,72-0,66 (m, 1H), 0,60-0,55 (m, 2H), 0,39-0,35 (m, 1H). LC-MS m/z: 408,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,83 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(2-фтор-6-метилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
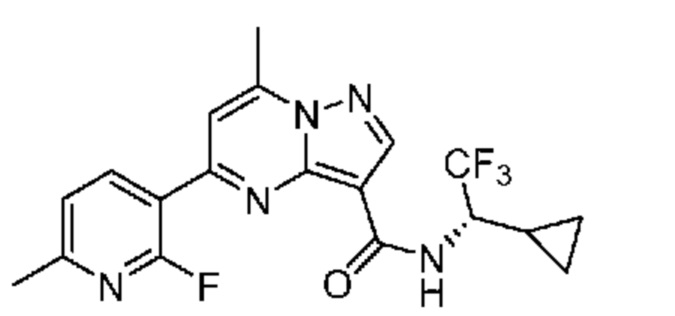
[00867] По общей методике D (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 2-фтор-6-метилпиридин-3-илбороновая кислота давали искомое соединение (45 мг, 46%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,71 (s, 1H), 8,48-8,53 (m, 2H), 7,77 (s, 1H), 7,53 (dd, J=7,5 Гц, 1,0 Гц, 1H), 4,46-4,40 (m, 1H), 2,88 (s, 3H), 2,55 (s, 3H), 1,26-1,22 (m, 1H), 0,72-0,66 (m, 1H), 0,60-0,55 (m, 2H), 0,39-0,35 (m, 1H). LC-MS m/z: 408,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,86 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(2-фтор-5-метилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
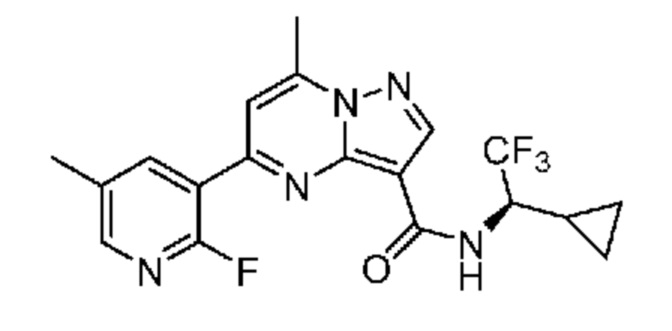
[00868] По общей методике D (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (60 мг, 0,18 ммоля) и 2-фтор-5-метилпиридин-3-илбороновая кислота давали искомое соединение (43 мг, 58%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,72 (s, 1H), 8,51 (d, J=9,5 Гц, 1H), 8,44 (dd, J=9,5 Гц, 2,0 Гц, 1H), 8,29 (s, 1H), 7,79 (s, 1H), 4,50-4,46 (m, 1H), 2,89 (s, 3H), 2,41 (s, 3H), 1,26-1,22 (m, 1H), 0,69-0,66 (m, 1H), 0,58-0,55 (m, 2H), 0,40-0,36 (m,1H). LC-MS m/z: 408,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,87 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(2-фтор-5-метилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
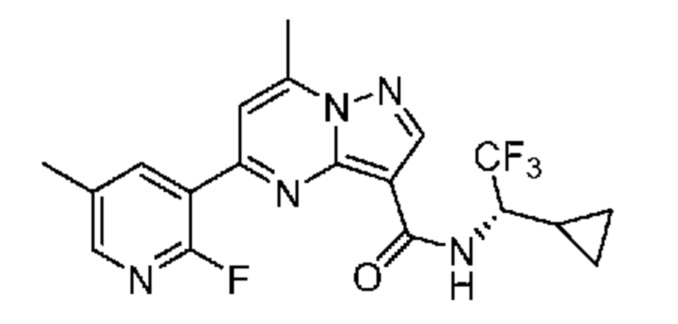
[00869] По общей методике D (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,15 ммоля) и 2-фтор-5-метилпиридин-3-илбороновая кислота давали искомое соединение (45 мг, 73%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,72 (s, 1H), 8,51 (d, J=9,5 Гц, 1H), 8,44 (dd, J=9,5 Гц, 2,0 Гц, 1H), 8,29 (s, 1H), 7,79 (s, 1H), 4,50-4,46 (m, 1H), 2,89 (s, 3H), 2,41 (s, 3H), 1,26-1,22 (m, 1H), 0,69-0,66 (m, 1H), 0,58-0,55 (m, 2H), 0,40-0,36 (m,1H). LC-MS m/z: 408,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,87 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(2-метилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
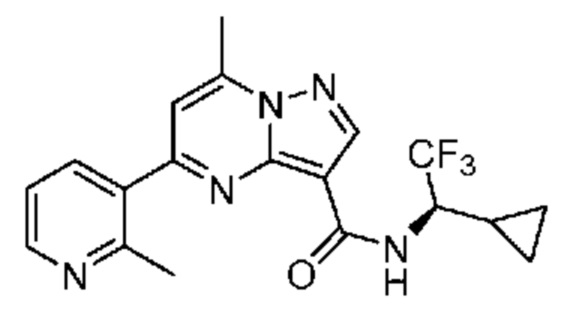
[00870] По общей методике D (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 2-метилпиридин-3-илбороновая кислота давали искомое соединение (36 мг, 39%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,71(s, 1H), 8,63 (dd, J=5,0 Гц, 1,5 Гц, 1H), 8,34 (d, J=9,5 Гц, 1H), 8,03 (dd, J=8,0 Гц, 1,5 Гц, 1H), 7,61 (s, 1H), 7,46 (dd, J=8,0 Гц, 5,0 Гц, 1H), 4,41-4,37 (m, 1H), 2,87 (s, 3H), 2,71 (s, 3H), 1,17-1,14 (m, 1H), 0,66-0,63 (m, 1H), 0,57-0,50 (m, 2H), 0,31-0,28 (m, 1H). LC-MS m/z: 390,1 [M+H]+. HPLC: Чистота (214 нм): 98%; tR=7,75 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(2-метилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
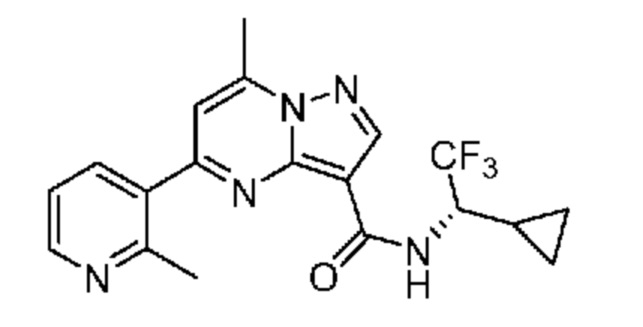
[00871] По общей методике D (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,15 ммоля) и 2-метилпиридин-3-илбороновая кислота давали искомое соединение (23 мг, 40%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CDCl3): δ 8,74 (s, 1H), 8,67(dd, J=5,0 Гц, 1,5 Гц, 1H), 8,33 (d, J=9,5 Гц, 1H), 7,86 (dd, J=8,0 Гц, 1,5 Гц, 1H), 7,33 (dd, J=8,0 Гц, 5,0 Гц, 1H), 7,05 (d, J=1,5 Гц, 1H), 4,41-4,36 (m, 1H), 2,93 (s, 3H), 2,77 (s, 3H), 1,16-1,09 (m, 1H), 0,72-0,66 (m, 1H), 0,57-0,49 (m, 2H), 0,46-0,41 (m, 1H). LC-MS m/z: 390,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=7,72 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(5-фтор-2-метилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
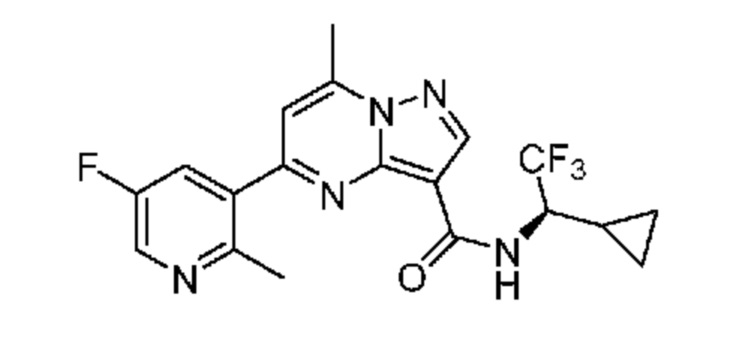
[00872] К раствору n-BuLi/THF (1,45 мл, 2,5 моль/л) в THF (5 мл) при -78°C по каплям добавляли раствор 3-бром-2-хлор-5-фторпиридина (630 мг, 3,0 ммоля) в THF (5 мл). Реакционную смесь перемешивали при -78°C в течение еще 30 мин, затем добавляли B(OiPr)3 (677 мг, 3,6 ммоля) в THF (2 мл). Смесь перемешивали при -78°C в течение еще 2 ч и реакцию останавливали 5% водным раствором NaOH (10 мл). Смесь подкисляли до pH 1~2 разбавленным водным раствором HCl и экстрагировали с помощью EA (60 мл×3). Объединенные органические фазы сушили над безводным MgSO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 2-хлор-5-фторпиридин-3-илбороновую кислоту (1,5 г, неочищенная) в виде серого масла, которое использовали на следующей стадии без дополнительной очистки. LC-MS m/z: 176,1 [M+H]+. tR=0,64 мин.
[00873] По общей методике D этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (800 мг, 3,34 ммоля) и 2-хлор-5-фторпиридин-3-илбороновая кислота давали этил-5-(2-хлор-5-фторпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (260 мг, 23%) в виде серого твердого вещества. LC-MS m/z: 335,1 [M+H]+. tR=1,75 мин.
[00874] Раствор этил-5-(2-хлор-5-фторпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (180 мг, 0,53 ммоля) и 2,4,6-триметил-1,3,5,2,4,6-триоксатриборинана (203 мг, 1,61 ммоля), K2CO3 (190 мг, 1,38 ммоля) и бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладия (II) (75 мг, 0,106 ммоля) в DMF (10 мл) перемешивали при 90°C в течение 16 ч в атмосфере N2, выливали в H2O (30 мл) и экстрагировали с помощью EA (80 мл×3). Объединенные органические фазы сушили над безводным MgSO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA=9/1) и получали этил-5-(5-фтор-2-метилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (146 мг, 88%) в виде красного твердого вещества. LC-MS m/z: 315,1 [M+H]+. tR=1,67 мин.
[00875] По общей методике B* этил-5-(5-фтор-2-метилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (144 мг, 0,45 ммоля) давал 5-(5-фтор-2-метилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (72 мг, 56%) в виде серого твердого вещества. LC-MS m/z: 287,1 [M+H]+. tR=1,11 мин.
[00876] По общей методике A 5-(5-фтор-2-метилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (20 мг, 0,07 ммоля) и (R)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (6,4 мг, 22%) в виде почти белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,74 (s, 1H), 8,67 (d, J=3,0 Гц, 1H), 8,31 (d, J=9,5 Гц, 1H), 8,03 (dd, J=9,5 Гц, 3,0 Гц, 1H), 7,67 (s, 1H), 4,44-4,35 (m, 1H), 2,88 (s, 3H), 2,70 (s, 3H), 1,21-1,14 (m, 1H), 0,68-0,64 (m, 1H), 0,60-0,49 (m, 2H), 0,33-0,28 (m, 1H). LC-MS m/z: 408,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,36 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(5-фтор-2-метилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
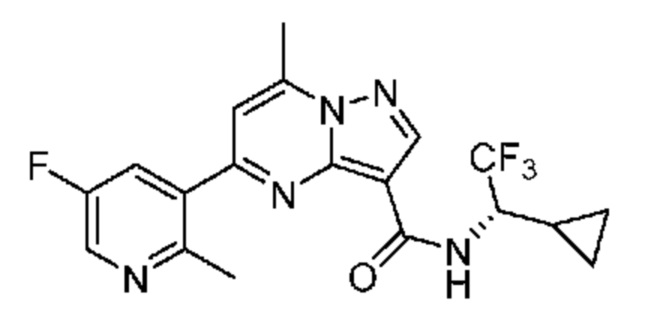
[00877] По общей методике A 5-(5-фтор-2-метилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (20 мг, 0,07 ммоля) и (S)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (6,4 мг, 22%) в виде почти белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,74 (s, 1H), 8,67 (d, J=3,0 Гц, 1H), 8,31 (d, J=9,5 Гц, 1H), 8,03 (dd, J=9,5 Гц, 3,0 Гц, 1H), 7,67 (s, 1H), 4,44-4,35 (m, 1H), 2,88 (s, 3H), 2,70 (s, 3H), 1,21-1,14 (m, 1H), 0,68-0,64 (m, 1H), 0,60-0,49 (m, 2H), 0,33-0,28 (m, 1H). LC-MS m/z: 408,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,36 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(5-фтор-6-метилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
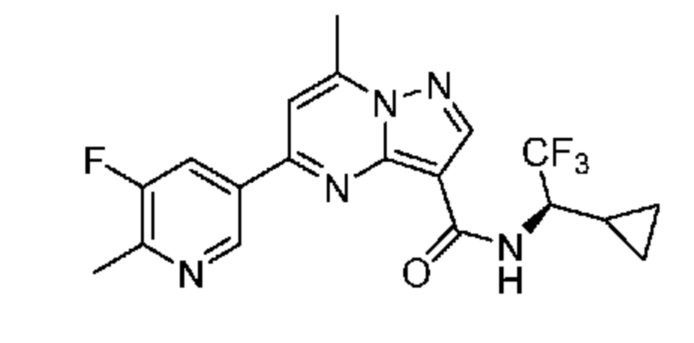
[00878] Раствор 5-бром-2-метилпиридин-3-амина (2 г, 10,69 ммоля) и NOBF4 (1,5 г, 12,83 ммоля) в DCM (20 мл) перемешивали при 20°C в течение 16 ч и реакционную смесь подщелачивали насыщенным раствором NaHCO3 (10 мл) до pH=8. Смесь разбавляли с помощью DCM (20 мл) и промывали с помощью H2O (10 мл×3). Органическую фазу сушили над безводным Na2SO4, фильтровали, концентрировали в вакууме и остаток очищали с помощью флэш-хроматографии на силикагеле (EA:PE; от 0 до 5%) и получали 5-бром-3-фтор-2-метилпиридин (500 мг, 40%) в виде желтого твердого вещества. LC-MS m/z: 191,1 [M+H]+. Чистота по данным LC-MS (214 нм): > 88%; tR=1,24 мин.
[00879] По общей методике E* (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 5-бром-3-фтор-2-метилпиридин давали искомое соединение (17 мг, 17%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,18 (s, 1H), 8,70 (s, 1H), 8,48 (d, J=10,0 Гц, 1H), 8,38 (dd, J=10,5 Гц, 1,5 Гц, 1H), 8,05 (s, 1H), 4,50-4,43 (m, 1H), 2,87 (s, 3H), 2,57 (d, J=3,0 Гц, 3H), 1,31-1,25 (m, 1H), 0,72-0,66 (m, 1H), 0,61-0,55 (m, 2H), 0,41-0,37 (m, 1H). LC-MS m/z: 408,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,66 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(5-фтор-6-метилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
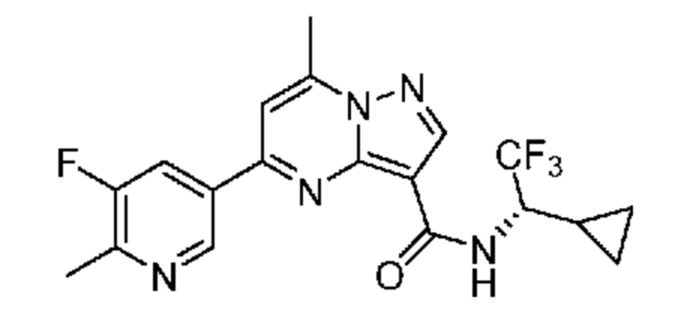
[00880] По общей методике E* (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (80 мг, 0,24 ммоля) и 5-бром-3-фтор-2-метилпиридин давали искомое соединение (8,8 мг, 9%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4): δ 9,14 (s, 1H), 8,66 (s, 1H), 8,34 (dd, J=10,5 Гц, 2,0 Гц, 1H), 7,83 (s, 1H), 4,46-4,43 (m, 1H), 2,96 (s, 3H), 2,64 (d, J=3,0 Гц, 3H),1,34-1,30 (m, 1H), 0,81-0,78 (m, 1H), 0,69-0,60 (m, 2H), 0,59-0,50 (m, 1H). LC-MS m/z: 408,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,70 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(6-метилпиридин-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
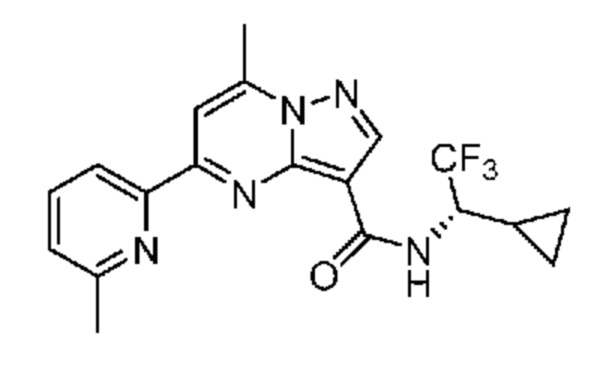
[00881] По общей методике F (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,15 ммоля) и 2-метил-6-(трибутилстаннил)пиридин давали искомое соединение (38 мг, 65%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 8,69 (s, 1H), 8,56 (d, J=10,0 Гц, 1H), 8,22 (d, J=7,5 Гц,1H), 8,16 (d, J=1,0 Гц, 1H), 8,00 (t, J=7,5 Гц, 1H), 7,50 (d, J=7,5 Гц,1H), 4,48~4,44 (m, 1H), 2,91 (s, 3H), 1,36-1,32 (m, 1H), 0,72-0,66 (m, 1H), 0,63-0,57 (m, 2H), 0,45-0,39 (m, 1H). LC-MS m/z: 390,1 [M+H]+. HPLC: Чистота (214 нм): 98,31%; tR=9,53 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(5-этинилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
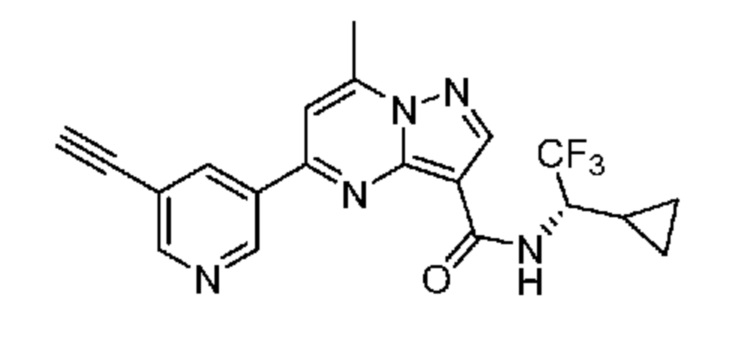
[00882] По общей методике D этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (721 мг, 2,97 ммоля) и 5-бромпиридин-3-илбороновая кислота давали этил-5-(5-бромпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (200 мг, 22%) в виде желтого твердого вещества. LC-MS m/z: 361,0 [M+H]+. tR=6,92 мин.
[00883] К раствору этил-5-(5-бромпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (150 мг, 0,41 ммоля) в CH3CN (5 мл) добавляли этинилтриметилсилан (61 мг, 0,62 ммоля), Et3N (84 мг, 0,83 ммоля), Pd(PPh3)2Cl2 (29 мг, 0,04 ммоля), CuI (4,5 мг, 0,04 ммоля) и PPh3 (33 мг, 0,3 ммоля). Смесь перемешивали в течение 18 ч при 80°C в атмосфере N2 и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (PE:EA=10:1~2:1) и получали этил-7-метил-5-(5-((триметилсилил)этинил)пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксилат (100 мг, 63%) в виде желтого твердого вещества. LC-MS m/z: 390,0 [M+H]+, tR=1,60 мин.
[00884] К раствору этил-7-метил-5-(5-((триметилсилил)этинил)пиридин-3-ил)пиразоло[1,5-a]пиримидин-3-карбоксилата (150 мг, 0,39 ммоля) в THF/MeOH/H2O (6 мл, 2/2/2) добавляли LiOH•2H2O (71 мг, 1,19 ммоля). Смесь перемешивали в течение 18 ч при 30°C и экстрагировали с помощью DCM (20 мл×3). Органические фазы сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и получали 5-(5-этинилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (100 мг, 91%) в виде желтого твердого вещества. LC-MS m/z: 279,1 [M+H]+, tR=1,01 мин.
[00885] По общей методике A 5-(5-этинилпиридин-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (100 мг, 0,36 ммоля) и (S)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (60 мг, 42%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,42 (d, J=2,0 Гц, 1H), 8,88 (d, J=1,5 Гц, 1H), 8,71 (s, 1H), 8,69 (t, J=2,0 Гц, 1H), 8,49 (d, J=9,0 Гц, 1H), 8,11 (s, 1H), 4,61 (s, 1H), 4,51-4,46 (m, 1H), 2,88 (s, 3H), 1,29-1,25 (m, 1H), 0,71-0,67 (m, 1H), 0,60-0,57 (m, 2H), 0,42-0,39 (m, 1H). LC-MS m/z: 400,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,36 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(6-(метоксиметокси)пиридин-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
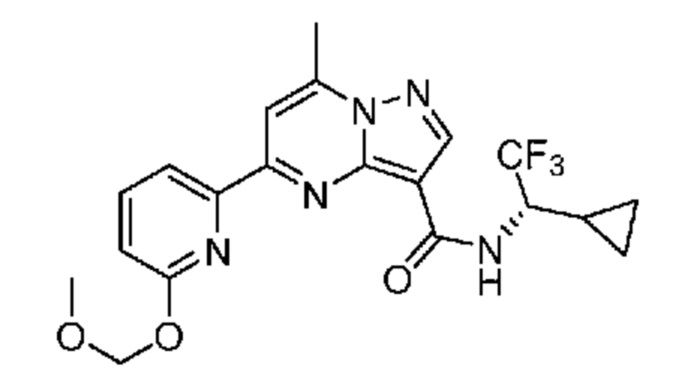
[00886] По общей методике E* (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 0,15 ммоля) и 2-бром-6-(метоксиметокси)пиридин (69 мг, 0,32 ммоля) давали искомое соединение (18 мг, 27%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,65 (s,1H), 8,15-8,12 (m, 2H), 7,97 (t, J=7,5 Гц, 1H), 7,06 (d, J=8,5 Гц, 1H), 5,73 (s, 2H), 4,47-4,44 (m,1H), 3,58 (s,3H), 2,96 (s, 3H), 1,38-1,33 (m,1H), 0,81-0,77 (m,1H), 0,70-0,65 (m,1H), 0,63-0,58 (m, 1H), 0,56-0,51 (m, 1H). LC-MS m/z: 436,1 [M+H]+, HPLC: Чистота (214 нм): >99%; tR=9,30 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3,5-диметилизотиазол-4-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
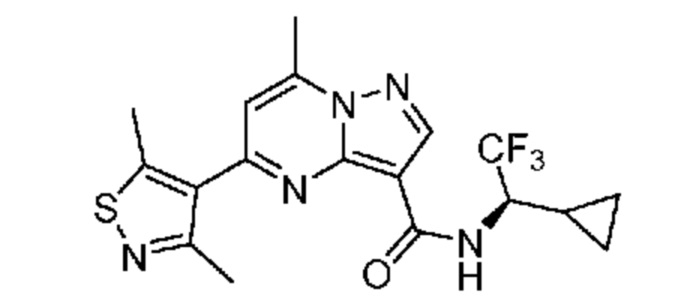
[00887] По общей методике F (R)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метил-5-(трибутилстаннил)пиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,12 ммоля) и 4-йод-3,5-диметилизотиазол давали искомое соединение (7,0 мг, 14%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,70 (s, 1H), 8,28 (d, J=9,5 Гц, 1H), 7,49 (s, 1H), 4,36-4,31 (m, 1H), 2,86 (s, 3H), 2,68 (s, 3H), 2,55 (s, 3H), 1,20-1,15 (m, 1H), 0,69-0,65 (m, 1H), 0,61-0,57(m, 1H), 0,54-0,50 (m, 1H), 0,31-0,26 (m, 1H). LC-MS m/z: 410,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=9,90 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(3,5-диметилизотиазол-4-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
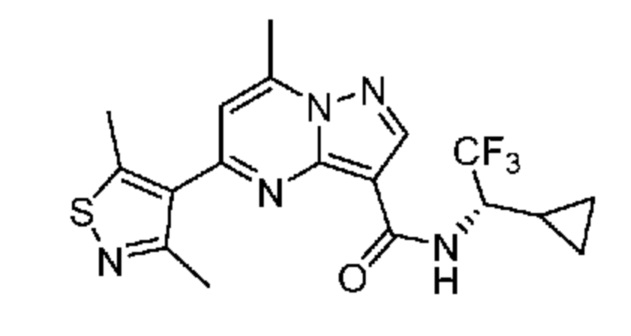
[00888] По общей методике F (S)-N-(1-циклопропил-2,2,2-трифторэтил)-7-метил-5-(трибутилстаннил)пиразоло[1,5-a]пиримидин-3-карбоксамид (70 мг, 0,12 ммоля) и 4-йод-3,5-диметилизотиазол давали искомое соединение (4,0 мг, 10%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,70 (s, 1H), 8,28 (d, J=9,5 Гц, 1H), 7,49 (s, 1H), 4,36-4,31 (m, 1H), 2,86 (s, 3H), 2,68 (s, 3H), 2,55 (s, 3H), 1,20-1,15 (m, 1H), 0,69-0,65 (m, 1H), 0,61-0,57(m, 1H), 0,54-0,50 (m, 1H), 0,31-0,26 (m, 1H). LC-MS m/z: 410,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=9,90 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(5-метилизотиазол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
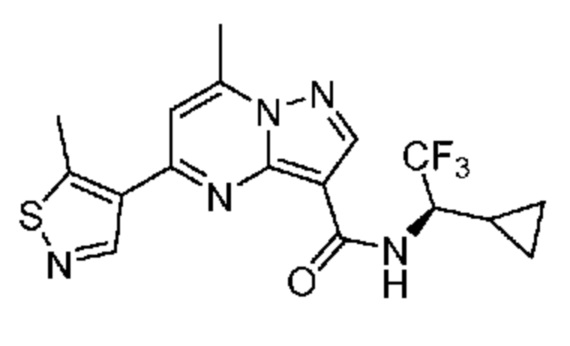
[00889] По общей методике E* (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и 4-бром-5-метилизотиазол давали искомое соединение (18 мг, 20%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 9,01 (s, 1H), 8,63 (s, 1H), 7,61 (s, 1H), 4,34-4,28 (m, 1H), 2,98 (s, 3H), 2,92 (s, 3H), 1,26-1,21 (m, 1H), 0,81-0,77 (m, 1H), 0,66-0,56 (m, 2H), 0,45-0,41(m, 1H). LC-MS m/z: 396,0 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,80 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(5-метилизотиазол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
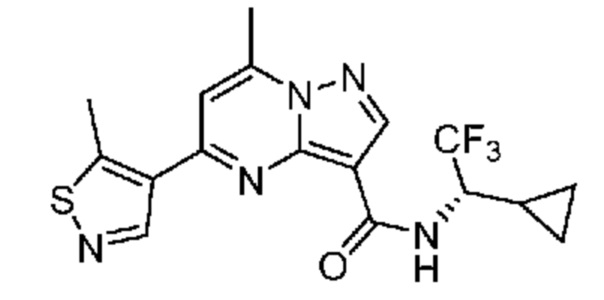
[00890] По общей методике E* (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,30 ммоля) и 4-бром-5-метилизотиазол давали искомое соединение (1,8 мг, 2,0%) в виде белого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 9,01 (s, 1H), 8,63 (s, 1H), 7,61 (s, 1H), 4,34-4,28 (m, 1H), 2,98 (s, 3H), 2,92 (s, 3H), 1,26-1,21 (m, 1H), 0,81-0,77 (m, 1H), 0,66-0,56 (m, 2H), 0,45-0,41(m, 1H). LC-MS m/z: 396,0 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,80 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(3-метилизотиазол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
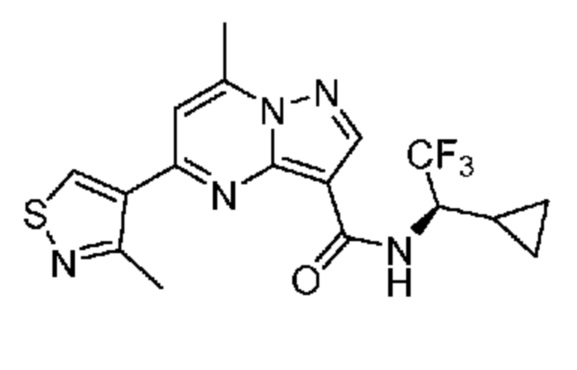
[00891] По общей методике E* (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (110 мг, 0,33 ммоля) и 4-бром-3-метилизотиазол давали искомое соединение (35 мг, 26%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,78 (s, 1H), 8,67 (s, 1H), 8,25 (d, J=9,5 Гц, 1H), 7,76 (s, 1H), 4,32-4,28 (m, 1H), 2,85 (s, 3H), 2,84 (s, 3H), 1,23-1,18 (m, 1H), 0,74-0,62 (m, 2H), 0,61-0,56 (m, 1H), 0,34-0,28 (m, 1H). LC-MS m/z: 396,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,54 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-7-метил-5-(3-метилизотиазол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
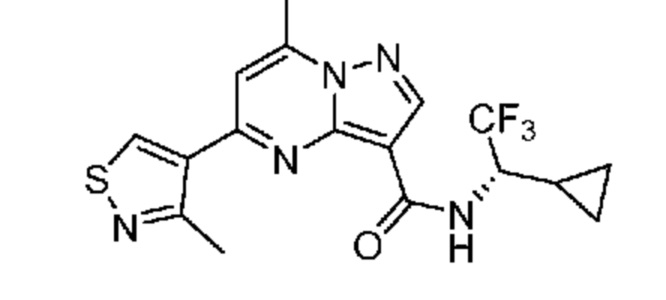
[00892] По общей методике E* (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (110 мг, 0,33 ммоля) и 4-бром-3-метилизотиазол давали искомое соединение (75 мг, 58%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6): δ 9,78 (s, 1H), 8,67 (s, 1H), 8,25 (d, J=9,5 Гц, 1H), 7,76 (s, 1H), 4,32-4,28 (m, 1H), 2,85 (s, 3H), 2,84 (s, 3H), 1,23-1,18 (m, 1H), 0,74-0,62 (m, 2H), 0,61-0,56 (m, 1H), 0,34-0,28 (m, 1H). LC-MS m/z: 396,0 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=8,54 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(5-изопропил-1,3,4-оксадиазол-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
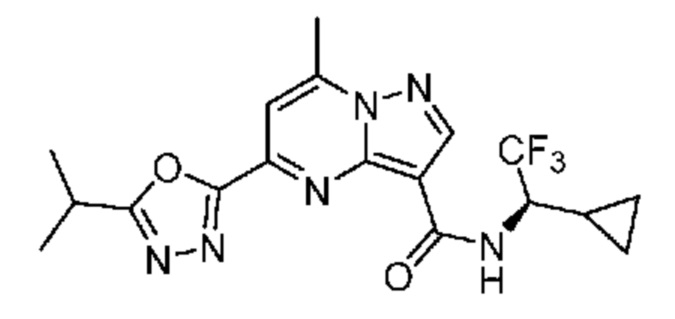
[00893] Смесь (R)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамида (100 мг, 0,30 ммоля), Pd(PPh3)2Cl2•CH2Cl2 (25 мг, 0,03 ммоля) и Et3N (100 мг, 0,9 ммоля) в MeOH (10 мл) перемешивали при 65°C в течение 6 ч при равном 10 атм. давлении CO. Реакционную смесь фильтровали и концентрировали в вакууме и получали неочищенную (R)-3-((1-циклопропил-2,2,2-трифторэтил)карбамоил)-7-метилпиразоло[1,5-a]пиримидин-5-карбоновую кислоту (100 мг, 93%) в виде желтого твердого вещества. LC-MS m/z: 343,1 [M+H]+, Чистота (214 нм): 90%; tR=1,23 мин.
[00894] Смесь (R)-3-((1-циклопропил-2,2,2-трифторэтил)карбамоил)-7-метилпиразоло [1,5-a]пиримидин-5-карбоновой кислоты (100 мг, 0,30 ммоля) и тионилхлорида (100 мг, 0,9 ммоля) в MeOH (10 мл) перемешивали при 65°C в течение 1 ч. Реакционную смесь концентрировали в вакууме и очищали с помощью хроматографии на силикагеле (EA) и получали метил (R)-3-((1-циклопропил-2,2,2-трифторэтил)карбамоил)-7-метилпиразоло[1,5-a]пиримидин-5-карбоксилат (70 мг, 67%) в виде желтого твердого вещества. LC-MS m/z: 357,1 [M+H]+, Чистота (214 нм): 93%; tR=1,76 мин.
[00895] Смесь метил (R)-3-((1-циклопропил-2,2,2-трифторэтил)карбамоил)-7-метилпиразоло[1,5-a]пиримидин-5-карбоксилата (55 мг, 0,15 ммоля) и гидразингидрата (55 мг, 1,5 ммоля) в EtOH (10 мл) перемешивали при RT в течение 1 ч. Реакционную смесь концентрировали в вакууме и получали неочищенный (R)-N-(1-циклопропил-2,2,2-трифторэтил)-5-(гидразинкарбонил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (50 мг, 97%) в виде желтого твердого вещества. LC-MS m/z: 357,1 [M+H]+, Чистота (214 нм): 90%; tR=1,46 мин.
[00896] Смесь (R)-N-(1-циклопропил-2,2,2-трифторэтил)-5-(гидразинкарбонил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамида (50 мг, 0,14 ммоля), 1,1,1-триметокси-2-метилпропана (50 мг, 0,28 ммоля) в HOAc (5 мл) перемешивали при RT в течение 4 ч. Затем добавляли EA (50 мл) и промывали насыщенным раствором NaHCO3 (50 мл) и рассолом (50 мл). Органический слой сушили над безводным Na2SO4 и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ и получали искомое соединение (10 мг, 15%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,80 (s, 1H), 8,41 (d, J=9,5 Гц, 1H), 8,00 (s, 1H), 4,65-4,60 (m, 1H), 3,42-3,36 (m, 1H), 2,92 (s, 3H), 3,41 (d, J=7,0 Гц, 6H), 1,26-1,20 (m, 1H), 0,69-0,65 (m, 1H), 0,62-0,57 (m, 1H) 0,53-0,49 (m, 2H). LC-MS m/z: 409,1 [M+H]+, HPLC: Чистота (214 нм): >99%; tR=8,52 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(5-изопропил-1,3,4-оксадиазол-2-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
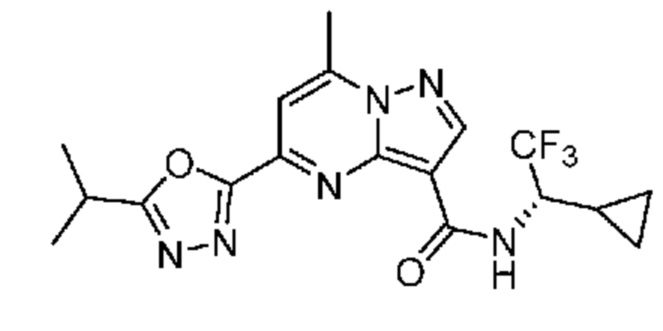
[00897] Смесь (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамида (150 мг, 0,45 ммоля), Pd(PPh3)2Cl2•CH2Cl2 (37 мг, 0,05 ммоля), Et3N (138 мг, 1,35 ммоля) в MeOH (10 мл) перемешивали при 65°C в течение 6 ч при равном 10 атм. давлении CO. Реакционную смесь фильтровали и концентрировали в вакууме и получали неочищенную (S)-3-((1-циклопропил-2,2,2-трифторэтил)карбамоил)-7-метилпиразоло[1,5-a]пиримидин-5-карбоновую кислоту (150 мг, 93%) в виде желтого твердого вещества. LC-MS m/z: 343,1 [M+H]+, Чистота (214 нм): 95%; tR=1,23 мин.
[00898] Смесь (S)-3-((1-циклопропил-2,2,2-трифторэтил)карбамоил)-7-метилпиразоло[1,5-a]пиримидин-5-карбоновой кислоты (150 мг, 0,45 ммоля) и тионилхлорида (145 мг, 0,9 ммоля) в MeOH (10 мл) перемешивали при 65°C в течение 1 ч. Реакционную смесь концентрировали в вакууме и очищали с помощью хроматографии на силикагеле (EA) и получали метил-(S)-3-((1-циклопропил-2,2,2-трифторэтил)карбамоил)-7-метилпиразоло[1,5-a]пиримидин-5-карбоксилат (120 мг, 75%) в виде белого твердого вещества. LC-MS m/z: 357,1 [M+H]+, Чистота (214 нм): 92%; tR=1,76 мин.
[00899] Смесь метил-(S)-3-((1-циклопропил-2,2,2-трифторэтил)карбамоил)-7-метилпиразоло[1,5-a]пиримидин-5-карбоксилата (120 мг, 0,34 ммоля) и гидразингидрата (120 мг, 3,40 ммоля) в EtOH (10 мл) перемешивали при RT в течение 1 ч. Реакционную смесь концентрировали в вакууме и получали неочищенный (S)-N-(1-циклопропил-2,2,2-трифторэтил)-5-(гидразинкарбонил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 80%) в виде желтого твердого вещества. LC-MS m/z: 357,1 [M+H]+, Чистота (214 нм): 97%, tR=1,46 мин.
[00900] Смесь (S)-N-(1-циклопропил-2,2,2-трифторэтил)-5-(гидразинкарбонил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамида (100 мг, 0,28 ммоля), 1,1,1-триметокси-2-метилпропана (100 мг, 0,56 ммоля) в HOAc (5 мл) перемешивали при RT в течение 16 ч. Затем добавляли EA (50 мл) и промывали насыщенным раствором NaHCO3 (50 мл) и рассолом (50 мл). Органический слой сушили над безводным Na2SO4 и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ и получали искомое соединение (10 мг, 8,0%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,80 (s, 1H), 8,41 (d, J=9,5 Гц, 1H), 8,00 (s, 1H), 4,65-4,60 (m, 1H), 3,42-3,36 (m, 1H), 2,92 (s, 3H), 3,41 (d, J=7,0 Гц, 6H), 1,27-1,21 (m, 1H), 0,70-0,64 (m, 1H), 0,61-0,56 (m, 1H) 0,54-0,49 (m, 2H). LC-MS m/z: 409,1 [M+H]+, HPLC: Чистота (214 нм): >99%; tR=8,52 мин.
(R)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(5-изопропил-1,2,4-оксадиазол-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
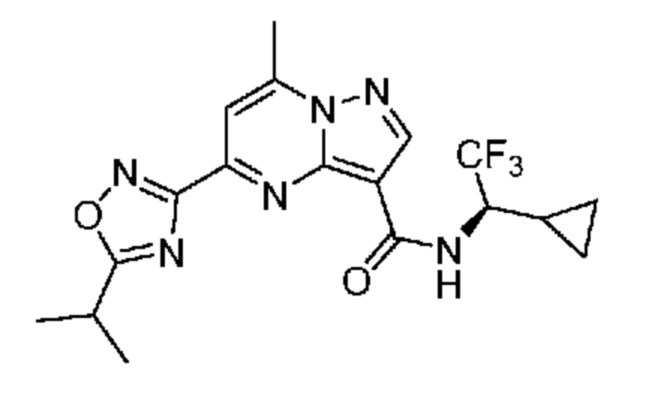
[00901] Смесь этил-5-хлор-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (2 г, 8,34 ммоля), Pd2(dba)3 (480 мг, 0,834 ммоля), dppf (924 мг, 1,67 ммоля) и Zn(CN)2 (1,96 г, 16,73 ммоля) продували с помощью N2, затем добавляли DMF (25 мл). Суспензию продували с помощью N2, нагревали при 90°C в течение 4 ч и затем охлаждали до RT и фильтровали. Фильтрат разбавляли водой (100 мл) и экстрагировали с помощью EA (80 мл×3). Органические фазы промывали с помощью H2O (50 мл×3), рассолом (100 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью хроматографии на силикагеле (PE/EA=6/4, об./об.) и получали этил-5-циано-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (1,50 г, 78%) в виде белого твердого вещества. LC-MS m/z: 231,1 [M+H].
[00902] Смесь этил-5-циано-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (500 мг, 2,17 ммоля), гидроксиламингидрохлорида (308 мг, 4,34 ммоля) и Et3N (657 мг, 6,51 ммоля) в 10 мл DMF перемешивали при 90°C в течение 17 ч и разбавляли водой (40 мл). Суспензию фильтровали и получали этил-5-(N-гидроксикарбамимидоил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (524 мг, 91%) в виде белого твердого вещества. LC-MS m/z: 264,1 [M+H]+.
[00903] Смесь этил-5-(N-гидроксикарбамимидоил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилата (514 г, 1,95 ммоля), изомасляного ангидрида (926 мг, 5,86 ммоля) в 15 мл DCM перемешивали при RT в течение 1 ч и концентрировали в вакууме. Остаток разбавляли с помощью 15 мл DMSO и нагревали при 90°C в течение 24 ч. Реакционную смесь разбавляли с помощью H2O (80 мл) и суспензию фильтровали и получали этил-5-(5-изопропил-1,2,4-оксадиазол-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (390 мг, 96%) в виде белого твердого вещества. LC-MS m/z: 316,1 [M+H]+.
[00904] По общей методике B* этил-5-(5-изопропил-1,2,4-оксадиазол-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксилат (580 мг, 1,84 ммоля) давал 5-(5-изопропил-1,2,4-оксадиазол-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту (529 мг, 100%) в виде коричневого твердого вещества. LC-MS m/z: 288,1 [M+H]+.
[00905] По общей методике A 5-(5-изопропил-1,2,4-оксадиазол-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (110 мг, 0,38 ммоля) и (R)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (39 мг, 25%) в виде серого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,78 (s, 1H), 8,52 (d, J=10,0 Гц, 1H), 7,89 (s, 1H), 4,67-4,61 (m, 1H), 3,48-3,40 (m, 1H), 2,92 (s, 3H), 1,43 (d, J=7,0 Гц, 6H), 1,25-1,21 (m, 1H), 0,66-0,56 (m, 3H), 0,50-0,46 (m, 1H). LC-MS m/z: 409,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,26 мин.
(S)-N-(1-Циклопропил-2,2,2-трифторэтил)-5-(5-изопропил-1,2,4-оксадиазол-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
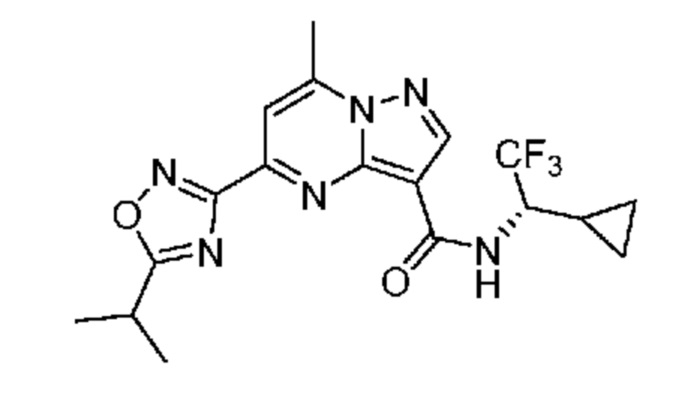
[00906] По общей методике A 5-(5-изопропил-1,2,4-оксадиазол-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,10 ммоля) и (S)-1-циклопропил-2,2,2-трифторэтанамингидрохлорид давали искомое соединение (4,7 мг, 11%) в виде серого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,70 (s, 1H), 7,85 (s, 1H), 4,55-4,49 (m,1H), 3,44-3,39 (m, 1H), 2,96 (s, 3H), 1,51 (d, J=7,0 Гц, 6H), 1,38-1,32 (m, 1H), 0,74-0,60 (m, 3H), 0,54-0,51 (m, 1H). LC-MS m/z: 409,1 [M+H]+. HPLC: Чистота (214 нм): > 99%; tR=9,26 мин.
(S)-5-Циано-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
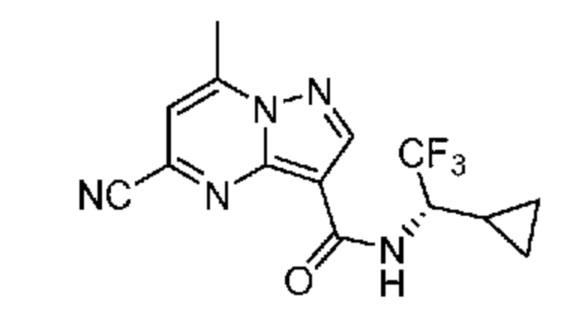
[00907] К раствору (S)-5-хлор-N-(1-циклопропил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамида (150 мг, 0,45 ммоля) в 3 мл диоксана при RT в атмосфере N2 добавляли Zn(CN)2 (158 мг, 1,355 ммоля) и Pd(PPh3)4 (52 мг, 0,045 ммоля). Смесь перемешивали при 110°C в течение 15 ч, затем охлаждали и концентрировали и очищали с помощью хроматографии на силикагеле (EA: PE=1:1) и получали искомое соединение (7 мг, 4,8%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, MeOD-d4) δ 8,81 (s, 1H), 7,60 (s, 1H), 4,38-4,34 (m, 1H), 2,96 (s, 3H), 1,35-1,31 (m, 1H), 0,81-0,78 (m, 1H), 0,70-0,67 (m, 1H), 0,62-0,59 (m, 1H), 0,50-0,48 (m, 1H). LC-MS m/z: 339,1 [M+H]+. HPLC: Чистота (214 нм): 100%; tR=8,68 мин.
(S)-5-(2-Циано-5-фторфенил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
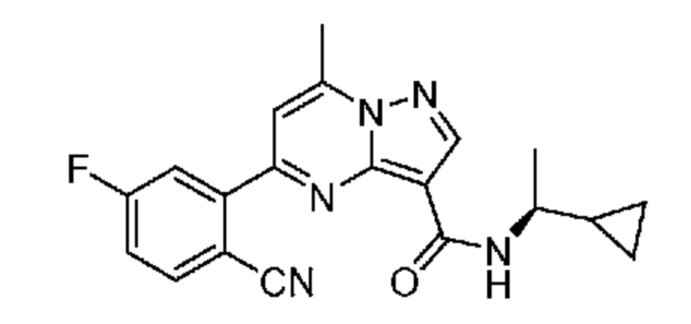
[00908] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид и (2-циано-5-фторфенил)бороновая кислота давали искомое соединение (55 мг, 60%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,67 (s, 1H), 8,25 (dd, J=8,5 Гц, 5,5 Гц, 1H), 8,10 (dd, J=10,0 Гц, 2,5 Гц, 1H), 8,01 (d, J=8,0 Гц, 1H), 7,85 (s, 1H), 7,69 (td, J=8,5 Гц, J=2,5 Гц, 1H), 3,55-3,52 (m, 1H), 2,89 (s, 3H), 1,29 (d, J=6,5 Гц, 1H), 1,12-1,09 (m, 1H), 0,47-0,44 (m, 1H), 0,38-0,32 (m, 1H), 0,32-0,25 (m, 1H). LC-MS m/z: 364,1 [M+H]+. HPLC: Чистота (214 нм): 96%; tR=8,20 мин.
(S)-5-(2-Циано-6-фторфенил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
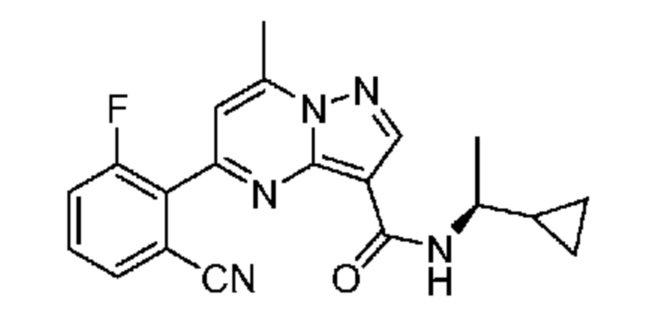
[00909] По общей методике E* (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид и 2-бром-3-фторбензонитрил давали искомое соединение (22 мг, 21%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,69 (s, 1H), 8,03 (d, J=7,5 Гц, 1H), 7,94 (d, J=8,0 Гц, 1H), 7,91-7,82 (m, 2H), 7,63 (d, J=3,0 Гц, 1H), 3,60-3,55 (m, 1H), 2,90 (s, 3H), 1,24 (d, J=6,5 Гц, 3H), 1,03-0,99 (m, 1H), 0,45-0,41 (m, 1H), 0,37-0,31 (m,2H), 0,26-0,24 (m, 1H). LC-MS m/z: 364,2 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,05 мин.
(S)-5-(2-Циано-3-фторфенил)-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
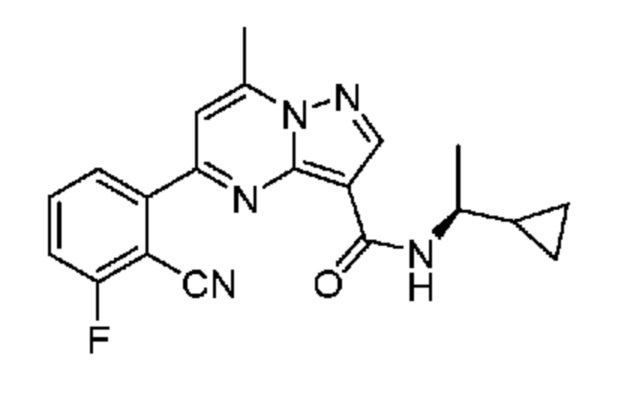
[00910] По общей методике D (S)-5-хлор-N-(1-циклопропилэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид и (2-циано-3-фторфенил)бороновая кислота давали искомое соединение (46 мг, 49%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,67 (s, 1H), 8,04-8,03 (m, 2H), 7,98 (d, J=8,5 Гц, 1H), 7,83 (s, 1H), 7,83-7,79 (m, 1H), 3,55-3,54 (m, 1H), 2,89 (s, 3H), 1,29 (d, J=6,5 Гц, 1H), 1,11-1,09 (m, 1H), 0,47-0,46 (m, 1H), 0,37-0,32 (m, 2H), 0,26-0,24 (m, 1H). LC-MS m/z: 364,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,12 мин.
(S)-5-(2-Циано-3-фторфенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
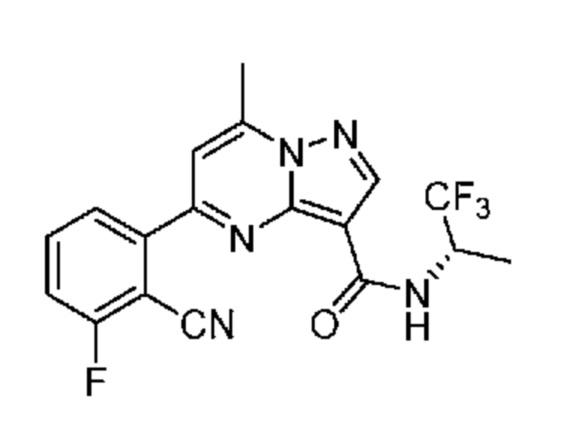
[00911] По общей методике D (S)-5-хлор-N-(1-метил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (79 мг, 0,26 ммоля) и (2-циано-3-фторфенил)бороновая кислота давали искомое соединение (65 мг, 64%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,77 (s, 1H), 8,08 (d, J=9,5 Гц, 1H), 8,05-8,01 (m, 2H), 7,86 (s, 1H), 7,82-7,78 (m, 1H), 5,01-4,99 (m, 1H), 2,91 (s, 3H), 1,44 (d, J=7,0 Гц, 3H). LC-MS m/z: 392,0 [M+H]+. HPLC: Чистота (214 нм): 97%; tR=8,26 мин.
(S)-5-(2-Циано-6-фторфенил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
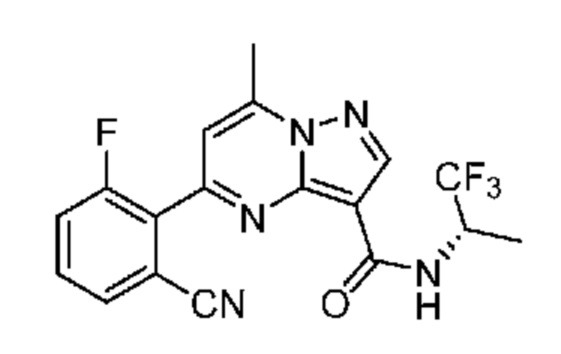
[00912] По общей методике E* (S)-5-хлор-N-(1-метил-2,2,2-трифторэтил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид (100 мг, 0,32 ммоля) и 2-бром-3-фторбензонитрил давали искомое соединение (64 мг, 41%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,79 (s, 1H), 8,13 (d, J=9,5 Гц, 1H), 8,03 (d, J=7,5 Гц, 1H), 7,92-7,83 (m, 2H), 7,68 (d, J=3,0 Гц, 1H), 4,98-4,94 (m, 1H), 2,91 (s, 3H), 1,39 (d, J=6,5 Гц, 3H). LC-MS m/z: 392,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,22 мин.
(S)-5-(5-Изопропил-1,2,4-оксадиазол-3-ил)-7-метил-N-(1,1,1-трифторпропан-2-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
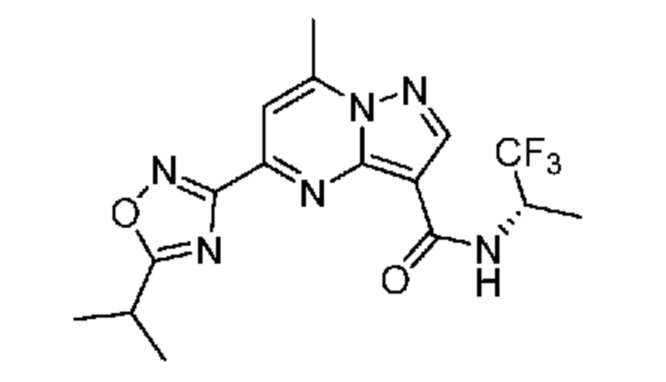
[00913] По общей методике A 5-(5-изопропил-1,2,4-оксадиазол-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,10 ммоля) и (S)-1,1,1-трифторпропан-2-амин (22 мг, 0,15 ммоля) давали искомое соединение (6,5 мг, 15%) в виде белого твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,79 (s, 1H), 8,54 (d, J=9,0 Гц, 1H), 7,88 (d, J=1,0 Гц, 1H), 4,95 (q, J=8,0 Гц, 1H), 3,47-3,41 (m, 1H), 2,92 (s, 3H), 1,43 (d, J=7,0 Гц, 9H). LC-MS m/z: 383,1 [M+H]+. HPLC: Чистота (214 нм): >99%; tR=8,83 мин.
(S)-N-(1-Циклопропилэтил)-5-(5-изопропил-1,2,4-оксадиазол-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоксамид
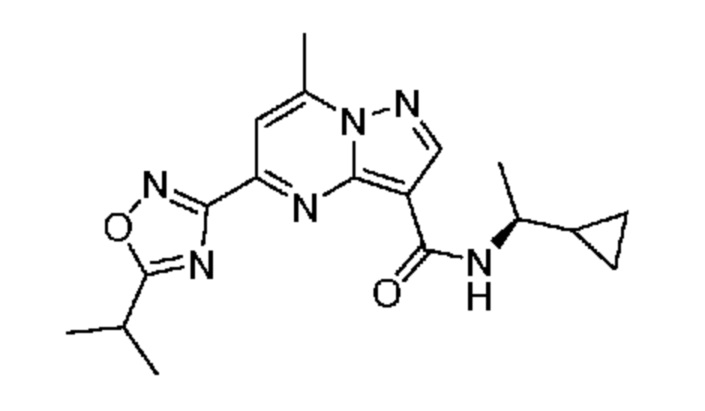
[00914] По общей методике A 5-(5-изопропил-1,2,4-оксадиазол-3-ил)-7-метилпиразоло[1,5-a]пиримидин-3-карбоновая кислота (30 мг, 0,10 ммоля) и (S)-1-циклопропилэтан-1-амин давали искомое соединение (8,8 мг, 23%) в виде красного твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 8,69 (s, 1H), 8,14 (d, J=7,5 Гц, 1H), 7,84 (s, 1H), 3,77-3,73 (m, 1H), 3,47-3,41 (m, 1H), 2,91 (s, 3H), 1,43 (d, J=7,0 Гц, 6H), 1,26 (d, J=6,5 Гц, 3H), 1,03-0,98 (m, 1H), 0,50-0,42 (m, 3H), 0,29-0,27 (m, 1H). LC-MS m/z: 355,2 [M+H]+. HPLC: Чистота (254 нм): 96%; tR=8,73 мин.
Пример 2 - Исследование биологической активности
[00915] Исследовали способность типичных соединений активировать глюкоцереброзидазу (Gcase). Экспериментальные методики и результаты приведены ниже.
Часть I: Методика исследования
[00916] Аликвоты объемом 484 мкл 1,0 мг/мл раствора фосфатидилсерина (PS) (Sigma P7769) в хлороформе выпаривали в потоке азота в течение 1 ч. Липидную пленку растворяли в течение 4 мин при энергичном взбалтывании в 40 мл смеси 176 мМ K2HPO4/50 мМ лимонная кислота (pH 4,7), содержащей 7,5 мкл Triton X-100, что давало смешанный мицеллярный препарат, содержащий 0,32 мМ Triton и 0,37 мол.% PS. 4-Метилумбеллиферил-бета-D-гликопиранозид (ACROS-337025000) растворяли в мицеллярном растворе до конечной концентрации, равной 2 мМ, для использования в качестве субстрата для реакции.
[00917] Исследуемые соединения из 10 мМ исходных растворов разбавляли до желательных концентраций диметилсульфоксидом (DMSO) и 0,41 мкл смеси соединения с DMSO добавляли к 100 мкл мицеллярного раствора, содержащего 10 нМ GCase и 100 нМ сапозина C (Enzo ALX-201-262-C050). Предварительную инкубацию проводили в течение 30 мин при комнатной температуре, после чего реакцию инициировали путем объединения 25 мкл раствора субстрата с 25 мкл смеси соединения/GCase/сапозин. Реакция протекала в течение 15 мин при комнатной температуре и ее останавливали путем добавления 150 мкл 1M глицина, pH 12,5. За завершением реакции следили путем измерения интенсивности флуоресценции (возбуждение: 365 нм; испускание: 440 нм) с помощью прибора SpectraMax i3 (Molecular Devices). Исследуемые соединения изучали при конечной концентрации, равной 1,0 и 0,1 мкМ, и затем 8-точечные зависимости доза-ответ получали с использованием 3-кратных разведений до максимальной конечной концентрации, равной 5 мкМ.
Часть II: Результаты
[00918] Ниже в таблицах 3A, 3B и 4 приведены характеристики активации Gcase для исследуемых соединений, а также cLogP, PSA и растворимость соединения в воде. Для экспериментов, в которых исследуемое соединение использовали при концентрации, равной 1,0 мкМ, символ "+" указывает на составляющую менее 30% активацию Gcase; символ "++" указывает на активацию Gcase в диапазоне от 30% до 60%; и символ "+++" указывает на активацию Gcase, превышающую 60%. Для экспериментов, в которых исследуемое соединение использовали при концентрации, равной 0,1 мкМ, символ "*" указывает на составляющую менее 10% активацию Gcase; символ "**" указывает на активацию Gcase в диапазоне от 10% до 20%; и символ "***" указывает на активацию Gcase, превышающую 20%.
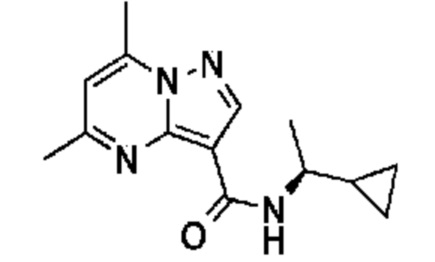
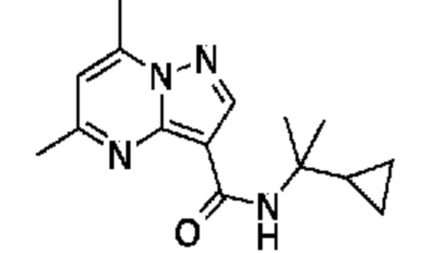
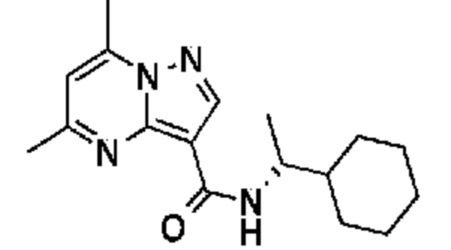
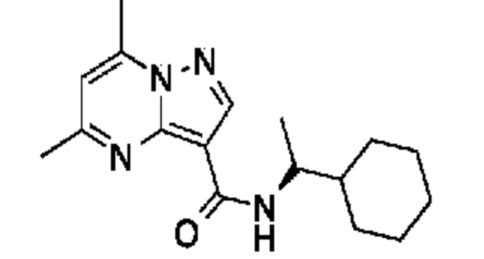
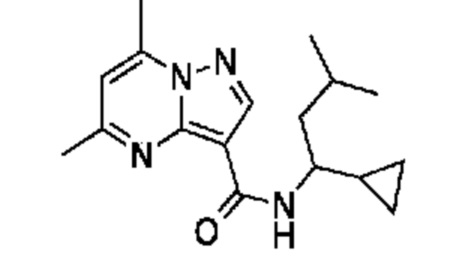
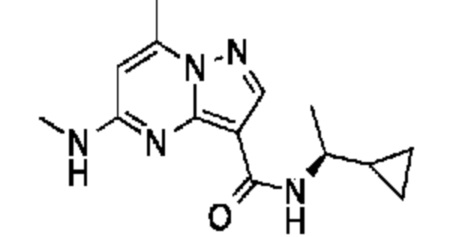
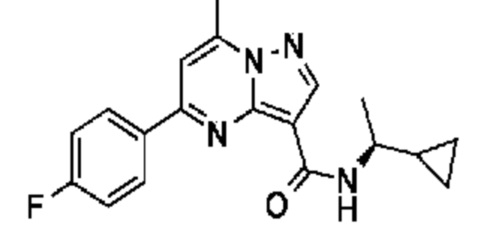
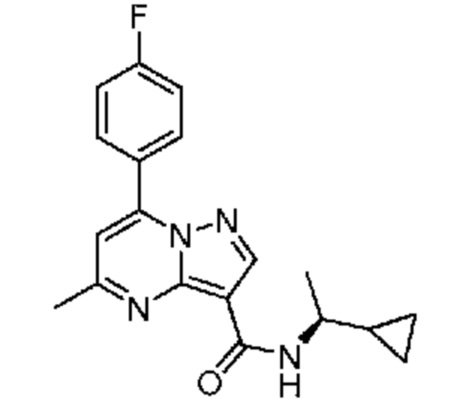
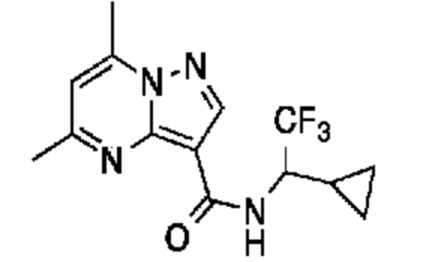
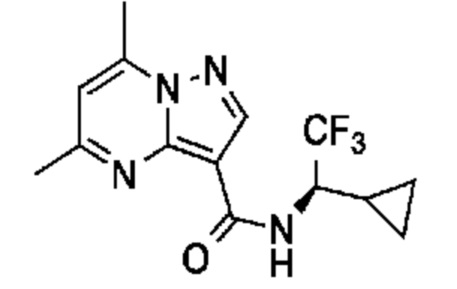
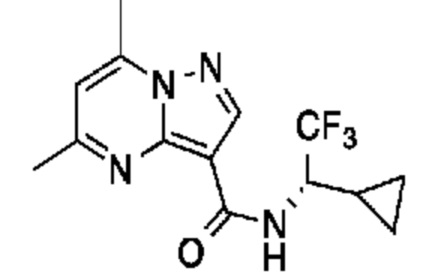
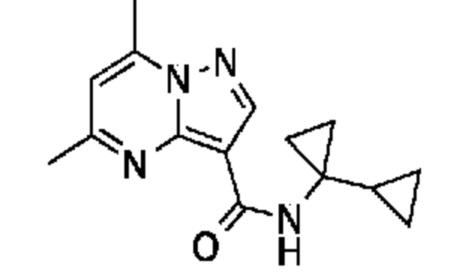
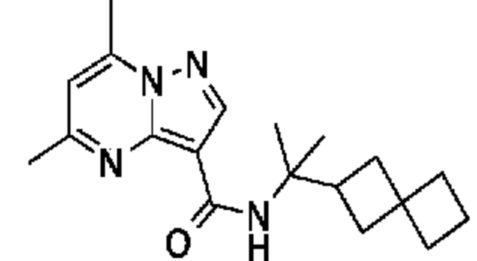
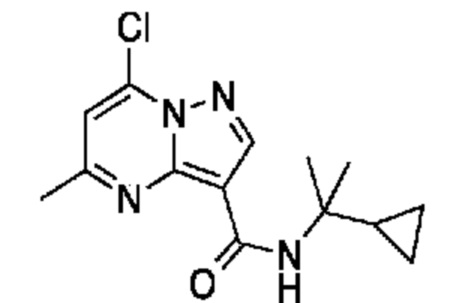
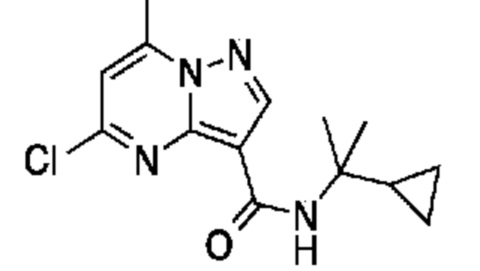
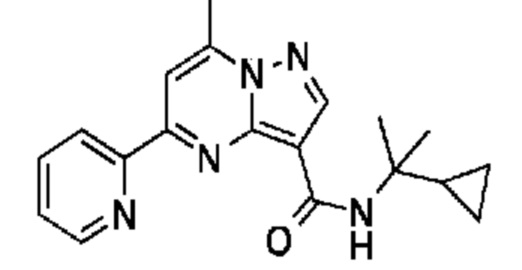
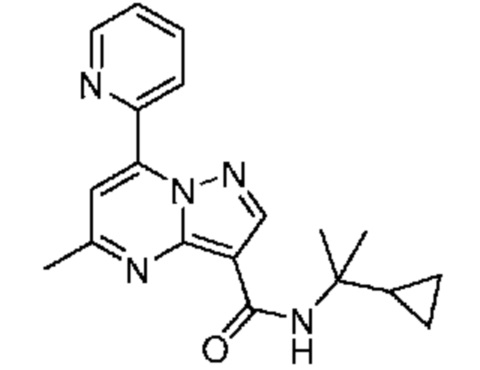
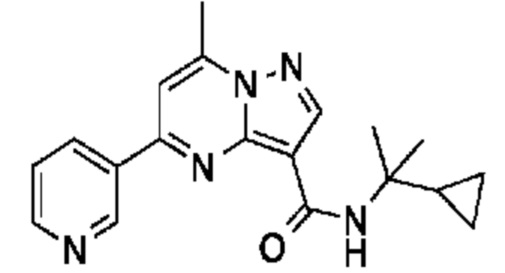
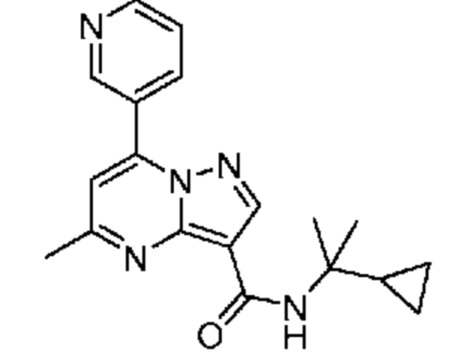
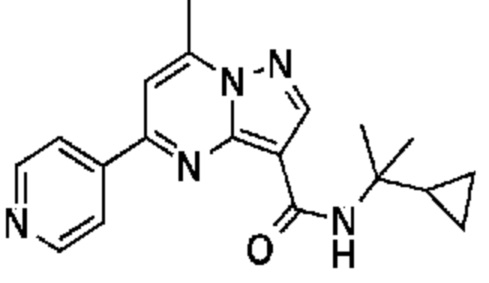
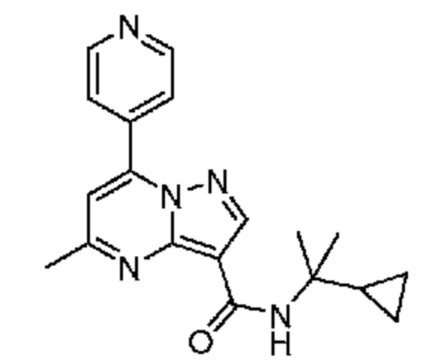
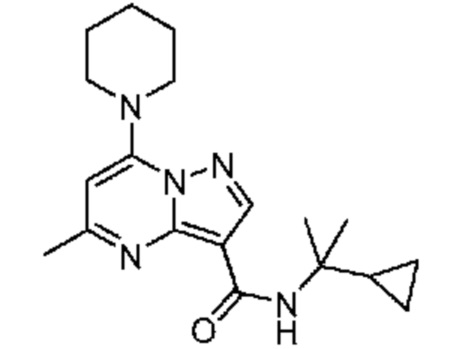
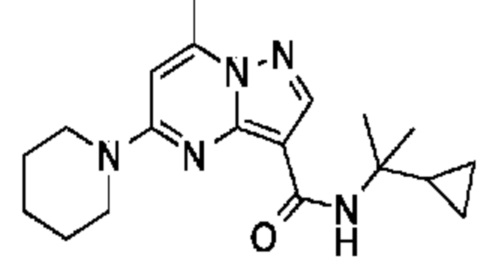
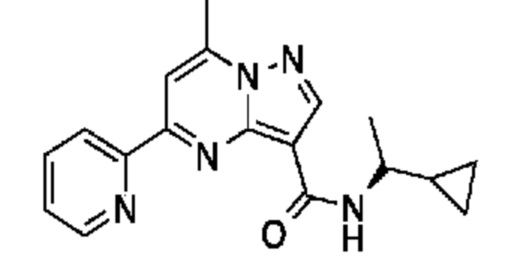
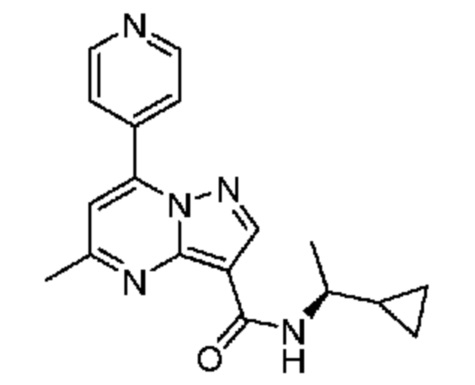
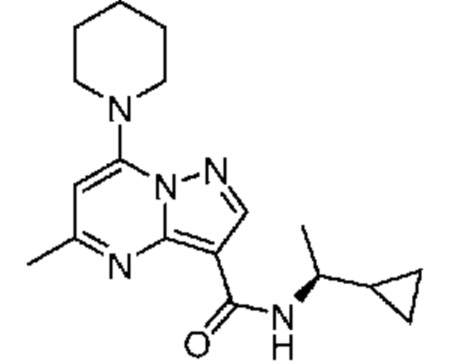
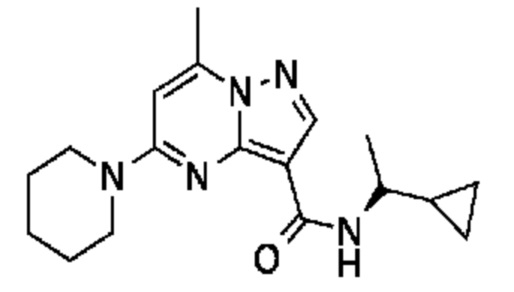
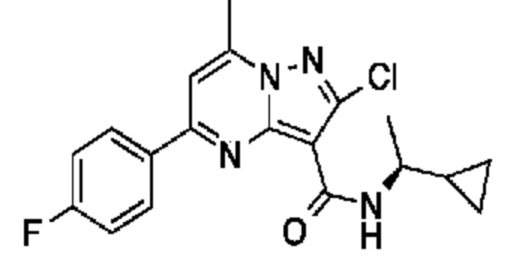
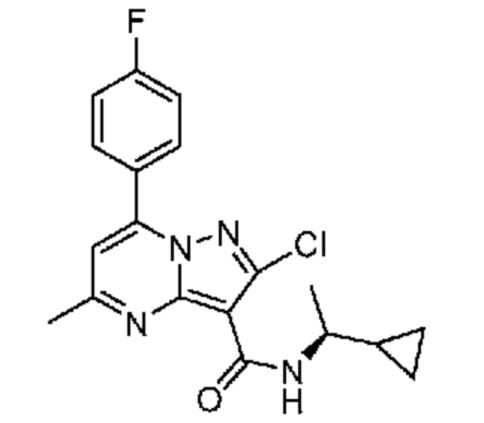
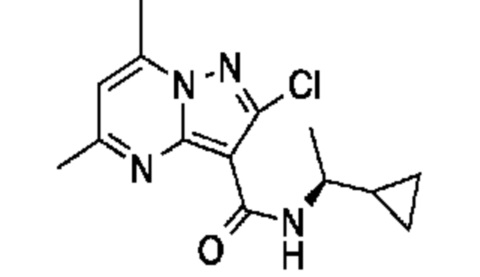
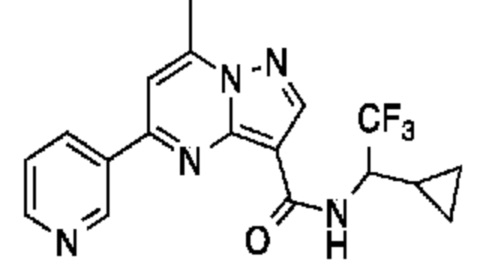
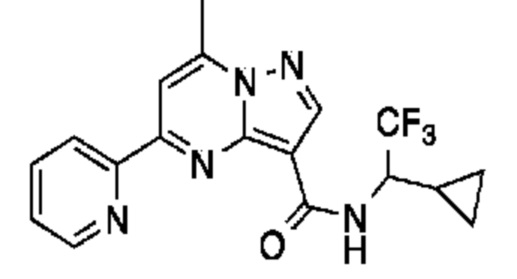
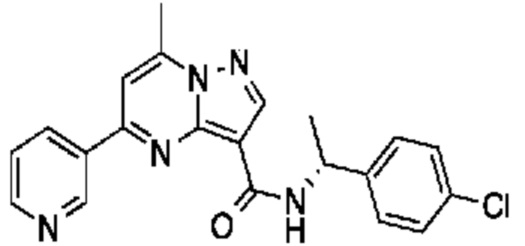
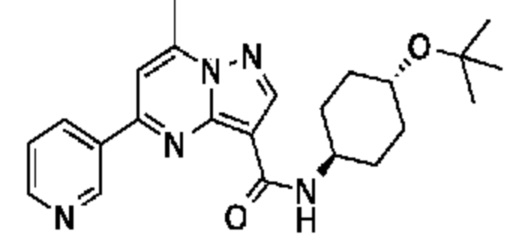
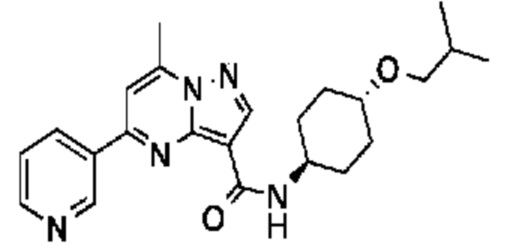
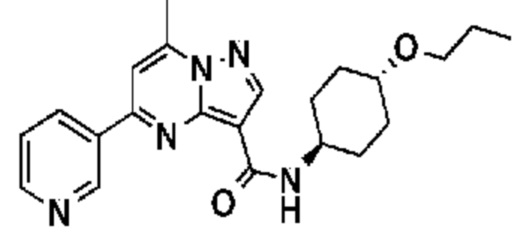
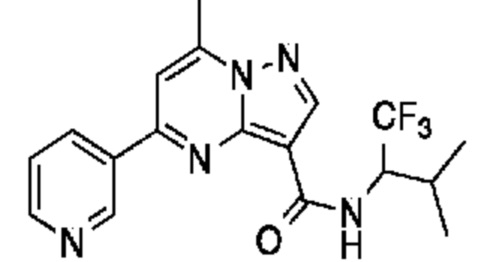
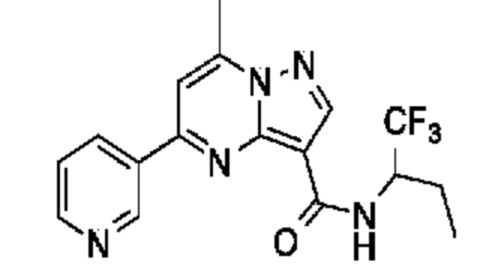
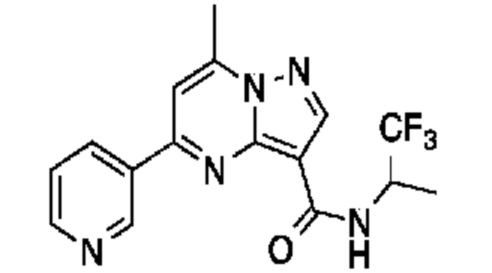
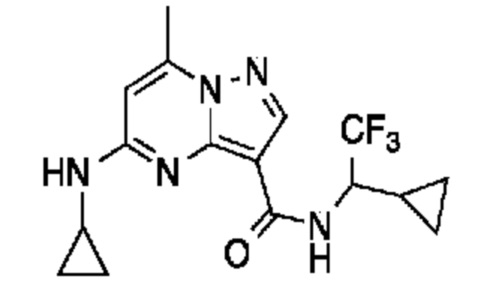
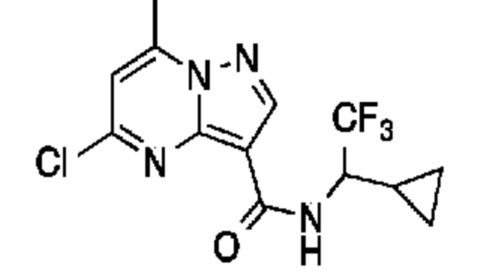
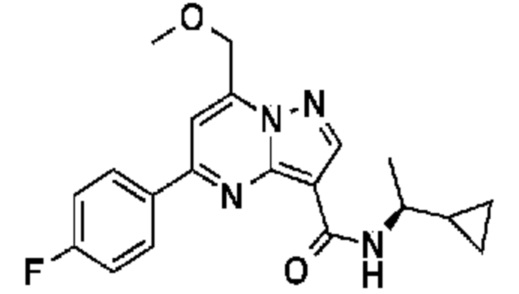
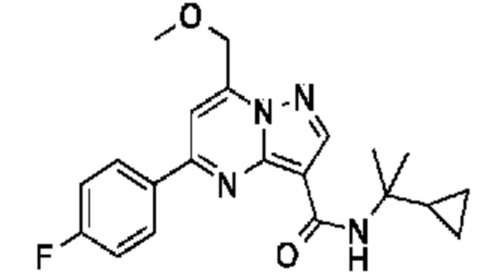
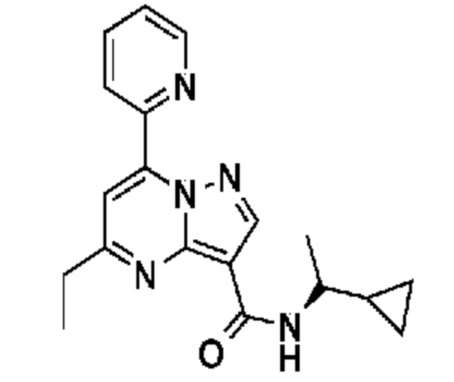
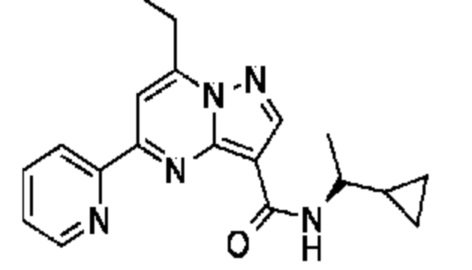
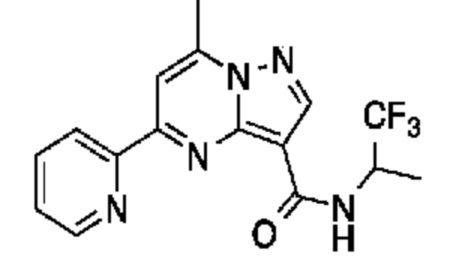
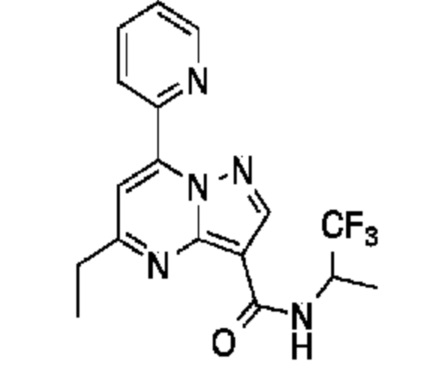
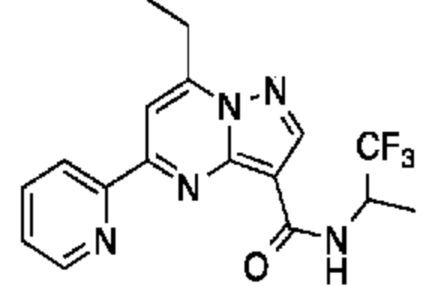
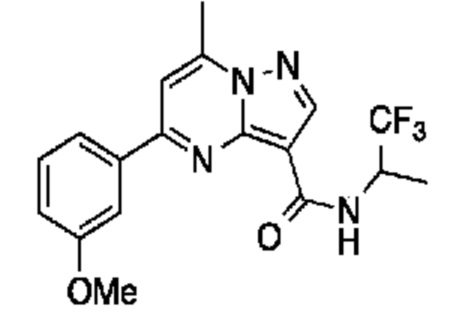
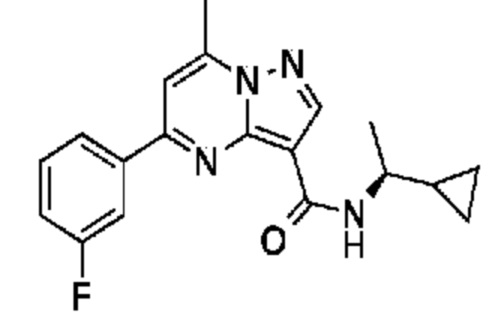
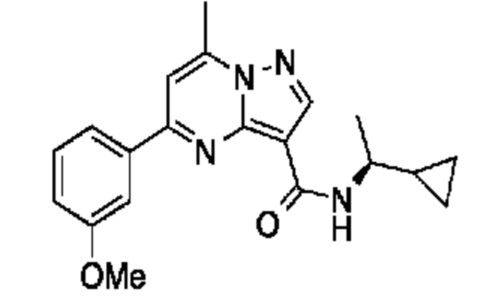
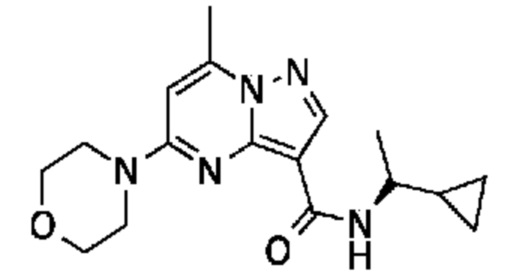
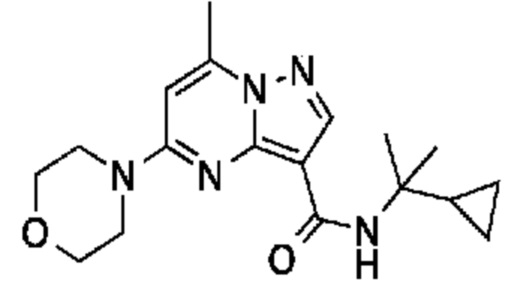
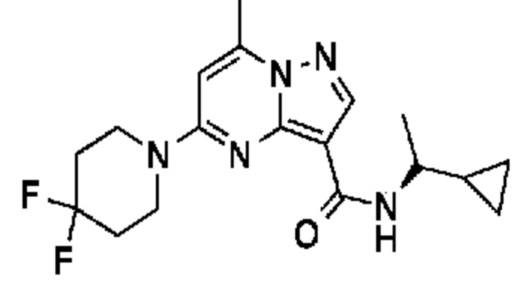
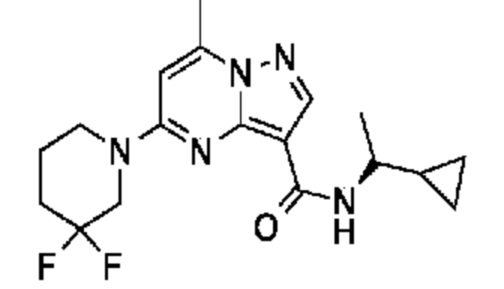
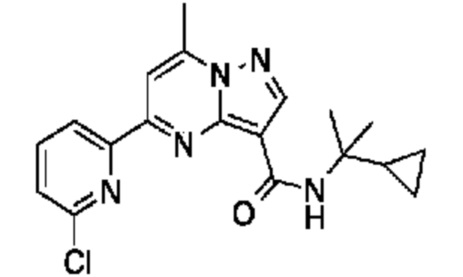
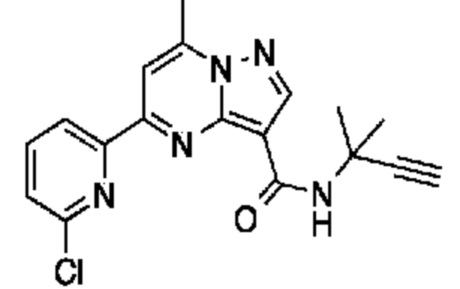
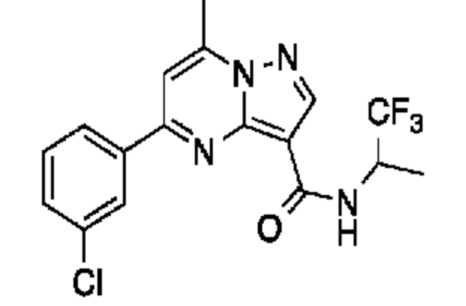
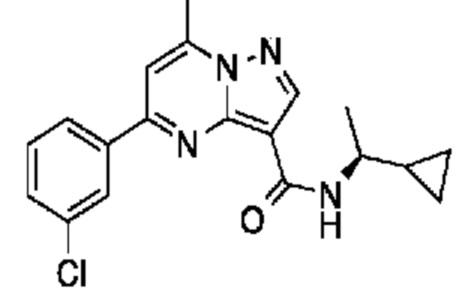
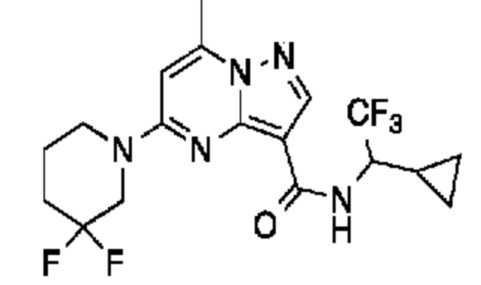
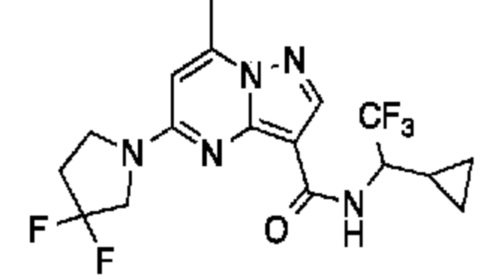
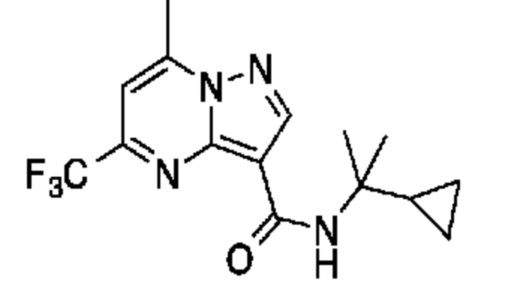
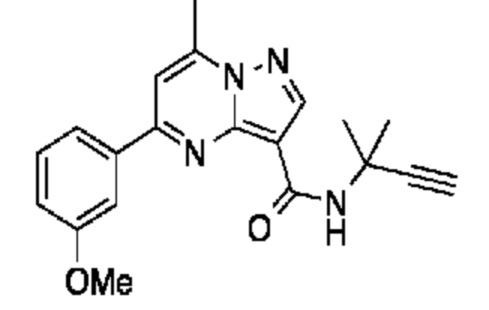
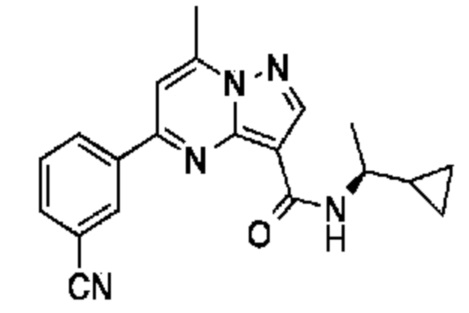
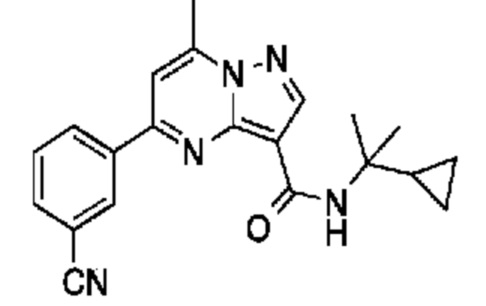
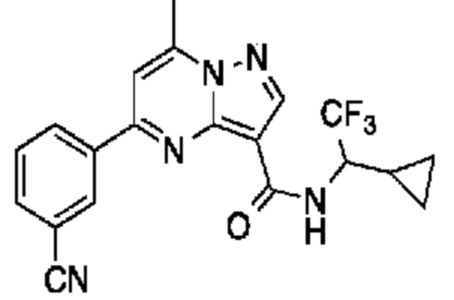
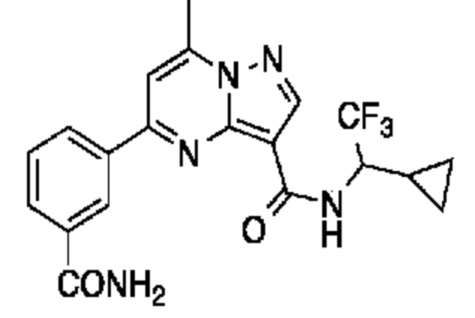
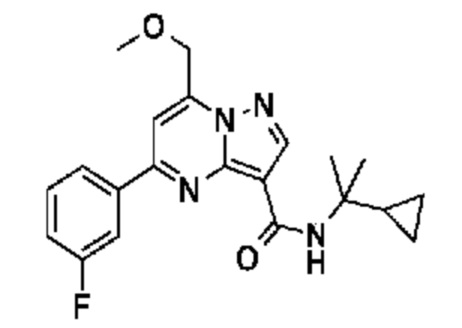
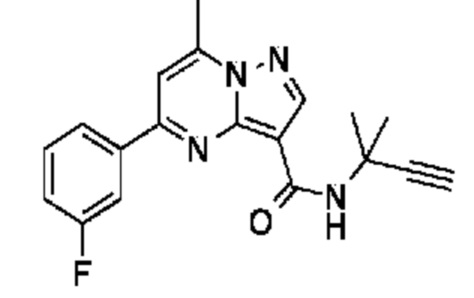
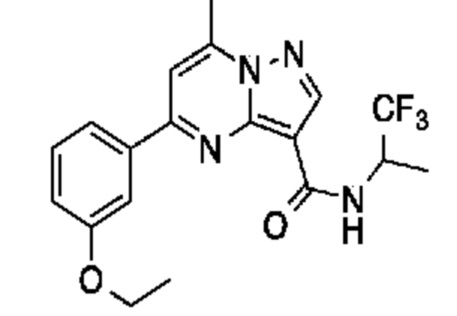
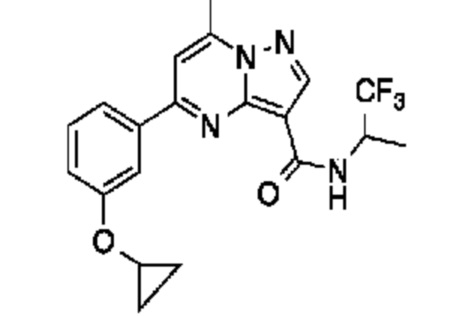
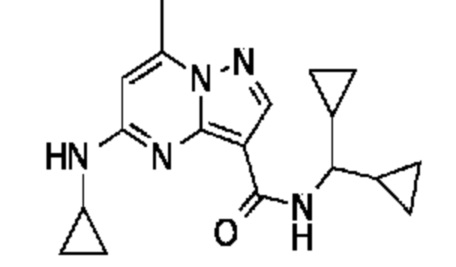
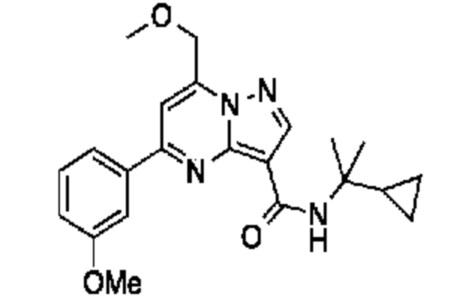
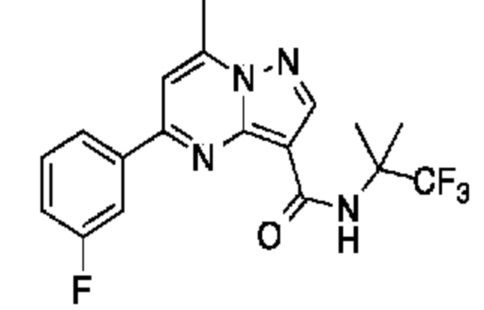
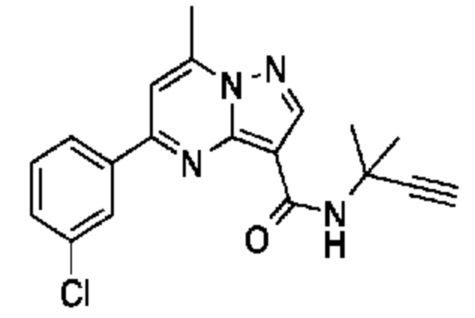
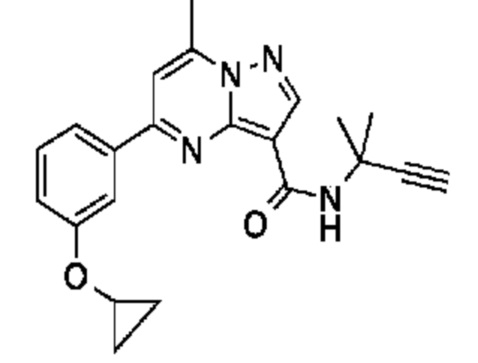
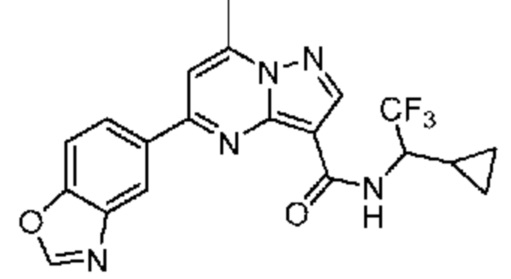
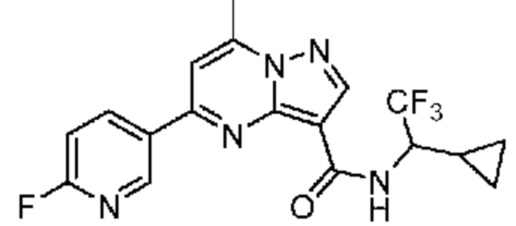
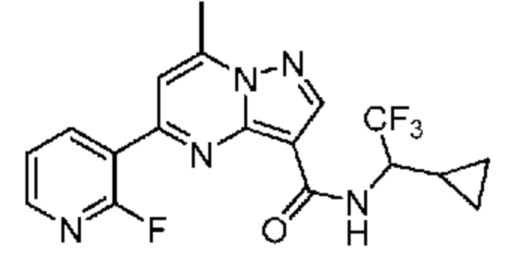
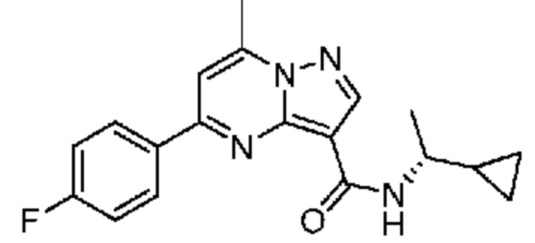
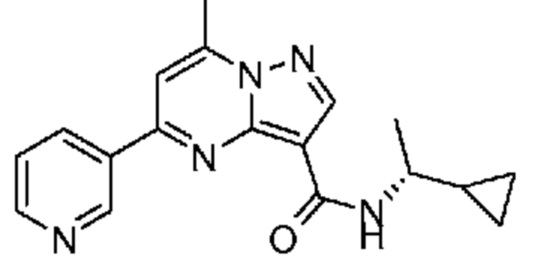
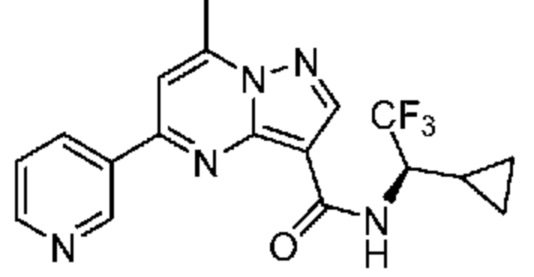
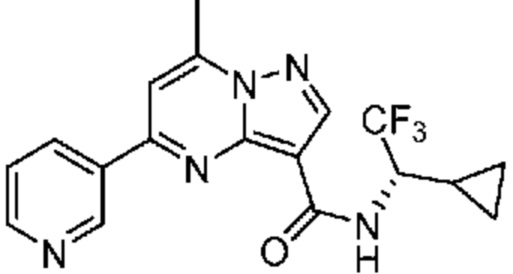
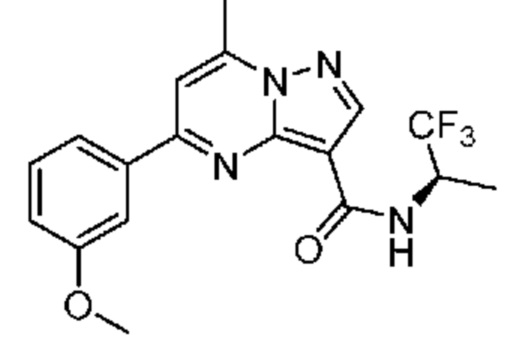
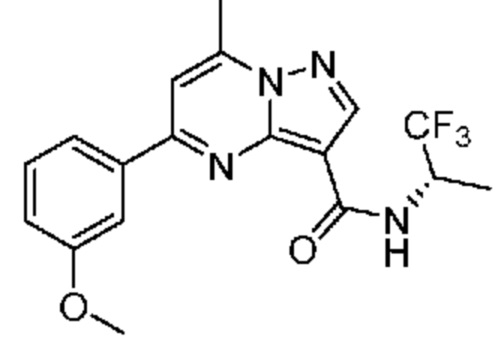
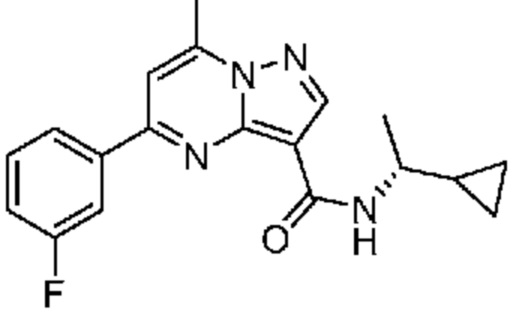
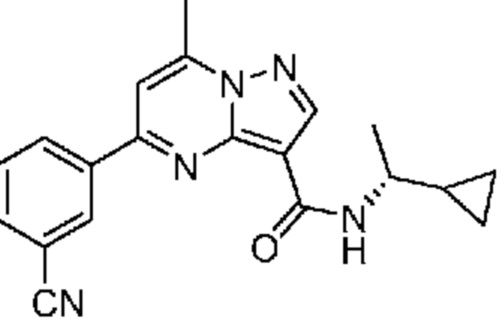
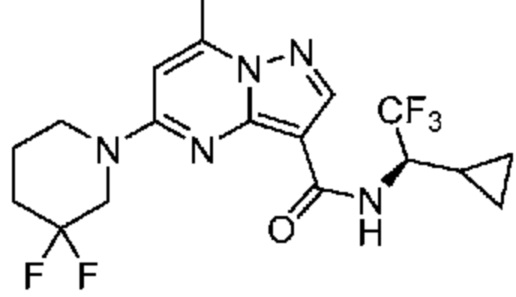
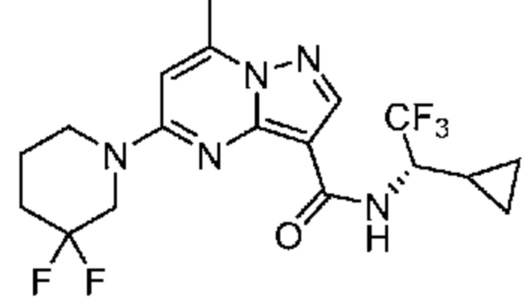
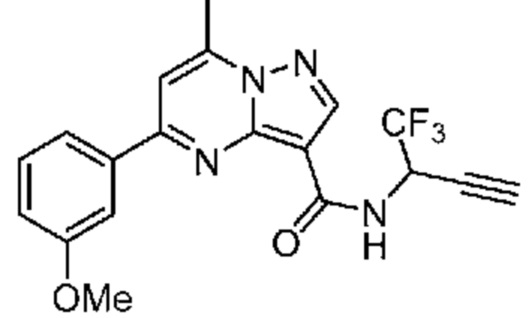
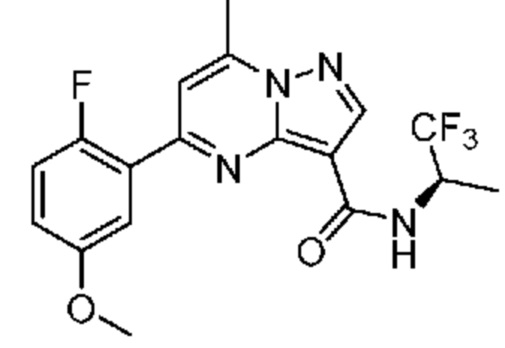
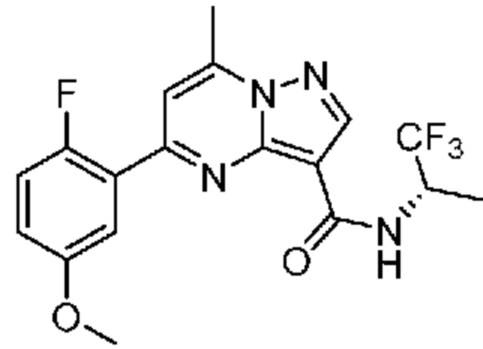
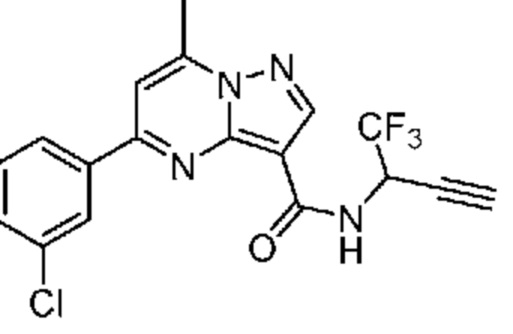
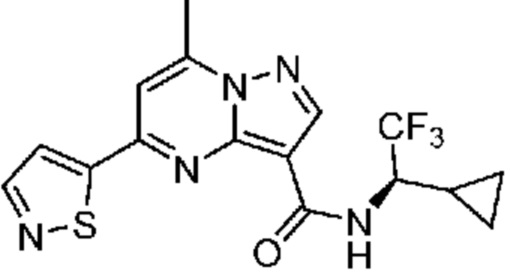
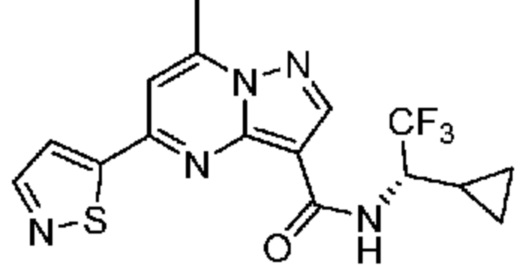
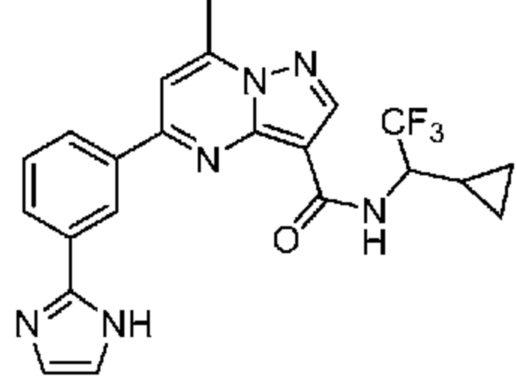
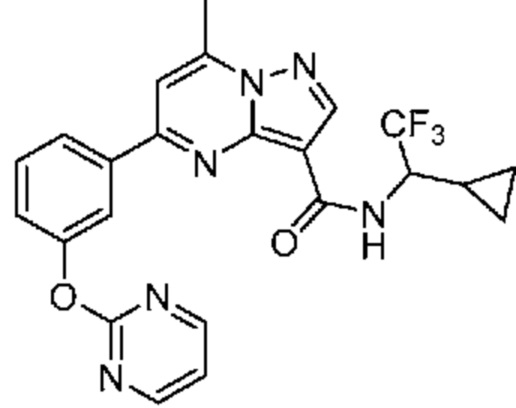
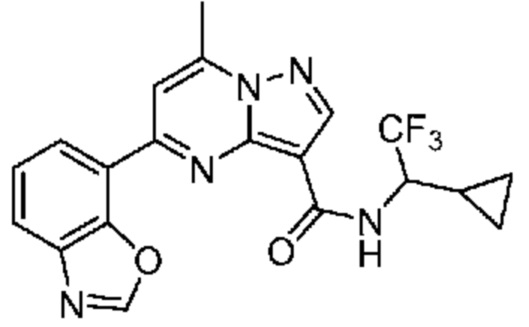
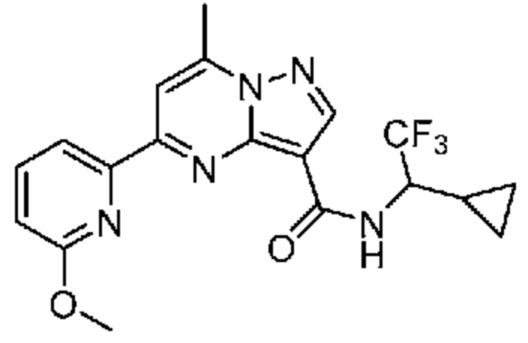
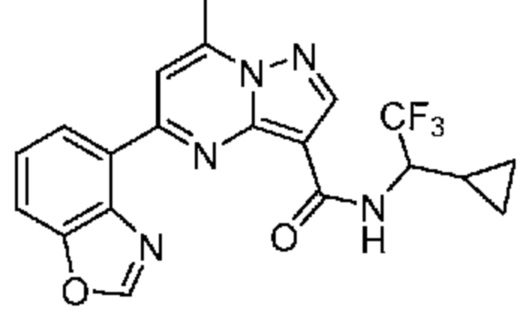
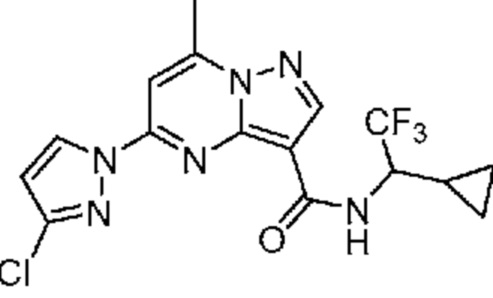
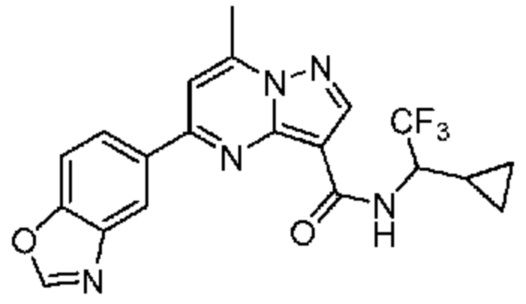
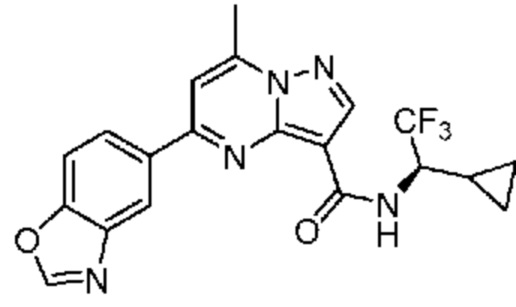
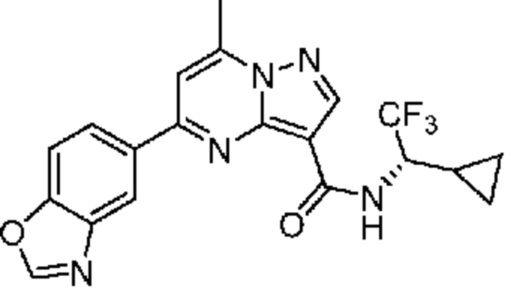
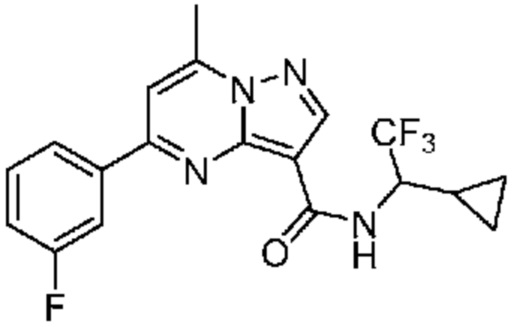
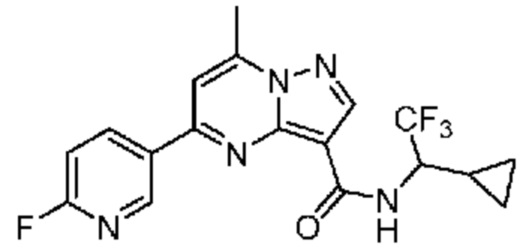
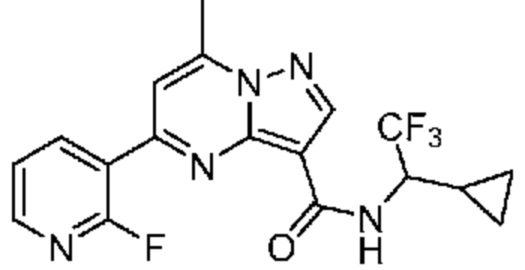
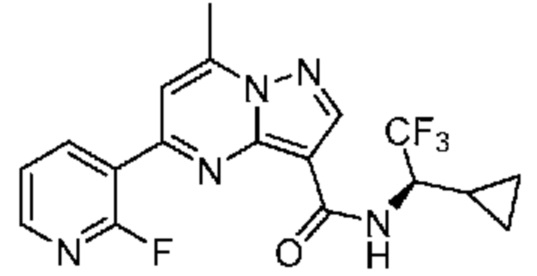
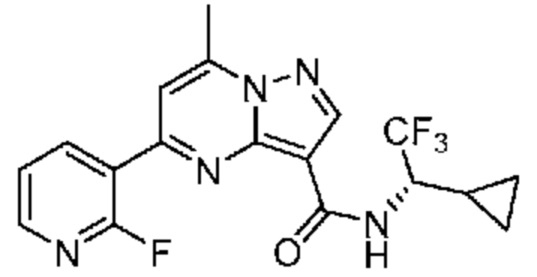
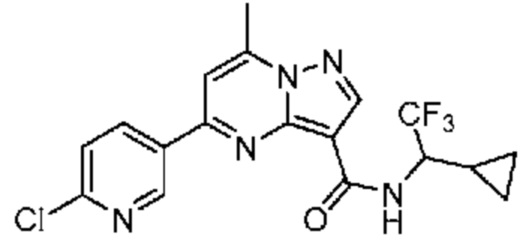
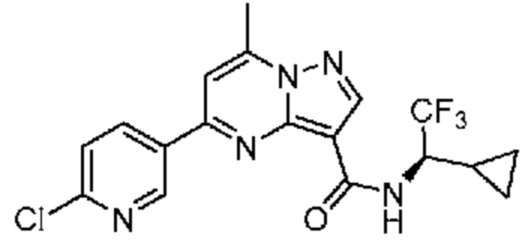
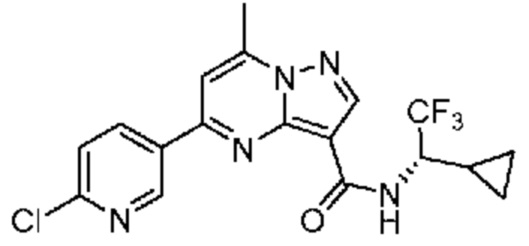
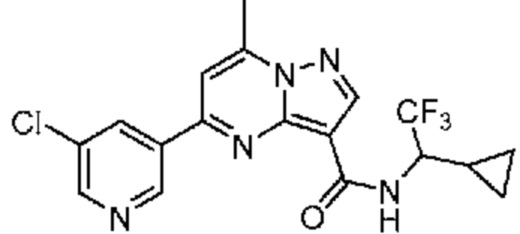
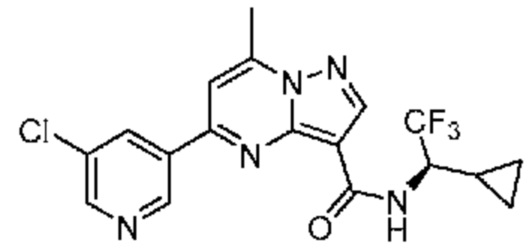
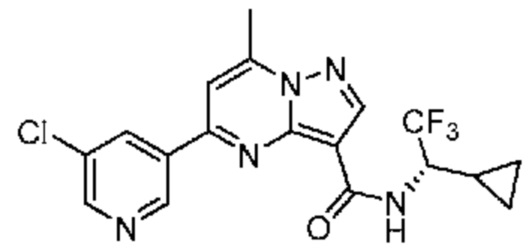
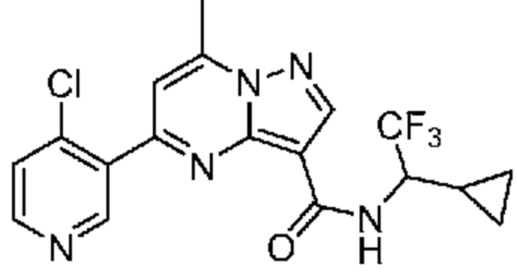
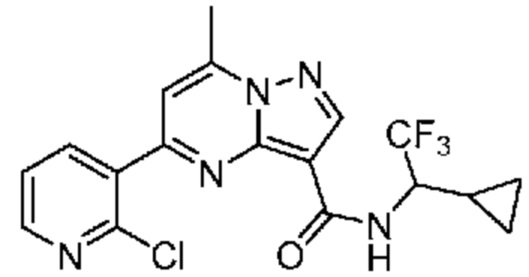
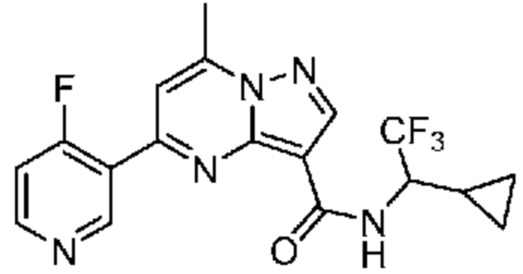
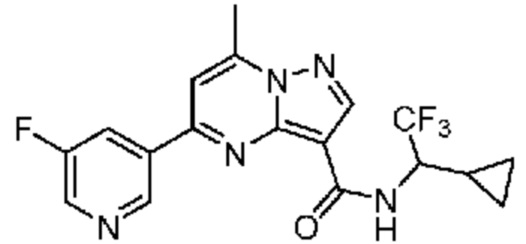
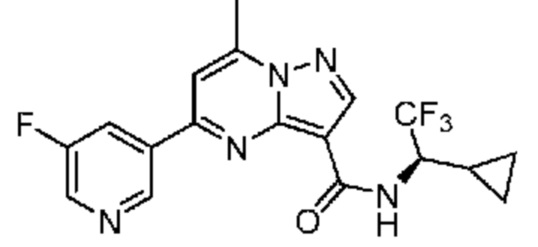
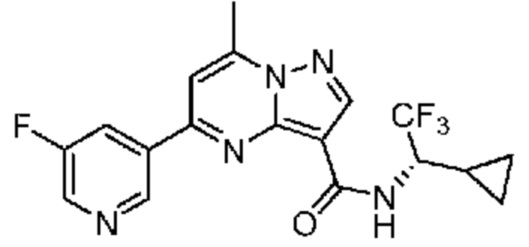
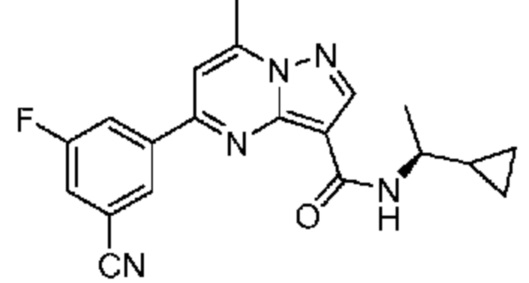
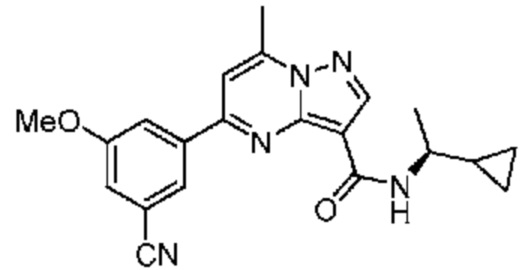
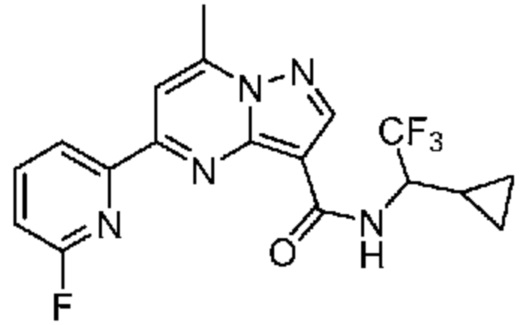
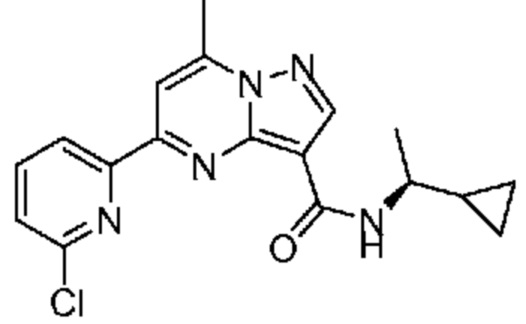
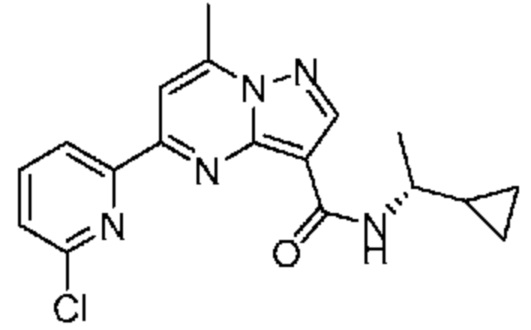
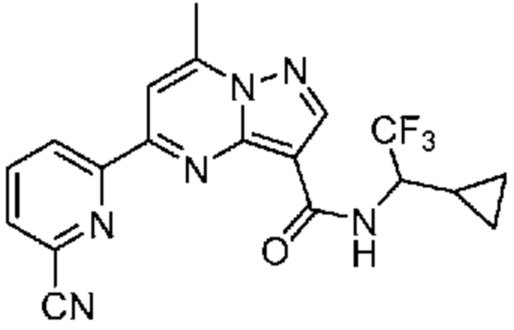
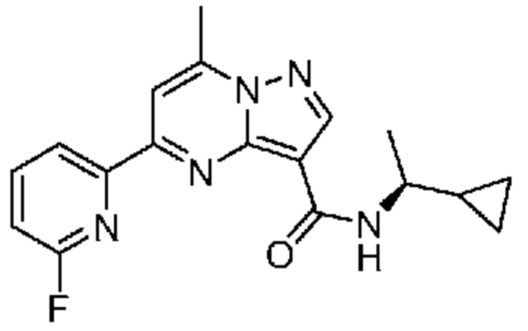
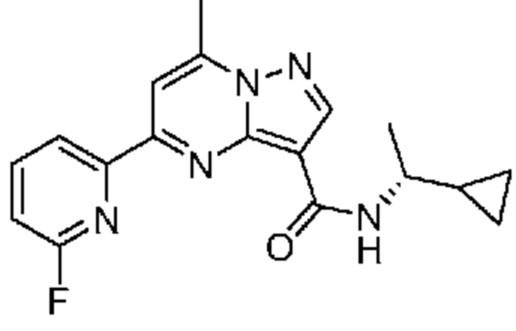
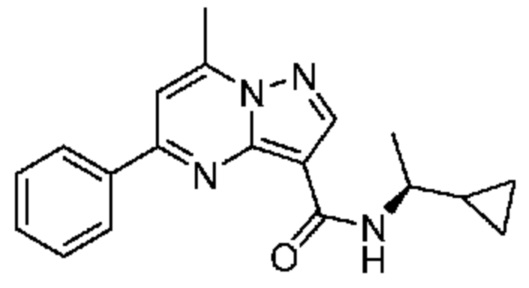
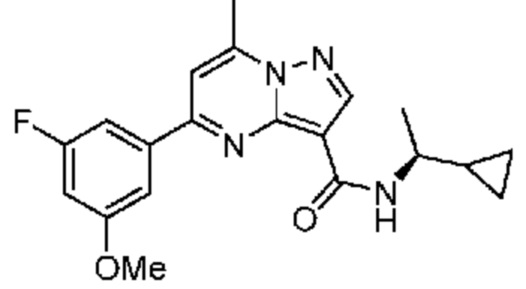
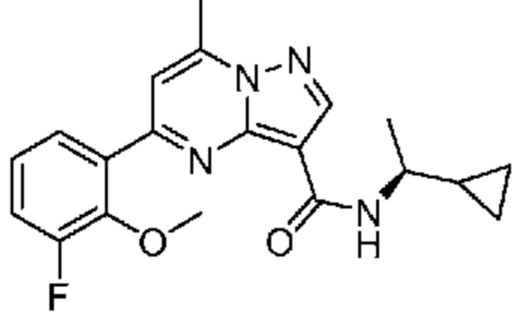
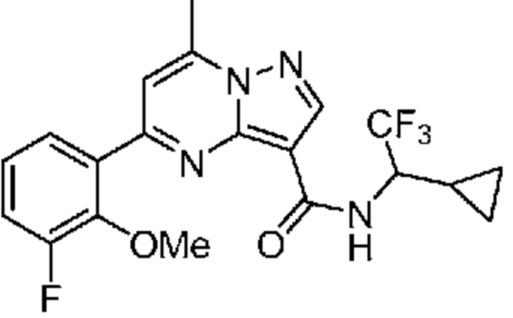
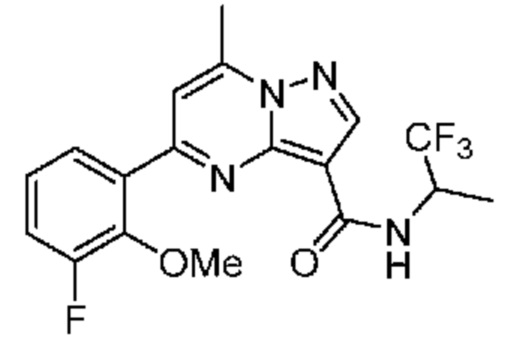
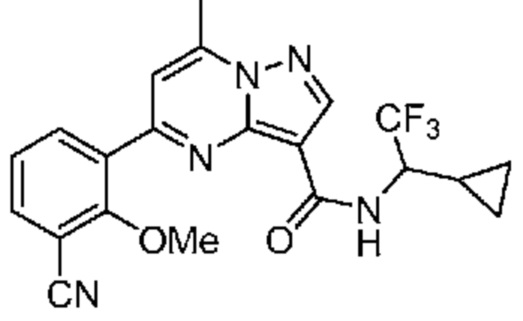
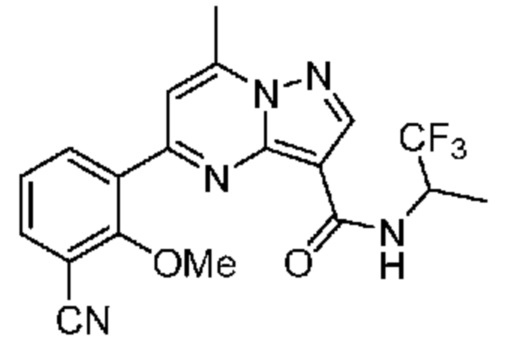
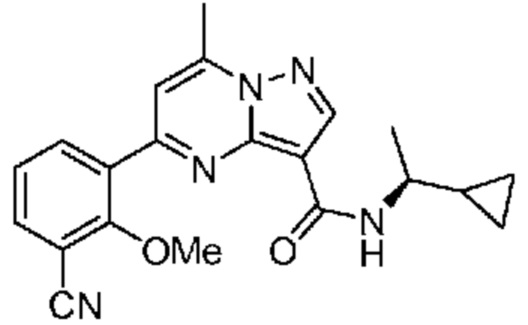
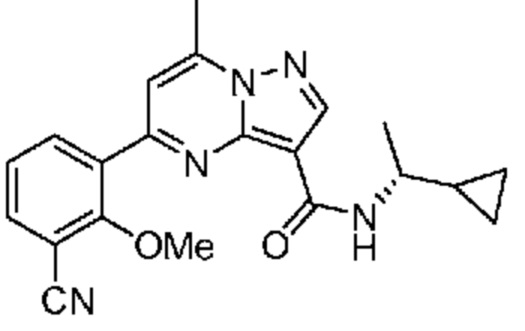
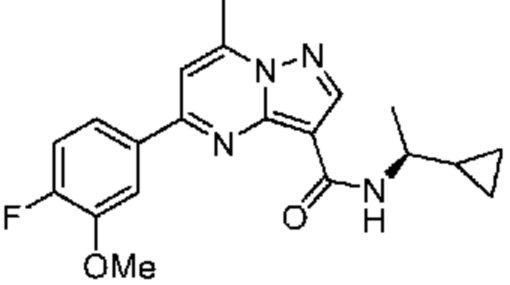
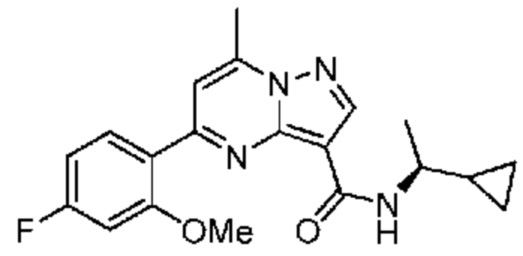
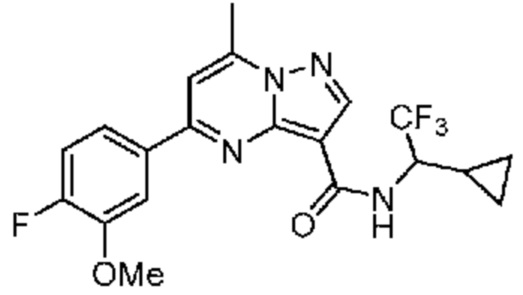
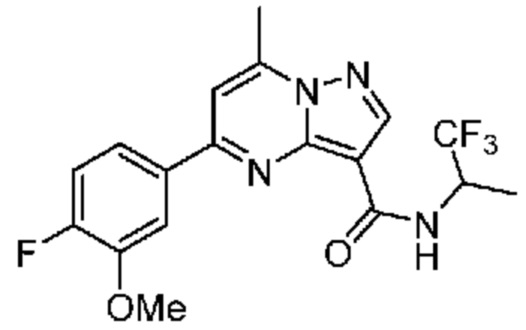
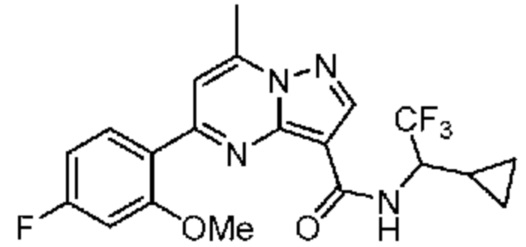
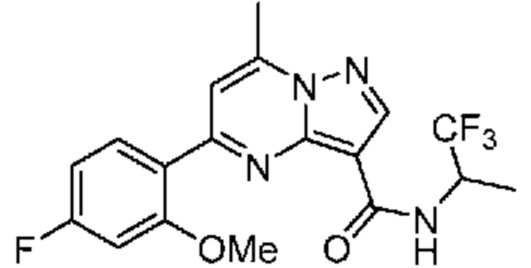
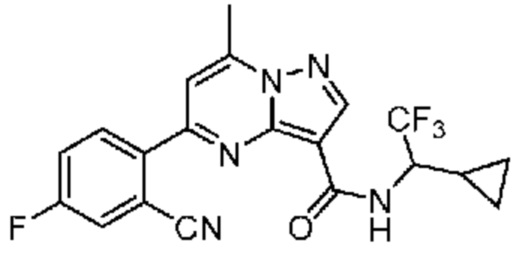
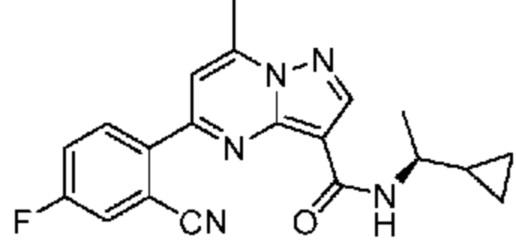
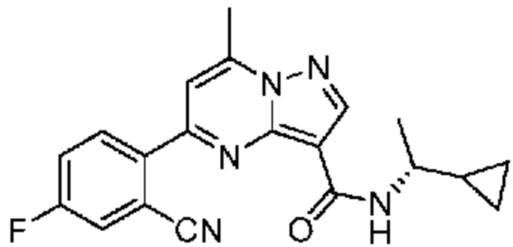
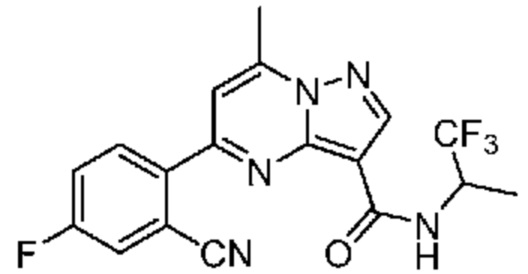
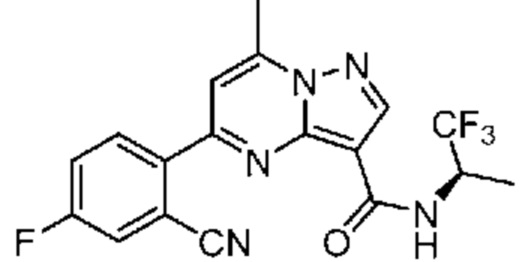
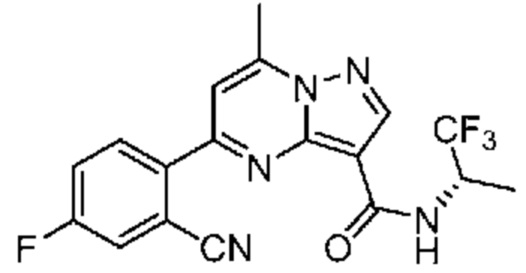
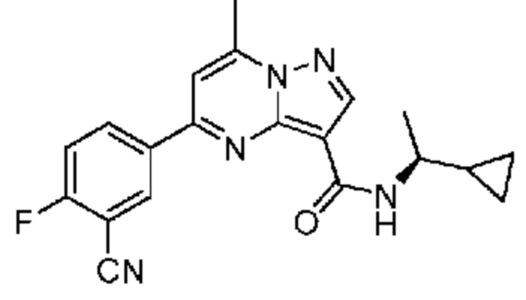
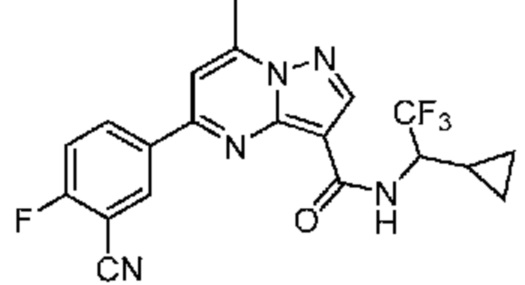
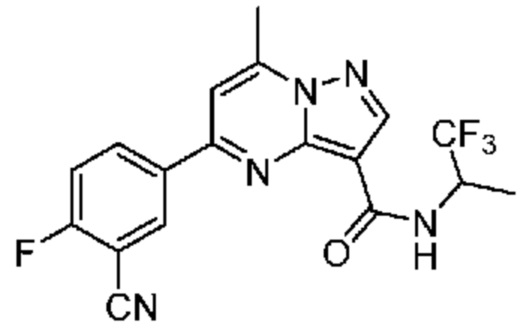
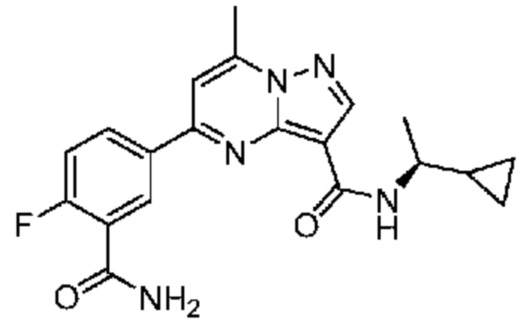
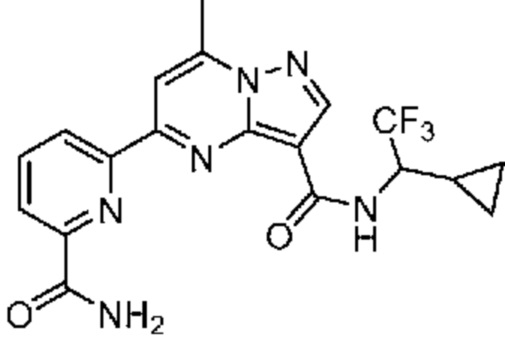
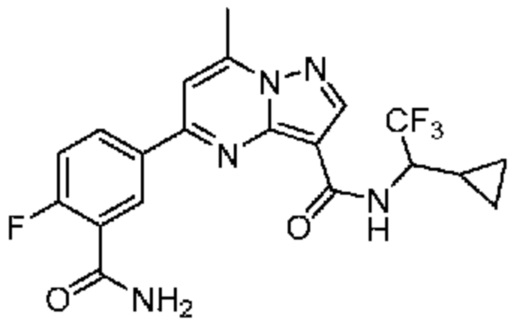
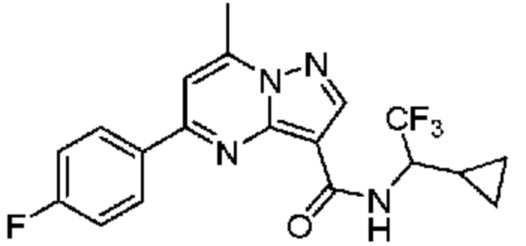
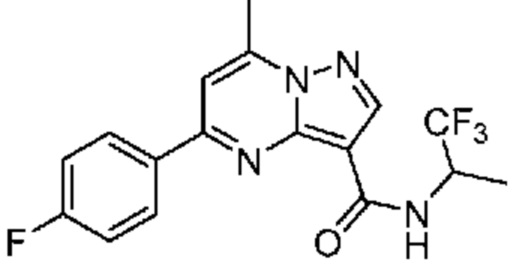
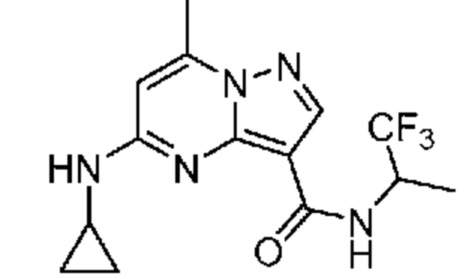
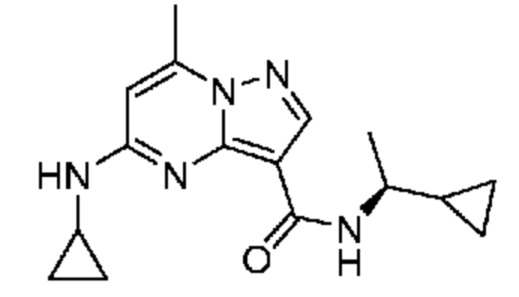
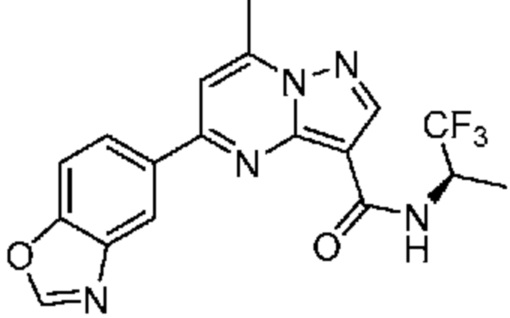
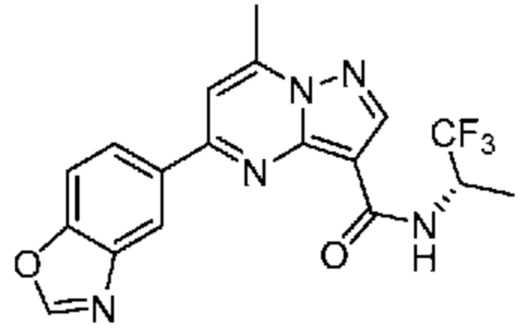
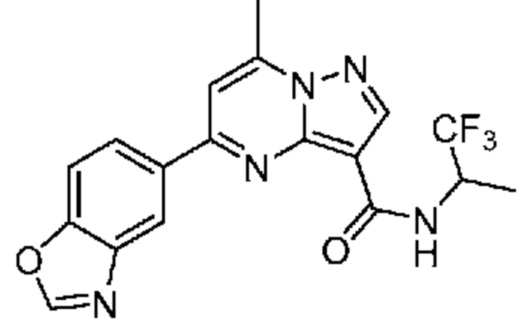
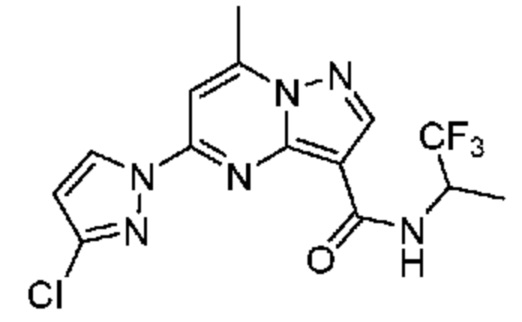
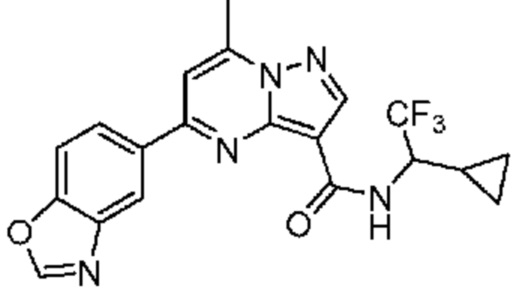
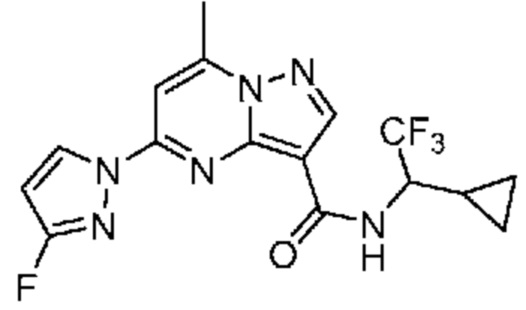
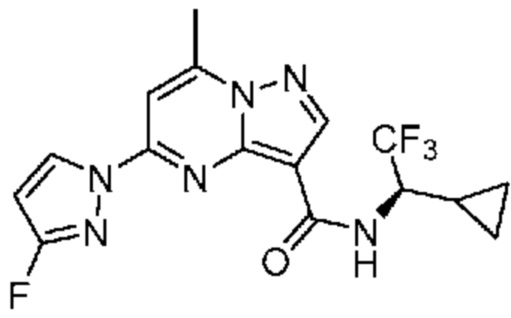
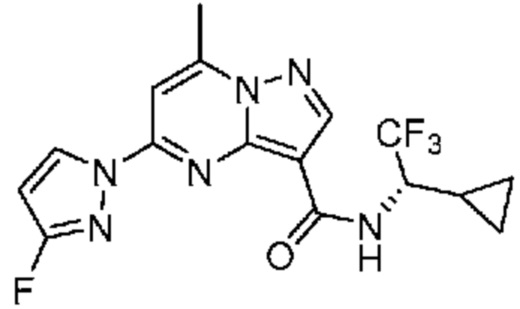
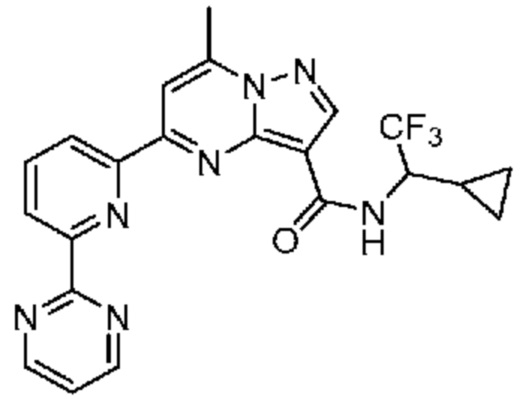
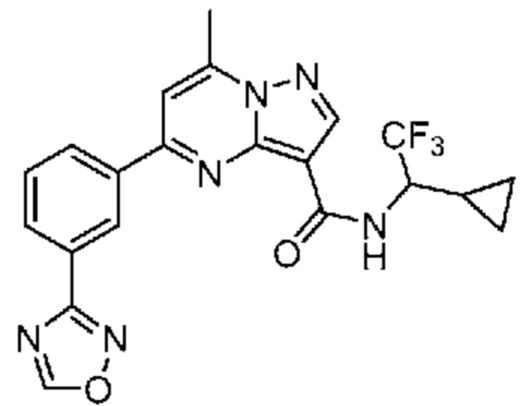
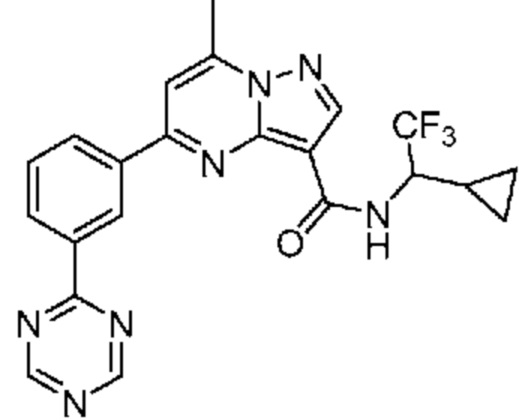
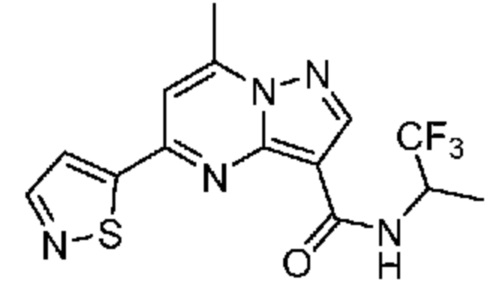
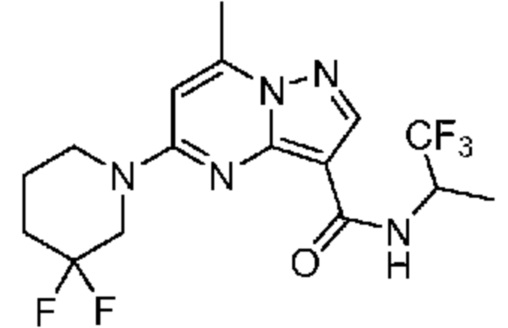
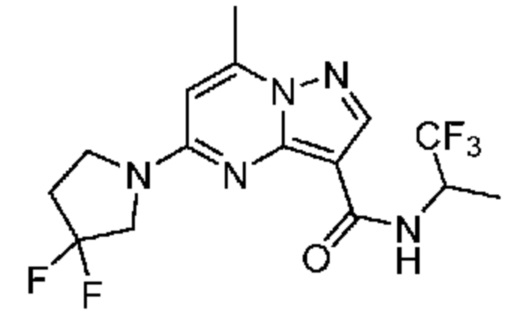
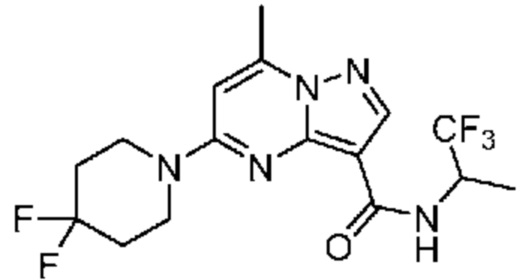
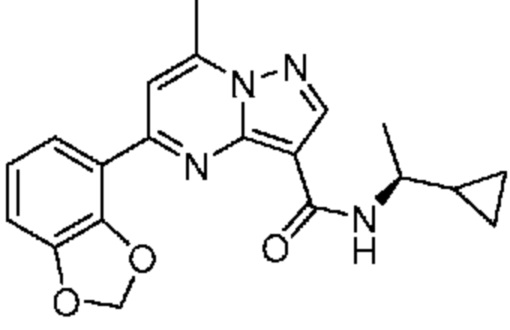
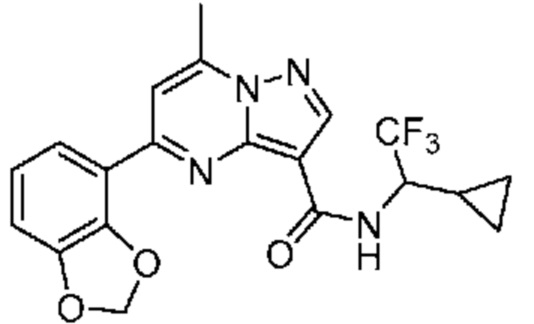
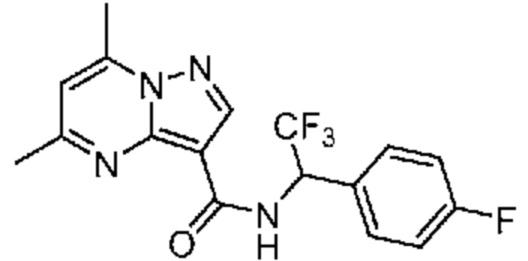
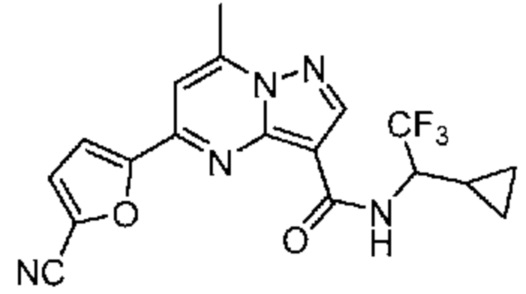
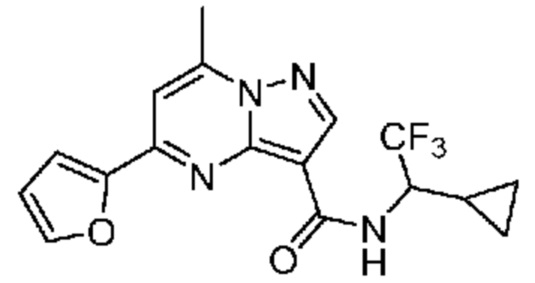
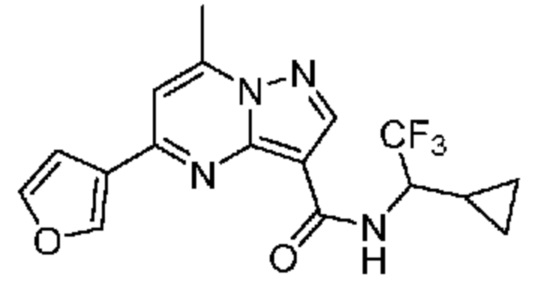
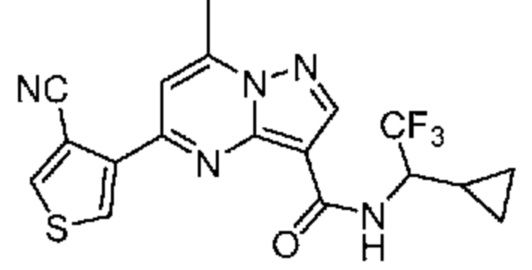
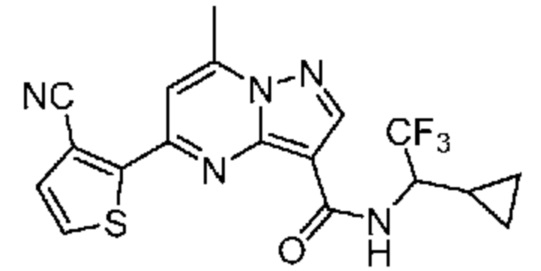
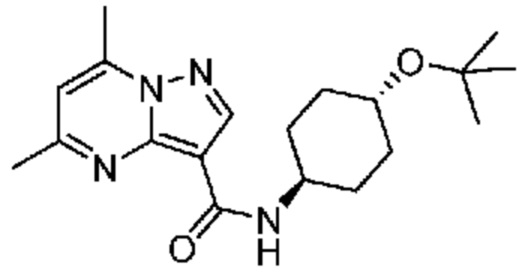
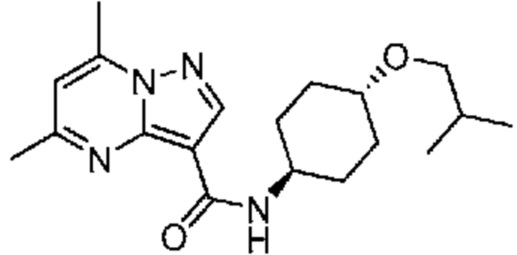
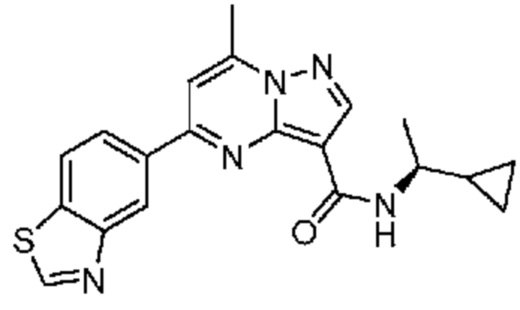
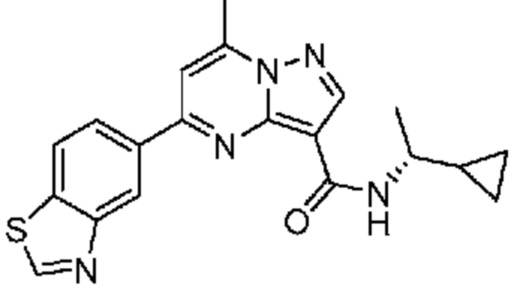
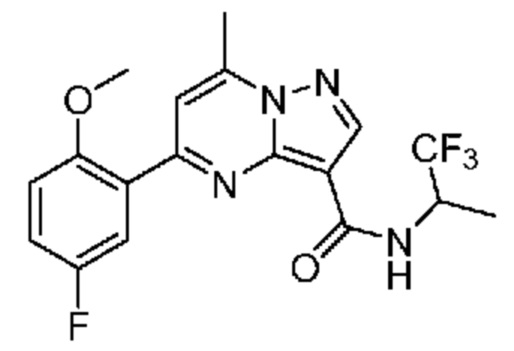
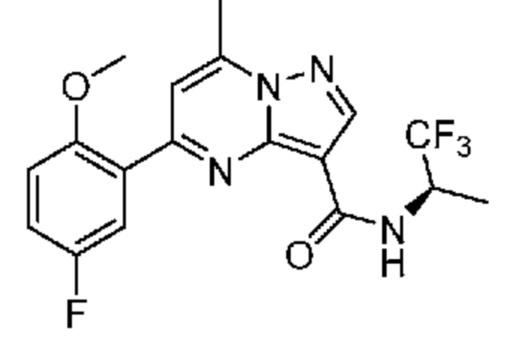
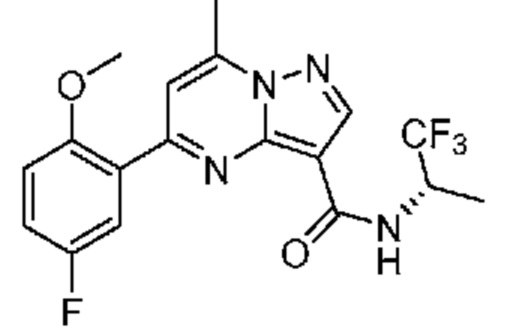
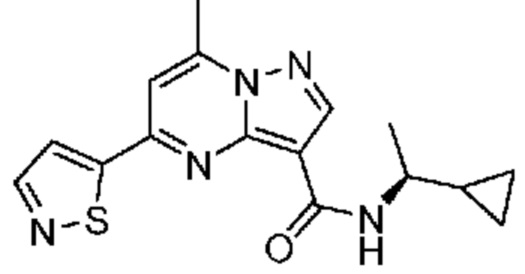
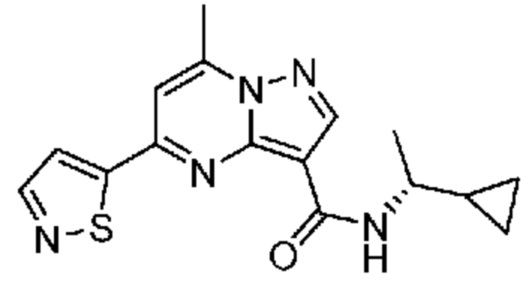
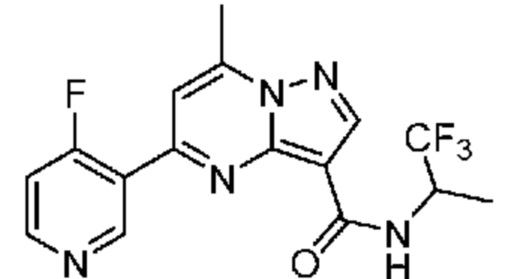
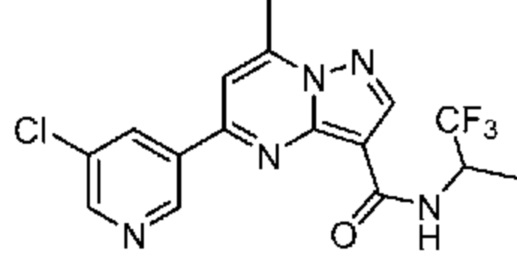
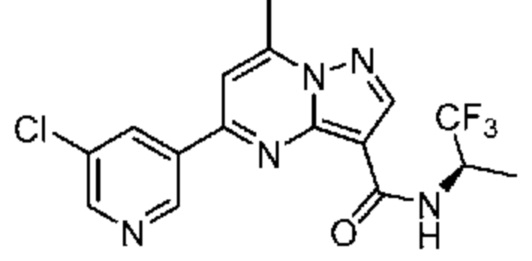
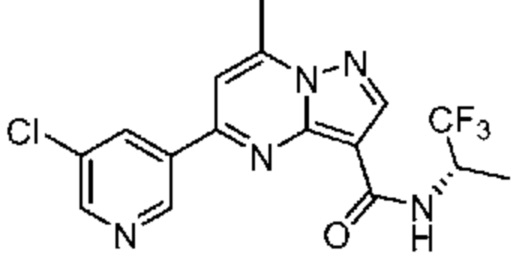
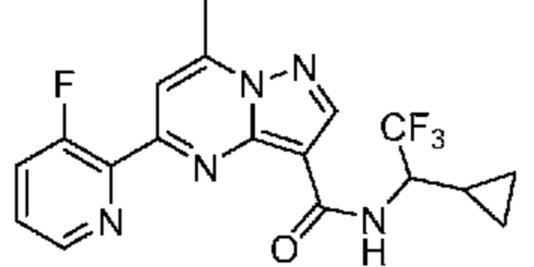
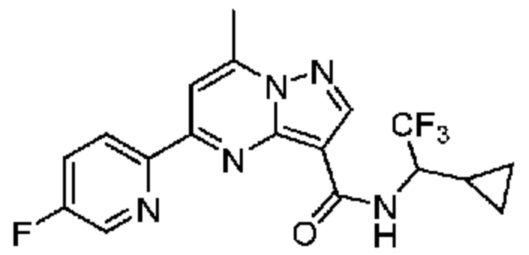
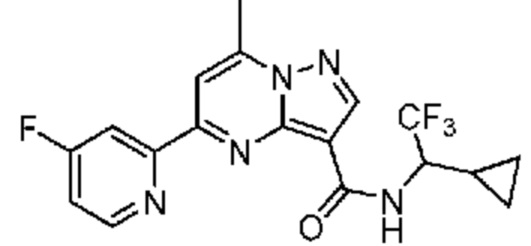
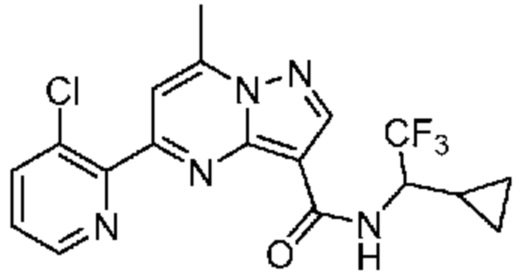
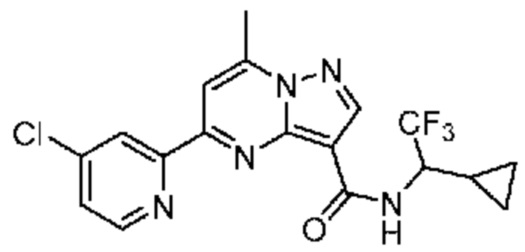
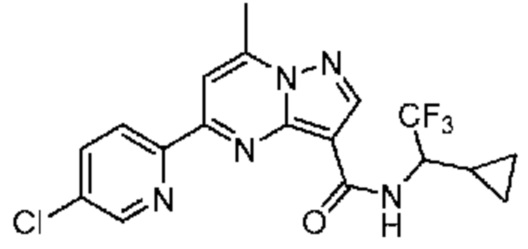
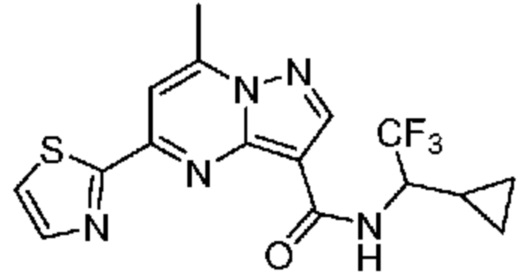
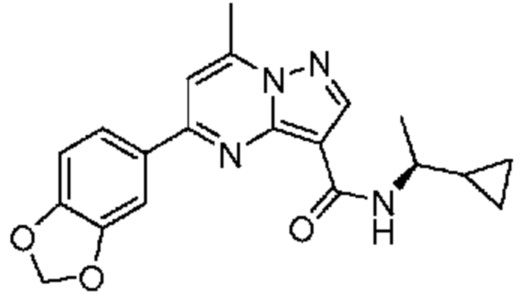
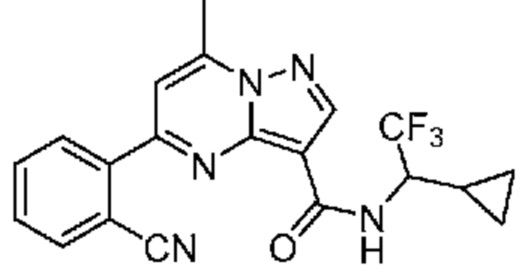
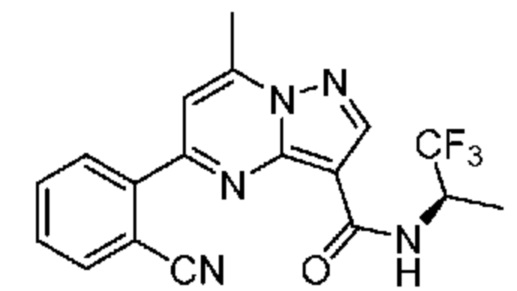
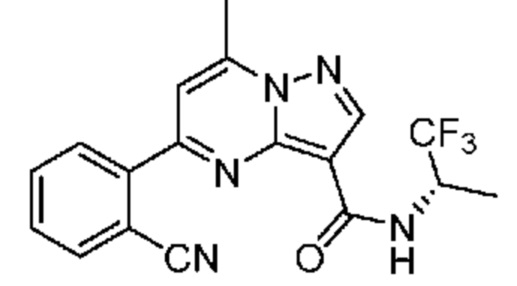
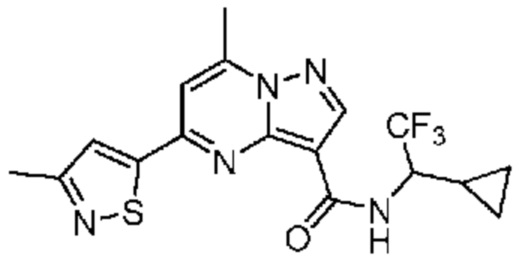
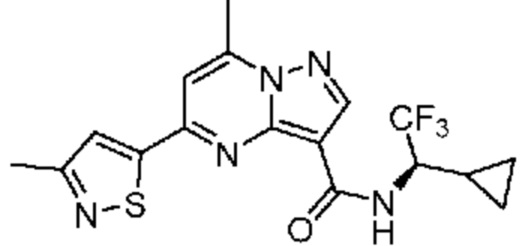
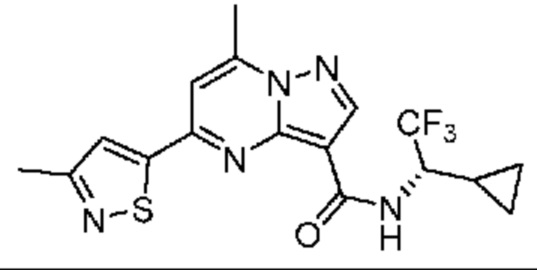
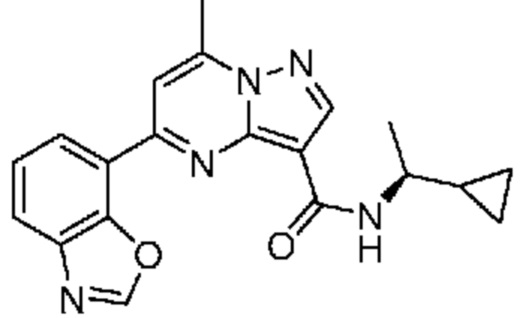
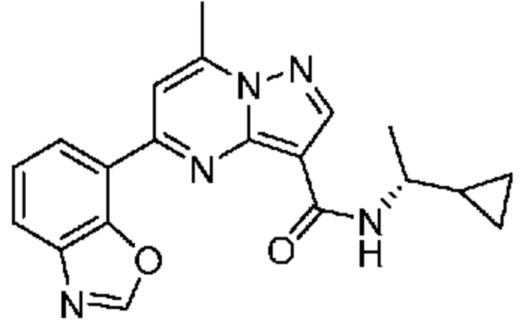
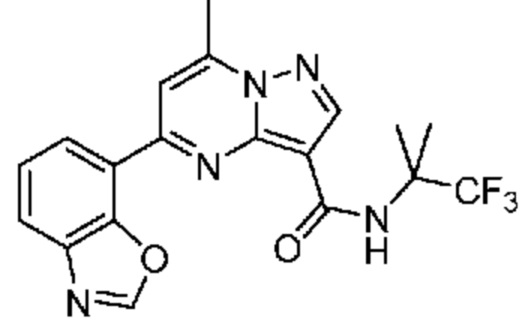
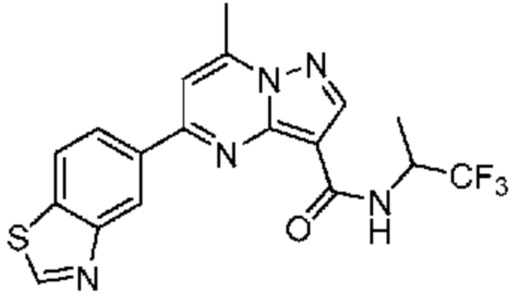
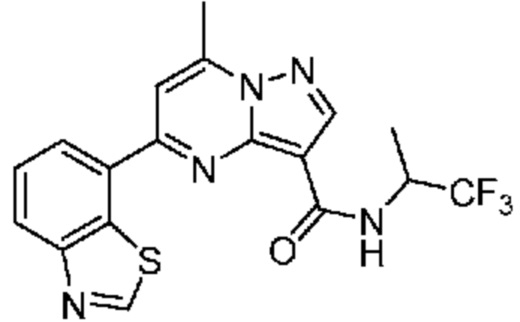
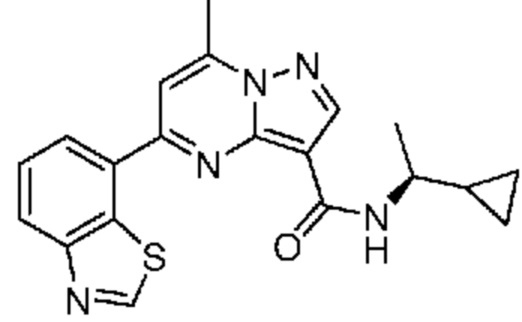
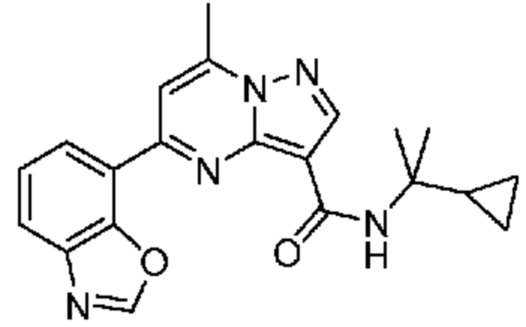
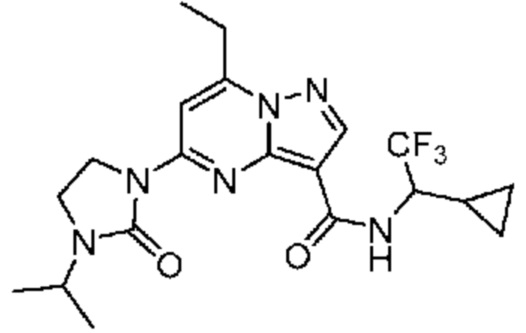
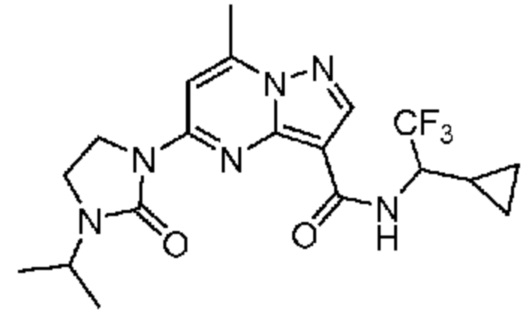
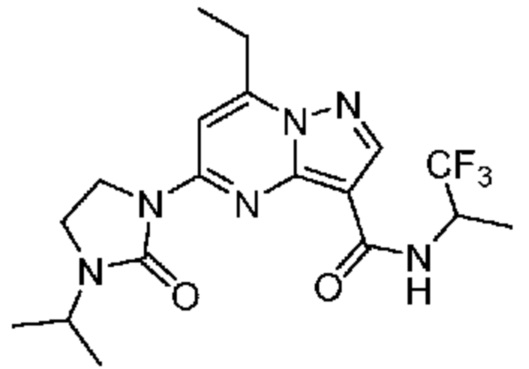
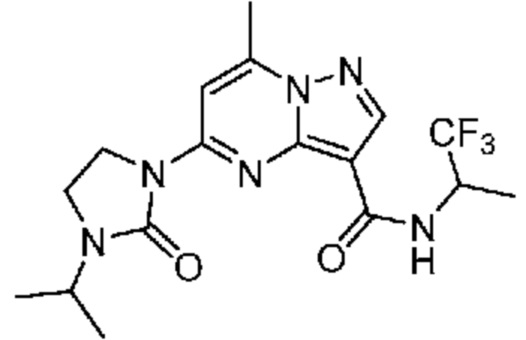
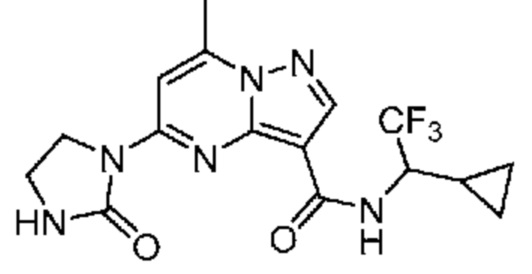
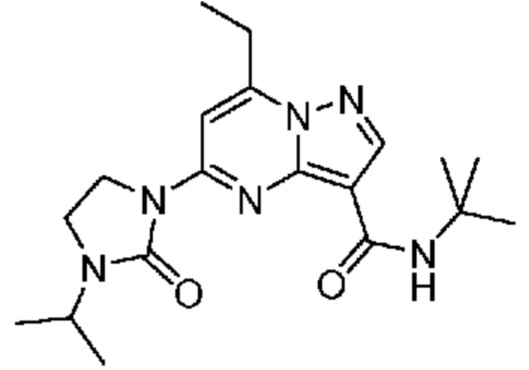
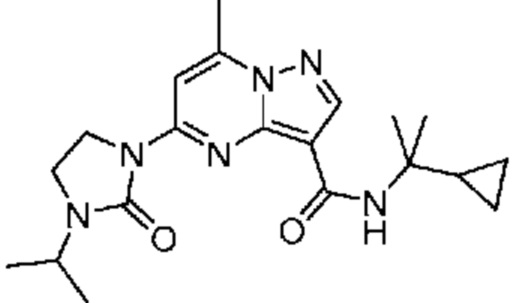
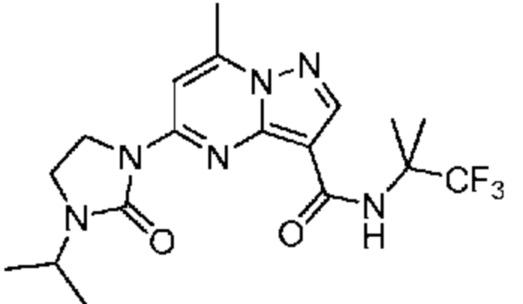
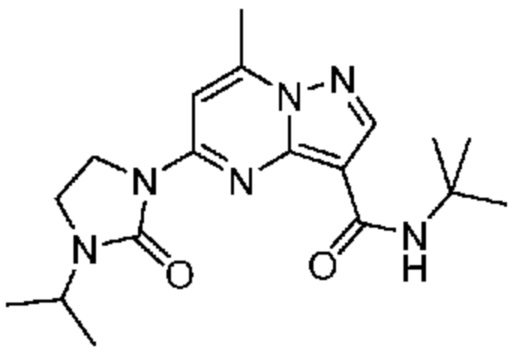
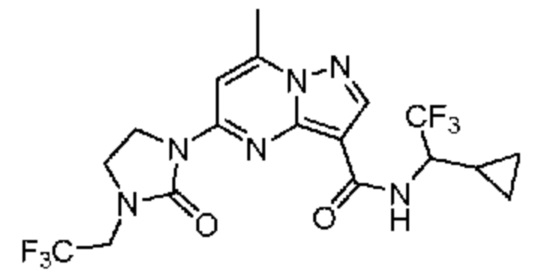
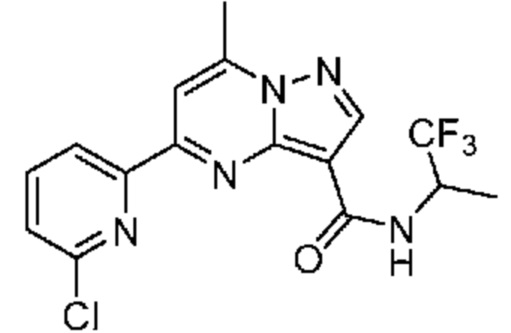
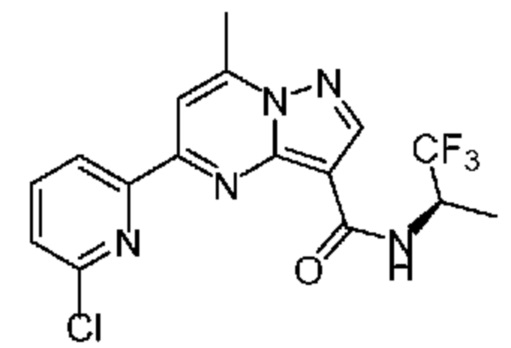
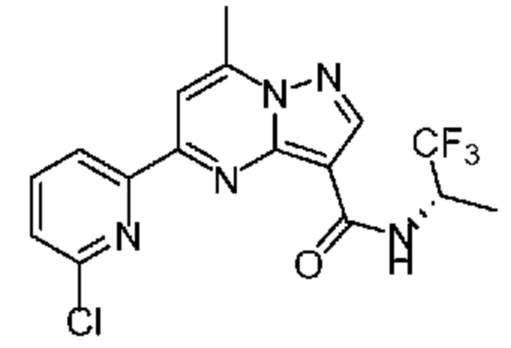
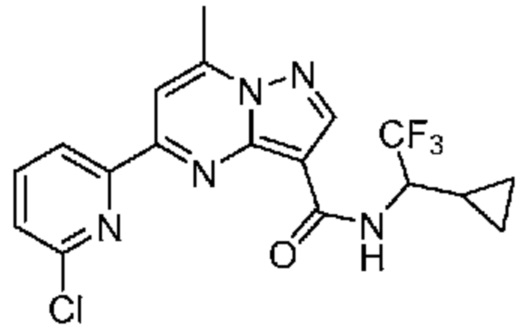
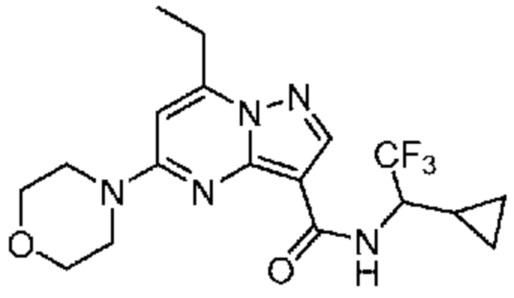
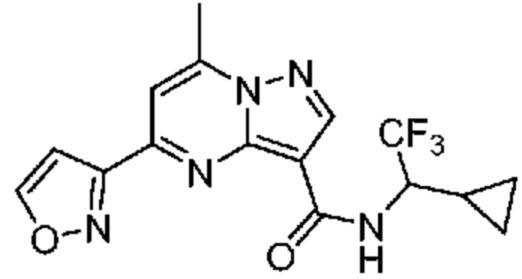
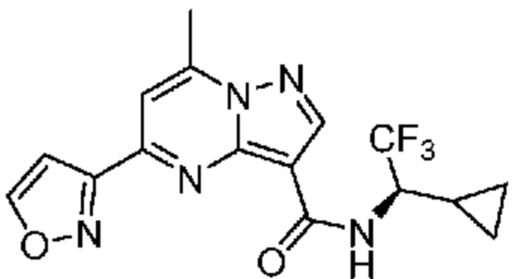
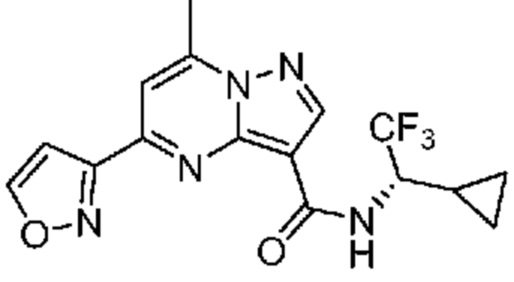
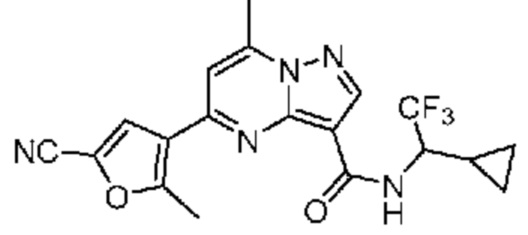
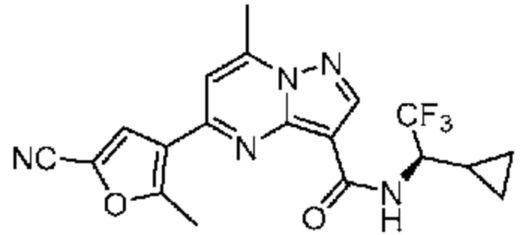
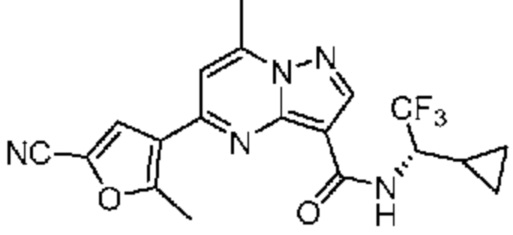
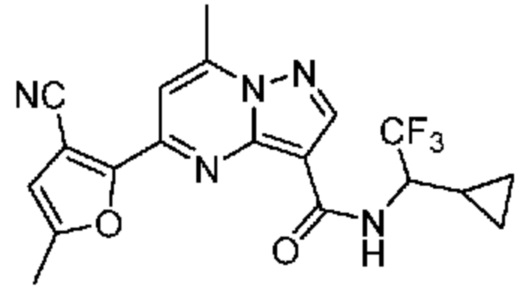
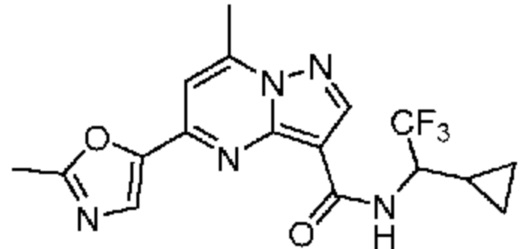
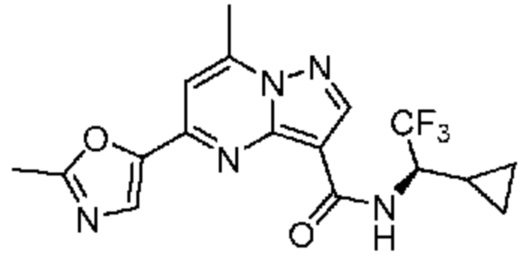
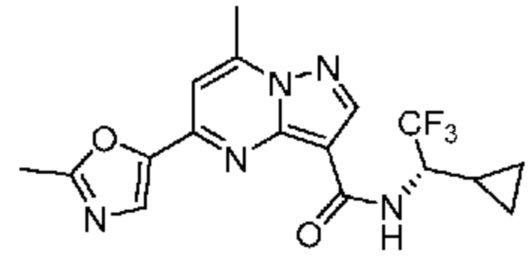
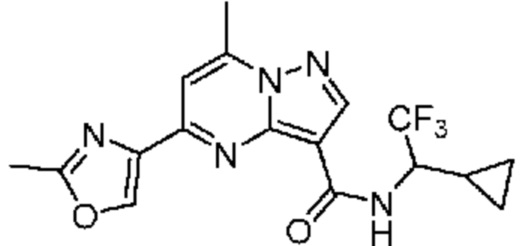
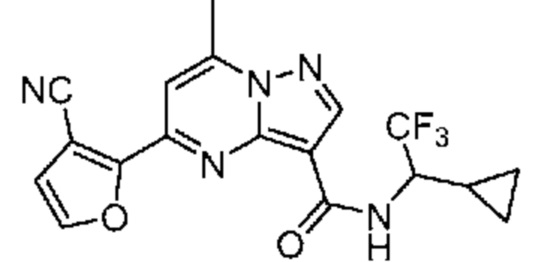
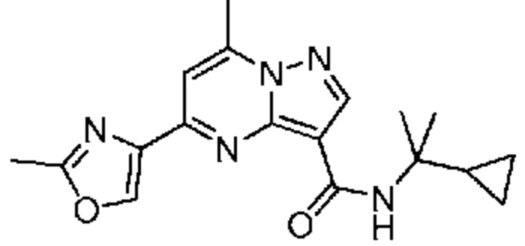
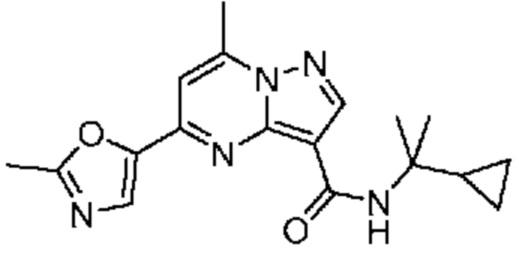
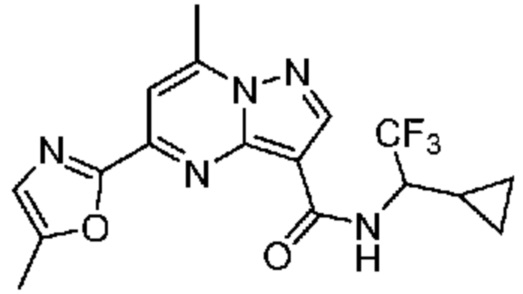
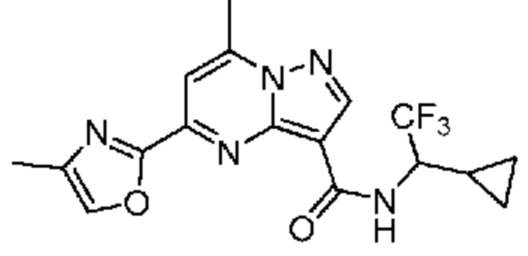
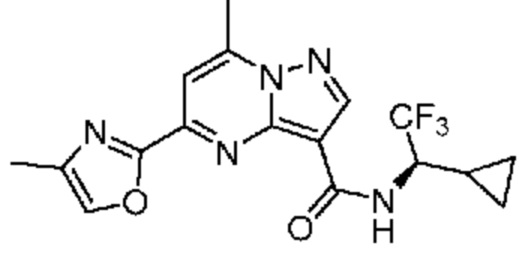
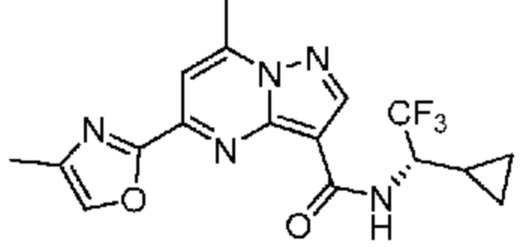
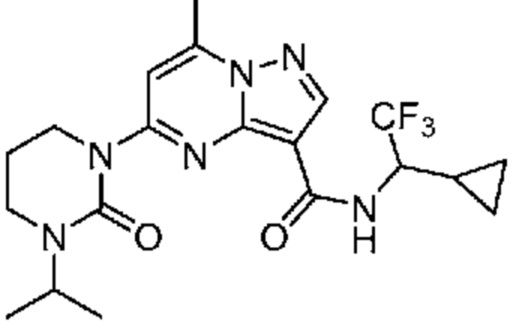
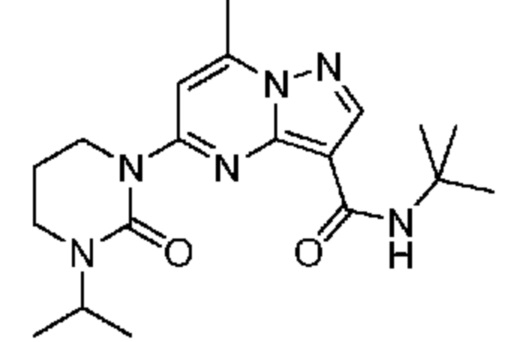
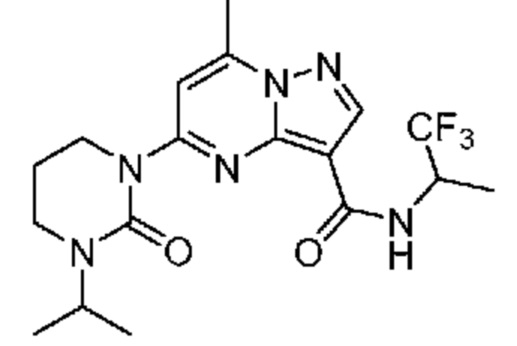
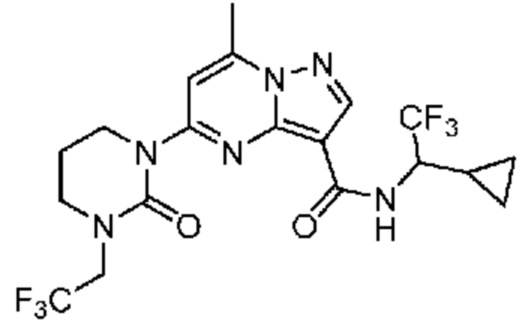
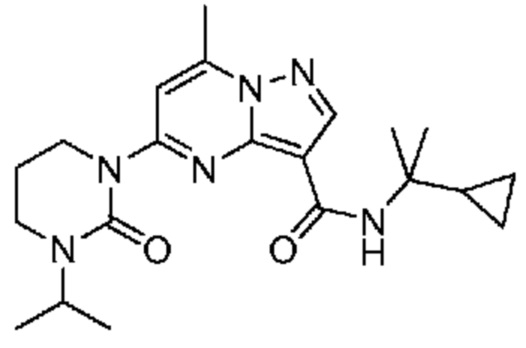
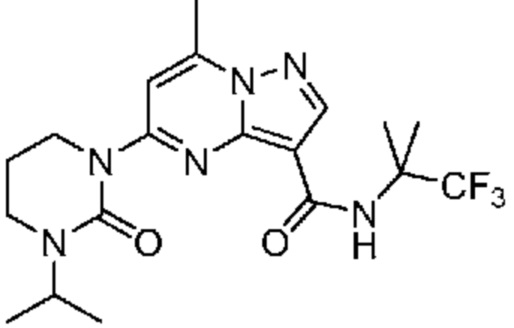
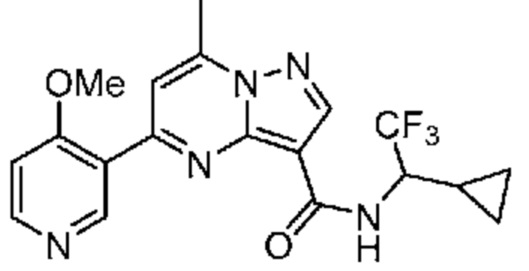
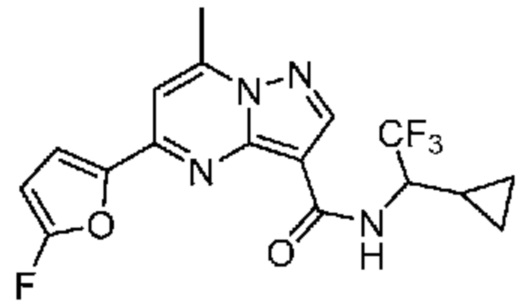
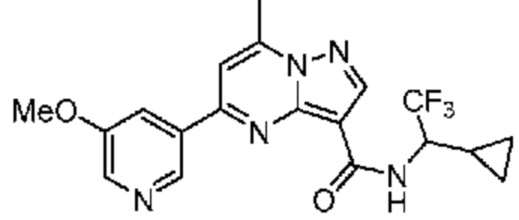
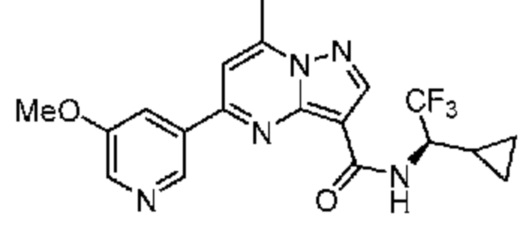
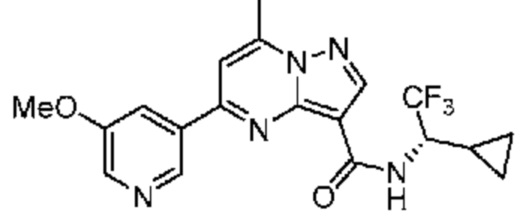
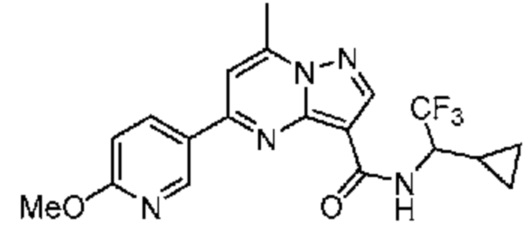
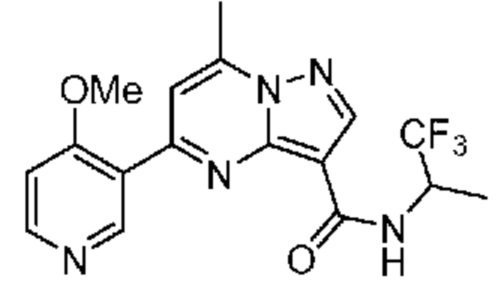
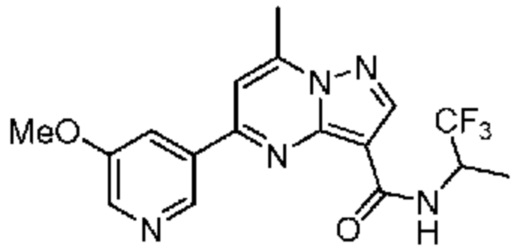
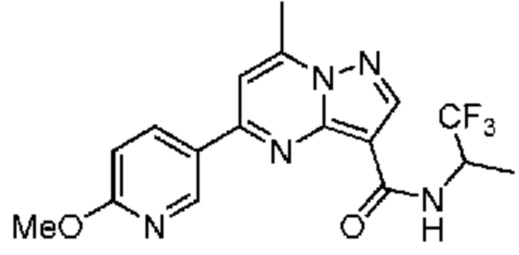
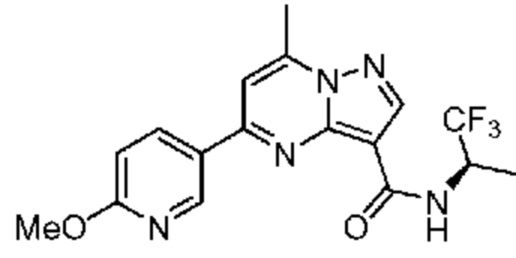
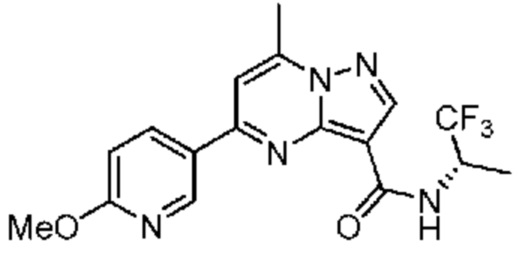
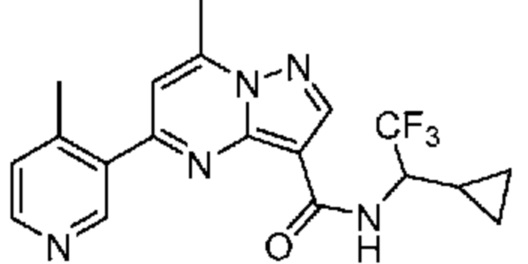
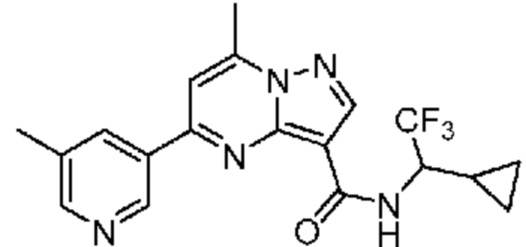
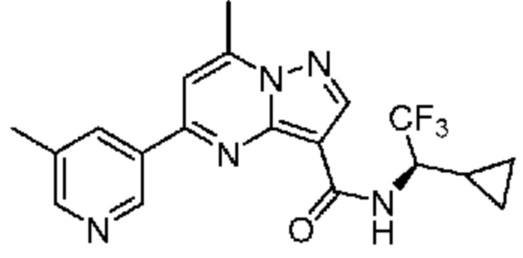
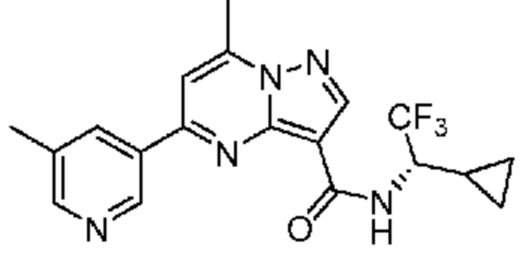
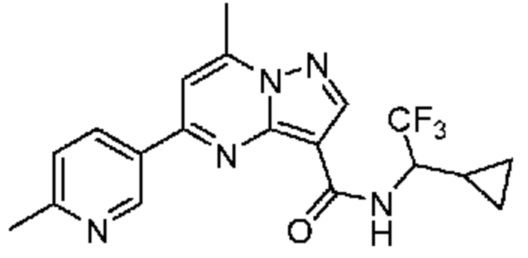
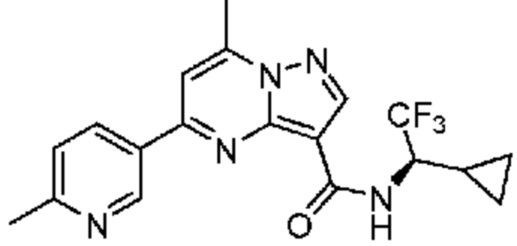
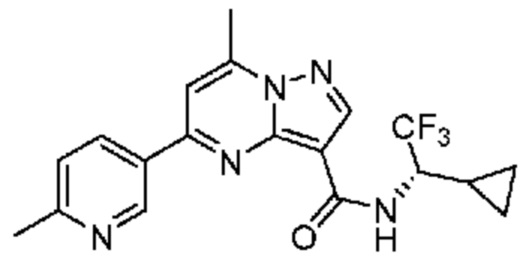
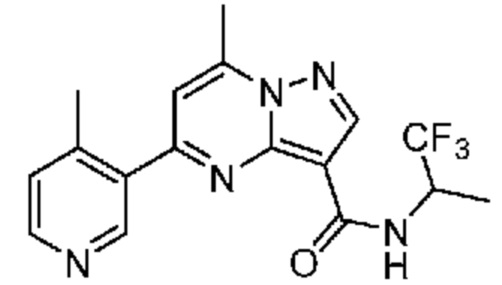
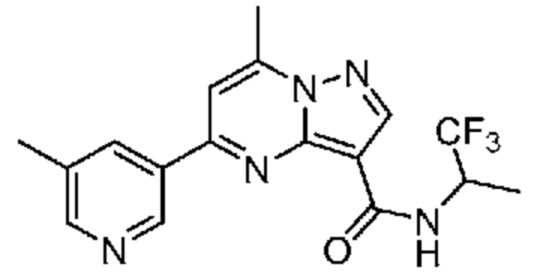
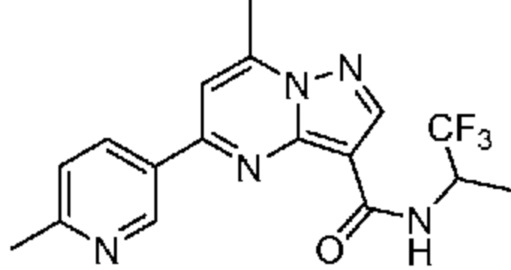
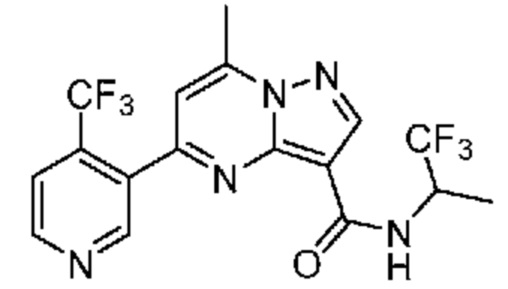
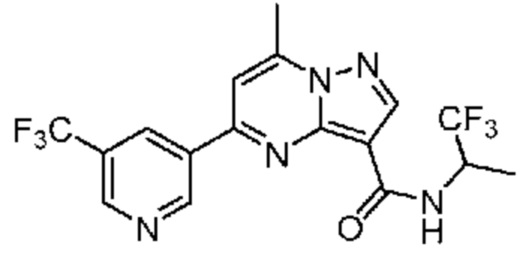
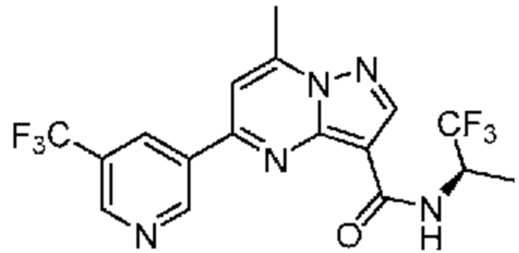
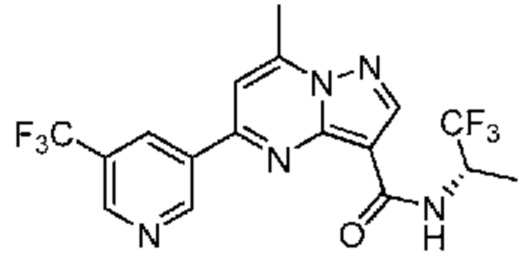
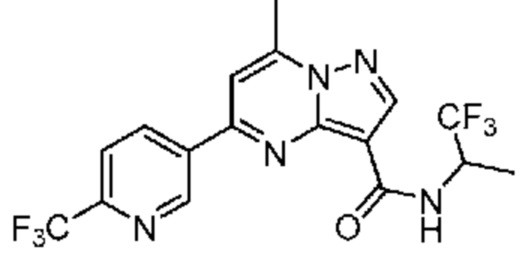
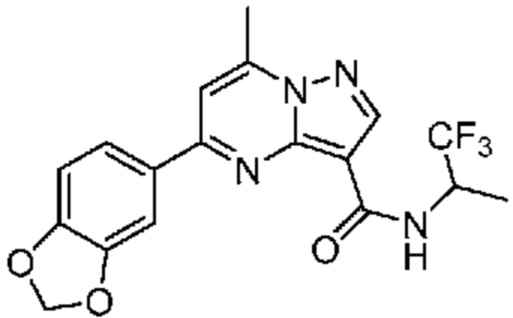
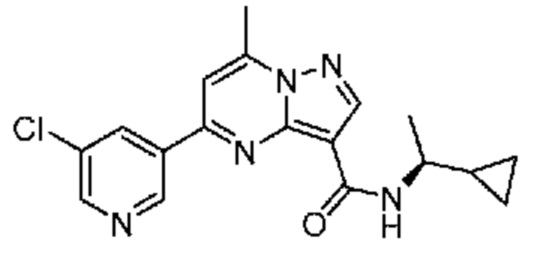
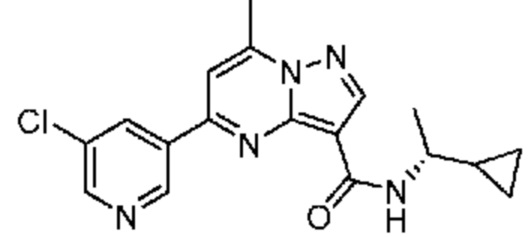
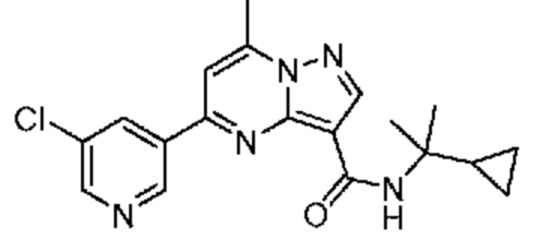
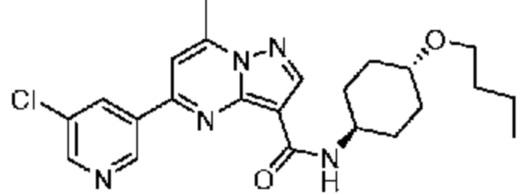
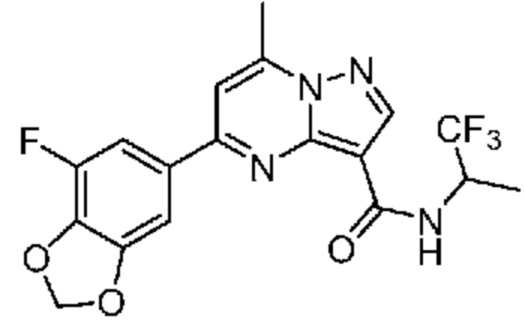
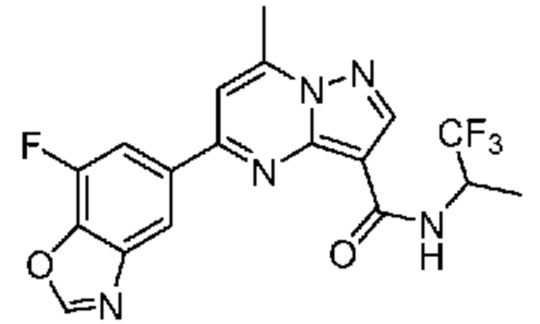
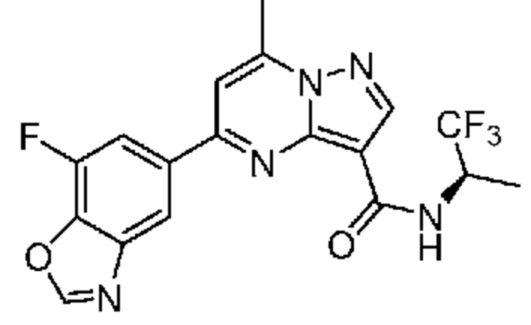
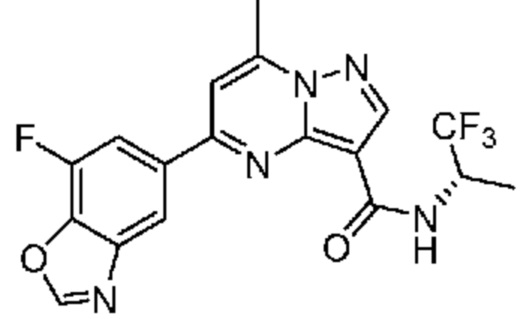
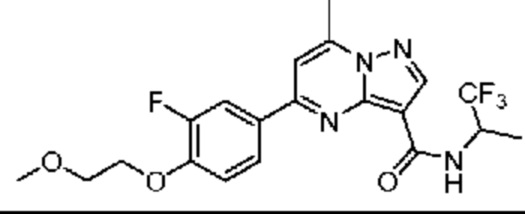
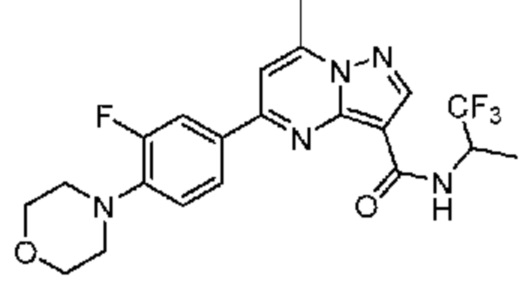
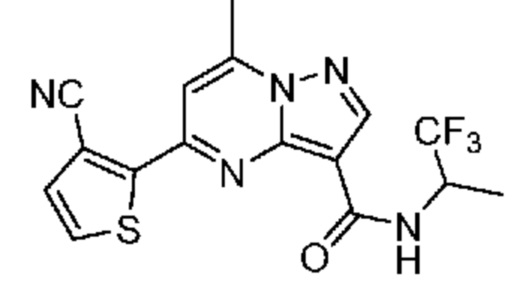
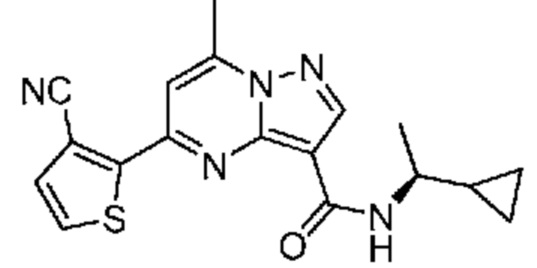
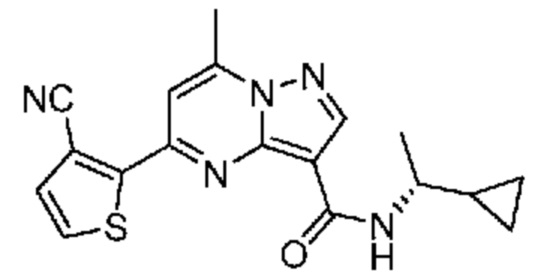
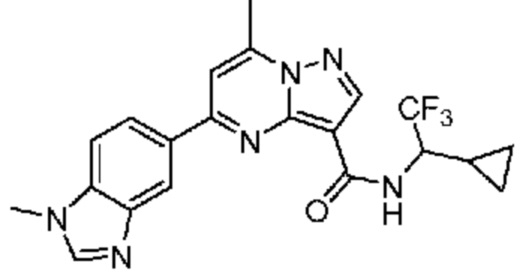
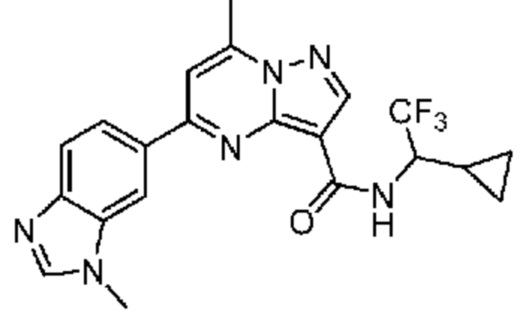
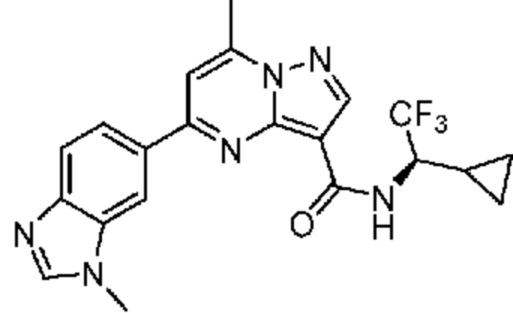
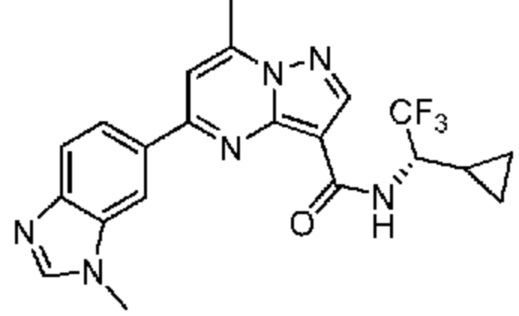
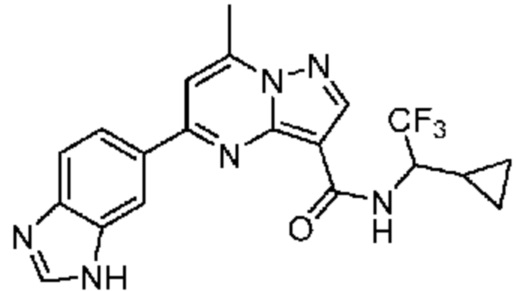
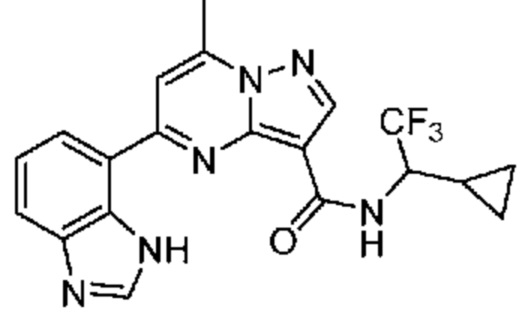
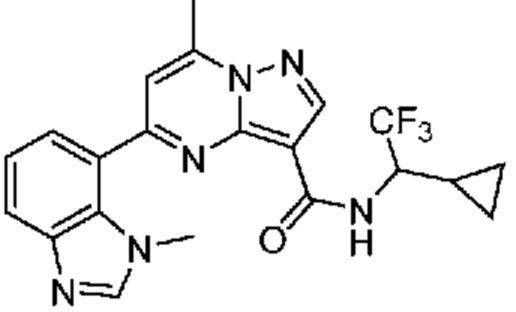
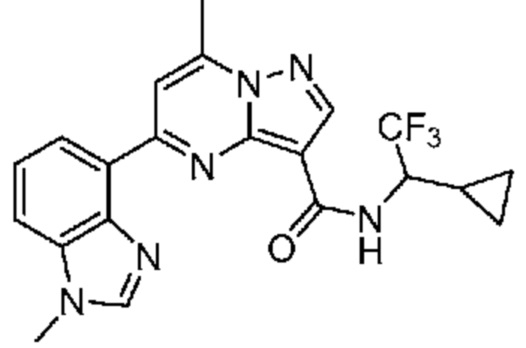
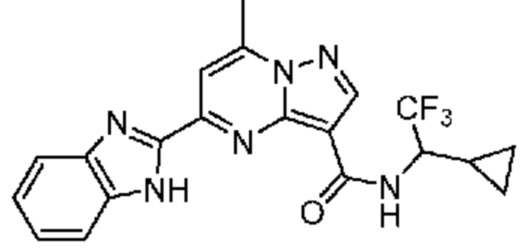
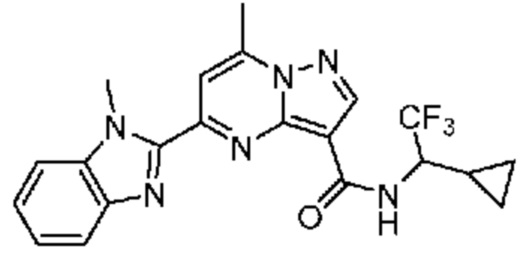
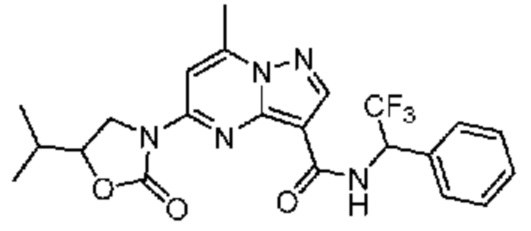
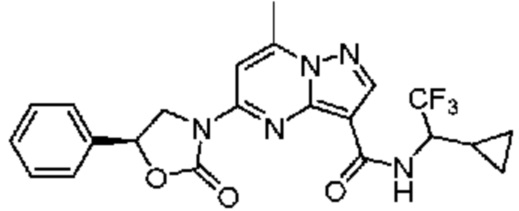
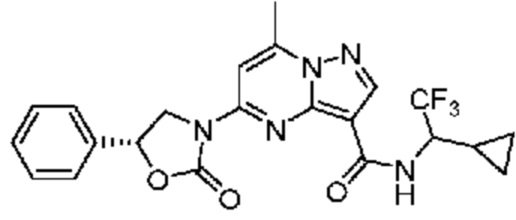
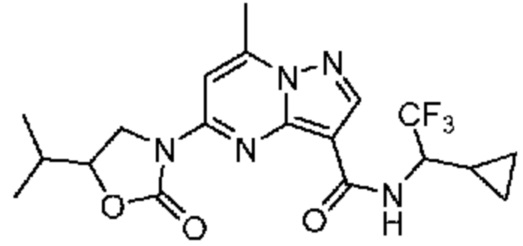
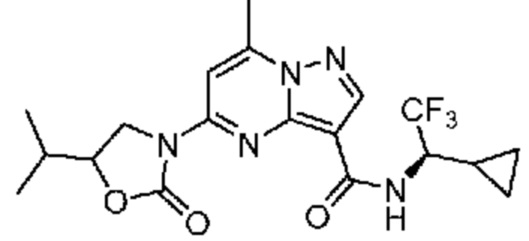
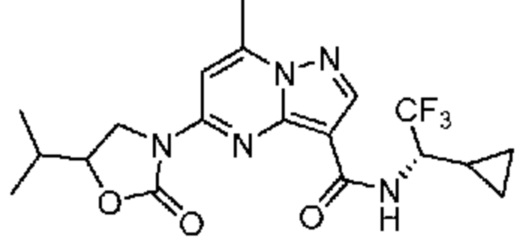
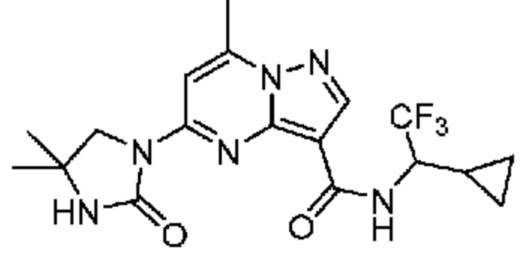
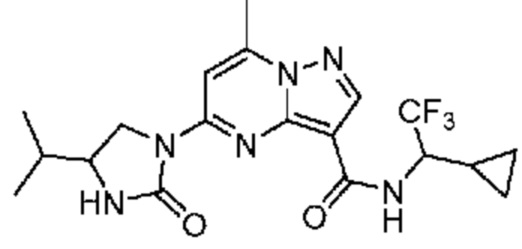
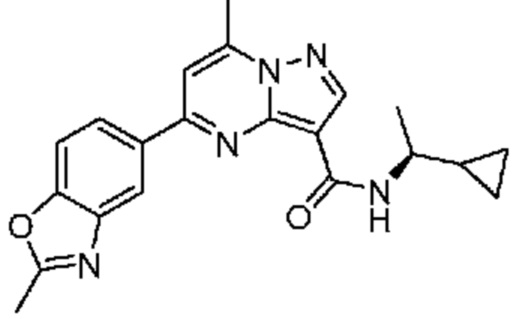
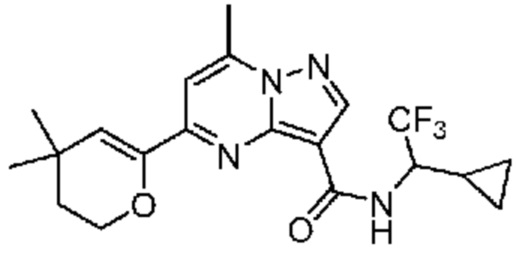
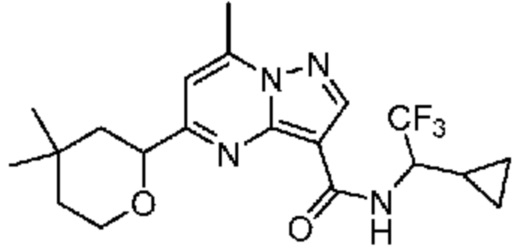
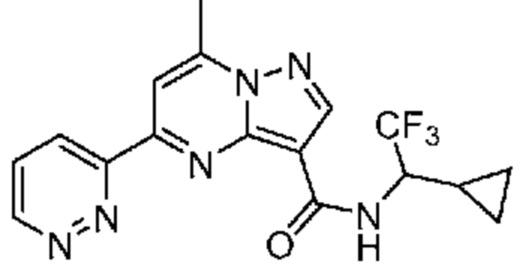
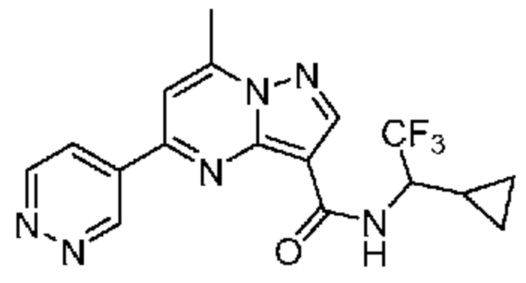
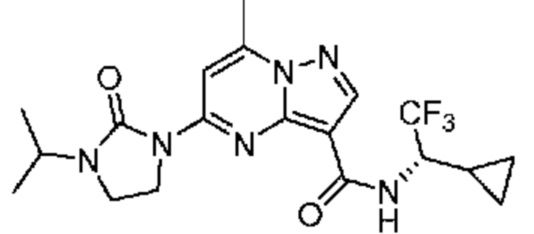
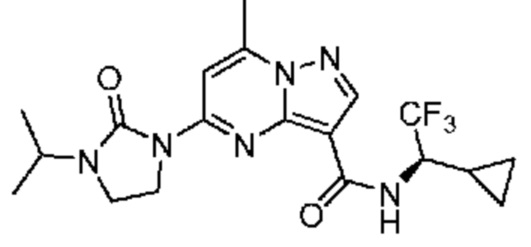
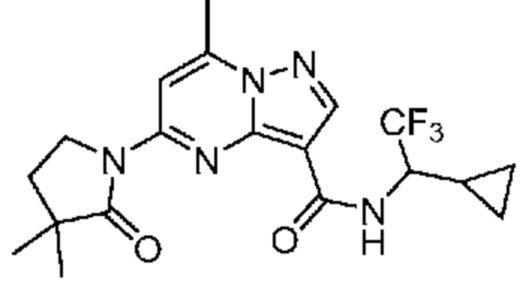
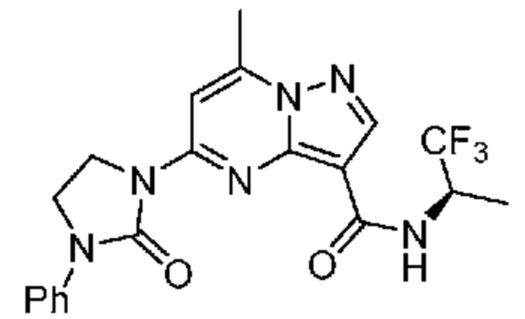
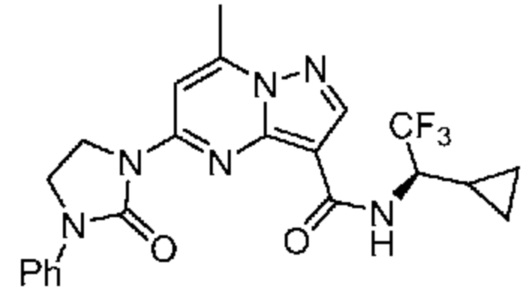
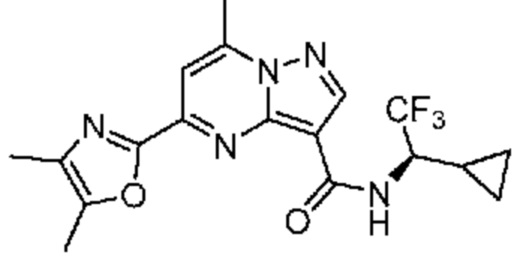
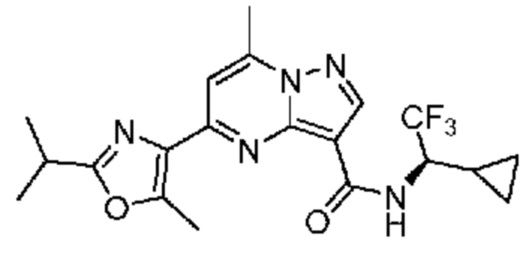
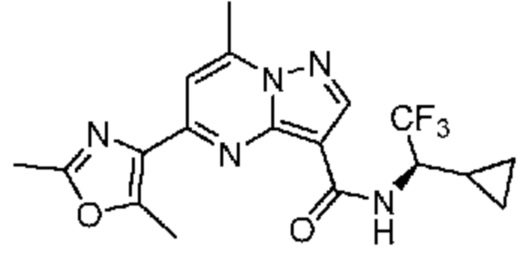
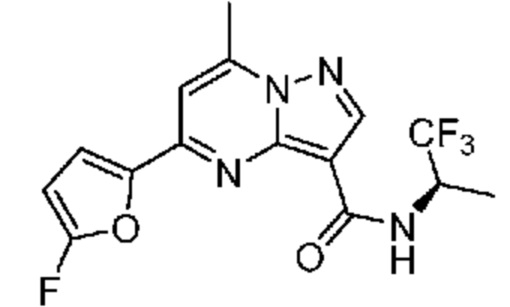
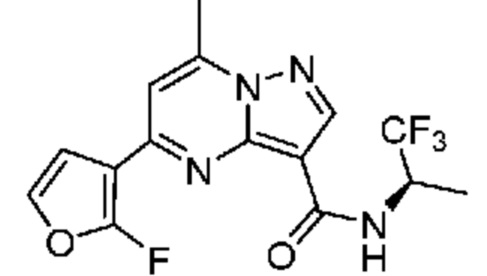
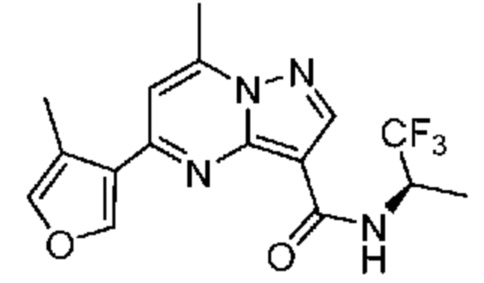
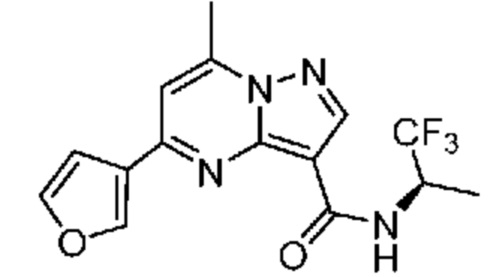
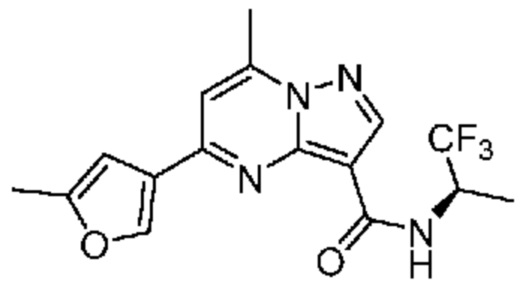
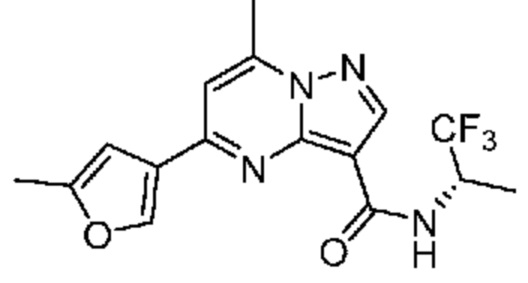
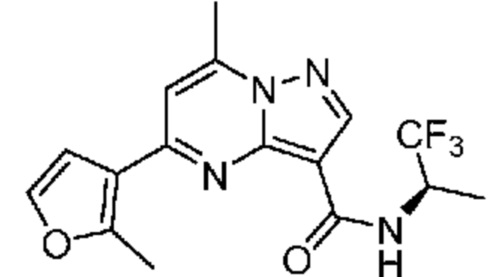
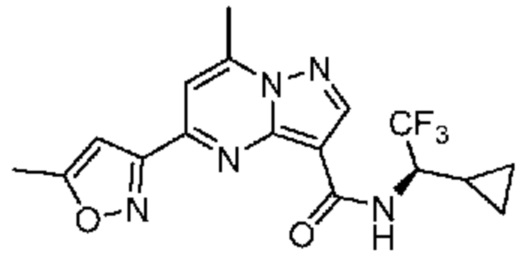
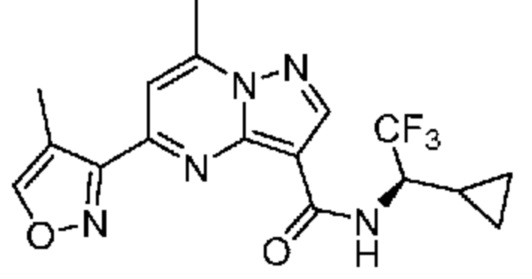
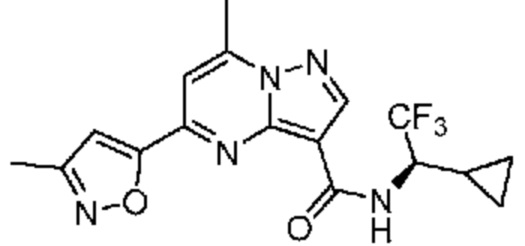
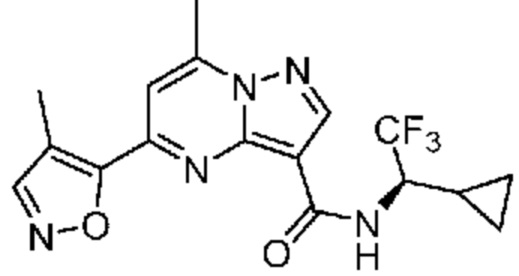

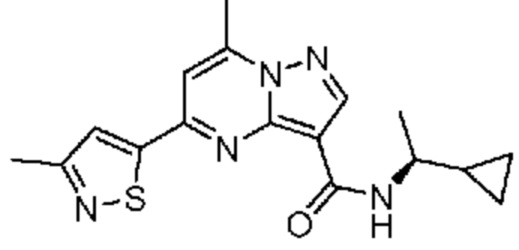
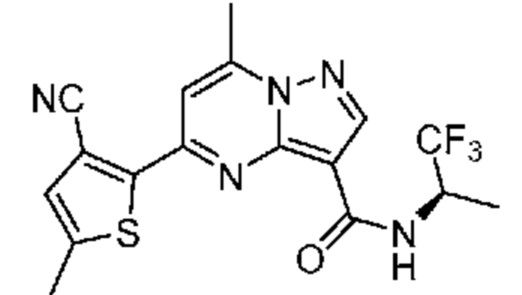
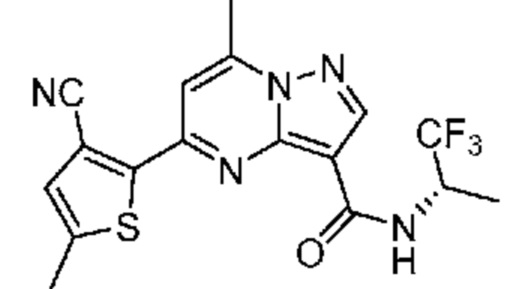
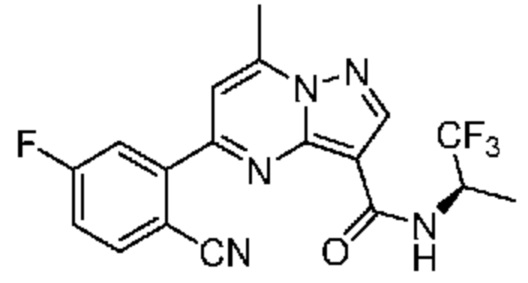
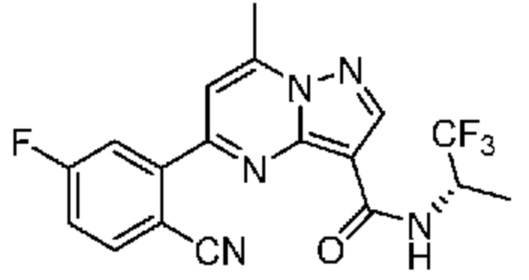
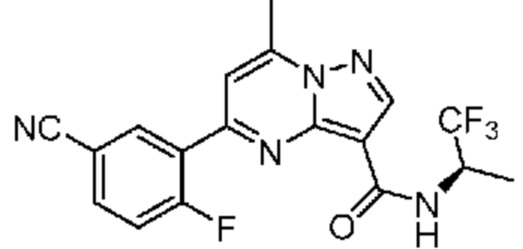
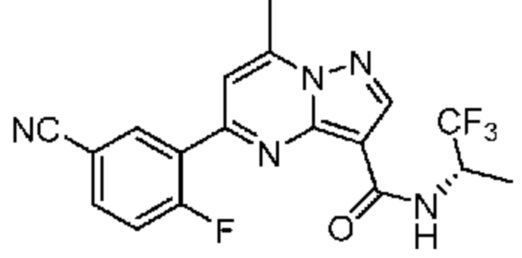
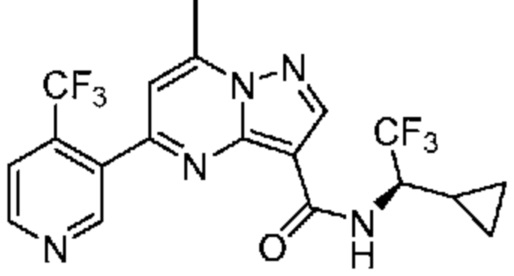
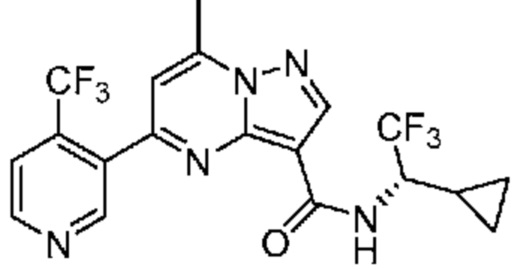
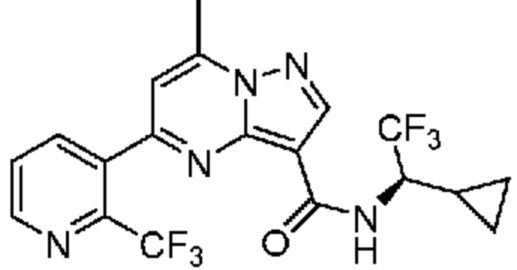
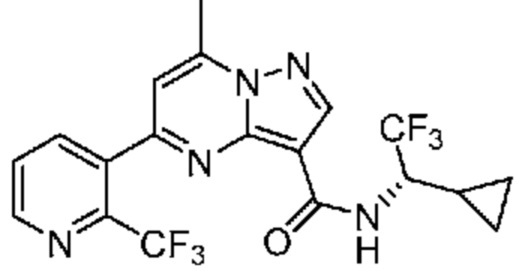
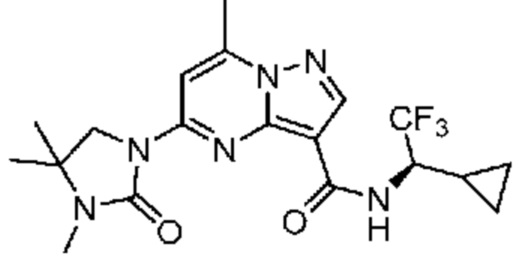
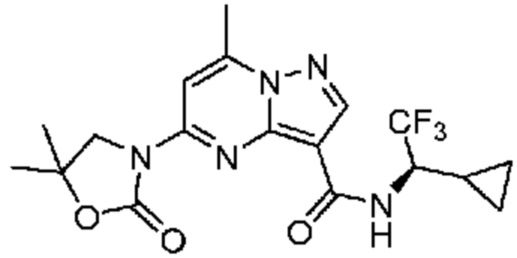
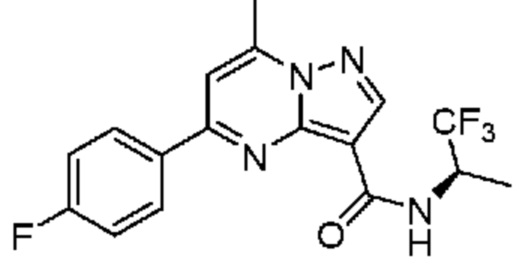
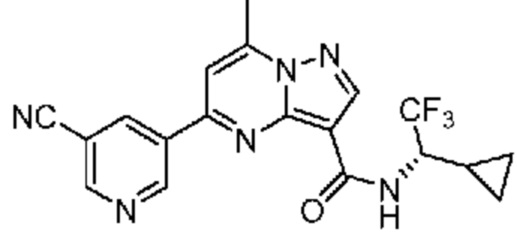
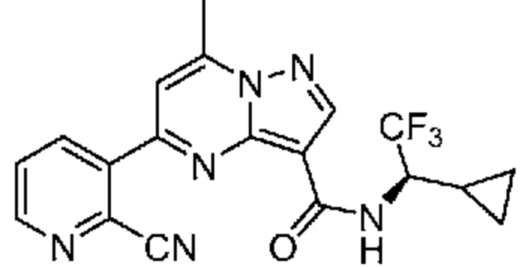
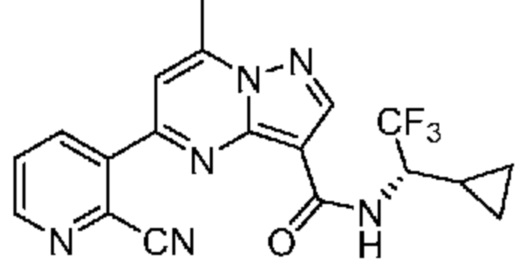
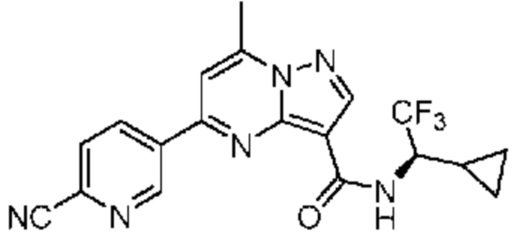
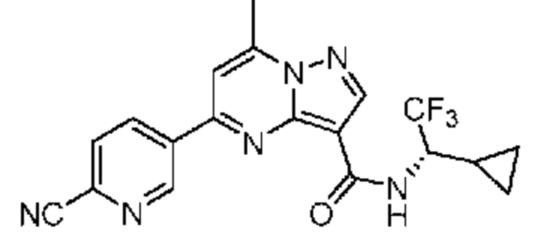
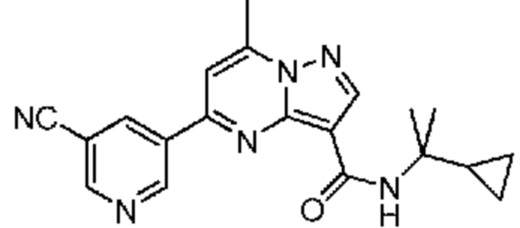
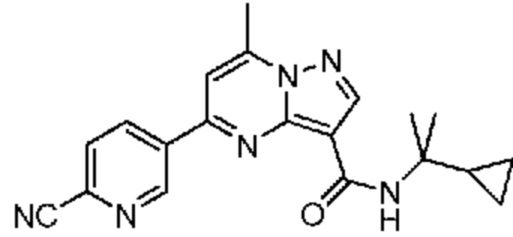
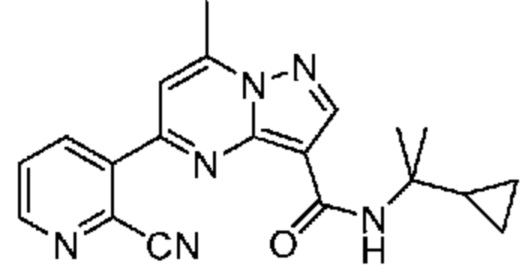
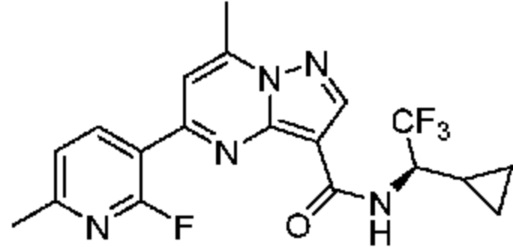
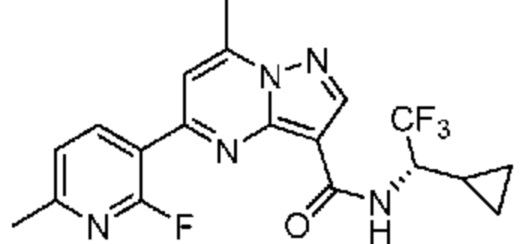
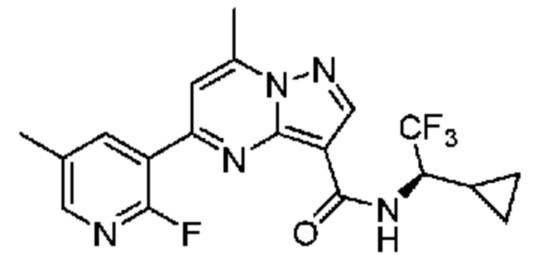
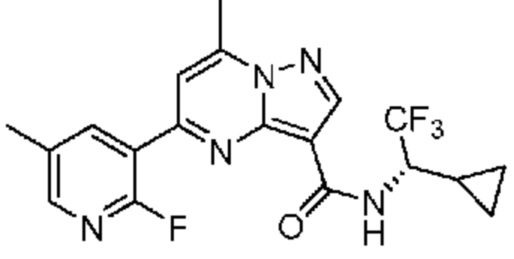
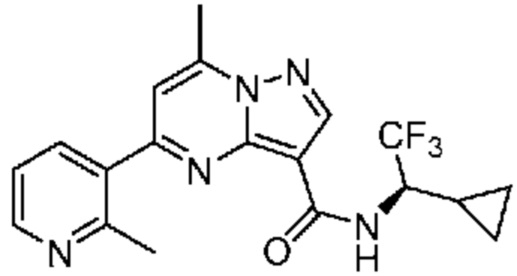
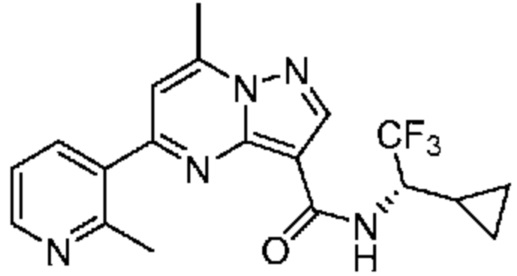
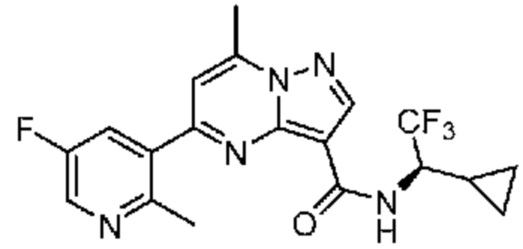
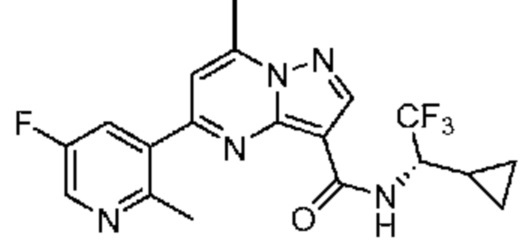
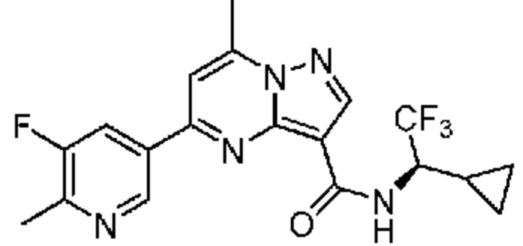
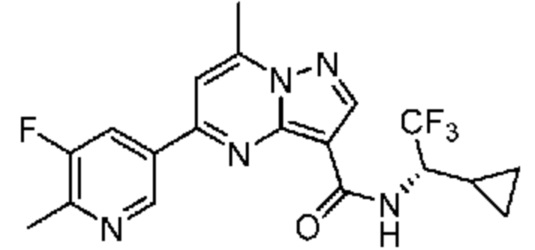
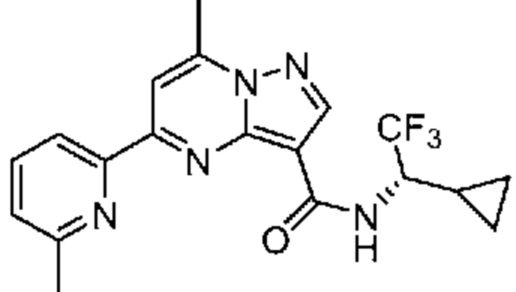
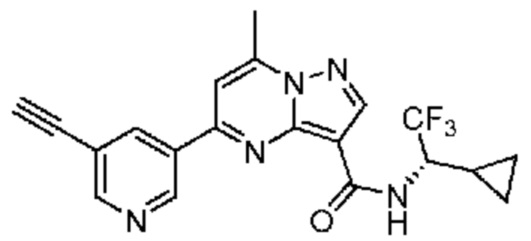
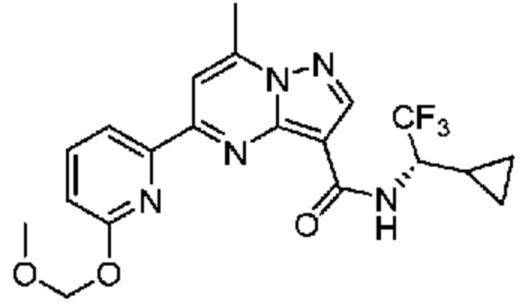
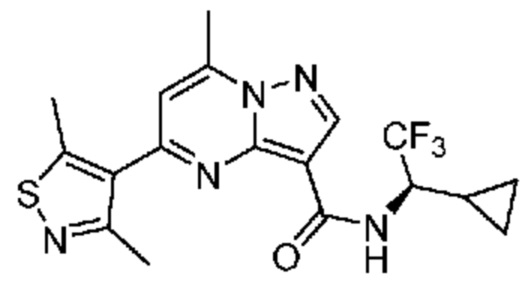
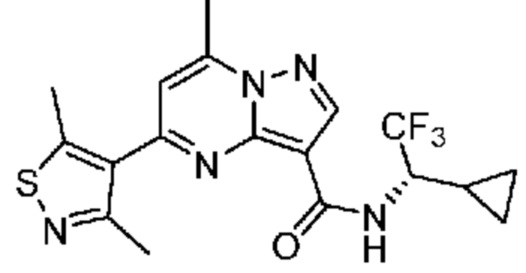
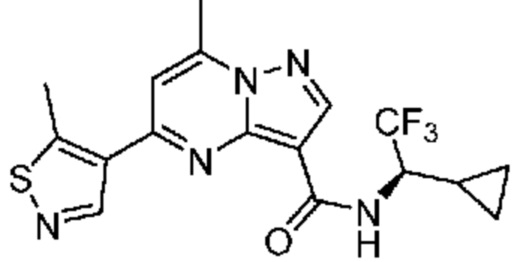
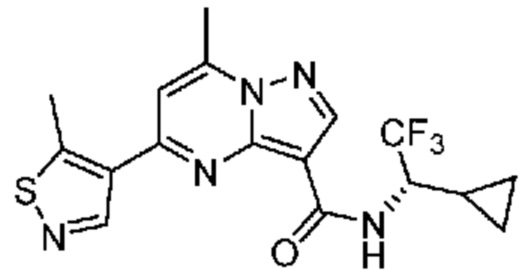
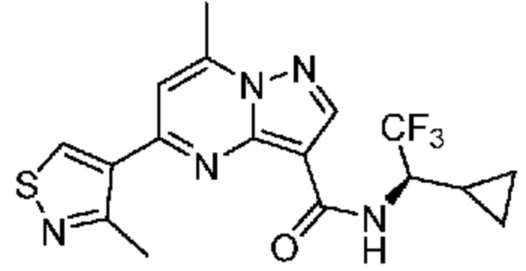
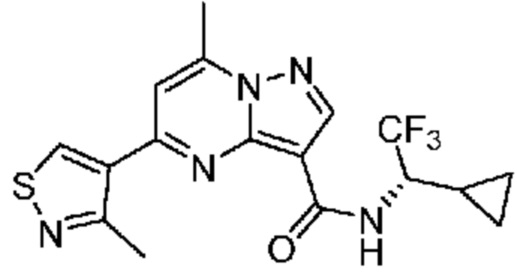
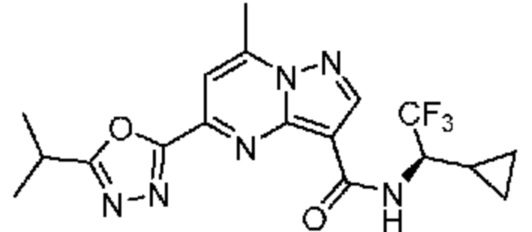
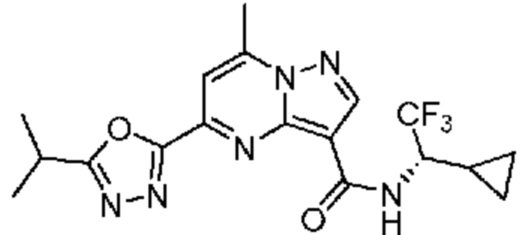

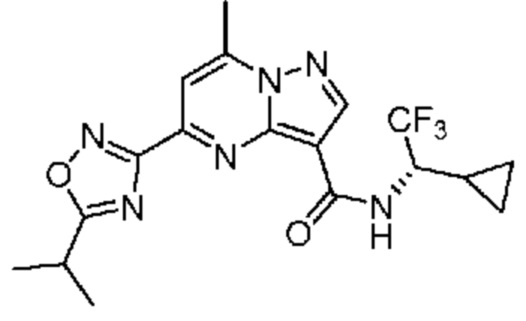

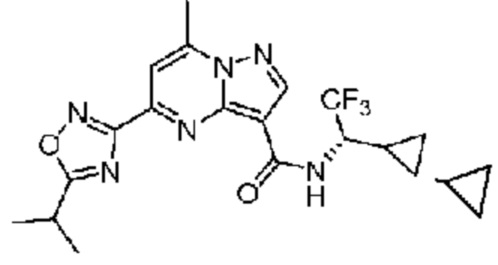
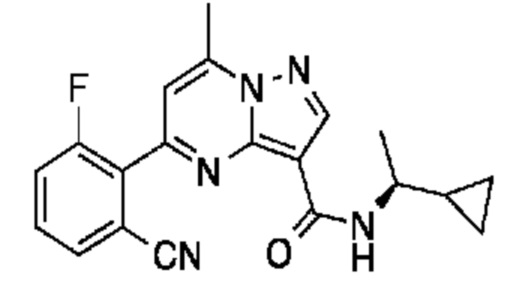
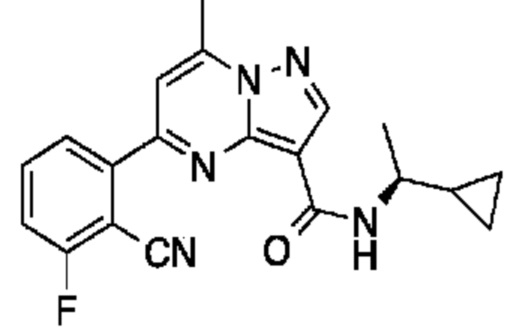
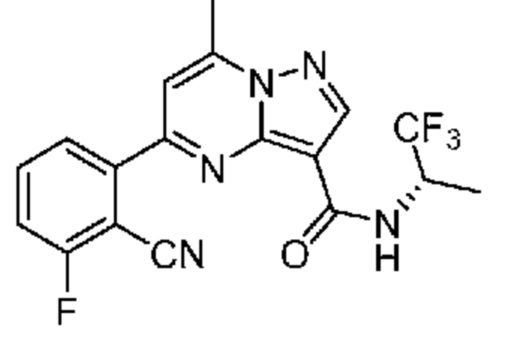
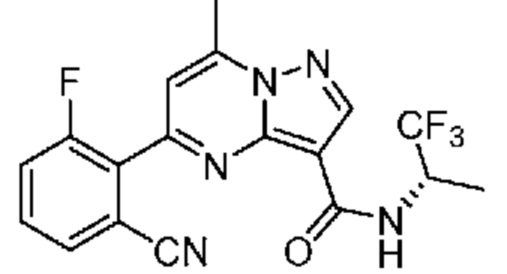
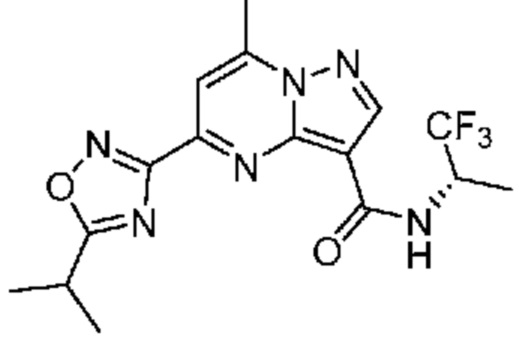
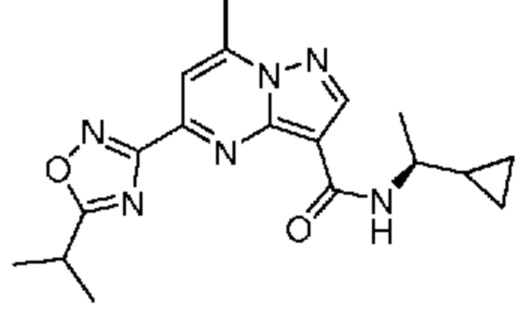
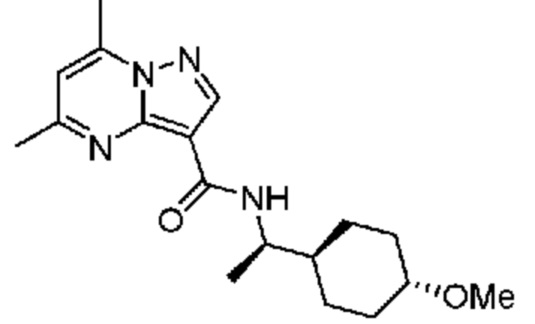
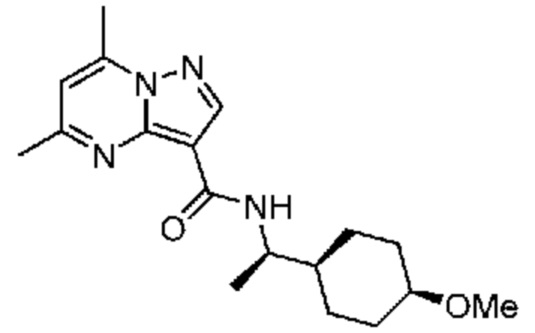
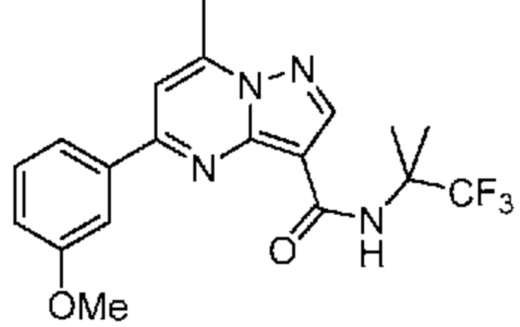
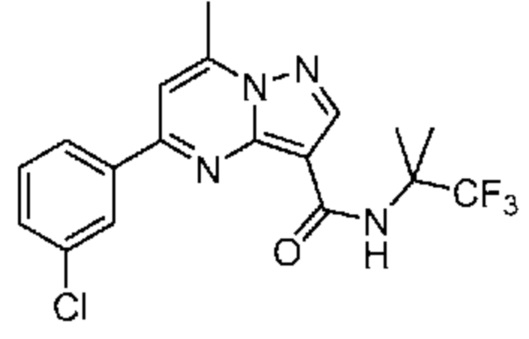
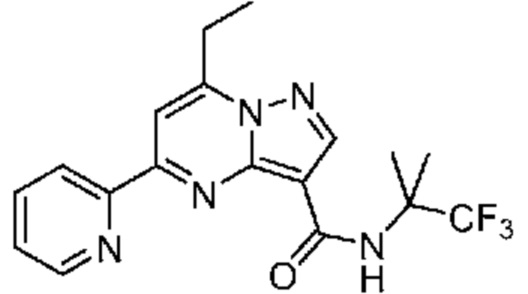
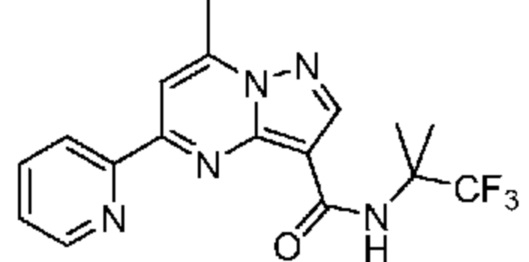
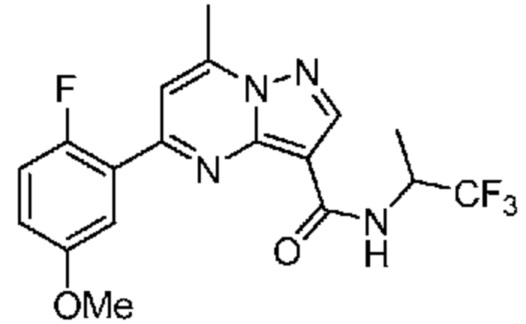
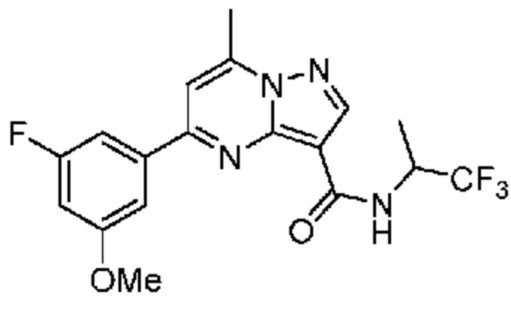
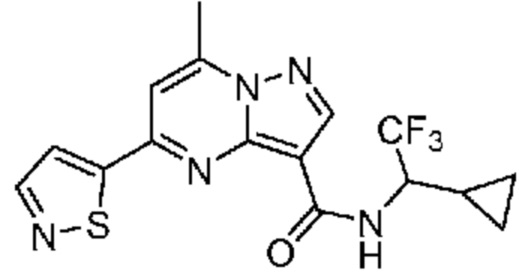
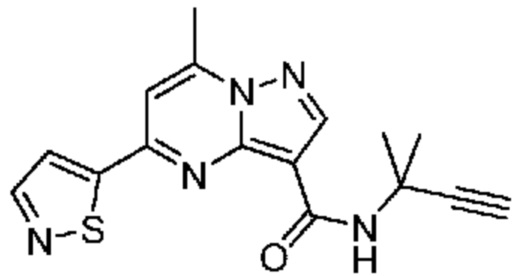
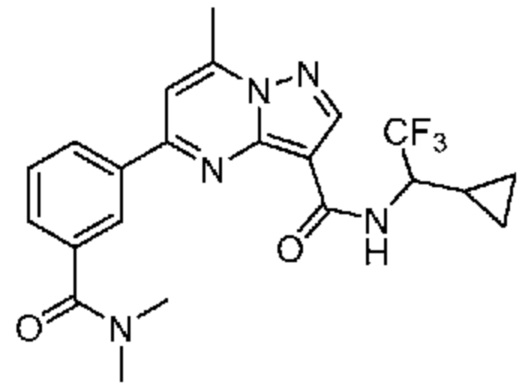
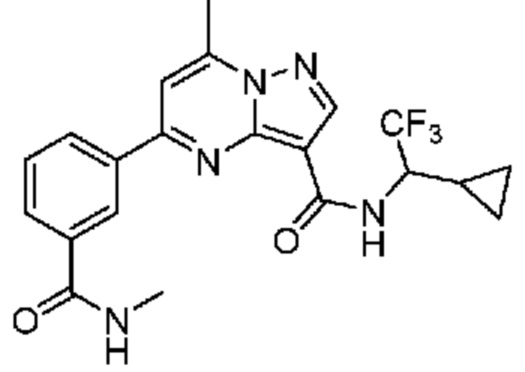
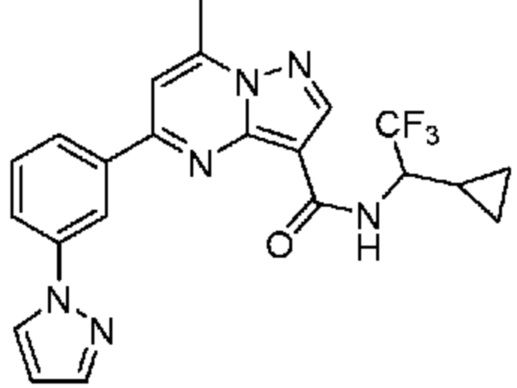

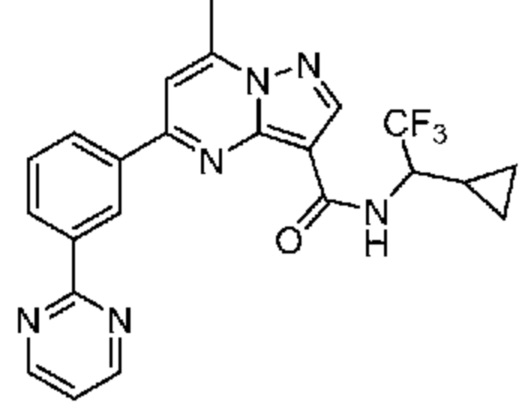
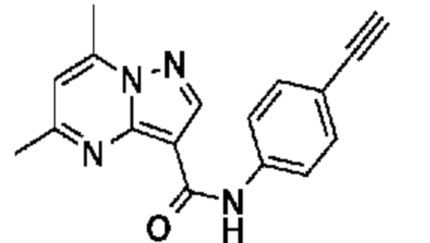
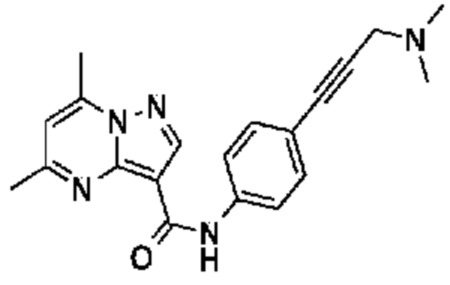
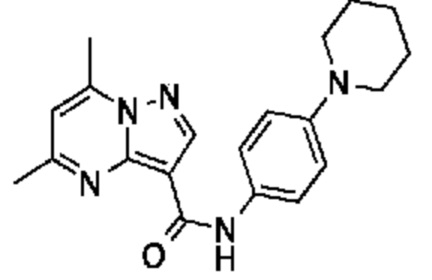
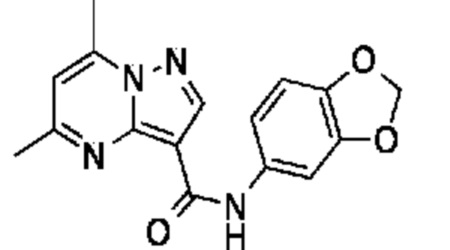
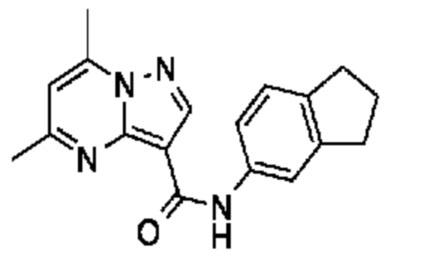
ВКЛЮЧЕНИЕ В КАЧЕСТВЕ ССЫЛКИ
[00919] Полные раскрытия всех патентных документов и научных статей, указанных в настоящем изобретении включены в настоящее изобретение в качестве ссылки для всех объектов.
ЭКВИВАЛЕНТЫ
[00920] Настоящее изобретение можно воплощать в других конкретных формах без отклонения от его сущности или существенных характеристик. Поэтому приведенные выше варианты осуществления следует во всех аспектах рассматривать в качестве иллюстративных, а не ограничивающих описанное изобретение. Таким образом, объем настоящего изобретения определяется формулой изобретения, а не предшествующим описанием, и подразумевается, что все изменения, которые находятся в пределах значения и эквивалентности формулы изобретения, входят в ее объем.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ ИМИДАЗО[1,2-b]ПИРИДАЗИНЫ, ЗАМЕЩЕННЫЕ ИМИДАЗО[1,5-b]ПИРИДАЗИНЫ, РОДСТВЕННЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ | 2017 |
|
RU2773333C2 |
| Применение 1H-пиразоло[4,3-b]пиридинов в качестве ингибиторов PDE1 | 2017 |
|
RU2759380C2 |
| ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ СПИРОПИПЕРИДИНИЛА И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2021 |
|
RU2839891C1 |
| ГИДРОКСИПУРИНОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2685417C1 |
| НОВЫЕ ПИРАЗОЛПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ | 2017 |
|
RU2769448C2 |
| ПУРИНОВЫЕ ИНГИБИТОРЫ ФОСФАТИДИЛИНОЗИТОЛ-3-КИНАЗЫ ДЕЛЬТА ЧЕЛОВЕКА | 2013 |
|
RU2661896C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИДИНА В КАЧЕСТВЕ БЛОКАТОРОВ TTX-S | 2013 |
|
RU2652117C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| СОЕДИНЕНИЯ НА ОСНОВЕ ПИРАЗОЛОПИРИДИНОНА | 2018 |
|
RU2806751C2 |
| НОВЫЕ ЗАМЕЩЕННЫЕ БИАРИЛОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ИНДОЛАМИН-2,3-ДИОКСИГЕНАЗЫ (IDO) | 2018 |
|
RU2786586C2 |
Изобретение относится к соединению формулы I или его фармацевтически приемлемой соли, в которой R1 в каждом случае независимо означает C1-4 алкил; R2 означает водород; R4 в каждом случае независимо означает водород, C1-4 алкил или циклопропил; R7 в каждом случае независимо означает галоген, цианогруппу, C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, -O-(C3-6 циклоалкил), -O-(C1-6 алкилен)-C1-6 алкоксил, -C(O)N(R4)2 или 5-10-членный гетероарил, имеющий от одного до трех гетероатомов, выбранных из азота и кислорода; X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ, где ψ означает связь с A1; где A1 означает 3-5-членный насыщенный карбоциклил, C1-8 алкил или C2-6 алкинил; A2 означает одно из следующих: фенил, 1, 2 или 3 раза замещенный с помощью R7; или циклическую группу, выбранную из группы, включающей 5-6-членный гетероциклил, имеющий от одного до двух гетероатомов, выбранных из азота, кислорода и серы, выбранный из пиперидинила, пирролидинила, морфолинила, бензоимидазолила, пиридинила, тиазолила, бензооксазолила, оксазолила, изоксазолила, тиофенила, фуранила, пиразолила, бензодиоксолила, изотиазолила; 5-6-членный оксогетероциклил, выбранный из оксазолидинила, имидазолидинила, тетрагидропиримидинила; каждый из которых необязательно 1, 2 или 3 раза замещен с помощью R7; и n равно 1 или 2. Изобретение также относится к соединению формулы IV и конкретным соединениям, представленным в формуле изобретения. Изобретение относится к фармацевтической композиции, которая способна активировать глюкоцереброзидазу, включающей эффективное количество соединения по изобретению и фармацевтически приемлемый носитель. Технический результат – соединения пиразоло[1,5-a]пиримидинилкарбоксамида, способные активировать глюкоцереброзидазу и применяемые для лечения болезни Гоше, Паркинсона и болезни телец Леви. 8 н. и 32 з.п. ф-лы, 5 табл.
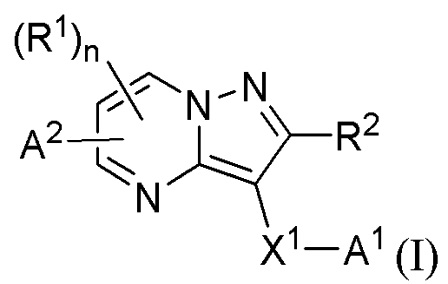
1. Соединение формулы I
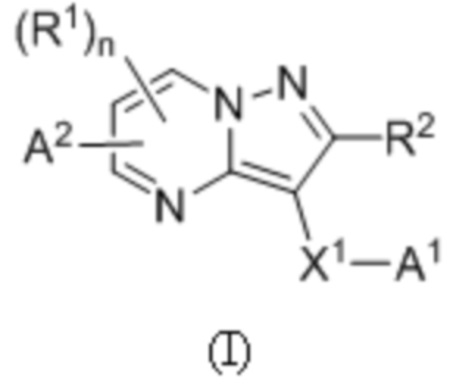
или его фармацевтически приемлемая соль, в которой:
R1 в каждом случае независимо означает C1-4 алкил;
R2 означает водород;
R4 в каждом случае независимо означает водород, C1-4 алкил или циклопропил;
R7 в каждом случае независимо означает галоген, цианогруппу, C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, -O-(C3-6 циклоалкил), -O-(C1-6 алкилен)-C1-6 алкоксил, -C(O)N(R4)2 или 5-10-членный гетероарил, имеющий от одного до трех гетероатомов, выбранных из азота и кислорода;
X1 означает -C(O)N(H)(C1-6 галогеналкилен)-ψ, где ψ означает связь с A1, где A1 означает 3-5-членный насыщенный карбоциклил, C1-8 алкил или C2-6 алкинил;
A2 означает одно из следующих:
фенил, 1, 2 или 3 раза замещенный с помощью R7; или
циклическую группу, выбранную из группы, включающей 5-6-членный гетероциклил, имеющий от одного до двух гетероатомов, выбранных из азота, кислорода и серы, выбранный из пиперидинила, пирролидинила, морфолинила, бензоимидазолила, пиридинила, тиазолила, бензооксазолила, оксазолила, изоксазолила, тиофенила, фуранила, пиразолила, бензодиоксолила, изотиазолила; 5-6-членный оксогетероциклил, выбранный из оксазолидинила, имидазолидинила, тетрагидропиримидинила; каждый из которых необязательно 1, 2 или 3 раза замещен с помощью R7; и
n равно 1 или 2.
2. Соединение по п. 1, в котором X1 означает -C(O)N(H)C(H)(CF3)-ψ.
3. Соединение по п. 1 или 2, в котором A2 означает фенил, содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, цианогруппу, галоген.
4. Соединение по любому из пп. 1-3, в котором A2 означает фенил, содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, цианогруппу и галоген, в котором содержится по меньшей мере один заместитель в мета-положении в фенильной группе.
5. Соединение по любому из пп. 1-4, в котором A2 означает фенил, замещенный в одном мета-положении C1-4 алкоксилом, цианогруппой или галогеном и необязательно замещенный где-либо в фенильной группе C1-4 алкилом, C1-4 галогеналкилом, C1-4 алкоксилом или галогеном.
6. Соединение по любому из пп. 1-4, в котором A2 означает фенил, замещенный C1-4 алкоксилом, цианогруппой или галогеном.
7. Соединение по любому из пп. 1-4, в котором A2 означает фенил, замещенный в одном мета-положении C1-4 алкоксилом, цианогруппой или галогеном.
8. Соединение по любому из пп. 1-4, в котором A2 означает 5-6-членный гетероциклил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, цианогруппу и галоген.
9. Соединение по любому из пп. 1-4, в котором A2 означает пиридинил, необязательно содержащий 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, цианогруппу и галоген.
10. Соединение по любому из пп. 1-4, в котором A2 означает 5-6-членный гетероциклоалкил, выбранный из группы, включающей морфолинил, пиперидинил и пирролидинил, каждый из которых необязательно содержит 1, 2 или 3 заместителя, независимо выбранных из группы, включающей C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксил, цианогруппу и галоген.
11. Соединение по любому из пп. 1-10, в котором A2 расположен в положении 5 пиразоло[1,5-a]пиримидинила.
12. Соединение по любому из пп. 1-10, в котором A2 расположен в положении 7 пиразоло[1,5-a]пиримидинила.
13. Соединение по любому из пп. 1-12, в котором n равно 1.
14. Соединение по п. 13, в котором n равно 1 и группа R1 расположена в положении 7 пиразоло[1,5-a]пиримидинила.
15. Соединение по п. 13, в котором n равно 1 и группа R1 расположена в положении 5 пиразоло[1,5-a]пиримидинила.
16. Соединение формулы IV
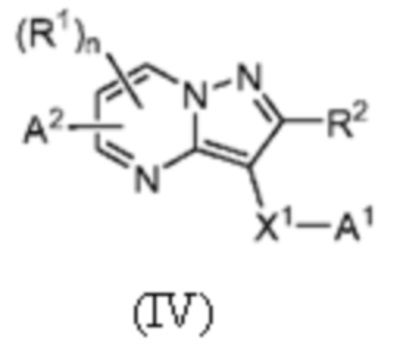
или его фармацевтически приемлемая соль, в которой:
R1 в каждом случае независимо означает C1-4 алкил;
R2 означает водород;
R7 в каждом случае независимо означает C1-4 алкил, C1-4 галогеналкил или фенил;
A2 означает одно из следующих:
фенил;
5-6-членный оксогетероциклил, выбранный из оксазолидина, имидазолидина и пирролидина, необязательно 1, 2 или 3 раза замещенный с помощью R7; или
6-членный гетероарил, имеющий один гетероатом, выбранный из азота, который замещен C2-4 алкинилом;
X1-A1 означает следующее:
(i) если A2 означает фенил, то X1-A1 означает -C(O)N(H)(C1-6 галогеналкилен)-циклопропил;
(ii) если A2 означает 5-6-членный оксогетероциклил, необязательно 1, 2 или 3 раза замещенный с помощью R7, то X1-A1 означает -C(O)N(H)(C1-6 галогеналкилен)-(C3-6 циклоалкил) или -C(O)N(H)(C1-6 галогеналкилен)-(C1-6 алкил); или
(iii) если A2 означает 6-членный гетероарил, имеющий один гетероатом, выбранный из азота, который замещен C2-4 алкинилом, то X1-A1 означает -C(O)N(H)(C1-6 галогеналкилен)-(C3-6 циклоалкил); и
n равно 1 или 2.
17. Соединение, выбранное из группы, состоящей из:
 ,
, 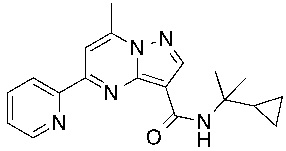 ,
, 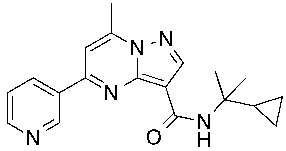 ,
,
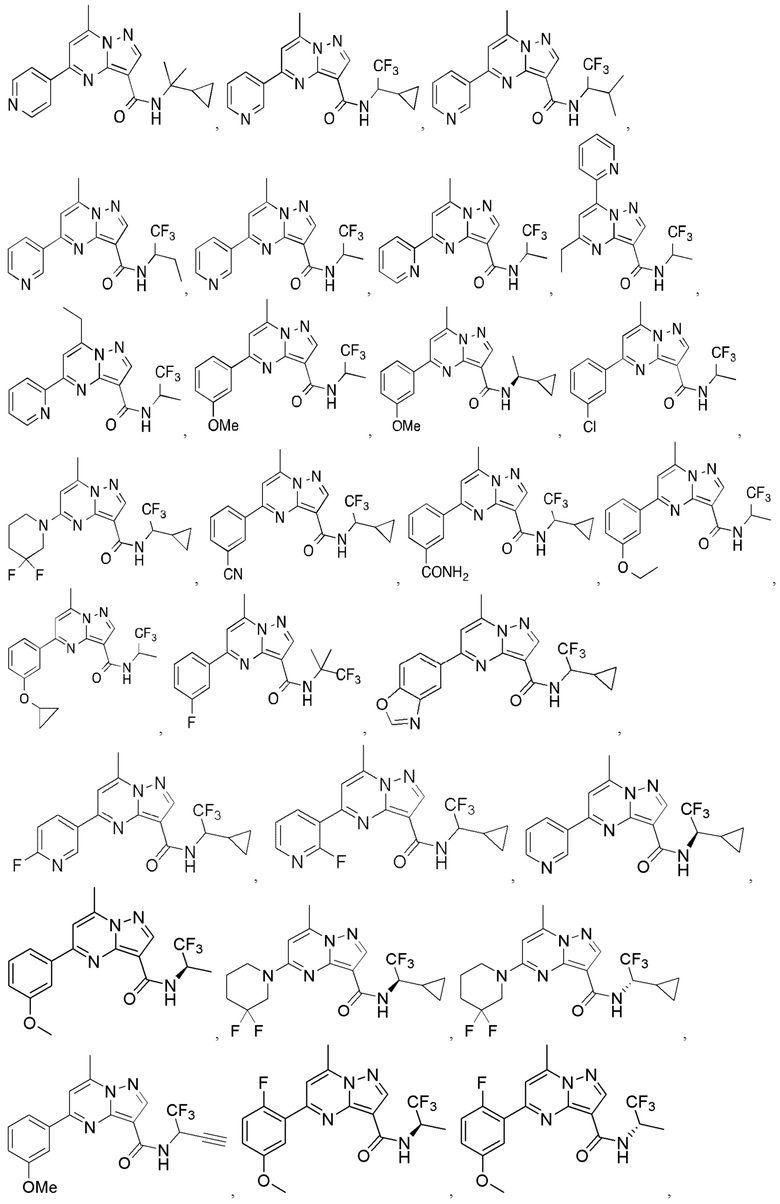
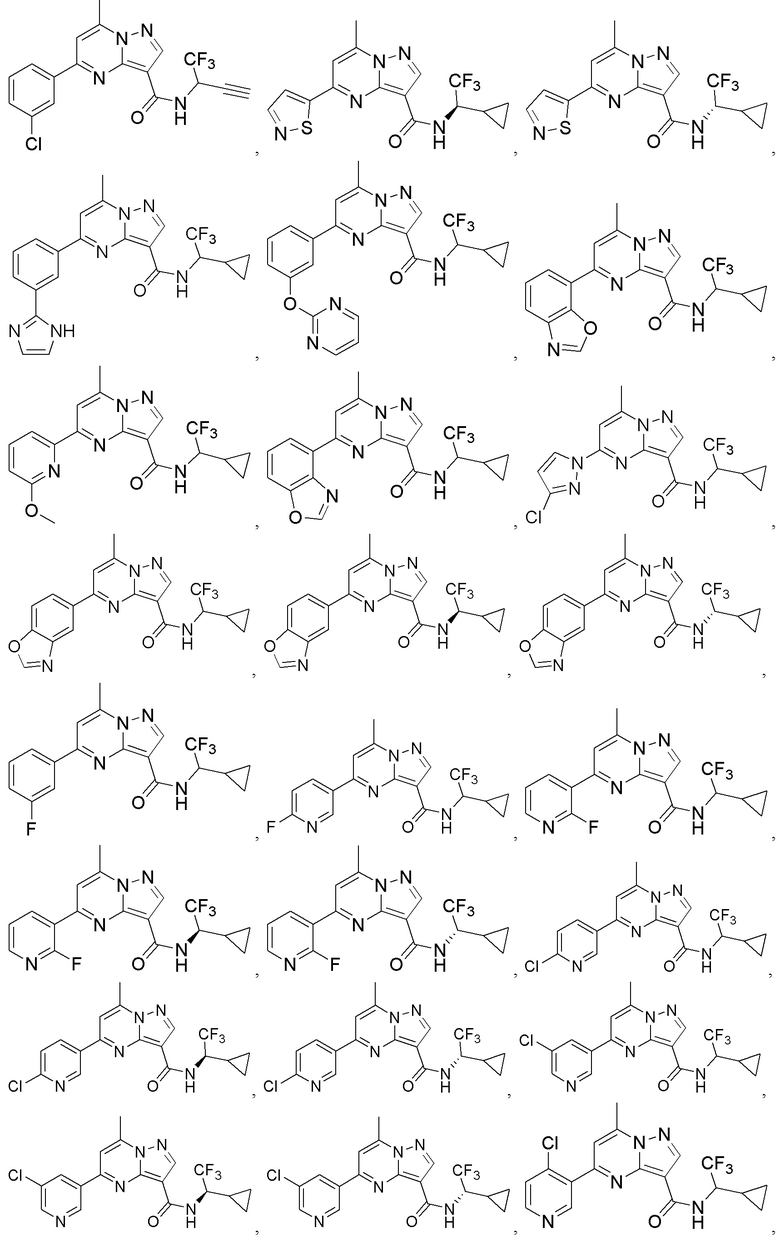
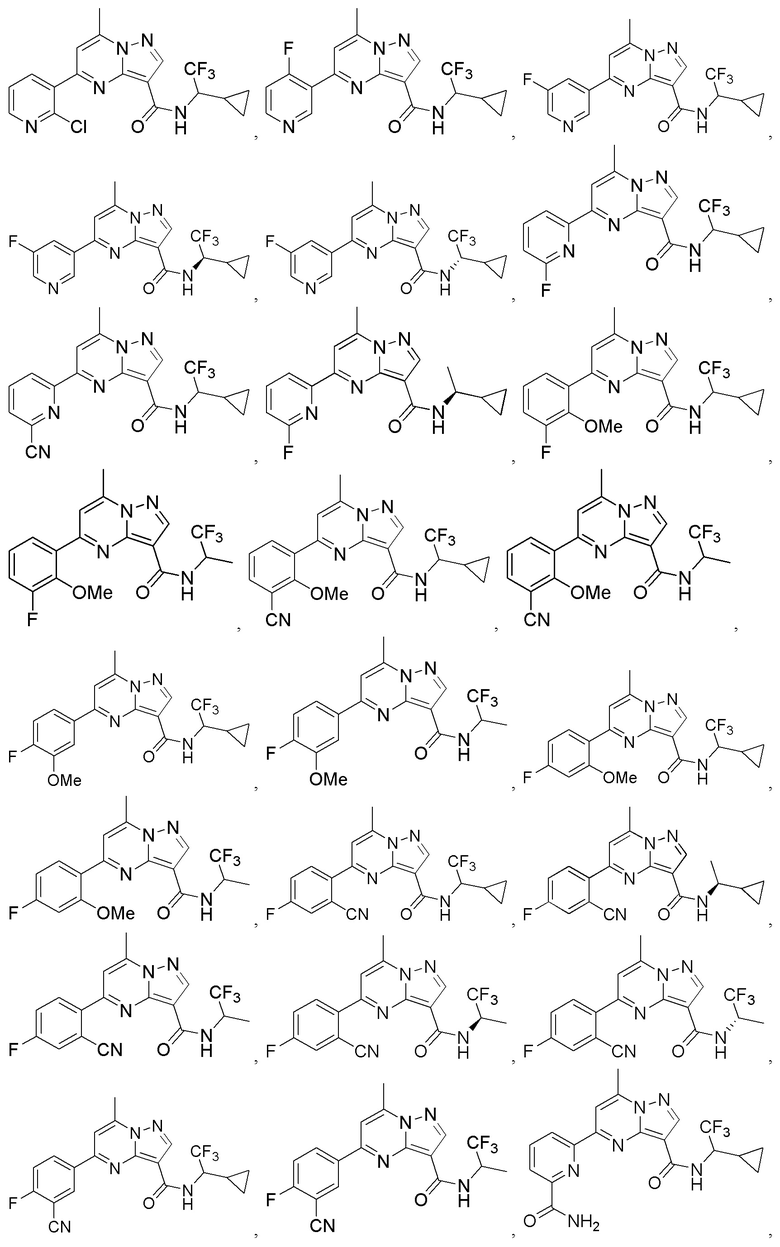
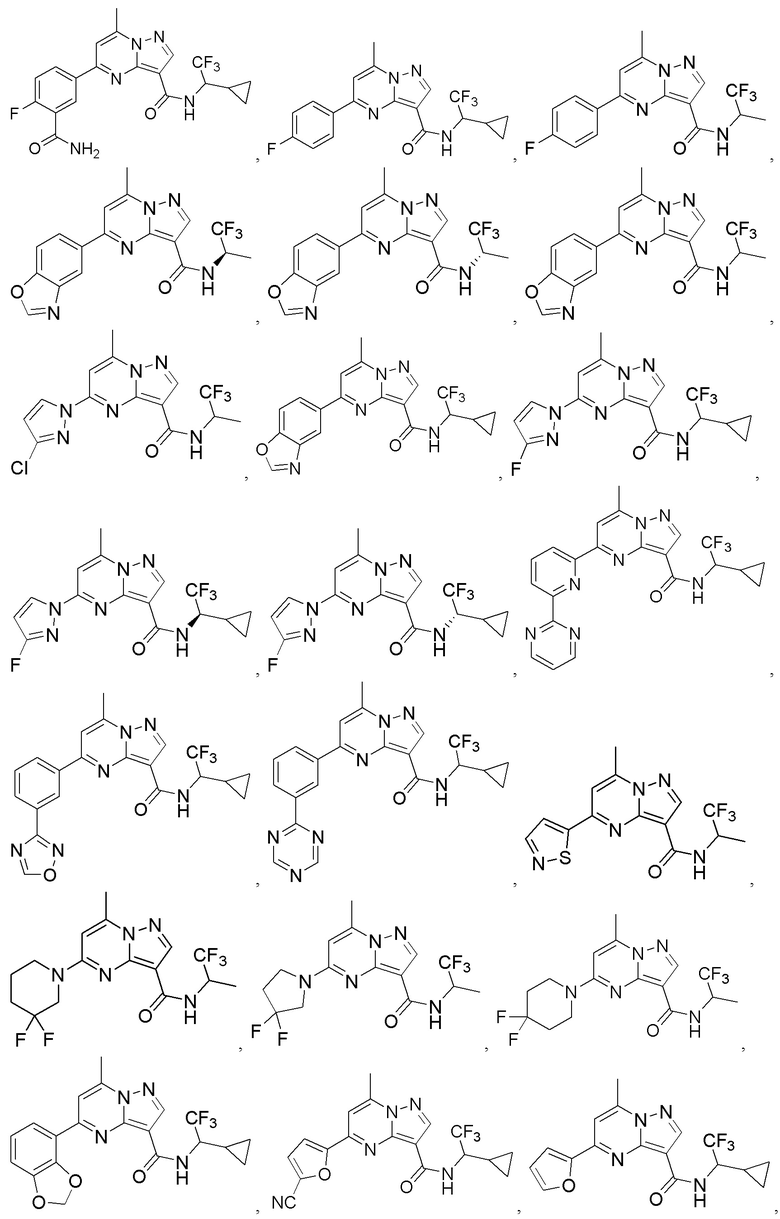
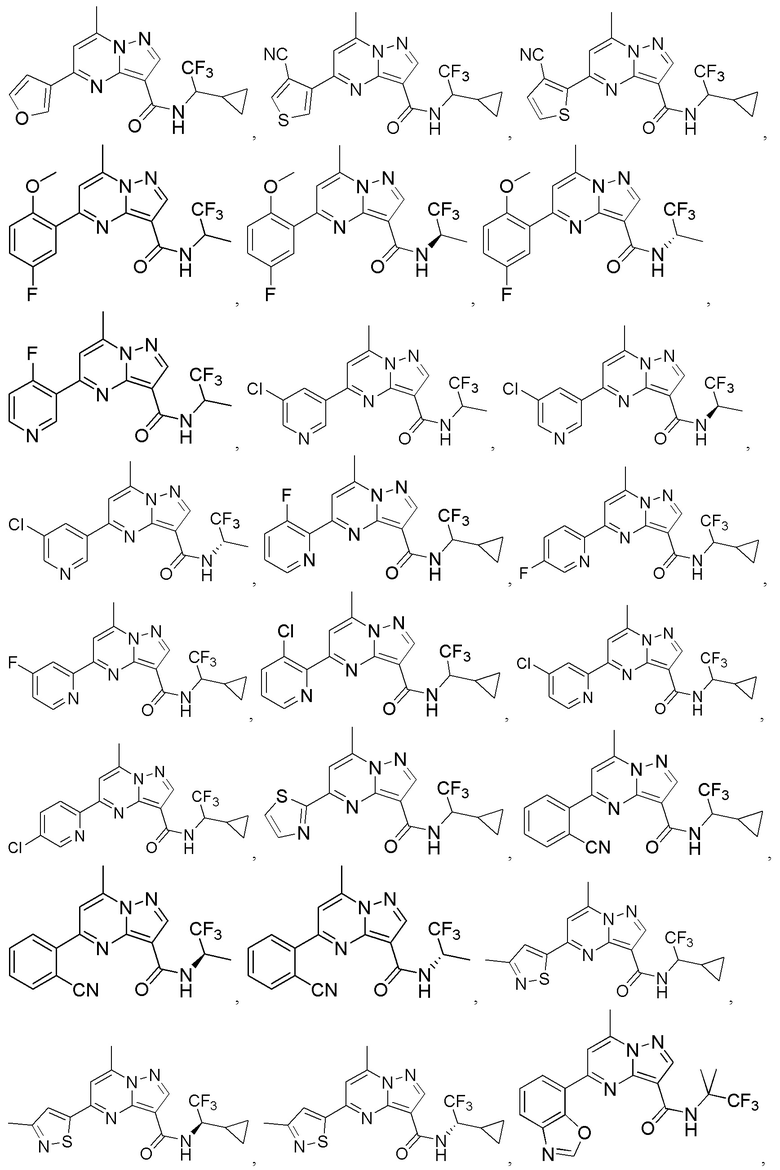
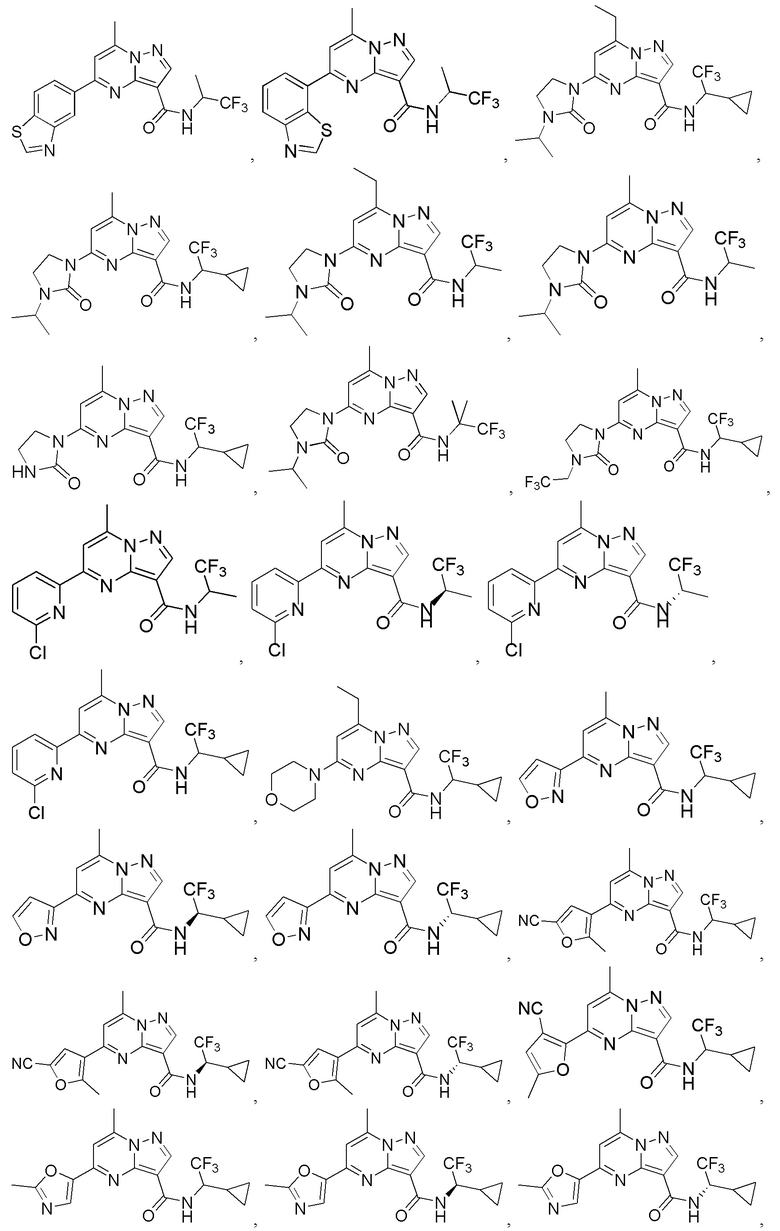
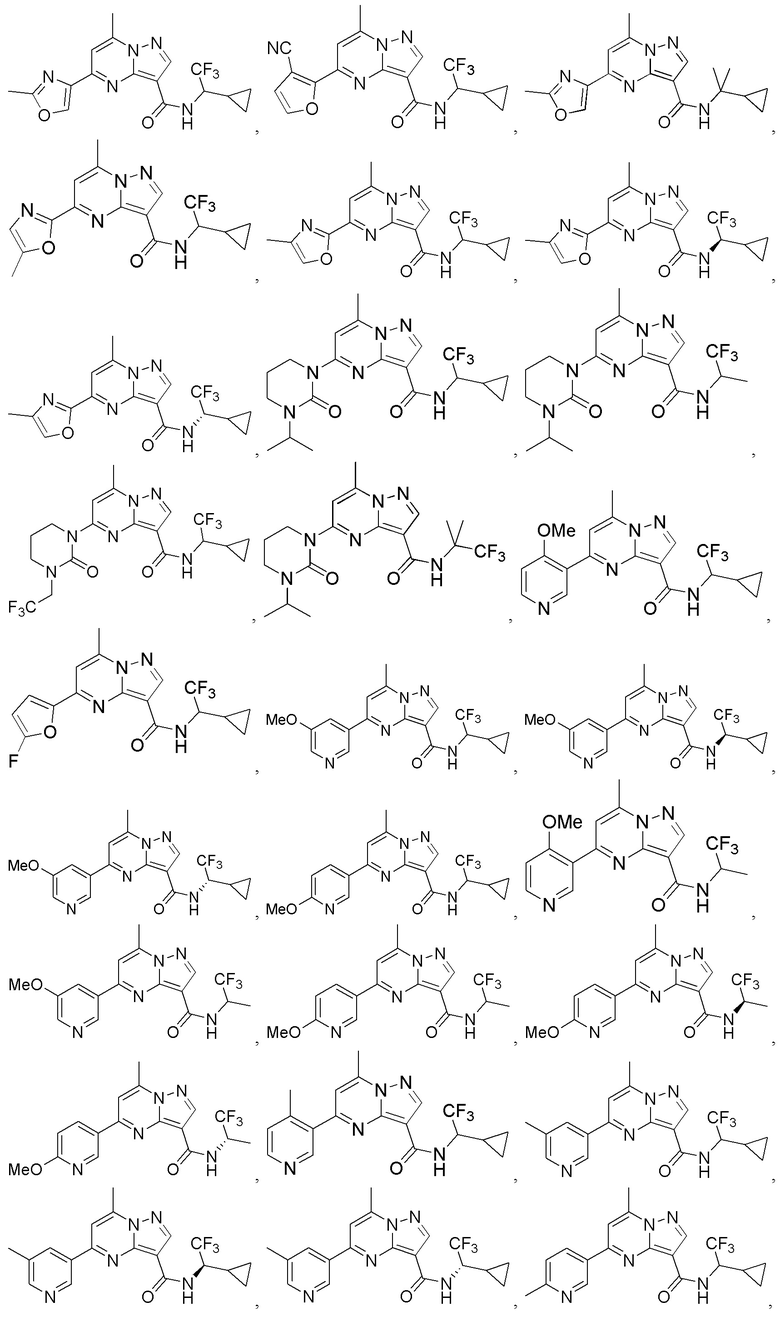
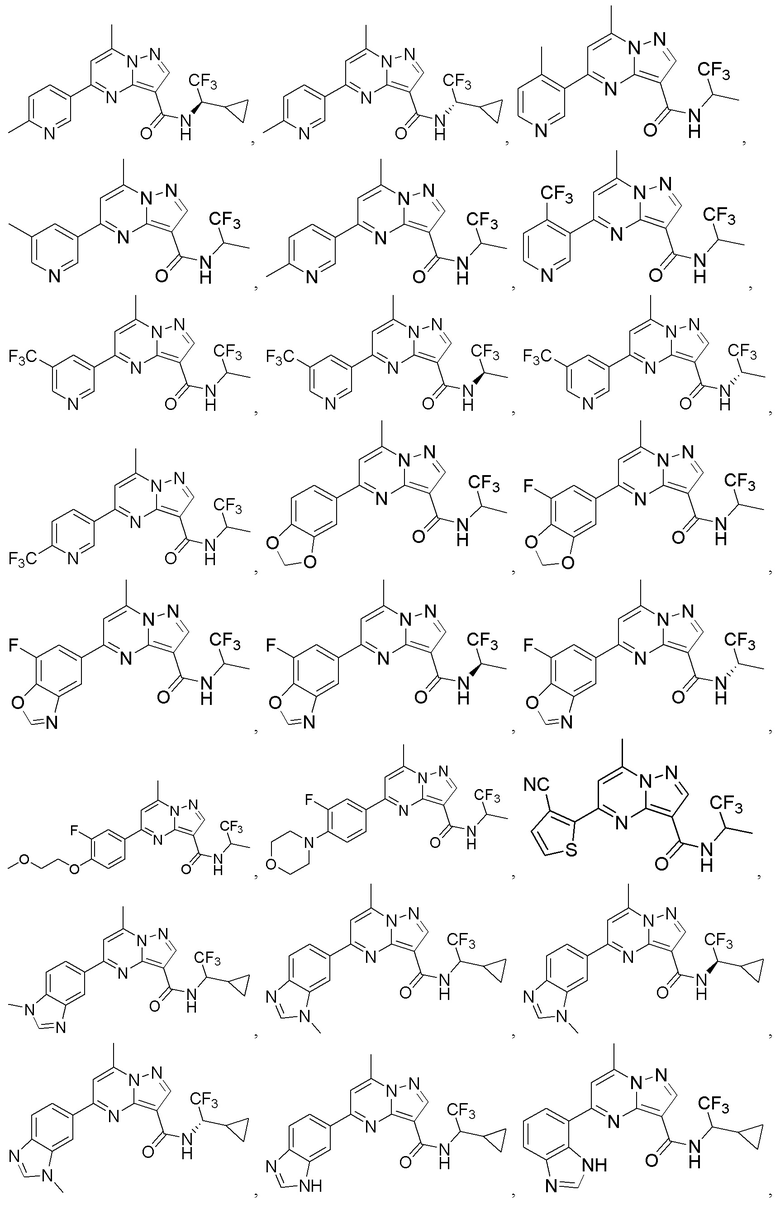
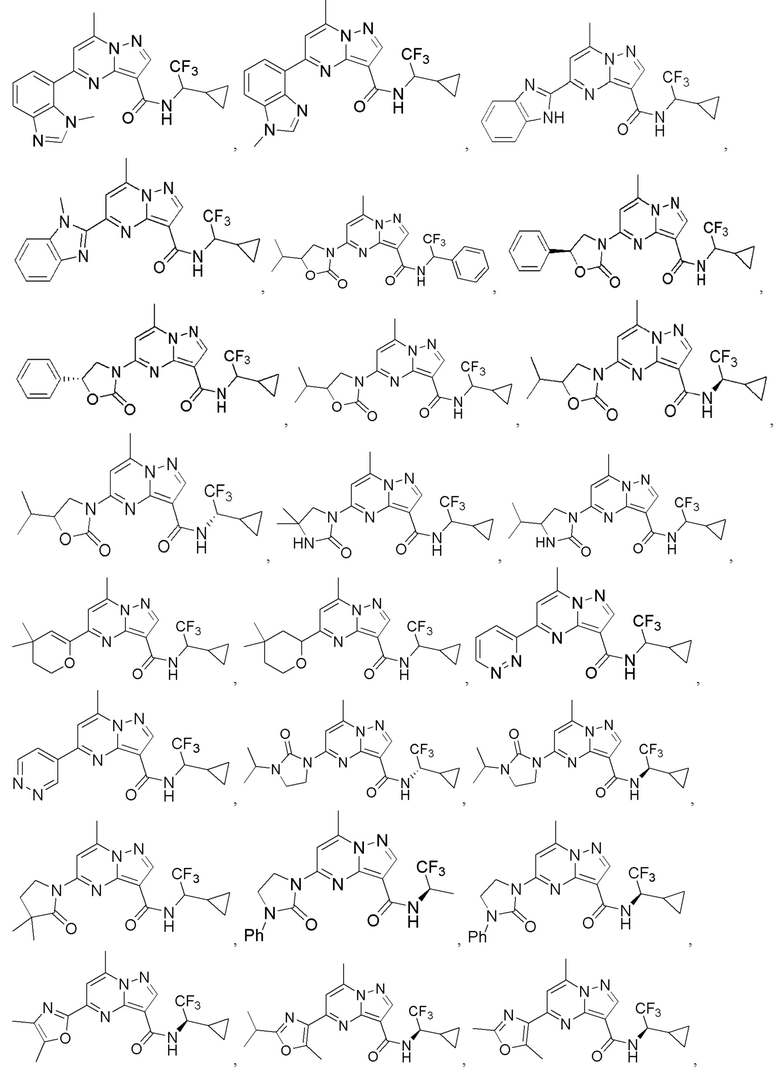
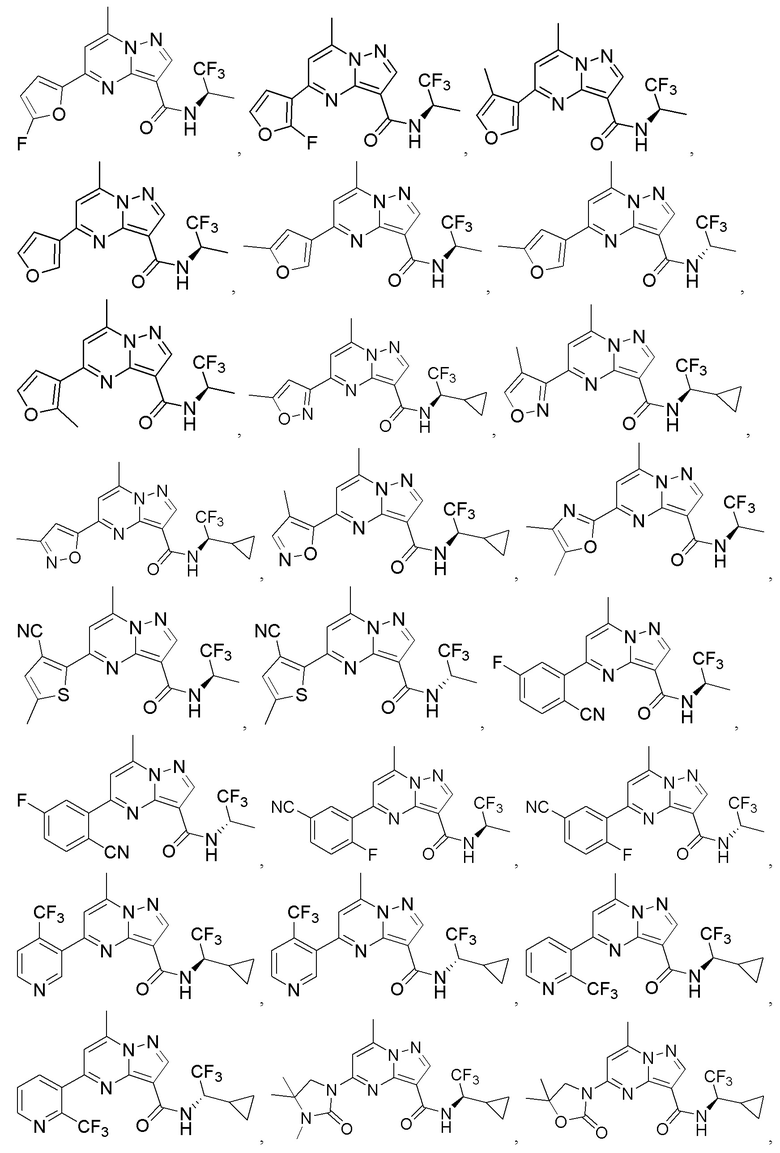
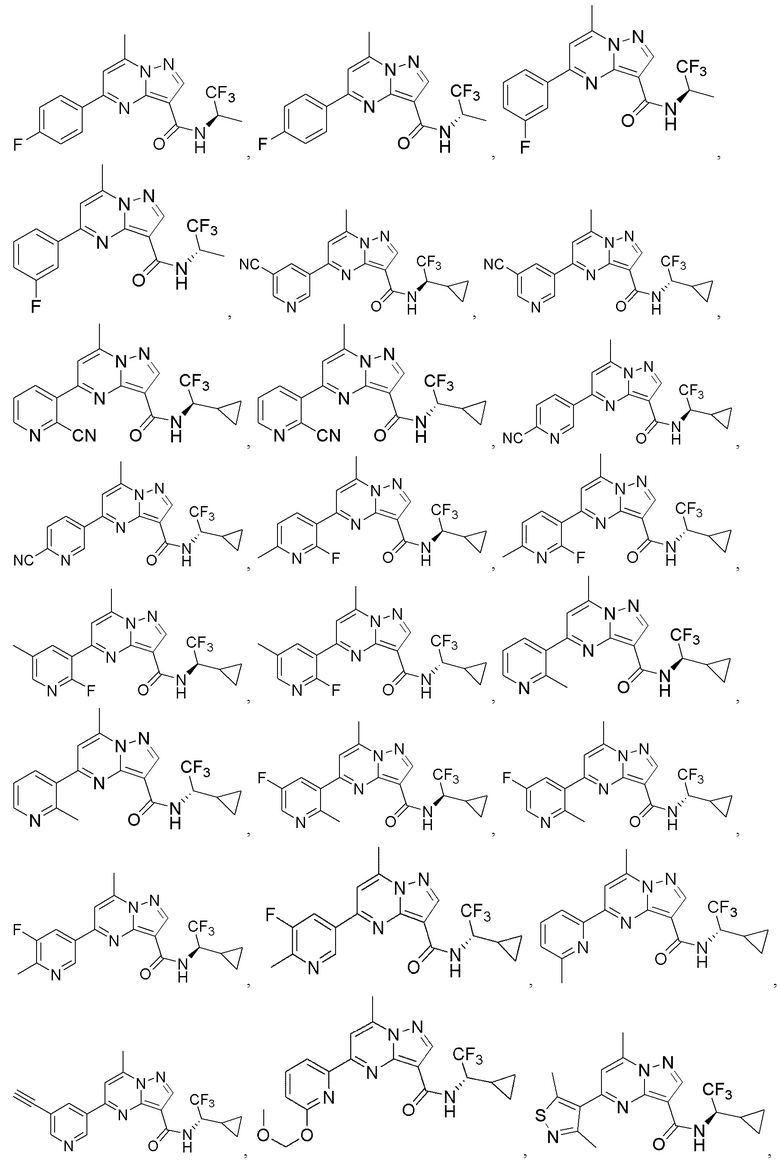
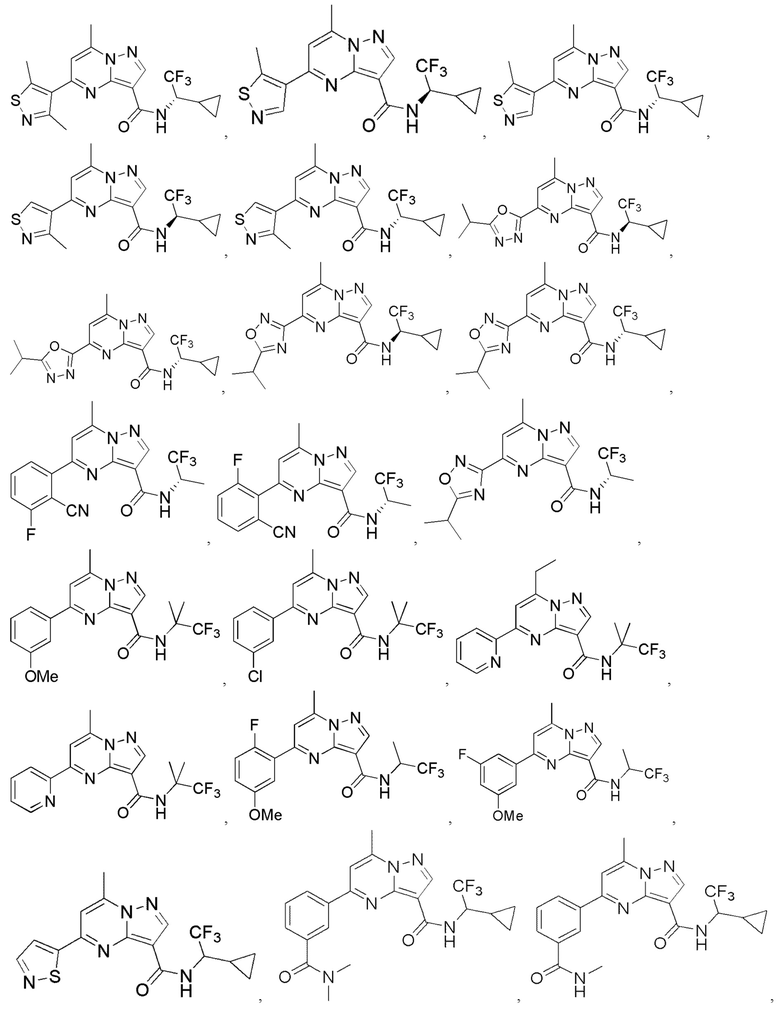
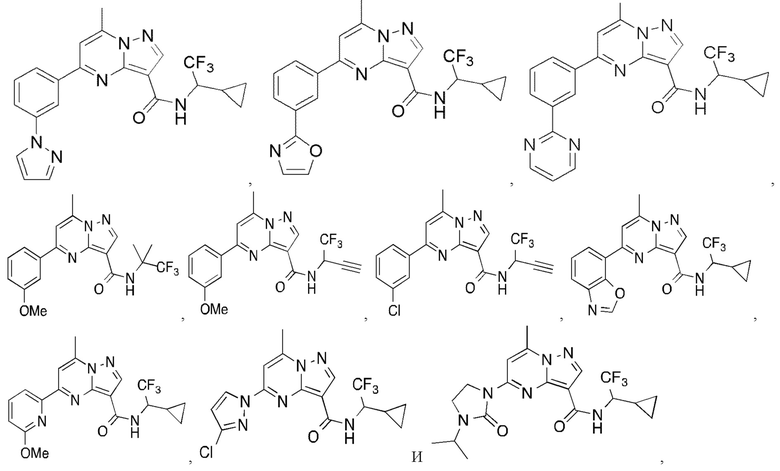
или его фармацевтически приемлемая соль.
18. Соединение по п. 17, представляющее собой
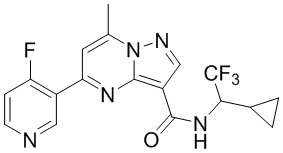 ,
,
или его фармацевтически приемлемая соль.
19. Соединение по п. 17, представляющее собой
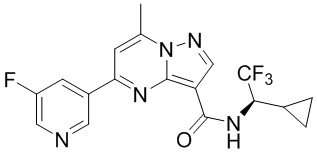 ,
,
или его фармацевтически приемлемая соль.
20. Соединение по п. 17, представляющее собой
 .
.
21. Соединение по п. 17, представляющее собой
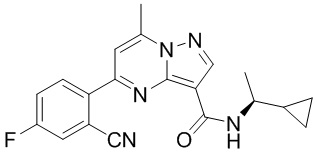 ,
,
или его фармацевтически приемлемая соль.
22. Соединение по п. 21, представляющее собой
 .
.
23. Соединение по п. 17, представляющее собой
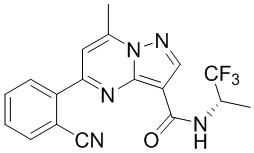 ,
,
или его фармацевтически приемлемая соль.
24. Соединение по п. 23, представляющее собой
 .
.
25. Соединение по п. 17, представляющее собой
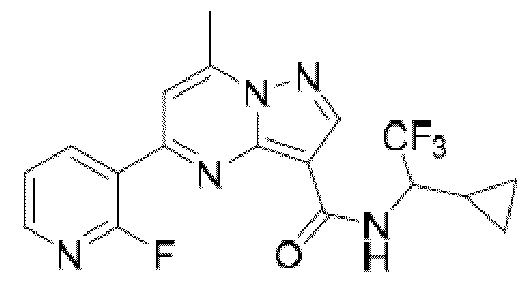 ,
,
или его фармацевтически приемлемая соль.
26. Соединение по п. 17, представляющее собой
 ,
,
или его фармацевтически приемлемая соль.
27. Соединение по п. 26, представляющее собой
 .
.
28. Соединение по п. 17, представляющее собой
 ,
,
или его фармацевтически приемлемая соль.
29. Соединение по п. 28, представляющее собой
 .
.
30. Соединение по п. 17, представляющее собой
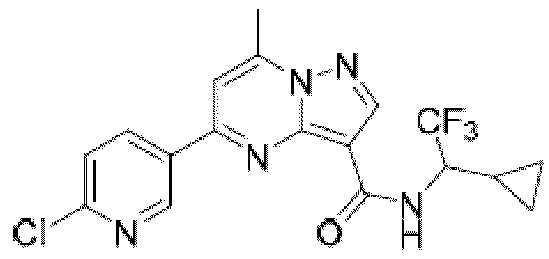 ,
,
или его фармацевтически приемлемая соль.
31. Соединение по п. 17, представляющее собой
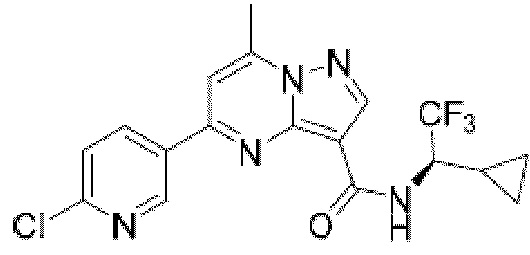 ,
,
или его фармацевтически приемлемая соль.
32. Соединение по п. 31, представляющее собой
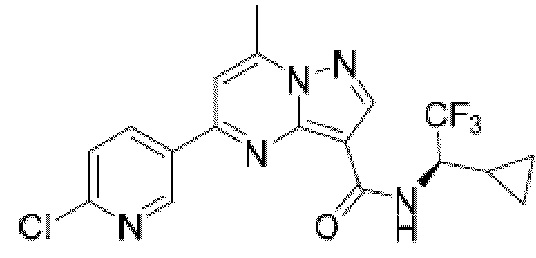 .
.
33. Соединение по п. 17, представляющее собой
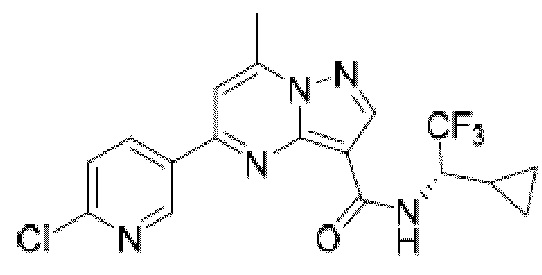 ,
,
или его фармацевтически приемлемая соль.
34. Соединение по п. 33, представляющее собой
 .
.
35. Фармацевтическая композиция, которая способна активировать глюкоцереброзидазу, включающая эффективное количество соединения по любому из пп. 1-16 и фармацевтически приемлемый носитель.
36. Фармацевтическая композиция, которая способна активировать глюкоцереброзидазу, включающая эффективное количество соединения по любому из пп. 17-34 и фармацевтически приемлемый носитель.
37. Способ лечения болезни Гоше путем активации глюкоцереброзидазы, включающий введение нуждающемуся в нем пациенту терапевтически эффективного количества соединения по любому из пп. 1-34 или его фармацевтически приемлемой соли или фармацевтической композиции по п. 35 или 36 для лечения нарушения.
38. Способ лечения болезни Паркинсона путем активации глюкоцереброзидазы, включающий введение нуждающемуся в нем пациенту терапевтически эффективного количества соединения по любому из пп. 1-34 или его фармацевтически приемлемой соли или фармацевтической композиции по п. 35 или 36 для лечения нарушения.
39. Способ лечения болезни телец Леви путем активации глюкоцереброзидазы, включающий введение нуждающемуся в нем пациенту терапевтически эффективного количества соединения по любому из пп. 1-34 или его фармацевтически приемлемой соли или фармацевтической композиции по п. 35 или 36 для лечения нарушения.
40. Способ по любому из пп. 37-39, в котором пациентом является человек.
| WO 2007048066 A2, 26.04.2007 | |||
| WO 2014141129 A9, 18.09.2014 | |||
| WO 2015073267 A1, 21.05.2015 | |||
| WO 2015012328 A1, 29.01.2015 | |||
| WO 2012075393 A2, 07.06.2012 | |||
| RU 2013126094 A, 20.01.2015 | |||
| WO 2005123738 A1, 29.12.2005 | |||
| WO 2006084634 A1, 17.08.2006 | |||
| RU 2014120166 A, 27.11.2015 | |||
| Brogi, S., Papazafiri, P., Roussis, V., & Tafi, A | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2023-07-04—Публикация
2017-04-06—Подача