Ссылка на родственные заявки
По этой заявке испрашивается приоритет по предварительной Заявке США No. 61/944,189, поданной 25 февраля 2014, предварительной Заявке США No. 62/022,916, поданной 10 июля 2014, и предварительной Заявке США No. 62/046,783, поданной 5 сентября 2014. Полнота каждой из этих заявок включена в настоящее описание посредством отсылки для всех целей.
Уровень техники
Система комплемента представляет собой часть врожденной иммунной системы, которая не приспосабливается к изменениям в течение жизни хозяина, но рекрутируется и используется адаптивной иммунной системой. Например, она помогает, или дополняет способности антител и фагоцитарных клеток удалять патогены. Этот сложный регуляторный путь позволяет быстро реагировать на патогенные организмы, защищая клетки-хозяева от разрушения. Более тридцати белков и белковых фрагментов составляют систему комплемента. Эти белки действуют через опсонизацию (усиливая фагоцитоз антигенов), хемотаксис (привлекая макрофагов и нейтрофилов), лизис клеток (разрывая мембраны чужеродных клеток) и агглютинацию (кластеризуя и связывая патогены вместе).
Система комплемента имеет три пути: классический, альтернативный и лектиновый. Фактор D комплемента играет раннюю и центральную роль в активации альтернативного пути каскада комплемента. Активация альтернативного пути комплемента инициируется спонтанным гидролизом тиоэфирной связи в С3 с получением С3(H2O), который связывается с фактором B с образованием комплекса С3(H2O)В. Фактор D комплемента действует, расщепляя фактор В в комплексе С3(H2O)B с образованием Ba и Bb. Фрагмент Bb остается связанным с С3(H2O) с образованием альтернативного пути C3 конвертазы С3(H2O)Bb. Кроме того, C3b, полученный любыми из C3 конвертаз, также связывается с фактором B с образованием C3bB, который расщепляет фактор D с получением более поздней стадии альтернативного пути C3 конвертазы C3bBb. Эта последняя форма альтернативного пути C3 конвертазы может обеспечивать важную амплификацию в нисходящем направлении B течение всех трех обозначенных путей комплемента, что приводит в конечном итоге к рекрутменту и сборке дополнительных факторов в каскадном пути комплемента, включая расщепление С5 на С5а и C5b. С5b действует в сборке факторов С6, С7, С8 и С9 в мембранный атакующий комплекс, который может уничтожать патогенные клетки путем лизиса клетки.
Дисфункция или чрезмерная активация комплемента связывалась с определенными аутоиммунными, воспалительными и нейродегенеративными заболеваниями, а также с ишемическо-реперфузионным повреждением и раком. Например, активация альтернативного пути каскада комплемента способствует получению C3а и С5а, оба являются сильнодействующими анафилатоксинами, которые также играют роль в ряде воспалительных расстройств. Таким образом, в некоторых случаях желательно уменьшить ответ пути комплемента, включая альтернативный путь комплемента. Некоторые примеры расстройств, опосредованных путем комплемента, включают возрастную макулярную дегенерацию (AMD), пароксизмальную ночную гемоглобинурию (PNH), рассеянный склероз и ревматоидный артрит.
Возрастная макулярная дегенерация (AMD) является ведущей причиной потери зрения в промышленно развитых странах. На основании ряда генетических исследований имеются данные о связи между каскадом комплемента и дегенерацией желтого пятна. Индивидуумы с мутациями в гене, кодирующем фактор Н комплемента, имеют пятикратно повышенный риск развития макулярной дегенерации, и индивидуумы с мутациями в других генах фактора комплемента также имеют повышенный риск развития AMD. Лица с мутантным фактором Н также имеют повышенные уровни C-реактивного белка, маркера воспаления. Без адекватного функционирования фактора Н альтернативный путь каскада комплемента чрезмерно активизируется, что приводит к повреждению клеток. Таким образом, желательно ингибирование альтернативного пути.
Пароксизмальная ночная гемоглобинурия (PNH) представляет собой доброкачественное, гематологическое заболевание, характеризующееся расширением гемопоэтических стволовых клеток и потомства зрелых клеток крови, которые дефицитны в некоторых поверхностных белках. Эритроциты PNH не способны модулировать свою поверхностную активацию комплемента, что приводит к типичной отличительной черте PNH: опосредованной хронической активацией комплемента внутрисосудистой анемии. В настоящее время только один продукт, анти-С5 моноклональное антитело экулизумаб, был одобрен в США для лечения PNH. Тем не менее, многие из пациентов, получавших экулизумаб, остаются с анемией, и многим пациентам по-прежнему требуются переливания крови. Кроме того, лечение экулизумабом требует внутривенных инъекций на протяжении всей жизни. Таким образом, существует неудовлетворенная потребность в разработке новых ингибиторов пути комплемента.
Фактор D представляет собой привлекательную мишень для ингибирования или регуляции каскада комплемента в связи с его ранней и важной ролью в альтернативном пути комплемента, а также его потенциальной ролью сигнальной амплификации в классических и лектиновых путях комплемента. Ингибирование фактора D эффективно прерывает путь и подавляет образование мембранного атакующего комплекса.
В то время как были сделаны первоначальные попытки разработки ингибиторов фактора D, в настоящее время не существует низкомолекулярных ингибиторов фактора D в клинических испытаниях. Примеры ингибиторов фактора D или пролильных соединений описаны в последующих раскрытиях.
В патенте США No. 6653340 BioCryst Pharmaceuticals под названием «Соединения, пригодные в комплементном, коагулятном и калликреиновом путях, и способ их получения» описываются слитые бициклические кольцевые соединения, которые являются потенциальными ингибиторами фактора D. Разработка ингибитора фактора D ВСХ1470 была прекращена из-за отсутствия специфичности и короткого периода полураспада соединения.
В патентной публикации РСТ WO 2012/093101 Novartis под названием «Индольные соединения или их аналоги, пригодные для лечения возрастной макулярной дегенерации» описываются некоторые ингибиторы фактора D.
В патентных публикациях РСТ WO 2014/002057 Novartis под названием «Производные пирролидина и их применение в качестве модуляторов пути комплемента» и WO 2014/009833 под названием «Модуляторы пути комплемента и их применение» описываются дополнительные ингибиторы фактора D с гетероциклическими заместителями. Дополнительные ингибиторы фактора D описаны в патентных публикациях РСТ Novartis WO 2014/002051, WO 2014/002052, WO 2014/002053, WO 2014/002054, WO 2014/002058, WO 2014/002059 и WO 2014/005150.
В патентной публикации РСТ Bristol-Myers Squibb WO 2004/045518 под названием «Связанные с мочевиной пролильные модуляторы с открытой цепью с функцией андрогенового рецептора» описываются связанные с мочевиной и тиомочевиной пролильные соединения с открытой цепью для лечения ассоциированных с андрогеновым рецептором состояний, таких как связанных с возрастом заболеваний, например, саркопении.
В патентной публикации РСТ Japan Tobacco Inc. WO 1999/048492 под названием «Амидные производные и антагонисты ноцицептина» описываются соединения с пролин-подобным ядром и ароматическими заместителями, связанными с ядром пролина через амидные связи, пригодные для лечения боли.
В патентной публикации РСТ Ferring B.V. и Yamanouchi Pharmaceutical Co. LTD. WO 1993/020099 под названием «Лиганды ССК и/или гастринового рецептора» описываются соединения с пролин-подобным ядром и гетероциклическими заместителями, связанными с ядром пролина через амидные связи, для лечения, например, расстройств желудка или боли.
В патентной публикации РСТ Alexion Pharmaceuticals WO 1995/029697 под названием «Способы и композиции для лечения гломерулонефрита и других воспалительных заболеваний» раскрыты антитела против С5 пути комплемента для лечения гломерулонефрита и воспалительных состояний, вовлекающих патологическую активацию системы комплемента. Анти-С5 антитело Alexion Pharmaceutical экулизумаб (Soliris®) является в настоящее время единственным комплемент-специфическим антителом на рынке и представляет собой первое и единственное одобренное лечение пароксизмальной ночной гемоглобинурии (PNH).
Соединения, которые опосредуют путь комплемента, и, например, действуют как ингибиторы фактора D, необходимы для лечения расстройств у реципиента, в том числе у человека, связанных с неправильным регулированием каскада комплемента.
Сущность изобретения
Было обнаружено, что соединение Формулы I, или его фармацевтически приемлемая соль, или композиция с ним, где R12 или R13 на группе A представляет собой арил, гетероарил или гетероцикл, является превосходным ингибитором фактора D комплемента.
В одном варианте выполнения изобретения предложен способ лечения расстройства, связанного с дисфункцией, включая повышенную активность, пути комплемента, который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли, необязательно, в фармацевтически приемлемом носителе, как описано более подробно ниже.
В одном варианте выполнения изобретения расстройство связано с альтернативным путем каскада комплемента. В еще одном варианте выполнения изобретения расстройство связано с классическим путем комплемента. В дополнительном варианте выполнения изобретения, расстройство, связано с лектиновым путем комплемента. Заявленные в настоящем документе ингибиторы фактора D могут, таким образом, ослабить или ингибировать пагубную активность комплемента у реципиента путем введения эффективного количества подходящим образом реципиенту, нуждающемуся в этом.
Конкретные варианты выполнения настоящего изобретения направлены на определенные показания заболеваний. В одном варианте выполнения изобретения способ лечения пароксизмальной ночной гемоглобинурии (PNH) включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли, необязательно, в фармацевтически приемлемом носителе. В другом варианте выполнения изобретения предложен способ лечения возрастной дегенерации желтого пятна (AMD), который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли, необязательно, в фармацевтически приемлемом носителе. В другом варианте выполнения изобретения предложен способ лечения ревматоидного артрита, который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли, необязательно, в фармацевтически приемлемом носителе. В другом варианте выполнения изобретения предложен способ лечения рассеянного склероза, который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли, необязательно, в фармацевтически приемлемом носителе.
В других вариантах выполнения изобретения заявленное в настоящем документе активное соединение может быть использовано для лечения или предотвращения расстройства у реципиента, опосредованного фактором D комплемента или чрезмерным или пагубным количеством амплификационной петли C3 пути комплемента. В качестве примеров настоящее изобретение включает способы лечения или предотвращения связанных с комплементом расстройств, которые индуцируются взаимодействиями антитело-антиген, компонентом иммунного или аутоиммунного расстройства, или ишемическим повреждением. Изобретение также относится к способам уменьшения воспаления или иммунного ответа, включая аутоиммунный ответ, который опосредован или находится под влиянием фактора D.
Настоящее изобретение относится к соединениям Формулы I

и их фармацевтически приемлемым солям и композициям с ними, в которых:
Q1 представляет собой N(R1) или C(R1R1');
Q2 представляет собой C(R2R2'), C(R2R2')-C(R2R2'), S, О, N(R2) или C(R2R22')O;
Q3 представляет собой N(R3), S или C(R3R3');
X1 и X2 независимо представляют собой N, СН, или CZ, или X1 и X2 вместе представляют собой С=С; и
где Q1, Q2, Q3, X1 и X2 выбраны таким образом, что приводят к стабильным соединениям.
Неограничивающие примеры кольца  показаны ниже (любое из которых может быть иначе замещено R1, R1', R2, R2', R3 и R3'), как это описано более подробно ниже.
показаны ниже (любое из которых может быть иначе замещено R1, R1', R2, R2', R3 и R3'), как это описано более подробно ниже.


 и
и 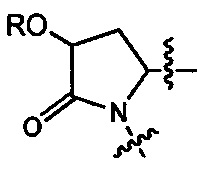 ; где q равно 0, 1, 2 или 3, и r равно 1, 2 или 3.
; где q равно 0, 1, 2 или 3, и r равно 1, 2 или 3.
R и R' независимо выбраны из Н, алкила, циклоалкила, циклоалкилалкила, гетероцикла, гетероциклоалкила, арила, арилалкила, гетероарила, гетероарилалкила, где каждая группа может быть необязательно замещена, или любой другой группы заместителей в настоящем документе, которая обеспечивает желаемые свойства. В некоторых вариантах выполнения изобретения кольцо включает один или более хиральных атомов углерода. Изобретение включает варианты выполнения, в которых хиральный углерод может быть представлен в качестве энантиомера или смесей энантиомеров, включая рацемическую смесь. Там, где кольцо включает более одного стереоцентра, все энантиомеры и диастереомеры включены в изобретение в качестве отдельных примеров.
Z представляет собой F, Cl, NH2, CH3, CH2D, CHD2 или CD3.
R1, R1', R2, R2', R3 и R3' независимо выбраны в каждом конкретном случае, по необходимости, и только когда приводят к стабильным соединениям, из водорода, галогена, гидроксила, нитро, циано, амино, C1-C6алкила, C2-C6алкенила, C2-C6алкинила, C1-C6алкокси, C2-C6алкинила, C2-C6алканоила, C1-C6тиоалкила, гидроксиC1-C6алкила, аминоC1-C6алкила, -C0-C4алкилNR9R10, -C(O)OR9, -OC(O)R9, -NR9C(O)R10, -C(O)NR9R10, -OC(O)NR9R10, -NR9C(O)OR10, C1-C2галогеналкила и C1-C2галогеналкокси, где R9 и R10 независимо выбраны в каждом случае из водорода, C1-C6алкила, (C3-C7циклоалкил)C0-C4алкила, -C0-C4алкил(C3-C7циклоалкила) и -O-C0-C4алкил(C3-C7циклоалкила).
В альтернативных вариантах вьшолнения изобретения R1 и R1' или R3 и R3' могут быть взяты вместе с образованием 3-6-членного карбоциклического спиро-кольца или 3-6-членного гетероциклического спиро-кольца, содержащего 1 или 2 гетероатома, независимо выбранных из N, О или S; R2 и R2' могут быть взяты вместе с образованием 3-6-членного карбоциклического спиро-кольца; или R2 и R2' могу быть взяты вместе с образованием 3-6-членного гетероциклического спиро-кольца; каждое из спиро-кольца может быть незамещенным или замещенным 1 или более заместителями, независимо выбранными из галогена (и, в частности, F), гидроксила, циано, -COOH, C1-C4алкила (в том числе, в частности, метила), C2-C4алкенила, C2-C4алкинила, C1-C4алкокси, C2-C4алканоила, гидроксиC1-C4алкила, (моно- и ди-C1-C4алкиламино)C0-C4алкила, -C0-C4алкил(C3-C7циклоалкила), -O-C0-C4алкил(C3-C7циклоалкила), C1-C2галогеналкила и C1-C2 галогеналкокси.
В альтернативных вариантах выполнения изобретения R1 и R2 могут быть взяты вместе с образованием 3-членного карбоциклического кольца; R1 и R2 могут быть взяты вместе с образованием 4-6-членного карбоциклического или арильного кольца, или 4-6-членного гетероциклического или гетероарильного кольца, содержащего 1 или 2 гетероатома, независимо выбранных из N, O и S; или R2 и R3, если связаны с соседними атомами углерода, могут быть взяты вместе с образованием 3-6-членного карбоциклического или арильного кольца, или 3-6-членного гетероциклического или гетероарильного кольца; каждое из колец может быть незамещенным или замещенным 1 или более заместителями, независимо выбранными из галогена (и, в частности, F), гидроксила, циано, -COOH, C1-C4алкила (в том числе, в частности, метила), C2-C4алкенила, C2-C4алкинила, C1-C4алкокси, C2-C4алканоила, гидроксиC1-C4алкила, (моно- и ди-C1-C4алкиламино)C0-C4алкила, -C0-C4алкил(C3-C7циклоалкила), -O-C0-C4алкил(C3-C7циклоалкила), C1-C2галогеналкила и C1-C2галогеналкокси.
В альтернативных вариантах выполнения изобретения R1 и R1', R2 и R2' или R3 и R3' могут быть взяты вместе с образованием карбонильной группы. В альтернативных вариантах выполнения изобретения R1 и R2 или R2 и R3 могут быть взяты вместе с образованием углерод-углеродной двойной связи.
А представляет собой группу, выбранную из:


 или
или 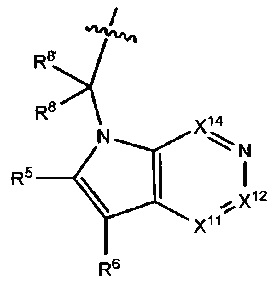 .
.
R4 выбран из -CHO, -CONH2, C2-C6алканоила, водорода, -SO2NH2, -C(CH2)2F, -CH(CF3)NH2, C1-C6алкила, -C0-C4алкил(C3-C7циклоалкила), -C(O)C0-C2алкил(C3-C7циклоалкила),
 или
или  ;
;
каждый из R4, отличный от водорода, -CHO и -CONH2, представляет собой незамещенный или замещенный одним или более из амино, имино, галогена, гидроксила, циано, цианимино, C1-C2алкила, C1-C2алкокси, -C0-C2алкил(моно- и ди-C1-C4алкиламино), C1-C2галогеналкила и C1-С2галогеналкокси.
R5 и R6 независимо выбраны из -CHO, -C(O)NH2, -C(O)NH(CH3), C2-C6алканоила, водорода, гидроксила, галогена, циано, нитро, -COOH, -SO2NH2, винила, C1-C6алкила (в том числе, метила), C2-C6алкенила, C1-C6алкокси, -C0-C4алкил(C3-C7циклоалкила), -С(O)C0-C4алкил(C3-C7циклоалкила), -P(O)(OR9)2, -OC(O)R9, -C(O)OR9, C(O)N(CH2CH2R9)(R10), -NR9C(O)R10, фенила или 5-6-членного гетероарила.
Каждый R5 и R6, отличный от водорода, гидроксила, циано и -COOH, является незамещенным или необязательно замещенным. Например, R5 и R6, отличные от водорода, гидроксила, циано и -COOH, могут быть замещены одним или более заместителями, независимо выбранными из галогена, гидроксила, амино, имино, циано, цианимино, C1-С2алкила, C1-C4алкокси, -C0-C2алкил(моно- и ди-C1-C4алкиламино), C1-C2галогеналкила и C1-C2галогеналкокси.
R6' представляет собой водород, галоген, гидроксил, C1-C4алкил, -C0-C4алкил(C3-C7циклоалкил) или C1-C4алкокси; или R6 и R6' могут быть взяты вместе с образованием оксо, винил или иминогруппы.
R7 представляет собой водород, C1-C6алкил или -C0-C4алкил(C3-C7циклоалкил).
R8 и R8' независимо выбраны из водорода, галогена, гидроксила, C1-C6алкила, -C0-C4алкил(C3-C7циклоалкила), C1-C6алкокси и (C1-C4алкиламино)C0-C2алкила; или R8 и R8', взятые вместе, образуют оксогруппу; или R8 и R8' могут быть взяты вместе с атомом углерода, с которым они связаны, с образованием 3-членного карбоциклического кольца.
R16 отсутствует или может включать один или более заместителей, независимо выбранных из галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, -C0-C4алкил(моно- и ди-C1-C6алкиламино), -C0-C4алкил(C3-C7циклоалкила), C1-C2галогеналкила и C1-C2галогеналкокси.
R19 представляет собой водород, C1-C6алкил, C2-C6алкенил, C2-C6алканоил, -SO2C1-С6алкил, (моно- и ди-C1-C6алкиламино)C1-C4алкил, -C0-C4алкил(C3-C7циклоалкил), -C0-C4алкил(C3-C7гетероциклоалкил), -C0-C4алкил(арил), C0-C4алкил(гетероарил), и где R19, отличный от водорода, является незамещенным или замещенным одним или более заместителями, независимо выбранными из галогена, гидроксила, амино, -COOH и -С(O)ОC1-C4алкила.
X11 представляет собой N или CR11.
X12 представляет собой N или CR12.
X13 представляет собой N или CR13.
X14 представляет собой N или CR14.
Не более чем 2 из X11, X12, X13 и X14 являются N.
Один из R12 и R13 выбран из R31, и другой из R12 и R13 выбран из R32. В альтернативном варианте выполнения изобретения R12 и R13 каждый независимо выбран из остатка R32.
R31 выбран из водорода, галогена, гидроксила, нитро, циано, амино, -COOH, C1-C2галогеналкила, C1-C2галогеналкокси, C1-C6алкила, -C0-C4алкил(C3-C7циклоалкила), C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, C2-C6алкенилокси, -C(O)OR9, C1-C6тиоалкила, -C0-C4алкилNR9R10, -C(O)NR9R10, -SO2R9, -SO2NR9R10, -OC(O)R9 и -C(NR9)NR9R10, каждый из R31, отличный от водорода, галогена, гидроксила, нитро, циано, C1-C2галогеналкила и С1-С2галогеналкокси, является незамещенным или замещенным одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, амино, -COOH, -CONH2 C1-C2галогеналкила и С1-С2галогеналкокси, и каждый из R31 также необязательно замещен одним заместителем, выбранным из фенила и 4-7-членного гетероцикла, содержащего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S; при этом фенил или 4-7-членный гетероцикл не замещен или замещен одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, (моно- и ди-C1-C6алкиламино)C0-C4алкила, C1-C6алкилэфира, -C0-C4алкил)(C3-C7циклоалкила), C1-C2галогеналкила и C1-C2галогеналкокси;
R32 выбран из арила; насыщенного или ненасыщенного гетероцикла (например, 5-6-членного кольца, имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S), где гетероцикл связан через атом углерода в гетероциклическом кольце с атомом углерода кольца A в положении R12 или R13; и гетероарила (например, 5-6-членного кольца, имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S), где арил, гетероцикл или гетероарильное кольцо может быть необязательно замещенным.
R11, R14 и R15 независимо выбраны в каждом случае из водорода, галогена, гидроксила, нитро, циано, -O(PO)(OR9)2, -(PO)(OR9)2, C1-C6алкила, C2-C6алкенила, C2-C6алкинила, C2-C6алкенил(арила), C2-C6алкенил(циклоалкила), C2-C6алкенил(гетероцикла), C2-C6алкенил(гетероарила), C2-C6алкинила, C2-C6алкинил(арила), C2-C6алкинил(циклоалкила), C2-C6алкинил(гетероцикла), C2-C6алкинил(гетероарила), C2-C6алканоила, C1-C6алкокси, C1-C6тиоалкила, -C0-C4алкил(моно- и ди-C1-C6алкиламино), -C0-C4алкил(C3-C7циклоалкила), -C0-C4алкокси(C3-C7циклоалкила), C1-C2галогеналкила и C1-C2галогеналкокси.
L представляет собой связь или выбран из формул  ,
,  и
и  , где R17 представляет собой водород, C1-C6алкил или -C0-C4алкил(C3-C7циклоалкил), и R18 и R18' независимо выбраны из водорода, галогена, гидроксиметила и метила; и m равно 0, 1, 2 или 3.
, где R17 представляет собой водород, C1-C6алкил или -C0-C4алкил(C3-C7циклоалкил), и R18 и R18' независимо выбраны из водорода, галогена, гидроксиметила и метила; и m равно 0, 1, 2 или 3.
В представляет собой моноциклическую или бициклическую карбоциклическую; моноциклическую или бициклическую карбоцикло-окси группу; моноциклическую, бициклическую или трициклическую гетероциклическую группу, имеющую 1, 2, 3 или 4 гетероатома, независимо выбранных из N, О и S, и от 4 до 7 кольцевых атомов в кольце; C2-C6алкенила; C2-C6алкинила; -(C0-C4-алкил)(арила); -(C0-C4-алкил)(гетероарила); или -(C0-C4-алкил)(бифенила).
Каждый из B незамещен или замещен одним или более заместителями, независимо выбранными из R33 и R34, и 0 или 1 заместитель выбран из R35 и R36.
R33 независимо выбран из галогена, гидроксила, -COOH, циано, C1-C6алкила, C2-C6алканоила, C1-C6алкокси, -C0-C4алкилNR9R10, -SO2R9, C1-C2галогеналкила и C1-C2галогеналкокси;
R34 независимо выбран из нитро, C2-C6алкенила, C2-C6алкинила, C1-C6тиоалкила, -JC3-C7циклоалкила, -B(ОН)2, -JC(O)NR9R23, -JOSO2OR21, -C(O)(CH2)1-4S(O)R21, -O(CH2)1-4S(O)NR21R22, -JOP(O)(OR21)(OR22), -JP(O)(OR21)(OR22), -JOP(O)(OR21)R22, JP(O)(OR21)R22, -JOP(O)R21R22, -JP(O)R21R22, -JSP(O)(OR21)(OR22), -JSP(O)(OR21)(R22), -JSP(O)(R21)(R22), -JNR9P(O)(NHR21)(NHR22), -JNR9P(O)(OR21)(NHR22), JNR9P(O)(OR21)(OR22), -JC(S)R21, -JNR21SO2R22, -JNR9S(O)NR10R22, -JNR9SO2NR10R22, -JSO2NR9COR22, -JSO2NR9CONR21R22, -JNR21SO2R22, -JC(O)NR21SO2R22, -JC(NH2)R22, -JC(NH2)NR9S(O)2R22, -JOC(O)NR21R22, -JNR21C(O)OR22, -JNR21OC(O)R22, -(CH2)1-4C(O)NR21R22, -JC(O)R24R25, -JNR9C(O)R21, -JC(O)R21, -JNR9C(O)NR10R22, -CCR21, -(CH2)1-4OC(O)R21 и -JC(O)OR23; каждый из R34 может быть незамещен или замещен одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, амино, оксо, -B(ОН)2, -Si(CH3)3, -COOH, -CONH2, -P(O)(ОН)2, C1-C6алкила, -C0-С4алкил(C3-C7циклоалкила), C1-C6алкокси, -C0-C2алкил(моно- и ди-C1-C4алкиламино), C1-C6алкилэфира, C1-C4алкиламино, C1-С4гидроксилалкила, C1-С2галогеналкила и C1-C2галогеналкокси.
35 независимо выбран из нафтила, нафтилокси, инданила, (4-7-членный гетероциклоалкил)С0-С4алкила, содержащего 1 или 2 гетероатома, выбранных из N, О и S, и бициклического гетероцикла, содержащего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, и содержащего от 4 до 7 кольцевых атомов в каждом кольце; каждый из R35 незамещен или замещен одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, С2-C6алканоила, C1-C6алкокси, (моно- и ди-C1-C6алкиламино)C0-C4алкила, C1-C6алкилэфира, -C0-C4алкил(C3-C7циклоалкила), -SO2R9, C1-C2галогеналкила и C1-C2галогеналкокси.
R36 независимо выбран из тетразолила, (фенил)C0-C2алкила, (фенил)C1-C2алкокси, фенокси и 5- или 6-членного гетероарила, содержащего 1, 2 или 3 гетероатома, независимо выбранных из N, О, В и S, каждый из R36 незамещен или замещен одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, (моно- и ди-C1-C6алкиламино)C0-C4алкила, C1-C6алкилэфира, -C0-C4алкил(C3-C7циклоалкила), -SO2R9, -OSi(CH3)2С(CH3)3, -Si(CH3)2С(CH3)3, C1-C2галогеналкила и C1-C2галогеналкокси.
R21 и R22 независимо выбраны в каждом случае из водорода, гидроксила, циано, амино, C1-C6алкила, C1-C6галогеналкила, C1-C6алкокси, (C3-C7циклоалкил)C0-C4алкила, (фенил)C0-C4алкила, -C1-C4алкилОС(O)ОC1-C6алкила, -C1-C4алкилОС(O)C1-C6-алкила, -C1-C4алкилС(O)ОC1-C6алкила, (4-7-членный гетероциклоалкил)C0-C4алкила, имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, и (5- или 6-членный ненасыщенный или ароматический гетероцикл)C0-C4-алкила, имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, и каждый из R21 и R22 может быть необязательно замещен.
R23 независимо выбран в каждом случае из C1-C6алкила, C1-C6галогеналкила, (арил)C0-C4алкила, (C3-C7циклоалкил)C0-C4алкила, (фенил)C0-C4алкила, (4-7-членный гетероциклоалкил)C0-C4алкила, имеющего 1, 2, или 3 гетероатома, независимо выбранных из N, О и S, и (5- или 6-членный ненасыщенный или ароматический гетероцикл)C0-C4алкила, имеющего 1, 2, или 3 гетероатома, независимо выбранных из N, О, и S, и каждый R23 может быть необязательно замещен.
R24 и R25 вместе с атомом азота, к которому они присоединены, образуют 4-7-членную моноциклическую гетероциклоалкильную группу или 6-10-членную бициклическую гетероциклическую группу, имеющую конденсированные, спиро или мостиковые кольца, и каждый из R24 и R25 может быть необязательно замещен.
J независимо выбран в каждом случае из ковалентной связи, C1-C4алкилена, -OC1-С4алкилена, C2-C4алкенилена и C2-C4алкинилена.
Также раскрываются фармацевтические композиции, содержащие соединение или соль Формулы I вместе с фармацевтически приемлемым носителем.
Раскрываются способы лечения или предотвращения расстройств, опосредованных фактором D каскада комплемента, в том числе, но не ограничиваясь, связанной с возрастом дегенерации желтого пятна (AMD), дегенерации сетчатки, других офтальмологических заболеваний (например, географической атрофии), пароксизималыюй ночной гемоглобинурии (PNH), рассеянного склероза (MS), артрита, включая ревматоидный артрит (RA), респираторного заболевания или сердечнососудистого заболевания, включающие введение терапевтически эффективного количества соединения или соли Формулы I реципиенту, в том числе человеку, нуждающемуся в таком лечении.
В другом варианте выполнения изобретение относится к эффективному количеству ингибирующего активный фактор D соединению для лечения воспалительного или иммунного расстройства, в том числе аутоиммунного расстройства, которое опосредовано или находится под влиянием фактора D. В альтернативном варианте выполнения изобретения соединение Формулы I может быть использовано для лечения расстройства, опосредованного путем комплемента, независимо от того, действует ли он через Фактор D.
Настоящее изобретение включает по меньшей мере следующие признаки:
(a) соединение Формулы I, как описано в настоящем документе, и его фармацевтически приемлемые соли и пролекарства (каждое из которых и их все подроды и виды, рассматриваемые по-отдельности и конкретно описанные);
(b) Формула I, как описано в настоящем документе, и ее фармацевтически приемлемые соли и пролекарства для применения в лечении или предотвращении расстройств, опосредованных путем комплемента, и, например, каскадным фактором D, в том числе возрастной макулярной дегенерации (AMD), дегенерации сетчатки, пароксизимальной ночной гемоглобинурии (PNH), рассеянного склероза (МС) и ревматоидного артрита (RA) и других расстройств, описанных в настоящем документе далее;
(c) применение Формулы I и ее фармацевтически приемлемых солей и пролекарств в изготовлении лекарственного средства для применения в лечении или предотвращении расстройств, опосредованных путем комплемента, и, например, каскадным фактором D, в том числе возрастной макулярной дегенерации (AMD), дегенерации сетчатки, пароксизимальной ночной гемоглобинурии (PNH), рассеянного склероза (МС) и ревматоидного артрита (RA) и других расстройств, описанных в настоящем документе далее;
(d) способ получения лекарственного средства, предназначенного для терапевтического применения для лечения или предотвращающего лечения или предупреждения нарушений, опосредованных фактором D каскада комплемента, в том числе возрастной макулярной дегенерации (AMD), дегенерации сетчатки, пароксизимальной ночной гемоглобинурии (PNH), рассеянного склероза (МС) и ревматоидного артрита (RA) и других расстройств, описанных в настоящем документе далее, характеризующийся тем, что Формула I, описанная в настоящем документе, используется при получении;
(e) фармацевтическая композиция, включающая эффективное для лечения реципиента количество Формулы I или ее фармацевтически приемлемой соли или пролекарства вместе с фармацевтически приемлемым носителем или разбавителем;
(f) Формула I, как описано в настоящем документе, в по существу чистом виде, в том числе по существу изолированные от других химических соединений (например, по меньшей мере 90 или 95%);
(g) способы получения соединений Формулы I и их солей, композиций, дозированных форм; и
(h) способы получения терапевтических продуктов, которые содержат эффективное количество Формулы I, как описано в настоящем документе.
Подробное описание изобретения
I. Терминология
Соединения описываются с использованием стандартной номенклатуры. Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно понимается специалистом в данной области техники, к которой принадлежит это изобретение.
Соединения в любой из Формул, описанных в настоящем документе, включают энантиомеры, смеси энантиомеров, диастереомеры, таутомеры, рацематы и другие изомеры, такие как ротамеры, как если бы каждый из них был конкретно описан. «Формула I» включает все подродовые группы Формулы I, такие как Формула IA и Формула IB, и также включает фармацевтически приемлемые соли соединения Формулы I, если иное явно противоречит контексту, в котором эта фраза приведена. «Формула I» также включает все подродовые группы Формулы I, такие как Формулы IC-ID и Формулы II-XXX, а также включает фармацевтически приемлемые соли всех подродовых групп Формулы I, такие как Формулы IA-ID и Формулы II- XXX, если иное явно противоречит контексту, в котором эта фраза приведена.
Термины "а" и "an" не означают ограничение количества, а скорее обозначают наличие, по меньшей мере, одного из описываемого. Термин «или» означает «и/или». Указание диапазонов значений предназначено лишь для использования в качестве сокращенного способа отсылки индивидуально к каждой отдельной величине, попадающей в диапазон, если в настоящем документе не указано иное, и каждая отдельная величина включена в описание, как если бы она была индивидуально указана в настоящем документе. Концевые значения всех диапазонов включены в пределы диапазона и независимо комбинируются. Все описанные в настоящем документе способы могут быть выполнены в подходящем порядке, если в настоящем документе не указано иное или иное явно противоречит контексту. Использование примеров или иллюстративных выражений (напр., «такой как») предназначено лишь для лучшей иллюстрации изобретения и не накладывает ограничений на объем изобретения, если не заявлено иное. Если не указано иное, технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно понимается специалистом в данной области техники, к которой принадлежит это изобретение.
Настоящее изобретение включает соединения Формулы I и применение соединений по меньшей мере с одним желаемым изотопным замещением атома в количестве, которое выше естественного содержания изотопа, т.е. обогащенным. Изотопы представляют собой атомы, имеющие одинаковый атомный номер, но разные массовые числа, т.е. одинаковое число протонов, но различное число нейтронов.
Примеры изотопов, которые могут быть включены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2Н, 3Н, 11С, 13С, 14С, 15N, 18F 31Р, 32Р, 35S, 36Cl, 125I соответственно. Изобретение включает изотопно модифицированные соединения Формулы I. В одном варианте выполнения изобретения меченные изотопами соединения могут быть использованы в метаболических исследованиях (с 14С), кинетических исследованиях реакций (с, например, 2Н или 3Н), в методиках обнаружения или визуализации, таких как позитронно-эмиссионная томография (ПЭТ) или однофотонная эмиссионная компьютерная томография (ОФЭКТ), включая анализы тканевого распределения лекарственных средств или субстратов, или в радиоактивном лечении пациентов. В частности, соединение, меченное 18F, может быть особенно желательным для исследований ПЭТ или ОФЭКТ. Меченные изотопами соединения по этому изобретению и их пролекарства, обычно, могут быть получены путем выполнения процедур, описанных в схемах или в примерах, и препараты, описанные ниже, могут быть получены путем замены легкодоступного меченного изотопом реагента на не меченный изотопом реагент.
В качестве общего примера и не ограничиваясь изотопы водорода, например, дейтерий (2Н) и тритий (3Н), можно использовать в любой позиции в описанных структурах, что обеспечивает достижение желаемого результата. В качестве альтернативы или в дополнение могут быть использованы изотопы углерода, например, 13С и 14С. В одном варианте выполнения изобретения изотопное замещение представляет собой замещение водорода дейтерием в одной или нескольких позициях молекулы для улучшения эффективности лекарственного средства, например, фармакодинамики, фармакокинетики, биораспределения, периода полураспада, стабильности, AUC, Tmax, Сmax и т.д. Например, дейтерий может быть связан с углеродом в месте разрыва связи в процессе обмена веществ (кинетический изотопный эффект α-дейтерия) или рядом с или вблизи места разрыва связи (кинетический изотопный эффект β-дейтерия).
Изотопные замены, например, замены дейтерием, могут быть частичными или полными. Частичное замещение дейтерием означает, что по меньшей мере один водород замещен дейтерием. В некоторых вариантах выполнения изобретения изотопом обогащено на 90, 95 или 99% или более в изотопе в любой позиции, представляющей интерес. В одном варианте выполнения изобретения в требуемой позиции дейтерием обогащено на 90, 95 или 99%. Если не указано иное, обогащение в любой позиции составляет выше естественного содержания и достаточно для того, чтобы изменить обнаруживаемое свойство лекарственного средства в организме человека.
В одном варианте выполнения изобретения замещение атома водорода на атом дейтерия происходит внутри заместителя группы R в области фрагмента L-B. В одном варианте выполнения изобретения замещение атома водорода на атом дейтерия происходит внутри группы R, выбранной из любой из R18, R18', R33, R34, R35 и/или R36. В одном варианте выполнения изобретения замещение атома водорода на атом дейтерия происходит внутри заместителя группы R в области фрагмента А-карбонил. В одном варианте выполнения изобретения замещение атома водорода на атом дейтерия происходит в R4, R5, R6, R6', R7, R8, R8', R11, R12, R13, R14, R15, R16, R19, R21, R22, R23, R31 и R32. В других вариантах выполнения изобретения определенные заместители на кольце пролина селективно дейтерированы. Например, в одном варианте выполнения изобретения замещение атома водорода на атом дейтерия происходит в R, R', R1, R1', R2, R2', R3 и/или R3'. В одном варианте выполнения изобретения, например, когда любой из заместителей R кольца пролина представляет собой метил или метокси, алкильный остаток необязательно дейтерирован, например, CD3 или OCD3. В некоторых других вариантах выполнения изобретения, когда два заместителя кольца пролина объединены с образованием циклопропильного кольца, незамещенный метиленовый углерод дейтерирован.
Замещение атома водорода на атом дейтерия происходит внутри группы R, когда по меньшей мере одна из переменных в группе R представляет собой водород (напр., 2Н или D) или алкил (напр., CD3). Например, когда какая-либо из групп R представляет собой или содержит, например, путем замены, метил или этил, алкильный остаток, как правило, дейтерирован, напр., CD3, CH2CD3 или CD2CD3.
Соединение по настоящему изобретению может образовывать сольват с растворителями (включая воду). Таким образом, в одном варианте выполнения изобретение включает сольватированную форму активного соединения. Термин «сольват» относится к молекулярному комплексу соединения по настоящему изобретению (в том числе его солей) с одной или более молекулами растворителя. Примерами растворителей могут служить вода, этанол, диметилсульфоксид, ацетон и другие обычные органические растворители. Термин «гидрат» относится к молекулярному комплексу, содержащему соединение по изобретению и воду. Фармацевтически приемлемые сольваты в соответствии с изобретением включают те, в которых растворитель кристаллизации может быть изотопно замещенным, напр., D2O, d6-ацетон, d6-DMSO. Сольват может быть в жидкой или твердой форме.
Черта («-»), которая не находится между двумя буквами или символами, используется для указания точки прикрепления заместителя. Например, -(C=O)NH2 является присоединенным через углерод кето (C=O) группы.
Термин «замещенный», как он использован в настоящем документе, означает, что любой один или несколько атомов водорода у указанного атома или группы заменен фрагментом, выбранным из указанной группы, при условии, что нормальная валентность указанного атома не превышена. Например, когда заместитель представляет собой оксо (т.е., =O), то два атома водорода на атоме заменены. Когда оксогруппа заменяет два атома водорода в ароматическом фрагменте, то соответствующее частично ненасыщенное кольцо заменяет ароматическое кольцо. Например, пиридильная группа, замещенная оксогруппой, представляет собой пиридон. Комбинации заместителей и/или переменных допустимы только, если такие комбинации приводят к получению стабильных соединений или полезных промежуточных продуктов синтеза.
Стабильное соединение или стабильная структура относится к соединению, приводящему к соединению, которое может быть выделено и может быть составлено в виде дозированной формы со сроком хранения по меньшей мере один месяц.
В «замещенной» или «необязательно замещенной» позиции может присутствовать любая подходящая группа, которая образует устойчивую молекулу и приводит к достижению желаемой цели изобретения, и включает, но не ограничиваясь перечисленным, напр., галоген (который может независимо быть F, Cl, Br или I); циано; гидроксил; нитро; азидо; алканоил (такой как C2-C6алканоильная группа); карбоксамид; алкил, циклоалкил, алкенил, алкинил, алкокси, арилокси, такой как фенокси; алкилтио, включая имеющие одну или более тиоэфирных связей; алкилсульфинил; алкилсульфонильные группы, включая имеющие одну или более сульфонильных связей; аминоалкильные группы, включая группы, имеющие один или более атомов N; арил (напр., фенил, бифенил, нафтил или тому подобное, при этом каждое кольцо является либо замещенным, либо незамещенным ароматическим); арилалкил, имеющий, например, от 1 до 3 отдельных или конденсированных колец и от 6 до около 14 или 18 кольцевых атомов углерода, причем бензил представляет собой пример арилалкильной группы; арилалкокси, например, имеющий от 1 до 3 отдельных или конденсированных колец с бензилокси, представляющим собой пример арилалкокси группы; или насыщенную, ненасыщенную, или ароматическую гетероциклическую группу, имеющую от 1 до 3 отдельных или конденсированных колец с одним или более атомами N, О или S, напр., кумаринил, хинолинил, изохинолинил, хиназолинил, пиридил, пиразинил, пиримидинил, фуранил, пирролил, тиенил, тиазолил, триазинил, оксазолил, изоксазолил, имидазолил, индолил, бензофуранил, бензотиазолил, тетрагидрофуранил, тетрагидропиранил, пиперидинил, морфолинил, пиперазинил и пирролидинил. Такие гетероциклические группы могут быть дополнительно замещены, напр., гидрокси, алкил, алкокси, галоген и амино. В некоторых вариантах выполнения изобретения «необязательно замещенный» включает один или более заместителей, независимо выбранных из галогена, гидроксила, амино, циано, -CHO, -COOH, -CONH2, C1-C6алкила, C2-C6алкенила, C2-C6алкинила, -C1-C6алкокси, C2-C6алканоила, C1-C6алкилэфира, (моно- и ди-C1-C6алкиламино)С0-C2алкила, C1-C2галогеналкила, гидроксиC1-C6алкила, сложного эфира, карбамата, мочевины, сульфаниламида, -C1-C6алкил(гетероцикло), C1-C6алкил(гетероарила), -C1-C6алкил(C3-C7циклоалкила), O-C1-C6алкил(C3-C7циклоалкила), B(OH)2, фосфата, фосфоната и C1-C2галогеналкокси.
«Алкил» представляет собой разветвленную или прямую цепь насыщенной алифатической углеводородной группы. В одном варианте выполнения изобретения алкил содержит от 1 до около 12 атомов углерода, более обычно от 1 до около 6 атомов углерода или от 1 до около 4 атомов углерода. В одном варианте выполнения изобретения алкил содержит от 1 до около 8 атомов углерода. В некоторых вариантах выполнения изобретения алкил представляет собой C1-C2, C1-C3 или C1-C6. Конкретные диапазоны, как используется в настоящем документе, указывают на алкильную группу, имеющую каждый член из диапазона, описанный в качестве самостоятельного вида. Например, термин C1-C6алкил, используемый в настоящем документе, указывает на прямую или разветвленную алкильную группу, имеющую от 1, 2, 3, 4, 5 или 6 атомов углерода, и означает, что каждая из них описывается как самостоятельный вид. Например, термин C1-C4алкил, используемый в настоящем документе, указывает на прямую или разветвленную алкильную группу, имеющую от 1, 2, 3 или 4 атомов углерода, и означает, что каждая из них описывается как самостоятельный вид. Когда С0-Cnалкил используется в настоящем документе в сочетании с другой группой, например, (C3-C7циклоалкил)C0-C4алкил или -C0-C4алкил(C3-C7циклоалкил), то указанная группа, в данном случае циклоалкил, либо непосредственно связана одинарной ковалентной связью (C0алкил), либо прикреплена алкильной цепью, в данном случае с 1, 2, 3 или 4 атомами углерода. Алкилы также могут быть присоединены через другие группы, такие как гетероатомы, как в -O-C0-C4алкил(C3-C7циклоалкил). Примеры алкила включают, но не ограничиваясь, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, трет-пентил, неопентил, н-гексил, 2-метилпентан, 3-метилпентан, 2,2-диметилбутан и 2,3-диметилбутан. В одном варианте выполнения изобретения алкильная группа необязательно замещена, как описано выше.
«Алкенил» представляет собой алифатическую углеводородную группу с прямой или разветвленной цепью, имеющую одну или более углерод-углеродную двойную связь, которая может быть в стабильной позиции на цепи. Неограничивающими примерами являются C2-C8алкенил, C2-C6алкенил и C2-C4алкенил. Конкретные диапазоны, как используется в настоящем документе, указывают на алкенильную группу, имеющую каждый член из диапазона, описанный как самостоятельный вид, как описано выше для алкильного остатка. Примеры алкенила включают, но не ограничиваясь, этенил и пропенил. В одном варианте выполнения изобретения алкенильная группа является необязательно замещенной, как описано выше.
«Алкинил» представляет собой алифатическую углеводородную группу с прямой или разветвленной цепью, имеющую одну или более углерод-углеродную тройную связь, которая может быть в любой стабильной позиции на цепи, например, C2-C8алкинил или C2-C6алкинил. Конкретные диапазоны, как используется в настоящем документе, указывают на алкинильную группу, имеющую каждый член из диапазона, описанный в качестве самостоятельного вида, как описано выше для алкильного остатка. Примеры алкинила включают, но не ограничиваясь, этинил, пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-гексенил, 2-гексинил, 3-гексинил, 4-гексинил и 5-гексинил. В одном варианте выполнения изобретения алкинильная группа необязательно замещена, как описано выше.
«Алкилен» означает двухвалентный насыщенный углеводород. Алкилены, например, могут представлять собой от 1 до 8 углеродный остаток, от 1 до 6 углеродный остаток или указанное количество атомов углерода, например, C1-C4алкилен, C1-C3алкилен или C1-C2алкилен.
«Алкенилен» представляет собой двухвалентный углеводород, имеющий по меньшей мере одну углерод-углеродную двойную связь. Алкенилены, например, могут быть от 2 до 8 углеродным остатком, от 2 до 6 углеродным остатком или указанным количеством атомов углерода, например, C2-C4алкенилен.
«Алкинилен» представляет собой двухвалентный углеводород, имеющий по меньшей мере одну углерод-углеродную тройную связь. Алкенилены, например, могут представлять собой от 2 до 8 углеродный остаток, от 2 до 6 углеродный остаток или указанное количество атомов углерода, например, C2-C4алкинилен.
«Алкокси» представляет собой алкильную группу, как определено выше, ковалентно связанную через кислородный мостик (-O-). Примеры алкокси включают, но не ограничиваясь, метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, 2-бутокси, трет-бутокси, н-пентокси, 2-пентокси, 3-пентокси, изопентокси, неопентокси, н-гексокси, 2-гексокси, 3-гексокси и 3-метилпентокси. Подобно этому группа «алкилтио» или «тиоалкил» представляет собой алкильную группу, как определено выше, с указанным числом атомов углерода, ковалентно связанную через серный мостик (-S-). В одном варианте выполнения изобретения алкокси группа необязательно замещена, как описано выше.
«Алкенилокси» представляет собой алкенильную группу, как определено, ковалентно связанную с группой, которую она замещает, через кислородный мостик (-O-).
«Алканоил» представляет собой алкильную группу, как определено выше, ковалентно связанную через карбонильный (C=O) мостик. Углерод карбонильной группы входит в число атомов углерода, то есть C2алканоил представляет собой группу CH3(C=O)-. В одном варианте выполнения изобретения алканоильная группа необязательно замещена, как описано выше.
«Алкилэфир» представляет собой алкильную группу, как определено в настоящем документе, ковалентно связанную через эфирную связь. Эфирная связь может быть в той или иной ориентации, напр., группа формулы -O(C=O)алкил или группа формулы -(C=O)Оалкил.
«Амид» или «карбоксамид» представляет собой -C(O)NRaRb, где Ra и Rb каждый независимо выбирал из водорода, алкила, например, C1-C6алкила, алкенила, например, C2-C6алкенила, алкинила, например, C2-C6алкинила, -C0-C4алкил(C3-C7циклоалкила), -C0-C4алкил(C3-C7гетероциклоалкила), -C0-C4алкил(арила) и -C0-C4алкил(гетероарила); или вместе с азотом, к которому они присоединены, Ra и Rb могут образовывать C3-C7гетероциклическое кольцо. В одном варианте выполнения изобретения группа Ra и Rb каждая независимо необязательно замещена, как описано выше.
«Карбоциклическая группа», «карбоциклическое кольцо» или «циклоалкил» представляют собой насыщенную или частично ненасыщенную (т.е., не ароматическую) группу, содержащую в кольце все атомы углерода. Карбоциклическая группа, как правило, содержит 1 кольцо с от 3 до 7 атомами углерода или 2 конденсированных кольца, каждое содержащее от 3 до 7 атомов углерода. Циклоалкильные заместители могут быть подвесными из замещенного азота или атома углерода, или замещенный атом углерода, который может иметь два заместителя, может иметь циклоалкильную группу, которая присоединена как спиро группа. Примеры карбоциклических колец включают циклогексенильное, циклогексильное, циклопентенильное, циклопентильное, циклобутенильное, циклобутильное и циклопропильное кольца. В одном варианте выполнения изобретения карбоциклическое кольцо необязательно замещено, как описано выше. В одном варианте выполнения изобретения циклоалкил представляет собой частично ненасыщенную (т.е., не ароматическую) группу, содержащую в кольце все атомы углерода. В другом варианте выполнения изобретения циклоалкил представляет собой насыщенную группу, содержащую в кольце все атомы углерода.
«Карбоциклическая окси группа» представляет собой моноциклическое карбоциклическое кольцо или моно- или бициклическую карбоциклическую группу, как определено выше, присоединенную к группе, которую она замещает, через кислородный, -O-, линкер.
«Галогеналкил» означает как разветвленные, так и неразветвленные алкильные группы, замещенные 1 или более атомами галогена, вплоть до максимально допустимого числа атомов галогена. Примеры галогеналкила включают, но не ограничиваясь, трифторметил, монофторметил, дифторметил, 2-фторэтил и пента-фторэтил.
«Галогеналкокси» означает галогеналкильную группу, как определено в настоящем документе, присоединенную через кислородный мостик (кислород от радикала спирта).
«Гидроксиалкил» представляет собой алкильную группу, как описано ранее, замещенную по меньшей мере одним гидроксильным заместителем.
«Аминоалкил» представляет собой алкильную группу, как описано ранее, замещенную по меньшей мере одним аминокислотным заместителем.
«Гало» или «галоген» означает независимо любой из фтора, хлора, брома и йода.
«Арил» означает ароматическую группу, содержащую только углерод в ароматическом кольце или кольцах. В одном варианте выполнения изобретения арильные группы содержат от 1 до 3 отдельных или конденсированных колец и от 6 до около 14 или 18 атомов в кольце без гетероатома в качестве члена кольца. Когда указано, такие арильные группы могут быть дополнительно замещены атомами углерода или неуглеродными атомами или группами. Такое замещение может включать конденсирование с от 5 до 7-членной насыщенной циклической группой, которая необязательно содержит 1 или 2 гетероатома, независимо выбранных из N, О и S, с образованием, например, 3,4-метилендиоксифенильной группы. Арильные группы включают, например, фенил и нафтил, в том числе 1-нафтил и 2-нафтил. В одном варианте выполнения изобретения арильные группы являются подвесными. Примером подвесного кольца является фенильная группа, замещенная фенильной группой. В одном варианте выполнения изобретения арильная группа необязательно замещена, как описано выше.
Термин «гетероцикл» или «гетероциклическое кольцо», как используется в настоящем документе, относится к насыщенному или частично ненасыщенному (т.е., имеющему одну или более двойных и/или тройных связей в кольце без ароматичности) карбоциклическому радикалу из от 3 до около 12 и более, как правило, от 3, 5, 6, 7 до 10 кольцевых атомов, в котором по меньшей мере один кольцевой атом представляет собой гетероатом, выбранный из азота, кислорода, фосфора и серы, а остальные кольцевые атомы представляют собой С, где один или более кольцевых атомов необязательно замещен независимо одним или более заместителями, описанными выше. Гетероцикл может быть моноциклом, имеющим от 3 до 7 членов в кольце (от 2 до 6 атомов углерода и от 1 до 4 гетероатомов, выбранных из N, О, P и S), или бициклом, имеющим от 6 до 10 членов в кольце (от 4 до 9 атомов углерода и от 1 до 6 гетероатомов, выбранных из N, О, P и S), например: системой бицикло[4,5], [5,5], [5,6] или [6,6]. В одном варианте выполнения изобретения единственный гетероатом представляет собой азот. В одном варианте выполнения изобретения единственный гетероатом представляет собой кислород. В одном варианте выполнения изобретения единственный гетероатом представляет собой серу. Гетероциклы описаны в Paquette, Leo A.; "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, New York, 1968), в частности, Главы 1, 3, 4, 6, 7 и 9; "The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, 1950 по н.в.), в частности, Тома 13, 14, 16, 19 и 28; и в J. Am. Chem. Soc. (1960) 82: 5566. Примеры гетероциклических колец включают, но не ограничиваясь, пирролидинил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидино, пиперидонил, морфолино, тиоморфолино, тиоксанил, пиперазинил, гомопиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 2-пирролинил, 3-пирролинил, индолинил, 2Н-пиранил, 4Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, дигидроизохинолил, тетрагидроизохинолинил, пиразолидинилимидазолинил, имидазолидинил, 2-окса-5-азабицикло[2.2.2]октан, 3-окса-8-азабицикло[3.2.1]октан, 8-окса-3-азабицикло[3.2.1]октан, 6-окса-3- азабицикло[3.1.1]гептан, 2-окса-5-азабицикло[2.2.1]гептан, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил, азабицикло[2.2.2]гексанил, 3Н-индолил, хинолизинил, N-пиридилмочевину и пирролопиримидин. Спиро остатки также включены в объем этого определения. Примеры гетероциклической группы, в которой 1 или 2 кольцевых атомов углерода замещены на оксо (=O) остатки, представляют собой пиримидинонил и 1,1-диоксотиоморфолинил. Гетероциклические группы в настоящем документе являются необязательно замещенными независимо одним или более заместителями, описанными в настоящем документе.
«Гетероцикликокси группа» представляет собой моноциклическую гетероциклическую кольцевую или бициклическую гетероциклическую группу, как описано ранее, связанную с группой, которую она замещает, через кислородный, -O-, линкер.
«Гетероарил» указывает на стабильное моноциклическое ароматическое кольцо, которое содержит от 1 до 3 или в некоторых вариантах выполнения изобретения от 1 до 2 гетероатомов, выбранных из N, О и S, причем остальные кольцевые атомы представляют собой углерод, или на стабильную бициклическую или трициклическую систему, содержащую по меньшей мере одно 5-7 членное ароматическое кольцо, которое содержит от 1 до 3 или в некоторых вариантах выполнения изобретения от 1 до 2 гетероатомов, выбранных из N, О и S, причем остальные кольцевые атомы представляют собой углерод. В одном варианте выполнения изобретения единственный гетероатом представляет собой азот. В одном варианте выполнения изобретения единственный гетероатом представляет собой кислород. В одном варианте выполнения изобретения единственный гетероатом представляет собой серу. Моноциклические гетероарильные группы, как правило, имеют от 5 до 7 атомов в кольце. В некоторых вариантах выполнения изобретения бициклические гетероарильные группы представляют собой 9-10-членные гетероарильные группы, то есть, группы, содержащие 9 или 10 атомов в кольце, в которых одно 5-7-членное ароматическое кольцо конденсировано со вторым ароматическим или неароматическим кольцом. Когда общее число атомов S и O в гетероарильной группе превышает 1, эти гетероатомы не являются смежными друг с другом. В одном варианте выполнения изобретения общее число атомов S и O в гетероарильной группе не более чем 2. В другом варианте выполнения изобретения изобретения общее число атомов S и O в ароматическом гетероцикла не более 1. Примеры гетероарильных групп включают, но не ограничиваясь, пиридинил (в том числе, например, 2-гидроксипиридинил), имидазолил, имидазопиридинил, пиримидинил (в том числе, например, 4-гидроксипиримидинил), пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксадиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, тетрагидроизохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, триазолил, тиадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил, тетрагидрофуранил и фуропиридинил. Гетероарильные группы необязательно замещены независимо одним или более заместителями, описанными в настоящем документе. "Гетероарилокси" представляет собой гетероарильную группу, как описывалось, связанную с группой, которую она замещает, через кислородный, -O-, линкер.
«Гетероциклоалкил» представляет собой насыщенную кольцевую группу. Она может иметь, например, 1, 2, 3 или 4 гетероатома, независимо выбранных из N, S и O, причем остальные кольцевые атомы представляют собой углерод. В типичном варианте выполнения изобретения азот представляет собой гетероатом. Моноциклические гетероциклоалкильные группы, как правило, имеют от 3 до 8 кольцевых атомов или от 4 до 6 кольцевых атомов. Примеры гетероциклоалкильных групп включают морфолинил, пиперазинил, пиперидинил и пирролинил.
Термин «моно- и/или диалкиламино» указывает на вторичные или третичные алкиламиногруппы, где алкильные группы являются независимо выбранными алкильными группами, как определено в настоящем документе. Точка присоединения алкиламиногруппы находится на азоте. Примеры моно- и диалкиламиногрупп включают этиламино, диметиламино и метилпропиламино.
«Дозированная форма» означает единицу введения активного агента. Примеры дозированных форм включают таблетки, капсулы, инъекции, суспензии, растворы, эмульсии, импланты, частицы, сферы, кремы, мази, суппозитории, ингаляционные формы, трансдермальные формы, буккальные формы, сублингвальные формы, топические формы, гель, мукозальные формы и тому подобное. «Дозированная форма» может также включать имплант, например, оптический имплант.
«Фармацевтические композиции» представляют собой композиции, содержащие по меньшей мере один активный агент, такой как соединение или соль Формулы I, а также по меньшей мере одно другое вещество, такое как носитель. «Фармацевтические комбинации» представляют собой комбинации по меньшей мере двух активных агентов, которые могут быть объединены в одной дозированной форме или предоставлены вместе в виде отдельных дозированных форм с инструкциями так, что активные агенты должны быть использованы вместе для лечения любого расстройства, описанного в настоящем документе.
«Фармацевтически приемлемые соли» включают производные раскрытых соединений, в которых исходное соединение модифицировано путем получения неорганических и органических, нетоксичных солей присоединения кислот или оснований. Соли соединений по настоящему изобретению могут быть синтезированы из исходного соединения, которое содержит основный или кислотный остаток, обычными химическими способами. Обычно такие соли могут быть получены путем взаимодействия форм свободной кислоты этих соединений со стехиометрическим количеством соответствующего основания (такого как гидроксид Na, Са, Mg или K, карбонат, бикарбонат и тому подобное), либо путем реакции форм свободного основания этих соединений со стехиометрическим количеством соответствующей кислоты. Такие реакции, как правило, проводят в воде, или в органическом растворителе, или в смеси этих двух. Обычно неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил, являются типичными, где это практически возможно. Соли соединений по настоящему изобретению дополнительно включают сольваты соединений и компаунд соли.
Примеры фармацевтически приемлемых солей включают, но не ограничиваясь, соли минеральных или органических кислот основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как карбоновые кислоты; и тому подобное. Фармацевтически приемлемые соли включают обычные нетоксичные соли и четвертичные аммониевые соли исходного соединения, образованные, например, из нетоксичных неорганических или органических кислот. Например, обычные нетоксичные соли кислот включают соли, полученные из неорганических кислот, таких как соляная, бромистоводородная, серная, сульфаминовая, фосфорная, азотная и подобных; и соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памоиновая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, мезиловая, эзиловая, безиловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изетионовая, НООС-(CH2)n-COOH, где n равно 0-4, и подобных. Списки дополнительных подходящих солей можно найти, напр., в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., p. 1418 (1985).
Термин «носитель» применительно к фармацевтическим композициям/комбинациям по изобретению относится к разбавителю, эксципиенту или носителю, с которым предоставляется активное соединение.
«Фармацевтически приемлемый эксципиент» означает эксципиент, который пригоден для получения фармацевтической композиции/комбинации, который, как правило, безопасен, нетоксичен и ни биологически, ни иным образом не подходит для введения хозяину, и включает в одном варианте выполнения изобретения эксципиент, который приемлем для применения в ветеринарии, а также в фармацевтических целях для человека. «Фармацевтически приемлемый эксципиент», как используется в настоящем документе, включает как один, так и более чем один такой эксципиент.
«Пациент», или «хозяин», или «субъект» представляет собой человека или не являющегося человеком животное, нуждающееся в модуляции пути фактора D комплемента. Как правило, хозяин представляет собой человека. «Пациент», или «хозяин», или «субъект» также относятся к, например, млекопитающим, приматам (напр., людям), коровам, овцам, козам, лошадям, собакам, кошкам, кроликам, крысам, мышам, рыбам, птицам и подобным.
«Пролекарство», как используется в настоящем документе, означает соединение, которое при введении хозяину in vivo превращается в исходное лекарственное средство. Используемый в настоящем документе термин «исходное лекарственное средство» означает любое из описанных в химических соединений, которые пригодны для лечения любых расстройств, описанных в настоящем документе, или для контроля или улучшения основной причины или симптомов, связанных с любым физиологическим или патологическим расстройством, описанным в настоящем документе, у хозяина, как правило, человека. Пролекарства могут быть использованы для достижения любого желаемого эффекта, в том числе для улучшения свойств исходного лекарственного средства или для улучшения фармацевтических или фармакокинетических свойств исходного. Существование пролекарственной стратегии обеспечивает выбор в модуляции условий для формирования in vivo исходного лекарственного средства, все из которых считаются включенными в настоящий документ. Неограничивающие примеры пролекарственных стратегий включают ковалентное присоединение съемных групп или съемных частей групп, например, но не ограничиваясь, ацилирование, фосфорилирование, фосфонилирование, фосфорамидатные производные, амидирование, восстановление, окисление, этерификацию, алкилирование, другие карбоксильные производные, сульфокси или сульфоновые производные, карбонилирование или ангидрид, среди других.
«Предоставление соединения Формулы I с по меньшей мере одним дополнительным активным агентом» означает соединение Формулы I и дополнительный активный агент(ы), представленные одновременно в одной дозированной форме, представленные параллельно в виде отдельных лекарственных форм или представленные в отдельных дозированных формах для введения, разделенного некоторым промежутком времени, который находится в пределах времени, в котором как соединение Формулы I, так и по меньшей мере один дополнительный активный агент находятся в крови пациента. В некоторых вариантах выполнения изобретения соединение Формулы I и дополнительный активный агент не должны быть предписаны пациенту одним и тем же медицинским работником. В некоторых вариантах выполнения изобретения для дополнительного активного агента или агентов не должно требоваться рецепта. Введение соединения Формулы I или по меньшей мере одного дополнительного активного агента может происходить с помощью любого соответствующего пути, например, в пероральных таблетках, в пероральных капсулах, в пероральных растворах, ингаляцией, инъекцией, суппозиторием или местным контактом.
«Терапевтически эффективное количество» фармацевтической композиции/комбинации по настоящему изобретению означает количество, эффективное при введении пациенту для того, чтобы обеспечить терапевтическую пользу, такую как улучшение симптомов, напр., количество, эффективное для снижения симптомов макулярной дегенерации. В одном варианте выполнения изобретения терапевтически эффективное количество представляет собой количество, достаточное для предотвращения значительного увеличения или будет значительно уменьшать обнаруживаемый уровень фактора D комплемента в крови, сыворотке или тканях пациента.
II. Подробное Описание Активных Соединений
В соответствии с настоящим изобретением заявлено соединение Формулы I:

а также его фармацевтически приемлемые соли и композиции. Формулу I можно считать, имеющей центральное ядро, заместитель L-B и заместитель (C=O)А. Было обнаружено, что соединение Формулы I или его фармацевтически приемлемая соль или композиция, где R12 или R13 на группе А представляют собой арил, гетероарил или гетероцикл, является превосходным ингибитором фактора D комплемента, и, следовательно, может быть использовано в эффективном количестве для лечения хозяина, нуждающегося в модуляции фактора D комплемента.
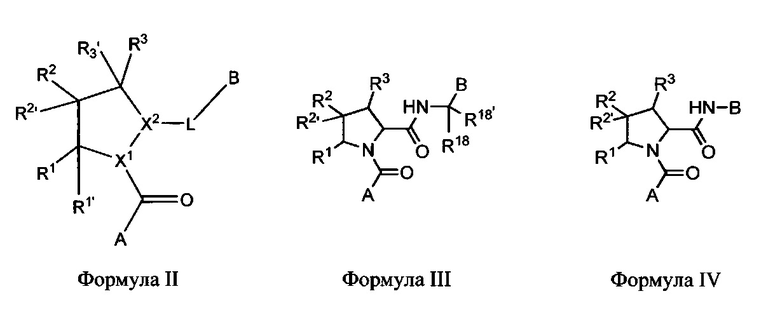
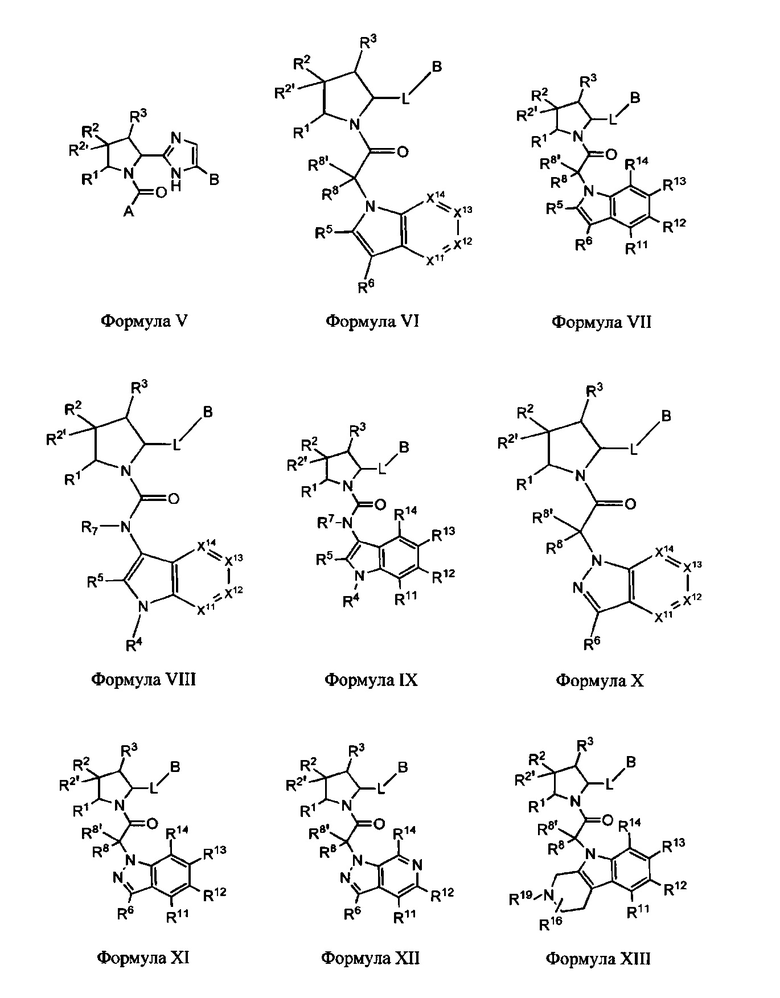
Неограничивающие примеры соединений, подпадающих под Формулу I с вариациями B переменных, напр., А, В, R1-R3' и L, показаны ниже. Описание включает все комбинации этих определений, приводящие к стабильным соединениям.
Формулы II-XXX
В одном аспекте изобретение включает соединения и соли Формул II, III, IV, V, VI, VII, VIII, IX, X, XI, XII, XIII, XIV, XV, XVI, XVII, XVIII, XIX, XX, XXI, XXII, XXIII, XXIV, XXV, XXVI, XXVII, XXVIII, XXIX и XXX, которые находятся в пределах объема Формулы I. Переменные, показанные в Формулах П-ХХХ, имеют определения, изложенные в разделе КРАТКОЕ ОПИСАНИЕ для Формулы I или любые определения, изложенные в данном описании.
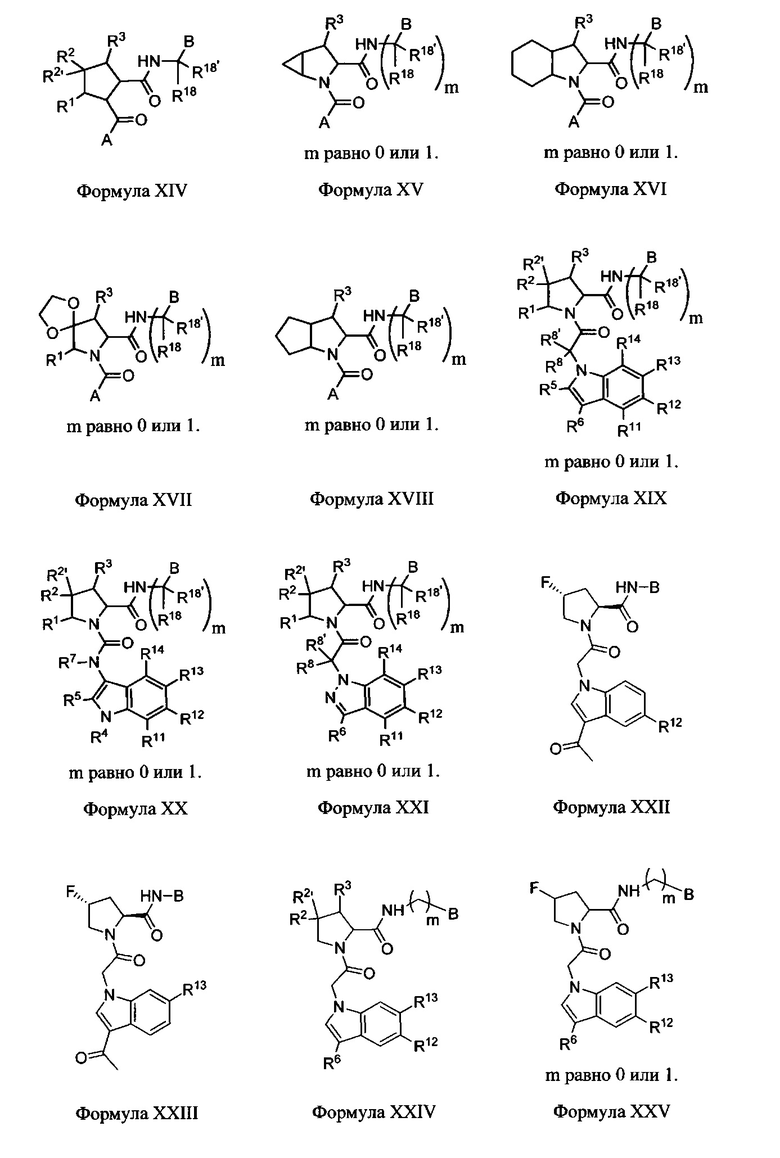
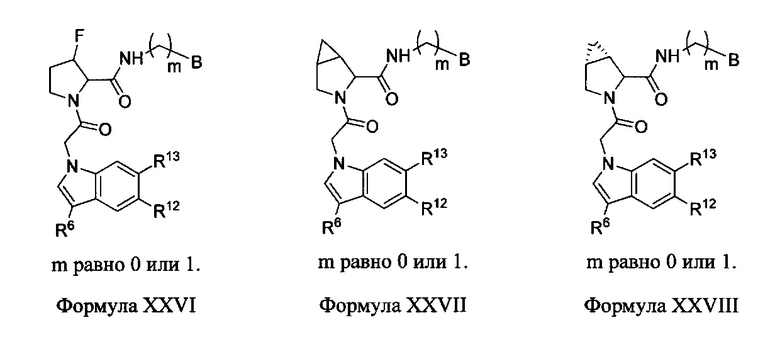

В этих вариантах выполнения изобретения следует понимать, что там, где R1 или R3 присоединен к атому углерода, могут быть два независимых присоединения, как в R2/R2', и эти формулы следует рассматривать как включающие все такие вариации.
Кроме того, изобретение включает соединения, и соли Формулы I, и их фармацевтически приемлемые композиции, и любые из их подформул (II-ХХХ), в которых по меньшей мере одно из следующих условий встречается в вариантах выполнения изобретения, описанных ниже.
Арильные, Гетероарильные и Гетероциклические Заместители R12 и R13
Было неожиданно обнаружено, что соединение Формулы I, его фармацевтически приемлемая соль или композиция, где R12 или R13 на группе A представляет собой арил, гетероарил или гетероцикл, является превосходным ингибитором Фактора D Комплемента.
Один из R12 и R13 выбран из R31, и другой из R12 и R13 выбран из R32. В другом варианте выполнения изобретения каждый из R12 и R13 могут быть независимо выбраны из R32.
R31 выбран из водорода, галогена, гидроксила, нитро, циано, амино, -COOH, C1-C2галогеналкила, C1-C2галогеналкокси, C1-C6алкила, -C0-C4алкил(C3-C7циклоалкила), C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, C2-C6алкенилокси, -C(O)OR9, C1-C6тиоалкила, -C0-C4алкилNR9R10, -C(O)NR9R10, -SO2R9, -SO2NR9R10, -OC(O)R9 и -C(NR9)NR9R10, каждый из R31, который отличается от водорода, галогена, гидроксила, нитро, циано, C1-C2галогеналкила и C1-C2галогеналкокси, является незамещенным или замещенным одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, амино, -COOH, -CONH2, C1-C2галогеналкила и C1-C2галогеналкокси, и из которых каждый R31 также необязательно замещен одним заместителем, выбранным из фенила и 4-7-членного гетероцикла, содержащего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S; при этом фенил или 4-7-членный гетероцикл не замещен или замещен одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, (моно- и ди-C1-C6алкиламино)C0-C4алкила, C1-C6алкилэфира, -C0-C4алкил)(C3-C7циклоалкила), C1-C2галогеналкила и C1-C2галогеналкокси;
R32 выбирают из арила; насыщенного или ненасыщенного гетероцикла (например, 5-6 членного кольца, имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S), где гетероцикл связан через атом углерода в гетероциклическом кольце с атомом углерода кольца A в положении R12 или R13; и гетероарила (например, 5-6-членного кольца, содержащего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S), где арил, гетероцикл или гетероарильное кольцо может быть необязательно замещенным.
Неограничивающие примеры R32 представляют собой
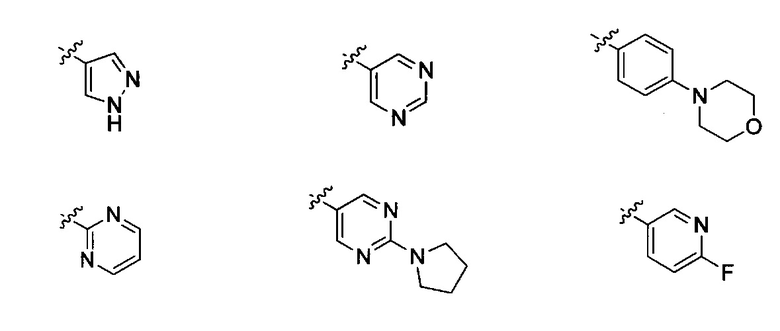

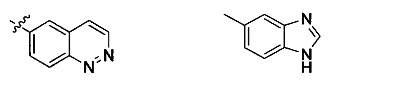 и
и  .
.
Неограничивающие Варианты R12/R13
В одном варианте выполнения изобретения R12 представляет собой R32.
В одном варианте выполнения изобретения R13 представляет собой R32.
В одном варианте выполнения изобретения R12 представляет R32, который представляет собой арил.
В одном варианте выполнения изобретения R12 представляет собой необязательно замещенный арил.
В одном варианте выполнения изобретения R12 представляет собой необязательно замещенный насыщенный или ненасыщенный гетероцикл, связанный через атом углерода в гетероциклическом кольце с атомом углерода кольца A в положении R12.
В одном варианте выполнения изобретения R12 представляет собой необязательно замещенный гетероарил.
В одном варианте выполнения изобретения R13 представляет собой необязательно замещенный арил.
В одном варианте выполнения изобретения R13 представляет собой необязательно замещенный насыщенный или ненасыщенный гетероцикл, связанный через атом углерода в гетероциклическом кольце с атомом углерода кольца A в положении R13.
В одном варианте выполнения изобретения R13 представляет собой необязательно замещенный гетероарил.
В одном варианте выполнения изобретения R12 представляет собой R32, который представляет собой (5- или 6-членный ненасыщенный или ароматический гетероцикл), имеющий 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, где (5- или 6-членный ненасыщенный гетероцикл) присоединен через атом углерода к атому углерода CR12 или CR13.
В одном варианте выполнения изобретения R12 представляет собой R32, который представляет собой (4-7 членный гетероциклоалкил), имеющий 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, где (4-7 членный гетероциклоалкил) присоединен через атом углерода к атому углерода CR12 или CR13.
В одном варианте выполнения изобретения R13 представляет R32, который представляет собой арил.
В одном варианте выполнения изобретения R13 представляет собой R32, который представляет собой (5- или 6-членный ненасыщенный или ароматический гетероцикл), имеющий 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, где (5- или 6-членный ненасыщенный гетероцикл) присоединен через атом углерода к атому углерода CR12 или CR13.
В одном варианте выполнения изобретения R13 представляет собой R32, который (4-7 членный гетероциклоалкил) имеет 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, где (4-7 членный гетероциклоалкил) связан через атом углерода с атомом углерода CR12 или CR13.
В одном варианте выполнения изобретение относится к соединениям Формулы I, где:
один из R12 и R13 представляет собой Н, а другой из R12 и R13 представляет собой R32, где
R32 выбран из арила, который может быть необязательно замещен; (5- или 6-членного ненасыщенного или ароматического гетероцикла), имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, где (5- или 6-членный ненасыщенный гетероцикл) присоединен через атом углерода к углероду CR12 или CR13, где (5- или 6-членный ненасыщенный или ароматический гетероцикл) может быть необязательно замещен; и (4-7-членного гетероциклоалкила), имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, где (4-7-членный гетероциклоалкил) присоединен через атом углерода к атому углерода CR12 или CR13, и (4-7 членный гетероциклоалкил) может быть необязательно замещенным.
В другом варианте выполнения изобретение относится к соединениям Формулы I, где:
R1, R1', R2 и R3' все представляют собой водород;
R2 представляет собой фтор, и R3 представляет собой водород, -C0-C4алкил(C3-C7циклоалкил) или -O-C0-C4алкил(C3-C7циклоалкил);
R5 представляет собой водород, галоген или C1-C2алкил;
R11, R13, R14 и R15, если присутствуют, независимо выбраны в каждом случае из водорода, галогена, гидроксила, амино, C1-C4алкила, C1-C4алкокси, -C0-C2алкил(моно- и ди-C1-C2алкиламино), трифторметила и трифторметокси;
X12 представляет собой CR12; и
R12 выбран из арила, который может быть необязательно замещен; (5- или 6-членного ненасьпценного или ароматического гетероцикла), имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, где (5- или 6-членный ненасыщенный гетероцикл) присоединен через атом углерода к углероду CR12 или CR13, где (5- или 6-членный ненасыщенный или ароматический гетероцикл) может быть необязательно замещен; и (4-7-членного гетероциклоалкила), имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, где (4-7 членный гетероциклоалкил) присоединен через атом углерода к атому углерода CR12 или CR13, и (4-7 членный гетероциклоалкил) может быть необязательно замещен.
В одном варианте выполнения изобретение относится к соединениям Формулы I, где:
m равно 0 или 1;
R2 представляет собой галоген, R2' представляет собой водород или галоген, и R3 представляет собой водород, галоген, -C0-C4алкил(C3-C7циклоалкил) или -O-C0-C4алкил(C3-C7циклоалкил);
R6 представляет собой -C(O)C1-C4алкил, -C(O)NH2, -C(O)CF3, -C(O)(C3-C7циклоалкил) или -этил(цианоимино);
один из R12 и R13 выбран из водорода, галогена, C1-C4алкила, C1-C4алкокси, трифторметила и трифторметокси; и другой из R12 и R13 представляет собой R32, где
R32 выбирают из арила; насыщенного или ненасыщенного гетероцикла (например, 5-6-членного кольца, содержащего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S), причем гетероцикл связан через атом углерода в гетероциклическом кольце с атомом углерода кольца A в положении R12 или R13; и гетероарила (например, 5-6-членного кольца, содержащего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S), где арил, гетероцикл или гетероарильное кольцо может быть необязательно замещенным.
В одном варианте выполнения изобретения изобретение относится к соединениям Формулы I, где один из R12 и R13 представляет собой водород, гидроксил, галоген, метил или метокси; а другой из R12 и R13 представляет собой R32, где
R32 выбран из арила, гетероарила или гетероцикла, связанного с кольцом A через атом углерода гетероцикла;
В одном варианте выполнения изобретения R32 может быть незамещен или замещен одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, амино, оксо, -B(ОН)2, -Si(CH3)3, -COOH, -CONH2, -P(O)(ОН)2, C1-C6алкила, C1-C6алкокси, -C0-C2алкил(моно- и ди-C1-C4алкиламино), C1-C6алкилэфиар, C1-C4алкиламино, C1-C4гидроксилалкила, C1-C2галогеналкила и C1-C2галогеналкокси.
Остаток Центрального Ядра
Остаток центрального ядра в Формуле I показан ниже:
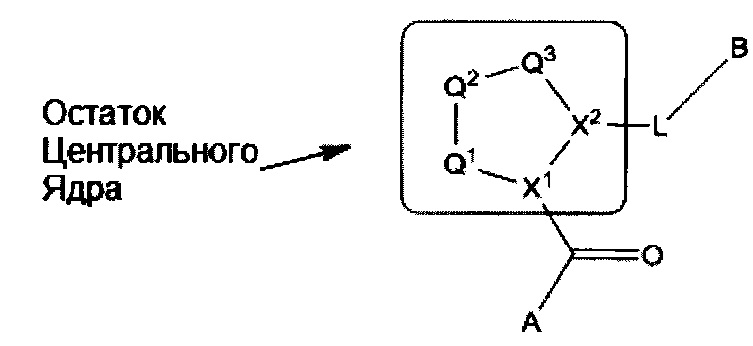 где:
где:
Q1 представляет собой N(R1) или C(R1R1);
Q2 представляет собой C(R2R2'), C(R2R2')-C(R2R2'), S, О, N(R2) или C(R2R2')O;
Q3 представляет собой N(R3), S или C(R3R3');
X1 и X2 независимо означают Н, СН или CZ, или X1 и X2 вместе представляют собой С=С; и где Q1, Q2, Q3, X1 и Х2 выбраны таким образом, что получаются стабильные соединения.
Неограничивающие примеры кольца  показаны ниже (любой из которых может быть иным образом замещен R1, R1', R2, R2', R3 и R3'), как это описано более подробно ниже.
показаны ниже (любой из которых может быть иным образом замещен R1, R1', R2, R2', R3 и R3'), как это описано более подробно ниже.


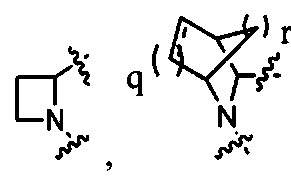 и
и  ; где q равно 0, 1, 2 или 3, и r равно 1, 2 или 3.
; где q равно 0, 1, 2 или 3, и r равно 1, 2 или 3.
R и R' независимо выбраны из Н, алкила, циклоалкила, циклоалкилалкила, гетероцикла, гетероциклоалкила, арила, гетероарила, гетероарилалкила, где каждая группа может быть необязательно замещена, или какой-либо другой группы заместителей в настоящем документе, которая обеспечивает желаемые свойства. В некоторых вариантах выполнения изобретения кольцо содержит один или более хиральных атомов углерода. Изобретение включает варианты выполнения, в которых хиральный углерод может быть представлен в качестве энантиомера или смесей энантиомеров, включая рацемическую смесь. Там, где кольцо включает более одного стереоцентра, все энантиомеры и диастереомеры включены в изобретении в качестве отдельных примеров.
Z представляет собой F, Cl, NH2, СН3, CH2D, CHD2 или CD3.
R1, R1', R2, R2', R3 и R3' независимо выбраны в каждом случае в зависимости от обстоятельств и только тогда, когда получаются стабильные соединения, из водорода, галогена, гидроксила, нитро, циано, амино, C1-C6алкила, C2-C6алкенила, C2-C6алкинила, C1-C6алкокси, C2-C6алкинила, C2-C6алканоила, C1-C6тиоалкила, гидроксиC1-C6алкила, аминоC1-C6алкила, -C0-C4алкилNR9R10, -C(O)OR9, -OC(O)R9, -NR9C(O)R10, -C(O)NR9R10, -OC(O)NR9R10, -NR9C(O)OR10, C1-C2галогеналкила и С1-С2галогеналкокси, где R9 и R10 независимо выбраны в каждом случае из водорода, C1-C6алкила, (C3-C7циклоалкил)C0-C4алкила, -C0-C4алкил(C3-C7циклоалкила) и -O-C0-C4алкил(C3-C7циклоалкила).
Неограничивающие Варианты Центрального Ядра
В альтернативных вариантах выполнения изобретения R1 и R1' или R3 и R3' могут быть взяты вместе с образованием 3-6-членного карбоциклического спиро кольца или 3-6-членного гетероциклического спиро кольцо, содержащего 1 или 2 гетероатома, независимо выбранных из N, O или S; R2 и R2' могут быть взяты вместе с образованием 3-6-членного карбоциклического спиро-кольца; или R2 и R2' могут быть взяты вместе с образованием 3-6-членного гетероциклического спиро-кольца;
каждое из колец может быть незамещенным или замещенным 1 или более заместителями, независимо выбранными из галогена (и, в частности, F), гидроксила, циано, -COOH, C1-C4алкила (включая, в частности, метил), C2-C4алкенила, C2-C4алкинила, C1-C4алкокси, C2-С4алканоила, гидроксиC1-C4алкила, (моно- и ди-C1-C4алкиламино)C0-C4алкила, -C0-C4алкил(C3-C7циклоалкила), -O-C0-C4алкил(C3-C7циклоалкила), C1-C2галогеналкила и С1-С2галогеналкокси.
В альтернативных вариантах выполнения изобретения R1 и R2 могут быть взяты вместе с образованием 3-членного карбоциклического кольца; R1 и R2 могут быть взяты вместе с образованием 4-6-членного карбоциклического или арильного кольца или 4-6-членного гетероциклического или гетероарильного кольца, содержащего 1 или 2 гетероатома, независимо выбранных из N, O и S; или R2 и R3, если связаны с соседними атомами углерода, могут быть взяты вместе с образованием 3-6-членного карбоциклического или арильного кольца или 3-6-членного гетероциклического или гетероарильного кольца;
каждое кольцо может быть незамещенным или замещенным 1 или более заместителями, независимо выбранными из галогена (в частности, F), гидроксила, циано, -COOH, C1-C4алкила (включая, в частности, метил), C2-C4алкенила, C2-C4алкинила, C1-С4алкокси, C2-C4алканоиа, гидроксиC1-C4алкил, (моно- и ди-C1-C4алкиламино)C0-C4алкила, -C0-C4алкил(C3-C7циклоалкила), -O-C0-C4алкил(C3-C7циклоалкила), C1-C2галогеналкила и C1-C2галогеналкокси.
В одном варианте выполнения изобретения остаток центрального ядра представляет собой пролин.
В одном варианте выполнения изобретения остаток центрального ядра представляет собой 4-фторпролин.
В одном варианте выполнения изобретения R1, R1', R2', R3 и R3', если присутствуют, все представляют собой водород; и R2 представляет собой фтор.
В одном варианте выполнения изобретения R1, R1', R2' и R3', если присутствуют, все представляют собой водород; и R2 представляет собой фтор, и R3 представляет собой -C0-C4алкил(C3-C7циклоалкил) или -O-C0-C4алкил(C3-C7циклоалкил).
В одном варианте выполнения изобретения R1 и R2, взятые вместе, образуют 3-6-членную циклоалкильную группу, и R1', R2', R3 и R3', где присутствуют, все представляют собой водород.
В одном варианте выполнения изобретения R1, R1', R3 и R3', если присутствуют, все представляют собой водород, a R2 и R2', взятые вместе, образуют 5- или 6-членную гетероциклоалкильную группу, имеющую 1 или 2 атома кислорода.
В одном варианте выполнения изобретения R1 представляет собой водород и R2 представляет собой фтор.
В одном варианте выполнения изобретения R1 и R2 соединены с образованием 3-членного кольца.
Раскрытие включает соединения Формулы I, в которых центральный пирролидин является замещенным винилом, например:

В одном варианте выполнения изобретения соединение Формулы I имеет структуру:

В одном варианте выполнения изобретения центральный пирролидин модифицирован добавлением второго гетероатома в пирролидиновое кольцо, такого как N, О, S или Si, например:

Другая модификация в пределах объема изобретения представляет собой присоединение заместителя на центральное кольцо пирролидина в R7 или R8 с образованием 5- или 6-членного гетероциклического кольца, например:

Примеры соединений, имеющих модификации, описанные выше, включают:

Заместители L-B Центрального Ядра
Заместители L-B центрального ядра в Формуле I приведены ниже:

L представляет собой связь или выбран из формул: 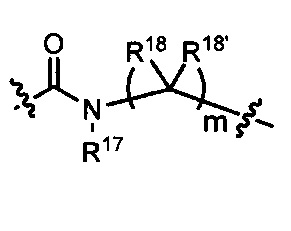 ,
,  и
и  , где R17 представляет собой водород, C1-C6алкил или -C0-C4алкил(C3-C7циклоалкил) и R18 и R18 независимо выбраны из водорода, галогена, гидроксиметила и метила; и m равно 0, 1, 2 или 3.
, где R17 представляет собой водород, C1-C6алкил или -C0-C4алкил(C3-C7циклоалкил) и R18 и R18 независимо выбраны из водорода, галогена, гидроксиметила и метила; и m равно 0, 1, 2 или 3.
В является моноциклическим или бициклическим карбоциклическим; моноциклической или бициклической карбоциклической окси-группой; моноциклической, бициклической или трициклической гетероциклической группой, имеющей 1, 2, 3 или 4 гетероатома, независимо выбранных из N, О и S, и от 4 до 7 кольцевых атомов в кольце; C2-C6алкенилом; C2-C6алкинилом; -(C0-C4-алкил)(арилом); -(C0-C4-алкил)(гетероарилом); или -(C0-C4-алкил)(бифенилом).
Каждый из B незамещен или замещен одним или более заместителями, независимо выбранными из R33 и R34, а также 0 или 1 заместителями, выбранными из R35 и R36:
R33 независимо выбран из галогена, гидроксила, -COOH, циано, C1-C6алкила, C2-C6алканоила, C1-C6алкокси, -C0-C4aлкилNR9R10, -SO2R9, С1-С2галогеналкила и C1-C2галогеналкокси;
R34 независимо выбран из нитро, C2-C6алкенила, C2-C6алкинила, C1-C6тиоалкила, -JС3-С7циклоалкила, -B(ОН)2, -JC(O)NR9R23, -JOSO2OR21, -C(O)(CH2)1-4S(O)R21, -O(CH2)1-4S(O)NR21R22, -JOP(O)(OR21)(OR22), -JP(O)(OR21)(OR22), -JOP(O)(OR21)R22, JP(O)(OR21)R22, -JOP(O)R21R22, -JP(O)R21R22, -JSP(O)(OR21)(OR22), -JSP(O)(OR21)(R22), -JSP(O)(R21)(R22), -JNR9P(O)(NHR21)(NHR22), -JNR9P(O)(OR21)(NHR22), JNR9P(O)(OR21)(OR22), -JC(S)R21, -JNR21SO2R22, -JNR9S(O)NR10R22, -JNR9SO2NR10R22, -JSO2NR9COR22, -JSO2NR9CONR21R22, -JNR21SO2R22, -JC(O)NR21SO2R22, -JC(NH2)NR22, -JC(NH2)NR9S(O)2R22, -JOC(O)NR21R22, -JNR21C(O)OR22, -JNR21OC(O)R22, -(CH2)1-4C(O)NR21R22, -JC(O)R24R25, -JNR9C(O)R21, -JC(O)R21, -JNR9C(O)NR10R22, -CCR21, -(CH2)1-4OC(O)R21 и -JC(O)OR23; каждый из R34 может быть незамещен или замещен одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, амино, оксо, -B(OH)2, -Si(CH3)3, -COOH, -CONH2, -P(O)(ОН)2, C1-C6алкила, -C0-C4алкил(C3-C7циклоалкила), C1-C6алкокси, -C0-C2алкил(моно- и ди-C1-C4алкиламино), C1-C6алкилэфира, C1-C4алкиламино, C1-C4гидроксилалкила, C1-C2галогеналкила и C1-C2галогеналкокси;
R35 независимо выбран из нафтила, нафтилокси, инданила, (4-7-членный гетероциклоалкил)C0-C4алкила, содержащего 1 или 2 гетероатома, выбранных из N, О и S, и бициклического гетероцикла, содержащего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, и содержащих от 4 до 7 кольцевых атомов в каждом кольце; каждый из R35 незамещен или замещен одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, (моно- и ди-C1-C6алкиламино)C0-C4алкила, C1-C6алкилэфира, -C0-C4алкил(C3-C7циклоалкила), -SO2R9, C1-C2галогеналкила и C1-C2галогеналкокси; и
R36 независимо выбран из тетразолила, (фенил)C0-C2алкила, (фенил)C1-C2алкокси, фенокси, и 5- или 6-членного гетероарила, содержащего 1, 2 или 3 гетероатома, независимо выбранныхиз N, О, В и S, каждый из R36 незамещен или замещен одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, (моно- и ди-C1-C6алкиламино)C0-C4алкила, C1-C6алкилэфира, -C0-C4алкил(C3-C7циклоалкила), -SO2R9, -OSi(CH3)2C(CH3)3, -Si(CH3)2C(CH3)3, C1-C2галогеналкила и C1-2галогеналкокси.
J независимо выбран в каждом случае из ковалентной связи, C1-C4алкилена, -OC1-С4алкилена, C2-C4алкенилена и C2-C4алкинилена.
В одном варианте выполнения изобретения -L-B- представляет собой
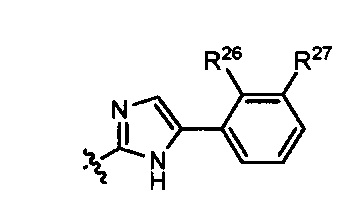 или
или  , где
, где
R26 и R27 независимо выбраны из водорода, галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, C1-C6тиоалкила, -C0-C4алкил(моно- и ди-C1-C6алкиламино), -C0-C4алкил(C3-C7циклоалкила), -C0-C4алкокси(C3-C7циклоалкила), C1-C2галогеналкила, C1-C2галогеналкокси и C1-C2галогеналкилтио.
Неограничивающие Варианты L-B
В другом варианте выполнения изобретения -L-B- представляет собой

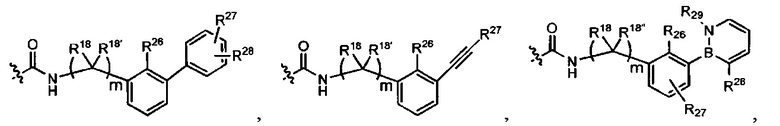
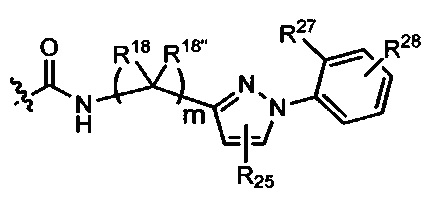 или
или  ; где
; где
R18 и R18' независимо выбраны из водорода, галогена, гидроксиметила и метила; и m равно 0 или 1; и
R26, R27 и R28 независимо выбраны из водорода, галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, C1-C6тиоалкила, (моно- и ди-С1-C6алкиламино)C0-C4алкила, (C3-C7циклоалкил)C0-C4алкила, (арил)C0-C4алкила-, (гетероарил)C0-C4алкила- и -C0-C4алкокси(C3-C7циклоалкила); каждый из которых R26, R27, R28, отличающийся от водорода, галогена, гидроксила, нитро, циано, является незамещенным или замещенным одним или более заместителями, независимо выбранными из галогена, гидроксила, амино, C1-C2алкокси, C1-C2галогеналкила, (C3-C7циклоалкил)C0-С4алкила- и C1-C2галогеналкокси; и
R29 представляет собой водород, C1-C2алкил, C1-C2галогеналкил или -Si(CH3)2C(CH3)3.
В одном варианте выполнения изобретения m равно 0.
В одном варианте выполнения изобретение дополнительно включает соединения и соли Формулы I, где B представляет собой 2-фтор-3-хлорфенил. В другом варианте выполнения изобретения используют другую карбоциклическую, арильную, гетероциклическую или гетероарильную группу, такую как 2-бром-пиридин-6-ил, 1-(2,2,2-трифторэтил)-1Н-пиразол-3-ил, 2,2-дихлорциклопропилметил или 2-фтор-3-триметилсилилфенил.
В другом варианте выполнения изобретения В представляет собой фенил, пиридил или инданил, каждый из которых незамещен или замещен одним или более заместителями, независимо выбранными из водорода, галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, C1-C6тиоалкила, (моно- и ди-C1-C6алкиламино)C0-C4алкила, (C3-C7циклоалкил)C0-C4алкила, -C0-C4алкокси(C3-C7циклоалкила), (фенил)C0-C2алкила, (пиридил)C0-C2алкила; каждый из заместителей, отличающийся от водорода, галогена, гидроксила, нитро, циано, является незамещенным или замещенным одним или более заместителями, независимо выбранными из галогена, гидроксила, амино, C1-C2алкил, C1-C2алкокси, -OSi(CH3)2С(CH3)3, -Si(CH3)2С(CH3)3, C1-C2галогеналкил и C1-C2галогеналкокси.
В другом варианте выполнения изобретения B представляет собой фенил или пиридил, замещенный 1, 2 или 3 заместителями, выбранными из хлора, брома, гидроксила, -SCF3, C1-C2алкила, C1-C2алкокси, трифторметила, фенила и трифторметокси, каждый из заместителей, отличающийся от хлора, брома, гидроксила, -SCF3, может быть необязательно замещенным.
В некоторых вариантах выполнения изобретения B представляет собой 2-фтор-3-хлорфенильную или 2-фтор-3-трифторметоксифенильную группу.
В одном варианте выполнения изобретения B представляет собой пиридил, необязательно замещенный галогеном, C1-C2алкокси и трифторметилом.
В одном варианте выполнения изобретения B представляет собой фенил, замещенный 1, 2 или 3 заместителями, независимо выбранными из галогена, C1-C2алкила, C1-C2алкокси, трифторметила и необязательно замещенного фенила.
В одном варианте выполнения изобретения R23 независимо выбран в каждом случае из (C3-C7циклоалкил)C0-C4-алкила, (фенил)C0-C4-алкила, (4-7-членного гетероциклоалкил)C0-C4алкила, имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, и (5- или 6-членного ненасыщенного или ароматического гетероцикл)C0-C4алкила, имеющего 1, 2, или 3 гетероатома, независимо выбранных из N, О и S.
В одном варианте выполнения изобретения B выбран из


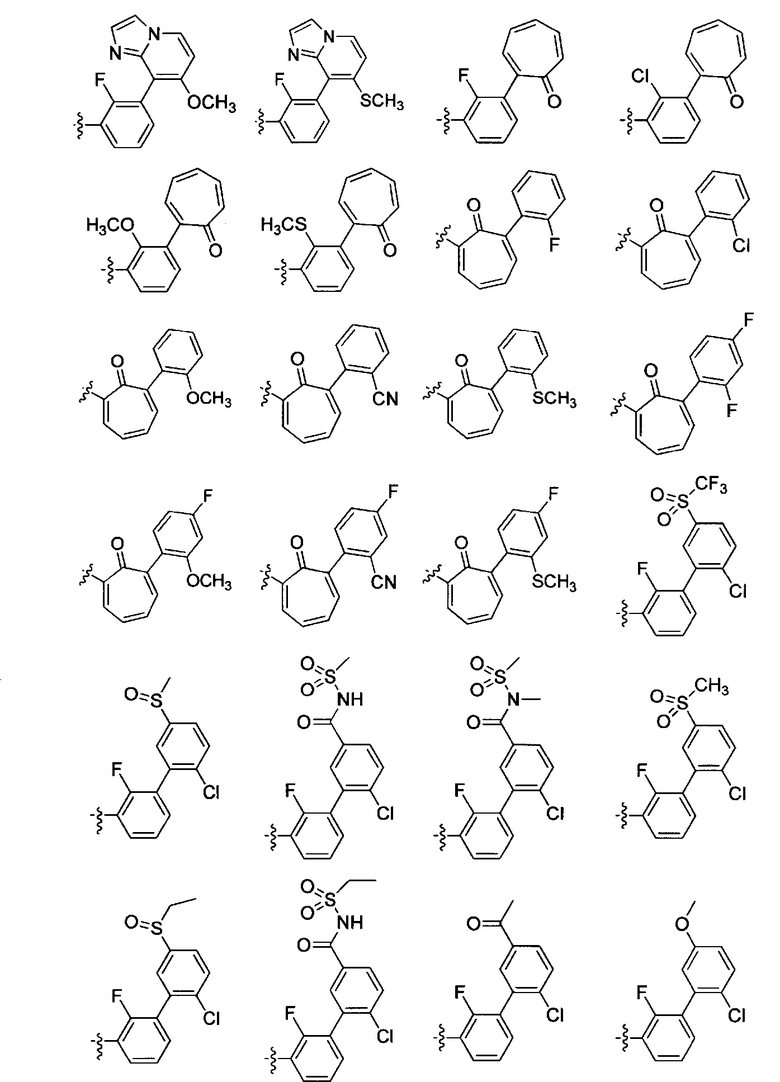



где R27 представляет собой водород, метил или трифторметил; R28 представляет собой водород или галоген; и R29 представляет собой водород, метил, трифторметил или -Si(CH3)2C(CH3)3.
Заместитель (C=O)А Центрального Ядра
Заместитель (C=O)А центрального ядра в Формуле I показан ниже:

А представляет собой группу, выбранную из:


или  .
.
R4 выбран из -CHO, -CONH2, С2-C6алканоила, водорода, -SO2NH2, -C(CH2)2F, -CH(CF3)NH2, C1-C6алкила, -C0-C4алкил(C3-C7циклоалкила), -C(O)C0-C2алкил(C3-C7циклоалкила),
 или
или  ;
;
каждый из R4, отличающийся от водорода, -CHO и -CONH2, является незамещенным или замещенным одним или более из амино, имино, галогена, гидроксила, циано, цианимино, C1-C2алкила, C1-C2алкокси, -C0-C2алкил(моно- и ди-C1-C4алкиламино), C1-C2галогеналкила и C1-C2галогеналкокси.
R5 и R6 независимо выбраны из -CHO, -C(O)NH2, -C(O)NH(CH3), C2-С6алканоиа, водорода, гидроксила, галогена, циано, нитро, -COOH, -SO2NH2, винила, C1-C6алкила (включая метил), C2-C6алкенила, C1-C6алкокси, -C0-C4алкил(C3-C7циклоалкила), -C(O)C0-C4алкил(С3-C7циклоалкила), -P(O)(OR9)2, -OC(O)R9, -C(O)OR9, -C(O)N(CH2CH2R9)(R10), -NR9C(O)R10, фенила или 5- или 6-членного гетероарила.
Каждый R5 и R6, отличаяющийся от водорода, гидроксила, циано, и -COOH, является незамещенным или необязательно замещенным. Например, R5 и R6, отличающиеся от водорода, гидроксила, циано и -COOH, могут быть замещены одним или более заместителями, независимо выбранными из галогена, гидроксила, амино, имино, циано, цианимино, C1-C2алкила, C1-C4алкокси, -C0-C2алкил(моно- и ди-C1-C4алкиламино), C1-С2галогеналкила и C1-C2галогеналкокси.
R6' представляет собой водород, галоген, гидроксил, C1-C4алкил, -C0-C4алкил(C3-C7циклоалкил) или C1-C4алкокси; или R6 и R6' могут быть взяты вместе с образованием оксо, винил или иминогруппы.
R7 представляет собой водород, C1-C6алкил или -C0-C4алкил(C3-C7циклоалкил).
R8 и R8' независимо выбраны из водорода, галогена, гидроксила, C1-C6алкила, -C0-C4алкил(C3-C7циклоалкила), C1-C6алкокси и (C1-C4алкиламино)C0-C2алкила; или R8 и R8', взятые вместе, образуют оксогруппу; или R8 и R8' могут быть взяты вместе с атомом углерода, с которым они связаны, с образованием 3-членного карбоциклического кольца.
R16 отсутствует или может включать один или более заместителей, независимо выбранных из галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, -C0-C4алкил(моно- и ди-C1-C6алкиламино), -C0-C4алкил(C3-C7циклоалкила), C1-C2галогеналкила и C1-C2галогеналкокси.
R19 представляет собой водород, C1-C6алкил, C2-C6алкенил, C2-C6алканоил, -SO2C1-С6алкил, (моно- и ди-C1-C6алкиламино)C1-C4алкил, -C0-C4алкил(C3-C7циклоалкил), -C0-C4алкил(С3-C7гетероциклоалкил), -C0-C4алкил(арил), C0-C4алкил(гетероарил), и где R19, отличающийся от водорода, является незамещенным или замещенным одним или более заместителями, независимо выбранными из галогена, гидроксила, амино, -COOH и -С(O)ОC1-C4алкила.
X11 представляет собой N или CR11.
X12 представляет собой N или CR12.
X13 представляет собой N или CR13.
X14 представляет собой N или CR14.
Не более чем 2 из X11, X12, X13 и X14 представляют собой N.
R11, R14 и R15 независимо выбраны в каждом случае из водорода, галогена, гидроксила, нитро, циано, -O(PO)(OR9)2, -(PO)(OR9)2, C1-C6алкила, C2-C6алкенила, C2-C6алкинила, C2-C6алкенил(арила), C2-C6алкенил(циклоалкила), C2-C6алкенил(гетероцикла), C2-C6алкенил(гетероарила), C2-C6алкинила, C2-C6алкинил(арила), C2-C6алкинил(циклоалкила), C2-C6алкинил(гетероцикла), C2-C6алкинил(гетероарила), C2-C6алканоила, C1-C6алкокси, C1-C6тиоалкила, -C0-C4алкил(моно- и ди-C1-C6алкиламино), -C0-C4алкил(C3-C7циклоалкила), -C0-C4алкокси(C3-C7циклоалкила), C1-C2галогеналкила и C1-C2галогеналкокси.
В одном варианте выполнения изобретения R5 и R6 независимо выбраны из -CHO, -C(O)NH2, -C(O)NH(CH3), C2-C6алканоила и водорода.
В одном варианте выполнения изобретения каждый из R5 и R6, отличающиеся от водорода, гидроксила, циано и -COOH, является незамещенным или замещенным одним или более заместителями, независимо выбранными из галогена, гидроксила, амино, имино, циано, цианимино, C1-C2алкила, C1-C4алкокси, -C0-C2алкил(моно- и ди-C1-C4алкиламино), C1-С2галогеналкила и C1-C2галогеналкокси.
В одном варианте выполнения изобретения R8 и R8' независимо представляют собой водород или метил.
В одном варианте выполнения изобретения R8 и R8' представляют собой водород.
В одном варианте выполнения изобретения R7 представляет собой водород или метил.
В одном варианте выполнения изобретения R7 представляет собой водород.
Варианты Формул IA, IB, IC и ID
Для дополнительной иллюстрации изобретения раскрыты различные варианты Формул IA, IB, IC и ID. Они представлены в качестве примера, чтобы показать некоторые из вариаций среди представленных соединений в пределах изобретения, и могут быть применены к любой из Формул I-XXX.
В одном аспекте настоящее раскрытие включает соединения и соли Формулы IA:
 , где
, где
R6, R13 и B могут иметь любое из определений, изложенных в настоящем документе, для этой переменной.
В другом аспекте настоящее раскрытие включает соединения и соли Формул IB, IC и ID.
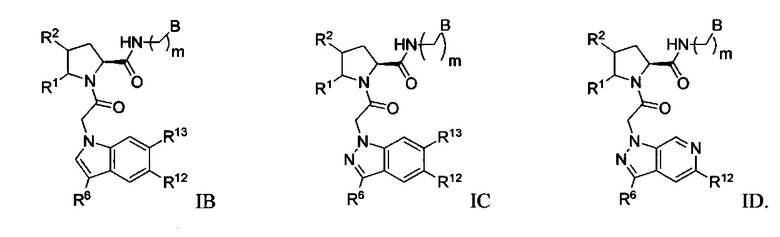
В Формулах IA, IB, IC и ID переменные могут включать любое из определений, изложенных в настоящем документе, которое приводит к стабильному соединению. В некоторых вариантах выполнения изобретения применяются следующие условия для Формул IB и IC.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой алканоил, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой алканоил, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой амид, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой амид, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой алканоил, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой алканоил, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой амид, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой амид, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой алканоил, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой фенил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой алканоил, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой фенил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой амид, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой фенил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой амид, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой фенил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой алканоил, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой фенил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой алканоил, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой фенил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой амид, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой фенил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=0, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой амид, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой фенил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой алканоил, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой алканоил, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой амид, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой амид, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой алканоил, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой алканоил, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой амид, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой амид, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой гетероарил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой алканоил, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой фенил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой алканоил, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой фенил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой амид, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой фенил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой амид, R12 представляет собой R32, R32 представляет собой гетероарил, R13 представляет собой Н и B представляет собой фенил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой алканоил, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой фенил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой алканоил, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой фенил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 представляет собой Н, R2 представляет собой F, R6 представляет собой амид, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой фенил.
В некоторых вариантах выполнения изобретения представлены структуры, включающие Формулы IB и IC, где m=1, R1 и R2 соединены с образованием 3-членного кольца, R6 представляет собой амид, R12 представляет собой Н, R13 представляет собой R32, R32 представляет собой гетероарил и B представляет собой фенил.
Варианты Формулы VII
Для дополнительной иллюстрации изобретения приведены различные варианты Формулы VII. В одном аспекте раскрытие включает соединения и соли Формулы VII:
 , где:
, где:
R1, R2, R2' и R3 независимо выбраны из водорода, галогена, C1-C4алкила, C1-С4алкокси, -C0-C2aлкилNR9R10, -C0-C4алкил(C3-C7циклоалкила), -O-C0-C4алкил(C3-C7циклоалкила), C1-C2галогеналкила и C1-C2галогеналкокси;
R8 и R8' независимо выбраны из водорода, галогена и метила;
R5 представляет собой водород, гидроксил, циано, -COOH, C1-C6алкил, C1-C6алкокси, C2-C6алканоил, -C0-C4алкил(C3-C7циклоалкил), -C(O)C0-C4алкил(C3-C7циклоалкил), C1-C2галогеналкил или C1-C2галогеналкокси;
R6 представляет собой -C(O)CH3, -C(O)NH2, -C(O)CF3, -С(O)(циклопропил) или -этил(цианоимино); и
R11 и R14 независимо выбраны из водорода, галогена, гидроксила, амино, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, C1-C6тиоалкила, -C0-C4алкил(моно- и ди-C1-C6алкиламино), -C0-C4алкил(C3-C7циклоалкила), -ОC0-C4алкил(C3-C7циклоалкила), C1-C2галогеналкила и C1-C2галогеналкокси.
Пролекарства Формулы I также включены в объем настоящего раскрытия.
Фармацевтические Препараты
Соединения, описанные в настоящем документе, могут быть введены в виде чистого химического вещества, но также могут вводиться в виде фармацевтической композиции, которая включает эффективное количество для хозяина, нуждающегося в лечении, выбранного соединения Формулы I, как описано в настоящем документе. Соответственно, изобретение относится к фармацевтическим композициям, содержащим эффективное количество соединения или фармацевтически приемлемой соли Формулы I вместе с по меньшей мере одним фармацевтически приемлемым носителем. Фармацевтическая композиция может содержать соединение или соль Формулы I в качестве единственного активного агента или в альтернативном варианте выполнения изобретения Формулу I и по меньшей мере один дополнительный активный агент. В некоторых вариантах выполнения изобретения фармацевтическая композиция находится в дозированной форме, содержащей от около 0,1 мг до около 2000 мг, от около 10 мг до около 1000 мг, от около 100 мг до около 800 мг или от около 200 мг до около 600 мг соединения Формулы I и необязательно от около 0,1 мг до около 2000 мг, от около 10 мг до около 1000 мг, от около 100 мг до около 800 мг или от около 200 мг до около 600 мг дополнительного активного агента в единичной дозированной форме. Примерами являются дозированные формы с по меньшей мере 25, 50, 100, 200, 250, 300, 400, 500, 600, 700 или 750 мг активного вещества или его соли. Фармацевтическая композиция может также включать молярное отношение соединения Формулы I и дополнительного активного агента. Например, фармацевтическая композиция может содержать молярное отношение около 0,5:1, около 1:1, около 2:1, около 3:1 или от около 1,5:1 до около 4:1 другого противовоспалительного агента.
Соединения, раскрытые в настоящем документе, могут быть введены перорально, местно, парентерально, путем ингаляции или спрея, подъязычно, с помощью импланта, включая глазной имплант, трансдермально, через трансбуккальное введение, ректально, в виде офтальмологического раствора, инъекцией, включая глазную инъекцию, внутривенно, внутриаортально, внутричерепным путем или другими средствами в дозированных единичных формах, содержащих обычные фармацевтически приемлемые носители. Фармацевтическая композиция может быть составлена в виде любой фармацевтически приемлемой формы, напр., в виде аэрозоля, крема, геля, таблетки, капсулы, таблетки, сиропа, трансдермального пластыря или офтальмологического раствора. Некоторые дозированные формы, такие как таблетки и капсулы, разделяются на единичные дозы подходящего размера, содержащие соответствующие количества активных компонентов, напр., эффективное количество для достижения желаемой цели.
Носители включают эксципиенты и разбавители и должны иметь достаточно высокую чистоту и достаточно низкую токсичность, чтобы быть пригодными для введения пациенту, подвергаемого лечению. Носитель может быть инертным или он может обладать собственными фармацевтическими преимуществами. Количество носителя, используемого в сочетании с соединением является достаточным для обеспечения практического количества материала для введения на единичную дозу соединения.
Классы носителей включают, но не ограничиваясь, связующие вещества, буферные агенты, красящие агенты, разбавители, разрыхлители, эмульгаторы, отдушки, глиданты, смазывающие вещества, консерванты, стабилизаторы, поверхностно-активные вещества, таблетирующие агенты и смачивающие агенты. Некоторые носители могут быть перечислены в более чем в одном классе, например, растительное масло может быть использовано в качестве смазочного материала в некоторых составах и в качестве разбавителя - в других. Примеры фармацевтически приемлемых носителей, включают сахара, крахмалы, целлюлозы, порошкообразный трагакант, мальтозу, желатин; тальк и растительные масла. В состав фармацевтической композиции могут быть включены необязательные активные агенты, которые по существу не влияют на активность соединения по настоящему изобретению.
Фармацевтические композиции/комбинации могут быть изготовлены для перорального введения. Эти композиции могут содержать любое количество активного соединения Формулы I, что позволяет достичь желаемого результата, например, от 0,1 до 99% массовых % (мас. %) соединения Формулы I, и обычно по меньшей мере около 5 мас. % соединения Формулы I. Некоторые варианты выполнения содержат от около 25 мас. % до около 50 мас. % или от около 5 мас. % до около 75 мас. % соединения Формулы I.
Ингибиторы фактора D комплемента по настоящему изобретению могут быть введены, например, либо системно, либо местно. Системное введение включает, например, пероральное, трансдермальное, субдермальное, интраперитонеальное, подкожное, трансназальное, сублингвальное или ректальное. Местное введение для глазного введения включает: местное, интравитреальное, периокулярное, транссклеральное, ретробульбарное, околосклеральное, субэписклеральное или через внутриглазное устройство. Ингибиторы могут быть доставлены с помощью устройства отсроченной доставки, имплантированного интравитрально или транссклерально, или с помощью других известных средств местной доставки в глаза.
Способы Лечения
Соединения и фармацевтические композиции, раскрытые в настоящем документе, могут использоваться для лечения или предотвращения расстройства, опосредованного путем комплемента, и, в частности, путем, который модулируется фактора D комплемента. В некоторых вариантах выполнения изобретения заболевание представляет собой воспалительное заболевание, иммунное заболевание, аутоиммунное заболевание или связанные с фактором D комплемента заболевания у хозяина. В одном варианте выполнения изобретения заболевание представляет собой глазное заболевание. Опосредованные комплементом заболевания, которые можно лечить или предотвращать с помощью соединений и композиций по настоящему изобретению, включают, но не ограничиваясь, воспалительные эффекты сепсиса, синдром системной воспалительной реакции (SIRS), ишемию/реперфузионное повреждение (I/R травмы), псориаз, миастению, системную красную волчанку (SLE), пароксизмальную ночную гемоглобинурию (PNH), наследственный ангионевротический отек, рассеянный склероз, травмы, ожоги, синдром капиллярной утечки, ожирение, диабет, деменцию Альцгеймера, инсульт, шизофрению, эпилепсию, возрастную макулярную дегенерацию, глаукому, диабетическую ретинопатию, астму, аллергию, острый респираторный дистресс-синдром (ARDS), атипичный гемолитико-уремический синдром (aHUS), гемолитико-уремический синдром (HUS), муковисцидоз, инфаркт миокарда, волчаночный нефрит, болезнь Крона, ревматоидный артрит, атеросклероз, отторжение трансплантата, предотвращение потери плода, реакции биоматериала (напр., при гемодиализе, имплантах), гломерулонефрит С3, аневризмы брюшной аорты, оптиконевромиелит (NMO), васкулит, неврологические расстройства, синдром Гийена-Барре, черепно-мозговую травму, болезнь Паркинсона, заболевания с несоответствующей или нежелательной активацией комплемента, осложнения гемодиализа, сверхострое отторжение аллотрансплантата, отторжение ксенографта, индуцированную интерлейкином-2 токсичность во время терапии IL-2, воспалительные заболевания, воспалительные аутоиммунные заболевания, респираторный дистресс-синдром взрослых, термическую травму, включая ожоги или обморожения, миокардит, пост-ишемические реперфузионные состояния, баллонную ангиопластику, постгемодиализный синдром в кардиопульморальном кровообращении или почечном кровообращении, гемодиализ, почечную ишемию, реперфузию брыжеечной артерии после реконструкции аорты, комплексные иммунные заболевания и аутоиммунные заболевания, нефрит SLE, пролиферативный нефрит, фиброз печени, гемолитическую анемию, регенерацию тканей и нейронную регенерацию. Кроме того, другими известными связанными с комплементом заболеваниями являются заболевания и расстройства легких, такие как одышка, кровохарканье, хроническая обструктивная болезнь легких (COPD), эмфизема, легочные эмболии и инфаркты, пневмония, фиброгенные пылевые заболевания, инертные пыли и минералы (напр., кремний, угольная пыль, бериллий и асбест), легочный фиброз, органические пылевые заболевания, химическая травма (из-за раздражающих газов и химических веществ, напр., хлора, фосгена, диоксида серы, сероводорода, диоксида азота, аммиака и соляной кислоты), дымовые травмы, термические травмы (напр., ожог, обморожение), бронхоспазм, гиперчувствительный пневмонит, паразитарные заболевания, синдром Гудпасчера, легочный васкулит, пауци-иммунный васкулит, воспаление, ассоциированное с иммунным комплексом, увеит (включая болезнь Бехчета и другие подтипы увеита), антифосфолипидный синдром, артрит, аутоиммунное заболевание сердца, воспалительное заболевание кишечника, ишемические-реперфузионные травмы, синдром Барракера-Симонса, гемодиализ, системная красная волчанка, эритематозная красная волчанка, трансплантация, заболевания центральной нервной системы и другие нейродегенеративные состояния, гломерулонефрит (в том числе пролиферативный гломерулонефрит мембран), кожные заболевания с образованием волдырей (в том числе буллезный пемфигоид, пузырчатка и буллезный эпидермолиз), глазной рубцовый пемфигоид, MPGN II, увеит, дегенерацию желтого пятна у взрослых, диабетическую ретинопатию, пигментный ретинит, макулярный отек, увеит Бехчета, мультифокальный хориоидит, синдром Фогта-Коянги-Харада, промежуточный увеит, дробьевидный ретинохориодит, симпатичесую офтальмию, глазной дикатрикиальный пемфигоид, глазную пузырчатку, ишемическую невропатию зрительного нерва, послеоперационное воспаление и окклюзию вен сетчатки.
В некоторых вариантах выполнения изобретения опосредованные комплементом заболевания включают офтальмологические заболевания (в том числе раннюю или неоваскулярную возрастную макулярную дегенерацию и географическую атрофию), аутоиммунные заболевания (в том числе артрит, ревматоидный артрит), респираторные заболевания, сердечно-сосудистые заболевания. В других вариантах выполнения изобретения соединения по настоящему изобретению пригодны для использования в лечении заболеваний и расстройств, связанных с метаболизмом жирных кислот, в том числе ожирения и других нарушений обмена веществ.
В одном варианте выполнения изобретение относится к способу лечения ночной пароксизмальной гемоглобинурии (PNH), который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли необязательно в фармацевтически приемлемом носителе. В другом варианте выполнения изобретения предложен способ лечения возрастной дегенерации желтого пятна (AMD), который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли необязательно в фармацевтически приемлемом носителе. В другом варианте выполнения изобретения предложен способ лечения ревматоидного артрита, который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли необязательно в фармацевтически приемлемом носителе. В другом варианте выполнения изобретения предложен способ лечения рассеянного склероза, который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли необязательно в фармацевтически приемлемом носителе. В другом варианте выполнения изобретения предложен способ лечения миастении, который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли необязательно в фармацевтически приемлемом носителе. В другом варианте выполнения изобретения предложен способ лечения атипичного гемолитико-уремического синдрома (aHUS), который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли необязательно в фармацевтически приемлемом носителе. В другом варианте выполнения изобретения предложен способ лечения гломерулонефрита С3, который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли необязательно в фармацевтически приемлемом носителе. В другом варианте выполнения изобретения предложен способ лечения аневризмы брюшной аорты, который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли необязательно в фармацевтически приемлемом носителе. В другом варианте выполнения изобретения предложен способ лечения оптиконевромиелита (NMO), который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли необязательно в фармацевтически приемлемом носителе.
В некоторых вариантах выполнения настоящее изобретение относится к способам лечения или предотвращения воспалительного расстройства, или расстройства, связанного с комплементом, путем введения хозяину, нуждающемуся в этом, эффективного количества соединения Формулы I по изобретению. В некоторых вариантах выполнения настоящее изобретение относится к способам лечения или предотвращения воспалительного расстройства, в более общем плане, иммунного расстройства, аутоиммунного расстройства или заболеваний, связанных с фактором D комплемента, путем предоставления эффективного количества соединения или фармацевтически приемлемой соли Формулы I пациенту с опосредованным фактором D воспалительным расстройством. Соединение или соль Формулы I могут быть предоставлены в качестве единственного активного агента или могут быть предоставлены вместе с одним или несколькими дополнительными активными агентами.
В одном варианте выполнения изобретения предложен способ лечения расстройства, связанного с дисфункцией в каскаде комплемента, который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли необязательно в фармацевтически приемлемом носителе. В одном варианте выполнения изобретения предложен способ ингибирования активации альтернативного пути комплемента у субъекта, который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли необязательно в фармацевтически приемлемом носителе. В одном варианте выполнения изобретения предложен способ модуляции активности фактора D у субъекта, который включает введение эффективного количества соединения Формулы I или его фармацевтически приемлемой соли необязательно в фармацевтически приемлемом носителе.
«Предотвращение», как используется в настоящем описании, означает, что уменьшается вероятность появления симптомов у пациента, которому профилактически вводят соединение, по сравнению с вероятностью появления симптомов у пациентов, которым не вводили соединение, или уменьшается тяжесть симптомов у пациента, которому профилактически вводят соединение, по сравнению с тяжестью симптомов, испытываемых пациентами с расстройством или состоянием, которым не вводили соединение. В альтернативном варианте выполнения изобретения эффективное количество соединения Формулы I используют для предотвращения или профилактики расстройств, связанных с фактором D комплемента.
Эффективным количеством фармацевтической композиции/комбинации по изобретению, может быть количество, достаточное для (а) ингибирования прогрессирования расстройства, опосредованного путем комплемента, в том числе воспалительного, иммунного, в том числе аутоиммунного, расстройства или связанного с фактором D заболевания; (b) инициации регресса воспалительного, иммунного, включая аутоиммунное, расстройства или связанного с фактором D заболевания; или (с) инициации из лечения воспалительного, иммунного, включая аутоиммунное, расстройства или связанного с фактором D заболевания.
Эффективное количество соединения или фармацевтической композиции, описанных в настоящем документе, также обеспечивает достаточное количество активного агента, которое при введении пациенту обеспечивает клиническое преимущество. Такое количество может быть экспериментально установлено, например, путем оценки концентрации агента в крови, или теоретически, путем вычисления биодоступности.
Комбинированная Терапия
В одном варианте выполнения изобретения соединение или соль Формулы I могут быть представлены в комбинации или в чередовании с по меньшей мере одним дополнительным ингибитором системы комплемента или вторым активным соединением с другим биологическим механизмом действия. В одном варианте выполнения изобретения соединение или соль Формулы I могут быть представлены в комбинации с ингибитором С5 комплемента или ингибитором конвертазы С5. В другом варианте выполнения изобретения соединение или соль Формулы I могут быть представлены в комбинации с экулизумабом. В одном варианте выполнения изобретения соединение или соль Формулы I могут быть представлены в комбинации с дополнительными ингибиторами фактора D.
В одном варианте выполнения изобретения соединение или соль Формулы I могут быть представлены вместе с соединением, которое ингибирует фермент, который метаболизирует ингибиторы протеазы. В одном варианте выполнения изобретения соединение или соль Формулы I могут быть представлены вместе с ритонавиром.
В неограничивающих вариантах выполнения изобретения соединение или соль Формулы I могут быть предоставлены вместе с ингибитором протеазы, растворимым регулятором комплемента, терапевтическим антителом (моноклональным или поликлональным), ингибиторами компонентов комплемента, агонистами рецептора или миРНК.
Неограничивающие примеры активных агентов в этих категориях:
Ингибиторы протеазы: полученные из плазмы концентраты C1-INH, например Cetor® (Sanquin), Berinert-P® (CSL Behring, Lev Pharma) и Cinryze®; и рекомбинантные человеческие ингибиторы С1, например Rhucin®;
Растворимые регуляторы комплемента: Растворимый рецептор 1 комплемента (TP10) (Avant Immunotherapeutics); sCR1-sLex/TP-20 (Avant Immunotherapeutics); MLN-2222/САВ-2 (Millenium Pharmaceuticals); Mirococept (Inflazyme Pharmaceuticals);
Терапевтические антитела: Экулизумаб/Soliris (Alexion Pharmaceuticals); Пекселизумаб (Alexion Pharmaceuticals); Офатумумаб (Genmab A/S); TNX-234 (Tanox); TNX-558 (Tanox); TA106 (Taligen Therapeutics); Neutrazumab (G2 Therapies); Анти-пропердин (Novelmed Therapeutics); HuMax-CD38 (Genmab A/S);
Ингибиторы компонентов комплемента: Compstatin/POT-4 (Potentia Pharmaceuticals); ARC 1905 (Archemix);
Агонисты рецепторов: PMX-53 (Peptech Ltd.); JPE-137 (Jerini); JSM-7717 (Jerini);
Другие: Рекомбинантный человеческий MBL (rhMBL; Enzon Pharmaceuticals).
В одном варианте выполнения изобретения настоящее изобретение относится к способу лечения или предотвращения возрастной дегенерации желтого пятна (AMD) путем введения субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей соединение по настоящему изобретению. В одном варианте выполнения изобретения композиции по настоящему изобретению вводят в комбинации с агентом анти-VEGF. Неограничивающие примеры агентов анти-VEGF включают, но не ограничиваясь, афлиберцепт (Eylea®; Regeneron Pharmaceuticals); ранибизумаб (Lucentis®: Genentech и Novartis); и пегаптаниб (Macugen®; OSI Pharmaceuticals и Pfizer); Бевацизумаб (Avastin; Genentech/Roche); ацетат анекортана, лактат скваламина и кортикостероиды, включая, но не ограничиваясь, ацетонид триамцинолона.
В другом варианте выполнения изобретения соединение Формулы I может быть объединено со вторым агентом для лечения расстройства глаза.
Примеры типов терапевтических агентов, которые могут быть использованы в комбинации для офтальмологических применений, включают противовоспалительные лекарственные средства, антимикробные агенты, анти-ангиогенезные агенты, иммуносупрессанты, антитела, стероиды, глазные антигипертензивные лекарственные средства и их комбинации. Примеры терапевтических агентов включают амикацин, ацетат анекортана, антраценедион, антрациклин, азол, амфотерицин B, бевацизумаб, камптотецин, цефуроксим, хлорамфеникол, хлоргексидин, диглюконат хлоргексидина, клотримазол, клотримазол цефалоспорин, кортикостероиды, дексаметазон, дезаметазон, эконазол, эфтазидим, эпиподофиллотоксин, флуконазол, флюцитозин, фторпиримидины, фторхинолины, гатифлоксацин, гликопептиды, имидазолы, итраконазол, ивермектин, кетоконазол, левофлоксацин, макролиды, миконазол, нитрат миконазола, моксифлоксацин, натамицин, неомицина, нистатин, офлоксацин, полигексаметилен бигуанид, преднизолон, ацетат преднизолона, пегаптаниб, аналоги платины, полимицин В, изетионат пропамидина, нуклеозид пиримидина, ранибизумаб, лактат скваламина, сульфонамиды, триамцинолон, ацетонид триамцинолона, триазолы, ванкомицин, агенты ингибирования фактора роста эндотелия сосудов (VEGF), антитела VEGF, фрагменты антител VEGF, алкалоид барвинка, тимолол, бетаксолол, травопрост, латанопрост, биматопрост, бримонидин, дорзоламид, ацетазоламид, пилокарпин, ципрофлоксацин, азитромицин, гентамицин, тобрамицин, цефазолин, вориконазол, ганцикловир, сидофовир, фоскарнет, диклофенак, непафенак, кеторолак, ибупрофен, индометацин, фторметалон, римексолон, анекортав, циклоспорин, метотрексат, такролимус и их комбинации. Примеры заболеваний глаз, которые могут быть подвергнуты лечению в соответствии с композициями и способами, описанными в данном документе, включают амебный кератит, грибковый кератит, бактериальный кератит, вирусный кератит, онхоцеркозный кератит, бактериальный кератоконъюнктивит, вирусный кератоконъюнктивит, дистрофические заболевания роговицы, эндотелиальная дистрофия Фукса, синдром Шегрена, синдром Стивенса-Джонсона, аутоиммунные заболевания сухих глаз, заболевания сухих глаз, связанные с окружающей средой, неоваскуляризационные заболевания роговицы, лечение и профилактика отторжения трансплантата роговицы, аутоиммунный увеит, инфекционный увеит, передний увеит, задний увеит (включая токсоплазмоз), пан-увеит, воспалительное заболевание стекловидного тела или сетчатки, профилактика и лечение эндофтальмита, макулярный отек, дегенерация желтого пятна, возрастная дегенерация желтого пятна, пролиферативная и непролиферативная диабетическая ретинопатия, гипертоническая ретинопатия, аутоиммунное заболевание сетчатки, первичная и метастатическая внутриглазная меланома, другие внутриглазные метастатические опухоли, открытоугольная глаукома, закрытоугольная глаукома, пигментная глаукома и их комбинации.
Соединение Формулы I или комбинация Формулы I и другого активного агента могут быть введены в глазную секцию путем инъекции в камеру стекловидного тела, субретинальное пространство, субхороидальное пространство, эписклеру, конъюнктиву, склеру, переднюю камеру, и роговицу, и секции в них (напр., субэпителиально, интрастромально, эндотелиально).
В альтернативном варианте выполнения изобретения соединение Формулы I или комбинация Формулы I и другого активного агента могут быть введены в глазную секцию посредством связывания с проникающими через слизистую оболочку частицами для лечения состояния, локализованного в камере стекловидного тела, субретинальном пространстве, субхороидальном пространстве, эписклере, конъюнктиве, склере или передней камере, и роговице, и секциях в них (напр., субэпителиально, интрастромально, эндотелиально). Проникающие через слизистую оболочку частицы известны в данной области техники и описаны, например, в опубликованной заявке РСТ WO 2013166436 Kala Pharmaceuticals, которая включена во всей своей полноте в настоящий документ.
В других вариантах выполнения изобретение относится к композиции, содержащей соединение Формулы I, пригодной для местного введения в глаз. Фармацевтическая композиция содержит множество покрытых частиц, содержащих ядро частицы, содержащее соединение Формулы I, где Формула I составляет по меньшей мере около 80 мас. % ядра частицы и покрытие содержит один или несколько изменяющих поверхность агентов, где один из более изменяющих поверхность агентов содержит по меньшей мере один полоксамер, поли(виниловый спирт) или полисорбат. Один или более изменяющих поверхность агентов присутствуют на внешней поверхности ядра частицы с плотностью по меньшей мере 0,01 молекул/нм. Один или более изменяющих поверхность агентов присутствуют в фармацевтической композиции в количестве от около 0,001% до около 5% по массе. Множество покрытых частиц имеют средний наименьший размер в поперечном сечении менее чем около 1 микрона. Фармацевтическая композиция также включает один или более офтальмологически приемлемых носителей, добавок и/или разбавителей.
Специалистам в данной области техники должно быть понятно, что частицы, пригодные для использования в раскрытых в настоящем документе способах, могут существовать в различных формах, включая, но не ограничиваясь, сфероиды, стержни, диски, пирамиды, кубы, цилиндры, наноспиралы, нанопружины, нанокольца, прутьевидные частицы, стреловидные частицы, каплевидные частицы, тетраподовидные частицы, призматические частицы и множество других геометрических и не геометрических форм. В некоторых вариантах выполнения изобретения описанные в настоящем изобретении частицы имеют сферическую форму.
В одном варианте выполнения настоящее изобретение относится к способу лечения или предотвращения пароксизмальной ночной гемоглобинурии (PNH) путем введения субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей соединение по настоящему изобретению. В одном варианте выполнения настоящее изобретение относится к способу лечения или предотвращения пароксизмальной ночной гемоглобинурии (PNH) путем введения субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей соединение по настоящему изобретению, в сочетании или в чередовании с дополнительными ингибиторами системы комплемента или другим активным соединением с другим биологическим механизмом действия. В другом варианте выполнения настоящее изобретение относится к способу лечения или предотвращения пароксизмальной ночной гемоглобинурии (PNH) путем введения субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей соединение по настоящему изобретению, в сочетании или чередовании с экулизумабом.
В одном варианте выполнения настоящее изобретение относится к способу лечения или предотвращения ревматоидного артрита путем введения субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей соединение по настоящему изобретению. В одном варианте выполнения настоящее изобретение относится к способу лечения или предотвращения ревматоидного артрита путем введения субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей соединение по настоящему изобретению, в сочетании или чередовании с дополнительным ингибитором системы комплемента. В другом варианте выполнения настоящее изобретение относится к способу лечения или предотвращения ревматоидного артрита путем введения субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей соединение по настоящему изобретению, в сочетании или чередовании с метотрексатом.
В некоторых вариантах выполнения изобретения соединение Формулы I вводят в комбинации или чередовании с по меньшей мере одним лекарственным средством против ревматоидного артрита, выбранным из: салицилатов, включая аспирин (Anacin, Ascriptin, Аспирин Bayer, Ecotrin) и салсалата (Mono-Gesic, Salgesic); нестероидных противовоспалительных препаратов (НПВП); неселективных ингибиторов ферментов циклооксигеназы (СОХ-1 и СОХ-2), включая диклофенак (Cataflam, Voltaren), ибупрофен (Advil, Motrin), кетопрофен (Orudis), напроксен (Aleve, Naprosyn), пироксикам (Feldene), этодолак (Lodine), индометацин, оксапрозин (Daypro), набуметон (Relafen) и мелоксикам (Mobic); селективных ингибиторов циклооксигеназы-2 (СОХ-2), включая Целекоксиб (Celebrex); модифицирующих заболевание противоревматических лекарственных средств (DMARD), включая азатиоприн (Imuran), циклоспорин (Sandimmune, Neoral), соли золота (Ridaura, Solganal, Aurolate, Myochrysine), гидроксихлорохин (Plaquenil), лефлуномид (Арава), метотрексат (Rheumatrex), пеницилламин (Cuprimine) и сульфасалазин (Azulfidine); биологических лекарственных средств, включая абатацепт (Orencia), этанерцепт (Enbrel), инфликсимаб (Remicade), адалимумаб (Humira) и анакинра (Kineret); кортикостероидов, включая бетаметазон (Celestone Soluspan), кортизон (Cortone), дексаметазон (Decadron), метилпреднизолон (SoluMedrol, DepoMedrol), преднизолон (Дельта-Cortef), преднизон (Deltasone, Orasone) и триамцинолон (Aristocort); солей золота, включая Ауранофин (Ridaura); Ауротиоглюкозу (Solganal); Ауролат; Миохризин; или любой их комбинации.
В одном варианте выполнения настоящее изобретение относится к способу лечения или предотвращения рассеянного склероза путем введения субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей соединение по настоящему изобретению. В одном варианте выполнения настоящее изобретение относится к способу лечения или предотвращения рассеянного склероза путем введения субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей соединение по настоящему изобретению, в сочетании или в чередовании с дополнительными ингибиторами системы комплемента. В другом варианте выполнения настоящее изобретение относится к способу лечения или предотвращения рассеянного склероза путем введения субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей соединение по настоящему изобретению, в сочетании или в чередовании с кортикостероидами. Примеры кортикостероидов включают, но не ограничиваясь, преднизон, дексаметазон, солюмедрол и метилпреднизолон.
В одном варианте выполнения изобретения соединение Формулы I объединено с по меньшей мере одним лекарственным средством против рассеянного склероза, выбранным из: Aubagio (терифлуномид), Avonex (интерферон бета-1a), Betaseron (интерферон бета-1b), Copaxone (ацетат глатирамера), Extavia (интерферон бета-1b), Gilenya (Финголимод), Lemtrada (алемтузумаб), Novantrone (митоксантрон), Plegridy (пэгинтерферон бета-1a), Rebif (интерферон бета-1a), Tecfidera (диметилфумарат), Tysabri (натализумаб), Solu-Medrol (метилпреднизолон), высокодозовый пероральный Дельтазон (преднизон), Н.Р. Acthar Gel (АСТН) и их комбинаций.
В одном аспекте соединение или соль Формулы I могут быть представлены в комбинации или чередовании с иммуносупрессантным агентом или противовоспалительным агентом.
В одном варианте выполнения настоящего изобретения соединение, описанное в настоящем документе, можно вводить в сочетании или чередовании с по меньшей мере одним иммуносупрессантным агентом. Иммуносупрессантным агентом, в качестве неограничивающих примеров, может быть ингибитор кальциневрина, напр. циклоспорин или аскомицин, напр., Циклоспорин A (NEORAL®), FK506 (такролимус), пимекролимус, ингибитор mTOR, напр., рапамицин или его производное, напр., Сиролимус (Rapamune®), Эверолимус (Certican®), темсиролимус, зотаролимус, биолимус-7, биолимус-9, рапалог, напр., ридафоролимус, азатиоприн, кампат 1Н, модулятор рецептора S1P, напр., финголимод или его аналог, антитело против IL-8, микофеноловая кислота или ее соль, напр., натриевая соль, или ее пролекарство, напр., Микофенолят Мофетила (CELLCEPT®), ОКТ3 (ORTHOCLONE ОКТ3®), Преднизон, ATGAM®, THYMOGLOBULIN®, Бреквинар Натрия, ОКТ4, Т10В9.А-3А, 33В3.1, 15-деоксипергуалин, тресперимус, Лефлуномид ARAVA®, CTLAI-Ig, анти-СD25, aнти-IL2R, Базиликсимаб (SIMULECT®), Даклизумаб (ZENAPAX®), мизорбин, метотрексат, дексаметазон, ISAtx-247, SDZ ASM 981 (пимекролимус, Elidel®), CTLA4lg (Абатацепт), белатацепт, LFA3lg, этанерцепт (продается как ENBREL® от Immunex), адалимумаб (Humira®), инфликсимаб (REMICADE®), антитело против LFA-1, натализумаб (Antegren®), Энлимомаб, гавилимомаб, антитимоцитарный иммуноглобулин, сиплизумаб, Алефацепт эфализумаб, пентаза, месалазин, асакол, фосфат кодеина, бенорилат, фенбуфен, напрозин, диклофенак, этодолак и индометацин, аспирин и ибупрофен.
Примеры противовоспалительных агентов включают метотрексат, дексаметазон, дексаметазоновый спирт, дексаметазона натрия фосфат, ацетат фторметалона, фторметалоновый спирт, этабонат лотопрендола, медризон, ацетат преднизолона, преднизолона натрия фосфат, дифлупреднат, римексолон, гидрокортизон, ацетат гидрокортизона, лодоксамида трометамин, аспирин, ибупрофен, супрофен, пироксикам, мелоксикам, флубипрофен, напроксан, кетопрофен, теноксикам, диклофенак натрия, фумарат кетотифена, диклофенак натрия, непафенак, бромфенак, флурбипрофен натрия, супрофен, целекоксиб, напроксен, рофекоксиб, глюкокортикоиды, диклофенак и любые их комбинации. В одном варианте выполнения изобретения соединение Формулы I объединено с одним или более нестероидными противовоспалительными препаратами (НПВП), выбранными из напроксена натрия (Апаргох), целекоксиба (Celebrex), сулиндака (Clinoril), оксапрозина (Daypro), салсалата (Disalcid), дифлунизала (Dolobid), пироксикама (Feldene), индометацина (Indocin), этодолака (Lodine), мелоксикама (Mobic), напроксена (Naprosyn), набуметона (Relafen), кеторолака трометамина (Toradol), напроксена/эзомепразола (Vimovo) и диклофенака (Voltaren) и их комбинаций.
VI. Способ получения соединений Формулы I
Сокращения
Общие Способы
Все неводные реакции проводили в атмосфере сухого аргона или газообразного азота с использованием безводных растворителей. Ход реакций и чистоту целевых соединений определяли с использованием одного из двух методов жидкостной хроматографии (LC), приведенных ниже. Структуру исходных материалов, промежуточных и конечных продуктов подтверждали стандартными аналитическими методиками, в том числе ЯМР-спектроскопией и масс-спектрометрией.
Метод A LC
Прибор: Waters Acquity Ultra Performance LC
Колонка: ACQUITY UPLC ВЕН C18 2,1×50 мм, 1,7 мкм
Температура Колонки: 40°C
Подвижная фаза: Растворитель А: H2O + 0,05% FA; Растворитель В: CH3CN + 0,05% FA
Скорость Потока: 0,8 мл/мин
Градиент: 0,24 мин @ 15% В, 3,26 мин градиент (от 15-85% В), затем 0,5 мин @ 85% В.
Детектирование: UV (PDA), ELS и MS (SQ в режиме EI)
Метод В LC
Прибор: Shimadzu LC-2010A НТ
Колонка: Athena, C18-WP, 50×4,6 мм, 5 мкм
Температура Колонки: 40°C
Подвижная фаза: Растворитель A: H2O/CH3OH/FA=90/10/0,1; Растворитель B:
H2O/CH3OH/FA=10/90/0,1
Скорость Потока: 3 мл/мин
Градиент: 0,4 мин @ 30% В, 3,4 мин градиент (30-100% В), затем 0,8 мин @ 100% В
Детектирование: UV (220/254 нм)
Пример 1. Общий путь синтеза
Соединение по настоящему изобретению может быть получено, например, из центрального ядра. В одном варианте выполнения изобретения, например, центральное ядро Структуры 1 представляет собой N-защищенную аминокислоту, где X1 представляет собой азот и PG = защитная группа. В одном варианте выполнения изобретения центральное ядро присоединяют к амину с получением амида Структуры 2 (где L-B включает остаток C(O)N). Со Структуры 2 затем может быть снята защита для получения Структуры 3. Структуру 3 присоединяют к Структуре 4 (A-COOH) с получением второй амидной связи, образуя соединение в пределах Формулы I. Химизм проиллюстрирован на Маршруте 1.

В альтернативном варианте центральное ядро Структуры 5 взаимодействует с гетероциклическим или гетероарильным соединением с получением соединения Структуры 6. В одном варианте выполнения изобретения со Структуры 6 снимают защиту с получением карбоновой кислоты, Структуры 7. В одном варианте выполнения изобретения Структуру 7 присоединяют к амину с получением соединения Формулы I. Этот химизм проиллюстрирован на Маршруте 2.

В альтернативном варианте выполнения изобретения со Структуры 8 снимают защиту с получением амина, который представляет собой Структуру 9. Структуру 9 затем соединяют с получением амида, который представляет собой Структуру 6. Со Структуры 6 снимают защиту с получением карбоновой кислоты, которая представляет собой Структуру 7. Затем присоединяют Структуру 7 с образованием амида, который попадает под Формулу I. Химизм проиллюстрирован на Маршруте 3.

В альтернативном варианте выполнения изобретения гетероарильный или арильный остаток 4-1 присоединяют к центральному ядру с получением 4-2. Защищенную кислоту, 4-2, деблокируют с образованием карбоновой кислоты, 4-3. Затем присоединяют карбоновую кислоту с образованием амида (L-B), который представляет собой 4-4. Гетероарильный или арильный остаток, А', затем может быть дополнительно использован для добавления заместителей в позиции X11, X12, X13 и X14 с получением соединений по Формуле I. Этот химизм проиллюстрирована на Маршруте 4.

В альтернативном варианте выполнения изобретения Структуру 5-1 присоединяют к кислоте, Структуре 5-2, с получением Структуры 5-3. Карбоновую кислоту, Структуру 5-3, деблокируют с получением карбоновой кислоты, которая представляет собой Структуру 5-4. Карбоновую кислоту со Структурой 5-4 присоединяют к амину с образованием амидного продукта (L-B), который представляет собой соединение в пределах Формулы I. Этот химизм проиллюстрирован на Маршруте 5.

В альтернативном варианте выполнения изобретения гетероарильное соединение Структуры 10 ацилируют с получением соединения Структуры 11, в котором LG представляет собой уходящую группу. В качестве примера, уходящая группа может быть галогенидом, например бромидом. Структуру 11 присоединяют к Структуре 12 с получением Структуры 13. В некоторых вариантах выполнения изобретения LG1 представляет собой уходящую группу. В некоторых вариантах выполнения изобретения LG1 представляет собой галогенид. Структуру 13 присоединяют к арильному, гетероарильному или гетероциклическому соединению с получением Структуры 14. В некоторых вариантах выполнения изобретения Структуру 13 обрабатывают арильной, гетероарильной или гетероциклической бороновой кислотой, металлоорганическим катализатором, основанием и органическим растворителем. В некоторых вариантах выполнения изобретения металлоорганический катализатор представляет собой тетракис(трифенилфосфин)палладий(0). В некоторых вариантах выполнения изобретения основание представляет собой карбонат цезия. В некоторых вариантах выполнения изобретения органический растворитель представляет собой DMF. Структуру 14 обрабатывают органической кислотой, такой как, но не ограничиваясь, трифторуксусная кислота, с получением Структуры 15. Структуру 15 присоединяют к Структуре 3 из Маршрута 1 с получением соединения в пределах Формулы I. Этот химизм проиллюстрирован на Маршруте 6.

В альтернативном варианте выполнения изобретения гетероарильное соединение Структуры 17 ацилируют с получением соединения Структуры 18, в котором LG представляет собой уходящую группу. В качестве примера, уходящая группа может быть галогенидом, например бромидом. Структуру 18 присоединяют к активированному сложному эфиру, Структуре 12 из Маршрута 6, в котором LG1 может быть галогеном, с получением Структуры 19.
Структуру 19 присоединяют к арильному, гетероарильному или гетероциклическому соединению с получением Структуры 20. В некоторых вариантах выполнения изобретения Структуру 19 обрабатывают арильной, гетероарильной или гетероциклической бороновой кислотой, металлоорганическим катализатором, основанием и органическим растворителем. В некоторых вариантах выполнения изобретения металлоорганический катализатор представляет собой тетракис(трифенилфосфин)палладий(0). В некоторых вариантах выполнения изобретения основание представляет собой карбонат цезия. В некоторых вариантах выполнения изобретения органический растворитель представляет собой DMF. Структуру 20 обрабатывают органической кислотой, такой как, но не ограничиваясь, трифторуксусная кислота, с получением Структуры 21. Структуру 21 присоединяют к Структуре 3 из Маршрута 1 с получением соединения в пределах Формулы I. Этот химизм проиллюстрирован на Маршруте 7.


В альтернативном варианте выполнения изобретения гетероарильное соединение Структуры 8-1 ацилируют с получением соединения Структуры 8-2, в котором LG представляет собой уходящую группу. В качестве примера, уходящая группа может быть галогенидом, например бромидом. Структуру 8-2 присоединяют к Структуре 8-3 с получением Структуры 8-4. В некоторых вариантах выполнения изобретения LG1 представляет собой уходящую группу. В некоторых вариантах выполнения изобретения LG1 представляет собой галогенид.
Структуру 8-4 присоединяют к арильному, гетероарильному или гетероциклическому соединению с получением Структуры 8-5. В некоторых вариантах выполнения изобретения Структуру 8-4 обрабатывают арильной, гетероарильной или гетероциклической бороновой кислотой, металлоорганическим катализатором, основанием и органическим растворителем. В некоторых вариантах выполнения изобретения металлоорганический катализатор представляет собой тетракис(трифенилфосфин)палладий(0). В некоторых вариантах выполнения изобретения основание представляет собой карбонат цезия. В некоторых вариантах выполнения изобретения органический растворитель представляет собой DMF. Структуру 8-5 обрабатывают органической кислотой, такой как, но не ограничиваясь, трифторуксусная кислота, с получением Структуры 8-6. Структуру 8-6 присоединяют к Структуре 3 из Маршрута 1 с получением соединения в пределах Формулы I. Этот химизм проиллюстрирован на Маршруте 8.

В альтернативном варианте выполнения изобретения гетероарильное соединение Структуры 9-1 ацилируют с получением соединения Структуры 9-2, в котором LG представляет собой уходящую группу. В качестве примера, уходящая группа может быть галогенидом, например бромидом. Структуру 9-2 присоединяют к активированному сложному эфиру, Структуре 9-3, в котором LG1 может представлять собой галогенид, с получением Структуры 9-4. Структуру 9-4 присоединяют к арильному, гетероарильному или гетероциклическому соединению с получением Структуры 9-5. В некоторых вариантах выполнения изобретения Структуру 9-4 обрабатывают арильной, гетероарильной или гетероциклической бороновой кислотой, металлоорганическим катализатором, основанием и органическим растворителем. В некоторых вариантах выполнения изобретения металлоорганический катализатор представляет собой тетракис(трифенилфосфин)палладий(0). В некоторых вариантах выполнения изобретения основание представляет собой карбонат цезия. В некоторых вариантах выполнения изобретения органический растворитель представляет собой DMF. Структуру 9-5 обрабатывают органической кислотой, такой как, но не ограничиваясь, трифторуксусная кислота, с получением Структуры 9-6. Структуру 9-6 присоединяют к Структуре 3 из Маршрута 1 для получения соединения в пределах Формулы I. Этот химизм проиллюстрирован на Маршруте 9.

В альтернативном варианте выполнения изобретения Структуру 10-1 присоединяют к амину с получением амида (L-B) и Структуры 10-2. Структуру 10-2 присоединяют к амину с получением соединений в пределах Формулы I. Этот химизм проиллюстрирован на Маршруте 10.

Пример 2. Примеры Центральных Синтонов

 и
и  .
.
ZA представляет собой галоген.
В одном варианте выполнения изобретения раскрыты дейтерированные синтоны L-пролина. Дейтерированные синтоны включают, но не ограничиваясь, например, следующие соединения:

Структуру А можно обработать оксидом дейтерия с получением Структуры В. Смотри Barraclough, P. et al. Tetrahedron Lett. 2005, 46, 4653-4655; Barraclough, P. et al. Org. Biomol. Chem. 2006, 4, 1483-1491 и WO 2014/037480 (р. 103). Структуру B можно восстановить с получением Структуры С. Смотри Barraclough, P. et al. Tetrahedron Lett. 2005, 46, 4653-4655; Barraclough, P. et al. Org. Biomol. Chem. 2006, 4, 1483-1491. Структуру C можно обработать в условиях реакции Мицунобу с получением Структуры D. Структуру B можно обработать DAST с получением Структуры Е. Смотри WO 2014/037480. Структуру A можно обработать бородейтеридом натрия с получением Структуры F. Смотри Dormoy, J.-R.; Castro, В. Synthesis 1986, 81-82. Соединение F можно использовать для получения Структуры К. Смотри Dormoy, J.-R.; Castro, В. Synthesis 1986, 81-82. Структуру B можно обработать дейтерированным восстанавливающим агентом, например бородейтеридом натрия, с получением Структуры G. Структуру G можно обработать DAST с получением Структуры Н. Структура F может быть использована для получения Структуры К. Смотри Dormoy, J.-R.; Castro, В. Synthesis 1986, 81-82. Структура G может быть использована для получения Структуры I. Структура J может быть получена в соответствии с Hruby, V. J. et al. J. Am. Chem. Soc. 1979, 101, 202-212. Структуры A-J могут быть использованы для получения соединений Формулы I.
Пример 3. Получение Центральных-L-B синтонов

На Маршруте 1а 5-(1,1-диметилэтил) сложный эфир 5-азаспиро[2,4]гептан-4,5-дикарбоновой кислоты, (4S)-, CAS 209269-08-9, может быть получен, как описано в Tandon, М. et al. Bioorg. Med. Chem. Lett. 1998, 8, 1139-1144. На Стадии 2, защищенный азаспиро[2,4]гептан присоединяют к амину в присутствии органического растворителя, основания и конденсирующего реагента с получением амидной связи; остатка L-B. В одном варианте выполнения изобретения амин представляет собой (3-хлор-2-фторфенил)метанамин. В одном варианте выполнения изобретения органический растворитель представляет собой DMF. В одном варианте выполнения изобретения основание представляет собой диизопропилэтиламин. В одном варианте выполнения изобретения конденсирующий реагент представляет собой HATU. На Стадии 3 удаляют защитную группу. В одном варианте выполнения изобретения исходный материал вступает в реакцию с кислотой в присутствии органического растворителя. В одном варианте выполнения изобретения выполнения изобретения кислота представляет собой 4н. хлороводородную кислоту. В одном варианте выполнения изобретения органический растворитель представляет собой диоксан.
На Маршруте 1b гидрохлорид (4S)-4-оксазолидинкарбоновой кислоты обрабатывают аминным защитным реагентом. В одном варианте выполнения изобретения аминный защитный реагент представляет собой ди-трет-бутилдикарбонат. В другом варианте выполнения изобретения 3-(1,1-диметилэтил) сложный эфир 3,4-оксазолидиндикарбоксиловой кислоты, (4S)-, является коммерчески доступным от JPM2 Pharmaceuticals. В одном варианте выполнения изобретения реакцию проводят в органическом растворителе в присутствии основания. В одном варианте выполнения изобретения органический растворитель представляет собой ацетонитрил. В одном варианте выполнения изобретения основание представляет собой 4-диметиламинопиридин (DMAP). На Стадии 2 защищенную 4-оксазолидинкарбоновую кислоту присоединяют к амину в присутствии органического растворителя, основания и конденсирующего реагента с получением амидной связи; остатка L-B. В одном варианте выполнения изобретения амин представляет собой (3-хлор-2-фторфенил)метанамин. В одном варианте выполнения изобретения органический растворитель представляет собой DMF. В одном варианте выполнения изобретения основание представляет собой диизопропилэтиламин. В одном варианте выполнения изобретения конденсирующий реагент представляет собой HATU. На Стадии 3 удаляют защитную группу. В одном варианте выполнения изобретения исходный материал вступает в реакцию с кислотой в присутствии органического растворителя. В одном варианте выполнения изобретения кислота представляет собой 4н. хлороводородную кислоту. В одном варианте выполнения изобретения органический растворитель представляет собой диоксан.
На Маршруте 1 с, (S)-5-(трет-Бутоксикарбонил)-5-азаспиро[2,4]гептан-6-карбоновая кислота, CAS 1129634-44-1, является коммерчески доступной от Ark Pharm. На Стадии 2 карбоновую кислоту присоединяют к амину в присутствии органического растворителя, основания и конденсирующего реагента с получением амидной связи; остатка L-B. В одном варианте выполнения изобретения амин представляет собой (3-хлор-2-фторфенил)метанамин. В одном варианте выполнения изобретения органический растворитель представляет собой DMF. В одном варианте выполнения изобретения основание представляет собой диизопропилэтиламин. В одном варианте выполнения изобретения конденсирующий реагент представляет собой HATU. На Стадии 3 удаляют защитную группу. В одном варианте выполнения изобретения исходный материал вступает в реакцию с кислотой в присутствии органического растворителя. В одном варианте выполнения изобретения кислота представляет собой 4н. хлороводородную кислоту. В одном варианте выполнения изобретения выполнения изобретения органический растворитель представляет собой диоксан.

На Маршруте 2а коммерчески доступный Boc-L-пролин присоединяют к амину в присутствии органического растворителя, основания и конденсирующего реагента с получением амидной связи; остатка L-B. В одном варианте выполнения изобретения амин представляет собой (3-хлор-2-фторфенил)метанамин. В одном варианте выполнения изобретения органический растворитель представляет собой DMF. В одном варианте выполнения изобретения основание представляет собой диизопропилэтиламин. В одном варианте выполнения изобретения конденсирующий реагент представляет собой HATU. На Стадии 3 удаляют защитную Вос-группу. В одном варианте выполнения изобретения исходный материал вступает в реакцию с кислотой в присутствии органического растворителя. В одном варианте выполнения изобретения кислота представляет собой 4н. хлороводородную кислоту. В одном варианте выполнения изобретения органический растворитель представляет собой диоксан.
На Маршруте 2b коммерчески доступную (1R,3S,5R)-2-[(трет-бутокси)карбонил]-2-азабицикло[3.1.0]гексан-3-карбоновую кислоту от Enamine присоединяют к амину в присутствии органического растворителя, основания и конденсирующего реагента с получением амидной связи; остатка L-B. В одном варианте выполнения изобретения амин представляет собой (3-хлор-2-фторфенил)метанамин. В одном варианте выполнения изобретения органический растворитель представляет собой DMF. В одном варианте выполнения изобретения основание представляет собой диизопропилэтиламин. В одном варианте выполнения изобретения конденсирующий реагент представляет собой HATU. На Стадии 2 удаляют защитную Вос-группу. В одном варианте выполнения изобретения исходный материал вступает в реакцию с кислотой в присутствии органического растворителя. В одном варианте выполнения изобретения кислота представляет собой 4н. хлороводородную кислоту. В одном варианте выполнения изобретения органический растворитель представляет собой диоксан.
На Маршруте 2 с коммерчески доступную (2S,4R)-1-(трет-бутоксикарбонил)-4-фторпирролидин-2-карбоновую кислоту от Manchester Organics присоединяют к амину в присутствии органического растворителя, основания и конденсирующего реагента с получением амидной связи; остатка L-B. В одном варианте выполнения изобретения амин представляет собой (3-хлор-2-фторфенил)метанамин. В одном варианте выполнения изобретения органический растворитель представляет собой DMF. В одном варианте выполнения изобретения основание представляет собой диизопропилэтиламин. В одном варианте выполнения изобретения конденсирующий реагент представляет собой HATU. На Стадии 2 удаляют защитную Вос-группу. В одном варианте выполнения изобретения исходный материал вступает в реакцию с кислотой в присутствии органического растворителя. В одном варианте выполнения изобретения кислота представляет собой 4н. хлороводородную кислоту. В одном варианте выполнения изобретения органический растворитель представляет собой диоксан.
На Маршруте 2d коммерчески доступную (S)-1-(трет-бутоксикарбонил)индолин-2-карбоновую кислоту от Chem-Impex присоединяют к амину в присутствии органического растворителя, основания и конденсирующего реагента с получением амидной связи; остатка L-B. В одном варианте выполнения изобретения амин представляет собой (3-хлор-2-фторфенил)метанамин. В одном варианте выполнения изобретения органический растворитель представляет собой DMF. В одном варианте выполнения изобретения основание представляет собой диизопропилэтиламин. В одном варианте выполнения изобретения конденсирующий реагент представляет собой HATU. На Стадии 2 удаляют защитную Вос-группу. В одном варианте выполнения изобретения исходный материал вступает в реакцию с кислотой в присутствии органического растворителя. В одном варианте выполнения изобретения кислота представляет собой 4н. хлороводородную кислоту. В одном варианте выполнения изобретения органический растворитель представляет собой диоксан. Этот химизм проиллюстрирован на Схеме 2.
Дополнительные исходные материалы, которые легко могут быть превращены в Центральные-L-B-Синтоны, включают, но не ограничиваясь: (S)-1-(трет-бутоксикарбонил)-2,3-дигидро-1Н-пиррол-2-карбоновую кислоту, CAS 90104-21-5, доступную от Ark Pharm; циклопент-1-ен-1,2-дикарбоновую кислоту, СAS 3128-15-2, приобретенную у Ark Pharm; имидазол, 1Н-имидазол-1,2-дикарбоновую кислоту, 1-(1,1-диметилэтил) 2-этиловый эфир, СAS 553650-00-3, коммерчески доступный от FCH Group; Вос-L-октагидроиндол-2-карбоновую кислоту, которая может быть приобретена у Chem Impex. Соединение,
 может быть получено в соответствии с методиками, описанными в WO 2004/111041; (S)-Вос-5-оксопирролидин-2-карбоновая кислота доступна от Aldrich Chemical Co.; (1S,2S,5R)-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]гексан-2-карбоновая кислота доступна от Ark Pharm; (S)-3-Вос-тиазолидин-2-карбоновая кислота доступна от Alfa Aesar; (2S,4R)-1-(трет-бутоксикарбонил)-4-хлоропирролидин-2-карбоновая кислота доступна от Arch Bioscience; (1S,3aR,6aS)-2-(трет-бутоксикарбонил)октагидроциклопента[с] пиррол-1-карбоновая кислота доступна от Ark Pharm; 1,2-пирролидиндикарбоновая кислота, 3-[[(фенилметокси)карбонил]амино]-, 1-(1,1-диметилэтил) сложный эфир, (2S,3R) может быть получен, как описано в WO 2004/007501. Группа Cbz может быть удалена, и аминогруппа может быть алкилирована с получением соединений с центральным ядром по настоящему изобретению.
может быть получено в соответствии с методиками, описанными в WO 2004/111041; (S)-Вос-5-оксопирролидин-2-карбоновая кислота доступна от Aldrich Chemical Co.; (1S,2S,5R)-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]гексан-2-карбоновая кислота доступна от Ark Pharm; (S)-3-Вос-тиазолидин-2-карбоновая кислота доступна от Alfa Aesar; (2S,4R)-1-(трет-бутоксикарбонил)-4-хлоропирролидин-2-карбоновая кислота доступна от Arch Bioscience; (1S,3aR,6aS)-2-(трет-бутоксикарбонил)октагидроциклопента[с] пиррол-1-карбоновая кислота доступна от Ark Pharm; 1,2-пирролидиндикарбоновая кислота, 3-[[(фенилметокси)карбонил]амино]-, 1-(1,1-диметилэтил) сложный эфир, (2S,3R) может быть получен, как описано в WO 2004/007501. Группа Cbz может быть удалена, и аминогруппа может быть алкилирована с получением соединений с центральным ядром по настоящему изобретению.
Соединение  , может быть получено, как описано в Braun, J.V.; Heymons, Albrecht Berichte der Deutschen Chemischen Gesellschaft [Abteilung] B: Abhandlungen (1930) 63B, 502-7.
, может быть получено, как описано в Braun, J.V.; Heymons, Albrecht Berichte der Deutschen Chemischen Gesellschaft [Abteilung] B: Abhandlungen (1930) 63B, 502-7.
Соединения (2S,3S,4S)-4-фтор-3-метоксипирролидин-1,2-дикарбоновой кислоты 1-трет-бутиловый сложный эфир и (2R,3R,4R)-3-фтор-4-метоксипирролидин-1,2-дикарбоновой кислоты 1-трет-бутиловый эфир могут быть получены в виде смеси в соответствии с WO 2012/093101 Novartis и региоизомеры могут быть в конечном счете отделены друг от друга, будучи присоединенными с получением синтонов центрального ядра-L-B. Соединение (S)-Вос-5-оксопирролидин-2-карбоновая кислота доступна от Aldrich Chemical Co.
Пример 4. Синтез Арильных, Гетероарильных и Гетероциклических Соединений Формулы I.
Синтез (2S,4R)-1-(2-(3-ацетил-5-(2-метоксипиридин-5-ил)-1Н-индол-1-ил)ацетил)-N-(2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)-4-фторпирролидин-2-карбоксамида (27).
Схема 1
 I
I
1-(5-Бром-1H-индол-3-ил)этанон (2) получали из 5-броминдола в соответствии с процедурой, описанной MacKay et al. (MacKay, J.A.; Bishop, R.; Rawal, V.H. Org. Lett. 2005, 7, 3421-3424.)
трет-Бутил-2-(3-ацетил-5-бром-1Н-индол-1-ил)ацетат (3).
Смесь 3,9 г (16,4 ммоль) 1-(5-бром-1Н-индол-3-ил)этанона, 2,63 мл (18,02 ммоль) трет-бутилбромацетата и 2,50 г (18,02 ммоль) карбоната калия в безводном ацетонитриле (80 мл) нагревали с обратным холодильником в течение 5 ч. Реакционную смесь затем охлаждали до к.т.и растворитель удаляли при пониженном давлении. Остаток растворяли в смеси 1:1 CH2Cl2 и воды (100 мл:100 мл). Два слоя разделяли и органический слой промывали водой (2×100 мл). В конце органический слой сушили (Na2SO4) и концентрировали. Полученный остаток перемешивали с 50 мл гептана в течение 30 мин, охлаждали на ледяной бане и фильтровали, промывая твердое вещество холодным гептаном (10 мл). Это твердое вещество кремового цвета сушили при высоком вакууме с получением 5,6 г трет-бутил-2-(3-ацетил-5-бром-1H-индол-1-ил)ацетата.
трет-бутил-2-(3-ацетил-5-(2-метоксипиримидин-5-ил)-1Н-индол-1-ил)ацетат (4).
Смесь 351 мг (1 экв.) 3, (2-метоксипиримидин-5-ил)бороновой кислоты (230 мг, 1,5 экв.), карбоната цезия (650 мг, 2 экв) в DMF (15 мл) и воды (1,5 мл) продували аргоном в сосуде под давлением в течение 5 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (57 мг, 0,05 экв.) в атмосфере аргона и сосуд под давлением герметично закрывали и нагревали при 100°C в течение ночи. Реакционную смесь охлаждали до к.т. и растворитель удаляли при пониженном давлении. Сырой продукт (7:3 смесь кислоты и сложного эфира) использовали непосредственно в следующей стадии синтеза.
2-(3-ацетил-5-(2-метоксипиримидин-5-ил)-1Н-индол-1-ил) уксусная кислота (5).
Взяли трет-бутил-2-(3-ацетил-5-(2-метоксипиримидин-5-ил)-1Н-индол-1-ил)ацетат (сырой продукт приведенной выше реакции) в 4н. HCl в диоксане (20 мл) и полученную реакционную смесь перемешивали при к.т. в течение 4 ч. После завершения реакции растворитель удаляли при пониженном давлении. Остальной материал использовали непосредственно на следующей стадии синтеза.
(2S,4R)-1-(2-(3-ацетил-5-(2-метоксипиримидин-5-ил)-1Н-индол-1-ил)ацетил)-N-(2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)-4-фторпирролидин-2-карбоксамид (27).
Соединение 5 (100 мг, 1 экв.) с предыдущей стадии растворяли в DMF (10 мл) и добавляли iPr2NEt (0,269 мл, 5 экв.) с последующим добавлением гидрохлорида (2S,4R)-N-(3-хлор-(2S,4R)-N-(6-хлорпиридин-2-ил)-4-фторпирролидин-2-карбоксамида (111 мг, 1 экв.) при температуре 5°C. Затем при этой же температуре медленно добавляли HATU (263 мг, 2,1 экв.) и реакционную смесь перемешивали втечение 3 ч при к.т. После завершения реакции, контролируемой с помощью ВЭЖХ, реакционную смесь добавляли в воду (50 мл + 10 г NaCl) и экстрагировали с помощью DCM (2×25 мл). Органический слой последовательно промывали водным раствором NaHCO3 (20 мл), водой (20 мл) и солевым раствором (20 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (ISCO элюируют смесью DCM/CH3OH) с получением 7. 1Н ЯМР (400 МГц, DMSO-d6, 300 К): (главный ротамер) δ 2,13-2,3 (m, 1Н), 2,45 (s, 3Н), 2,68-2,70 (m, 1Н), 3,95-4,05 (m, 4Н), 4,16-4,24 (m, 1Н), 4,78 (t, J=8 Гц, 1H), 5,28 (d, J=20 Гц, 1Н), 5,45 (d, J=20 Гц, 1H), 5,50-5,63 (m, 1Н), 7,04-7,08 (m, 1H), 7,20-7,24 (m, 1H), 7,37-7,61 (m, 7Н), 7,75-7,78 (m, 1H), 7,94-7,98 (m, 1H), 8,31 (s, 1Н), 8,88 (s, 1Н), 8,97 (s, 1H); 19F ЯМР (376 МГц, DMSO-d6, 300 К): (главный ротамер) δ -126,64, -175,79. LC (метод A): tR=2,16 мин. LC/MS (EI) m/z: [М+Н]+ рассч. для C34H28ClF2N5O4, 643; найдено 644.
Схема 2

Гидрохлорид 2'-хлор-2-фтор-[1,1'-бифенил]-3-амина (10).
Смесь 8 (30 г), 9 (60 г), К2СО3 (91 г) и Pd(dppf)2Cl2 (19,25 г) в растворителе (диоксан 400 мл, H2O 100 мл) продували аргоном в сосуде высокого давления в течение 5 мин и перемешивали в течение 15 ч при 100°C. Растворитель удаляли при пониженном давлении и полученный остаток очищали с помощью колоночной флэш-хроматографии. Очищенный материал затем растворяли в МеОН и обрабатывали HCl/МеОН. Растворитель удаляли и оставшееся твердое вещество промывали IPA-гептаном (1/1) с получением 10.
(2S,4R)-трет-Бутил-2-((2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)карбамоил)-4-фторпирролидин-1-карбоксилат (12).
К охлажденному льдом раствору 11 (530 мг) в 20 мл CH2Cl2 по каплям при перемешивании добавляли 1-хлор-N,N,2-триметил-1-пропениламин (0,333 мл, 1,1 экв.). Перемешивание продолжали в течение 3 ч при этой температуре, затем добавляли твердый 10 (640 мг, 1,1 экв) и затем 1,12 мл iPr2NEt (3 экв.). Охлаждающую баню удаляли и реакционную смесь перемешивали в течение ночи при к.т. После завершения реакции, контролируемого с помощью ВЭЖХ, реакционную смесь добавляли в воду (20 мл) и экстрагировали с помощью DCM (2×25 мл). Органический слой последовательно промывали водным раствором NaHCO3 (20 мл), водой (20 мл) и солевым раствором (20 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (ISCO элюируют смесью Гексаны/EtOAC) с получением 12.
Гидрохлорид (2S,4R)-N-(2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)-4-фторпирролидин-2-карбоксамида (6).
Взяли (2S,4R)-трет-бутил-2-((2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)карбамоил)-4-фторпирролидин-1-карбоксилат 12 (700 мг) в 4н. HCl в диоксане (25 мл) и полученную реакционную смесь перемешивали при к.т. в течение 3 ч. После завершения реакции, контролируемой с помощью ВЭЖХ, растворитель удаляли при пониженном давлении. Остающийся остаток 6 использовали непосредственно в следующей стадии синтеза (получение 7).
Пример 5. Дополнительные Синтезы Арильных, Гетероарильных и Гетероциклических Соединений Формулы I.
Схема 1

Стадия 1:1-(5-Бром-1Н-индол-3-ил)этанон.
Указанное в заголовке соединение получали из 5-броминдола в соответствии с процедурой, описанной MacKay et al. (MacKay, J.A.; Bishop, R.; Rawal, V.H. Org. Lett. 2005, 7, 3421-3424.)
Стадия 2: трет-Бутил-2-(3-ацетил-5-бром-1Н-индол-1-ил)ацетат.
Смесь 1-(5-бром-1Н-индол-3-ил)этанона (3,9 г, 16,4 ммоль), трет-бутилбромацетата (2,63 мл, 18,02 ммоль) и карбоната калия (2,50 г, 18,02 ммоль) в безводном ацетонитриле (80 мл) нагревали с обратным холодильником в течение 5 часов. Реакционную смесь затем охлаждали до к.т. и растворитель удаляли при пониженном давлении. Остаток растворяли в смеси 1:1 DCM и воды (100 мл:100 мл). Два слоя разделяли и органический слой промывали водой (2×100 мл). В конце органический слой сушили (Na2SO4) и концентрировали. Полученный остаток перемешивали с 50 мл гептана в течение 30 мин, охлаждали на ледяной бане и фильтровали, промывая твердое вещество холодным гептаном (10 мл). Это твердое вещество кремового цвета сушили при высоком вакууме с получением 5,6 г трет-бутил-2-(3-ацетил-5-бром-1H-индол-1-ил)ацетата.
Стадия 3: трет-бутил-2-(3-ацетил-5-(пиридазин-4-ил)-1Н-индол-1-ил)ацетат.
Смесь трет-бутил-2-(3-ацетил-5-бром-1Н-индол-1-ил)ацетата (351 мг, 1 экв.), 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридазина (250 мг, 1,5 экв), карбоната цезия (700 мг, 2 экв), DMF (15 мл) и воды (1,5 мл) продували аргоном в сосуде под давлением в течение 5 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (57 мг, 0,05 экв.) в атмосфере аргона и сосуд под давлением герметично закрывали и нагревали при 100°C в течение ночи. Реакционную смесь охлаждали до к.т. и растворитель удаляли при пониженном давлении. Сырой продукт использовали непосредственно в следующей стадии синтеза.
Стадия 4: 2-(3-Ацетил-5-(пиридазин-4-ил)-1H-индол-1-ил)уксусная кислота.
Взяли трет-Бутил-2-(3-ацетил-5-(пиридазин-4-ил)-1Н-индол-1-ил)ацетат (сырой из приведенной выше реакции) в 4н. HCl в диоксане (20 мл), и полученную реакционную смесь перемешивали при к.т. в течение 4 ч. Растворитель удаляли при пониженном давлении и оставшийся материал использовали непосредственно на следующей стадии синтеза.
Стадия 5: (2S,4R)-1-(2-(3-Ацетил-5-(пиридазин-4-ил)-1H-индол-1-ил)ацетил)-N-(2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)-4-фторпирролидин-2-карбоксамид (20).
2-(3-Ацетил-5-(пиридазин-4-ил)-1H-индол-1-ил)уксусную кислоту (100 мг, 1 экв.) растворяли B DMF (10 мл) и добавляли DIEA (0,269 мл, 5 экв.) с последующим добавлением гидрохлорид (2S,4R)-N-(3-хлор-(2S,4R)-N-(6-хлорпиридин-2-ил)-4-фторпирролидин-2-карбоксамида (111 мг, 1 экв.) при температуре 5°C. Затем при этой же температуре медленно добавляли HATU (263 мг, 2,1 экв.) и реакционную смесь перемешивали в течение 3 ч при к.т. Реакционную смесь затем добавляли к воде (50 мл + 10 г твердого NaCl) и экстрагировали с помощью DCM (2×25 мл). Органический слой последовательно промывали водным раствором NaHCO3 (20 мл), водой (20 мл) и солевым раствором (20 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (элюировали DCM/MeOH) с получением 20. 1Н ЯМР (400 МГц, DMSO-d6, 300 K): (главный ротамер) δ 2.13-2.30 (m, 1Н), 2.45 (s, 3Н), 2.58-2.68 (m, 1Н), 3.95-4.05 (m, 1Н), 4.13-4.22 (m, 1 Н), 4.75 (t, J=8 Гц, 1Н), 5.28 (d, J=20 Гц, 1Н), 5.45 (d, J=20 Гц, 1Н), 5.50-5.63 (m, 1Н), 7.06-7.10 (m, 1Н), 7.31-7.49 (m, 4Н), 7.51-7.61 (m, 1Н), 7.65-7.80 (m, 1H), 7.92-8.03 (m, 2Н), 8.35 (s, 1H), 8.61 (s 1Н), 9.23 (d, 1H), 9.61 (s, 1H), 9.97 (s, 1H); 19F ЯМР (376 МГц, DMSO-d6, 300 K): (главный ротамер) δ -126.74, -175.78. LC (метод A): tR=2.58 мин. LC/MS (EI) m/z: [М+Н]+ 614.
Схема 2
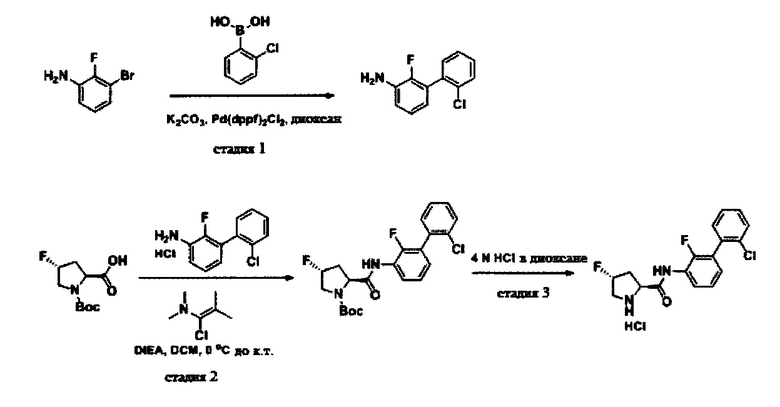
Стадия 1: Гидрохлорид 2'-Хлор-2-фтор-[1,1'-бифенил]-3-амина.
Смесь 3-бром-2-фторанилина (30 г), (2-хлорфенил)бороновой кислоты (60 г), K2CO3 (91 г) и Pd(dppf)2Cl2 (19,25 г) в растворителе (диоксан 400 мл, H2O 100 мл) продували аргоном в сосуде под давлением в течение 5 мин и перемешивали втечение 15 ч при 100°C. Растворитель удаляли при пониженном давлении и остающийся остаток очищали с помощью колоночной флэш-хроматографии. Очищенный материал затем растворяли в МеОН и обрабатывали HCl/МеОН. Растворитель удаляли, и оставшееся твердое вещество промывали IPA-гептанном (1/1) с получением указанного в заголовке соединения.
Стадия 2: (2S,4R)-трет-Бутил-2-((2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)карбамоил)-4-фторпирролидин-1-карбоксилат.
К охлажденному льдом раствору (2S',4R)-1-(трет-бутоксикарбонил)-4-фторпирролидин-2-карбоновой кислоты (530 мг) в DCM (20 мл) добавляли по каплям при перемешивании 1-хлор-N,N,2 триметил-1-пропениламин (0,333 мл, 1,1 экв.). Перемешивание продолжали в течение 3 ч при этой температуре, и затем добавляли твердый гидрохлорид 2'-хлор-2-фтор-[1,1'-бифенил]-3-амина (640 мг, 1,1 экв.) с последующим DIEA (1,12 мл, 3 экв.). Охлаждающую баню удаляли и реакционную смесь перемешивали в течение ночи при к.т. Реакционную смесь затем добавляли к воде (20 мл) и экстрагировали с помощью DCM (2×25 мл). Органический слой последовательно промывали водным раствором NaHCO3 (20 мл), водой (20 мл) и солевым раствором (20 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (элюировали гексанами/EtOAc) с получением (2S,4R)-трет-Бутил-2-((2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)карбамоил)-4-фторпирролидин-1-карбоксилата.
Стадия 3: Гидрохлорид (2S,4R)-N-(2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)-4-фторпирролидин-2-карбоксамида.
Взяли (2S,4R)-трет-бутил-2-((2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)карбамоил)-4-фторпирролидин-1-карбоксилат (700 мг) в 4н. HCl в диоксане (25 мл), и полученную реакционную смесь перемешивали при к.т. в течение 3 ч. Растворитель удаляли при пониженном давлении и оставшийся остаток использовали непосредственно на следующей стадии синтеза.
Схема 3
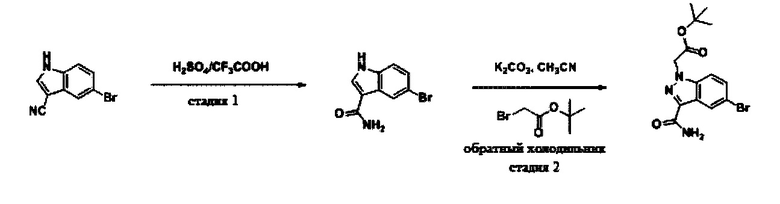
Стадия 1: 5-Бром-1H-индол-3-карбоксамид.
Смесь 5-бром-1Н-индол-3-карбонитрила (10 г) в TFA (160 мл) и серной кислоты (40 мл) перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь затем выливали в лед, и выпавшее в осадок твердое вещество собирали фильтрацией, промывали водой и сушили в вакууме с получением 5-бром-1Н-индол-3-карбоксамида.
Стадия 2: трет-Бутил-2-(5-бром-3-карбамоил-1H-индазол-1-ил) ацетат.
Смесь 5-бром-1Н-индол-3-карбоксамида (9,8 г, 41,66 ммоль), трет-бутилбромацетата (6,67 мл, 1,1 экв.) и карбоната калия (6,32 г, 1,1 экв.) в безводном ацетонитриле (100 мл) нагревали с обратным холодильником в течение 5 часов. Реакционную смесь затем охлаждали до к.т. и растворитель удаляли при пониженном давлении. Остаток растворяли в смеси DCM и воды. Два слоя разделяли и органический слой промывали водой, сушили (Na2SO4) и концентрировали. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (элюировали DCM/MeOH) с получением трет-бутил-2-(5-бром-3-карбамоил-1Н-индазол-1-ил)ацетата.
Схема 4

Стадия 1: трет-Бутил-2-(3-карбамоил-5-(1H-пиразол-4-ил)-1H-индазол-1-ил)ацетат.
Смесь трет-бутил-2-(5-бром-3-карбамоил-1H-индазол-1-ил)ацетата (211 мг, 1 экв.), 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола (140 мг), карбоната цезия (391 мг, 2 экв), DMF (10 мл) и воды (1,0 мл) продували аргоном в сосуде под давлением в течение 5 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (35 мг) в атмосфере аргона и сосуд под давлением герметично закрывали и нагревали при 100°C в течение ночи. Реакционную смесь охлаждали до к.т. и растворитель удаляли при пониженном давлении. Сырой продукт использовали непосредственно в следующей стадии синтеза.
Стадия 2: 2-(3-Карбамоил-5-(1H-пиразол-4-ил)-1H-индазол-1-ил)уксусная кислота.
Взяли трет-бутил-2-(3-карбамоил-5-(1H-пиразол-4-ил)-1H-индазол-1-ил)ацетат (сырой из приведенной выше реакции) в 4н. HCl в диоксане (5 мл) и полученную реакционную смесь перемешивали при к.т. в течение 4 ч. Растворитель удаляли при пониженном давлении и оставшийся материал использовали непосредственно на следующей стадии синтеза.
Стадия 3: 1-(2-((2S,4R)-2-((2'-Хлор-2-фтор-[1,1'-бифенил)карбамоил)-4-фторпирролидин-1-ил)-2-оксоэтил)-5-(1H-пиразол-4-ил)-1H-индазол-3-карбоксамид (1).
2-(3-Карбамоил-5-1H-(пиразол-4-ил)-1H-индазол-1-ил)уксусную кислоту (100 мг, 1 экв.) растворяли в DMF (10 мл) и добавляли DIEA (0,269 мл, 5 экв.) с последующим добавлением гидрохлорида (2S,4R)-N-(3-хлор-(2S,4R)-N-(6-хлорпиридин-2-ил)-4-фторпирролидин-2-карбоксамида (111 мг, 1 экв.) при температуре 5°C. Затем при этой же температуре медленно добавляли HATU (263 мг, 2,1 экв.) и реакционную смесь перемешивали в течение 3 ч при к.т. Реакционную смесь затем добавляли к воде (50 мл + 10 г твердого NaCl) и экстрагировали с помощью DCM (2×25 мл). Органический слой последовательно промывали водным раствором NaHCO3 (20 мл), водой (20 мл) и солевым раствором (20 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (элюировали DCM/MeOH) с получением 1. 1Н ЯМР (400 МГц, DMSO-d6, 300 K): (главный ротамер) δ 2.01-2.21 (m, 1Н), 2.49-2.55 (m, 1Н), 3.80-3.92 (m, 1Н), 4.08-4.21 (m, 1Н), 4.61 (t, 1H), 5.47-5.62 (m, ЗН), 7.05 (t, 1H), 7.15 (t, J=8.0 Гц, 1H), 7.31-7.40 (m, 4Н), 7.49-7.62 (m, 5Н), 7.77 (m, 1H), 8.21 (s, 1Н); 19F ЯМР (376 МГц, DMSO-d6, 300K): (главный ротамер) δ -126.75, -175.87. LC (метод A): tR=1.79 мин. LC/MS (EI) m/z: [М+Н]+ 604.
Схема 5

Стадия 1: трет-Бутил-2-(3-карбамоил-5-(пиримидин-5-ил)-1H-индазол-1-ил)ацетат.
Смесь трет-бутил-2-(5-бром-3-карбамоил-1H-индазол-1-ил)ацетата (211 мг), пиримидин-5-илбороновой кислоты (82 мг), карбоната цезия (391 мг, 2 экв), DMF (9 мл) и воды (1,0 мл) продували аргоном в сосуде под давлением в течение 5 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (40 мг) в атмосфере аргона и сосуд под давлением герметично закрывали и нагревали при 100°C в течение ночи. Реакционную смесь охлаждали до к.т. и растворитель удаляли при пониженном давлении. Сырой продукт использовали непосредственно в следующей стадии синтеза.
Стадия 2: 2-(3-Карбамоил-5-(пиримидин-5-ил)-1H-индазол-1-ил)уксусная кислота.
Взяли трет-бутил-2-(3-карбамоил-5-(пиримидин-5-ил)-1H-индазол-1-ил)ацетат (сырой из приведенной выше реакции) в 4н. HCl в диоксане (5 мл) и полученную реакционную смесь перемешивали при к.т. в течение 4 ч. Растворитель удаляли при пониженном давлении и оставшийся материал использовали непосредственно на следующей стадии синтеза.
Стадия 3: 1-(2-((2S,4R)-2-((2'-Хлор-2-фтор-[1,1'-бифенил)карбамоил)-4-фторпирролидин-1-ил)-2-оксоэтил)-5-(пиримидин-5-ил)-1H-индазол-3-карбоксамид (2).
2-(3-Карбамоил-5-(пиримидин-5-ил)-1H-индазол-1-ил)уксусную кислоту (45 мг, 1 экв.) с предыдущей стадии растворяли в DMF (10 мл) и добавляли DIEA (0,12 мл, 5 экв.) с последующим добавлением гидрохлорида (2S,4R)-N-(3-хлор-(2S,4R)-N-(6-хлорпиридин-2-ил)-4-фторпирролидин-2-карбоксамида (50 мг, 1 экв.) при 5°C. Затем при этой же температуре медленно добавляли HATU (118 мг, 2,1 экв.) и реакционную смесь перемешивали в течение 3 ч при к.т. Реакционную смесь затем добавляли к воде (25 мл + 5 г твердого NaCl) и экстрагировали с помощью DCM (2×15 мл). Органический слой последовательно промывали водным раствором NaHCO3 (10 мл), водой (10 мл) и солевым раствором (10 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (элюировали DCM/MeOH) с получением 2. 1Н ЯМР (400 МГц, DMSO-d6, 300 K): (главный ротамер) δ 2.11-2.29 (m, 1Н), 2.51-2.62 (m, 1Н), 3.89-4.08 (m, 1H), 4.18-4.30 (m, 1H), 4.76 (t, 1H), 5.48-5.76 (m, 3Н), 7.06 (t, 1H), 7.23 (t, J=8.0 Гц, 1Н), 7.37-7.48 (m, 4Н), 7.57 (m, 1H), 7.72-7.88 (m, 2Н), 7.86 (t, 1H), 8.47 (s, br, 1Н), 9.15 (s, 2Н), 9.21 (s, 1Н), 9.99 (s, 1H); 19F ЯМР (376 МГц, DMSO-d6, 300K): (главный) δ -126.69, -175.86. LC (метод A): tR=1.82 мин. LC/MS (EI) m/z: [M+H]+ 616.
Схема 6

Стадия 1: трет-Бутил-2-(3-карбамоил-5-(2-пирролидин-1-ил)пиримидин-5-ил)-1H-индазол-1-ил)ацетат.
Смесь трет-бутил-2-(5-бром-3-карбамоил-1H-индазол-1-ил)ацетата (316 мг), 2-(пирролидин-1-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиримидина (271 мг), карбоната цезия (350 мг, 2 экв), DMF (10 мл) и воды (1,5 мл) продували аргоном в сосуде под давлением в течение 5 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (57 мг) в атмосфере аргона и сосуд под давлением герметично закрывали и нагревали при 100°C в течение ночи. Реакционную смесь охлаждали до к.т. и растворитель удаляли при пониженном давлении. Сырой продукт использовали непосредственно на следующей стадии синтеза.
Стадия 2: 2-(3-Карбамоил-5-(2-пирролидин-1-ил)пиримидин-5-ил)-1H-индазол-1-ил)уксусная кислота.
Взяли трет-Бутил-2-(3-карбамоил-5-(2-пирролидин-1-ил)пиримидин-5-ил)-1Н-индазол-1-ил)ацетат (сырой из приведенной выше реакции) в 4н. HCl в диоксане (5 мл) и полученную реакционную смесь перемешивали при к.т. в течение 4 ч. Растворитель удаляли при пониженном давлении и оставшийся материал использовали непосредственно на следующей стадии синтеза.
Стадия 3: 1-(2-((2S,4R)-2-((2'-Хлор-2-фтор-[1,1'-бифенил)карбамоил)-4-фторпирролидин-1-ил)-2-оксоэтил)-5-(2-пирролидин-1-ил)-1H-индазол-3-карбоксамид (10).
2-(3-Карбамоил-5-(2-пирролидин-1-ил)пиримидин-5-ил)-1H-индазол-1-ил)уксусную кислоту (110 мг, 1 экв.) растворяли в DMF (10 мл) и добавляли DIEA (0,3 мл) с последующим добавлением гидрохлорида (2S,4R)-N-(3-хлор-(2S,4R)-N-(6-хлорпиридин-2-ил)-4-фторпирролидин-2-карбоксамида (110 мг, 1 экв.) при 5°C. Затем при этой же температуре медленно добавляли HATU (118 мг,) и реакционную смесь перемешивали в течение 3 ч при к.т. Реакционную смесь затем добавляли к воде (50 мл + 10 г твердого NaCl) и экстрагировали с помощью DCM (2×20 мл). Органический слой последовательно промывали водным раствором NaHCO3 (20 мл), водой (20 мл) и солевым раствором (20 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (элюировали DCM/MeOH) с получением 10. 1Н ЯМР (400 МГц, DMSO-d6, 300 K): (главный ротамер) δ 1.96 (m, 4Н), 2.07-2.25 (m, 1Н), 2.49-2.62 (m, 1Н), 3.53 (m, 4Н), 3.78-3.92 (m, 1Н), 4.18-4.27 (m, 1H), 4.66 (t, 1H), 5.45-5.51 (m, 1H), 5.58-5.69 (m, 2Н), 7.04 (t, 1Н), 7.21 (t, J=8.0 Гц, 1H), 7.32-7.48 (m, 4Н), 7.53-7.69 (m, 4Н), 7.95 (m, 1Н), 8.24 (s, 1H), 9.97 (s, 1Н); 19F ЯМР (376 МГц, DMSO-d6, 300К): (главный ротамер) δ -126.70, -175.88. LC (метод A): tR=2.33 мин. LC/MS (EI) m/z: [М+Н]+ 685.
Схема 7

Стадия 1: трет-Бутил-2-(3-карбамоил-5-(6-фторпиридин-3-ил)-1H-индазол-1-ил)ацетат.
Смесь трет-бутил-2-(5-бром-3-карбамоил-1H-индазол-1-ил)ацетата (211 мг), 6-фторпиридин-3-илбороновой кислоты (135 мг), карбоната цезия (350 мг, 2 экв.), DMF (9 мл) и воды (1,0 мл) продували аргоном в сосуде под давлением в течение 5 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (50 мг) в атмосфере аргона и сосуд под давлением герметично закрывали и нагревали при 100°C в течение ночи. Реакционную смесь охлаждали до к.т. и растворитель удаляли при пониженном давлении. Сырой продукт использовали непосредственно на следующей стадии синтеза.
Стадия 2: 2-(3-Карбамоил-5-(6-фторпиридин-3-ил)-1H-индазол-1-ил)уксусная кислота.
Взяли трет-бутил-2-(3-карбамоил-5-(6-фторпиридин-3-ил)-1Н-индазол-1-ил)ацетат (сырой из приведенной выше реакции) в 4н. HCl в диоксане (5 мл) и полученную реакционную смесь перемешивали при к.т. в течение 4 ч. Растворитель удаляли при пониженном давлении и оставшийся материал использовали непосредственно на следующей стадии синтеза.
Стадия 3: 1-(2-((2S,4R)-2-((2'-Хлор-2-фтор-[1,1'-бифенил)карбамоил)-4-фторпирролидин-1-ил)-2-оксоэтил)-5-(6-фторпиридин-3-ил)-1H-индазол-3-карбоксамид (12).
2-(3-Карбамоил-5-(6-фторпиридин-3-ил)-1H-индазол-1-ил)уксусную кислоту (110 мг, 1 экв.) растворяли в DMF (10 мл) и добавляли DIEA (0,3 мл) с последующим добавлением гидрохлорида (2S,4R)-N-(3-хлор-(2S,4R)-N-(6-хлорпиридин-2-ил)-4-фторпирролидин-2-карбоксамида (110 мг, 1 экв.) при 5°C. Затем при этой же температуре медленно добавляли HATU (118 мг,) и реакционную смесь перемешивали в течение 3 ч при к.т. Реакционную смесь затем добавляли к воде (50 мл + 10 г твердого NaCl) и экстрагировали с помощью DCM (2×20 мл). Органический слой последовательно промывали водным раствором NaHCO3 (20 мл), водой (20 мл) и солевым раствором (20 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (элюировали DCM/MeOH) с получением 12. 1Н ЯМР (400 МГц, DMSO-d6, 300 K): (главный ротамер) δ 2.10-2.32 (m, 1H), 2.49-2.65 (m, 1Н), 3.88-4.06 (m, 1H), 4.18-4.29 (m, 1Н), 4.73 (t, 1Н), 5.95-5.74 (m, 3Н), 7.05 (t, 1Н), 7.21 (t, J=8.0 Гц, 1H), 7.31-7.48 (m, 5Н), 7.46 (m, 1H), 8.27 (m, 1Н), 8.39 (s, 1H), 8.55 (s, 1H), 9.98 (s, 1H); 19F ЯМР (376 МГц, DMSO-d6, 300K): (главный ротамер) δ -125.25, -175.87. LC (метод A): tR=2.43 мин. LC/MS (EI) m/z: [M+H]+ 633.
Схема 8

Стадия 1: (1R,3S,5R)-трет-Бутил-3-((6-бромпиридин-2-ил)карбамоил)-2-азабицикло[3.1.0]гексан-2-карбоксилат.
К охлажденному льдом раствору (1R,3S,5R)-трет-бутоксикарбонил)-2-азабицикло[3.1.0]гексан-2-карбоновой кислоты (1,5 г) в DCM (20 мл) добавляли по каплям при перемешивании 1-хлор-N,N,2-триметил-1-пропениламин (998 мг, 1,1 экв.). Перемешивание продолжали в течение 3 ч при этой температуре и затем добавляли твердый 6-бромпиридин-2-амин (1,3 г, 1,1 экв.), а затем DIEA (3,34 мл, 3 экв.). Охлаждающую баню удаляли и реакционную смесь перемешивали в течение ночи при к.т. Реакционную смесь затем добавляли к воде (20 мл) и экстрагировали с помощью DCM (2×25 мл). Органический слой последовательно промывали водным раствором NaHCO3 (20 мл), водой (20 мл) и солевым раствором (20 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной флэш-хроматографии (элюировали гексанами/EtOAc) с получением (1R,3S,5R)-трет-бутил-3-((6-бромпиридин-2-ил)карбамоил)-2-азабицикло[3.1.0]гексан-2-карбоксилата.
Стадия 2: Гидрохлорид (1R,3S,5R)-N-(6-бромпиридин-2-ил)-2-азабицикло[3.1.0]гексан-3-карбоксамида.
Взяли (1R,3S,5R)-трет-бутил-3-((6-бромпиридин-2-ил)карбамоил)-2-азабицикло[3.1.0]гексан-2-карбоксилат (500 мг) в 4н. HCl в диоксане (25 мл) и полученную реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Растворитель удаляли при пониженном давлении и оставшийся остаток использовали непосредственно на следующей стадии синтеза.
Схема 9

Стадия 1: трет-Бутил-2-(3-карбамоил-5-(пиримидин-5-ил)-1H-индазол-1-ил)ацетат.
Смесь трет-бутил-2-(5-бром-3-карбамоил-1H-индазол-1-ил)ацетата (211 мг), пиримидин-5-илбороновой кислоты (135 мг), карбоната цезия (350 мг, 2 экв)., DMF (9 мл) и воды (1,0 мл) продували аргоном в сосуде под давлением в течение 5 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (50 мг) в атмосфере аргона и сосуд под давлением герметично закрывали и нагревали при 100°C в течение ночи. Реакционную смесь охлаждали до к.т. и растворитель удаляли при пониженном давлении. Сырой продукт использовали непосредственно на следующей стадии синтеза.
Стадия 2: 2-(3-Карбамоил-5-(пиримидин-5-ил)-1H-индазол-1-ил)уксусная кислота.
Взяли трет-бутил-2-(3-карбамоил-5-(пиримидин-5-ил)-1H-индазол-1-ил)ацетат (сырой из приведенной выше реакции) в 4н. HCl в диоксане (5 мл) и полученную в результате реакционную смесь перемешивали при к.т. в течение 4 ч. Растворитель удаляли при пониженном давлении и оставшийся материал использовали непосредственно на следующей стадии синтеза.
Стадия 3: 1-(2-((1R,3S,5R)-3-((6-Бромпиридин-2-ил)карбамоил)-2-азабицикло[3.1.0]гексан-2-ил-2-оксоэтил)5-(пиримидин-5-ил)-1H-индазол-3-карбоксамид (4).
2-(3-карбамоил-5-(пиримидин-5-ил)-1H-индазол-1-ил)уксусную кислоту (110 мг), полученную на предыдущей стадии, растворяли в DMF (20 мл) и добавляли DIEA (0,3 мл) с последующим добавлением гидрохлорида (1R,3S,5R)-N-(6-бромпиридин-2-ил)-2-азабицикло[3.1.0]гексан-3-карбоксамида (126 мг) при 5°C. Затем медленно добавляли HATU (350 мг) при этой же температуре и реакционную смесь перемешивали в течение 3 ч при к.т.Реакционную смесь затем добавляли к воде (50 мл + 10 г твердого NaCl) и экстрагировали с помощью DCM (2×20 мл). Органический слой последовательно промывали водным раствором NaHCO3 (20 мл), водой (20 мл) и солевым раствором (20 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (элюировали DCM/MeOH) с получением 4. 1Н ЯМР (400 МГц, DMSO-d6, 300 K): (главный ротамер) δ 0.75 (m, 1Н), 1.02 (m, 1Н), 1.85 (m, 1Н), 2.16-2.35 (m, 2Н), 3.80 (m, 1Н), 4.42 (m, 1Н), 5.54 (d, 1H), 5.86 (d, 1Н), 7.32 (t, 1H), 7.48 (br s, 1Н), 7.68-7.88 (m, 4Н), 8.03 (d, 1H), 8.46 (s, 1H), 9.23 (s, 2Н), 10.76 (s, 1Н); LC (метод A): tR=1.42 мин. LC/MS (EI) m/z: [М+Н]+ 561.
Схема 10

Стадия 1: трет-Бутил-2-(3-карбамоил-5-(2-пирролвдин-1-ил)пиримидин-5-ил)-1H-индазол-1-ил)ацетат.
Смесь трет-бутил-2-(5-бром-3-карбамоил-1H-индазол-1-ил)ацетата (316 мг), 2-(пирролидин-1-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиримидина (271 мг), карбоната цезия (350 мг), DMF (10 мл) и воды (1,5 мл) продували аргоном в сосуде под давлением в течение 5 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (57 мг) в атмосфере аргона и сосуд под давлением герметично закрывали и нагревали при 100°C в течение ночи. Реакционную смесь охлаждали до к.т. и растворитель удаляли при пониженном давлении. Сырой продукт использовали непосредственно на следующей стадии синтеза.
Стадия 2: 2-(3-Карбамоил-5-(2-пирролидин-1-ил)пиримидин-5-ил)-1H-индазол-1-ил)уксусная кислота.
Взяли трет-Бутил-2-(3-карбамоил-5-(2-пирролидин-1-ил)пиримидин-5-ил)-1Н-индазол-1-ил)ацетат (сырой из приведенной выше реакции) в 4н. HCl в диоксане (5 мл) и полученную реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Растворитель удаляли при пониженном давлении и оставшийся материал использовали непосредственно на следующей стадии синтеза.
Стадия 3: 1-(2-((1R,3S,5R)-3-((6-Бромпиридин-2-ил)карбамоил)-2-азабицикло[3.1.0]гексан-2-ил-2-оксоэтил)5-((2-пирролидин-1-ил)пиримидин-5-ил)-1H-индазол-3-карбоксамид (11).
2-(3-Карбамоил-5-(2-пирролидин-1-ил)пиримидин-5-ил)-1H-индазол-1-ил)уксусную кислоту (131 мг), полученную на предыдущей стадии, растворяли в DMF (20 мл) и добавляли DIEA (0,25 мл) с последующим добавлением гидрохлорида (1R,3S,5R)-N-(6-бромпиридин-2-ил)-2-азабицикло[3.1.0]гексан-3-карбоксамида (110 мг) при 5°C. Затем медленно добавляли HATU (240 мг) при этой же температуре и реакционную смесь перемешивали в течение 3 ч при к.т. Реакционную смесь затем добавляли к воде (50 мл + 10 г твердого NaCl) и экстрагировали с помощью DCM (2×20 мл). Органический слой последовательно промывали водным раствором NaHCO3 (20 мл), водой (20 мл) и солевым раствором (20 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (элюировали DCM/MeOH) с получением 11. 1Н ЯМР (400 МГц, DMSO-d6, 300 K): (главный ротамер) δ 0.74 (m, 1Н), 1.01 (m, 1Н), 1.25 (m, 1H), 1.86-1.98 (m, 5Н), 2.13-2.38 (m, 2Н), 3.56 (m, 4Н), 3.80 (m, 1Н), 4.42 (m, 1H), 5.51 (d, 1Н), 5.82 (d, 1H), 7.19 (d, J=6.8 Гц, 1Н), 7.40 (br s, 1Н), 7.64-7.72 (m, 4Н), 8.01 (d, 1Н), 8.27 (s, 1H), 8.66 (s, 2Н), 10.75 (s, 1Н); LC (метод A): tR=1.82 мин. LC/MS (EI) m/z: [М+Н]+ 630.
Схема 11
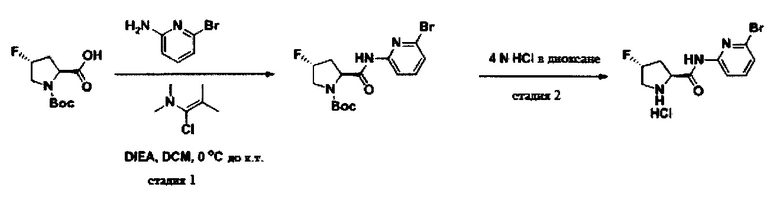
Стадия 1: (2S,4R)-1-трет-Бутил-2-((6-бромпиридин-2-ил)карбамоил)-4-фторпирролидин-1-карбоксилат.
К охлажденному льдом раствору (2S,4R)-1-трет-бутоксикарбонил)-4-фторпирролидин-2-карбоновой кислоты (1,59 г) в DCM (20 мл) добавляли по каплям при перемешивании 1-хлор-N,N,2-триметил-1-пропениламин (998 мг, 1,1 экв.). Перемешивание продолжали в течение 3 ч при этой температуре и затем добавляли твердый 6-бромпиридин-2-амин (1,3 г, 1,1 экв.), а затем DIEA (3,34 мл, 3 экв.). Охлаждающую баню удаляли и реакционную смесь перемешивали в течение ночи при к.т. Реакционную смесь затем добавляли к воде (20 мл) и экстрагировали с помощью DCM (2×25 мл). Органический слой последовательно промывали водным раствором NaHCO3 (20 мл), водой (20 мл) и солевым раствором (20 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной флэш-хроматографии (элюировали гексанами/EtOAc) с получением (2S,4R)-трет-Бутил-2-((6-бромпиридин-2-ил)карбамоил)-4-фторпирролидин-1-карбоксилата.
Стадия 2: Гидрохлорид (2S,4R)-N-(6-Бромпиридин-2-ил)-4-фторпирролидин-2-карбоксамида.
Взяли (2S,4R)-1-трет-Бутил-2-((6-бромпиридин-2-ил)карбамоил)-4-фторпирролидин-1-карбоксилат (1,5 г) в 4н. HCl в диоксане (25 мл) и полученную реакционную смесь перемешивали при к.т. в течение 3 ч. Растворитель удаляли при пониженном давлении и оставшийся остаток использовали непосредственно на следующей стадии синтеза.
Схема 12

Стадия 1: трет-Бутил-2-(3-карбамоил-5-(4-морфолинофенил)-1H-индазол-1-ил)ацетат.
Смесь трет-бутил-2-(5-бром-3-карбамоил-1H-индазол-1-ил)ацетата (316 мг), (4-морфолинофенил)бороновой кислоты (224 мг), карбоната цезия (585 мг, 2 экв), DMF (20 мл) и воды (2 мл) продували аргоном в сосуде под давлением в течение 5 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (45 мг) в атмосфере аргона и сосуд под давлением герметично закрывали и нагревали при 100°C в течение ночи. Реакционную смесь охлаждали до к.т. и растворитель удаляли при пониженном давлении. Сырой продукт использовали непосредственно на следующей стадии синтеза.
Стадия 2: 2-(3-Карбамоил-5-(4-морфолинофенил)-1H-индазол-1-ил)уксусная кислота.
Взяли трет-бутил-2-(3-карбамоил-5-(4-морфолинофенил)-1H-индазол-1-ил)ацетат (сырой из приведенной выше реакции) в 4н. HCl в диоксане (5 мл) и полученную реакционную смесь перемешивали при к.т. в течение 4 ч. Растворитель удаляли при пониженном давлении и оставшийся материал использовали непосредственно на следующей стадии синтеза.
Стадия 3: 1-(2-((2S,4R)-2-((6-Бромпиридин-2-ил)карбамоил)-4-фторпирролидин-1-ил)-2-оксоэтил)-5-(4-морфолинофенил)-1H-индазол-3-карбоксамид (3).
2-(3-Карбамоил-5-(4-морфолинофенил)-1H-индазол-1-ил)уксусную кислоту (177 мг, 1 экв.) с предыдущей стадии растворяли в DMF (10 мл) и добавляли DIEA (0,25 мл) с последующим добавлением гидрохлорида (2S,4R)-N-(6-бромпиридин-2-ил)-4-фторпирролидин-2-карбоксамида (118 мг, 1 экв.) при 5°C. Затем медленно добавляли HATU (248 мг) при этой же температуре и реакционную смесь перемешивали в течение 3 ч при к.т. Реакционную смесь затем добавляли к воде (50 мл + 10 г твердого NaCl) и экстрагировали с помощью DCM (2×20 мл). Органический слой последовательно промывали водным раствором NaHCO3 (20 мл), водой (20 мл) и солевым раствором (20 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (элюировали DCM/MeOH) с получением 3. 1Н ЯМР (400 МГц, DMSO-d6, 300 K): (главный ротамер) δ 2.07-2.22 (m, 1Н), 2.49-2.61 (m, 1H), 3.12-3.18 (m, 4Н), 3.73-3.78 (m, 4Н), 3.86-4.09 (m, 1Н), 4.13-4.25 (m, 1H), 4.66 (t, J=8.4 Гц, 1Н), 5.42-5.48 (m, 1Н), 5.58-5.70 (m, 2Н), 7.04 (t, J=6.4 Гц, 1Н), 7.31 (t, J=8.0 Гц, 1H), 7.35-7.52 (m, 1Н), 7.50-7.58 (d, J=8.4 Гц, 2Н), 7.63-7.75 (m, 4Н), 8.02 (d, J=8 Гц, 1H), 8.32 (s, 1Н), 10.99 (s, 1Н); 19F ЯМР (376 МГц, DMSO-d6, 300K): (главный) δ -175.70. LC (метод А): tR=1.82 мин. LC/MS (EI) m/z: [М+Н]+ 650.
Схема 13

Стадия 1: (1R,3S,5R)-трет-Бутил-3-((2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)карбамоил)-2-азабицикло [3.1.0] гексан-2-карбоксилат.
К охлажденному льдом раствору (1R,3S,5R)-трет-бутоксикарбонил)-2-азабицикло[3.1.0]гексан-2-карбоновой кислоты (1,13 г) в DCM (20 мл) добавляли по каплям при перемешивании 1-хлор-N,N,2-триметил-1-пропениламин (731 мг, 1,1 экв.). Перемешивание продолжали в течение 3 ч при этой температуре и затем добавляли твердый гидрохлорид 2'-хлор-2-фтор-[1,1'-бифенил]-3-амина (1,3 г, 1 экв.) с последующим добавлением DIEA (2,45 мл). Охлаждающую баню удаляли и реакционную смесь перемешивали в течение ночи при к.т. Реакционную смесь затем добавляли к воде (20 мл) и экстрагировали с помощью DCM (2×25 мл). Органический слой последовательно промывали водным раствором NaHCO3 (20 мл), водой (20 мл) и солевым раствором (20 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (элюировали гексанами/EtOAc) с получением (1R,3S,5R)-трет-Бутил-3-((2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)карбамоил)-2-азабицикло[3.1.0]гексан-2-карбоксилата.
Стадия 2: Гидрохлорид (1R,3S,5R)-N-(2'-Хлор-2-фтор-[1,1'-бифенил]-3-ил)-2-азабицикло[3.1.0]гексан-3-карбоксамида.
Взяли (1R,3S,5R)-трет-бутил-3-((2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)карбамоил)2-азабицикло[3.1.0]гексан-2-карбоксилат (700 мг) в 4н. HCl в диоксане (25 мл) и полученную реакционную смесь перемешивали при к.т. в течение 3 ч. Растворитель удаляли при пониженном давлении и оставшийся остаток использовали непосредственно на следующей стадии синтеза.
Схема 14

Стадия 1: трет-Бутил-2-(3-карбамоил-5-(пиримидин-5-ил)-1H-индазол-1-ил)ацетат.
Смесь трет-бутил-2-(5-бром-3-карбамоил-1H-индазол-1-ил)ацетата (211 мг), пиримидин-5-илбороновой кислоты (82 мг), карбоната цезия (391 мг, 2 экв.), DMF (9 мл) и воды (1,0 мл) продували аргоном в сосуде под давлением в течение 5 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (40 мг) в атмосфере аргона и сосуд под давлением герметично закрывали и нагревали при 100°C в течение ночи. Реакционную смесь охлаждали до к.т. и растворитель удаляли при пониженном давлении. Сырой продукт использовали непосредственно на следующей стадии синтеза.
Стадия 2: 2-(3-Карбамоил-5-(пиримидин-5-ил)-1H-индазол-1-ил)уксусная кислота.
Взяли трет-бутил-2-(3-карбамоил-5-(пиримидин-5-ил)-1H-индазол-1-ил)ацетат (сырой из приведенной выше реакции) в 4н. HCl в диоксане (5 мл) и полученную в результате реакционную смесь перемешивали при к.т. в течение 4 ч. Растворитель удаляли при пониженном давлении и оставшийся материал использовали непосредственно на следующей стадии синтеза.
Стадия 3: 1-(2-((1R,3S,5R)-3-((2'-Хлор-2-фтор-[1,1'-бифенил]-3-ил)карбамоил)-азабицикло[3.1.0]гексан-2-ил)-2-оксоэтил)-5-(пиримидин-5-ил)-1H-индазол-3-карбоксамид (6).
2-(3-Карбамоил-5-(пиримидин-5-ил)-1H-индазол-1-ил)уксусную кислоту (131 мг, 1 экв.) с предыдущей стадии растворяли в DMF (10 мл) и добавляли DIEA (0,33 мл, 5 экв.) с последующим добавлением гидрохлорида (1R,3S,5R)-N-(2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)2-азабицикло[3.1.0]гексан-3-карбоксамида (131 мг, 1 экв.) при 5°C. Затем медленно добавляли HATU (350 мг, 2,1 экв.) при этой же температуре и реакционную смесь перемешивали в течение 3 ч при к.т. Реакционную смесь затем добавляли к воде (25 мл + 5 г твердого NaCl) и экстрагировали с помощью DCM (2×15 мл). Органический слой промывали последовательно водным раствором NaHCO3 (10 мл), водой (10 мл) и солевым раствором (10 мл), затем высушивали над Na2SO4 и концентрировали при пониженном давлении. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (элюировали DCM/MeOH) с получением 6. 1Н ЯМР (400 МГц, DMSO-d6, 300 K): (главный ротамер) δ 0.73 (m, 1H), 1.07 (m, 1H), 1.26 (m, 1Н), 1.90 (m, 1H), 2.28-2.35 (m, 2Н), 3.78-3.83 (m, 1H), 4.54 (m, 1Н), 5.52 (d, 1H), 5.84 (d, 1Н), 7.07 (t, J=6.4 Гц, 1H), 7.27 (t, J=8.0 Гц, 1Н), 7.35-7.58 (m, 4Н), 7.55 (d, 1H), 7.72-7.84 (m, 4Н), 8.47(s, 1Н), 9.72 (s, 1Н); 19F ЯМР (376 МГц, DMSO-d6, 300K): (главный) δ -126.54. LC (метод A): tR=1.96 мин. LC/MS (EI) m/z: [М+Н]+ 610.
Схема 15
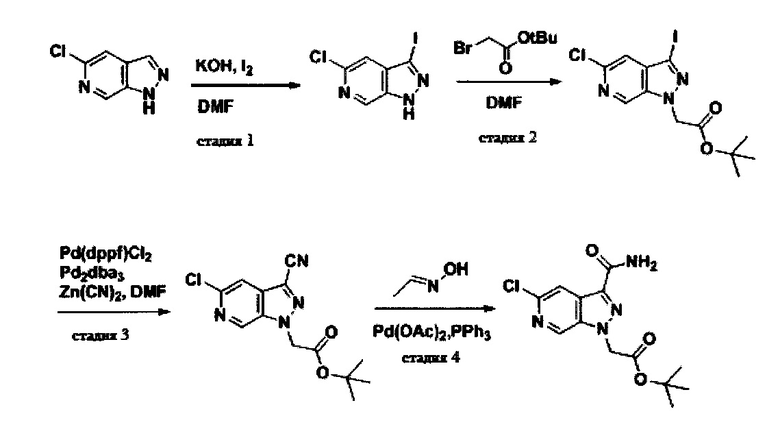
Стадия-1: 5-Хлор-3-йод-1Н-пиразоло[3,4]пиридин.
К раствору 5-хлор-1Н-пиразоло[3,4-с]пиридина (15 г, 1 экв.) в DMF (150 мл) добавляли йод (37,2 г, 1,5 экв.) и гидроксид калия (13,7 г, 2,5 экв.) при 0°C. Реакционную смесь перемешивали при к.т. в течение 12 ч, а затем разбавляли 10%-ным водным раствором тиосульфата натрия (250 мл) и экстрагировали EtOAc. Объединенные органические экстракты промывали солевым раствором и затем сушили. Полученное твердое вещество (15 г) суспендировали с МТВЕ, фильтровали и сушили.
Стадия-2: трет-Бутил-2-(5-хлор-3-йод-1Н-пиразоло[3,4]пиридин-1-ил)ацетат.
К смеси 5-хлор-3-йод-1Н-пиразоло[3,4]пиридина (14 г, 1 экв.) и карбоната калия (8,3 г, 1,2 экв.) в DMF (140 мл) добавляли по каплям трет-бутилбромацетат (8,9 мл, 1,2 экв.) при к.т. и полученную смесь перемешивали при 50°C в течение 3 ч. Реакционную смесь затем выливали в воду и экстрагировали EtOAc; объединенные органические экстракты концентрировали при пониженном давлении. Полученный материал брали на следующей стадии без дополнительной очистки.
Стадия-3: трет-Бутил-2-(5-хлор-3-циано-1Н-пиразоло[3,4-с]пиридин-1-ил)ацетат.
Смесь трет-бутил-2-(5-хлор-3-йод-1Н-пиразоло[3,4]пиридин-1-ил)ацетата (12,5 г, 1 экв.), Zn(CN)2 (4,5 г, 1,2 экв.), Pd(dppf)Cl2 (2,6 г, 0,1 экв.), Pd2(dba)3 (2,9 г, 0,1 экв.), воды (25 мл) и DMF (125 мл) перемешивали при 100°C в течение 5 ч в атмосфере азота. Реакционную смесь разбавляли EtOAc и затем последовательно промывали водой, насыщенным водным NaHCO3 и солевым раствором. Объединенный органический слой концентрировали при пониженном давлении. Сырой остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/EtOAc) с получением указанного в заголовке соединения.
Стадия-4: трет-Бутил-2-(3-карбамоил-5-хлор-1Н-пиразоло[3,4-с]пиридин-1-ил)ацетат.
Смесь трет-бутил-2-(5-хлор-3-циано-1Н-пиразоло[3,4-с]пиридин-1-ил)ацетата (5,7 г, 1 экв.), ацетальдоксима (2,3 г, 2 экв.), Pd(OAc)2 (0,22 г, 0,05 экв.) и PPh3 (0,54 г, 0,1 экв.) в водном этаноле (143 мл, H2O/EtOH (29 мл/114 мл) нагревали до 90°C с в течение 3 ч в атмосфере азота. Реакционную смесь фильтровали через Целит и растворитель удаляли при пониженном давлении. Сырой остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/EtOAc) с получением указанного в заголовке соединения (3,5 г).
Схема 16
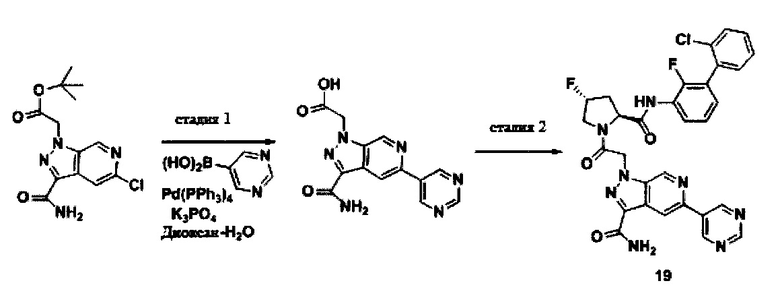
Стадия 1: 2-(3-Карбамоил-5-(пиримидин-5-ил)-1Н-пиразоло[3,4-с]пиридин-1-ил)уксусная кислота.
Смесь трет-бутил-2-(3-карбамоил-5-хлор-1Н-пиразоло[3,4-с]пиридин-1-ил)ацетата (311 мг, 1 ммоль), пиримидин-5-илбороновой кислоты (248 мг, 2 ммоль), K3PO4 (634 мг, 3 ммоль), диоксана (9 мл) и воды (1 мл) дегазировали и пополняли аргоном три раза. К этой смеси добавляли Pd(PPh3)4 (58 мг, 0,05 ммоль) в атмосфере аргона и реакционную смесь нагревали на масляной бане при 85°C в течение ночи. Добавляли к раствору дополнительный Pd(PPh3)4 (58 мг, 0,05 ммоль) и реакционную смесь выдерживали при 85°C в течение дополнительных 24 ч. Реакционную смесь охлаждали до к.т. и летучие вещества удаляли при пониженном давлении. Остающийся остаток подкисляли 10%-ной водной лимонной кислотой (10 мл) и экстрагировали этилацетатом (20 мл). Отбрасывали органический слой и упаривали водную фазу досуха. Оставшееся твердое вещество загружали на слой силикагеля и промывали метанолом. Раствор метанола концентрировали и выпаривали совместно с толуолом. Полученное твердое вещество сушили при высоком вакууме и использовали на следующей стадии без дополнительной очистки.
Стадия 2: 1-(2-((2S,4R)-2-((2'-Хлор-2-фтор-[1,1'-бифенил]-3-ил)карбамоил)-4-фторпирролидин-1-ил)-2-оксоэтил)-5-(пиримидин-5-ил)-1Н-пиразоло[3,4-с]пиридин-3-карбоксамид (19)
К смеси 2-(3-карбамоил-5-(пиримидин-5-ил)-1Н-пиразоло [3,4-с] пиридин-1-ил)уксусной кислоты (77 мг, 0,26 ммоль), HATU (120 мг, 0,32 ммоль, 1,2 экв.), гидрохлорида (2S,4R)-N-(2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)-4-фторпирролидин-2-карбоксамида (96 мг, 0,26 ммоль) и DMF (2,5 мл) добавляли DIEA (0,15 мл, 0,86 ммоль) при к.т.Реакционную смесь перемешивали в течение 30 мин при к.т. и затем удаляли летучие вещества при пониженном давлении. Остающийся остаток подвергали препаративной ВЭЖХ с получением 40,9 мг указанного в заголовке продукта. 1Н ЯМР (400 МГц, DMSO-d6, 300 K): (главный ротамер) δ 2.17-2.25 (m, 1Н), 2.49-2.57 (m, 1Н), 3.86-3.99 (m, 1H), 4.13-4.22 (m, 1Н), 4.73 (t, J=8.4 Гц, 1H), 5.57-5.61 (m, 1Н), 5.65-5.84 (m, 2Н), 6.99 (t, J=6.4 Гц, 1H), 7.14 (t, J=8.0 Гц, 1Н), 7.28-7.42 (m, 4Н), 7.50-7.58 (m, 1Н), 7.83-7.92 (m, 2Н), 8.58 (s, 1H), 9.15 (s, 1Н), 9.23 (s, 1Н), 9.38 (s, 2Н), 9.95 (s, 1Н); 19F ЯМР (376 МГц, DMSO-d6, 300K): (главный ротамер) δ -126.77, -175.85. LC (метод A): tR=2.47 мин. LC/MS (EI)m/z: [М+Н]+ 617.
Схема 17

Стадия 1: трет-Бутил-2-(3-ацетил-5-(2-метоксипиримидин-5-ил)-1Н-индол-1-ил)ацетат.
Смесь трет-бутил-2-(3-ацетил-5-бром-1H-индол-1-ил)ацетата (351 мг, 1 экв.), (2-метоксипиримидин-5-ил)бороновой кислоты (230 мг, 1,5 экв.), карбоната цезия (650 мг, 2 экв.), DMF (15 мл) и воды (1,5 мл) продували аргоном в сосуде под давлением в течение 5 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (57 мг, 0,05 экв.) в атмосфере аргона и сосуд под давлением герметично закрывали и нагревали при 100°C в течение ночи. Реакционную смесь охлаждали до к.т. и растворитель удаляли при пониженном давлении. Сырой продукт использовали непосредственно на следующей стадии синтеза.
Стадия 2: 2-(3-Ацетил-5-(2-метоксипиримидин-5-ил)-1Н-индол-1-ил)уксусная кислота.
Взяли Сырой трет-бутил-2-(3-ацетил-5-(2-метоксипиримидин-5-ил)-1Н-индол-1-ил)ацетат (сверху) в 4н. HCl в диоксане (20 мл) и полученную реакционную смесь перемешивали при к.т. в течение 4 ч. Растворитель удаляли при пониженном давлении и оставшийся материал использовали непосредственно на следующей стадии синтеза.
Стадия 3: (2S,4R)-1-(2-(3-Ацетил-5-(2-метоксипиримидин-5-ил)-1Н-индол-1-ил)ацетил)-N-(2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)-4-фторпирролидин-2-карбоксамид (27).
2-(3-Ацетил-5-(2-метоксипиримидин-5-ил)-1Н-индол-1-ил)уксусную кислоту (100 мг, 1 экв.) с предыдущей стадии растворяли в DMF (10 мл) и добавляли в DIEA (0,269 мл, 5 экв.) с последующим добавлением гидрохлорида (2S,4R)-N-(3-хлор-(2S,4R)-N-(6-хлорпиридин-2-ил)-4-фторпирролидин-2-карбоксамида (111 мг, 1 экв.) при 5°C. Затем медленно добавляли HATU (263 мг, 2,1 экв.) при этой же температуре и реакционную смесь перемешивали в течение 3 ч при к.т. Реакционную смесь затем добавляли к воде (50 мл + 10 г NaCl) и экстрагировали с помощью DCM (2×25 мл). Органический слой последовательно промывали водным раствором NaHCO3 (20 мл), водой (20 мл) и солевым раствором (20 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (элюировали DCM/MeOH) с получением 27. 1Н ЯМР (400 МГц, DMSO-d6, 300 K): (главный ротамер) δ 2.13-2.3 (m, 1Н), 2.45 (s, 3Н), 2.68-2.70 (m, 1Н), 3.95-4.05 (m, 4Н), 4.16-4.24 (m, 1 Н), 4.78 (t, J=8 Гц, 1Н), 5.28 (d, J=20 Гц, 1Н), 5.45 (d, J=20 Гц, 1Н), 5.50-5.63 (m, 1H), 7.04-7.08 (m, 1H), 7.20-7.24 (m, 1H), 7.37-7.61 (m, 7Н), 7.75-7.78 (m, 1H), 7.94-7.98 (m, 1H), 8.31 (s, 1H), 8.88 (s 1Н), 8.97 (s 1H); 19F ЯМР (376 МГц, DMSO-d6, 300 K): (главный ротамер) δ -126.64, -175.79. LC (метод A): tR=2.16 мин. LC/MS (EI) m/z: [М+Н]+ 644.
Схема 18: Синтез (2S,4R)-1-(2-(3-ацетил-5-(4-ацетилпиперазин-1-ил)-1Н-индол-1-ил)ацетил)-N-(2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)-4-фторпирролидин-2-карбоксамида (16)
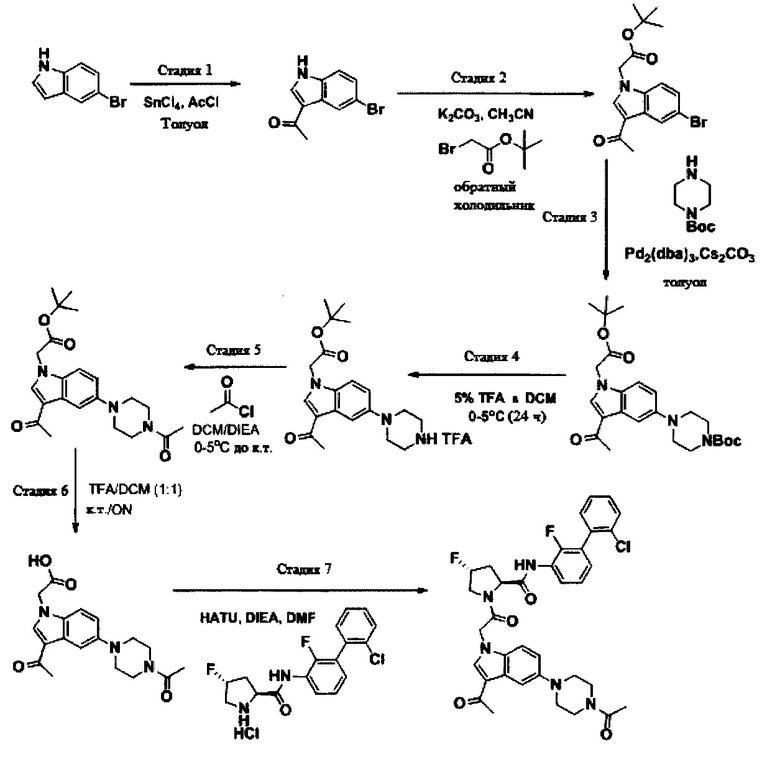
Стадия 1: 1-(5-Бром-1Н-индол-3-ил)этанон
1-(5-Бром-1H-индол-3-ил)этанон получали из 5-броминдола в соответствии с процедурой, описанной MacKay et al. (MacKay, J.A.; Bishop, R.; Rawal, V.H. Org. Lett. 2005, 7, 3421-3424.)
Стадия 2: трет-Бутил-2-(3-ацетил-5-бром-1Н-индол-1-ил)ацетат
Смесь 1-(5-бром-1Н-индол-3-ил)этанона (3,9 г, 16,4 ммоль), трет-бутилбромацетата (2,63 мл (18,02 ммоль) и карбоната калия (2,50 г, 18,02 ммоль) в безводном ацетонитриле (80 мл) нагревали с обратным холодильником в течение 5 ч. Реакционную смесь затем охлаждали до к.т. и растворитель удаляли при пониженном давлении. Остаток растворяли в смеси 1:1 ДХМ и воды (100 мл:100 мл). Два слоя разделяли и органический слой промывали водой (2×100 мл). В конце органический слой сушили (Na2SO4) и концентрировали. Полученный остаток перемешивали с 50 мл гептана в течение 30 мин, охлаждали на ледяной бане и отфильтрованный твердый остаток, промывали холодным гептаном (10 мл). Твердый остаток сушили при высоком вакууме с получением трет-бутил-2-(3-ацетил-5-бром-1H-индол-1-ил)ацетата (5,6 г).
Стадия 3: трет-Бутил-4-(3-ацетил-1-(2-(трет-бутокси)-2-оксоэтил)-1Н-индол-5-ил)пиперазин-1-карбоксилат
Смесь трет-бутил-2-(3-ацетил-5-бром-1H-индол-1-ил)ацетата (379 мг), трет-бутилпиперазин-1-карбоксилата (223 мг, 1,2 экв.), карбоната цезия (489 мг, 1,4 экв.), (S)-(-)-2,2-бис(бифенилфосфино)-1,1-бинафтила (40 мг) и толуола (8 мл) продували аргоном в течение 5 мин. Затем добавляли трис(дибензилиденацетон)дипалладий(0) (40 мг) в атмосфере аргона и реакционную смесь нагревали при 100°C в течение ночи. Реакционную смесь охлаждали до к.т. и растворитель удаляли при пониженном давлении. Сырой продукт очищали с помощью колоночной хроматографии (градиент EtOAc в гексанах) с получением трет-бутил-4-(3-ацетил-1-(2-(трет-бутокси)-2-оксоэтил)-1Н-индол-5-ил)пиперазин-1-карбоксилата (89 мг).
Стадия 4: TFA соль трет-бутил-2-(3-ацетил-5-(пиперазин-1-ил)-1Н-индол-1-ил)ацетата
трет-Бутил-4-(3-ацетил-1-(2-(трет-бутокси)-оксоэтил-1H-индол-5-ил)пиперазин-1-карбоксилат (65 мг) растворяли в 5% TFA (0,5 мл) в ДХМ (10 мл) при 0-5°C и полученную реакционную смесь перемешивали при 0-5°C в течение 24 ч. Растворитель затем удаляли при пониженном давлении и оставшийся материал использовали непосредственно на следующей стадии синтеза.
Стадия 5: трет-Бутил-2-(3-ацетил-5-(4-ацетилпиперазин-1-ил)-1Н-индол-1-ил)ацетат
TFА соль трет-бутил-2-(3-ацетил-5-(пиперазин-1-ил)-1Н-индол-1-ил)ацетата с Стадияа 4 растворяли в ДХМ (4 мл) и добавляли DIEA (0,14 мл, избыток) с последующим добавлением AcCl (0,02 мл, 1 экв.) при 0-5°C. После перемешивания в течение 10 мин реакционную смесь разбавляли EtOAc (10 мл) и водой (4 мл). Слой EtOAc отделяли, промывали солевым раствором (15 мл), сушили (Na2SO4) и упаривали досуха при пониженном давлении. Остальной материал использовали непосредственно на следующей стадии.
Стадия 6: 2-(3-Ацетил-5-(4-ацетилпиперазин-1-ил)-1Н-индол-1-ил)уксусная кислота
трет-Бутил-2-(3-ацетил-5-(4-ацетилпиперазин-1-ил)-1Н-индол-1-ил)ацетат с предыдущей стадии растворяли в ДХМ (5 мл) и добавляли TFA (1 мл). Реакционную смесь перемешивали в течение ночи при к.т. Затем растворитель удаляли при пониженном давлении и оставшийся материал использовали непосредственно на следующей стадии синтеза.
Стадия 7: (2S,4R)-1-(2-(3-Ацетил-5-(4-ацетилпиперазин-1-ил)-1Н-индол-1-ил)ацетил)-N-(2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)-4-фторпирролидин-2-карбоксамид
К раствору 2-(3-ацетил-5-(4-ацетилпиперазин-1-ил)-1Н-индол-1-ил)уксусной кислоты с Стадия 6 в ДМФ (5 мл) добавляли DIEA (0,13 мл, 3 экв) и затем гидрохлорид (2S,4R)-N-(3-хлор-(2S,4R)-N-(6-хлорпиридин-2-ил)-4-фторпирролидин-2-карбоксамида (108 мг, 1,1 экв.), Затем медленно добавляли HATU (120 мг, 1,2 экв.) и реакционную смесь перемешивали в течение 18 ч при к.т. Реакционную смесь затем добавляли к воде (10 мл) и экстрагировали с помощью EtOAc (2×15 мл). Органический слой последовательно промывали водным раствором NaHCO3 (10 мл), водой (10 мл) и солевым раствором (10 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Остающийся остаток очищали с помощью колоночной флэш-хроматографии (элюировали ДХМ/CH3OH) с получением указанного в заголовке соединения. 1Н ЯМР (400 МГц, ДМСО-d6, 300 K): (главный ротамер) δ 2.18 (s, 3Н), 2.24-2.41 (m, 1H), 2.50 (s, 3Н), 2.64-2.78 (m, 1Н), 3.08-3.19 (m, 4Н), 3.69-3.80 (m, 4Н), 3.91-4.09 (m, 1Н), 4.16-4.27 (m, 1 Н), 4.78 (t, J=8 Гц, 1Н), 5.16 (d, J=17 Гц, 1Н), 5.26 (d, J=17 Гц, 1Н), 5.45-5.61 (m, 1Н), 7.04-7.08 (m, 1Н), 7.18-7.25 (m, 1H), 7.38-7.47 (m, 4Н), 7.51-7.56 (m, 1H), 7.86-7.90 (s, 1Н), 7.93-7.98 (m, 1H), 8.12 (s, 1Н); 19F ЯМР (376 МГц, ДМСО-d6, 300 K): (главный ротамер) δ -128.56, -178.51. LC (метод A): tR=2.30 мин. LC/MS (EI) m/z: [М+Н]+ 664.
Схема 19: (2S,4R)-1-(2-(3-ацетил-5-(4-метилсульфонилпиперазин-1-ил)-1Н-индол-1-ил)ацетил)-N-(2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)-4-фторпирролидин-2-карбоксамида (33)

Стадия 1: трет-Бутил-2-(3-ацетил-5-(4-(метилсульфонил)пиперазин-1-ил)-1Н-индол-1-ил)ацетат
TFА соль трет-бутил-2-(3-ацетил-5-(пиперазин-1-ил)-1Н-индол-1-ил)ацетата (90 мг) растворяли в ДХМ (4 мл). К этому раствору добавляли DIEA (0,14 мл) с последующим добавлением метилсульфонилхлорида (0,06 мл) при 0-5°C. После перемешивания в течение 10 мин реакционную смесь разбавляли EtOAc (10 мл) и водой (4 мл). Отделенный органический слой промывали солевым раствором (15 мл), сушили (Na2SO4) и упаривали досуха при пониженном давлении. Остальной материал использовали непосредственно на следующей стадии.
Стадия 2: 2-(3-Ацетил-5-(4-(метилсульфонил)пиперазин-1-ил)-1Н-индол-1-ил)уксусная кислота
трет-Бутил-2-(3-ацетил-5-(4-(метилсульфонил)пиперазин-1-ил)-1Н-индол-1-ил)ацетат растворяли в ДХМ (5 мл) и добавляли TFA (1 мл). Реакционную смесь перемешивали в течение ночи при к.т. и затем удаляли растворитель при пониженном давлении. Остальной материал использовали непосредственно на следующей стадии.
Стадия 3: (2S,4R)-1-(2-(3-Ацетил-5-(4-(метилсульфонил)пиперазин-1-ил)-1Н-индол-1-ил)ацетил)-N-(2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)-4-фторпирролидин-2-карбоксамид
К раствору 2-(3-ацетил-5-(4-(метилсульфонил)пиперазин-1-ил)-1Н-индол-1-ил)уксусной кислоты DMF (5 мл) добавляли DIEA (0,17 мл, 4 экв.), а затем гидрохлорид (2S,4R)-N-(3-хлор-(2S,4R)-N-(6-хлорпиридин-2-ил)-4-фторпирролидин-2-карбоксамида (102 мг, 1,1 экв.). Затем медленно добавляли HATU (120 мг, 1,2 экв.) и реакционную смесь перемешивали в течение 18 ч при к.т. Реакционную смесь затем добавляли к воде (10 мл) и экстрагировали с помощью EtOAc (2×15 мл). Органический слой последовательно промывали водным раствором NaHCO3 (10 мл), водой (10 мл) и солевым раствором (10 мл), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали с помощью ВЭЖХ с получением указанного в заголовке соединения. 1Н ЯМР (400 МГц, ДМСО-d6, 300 K): (главный ротамер) δ 2.18 (s, 3Н), 2.27-2.42 (m, 1Н), 2.50 (s, 3Н), 2.67-2.80 (m, 1H), 2.98 (s, 3Н), 3.52 (m, 8Н), 3.95-4.29 (m, 2Н), 4.78 (t, J=8 Гц, 1H), 5.21 (d, J=18 Гц, 1Н), 5.35 (d, J=18 Гц, 1H), 5.42-5.63 (m, 1Н), 7.04-7.08 (m, 1H), 7.14-7.20 (m, 1H), 7.22-7.29 (m, 1H), 7.30-7.42 (m, 3Н), 7.43-7.51 (m, 3Н), 7.93-7.96 (m, 1H), 8.15 (s, 1Н); 19F ЯМР (376 МГц, ДMCO-d6, 300 K): (главный ротамер) δ -128.49, -178.41. LC (способ A): tR=2.09 мин. LC/MS (EI) m/z: [М+Н] 698.
Схема 20: Синтез (2S,4R)-1-(2-(3-ацетил-5-(1-ацетил-1,2,3,6-тетрагидропиридин-4-ил)-1Н-индол-1-ил)ацетил)-N-(2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)-4-фторпирролидин-2-карбоксамида (28)


Стадия 1: трет-Бутил-2-(3-ацетил-5-(1-ацетил-1,2,3,6-тетрагидропиридин-4-ил)-1Н-индол-1-ил)ацетат
Смесь трет-бутил-2-(3-ацетил-5-бром-1H-индол-1-ил)ацетата (113 мг, 0,32 ммоль), 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2Н)-ил)этанона (80 мг, 0,32 ммоль), карбоната цезия (209 мг, 0,64 ммоль) и ДМФ (10 мл) продували аргоном в сосуде под давлением в течение 5 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (18 мг, 0,016 ммоль) в атмосфере аргона и сосуд под давлением герметично закрывали и нагревали при 90°C в течение ночи. Реакционную смесь охлаждали до к.т. и растворитель удаляли при пониженном давлении. Оставшийся сырой продукт использовали непосредственно на следующей стадии синтеза.
Стадия 2: 2-(3-Ацетил-5-(1-ацетил-1,2,3,6-тетрагидропиридин-4-ил)-1Н-индол-1-ил)уксусная кислота
Взяли трет-бутил-2-(3-ацетил-5-(1-ацетил-1,2,3,6-тетрагидропиридин-4-ил)-1Н-индол-1-ил)ацетат в 4н. HCl в диоксане (10 мл) и полученную реакционную смесь перемешивали при к.т. в течение 4 ч. Растворитель затем удаляли при пониженном давлении, а оставшийся материал использовали непосредственно на следующей стадии синтеза.
Стадия 3: (2S,4R)-1-(2-(3-Ацетил-5-(1-ацетил-1,2,3,6-тетрагидропиридин-4-ил)-1Н-индол-1-ил)ацетил)-N-(2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)-4-фторпирролидин-2-карбоксамид
Указанное в заголовке соединение получали из 2-(3-ацетил-5-(1-ацетил-1,2,3,6-тетрагидропиридин-4-ил)-1Н-индол-1-ил)уксусной кислоты (100 мг, 0,29 ммоль) и гидрохлорида (2S,4R)-N-(3-хлор-(2S,4R)-N-(6-хлорпиридин-2-ил)-4-фторпирролидин-2-карбоксамида (110 мг, 0,29 ммоль) способом, подобным описанному выше для (2S,4R)-1-(2-(3-ацетил-5-(4-ацетилпиперазин-1-ил)-1Н-индол-1-ил)ацетил)-N-(2'-хлор-2-фтор-[1,1'-бифенил]-3-ил)-4-фторпирролидин-2-карбоксамида. 1Н ЯМР (400 МГц, ДМСО-d6, 300 K): (главный ротамер) δ 2.05-2.07 (s, 3Н), δ 2.31-2.38 (m, 1Н), 2.50 (s, 3Н), 2.50-2.70 (m, 3Н), 3.73-3.79 (m, 2Н), 4.01-4.31 (m, 4Н), 4.85 (t, J=8.4 Гц, 1Н), 5.28-5.50 (m, 2Н), 5.64 (d, J=52.8 Гц, 1Н), 6.18 (s, 1H), 7.16 (t, J=6.8 Гц, 1H), 7.31 (t, J=7.6 Гц, 1Н),7.41-7.68 (m, 6Н), 8.04 (t, J=7.6 Гц, 1Н), 8.30 (d, J=8 Гц, 1Н), 8.35 (s, 1Н), 10.05 (s, 1Н); 19F ЯМР (376 МГц, ДМСО-d6, 300 K): (главный ротамер) δ -126.64, -175.81. LC (метод A): tR=2.07 мин. LC/MS (EI) m/z: [М+Н]+ 659.
Пример 6. Неограничивающие Примеры Соединений Формулы i
В таблице 1 представлены иллюстративные соединения Формулы I с характеристическими данными. Анализ Примера 7 использовали для определения IC50 соединений. Также доступны другие стандартные анализы ингибирования фактора D. Три *** используются для обозначения соединений с IC50 менее чем 1 микромолярный; две ** указывают на соединение с IC50 между 1 микромолярный и 10 микромолярный, и одна * обозначает соединения с IC50 более чем 10 микромолярный.




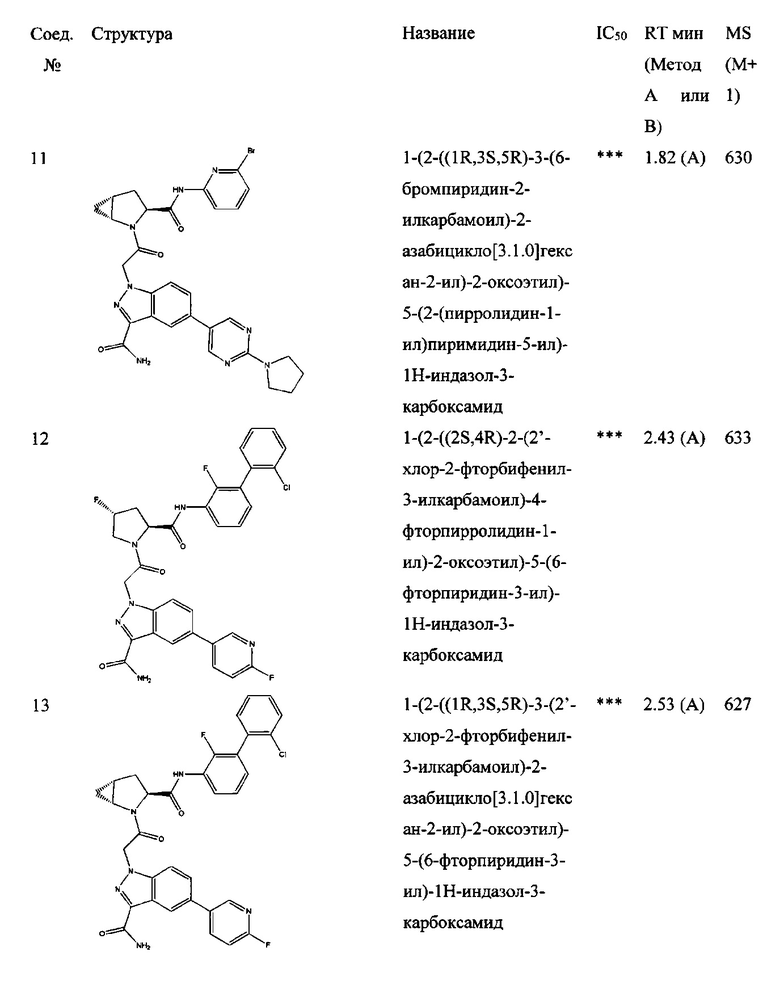



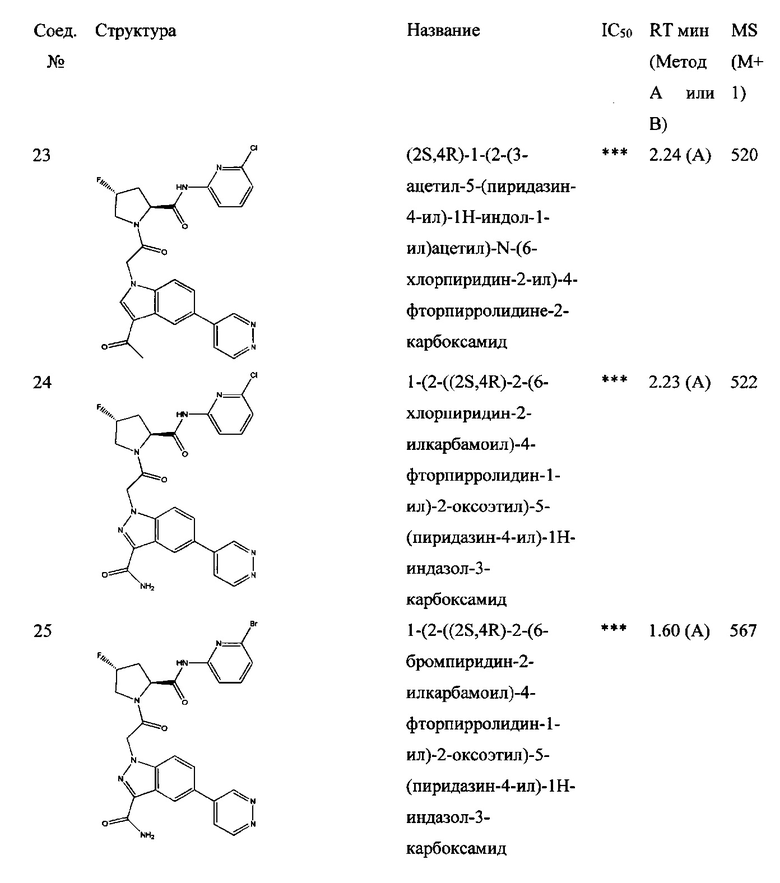


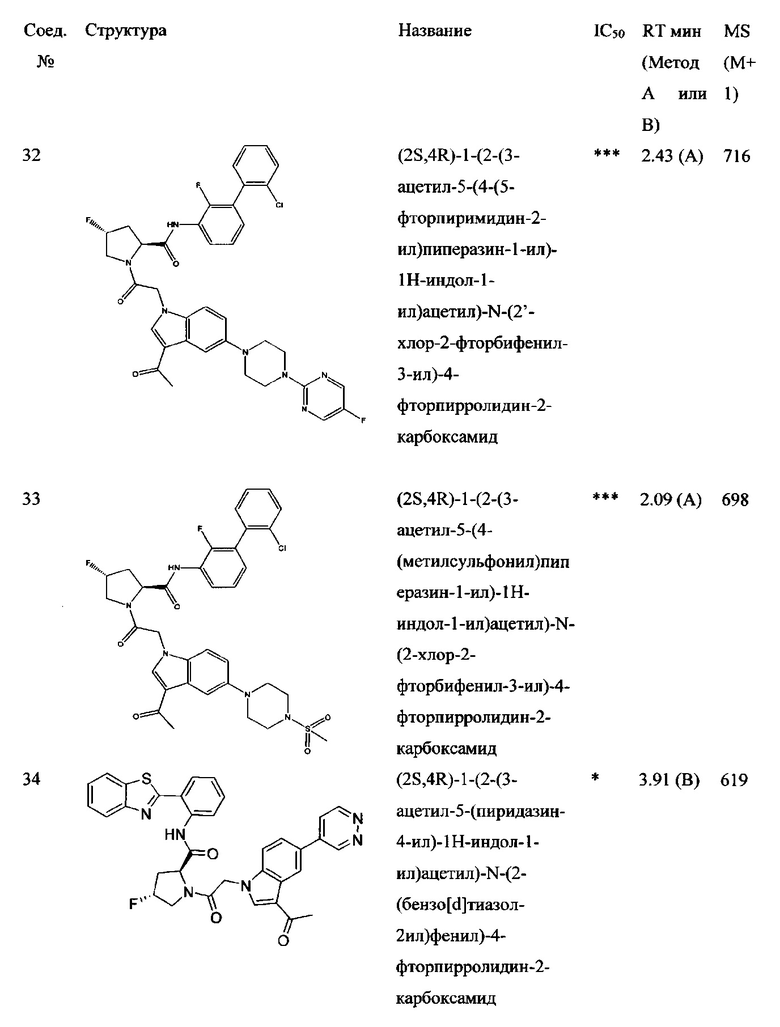

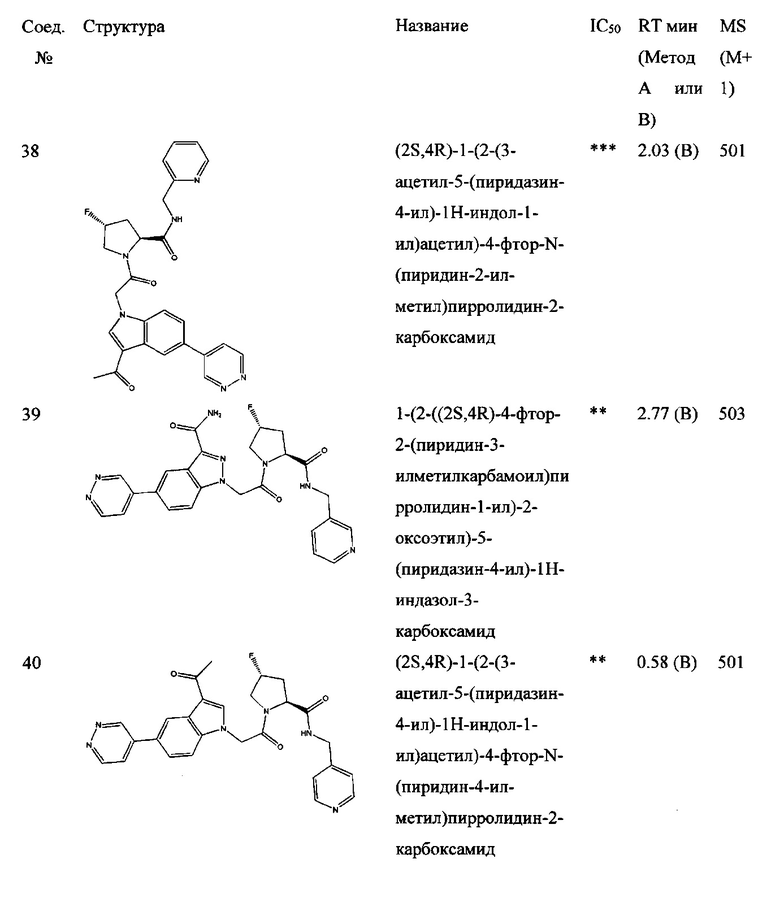

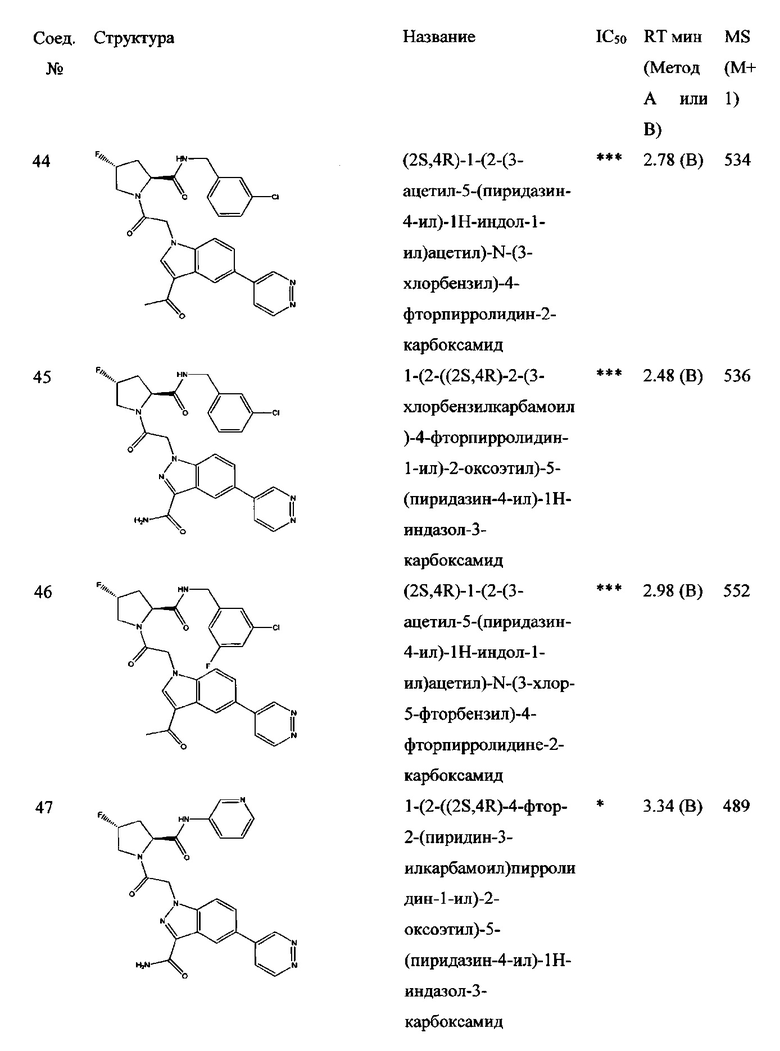







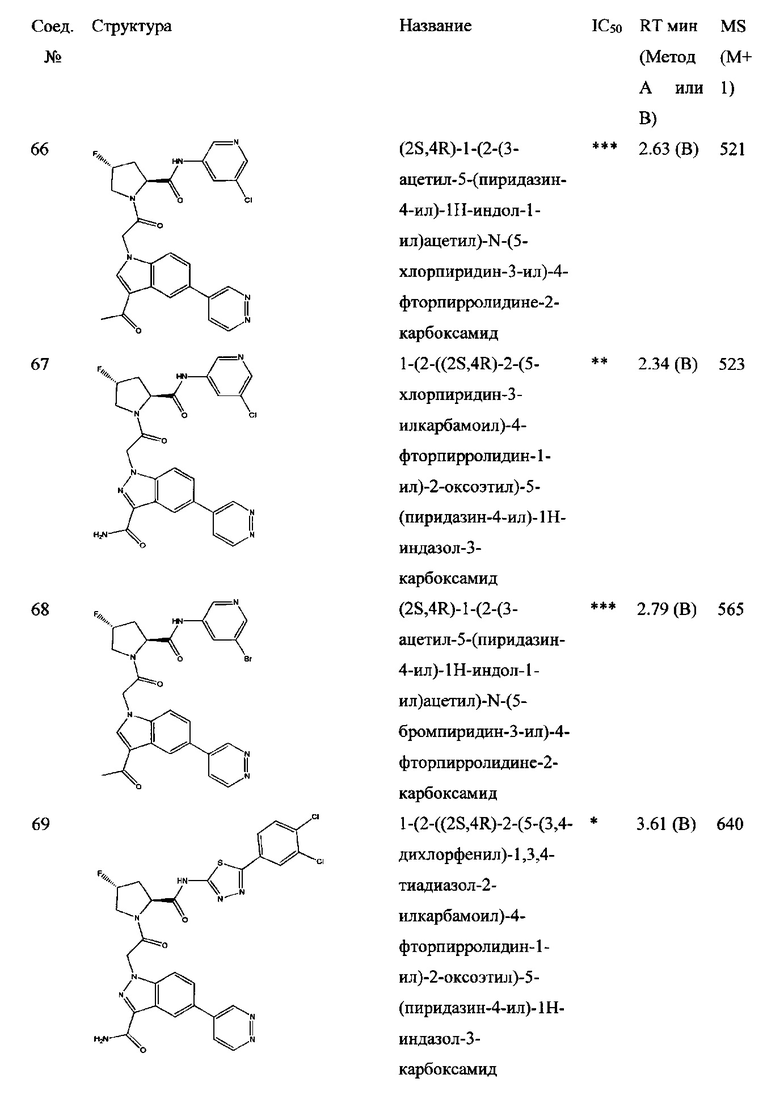
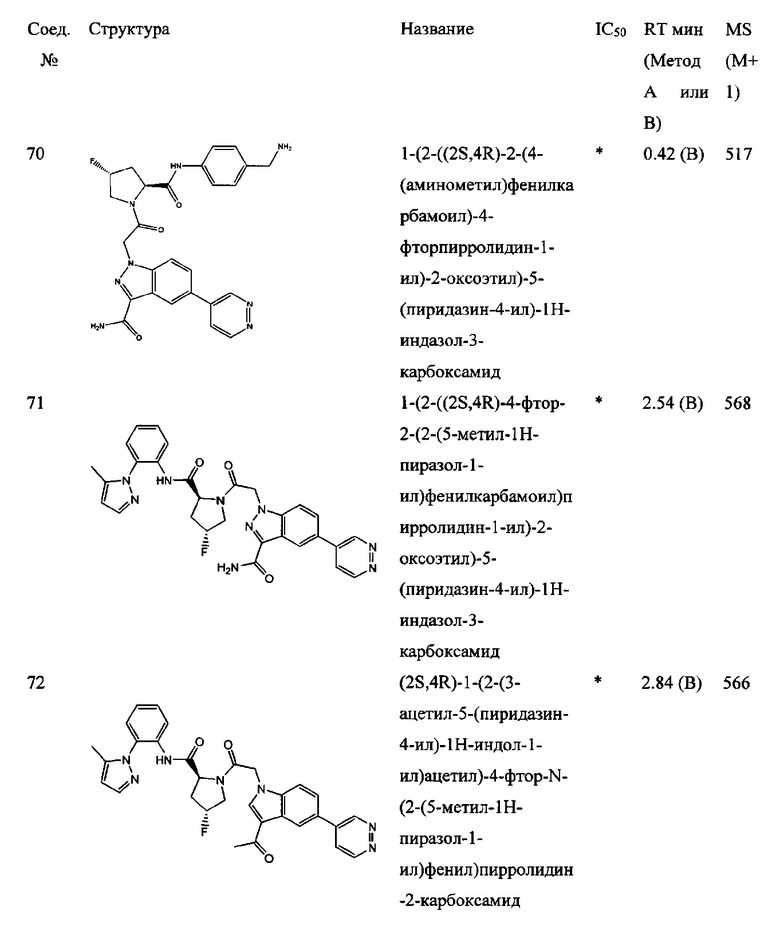


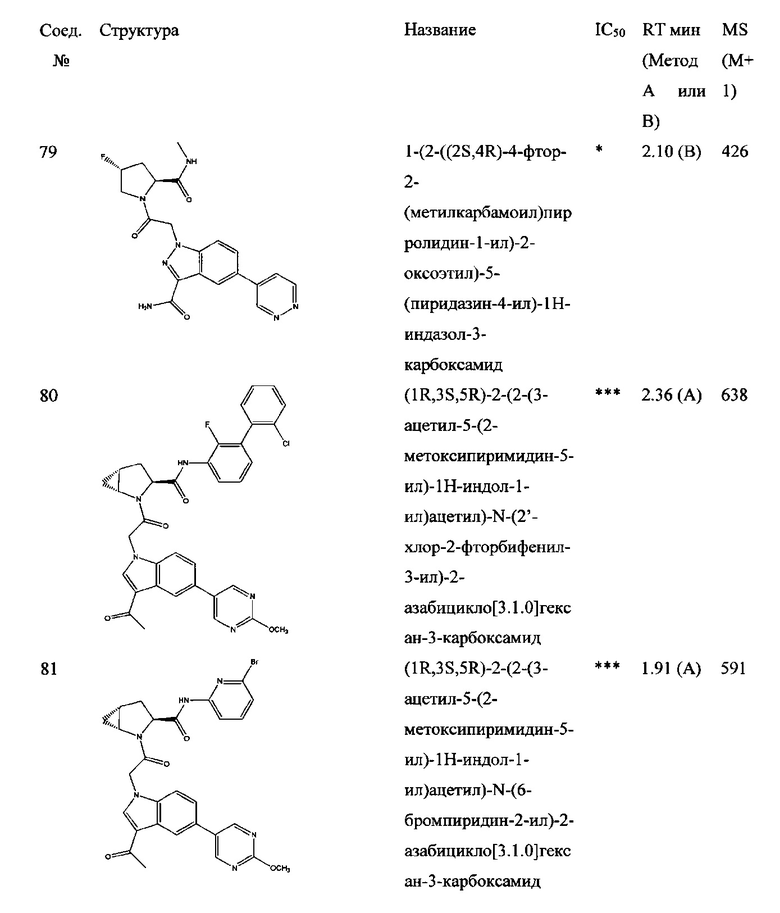
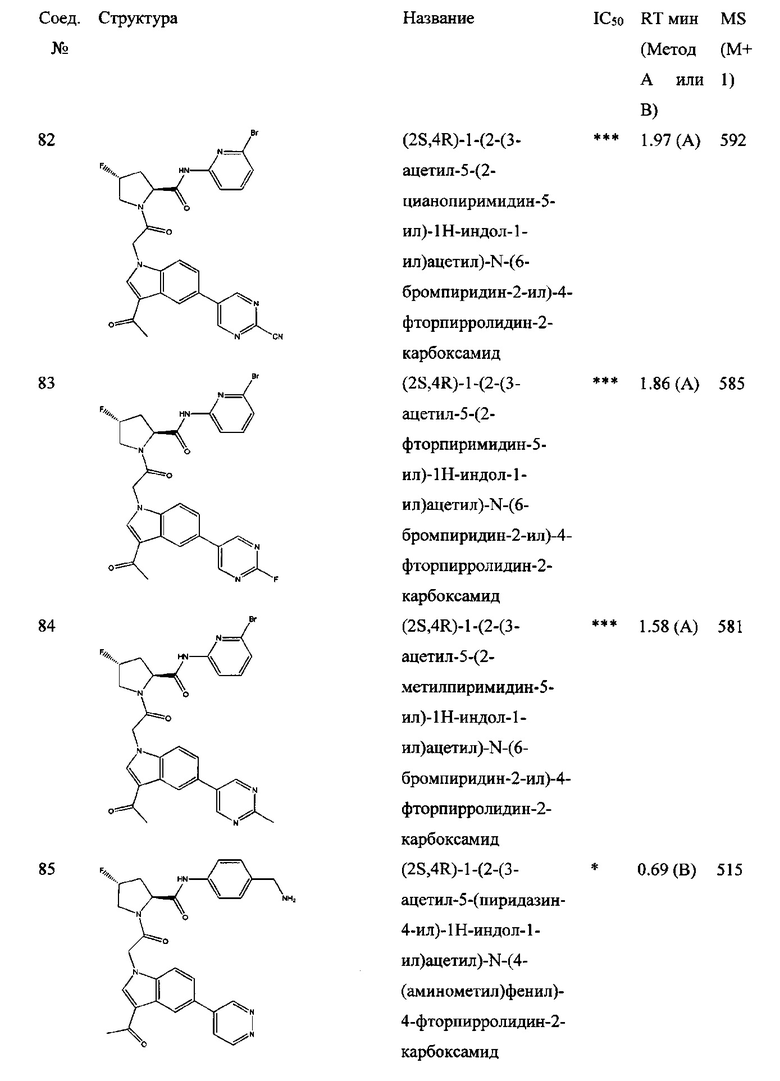
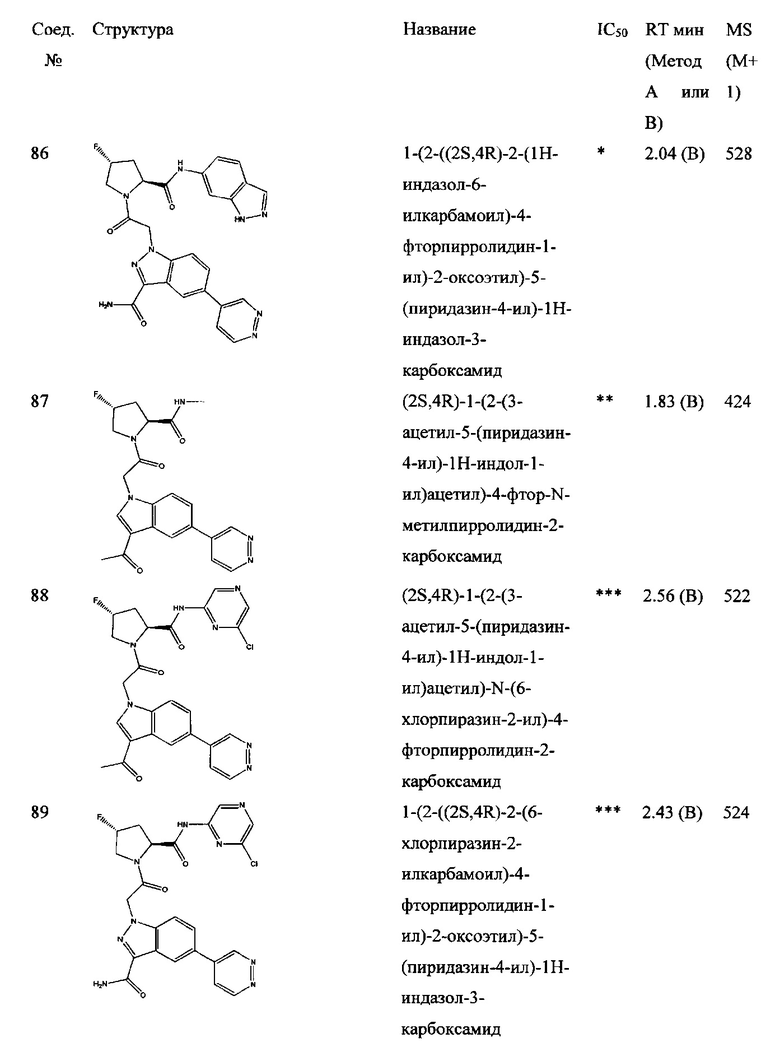




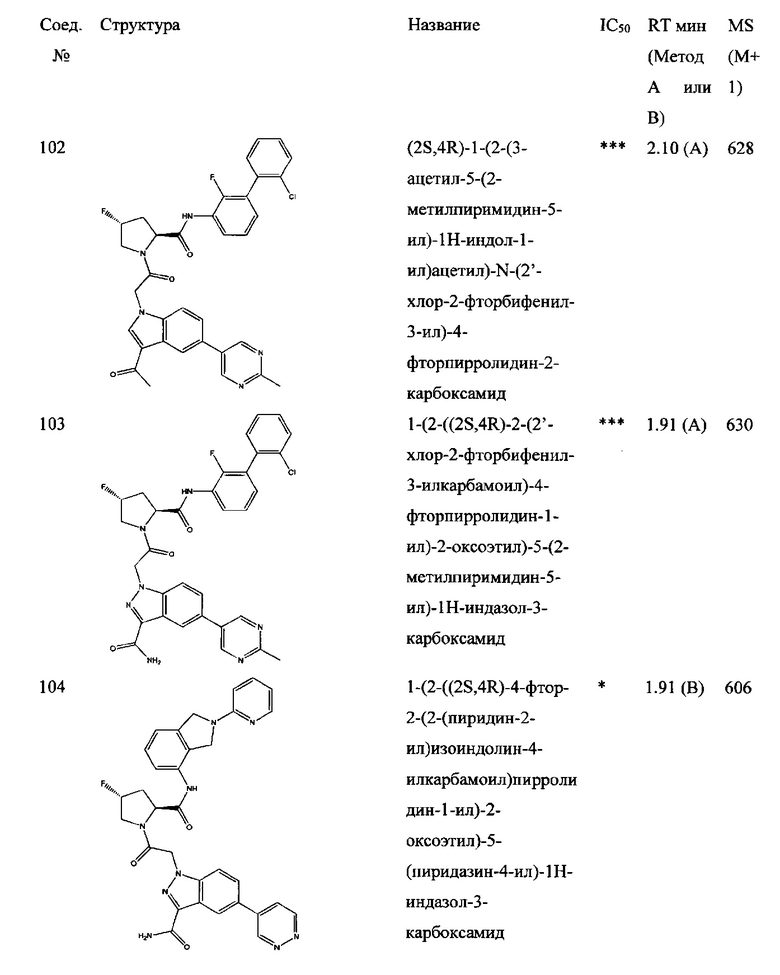

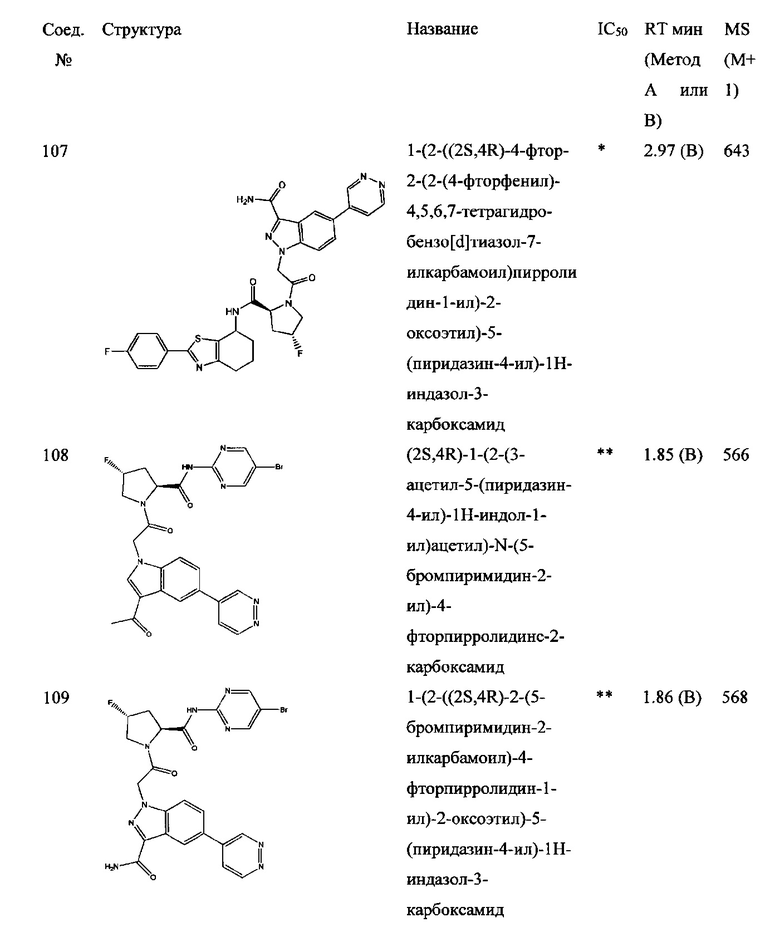



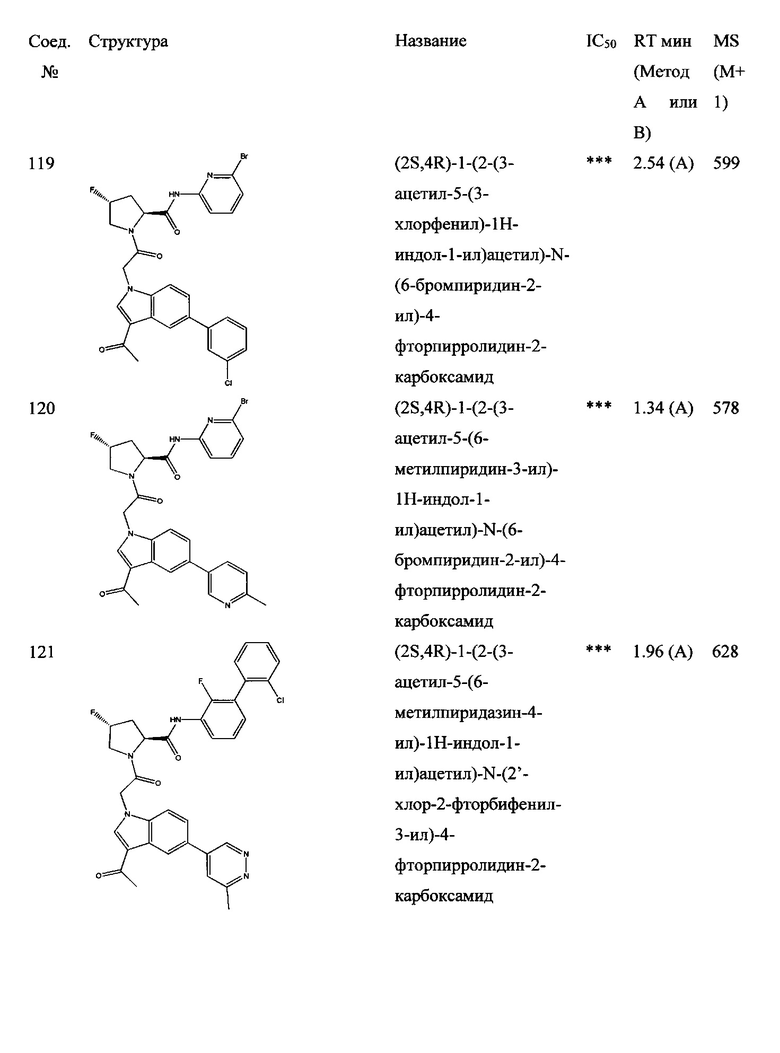
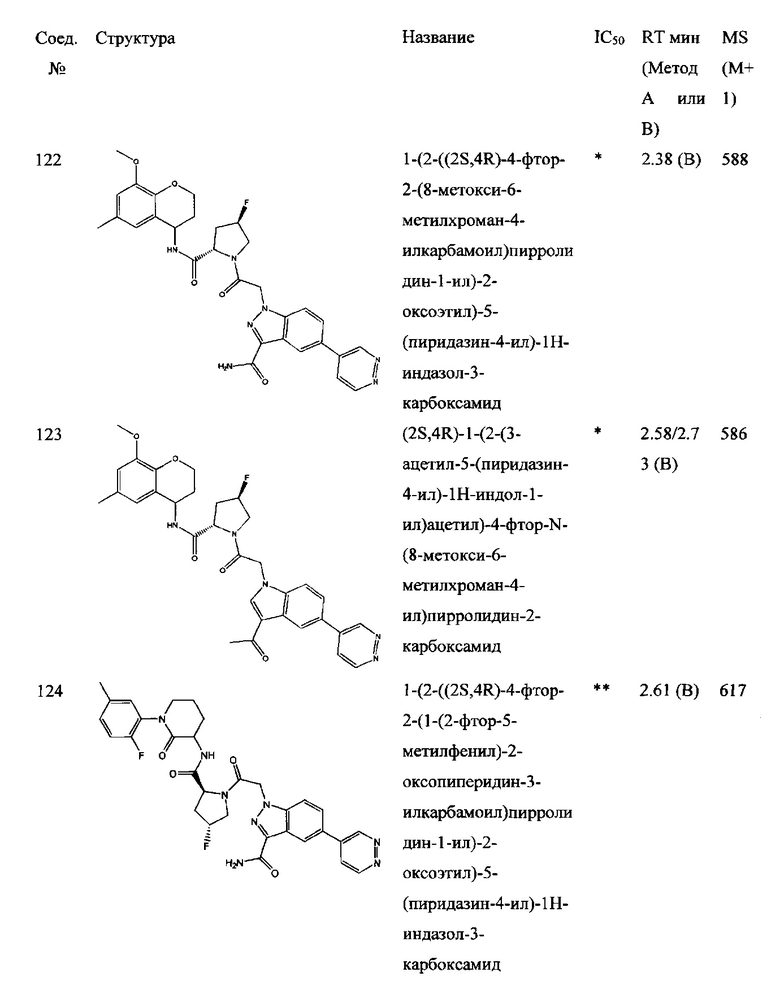














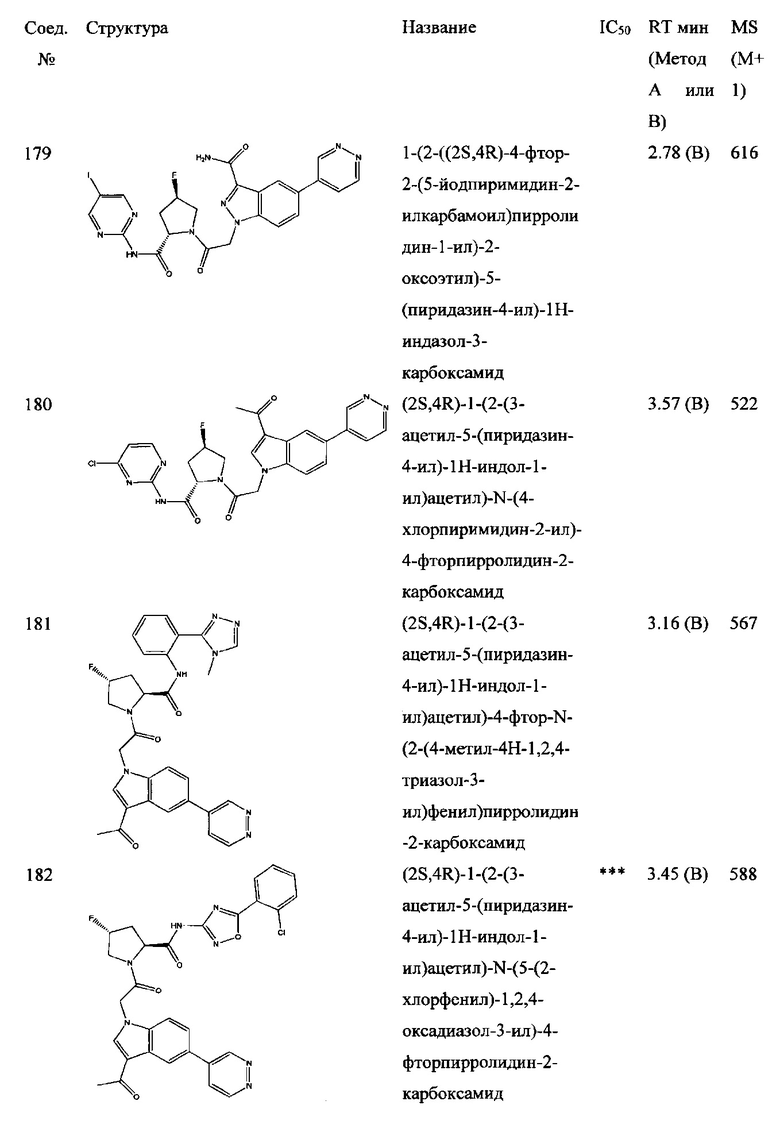

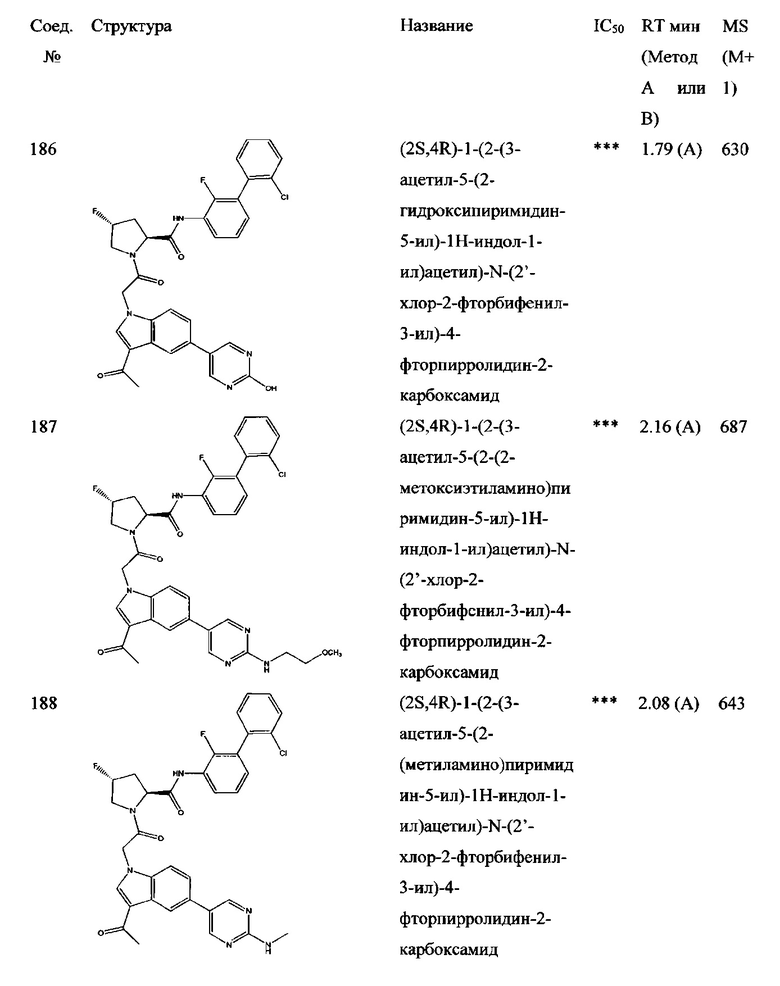
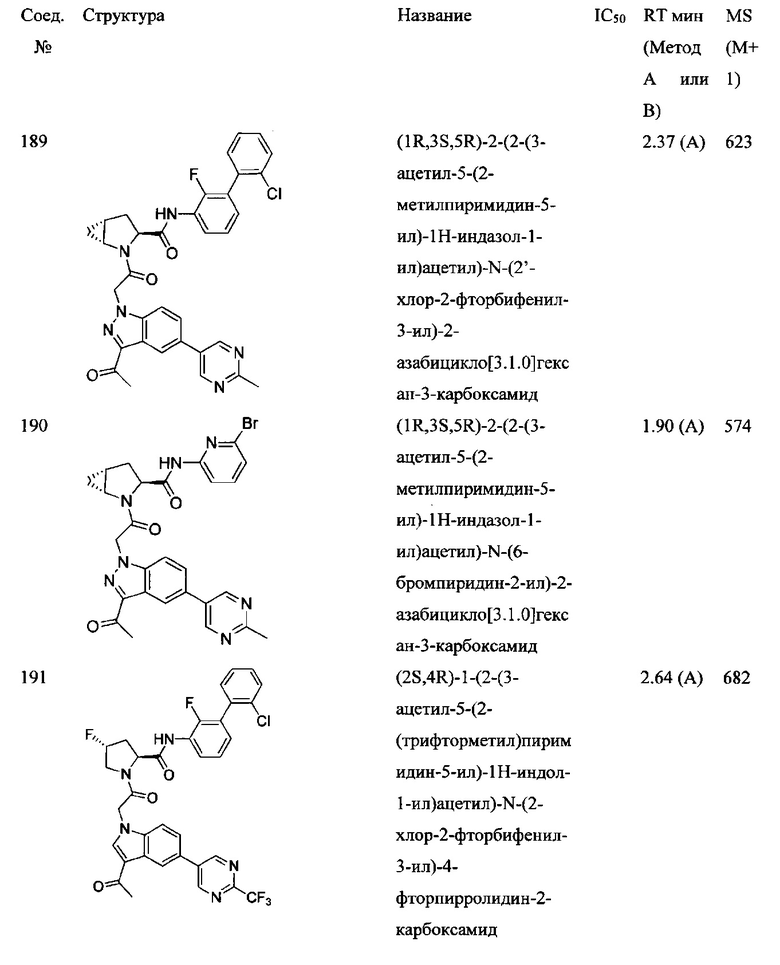
Пример 7. Анализ Фактора D Человека
Фактор D человека (очищенный из сыворотки человека, Complement Technology, Inc.) при конечной концентрации 80 нМ инкубируют с тестируемым соединением при различных концентрациях в течение 5 минут при комнатной температуре в 50 мМ Tris, 1 М NaCl, pH 7,5. Добавляют синтетический субстрат Z-L-Lys-SBzl и DTNB (реагент Эллмана) до конечной концентрации 100 мкМ каждый. Увеличение цвета записывают при OD405 нм на микропланшете в кинетическом режиме в течение 30 минут с 30-секундными точками времени на спектрофлуориметре. Величины IC50 рассчитывают с помощью нелинейной регрессии из процента ингибирования активности комплемента фактора D в зависимости от концентрации тестируемого соединения.
Пример 8. Анализ Гемолиза
Анализ гемолиза был ранее описан G. Ruiz-Gomez, et al., J. Med. Chem. (2009) 52: 6042-6052. В анализе красных кровяных клеток (RBC), эритроциты кролика (приобретенные у Complement Technologies) промывают с использованием GVB Buffer (0,1% желатина, 5 мМ Veronal, 145 мМ NaCl, 0,025% NaN3, pH 7,3) плюс 10 мМ конечного Mg-EGTA. Клетки используют в концентрации 1×108 клеток/мл. До анализа гемолиза оптимальную концентрацию Нормальной Сыворотки Человека (NHS), которая необходима для достижения 100% лизиса эритроцитов кролика, определяют титрованием. NHS (Complement Technologies) инкубируют с ингибитором в течение 15 мин при 37°C, добавляли эритроциты кролика в буфере и инкубировали в течение еще 30 мин при 37°C. Положительный контроль (100% лизис) состоит из сыворотки и RBC и отрицательный контроль (0% лизис) только из буфера Mg-EGTA и RBC. Пробы центрифугировали при 2000 об/мин в течение 5 мин, и собирали супернатанты. Оптическую плотность супернатанта измеряют при 405 нм с помощью УФ/видимого спектрофотометра. Процент лизиса в каждом образце рассчитывают относительно положительного контроля (100% лизиса).
Пример 9. НЕОГРАНИЧИВАЮЩИЕ ПРИМЕРЫ СОЕДИНЕНИЙ ФОРМУЛЫ I







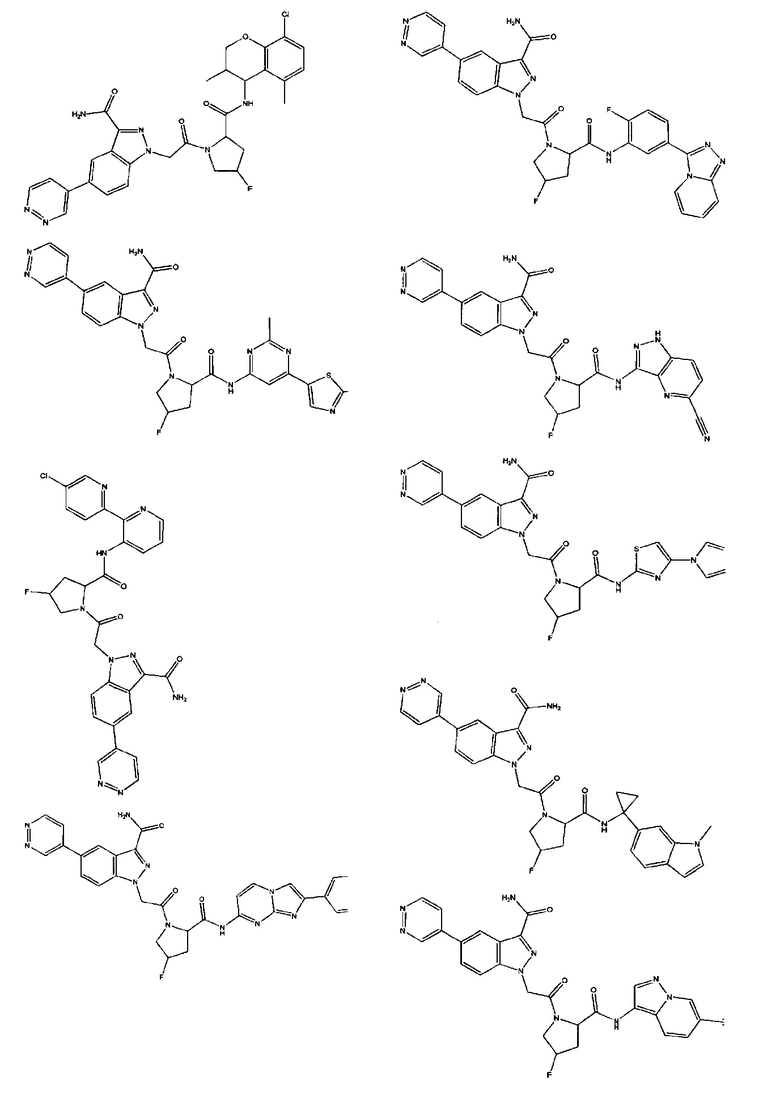










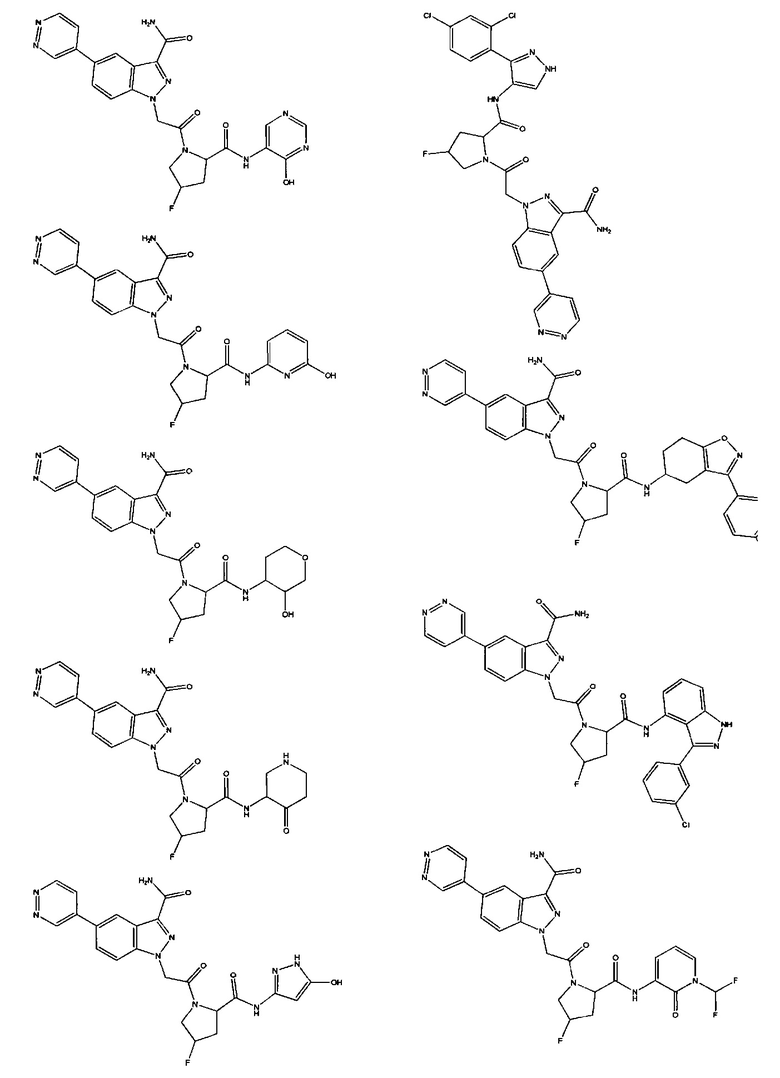









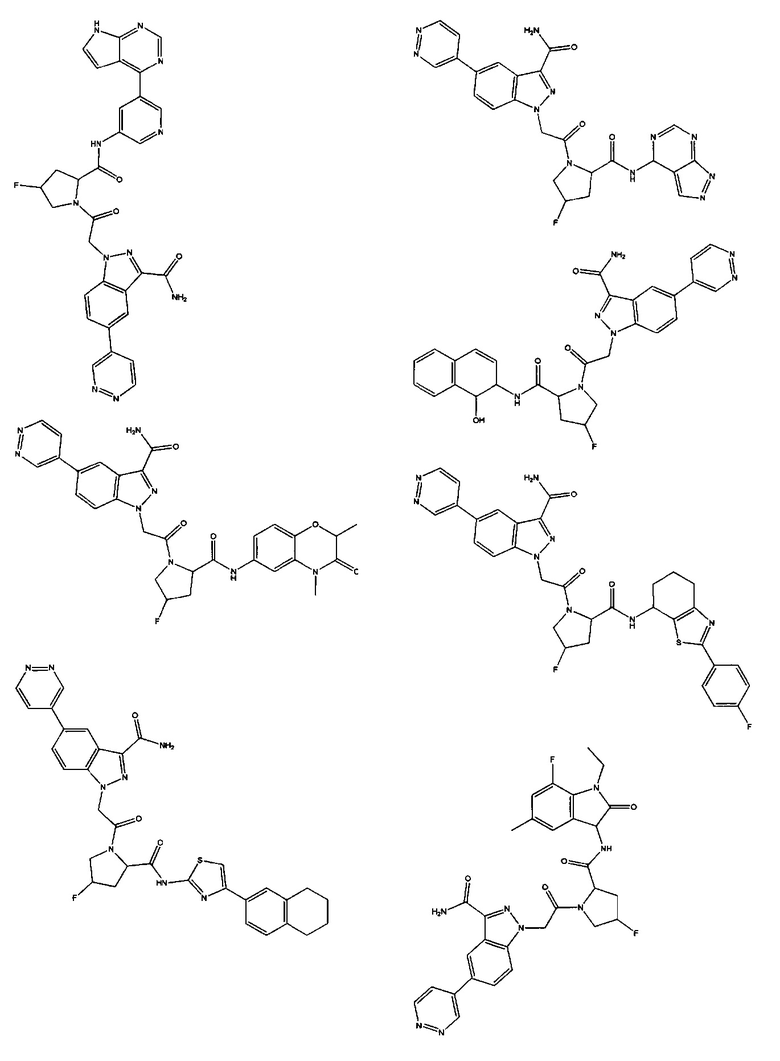
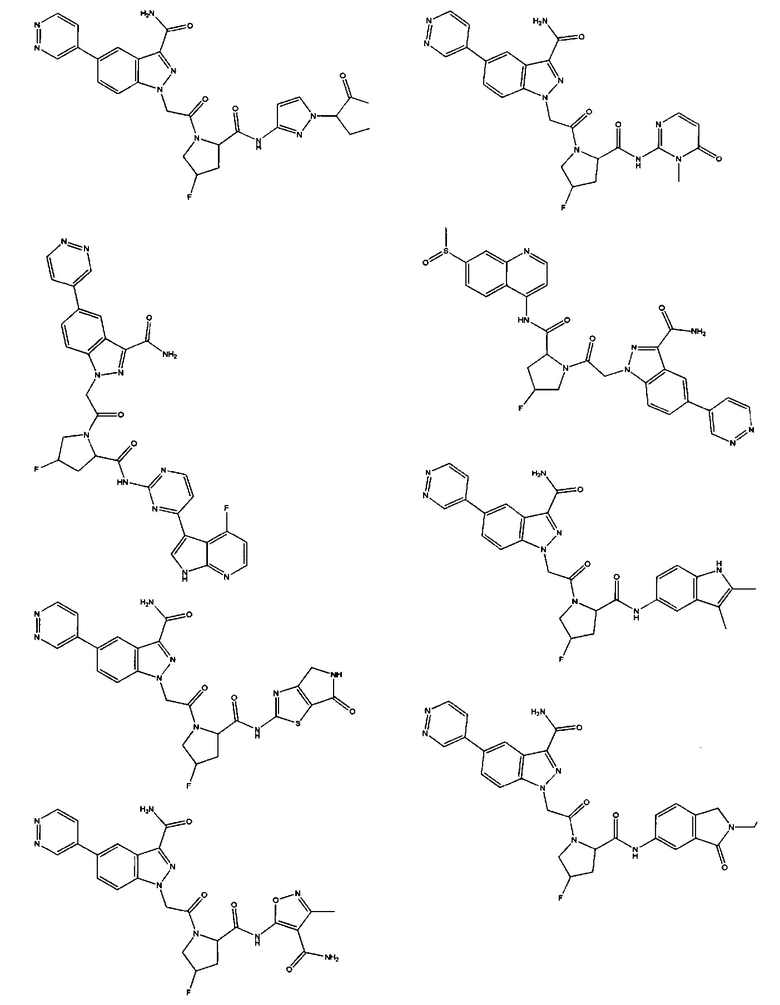



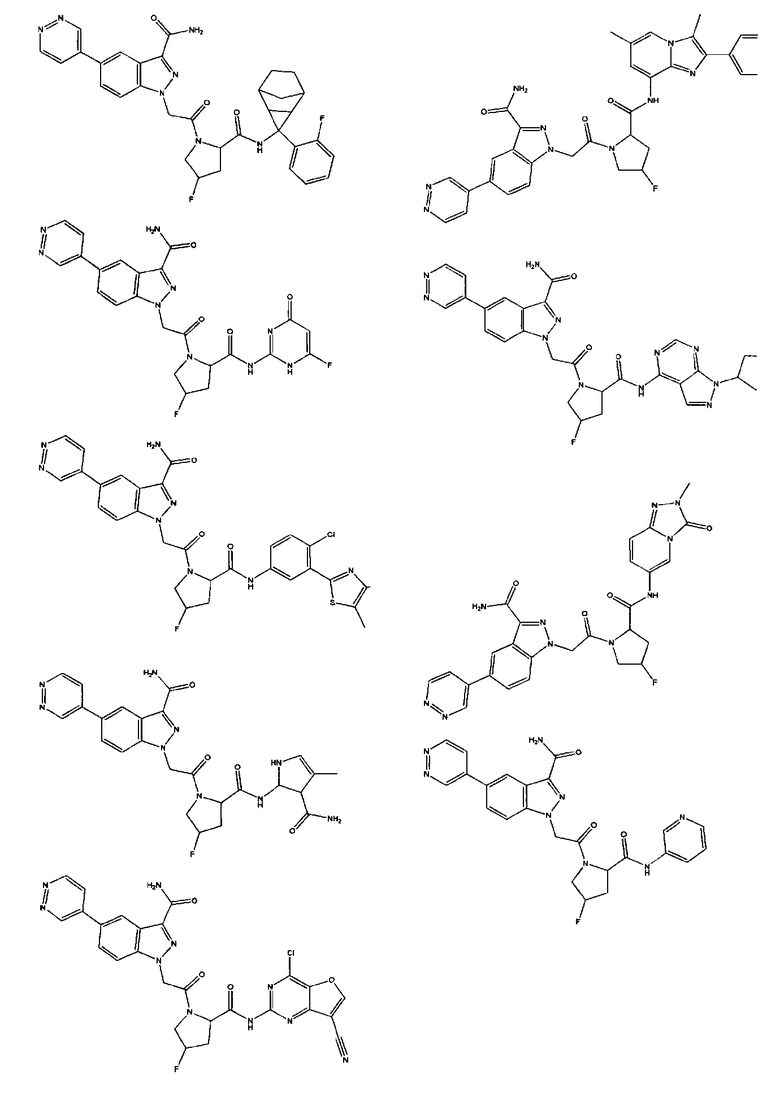
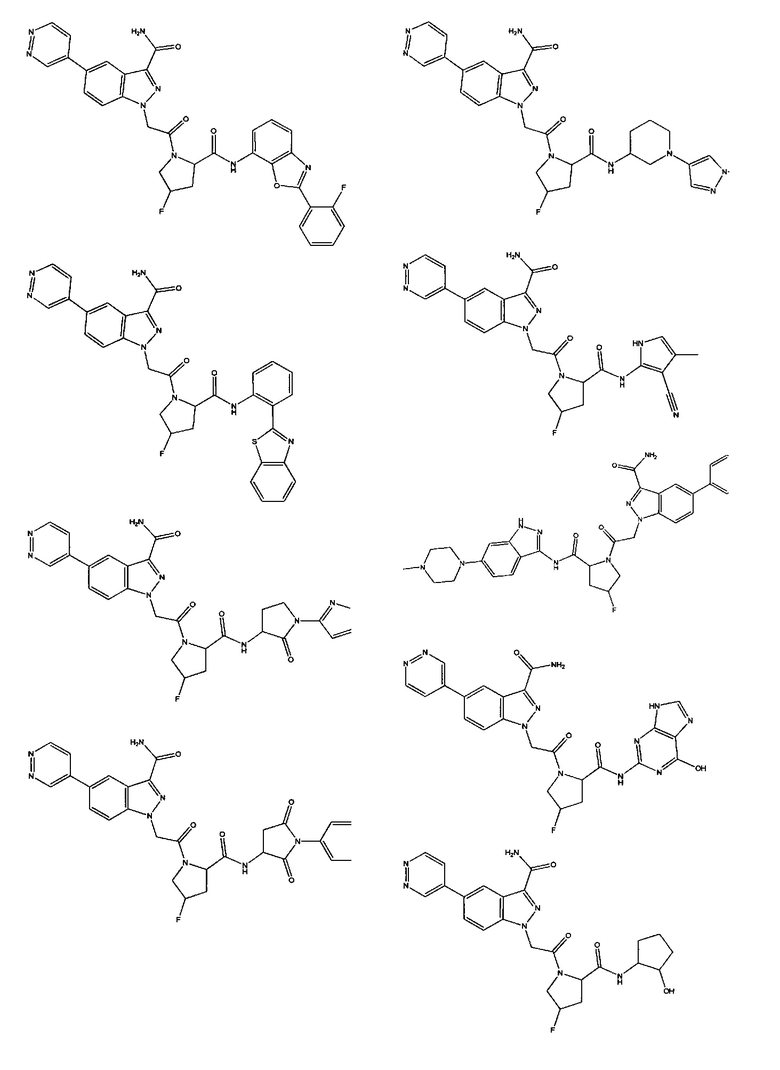

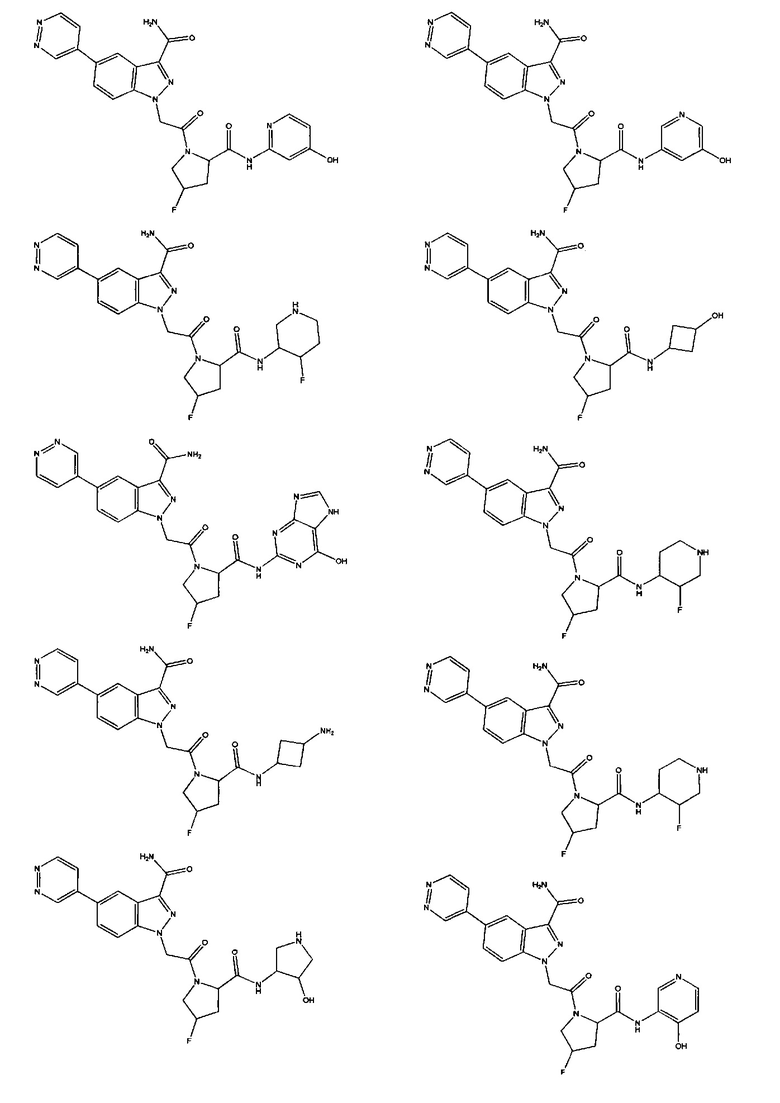








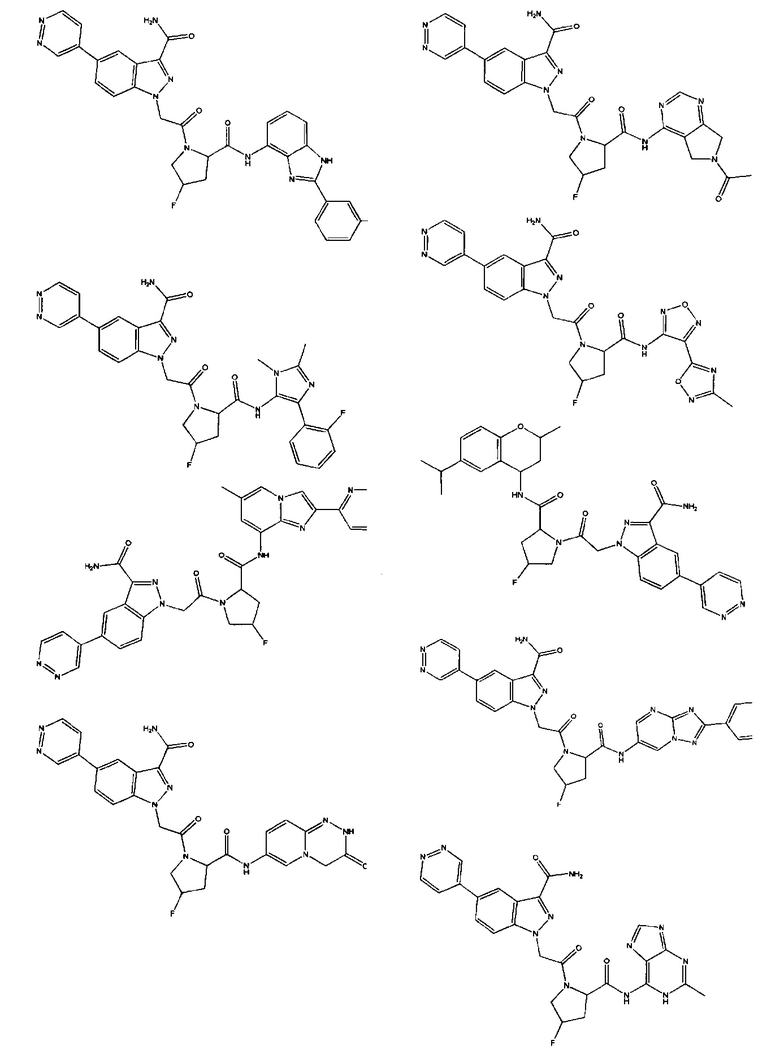





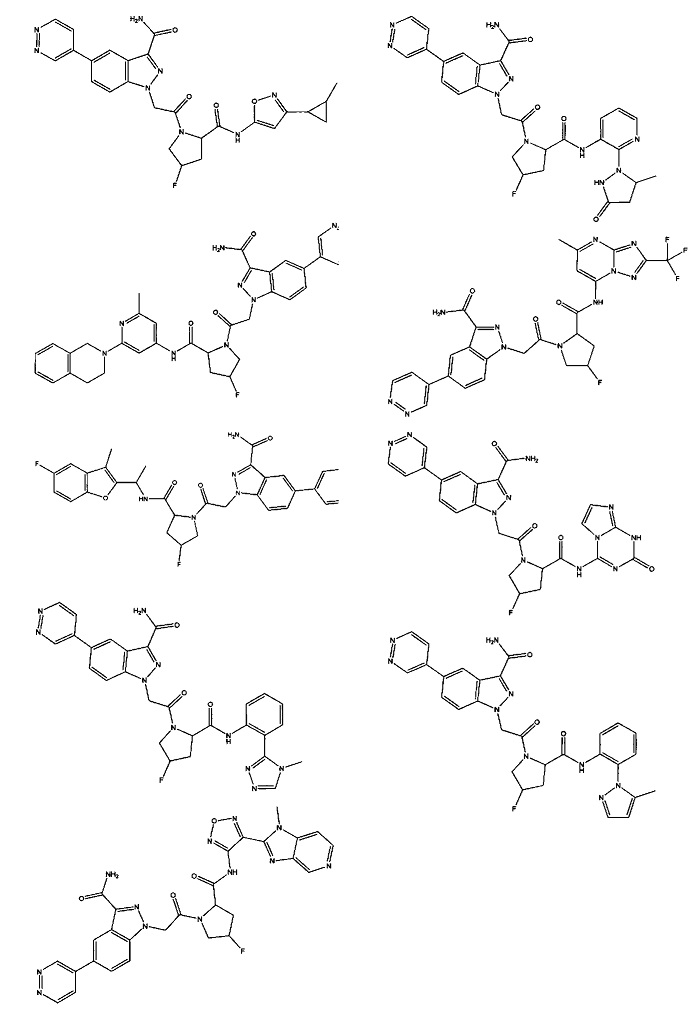
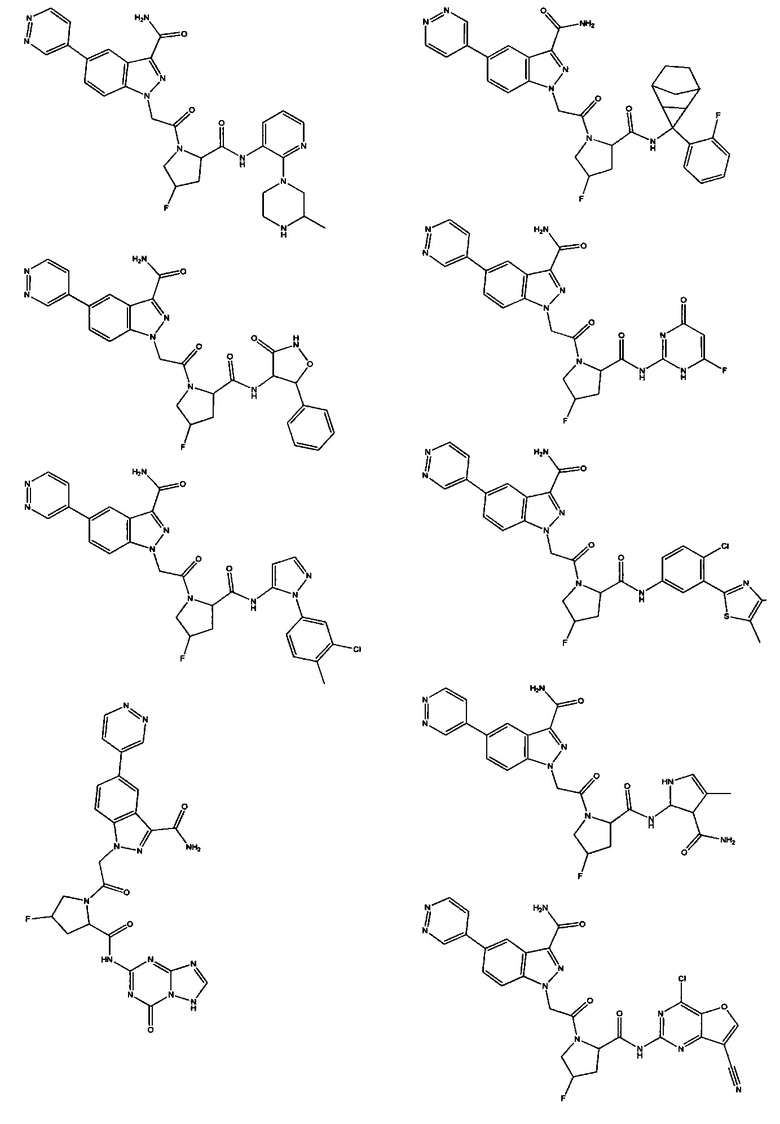





Это описание было раскрыто со ссылкой на варианты выполнения изобретения. Тем не менее, среднему специалисту в данной области техники будет очевидно, что могут быть сделаны различные модификации и изменения без отступления от объема настоящего изобретения, как изложено ниже в формуле изобретения. Соответственно, описание следует рассматривать в иллюстративном, а не ограничительном смысле, и все такие модификации должны быть включены в объем изобретения.
Часть В. ВКЛЮЧЕНИЕ ТЕКСТА ПРИОРИТЕТНЫХ ДОКУМЕНТОВ
В целях обеспечения полного права приоритета по ранее поданным приоритетным заявкам, текст предварительной Заявки США 62/046,783, поданной 5 сентября 2014, включен в настоящий документ посредством ссылки и релевантные части приводятся ниже. Там, где термины накладываются друг на друга, термин, используемый в формуле изобретения, считается относящимся к терминам, предусмотренным в Части A выше, если не указано иное или не ясно из текста пункта формулы, однако, все раскрытие считается частью изобретения для всех раскрытых целей.
Настоящее изобретение относится к соединениям Формулы I

и их фармацевтически приемлемым солям. В Формуле I переменные, напр. А, В, L, X1, X2, Q1, Q2 и Q3 имеют следующие значения.
Q1 представляет собой N(R1) или C(R1R1');
Q2 представляет собой C(R2R2'), C(R2R2')-C(R2R2') или C(R2R2')O;
Q3 представляет собой N(R3), S или C(R3R3');
(а) X1 и X2 независимо означают N или СН или (b) X1 и X2 вместе представляют собой C=C;
R1, R1', R2, R2', R3 и R3' независимо выбраны в каждом случае из (с) и (d):
(с) водород, галоген, гидроксил, нитро, циано, амино, C1-C6алкил, C2-C6алкенил, C1-C6алкокси, C2-C6алкинил, C2-C6алканоил, C1-C6тиоалкил, гидроксиC1-C6алкил, аминоC1-C6алкил, -C0-C4алкилNR9R10, -C(O)OR9, -OC(O)R9, -NR9C(O)R10, -C(O)NR9R10, -OC(O)NR9R10, -NR9C(O)OR10, C1-C2галогеналкил и C1-C2галогеналкокси, где R9 и R10 независимо выбраны в каждом случае из водорода, C1-C6алкила и (C3-C7циклоалкил)C0-C4-алкила;
(d) -C0-C4алкил(C3-C7циклоалкил) и -O-C0-C4алкил(C3-C7циклоалкил).
Кроме того, может присутствовать любое одно из следующих колец (е), (f), (g), (h), (i) или (j):
(e) R1 и R1' или R3 и R3' могут быть взяты вместе с образованием 3-6-членного карбоциклического спиро-кольца или 3-6-членного гетероциклического спиро-кольца, содержащего 1 или 2 гетероатома, независимо выбранных из N, О или S;
(f) R2 и R2' могут быть взяты вместе с образованием 3-6-членного карбоциклического спиро-кольца,
(g) R2 и R2' могут быть взяты вместе с образованием 3-6-членного гетероциклического спиро-кольца,
каждое из спиро-колец (е), (f) и (g) является незамещенным или замещенным одним или более галогеновыми или метальными заместителями;
(h) R1 и R2 могут быть взяты вместе с образованием 3-членного карбоциклического кольца;
(i) R1 и R2 могут быть взяты вместе с образованием 4-6-членного карбоциклического кольца или 4-6-членного гетероциклического кольца, содержащего 1 или 2 гетероатома, независимо выбранных из N, О и S.
(j) R2 и R3, если связаны с соседними атомами углерода, могут быть взяты вместе с образованием 3-6-членного карбоциклического кольца или 3-6-членного гетероциклического кольцо; каждое кольцо (g), (h) и (i) может быть незамещенным или замещенным 1 или более заместителями, независимо выбранными из галогена, гидроксила, циано, -COOH, C1-C4алкила, C2-C4алкенила, C1-C4алкокси, C2-C4алканоила, гидроксиC1-C4алкила, (моно- и ди-C1-C4алкиламино)C0-C4алкила, -C0-C4алкил(C3-C7циклоалкила), -O-C0-C4алкил(C3-C7циклоалкила), C1-C2галогеналкила и C1-С2галогеналкокси;
А представляет собой гетероциклическую группу, выбранную из (k) и (l), где (k) представляет собой
 или
или 
и (l) представляет собой

 или
или  .
.
X4 представляет собой В(ОН), и Y представляет собой CHR9; или X4 представляет собой CHR9, и Y представляет собой В(ОН).
R4 представляет собой (m) или (n):
(m) -CHO, -CONH2 или C2-C6алканоил;
(n) водород, -SO2NH2, -C(CH2)F, -CH(CF3)NH2, C1-C6алкил, -C0-C4алкил(C3-C7циклоалкил), -C(O)C0-C2алкил(C3-C7циклоалкил),
 или
или  ;
;
каждый из R4, отличный от водорода, -CHO и -CONH2, незаметен или замещен одним или более из амино, имино, галогена, гидроксила, циано, цианимино, C1-C2алкила, C1-С2алкокси, -C0-C2алкил(моно- и ди-C1-C4алкиламино), C1-C2галогеналкила и C1-С2галогеналкокси.
R5 и R6 независимо выбраны из (о) и (р):
(о) -CHO, -C(O)NH2, -C(O)NH(CH3) или C2-C6алканоил;
(p) водород, гидроксил, галоген, циано, нитро, -COOH, -SO2NH2, винил, C1-C6-алкил, C2-C6алкенил, C1-C6алкокси, -C0-C4алкил(C3-C7циклоалкил), -C(O)C0-C4алкил(C3-C7циклоалкил), -P(O)(OR9)2, -OC(O)R9, -C(O)OR9, -C(O)N(CH2CH2R9)(R10), -NR9C(O)R10, фенил или 5-6-членный гетероарил.
Каждый R5 и R6, отличный от водорода, гидроксила, циано и -COOH, незамещен или замещен одним или более заместителями, независимо выбранными из галогена, гидроксила, амино, имино, циано, цианоимино, С1-С2алкила, C1-C4алкокси, -C0-C2алкил(моно- и ди-C1-C4алкиламино), C1-C2галогеналкила и C1-С2галогеналкокси.
R6 представляет собой водород, галоген, гидроксил, C1-C4алкил или C1-C4алкокси; или R6 и R6' могут быть взяты вместе с образованием оксо, винил или имино группы.
R7 представляет собой водород, C1-C6алкил или -C0-C4алкил(C3-C7циклоалкил.
R8 и R8' независимо выбраны из водорода, галогена, гидроксила, C1-C6алкила, C1-C6алкокси и (C1-C4алкиламино)C0-C2алкила или R8 и R8', взятые вместе, образуют оксо группу.
R16 представляет собой 0, или 1, или более заместителей, независимо выбранных из галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, -C0-C4алкил(моно- и ди-C1-C6алкиламино), -C0-C4алкил(C3-C7циклоалкила), C1-С2галогеналкила и C1-C2галогеналкокси.
R19 представляет собой водород, C1-C6алкил, C2-C6алкенил, C2-C6алканоил, -SO2C1-C6алкил, (моно- и ди-C1-C6алкиламино)C1-C4алкил, -C0-C4алкил(C3-C7циклоалкил), каждый из R19, отличающийся от водорода, замещен 0, или 1 или более заместителями, независимо выбранными из галогена, гидроксила, амино, -COOH и -С(O)ОC1-C4-алкила.
X11 представляет собой N или CR11.
X12 представляет собой N или CR12.
X13 представляет собой N или CR13.
X14 представляет собой N или CR14.
X15 представляет собой N или CR15.
Не более 2 из X11, X12, X13, X14 и X15 представляют собой N.
R11, R14 и R15 независимо выбраны в каждом случае из водорода, галогена, гидроксила, нитро, циано, -O(PO)(OR9)2, -(PO)(OR9)2, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, C1-C6тиоалкила, -C0-C4алкил(моно- и ди-C1-C6алкиламино), -C0-C4алкил(C3-C7циклоалкила), -C0-C4алкокси(C3-C7циклоалкила), C1-C2галогеналкила и C1-C2галогеналкокси.
R12 и R13 независимо выбраны из (q), (r) и (s):
(q) водород, галоген, гидроксил, нитро, циано, амино, -COOH, C1-C2галогеналкил и C1-C2галогеналкокси,
(r) C1-C6алкил, C2-C6алкенил, C2-C6алканоил, C1-C6алкокси, C2-C6алкенилокси, -C(O)OR9, C1-C6тиоалкил, -C0-C4алкилNR9R10, -C(O)NR9R10, -SO2R9R10, -SO2NR9R10, -OC(O)R9 и -C(NR9)NR9R10, каждый из (r) незаметен или замещен одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, амино, -COOH, -CONH2 C1-С2галогеналкила и C1-С2галогеналкокси, и каждый из (r) также необязательно замещен одним заместителем, выбранным из фенила и 4-7-членного гетероцикла, содержащего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S; при этом фенил или 4-7-членный гетероцикл не замещен или замещен одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, (моно- и ди-C1-С6алкиламино)C0-C4алкила, C1-C6алкилэфира, -C0-C4алкил)(C3-C7циклоалкила), C1-С2галогеналкила и C1-С2галогеналкокси;
(s) -C2-C6алкинил, -C2-C6aлкинилR23, C2-C6алканоил, -JC3-C7циклоалкил, -B(ОН)2, -JC(O)NR9R23, -JOSO2OR21, -C(O)(CH2)1-4S(O)R21, -O(CH2)1-4S(O)NR21NR22, JOP(O)(OR21)(OR22), -JP(O)(OR21)(OR22), -JOP(O)(OR21)R22, -JP(O)(OR21)R22, -JOP(O)R21R22, -JP(O)R21R22, -JSP(O)(OR21)(OR22), -JSP(O)(OR21)(R22), -JSP(O)(R21)(R22), -JNR9P(O)(NHR21)(NHR22), -JNR9P(O)(OR21)(NHR22), -JNR9P(O)(OR21)(OR22), -JC(S)R21, -JNR21SO2R22, -JNR9S(O)NR10R22, -JNR9SO2NR10R22, -JSO2NR9COR22, -O(CH2)1-4SO2NR21R22, -JSO2NR9CONR21R22, -JNR21SO2R22, -JC(O)NR21SO2R22, -JC(NH2)NR22, -JC(NH2)NS(O)2R22, -JOC(O)NR21R22, -JOC(O)NR24R25, -JNR9C(O)OR10, -JNR9C(O)OR23, -JNR21OC(O)R22, -(CH2)1-4C(O)NR21R22, -JC(O)R24R25, -JNR9C(O)R21, -JC(O)R21, -JNR9C(O)NR9R10, -JNR9C(O)NR10R23, -JNR9C(O)NR24R25, -CCR21, -(CH2)1-4OC(O)R21, -JC(O)OR23, -C2-C4aлкилR23, -C2-C4aлкeнилR23, -C2-C4aлкинилR23 и - Jпарациклофан.
J независимо выбран в каждом случае из ковалентной связи, C1-C4алкилена, -OC1-С4алкилена, C2-C4алкенилена и C2-C4алкинилена.
R21 и R22 независимо выбраны в каждом случае из водорода, гидроксила, циано, амино, C1-C6алкила, C1-C6алкила, C1-C6алкокси, (C3-C7циклоалкил)C0-C4алкила, (фенил)C0-C4алкила, -C1-C4алкилОС(O)ОC1-C6алкила, -C1-C4алкилОС(O)C1-C6-алкила, -C1-C4алкилС(O)ОC1-C6алкила, (4-7-членный гетероциклоалкил)C0-C4алкила, имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, и (5- или 6-членный ненасыщенный или ароматический гетероцикл)C0-C4-алкила, имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S.
R23 независимо выбран в каждом случае из (C3-C7циклоалкил)C0-C4-алкила, (фенил)C0-C4-алкила, (4-7-членный гетероциклоалкил)C0-C4алкила, имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, и (5- или 6-членный ненасыщенный или ароматический гетероцикл)C0-C4алкила, имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S.
R24 и R25, взятые вместе с атомом азота, к которому они присоединены, образуют от 4- до 7-членную моноциклическую гетероциклоалкильную группу или от 6- до 10-членную бициклическую гетероциклическую группу, имеющую конденсированные, спиро или мостиковые кольца.
Каждый из (s) может быть незамещенным или замещенгым одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, амино, оксо, -B(ОН)2, -Si(CH3)3, -COOH, -CONH2, -P(O)(ОН)2, C1-C6алкила, C1-C6алкокси, -C0-C2алкил(моно- и ди-C1-C4алкиламино), C1-C6алкилэфира, C1-C4алкиламино, C1-C4гидроксилалкила, C1-C2галогеналкила и C1-C2галогеналкокси.
L представляет собой либо (t), (u), либо (v):
(t) представляет собой группу формулы
 или
или  , где R17 представляет собой водород или C1-C6алкил, и R18 и R18' независимо выбраны из водорода, галогена и метила; и m представляет собой 0, 1, 2 или 3; и
, где R17 представляет собой водород или C1-C6алкил, и R18 и R18' независимо выбраны из водорода, галогена и метила; и m представляет собой 0, 1, 2 или 3; и
(u) представляет собой связь,
(v) или группу формулы
 или
или  .
.
В представляет собой моноциклическую или бициклическую карбоциклическую или карбоциклическую-окси группу или моноциклическую, бициклическую или трициклическую гетероциклическую группу, имеющую 1, 2, 3 или 4 гетероатома, независимо выбранных из N, О, и S, и от 4 до 7 кольцевых атомов на кольцо, или B представляет собой группу C2-C6алкенил или C2-C6алкинил.
Каждый из B незамещен или замещен одним или несколькими заместителями, независимо выбранными из (w) и (x), и 0 или 1 заместителем, выбранным из (y) и (z):
(w) галоген, гидроксил, -COOH, циано, C1-C6алкил, C2-C6алканоил, C1-C6алкокси, -C0-C4алкилNR9R10, -SO2R9, C1-C2галогеналкил и C1-C2галогеналкокси;
(x) нитро, C2-C6алкенил, C2-C6алкинил, C1-C6тиоалкил, -JC3-C7циклоалкил, -B(ОН)2, -JC(O)NR9R23, -JOSO2OR21, -C(O)(CH2)1-4S(O)R21, -O(CH2)1-4S(O)NR21R22, -JOP(O)(OR21)(OR22), -JP(O)(OR21)(OR22), -JOP(O)(OR21)R22, -JP(O)(OR21)R22, -JOP(O)R21R22, -JP(O)R21R22, -JSP(O)(OR21)(OR22), -JSP(O)(OR21)(R22), -JSP(O)(R21)(R22), -JNR9P(O)(NHR21)(NHR22), -JNR9P(O)(OR21)(NHR22), -JNR9P(O)(OR21)(OR22), -JC(S)R21, -JNR21SO2R22, -JNR9S(O)NR10R22, -JNR9SO2NR10R22, -JSO2NR9COR22, -JSO2NR9CONR21R22, -JNR21SO2R22, -JC(O)NR21SO2R22, -JC(NH2)NR22, -JC(NH2)NS(O)2R22, -JOC(O)NR21R22, -JNR21C(O)OR22, -JNR21OC(O)R22, -(CH2)1-4C(O)NR21R22, -JC(O)R24R25, -JNR9C(O)R21, -JC(O)R21, -JNR9C(O)NR10R22, -CCR21, -(CH2)1-4OC(O)R21 и -JC(O)OR23; каждый из (x) может быть незамещенным или замещенным одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, амино, оксо, -B(OH)2, -Si(CH3)3, -COOH, -CONH2, -P(O)(ОН)2, C1-C6алкила, C1-C6алкокси, -C0-C2алкил(моно- и ди-C1-С4алкиламино), C1-C6алкилэфира, C1-C4алкиламино, С1-C4гидроксилалкила, C1-С2галогеналкила и C1-C2галогеналкокси;
(y) нафтил, нафтилокси, инданил, (4-7-членный гетероциклоалкил)C0-C4алкил, содержащий 1 или 2 гетероатома, выбранных из N, О и S, и бициклический гетероцикл, содержащий 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, и содержащий от 4- до 7-кольцевых атомов в каждом кольце; каждый из (y) незамещенный или замещенный одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, (моно- и ди-C1-C6алкиламино)C0-C4алкила, C1-C6алкилэфира, -C0-C4алкил(C3-C7циклоалкила), -SO2R9, C1-C2галогеналкила и C1-C2галогеналкокси; и
(z) тетразолил, (фенил)C0-C2алкил, (фенил)С1-С2алкокси, фенокси и 5- или 6-членный гетероарил, содержащий 1, 2 или 3 гетероатома, независимо выбранных из N, О, В и S, каждый из (z) незамещенный или замещенный одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, (моно- и ди-C1-C6алкиламино)C0-C4алкила, C1-C6алкилэфира, -C0-C4алкил(C3-C7циклоалкила), -SO2R9, -OSi(CH3)2C(CH3)3, Si(CH3)2C(CH3)3, C1-C2галогеналкила и C1-C2галогеналкокси.
Либо X2 представляет собой азот, либо по меньшей мере, один из (d), (е), (g), (i), (l), (n), (p), (s), (v), (x) и (y) присутствует. Также раскрыта фармацевтическая композиция, содержащая соединение или соль Формулы I вместе с фармацевтически приемлемым носителем.
Также раскрыты способы лечения или предотвращения расстройств, опосредованных комплементом каскада фактора D, таких как возрастная дегенерация желтого пятна и дегенерация сетчатки, включающие введение терапевтически эффективного количества соединения или соли Формулы I пациенту, нуждающемуся в таком лечении.
Терминология Приоритетного Документа
Соединения описываются с использованием стандартной номенклатуры. Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно понимается специалистом в данной области техники, к которой принадлежит это изобретение. Если явно не противоречит контексту, каждое название соединения включает форму свободной кислоты или свободного основания соединения, а также все фармацевтически приемлемые соли соединения.
Термин «Формула I» охватывает все соединения, которые удовлетворяют Формуле I, в том числе любые энантиомеры, рацематы и стереоизомеры, а также все фармацевтически приемлемые соли этих соединений. «Формула I» включает все подродовые группы Формулы I, такие как Формула IA и IB, и также включает фармацевтически приемлемые соли соединений Формулы I, если явно не противоречит контексту, в котором используется эта фраза.
Термины "а" и "an" не означают ограничение количества, а скорее обозначают наличие, по меньшей мере, одного из описываемого. Термин «или» означает «и/или». Открытая переходная фраза «содержащий» охватывает промежуточную переходную фразу «состоящий по существу из» и закрытую фразу «состоящий из». Притязания, излагаемые одной из этих трех переходных фраз или альтернативной переходной фразой, такой как «содержащий» или «включающий», могут быть записаны посредством какой-либо другой переходной фразы, если это явно не исключается контекстом или областью техники. Указание диапазонов значений предназначено лишь для использования в качестве сокращенного способа отсылки индивидуально к каждой отдельной величине, попадающей в диапазон, если в настоящем документе не указано иное, и каждая отдельная величина включена в описание, как если бы она была индивидуально указана в настоящем документе. Концы всех диапазонов включены в пределах диапазона и независимо комбинируется. Все описанные в настоящем документе способы могут быть выполнены в подходящем порядке, если в настоящем документе не указано иное или иное явно противоречит контексту. Использование любого или всех примеров или иллюстративных выражений (напр., «такой как») предназначено лишь для лучшей иллюстрации изобретения и не накладывает ограничений на объем изобретения, если не заявлено иное. Ни одно из выражений в описании не должно быть истолковано как указание на какой-либо не заявленный элемент как существенное для практического осуществления изобретения, как используется в настоящем документе. Если не указано иное, технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно понимается специалистом в данной области техники, к которой принадлежит это изобретение.
Соединения Формулы I включают все соединения Формулы I, имеющие изотопные замены в любом положении. Изотопы включают те атомы, которые имеют один и тот же атомный номер, но разные массовые числа. В качестве общего примера и без ограничения, изотопы водорода включают тритий и дейтерий и изотопы углерода включают 11С, 13С и 14С. Хотя соединения Формулы I, требуют умеренного или высокого уровня дейтерировании (замещение водорода дейтерием) в определенных положениях, Формула I включает в себя варианты осуществления, в которых другие позиции обогащены изотопами.
«Активный агент» означает соединение (в том числе соединение, описанное в настоящем документе), элемент или смесь, которые при введении пациенту отдельно или в комбинации с другим соединением, элементом или смесью, приводят прямо или косвенно к физиологическому эффекту на пациента. Косвенный физиологический эффект может иметь место через метаболический или другой косвенный механизм.
Черта («-»), которая не находится не между двумя буквами или символами, используется для указания точки прикрепления заместителя. Например, -(C=O)NH2 является присоединенным через углерод кето (С=O) группы.
«Алкил» представляет собой разветвленную или линейную насыщенную алифатическую углеводородную группу, имеющую определенное число атомов углерода, как правило, от 1 до около 12 атомов углерода. Термин C1-C6алкил, используемый в настоящем документе, указывает на алкильную группу, имеющую от 1, 2, 3, 4, 5 или 6 атомов углерода. Другие варианты выполнения включают алкильные группы, имеющие от 1 до 8 атомов углерода, от 1 до 4 атомов углерода или 1 или 2 атома углерода, напр., C1-C8алкил, C1-C4алкил и С1-С2алкил. Когда C0-Cn алкил используется в настоящем документе в сочетании с другой группой, например, (C3-C7циклоалкил)C0-C4алкилом или -C0-C4алкил(C3-C7циклоалкилом), то указанная группа, в данном случае циклоалкил, либо непосредственно связана одинарной ковалентной связью (C0алкил), либо присоединена алкильной цепью, имеющей указанное число атомов углерода, в данном случае 1, 2, 3 или 4 атома углерода. Алкилы также могут быть присоединены через другие группы, такие как гетероатомы, как в -O-C0-C4алкил(C3-C7циклоалкил). Примеры алкила включают, но без ограничения, метил, этил, н-пропил, изопропил, н-бутил, 3-метилбутил, трет-бутил, н-пентил и втор-пентил.
«Алкенил» представляет собой прямую или разветвленную алифатическую углеводородную группу, имеющую одну или более углерод-углеродную двойную связь, которая может возникнуть в любой стабильной точке на цепи, имеющей указанное число атомов углерода. Примеры алкенила включают, но без ограничения, этенил и пропенил.
«Алкинил» представляет собой прямую или разветвленную алифатическую углеводородную группу, имеющую одну или более двойную углерод-углеродную тройную связь, которая может возникнуть в любой стабильной точке на цепи, имеющей указанное число атомов углерода.
«Алкилен» означает двухвалентный насыщенный углеводород. Алкилены включают группы, имеющие от 1 до 8 атомов углерода, от 1 до 6 атомов углерода или указанное число атомов углерода, например, C1-C4алкилен.
«Алкенилен» представляет собой двухвалентный углеводород, имеющий по меньшей мере одну углерод-углеродную двойную связь. Алкенилены включают группы, имеющие от 2 до 8 атомов углерода, от 2 до 6 атомов углерода, или указанное число атомов углерода, например, C2-C4алкенилен.
«Алкинилен» представляет собой двухвалентный углеводород, имеющий по меньшей мере одну углерод-углеродную тройную связь. Алкинилены включают группы, имеющие от 2 до 8 атомов углерода, от 2 до 6 атомов углерода или указанное число атомов углерода, например, C2-C4алкинилен.
«Алкокси» означает алкильную группу, как определено выше, с указанным числом атомов углерода, ковалентно связанных с группой, которую он замещает, через кислородный мостик (-O-). Примеры алкокси включают, но не ограничиваясь, метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, 2-бутокси, трет-бутокси, н-пентокси, 2-пентокси, 3-пентокси, изопентокси, неопентокси, н-гексокси, 2-гексокси, 3-гексокси и 3-метилпентокси. Подобно этому группа «алкилтио» или «иоалкил» представляет собой алкильную группу, как определено выше, с указанным числом атомов углерода, ковалентно связанную с группой, которую она замещает, через серный мостик (-S-).
«Алкенилокси» представляет собой алкенильную группу, как определено выше, с указанным числом атомов углерода, ковалентно связанную с группой, которую она замещает, через кислородный мостик (-O-).
«Алканоил» представляет собой алкильную группу, как определено выше, с указанным числом атомов углерода, ковалентно связанную с группой, которую она замещает, через карбонильный мостик (С=O). Углерод карбонильной группы входит в число атомов углерода, то есть C2алканоил представляет собой группу CH3(С=O)-.
«Алкилэфир» представляет собой алкильную группу, как определено в настоящем документе, ковалентно связанную с группой, которую она замещает, посредством сложноэфирной связи. Сложноэфирная связь может быть в той или иной ориентации, напр., группа формулы -O(С=O)алкил или группа формулы -(С=O)Оалкил.
«Карбоциклическая группа» представляет собой насыщенную, ненасыщенную или частично ненасыщенную (напр., ароматическую) группу, содержащую все углеродные кольцевые атомы. Карбоциклическая группа, как правило, содержит 1 кольцо с от 3 до 7 атомами углерода или 2 конденсированных кольца, каждое содержащее от 3 до 7 атомов углерода. «Карбоциклическое кольцо» представляет собой насыщенное, ненасыщенное или частично ненасыщенное (напр., ароматические) кольцо, содержащее углеродные кольцевые атомы. Карбоциклическое кольцо, как правило, содержит 1 кольцо из от 3 до 7 атомов углерода, или «карбоциклическая группа» может содержать 1 карбоциклическое кольцо или 2 конденсированных карбоциклических кольца, каждое из которых содержит от 3 до 7 атомов углерода. Примеры карбоциклических колец включают фенильное, циклогексенильное, циклогексильное и циклопропильное кольца.
«Карбоциклическая окси группа» представляет собой моноциклическую карбоциклическую кольцевую или моно- или бициклическую карбоциклическую группу, как определено выше, присоединенную к группе, которую она замещает, через кислородный, -O-, линкер.
«Циклоалкил» представляет собой насыщенную углеводородную кольцевую группу, имеющую определенное число атомов углерода. Моноциклические циклоалкильные группы, как правило, имеют от 3 до около 8 атомов углерода в кольце или от 3 до 7 (3, 4, 5, 6 или 7) атомов углерода в кольце. Циклоалкильные заместители могут быть подвесными из замещенного атома азота или атома углерода, или замещенный атом углерода, который может иметь два заместителя, может иметь циклоалкильную группу, которая присоединена как спиро группа. Примеры циклоалкильных групп включают циклопропан, циклобутил, циклопентил и циклогексил.
«Галогеналкил» означает как разветвленные, так и неразветвленные алкильные группы, имеющие определенное число атомов углерода, замещенные 1 или более атомами галогена, вплоть до максимально допустимого числа атомов галогена. Примеры галогеналкила включают, но не ограничиваясь, трифторметил, дифторметил, 2-фторэтил и пента-фторэтил.
«Галогеналкокси» означает галогеналкильную группу, как определено в настоящем документе, присоединенную через кислородный мостик (кислород от радикала спирта).
«Гидроксиалкил» представляет собой алкильную группу, как описано ранее, замещенную по меньшей мере одним гидроксильным заместителем.
«Аминоалкил» представляет собой алкильную группу, как описано ранее, замещенную по меньшей мере одним амино-заместителем. «Гало» или «галоген» представляет собой любой из атомов фтора, хлора, брома и йода.
«Арил» представляет собой ароматические группы, содержащие только углерод в ароматическом кольце или кольцах. Типичные арильные группы содержат от 1 до 3 отдельных, конденсированных или подвесных колец и от 6 до около 18 атомов в кольце, без гетероатома в качестве члена кольца. Когда указано, такие арильные группы могут быть дополнительно замещены атомами углерода или неуглеродными атомами или группами. Такое замещение может включать конденсирование с от 5 до 7-членной насыщенной циклической группой, которая необязательно содержит 1 или 2 гетероатома, независимо выбранных из N, О и S, с образованием, например, 3,4-метилендиоксифенильной группы. Арильные группы включают, например, фенил, нафтил, в том числе 1-нафтил и 2-нафтил и бифенил.
«Гетероциклическое кольцо» представляет собой насыщенное, ненасыщенное или частично ненасыщенное (напр., ароматическое) кольцо, содержащее от 1 до 4 гетероатомов в кольце, независимо выбранных из N, О и S, или если указано, N, О, S и B, с остальными углеродными кольцевыми атомами. «Гетероциклическая группа» может содержать 1 гетероциклическое кольцо 1 кольцо с от 3 до 7 атомами в кольце или 2 конденсированных кольца, каждое из которых содержит от 3 до 7 атомов в кольце, с по меньшей мере одним кольцом, которое является гетероциклическим кольцом.
«Гетероциклилокси группа» представляет собой моноциклическую гетероциклическую кольцевую или бициклическую гетероциклическую группу, как описано ранее, связанную с группой, которую она замещает, через кислородный, -O-, линкер.
«Гетероарил» представляет собой стабильное моноциклическое ароматическое кольцо, содержащее указанное число атомов в кольце, которое содержит от 1 до 3 или в некоторых вариантах выполнения изобретения от 1 до 2, гетероатомов, выбранных из N, О и S, причем оставшиеся кольцевые атомы представляют собой углерод, или стабильную бициклическую или трициклическую систему, содержащую по меньшей мере одно от 5 до 7-членное ароматическое кольцо, содержащее от 1 до 3, или в некоторых вариантах выполнения изобретения от 1 до 2 гетероатома, выбранных из N, О и S, причем остальные кольцевые атомы представляют собой углерод. Моноциклические гетероарильные группы, как правило, имеют от 5 до 7 атомов в кольце. В некоторых вариантах выполнения изобретения бициклические гетероарильные группы представляют собой от 9- до 10-членные гетероарильные группы, то есть, группы, содержащие 9 или 10 атомов в кольце, в которых одно 5-7 членное ароматическое кольцо конденсировано со вторым ароматическим или неароматическим кольцом. Когда общее число атомов S и O в гетероарильной группе превышает 1, эти гетероатомы не являются смежными друг с другом. Предпочтительно, чтобы общее число атомов S и O в гетероарильной группе было не более чем 2. Особенно предпочтительно, чтобы общее число атомов S и O в ароматическом гетероцикле было не более чем 1. Примеры гетероарильных групп включают, но не ограничиваясь, оксазолил, пиранил, пиразинил, пиразолопиримидинил, пиразолил, пиридизинил, пиридил, пиримидинил, пирролил, хинолинил, тетразолил, тиазолил, тиенилпиразолил, тиофенил, триазолил, бензо[d]оксазолил, бензофуранил, бензотиазолил, бензотиофенил, бензоксадиазолил, дигидробензодиоксинил, фуранил, имидазолил, индолил и изоксазолил. «Гетероарилокси» представляет собой гетероарильную группу, как описывалось, связанную с группой, которую она замещает, через кислородный мостик.
«Гетероциклоалкил» представляет собой насыщенную кольцевую группу, имеющую 1, 2, 3 или 4 гетероатома, независимо выбранных из N, S и O, причем остальные кольцевые атомы представляют собой углерод. Моноциклические гетероциклоалкильные группы, как правило, имеют от 3 до 8 кольцевых атомов или от 4 до 6 кольцевых атомов. Примеры гетероциклоалкильных групп включают морфолинил, пиперазинил, пиперидинил и пирролинил.
Термин «моно- и/или диалкиламино» указывает на вторичные или третичные алкиламиногруппы, где алкильные группы независимо выбраны из алкильных групп, как определено в настоящем документе, содержащих указанное количество атомов углерода. Точка присоединения алкиламиногруппы находится на азоте. Примеры моно- и диалкиламино групп включают этиламино, диметиламино и метилпропиламино.
Термин «замещенный», как он использован в настоящем документе, означает, что любой один или несколько атомов водорода у указанного атома или группы заменен выбранным из указанной группы, при условии, что нормальная валентность указанного атома не превышена. Когда заместитель представляет собой оксо (т.е. =O), то 2 атома водорода на атоме заменены. Когда оксогруппу заменяет ароматические фрагменты, то соответствующее частично ненасыщенное кольцо заменяет ароматическое кольцо. Например, пиридильная группа, замещенная оксо группой, представляет собой пиридон. Комбинации заместителей и/или переменных допустимы только, если такие комбинации приводят к получению стабильных соединений или полезных промежуточных продуктов синтеза. Стабильное соединение или стабильная структура подразумевает соединение, которое достаточно устойчиво, чтобы выдержать выделение из реакционной смеси и последующую переработку в эффективный терапевтический агент. Если не указано иное, то заместители названы в основной структуре. Например, следует понимать, что, когда аминоалкил указан в качестве возможного заместителя, то точка присоединения этого заместителя к структуре ядра находится в алкильной части.
Подходящие группы, которые могут присутствовать на «замещенной» или «необязательно замещенной» позиции, включают, но не ограничиваясь, напр., галоген; циано; гидроксил; нитро; азидо; алканоил (включая C2-C6 алканоильную группу); карбоксамид; алкильные группы (включая циклоалкильные группы), имеющие от 1 до около 8 атомов углерода или от 1 до около 6 атомов углерода; алкенильные и алкинильные группы, включая группы, имеющие одну или более ненасыщенных связей и от 2 до около 8 или от 2 до около 6 атомов углерода; алкокси группы, имеющие одно или более кислородное связывание и от 1 до около 8 или от 1 до около 6 атомов углерода; арилокси, такой как фенокси; алкилтиогруппы, включая имеющие одно или более тиоэфирных связываний и от 1 до 8 атомов углерода или от 1 до 6 атомов углерода; алкилсульфинильные группы, включая имеющие одно или более сульфинильных связываний и от 1 до около 8 атомов углерода или от 1 до около 6 атомов углерода; алкилсульфонильную группу, включая имеющую одно или более сульфонильных связываний и от 1 до около 8 атомов углерода или от 1 до около 6 атомов углерода; аминоалкильные группы, включая группы, имеющие один или более атомов N и от 1 до около 8 или от 1 до около 6 атомов углерода; арил, содержащий 6 или более атомов углерода и одно или более колец (напр., фенил, бифенил, нафтил или тому подобное, при этом каждое кольцо является либо замещенным, либо незамещенным ароматическим); арилалкил, имеющий от 1 до 3 отдельных или конденсированных колец и от 6 до около 18 атомов углерода в кольце с бензилом, являющимся примером арилалкильной группы; арилалкокси, имеющую от 1 до 3 отдельных или конденсированных колец и от 6 до около 18 атомов углерода в кольце с бензилокси, являющимся примером арилалкокси группы; или насыщенную, ненасыщенную или ароматическую гетероциклическую группу, имеющую от 1 до 3 отдельных или конденсированных колец с от 3 до около 8 членов в кольце и одним или более атомом N, O или S, напр., кумаринил, хинолинил, изохинолинил, хиназолинил, пиридил, пиразинил, пиримидинил, фуранил, пирролил, тиенил, тиазолил, триазинил, оксазолил, изоксазолил, имидазолил, индолил, бензофуранил, бензотиазолил, тетрагидрофуранил, тетрагидропиранил, пиперидинил, морфолинил, пиперазинил и пирролидинил. Такие гетероциклические группы могут быть дополнительно замещены, напр., гидрокси, алкилом, алкокси, галогеном и амино. В некоторых вариантах выполнения изобретения «необязательно замещенный» включает в себя один или более заместителей, независимо выбранных из галогена, гидроксила, амино, циано, -CHO, -COOH, -CONH2, C1-C6-алкила, C2-C6алкенила, C1-C6алкокси, C2-C6алканоила, C1-C6алкилэфира, (моно- и ди-C1-C6алкиламино)C0-C2алкила, C1-С2галогеналкила и C1-C2галогеналкокси.
«Дозированная форма» означает единицу введения активного агента. Примеры дозированных форм включают таблетки, капсулы, инъекции, суспензии, растворы, эмульсии, кремы, мази, суппозитории, ингаляционные формы, трансдермальные формы и тому подобное.
«Фармацевтические композиции» представляют собой композиции, содержащие по меньшей мере один активный агент, такой как соединение или соль Формулы I, а также по меньшей мере одно другое вещество, такое как носитель. Фармацевтические композиции необязательно содержат один или более дополнительных активных агентов. Если указано, фармацевтические композиции отвечают стандартам U.S. FDA's GMP (надлежащей производственной практике) для лекарственных препаратов для человека или не для людей. «Фармацевтические комбинации» представляют собой комбинации по меньшей мере двух активных агентов, которые могут быть объединены в одной дозированной форме или предоставлены вместе в виде отдельных дозированных форм с инструкциями так, что активные агенты должны быть использованы вместе для лечения заболевания, такого как гепатит С.
Термин «фармацевтически приемлемые соли» включает производные раскрытых соединений, в которых исходное соединение модифицируют путем образования неорганических и органических нетоксических кислотных или основных солей присоединения. Соли соединений по настоящему изобретению могут быть синтезированы из исходного соединения, которое содержит основный или кислотный остаток, обычными химическими способами. Как правило, такие соли могут быть получены взаимодействием форм свободной кислоты этих соединений со стехиометрическим количеством соответствующего основания (например, гидроксида, карбоната, бикарбоната Na, Ca, Mg или K и т.п.), либо путем реакции формы свободного основания этих соединений со стехиометрическим количеством соответствующей кислоты. Такие реакции обычно проводят в воде, или в органическом растворителе, или в смеси этих двух. Как правило, неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил, являются предпочтительными, где это практически возможно. Соли соединений по настоящему изобретению дополнительно включают сольваты соединений и кампаунд соли.
Примеры фармацевтически приемлемых солей включают, но не ограничиваясь, соли минеральных или органических кислот основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как карбоновые кислоты; и тому подобное. Фармацевтически приемлемые соли включают обычные нетоксичные соли и четвертичные аммониевые соли исходного соединения, образованные, например, из нетоксичных неорганических или органических кислот. Например, обычные соли нетоксичных кислот включают соли, полученные из неорганических кислот, таких как соляная, бромистоводородная, серная, сульфаминовая, фосфорная, азотная и подобных; и соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памоиновая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, мезиловая, эзиловая, безиловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изетионовая, HOOC-(CH2)n-COOH, где n равно 0-4 и подобных. Списки дополнительных подходящих солей можно найти, напр., в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., p. 1418 (1985).
Термин «носитель» применительно к фармацевтическим композициям/комбинациям по изобретению относится к разбавителю, эксципиенту или носителю, с которым предоставляется активное соединение.
Термин «фармацевтически приемлемый эксципиент» означает эксципиент, который пригоден для получения фармацевтической композиции/комбинации, который, как правило, безопасен, нетоксичен и ни биологически, ни иным образом не является нежелателеным, и включает эксципиент, который приемлем для применения в ветеринарии, а также в фармацевтических целях для человека. «Фармацевтически приемлемый эксципиент», как используется в настоящем документе, включает как один, так и более чем один такой эксципиент.
«Пациент» представляет собой человека или не человеческое животное, нуждающегося в медицинском лечении. Медицинское лечение может включать лечение существующего состояния, такого как заболевание или расстройство, профилактическое лечение или лечение для предотвращения, или диагностическое лечение. В некоторых вариантах выполнения изобретения пациент представляет собой пациента-человека.
«Предоставление» означает подачу, введение, продажу, распространение, передачу (с целью получения прибыли или нет), производство, компаундирование или диспергирование.
«Получение соединения Формулы I по меньшей мере с одним дополнительным активным агентом» означает соединение Формулы I и дополнительный активный агент(ы) предоставлены одновременно в одной лекарственной форме, предоставлены одновременно в виде отдельных лекарственных форм или предоставлены, в отдельных лекарственных формах для введения, разделенных промежутком времени, который находится в интервале времени, в котором соединение Формулы I и по меньшей мере один дополнительный активный агент находится в потоке крови пациента. В некоторых вариантах выполнения изобретения соединение Формулы I и дополнительный активный агент не должны быть предписаны для пациента одним и тем же работником медицинской помощи. В некоторых вариантах выполнения изобретения дополнительный активный агент или агенты не должны требовать рецепта. Введение соединения Формулы I или по меньшей мере одного дополнительного активного агента может происходить с помощью любого соответствующего пути, например, в пероральных таблетках, в пероральных капсулах, в пероральных растворах, ингаляцией, инъекцией, суппозиторием или местным контактом.
«Лечение», как используется в настоящем документе, включает предоставление соединения Формулы I либо в качестве единственного активного агента, либо вместе с по меньшей мере одним дополнительным активным агентом, достаточное, чтобы: (а) предотвратить заболевание или симптом заболевания у пациента, который может быть предрасположен к заболеванию, но еще не установлено, что он ему подвержен (напр., в том числе заболевания, которые могут быть связаны с или вызваны первичным заболеванием (как при макулярной дегенерацией, что может быть результатом в контексте активации фактора D); (b) ингибировать заболевание, т.е. задержать его развитие, и (с) облегчить заболевание, т.е. вызвать регрессию заболевания. Термины «лечение» и «лечить» также означают предоставление терапевтически эффективного количества соединения Формулы I в качестве единственного активного агента либо вместе с по меньшей мере одним дополнительным активным агентом пациенту, имеющему или восприимчивому к состоянию, опосредованному фактором D комплемента.
Термин «терапевтически эффективное количество» фармацевтической композиции/комбинации по настоящему изобретению означает количество, эффективное при введении пациенту, для обеспечения терапевтической пользы, такой как улучшение симптомов, напр., количество, эффективное для снижения симптомов макулярной дегенерации. Терапевтически эффективное количество представляет собой также количество, достаточное для предотвращения значительного увеличения или значительного уменьшения обнаруживаемого уровня комплемента фактора D в крови, сыворотке или тканях пациента.
Химическое Описание
В дополнение к соединениям Формулы I, приведенным в разделе СУЩНОСТЬ ИЗОБРЕТЕНИЯ, настоящее изобретение также включает соединения, в которых переменные, напр., А, В, L, R1-R3' и L имеют следующие определения. Описание включает все комбинации этих определений, приводящие к стабильным соединениям.
Например, раскрытие включает соединения и соли Формул II, III, IV, V, VI, VII, VIII, IX, X, XI, XII, XIII, XIV, XV, XVI, XVII, XVIII, XIX, XX, XXI и XXII, которые входят в объем Формулы I. Переменные, указанные в Формулах II-XXIV, имеют определения, изложенные в разделе СУЩНОСТЬ ИЗОБРЕТЕНИЯ для Формулы I или любые из определений, изложенных в настоящем описании. 
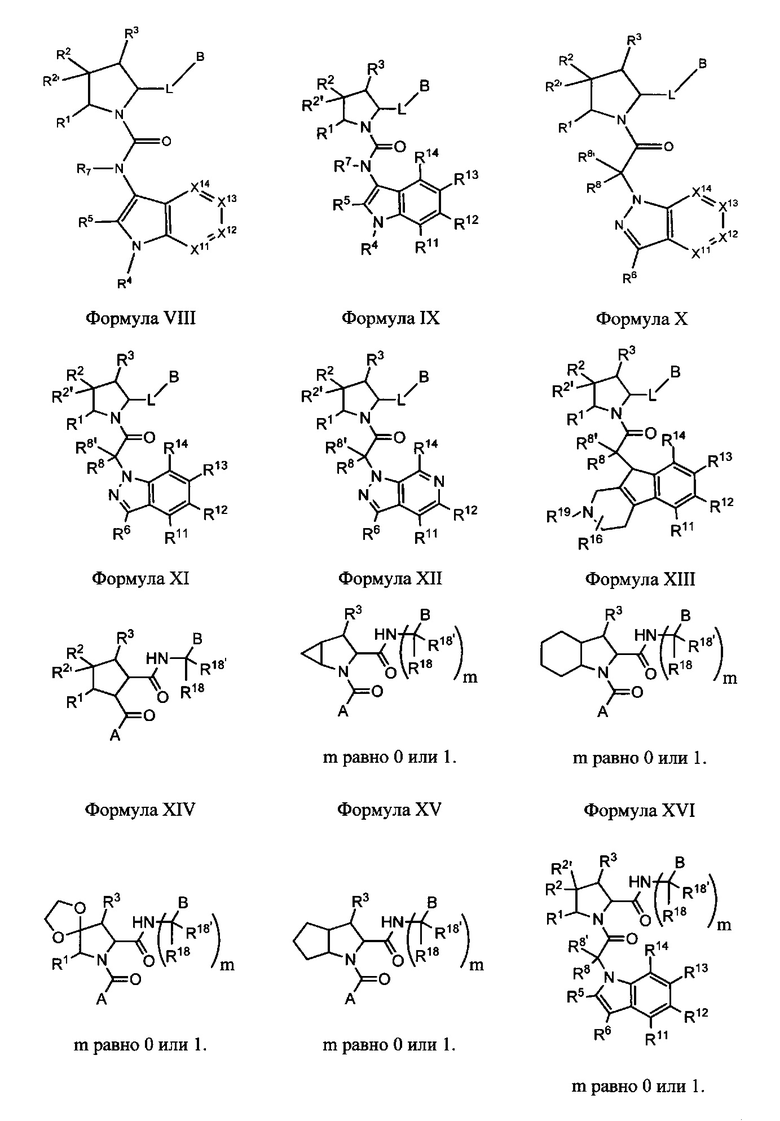

Кроме того, изобретение включает соединения и соли Формулы I и любых ее подформул (II-XXIV), в которых выполняется по меньшей мере одно из следующих условий.
R1, R1', R2', R3 и R3', если присутствуют, все представляют собой водород; и R2 представляет собой фтор.
R1, R1', R2' и R3', если присутствуют, все представляют собой водород; и R2 представляет собой фтор и R3 представляет собой -C0-C4алкил(C3-C7циклоалкил) или -O-C0-C4алкил(C3-C7циклоалкил.
R1 и R2, взятые вместе, образуют от 3- до 6-членную циклоалкильную группу, и R1', R2', R3 и R', где присутствуют, все представляют собой водород.
R1, R1', R3 и R3', если присутствуют, все представляют собой водород, и R2 и R2', взятые вместе, образуют 5- или 6-членную гетероциклоалкильную группу, имеющую 1 или 2 атома кислорода.
-L-B- представляет собой
 или
или 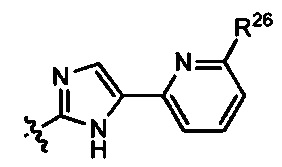 , где
, где
R26 и R27 независимо выбраны из водорода, галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, C1-C6тиоалкила, -C0-C4алкил(моно- и ди-C1-C6алкиламино), -C0-C4алкил(C3-C7циклоалкила), -C0-C4алкокси-(C3-C7циклоалкила), C1-С2галогеналкила, C1-C2галогеналкокси и C1-С2галогеналкилтио.
(f) -L-B- представляет собой;
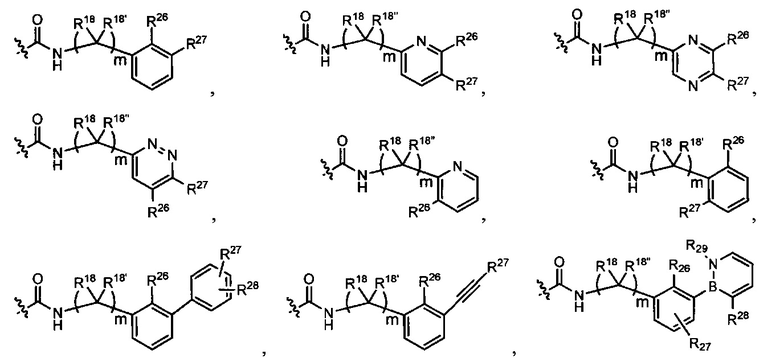 или
или  ; где
; где
R18 и R18' независимо выбраны из водорода, галогена и метила; и m представляет собой 0 или 1; и
R26, R27 и R28 независимо выбраны из водорода, галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, C1-C6тиоалкила, (моно- и ди-C1-C6алкиламино)C0-C4алкила, (C3-C7циклоалкила)C0-C4алкила и -C0-C4алкокси(C3-C7циклоалкила); каждый из R26, R27 и R28, отличающийся от водорода, галогена, гидроксила, нитро, циано, является незамещенным или замещенным одним или более заместителями, независимо выбранными из галогена, гидроксила, амино, C1-С2алкокси, C1-С2галогеналкила и C1-C2галогеналкокси; и
R29 представляет собой водород, C1-С2алкил, C1-С2галогеналкил или -Si(CH3)2C(CH3)3.
(g) R8 и R8' независимо представляют собой водород или метил.
(h) R8 и R8' представляют собой водород.
(i) R7 представляет собой водород или метил,
(j) R7 представляет собой водород.
(k) Один из R12 и R13 выбран из водорода, галогена, гидроксила, амино, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, C1-C6тиоалкила, -C0-C4алкил(моно- и ди-C1-C6алкиламино), -C0-C4алкил(C3-C7циклоалкила), -ОC0-C4алкил(C3-C7циклоалкила), C1-C2галогеналкила и C1-С2галогеналкокси.
(l) R1, R1', R2 и R3' все представляют собой водород;
R2 представляет собой фтор и R3 представляет собой водород, -C0-C4алкил(C3-C7циклоалкил) или -O-C0-C4алкил(C3-C7циклоалкил);
R5 представляет собой водород, галоген или C1-С2алкил;
R11, R13 R14 и R15, если присутствуют, независимо выбраны в каждом случае из водорода, галогена, гидроксила, амино, C1-C4алкила, C1-C4алкокси, -C0-C2алкил(моно- и ди-C1-C2алкиламино), трифторметила и трифторметокси;
X12 представляет собой CR12; и
R12 представляет собой -JNR9C(O)OR10, -JNR9C(O)OR23, -JOC(O)NR21R22, -JOC(O)NR24R25, -JNR9C(O)NR10R23 или -JNR9C(O)NR24R25.
(m) J представляет собой связь,
(n) Один из R12 и R13 выбран из


где p равно 0, 1, 2, 3 или 4.
(о) Раскрытие включает соединения и соли для Формулы VII
 , где:
, где:
R1, R2, R2' и R3 независимо выбраны из водорода, галогена, C1-C4алкила, C1-C4алкокси, -C0-C2алкилNR9R10, -C0-C4алкил(C3-C7циклоалкила), -O-C0-C4алкил(C3-C7циклоалкила, C1-C2галогеналкила и C1-C2галогеналкокси;
R8 и R8' независимо выбраны из водорода, галогена и метила;
R5 представляет собой водород, гидроксил, циано, -COOH, C1-C6алкил, C1-C6алкокси, C2-C6алканоил -C0-C4алкил(C3-C7циклоалкил), -С(O)C0-C4алкил(C3-C7циклоалкил, C1-C2галогеналкил или C1-C2галогеналкокси;
R6 представляет собой -C(O)CH3, -C(O)NH2, -C(O)CF3, -С(O)(циклопропил) или -этил(цианоимино); и
R11 и R14 независимо выбраны из водорода, галогена, гидроксила, амино, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, C1-C6тиоалкила, -C0-C4алкил(моно- и ди-C1-C6алкиламино), -C0-C4алкил(C3-C7циклоалкила), -ОC0-C4алкил(C3-C7циклоалкила), C1-C2галогеналкила и C1-C2галогеналкокси.
(p) В выбран из

где R27 представляет собой водород, метил или трифторметил; R28 представляет собой водород или галоген; и R29 представляет собой водород, метил, трифторметил или -Si(CH3)2C(CH3)3.
(q) В представляет собой фенил, пиридил или инданил, каждый из которых незамещен или замещен одним или более заместителями, независимо выбранными из водорода, галогена, гидроксила, нитро, циано, C1-C6алкила, C2-C6алкенила, C2-C6алканоила, C1-C6алкокси, C1-C6тиоалкила, (моно- и ди-C1-C6алкиламино)C0-C4алкила, (C3-C7циклоалкил)C0-C4алкила, -C0-C4алкокси(C3-C7циклоалкила), (фенил)C0-C2алкила, (пиридил)C0-C2алкила; каждый из заместителей, отличающихся от водорода, галогена, гидроксила, нитро, циано, является незамещенным или замещенным одним или несколькими заместителями, независимо выбранными из галогена, гидроксила, амино, С1-С2алкила, С1-С2алкокси, -OSi(CH3)2C(CH3)3, -Si(CH3)2C(СН3)3, C1-С2галогеналкила и C1-С2галогеналкокси.
(r) В представляет собой фенил или пиридил, замещенный 1, 2 или 3 заместителями, выбранными из хлора, брома, гидроксила, -SCF3, C1-С2алкила, C1-С2алкокси, трифторметила и трифторметокси.
(s) А представляет собой группу формулы
 или
или  .
.
(t) -L-B представляет собой связь и инданильную группу формулы
 or
or 
Настоящее изобретение дополнительно включает варианты выполнения изобретения, в которых m равно 0 или 1;
R2 представляет собой галоген, R2' представляет собой водород или галоген, и R3 представляет собой водород, галоген, -C0-C4алкил(C3-C7циклоалкил) или -О-C0-C4алкил(C3-C7циклоалкил;
R6 представляет собой -C(O)C1-C4алкил, -C(O)NH2, -C(O)CF3, -C(O)(C3-С7циклоалкил) или -этил(цианоимино);
один из R12 и R13 выбран из водорода, галогена, C1-C4алкила, C1-C4алкокси, трифторметила и трифторметокси; другой из R12 и R13 выбирается из (s),
где (s) представляет собой C2-C6алкинил, -C2-C6алкинилR23, C2-C6алканоил, -JC3-С7циклоалкил, -B(ОН)2, -JC(O)NR9R23, -JOSO2OR21, -C(O)(CH2)1-4S(O)R21, -O(CH2)1-4S(O)NR21NR22, -JOP(O)(OR21)(OR22), -JP(O)(OR21)(OR22), -JOP(O)(OR21)R22, -JP(O)(OR21)R22, -JOP(O)R21R22, -JP(O)R21R22, -JSP(O)(OR21)(OR22), -JSP(O)(OR21)(R22), -JSP(O)(R21)(R22), -JNR9P(O)(NHR21)(NHR22), -JNR9P(O)(OR21)(NHR22), JNR9P(O)(OR21)(OR22), -JC(S)R21, -JNR21SO2R22, -JNR9S(O)NR10R22, JNR9SO2NR10R22, -JSO2NR9COR22, -O(CH2)1-4SO2NR21R22, -JSO2NR9CONR21R22, -JNR21SO2R22, JC(O)NR21SO2R22, -JC(NH2)NCN, -JC(NH2)NR22, -JC(NH2)NS(O)2R22, -JOC(O)NR21R22, -JOC(O)NR24R25, -JNR9C(O)OR10, -JNR9C(O)OR23, -JNR21OC(O)R22, -(CH2)1-4C(O)NR21R22, -JNR9C(O)R21, -JC(O)R21, -JNR9C(O)NR9R10, -JNR9C(O)NR10R23, -JNR9C(O)NR24R25, -CCR21, -(CH2)1-4OC(O)R21, -JC(O)OR23, -C2-C4алкилR23 и -Jпарациклофан; где J независимо выбран в каждом случае и представляет собой ковалентную связь, C1-C4алкилен, C2-C4алкенилен или C2-C4алкинилен;
R21 и R22 независимо выбраны в каждом случае из водорода, гидроксила, циано, амино, C1-C6алкила, C1-C6алкила, C1-C6алкокси, (C3-C7циклоалкил)C0-C4алкила, (фенил)C0-C4алкила, -C1-C4алкилОС(O)ОC1-C6алкила, -C1-C4алкилОС(O)C1-C6алкила, -C1-С4алкилС(O)ОC1-C6алкила, (4-7-членный гетероциклоалкил)C0-C4алкила, имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, и (5- или 6-членный ненасыщенный или ароматический гетероциклоалкил)C0-C4-алкил, имеющий 1, 2 или 3 гетероатома, независимо выбранных из N, О и S;
R23 независимо выбран в каждом случае из (C3-C7циклоалкил)C0-C4алкила, (фенил)C0-C4алкила, (4-7-членный гетероциклоалкил)C0-C4алкила, имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, и (5- или 6-членный ненасыщенный или ароматический гетероцикл)C0-C4алкила, имеющего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S;
R24 и R25, взятые вместе с атомом азота, к которому они присоединены, образуют от 4- до 7-членную моноциклическую гетероциклоалкилую группу или 6-10-членную бициклическую гетероциклоалкильную группу, имеющую конденсированные, спиро или мостиковые кольца; каждый из (s) может быть незамещен или замещен одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, амино, оксо, -B(ОН)2, -Si(CH3)3, -COOH, -CONH2, -P(O)(ОН)2, C1-C6алкила, C1-C6алкокси, -C0-C2алкил(моно- и ди-C1-C4алкиламино), С1-C6алкилэфира, C1-C4алкиламино, C1-C4гидроксилалкила, C1-C2галогеналкила и C1-С2галогеналкокси.
(r) Настоящее изобретение включает соединения и соли, в которых один из R12 и R13 представляет собой водород, гидроксил, галоген, метил или метокси; а другой
R12 и R13 независимо выбирают из (s), где (s) представляет собой C2-C6алкинил, -C2-C6алкинилR23, C2-C6алканоил, -JC3-C7циклоалкил, -JC(O)NR9R23, -C(O)(CH2)1-4S(O)R21, -JP(O)(OR21)(OR22), -JOP(O)(OR21)R22, -JP(O)(OR21)R22, -JOP(O)R21R22, -JP(O)R21R22, -JNR21SO2R22, -JNR21SO2R22, -JC(O)NR21SO2R22, -JC(NH2)NCN, -JC(NH2)NR22, -JC(NH2)NS(O)2R22, -JOC(O)NR21R22, -JOC(O)NR24R25, -JNR9C(O)OR10, -JNR9C(O)OR23, -JNR21OC(O)R22, -JC(O)R21, -JNR9C(O)NR9R10, -JNR9C(O)NR10R23, -JNR9C(O)NR24R25 и -Jпарациклофан; где J независимо выбран в каждом случае и представляет собой ковалентную связь, C1-C4алкилен, C2-C4алкенилен или C2-C4алкинилен;
R21 и R22 независимо выбраны в каждом случае из водорода, гидроксила, циано, амино, C1-C6алкил, C1-C6алкила, C1-C6алкокси, (C3-C7циклоалкил)C0-C4алкила, (фенил)C0-C4алкила, -C1-C4алкилОС(O)ОC1-C6алкила, -C1-C4алкилОС(O)C1-C6-алкила, -C1-С4алкилС(O)ОС1-C6алкила, (пирролидинил)C0-C4алкила, ((морфолинил)C0-C4алкила, (тиоморфолинил)C0-C4алкила, (пиперидинил)C0-C4алкила, (пиперазинил)C0-C4алкила, (тетрагидрофуранил)C0-C4алкила, пиразолил)C0-C4алкила, (тиазолил)C0-C4алкил, (триазолил)C0-C4алкила, (тетразолил)C0-C4алкила, (имидазолил)C0-C4алкила, (оксазолил)C0-C4алкила, (фуранил)C0-C4алкила, (пиридинил)C0-C4алкила, (пиримидинил)C0-C4алкила, (пиразинил)C0-C4алкила, (пиридизинил)C0-C4алкила и (тетрагидропиридинил)C0-C4алкила;
R23 независимо выбран в каждом случае из (C3-C7циклоалкил)C0-C4алкила, (фенил)C0-C4алкила, (пирролидинил)C0-C4алкила, (морфолинил)C0-C4алкила, (тиоморфолинил)C0-C4алкила, (пиперидинил)C0-C4алкила, (пиперазинил)C0-C4алкила, (тетрагидрофуранил)C0-C4алкила, (пиразолил)C0-C4алкила, (тиазолил)C0-C4алкила, (триазолил)C0-C4алкила, (тетразолил)C0-C4алкила, (имидазолил)C0-C4алкила, (оксазолил)C0-C4алкила, (фуранил)C0-C4алкила, (пиридинил)C0-C4алкила, (пиримидинил)C0-C4алкиал, (пиразинил)C0-C4алкила, (пиридизинил)C0-C4алкила и (тетрагидропиридинил)C0-C4алкила;
R24 и R25, взятые вместе с атомом азота, к которому они присоединены, образуют пирролидинильнуь, пиперазинильную, пиперидинильную или морфолинильную группу, каждая из которых необязательно соединена мостиком с метиленовой или этиленовой группой или спиро с группой C3-C5циклоалкил;
каждый из (s) может быть незамещен или замещен одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, амино, оксо, -B(ОН)2, -Si(CH3)3, -COOH, -CONH2, -P(O)(ОН)2, C1-C6алкила, C1-C6алкокси, -C0-C2алкил(моно- и ди-C1-C4алкиламино), C1-C6алкилэфира, C1-C4алкиламино, C1-C4гидроксилалкила, C1-С2галогеналкила и C1-C2галогеналкокси.
Настоящее раскрытие включает соединения и соли, в которых один из R12 и R13 представляет собой водород, гидроксил, галоген, метил или метокси; а другой из R12 и R13 выбран из (s), где (s) представляет собой -JP(O)(OR21)(OR22), -JOP(O)(OR21)R22, -JP(O)(OR21)R22, -JOP(O)R21R22 или -JP(O)R21R22;
где J независимо выбран в каждом случае и представляет собой ковалентную связь, C1-C4алкилен, C2-C4алкенилен или C2-C4алкинилен;
R21 и R22 независимо выбраны в каждом случае из водорода, гидроксила, циано, амино, C1-C6алкила, C1-C6алкила, C1-C6алкокси, (C3-C7циклоалкил)C0-C4алкила, (фенил)C0-C4алкила и -C1-C4алкилОС(O)ОC1-C6алкила, -C1-C4алкилОС(O)C1-C6алкила, -C1-С4алкилС(O)ОС1-C6алкила;
каждый из (s) может быть незамещенным или замещенным одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, амино, оксо, -B(ОН)2, -Si(CH3)3, -COOH, -CONH2, -P(O)(ОН)2, C1-C6алкила, C1-C6алкокси, -С0-С2алкил(моно- и ди-C1-C4алкиламино), C1-C6алкилэфира, C1-C4алкиламино, C1-С4гидроксилалкила, C1-C2галогеналкила и C1-C2галогеналкокси.
Настоящее раскрытие включает соединения и соли, в которых один из R12 и R13 представляет собой водород, гидроксил, галоген, метил или метокси; а другой из R12 и R13 представляет собой C2-C6алкинилR23; где
R23 представляет собой (C3-C7циклоалкил)C0-C4алкил, (фенил)C0-C4алкил, (пирролидинил)C0-C4алкил, (морфолинил)C0-C4алкил, (тиоморфолинил)C0-C4алкил, (пиперидинил)C0-C4алкил, (пиперазинил)C0-C4алкил, (тетрагидрофуранил)C0-C4алкил, (пиразолил)C0-C4алкил, (тиазолил)C0-C4алкил, (триазолил)C0-C4алкил, (тетразолил)C0-C4алкил, (имидазолил)C0-C4алкил, (оксазолил)C0-C4алкил, (фуранил)C0-C4алкил, (пиридинил)C0-C4алкил, (пиримидинил)C0-C4алкил, (пиразинил)C0-C4алкил, (пиридизинил)C0-C4алкил и (тетрагидропиридинил)C0-C4алкил; который может быть незамещенным или замещенным одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, амино, оксо, -В(ОН)2, -Si(CH3)3, -COOH, -CONH2, -Р(O)(ОН)2, C1-C6алкила, C1-C6алкокси, -C0-C2алкил(моно- и ди-C1-С4алкиламино), C1-C6алкилэфира, C1-C4алкиламино, C1-C4гидроксилалкила, C1-С2галогеналкила и C1-C2галогеналкокси.
Настоящее раскрытие включает соединения и соли, в которых один из R12 и R13 представляет собой водород, гидроксил, галоген, метил или метокси; а другой из R12 и R13 выбирают из (s), где (s) выбирают из -JNR9C(O)OR10, -JNR9C(O)OR23, -JOC(O)NR21R22, JOC(O)NR24R25, JNR9C(O)NR10R23 и -JNR9C(O)NR24R25;
R21 и R22 независимо выбраны в каждом случае из водорода, гидроксила, циано, амино, C1-C6алкила, C1-C6алкила, C1-C6алкокси, (C3-C7циклоалкил)C0-C4алкила, (фенил)C0-C4алкила, -C1-C4алкилОС(O)ОC1-C6алкила, -C1-C4алкилОС(O)C1-C6алкила, -C1-C4алкилС(O)ОС1-C6алкила, (пирролидинил)C0-C4алкила, (морфолинил)C0-C4алкила, (тиоморфолинил)C0-C4алкила, (пиперидинил)C0-C4алкила, (пиперазинил)C0-C4алкила, (тетрагидрофуранил)C0-C4алкила, (пиразолил)C0-C4алкила, (тиазолил)C0-C4алкила, (триазолил)C0-C4алкила, (тетразолил)C0-C4алкила, (имидазолил)C0-C4алкила, (оксазолил)C0-C4алкила, (фуранил)C0-C4алкила, (пиридинил)C0-C4алкила, (пиримидинил)C0-C4алкила, (пиразинил)C0-C4алкила, (пиридизинил)С0-С4алкила и (тетрагидропиридинил)C0-C4алкила;
R23 независимо выбран в каждом случае из (C3-C7циклоалкил)C0-C4-алкила, (фенил)C0-C4алкила, (пирролидинил)C0-C4алкила, (морфолинил)C0-C4алкила, (тиоморфолинил)C0-C4алкила, (пиперидинил)C0-C4алкила, (пиперазинил)C0-C4алкила, (тетрагидрофуранил)C0-C4алкила, (пиразолил)C0-C4алкила, (тиазолил)C0-C4алкила, (триазолил)C0-C4алкила, (тетразолил)C0-C4алкила, (имидазолил)C0-C4алкила, (оксазолил)C0-C4алкила, (фуранил)C0-C4алкила, (пиридинил)C0-C4алкила, (пиримидинил)C0-C4алкила, (пиразинил)C0-C4алкила, (пиридизинил)C0-C4алкила и (тетрагидропиридинил)C0-C4алкила;
R24 и R25 вместе с атомом азота, к которому они присоединены, образуют пирролидинильную, пиперазинильную, пиперидинильную или морфолинильную группу, каждая из которых необязательно соединена мостиком с метиленовой или этиленовой группой или спиро с группой C3-C5циклоалкил; каждый из (s) может быть незамещенным или замещенным одним или более заместителями, независимо выбранными из галогена, гидроксила, нитро, циано, амино, оксо, -B(ОН)2, -Si(CH3)3, -COOH, -CONH2, -P(O)(ОН)2, C1-C6алкила, C1-C6алкокси, -C0-C2алкил(моно- и ди-C1-C4алкиламино), C1-C6алкилэфира, C1-C4алкиламино, C1-C4гидроксилалкила, C1-C2галогеналкила и C1-C2галогеналкокси.
Настоящее изобретение включает соединения и соли Формулы IA:
 , где
, где
В может иметь любое из определений, изложенных в настоящем документе для этой переменной. В некоторых вариантах выполнения изобретения B представляет собой 2-фтор-3-хлорфенил или 2-фтор-3-трифторметоксифенил. Примеры таких соединений включают соединения, представленные в Таблице 1. В любом из соединений, показанных в Таблице 1, 2-фтор-3-хлор-фенильная группа может быть заменена на 2-фтор-3-трифторметокси-фенил.
Настоящее раскрытие включает соединения и соли Формулы IB, IC и ID.

В Формуле IB, IC и ID переменные могут включать любое из определений, изложенных в настоящем документе, которое приводит к образованию стабильного соединения. В некоторых вариантах выполнения изобретения для Формулы IB, IC и ID применяются следующие условия.
R1 представляет собой водород, и R2 представляет собой фтор.
R1 и R2 соединены с образованием 3-членного кольца.
m равно 0.
В представляет собой пиридил, необязательно замещенный галогеном, C1-С2алкокси и трифторметилом.
В представляет собой фенил, замещенный 1, 2 или 3 заместителями, независимо выбранными из галогена, C1-C2алкила, C1-C2алкокси, трифторметила и необязательно замещенного фенила.
R13 представляет собой водород, и R12 представляет собой -NHC(O)NR24R25.
R13 представляет собой водород, и R12 представляет собой -CCR23.
R13 представляет собой водород, и R12 представляет собой -NHC(O)NHR23.
R13 представляет собой водород, и R12 представляет собой -C(O)R23.
Эта спецификация была описана со ссылкой на варианты выполнения изобретения. Тем не менее, среднему специалисту в данной области техники будет очевидно, что могут быть сделаны различные модификации и изменения без отступления от объема настоящего изобретения, как изложено ниже в формуле изобретения. Соответственно, описание следует рассматривать в иллюстративном, а не ограничительном смысле, и все такие модификации должны быть включены в объем изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЁННЫЕ ПИРАЗОЛОПИРИМИДИНЫ КАК АКТИВАТОРЫ ГЛЮКОЦЕРЕБРОЗИДАЗЫ | 2011 |
|
RU2603637C2 |
| СОЕДИНЕННЫЕ МОСТИКОВОЙ СВЯЗЬЮ N-ЦИКЛИЧЕСКИЕ СУЛЬФОНАМИДО-ИНГИБИТОРЫ ГАММА-СЕКРЕТАЗЫ | 2006 |
|
RU2422443C2 |
| ИНГИБИТОРЫ КИНАЗЫ | 2012 |
|
RU2623734C9 |
| АРИЛЬНЫЕ, ГЕТЕРОАРИЛЬНЫЕ И ГЕТЕРОЦИКЛИЧЕСКИЕ ФАРМАЦЕВТИЧЕСКИЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ МЕДИЦИНСКИХ НАРУШЕНИЙ | 2018 |
|
RU2801278C2 |
| НЕМАТОЦИДНЫЕ СУЛЬФОНАМИДЫ | 2010 |
|
RU2531317C2 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ СОСТОЯНИЙ, АССОЦИИРОВАННЫХ С АКТИВНОСТЬЮ NLRP | 2019 |
|
RU2795108C2 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ СОСТОЯНИЙ, АССОЦИИРОВАННЫХ С АКТИВНОСТЬЮ NLRP | 2018 |
|
RU2786719C2 |
| НОВЫЕ СОЕДИНЕНИЯ, КОТОРЫЕ ЯВЛЯЮТСЯ ИНГИБИТОРАМИ ERK | 2013 |
|
RU2660429C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ОПОСРЕДОВАННЫХ КОМПЛЕМЕНТОМ НАРУШЕНИЙ | 2015 |
|
RU2703995C2 |
| 1,1,2,2-ТЕТРА (ГЕТЕРО) АРИЛЭТАНЫ ИЛИ 1,1,2-ТРИ (ГЕТЕРО) АРИЛ-2-ГЕТЕРОЦИКЛИЛЭТАНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ КАЛИЕВЫХ КАНАЛОВ | 2005 |
|
RU2344134C2 |
Заявлены соединения Формулы I или их фармацевтически приемлемые соли, их содержащая фармацевтическая композиция, способы лечения и применение этих соединений для получения лекарственного средства для лечения заболеваний, опосредованных фактором D комплемента. В формуле I символы и группы имеют значения, указанные в формуле изобретения. Описанные в настоящем документе ингибиторы воздействуют на фактор D и ингибируют или регулируют каскад комплемента в ранней и существенной точке альтернативного пути комплемента, и снижают способность фактора D модулировать классический и лектиновый пути комплемента. Описанные в настоящем документе ингибиторы фактора D способны снижать чрезмерную активацию комплемента, которая связана с определенными аутоиммунными, воспалительными и нейродегенеративными заболеваниями, а также ишемически-реперфузионными повреждениями и раком. 8 н. и 48 з.п. ф-лы, 2 табл., 6 пр.

1. Соединение Формулы I

или его фармацевтически приемлемые соли, где:
Q1 представляет собой C(R1R1');
Q2 представляет собой C(R2R2');
Q3 представляет собой C(R3R3');
X1 представляет собой N; и X2 представляет собой СН;
R1, R1', R2, R3 и R3' независимо выбраны из водорода, галогена и C1-С6алкила,
R2' представляет собой водород;
или R1 и R2 связаны с образованием 3-6-членного карбоциклического кольца;
А представляет собой группу, выбранную из:

R5 представляет собой водород;
R6 представляет собой -C(O)NH2 или С2-С6алканоил;
R8 и R8' независимо выбраны из водорода и C1-С6алкила;
X11 представляет собой CR11;
X12 представляет собой CR12;
X13 представляет собой CR13;
X14 представляет собой CR14;
R13 представляет собой водород;
R12 выбран из R32;
R32 выбран из фенила; насыщенного или ненасыщенного 6-членного гетероцикла, имеющего 1 и 2 атома азота, где гетероцикл связан через атом углерода в гетероциклическом кольце с атомом углерода кольца А в положении R12; и 5-6-членного гетероарила, имеющего 1 или 2 атома азота, где указанный фенил необязательно замещен галогеном или морфолинилом, указанный гетероцикл необязательно замещен C2-С6алканоилом, C1-С6алкилсульфонилом или пиримидинилом; и гетероарил необязательно замещен заместителем, выбранным из галогена, циано, гидроксила, С2-С6алканоила, C1-С6алкила, C1-С6алкокси, C1-С2галоалкила и пирролидинила;
R11 и R14 представляют собой водород;
L представляет собой 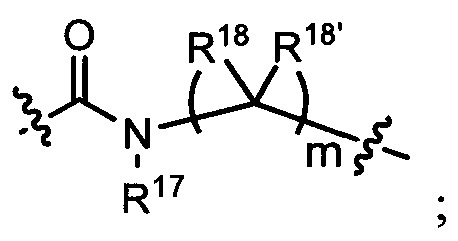
R17 представляет собой водород или C1-С6алкил;
R18 и R18' независимо выбраны из водорода и метила;
m равно 0 или 1;
В представляет собой моноциклическую или бициклическую карбоциклическую группу, имеющую 5-12 атомов углерода; моноциклическую или бициклическую гетероциклическую группу, имеющую 1, 2, 3 или 4 гетероатома, независимо выбранных из N, О и S, и от 5 до 6 кольцевых атомов на кольцо; фенил; 6-членный гетероарил с 1 или 2 атомами азота; или бифенил, причем каждый из указанных В не замещен или замещен одним или более заместителями, независимо выбранными из R33, и 0 или 1 заместителем, выбранным из R35 и R36;
R33 независимо выбран из галогена, гидроксила, C1-С6алкила, C1-С6алкокси, -С0-С4алкилNR9R10, C1-С2галогеналкила и C1-С2галогеналкокси;
R9 и R10 независимо выбраны из водорода и C1-С6алкила;
R35 независимо выбран из 5-6-членного гетероциклоалкила, содержащего 1 или 2 гетероатома, выбранных из N, О и S, и бициклического гетероцикла, содержащего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, и содержащего от 5 до 6 кольцевых атомов в каждом кольце; причем каждый из указанных R35 не замещен или замещен одним или более заместителями, независимо выбранными из галогена, гидроксила и C1-С6алкила; и
R36 независимо выбран из фенила, (фенил)С1-С2алкокси и 5- или 6-членного гетероарила, содержащего 1, 2 или 3 гетероатома, независимо выбранных из N, О и S, каждый из R36 не замещен или замещен одним или более заместителями, независимо выбранными из галогена и C1-С6алкила.
2. Соединение по п. 1, в котором кольцо
 представляет собой:
представляет собой: 
3. Соединение по п. 1, в котором кольцо
 выбирается из:
выбирается из: 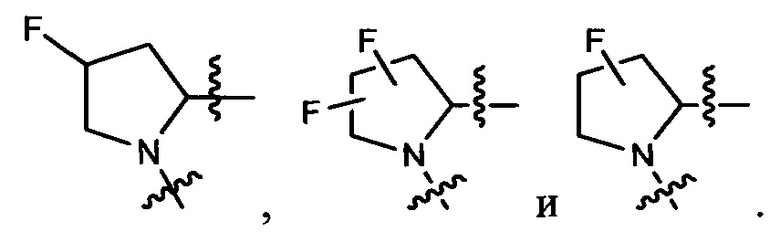
4. Соединение по п. 1, в котором А является группой, выбранной из:

5. Соединение по п. 1, в котором А является группой, выбранной из:

6. Соединение по п. 1, в котором фрагмент R32 имеет заместитель, выбранный из заместителей, указанных в п. 1.
7. Соединение по п. 1, в котором R32 представляет собой фенил, необязательно замещенный галогеном.
8. Соединение по п. 1, в котором необязательно замещенное гетероарильное кольцо R32 представляет собой пиримидинил, и необязательные заместители выбраны из галогена, циано, гидроксила, С2-С6алканоила, C1-С6алкила, C1-С6алкокси, C1-С2галоалкила и пирролидинила.
9. Соединение по п. 8, в котором необязательный заместитель представляет собой C1-С6алкил.
10. Соединение Формулы I
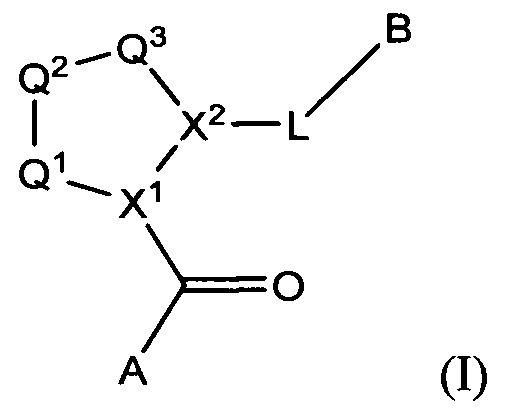
или его фармацевтически приемлемая соль, в котором:
 является таким, как определено в п. 1;
является таким, как определено в п. 1;
А является таким, как определено в п. 1; и
-L-B- выбирается из:

R18 и R18' независимо выбраны из водорода и метила;
m равно 0 или 1; и
R26, R27 и R28 независимо выбраны из водорода, галогена, гидроксила, C1-С6алкила, C1-С6алкокси, C1-С6тиоалкила, (моно- и ди-С1-С6алкиламино)С0-С4алкила, C1-С2галоалкила, С1-С2галоалкокси и 5- или 6-членного гетероарила, имеющего 1, 2 или 3 гетероатома, независимо выбранные из N, О и S, необязательно замещенного одним или более заместителями, независимо выбранными из галогена и C1-С6алкила.
11. Соединение по п. 1, в котором В выбирается из моноциклического карбоциклического или бициклического карбоциклического фрагмента, имеющего 5-12 атомов углерода, который не замещен или замещен одним или более заместителями, независимо выбранными из R33, и 0 или 1 заместителем, выбранным из R35 и R36.
12. Соединение по п. 11, в котором моноциклический карбоциклический фрагмент выбран из циклогексенила, циклогексила, циклопентенила и циклопентила.
13. Соединение по п. 1, в котором В выбирается из моноциклической или бициклической гетероциклической группы, имеющей 1, 2, 3 или 4 гетероатома, независимо выбранных из N, О и S, и от 5 до 6 кольцевых атомов на кольцо; где В является незамещенным или замещенным одним или более заместителями, независимо выбранными из R33, и 0 или 1 заместителем, выбранным из R35 и R36.
14. Соединение по п. 1, в котором В выбирается из фенила; 6-членного гетероарила с 1 атомом азота; или бифенила, где В является незамещенным или замещенным одним или более заместителями, независимо выбранными из R33, и 0 или 1 заместителем, выбранным из R35 и R36.
15. Соединение по п. 1, в котором В представляет собой:

16. Соединение по п. 1, в котором В выбирается из:
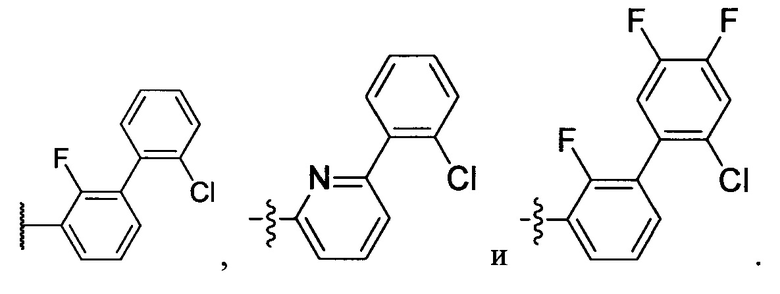
17. Соединение по п. 1, в котором R32 выбирается из:
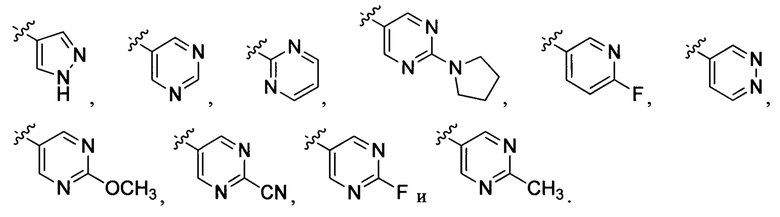
18. Соединение по п. 1, в котором R32 представляет собой:
19. Соединение по п. 1, в котором соединение выбирается из:

20. Соединение по п. 1, в котором соединение выбирается из:

21. Соединение по п. 1, в котором соединение выбирается из:

22. Соединение структуры:

или его фармацевтически приемлемая соль.
23. Способ лечения расстройства, опосредованного путем комплемента, включающий введение организму, нуждающемуся в этом, эффективного количества соединения, выбранного из любого по пп. 1-22, или его фармацевтически приемлемой соли, необязательно в фармацевтически приемлемом носителе.
24. Способ по п. 23, в котором расстройство является возрастной макулярной дегенерацией (AMD).
25. Способ по п. 23, в котором расстройство является дегенерацией сетчатки, офтальмологическим заболеванием, рассеянным склерозом, артритом или ХОБЛ.
26. Способ по п. 23, в котором расстройство является офтальмологическим заболеванием.
27. Способ по п. 23, в котором расстройство является пароксизмальной ночной гемоглобинурией (PNH).
28. Способ по п. 23, в котором расстройство является респираторным заболеванием.
29. Способ по п. 23, в котором расстройство является сердечно-сосудистым заболеванием.
30. Способ по п. 23, в котором расстройство является атипичным или типичным гемолитико-уремическим синдромом.
31. Способ по п. 23, в котором расстройство является ревматоидным артритом.
32. Способ по п. 23, в котором расстройство является гломерулонефритом С3.
33. Способ по п. 23, в котором расстройство представляет собой МПГН II.
34. Способ по любому из пп. 23-33, в котором хозяин является человеком.
35. Применение соединения по любому из пп. 1-22 для производства лекарственного средства для лечения расстройства, опосредованного Фактором D комплемента.
36. Соединение по любому из пп. 1-22 для применения в лечении расстройства, опосредованного Фактором D комплемента.
37. Применение по п. 35, в котором расстройство представляет собой пароксизмальную ночную гемоглобинурию (PNH).
38. Применение по п. 35, в котором расстройство представляет собой рассеянный склероз, артрит или ХОБЛ.
39. Применение по п. 35, в котором расстройство представляет собой офтальмологическое заболевание.
40. Применение по п. 35, в котором расстройство представляет собой респираторное заболевание.
41. Применение по п. 35, в котором расстройство представляет собой сердечнососудистое заболевание.
42. Применение по п. 35, в котором расстройство представляет собой атипичный или типичный гемолитико-уремический синдром.
43. Применение по п. 35, в котором расстройство представляет собой ревматоидный артрит.
44. Применение по п. 35, в котором расстройство представляет собой гломерулонефрит С3.
45. Применение по п. 35, в котором расстройство представляет собой МПГН II.
46. Применение по любому из пп. 35 или 37-45, в котором хозяин является человеком.
47. Соединение по п. 36, в котором расстройство является рассеянным склерозом, артритом, ревматоидным артритом или ХОБЛ.
48. Соединение по п. 36, в котором расстройство представляет собой респираторное заболевание.
49. Соединение по п. 36, в котором расстройство является сердечно-сосудистым заболеванием.
50. Соединение по п. 36, в котором расстройство является атипичным или типичным гемолитико-уремическим синдромом.
51. Соединение по п. 36, в котором расстройство является зрительным расстройством.
52. Соединение по п. 36, в котором расстройство является гломерулонефритом С3.
53. Соединение по п. 36, в котором расстройство представляет собой МПГН II.
54. Фармацевтическая композиция для лечения расстройства, опосредованного Фактором D комплемента, содержащая эффективное количество соединения, выбранного из любого по пп. 1-22, в фармацевтически приемлемом носителе.
55. Способ лечения расстройства, опосредованного Фактором D комплемента, включающий введение хозяину, нуждающемуся в этом, эффективного количества соединения или его фармацевтически приемлемой соли, необязательно в фармацевтически приемлемом носителе, где соединение представляет собой

56. Фармацевтическая композиция для лечения расстройства, опосредованного Фактором D комплемента, содержащая эффективное количество соединения в фармацевтически приемлемом носителе, где соединение представляет собой
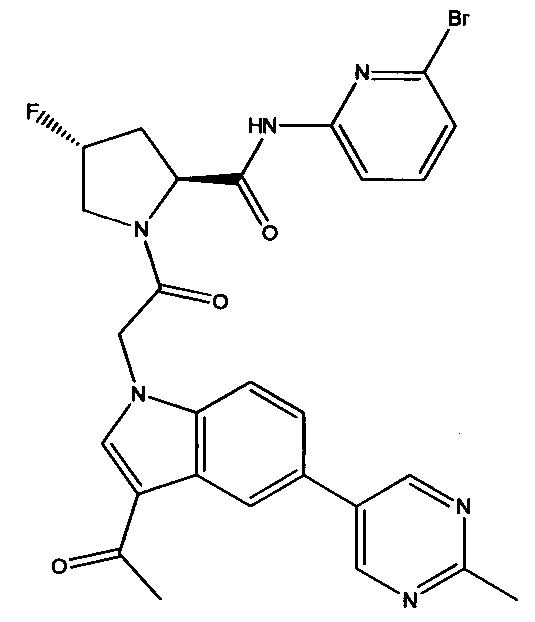
или его фармацевтическую приемлемую соль.
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| НОВЫЕ ПРОИЗВОДНЫЕ ИНДОЛА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ IκB КИНАЗЫ β | 2008 |
|
RU2470918C2 |
Авторы
Даты
2019-11-29—Публикация
2015-02-25—Подача