Предполагаемое изобретение относится к биотехнологии микроводорослей и может быть использовано для промышленного получения природного астаксантина из микроводоросли Haematococcus pluvialis.
Кетокаротиноид астаксантин (3,3'-дигидрокси-4,4'-дикето-β-каротин) является высоко ценным биологически активным соединением, проявляющим свойства иммуностимулятора, УФ- и радиопротектора, антиканцерогена, регулятора деятельности нервной, сердечно-сосудистой и эндокринной систем человека и животных. Полифункциональность физиологического действия астаксантина определяется его высокой антиоксидантной (АО) активностью, превышающей в системах in vivo АО-активность β-каротина и α-токоферола на порядок. Наиболее перспективным промышленным источником природного астаксантина является зеленая микроводоросль Haematococcus pluvialis, в клетках которой содержание пигмента может достигать 2-3% сухого вещества (СВ). При этом АО-активность астаксантина, продуцируемого водорослью, существенно выше активности синтетического аналога, благодаря преобладанию в составе изомеров природной формы 3S,3'S-изомера.
Использующиеся в настоящее время двухстадийные промышленные технологии получения астаксантина из Н. pluvialis предусматривают такой способ культивирования водоросли, при котором процессы роста и биосинтеза вторичных каротиноидов приурочены к разным стадиям клеточного цикла (вегетативной и спорогенеза) [см. Boussiba S. Carotenogenesis in the green alga Haematococcus pluvialis: Cellular physiology and stress response // Physiol. Plant. - 2000. - 108. - P. 111-11]. Ha первой («зеленой») стадии технологического процесса водоросль выращивают в контролируемых условиях, обеспечивающих максимальную скорость деления вегетативных клеток. На второй («красной») стадии, начинающейся с момента достижения культурами стационарной фазы роста, полученную биомассу переносят в условия, инициирующие образование апланоспор и накопление в них астаксантина. Трансформацию вегетативных клеток в апланоспоры и индукцию в последних вторичного каротиногенеза вызывают различными видами стресс-воздействия на культуры: увеличением освещенности, и температуры, дефицитом биогенных элементов или добавлением в среду различных химических соединений - активаторов свободно-радикального окисления [см. WO 97/28274, WO 2005/116238, ЕР 1760157, JP 3163127; ЕР 1724357]. В результате стресс-воздействия монадные эллипсоидные клетки приобретают сначала пальмеллевидную структуру (теряют жгутики, округляются и увеличиваются в размерах), а затем образуют апланоспоры, окруженные многослойной, устойчивой к химическому воздействию (щелочному и кислотному гидролизу), трудно разрушаемой механическими методами оболочкой, образованной целлюлозой и биополимером, аналогичным по структуре спорополленину, получившим название «альгенан». Созревание апланоспор сопровождается интенсивным накоплением моно- и диэфиров астаксантина в липидных включениях цитоплазмы. Продолжительность второй стадии культивирования, выход астаксантина из литра культуры и его содержание в биомассе варьируют в зависимости от методов индукции вторичного каротиногенеза.
Известные двухстадийные технологии культивирования H pluvialis, характеризуются рядом недостатков, определяющих высокую себестоимость получения астаксантина из H. pluvialis и ограничивающих непосредственное применение получаемой биомассы для производства БАД, продуктов питания и кормовых добавок. Наиболее существенные из них состоят в следующем:
1. Наличие у апланоспор прочных оболочек существенно затрудняет экстракцию астаксантина из биомассы при его получении в чистом виде, и обусловливает низкую биодоступность каротиноида для человека и млекопитающих при непосредственном употреблении биомассы в пищу из-за отсутствия в их желудочно-кишечном тракте ферментов, гидролизующих клетчатку и альгенан. Эти обстоятельства требуют применения комбинаций специальных энергоемких методов дезинтеграции клеток (измельчения биомассы до частиц размером менее 5-8 мкм) и приводят к использованию дорогостоящего и энергоемкого оборудования (шаровые мельницы, ультразвуковые дезинтеграторы, прессы и т.п.).
2. Индукция образования апланоспор и накопления в них астаксантина при помощи используемых в настоящее время методов стресс-воздействия на культуры вызывает значительные потери биомассы, полученной на I этапе, из-за массовой гибели вегетативных клеток (до 40-60%), что приводит к непроизводительным затратам на минеральные соли, электроэнергию и техническое обслуживание культиваторов.
3. Еще одним недостатком, требующим дополнительных капиталовложений, является агрегация пальмеллевидных клеток на начальном этапе второй стадии и оседание их на стенках культиваторов, приводящее к снижению интенсивности светового потока, проникающего во внутренний слой культуры. Это явление требует использования эрлифтов или мощных мембранных насосов для увеличения скорости турбулентного потока в культиваторах, а также обязательной чистки культиваторов перед каждым технологическим циклом (обработкой горячим паром под высоким давлением).
Известен способ одностадийного культивирования Н. pluvialis, при котором деление клеток и накопление в них астаксантина происходят на одной (вегетативной) стадии клеточного цикла [см. Del Rio Ε., Acien F.G., Garcia-Malea M.C., Rivas J., Molina- Grima E., Guerrero M.G. Efficient one-step production of astaxanthin by the microalga Haematococcus pluvialis in continuous culture // Biotechnol. and Bioeng. - 2005. - 91, №. 7. - P. 808-815]. Преимущество способа состоит в том, что вегетативные монадные клетки, обогащенные астаксантином, не имеют альгенановой трудноразрушаемой оболочки, благодаря чему повышается биодоступность каротиноида, снижаются затраты на измельчение биомассы и увеличивается выход астаксантина при его получении в чистом виде. Водоросль выращивают автотрофно методом непрерывной культуры на питательной среде с пониженным содержанием азота (1,7 мМ) при искусственном освещении люминесцентными лампами с интенсивностью светового потока в 1220 μЕ·м-2·с-1 и скорости протока среды (ω), равной 0,9·сут-1. Получаемая таким образом биомасса на 95% состоит из монадных и пальмеллевидных вегетативных клеток и на 5% - из апланоспор. Наиболее рациональным методом сбора биомассы в этом случае является центрифугирование. Содержание сухого вещества (СВ) в литре культуры составляет 0,7г, содержание астаксантина в биомассе - 0,8% СВ.
Указанная работа имеет принципиальное значение, так как подтверждает возможность получения биомассы Н. pluvialis, состоящей из вегетативных клеток, обогащенных астаксантином. Однако предложенный режим культивирования имеет существенные ограничения для использования в промышленных масштабах. Наиболее важными из них являются:
а) высокие затраты электроэнергии на создание светового потока интенсивностью 1220 μЕ·м-2·с-1 и ежедневный сбор биомассы путем центрифугирования (90% всего объема культуры);
б) более низкое содержание астаксантина в сухом веществе (0,7% СВ), по сравнению с использующимися в настоящее время вариантами двухстадийного метода культивирования водоросли (2-2,5% СВ);
Кроме того, в работе отсутствуют сведения о продолжительности стационарной фазы роста культур (т.е. продолжительности технологического цикла) и все данные, характеризующие продуктивность культур по биомассе и астаксантину, приведены для 5-х суток культивирования. Отсутствуют также и сведения о соотношении монадных и пальмеллевидных клеток в получаемой биомассе, имеющие важное значение для оценки ее биодоступности, так как оболочки пальмелл, так же как и оболочки апланоспор, содержат альгенан.
В основу изобретения Способ культивирования одноклеточной зеленой водоросли Haematococcus pluvialis поставлена задача повысить эффективность одностадийного способа культивирования Η. pluvialis путем снижения затрат на производство биомассы и повышения ее биологической ценности (биодоступности и содержания астаксантина).
Способ культивирования одноклеточной зеленой водоросли Haematococcus pluvialis для получения астаксантина основан на методе индукции биосинтеза астаксантина в монадных вегетативных клетках, а его модификация и подбор условий культивирования, исключающих образование апланоспор, обеспечивающих преобладание в культурах подвижных клеток над пальмеллевидными (более 80%) на протяжении 20-ти дневного технологического цикла и накопление в них астаксантина до уровня его обычного содержания в апланоспорах (не менее 2%), были выполненными авторами в лабораторных экспериментах.
Поставленная задача достигается тем, что культуру, выращенную на питательной среде МОНМ-1, в состоянии субстратного насыщения клеток по биогенным элементам вносят в количестве 0,3-0,35·107 кл·л-1 в питательную среду. Среда характеризуется 30-кратно пониженным содержанием азота (0,2 мМ·л-1) и фосфора (0,12 мМ·л-1) (среда МОНМ-2). В среду также однократно вносят 15 мМ ацетата натрия. Выращивание в течение 20 сут. осуществляют в полупроточном режиме (0,1-0,3 сут-1), поддерживая в среде МОНМ-2 заданный уровень азота и фосфора, при круглосуточном освещении люминесцентными лампами дневного света с интенсивностью светового потока 120 μЕ·м-2·с-1, непрерывной продувке воздухом (0,3 л·мин-1) и температуре 22-26°С,
Общим для прототипа и заявляемого способа является индукция биосинтеза астаксантина в монадных клетках. В отличие от прототипа, где индукция биосинтеза астаксантина осуществляется снижением концентрации только азота до 1,7 мМ·л-1 и резким увеличением освещенности до 1220 μЕ·м-2·с-1, в заявляемом способе проводится одновременно резкое снижение концентрации азота и фосфора до 0,2 Мм N л-1 и 0,01 мМ Ρ л-1 в сочетании с одноразовым увеличением молярного соотношения C/N в среде без существенного увеличения освещенности. Кроме того, в прототипе используется метод непрерывной культуры со скоростью протока 0,9 сут-1, а в заявляемом - метод полупроточной культуры со скоростью протока 0,1-0,3сут-1
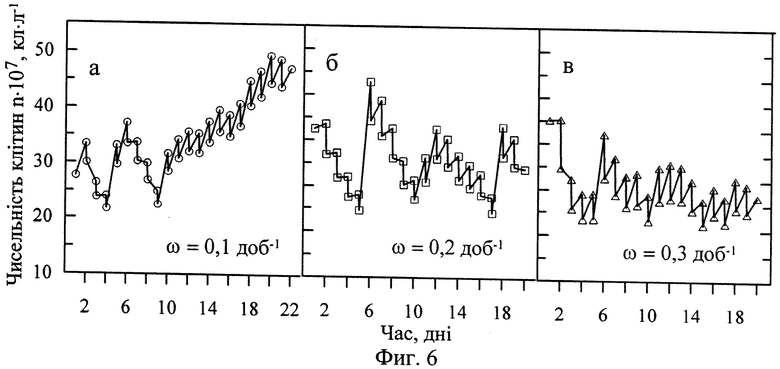
Изобретение поясняется иллюстрациями. Фиг. 1 - Динамика содержания суммарных каротиноидов и астаксантина в культурах и клетках H. pluvialis в зависимости от скорости протока питательной среды. Фиг. 2- Содержание каротиноидов (а) и астаксантина (б, в) в сухой биомассе в зависимости от скорости протока питательной среды. Фиг.3 - Средняя удельная скорость роста культур при различной скорости протока среды. Фиг. 4 - Динамика численности пальмеллевидных клеток в культурах при различной скорости протока среды. Фиг. 5 - Выход суммарных каротиноидов (а) и астаксантина (б) из литра культуры за 20-дневный технологический цикл в условиях одностадийной полупроточной культуры. Фиг.6 - Динамика биомассы в культурах Я. pluvialis (штамм HBSS-18) при различной скорости протока среды. Фиг. 7 - Выход суммарных каратиноидов и астаксантина из литра культуры в условиях двухстадийной культуры.
Способ культивирования одноклеточной зеленой водоросли Haematococcus pluvialis реализуется следующим образом:
Для культивирования может быть использован любой штамм Haematococcus pluvialis, например CALU-79, С ALU 333, CAUP G1002, ССАР 34/1D, ССАР 213/4, SAG 34-1d, SAG 213-4, UTEX 113, IBSS-18 при предпочтительности крупноклеточных штаммов. Их коллекционное хранение осуществляют на агаризованной (1.5%) базовой среде OHM (табл.1) при освещенности 1000-1500 Лк, и температуре 15-18°С с пересевом каждые 1,5-2 месяца. 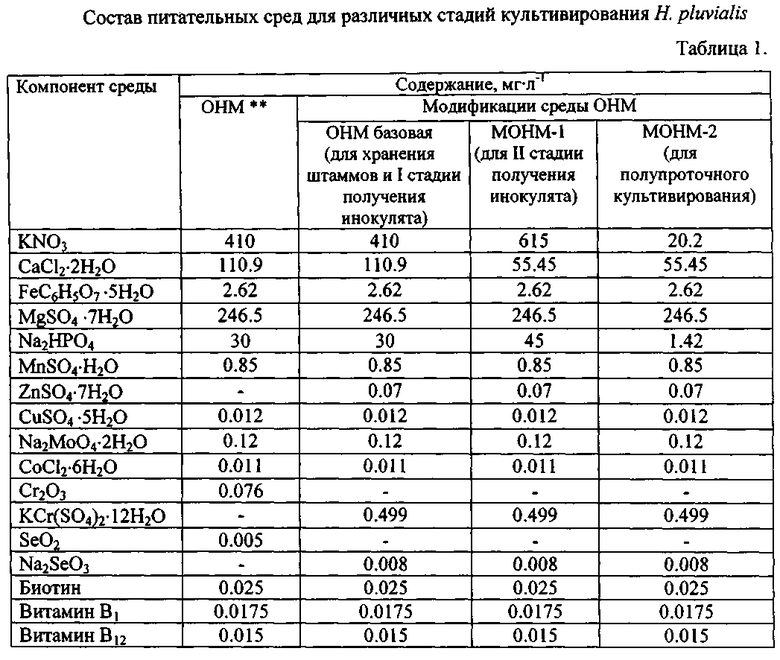
Примечание: **-[см. Fdbregas J., Domiguez Α., Regueiro Μ, MasedaA., Otero Α. Optimization of culture medium for the continuous cultivation of the microalga Haematococcus pluvialis // Appl. Microbiol. Biotechnol. - 2000 - 53. - P. 530-535]
Получение инокулята. Для получения инокулята водоросль с агаризованных косяков переносят в жидкую стерильную базовую среду OHM и 5-7 дней выращивают методом накопительной культуры при рассеянном естественном освещении. Затем культуру переносят в среду МОНМ-1 (см. табл.1) и продолжают культивировать при искусственном освещении люминесцентными лампами дневного света (50-60 μЕ·м-2·с-1 16 час свет: 8 час темнота) в накопительном режиме при непрерывном барботаже воздухом со скоростью 0,1-0,2 л·мин-1. Для засева культиваторов используют активно делящуюся культуру, взятую на логарифмической стадии роста, когда все клетки имеют монадную структуру и остаточное содержание азота и фосфора составляет не ниже 40% исходного уровня в среде МОНМ-1. Суспензию клеток концентрируют и вносят в культиваторы из такого расчета, чтобы начальная плотность культур составляла 3-3,5·108 кл·л-1 или 0,3-0,4 г·л-1 сухого вещества.
Процесс культивирования. Питательной средой для предлагаемого способа культивирования служит среда МОНМ-2, в которую однократно сразу после засева культиваторов добавляют ацетат натрия до концентрации 15 мМ·л-1. Выращивание водоросли осуществляют при непрерывном освещении интенсивностью 120 μЕ·м-2·с-1, скорости продувки воздухом 0,2-0,3 л·мин-1 и температуре питательной среды 22-26°С. С интервалом в 24 часа из культиваторов отбирают 10-30% объема культуры, заменяя его равноценным объемом свежей среды и восстанавливая при этом исходный уровень азота (0,2 мМ·л-1) и фосфора (0,01 мМ·л-1).
Создание резкого отрицательного градиента концентраций азота и фосфора (не менее чем 10-кратного) в сочетании с увеличением молярного соотношения C/N в среде до 150 приводит к индукции биосинтеза астаксантина в вегетативных клетках Я. pluvialis при освещенности на порядок более низкой, чем в прототипе (фиг.1).
Содержание астаксантина в сухой биомассе в процессе культивирования увеличивается до 2,2-2,8% сухого вещества (фиг.2б), т.е. до уровня, обычно регистрируемого в биомассе апланоспор при двухстадийном культивировании H. pluvialis -2-3 % СВ. Его доля в суммарных каротиноидах, начиная с 10-х суток составляет 70-80 % (Фиг. 2 в).
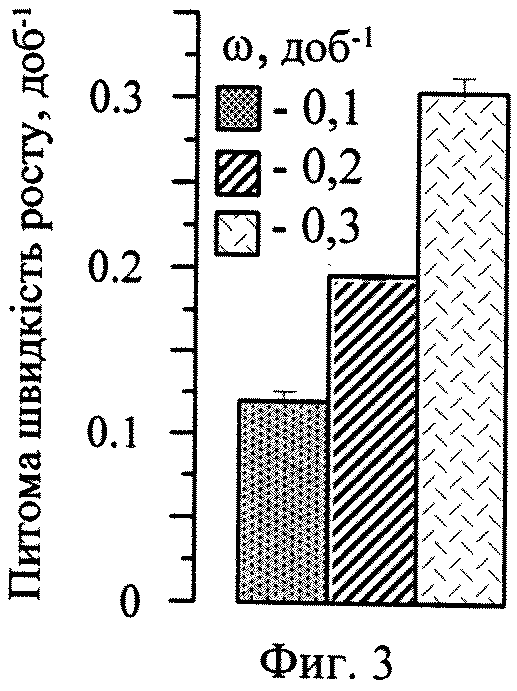
Ежедневное восполнение начального уровня нитратов и фосфатов обеспечивает поддержание клеток в культурах в вегетативном состоянии. Средняя за 20 суток удельная скорость роста астаксантин-продуцирующих культур составляет 0,12-0,3 сут-1 (фиг. 3), что сопоставимо со скоростью роста автотрофных накопительных культур на первой («зеленой») стадии 2-х стадийной технологии культивирования (0,1- 0,35 сут-1). При этом 80-90 % астаксантин-содержащих клеток на протяжении периода не менее 20-ти суток сохраняют монадную структуру, а апланоспоры в культурах отсутствуют (фиг.4).
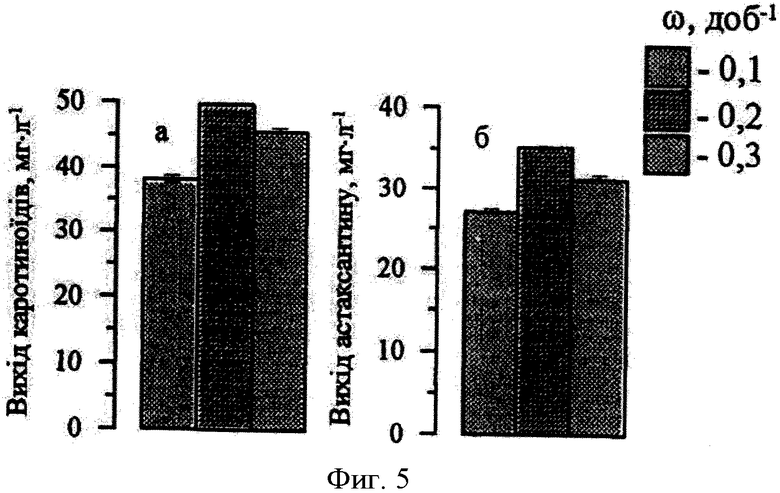
В предлагаемом способе культивирования величина скорости протока (ω) находится в диапазоне 0,1-0,3сут-1 но наиболее предпочтительной является ω=0,2 сут-1 (ежедневный 20% обмен среды). В этом случае общий выход каротиноидов и астаксантина из литра культуры за 20 суток культивирования выше, чем во всех апробированных авторами вариантах, и составляет 50 мг·л-1 и 35 мг·л-1, соответственно (фиг. 5 и 7).
Пример.
Для культивирования использовали штамм IBSS-18, выделенный авторами в окрестностях г. Адлер в 2003 г. Штамм характеризуется крупными размерами клеток (средняя длина монад составляет 33-34 мкм) и более высокой скоростью накопления астаксантина, по сравнению с коллекционными штаммами IPPAS Н-239 и CALU-79.
Для получения инокулята штамм в течение недели выращивали методом накопительной культуры в стеклянных колбах объемом 50 мл при естественном освещении (30-35Е·м-2·с-1) на базовой среде OHM. Затем культуру концентрировали, при помощи центрифугирования (800 об·мин-1, 2 мин), переносили в колбы большего объема (500 мл), содержащие 300 мл среды МОНМ-1, и продолжали выращивать в течение 4-х суток при освещении люминесцентными лампами «Feron» DL 20W Т4 6400К (50-60μЕ·м-2·с-1 с фотопериодом 16 час свет:8 час темнота) при непрерывном барботаже стерильным воздухом со скоростью 0,2 л·мин»-1 и температуре 22-23°С. На 5-е сутки (на логарифмической фазе роста), когда все клетки в культуре имели монадную структуру, а остаточное содержание азота и фосфора в среде составляло 52,14 и 4,64 мг·л-1, соответственно, суспензию клеток концентрировали при помощи центрифугирования (800 об мин»1,2 мин) и использовали в качестве инокулята.
Культивирование Н. pluvialis для получения астаксантина проводили в трех вариантах полупроточного режима в 1-литровых конических колбах на питательной среде МОНМ-2 при круглосуточном боковом освещении с интенсивностью светового потока 120 μЕ·м-2·с-1, скорости продувки воздухом 0,3 л·мин-1 и температуре 22-24°С. Объем культуры в колбах составлял 0,7 л, начальная численность клеток - 3-3.5·108 кл·л-1. Сразу после засева колб инокулятом в культуры внесли по 5,3 мл 2 Μ стерильного раствора ацетата натрия. С интервалом в 24 часа из колб отбирали 10, 20 и 30% объема культуры (ω=0,1-0,3 сут-1) и заменяли его равноценным объемом свежей среды, восстанавливая при этом исходную концентрацию азота (0,2 мМ·л-1) и фосфора (0,01 мМ·л-1). Появление астаксантина в клетках было зарегистрировано уже через сутки после внесения инокулята в среду МОНМ-2 и, начиная с 10-х суток культивирования, его содержание в расчете на одну клетку стабилизировалось и, в зависимости от скорости протока, составляло: а) 27-31 пг·кл-1 при ω=0,1 сут-1; б) 36-40 пг·кл-1 при ω=0,2 сут-1; в) 30-35 пг·кл-1 ω=0,3 сут-1 (фиг. 2). Астаксантин-продуцирующие монадных клетки активно делились на протяжении всего периода культивирования (фиг. 6). Азот и фосфор, ежедневно вносимые в среду во время обмена, полностью утилизировались культурами в течение суток, что являлось необходимым условием накопления астаксантина в клетках и одновременно с этим предотвращало непроизводительные затраты минеральных солей. Общий выход биомассы как сырья для получения астаксантина при полупроточном культивировании складывался из ежедневных 10-30% отборов и биомассы, собираемой из культиваторов по окончании технологического цикла. Данные, характеризующие выход каротиноидов и астаксантина за 20-ти суточный цикл культивирования, содержание каротиноидов в биомассе на заключительной стадии и диапазоны численности монадных клеток в культурах при различных вариантах протока среды представлены в табл. 2. 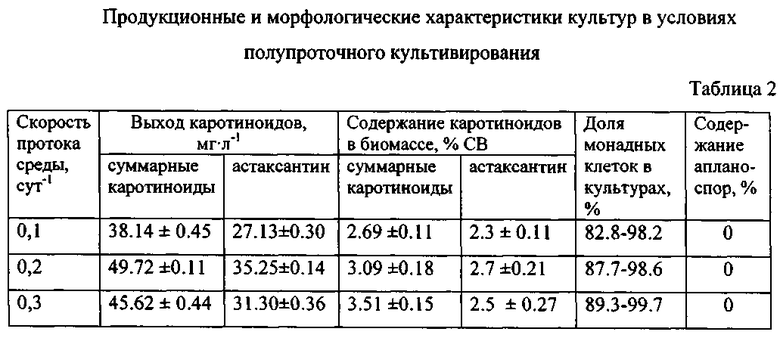
В условиях двухстадийного культивирования штамма IBSS-18 при индукции биосинтеза астаксантина стресс-комплексом CH3COONa (45 мМ) + NaCl (17 мМ)+t° =30°С его содержание в зрелых апланоспорах штамма IBSS-18 (в расчете на клетку) существенно выше (120-200 пг·кл-1), чем в монадных клетках, получаемых при реализации предлагаемого одностадийного способа культивирования. Однако максимальный выход астаксантина из литра культуры (с такой же начальной численностью клеток и продолжительностью технологического цикла), зарегистрированный авторами в серии экспериментов, при двухстадийном способе у данного штамма не превышает 27,5±1,4 мг·л-1 из-за массовой гибели клеток в постстрессорный период (см. фиг.7).
Предложенный способ обладает рядом преимуществ по сравнению с прототипом. Во-первых, 10-кратная экономия электроэнергии, затрачиваемой на освещение культиваторов, во-вторых, 3-9-кратная (в зависимости от величины ежедневного обмена) экономия электроэнергии, затрачиваемой на сбор биомассы, в-третьих, отсутствие непроизводительных потерь нитратов и фосфатов в процессе полу проточного культивирования, и, наконец, содержание астаксантина в биомассе по прототипу - 0,8% сухого вещества, а в предлагаемом способе - 2,2-2,8% сухого вещества.
Разработан экономичный и эффективный способ, который может быть положен в основу промышленного культивирования одноклеточной зеленой водоросли Haematococcus pluvialis, как сырья для получения природного астаксантина в чистом виде и БАД с повышенной биодоступностью каротиноида. биологически активного соединения. Способ исключает трансформацию вегетативных клеток в апланоспоры, обеспечивает преобладание в культурах клеток монадной структуры (>80%) на протяжении не менее 20 суток и содержание астаксантина в биомассе не менее 2% сухого вещества.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ МИКРОВОДОРОСЛИ Bracteacoccus aggregatus - ПРОДУЦЕНТ СМЕСИ НАТУРАЛЬНОГО БИОАНТИОКСИДАНТА АСТАКСАНТИНА И ПРОВИТАМИНА А | 2019 |
|
RU2710131C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРОВОДОРОСЛИ CHROMOCHLORIS ZOFINGIENSIS ДЛЯ ПОЛУЧЕНИЯ ЛИПИДОВ И КАРОТИНОИДОВ | 2019 |
|
RU2715039C1 |
| ШТАММ МИКРОВОДОРОСЛИ Coelastrella sp. - ПРОДУЦЕНТ СМЕСИ НАТУРАЛЬНОГО БИОАНТИОКСИДАНТА АСТАКСАНТИНА И β-КАРОТИНА | 2018 |
|
RU2703420C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРОВОДОРОСЛИ COELASTRELLA RUBESCENS ДЛЯ ПОЛУЧЕНИЯ КАРОТИНОИДОВ И ЛИПИДОВ | 2017 |
|
RU2661086C1 |
| ШТАММ МИКРОВОДОРОСЛИ HAEMATOCOCCUS PLUVIALIS - ПРОДУЦЕНТ НАТУРАЛЬНОГО АСТАКСАНТИНА | 2014 |
|
RU2573944C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ОДНОКЛЕТОЧНОЙ ЗЕЛЕНОЙ МИКРОВОДОРОСЛИ DUNALIELLA SALINA ДЛЯ ПОЛУЧЕНИЯ БИОМАССЫ | 2014 |
|
RU2541446C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ВИДА HAEMATOCOCCUS ДЛЯ ПРОИЗВОДСТВА АСТАКСАНТИНА | 2016 |
|
RU2730670C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ПИТАТЕЛЬНОЙ СРЕДЫ ДЛЯ КУЛЬТИВИРОВАНИЯ ДРОЖЖЕЙ XANTHOPHYLLOMYCES DENDRORHOUS (PHAFFIA RHODOZYMA) НА ОСНОВЕ СОЕВОЙ МЕЛАССЫ И ДРОЖЖЕВОГО ЭКСТРАКТА | 2022 |
|
RU2785792C1 |
| ШТАММ ЗЕЛЁНОЙ МИКРОВОДОРОСЛИ DUNALIELLA SALINA ДЛЯ ПОЛУЧЕНИЯ ЕЁ БИОМАССЫ В ПРОМЫШЛЕННЫХ УСЛОВИЯХ | 2021 |
|
RU2788527C2 |
| Способ выращивания микроводоросли Porphyridium purpureum | 2016 |
|
RU2675318C2 |




Изобретение относится к способу культивирования одноклеточной зеленой водоросли Haematococcus pluvialis для получения астаксантина, предусматривающему индукцию биосинтеза астаксантина в монадных вегетативных клетках причем культуру, выращенную на питательной среде МОНМ-1, в состоянии субстратного насыщения клеток по биогенным элементам (инокулят) вносят в количестве 0,3-0,35107кл.л-1 в питательную среду МОНМ-2, отличающуюся от среды МОНМ-1 30-кратно сниженным содержанием азота (0,2 мМл-1) и фосфора (0,12 ммл-1), однократно вносят 15 мМ ацетата натрия и дальнейшее выращивание на протяжении 20 суток осуществляют в полу проточном режиме (0,1-0,3 сут-1), поддерживая в среде МОНМ-2 заданный уровень азота и фосфора, при круглосуточном освещении люминесцентными лампами дневного света с интенсивностью светового потока 120 µЕг-2·с-1 непрерывной продувке воздухом (0,3 л мин-1) и температуре 22-26°С. Разработан экономичный и эффективный способ, который может быть положен в основу промышленного культивирования одноклеточной зеленой водоросли Haematococcus pluvialis, как сырья для получения естественного астаксантина в чистом виде и БАД с повышенной биодоступностью каротиноида. Способ исключает трансформацию вегетативных клеток в апланоспоры, обеспечивает преимущество в культурах клеток монадной структуры (>80%) на протяжении не менее 20 суток и содержание астаксантина в биомассе не менее 2 % сухого вещества.
1. Способ культивирования одноклеточной зеленой водоросли Haematococcus pluvialis для получения астаксантина, предусматривающий индукцию биосинтеза астаксантина в монадных вегетативных клетках, отличающийся тем, что культуру, выращенную на питательной среде МОНМ-1, в состоянии субстратного насыщения клеток по биогенным элементам (инокулят) вносят в количестве 0,3-0,35·107 кл·л-1 в питательную среду МОНМ-2, отличающуюся от среды МОНМ-1 30-кратно пониженным содержанием азота (0,2 мМ·л-1) и фосфора (0,12 мМ·л-1), однократно вносят 15 мМ ацетата натрия и дальнейшее выращивание в течение 20 сут осуществляют в полупроточном режиме (0,1-0,3 сут-1), поддерживая в среде МОНМ-2 заданный уровень азота и фосфора, при круглосуточном освещении люминесцентными лампами дневного света с интенсивностью светового потока 120 µЕ·м-2·c-1, непрерывной продувке воздухом (0,3 л·мин-1) и температуре 22-26°С, а модифицированная среда МОНМ-1 имеет следующий состав, мг··л-1:
Авторы
Даты
2015-02-10—Публикация
2014-10-03—Подача