Область применения
Изобретение относится к фотобиотехнологии и представляет собой новый штамм микроводоросли Coelastrella sp. K1, предназначенный для одновременного получения натуральных биоантиоксидантов астаксантина и β-каротина (провитамина А).
Уровень техники
Известно, что зеленая микроводоросль Coelastrella rubescens (ранее Scotiellopsis rubescens Vinatzer) [Kaufherova V., Elias M. The demise of the genus Scotiellopsis Vinatzer (Chlorophyta). Nova Hedwigia. 2013, 97, pp. 415-428] относится к группе экстремобионтных одноклеточных эукариот, способных при неблагоприятных условиях внешней среды переходить из вегетативного состояния в стадию покоя и накапливать в образующихся апланоспорах коммерчески значимое количество (1-2% сухого веса) специфических защитных кетокаротиноидов - продуктов многостадийного ферментативного окисления β-каротина в астаксантин [Lemoine, Y., Schoefs, В. Secondary ketocarotenoid astaxanthin biosynthesis in algae: a multifunctional response to stress. Photosynth. Res. 2010, 106, pp. 155-177; Чубчикова И.Н. Влияние состава среды на содержание вторичных каротиноидов у микроводоросли Scotiellopsis rubescens (Chlorophyceae). Морск. экол. журн. 2012, т. 11, №4, с. 95-101; Минюк Г.С. и др. Влияние рН и СО2 на рост и метаболизм микроводоросли Coelastrella (Scotiellopsis) rubescens. Физиология растений. 2016, т. 63, с. 601-610].
Астаксантин - кетокаротиноид красного цвета, наиболее эффективный природный антиокислитель, оказывающий благотворное влияние на организм человека и животных. Астаксантин широко востребован как компонент косметических формул, лекарственных средств, пищевых и кормовых добавок [Guerin, М. et al. Haematococcus astaxanthin: applications for human health and nutrition. Trends Biotechnol. 2003, 21, pp. 210-216.; Han, D. et al. Biology and commercial aspects of Haematococcus pluvialis. In Handbook of Microalgal Culture: Applied Phycology and Biotechnology. 2 ed.; Richmond, A.; Hu, Q., Eds. Blackwell: 2013; pp. 388-405]. Единственным источником астаксантина у животных является пища [Lorenz, R.T., Cysewski, G.R. Commercial potential for Haematococcus microalgae as a natural source of astaxanthin. Trends Biotechnol. 2000, 18, 160-167]. В настоящее время значительная доля астаксантина синтезируется химическим путем, но синтетический пигмент, в отличие от натурального, является рацематом с большим содержанием стереоизомеров, не обладающих биологической активностью. Для промышленного получения натурального астаксантина используют преимущественно штаммы зеленой микроводоросли Haematococcus pluvialis Flotow, способной накапливать астаксантин до 3-6% сухого веса [Lemoine, Y., Schoefs, В. Secondary ketocarotenoid astaxanthin biosynthesis in algae: a multifunctional response to stress. Photosynth. Res. 2010, 106, pp. 155-177] благодаря способности к образованию богатых астаксантином неподвижных коккоидных клеток, устойчивых к неблагоприятным условиям среды [Boussiba, S. Carotenogenesis in the green alga Haematococcus pluvialis: cellular physiology and stress response. Physiol. Plant. 2000, 108, pp. 111-117; Solovchenko, A. Physiology and adaptive significance of secondary carotenogenesis in green microalgae. Russ. J. Plant Physiol. 2013, 60, pp. 1-13]. Известен штамм микроводорослей Haematococcus pluvialis BM1, пригодный для получения астаксантина и характеризующийся способностью расти на средах, содержащих до 27% хлорида натрия, высокой способностью к накоплению астаксантина - до 3-6% сухой биомассы и обладающий высокой продуктивностью (до 300 мг сухой биомассы в сутки с 1 л культуры) [патент RU 2573944, 27.01.2016]. Известен способ культивирования Haematococcus pluvialis для промышленного производства биомассы, обогащенной астаксантином [патент US 6022701, 2000-02-08] (культивирование при освещении в диапазоне 30-140 мкЕ ФАР/(м2⋅с) и температуре 15-28°С с использованием в качестве среды водопроводной воды и барботированием культуры газо-воздушной смесью с 1,5% СО2). Также, известен способ эффективного производства каротиноидов, включая астаксантин, путем получения мутантных штаммов Haematococcus pluvialis [патент ЕР 1995325, 2008-11-26] ССАР 34/8 и SAG 34-1b с повышенной способностью к накоплению каротиноидов.
Однако для известных штаммов микроводорослей Haematococcus pluvialis характерна невысокая скорость роста, узкий диапазон физико-химических параметров культивирования и высокий риск контаминации, требующий применения дорогостоящих закрытых систем культивирования, чрезмерно повышающих цену на натуральный астаксантин.
Также известен штамм дрожжей Phaffia rhodozyma [патент RU 2385925, 10.04.2010] ВКПМ Y-2982, способный продуцировать астаксантин (7,0-8,0 мг/г сухой биомассы в условиях оптимальной (60 лк) освещенности). Доля астаксантина в общем пуле каротиноидов может составлять до 70%. Описан штамм одноклеточной зеленой водоросли Chlorella zofingiensis АТСС 30412 [патент US 7063957, 2005-09-29], способный к гетеротрофному росту в темноте и после 2-х недель роста способный накапливать до 10 мг/л астаксантина.
β-каротин - оранжевый пигмент, непредельный углеводород из группы каротиноидов. Встречается во всех зеленых растениях и достаточно давно используется в качестве красителя в пищевой промышленности и кормах для животных [L.J. Borowitzka, М.А. Borowitzka, Т.Р. Moulton. The mass culture of Dunaliella salina for fine chemicals: From laboratory to pilot plant. Hydrobiologia. 1984, 1, pp. 115-121]. Кроме этого, β-каротин используется в качестве компонента биологически активных добавок и витаминных комплексов. Общий объем мирового рынка β-каротина оценивается примерно в 270-300 млн. долл. США, из них 20-30% - доля природного β-каротина [Borowitzka М.А. High-value products from microalgae - their development and commercialisation. Journal of Applied Phycology. 2013, V. 25, Issue 3, pp. 743-756].
В настоящее время известны микроводоросли - перспективные продуценты натурального β-каротина, особенно Dunaliella salina (до 10% β-каротина от сухого веса клеток) [Oren, A. Adaptation to life at high salt concentrations in Archaea, Bacteria, and Eukarya (Gunde-Cimerman, N., Oren A., and Plemenitas, A., eds), Springer. N.Y., 2005, pp. 493-502]. Известен штамм водоросли Dunaliella salina Teod. CALU-834, выделенный из прибрежной зоны лимана Сасык [патент SU 1324627, 19.11.1986], который используется в микробиологической промышленности как продуцент белка и β-каротина, в качестве кормовых, витаминных и биостимулирующих добавок в рацион животных, а также для утилизации отходов. Также известен штамм одноклеточных водорослей Dunaliella salina - продуцент биоантиоксидантов [патент RU 2497945, 10.11.2013] и способ культивирования Dunaliella salina [патент RU 2541446, 10.02.2015]. Известно изобретение, охватывающее сразу несколько новых галотолерантных гипераккумулирующих каротиногенных штаммов микроводоросли Dunaliella salina DF15, DF17 и DF40 [заявка WO 2018141978, 2018-08-09] с коммерчески значимым потенциалом накопления β-каротина. В последние годы гриб Blakeslea trispora стал важным альтернативным источником природного β-каротина, конкурирующего с водорослевым продуктом [заявка ЕР 1367131, 2003-12-03].
Основными недостатками перечисленных выше примеров являются отсутствие способности к одновременному накоплению коммерчески значимых количеств астаксантина и β-каротина.
Известна зеленая почвенная микроводоросль Bracteacoccus minor (Chodat)  накопливающая смесь вторичных кетокаротиноидов с доминированием диацильных эфиров астаксантина (37-42% суммы) [Г.С. Минюк и др. Особенности вторичного каротиногенеза у Bracteacoccus minor (Chlorophyta) в условиях двухстадийной культуры. Algologia. 2015, 25(1): 21-34].
накопливающая смесь вторичных кетокаротиноидов с доминированием диацильных эфиров астаксантина (37-42% суммы) [Г.С. Минюк и др. Особенности вторичного каротиногенеза у Bracteacoccus minor (Chlorophyta) в условиях двухстадийной культуры. Algologia. 2015, 25(1): 21-34].
Недавно описан штамм Scenedesmus sp. CCALA 1074 который был выделен из планктона реки Силь (Швейцария, 47°10'47.982ʺN, 8°41'33.504ʺЕ) [Pavel  et al. The role of light and nitrogen in growth and carotenoid accumulation in Scenedesmus sp. Algal Research. 2016, 16, pp. 69-75]. Сумма каротиноидов на ранней стационарной фазе роста культуры Scenedesmus sp. CCALA 1074 составляла 2,3% от сухого веса, при этом доля астаксантина составляла 9%, а β-каротина 5,4% от суммы каротиноидов. Scenedesmus sp. CCALA 1074 успешно выращивают в открытом тонкослойном фотобиореакторе объемом 150 л., при этом, он демонстрирует превосходный рост, высокую продуктивность каротиноидов и термотолерантность, что делает этот штамм перспективным кандидатом для биотехнологического производства богатой каротиноидами биомассы.
et al. The role of light and nitrogen in growth and carotenoid accumulation in Scenedesmus sp. Algal Research. 2016, 16, pp. 69-75]. Сумма каротиноидов на ранней стационарной фазе роста культуры Scenedesmus sp. CCALA 1074 составляла 2,3% от сухого веса, при этом доля астаксантина составляла 9%, а β-каротина 5,4% от суммы каротиноидов. Scenedesmus sp. CCALA 1074 успешно выращивают в открытом тонкослойном фотобиореакторе объемом 150 л., при этом, он демонстрирует превосходный рост, высокую продуктивность каротиноидов и термотолерантность, что делает этот штамм перспективным кандидатом для биотехнологического производства богатой каротиноидами биомассы.
Известен штамм микроводоросли Coelastrella striolata var. multistriata, который был выделен с поверхности горной породы в Шизуоке, Япония [Katsuya Abe et al. Accumulation and antioxidant activity of secondary carotenoids in the aerial microalga Coelastrella striolata var. multistriata. Food Chemistry. 2007, 100, pp. 656-661]. Авторы заявляют о способности данной микроводоросли синтезировать значительное количество смеси каротиноидов, таких как кантаксантин, астаксантин и β-каротин. Красновато-оранжевые клетки микроводоросли могут накапливать до 56,0 мг вторичных каротиноидов на 1 г. биомассы. По содержанию в клетках каротиноиды кантаксантин, астаксантин и β-каротин составляли 47,5, 1,5 и 7,0 мг/г. сух. веса соответственно.
Наиболее близким аналогом является изобретение, описывающее микроводоросли Coelastrella rubescens и способ их культивирования для получения каротиноидов и липидов [патент RU 2661086, 11.07.2018]. Для реализации предлагаемого способа получения биомассы Coelastrella rubescens используют штамм Coelastrella (Scotiellopsis) rubescens IPPAS H-350 (Vinatzer/Innsbruck V195=CCALA475), который выращивают методом двухстадийной накопительной культуры. Полученную в конце «зеленой» стадии биомассу С. rubescens, состоящую из метаболически активных делящихся клеток, авторы предлагают использовать (частично или целиком) как самостоятельное сырье для получения смеси ксантофиллов (лютеина, зеаксантина, неоксантина и β-каротина) и незаменимых ЖКС18:2ω и С18:3ω пищевого назначения, а также (частично или целиком) в качестве инокулята для проведения II («красной») стадии культивирования с целью получения кетокаротиноидов группы астаксантина и технических липидов. Содержание суммарных каротиноидов в биомассе в конце «зеленой» стадии роста культуры, собранной на 11-е сутки, достигало 2,1±0,17% СВ при продуктивности 2,2±0,08 мг⋅л-1⋅сут-1. В составе каротиноидов доминировали лютеин/зеаксантин (51,9% от суммы), неоксантин (18,1%), α- и β-каротины (10,6%). Астаксантин и интермедиаты его биосинтеза в биомассе отсутствовали. При условии использования для проведения «красной» стадии всей «зеленой» биомассы выход суммарных каротиноидов из литра исходной культуры с начальной плотностью 1,1×106 кл⋅мл-1 (или 0,17 г/л СВ) за 19 суток составил 52,3 мг⋅л-1, средняя продуктивность - 2,75 мг⋅л-1⋅сут-1, содержание суммарных каротиноидов в биомассе 0,9-1,0% СВ, доля астаксантина составляла 26%. К недостаткам прототипа можно отнести незначительное содержание β-каротина в биомассе на «красной» стадии культивирования и недостаточно высокую долю астаксантина, а также весьма скромные показатели по содержанию суммарных каротиноидов.
Раскрытие изобретения
Техническая проблема, на решение которой направлено изобретение, заключается в получении штамма микроводоросли с высоким уровнем одновременного накопления астаксантина и β-каротина при сохранении высокой продуктивностью культуры, способностью к биоизъятию фосфатов из среды и низкой контаминируемостью культуры.
Техническая проблема была решена получением штамма микроводоросли Coelastrella sp. K1, выделенного авторами из водоема в Средней полосе России, Тверская область, район Конаково (56°41'25.72ʺN, 36°45'42.11ʺЕ), депонированного в Российской Коллекции Микроводорослей при учреждении Институт физиологии растений им. К.А. Тимирязева Российской Академии Наук (IPPAS) с присвоенным идентификатором IPPAS С-2028.
Техническим результатом заявляемого изобретения является получение штамма микроводоросли с высоким уровнем одновременного накопления астаксантина и β-каротина - не менее 45 масс. % каждого компонента при сохранении высокой продуктивностью культуры - не менее 2,1 мг⋅л-1⋅сут-1 по сумме каротиноидов, способностью к биоизъятию фосфатов из среды - не менее 2,3 мг⋅л-1⋅сут-1 и низкой контаминируемостью культуры.
Сущность изобретения заключается в том, что для достижения цели используют зеленую микроводоросль Coelastrella sp. штамм K1, выделенный и идентифицированный авторами заявки из водоема в Средней полосе России, Тверская область, район Конаково (56°41'25.72ʺN, 36°45'42.11ʺЕ). В результате полученный штамм характеризуется высокой способностью к одновременному накоплению астаксантина и β-каротина (45-50 масс. % и 45-50 масс. %, соответственно от суммы каротиноидов на «красной» стадии культивирования), при этом сумма каротиноидов оценивается в 1,3-1,7% сухого веса, культура обладает высокой продуктивностью (100-200 мг сухой биомассы и 2,1-2,3 мгкаротиноидов в сутки с 1 л культуры), способностью к биоизъятию фосфатов из среды (2,3-2,6 мг⋅л-1⋅сут-1), а также низкой контаминируемостью культуры.
Для культивирования используют питательную среду BG-11 [Stanier, R., et al. Purification and properties of unicellular blue-green algae (order Chroococcales). Microbiology and Molecular Biology Reviews. 1971, 35(2): 171-205]. Инокулят вносят в среду до конечной концентрации хлорофилла 5-7 мкг/мл, культивирование проводят в фотобиореакторе при постоянном освещении с интенсивностью 200 моль квантов⋅м-2⋅с с помощью светодиодов (4700 К), при температуре 26-28°С и барботировании среды газо-воздушной смесью с содержанием СО2 2-5% со скоростью 0,8-1,2 л/мин. Значение рН среды в начале культивирования - 7,5-8, в конце культивирования - 7,0-7,2. Для индукции каротиногенеза и перехода на «красную» стадию культивирования, клетки, находящиеся на экспоненциальной фазе роста, дважды промывают дистиллированной водой, ресуспендируют в дистиллированной воде и инкубируют при освещении 320 мкмоль фотонов ФАР м-2⋅с-1 в течение 7 суток. Для достижения технического результата изобретения культуру водоросли Coelastrella sp. штамм K1 выращивают двухстадийным методом, направленным на достижение коммерчески значимого выхода целевых продуктов (смеси астаксантина и β-каротина). После этого отделяют биомассу от среды центрифугированием.
В результате получают в сутки 100-200 мг⋅л-1 биомассы (по сухому весу) и 2,1-2,3 мг каротиноидов в сутки с 1 л культуры, биомасса содержит 1,3-1,7% каротинодоиов, в которых доля астаксантина 45-50 масс. % и β-каротина 45-50 масс. %. Предлагаемый штамм культуры микроводоросли характеризуется способностью к биоизъятию фосфатов из среды (2,3-2,6 мг⋅л-1⋅сут-1) а также низкой контаминируемостью культуры.
Краткое описание чертежей
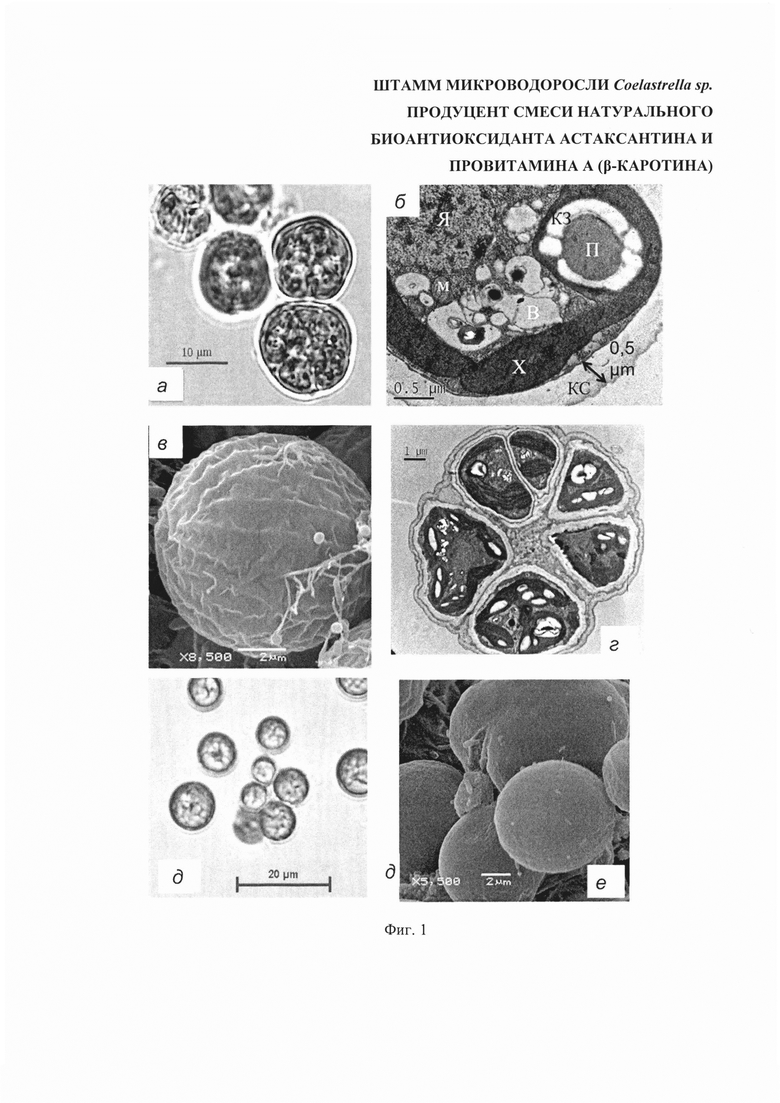
На Фиг. 1 представлены клетки микроводорослей Coelastrella sp. штамм К1. а, д - светлопольная микроскопия; б, в, г, е - электронные микрофотографии, а - вегетативные клетки; б - срез, вегетативная клетка; в - поверхность клеточной стенки, покрытая меридиональными бороздками; г - вегетативная клетка, спорангий; д - циста; е - гладка поверхность клеточной стенки цисты. Обозначения на рисунке б: (В) - вакуоль; (КЗ) - крахмальное зерно; (КС) - клеточная стенка, (М) - митохондрия; (П) - пиреноид; (X) - хлоропласт; (Я) - ядро.
На Фиг. 2 показан рост культуры Coelastrella sp. штамм К1 в оптимальных и стрессовых условиях (индукция вторичного каротиногенеза).
На Фиг. 3 показано сверху: клетки культуры Coelastrella sp. штамм К1, прижизненно окрашенные флуоресцентным красителем Нильский Красный, флуоресцирующим желтым цветом в гидрофобной среде нейтральных липидов. Снизу: изменение соотношения каротиноидов и хлорофиллов при культивировании в стрессовых условиях у представленного штамма микроводоросли.
На Фиг. 4 показаны филогенетические взаимоотношения штамма микроводоросли К1 и близких штаммов, основанные на частичной последовательности гена 18s рРНК.
На Фиг. 5 показана кинетика поглощения фосфатов культурой микроводорослей Coelastrella sp. штамм К1.
Осуществление изобретения
Штамм Coelastrella sp. К1 выделен из водоема в Средней полосе России, Тверская область, район Конаково (56°41'25.72ʺN, 36°45'42.11ʺЕ). Отселектирован в результате скрининга по способности к биосинтезу каротиноидов (смеси астаксантина и β-каротина).
Способ выделения - из накопительной культуры, полученной путем инокуляции среды BG-11 отобранными клетками с последующим рассевом по твердой среде BG-11.
Морфологические признаки.
Клетки мелкие (5-8 мкм) с одним пиреноидом в плоскости среза, хлоропласт пристенный с включениями крахмальных зерен (Фиг. 1б). При интенсивном культивировании большинство клеток культуры находятся в виде спорангиев (Фиг. 1г), дочерние клетки не покидают материнские и оказываются окруженными как собственной, так и материнской клеточной стенкой. Поверхность клеточной стенки покрыта меридиональными бороздками (Фиг. 1в). Клеточная стенка состоит из слоев разной электронной плотности: можно визуально выделить внешний и внутренний слои. В клетках культуры присутствуют следующие органеллы: клеточное ядро, пристенный хлоропласт с одним пиреноидом, окруженным крахмальными зернами, митохондрии, множество вакуолей, небольшое количество липидных глобул.
Особенности морфологии в условиях, обеспечивающих максимальный выход продукта: клетки приобретают оранжевую окраску. Клеточная стенка вегетативных клеток - 0,2-0,5 мкм, при стрессе не утолщается. Поверхность клеточной стенки при стрессе становится гладкой, меридиональные бороздки выражены хуже, чем у вегетативных клеток (Фиг. 1е). Набор органелл аналогичен таковому в вегетативном состоянии, однако хлоропласт претерпевает значительную деградацию. Накопление липидов начинается уже в вегетативном состоянии клеток на 5-6 день культивирования, на поздних стадиях стресса олеосомы занимают большую часть объема цитоплазмы.
Физиологические свойства штамма.
Оптимальные условия культивирования:
Для культивирования используют жидкую питательную среду BG-11 [Stanier, R. et al. Purification and properties of unicellular blue-green algae (order Chroococcales). Microbiology and Molecular Biology Reviews. 1971, 35(2): 171-205], готовится из стоковых растворов; все компоненты можно автоклавировать.
Среда BG-11 следующего состава:
K2НРO4 - 0,04 г/л, NaNO3 - 0,3 г/л, MgSO4⋅7H2O - 0,075 г/л,
СаСl2⋅2Н2O - 0,036 г/л, лимонная кислота - 0,006 г/л,
FeSO4⋅7H2O - 0,006 г/л, Na2CO3 - 0,2 г/л, ЭДТА - 0,001 г/л,
раствор FeSO4⋅7H2O (7,45 г/л)+ЭДТА (5,57 г/л) - 1 мл/л,
раствор микроэлементов (Н3ВО3 - 2,86 г/л, МnСl2⋅4Н2O - 1,86 г/л, ZnSO4⋅7H2O - 0,22 г/л, CuSO4⋅5H2O - 0,08 г/л, Na2MoO4⋅7H2O - 0,39 г/л, Co(NO3)2⋅6H2O - 0,05 г/л) - 1 мл/л,
рН в начале культивирования - 7,5-8,0
рН в конце культивирования 7,0-7,2
содержание СO2 в ГВС - 2-5%, скорость барботажа 0,8-1,2 л/мин
температура 26-28°С
освещение круглосуточное, освещенность 200 моль квантов /м2/сек
тип ламп: светодиодные, 4700 К
Продуктивность в оптимальных условиях культивирования:
по накоплению биомассы (сухой вес, мг/мл в сутки): 100-200;
выход полезного продукта: сумма каротиноидов оценивается в 1,3-1,7% сухого веса, продуктивность по каротиноидам 2,1-2,3 мг в сутки с 1 л культуры, одновременное накопление астаксантина и β-каротина (45-50 масс. % и 45-50 масс. %, соответственно от суммы каротиноидов).
Биотехнологическая характеристика штамма.
Штамм микроводоросли Coelastrella sp. K1, депонированный в Российской Коллекции Микроводорослей при учреждении Институт физиологии растений им. К.А. Тимирязева Российской Академии Наук (IPPAS) с присвоенным идентификатором IPPAS С-2028, продуцент смеси натурального биоантиоксиданта астаксантина и β-каротина (провитамина А) в соотношении 45-50 масс. % и 45-50 масс. % от суммы каротиноидов, соответственно, которая составляет 1,3-1,7% сухого веса, при продуктивности по сумме каротиноидов 2,1-2,3 мг в сутки с 1 л культуры, способный к биоизъятию фосфатов из среды со скоростью 2,3-2,6 мг⋅л-1⋅сут-1.
Условия культивирования, обеспечивающие максимальный уровень (выход) полезного свойства (продукта): любой стрессор, снижающий скорость деления клеток (яркое освещение более 250 моль квантов⋅м-1⋅сек-1 не менее 1 суток, исключение азота из состава среды культивирования).
Генотипирование.
Выделение ДНК.
Для выделения ДНК отбирают 5-10 мг биомассы культуры микроводоросли. Выделение ДНК проводят методом фенол-хлороформной экстракции. Перед выделением проводят трехкратное замораживание образцов при -4°С с последующим оттаиванием. Это необходимо для разрушения прочных клеточных стенок водорослей. Образцы инкубируют в течение часа в 300 мкл ТЕ буфера (10 mM Tris-Cl (рН 7.5), 1 mМ EDTA), содержащего 10 мг/мл лизоцима при 37°С. Затем добавляют 2% додецилсульфата натрия и инкубируют в течение часа при 40°С и интенсивном перемешивании. Далее добавляют 1 М NaCl и оставляют на ночь на льду для высаливания белков. После чего проводят процедуру фенол-хлороформной экстракции. Чистоту образцов ДНК оценивают методом электрофореза в 1,5% агарозном геле. Полученные образцы ДНК хранят в ТЕ-буфере при -4°С.
Филогенетический анализ.
Филогенетические взаимоотношения штамма К1 и близких штаммов оценивают по сходству частичной последовательности гена 18s рРНК. Представленное филогенетическое дерево получено методом NJ (Фиг. 4). Филогенетический анализ проведен в программе BioNJ. Визуализация проведена в программе TreeDyn 198.3. Процент репликативных деревьев, в которые были объединены таксоны в бустрап-тесте показаны рядом ветками.
В результате проведенного филогенетического анализа установлена родовая принадлежность исследуемого изолята. Изолят идентифицирован как Coelastrella sp. и получил идентификатор К1; после депонирования в Российской Коллекции Микроводорослей при учреждении Институт физиологии растений им. К.А. Тимирязева Российской Академии Наук (IPPAS) ему присвоен идентификатор IPPAS С-2028.
Оценка уровня контаминируемости культуры.
Оценку уровня контаминируемости культуры микроводоросли Coelastrella sp. штамм К1 проводят путем микроскопирования после 7, 14 и 21 дней культивирования в фотобиореакторе. В результате проведенных исследований клетки соответствуют морфологическому описанию для данного штамма, других организмов не выявлено. Дополнительно производят высев культуральной жидкости на твердую среду LB с 2% агара (Bertani G. Lysogeny at mid-twentieth century: P1, P2, and other experimental systems. // Journal of bacteriology. - 2004. - Vol. 186, no. 3. - P. 595-600.) после 14 дней культивирования в фотобиореакторе. Тестовую среды разливают по чашкам, высевают культуральную жидкость методом истончающегося штриха, инкубируют в темноте при комнатной температуре и подсчитывают бактериальные и грибные колонии на 3, 7, 14 и 21 день. В результате тестирования наличие бактериальных и грибных колоний до накопления максимального количества каротиноидов не зафиксировано.
Кинетика поглощения фосфатов
Кинетику поглощения фосфатов культурой микроводоросли Coelastrella sp. штамм К1 оценивают по остаточному содержанию ортофосфата в среде методом ионной хроматографии. Начальная плотность культуры - 0,5 г с.в.⋅л-1, освещенность - 120 мкмоль квантов ФАР/м2/с. При добавлении ортофосфата до конечной концентрации 400 мкмол⋅л-1 к культуре штамма К1, предварительно проинкубированной в течение 10 суток на среде BG-11, не содержащей источника фосфора, наблюдается быстрое поглощение ортофосфата. В результате способность штамма микроводоросли К1 к биоизъятию фосфатов из среды составляет 2,3-2,6 мг⋅л-1⋅сут-1 в пересчете на ортофосфат.
Следующие материалы иллюстрируют достижение цели.
Штамм микроводоросли Coelastrella sp. K1 демонстрирует высокую способность к одновременному накоплению астаксантина и β-каротина, что не встречается у известных аналогов. Накопление астоксантина и β-каротина составляет 45-50 масс. % и 45-50 масс. %, соответственно от суммы каротиноидов на «красной» стадии культивирования, что в 2 раза превосходит аналогичный показатель у известного прототипа. Сумма каротиноидов составляет 1,3-1,7% сухого веса, что в 1,5 раза выше, по сравнению с прототипом. Штамм Coelastrella sp. K1 сохраняет высокую продуктивность (100-200 мг сухой биомассы и 2,1-2,3 мг каротиноидов в сутки с 1 л культуры) и одновременную способность к биоизъятию фосфатов из среды со скоростью 2,3-2,6 мг⋅л-1⋅сут-1., что соответствует уровню известных аналогов, не способных к одновременному накоплению астаксантина и β-каротина.
Штамм микроводоросли Coelastrella sp. K1 успешно прошел предварительное тестирование и этап пробного культивирования в экспериментальных и полупромышленных фотобиореакторах объемом до 50 л. Таким образом, можно считать степень готовности штамма к масштабированию культуры для промышленного применения высокой.
В результате получен штамм микроводоросли Coelastrella sp. K1, депонированный в Российской Коллекции Микроводорослей при учреждении Институт физиологии растений им. К.А. Тимирязева Российской Академии Наук (IPPAS) с присвоенным идентификатором IPPAS С-2028, который обладает высоким уровнем накопления смеси натурального биоантиоксиданта астаксантина и провитамина А (β-каротина), сохраняющий высокую продуктивность при выращивании, обладающий способностью к одновременному биоизъятию фосфатов из среды и низкой контаминируемостью культуры по сравнению с известными аналогами.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ МИКРОВОДОРОСЛИ Bracteacoccus aggregatus - ПРОДУЦЕНТ СМЕСИ НАТУРАЛЬНОГО БИОАНТИОКСИДАНТА АСТАКСАНТИНА И ПРОВИТАМИНА А | 2019 |
|
RU2710131C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРОВОДОРОСЛИ COELASTRELLA RUBESCENS ДЛЯ ПОЛУЧЕНИЯ КАРОТИНОИДОВ И ЛИПИДОВ | 2017 |
|
RU2661086C1 |
| ШТАММ МИКРОВОДОРОСЛИ HAEMATOCOCCUS PLUVIALIS - ПРОДУЦЕНТ НАТУРАЛЬНОГО АСТАКСАНТИНА | 2014 |
|
RU2573944C1 |
| Морская микроводоросль - продуцент лютеина и иных каротиноидов | 2024 |
|
RU2835137C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ОДНОКЛЕТОЧНОЙ ЗЕЛЕНОЙ ВОДОРОСЛИ HAEMATOCOCCUS PLUVIALIS ДЛЯ ПОЛУЧЕНИЯ АСТАКСАНТИНА | 2014 |
|
RU2541455C1 |
| Морская микроводоросль - продуцент бета-каротина, лютеина и иных каротиноидов | 2024 |
|
RU2835138C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРОВОДОРОСЛИ CHROMOCHLORIS ZOFINGIENSIS ДЛЯ ПОЛУЧЕНИЯ ЛИПИДОВ И КАРОТИНОИДОВ | 2019 |
|
RU2715039C1 |
| Модифицированная нуклеотидная последовательность, кодирующая полипептид, обладающий активностью фитоен синтазы и геранилгеранилпирофосфат синтазы (варианты), ее использование при конструировании трансформантов дрожжей Yarrowia lipolytica, продуцирующих каротиноиды | 2021 |
|
RU2794980C1 |
| Трансформант дрожжей Yarrowia lipolytica, продуцирующий кантаксантин | 2023 |
|
RU2827562C1 |
| ШТАММ ДРОЖЖЕЙ Phaffia rhodozyma - ПРОДУЦЕНТ АСТАКСАНТИНА | 2008 |
|
RU2385925C1 |


Изобретение относится к биотехнологии и касается штамма микроводоросли Coelastrella sp. K1. Штамм депонирован в коллекции Института физиологии растений им. К.А. Тимирязева РАН под регистрационным номером IPPAS C-2028. Штамм микроводоросли Coelastrella sp. IPPAS C-2028 отличается высоким уровнем одновременного накопления астаксантина и β-каротина (не менее 45 мас.% каждого компонента) и предназначен для одновременного получения астаксантина и β-каротина. 5 ил.
Штамм микроводоросли Coelastrella sp. K1, депонированный в Российской Коллекции Микроводорослей при учреждении Институт физиологии растений им. К.А. Тимирязева Российской Академии Наук (IPPAS) с присвоенным идентификатором IPPAS С-2028 - продуцент смеси натурального биоантиоксиданта астаксантина и β-каротина.
| СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРОВОДОРОСЛИ COELASTRELLA RUBESCENS ДЛЯ ПОЛУЧЕНИЯ КАРОТИНОИДОВ И ЛИПИДОВ | 2017 |
|
RU2661086C1 |
| ШТАММ МИКРОВОДОРОСЛИ HAEMATOCOCCUS PLUVIALIS - ПРОДУЦЕНТ НАТУРАЛЬНОГО АСТАКСАНТИНА | 2014 |
|
RU2573944C1 |
| ШТАММ ДРОЖЖЕЙ Xanthophyllomyces dendrorhous - ПРОДУЦЕНТ АСТАКСАНТИНА | 2001 |
|
RU2273667C2 |
| БОРОВКОВ А.Б., Зеленая микроводоросль Dunaliella salina teod | |||
| (обзор) | |||
| Экология моря, 2005, вып | |||
| Приспособление для получения кинематографических стерео снимков | 1919 |
|
SU67A1 |
| с | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2019-10-16—Публикация
2018-12-25—Подача