Изобретение относится к биотехнологии микроводорослей и может быть использовано при промышленном культивировании зеленой аэрофильной микроводоросли Coelastrella (Scotiellopsis) rubescens (Vinatzer)  &
&  (Chlorophyceae, Sphaeropleales, Scenedesmaceae) для одновременного получения кетокаротиноидов группы астаксантина и липидов для производства биодизеля.
(Chlorophyceae, Sphaeropleales, Scenedesmaceae) для одновременного получения кетокаротиноидов группы астаксантина и липидов для производства биодизеля.
Зеленая микроводоросль С. ubescens (ранее Scotiellopsis rubescens Vinatzer) [ ,
,  , 2013] относится к группе экстремобионтных одноклеточных эукариот, способных при неблагоприятных условиях внешней среды (голодании, высыхании, высокой освещенности, солености, температуре и др.) переходить из вегетативного состояния в стадию покоя и накапливать в образующихся спорах коммерчески значимое количество (1-2% сухого вещества) специфических защитных кетокаротиноидов (ККар) - продуктов многостадийного ферментативного окисления β-каротина (β-кар) в астаксантин (Act) (далее ККар группы Act) [Lemoine, Schoefs, 2010; Чубчикова и др., 2010; Чубчикова, 2012].
, 2013] относится к группе экстремобионтных одноклеточных эукариот, способных при неблагоприятных условиях внешней среды (голодании, высыхании, высокой освещенности, солености, температуре и др.) переходить из вегетативного состояния в стадию покоя и накапливать в образующихся спорах коммерчески значимое количество (1-2% сухого вещества) специфических защитных кетокаротиноидов (ККар) - продуктов многостадийного ферментативного окисления β-каротина (β-кар) в астаксантин (Act) (далее ККар группы Act) [Lemoine, Schoefs, 2010; Чубчикова и др., 2010; Чубчикова, 2012].
В отличие от планктонной микроводоросли Haematococcus pluvialis, у которой ККар на 90-95% представлены эфирами Аст, у аэрофильных видов рода Coelastrella (С. striolata var. multistricata, С. oocystifomis, С. sp. F50 и др.) в составе ККар заметную роль играют интермедиаты биосинтеза Аст: адониксантин (Адк), адонирубин (Адр), кантаксантин (Кан), эхиненон (Эх) и др. [Abe et al., 2007; Чубчикова, 2012; Чубчикова и др., 2010; Нu et al., 2013; Iyer et al., 2015]. Все перечисленные ККар проявляют ярко выраженные антиоксидантные и регуляторные свойства (включая способность тормозить рост раковых клеток) [Yuan et al., 2010; Surai, 2012; Maoka et al., 2013. Iyer et al., 2015], вследствие чего широко востребованы в производстве парафармацевтиков, кормов для аквакультуры и птицеводства, функциональных продуктов питания и косметики [Han et al., 2013; Ahmed et al., 2013].
Процесс накопления ККар в клетках каротиногенных микроводорослей тесно связан с интенсификацией биосинтеза липидов, служащих средой для депонирования пигментов в цитоплазматических включениях. Содержание липидов в биомассе у Coelastrella spp варьирует в широких пределах (25-50% сухой массы) в зависимости от видовых особенностей водорослей и стадий их жизненного цикла [Abe et al., 2007; Нu et al., 2013; Luo et al., 2016; Минюк и др., 2015]. В вегетативных быстро делящихся клетках в составе жирных кислот (ЖК) суммарных липидов преобладают (не менее 50 масс% в сумме) две незаменимые кислоты С18:2ω6 (линолевая) и С18:3ω (α-линоленова), играющие важную роль в метаболизме человека и животных как предшественники мембранных полиненасыщенных ЖК (арахидоновой, эйкозопентаеновой и докозагексаеновой) и регуляторы деятельности сердечно-сосудистой и иммунной систем [Lunn, Theobald, 2006; Rasmussen et al., 2006; Bentley, 2007]. В клетках с высоким содержанием ККар (зрелые споры) в составе жирных кислот, доминируют насыщенные (С16:0 и С18:0) и моноеновые кислоты (С16:1, С18:1) [Abe et al., 2007; Нu et al., 2013; Luo et al., 2016], что делает такие липиды пригодными для производства биодизеля [Islam et al., 2013].
Возможность одновременного получения из биомассы Coelastrella spp двух или нескольких высоко востребованных рынком продуктов (антиоксидантных ККар группы ACT, незаменимых ди- и триеновых ЖК и липидов для биодизеля), а также потенциальная возможность их культивирования открытым способом [Hong et al., 2016] определяют перспективность этих видов в качестве объектов промышленной биотехнологии.
Известен способ получения биомассы Coelastrella rubescens, состоящей из вегетативных клеток [Чубчикова и др., 2013], основанный на оптимизации состава питательный среды Болда (ВВМ) [Bold, 1942] по содержанию азота (N) и фосфора (Р). Ключевыми критериями для выбора концентраций N и Р, адекватных потребностям клеток, служили показатели роста культуры и массовая доля хлорофилла a (Хл а) и первичных каротиноидов (Кар). Среди 9 вариантов соотношения N и Р в среде наилучшие результаты получены на модифицированной среде ВВМ (далее среда МВВМ) следующего состава (г/л): NaNO3 - 1,34; MgSO4⋅7H2O - 0,075; NaCl - 0,03; K2HPO4⋅3H2O - 0.04; KH2PO4 - 0,1; Na2-ЭДТА - 0,05; KOH - 0,03; H3BO3 - 0,011; ZnSO4⋅7H2O - 0,0094; MnCl2⋅4H2O - 0,0014; Na2MoO4⋅2H2O - 0,0024; CuSO4⋅5H2O - 0,0016; Co(NO3)2⋅6H2O - 0,0005; FeSO4⋅7H2O - 0,005; CaCl2 - 0,019; H2SO4конц. - 1 мкл. Остальные условия культивирования были следующими: начальная численность клеток (nнач.) - 1,4-1,6⋅106 кл⋅мл-1; Интенсивность ФАР (далее I - количество микромолей (μЕ) квантов фотосинтетически активной радиации (ФАР) в диапазоне 400-700 нм, падающей на поверхность площадью 1 м2 за 1 с) - 120 μЕ⋅м-2⋅с-1; фотопериод (далее ФП) - 15 ч свет: 9 час темнота: скорость продувки газо-воздушной смесью (0,2% CO2) - 0,5 л⋅мин-1⋅л-1; температура среды (Т) - 25-28°C; длительность культивирования (t) - 9 сут. Максимальная удельная скорость роста культуры (μмакс) составляла 1,4 сут-1, средняя удельная скорость (μcp.) - 0,54 сут-1, содержание Хл а и суммарных Кар в биомассе - 1.26 и 1.34% сухого вещества (СВ) соответственно. Возможность одновременного получения Кар и липидов не рассматривалась.
Известен способ получения биомассы Coelastrella rubescens состоящей из вегетативных клеток, основанный на методе накопительной культуры и стабилизации pH питательной среды МВВМ в диапазоне 5.0-9.5 ед., путем контролируемой подачи в среду газообразного CO2 [Минюк и др., 2015]. Остальные параметры культивирования были следующие: (nнач.) - 1,1⋅106 кл⋅мл-1; I - 136 μЕ⋅м-2⋅с-1; ФП - 15 ч свет: 9 час темнота: скорость продувки культур воздухом - 1 л⋅мин-1⋅л-1; Т - 25-26°C; t - 11 сут. Наилучшие результаты получены при поддержании pH среды на уровне 6-8 ед. В этих условиях μср варьировала в пределах 0.28-0.31 сут-1, средняя продуктивность культур по Кар (Ркар) составляла 1.6-2.2 мг⋅л-1⋅сут-1 при массовой доле хлорофилла а (Хл а) и суммарных Кар - 4.8-4.9 и 1.3-2.1% СВ. В составе Кар присутствовали только фотосинтетические пигменты. Аст и другие ККар отсутствовали. Содержание суммарных липидов в культурах на заключительной стадии составляло 337-520 мг⋅л-1 при их массовой доле в сухом веществе 23-43% и средней продуктивности по липидам (Рлип) 37-43 мг⋅л-1⋅сут-1. В составе жирных кислот (ЖК) суммарных липидов преобладали незаменимые ди- и триненасыщенные ЖК - С18:2ω6 (20.8-22.9 масс%), С18:3ω3 (28,1-30.4 масс%) а также С16:0 (19.8-20.5 масс%). Недостатками обоих способов по отношению к заявляемому являются отсутствие в получаемой биомассе ККар группы Аст и липидов, пригодных для получения биодизеля.
Наиболее близким к заявляемому является двухстадийный способ получения биомассы Coelastrella rubescens, состоящей из покоящихся клеток, обогащенных ККар группы Аст, основанный на результатах оптимизации состава питательной среды для «красной» стадии с целью увеличения выхода ККар [Чубчикова и др., 2012]. На I «зеленой» стадии продолжительностью 21 сут водоросль выращивали на среде ВВМ 3N при следующих условиях: одностороннее освещение, I - 60 μЕ⋅м-2⋅с-1, ФП - 15 ч свет: 9 ч темнота, продувка воздухом со скоростью 0,3 л⋅мин-1⋅л-1, Т - 22-24°С. μмакс. культуры на этой стадии составляла 0.25 сут-1, μср. - 0.15 сут-1. На II «красной» стадии культуру подвергли комплексному стресс-воздействию для индукции биосинтеза Аст. В стресс-комплекс входили: 15-кратное разведение культуры редуцированной по N, Р и микроэлементам (МЭ) средой ВВМ для создания дефицита элементов питания в среде и увеличения облученности клеток, перевод культур на круглосуточное двухстороннее освещение (140 μE⋅м-2⋅с-1 с каждой стороны) и внесение в среду химических активаторов биосинтеза Аст - ацетата натрия (CH3COONa) и хлорида натрия (NaCl) до концентрации соответственно 0.05 и 0.2 М. Продолжительность «красной» стадии составляла 6 сут. Наилучшие результаты получены при использовании на «красной» стадии редуцированной по N и Р среды ВВМ, содержащей: а) 4.1 мг⋅л-1N и 53 мг⋅л-1Р и б) 4.1 мг⋅л-1N и 5,3 мг⋅л-1Р. Обе среды включали полный набор МЭ по прописи среды ВВМ [Bold, 1942]. При таких условиях Ркар составила 1.7-1.8 мг⋅л-1⋅сут-1, а содержание суммарных Кар в биомассе 0.9-1.1% СВ. В составе Кар идентифицированы (% от суммы): лютеин (5.6-6.0%), β-кар, свободные Аст и Адк (7.0-7.5%), Кан (9.2-12.04%), моноэфиры Адк (11.1-11.6%), моноэфиры Аст (15.5-24.63%)), диэфиры Аст (8.6-9.5%). Сумма неидентифицированных фракций составляла 16.8-18.2%).
Недостатками известного способа получения биомассы С. rubescens являются: недооценка возможности использования биомассы водоросли для получения других ценных продуктов (незаменимых ЖК, липидов для биодизеля и каротиноидов, отличных по биологической активности от ККар группы Аст); низкая скорость роста водоросли на среде ВВМ 3N на I «зеленой» стадии; частичные потери биомассы (9%) на «красной» стадии в результате отмирания вегетативных клеток при действии CH3COONa и NaCl; сравнительно низкая Ркар культуры.
Задачей изобретения Способ культивирования микроводоросли Coelastrella rubescens для получения каротиноидов и липидов является создание условий культивирования Coelastrella rubesceny для увеличения продуктивности культуры по каротиноидам и повышения ценности получаемой биомассы как полифункционального сырья пищевого и технического назначения.
Техническим результатом изобретения является:
- увеличение среднесуточной продуктивности культуры по каротиноидам на 53%) путем повышения средней удельной скорости культуры на I стадии культивирования до 0.35 сут-1 (против 0.15 сут-1 в условиях прототипа) и нивелирования отхода вегетативных клеток, характерного для прототипа при стресс-индукции биосинтеза астаксантина;
- сокращение периода культивирования с 27 до 19 суток;
- сокращение потребления электроэнергии на освещение на 14%;
- обеспечение продуктивности культур по липидам, превышающей в 7.7-10 раз среднюю продуктивность других видов Coelastrella [Iyer et al., 2015; Luo et al., 2016];
- возможность одновременного использования биомассы С. rubescens как полифункционального сырья для получения каротиноидов с различной биологической активностью (лютеина и кетокаротиноидов группы астаксантина), незаменимых жирных кислот (линолевой и альфа-линоленовой) и биодизеля, что существенно снизит затраты на производство каждого из продуктов.
Поставленная задача достигается тем, что в Способе культивирования микроводоросли Coelastrella rubescens для получения каротиноидов и липидов, включающем культивирование методом двухстадийной накопительной культуры на питательной среде с соблюдением на I («зеленой») стадии фотопериода 15 ч свет/9 ч темнота, с переводом полученной культуры на II («красную») путем разведения полученной биомассы питательной средой ВВМ, редуцированной по азоту и фосфору, с одновременным переходом на круглосуточный режим освещения с интенсивностью ФАР 280 μЕ⋅м-2⋅с-1, предусмотрены следующие отличия. На I («зеленой») стадии С. rubescens культивируют в течение 11 суток на питательной среде МВВМ при nнач=1.1-1.3 кл⋅мл-1 и постоянном pH 7, поддерживаемом контролируемой подачей газообразного СО2 в культуру, соблюдая условия культивирования: I - 140 μЕ⋅м-2⋅с-1, Т - 25-26°C, скорость продувки воздухом - 1 л⋅мин-1⋅л-1. На II («красной») стадии при разведении биомассы в 11 раз до nнач≈2.5×106 кл⋅мл-1 водоросли культивируют в течение 8 суток. В состав питательной среды МВВМ (г/л дистиллированной воды) входят: NaNO3 - 134; MgSO4⋅7H2O - 0,075; NaCl - 0,03; K2HPO4⋅3H2O - 004; KH2PO4 - 0,1; Na2-ЭДТА - 0,05; KOH - 0,03; H3BO3 - 0,011; ZnSO4⋅7H2O - 0,0094; MnCl2⋅4H2O - 0,0014; Na2MoO4⋅2H2O - 0,0024; CuSO4⋅5H2O - 0,0016; Co(NO3)2⋅6H2O - 0,0005; FeSO4⋅7H2O - 0,005; CaCl2 - 0,019; H2SO4 конц - 1 мкл.
Для достижения технического результата изобретения культуру водоросли С. rubescens выращивают оптимизированным двухстадийным методом в сочетании всех наиболее эффективных приемов по интенсификации роста и метаболизма водоросли, разработанных авторами, и направленных на достижение коммерчески значимого выхода целевых продуктов (каротиноидов и липидов с различными функциональными свойствами).
Заявляемый Способ культивирования микроводоросли Coelastrella rubescens для получения каротиноидов и липидов отличается от прототипа следующими параметрами: а) культивированием водоросли на «зеленой» стадии на модифицированной питательной среде МВВМ в режиме рН-стата, создаваемого контролируемой подачей в среду газообразного СO2 до рН 7; б) увеличением на «зеленой» стадии внешней освещенности культуры в 2.3 раза; в) сокращением продолжительности «зеленой» стадии с 21 до 11 сут; г) использованием более щадящего способа индукции биосинтеза Аст в клетках (без использования химических индукторов биосинтеза Аст), предотвращающим потери «зеленой» биомассы при переводе культуры на «красную» стадию культивирования; д) использованием дополнительных аналитических методов контроля технико-химических характеристик биомассы (ФЭЖХ и ГЖХ-МС), позволяющих производить ее отбор в наиболее оптимальные сроки.
Сходство с прототипом заключается в использовании общего принципа культивирования каротиногенных микроводорослей - метода двухстадийной накопительной культуры, основанного на стресс-индукции биосинтеза Аст путем сочетания острого дефицита элементов питания и высокой освещенности.
Изобретение поясняется таблицами и иллюстрациями.
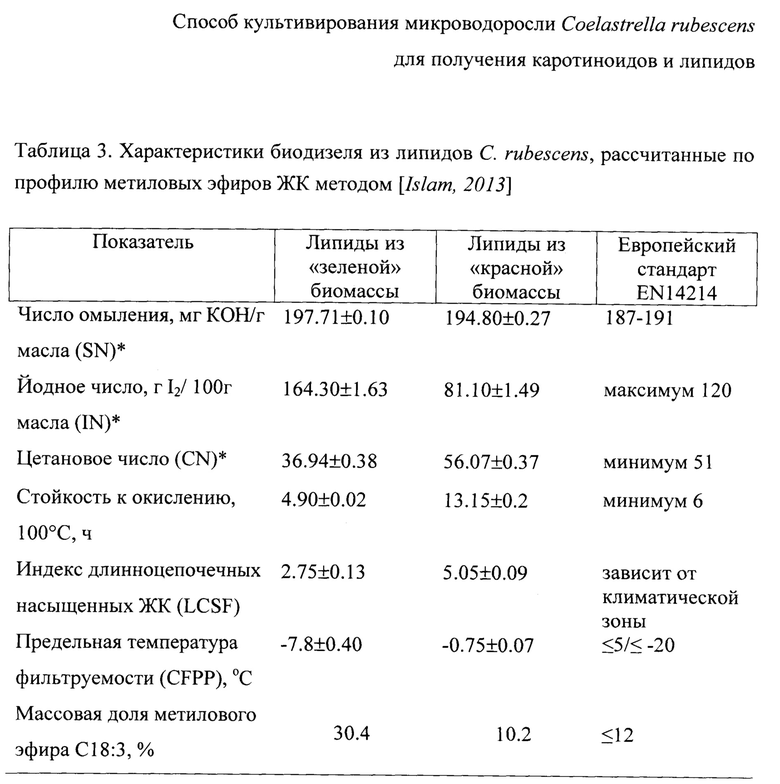
Фиг. 1 - Динамика численности клеток Coelastrella rubescens на «зеленой» стадии культивирования;
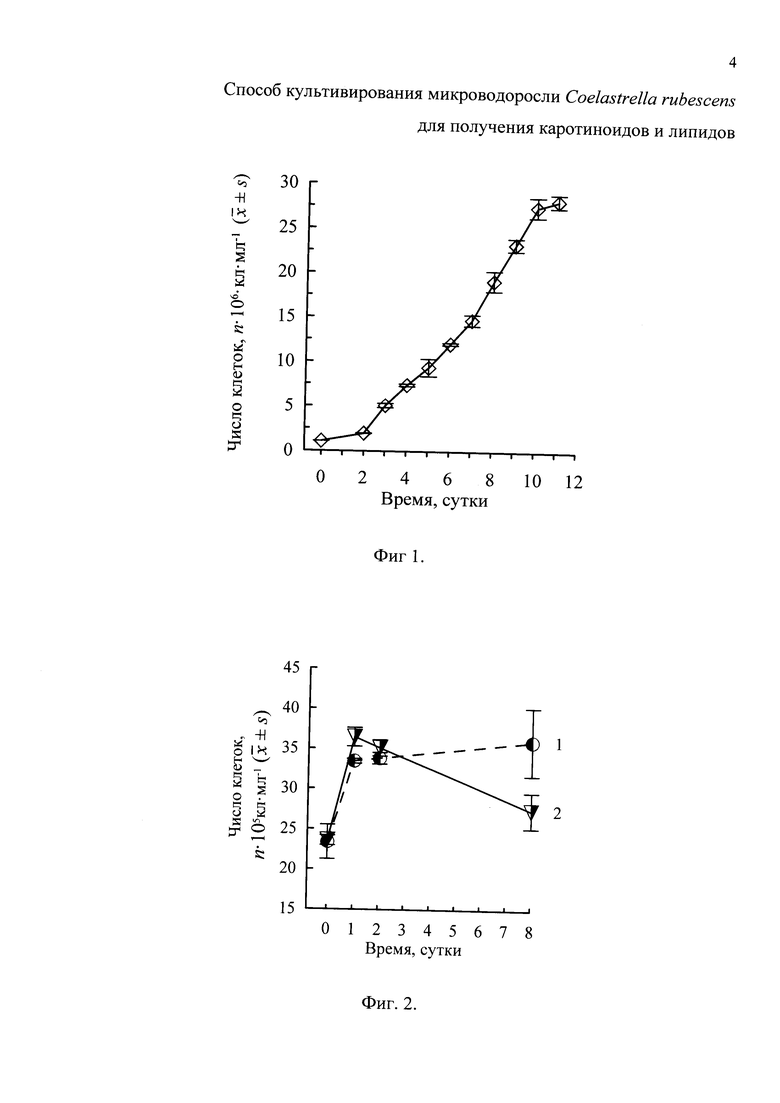
Фиг. 2 - Динамика численности клеток Coelastrella rubescens на «красной» стадии при культивировании заявляемым способом (1) и с применением ацетата натрия (2);
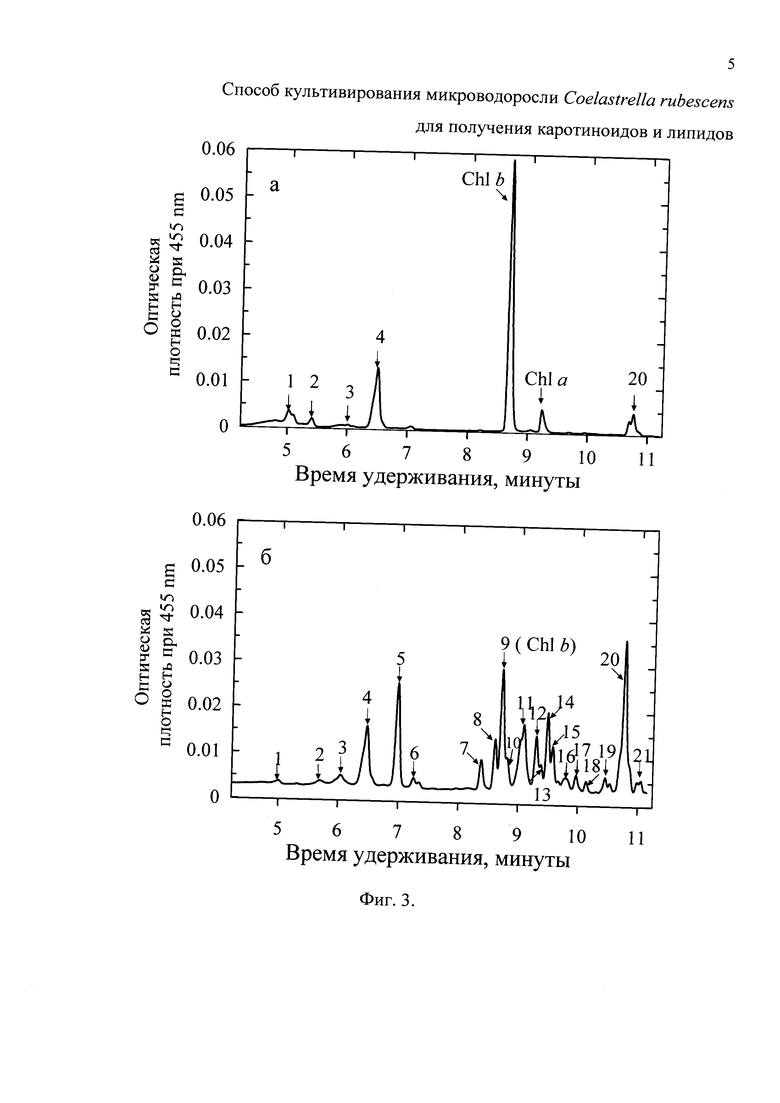
Фиг. 3 - Состав суммарных каротиноидов Coelastrella rubescens в конце «зеленой» (а) и «красной» (б) стадий культивирования: 1 - неоксантин. 2 - виолаксантин. 3 - антераксантин. 4 - лютеин + зеаксантин. 5 - кантаксантин. 6 - изокантаксантин. 7, 10, 12, 13, 16 - моноэфиры астаксантина. 8, 14, 15, 17 - моноэфиры адониксантина. 11 - моноэфиры адониксантина + эхиненон. 18, 19, 21 - диэфиры астаксантина. 20 - α - и β-каротин.
Для реализации предлагаемого способа получения биомассы С.rubescens используют штамм Coelastrella (Scotiellopsis) rubescens IPPAS H-350 (Vinatzer/Innsbruck V 195 = CCALA 475), который выращивают методом двухстадийной накопительной культуры. На I («зеленой») стадии С. rubescens культивируют в режиме pH-стата (pH 7) в условиях, благоприятных для роста и накопления в культуре первичных Кар и незаменимых ЖК (линолевой и α-линоленовой). Полученная в конце «зеленой» стадии биомасса С. rubescens, состоящая из метаболически активных делящихся клеток, может быть использована (частично или целиком) как самостоятельное сырье для получения смеси ксантофиллов (лютеина, зеаксантина, неоксантина и β-каротина) и незаменимых ЖК С18:2ω и С18:3ω пищевого назначения, а также (частично или целиком) в качестве инокулята для проведения II («красной») стадии культивирования с целью получения ККар группы Аст и технических липидов. В этом случае «зеленую» культуру частично или полностью (в зависимости от требуемых целевых продуктов) подвергают комплексному стресс-воздействию, индуцирующему переход клеток С. rubescens в фазу покоя и накопление в них ACT и триацилглицеринов со специфическим составов ЖК, пригодных для получения биодизеля. Перевод «зеленой» культуры на «красную» стадию осуществляется путем создания острого дефицита азота и фосфора в среде (путем 11-кратного разведения культуры редуцированной по N и Р средой ВВМ) и одновременного резкого увеличения освещенности клеток, которое достигается за счет существенного снижения плотности культуры при ее разведении и 2-х кратного увеличения интенсивности ФАР. Пример реализации способа культивирования C. rubescens для получения кетокаротиноидов группы астаксантина и липидов для биодизеля.
Пример реализации способа.
Получение инокулята (посевного материала).
Штамм IPPAS Н-350 с момента получения из коллекции микроводорослей Института физиологии растений РАН (2006 г) до проведения исследования хранили в лабораторных стеклянных пробирках на агаризованной питательной среде ВВМ (1.5%) при Т=15-16°С и I=40 μЕ⋅м-2⋅с-1 с пересевом каждые 45 суток. Для получения инокулята биомассу с твердой среды ВВМ перенесли в жидкую среду МВВМ и выращивали в течение 7 суток в стеклянных конических колбах объемом 250 мл при естественном рассеянном свете (I=30 μЕ⋅м-2⋅с-1), Т=20-22°C и продувке стерильным воздухом со скоростью 0.3 л⋅мин-1⋅л-1 культуры. Полученную культуру центрифугировали при 800-1000g в течение 5 мин, супернатант удалили, осадок клеток перенесли в колбы объемом 1 л со свежей средой МВВМ и снова культивировали в течение 7 дней при 100 μЕ⋅м-2⋅с-1, Т 20-22°C. Последнюю процедуру повторили дважды. Биомассу, собранную после 2-цикла культивирования при I=100 μЕ⋅м-2⋅с-1 развели в свежей среде МВВМ и использовали в качестве инокулята для засева экспериментальных колб. Численность клеток в инокуляте составляла 1.44⋅108 кл⋅мл-1, в размерной структуре культуры преобладали молодые мелкие клетки с объемом, равным 30-80 мкм3 (80%).
Проведение «зеленой» стадии.
Инокулят вносили в 3-х повторностях в стеклянные конические колбы объемом 1 л с таким расчетом, чтобы nнач во всех колбах составляла около 1.0⋅106 кл⋅мл-1 при общем объеме культуры 0.45 л (3.8 мл инокулята + 447 мл среды МВВМ). В состав питательной среды входили (г/л дистиллированной воды): NaNO3 - 1.34; MgSO4⋅7H2O - 0.075; NaCl - 0.03; K2HPO4⋅3H2O - 004; KH2PO4 - 0,1; Na2-ЭДТА - 0.05; KOH - 0.03; H3BO3 - 0.011; ZnSO4⋅7H2O - 0.0094; MnCl2⋅4H2O - 0.0014; Na2MoO4⋅2H2O - 0.0024; CuSO4⋅5H2O - 0.0016; Co(NO3)2⋅6H2O - 0.0005; FeSO4⋅7H2O - 0.005; CaCl2 - 0.019; H2SO4конц - 1 мкл. pH среды поддерживали на уровне 7 ед. путем дробной подачи в культуру газообразного CO2 (по ГОСТ 8050-85), контролируемой цифровым pH-контроллером (Aqua Medic pH 2001С, Германия) и электромагнитым клапаном (Camozzi А7Е, Италия). Интенсивность ФАР I составляла 140 μЕ⋅м-2⋅с-1, ФП - 15 ч свет/9 ч темнота, Т - 25-26°C. Культуры непрерывно продували воздухом со скоростью 0.5 л⋅мин-1⋅л-1 при помощи воздушного насоса (Resun АСО-9630. Китай). Продолжительность I стадии составляла 11 суток.
При этих условиях динамика численности клеток С. rubescens на «зеленой» стадии имела типичный для накопительной культуры характер (Фиг. 1). Ее ростовые характеристики составляли: μмакс - (1.1±0.02) сут-1 (что было выше, чем в прототипе в 4.4 раза), μср - (0.35±0.001) сут-1 (что было выше, чем в прототипе в 2.3 раза). Средняя продуктивность культуры по клеткам (Pncp) равнялась (25.2±0.28)×105 кл.⋅мл-1⋅сут-1, продуктивность по сухому веществу (PCBcp) - 112.68±2.74 мг⋅л-1⋅сут-1.
Содержание суммарных Кар в биомассе, собранной на 11-е сутки, достигало 2.1±0.17% СВ при Ркар, равной 2.2±0.08 мг⋅л-1⋅сут-1. В составе Кар доминировали лютеин/зеаксантин (51.9% от суммы), неоксантин (18.1%) и α- и β-каротины (10.6%). Аст и интермедиаты его биосинтеза в биомассе отсутствовали (табл. 1).
Содержание липидов в культуре и биомассе на 11-е сут составляло соответственно 520.38±16.43 мг⋅л1 и 39.68±5.43% СВ, средняя Рлип - 47±3.2 мг⋅л-1⋅сут-1. В составе жирных кислот преобладали полиненасыщенные кислоты (66.2% от суммы), причем на долю двух высокоценных ЖК С18:2Δ9,12 и С18:3Δ9,12,15 (эссенциальных предшественников арахидоновой, эйкозапентаеновой и докозагексаеновой ПНЖК), приходилось 20.8 и 30.4% соответственно (табл. 2).
При необходимости полученная «зеленая» биомасса может быть использована (частично или целиком) как сырье для получения смеси Кар (лютеина, зеаксантина, неоксантина и β-каротина) и незаменимых ЖК пищевого и медицинского назначения.
Проведение «красной» стадии.
Для получения Аст и липидов технического назначения «зеленую» культуру разводили в 11 раз редуцированной средой ВВМ следующего состава (г/л дистиллированной воды): NaNO3 - 24.1; MgSO4⋅7H2O - 75; NaCl - 25, K2HPO4⋅3H2O - 7.5; KH2PO4. - 17.5; Na2-ЭДТА - 50; KOH - 31; H3BO3 - 11; ZnSO4⋅7H2O - 8.82; MnCl2⋅4H2O - 1.44; Na2MoO4⋅2H2O - 2.42; CuSO4⋅5H2O - 1.57; Co(NO3)2⋅6H2O - 0.49; FeSO4⋅7H2O - 4.98; CaCl2 - 18.9; H2SO4. конц. - 1
Для этого 40 мл «зеленой» культуры и 410 мл обедненной по Р и N среды вносили в стеклянные конические колбы объемом 1 л (в 3-х кратной повторности). При этом nнач на «красной» стадии во всех колбах была сходной и составляла около 2.5×106 кл⋅мл-1, т.е. снизилась по отношению к концу «зеленой» стадии примерно в 11 раз. Внешнюю освещенность увеличили вдвое (до 280 μE⋅м-2⋅с-1), что в совокупности со снижением численности клеток обеспечило резкий (примерно 22-кратный) положительный градиент их облученности. Культуру перевели на круглосуточное освещение с продувкой только воздухом со скоростью 1 л⋅мин-1⋅л-1 и поддерживали в накопительном режиме при указанных условиях в течение 8 суток. Использованный прием индукции биосинтеза ККар позволил устранить характерный для прототипа отход клеток (их число не сократилось, а выросло в 1.56 раза) (Фиг. 2) и увеличить продуктивность культуры по Кар и липидам. При условии использования для проведения «красной» стадии всей «зеленой» биомассы выход суммарных Кар из литра исходной культуры с начальной плотностью 1.1×106 кл⋅мл-1 (или 0.17 г/л СВ) за 19 суток составил 52.3 мг⋅л-1, средняя Ркар, - 2.75 мг⋅л-1⋅сут-1 (что в 1.6 раза выше, по сравнению с прототипом), содержание суммарных Кар в биомассе 0.9-1.0% СВ, доля ККар группы Аст в суммарных Кар - 68%, доля всех форм Аст - 26% (табл. 1, Фиг. 3).
Содержание липидов в разбавленной культуре за 8 сут «красной» стадии выросло почти в 12 раз (с 45.9 до 534 мг⋅л-1). Средняя Рлип. культуры составила 61.73±4.08 мг⋅л-1 сут-1, что в 7.7-10 раз превысило Рлип у других видов Coelastrella, выращивавшихся одностадийным методом [Iyer et al., 2015; Luo et al., 2016]. При расчете на всю «зеленую» культуру, полученную на I стадии, средняя за 19 сут Рлип составила 138.71±25.34 мг⋅л-1 сут-1 при содержании липидов в конечной биомассе 58.07±1.35% СВ. По этому признаку С. rubescens превосходил близкородственные виды примерно в 2 раза [Abe et al. 2007; Iyer et al., 2015; Luo et al., 2016]. В результате стресса в составе жирных кислот произошли существенные изменения: доля триненасыщенных ЖК (С16:3Δ4,7,10 и С18:3Δ9,12,15) снизилась примерно в 3 раза при одновременном почти 5-кратном увеличении доли мононенасыщенной олеиновой кислоты (С18:1Δ9) (табл. 2). Это, в свою очередь, определило приобретение липидами С.rubescens технических характеристик, соответствующих требованиям европейского стандарта на биодизель EN14214 (табл. 3).
Источники информации
1. Минюк Г.С., Челебиева Э.С., Чубчикова И.Н., Данцюк Н.В., Дробецкая И.В., Сахонь Е.Г., Чивкунова О.Б., Чеканов К.А., Лобакова Е.С., Сидоров Р.А., Соловченко А.Е. Влияние рН и СO2 на рост и метаболизм микроводоросли Coelastrella (Scotiellopsis) rubescens // Физиология растений. 2016. Т. 63. С. 601-610.
2. Чубчикова И.Н. Влияние состава среды на содержание вторичных каротиноидов у микроводоросли Scotiellopsis rubescens (Chlorophyceae) // Морск. экол. журн. 2012. Т. XI, №4. С. 95-101.
3. Чубчикова И.Н, Минюк Г.С., Дробецкая И.В. Вторичный каротиногенез у зеленой микроводоросли Scotiellopsis rubescens Vinatz. в условиях природной освещенности и температуры // Экология моря. 2010. Вып. 81. С. 77-81.
4. Чубчикова И.Н., Минюк Г.С., Дробецкая И.В., Данцюк Н.В. Оптимизация состава питательной среды для выращивания микроводоросли Scotiellopsis rubescens Vinatz. (Chlorophyceae) // Ученые записки Крымского федерального университета им. В.И. Вернадского. Серия «Биология, химия». 2013. Том 26 (65). №4. С. 196-205.
5. Abe К., Hattori Н., Hirano М. Accumulation and antioxidant activity of secondary carotenoids in the aerial microalga Coelastrella striolata var. multistriata // Food Chem. 2007. Vol. 100. pp. 656-661.
6. Ahmed F., Fanning K., Schuhmann H., Netzel M., Schenk P.M. Microalgae: a valuable source of natural carotenoids with potential health benefits // Ed. Yamaguchi M. Carotenoids: Food Sources, Production and Health Benefits. Hauppauge, NY: Nova Science Publishers, 2013. P. 143-164.
7. Bentley G. The health effects of dietary unsaturated fatty acids // Nutr.Bull. 2007. Vol. 32(1). P. 82-84.
8. Bold H.С. The cultivation of algae // Bot. Rev. - 1942. - 8. - P. 69 - 138.
9. Han D.X., Li Y.T., Нu Q. Astaxanthin in microalgae: pathways, functions and biotechnological implications. Algae, 2013 Vol. 28 (2), P. 131-147.
10. Hong J.W., Kim O.H., Kim H., Jo S.W., Cho H.W., Yoon H.S. Mass Cultivation from a Korean Raceway Pond System of Indigenous Microalgae as Potential Biofuel Feedstock // Oil Gas. Res. 2016. Vol. 2: 108. Doi:10.4172/ogr.1000108.
11. Нu C.-W., Chuang L.T., Yu P.C., Chen C.-N. Pigment production by thermotolerant microalga Coelastrella sp. F50 // Food Chem. 2013. Vol. 138. P. 2071-2078.
12. Islam M.A., Magnusson M., Brown R.J., Ayoko G.A., Nabi Md. N., Heimann K. Microalgal species selection for biodiesel production based on fuel properties derived from fatty acid profiles // Energies. 2013. Vol. 6. P. 5676-5702.
13. Iyer G., Nagle V., Gupte Y.V., Desai S., Iyer M., Moramkar N., Sawant V. Characterization of High Carotenoid Producing Coelastrlla oocystiformis and its Anti-Cancer Potential // Int. J. Curr. Microbiol. App. Sci. 2015. Vol. 4 (10). P. 527-536.
14. Kaufnerova V.,  M. The demise of the genus Scotiellopsis Vinatzer (Chlorophyta) // Nova Hedwigia. 2013. V. 97. P. 415-428.
M. The demise of the genus Scotiellopsis Vinatzer (Chlorophyta) // Nova Hedwigia. 2013. V. 97. P. 415-428.
15. Lemoine Y., Schoefs B. Secondary ketocarotenoid astaxanthin biosynthesis in algae: a multifunctional response to stress // Photosynth. Res. 2010. Vol. 106. P. 155-177.
16. Lunn J., Theobald H.E. The health effects of dietary unsaturated fatty acids // Nutr. Bull. 2006. Vol. 31(3). P. 178-224.
17. Luo L., He H., Yang C., Wen S., Zeng G., Wu M., Zhou Z., Lou W. Nutrient removal and lipid production by Coelastrella sp.in anaerobically and aerobically treated swine wastewater // Biores. technol., 2016. Vol. 216. P. 135-141.
18. Maoka T., Yasui H., Ohmori A., Tokuda H., Suzuki N., Osawa A., Shindo K., Ishibashi T. Anti-oxidative, anti-tumor-promoting, and anticarcinogenic activities of adonirubin and adonixanthin // J. Oleo Sci. 2013, Vol. 62. P. 181-186.
19. Rasmussen В.M., Vessby В., Uusitupa М., Berglund L., Pedersen E., Riccardi G., Rivellese A.A., Tapsell L., Hermansen K. For KANWU Study Group. Effects of dietary saturated, monounsaturated, and n-3 fatty acids on blood pressure in healthy subjects // Am. j. clin. nutr. 2006. Vol. 83(2). P. 221-226.
20. Surai P.F. The antioxidant properties of canthaxanthin and its potential effects in the poultry eggs and on embryonic development of the chick. Part 2. // World's Poultry Sci. J. 2012. Vol. 68 P. 717-726.
21. Yuan J.-P., Peng J., Yin K., Wang J.-H. Potential health-promoting effects of astaxanthin: A high-value carotenoid mostly from microalgae // Mol. Nutr. Food Res. 2011. V. 55. P. 150-165.


| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРОВОДОРОСЛИ CHROMOCHLORIS ZOFINGIENSIS ДЛЯ ПОЛУЧЕНИЯ ЛИПИДОВ И КАРОТИНОИДОВ | 2019 |
|
RU2715039C1 |
| ШТАММ МИКРОВОДОРОСЛИ Coelastrella sp. - ПРОДУЦЕНТ СМЕСИ НАТУРАЛЬНОГО БИОАНТИОКСИДАНТА АСТАКСАНТИНА И β-КАРОТИНА | 2018 |
|
RU2703420C1 |
| ШТАММ МИКРОВОДОРОСЛИ Bracteacoccus aggregatus - ПРОДУЦЕНТ СМЕСИ НАТУРАЛЬНОГО БИОАНТИОКСИДАНТА АСТАКСАНТИНА И ПРОВИТАМИНА А | 2019 |
|
RU2710131C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОМАССЫ СПИРУЛИНЫ С ВЫСОКИМ СОДЕРЖАНИЕМ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ | 2022 |
|
RU2790921C1 |
| ШТАММ ЗЕЛЁНОЙ МИКРОВОДОРОСЛИ DUNALIELLA SALINA ДЛЯ ПОЛУЧЕНИЯ ЕЁ БИОМАССЫ В ПРОМЫШЛЕННЫХ УСЛОВИЯХ | 2021 |
|
RU2788527C2 |
| Штамм микроводоросли Chlorella sp. VADA 2020, продуцирующий биомассу, пригодную для использования в пищевых целях | 2021 |
|
RU2770484C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ОДНОКЛЕТОЧНОЙ ЗЕЛЕНОЙ ВОДОРОСЛИ HAEMATOCOCCUS PLUVIALIS ДЛЯ ПОЛУЧЕНИЯ АСТАКСАНТИНА | 2014 |
|
RU2541455C1 |
| Способ культивирования Cyanobacterium sp. для получения полисахаридов | 2023 |
|
RU2820201C1 |
| ШТАММ МИКРОВОДОРОСЛИ Chlorella vulgaris ДЛЯ ПОЛУЧЕНИЯ ЛИПИДОВ В КАЧЕСТВЕ СЫРЬЯ ДЛЯ ПРОИЗВОДСТВА МОТОРНОГО ТОПЛИВА | 2012 |
|
RU2508398C1 |
| ШТАММ МИКРОВОДОРОСЛИ Desmodesmus sp. ДЛЯ КОНВЕРСИИ УГЛЕКИСЛОТЫ ИЗ ПРОМЫШЛЕННЫХ СБРОСНЫХ ГАЗОВ В СЫРЬЕ ДЛЯ ПРОИЗВОДСТВА БИОТОПЛИВА И КОРМОВЫХ ДОБАВОК | 2013 |
|
RU2555520C2 |
Изобретение относится к биотехнологии микроводорослей и может быть использовано для получения каротиноидов и липидов. Предложен способ культивирования микроводоросли Coelastrella rubescens для одновременного получения кетокаротиноидов группы астаксантина и липидов для производства биодизеля. В способе предусмотрено культивирование Coelastrella rubescens методом двухстадийной накопительной культуры на питательной среде с соблюдением на I («зеленой») стадии режима освещения 15 ч свет/9 ч темнота. Перед культивированием на II («красной») стадии на среде ВВМ культуру подвергают комплексному стресс-воздействию - разведению полученной биомассы питательной средой ВВМ, редуцированной по азоту и фосфору, и переходят на круглосуточный режим освещения. На I («зеленой») стадии С. rubescens культивируют в течение 11 суток на питательной среде МВВМ при nнач=1.1-1.3 кл⋅мл-1 и рН 7, соблюдая условия культивирования: I-140 μE⋅м-2⋅с-1, Т - 25-26°С, скорость продувки воздухом - 1 л⋅мин-1⋅л-1. На II («красной») стадии культивирования выполняют 11-кратное разведение культуры, которую затем культивируют в течение 8 суток. Изобретение обеспечивает: увеличение среднесуточной продуктивности культуры по каротиноидам на 53% и сокращение периода культивирования с 27 до 19 суток. 1 з.п. ф-лы, 3 ил., 3 табл., 1 пр.
1. Способ культивирования микроводоросли Coelastrella rubescens для получения каротиноидов и липидов, включающий культивирование методом двухстадийной накопительной культуры на питательной среде с соблюдением на I («зеленой») стадии фотопериода 15 ч свет/9 ч темнота, перевод полученной культуры на II («красную») стадию культивирования путем разведения полученной биомассы редуцированной по азоту и фосфору питательной средой ВВМ с одновременным переходом на круглосуточный режим освещения с интенсивностью ФАР 280 μЕ⋅м-2⋅с-1, отличающийся тем, что на I («зеленой») стадии С. rubescens культивируют в течение 11 суток на питательной среде МВВМ при nнач=1.1-1.3 кл⋅мл-1 и постоянном pH 7, поддерживаемым контролируемой подачей газообразного CO2 в культуру, соблюдая условия культивирования: I - 140 μЕ⋅м-2⋅с-1, Т - 25-26°C, скорость продувки воздухом - 1 л⋅мин-1⋅л-1; а на II («красной») стадии при разведении биомассы в 11 раз до nнач≈2.5×106 кл⋅мл-1 водоросли культивируют в течение 8 суток.
2. Способ по п. 1, отличающийся тем, что в состав питательной среды МВВМ (г/л дистиллированной воды) входят: NaNO3 - 1,34; MgSO4⋅7H2O - 0,075; NaCl - 0,03; K2HPO4⋅3H2O - 004; KH2PO4 - 0,1; Na2-ЭДТА - 0,05; KOH - 0,03; H3BO3 - 0,011; ZnSO4⋅7H2O - 0,0094; MnCl2⋅4H2O - 0,0014; Na2MoO4⋅2H2O - 0,0024; CuSO4⋅5H2O - 0,0016; Co(NO3)2⋅6H2O - 0,0005; FeSO4⋅7H2O - 0,005; CaCl2 - 0,019; H2SO4 конц - 1 мкл.
| МИНЮК Г.С., ЧЕЛЕБИЕВА Э.С., ЧУБЧИКОВА И.Н | |||
| Особенности вторичного каротиногенеза у Bracteacoccus minor (CHLOROPHYTA) в условиях двухстадийной культуры., Algologia, 2015, 25 (1), 21-34 | |||
| МИНЮК Г.С., ЧЕЛЕБИЕВА Э.С., ЧУБЧИКОВА И.Н | |||
| и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ПИЛЬНЫЙ СТАНОК ДЛЯ ВАЛКИ ЛЕСА И ПОПЕРЕЧНОЙ РАСПИЛОВКИ | 1921 |
|
SU601A1 |
| ЧУБЧИКОВА И.Н., МИНЮК Г.С., ДРОБЕЦКАЯ И.В | |||
| Вторичный каротиногенез у зеленой микроводоросли Scotiellopsis rubescens vinatz в условиях природных освещенности и температуры, Экология моря, 2010, т.81, с | |||
| Спускная труба при плотине | 0 |
|
SU77A1 |
| ЧУБЧИКОВА И.Н., МИНЮК Г.С., ДРОБЕЦКАЯ И.В | |||
| и др | |||
| Оптимизация состава питательной среды для выращивания микроводоросли Scotiellopsis rubescens vinatz (CHLOROPHYCEAE), Ученые записки Таврического национального Университета им | |||
| В.И | |||
| Вернадского | |||
| Серия "Биология, химия ", 2013, N 4, Т | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| Пылеочистительное устройство к трепальным машинам | 1923 |
|
SU196A1 |
| ШТАММ МИКРОВОДОРОСЛИ HAEMATOCOCCUS PLUVIALIS - ПРОДУЦЕНТ НАТУРАЛЬНОГО АСТАКСАНТИНА | 2014 |
|
RU2573944C1 |
Авторы
Даты
2018-07-11—Публикация
2017-03-31—Подача