Область применения
Изобретение относится к фотобиотехнологии и представляет собой новый штамм микроводоросли Bracteacoccus aggregatus (syn. cohaerens), предназначенный для одновременного получения натуральных биоантиоксидантов астаксантина и β-каротина (провитамина А). Данное изобретение возможно применять при получении сырья для изготовления косметики, БАД, функционального питания, кормовых и пищевых добавок, а также, при биотехнологической очистке сточных вод с попутным получением ценных каротиноидов (астаксантин и β-каротин).
Уровень техники
Известно, что род Bracteacoccus Tereg 1923 является типовым для семейства Bracteacoccaceae, расположенный в системе у основания филогенетического древа порядка Scenedesmales. Примечательной особенностью порядка является наличие во всех без исключения 9 семействах видов, обладающих специфическим, генетически обусловленным признаком - способностью к вторичному каротиногенезу. Как правило, это - обитатели солоноватых и временных пресноводных водоемов, а также почвенные и аэрофитные водоросли [Чубчикова И.Н. и др. Хлорококковые микроводоросли как потенциальный источник природных кетокаротиноидов. Экология моря. 2009, Вып. 77, с. 77-83; Abe K., Hattori Н., Hirano М. Accumulation and antioxidant activity of secondary carotenoids in the aerial microalga Coelastrella striolata var. multistriata. Food Chem. 2007, т. 100, №2, p. 656-661; Fujii K., Imazato E., Nakashima H. et al. Isolation of non fastidious microalgae with astaxanthin-accumulation property and its potential for application to aquaculture. Aquaculture. 2006, т. 261, р. 285-293]. Известны зеленые микроводоросли Bracteacoccus minor и Bracteacoccus giganteus у которых среднесуточный выход суммарных каротиноидов из литра исходной культуры может составлять 2,3 мг⋅л-1⋅сут-1 и относительное содержание в них всех форм астаксантина достигает 50% от суммы [Чубчикова И.Н. и др., Скрининг одноклеточных зеленых водорослей как потенциальных источников природных кетокаротиноидов. Особенности роста и вторичного каротиногенеза у представителей рода Bracteacoccus (Chlorophyceae). Морск. экол. журн. 2011, т. 10, №1, с. 91-97].
Известно, что зеленая микроводоросль Coelastrella rubescens (ранее Scotiellopsis rubescens Vinatzer) [Kaufnerova V., Elias M. The demise of the genus Scotiellopsis Vinatzer (Chlorophyta). Nova Hedwigia. 2013, 97, pp. 415-428] относится к группе экстремобионтных одноклеточных эукариот, способных при неблагоприятных условиях внешней среды переходить из вегетативного состояния в стадию покоя и накапливать в образующихся апланоспорах коммерчески значимое количество (1-2% сухого веса) специфических защитных кетокаротиноидов - продуктов многостадийного ферментативного окисления β-каротина в астаксантин [Lemoine, Y., Schoefs, В. Secondary ketocarotenoid astaxanthin biosynthesis in algae: a multifunctional response to stress. Photosynth. Res. 2010, 106, pp. 155-177; Чубчикова И.Н. Влияние состава среды на содержание вторичных каротиноидов у микроводоросли Scotiellopsis rubescens (Chlorophyceae). Морск. экол. журн. 2012, т. 11, №4, с. 95-101; Минюк Г.С. и др. Влияние рН и CO2 на рост и метаболизм микроводоросли Coelastrella (Scotiellopsis) rubescens. Физиология растений. 2016, т. 63, с. 601-610].
Астаксантин - кетокаротиноид красного цвета, наиболее эффективный природный антиокислитель, оказывающий благотворное влияние на организм человека и животных. Астаксантин широко востребован как компонент косметических формул, лекарственных средств, пищевых и кормовых добавок [Guerin, М. et al. Haematococcus astaxanthin: applications for human health and nutrition. Trends Biotechnol. 2003, 21, pp. 210-216.; Han, D. et al. Biology and commercial aspects of Haematococcus pluvialis. In Handbook of Microalgal Culture: Applied Phycology and Biotechnology. 2 ed.; Richmond, A.; Hu, Q., Eds. Blackwell: 2013; pp. 388-405]. Единственным источником астаксантина у животных является пища [Lorenz, R.T., Cysewski, G.R. Commercial potential for Haematococcus microalgae as a natural source of astaxanthin. Trends Biotechnol. 2000, 18, 160-167]. В настоящее время значительная доля астаксантина синтезируется химическим путем, но синтетический пигмент, в отличие от натурального, является рацематом с большим содержанием стереоизомеров, не обладающих биологической активностью. Для промышленного получения натурального астаксантина используют преимущественно штаммы зеленой микроводоросли Haematococcus pluvialis Flotow, способной накапливать астаксантин до 3-6% сухого веса [Lemoine, Y., Schoefs, В. Secondary ketocarotenoid astaxanthin biosynthesis in algae: a multifunctional response to stress. Photosynth. Res. 2010, 106, pp. 155-177] благодаря способности к образованию богатых астаксантином неподвижных коккоидных клеток, устойчивых к неблагоприятным условиям среды [Boussiba, S. Carotenogenesis in the green alga Haematococcus pluvialis: cellular physiology and stress response. Physiol. Plant. 2000, 108, pp. 111-117; Solovchenko, A. Physiology and adaptive significance of secondary carotenogenesis in green microalgae. Russ. J. Plant Physiol. 2013, 60, pp. 1-13]. Известно изобретение [RU 2573944 C1, 27.01.2016]: штамм микроводорослей Haematococcus pluvialis ВМ1, пригодный для получения астаксантина и характеризующийся способностью расти на средах, содержащих до 27% хлорида натрия, высокой способностью к накоплению астаксантина - до 3-6% сухой биомассы и обладающий высокой продуктивностью (до 300 мг сухой биомассы в сутки с 1 л культуры). Известен способ культивирования Haematococcus pluvialis для промышленного производства биомассы, обогащенной астаксантином [патент US 6022701 С16Р] (культивирование при освещении в диапазоне 30-140 мкЕ ФАР/(м2⋅с) и температуре 15-28°С с использованием в качестве среды водопроводной воды и барботированием культуры газо-воздушной смесью с 1,5% CO2). Также, известен способ эффективного производства каротиноидов, включая астаксантин, путем получения мутантных штаммов Haematococcus pluvialis [ЕР 1995325 А1, 26.11.2008] ССАР 34/8 и SAG 34-1b с повышенной способностью к накоплению каротиноидов.
Однако для известных штаммов микроводорослей Haematococcus pluvialis характерна невысокая скорость роста, узкий диапазон физико-химических параметров культивирования и высокий риск контаминации, требующий применения дорогостоящих закрытых систем культивирования, чрезмерно повышающих цену на натуральный астаксантин.
Также известен штамм дрожжей Phaffia rhodozyma [RU 2385925 C1, 10.04.2010] ВКПМ Y-2982, способный продуцировать астаксантин (7,0-8,0 мг/г сухой биомассы в условиях оптимальной (60 лк) освещенности). Доля астаксантина в общем пуле каротиноидов может составлять до 70%. Описан штамм одноклеточной зеленой водоросли Chlorella zofingiensis АТСС 30412 [US 7063957 B2, 20.06.2006], способный к гетеротрофному росту в темноте и после 2-х недель роста способный накапливать до 10 мг/л астаксантина.
β-каротин - оранжевый пигмент, непредельный углеводород из группы каротиноидов. Встречается во всех зеленых растениях и достаточно давно используется в качестве красителя в пищевой промышленности и кормах для животных [L.J. Borowitzka, М.А. Borowitzka, Т.Р. Moulton. The mass culture of Dunaliella salina for fine chemicals: From laboratory to pilot plant. Hydrobiologia. 1984, 1, pp. 115-121]. Кроме этого, β-каротин используется в качестве компонента биологически активных добавок и витаминных комплексов. Общий объем мирового рынка β-каротина оценивается примерно в 270-300 млн. долл. США, из них 20-30% - доля природного β-каротина [Borowitzka М.А. High-value products from microalgae-their development and commercialisation. Journal of Applied Phycology. 2013, V. 25, Issue 3, pp. 743-756].
В настоящее время известны микроводоросли - перспективные продуценты натурального β-каротина, особенно Dunaliella salina (до 10% β-каротина от сухого веса клеток) [Oren, A. Adaptation to life at high salt concentrations in Archaea, Bacteria, and Eukarya (Gunde-Cimerman, N., Oren A., and Plemenitas, A., eds), Springer. N.Y., 2005, pp. 493-502]. Известен штамм водоросли Dunaliella salina Teod. CALU - 834, выделенный из прибрежной зоны лимана Сасык [SU 1324627 A1], который используется в микробиологической промышленности как продуцент белка и β-каротина, в качестве кормовых, витаминных и биостимулирующих добавок в рацион животных, а также для утилизации отходов. Также известен штамм одноклеточных водорослей Dunaliella salina - продуцент биоантиоксидантов [RU 2497945 C2, 20.06.2012] и способ культивирования Dunaliella salina [RU 2541446 C1, 10.02.2015]. Известно изобретение, охватывающее сразу несколько новых галотолерантных гипераккумулирующих каротиногенных штаммов микроводоросли Dunaliella salina DF15, DF17 и DF40 [WO 2018141978, 09.08.2018] с коммерчески значимым потенциалом накопления β-каротина. В последние годы гриб Blakeslea trispora стал важным альтернативным источником природного β-каротина, конкурирующего с водорослевым продуктом [ЕР 1367131 А1, 03.12.2003].
Основными недостатками перечисленных выше примеров являются отсутствие способности к одновременному накоплению коммерчески значимых количеств астаксантина и β-каротина.
Известна зеленая почвенная микроводоросль Bracteacoccus minor (Chodat)  накопливающая смесь вторичных кетокаротиноидов с доминированием диацильных эфиров астаксантина (37-42% суммы) [Г.С. Минюк и др. Особенности вторичного каротиногенеза у Bracteacoccus minor (Chlorophyta) в условиях двухстадийной культуры. Algologia. 2015, 25(1): 21-34].
накопливающая смесь вторичных кетокаротиноидов с доминированием диацильных эфиров астаксантина (37-42% суммы) [Г.С. Минюк и др. Особенности вторичного каротиногенеза у Bracteacoccus minor (Chlorophyta) в условиях двухстадийной культуры. Algologia. 2015, 25(1): 21-34].
Недавно описан штамм Scenedesmus sp. CCALA 1074 который был выделен из планктона реки Силь (Швейцария, 47°10'47.982''N, 8°41'33.504''Е) [Pavel  et al. The role of light and nitrogen in growth and carotenoid accumulation in Scenedesmus sp. Algal Research. 2016, 16, pp. 69-75]. Сумма каротиноидов на ранней стационарной фазе роста культуры Scenedesmus sp. CCALA 1074 составляла 2,3% от сухого веса, при этом доля астаксантина составляла 9%, а β-каротина 5,4% от суммы каротиноидов. Scenedesmus sp. CCALA 1074 успешно выращивают в открытом тонкослойном фотобиореакторе объемом 150 л., при этом, он демонстрирует превосходный рост, высокую продуктивность каротиноидов и термотолерантность, что делает этот штамм перспективным кандидатом для биотехнологического производства богатой каротиноидами биомассы.
et al. The role of light and nitrogen in growth and carotenoid accumulation in Scenedesmus sp. Algal Research. 2016, 16, pp. 69-75]. Сумма каротиноидов на ранней стационарной фазе роста культуры Scenedesmus sp. CCALA 1074 составляла 2,3% от сухого веса, при этом доля астаксантина составляла 9%, а β-каротина 5,4% от суммы каротиноидов. Scenedesmus sp. CCALA 1074 успешно выращивают в открытом тонкослойном фотобиореакторе объемом 150 л., при этом, он демонстрирует превосходный рост, высокую продуктивность каротиноидов и термотолерантность, что делает этот штамм перспективным кандидатом для биотехнологического производства богатой каротиноидами биомассы.
Известен штамм микроводоросли Coelastrella striolata var. multistriata, который был выделен с поверхности горной породы в Шизуоке, Япония [Katsuya Abe et al. Accumulation and antioxidant activity of secondary carotenoids in the aerial microalga Coelastrella striolata var. multistriata. Food Chemistry. 2007, 100, pp. 656-661]. Авторы заявляют о способности данной микроводоросли синтезировать значительное количество смеси каротиноидов, таких как кантаксантин, астаксантин и β-каротин. Красновато-оранжевые клетки микроводоросли могут накапливать до 56,0 мг вторичных каротиноидов на 1 г. биомассы. По содержанию в клетках каротиноиды кантаксантин, астаксантин и β-каротин составляли 47,5, 1,5 и 7,0 мг/г.сух.веса соответственно.
Наиболее близким аналогом (прототипом) является микроводоросли Coelastrella rubescens и способ их культивирования для получения каротиноидов и липидов [RU 2661086 С1, 11.07.2018]. Для реализации предлагаемого способа получения биомассы Coelastrella rubescens используют штамм Coelastrella (Scotiellopsis) rubescens IPPAS H-350 (Vinatzer/Innsbruck V195=CCALA475), который выращивают методом двухстадийной накопительной культуры. Полученную в конце «зеленой» стадии биомассу С. rubescens, состоящую из метаболически активных делящихся клеток, авторы предлагают использовать (частично или целиком) как самостоятельное сырье для получения смеси ксантофиллов (лютеина, зеаксантина, неоксантина и β-каротина) и незаменимых ЖКС18:2ω и С18:3ω пищевого назначения, а также (частично или целиком) в качестве инокулята для проведения II («красной») стадии культивирования с целью получения кетокаротиноидов группы астаксантина и технических липидов. Содержание суммарных каротиноидов в биомассе в конце «зеленой» стадии роста культуры, собранной на 11-е сутки, достигало 2,1±0,17% СВ при продуктивности 2,2±0,08 мг⋅л-1⋅сут-1. В составе каротиноидов доминировали лютеин/зеаксантин (51,9% от суммы), неоксантин (18,1%), α- и β-каротины (10,6%). Астаксантин и интермедиаты его биосинтеза в биомассе отсутствовали. При условии использования для проведения «красной» стадии всей «зеленой» биомассы выход суммарных каротиноидов из литра исходной культуры с начальной плотностью 1,1×106 кл⋅мл-1 (или 0,17 г/л СВ) за 19 суток составил 52,3 мг⋅л-1, средняя продуктивность - 2,75 мг⋅л-1⋅сут-1, содержание суммарных каротиноидов в биомассе 0,9-1,0% СВ, доля астаксантина составляла 26%. К недостаткам прототипа можно отнести незначительное содержание β-каротина в биомассе на «красной» стадии культивирования и недостаточно высокую долю астаксантина, а также весьма скромные показатели по содержанию суммарных каротиноидов.
Технической проблемой, на решение которой направлено заявляемое изобретение, является получение штамма микроводоросли с высоким уровнем одновременного накопления астаксантина и β-каротина (не менее 55 масс. % астаксантина и 35 масс. % β-каротина) при сохранении высокой продуктивностью культуры (не менее 3,6 мг⋅л-1⋅сут-1 по сумме каротиноидов), способностью к биоизъятию фосфатов из среды (не менее 2,3 мг⋅л-1⋅сут-1).
Раскрытие изобретения
Техническая проблема была решена штаммом микроводоросли Bracteacoccus aggregatus (syn. cohaerens) BM 5/15 IPPAS C-2045, выделенным из водоема на севере России, республика Карелия, д. Лоухи, Проток между Белым морем и Нижним Ершовским озером, 66°32'07''N, 33°03'59''Е, депонированным в Российской Коллекции Микроводорослей при учреждении Институт физиологии растений им. К.А. Тимирязева Российской Академии Наук (IPPAS) с присвоенным идентификатором IPPAS С-2045.
Впервые был получен штамм микроводоросли, способный к высокому уровню одновременного накопления смеси астаксантина и β-каротина, обеспечивающий высокую продуктивность при выращивании, обладающий способностью к биоизъятию фосфатов из среды.
Сущность изобретения заключается в том, что для достижения цели используют зеленую микроводоросль Bracteacoccus aggregatus (syn. cohaerens) штамм IPPAS C-2045, выделенный и идентифицированный авторами заявки из водоема на севере России, республика Карелия, д. Лоухи, Проток между Белым морем и Нижним Ершовским озером (66°32'07''N, 33°03'59''Е). В результате полученный штамм характеризуется высокой способностью к одновременному накоплению астаксантина и β-каротина (55-60 масс. % и 35-40 масс. %, соответственно от суммы каротиноидов на «красной» стадии культивирования), при этом сумма каротиноидов оценивается в 2,4-2,6% сухого веса, культура обладает высокой продуктивностью (100-200 мг сухой биомассы и 3,6-3,8 мг каротиноидов в сутки с 1 л культуры), способностью к биоизъятию фосфатов из среды (2,3-2,6 мг⋅л-1⋅сут-1).
Для достижения технического результата изобретения культуру водоросли Bracteacoccus aggregatus (syn. cohaerens) штамм IPPAS C-2045 выращивают двухстадийным методом, направленным на достижение коммерчески значимого выхода целевых продуктов (смеси астаксантина и β-каротина).
В результате получают в сутки 100-200 мг⋅л-1 биомассы (по сухому весу) и 3,6-3,8 мг каротиноидов в сутки с 1 л культуры, биомасса содержит 2,4-2,6% каротинодоиов, в которых доля астаксантина 55-60 масс. % и β-каротина 35-40 масс. %. Предлагаемый штамм культуры микроводоросли характеризуется способностью к биоизъятию фосфатов из среды (2,3-2,6 мг⋅л-1⋅сут-1).
Краткое описание чертежей
Изобретение поясняется следующими чертежами.
На Фиг. 1 представлены клетки микроводорослей Bracteacoccus aggregatus (syn. cohaerens) штамм IPPAS C-2045 в условиях вегетативного культивирования и накопления каротиноидов - светлопольная микроскопия.
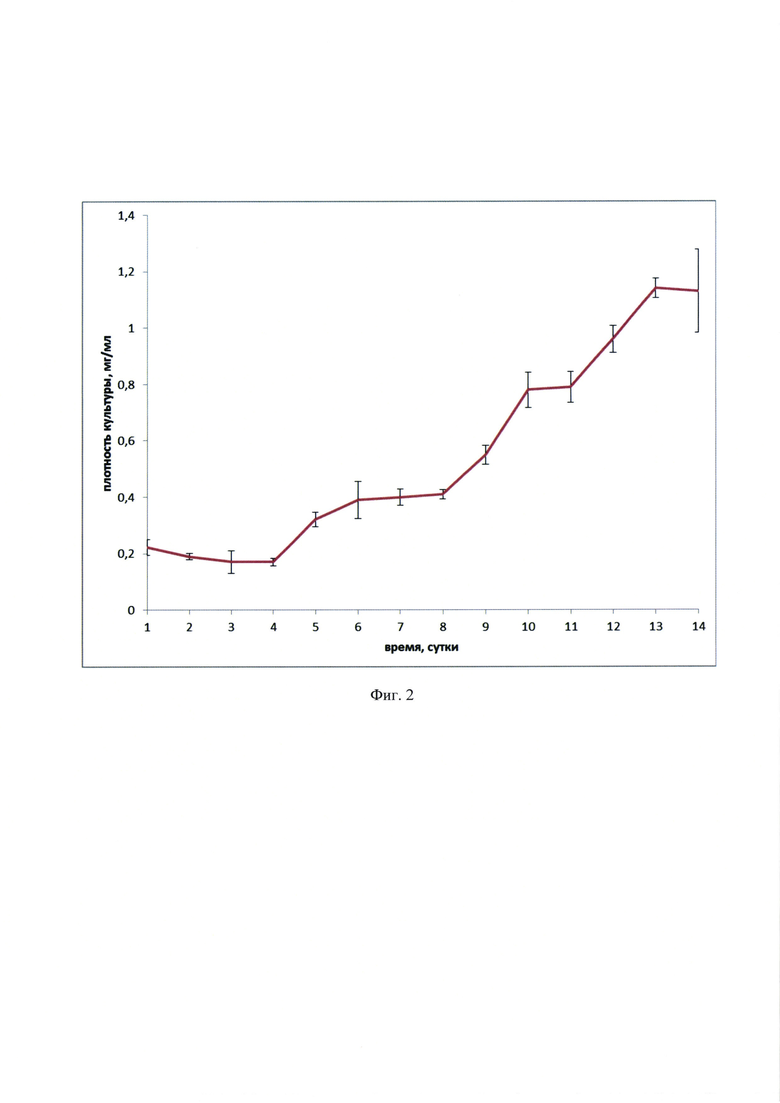
На Фиг. 2 Накопление сухой массы Bracteacoccus aggregatus (syn. cohaerens) IPPAS C-2045 при культивировании на среде BG-11 в условиях вегетативного роста показаны средние значения и стандартные отклонения (2 биологические повторности).
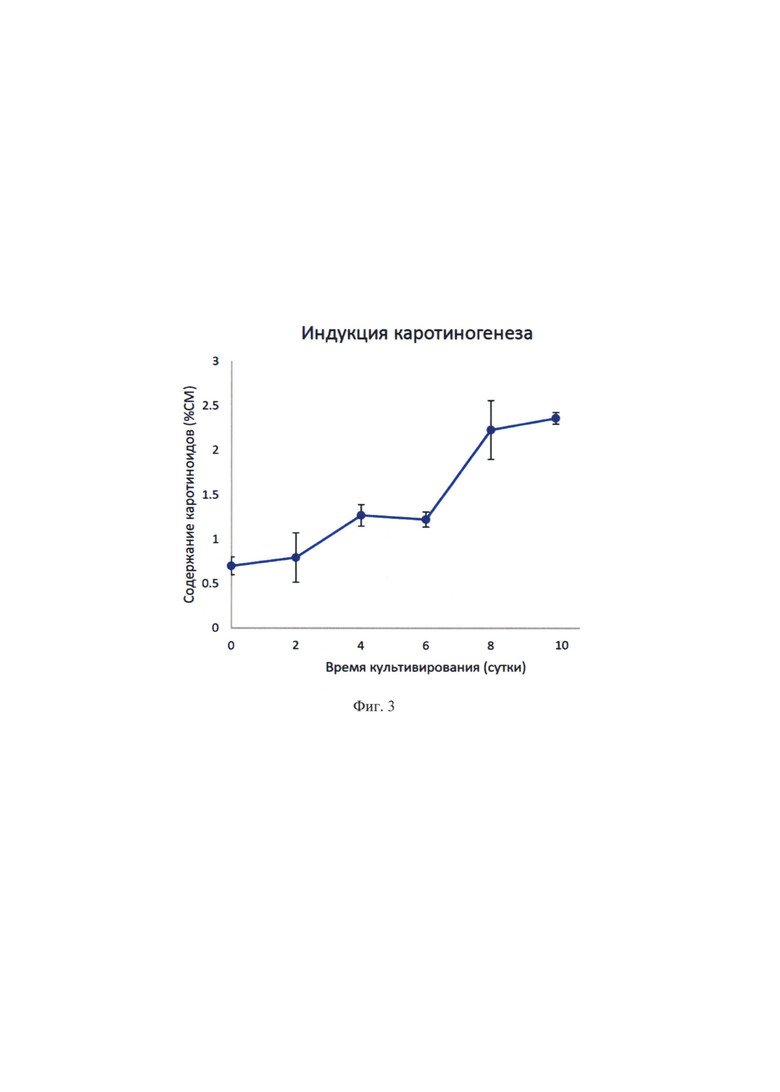
На Фиг. 3 показано содержание каротиноидов в клетках культуры Bracteacoccus aggregatus (syn. cohaerens) штамм IPPAS C-2045.
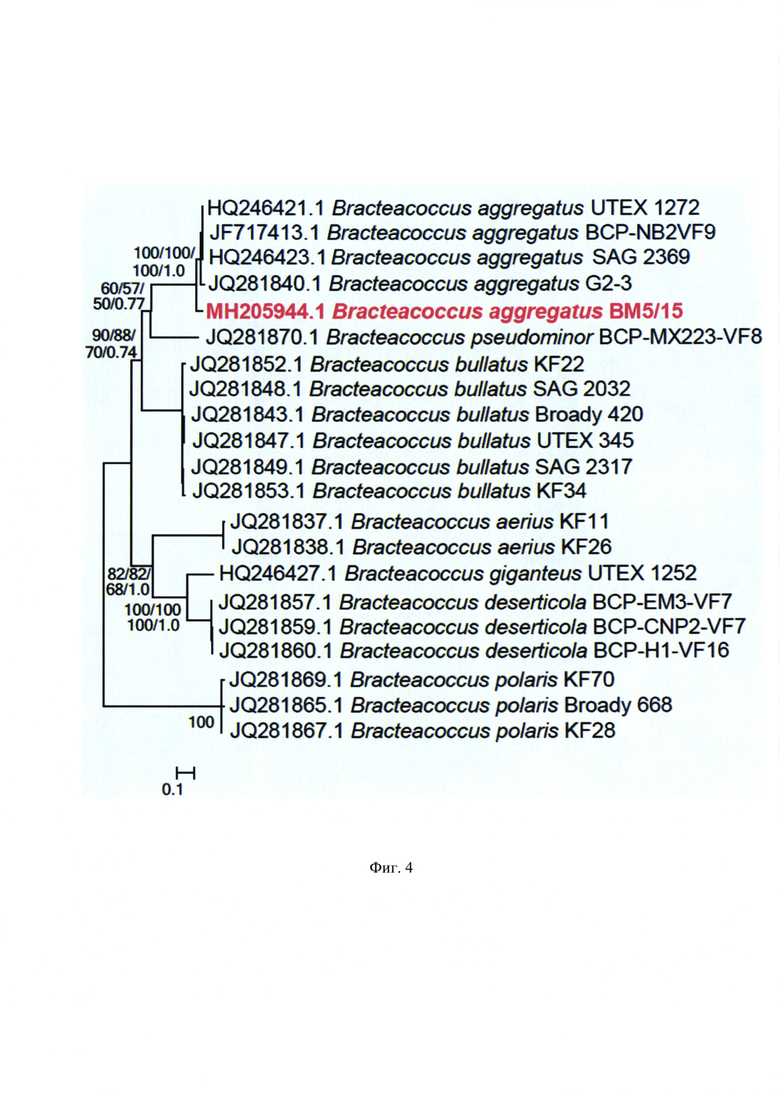
На Фиг. 4 показано филогенетичское дерево штамма Bracteacoccus aggregatus (syn. cohaerens) IPPAS C-2045 на основании последовательности внутреннего транскрибируемого спейсера 2 (ITS2) ядерного рибосомального кластера генов, полученное при помощи алгоритма максимального правдоподобия. Точность различных элементов топологии, определенная при помощи bootstrap-теста, указана около них (в процентах). Масштаб - число нуклеотидных замен в расчете на число позиций в множественном выравнивании.
Осуществление изобретения
Штамм Bracteacoccus aggregatus (syn. cohaerens) IPPAS C-2045 выделен из водоема на севере России, республика Карелия, д. Лоухи, Проток между Белым морем и Нижним Ершовским озером (66°32'07''N, 33°03'59''Е). Отселектирован в результате скрининга по способности к биосинтезу каротиноидов (смеси астаксантина и β-каротина).
Способ выделения - из накопительной культуры, полученной путем инокуляции среды BG-11 отобранными клетками с последующим рассевом по твердой среде BG-11.
Морфологические признаки.
Характер роста на среде хранения: гомогенный, на поздних стадиях возможна агрегация. Цитологическое описание:
форма клеток, размер: штамм В. aggregatus (syn. cohaerens) IPPAS C-2045 представлен небольшими коккоидными клетками (до 9 мкм диаметром) или эллиптическими (Фиг. 1). При росте на среде BG-11 часто формируются многоклеточные кластеры. При снижении скорости роста или переносе в неблагоприятные условия клетки существенно увеличиваются в размере (до 20 мкм) и приобретают оранжевую окраску (Фиг. 1). Пиреноид отсутствует.
а) хроматофор (форма, цвет): один крупный париетальный хроматофор, с увеличением размеров появляются более мелкие хлоропласты зеленого цвета.
б) при культивировании жгутиковые стадии не обнаружены (однако по литературным данным в редких случаях встречаются зооспоры с двумя жгутиками [ et al., 2013]).
et al., 2013]).
в) особенности морфологии в условиях оптимального роста: клетки мелкие, имеют зеленую окраску, коккоидные (Фиг. 1).
г) при длительном хранении клетки увеличиваются в размерах, приобретают оранжевую окраску (Фиг. 1).
д) особенности морфологии в условиях, обеспечивающих максимальный выход продукта: клетки приобретают оранжевую окраску. Наблюдается редукция фотосинтетического аппарата, уменьшение объема занимаемого пластидами, в строме пластид появляются многочисленные пластоглобулы.
Физиологические свойства штамма.
Оптимальные условия культивирования:
Для культивирования используют жидкую питательную среду BG-11 [Stanier, R. et al. Purification and properties of unicellular blue-green algae (order Chroococcales). Microbiology and Molecular Biology Reviews. 1971, 35(2): 171-205], готовится из стоковых растворов; все компоненты можно автоклавировать.
Среда BG-11 следующего состава:
K2НРO4 - 0,04 г/л, NaNO3 - 0,3 г/л, MgSO4⋅7H2O - 0,075 г/л,
СаСl2⋅2Н20 - 0,036 г/л, лимонная кислота - 0,006 г/л,
FeSO4⋅7H20 - 0,006 г/л, Na2CO3 - 0,2 г/л, ЭДТА- 0,001 г/л,
раствор FeSO4⋅7H20 (7,45 г/л)+ЭДТА (5,57 г/л) - 1 мл/л,
раствор микроэлементов (Н3ВО3 - 2,86 г/л, MnCl2⋅4Н20 - 1,86 г/л, ZnSO4⋅7H20 - 0,22 г/л, CuSO4⋅5H20 - 0,08 г/л, Na2MoO4⋅7H20 - 0,39 г/л, Co(NO3)2⋅6H20 - 0,05 г/л) - 1 мл/л,
рН в начале культивирования - 7,4-7,7
рН в конце культивирования 6,9-7,2
скорость барботажа воздухом 0,8-1,2 л/мин
температура 23-25°С
освещение круглосуточное, освещенность 60-80 моль квантов /м2/сек
тип ламп: светодиодные, 4700 К
Для индукции каротиногенеза и перехода на «красную» стадию культивирования, клетки, находящиеся на экспоненциальной фазе роста, дважды промывают безазотной средой BG-110 [Rippka, R. et al. Generic Assignments, Strain Histories and Properties of Pure Cultures of Cyanobacteria. Journal of General Microbiology. 1979, 111, 1-61), ресуспензируют в 300-400 мл этой среды и инкубируют при освещении 460-480 мкмоль фотонов ФАР м-2⋅с-1 в течение 7-10 суток.
После этого отделяют биомассу от среды центрифугированием с ускорением не менее 3000 g в течение 4-5 минут.
Продуктивность в оптимальных условиях культивирования:
по накоплению биомассы (сухой вес, мг/л в сутки): 100-200;
выход полезного продукта: сумма каротиноидов оценивается в 2,4-2,6% сухого веса, продуктивность по каротиноидам 3,6-3,8 мг в сутки с 1 л культуры, одновременное накопление астаксантина и β-каротина (55-60 масс. % и 35-40 масс. %, соответственно от суммы каротиноидов).
Биотехнологическая характеристика штамма.
Штамм микроводоросли Bracteacoccus aggregatus (syn. cohaerens) IPPAS C-2045, депонированный в Российской Коллекции Микроводорослей при учреждении Институт физиологии растений им. К.А. Тимирязева Российской Академии Наук (IPPAS) с присвоенным идентификатором IPPAS С-2045, продуцент смеси натурального биоантиоксиданта астаксантина и β-каротина (провитамина А) в соотношении 55-60 масс. % и 35-40 масс. % от суммы каротиноидов соответственно, которая составляет 2,4-2,6% сухого веса, при продуктивности по сумме каротиноидов 3,6-3,8 мг в сутки с 1 л культуры, способный к биоизъятию фосфатов из среды со скоростью 2,3-2,6 мг⋅л-1⋅сут-1.
Условия культивирования, обеспечивающие максимальный уровень (выход) полезного свойства (продукта): любой стрессор, снижающий скорость деления клеток (освещение 460-480 мкмоль фотонов ФАР м-2⋅с-1, исключение азота из состава среды культивирования).
Генотипирование.
Выделение ДНК.
Для выделения ДНК отбирают 5-10 мг биомассы культуры микроводоросли. Выделение ДНК проводят методом фенол-хлороформной экстракции. Перед выделением проводят трехкратное замораживание образцов при -4°С с последующим оттаиванием. Это необходимо для разрушения прочных клеточных стенок водорослей. Образцы инкубируют в течение часа в 300 мкл ТЕ буфера (10 mM Tris-Cl (рН 7.5), 1 mM EDTA), содержащего 10 мг/мл лизоцима при 37°С. Затем добавляют 2% додецилсульфата натрия и инкубируют в течение часа при 40°С и интенсивном перемешивании. Далее добавляют 1 М NaCl и оставляют на ночь на льду для высаливания белков. После чего проводят процедуру фенол-хлороформной экстракции. Чистоту образцов ДНК оценивают методом электрофореза в 1,5% агарозном геле. Полученные образцы ДНК хранят в ТЕ-буфере при -4°C.
Филогенетический анализ.
Филогенетические взаимоотношения штамма IPPAS С-2045 и близких штаммов оценивают по сходству частичной последовательности гена 18s pРНК. Представленное филогенетическое дерево получено методом NJ (Фиг. 4). Филогенетический анализ проведен в программе BioNJ. Визуализация проведена в программе TreeDyn 198.3. Процент репликативных деревьев, в которые были объединены таксоны в бустрап-тесте показаны рядом ветками.
В результате проведенного филогенетического анализа установлена видовая принадлежность исследуемого изолята. Изолят идентифицирован как Bracteacoccus aggregatus (syn. cohaerens) и получил идентификатор IPPAS С-2045; после депонирования в Российской Коллекции Микроводорослей при учреждении Институт физиологии растений им. К.А. Тимирязева Российской Академии Наук (IPPAS) ему присвоен идентификатор IPPAS С-2045.
Кинетика поглощения фосфатов
Кинетику поглощения фосфатов культурой микроводоросли Bracteacoccus aggregatus (syn. cohaerens) штамм IPPAS C-2045 оценивают по остаточному содержанию ортофосфата в среде методом ионной хроматографии. Начальная плотность культуры - 0,5 г с.в.⋅л-1, освещенность - 60-80 мкмоль фотонов ФАР м-2⋅с-1. При добавлении ортофосфата до конечной концентрации 400 мкмоль⋅л-1 к культуре штамма IPPAS С-2045, предварительно проинкубированной в течение 10 суток на среде BG-11, не содержащей источника фосфора, наблюдается быстрое поглощение ортофосфата. В результате способность штамма микроводоросли IPPAS С-2045 к биоизъятию фосфатов из среды составляет 2,3-2,6 мг⋅л-1⋅сут-1 в пересчете на ортофосфат.
Настоящее изобретение поясняется конкретными примерами выполнения, которые не являются единственно возможным, но наглядно демонстрирует возможность достижения требуемого технического результата.
Для культивирования использовали жидкую питательную среду BG-11 [Stanier, R. et al. Purification and properties of unicellular blue-green algae (order Chroococcales). Microbiology and Molecular Biology Reviews. 1971, 35(2): 171-205], готовилась из стоковых растворов.
Среда BG-11 следующего состава:
K2НРO4 - 0,04 г/л, NaNO3 - 0,3 г/л, MgSO4⋅7H20 - 0,075 г/л,
СаСl2⋅2Н20 - 0,036 г/л, лимонная кислота - 0,006 г/л,
FeSO4⋅7H20 - 0,006 г/л, Na2CO3 - 0,2 г/л, ЭДТА - 0,001 г/л,
раствор FeSO4⋅7H20 (7,45 г/л)+ЭДТА (5,57 г/л) - 1 мл/л,
раствор микроэлементов (Н3BO3 - 2,86 г/л, MnCl2⋅4Н20 - 1,86 г/л, ZnSO4⋅7H20 - 0,22 г/л, CuSO4⋅5H20 - 0,08 г/л, Na2MoO4⋅7H20 - 0,39 г/л, Co(NO3)2⋅6H20 - 0,05 г/л) - 1 мл/л,
рН в начале культивирования - 7,4-7,7
рН в конце культивирования 6,9-7,2
скорость барботажа воздухом 0,8-1,2 л/мин
Штамм культивировали при температуре 23-25°С и круглосуточном освещении (освещенность 60-80 мкмоль фотонов ФАР м-2⋅с-1, тип ламп: светодиодные, 4700 К).
Культивирование проводилось в течении 10-14 суток.
Для индукции каротиногенеза и перехода на «красную» стадию культивирования, клетки, находящиеся на экспоненциальной фазе роста, дважды промывают безазотной средой BG-110 [Rippka, R. et al. Generic Assignments, Strain Histories and Properties of Pure Cultures of Cyanobacteria. Journal of General Microbiology. 1979, 111, 1-61), ресуспензируют в 300-400 мл этой среды и инкубируют при освещении 460-480 мкмоль фотонов ФАР м-2⋅с-1 в течение 7-10 суток.
После этого отделяют биомассу от среды центрифугированием с ускорением не менее 3000 g в течение 4-5 минут.
Анализ каротиноидов проводят сразу после отделения биомассы, либо через 30 суток, сохраняя образцы при -80°С. Для пигментного анализа, используют спектрофотометрические и хроматографические методы [Chekanov K. et al. Accumulation of Astaxanthin by a New Haematococcus pluvialis Strain BM1 from the White Sea Coastal Rocks (Russia). Marine Drugs. 2014, 12, 4504-4520].
Продуктивность в оптимальных условиях культивирования:
по накоплению биомассы (сухой вес, мг/л в сутки): 100-200;
выход полезного продукта: сумма каротиноидов оценивается в 2,4-2,6% сухого веса, продуктивность по каротиноидам 3,6-3,8 мг в сутки с 1 л культуры, одновременное накопление астаксантина и β-каротина (55-60 масс. % и 35-40 масс. %, соответственно от суммы каротиноидов). Результаты представлены на фиг. 2 и 3.
Таким образом штамм микроводоросли Bracteacoccus aggregatus (syn. cohaerens) IPPAS C-2045 демонстрирует высокую способность к одновременному накоплению астаксантина и провитамина А (β-каротина), что не встречается у известных аналогов. Накопление астоксантина и β-каротина составляет 55-60 масс. % и 35-40 масс. % соответственно от суммы каротиноидов на «красной» стадии культивирования, что в 2 раза превосходит аналогичный показатель у известного прототипа. Сумма каротиноидов составляет 2,4-2,6% сухого веса, что в 2,5 раза выше, по сравнению с прототипом. Штамм Bracteacoccus aggregatus (syn. cohaerens) IPPAS C-2045 сохраняет высокую продуктивность (100-200 мг сухой биомассы и 3,6-3,8 мг каротиноидов в сутки с 1 л культуры) и одновременную способность к биоизъятию фосфатов из среды со скоростью 2,3-2,6 мг⋅л-1⋅сут-1, что превышает уровень известных аналогов, не способных к одновременному накоплению астаксантина и β-каротина.
Штамм микроводоросли Bracteacoccus aggregatus (syn. cohaerens) IPPAS C-2045 успешно прошел предварительное тестирование и этап пробного культивирования в экспериментальных и полупромышленных фотобиореакторах объемом до 50 л.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ МИКРОВОДОРОСЛИ Coelastrella sp. - ПРОДУЦЕНТ СМЕСИ НАТУРАЛЬНОГО БИОАНТИОКСИДАНТА АСТАКСАНТИНА И β-КАРОТИНА | 2018 |
|
RU2703420C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРОВОДОРОСЛИ COELASTRELLA RUBESCENS ДЛЯ ПОЛУЧЕНИЯ КАРОТИНОИДОВ И ЛИПИДОВ | 2017 |
|
RU2661086C1 |
| ШТАММ МИКРОВОДОРОСЛИ HAEMATOCOCCUS PLUVIALIS - ПРОДУЦЕНТ НАТУРАЛЬНОГО АСТАКСАНТИНА | 2014 |
|
RU2573944C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРОВОДОРОСЛИ CHROMOCHLORIS ZOFINGIENSIS ДЛЯ ПОЛУЧЕНИЯ ЛИПИДОВ И КАРОТИНОИДОВ | 2019 |
|
RU2715039C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ОДНОКЛЕТОЧНОЙ ЗЕЛЕНОЙ ВОДОРОСЛИ HAEMATOCOCCUS PLUVIALIS ДЛЯ ПОЛУЧЕНИЯ АСТАКСАНТИНА | 2014 |
|
RU2541455C1 |
| Морская микроводоросль - продуцент лютеина и иных каротиноидов | 2024 |
|
RU2835137C1 |
| Морская микроводоросль - продуцент бета-каротина, лютеина и иных каротиноидов | 2024 |
|
RU2835138C1 |
| ШТАММ МИКРОВОДОРОСЛИ Lobosphaera (Parietochloris) sp. - ПРОДУЦЕНТ АРАХИДОНОВОЙ КИСЛОТЫ | 2020 |
|
RU2737139C1 |
| ШТАММ ЗЕЛЁНОЙ МИКРОВОДОРОСЛИ DUNALIELLA SALINA ДЛЯ ПОЛУЧЕНИЯ ЕЁ БИОМАССЫ В ПРОМЫШЛЕННЫХ УСЛОВИЯХ | 2021 |
|
RU2788527C2 |
| Модифицированная нуклеотидная последовательность, кодирующая полипептид, обладающий активностью фитоен синтазы и геранилгеранилпирофосфат синтазы (варианты), ее использование при конструировании трансформантов дрожжей Yarrowia lipolytica, продуцирующих каротиноиды | 2021 |
|
RU2794980C1 |

Изобретение относится к фотобиотехнологии. Предложен штамм микроводоросли Bracteacoccus aggregatus (syn. cohaerens), являющийся продуцентом смеси натурального биоантиоксиданта астаксантина и провитамина А (β-каротина). Штамм депонирован в Российской Коллекции Микроводорослей при учреждении «Институт физиологии растений им. К.А. Тимирязева Российской Академии Наук (IPPAS)» с присвоенным идентификатором IPPAS С-2045. Штамм способен одновременно накапливать высокие уровни астаксантина и β-каротина. 4 ил.
Штамм микроводоросли Bracteacoccus aggregatus, депонированный в Российской Коллекции Микроводорослей при учреждении «Институт физиологии растений им. К.А. Тимирязева Российской Академии Наук» с присвоенным идентификатором IPPAS С-2045, - продуцент смеси натурального биоантиоксиданта астаксантина и провитамина А.
| ЧУБЧИКОВА И.Н | |||
| И ДР | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Особенности роста и вторичного каротиногенеза у представителей рода Вracteacoccus (Сhlorophyceae) | |||
| Морской экологический журнал, N1, Т.Х, 2011, с | |||
| Огнетушитель | 0 |
|
SU91A1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРОВОДОРОСЛИ COELASTRELLA RUBESCENS ДЛЯ ПОЛУЧЕНИЯ КАРОТИНОИДОВ И ЛИПИДОВ | 2017 |
|
RU2661086C1 |
| FUCIKOVA K | |||
| ET AL | |||
| Revision of the genus | |||
Авторы
Даты
2019-12-24—Публикация
2019-07-17—Подача