Настоящее изобретение относится к новым производным тетрагидроциннолина, полезным в качестве ингибиторов 11b-HSD1 (T2D).
Настоящее изобретение, в частности, относится к соединениям формулы (I):
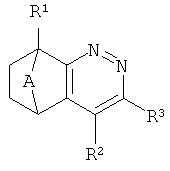
где А представляет собой CRaRb или -CH2-CH2-;
R1 представляет собой водород или алкил;
R2 представляет собой водород или алкил;
R3 представляет собой алкил, циклоалкил, циклоалкилалкил, арил, замещенный арил, 1H-пиразолил или замещенный 1H-пиразолил, где замещенный арил представляет собой арил, замещенный 1-3 заместителями, независимо выбранными из алкила, галогена и галогеналкила и где замещенный 1H-пиразолил представляет собой 1H-пиразолил, замещенный 1-3 заместителями, независимо выбранными из алкила и арила;
Ra представляет собой водород или метил;
Rb представляет собой водород или метил; или
Ra и Rb вместе с атомом углерода, к которому они присоединены, образуют циклопропил, циклобутил или циклопентил;
при условии, что когда Ra и Rb оба представляют собой водород или метил одновременно, тогда R представляет собой (1-метилциклопропил)метил;
и их фармацевтически приемлемым солям и сложным эфирам.
Глюкокортикоиды (кортизол у человека, кортикостерон у мыши и крысы) представляют собой важный класс адренокортикостероидов, который регулирует многочисленные метаболические и гомеостатические процессы и составляет ключевой компонент отклика на стресс. Глюкокортикоиды действуют через внутриклеточные глюкокортикоидные рецепторы и в некоторых тканях через минералкортикоидные рецепторы; оба являются факторами ядерной транскрипции. Глюкокортикоидное действие на целевые ткани зависит не только от циркулирующих концентраций стероида и от клеточной экспрессии рецепторов, но также от внутриклеточных ферментов, которые в основном определяют, в какой степени Глюкокортикоиды обеспечивают доступ к рецепторам в активных формах. 11бета-гидроксистероидные дегидрогеназы (11бета-HSD) катализируют внутреннее превращение принципиально активного 11-гидроксиглюкокортикоида (кортизола у человека) и его неактивных 11-кето-метаболитов (кортизона у человека).
Фермент 11бета-гидроксистероидная дегидрогеназа 1 типа (11бета-НSD1) превращает Глюкокортикоиды из неактивных в активные, тем самым играя основную роль в местном регулировании клеточной концентрации агониста и активируя кортикостероидные рецепторы в целевых тканях. В последних исследованиях, проведенных F. Hoffmann-La Roche, анализировали различия экспрессии генов у худощавых и полных людей, используя методики набора генов, для идентификации специфических изменений генной экспрессии, которые могли бы быть связаны с инсулиновой резистентностью или измененным метаболизмом. Эти исследования показали, что мРНК 11бета-HSD1 примерно в два раза сильнее регулирует в жировой ткани у полных пациентов. Более того, сверхэкспрессия 11бета-HSD1 в адипоцитах мыши приводит к висцеральному ожирению и к синдрому-Х такого фенотипа (статья Masuzaki Н. и др., Science., 2001, Dec 7; 294 (5549), сс.2166-70). Все вместе эти данные хорошо подтверждают важную роль 11бета-HSD1 в вызывании ожирения и ослаблении глюкозного гомеостаза и липидных параметров. Так, селективное ингибирование этого фермента могло бы понизить уровни глюкозы в крови у пациентов с диабетом 2 типа, нормализовать повышенные липидные параметры и/или понизить вес пациентов с ожирением.
Первые фармакологические доказательства того, что ингибирование 11бета-HSD1 у человека могло бы оказать благоприятное действие, были получены с помощью карбеноксолона, противоязвенного лекарственного препарата, который ингибирует как 11бета-HSD1, так и связанный с ним фермент 11бета-HSD2. Лечение карбеноксолоном приводит к повышению чувствительности к инсулину, показывая, что ингибирование 11бета-HSD1 может снижать клеточные уровни кортизола и, следовательно, минимизировать некоторые его неблагоприятные действия (статья Walker и др., J. din. Endocrinol. Metab., 1995, 80, сс. 31155-3159).
11бета-HSD1 экспрессируется в многочисленных тканях, включая печень, жировую ткань, васкулярную гладкую мускулатуру, поджелудочную железу и головной мозг.Его активность зависит от NADP(H), и он имеет относительно низкое сродство с его субстратом (по сравнению с 11бета-HSD1). 11бета-HSD1 в гомогенатах ткани и при очистке является двунаправленным, показывая как реакции 11бета-дегидрогеназы, так и реакции 11бета-редуктазы, с большей стабильностью для активности дегидрогеназы (статья P.M.Stewart и Z.S.Krozowski, Vitam. Horm., 1999, 57, сс.249-324). Однако, когда активность фермента тестировалась на интактных клетках, активность 11бета-редуктазы преобладала, что позволяет получить активные глюкокортикоиды из инертных 11-кетоформ. Такая регенерация глюкокортикоида повышает эффективные внутриклеточные глюкокортикоидные уровни и тем самым усиливает глюкокортикоидную активность. Именно эта повышенная клеточная концентрация кортизола могла бы привести к повышению продуцирования глюкозы печенью, дифференциации адипоцитов и инсулиновой резистентности.
Ингибирование 11бета-HSD1 не только снижает обычные симптомы, связанные с синдромом-Х/диабетом, но также является безопасным и не имеет основных побочных эффектов. Исследования с неспецифическим ингибитором карбеноксолона показали важность разработки специфических ингибиторов 11бета-HSD1. Ингибирование фермента 11бета-HSD2 плохо переносится и приводит к повышению кровяного давления. Наоборот, ингибирование 11бета-HSD1 хорошо переносится, поскольку было обнаружено, что мыши с блокированным 11бета-HSD1 являются здоровыми и устойчивыми к гипергликемии, вызванной ожирением или стрессом (статья Kotelevtsev Y. и др., Proc Nati Acad Sci USA., 1997, Dec 23; 94(26), сс.14924-9). Аналогично, при голодании эти мыши имели ослабленную активацию ключевых ферментов печени, которые участвуют в глюконеогенезе. Кроме того, у этих мышей улучшались липидный и липопротеиновый профили, предполагая, что Ингибирование HSD1 может быть высокоэффективным и безопасным. Последние исследования показали, что ингибиторы 11бета-HSD1 также могли бы быть полезными для снижения высокого кровяного давления (статьи Masuzaki Н. и др., J Clin Invest., 2003, July; 112(1), ее. 83-90; Rauz S. и др., QJM., 2003, July; 96(7), сс.481-90), для улучшение когнитивной способности (статья Sandeep TC. и др., Proc Nati Acad Sci USA., 2004, Apr. 27; 101(17), сс.6734-9) или для улучшения нарушений, связанных с болезнью Альцгеймера. Все вместе Ингибирование 11бета-HSD1 могло бы быть безопасным и эффективным подходом для лечения симптомов диабета, ожирения и других заболеваний.
Соединения формулы (I) и их фармацевтически приемлемые соли и сложные эфиры являются новыми и имеют ценные фармакологические свойства. В частности, они являются ингибиторами 11бета-HSD1 (T2D), и они проявляют селективность в отношении связанного фермента 11бета-HSD2. Следовательно, соединения, которые являются специфическими ингибиторами 11бета-HSD1 (T2D), например, подходят для снижения уровней глюкозы в крови и нормализации липидных параметров у пациентов с диабетом 2 типа путем модулирования локальной концентрации активного глюкокортикоидного кортизола в целевой ткани (печени, жировой ткани).
Соединения настоящего изобретения могут использоваться для профилактики и/или лечения метаболических нарушений, ожирения, дислипидемии и/или диабета, особенно диабета II типа.
Соединения настоящего изобретения далее могут использоваться для профилактики и/или лечения высокого глазного давления, когнитивной способности, гипертензии, болезни Альцгеймера и/или нейродегенерации.
Кроме того, соединения настоящего изобретения могут использоваться для улучшения заживления ран, особенно при местном применении. Более того, соединения настоящего изобретения могут использоваться для улучшения когнитивного ослабления, особенно возрастного ослабления, и ослабления памяти.
Объектами настоящего изобретения являются соединения формулы I и их описанные соли и сложные эфиры как таковые, и их применение в качестве терапевтически активных веществ, способ получения указанных соединений, промежуточные соединения, фармацевтические композиции, лекарственные средства, содержащие указанные соединения, их фармацевтически приемлемые соли и сложные эфиры, применение указанных соединений, сложных эфиров и солей для профилактики и/или терапии заболеваний, особенно для лечения или профилактики нарушения приема пищи, ожирения, дислипидемии и/или диабета, особенно диабета II типа, и применение указанных соединений, солей и сложных эфиров для изготовления лекарственных средств для лечения или профилактики метаболических нарушений, ожирения, дислипидемии и/или диабета, особенно диабета II типа.
Соединения настоящего изобретения также могут быть объединены с агонистами PPAR (альфа, гамма, дельта), DHEA (дегидроэпиандростерон), ингибиторами DPPIV, инсулином и/или ингибиторами липазы, особенно орлистатом.
В настоящем описании термин "алкил", отдельно или в комбинации, обозначает линейную или разветвленную алкильную группу, содержащую от 1 до 8 атомов углерода, предпочтительно линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, и особенно предпочтительно линейную или разветвленную алкильную группу, содержащую 1-4 атома углерода. Примерами линейных и разветвленных С1-С8 алкильных групп являются метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, изомерные пентилы, изомерные гексилы, изомерные гептилы и изомерные октилы, предпочтительно метил, 2,2-диметилпропил и трет-бутил.
Термин "циклоалкил", отдельно или в комбинации, обозначает циклоалкильное кольцо, содержащее от 3 до 8 атомов углерода, и предпочтительно циклоалкильное кольцо, содержащее от 3 до 6 атомов углерода. Примерами С3-C8 циклоалкила являются циклопропил, метилциклопропил, диметилциклопропил, циклобутил, метилциклобутил, циклопентил, метилциклопентил, циклогексил, метилциклогексил, диметилциклогексил, циклогептил и циклооктил. Предпочтительными циклоалкилами являются циклопропил, метилциклопропил и особенно 1-метилциклопропил.
Термин "арил", отдельно или в комбинации, обозначает фенильную или нафтильную группу, предпочтительно фенильную группу, которая необязательно содержит один или несколько заместителей, предпочтительно от одного до трех, каждый независимо выбран из галогена, галогеналкила и алкила. Примерами являются фенил, необязательно замещенный 1-3, предпочтительно одним или двумя заместителями, независимо выбранными из метила, фтора, хлора и трифторметила.
Термин "галоген", отдельно или в комбинации, например, в галогеналкиле, обозначает фтор, хлор, бром или йод, предпочтительно фтор или хлор.
Термин "фармацевтически приемлемые соли" обозначает соли, которые сохраняют биологическую эффективность и свойства свободных оснований или свободных кислот, которые не являются ни биологически, ни иным образом опасными. Соли получают с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и им подобные, предпочтительно хлористоводородная кислота, и органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота, N-ацетилцистеин и им подобные. Кроме того, эти соли могут быть получены добавлением неорганического основания или органического основания к свободной кислоте. Соли, полученные с неорганическими основаниями, включают, но не ограничиваются ими, соли натрия, калия, лития, аммония, кальция, магния и им подобных. Соли, полученные с органическими основаниями, включают, но не ограничиваются ими, соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклические амины и основные ионообменные смолы, такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин, аргинин, N-этилпиперидин, пиперидин, полиминовые смолы и им подобные. Соединение формулы I также может быть представлено в форме цвиттерионов. Особенно предпочтительными фармацевтически приемлемыми солями соединений формулы I являются гидрохлориды.
Соединения формулы (I) также могут быть сольватированы, например гидратированы. Сольватация может осуществляться в ходе способа получения или может протекать, например, вследствие гигроскопичных свойств изначально безводного соединения формулы (I) (гидратация). Термин "фармацевтически приемлемые соли" также включает физиологически приемлемые сольваты.
"Фармацевтически приемлемые сложные эфиры" обозначает, что из соединений общей формулы (I) могут быть получены производные по функциональным группам с получением производных, которые способны превращаться обратно в исходные соединения in vivo. Примеры таких соединений включают физиологически приемлемые и метаболически лабильные сложноэфирные производные, такие как метоксиметиловые эфиры, метилтиометиловые эфиры и пивалоилоксиметиловые эфиры. Дополнительно, любые физиологически приемлемые эквиваленты соединений общей формулы (I), аналогичные метаболически лабильным сложным эфирам, которые способны давать исходные соединения общей формулы (I) in vivo, входят в объем настоящего изобретения.
Соединения формулы I могут содержать несколько асимметричных центров и могут присутствовать в форме оптически чистых энантиомеров, смесей энантиомеров, таких как, например, рацематы, оптически чистых диастереоизомеров, смесей диастереоизомеров, диастереоизомерных рацематов или смесей диастереоизомерных рацематов.
Термин "асимметричный атом углерода" обозначает атом углерода с четырьмя различными заместителями. В соответствии с правилом Кана-Ингольда-Прелога, асимметричный атом углерода может находиться в "R-" или "S”-конфигурации.
Предпочтительными являются соединения формулы (I) и их фармацевтически приемлемые соли, особенно соединения формулы (I).
Особенно предпочтительными являются соединения формулы (I), где Ra представляет собой водород или метил.
Также предпочтительными являются соединения формулы (I), где Rb представляет собой водород или метил.
Кроме того, предпочтительными являются соединения формулы (I), где Ra и Rb оба представляют собой водород или оба представляют собой метил одновременно.
Предпочтительными являются соединения формулы (I), где Ra и Rb вместе с атомом углерода, к которому они присоединены, образуют циклопропил или циклопентил.
Особенно предпочтительными являются соединения формулы (I), где Ra и Rb вместе с атомом углерода, к которому они присоединены, образуют циклопропил.
Другими предпочтительными являются соединения формулы (I), где Ra и Rb вместе с атомом углерода, к которому они присоединены, образуют циклобутил.
Также предпочтительными являются соединения формулы (I), где Ra и Rb вместе с атомом углерода, к которому они присоединены, образуют циклопентил.
Также предпочтительными являются соединения формулы (I), где А представляет собой -СН2-СН2-.
Кроме того, предпочтительными являются соединения формулы (I), где R представляет собой водород или метил, и, в частности, соединения формулы (I), где R представляет собой водород.
Соединения формулы (I), где R2 представляет собой водород или метил, также являются предпочтительными. Особенно предпочтительными являются соединения формулы (I), где R2 представляет собой водород.
Предпочтительными являются соединения формулы (I), где R3 представляет собой алкил, циклоалкил или циклоалкилалкил.
Также предпочтительными являются соединения формулы (I), где R3 представляет собой диметилпропил, трет-бутил, циклопропил, метилциклопропил или (метилциклопропил)метил.
Также предпочтительными являются соединения формулы (I), где R3 представляет собой 2,2-диметилпропил, трет-бутил, циклопропил, 1-метилциклопропил или (1-метилциклопропил)метил.
Предпочтительными являются соединения формулы (I), где R3 представляет собой фенил, замещенный фенил, 1H-пиразолил или замещенный 1Н-пиразолил, где замещенный фенил представляет собой фенил, замещенный 1-3 заместителями, независимо выбранными из алкила, галогена и галогеналкила, и где замещенный 1Н-пиразолил представляет собой 1Н-пиразолил, замещенный 1-3 заместителями, независимо выбранными из алкила и фенила.
Соединения формулы (I), где R3 представляет собой фенил, замещенный фенил, 1Н-пиразолил или замещенный 1Н-пиразолил, где замещенный фенил представляет собой фенил, замещенный 1-3 заместителями, независимо выбранными из метила, фтора, хлора и трифторметила, и где замещенный 1Н-пиразолил представляет собой 1Н-пиразолил, замещенный 1-3 заместителями, независимо выбранными из метила, трет-бутила и фенила, также являются предпочтительными.
Другими предпочтительными являются соединения формулы (I), где R3 представляет собой алкил, циклоалкил, циклоалкилалкил, арил, замещенный арил, 1Н-пиразолил или замещенный 1Н-пиразолил, где замещенный арил представляет собой арил, замещенный 1-3 заместителями, независимо выбранными из метила, фтора, хлора и трифторметила, и где замещенный 1 Н- пиразолил представляет собой 1H-пиразолил, замещенный 1-3 заместителями, независимо выбранными из метила, трет-бутила и фенила.
Предпочтительными являются соединения формулы (I), где R3 представляет собой алкил, циклоалкил, циклоалкилалкил, фенил, замещенный фенил, 1H-пиразолил или замещенный 1H-пиразолил, где замещенный фенил представляет собой фенил, замещенный 1-3 заместителями, независимо выбранными из алкила, галогена и галогеналкила, и где замещенный 1Н-пиразолил представляет собой lH-пиразолил, замещенный 1-3 заместителями, независимо выбранными из алкила и фенила.
Также предпочтительными являются соединения формулы (I), где R представляет собой диметилпропил, трет-бутил, циклопропил, метилциклопропил, (метилциклопропил)метил, фенил, замещенный фенил, 1Н-пиразолил или замещенный 1H-пиразолил, где замещенный фенил представляет собой фенил, замещенный 1-3 заместителями, независимо выбранными из метила, фтора, хлора и трифторметила, и где замещенный 1H-пиразолил представляет собой 1H-пиразолил, замещенный 1-3 заместителями, независимо выбранными из метила, трет-бутила и фенила.
Предпочтительными являются соединения формулы (I), где R3 представляет собой диметилпропил, трет-бутил, циклопропил, метилциклопропил, (метилциклопропил)метил, фенил, фенил, замещенный метилом, фенил, замещенный трифторметилом, фенил, замещенный фтором и трифторметилом, фенил, замещенный хлором и трифторметилом, фенил, замещенный хлором и фтором, 1H-пиразолил, замещенный метилом и фенилом, или 1H-пиразолил, замещенный трет-бутилом и метилом.
Соединения формулы (I), где R3 представляет собой 2,2-диметилпропил, трет-бутил, 1-метилциклопропил, (1-метилциклопропил)метил, циклопропил, (трифторметил)фенил, фтор(трифторметил)фенил, хлор(трифторметил)фенил, 5-метил-1 -фенил-1 Н-пиразол-4-ил, 1 -трет-бутил-5-метил-1 Н-пиразол-4-ил, хлорфторфенил или метилфенил также являются предпочтительными.
Также предпочтительными являются соединения формулы (Iа):
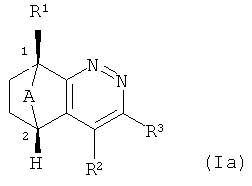
где A, R1, R2 и R3 являются такими, как определено выше. В формуле (1а) асимметричный атом углерода 1 имеет (S)-конфигурацию, и асимметричный атом углерода 2 имеет (R)-конфигурацию в соответствии с правилом Кана-Ингольда-Прелога.
Соединения формулы (Ib):

где A, R1, R2 и R3 являются такими, как определено выше, также являются предпочтительными. В формуле (Ib) асимметричный атом углерода 1 имеет (R)-конфигурацию, и асимметричный атом углерода 2 имеет (S)-конфигурапию в соответствии с правилом Кана-Ингольда-Прелога.
Предпочтительными являются соединения формулы (I), выбранные из следующих соединений:
(5'RS,8'SR)-3'-(2,2-диметилпропил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'R,8'S)-3'-(2,2-диметилпропил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'S,8'R)-3'-(2,2-диметилпропил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-трет-бутил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'R,8'S)-3'-трет-бутил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'S,8'R)-3'-трет-бутил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'8R)-3'-[(1-метилциклопропил)метил]-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-(1-метилциклопропил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-циклопропил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'R,8'S)-3'-циклопропил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'S,8'R)-3'-циклопропил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-циклопропил-4'-метил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
3-циклопропил-5,6,7,8-тетрагидро-5,8-этаноциннолин;
3-[(1-метилциклопропил)метил]-5,6,7,8-тетрагидро-5,8-этаноциннолин;
3-(2,2-диметилпропил)-5,6,7,8-тетрагидро-5,8-этаноциннолин;
3-трет-бутил-5,6,7,8-тетрагидро-5,8-этаноциннолин;
(5'RS,8'SR)-3'-(1-метилциклопропил)-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-[(1-метилциклопропил)метил]-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-(2,2-диметилпропил)-5',б',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-трет-бутил-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-циклопропил-5',б',7',8'-тетрагидроспиро[циклопентан-1,9'-[Г,2']диаза[5',8']метаноциннолин],
(5RS,8SR)-9,9-диметил-3-[(1-метилциклопропил)метил]-5,6,7,8-тетрагидро-5,8-метаноциннолин;
(5R,8S)-8,9,9-триметил-3-[(1-метилциклопропил)метил]-5,6,7,8-тетрагидро-5,8-метаноциннолин;
(5RS,8SR)-3-[(1-метилциклопропил)метил]-5,6,7,8-тетрагидро-5,8-метаноциннолин;
(5'RS,8'SR)-3'-[4-фтор-2-(трифторметил)фенил]-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-(5-метил-1-фенил-1Н-пиразол-4-ил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-(2-хлор-4-фторфенил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-[2-(трифторметил)фенил]-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1 ',2']диаза[5', 8']метаноциннолин];
(5'RS,8'SR)-3'-(1-трет-бутил-5-метил-1Н-пиразол-4-ил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-[5-хлор-2-(трифторметил)фенил]-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
3-[4-фтор-2-(трифторметил)фенил]-5,6,7,8-тетрагидро-5,8-этаноциннолин;
(5'RS,8'SR)-3'-(2-метилфенил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-[4-фтор-2-(трифторметил)фенил]-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-(2-хлор-4-фторфенил)-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-(2-метилфенил)-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-(5-метил-1-фенил-1Н-пиразол-4-ил)-5',6',7',8'-тетрагидроспиро[циклопбнтан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-(1-трет-бутил-5-метил-1Н-пиразол-4-ил)-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин] и
(5'RS,8'SR)-3'-[5-хлор-2-(трифторметил)фенил]-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин].
Особенно предпочтительными являются соединения формулы (I), выбранные из следующих соединений:
(5'RS,8'SR)-3'-(2,2-диметилпропил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'R,8'S)-3'-(2,2-диметилпропил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'S,8'R)-3'-(2,2-диметилпропил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-трет-бутил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'R,8'S)-3'-трет-бутил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин];
(5'S,8'R)-3'-трет-бутил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-[(1-метилциклопропил)метил]-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-(1-метилциклопропил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин],
(5'RS,8'SR)-3'-циклопропил-4'-метил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин];
3-циклопропил-5,6,7,8-тетрагидро-5,8-этаноциннолин;
3-[(1-метилциклопропил)метил]-5,6,7,8-тетрагидро-5,8-этаноциннолин;
3-(2,2-диметилпропил)-5,6,7,8-тетрагидро-5,8-этаноциннолин и
3-трет-бутил-5,6,7,8-тетрагидро-5,8-этаноциннолин.
Получение соединений формулы (I) настоящего изобретения может осуществляться последовательными или параллельными схемами синтеза. Синтезы по изобретению показаны на следующих схемах. Инструменты, необходимые для осуществления реакции и очистки полученных продуктов, известны специалисту в данной области техники. Заместители и индексы, используемые в следующем описании способов, имеют приведенное выше значение.
Обычно соединения формулы (I) легко доступны обработкой соединений формулы (II) гидразином: различные реакционные условия могут использоваться для осуществления реакции конденсации, например: нагревание соединения (II) с моногидратом гидразина в толуоле в присутствии кислоты, такой как п-толуолсульфоновая кислота, (ii) нагревание соединения (II) и моногидрата гидразина в смеси вода/уксусная кислота при температуре кипения, (iii) нагревание соединения (II) и моногидрата гидразина в растворителе, таком как этанол, при температуре кипения в присутствии основания, такого как триэтиламин.
Применение различных условий зависит от соответствующих используемых исходных материалов и приведено в экспериментальной части. Геометрии двойной связи соединений типа (II) могут быть Е или Z, или смеси Е и Z. Независимо от геометрии двойной связи они могут быть превращены в соединение (I) выбором наиболее подходящих приведенных выше реакционных условий и как представлено в экспериментальной части.
Схема 1
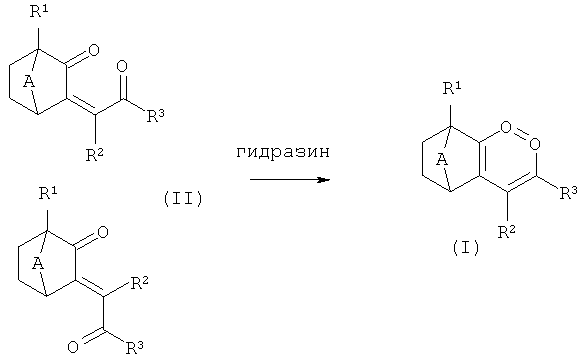
Соединение типа (II), приведенное на схеме 1 в качестве исходных материалов, может быть получено, как описано на схеме 2.
Так, при реакции 1,2-дикетона формулы (III) с фосфонатом формулы (IV) в реакции Хорнера-Эммонса (или Виттига-Хорнера) получают соединения формулы (II). Условиями, которые могут использоваться, являются, например: (i) трет-бутоксид калия в качестве основания в трет-бутаноле в качестве растворителя при кипении с обратным холодильником или (ii) с NaH в качестве основания в ТГФ в качестве растворителя при 0°С.
Геометриями двойной связи соединений формулы (II) могут быть Е, Z или смесь Е и Z, в зависимости от групп R1, R2, R3 и условий реакции. В большинстве случаев получают смеси, которые могут быть разделены хроматографией или использоваться в виде смесей в реакции образования кольца. Стереохимия двойной связи может быть определена ЯМР для соединений формулы (II). Вместо фосфоната типа (IV) также возможно использование соответствующего аналога альфа-галогенкетона, и осуществление реакции Реформатского с последующим устранением воды (в качестве примера реакции этого типа: статья Huang, J. Chem. Soc., Perkin Trans., 1, 1989, с.2397).
Для соединений формулы (III), где R1 представляет собой алкил, соединения формулы (II) предпочтительно получают как основные продукты вследствие низкой реакционноспособности карбонильной группы, соседней с R1, из-за стерических затруднений. В случаях, когда получаются смеси, они могут быть легко разделены хроматографией, и соответствующим образом обработаны далее.
Схемы 2

Фосфонаты формулы (IV) являются либо известными из уровня техники, либо могут быть получены стандартными методиками. Пример получения соединений (IV) включает обработку диметилового эфира алкилфосфоновой кислоты основанием, таким как N-бутиллитий, в ТГФ в качестве растворителя при -78°С, и последующую реакцию с алкилкарбоксилатом с получением соединения (IV). Альтернативно, диметиловый эфир метилфосфоновой кислоты (R2=Н) может использоваться в реакции, с последующей стадией алкилирования для введения R2; реакцию соединения (IV) (R=H) с алкилирующим реагентом (R2-hal) в присутствии основания, такого как трет-бутоксид калия или N-бутиллитий или карбонат калия (аналогичная реакция: статья В. Kirschberger, Synthesis, 1986, 11, с.926).
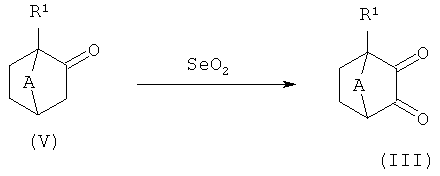
1,2-Дикетоны (III), используемые на схеме 2, являются коммерчески доступными, известными из уровня техники или могут быть получены комбинацией методов, известных из предшествующего уровня техники (схема 3). Предпочтительные методы получения дикетонов (III) включают окисление соответствующих монокетонов (V) с помощью SeO2 в уксусной кислоте при температуре кипения. Альтернативно, превращение может осуществляться сначала реакцией соединения (V) с алкилнитритами с получением соответствующего оксима и последующим гидролизом оксима до соединений формулы (III) (общий метод: статья В.Е.Love и др., Synth. Communications; 1999;16; с.2831).
Схема 3
Альтернативные способы получения соединений формулы (II), где R представляет собой Н, включают реакцию кетона формулы (V) с соединениями формулы (VI) в соответствии со схемой 4. Реакция осуществляется аналогично методам, описанным в статье Mukaiyama (J. Am. Chem. Soc., 1974, 96, с.7503), перекрестной альдольной реакцией; реакцией соединения (V) через его предварительно полученный силиленольный эфир с формилкарбонилом формулы (IV), в присутствии тетрахлорида титана с получением соединения (II), где R представляет собой Н, после дегидратации первичного продукта конденсации. Соединения (VI) являются коммерчески доступными или получаются аналогично методам, описанным в уровне техники, например, из соответствующих метилкетонов и окислением SeO2 (литературный пример: статья К.С.Joshi, Heterocycles, 1981, 16, с.1545) или из альфа-галогенкетонов и окислением Шверна (например статья D. Swern, Synthesis, 1981, с.165).
Схема 4

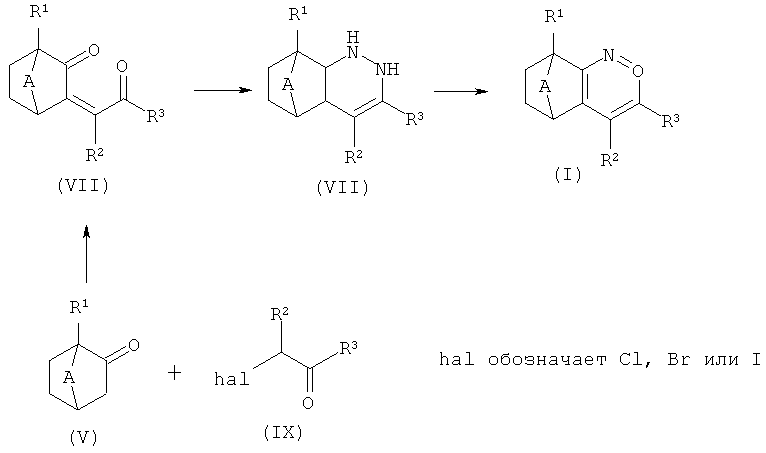
Другой альтернативный способ получения соединений формулы (I) приведен на схеме 5: он заключается в реакции 1,4-дикетонов формулы (VII) с гидразином в условиях, описанных выше, с получением дигидропиридазинов формулы (VIII) (приведена одна из нескольких возможных изомерных форм). Они затем могут быть ароматизированы, например, с помощью Pd на угле или другого окисляющего реагента, такого как Br2 (аналогичные методики: статья Baumgarten, J. Am. Chem. Soc., 1958, 80, с.6609) с получением соединений формулы (I). 1,4-Дикетоны формулы (VII) широко используются как синтетические строительные блоки, и многочисленные способы их получения известны из уровня техники (например: статьи Corey J. Am. Chem. Soc., 1969, 91, с.4926; Katritzky, J. Org. Chem., 1991, 56, с.6917). Более поздний пример получения этих соединений включает методику, описанную A. Baba (статья J. Org. Chem, 1997, 62, с.8282): Она заключается в реакции кетона (V), через превращение в соответствующий енолят олова, с помощью альфа-галогенкетона (IX) в присутствии каталитических количеств ZnCl2.
Схема 5
Способы получения соединений формулы (I) являются объектом изобретения.
Особенно предпочтительным является способ получения соединений формулы (I), включающий одну из следующих стадий:
а) реакция соединения в соответствии с формулой (11а) или (11b):
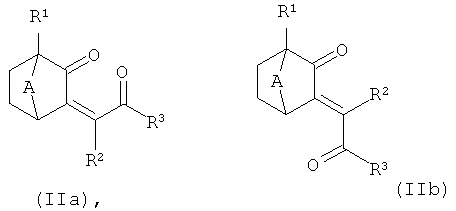
в присутствии гидразина с получением соединения формулы (I); или б) реакция соединения в соответствии с формулой (VIII):

в присутствии окисляющего реагента с получением соединения формулы (I);
где A, R1, R2 и R3 являются такими, как определено выше. Окисляющим реагентом на стадии б) может быть, например, Pd на угле или Br2.
Соединения формулы (I), описанные выше для применения в качестве терапевтически активного вещества, являются другим объектом изобретения.
Также объектом изобретения являются соединения как описано выше для получения лекарственных средств для профилактики и лечения заболеваний, которые вызваны нарушениями, связанными с ферментом 11бета-гидроксистероиднойдегидрогеназы 1 (11bHSD1).
Аналогично, объектом изобретения являются фармацевтические композиции, содержащие соединение формулы (I), как определено выше, и терапевтически инертный носитель.
Другим предпочтительным вариантом осуществления настоящего изобретения является применение соединения формулы (I), как определено выше, для изготовления лекарственных средств для лечения и профилактики диабета, ожирения, пищевых нарушений и дислипидемии.
Другим предпочтительным объектом настоящего изобретения являются соединения формулы (I) для применения в качестве лекарственного средства для лечения и профилактики диабета, ожирения, пищевых нарушений и дислипидемии.
Особенно предпочтительным является применение соединения в соответствии с формулой (I), как описано выше, для изготовления лекарственных средств для лечения и профилактики диабета II типа.
Особенно предпочтительными являются соединения формулы (I) для применения в качестве лекарственного средства для лечения и профилактики диабета II типа.
Другой объект настоящего изобретения включает соединение в соответствии с формулой (I), как определено выше, полученное в соответствии с любым одним из описанных способов.
Также объектом изобретения является способ лечения и профилактики диабета, ожирения, пищевых нарушений и дислипидемии, который включает введение эффективного количества соединения формулы (I), как описано выше.
Особенно предпочтительным является способ лечения и профилактики диабета II типа, который включает введение эффективного количества соединения формулы (I), как описано выше.
Методики анализа
Переходная экспрессия и частичная очистка:
кДНК, кодирующую белок 11бета-HSDl человека, клонировали в вектор экспрессии pcDNA3 (Stratagene). Эту конструкцию (более подробно см. статью Alex Odermatt и др.; J Biol Chem., 1999, Т. 274, Issue 40, cc.28762-28770) использовали для переходной экспрессии белка в клетки НЕК293 (номер доступа в АТСС: CRL-1573, описан Graham, F.L., Smiley, t, Russell, W.C., Nairn, R.; (1977)), используя липофектамин. Через 48 ч после трансфекции клетки промывали дважды охлажденным льдом PBS (забуференный фосфатом соляной раствор). К 1 объему клеточной суспензии в PBS добавляли 2 объема охлажденного льдом буфера для лизиса (50 мМ Tris; pH 7,5; 1 мМ EDTA; 100 мМ NaCl). Клетки подвергали лизису с помощью гомогенизатора Potter (20 оборотов). Полученный гомогенат подвергали обработке ультразвуком с помощью устройства для обработки ультразвуком (10% вход; 2 × 30 сек) и очищали низкоскоростным центрифугированием (10 мин × 9000 g; 4°C). Микросомальную фракцию собирали высокоскоростным центрифугированием (60 мин х 110'000 g). Полученный остаток повторно суспендировали в буфере для хранения (20 мМ Tris pH 7,5; 1 мМ EDTA; 10% глицерин), и центрифугирование повторяли. Полученный остаток, содержащий микросомальную фракцию, снова переносили в буфер для хранения, и аликвоты хранили замороженными в жидком азоте до использования.
Получение стабильных клеточных линий, экопрессируюших 11бета-HSDl:
Такую же конструкцию, используемую для переходной экспрессии 11бета-HSD1 человека, также использовали для получения клеточных линий, стабильно экспрессирующих белок. Кратко, (НЕК293) клетки трансфецировали с помощью конструкции 11бета-HSD1, используя реагент липофектамин (Gibco BRL) в соответствии с инструкцией производителя. Через два дня после трансфекции инициировали селекцию генецитином (0,8 мг/мл) и выделяли несколько стабильных клонов. Один клон далее использовали для фармакологической характеристики.
Микросомальный анализ
Микросомы, выделенные из клеток НЕК.293, переходно экспрессирующих 11бета-HSDl человека (более подробно см. выше), инкубировали в буфере для анализа (100 мМ NaCl; 1 мМ EDTA; 1 мМ EGTA; 1 мМ MgCl; 250 мМ сахарозы; 20 мМ Tris pH 7,4; кортизон 50-200 нМ и NADPH 1 мМ) вместе с различными концентрациями тестируемых веществ. Через 60 мин инкубирования при 37°С анализ останавливали нагреванием до 80°С (5 мин) и добавлением ингибитора карбеноксолона (1 uM). Количество кортизола, полученное в этом анализе, определяли коммерчески доступным набором для определения кортизола на основании ELISA (от Assay Design, Inc.). Ингибиторы характеризовали значениями IC50, например концентрацией, при которой продуцирование кортизола снижается на 50%.
Клеточный анализ
Для измерения действия ингибиторов на интактные клетки НЕК293 клетки, стабильно экспрессирующие Нбета-HSDl человека (см. выше), культивировали в 96-луночные планшеты в DMEM. Сначала ингибиторы, а через 60 мин кортизон добавляли к клеткам. Через 60 мин инкубирования при 37°С в 5% атмосфере СО2 часть среды удаляли и превращение кортизона в кортизол измеряли коммерчески доступным набором ELISA (от Assay Design, Inc.).
Результаты, полученные в микросомальном анализе, используя некоторые соединения по изобретению в качестве тестируемых соединений, показаны в следующей таблице:
Соединения, как описано выше, имеют значения IС50 ниже 1 нМ. Предпочтительные соединения имеют значения IС50 ниже 0,1 нМ и 0,001 нМ. Более предпочтительные соединения имеют значения IС50 от 0,06 нМ до 0,001 нМ.
Соединения формулы (I) и их фармацевтически приемлемые соли и сложные эфиры могут использоваться в качестве лекарственных средств (например, в форме фармацевтических препаратов). Фармацевтические препараты могут вводиться внутренне, например перорально (например, в форме таблеток, оболоченных таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий), назально (например, в форме назальных спреев) или ректально (например, в форме суппозиториев). Однако введение также может осуществляться парентерально, например, внутримышечно или внутривенно (например, в форме инъекционных растворов).
Соединения формулы (I) и их фармацевтически приемлемые соли и сложные эфиры могут быть составлены с фармацевтически инертными, неорганическими или органическими адъювантами для получения таблеток, оболоченных таблеток, драже и твердых желатиновых капсул. Лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и т.д. могут использоваться, например, в качестве таких адъювантов для таблеток, драже и твердых желатиновых капсул.
Подходящими адъювантами для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые вещества и жидкие полиолы и т.д.
Подходящими адъювантами для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.д.
Подходящими адъювантами для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.д.
Подходящими адъювантами для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полутвердые или жидкие полиолы и т.д.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, вещества для повышения вязкости, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, отдушки, соли для регулирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать другие терапевтически активные вещества.
В соответствии с изобретением соединения формулы (I) и их фармацевтически приемлемые соли могут использоваться для профилактики и лечения артрита, сердечно-сосудистых заболеваний, диабета, почечной недостаточности и особенно пищевых нарушений и ожирения. Дозировка может варьироваться в широких пределах и, конечно, определяется для конкретных требований в каждом конкретном случае. Обычно для перорального введения суточная дозировка составляет от около 0,1 мг до 20 мг на кг веса тела, предпочтительно от около 0,5 мг до 4 мг на кг веса тела (например, около 300 мг для пациента), разделенная предпочтительно на 1 -3 отдельные дозы, которые могут содержать, например, одинаковые количества. Однако, следует понимать, что указанный выше верхний предел может быть превышен при необходимости.
Настоящее изобретение далее иллюстрируется примерами, которые не имеют ограничивающего характера.
Примеры
Пример 1
(5'RS,8'SR)-3'-(2,2-Диметилпропил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаэа[5',8']метанопиннолин]
Стадия А): Диметиловый эфир (4,4-диметил-2-оксопентил)фосфоновой кислоты
Раствор диметилового эфира метилфосфоновой кислоты (9,53 г) в ТГФ (50 мл) в атмосфере аргона охлаждали до -65°С и по каплям обрабатывали 48 мл 1,6 М раствора N-бутиллития в гексане, поддерживая температуру реакционной смеси ниже -65°С. После перемешивания в течение 15 минут медленно добавляли метиловый эфир 3,3-диметилбутановой кислоты (5 г в 5 мл ТГФ), и смесь перемешивали в течение 30 минут (температуру реакции поддерживали ниже -65°С). Реакционную смесь оставляли нагреваться до 0°С, гасили 1N водным раствором НСl и затем разделяли между AcOEt и водой. Слои разделяли, органический слой промывали водой, сушили MgSO4, отфильтровывали и упаривали с получением диметилового эфира (4,4-диметил-2-оксопентил)фосфоновой кислоты (9,21 г) в виде светло-желтой жидкости. MS (ESI): 223,2 (МН+).
Стадия В): Спиро[бицикло[2.2.1]гептаа-7,1'-циклопропан1-2,3-дион
Раствор спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2-она (рац.), 8,6 г (синтез: статья N. 1 Turro, JACS, 1980, 102, с.6056) в уксусной кислоте, 38 мл, обрабатывали при КТ SeO2 (16,15 г), и суспензию затем нагревали при кипении с обратным холодильником в течение 12 ч. Реакционную смесь охлаждали до КТ, отфильтровывали, и остаток на фильтре промывали этилацетатом. Фильтрат подщелачивали 3N водным раствором NaOH, и добавляли еще AcOEt. Слои разделяли, органический слой сушили Na2SO4, отфильтровывали и упаривали. Остаток очищали ускоренной хроматографией (гептан/AcOEt: от 100% до 90%) с получением спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2,3-диона (2,5 г) в виде желтого твердого вещества. MS (ESI): 168 (M+NH4)+.
Стадия С):(3Е)-3-(4,4-Диметил-2-оксопентилиден)Спиро [бицикло[2.2.1] гсптан-7,1 '-циклопропан1 -2-он и (3Z)-3 -(4,4-диметил-2-оксопентилиден)спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2-он
Раствор диметилового эфира (4,4-диметил-2-оксопентил)фосфорной кислоты (1,249 г) в ТГФ (40 мл) охлаждали до 0°С в атмосфере аргона, и добавляли гидрид натрия (0,268 г) 4 порциями. К реакционной смеси затем по каплям добавляли спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2,3-дион (1,023 г), растворенный в ТГФ (30 мл). Смесь затем перемешивали в течение 15 минут при 0°С (до окончания реакции в соответствии с анализом ТСХ). Реакционную смесь разделяли между смесью вода/3N раствор НСl и AcOEt, слои разделяли, органический слой промывали насыщенным водным раствором Nad, сушили Na2SO4; отфильтровывали и упаривали. Остаток очищали ускоренной хроматографией с гептан/AcOEt: от 100% до 95% в качестве элюента с получением (3Е)-3-(4,4-диметил-2-оксопентилиден)спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2-она (0,284 г) и (3г)-3-(4,4-диметил-2-оксопентилиден)спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2-она (0,287 г) в виде желтых масел, соответственно, которые непосредственно использовали на следующей стадии. Оценку соотношения E/Z изомеров осуществляли с помощью ЯМР.
Стадия D): (5'RS,8'SR)-3'-(2,2-Диметилпропил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метанопиннолин]
Раствор (3Е)-3-(4,4-диметил-2- оксопентилиден)спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2-она (0,284 г) в этаноле (15 мл) обрабатывали при КТ моногидратом гидразина (0,237 г) и триэтиламином (0,234 г), и смесь затем нагревали при кипении с обратным холодильником в течение 12 ч (температура масляной бани: 105°С). Реакционную смесь разделяли между водой и AcOEt. Слои затем разделяли; объединенные органические слои сушили Na2SO4, отфильтровывали и упаривали. Остаток очищали ускоренной хроматографией (гептан/AcOEt: от 100% до 65%) с получением (5'RS,8'SR)-3'-(2,2-диметилпропил)-5',6',7',8'- тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолина] (0,188 г) в виде светло-желтого твердого вещества. MS (ESI): 243,1 (МН).
В аналогичных реакционных условиях (3Z)-3-(4,4-диметил-2-оксопентилиден)спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2-он (0,287 г) превращали в целевое соединение (5'RS,8'SR)-3'-(2,2-диметилпропил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин] (0,191 г).
Примеры 1 a. b
(5'R,8'S)-3'-(2,2-Диметилпропил)-5',6',7',8'-тетрагидроспиро[ииклопропан-1,9'-[1',2'1диаза[5',8']метаноциннолин] и (5'S,8'R)-3'-(2,2-диметилпропил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метанопиннолин]
Подвергая соединение примера 1 препаративной ВЭЖХ, используя хиральную колонку Chiralpak AD с гептан/изопропанол: 95/2 в качестве элюента, получали два энантиомера в оптически чистой форме в виде белых твердых веществ.
Следующие соединения получали в соответствии с методикой примера 1, стадии A)-D):
Пример 2
(5'RS,8'SR)-3'-трет-Бутил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2'диаза[5',8']метаноциннолин]
Беловатое твердое вещество MS (ESI): 229,0 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2,3-диона, диметилового эфира (3,3-диметил-2-оксобутил)фосфоновой кислоты, моногидрата гидразина.
Примеры 2а. b
(5'R,8'S)-3'-трет-Бутил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин] и (5'S,8'R)-3'-трет-бутил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Подвергая соединение примера 2 препаративной ВЭЖХ, используя хиральную колонку Chiralpak AD с гептан/изопропанол: 95/2 в качестве элюента, получали два энантиомера в оптически чистой форме в виде белых твердых веществ.
Пример 3
(5'RS,8'8R)-3'-[(1-Метилциклопропил)метил]-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Светло-желтое твердое вещество, MS (ESI): 241,1 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2,3-диона, диметилового эфира [3-(1-метилциклопропил)-2-оксопропил]фосфоновой кислоты, моногидрата гидразина.
Получение исходные материалов:
3,1) Получение диметилового эфира 3-(1-метилциклопропил)-2-оксопропил]фосфоновой кислоты:
Его получали в соответствии с примером 1, стадия А), из диметилового эфира метилфосфоновой кислоты (7,44 г), N-бутиллития (1,6 М, 37,5 мл) и этилового эфира (1-метилциклопропил)уксусной кислоты (4,266 г) в виде светло-желтой жидкости (2,4 г) после очистки ускоренной хроматографией с гептан/AcOEt: 60-40% в качестве элюента.
3.2) Получение этилового эфира (1-метилциклопропил)уксусной кислоты:
Комплекс Zn-Cu (10,726 г), суспендированный в диэтиловом эфире (20 мл), обрабатывали при КТ в атмосфере аргона CH2I2 (14,86 г) и этиловым эфиром 3-метилбут-3-еновой кислоты (3,9 г), и нагревали в закрытом реакционном сосуде при 60°С в течение 20 ч. Смесь затем охлаждали до КТ, добавляли AcOEt (50 мл), и реакционную смесь отфильтровывали. Остаток на фильтре промывали AcOEt, объединенные фильтраты промывали водой (125 мл), сушили MgSO4 и затем упаривали (используя вакуум 40 мбар). Это приводило к получению целевого этилового эфира (1-метилциклопропил)уксусной кислоты (4,4 г) в виде коричневой жидкости, которая по существу была чистой (в соответствии с ЯМР), и использовали непосредственно на следующей стадии реакции.
Пример 4
(5'RS,8'SR)-3'-(1-Метилциклопропил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Светло-желтое твердое вещество. MS (ESI): 227,0 (МН). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2,3-диона, диметилового эфира [2-(1-метилциклопропил)-2-оксоэтил]фосфоновой кислоты, моногидрата гидразина.
Пример 5
(5'RS,8'SR)-3'-Циклопропил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Светло-желтое вязкое масло. MS (ESI): 213,0 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2,3-диона, диметилового эфира (2-циклопропил-2-оксоэтил)фосфоновой кислоты, моногидрата гидразина.
Примеры 5а, b
(5'R,8'S)-3'-Циклопропил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин] и (5'S,8'R)-3'-циклопропил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Подвергая соединение примера 5 препаративной ВЭЖХ, используя хиральную колонку Chiralpak AD с гептан/изопропанол: 95/5 в качестве элюента, получали два энантиомера в оптически чистой форме в виде белых твердых веществ.
(5'RS,8'SR)-3'-Циклопропил-4'-метил-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Светло-желтое масло. MS (ESI): 227,2 (МН). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2,3-диона, диэтилового эфира (2-циклопропил-1-метил-2-оксоэтил)фосфоновой кислоты, моногидрата гидразина.
Пример 7
3-Циклопропил-5,6,7,8-тетрагидро-5,8-этаноциннолин
Белое твердое вещество. MS (ESI): 201,1 (МН+). Получали из бицикло[2,2,2]октан-2,3-диона, диметилового эфира (2-циклопропил-2-оксоэтил)фосфоновой кислоты, моногидрата гидразина.
Получение исходных материалов
7,1) Получение бицикло[2,2,2]октаа-2,3-диона
Аналогично примеру 1, стадия В): из бицикло[2,2,2]октан-2-она, 1,416 г, (синтез: статья JOC., 1993, 58, с.7622), SeO2 (2,218 г) в уксусной кислоте (8 мл) при нагревании при 130°С в течение 12 ч, очистка сырого продукта ускоренной хроматографией (гептан/AcOEt 100-75%), получали бицикло[2,2,2]октан-2,3-дион (0,396 г) в виде желтого твердого вещества. MS (ESI): 156 (М+NH4)+.
Пример 8
3-[(1-Метилциклопропил)метил]-5,6,7,8-тетрагидро-5,8-этаноциннолин
Светло-желтое твердое вещество MS (ESI): 229,2 (МН+). Получали из бицикло[2,2,2]октан-2,3-диона, диметилового эфира [3-(1-метилциклопропил)-2-оксопропил]фосфоновой кислоты, моногидрата гидразина.
Пример 9
3-(2,2-Диметилпропил)-5,6,7,8-тетрагидро-5,8-этаноциннолин
Белое твердое вещество. MS (ESI): 231,1 (МН+). Получали из бицикло[2,2,2]октан-2,3-диона, диметилового эфира (4,4-диметил-2-оксопентил)фосфоновой кислоты, моногидрата гидразина.
Пример 10
3-Трет-бутил-5,6,7,8-тетрагидро-5,8-этаноциннолин
Белое твердое вещество. MS (ESI): 217,1 (МН+). Получали из бицикло[2,2,2]октан-2,3-диона, диметилового эфира (3,3-диметил-2-оксобутил)фосфоновой кислоты, моногидрата гидразина.
Пример 11
(5'RS,8'SR)-3'-(1-Метилциклопропил)-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Светло-желтое твердое вещество. MS (ESI): 255,2,1 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопентан]-2,3-диона, диметилового эфира 2-(1-метилциклопропил)-2-оксоэтил]фосфоновой кислоты, моногидрата гидразина.
Получение исходных материалов:
11,1) Получение опиро[бицикло[2.2.] гептан-7,1'-циклопентан]-2-она
Раствор бицикло[2.2.1]гепт-5-ен-2-он-7-спиро-1'-циклопентана (1,063 г) (синтез: статья А.Р. Marchand и др, JOC, 1985, 50, с.396) в этаноле (15 мл) обрабатывали 10% Pd/C (35 мг), и затем гидрировали при КТ в течение 12 ч при атмосферном давлении. Катализатор удаляли фильтрацией, и фильтрат концентрировали в вакууме (30°С, 85 бар) с получением целевого спиро[бицикло[2.2.1]гептан-7,1'-циклопентан]-2-она (1,05 г) в виде бесцветного масла, которое по существу являлось чистым, и непосредственно использовали на следующей стадии.
11,2) Получение опиро[бицикло[2.2.1]гептан-7,1'-циклопентан1-2,3-диона
Как описано в примере 1, стадия В): из спиро[бицикло[2.2.1]гептан-7,1'-циклопентан]-2-она: 1,05 г, SeO2 (1,56 г) в уксусной кислоте (5 мл) нагревали при 120°С в течение 12 ч, очистка сырого продукта ускоренной хроматографией (гептан/AcOEt 100-90%, получали спиро[бицикло[2.2.1]гептан-7,1'-циклопентан]-2,3-дион (0,88 г) в виде желтого твердого вещества. MS (ESI): 196,2(M+NH4)+.
Пример 12
(5'RS,8'SR)-3'-[(1-Метилциклопропил)метил]-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Беловатое твердое вещество. MS (ESI): 269,1 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопентан]-2,3-диона, диметилового эфира [3-(1-метилциклопропил)-2-оксопропил]фосфоновой кислоты, моногидрата гидразин.
Пример 13
(5'RS,8'SR)-3'-(2,2-Диметилпропил)-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Беловатое твердое вещество. MS (ESI): 271,1 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопентан]-2,3-диона, диметилового эфира (4,4-диметил-2-оксопентил)фосфоновой кислоты, моногидрата гидразина.
Пример 14
(5'RS,8'SR)-3'-трет-Бутил-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Беловатое твердое вещество. MS (ESI): 257,1 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопентан]-2,3-диона, диметилового эфира (3,3-диметил-2-оксобутил)фосфоновой кислоты, моногидрата гидразина.
Пример 15
(5'RS,8'SR)-3'-Циклопропил-5',б',7',8'-тетрагидроспиро[циклопентан-1,9'-[5',2']диаза[5',8']метаноциннолин]
Беловатое масло. MS (ESI): 241,2 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопентан]-2,3-диона, диметилового эфира (2-циклопропил-2-оксоэтил)фосфоновой кислоты, моногидрата гидразина.
Пример 16
(5RS,8SR)-9,9-Диметил-3-[(1-метилциклопропил)метил]-5,6,7,8-тетрагидро-5,8-метаноциннолин
Светло-желтое твердое вещество. MS (ESI): 243,1 (МН+). Получали из 7,7-диметилбицикло[2.2.1]гептан-2,3-диона (статья R.F.Childs и др., J. Am. Chem. Soc.; 1980; 102; с.4159), диметилового эфира [3-(1-метилциклопропил)-2-оксопропил]фосфоновой кислоты, моногидрата гидразина.
Пример 17
(5R,8S)-8,9,9-Триметил-3-[(1-метилциклопропил)метил]-5,6,7,8-тетрагидро-5,8-метаноциннолин
Светло-желтое твердое вещество. MS (ESI): 257,1 (МН+). Получали из (18,4К)-1,7,7-триметилбицикло[2.2.1]гептан-2,3-диона (коммерчески доступный), диметилового эфира [3-(1-метилциклопропил)-2-оксопропил]фосфоновой кислоты, моногидрата гидразина.
Пример 18
(5RS,8SR)-3-[(1-Метилциклопропил)метил]-5,6,7,8-тетрагидро-5,8-метаноциннолин
Светло-желтое твердое вещество. MS (ESI): 215,2 (МН+). Получали из (1S, 4R)-бицикло[2.2.1]гептан-2,3-диона (статья М. Hanack и др, Justus Liebigs Annalen der Chemie; 1973; с.1557), диметилового эфира [3-(1-метилциклопропил)-2-оксопропил]фосфоновой кислоты, моногидрата гидразина.
Пример 19
(5'RS,8'SR)-3'-[4-Фтор-2-(трифторметил)фенил]-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Беловатое твердое вещество. MS (ESI): 335,1 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2,3-диона, диметилового эфира [2-(4-фтор-2-трифторметилфенил)-2-оксоэтил]фосфоновой кислоты, моногидрата гидразина.
Пример 20
(5'RS,8'SR)-3'-(5-метил-1-фенил-1Н-пиразол-4-ил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Желтая пена MS (ESI): 329,1 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2,3-диона, диметилового эфира [2-(5-метил-1-фенил-1Н-пиразол-4-ил)-2-оксоэтил]фосфоновой кислоты, моногидрата гидразина.
Пример 21
(5'RS,8'SR)-3'-(2-Хлор-4-фторфенил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Желтое твердое вещество. MS (ESI): 301,1 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2,3-диона, диметилового эфира [2-(2-хлор-4-фторфенил)-2-оксоэтил]фосфоновой кислоты, моногидрата гидразина.
Пример 22
(5'RS,8'SR)-3'-[2-(Трифторметил)фенил]-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1 ',2']диаза[5', 8']метаноциннолин]
Светло-желтое твердое вещество. MS (ESI): 317,1 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2,3-диона, диметилового эфира 2-оксо-2-(2-трифторметилфенил)этил]фосфоновой кислоты, моногидрата гидразина.
Пример 23
(5'RS,8'SR)-3'-(1-трет-бутил-5-метил-1Н-пиразол-4-ил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Желтое твердое вещество. MS (ESI): 309,2 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2,3-диона, диметилового эфира [2-(1-трет-бутил-5-метил-1Н-пиразол-4-ил)-2-оксоэтил]фосфоновой кислоты, моногидрата гидразина.
Пример 24
(5'RS,8'SR)-3'-[5-Хлор-2-(трифторметил)фенил]-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Желтое аморфное твердое вещество. MS (ESI): 351,1 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2,3-диона, диметилового эфира [2-(5-хлор-2-трифторметилфенил)-2-оксоэтил]фосфоновой кислоты, моногидрата гидразина.
Пример 25
3-[4-Фтор-2-(трифторметил)фенил]-5,6,7,8-тетрагидро-5,8-этаноциннолин
Белое твердое вещество. MS (ESI): 323,1 (МН+). Получали из бицикло[2,2,2]октан-2,3-диона, диметилового эфира [2-(4-фтор-2-трифторметилфенил)-2-оксоэтил]фосфоновой кислоты, моногидрата гидразина.
Пример 26
(5'RS,8'SR)-3'-(2-Метилфенил)-5',6',7',8'-тетрагидроспиро[циклопропан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Светло-желтое масло. MS (ESI): 363,0 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопропан]-2,3-диона, диметилового эфира (2-оксо-2-о-толилэтил)фосфоновой кислоты, моногидрата гидразина.
Пример 27
(5'RS,8'SR)-3'-[4-Фтор-2-(трифторметил)фенил]-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Беловатое твердое вещество. MS (ESI): 363,2 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопентан]-2,3-диона, диметилового эфира [2-(4-фтор-2-трифторметилфенил)-2-оксоэтил]фосфоновой кислоты, моногидрата гидразина.
Пример 28
(5'RS,8'SR)-3'-(2-Хлор-4-фторфенил)-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Беловатое твердое вещество. MS (ESI): 329,1 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопентан]-2,3-диона, диметилового эфира [2-(2-хлор-4-фторфенил)-2-оксоэтил]фосфоновой кислоты, моногидрата гидразина.
Пример 29
(5'RS,8'SR)-3'-(2-Метилфенил)-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Беловатое твердое вещество. MS (ESI): 291,0 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопентан]-2,3-диона, диметилового эфира (2-оксо-2-о-толилэтил)фосфоновой кислоты, моногидрата гидразина.
Пример 30
(5'RS,8'SR)-3'-(5-Метил-1-фенил-1Н-пиразол-4-ил)-5',6',7',8'-тетрагидроспиро[циклопбнтан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Светло-белое твердое вещество. MS (ESI): 357,2 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопентан]-2,3-диона, диметилового эфира [2-(5-метил-1 -фенил-1 Н-пиразол-4-ил)-2-оксоэтил]фосфоновой кислоты, моногидрата гидразина.
Пример 31
(5'RS,8'SR)-3'-(1-трет-Бутил-5-метил-1Н-пиразол-4-ил)-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Желтое твердое вещество. MS (ESI): 337,2 (МН+). Получали из диметилового эфира спиро[бицикло[2.2.1]гептан-7,1'-циклопентан]-2,3-дион[2-(1-трет-бутил-5-метил-1Н-пиразол-4-ил)-2-оксоэтил]фосфоновой кислоты, моногидрата гидразина.
Пример 32
(5'RS,8'SR)-3'-[5-хлор-2-(трифторметил)фенил]-5',6',7',8'-тетрагидроспиро[циклопентан-1,9'-[1',2']диаза[5',8']метаноциннолин]
Желтое аморфное твердое вещество. MS (ESI): 379,1 (МН+). Получали из спиро[бицикло[2.2.1]гептан-7,1'-циклопентан]-2,3-диона, диметилового эфира [2-(5-хлор-2-трифторметилфенил)-2-оксоэтил]фосфоновой кислоты, моногидрата гидразина.
Пример А
Соединение формулы (I) может использоваться известным способом в качестве активного ингредиента для получения таблеток следующего состава на таблетку, мг:
Пример Б
Соединение формулы (I) может использоваться известным способом в качестве активного ингредиента для получения капсул следующего состава на капсулу, мг:
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ АЛКИЛПИРИДАЗИНА В КАЧЕСТВЕ ИНГИБИТОРОВ 11β-ГИДРОКСИСТЕРОИДДЕГИДРОГЕНАЗЫ ТИПА 1 (11β-HSD1) | 2007 |
|
RU2417989C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОНА | 2006 |
|
RU2407737C2 |
| КОНДЕНСИРОВАННОЕ ПИРИМИДИНОВОЕ СОЕДИНЕНИЕ ИЛИ ЕГО СОЛЬ | 2016 |
|
RU2729636C2 |
| ТИАЗОЛОПИРИМИДИНОНЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ РЕЦЕПТОРОВ NMDA | 2014 |
|
RU2703273C2 |
| МАКРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ КАК ИНГИБИТОРЫ КИНАЗ TRK | 2019 |
|
RU2778294C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩИМ ДЕЙСТВИЕМ В ОТНОШЕНИИ 11b-HSD1 | 2005 |
|
RU2375351C2 |
| 9-[(ЗАМЕЩЕННЫЙ ГЛИЦИЛ)АМИДО]-6-ДЕМЕТИЛ-6-ДЕЗОКСИТЕТРАЦИК-ЛИН, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЙ ПРОДУКТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, АНТИБАКТЕРИАЛЬНАЯ КОМПОЗИЦИЯ И СПОСОБ АНТИБАКТЕРИАЛЬНОГО ВОЗДЕЙСТВИЯ | 1993 |
|
RU2123999C1 |
| НОВЫЕ АЗАЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2011 |
|
RU2603263C2 |
| АМИДНОЕ ПРОИЗВОДНОЕ ПИРАЗОЛА | 2015 |
|
RU2658827C2 |
| 2-ОКСА-5-АЗАБИЦИКЛО[2.2.1]ГЕПТАН-3-ИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2015 |
|
RU2697651C2 |
Изобретение относится к соединениям формулы (I):

где А представляет собой CRaRb или -CH2-CH2-; R1 представляет собой водород или алкил; R2 представляет собой водород или алкил; R3 представляет собой алкил, циклоалкил, циклоалкилалкил, арил, замещенный арил, 1H-пиразолил или замещенный 1Н-пиразолил, где замещенный арил представляет собой арил, замещенный 1-3 заместителями, независимо выбранными из алкила, галогена и галогеналкила, и где замещенный 1Н-пиразолил представляет собой 1Н-пиразолил, замещенный 1-3 заместителями, независимо выбранными из алкила и арила; Ra представляет собой водород или метил; Rb представляет собой водород или метил; или Ra и Rb вместе с атомом углерода, к которому они присоединены, образуют циклопропил, циклобутил или циклопентил; при условии, что когда Ra и Rb оба представляют собой водород или оба представляют собой метил одновременно, тогда R3 представляет собой (1-метилциклопропил)метил, которые обладают ингибирующим действием в отношении 11b-HSD1. 2 н. и 13 з.п. ф-лы, 1 табл., 32 пр.
1. Соединения формулы (I):

где А представляет собой CRaRb или -CH2-CH2-;
R1 представляет собой водород или алкил;
R2 представляет собой водород или алкил;
R3 представляет собой алкил, циклоалкил, циклоалкилалкил, арил, замещенный арил, 1H-пиразолил или замещенный 1Н-пиразолил, где замещенный арил представляет собой арил, замещенный 1-3 заместителями, независимо выбранными из алкила, галогена и галогеналкила, и где замещенный 1Н-пиразолил представляет собой 1Н-пиразолил, замещенный 1-3 заместителями, независимо выбранными из алкила и арила;
Ra представляет собой водород или метил;
Rb представляет собой водород или метил; или
Ra и Rb вместе с атомом углерода, к которому они присоединены, образуют циклопропил, циклобутил или циклопентил;
при условии, что когда Ra и Rb оба представляют собой водород или оба представляют собой метил одновременно, тогда R3 представляет собой (1-метилциклопропил)метил;
и их фармацевтически приемлемые соли и сложные эфиры.
2. Соединения по п.1, где А представляет собой CRaRb, и где Ra и Rb вместе с атомом углерода, к которому они присоединены, образуют циклопропил.
3. Соединения по п.1 или 2, где А представляет собой -СН2-СН2-.
4. Соединения по п.1 или 2, где R1 представляет собой водород или метил.
5. Соединения по п 1 или 2, где R2 представляет собой водород или метил.
6. Соединения по п.1 или 2, где R3 представляет собой алкил, циклоалкил, циклоалкилалкил, фенил, замещенный фенил, 1Н-пиразолил или замещенный 1Н-пиразолил, где замещенный фенил представляет собой фенил, замещенный 1-3 заместителями, независимо выбранными из алкила, галогена и галогеналкила, и где замещенный 1Н-пиразолил представляет собой 1Н-пиразолил, замещенный 1-3 заместителями, независимо выбранными из алкила и фенила.
7. Соединения по п.1 или 2, где R3 представляет собой диметилпропил, трет-бутил, циклопропил, метилциклопропил, (метилциклопропил)метил, фенил, замещенный фенил, 1Н-пиразолил или замещенный 1Н-пиразолил, где замещенный фенил представляет собой фенил, замещенный 1-3 заместителями, независимо выбранными из метила, фтора, хлора и трифторметила, и где замещенный 1Н-пиразолил представляет собой 1Н-пиразолил, замещенный 1-3 заместителями, независимо выбранными из метила, трет-бутила и фенила.
8. Соединения по п.1 или 2, где R3 представляет собой диметилпропил, трет-бутил, циклопропил, метилциклопропил, (метилциклопропил)метил, фенил, фенил, замещенный метилом, фенил, замещенный трифторметилом, фенил, замещенный фтором и трифторметилом, фенил, замещенный хлором и трифторметилом, фенил, замещенный хлором и фтором, 1Н-пиразолил, замещенный метилом и фенилом, или 1Н-пиразолил, замещенный трет-бутилом и метилом.
9. Соединения по п.1 или 2, выбранные из следующих соединений:
(5′RS,8′SR)-3'-(2,2-диметилпропил)-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8']метаноциннолин];
(5′R,8′S)-3'-(2,2-диметилпропил)-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′S,8′R)-3′-(2,2-диметилпропил)-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3'-трет-бутил-5′,6′,7′,8'-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′R,8′S)-3′-трет-бутил-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′S,8′R)-3′-трет-бутил-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-[(1-метилциклопропил)метил]-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3-(1-метилциклопропил)-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-циклопропил-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′R,8′S)-3′-циклопропил-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′] диаза[5′,8′]метаноциннолин];
(5′S,8′R)-3′-циклопропил-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-циклопропил-4′-метил-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
3-циклопропил-5,6,7,8-тетрагидро-5,8-этаноциннолин;
3-[(1-метилциклопропил)метил]-5,6,7,8-тетрагидро-5,8-этаноциннолин;
3-(2,2-диметилпропил)-5,6,7,8-тетрагидро-5,8-этаноциннолин;
3-трет-бутил-5,6,7,8-тетрагидро-5,8-этаноциннолин;
(5′RS,8′SR)-3′-(1-метилциклопропил)-5′,6′,7′,8′-тетрагидроспиро[циклопентан-1,9′-[1′,2′] диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-[(1-метилциклопропил)метил]-5′,6′,7′,8′-тетрагидроспиро[циклопентан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-(2,2-диметилпропил)-5′,6′,7′,8′-тетрагидроспиро[циклопентан-1,9′-[1′,2']диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-трет-бутил-5′,6′,7′,8′-тетрагидроспиро[циклопентан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-циклопропил-5′,6′,7′,8′-тетрагидроспиро[циклопентан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5RS,8SR)-9,9-диметил-3-[(1-метилциклопропил)метил]-5,6,7,8-тетрагидро-5,8-метаноциннолин;
(5R,8S)-8,9,9-триметил-3-[(1-метилциклопропил)метил]-5,6,7,8-тетрагидро-5,8-метаноциннолин;
(5RS,8SR)-3-[(1-метилциклопропил)метил]-5,6,7,8-тетрагидро-5,8-метаноциннолин;
(5′RS,8′SR)-3′-[4-фтор-2-(трифторметил)фенил]-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′] диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-(5-метил-1-фенил-1Н-пиразол-4-ил)-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-(2-хлор-4-фторфенил)-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-[2-(трифторметил)фенил]-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-(1-трет-бутил-5-метил-1Н-пиразол-4-ил)-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-[5-хлор-2-(трифторметил)фенил]-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
3-[4-фтор-2-(трифторметил)фенил]-5,6,7,8-тетрагидро-5,8-этаноциннолин;
(5′RS,8′SR)-3′-(2-метилфенил)-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-[4-фтор-2-(трифторметил)фенил]-5′,6′,7′,8′-тетрагидроспиро[циклопентан-1,9′-[1′,2']диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-(2-хлор-4-фторфенил)-5′,6′,7′,8′-тетрагидроспиро[циклопентан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-(2-метилфенил)-5′,6′,7′,8′-тетрагидроспиро[циклопентан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-(5-метил-1-фенил-1Н-пиразол-4-ил)-5′,6′,7′,8′-тетрагидроспиро[циклопентан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-(1-трет-бутил-5-метил-1Н-пиразол-4-ил)-5′,6′,7′,8′-тетрагидроспиро[циклопентан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин] и
(5′RS,8′SR)-3′(5-хлор-2-(трифторметил)фенил]-5′,6′,7′,8′-тетрагидроспиро[циклопентан-1,9′[1′,2′]диаза[5′,8′]метаноциннолин].
10. Соединения по п. 1 или п.2, выбранные из следующих соединений:
(5′RS,8,SR)-3′-(2,2-диметилпропил)-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′R,8′S)-3′-(2,2-диметилпропил)-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′S,8′R)-3′-(2,2-диметилпропил)-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-трет-бутил-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′R,8′S)-3′-трет-бутил-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′S,8′R)-3′-трет-бутил-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-[(1-метилциклопропил)метил]-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-(1-метилциклопропил)-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
(5′RS,8′SR)-3′-циклопропил-4′-метил-5′,6′,7′,8′-тетрагидроспиро[циклопропан-1,9′-[1′,2′]диаза[5′,8′]метаноциннолин];
3-циклопропил-5,6,7,8-тетрагидро-5,8-этаноциннолин;
3-[(1-метилциклопропил)метил]-5,6,7,8-тетрагидро-5,8-этаноциннолин;
3-(2,2-диметилпропил)-5,6,7,8-тетрагидро-5,8-этаноциннолин и
3-трет-бутил-5,6,7,8-тетрагидро-5,8-этаноциннолин.
11. Соединения по п.1 или 2, предназначенные для использования в качестве терапевтически активного вещества, обладающего ингибирующим действием в отношении 11b-HSD1.
12. Соединения по п.1 или 2, предназначенные для изготовления лекарственных средств для профилактики и лечения заболеваний, которые вызваны нарушениями, связанными с ферментом 11 бета-гидроксистероидная дегидрогеназа 1.
13. Фармацевтическая композиция, обладающая ингибирующим действием в отношении 11b-HSD1, включающая соединение по любому из пп.1-10 и терапевтически инертный носитель.
14. Соединения по п.1 или 2, предназначенные для использования в качестве лекарственных средств для лечения или профилактики диабета, ожирения, пищевых нарушений или дислипидемии.
15. Соединения по п.1 или 2, предназначенные для использования в качестве лекарственных средств для лечения или профилактики диабета II типа.
Авторы
Даты
2015-02-20—Публикация
2009-07-06—Подача