Область техники, к которой относится изобретение
Настоящее изобретение относится к мутантной O-фосфосеринсульфгидрилазе (также обозначаемой как «OPSS»), которая имеет аминокислотную последовательность, происходящую от Mycobacterium smegmatis, соответствующую последовательности SEQ ID NO: 1, в которой осуществлены делеции от трех до семи C-концевых аминокислотных остатков. Настоящее изобретение относится также к молекуле нуклеиновой кислоты, кодирующей мутантную OPSS, экспрессионному вектору, несущему молекулу нуклеиновой кислоты, и к трансформанту, трансформированному экспрессионным вектором. Кроме того, настоящее изобретение касается способа получения цистеина в результате взаимодействия O-фосфо-L-серина (OPS) с сульфидом в присутствии мутантной OPSS.
Известный уровень техники
L-цистеин представляет собой аминокислоту, которая играет важную роль в метаболизме серы у всех живых организмов. Он используется в биосинтезе белков, таких как кератин волос, глутатиона, биотина, метионина и других содержащих серу метаболитов, а также служит в качестве предшественника коэнзима A. Кроме того, как известно, биосинтез цистеина тесно связан с биосинтезом других аминокислот, включая L-серин, L-глицин и L-метионин. L-цистеин, и его производные находят применение в различных отраслях промышленности, включая фармацевтическую промышленность (для лечения бронхиальных заболеваний), косметическую промышленность (в шампунях для волос, составах для перманентной завивки и т.д.) и пищевую промышленность (для антиоксидантов, усилителей вкуса, в качестве вспомогательного агента при приготовлении теста и т.д.).
Традиционно L-цистеин получали промышленным способом с помощью кислотного гидролиза волос человека или перьев животных (Biotechnology of the Amino Acids Production под редакцией Ko Aida, p 217-223, 1986). Однако получение цистеина из волос или перьев не только приводило к такому низкому выходу, как 7-8%, но также из-за использования хлористоводородной кислоты или серной кислоты возникало большое количество отходов, что приводило к загрязнению окружающей среды. Кроме того, экстракция из волос или перьев может индуцировать у пользователя сильные неблагоприятные эффекты. Эти проблемы дали толчок к развитию способов получения L-цистеина, благоприятных для окружающей среды, которые привели к ферментации с использованием микроорганизмов для получения L-цистеина.
Среди вариантов микробной продукции L-цистеина примером является биологическое превращение D,L-ATC с использованием микроорганизма (Ryu OH, Ju JY and Shin CS, Process Biochem., 32:201-209, 1997). Этот способ превращения является, однако, трудным для применения в промышленном масштабе из-за низкой растворимости предшественника D,L-ATC. Другой способ получения L-цистеина представляет собой прямую ферментацию с использованием E. coli (патент No. EP 0885962B; Wada M and Takagi H, Appl. Microbiol. Biochem., 73:48-54, 2006). Избыточная аккумуляция L-цистеина в микроорганизмах вызывает внутриклеточную токсичность, создавая ограничение для получения L-цистеина в высокой концентрации. Для преодоления этого препятствия применяли белки, экспортирующие L-цистеин, однако при этом не выявлено существенных улучшений продуктивности.
Относительно пути биосинтеза L-цистеина в бактериях и растениях, O-ацетилсерин (OAS) выполняет функцию промежуточного продукта предшественника, создавая углеродный каркас L-цистеина (Kredich NM and Tomkins GM, J. Biol. Chem., 241: 4955-4965, 1966). Фермент O-ацетилсеринсульфгидрилаза (OASS), используя сульфид водорода в качестве донора серы, катализирует превращение O-ацетилсерина в S-ацетилсерин и, наконец, в цистеин, высвобождая ацетат. Альтернативно, SO4 может быть восстановлен до тиосульфата для использования в качестве донора серы при получении цистеина (Nakamura T, Kon Y, Iwahashi H and Eguchi Y, J. Bacteriol., 156: 656-662, 1983). В пути биосинтеза цистеина через OAS используются два фермента - серинацетилтрансфераза (CysE), которая катализирует превращение серина в OAS, и цистеинсинтаза (CysK), которая катализирует превращение OAS в цистеин. Следует отметить, что среди них серинацетилтрансфераза (CysE) высоко чувствительна к ингибированию конечным продуктом цистеином по механизму обратной связи (Wada M and Takagi H, Appl. Microbiol. Biochem., 73:48-54, 2006). Следовательно, существует потребность в измененном ферменте, который не чувствителен к ингибированию по механизму обратной связи, однако, его трудно создать.
Раскрытие изобретения
Техническая задача
Следуя настоящему изобретению, изобретателями настоящего изобретения проведено интенсивное и исчерпывающее исследование продукции L-цистеина с высоким выходом с целью преодоления проблем, с которыми сталкивались на предшествующем уровне техники, что привело к обнаружению того, что в Aeropyrum pernix, Mycobacterium tuberculosis и Trichomonas vaginalis существует O-фосфосеринсульфгидрилаза (OPSS), которая использует O-фосфо-L-серин(OPS)-специфичный путь, а не OAS-специфичный путь, для синтеза L-цистеина (Mino K and Ishikawa K, FEBS letters, 551: 133-138, 2003; Burns KE, Baumgart S, Dorrestein PC, Zhai H, McLafferty FW and Begley TP, J. Am. Chem. Soc., 127: 11602-11603, 2005; Westrop GD, Goodall G, Mottram JC and Coombs GH, J. Biol. Chem., 281: 25062-25075, 2006), и что OPSS из M. tuberculoses, которая катализирует превращение OPS в цистеин с дополнительными ферментами mec+ и cysO, может использовать Na2S в качестве донора серы при превращении OPS в цистеин даже в отсутствие дополнительных ферментов, когда из нее удаляется пять C-концевых аминокислотных остатков (Argen D, Schnell R and Schneider G, FEBS letters, 583: 330-336, 2009).
Техническое решение
Следовательно, целью настоящего изобретения является предоставление мутантной O-фосфосеринсульфгидрилазы (обозначаемой также как «OPSS»), которая имеет аминокислотную последовательность, происходящую от Mycobacterium smegmatis, соответствующую последовательности SEQ ID NO: 1, в которой осуществлены делеции от трех до семи C-концевых аминокислотных остатков.
Дугой целью настоящего изобретения является предоставление молекулы нуклеиновой кислоты, кодирующей мутантную OPSS.
Дополнительной целью настоящего изобретения является предоставление экспрессионного вектора, несущего молекулу нуклеиновой кислоты.
Еще одной целью настоящего изобретения является предоставление трансформанта, трансформированного экспрессионным вектором.
Еще одной целью настоящего изобретения является предоставление способа превращения O-фосфо-L-серина в цистеин при взаимодействии с сульфидом в присутствии мутантной OPSS.
Эффективные результаты изобретения
Как описано выше, мутантная OPSS с улучшенной ферментативной активностью, которая существенна для ферментативного превращения O-фосфосерина в L-цистеин, может быть использована для получения L-цистеина из OPS в широком масштабе и с высоким выходом с использованием простого способа.
Краткое описание фигур
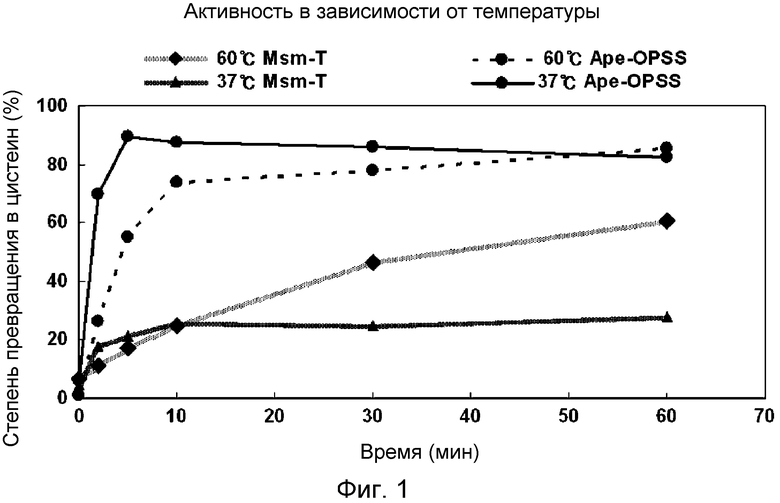
Фиг. 1 представляет собой график, демонстрирующий активность OPSS при различной температуре.
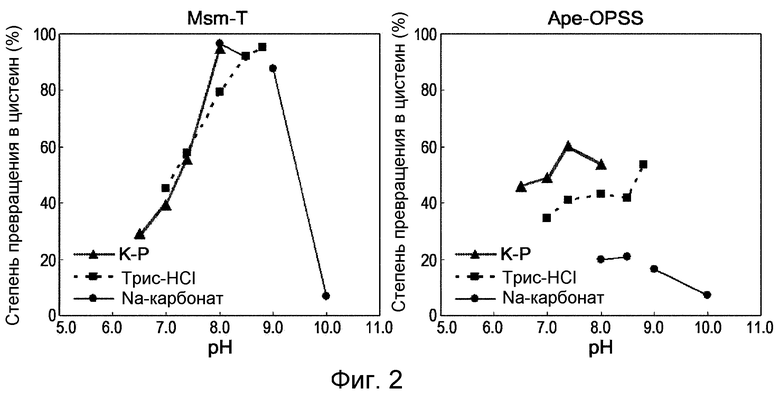
Фиг. 2 представляет собой панель графиков, демонстрирующих чувствительность OPSS к рН.
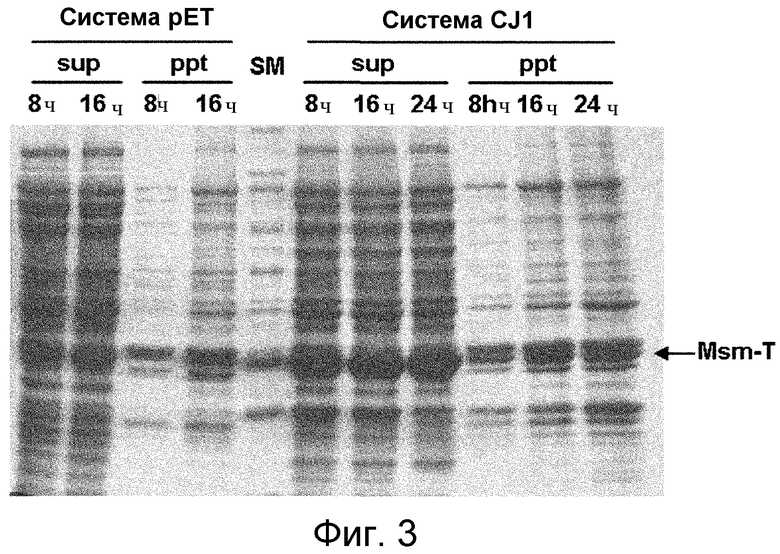
Фиг. 3 представляет собой фотографию, демонстрирующую уровень экспрессии фермента в системе pET и системе pCL-Pcj1 при анализе с помощью SDS-ПААГ.
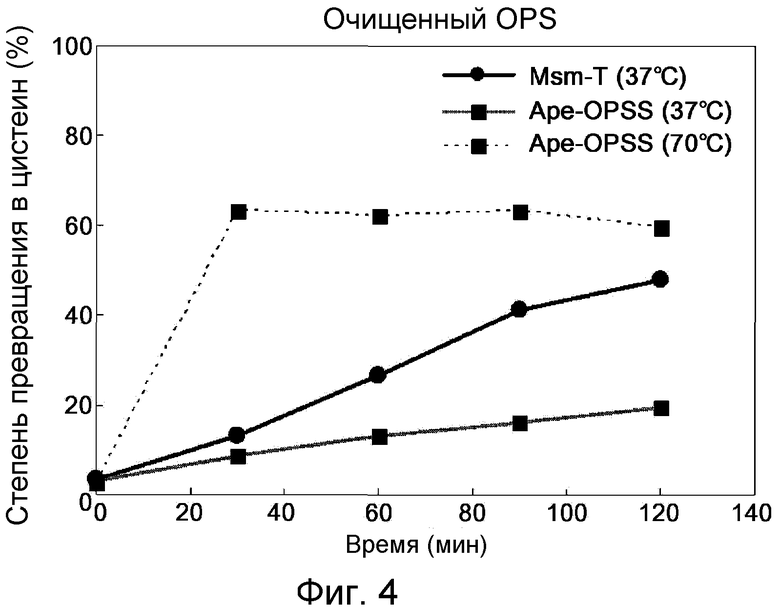
Фиг. 4 представляет собой график, демонстрирующий ферментативную активность OPSS при превращении очищенного из ферментационного бульона OPS в цистеин.
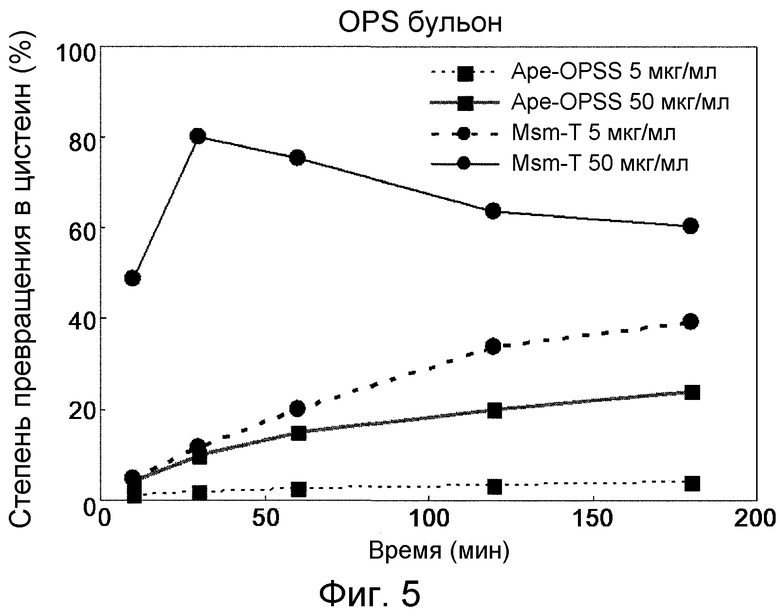
Фиг. 5 представляет собой график, демонстрирующий ферментативную активность OPSS при превращении OPS ферментационного бульона в цистеин.
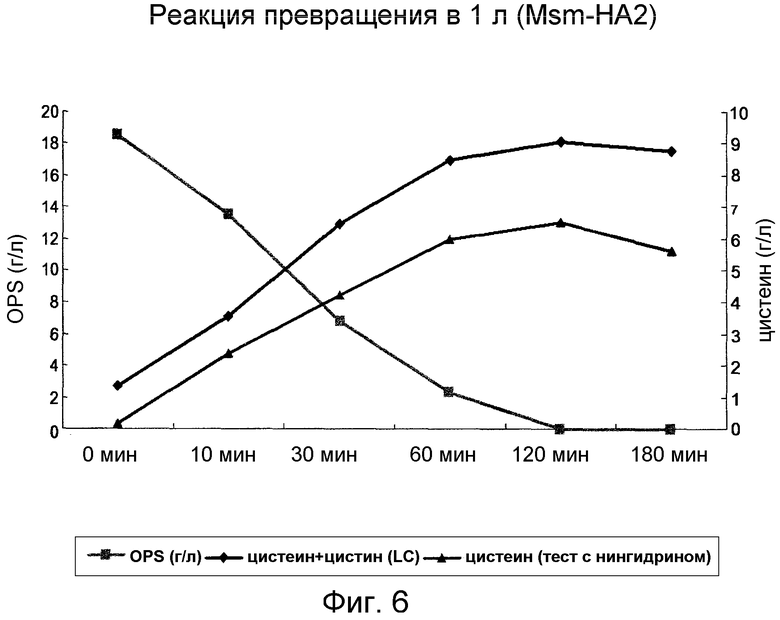
Фиг. 6 представляет собой график, демонстрирующий продукцию OPS и цистеина, который получен под действием OPSS, использующей в качестве субстрата OPS, в масштабе 1 л сосуда.
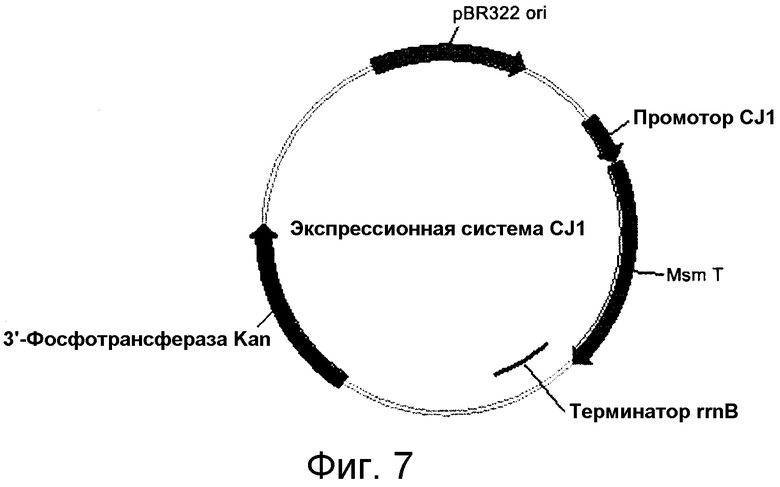
Фиг. 7 представляет собой схематическое изображение карты экспрессионного вектора pCL-Pcj1, несущего ген, кодирующий мутантную OPSS.
Лучший способ осуществления изобретения
В соответствии с одним его аспектом в настоящем изобретении предлагается мутантная OPSS из Mycobacterium smegmatis с той же аминокислотной последовательностью, что и SEQ ID NO: 1 за исключением отсутствия от 3 до 7 C-концевых аминокислотных остатков аминокислотной последовательности O-фосфосеринсульфгидрилазы дикого типа.
В одном варианте осуществления настоящего изобретения мутантная OPSS по настоящему изобретению может иметь аминокислотные последовательности SEQ ID NO: 2, 3 и 4. Мутантная OPSS, имеющая аминокислотную последовательность SEQ ID NO: 2, может быть дополнительно модифицирована с заменой остатка пролина (Pro) в положении 77 остатком серина (Ser). Кроме того, мутантная OPSS, имеющая аминокислотную последовательность SEQ ID NO: 2, может быть дополнительно модифицирована с заменой остатка треонина (Thr) в положении 131 остатком аланина (Ala), остатка лизина (Lys) в положении 137 остатком аспарагина (Asp) и остатка треонина (Thr) в положении 238 остатком серина (Ser). Кроме того, аминокислотные последовательности, которые гомологичны, по меньшей мере, на 50%, предпочтительно на 60%, 70%, 75% и 80%, более предпочтительно на 85%, 90% и 95% и наиболее предпочтительно на от 97% до 99% указанных выше мутантов, попадают в объем настоящего изобретения.
Термин «Mycobacterium smegmatics» обозначает штамм в форме бацилл типа Actinobacteria, которые являются тонкими, прямыми или слегка изогнутыми, имеют нерегулярное ветвление и могут быть окрашены основным красителем анилином. В настоящем изобретении было обнаружено, что когда ее аминокислотная последовательность модифицирована, O-фосфосеринсульфгидрилаза из этого штамма может катализировать биосинтез L-цистеина с повышенным выходом.
Используемый в настоящем описании термин «O-фосфосеринсульфгидрилаза (OPSS)» обозначает фермент, который катализирует превращение OPS в цистеин. Фермент был впервые обнаружен в Aeropyrum pernix и так назван (Mino K and Ishikawa K, FEBS letters, 551: 133-138, 2003, SEQ ID NO: 6).
Различные хорошо известные методы могут быть использованы для получения OPSS. Иллюстративные примеры методов включают, но не ограничиваются этим, методы генного синтеза на основе оптимизации кодонов, с помощью которых представляющие интерес ферменты могут быть получены с высоким выходом, и методы скрининга пригодных источников фермента с помощью биоинформатики, основанные на анализе массивов сохраненной генетической информации о микроорганизмах. В одном варианте осуществления настоящего изобретения ферменты OPSS, которые используют OPS в качестве субстрата для синтеза цистеина, были отобраны из различных микробов. В этом случае осадки клеток, полученные с использованием подходящей среды и культуральных условий, известных на данном уровне техники, (лизировали) с последующей очисткой супернатанта, содержащего фермент, с получением фермента OPSS.
Используемый в настоящем описании термин «мутантный» обозначает культуру или индивидуум, которые проявляют наследуемое или ненаследуемое стабильное изменение фенотипа. При использовании в отношении OPSS (O-фосфосеринсульфгидрилазы) термин «мутантный» предназначен для обозначения фермента OPSS, который генетически изменен так, что его активность может быть эффективно улучшена по сравнению с ферментом дикого типа.
На основе сообщения о том, что мутантные OPSS из Mycobacterium tuberculosis H37Rv с делецией пяти C-концевых аминокислотных остатков проявляют повышенное сродство к источнику серы, содержащему группу S2-, даже в отсутствие дополнительных ферментов, была получена мутантная OPSS с помощью делеции пяти C-концевых аминокислотных остатков из OPSS Mycobacterium smegmatics. Мутантная OPSS по настоящему изобретению может иметь аминокислотную последовательность, соответствующую последовательности SEQ ID NO: 1 OPSS из Mycobacterium smegmatis с делецией у нее от трех до семи, предпочтительно пяти C-концевых аминокислотных остатков.
В одном варианте осуществления настоящего изобретения мутант, имеющий аминокислотную последовательность SEQ ID NO: 2, как обнаружено, характеризовался степенью превращения 100% в пределах одного часа после его применения для превращения OPS в цистеин (таблица 5).
Замена аминокислот может дополнительно повышать ферментативную активность мутантной OPSS по настоящему изобретению. До тех пор, пока он хорошо известен в данной области техники, любой метод может быть использован для улучшения активности фермента. В настоящем изобретении предпочтительно применяли случайный мутагенез для осуществления улучшения ферментативной активности мутантной OPSS. Подробнее, после подвергания OPSS случайному мутагенезу отбирали мутантов с улучшенной ферментативной активностью с использованием системы скрининга на основе HTS (скрининга с высокой производительностью), разработанной изобретателями настоящего изобретения. В результате с помощью проведения HTS скрининга гена Msm-T получены мутантные OPSS, Msm-T-HA2 и Msm-T-EP3, которые обладали улучшенной ферментативной активностью. Msm-T-HA2 представляет собой мутантную OPSS, которая имеет ту же самую аминокислотную последовательность что и SEQ ID NO: 2, за исключением того, что остаток (Pro) в положении 77 заменен остатком серина (Ser). Msm-T-EP3 представляет собой мутантную OPSS, которая имеет тот же самый аминокислотный остаток, что и SEQ ID NO: 2, за исключением того, что в мутанте существуют замены остатка аланина (Ala) на остаток треонина (Thr) в положении 131, остатка аспарагина (Asp) на остаток лизина (Lys) в положении 137, и остатка серина (Ser) на остаток треонина (Thr) в положении 238. Предпочтительно мутантные OPSS Msm-T-HA2 и Msm-T-EP3 имеют аминокислотные последовательности, представленные SEQ ID NO: 3 и SEQ ID NO: 4, соответственно.
В одном варианте осуществления настоящего изобретения как Msm-T-HA2 так и Msm-T-EP3, как обнаружено, проявляли более высокую ферментативную активность, чем Msm-T, имеющая аминокислотный остаток SEQ ID NO: 2 (таблицы 5 и 6). Более конкретно, мутантные OPSS Msm-T-HA2 и Msm-T-EP3 при измерении проявляли 5-кратное и 1,2-кратное увеличение степеней превращения на ранней стадии реакции превращения по сравнению с контрольной Msm-T. Кроме того, даже когда мутантную Msm-T-HA2, у которой активность в отношении синтеза цистеина в 4 раза выше, чем у фермента Msm-T, использовали в количестве, соответствующем 40% Msm-T, конечная степень превращения в цистеин была сходной.
При применении в настоящем описании термин «гомология» предназначен для обозначения процента идентичности между двумя полипептидами. Соответствие между одной и другой последовательностью может быть определено с помощью методов, известных в данной области техники. Например, гомология может быть определена путем прямого сравнения информации о последовательностях двух полипептидных молекул с помощью выравнивания последовательностей методами информатики и использования легкодоступных компьютерных программ. Альтернативно, гомология может быть определена путем гибридизации полинуклеотидов в условиях, при которых образуются стабильные дуплексы между гомологичными областями, с последующим гидролизом нуклеазой, специфичной для одной цепи, и определения размеров гидролизованных фрагментов.
При применении в настоящем описании термин «гомологичный» во всех его грамматических формах и вариантах написания относится к взаимоотношению между белками, которые обладают «общим эволюционным происхождением», включая белки надсемейств (например, надсемейства иммуноглобулинов), и к гомологичным белкам различных видов (например, к легкой цепи миозина и т.д.). Такие белки (и кодирующие их гены) обладают гомологией последовательностей, что отражается в сходстве их последовательностей. Однако при обычном использовании и в текущей заявке термин «гомологичный» при применении с таким наречием как «высоко», может относиться к сходству последовательностей и может относиться, или может не относиться к общему эволюционному происхождению.
При применении в настоящем описании термин «сходство последовательностей» во всех его грамматических формах относится к степени идентичности или соответствия между последовательностями нуклеиновой кислоты или аминокислотными последовательностями белков, которые могут иметь или могут не иметь общее эволюционное происхождение. В конкретном варианте осуществления две аминокислотные последовательности являются «по существу гомологичными» или «по существу сходными», когда, по меньшей мере, 21% (предпочтительно, по меньшей мере, приблизительно 50% и наиболее предпочтительно, по меньшей мере, приблизительно 75%, 90%, 95%, 96%, 97% или 99%) аминокислот совпадают на протяжении определенной длины аминокислотных последовательностей. Последовательности, которые по существу гомологичны, могут быть идентифицированы путем сравнения последовательностей с использованием стандартных компьютерных программ и доступных баз данных последовательностей или с помощью эксперимента с гибридизацией по Саузерну, например, в жестких условиях, как определяется для этой конкретной системы. Определяемые условия гибридизации находятся в объеме данного уровня техники (например, Sambrook et al., 1989, ниже).
Мутантные OPSS по настоящему изобретению могут катализировать перенос тиоловой группы (SH группы) на OPS с получением цистеина. Предпочтительно, чтобы условия, которые позволяют мутантным OPSS по настоящему изобретению проявлять их оптимальную активность, включали, но не ограничивались этим: i) присутствие 0-2 мМ PLP (пиридоксаль-5'-фосфата) или 0-100 мМ DTT (дитиотреитола) в качестве кофактора, ii) температуру реакции от 25 до 60°С и iii) рН от 6,0 до 10,0.
Метод определения ферментативной активности OPSS, которая катализирует синтез цистеина путем переноса тиоловой группы на субстрат OPS, был раскрыт вместе с номенклатурой Ape-OPSS (Ape-O-фосфосеринсульфгидрилазы). Особенно из-за того, что Ape-OPSS обладает активностью превращения OAS в цистеин путем переноса тиоловой группы, метод основан на измерении активности фермента синтеза цистеина E. coli (OASS, O-ацетилсеринсульфгидрилазы, EC 4.2.99.8)) (Mino K and Ishikawa K, FEBS letters, 551: 133-138, 2003).
В методе в соответствии с одним вариантом осуществления настоящего изобретения PLP, который предоставляет тиоловую группу для OAS (O-ацетилсерина) или OPS, служащий кофактором OASS или OPSS при превращении в цистеин, добавляют в концентрации 0,2 мМ. Добавляют также DTT не только для предотвращения, благодаря его восстанавливающей силе окисления, экспонируемого на воздухе цистеина в цистин, но также для количественного определения количества уже окисленного цистеина. Предпочтительно чтобы, когда добавлено 25 мМ DTT или 0,2 мМ PLP, степень превращения в цистеин повышалась в 2,3 раза. Это означает, что PLP и DTT оказывают положительное влияние на превращение OPS в цистеин.
Ферменты Ape-OPSS, Mtb-OPSS и Mtb-T характеризуются оптимальной температурой реакции 60°С или 37°С при оптимальном рН 7,4, как сообщалось ранее (Mino K and Ishikawa K, FEBS letters, 551: 133-138, 2003; Agren D, Schnell R and Schneider G, FEBS letters, 583: 330-336, 2009). На основе этих данных могут быть оптимизированы условия реакции превращения для мутантных OPSS с улучшенной ферментативной активностью.
В одном варианте осуществления настоящего изобретения мутантные OPSS могут катализировать превращение при температуре от 37°С до 80°С. Подробнее, фермент Ape-OPSS из Archea spp., которая может расти даже при высоких температурах, проявляет более высокую ферментативную активность при 60°С, чем при 37°С. Высокая термостабильность самого фермента также ведет к оптимальной температуре 60°С. С другой стороны, Msm-T проявляет оптимальную ферментативную активность при 37°С и уязвима при температурной обработке при 60°С. Ферменты OPSS, как обнаружено, сохраняют активность в отношении превращения на протяжении диапазона рН от 6,0 до 10,0. Оптимальная ферментативная активность была определена при рН 7,4 у Ape-OPSS и при рН от 8,0 до 9,0 у Msm-T. Однако Msm-T стабильна на протяжении более широкого диапазона рН, чем Ape-OPSS.
В соответствии с другим его аспектом в настоящем изобретении предлагается молекула нуклеиновой кислоты, кодирующая мутантную OPSS.
При применении в настоящем описании термин «молекула нуклеиновой кислоты» предназначен для охвата молекул ДНК и РНК. Нуклеотиды, которые составляют структурные единицы молекул нуклеиновой кислоты, включают не только существующие в природе нуклеотиды, но также аналоги с модифицированной структурой сахаров или оснований (Scheit, Nucleotide Analogs, John Wiley, New York (1980); Uhlman and Peyman, Chemical Reviews, 90:543-584 (1990)).
В соответствии с дополнительным аспектом в настоящем изобретении предлагается экспрессионный вектор, несущий молекулу нуклеиновой кислоты.
«Вектор» относится к любому носителю для клонирования и/или переноса нуклеиновой кислоты в клетку-хозяина. Вектор может представлять собой репликон, к которому может быть присоединен другой сегмент ДНК так, чтобы осуществлялась репликация присоединенного сегмента. «Репликон» относится к любому генетическому элементу (например, к плазмиде, фагу, космиде, хромосоме, вирусу), который функционирует в качестве автономной единицы репликации ДНК in vivo, т.е. способен реплицироваться под своим собственным контролем. Термин «вектор» включает как вирусные, так и невирусные носители для введения нуклеиновой кислоты в клетку-хозяина in vitro, ex vivo или in vivo. Термин «вектор» может также включать миникольцевые ДНК. Например, вектор может представлять собой плазмиду без последовательностей бактериальной ДНК. Удаление последовательностей бактериальной ДНК, которые обогащены областями CpG, как показано, снижает сайленсинг экспрессии трансгенов и ведет к более устойчивой экспрессии из плазмидных ДНК-векторов (смотри, например, Ehrhardt, A. et al. (2003) Hum Gene Ther 10: 215-25; Yet, N. S. (2002) Mol Ther 5: 731-38; Chen, Z. Y. et al. (2004) Gene Ther 11: 856-64). Термин «вектор» может также включать транспозоны, такие как транспозон Спящая Красавица (Izsvak et al. J. Mol. Biol. 302:93-102 (2000)), или искусственные хромосомы.
В качестве вектора в данной области техники хорошо известна система pET (Novagen), использующая промотор T7. В настоящем изобретении могут быть использованы без ограничения различные экспрессионные системы, известные в данной области техники.
В одном варианте осуществления настоящего изобретения применялась экспрессионная система, использующая CJ1 промотор, разработанная изобретателями настоящего изобретения для экспрессии экзогенного гена (смотри вложенную корейскую патентную публикацию No. 10-2006-0068505, фиг. 7).
В одном варианте осуществления настоящего изобретения сравнивали уровни экспрессии OPSS между системой pET, включающей промотор T7, и системой CJ1, включающей промотор CJ1, при одних и тех же заданных условиях. В результате система CJ1 продемонстрировала более высокий уровень экспрессии OPSS, чем система pET (фиг. 3). Кроме того, для гиперэкспрессии OPSS в системе pET требовалась низкая температура (18°С) и длительный период времени, а в системе CJ1 высокая температура (37°С) и короткий период времени. Следовательно, для эффективного получения OPSS предпочтительно использовать промотор CJ1, но настоящее изобретение этим не ограничивается.
В соответствии с еще одним его аспектом в настоящем изобретении предлагается трансформант, трансформированный экспрессионным вектором.
При применении в настоящем описании термин «трансформация» во всех его грамматических формах и вариантах написания относится к искусственному генетическому изменению клетки, являющемуся результатом введения чужеродного гена в клетку-хозяина, так что введенный ген может реплицироваться сам или как часть, включенная в хромосому.
Вектор по настоящему изобретению может быть введен в клетки-хозяева с помощью подходящих стандартных методов, известных в данной области техники, примеры которых включают, но не ограничиваются этим, электропорацию, сопреципитацию с фосфатом кальция, инфицирование ретровирусами, микроинъекцию, использование ДЭАЭ-декстрана и липосомный катионный кальций.
Термин «клетка-хозяин, трансформированная рекомбинантным вектором», при применении в настоящем описании, относится к клетке-хозяину, которая фиксирует в себе рекомбинантный вектор, несущий представляющий интерес ген. Клетка-хозяин, подходящая для использования в настоящем изобретении, может быть прокариотной или эукариотной. Примеры включают энтеробактерии и дифтериеподобные бактерии, предпочтительно Escherichia spp. и Serratia spp. при наибольшей предпочтительности E. coli.
В соответствии с еще одним его аспектом в настоящем изобретении предлагается способ получения цистеина, включающий превращение OPS с помощью сульфида в присутствии мутантной OPSS по настоящему изобретению.
Мутант по настоящему изобретению может быть применен для массового производства цистеина. Когда используется трансформант, экспрессирующий мутант, массовая продукция цистеина может осуществляться в оптимальных культуральных условиях, которые хорошо известны в данной области техники. Следовательно, способ массовой продукции цистеина включает культивирование трансформанта в оптимальных условиях, которые хорошо известны в данной области техники.
Для использования в качестве субстрата OPS может быть в чистой форме или может быть в форме ферментируемой культуры, содержащей OPS. Чистый OPS может быть коммерческим препаратом, продаваемым Sigma-Aldrich под каталожным No. P0878, или CAS407-41-0 от Wako. Однако содержащая OPS культура, полученная путем микробной ферментации, имеет экономические преимущества по сравнению с имеющимся в продаже чистым OPS, заключающиеся в том, что содержащая OPS культура может быть использована без дополнительной очистки, и кофактор PLP, необходимый для превращения, может быть получен в ферментируемой культуре.
Любое соединение серы может быть использовано в настоящем изобретении до тех пор, пока оно может превращаться в тиоловую группу (SH). Предпочтительно могут быть использованы Na2S, H2S или S2O3 в форме жидкости или газа.
В одном варианте осуществления настоящего изобретения в качестве источника серы использовался Na2S. Na2S может быть добавлен в молярной концентрации, в от 0,1 до 3 раз более высокой, чем концентрация OPS, используемая в ферментативном превращении. Подробнее, Msm-T-HA2, которая обеспечивала 80% степени превращения в цистеин, что эквивалентно степени превращения под действием Msm-T, используют в концентрации 50 мкг/мл при условиях реакции, включающих 50 мМ OPS ферментационного бульона или 60 мМ очищенного OPS ферментационного бульона, 100 мМ или 120 мМ Na2S и 0,2 мМ PLP.
Специалистам в данной области техники должно быть ясно и вполне понятно, что с высокоактивными ферментами процесс ферментативного превращения может быть оптимизирован и масштабирован. В одном варианте осуществления, когда 19,317 г/л OPS ферментационного бульона инкубировали в присутствии 50 мг Msm-T-HA2, цистеин продуцировался в концентрации до 9,075 г/л. В 1 л сосуде OPS превращался в цистеин в присутствии мутанта со степенью 71,83% (фиг. 6).
Аббревиатура и терминология
Для лучшего понимания настоящего изобретения и для обучения тем методам в данной области техники, которые необходимы для осуществления настоящего изобретения, дано описание последующих выражений и методов. Пока в контексте ясно не указано иначе, во всем описании и формуле изобретения слова «включает», «включающий» и тому подобное должны истолковываться в смысле включения как противоположного смыслу исключения или исчерпания, что соответствует смыслу выражения «включая, но, не ограничиваясь этим». Формы единственного числа включают ссылки на множественное число, если в контексте ясно не указано иначе. Например, термин «включающий клетку» обозначает «включающий одну клетку или множество таких клеток, но не ограничивается этим».
Когда используется ссылка на перечисление двух или более предметов, «или» покрывает все последующие интерпретации слова: любого из предметов в перечислении, всех предметов в перечислении и любого сочетания предметов в перечислении.
Если не указано иначе, все технические и научные термины, используемые в настоящем описании, имеют то же самое значение, что и понимаемое специалистами в той области техники, к которой принадлежит настоящее изобретение. Имеющие отношение к изобретению методы и вещества раскрыты ниже, но сходные или эквивалентные методы и вещества могут быть использованы на практике или в экспериментах по настоящему изобретению. Вещества, методы и примеры, представленные ниже, предлагаются как иллюстративные, но не должны быть истолкованы как ограничивающие настоящее изобретение. Другие характеристики и преимущества настоящего изобретения должны быть понятны из последующего описания и прилагаемой формулы изобретения.
Делеция: мутация, при которой один или более нуклеотидов или аминокислотных остатков удалены из молекулы нуклеиновой кислоты или белка, соответственно.
Способ осуществления изобретения
Лучшее понимание настоящего изобретения может быть достигнуто с помощью последующих примеров, которые предлагаются с целью иллюстрации, но не истолковываются как ограничивающие настоящее изобретение.
Пример 1: Конструирование OPSS
Сообщалось, что Aeropyrum pernix, Mycobacterium tuberculosis и Trichomonas vaginalis содержат OPSS, фермент, который использует OPS вместо OAS в E. coli в качестве субстрата для синтеза цистеина (Mino K and Ishikawa K, FEBS letters, 551: 133-138, 2003; Burns KE, Baumgart S, Dorrestein PC, Zhai H, McLafferty FW and Begley TP, J. Am. Chem. Soc., 127: 11602-11603, 2005; Westrop GD, Goodall G, Mottram JC and Coombs GH, J. Biol. Chem., 281: 25062-25075, 2006). На основании этих сообщений авторы настоящего изобретения обнаружили два типа OPSS, которые превращают OPS в цистеин, в Aeropyrum pernix и Mycobacterium tuberculosis H37Rv. Из них фермент OPSS из Mycobacterium tuberculosis H37Rv был использован для скрининга аминокислотной гомологии. В результате было получено три мутанта OPSS Msm-OPSS, Rjo-OPSS и Nfa-OPSS из Mycobacterium smegmatis str. MC2 155, Rhodococcus jostii RHA1 и Nocardia farcinica IFM 10152, соответственно.
Для получения OPSS из каждого штамма была сконструирована векторная система pET28a (Novagen), которая обычно используется для экспрессии ферментов. Все матрицы и праймеры, использованные для клонирования пяти разных ферментов сульфгидрилазы OPS, и полученные рекомбинантные плазмиды суммированы в таблице 1 ниже. Подходящие сочетания матриц и праймеров, как представлено в таблице 1, были использованы для ПЦР для амплификации каждого гена OPSS. Продукты ПЦР и вектор pET28a гидролизовали NdeI и HindIII (37°С в течение 3 часов). Каждый из фрагментов генов лигировали с гидролизованным вектором pET28a (Novagen). Секвенирование оснований подтвердило конструирование экспрессионных векторов, несущих каждый из генов OPSS. Экспрессионные векторы фермента были введены в E. coli (DE3) с получением штаммов, способных экспрессировать ферменты OPSS. Наименования ферментов представлены в таблице 1 ниже.
Экспрессию ферментов осуществляли в соответствии с инструкциями производителя системы pET (Novagen). Одиночные колонии каждого штамма с чашек LB инокулировали в 5 мл бульона LB и инкубировали при 37°С в течение 16 часов со встряхиванием при 200 об/мин. Культуры переносили в 25 мл свежего бульона LB (в 250-мл флаконах) и инкубировали до OD600, равной 0,5-0,6 (в течение 2-3 часов), в тех же условиях, сразу после чего к среде добавляли 1 мМ IPTG для индукции подлежащих экспрессии ферментов во время инкубации при 18°С в течение 18 часов со встряхиванием при 120 об/мин. Ферменты очищали с использованием колонок Ni-NTA для His-tag с помощью His SpinTrap (GE Healthcare). Из пяти выделенных таким образом ферментов, OPSS четыре были обнаружены в растворимой форме, а один (Rjo-OPSS) находился в тельцах включений по данным анализа с помощью 14% SDS-ПААГ-электрофореза.
Пример 2: Анализ OPSS на предмет активности в синтезе цистеина
Четыре фермента OPSS, полученные из разных штаммов микроорганизмов, анализировали на способность катализировать превращение OPS в цистеин. В плане условий и методов анализа (ферментативного анализа cysM) дается ссылка на предшествующие сообщения (Mino K and Ishikawa K, FEBS letters, 551: 133-138, 2003; Burns KE, Baumgart S, Dorrestein PC, Zhai H, McLafferty FW and Begley TP, J. Am. Chem. Soc., 127: 11602-11603, 2005; Westrop GD, Goodall G, Mottram JC and Coombs GH, J. Biol. Chem., 281: 25062-25075, 2006). Количество использованного субстрата представлено в единицах на мл. Условия анализа ферментативной активности суммированы в таблице 2 ниже.
Растворы для реакции, исключая ферменты, инкубировали при 37°С в течение 5 мин, после чего к раствору для реакции добавляли 50 мг очищенной OPSS. В заранее определенные моменты времени инкубации при 37°С отбирали 100 мл раствора ферментативной реакции и смешивали с 100 мл 33,2% ТХУ для остановки ферментативной реакции. Концентрации цистеина в растворах ферментативной реакции количественно анализировали путем измерения поглощения при ОП560 согласно методу Гейтонд. Активность в отношении синтеза цистеина четырех разных ферментов сульфгидрилазы OPS суммирована в таблице 3 ниже. Титры синтеза цистеина ферментов OPSS выражены в виде степени превращения в цистеин за время реакции.
Как можно видеть в таблице 3, было подтверждено, что ферменты OPSS из Aeropyrum pernix и Mycobacterium tuberculosis H37Rv обладают способностью использовать OPS в качестве субстрата для синтеза цистеина. Впервые была обнаружена способность к синтезу цистеина новой OPSS из Mycobacterium smegmatis str. MC2 155, которая была получена путем скрининга аминокислотной гомологии с ферментом Mtb-OPSS. С другой стороны, новая OPSS из Nocardia farcinica IFM 10152, полученная скринингом гомологии, проявляла несущественную активность в отношении превращения O-фосфосерина в цистеин.
Как видно из данных таблицы 3, степень превращения OPS в цистеин Ape-OPSS достигает почти 100% за один час.
Конечная степень превращения под действием фермента Msm-OPSS, который был впервые отобран посредством скрининга фермента на основе OPSS из Mycobacterium tuberculosis H37Rv, о которой сообщалось ранее, составляла 43,7%, что в 4,3 раза превышало степень превращения под действием Mtb-OPSS.
Пример 3: Получение Mtb-T и Msm-T, мутантов, лишенных 5 C-концевых аминокислотных остатков Mtb-OPSS и Msm-OPSS
OPSS из Mycobacterium tuberculosis H37Rv (Mtb-OPSS), которая катализирует превращение OPS в цистеин с помощью дополнительных ферментов mec+ и cysO, способна использовать источник серы, содержащий S2-, для превращения OPS в цистеин даже в отсутствие дополнительных ферментов, когда из нее удалены пять C-концевых аминокислотных остатков. На основании этого факта была получена Mtb-T (SEQ ID NO: 24), которая может быстро превращать OPS в присутствии S2- в качестве источника серы. Была также получена Msm-T из Msm-OPSS, которая имеет высокую аминокислотную гомологию с Mtb-OPSS, путем делеции 5 C-концевых аминокислотных остатков. Были сконструированы экспрессионные векторы, несущие два мутантных фермента. Для этого проводили ПЦР c pfu на геномной ДНК Mycobacterium tuberculosis H37Rv и Mycobacterium smegmatis str. MC2 155 в присутствии каждой пары праймеров SEQ ID NOS: 17 и 18 и SEQ ID NO: 19 и 20. Полученные таким образом фрагменты генов OPSS обрабатывали NdeI и HindIII и клонировали в вектор pET28a, гидролизованный теми же ферментами рестрикции, для конструирования рекомбинантных экспрессионных векторов, названных pET28a-Mtb-T и pET28a-Msm-T, соответственно. Рекомбинантные экспрессионные векторы были введены в E. coli (DE3). Экспрессия двух мутантных OPSS, полученных в тех же условиях, что и в примере 1, была подтверждена с помощью 14% SDS-ПААГ. В результате были получены Mtb-T (SEQ ID NO: 5) и Msm-T (SEQ ID NO: 2).
Пример 4: Анализ Mtb-T и Msm-T на предмет способности к синтезу цистеина
Ферментативную активность полученных выше Mtb-T и Msm-T оценивали путем измерения конечной степени образования цистеина. Ферментативную активность анализировали таким же образом, что и в примере 2. Образованный цистеин количественно определяли методом Гейтонд, и результаты суммированы в таблице 4 ниже.
Как видно из таблицы 4, Msm-T обеспечивала степень образования цистеина из субстрата, равную 100% за один час.
Пример 5: Анализ берущих начало от Msm-T мутантов Msm-T-HA2 и Msm-T-EP3 на предмет способности к синтезу цистеина
На основе Msm-T, которая способна превращать OPS в цистеин со 100% эффективностью, были получены мутантные ферменты с улучшенной активностью с использованием метода эволюции ферментов, названные Msm-T-HA2 (SEQ ID NO: 25) и Msm-T-EP3 (SEQ ID NO: 26). Msm-T была подвергнута случайному мутагенезу с помощью обработки гидроксиламином и набора для подверженной ошибкам ПЦР (Clontech. Diversity PCR random mutagenesis kit) с конструированием библиотеки мутантов Msm-T, которые затем были подвергнуты скринингу для отбора мутантов OPSS с улучшенной ферментативной активностью.
Было обнаружено, что мутанты OPSS Msm-T-HA2 и Msm-T-EP3, полученные скринингом HTS на гене Msm-T, имеют аминокислотные последовательности SEQ ID NO: 3 и 4, соответственно, по данным секвенирования оснований.
Мутанты OPSS Msm-T-HA2 и Msm-T-EP3 и контрольная Msm-T были проанализированы на предмет ферментативной активности, и результаты суммированы в таблицах 5 и 6. Анализ ферментативной активности производили таким же образом, что и в примере 2.
Как можно видеть в таблицах 5 и 6, мутанты OPSS Msm-T-HA2 и Msm-T-EP3, полученные методом эволюции ферментов, по данным измерений в течение 10 мин после инициации реакции проявляли 5-кратно и 1,2-кратно повышенную степень превращения, соответственно, по сравнению с контрольной Msm-T. Их также сравнивали в плане удельной активности (концентрация продукта/время/количество фермента), которая широко используется для определения ферментативной активности. Удельная активность Msm-HA2 была в три раза повышена по сравнению с контрольной Msm-T, что указывает на то, что мутант OPSS улучшен по ферментативной активности и обладает способностью синтезировать цистеин в больших количествах за единицу времени на единицу фермента.
Пример 6: Потребность в кофакторе для активности OPSS
Для проверки влияния кофакторов на образование цистеина под действием OPSS степень превращения в цистеин под действием Msm-T измеряли в отсутствие или в присутствии PLP и DTT. Для этого субстраты в бульоне 50 мМ OPS и 100 мМ Na2S вводили во взаимодействие при 37°С в течение 30 мин в присутствии 25 мМ DTT или 0,2 мМ PLP. Продуцированный таким образом цистеин, количественно определяли методом Гейтонд. Результаты суммированы в таблице 7 ниже.
Как видно из таблицы 7, степень превращения в цистеин в присутствии и PLP, и DTT была в 2,3 раза выше, чем в отсутствие и PLP, и DTT. Таким образом, наблюдалось положительное действие и PLP, и DTT на превращение.
Пример 7: Влияние температуры на активность OPSS
Была оценена степень превращения в цистеин под действием Ape-OPSS и Msm-T в зависимости от температуры. Ферментативную активность при 37°С и 60°С измеряли через 2, 5, 10, 30 и 60 мин прохождения реакции. Реакцию проводили в условиях 100 мМ HEPES (pH 7,4), 5 мМ OPS, 10 мМ Na2S, 0,2 мМ PLP и 50 мкг/мл CysM. Количество продуцированного цистеина определяли методом Гейтонд. Результаты показаны на фиг. 1.
В условиях буфера, как показано на фиг. 1, Ape-OPSS проявляла более высокую начальную скорость реакции при 37°С, а также большую активность при 60°С по сравнению с Msm-T.
Пример 8: Температурная стабильность OPSS
Была произведена оценка термостабильности Ape-OPSS и Msm-T. Каждый из ферментов разбавляли до концентрации 2 мг/мл в бульоне OPS и обрабатывали нагреванием при 37°С и 60°С в течение 10, 30, 60, 120 и 240 мин с последующим проведением реакции при 37°С в течение 30 мин в условиях 5 мМ OPS, 10 мМ Na2S, 0,2 мМ PLP и 100 мМ HEPES (pH 7,4). Для этой реакции использовали 10 мкг/мл Ape-OPSS и 50 мкг/мл Msm-T. Количество продуцированного цистеина определяли методом Гейтонд, и результаты суммированы в таблице 8 ниже.
Как можно видеть в таблице 8, было обнаружено, что Ape-OPSS сохраняет свою исходную активность, несмотря на термообработку при 60°С в течение 4 часов, в то время как активность Msm-T сохранялась при 37°С, но снижалась до 50% после термообработки при 60°С в течение 30 мин.
Была произведена оценка сохранения ферментативной активности при 37°С, когда Msm-T использовали в количестве 50 мкг/мл, представляющем собой реальную концентрацию в бульоне OPS. Обработку 50 мкг/мл Msm-T производили в отсутствие Na2S, но в присутствии 50 мМ бульона OPS и 0,2 мМ PLP при 37°C в течение 0,5, 1, 2, 4 и 6 часов, после чего добавляли Na2S для индукции ферментативной реакции. После проведения реакции в течение 30 мин измеряли активность Msm-T. Количество продуцированного цистеина было определено методом Гейтонд и представлено в таблице 9 ниже.
Как можно видеть в таблице 9, активность Msm-T снижалась ниже 50% через 2 часа реакции при 37°С в бульоне OPS.
Пример 9: Чувствительность OPSS к pH
Измеряли степень превращения в цистеин под действием Ape-OPSS и Msm-T в зависимости от pH. Реакцию проводили при 37°С в течение 10 мин в 100 мМ буфере с Ape-OPSS и Msm-T, каждая в концентрации 50 мкг/мл. Для этого использовали K-фосфатный буфер с pH 6,4/7,0/7,4/8,0, трис-HCl буфер с pH 7,0/7,4/8,0/8,5/8,8 и Na-карбонатный буфер с pH 8,0/8,5/9,0/10,0. Количественный анализ продуцированного цистеина проводили методом Гейтонд. Результаты суммированы на фиг. 2.
Как видно из фиг. 2, Msm-T проявляла наибольшую активность при pH от 8,0 до 9,0 независимо от буфера. Что касается Ape-OPSS, то наибольшая активность была обнаружена в K-фосфате (pH 7,4) с оптимумом pH, различающемся в разных буферах.
Пример 10: Влияние ионов на активность OPSS
Влияние ионов на активность ферментов OPSS оценивали следующим образом. Ферменты вводили в реакцию в реакционной смеси, содержащей 5 мМ OPS, 10 мМ Na2S, 0,2 мМ PLP и 100 мМ HEPES (pH 7,4), при 37°С в течение 30 мин в присутствии (NH4)2SO4 [1, 3, 5, 10, 20 г/л], KH2PO4 [0,5, 1, 2, 4, 8 г/л] или NH4Cl [0,2, 0,5, 1, 2 г/л]. Ape-OPSS и Msm-T находились в концентрации 10 мкг/мл и 50 мкг/мл, соответственно. Количество продуцированного цистеина было определено методом Гейтонд и представлено в таблице 10 ниже.
Не было обнаружено изменений в скорости превращения в цистеин при добавлении к реакционной смеси (NH4)2SO4 или KH2PO4. С другой стороны, как можно видеть в таблице 10, скорость образования цистеина снижалась при увеличении концентрации NH4Cl. В частности, максимальная ферментативная активность снижалась более чем на 70% при добавлении 2 г/л NH4. Таким образом, наблюдалось негативное действие NH4Cl и NH4 на превращающую активность OPSS.
Пример 11: Влияние источника серы на активность OPSS в отношении синтеза цистеина
Был проведен эксперимент по оценке влияния источников серы на активность каждого фермента в синтезе цистеина. Каждый фермент (50 мкг/мл Ape-OPSS, 50 мкг/мл Msm-T) вводили в реакцию в реакционной смеси, содержащей 5 мМ OPS, 0,2 мМ PLP и 100 мМ HEPES, при 37°С в течение 1 часа в присутствии 10 мМ Na2S, NaSH или Na2S2O3. Количество продуцированного цистеина определяли методом Гейтонд. Наблюдалось, что Ape-OPSS предпочитает Na2S2O3 в качестве источника серы, тогда как Msm-T предпочитает Na2S. Результаты суммированы в таблице 11 ниже.
Пример 12: Конструирование экспрессионного вектора, несущего OPSS (система pCL-Pcj1), и экспрессия фермента
Проводили ПЦР с использованием праймеров SEQ ID NO: 21 и 22 с вектором pET28a-Msm-T, служившим в качестве матрицы. Полученный таким образом продукт ПЦР, обрабатывали EcoRV и HindIII и клонировали для конструирования рекомбинантного вектора, названного pCL-P(CJ1)-Msm-T (pCJI-MsmT CysM, фиг. 7). Для оценки разницы в уровнях экспрессии Msm-tc между системой pET и системой pCL-Pcj1 были получены штаммы, экспрессирующие фермент. Система pET была введена в Rosetta (DE3), а для системы pCL-Fcj1 использовали штамм K12G. Одиночные колонии, отобранные с чашек LB, инокулировали в 5 мл бульона LB и культивировали при 37°С в течение 16 часов со встряхиванием при 200 об/мин. Эти культуры переносили в 25 мл свежего бульона LB, содержащего канамицин или спектиномицин и 0,2% глюкозы (в 250-мл флаконах), и инкубировали до OD600, равной 0,5-0,6, сразу после чего к среде добавляли 1 мМ IPTG для индукции подлежащих экспрессии ферментов. Во время инкубации при 37°С со встряхиванием при 200 об/мин измеряли уровни экспрессии фермента через разные периоды культивирования (8, 16, 24 часов). Уровни экспрессии фермента в двух системах были анализированы с помощью 14% SDS-ПААГ и показаны на фиг. 3.
Как можно видеть на фиг. 3, в одинаковых условиях система pCL-Pcj1 обеспечивает более высокий уровень экспрессии фермента по сравнению с системой pET. Кроме того, имеет место улучшение условий культивирования, поскольку система обеспечивает экспрессию фермента при высокой температуре, равной 37°С, и низкой концентрации IPTG, равной 0,1 мМ. Таким образом, система pCL-Pcj1 может эффективно заменять работу pET.
Пример 13: Синтез цистеина под действием OPSS при использовании в качестве субстрата OPS, очищенного из бульона ферментации
Были определены скорости превращения очищенного OPS в цистеин под действием Msm-T и Ape-OPSS. В присутствии 75 мкг/мл каждого из ферментов и 0,2 мМ PLP 60 мМ OPS, очищенного из бульона ферментации OPS, вводили во взаимодействие с 120 мМ Na2S при 37°С или 70°С в течение 30, 60, 90 и 120 мин. Реакцию проводили лишь при 37°С для Msm-T, но и при 37°С, и при 70°С для Ape-OPSS. Количество продуцированного цистеина определяли методом Гейтонд. Результаты показаны на фиг. 4.
Как видно на фиг. 4, OPS, очищенный из бульона ферментации, хорошо служил в качестве субстрата для ферментативного превращения в цистеин. В частности, скорость превращения в цистеин под действием Ape-OPSS увеличивалась при 70°С даже при использовании OPS, очищенного из бульона ферментации.
Пример 14: Синтез цистеина под действием OPSS при использовании в качестве субстрата OPS бульона ферментации
При использовании в качестве субстрата бульона ферментации OPS скорость превращения в цистеин под действием Msm-T и Ape-OPSS измеряли в зависимости от концентраций ферментов. В присутствии 5 мкг/мл или 50 мкг/мл каждого из Msm-T и Ape-OPSS и 0,2 мМ PLP 50 мМ OPS бульона ферментации вводили во взаимодействие с 100 мМ Na2S при 37°С. Количество продуцированного цистеина определяли методом Гейтонд. Результаты показаны на фиг. 5.
Как видно на фиг. 5, наибольшая скорость превращения была обнаружена при 50 мкг/мл Msm-T. Кроме того, при использовании в качестве субстрата бульона ферментации OPS активность Msm-T превышала активность Ape-OPSS.
Пример 15: Степень превращения в цистеин в зависимости от концентрации OPSS
К бульону OPS, содержащему OPS в концентрации 9,76 г/л, добавляли Na2S в количестве, в два раза превышающем молярное количество OPS, с последующей инкубацией при 37°С в течение 5 мин. После этого добавляли очищенную Msm-T в количестве 50 мг, а очищенную Msm-T-HA2 использовали в количестве 5 мкг, 10 мкг, 20 мкг и 50 мкг. В заранее намеченные моменты времени инкубации при 37°С отбирали 100 мл смеси ферментативной реакции и смешивали с 100 мл 33,2% ТХУ для остановки ферментативной реакции. Концентрацию цистеина в ферментативных реакциях количественно определяли измерением поглощения при ОП560 по методу Гейтонд. Активность ферментов OPSS в отношении синтеза цистеина в зависимости от концентрации фермента суммирована в таблице 12 ниже.
Как можно видеть в таблице 12, даже когда мутант Msm-T-HA2, активность которого в отношении синтеза цистеина была улучшена, использовали в количестве, соответствующем 40% количества Msm-T, конечная степень превращения в цистеин (%) была сходной. Кроме того, при использовании в одинаковом количестве мутант Msm-T-HA2 показал более высокую начальную реакционную активность по сравнению с Msm-T.
Пример 16: Степень превращения в цистеин в зависимости от концентрации OPS
Для оценки влияния концентрации OPS на скорость превращения под действием Msm-T и Msm-T-HA2 к бульону ферментации OPS добавляли заранее определенные количества очищенного OPS для индукции реакции превращения. Фермент использовали в количестве 50 мкг для Msm-T и 20 мкг для Msm-T-HA2. Количество цистеина в реакционном растворе определяли методом Гейтонд. Результаты суммированы в таблицах с 13 по 15.
Степень превращения в цистеин (измеренный OPS равен 10,65 г/л)
Степень превращения в цистеин (измеренный OPS равен 36,09 г/л)
Степень превращения в цистеин (измеренный OPS равен 55,6 г/л)
Как видно из таблиц с 13 по 15, когда концентрация OPS составляла около 30 г/л, наибольшая измеренная степень превращения составляла 100% для Msm-T и 80% для Msm-T-HA2. Было обнаружено, что когда концентрация OPS превышала 50 г/л, и скорость превращения, и процент превращения снижаются.
Данные таблиц с 13 по 15 были использованы для выбора оптимального соотношения концентраций между OPS и Msm-T-HA2 для процесса превращения с использованием высокой концентрации OPS и для снижения времени реакции для Msm-T-HA2 по сравнению с Msm-T.
Пример 17: Степень превращения в цистеин в зависимости от концентрации Na2S
Для оценки влияния количества Na2S, используемого в качестве источника серы, на скорость превращения в цистеин, проводили реакции превращения OPS в присутствии 20 мкг Msm-T-HA2, когда Na2S применялся в концентрации 160 мМ, 320 мМ и 480 мМ, что соответствовало количествам, эквивалентным и превышающим в два и три раза молярное количество OPS, соответственно. Полученные степени превращения в цистеин суммированы в таблице 16 ниже.
Степень превращения в цистеин (OPS 29,76 г/л)
Как можно видеть в таблице 16, степень превращения в цистеин достигала максимума при молярном содержании Na2S, в два раза превышающем использованное содержание OPS. Из результатов понятно, что оптимальное условие устанавливается при молярном отношении Na2S к OPS, равном 2.
Пример 18: Степень превращения в цистеин в зависимости от pH
Для оценки влияния pH на ферментативное превращение OPS в цистеин проводили реакцию превращения в присутствии 20 мкг Msm-T-HA2 при различных значениях pH. Результаты суммированы в таблице 17 ниже.
Степень превращения в цистеин (%)
Как можно видеть, было определено, что оптимальное значение pH для реакции превращения находится между 8,5 и 9,5.
Пример 19: Способ превращения в масштабе 1-л сосуда.
Способ реакции превращения бульона OPS в цистеин был увеличен в масштабе 1-л сосуда. На основании свойств OPSS и данных для реакции превращения в условиях 1-мл пробирки был установлен способ реакции превращения для Msm-T-HA2.
Перед проведением реакции превращения в масштабе 1-л сосуда бульон ферментации OPS, полученный в 1-л сосуде, центрифугировали (10000 об/мин, 10 мин, 4ºС), и супернатант пропускали через мембрану (0,45 мкм) для удаления клеток. К отфильтрованному бульону OPS (19,317 г/л) добавляли 72 г Na2S с последующим удалением осадка фильтрованием через ватманскую фильтровальную бумагу (6 мкм). После добавления 10 мМ PLP реакционную смесь предварительно инкубировали при 37ºС в течение 5 мин со встряхиванием при 200 об/мин. Наконец, проводили реакцию превращения в присутствии 50 мг Msm-T-HA2 в масштабе 1-л сосуда. Через 0, 10, 30, 60, 120 и 180 мин периода инкубации при 37ºС отбирали 100 мкл смеси ферментативной реакции и смешивали с 100 мкл 33,2% ТХУ для остановки ферментативной реакции. Отобранные образцы разбавляли 0,1 н HCl и анализировали на содержание цистеина и цистина с помощью ЖХ. Кроме того, для определения количества цистеина использовали метод Гейтонд. Концентрации субстратов и фермента, использованные в способе реакции превращения, суммированы в таблице 18 ниже. Использованное количество субстратов представлено в единицах на мл.
Концентрацию цистеина в реакционной смеси, полученной после проведения реакции превращения в условиях таблицы 18, количественно анализировали методом Гейтонд и ЖХ, и результаты представлены на фиг. 6.
Как видно на фиг. 6, при инкубации бульона OPS 19,317 г/л в течение 2 часов в присутствии 50 мг Msm-T-HA2 количество продуцированного цистеина или цистина достигало максимума 9,075 г/л, что указывает на то, что степень продукции цистеина и цистина из OPS может составлять 71,83% при способе ферментативного превращения в масштабе 1-л сосуда.
Степень превращения в цистеин/цистин (%)
Цистеин/цистин (г/л)
Применимость для производства
Как описано в настоящем описании, мутанты OPSS по настоящему изобретению могут быть пригодны для массовой продукции L-цистеина, который, как и его производные, может найти применение во многих областях, включая фармацевтическую промышленность (для лечения бронхиальных заболеваний), косметическую промышленность (в шампунях для волос, составах для перманентной завивки и т.д.) и пищевую промышленность (антиоксиданты, усилители вкуса, вспомогательные добавки для теста и т.д.).













Группа изобретений относится к биотехнологии, в частности к мутантной O-фосфосеринсульфгидрилазе (OPSS) из Mycobacterium smegmatis с аминокислотной последовательностью, соответствующей последовательности SEQ ID NO: 1, в которой отсутствуют от трех до семи C-концевых аминокислотных остатков. Изобретения относятся также к молекуле нуклеиновой кислоты, кодирующей мутантную OPSS, к экспрессионному вектору, несущему молекулу нуклеиновой кислоты, и к трансформанту, трансформированному экспрессионным вектором. Кроме того, предлагается способ получения цистеина, в котором O-фосфо-L-серин (OPS) вводится в реакцию с сульфидом в присутствии мутантной OPSS. Мутантная OPSS имеет улучшенную ферментативную активность и может применяться для получения L-цистеина в условиях, благоприятных для окружающей среды, путем простой ферментативной реакции превращения. Группа изобретений обеспечивает высокий выход продукции L-цестеина. 8 н. и 8 з.п. ф-лы, 7 ил., 20 табл., 19 пр.
1. Мутантная O-фосфосеринсульфгидрилаза (OPSS) из Mycobacterium smegmatis, имеющая ту же самую аминокислотную последовательность, что и последовательность SEQ ID NO: 1, за исключением делеции от последних трех до семи C-концевых аминокислотных остатков последовательности SEQ ID NO: 1.
2. Мутантная OPSS из Mycobacterium smegmatis по п.1, у которой отсутствуют пять C-концевых аминокислотных остатков.
3. Мутантная OPSS из Mycobacterium smegmatis по п.2, обладающая аминокислотной последовательностью SEQ ID NO: 2.
4. Мутантная O-фосфосеринсульфгидрилаза (OPSS) из Mycobacterium smegmatis, представленная полипептидом SEQ ID NO: 1, имеющим полную последовательность SEQ ID NO: 1, за исключением (a) делеции от последних трех до семи C-концевых аминокислотных остатков,и (b) замены остатка пролина в положении 77 последовательности SEQ ID NO: 1 остатком серина.
5. Мутантная OPSS из Mycobacterium smegmatis по п.4, обладающая аминокислотной последовательностью SEQ ID NO: 3.
6. Мутантная O-фосфосеринсульфгидрилаза (OPSS) из Mycobacterium smegmatis, представленная полипептидом SEQ ID NO: 1, имеющим полную последовательность SEQ ID NO: 1, за исключением (a) делеции от последних трех до семи C-концевых аминокислотных остатков и (b) замены остатка треонина в положении 131, остатка лизина в положении 137 и остатка треонина в положении 238 последовательности SEQ ID NO: 1 остатком аланина, остатком аспаргина и остатком серина соответственно.
7. Мутантная OPSS из Mycobacterium smegmatis по п.6, обладающая аминокислотной последовательностью SEQ ID NO: 4.
8. Мутантная OPSS из Mycobacterium smegmatis по п.1, проявляющая оптимальную активность в условиях, включающих:
i) добавление от приблизительно 0,001 до приблизительно 2 мМ PLP (пиридоксаль-5′-фосфата) или от приблизительно 0,001 до приблизительно 100 мМ DTT (дитиотреитола) в качестве кофактора;
ii) температуру реакции в диапазоне 25~60°C; и
iii) диапазон pH 6,0~10,0.
9. Молекула нуклеиновой кислоты, кодирующая мутантную OPSS по любому из пп.1-8.
10. Экспрессионный вектор, несущий молекулу нуклеиновой кислоты, кодирующую мутантную OPSS по любому из пп.1-8.
11. Прокариотический трансформант для экспрессии мутантной O-фосфосеринсульфгидрилазы (OPSS), трансформированный экспрессионным вектором по п.10.
12. Способ получения цистеина, включающий взаимодействие O-фосфо-L-серина (OPS) с сульфидами в присутствии мутантной OPSS по одному из пп.1-8.
13. Способ получения цистеина по п.12, где OPS находится в очищенной форме или в форме ферментируемой культуры, содержащей OPS.
14. Способ получения цистеина по п.12, включающий сульфид, выбранный из группы, состоящей из Na2S, NaSH, (NH4)2SH, H2S и S2O3, причем все они находятся в газообразном или жидком состоянии.
15. Способ получения цистеина по п.12, где сульфид используют в количестве, в 0,1-3 раза превышающем молярную концентрацию OPS.
16. Применение мутантной OPSS по любому из пп.1-8 для биосинтеза цистеина из OPS.
| AGREN D et.al | |||
| Cysteine synthase (CysM) of Mycobacterium tuberculosis is an O-phosphoserine sulfhydrylase: evidence for an atlernative cysteine diosynthesis pathway in mycobacteria, J Biol Chem | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| AGREN D | |||
| et.al | |||
| The C-terminal of CysM from Mycobacterium tuberculosis | |||
Авторы
Даты
2015-02-20—Публикация
2011-10-14—Подача