Изобретение относится к области тканевой инженерии, а именно к биоинженерным конструктам, включающим девитализированный и/или децеллюляризированный внеклеточный матрикс, продуцированный и собранный клетками организма.
Объект настоящего изобретения имеет отношение к дисциплинам тканевой инженерии, регенерации ткани и регенеративной медицины, объединяющей методы биоинженерии с принципами наук о жизни для понимания структурных и функциональных связей в нормальных и патологических тканях млекопитающих. Общая цель этих дисциплин - развитие и конечное применение биологических заместителей для восстановления, поддержания или улучшения функций ткани. Таким образом, возможно спроектировать и изготовить биоинженерную ткань в лаборатории. Биоинженерные ткани могут включать клетки, которые обычно связываются с природными тканями млекопитающих или человека и синтетическими или естественными матричными подложками. Новая биоинженерная ткань должна быть функциональной после трансплантации в организм и быть надолго инкорпорирована в организм или постепенно ремоделирована (сделана заново) клетками биоинженерной ткани или организма реципиента. Выбор скаффолда является одним из ключевых элементов, от которого во многом зависит конечный успех в реконструкции тканей. Скаффолды обеспечивают не только прикрепление клеток и их рост, но и способствуют формированию необходимой ткани. Выращивание клеток на носителе/скаффолде, который поддерживает формирование и созревание ткани in vitro, является одним из наиболее бурно развивающихся подходов тканевой инженерии. Впоследствии биоинженерный продукт имплантируется пациенту, где происходит его ремоделирование и встраивание в гистоархитектонику ткани или органа (Boccaccini, Blaker, 2005; Chai, Leong, 2007). He вызывает сомнений, что лучшим скаффолдом для искусственной ткани является внеклеточный матрикс (ВКМ) ткани-мишени в его естественном состоянии. Недавно было рекомендовано использование биологических каркасов, состоящих из ВКМ, полученного путем децеллюляризации клеточной ткани. Децеллюляризация определяется как эффективное удаление всего клеточного и ядерного содержимого без отрицательного влияния на состав ВКМ (Badylak et al. 2009). Сохранение этой наноструктурированной среды и сетчатой структуры из волокнистых и адгезивных белков обеспечивает закрепление клеток и регулирует будущую клеточную активность (Galler et al. 2011). Бесклеточная матрица считается идеальным каркасом для регенерации ткани (Badylak 2002), а создание бесклеточного каркаса, способного привлекать и поддерживать локальные резидентные клетки, является возможным направлением для инженерии клеточно-дентинной ткани (Galler et al. 2011). Существуют различные подходы к децеллюляризации ВКМ и, в частности, зуба (Gilpin A., Yang Y. 2017; Porzionato A. et al. 2018). Продемонстрировано успешное использование децеллюляризированного зуба, а точнее дентальной пульпы для регенеративной эндодонтии (Song J.S. et al. 2017). Третьи моляры были децеллюляризированы тремя различными методами и лучший, по мнению авторов, вариант был рецеллюляризирован стволовыми клетками апикального сосочка с их последующей дифференцировкой в одонтобасто-подобные клетки. В работе Hu с соавторами (Hu L. et al., 2017) использовали децеллюляризированный 10% SDS в комбинации с Triton Х-100 матрикс дентальной пульпы свиньи, который был заселен стволовыми клетками пульпы с последующим образованием пульпо-подобной ткани. Указанный способ децеллюляризации является аналогом и прототипом изобретения. Однако децеллюляризированный ВКМ в изобретении используется не для восстановления тканей пульпы зуба, как в большинстве проводимых работ, а для восстановления резорбированной костной ткани.
Проблема регенерации костной ткани является одной из актуальных областей современной регенеративной медицины. Отдельной проблемой стоит заживление костной ткани в геронтологии. Здесь присоединяется временной фактор, выражающийся в увеличении времени заживления кости, который тесным образом связан с возрастными нарушениями активности остеобластов, их метаболической и регенеративной несостоятельности. Другой обширной областью, в которой могут быть указанные нарушения, является стоматология. Некоторые стоматологические заболевания приводят к инвалидизации пациентов, и основная причина этого - утрата альвеолярной костной ткани. К таким заболеваниям относят: рецессию десны, выраженную атрофию беззубых челюстей, посттравматические деформации лица и т.д. В связи с этим актуальной задачей остается поиск эффективных способов борьбы с потерей альвеолярной кости. Восстановить утраченный объем костной ткани позволяет остеопластика, «золотым стандартом» которой является аутотрансплантация (т.н. костная аугментация) из крыла подвздошной кости. В качестве других источников используется аутологичный костный материал бедра, затылка, челюсти человека. Операционная процедура достаточно тяжело переносится пациентами, опасна осложнениями, не всегда возможна, костная ткань в месте оперативного вмешательства формируется обычно через 4-8 месяцев (Jakob et al., 2012). Проблемы использования трупной кости или синтетических материалов часто связаны с отсутствием остеоиндуктивного и остеогенного потенциала используемых материалов (Logeart-Avramoglou et al., 2005).
Одним из наиболее перспективных подходов к решению этой проблемы является направленная регенерация тканей, основанная на способности стволовых и прогениторных клеток к восстановлению поврежденных в результате болезни или травмы тканей человека. Для усиления регенерации кости требуется три ключевых фактора: эффективные прогениторные клетки, эффективные микроносители или поддерживающий их матрикс, сигнальные молекулы (цитокины и ростовые факторы) (Marolt et al., 2010).
Традиционно для создания биоинженерных конструкций в качестве клеточного материала применяют мезенхимальные стволовые клетки (МСК) - плюрипотентные стволовые клетки, обладающие хондрогенной, остеогенной и адипогенной дифференцировкой. В качестве источника таких прогениторных клеток, дифференцирующихся в остеобласты, цементобласты и фибробласты, наиболее часто рассматривают пульпу зуба, периодентальную связку и расщепленные молочные зубы (Nishimura et al., 2012; Liu et al., 2015). Однако трудности стимуляции МСК и контроль их дифференцировки in vivo затрудняют их широкое использование в клинической практике. Частично данную проблему решает известный способ культивирования плюрипотентных стволовых клеток надкостницы (Ringe et al. 2008; Иванов с соавт., 2016). Однако описанный известный способ, являющийся прототипом данного изобретения, не позволяет применять его и проводить культивирование на всех известных приемлемых микроносителях, что ограничивает его применение.
Для решения данной проблемы заявителями разработан способ использования децеллюляризированных тканей зуба человека как аллографта (аллотрасплантата) для восстановления резорбированной костной ткани.
Термины и определения
• Под термином «биоинженерная конструкция» понимается микроноситель с остеогенными клетками человека.
• Под термином «микроноситель» понимается особая клеточная матрица из децеллюляризированного зуба, имеющая архитектонику, обеспечивающую надежную адгезию клеток, высокую остеоиндуктивность и дифференцировку прогениторных клеток, применяемая для их последующего культивирования.
• Под термином «мезенхимальные стволовые клетки» (МСК) понимаются плюрипотентные стволовые клетки, обладающие хондрогенной, остеогенной и адипогенной дифференцировкой.
• Под термином «заболевания, связанные с необходимостью восстановления целостности или объема костной ткани», в настоящем изобретении подразумеваются любые стоматологические дефекты, в том числе вокруг имплантата, постэкстракционные лунки, фуркационные дефекты, пародонтит, сопровождающийся активной деструкцией всех тканей пародонта и приводящему к утрате имеющихся зубов; дефекты зубных рядов со значительной утратой альвеолярных отростков, реабилитация которых затруднена использованием классических лечебных мероприятий.
Техническим результатом данного изобретения является улучшение приживаемости клеток, повышение их остеогенного потенциала, что гарантирует дальнейшую сохранную транспортировку с целью восполнения нарушений целостности костной ткани, а также способствуют удешевлению биоинженерной конструкции и ускорению сроков заживления.
Ниже приводится обоснование для осуществления настоящего изобретения.
Биоинженерный конструкт ткани произведен и самособран клетками организма человека с учетом особенностей окружающих тканей без необходимости в дополнении экзогенными внеклеточными матричными компонентами. Конструкты ткани, полученные таким образом, могут использоваться для трансплантации субъекту или для тестирования in vitro. Изобретение представляет собой клеточно-матричный конструкт, включающий эндогенно продуцированный внеклеточный матрикс резидентные клетки, заселяющие этот матрикс. Резидентные клетки сами способны к синтезу и секреции внеклеточного матрикса, улучшая структуру клеточно-матричного конструкта.
В изобретении используются клетки и внеклеточный матрикс, полученные от человека, без химически неопределенных или отличных от человеческих биологических компонентов или клеток. Биологические конструкты, таким образом, не содержат экзогенные матричные компоненты, то есть матричные компоненты, произведенные не культивированными клетками, а введенные другими способами. Используя стандартные методы иммуногистохимии, клеточно-матричный конструкт положительно окрашивается на щелочную фосфатазу, остеокальцин, а также ализариновым красным S на соли Са2+.
Наличие указанных компонентов в полностью сформированном культивированном клеточно-матричном конструкте кости указывает, что конструкт обладает структурными и биохимическими особенностями, приближающимися к таковым особенностям нормальной кости.
В предпочтительном способе изобретения для формирования клеточно-матричного конструкта поверхность клеточно-матричного конструкта засевается клетками и культивируется для формирования объемного конструкта ткани. В данном способе конструкт, имеющий характеристики, подобные натуральной губчатой кости человека, заселен культивированными остеобластами в условиях, достаточных для индуцирования синтеза матрикса для формирования клеточно-матричной конструкции из остеобластов и матрикса. Таким образом, способ получения биоинженерной конструкции существующего изобретения включает: (а) децеллюляризацию конструкта ткани, содержащего компоненты матрикса, для клинического использования; (b) культивирование одного типа клеток (остеобластов), производящих внеклеточный матрикс в отсутствие экзогенных внеклеточных матричных компонентов или структурного элемента поддержки; (с) стимулирование клеток стадии (b) для синтеза, секреции и организации компонентов внеклеточного матрикса для формирования конструкта ткани, включающего клетки и матрикс, синтезированный этими клетками, в котором стадии (а) и (b) могут осуществляться одновременно или последовательно. Осуществление изобретения проиллюстрировано, но не ограничено, следующими примерами.
Пример 1. Забор и децеллюляризация тканей зуба человека.
У удаляемых по медицинским показаниям здоровых зубов оставляют корневую часть для проведения децеллюляризации. Децеллюляризация клеточного матрикса по изобретению означает удаление клеток из клеточного матрикса таким образом, что клетки и остатки клеток удаляются из клеточного матрикса, с целью получения внеклеточного матрикса без клеток, которые его произвели. Другими словами, продуцирующие матрикс клетки, которые производят эндогенные внеклеточные компоненты матрикса для формирования клеточно-матричных конструктов удаляются из клеточного матрикса. После удаления клеток клеточный матрикс, эндогенно продуцированный культивированными клетками, остается, но не содержит тех клеток, которые его сформировали. В данном способе для децеллюляризации клеточно-матричных конструктов изобретения используется ряд химических воздействий для удаления клеток, остатков клеток и остаточных клеточных ДНК и РНК. Клеточно-матричный конструкт сначала обрабатывается контактированием с эффективным количеством хелатирующего агента, предпочтительно физиологически щелочного для контролируемо ограниченного набухания клеточного матрикса. Хелатирующие агенты усиливают удаление клеток, клеточного детрита и структур базальной мембраны из матрикса, уменьшая концентрацию двухвалентных катионов. Хелатирующий агент, этилендиаминтетрауксусной кислотой (ЭДТА) и его натриевая соль ЭДТА-Na2 представляют собой предпочтительные хелатирующие агенты и могут быть сделаны более щелочными посредством добавления гидроксида натрия (NaOH). Концентрации ЭДТА или ЭДТА-Na2 предпочтительно находятся в диапазоне от приблизительно 50 до приблизительно 150 мМ. Предпочтительная концентрация NaOH находится в диапазоне от 0,001 до 0,10 М, наиболее предпочтительно приблизительно 0,01 М. Конечный рН основного хелатирующего раствора должен быть предпочтительно от приблизительно 11,1 до 11,8. В наиболее предпочтительном варианте клеточный матрикс контактирует с раствором 100 мМ ЭДТА-Na2 /10 мМ NaOH в дистиллированной воде. Клеточный матрикс контактирует с щелочным хелатирующим агентом путем погружения в него, однако более эффективная обработка получается нежным взбалтыванием конструкта и раствора вместе в течение эффективного для обработки времени (в течение суток). Для дополнительного разрушения мембран и солюбилизации мембранных белков и экстракции ДНК используется 1% водный раствор Triton Х-100 в течение суток. Конечный рН раствора, содержащего поверхностно-активное вещество, должен быть предпочтительно от приблизительно 7,1 до 8,0.
Кроме того, клеточный матрикс контактирует с эффективным количеством кислого раствора, предпочтительно содержащего соли для удаления нуклеиновых кислот, таких как ДНК и РНК. Соли, которые могут использоваться, являются предпочтительно неорганическими хлористыми солями, такими как хлорид натрия (NaCl) или хлорид магния (MgCl2). Предпочтительно хлориды используются в концентрации от приблизительно 1 до приблизительно 5 мМ, наиболее предпочтительно от 3,75 до приблизительно 4,5 мМ. В способе изобретения использован 4.2 мМ хлорид магния (MgCl2), содержащий раствор ДНКазы (20 μg/ml). Клеточный матрикс контактирует предпочтительно погружением в кислотный/солевой раствор, при этом эффективная обработка достигается при осторожном взбалтывании конструкта вместе с раствором в течение времени, эффективного для обработки (2-3 часа).
Кроме того, клеточный матрикс промывают эффективным количеством раствора фосфатно-солевого буфера (ФСБ), который предпочтительно буферизован до приблизительно физиологического рН. Буферный раствор соли нейтрализует материал, в то же время уменьшая его набухание. Клеточный матрикс погружают в буферный раствор, при этом эффективная обработка достигается при осторожном взбалтывании конструкта вместе с раствором в течение времени, эффективного для обработки (в течение 1 часа).
После химической очистки клеточный матрикс ополаскивается ФСБ, содержащим антибиотики (300 МЕ/мл пенициллина + 300 МЕ/мл стрептомицина + 75 мкг/мл амфотерицина В) в течение 1 часа и хранится в свежей порции ФСБ с антибиотиками при -70°С.
Результат децеллюляризации клеточно-матричного конструкта представляет собой эндогенно продуцированный внеклеточный матрикс, продуцированный клетками зуба, который был децеллюляризирован от клеток, которые его произвели.
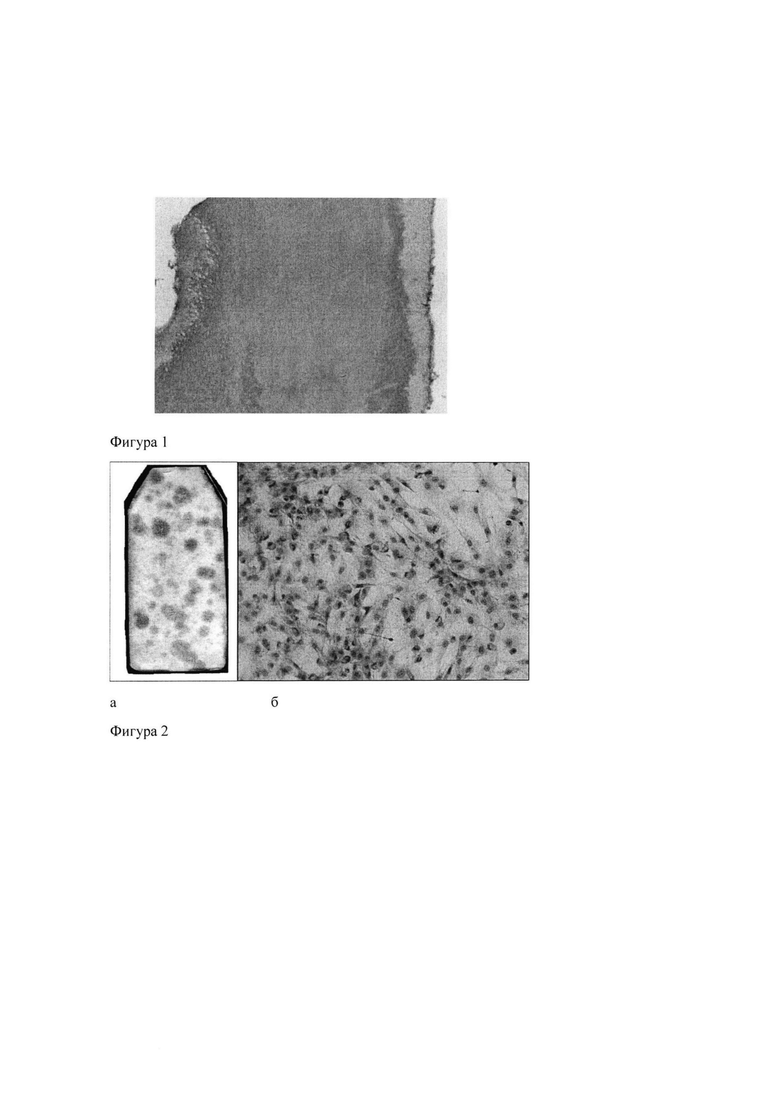
Для контроля децеллюляризации образцы фиксировали в 10% нейтральном формалине, декальцинировали 5%-ной трихлоруксусной кислотой в течение 8 ч, заливали в гистомикс, приготавливали на микротоме серийные срезы и окрашивали их гематоксилин-эозином. Как показал анализ гистологических препаратов с помощью светового микроскопа, полученные скаффолды состояли из дентина, в котором местами были различимы дентинные канальцы, и покрывающего его снаружи слоя цемента с лакунами на месте удаленных клеток. Отсутствие клеток или их остатков в скаффолдах свидетельствовало об эффективности децеллюляризации (фиг. 1).
Децеллюляризированные клеточно-матричные конструкты могут использоваться в таком виде, но они также могут быть дополнительно модифицированы химической обработкой, физической обработкой, добавлением других веществ, таких как лекарства, факторы роста, культивируемые клетки, других компонентов матрикса естественного, биосинтетического или полимерного происхождения.
Пример 2. Оценка эффективности иммобилизации клеток на децеллюляризированном матриксе.
Формирование внеклеточного матрикса мезенхимальными стволовыми клетками (МСК).
МСК для последующего заселения скаффолдов были выделены из костного мозга половозрелых (3-4-месячных) крыс Wistar. Костный мозг извлекали из бедренных и большеберцовых костей, удаляя эпифизы и промывая диафизы средой α-МЕМ, суспендировали с помощью шприца и пропускали через нейлоновый фильтр с диаметром пор 40 мкм. Клетки подсчитывали в камере Горяева и помещали с плотностью 1×106 клеток/мл в культуральные флаконы площадью 25 см2 для клонального анализа либо с плотностью 2-5×106 клеток/мл во флаконы площадью 75 см2 для последующего пассирования. Культуры инкубировали при 37°С и 5% СО2 в среде α-МЕМ с добавлением 10% фетальной телячьей сыворотки, L-глутамина, антибиотика-антимикотика и пенициллина-стрептомицина. Среду сменяли через 7 суток. По достижении 90-95% конфлуентного монослоя клетки снимали 0,25%-ным раствором трипсина в 1 мМ ЭДТА и пересевали в новые флаконы с плотностью 1×105 клеток/мл. Для оценки иммунофенотипа и потенций к дифференцировке использовали клетки первого-третьего пассажей.
2) Оценка клоногенной способности
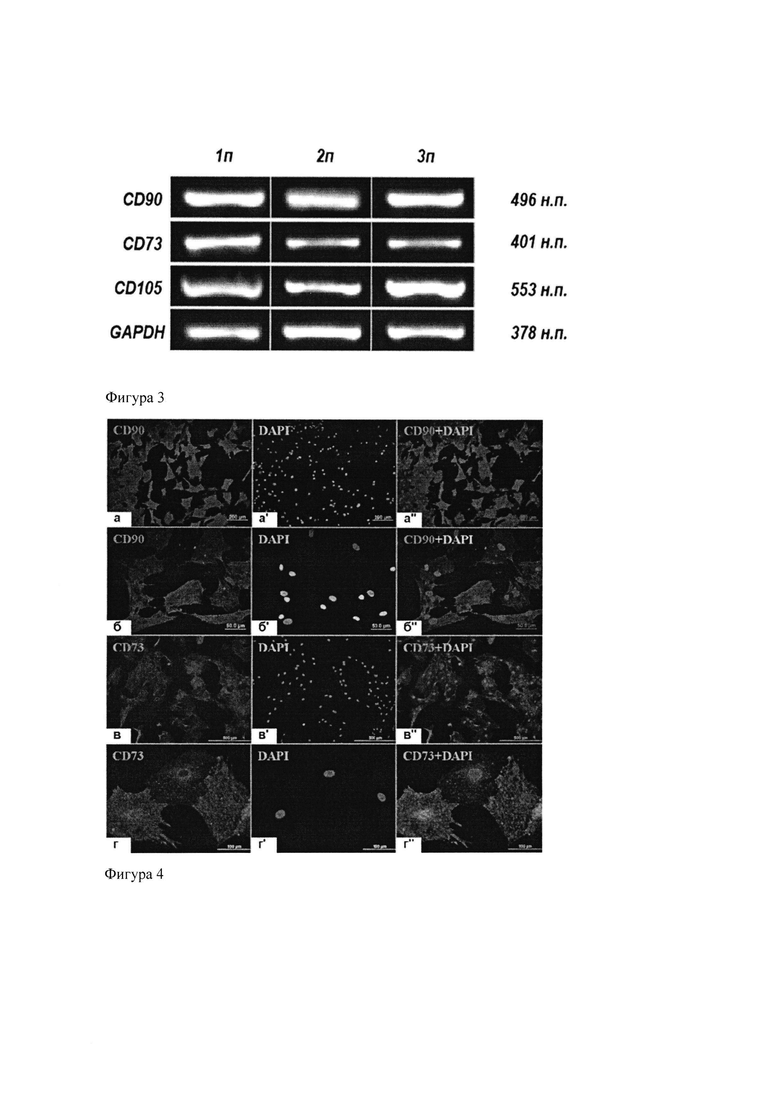
Для оценки способности стромальных клеток к клональному росту, являющейся одной из основных характеристик МСК, использовали первичные культуры клеток костного мозга, посеянных с плотностью 1×106 клеток/мл. Через 11-12 сут после посева флаконы с культурами фиксировали 96°-ным спиртом и окрашивали азур-эозином. К этому сроку в культурах присутствовали дискретные макроскопически различимые колонии различной величины, состоящие из фибробластоподобных клеток (фиг. 2). С помощью бинокулярной лупы подсчитывали колонии, содержащие не менее 50 клеток, и определяли эффективность клонирования как число колониеобразующих единиц фибробластов (КОЕ-Ф) на 1×106 посаженных клеток. При трех независимых повторах эксперимента эффективность клонирования клеток костного мозга составила 16,77±1,13, 13,11±0,89 и 16,00±1,19 КОЕ-Ф на 1 млн клеток.
3) Иммунофенотипическая характеристика клеток
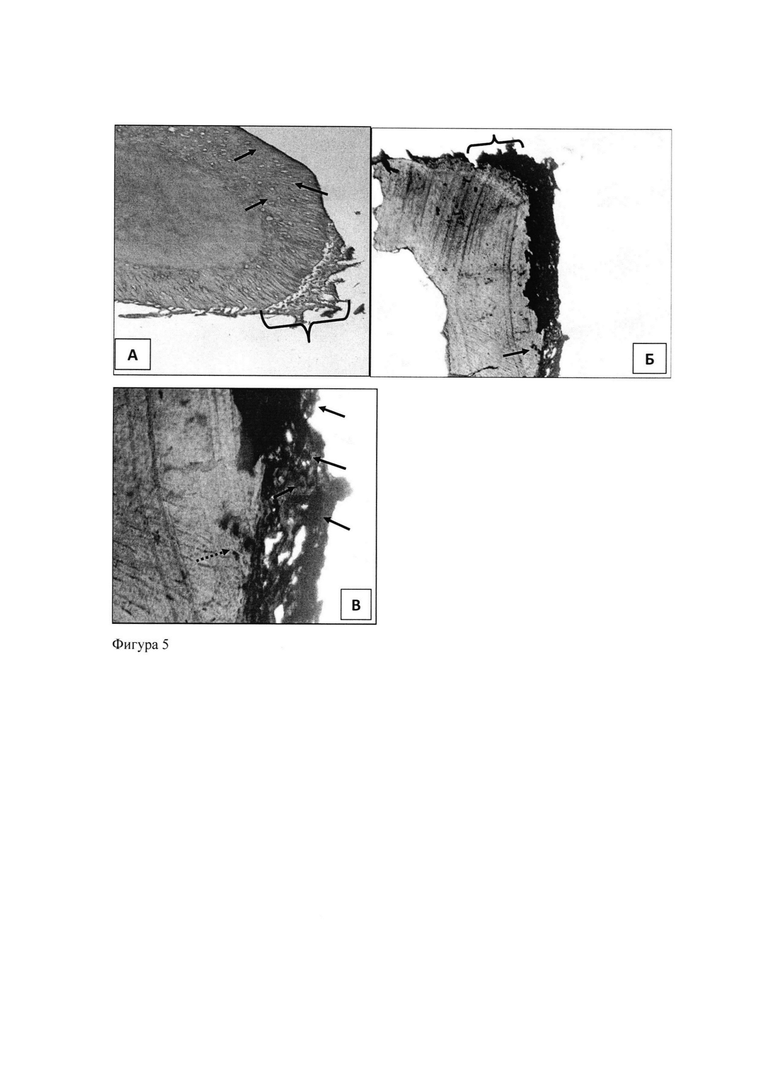
Для подтверждения принадлежности выделенных клеток к категории МСК был выполнен ПЦР-анализ на экспрессию генов CD73, CD90 и CD105 - поверхностных маркеров, рекомендуемых Международным обществом клеточной терапии для идентификации МСК (Dominici et al., 2006).
Тотальную РНК выделяли с помощью реактива TRI Reagent, синтезировали кДНК с помощью обратной транскриптазы M-MLV и олиго(дТ)15 праймера и проводили ПЦР на матрице кДНК с использованием ColoredTaq полимеразы. Предварительно кДНК нормировали по GAPDH. Продукты ПЦР разделяли электрофорезом в 1%-ном агарозном геле с бромистым этидием, интенсивность их свечения оценивали на УФ-трансиллюминаторе). Нуклеотидные последовательности использованных праймеров и условия реакции приведены в таблице 1.
В культурах клеток первого-третьего пассажей были детектированы транскрипты всех трех исследуемых генов (фиг. 3). Уровень их экспрессии при пассировании существенно не изменялся, что говорит о сохранении клетками свойств МСК в ходе культивирования.
Результаты молекулярно-генетического анализа были подтверждены непрямым иммунофлуоресцентным окрашиванием культуры моноклональными антителами к антигенам CD73 и CD90 с использованием вторых антител, меченных флуорохромом Alexa Fluor 488 или Alexa Fluor 568. Ядра клеток окрашивали Hoechst 33342 или DAPI (фиг. 4). Иммуноцитохимический анализ на CD 105 проведен не был в связи с отсутствием коммерчески доступных антител к этому антигену крысы. Практически все клетки в культуре костного мозга положительно окрашивались на CD90, на поверхности большинства из них был также выявлен CD73.
Гистологический анализ скаффолдов, культивируемых с МСК в течение 62 суток в стандартной ростовой среде без индукторов (αМЕМ с 10% фетальной телячьей сыворотки), показал присутствие на их поверхности слоя клеток округлой или фибробластоподобной формы, расположенных в один или несколько рядов и окруженных внеклеточным матриксом. Толщина клеточного слоя, плотность расположения клеток и количество матрикса были неодинаковы на разных участках скаффолда. Отмечалось также проникновение отдельных клеток в материал скаффолда, главным образом в местах их активного разрастания на его поверхности (фиг. 5 А). При этом клеточный слой, покрывающий скаффолд, демонстрировал интенсивную положительную реакцию на остеокальцин, локализованную преимущественно в связи с клетками, в меньшей степени - в межклеточном веществе (фиг. 5Б, В). Присутствие этого белка, являющегося специфическим маркером остеобластов и участвующего в минерализации внеклеточного матрикса, свидетельствует о спонтанной реализации остеогенных потенций МСК при длительном культивировании в контакте со скаффолдом. Было также отмечено слабое диффузное окрашивание на остеокальцин материала скаффолда, очевидно, отражающее присутствие этого белка в дентине зубов, послуживших материалом для его изготовления.
Таким образом, результаты гистохимического исследования (реакция на остеокальцин) свидетельствуют, что МСК, культивируемые на скаффолде в течение 2 месяцев, способны к спонтанной дифференцировке в остеогенном направлении на биоинженерной конструкции, представленной децеллюляризированими тканями зуба. Следовательно, децеллюляризированные ткани зуба человека можно использовать в виде естественного аллографта для лечения резорбции альвеолярной костной ткани.
СПИСОК ЛИТЕРАТУРЫ
Boccaccini A.R, Blaker J.J. Bioactive composite materials for tissue engineering scaffolds. Expert Rev. Med. Devices. 2005; 2(3):303-17. doi:10.1586/17434440.2.3.303
Chai C., Leong K.W. Biomaterials approach to expand and direct differentiation of stem cells. Mol. Ther. 2007; 15 (3):467-480. doi:10.1038/sj.mt.6300084
Badylak S.F., Freytes D.O., Gilbert T.W. Extracellular matrix as a biological scaffold material: Structure and function. Acta Biomater. 2009; 5(1): 1-13. doi: 10.1016/j.actbio.2008.09.013
Galler K.M., D'Souza R.N., Federlin M., Cavender A.C., Hartgerink J.D., Hecker S., Schmalz G. Dentin conditioning codetermines cell fate in regenerative endodontics. J Endod. 2011; 37(11): 1536-41. doi: 10.1016/j.joen.2011.08.027
Badylak S.F. The extracellular matrix as a scaffold for tissue reconstruction. Semin. Cell. Dev. Biol. 2002; 13(5):377-83.
Gilpin A., Yang Y. Decellularization Strategies for Regenerative Medicine: From Processing Techniques to Applications. Biomed. Res. Int. 2017; 2017:9831534. doi: 10.1155/2017/9831534 Porzionato A., Stocco E., Barbon S., Grandi F., Macchi V., De Caro R. Tissue-Engineered Grafts from Human Decellularized Extracellular Matrices: A Systematic Review and Future Perspectives. Int. J. Mol. Sci. 2018; 19(12): 4117; doi.org/10.3390/ijms19124117
Song J.S., Takimoto K., Jeon M., Vadakekalam J., Ruparel N.B., Diogenes A. Decellularized Human Dental Pulp as a Scaffold for Regenerative Endodontics. J. Dent. Res. 2017; 96(6):640-646. doi: 10.1177/0022034517693606
Hu L., Gao Z., Xu J., Zhu Z., Fan Z., Zhang C., Wang J., Wang S. Decellularized Swine Dental Pulp as a Bioscaffold for Pulp Regeneration. BioMed Research International 2017; 1-9. doi.org/10.1155/2017/9342714
Jakob M., Saxer F., Scotti C., Schreiner S., Studer P., Scherberich A., Heberer M., Martin I. Perspective on the Evolution of Cell-Based Bone Tissue Engineering Strategies. Eur. Surg. Res. 2012; 49(1): 1-7. doi: 10.1159/000338362
Logeart-Avramoglou D., Anagnostou F., Bizios R., Petite H. Engineering bone: challenges and obstacles. J. Cell. Mol. Med. 2005; 9(1): 72-84. doi: 10.1111/j.1582-4934.2005.tb00338.x
Marolt D., Knezevic M., Vunjak-Novakovic G. Bone tissue engineering with human stem cells. Stem Cell Res. & Therapy 2010; 1(2): 1-10. doi: 10.1186/scrt10
Nishimura M., Takase K., Suehiro F., Murata H. Candidates cell sources to regenerate alveolar bone from oral tissue. Int. J. Dentistry 2012; 2012:857192. doi: 10.1155/2012/857192
Liu J., Yu F., Sun Y., Jiang В., Zhang W., Yang J., Xu G.-T., Liang A., Liu S. Characteristics and Potential Applications of Human Dental Tissue-Derived Mesenchymal Stem Cells. Stem Cells. 2015; 33(3): 627-638. doi: 10.1002/stem.l909
Ringe J, Leinhase L, Stich S, Loch A, Neumann K, Haisch A, et al: Human mastoid periosteum-derived stem cells: Promising candidates for skeletal tissue engineering. J. Tissue Eng. Regen. Med. 2008; 2(2-3): 136-46. doi: 10.1002/term.75
Иванов A.A., Данилова Т.И., Попова О.П., Ерохин А.И., Семенихина Е.С.1, Волова Л.Т. (2016). Надкостница как источник прогениторных остеогенных клеток для восстановления резорбированной альвеолярной кости // Российская стоматология 9,4, 39-42.
Краткое описание чертежей
Фиг. 1. Срез скаффолда после децеллюляризации (увел.: об. ×10, ок. ×10). Окраска гематоксилин-эозином.
Фиг. 2. Колонии стромальных клеток в первичной культуре костного мозга (11 сут после посева), а - общий вид культуры, б - фрагмент колонии (увел.: об. 10, ок. ×10). Окрашивание азур-эозином.
Фиг. 3. ПЦР-анализ экспрессии генов маркеров МСК клетками костного мозга на первых трех пассажах.
Фиг. 4. Поверхностные антигены CD90 (а, б) и CD73 (в, г) в культуре клеток костного мозга 3-го пассажа. Непрямое иммунофлуоресцентное мечение с применением флуорохромов Alexa 568 (а, б) и Alexa 488 (в, г), а'', б'', в'', г'' - совмещение изображений результата иммуномечения и ядер клеток, окрашенных DAPI (а', б', в', г').
Фиг. 5. Спонтанная остеогенная дифференцировка МСК после 62 суток культивирования на скаффолде.
А - окрашивание гематоксилином и эозином. Поверхность скаффолда покрыта слоем фибробластоподобных клеток (показан фигурной скобкой). Кроме того, клетки проникают вглубь скаффолда (показаны стрелками). Увел.: об. ×10, ок. ×10.
Б - иммунопероксидазная реакция на остеокальцин. Видна слабая реакция в материале скаффолда и интенсивная - в клеточном слое на его поверхности (показан фигурной скобкой), а также в отдельных клетках внутри скаффолда (показаны стрелкой). Увел.: об. ×10, ок. ×10.
В - иммунопероксидазная реакция на остеокальцин, детали строения наружного слоя скаффолда. Клетки в слое, покрывающем скаффолд, окрашены более интенсивно, чем окружающий их внеклеточный матрикс. Видна также интенсивная реакция в клетках внутри скаффолда (показаны пунктирной стрелкой). Увел.: об. ×20, ок. ×10.
Табл. 1. Праймеры, использованные для ПЦР-анализа

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ индукции спонтанной дифференцировки клеток периодонтальной связки и надкостницы в одонтогенном и остеогенном направлениях путем использования децеллюляризированного матрикса зуба и периодонтальной связки человека | 2022 |
|
RU2813729C1 |
| Способ создания тканеинженерных конструкций методом биопечати биочернилами для регенерации хрящевой ткани в условиях организма | 2021 |
|
RU2770558C2 |
| Способ восстановления функциональных свойств тканеинженерной конструкции диафрагмы | 2017 |
|
RU2654686C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ БЕСКЛЕТОЧНОГО МАТРИКСА ИЗ ПУПОВИНЫ ЧЕЛОВЕКА ДЛЯ СОЗДАНИЯ ВЫСОКОРЕГЕНЕРАТИВНОГО РАНЕВОГО ПОКРЫТИЯ | 2022 |
|
RU2795904C1 |
| БИОМАТЕРИАЛ НА ОСНОВЕ БЕСКЛЕТОЧНОГО МАТРИКСА, ПРОИЗВОДИМОГО МЕЗЕНХИМНЫМИ СТРОМАЛЬНЫМИ КЛЕТКАМИ ЧЕЛОВЕКА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ПРИМЕНЕНИЯ ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ | 2018 |
|
RU2718907C1 |
| Трансплантат - тканеинженерная надхрящница для восстановления хряща субъекта | 2023 |
|
RU2822238C1 |
| Клеточная культура и биотрансплантат для регенерации костной ткани на ее основе | 2018 |
|
RU2721532C1 |
| Способ получения тканеинженерной надкостницы из клеточных сфероидов для восстановления костных дефектов субъекта | 2022 |
|
RU2819284C2 |
| Способ прогнозирования возможного рецидива аденокарциномы поджелудочной железы после ее резекции или воздействия методами локальной деструкции на примере радиочастотной абляции | 2022 |
|
RU2790982C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИНЕРАЛИЗОВАННЫХ КОМПОЗИТНЫХ МИКРОСКАФФОЛДОВ ДЛЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ | 2016 |
|
RU2660558C2 |
Изобретение относится к области тканевой инженерии. Представлен способ восстановления резорбированной альвеолярной костной ткани биоинженерной конструкцией, полученной из децеллюляризированных тканей зуба человека путем заселения бесклеточного эндогенно продуцированного внеклеточного матрикса резидентными клетками, заключающийся в том, что корень удаляемого зуба децеллюляризируют путем последовательной обработки раствором 100 мМ ЭДТА-Na2 /10 мМ NaOH в дистиллированной воде в течение суток, 1% водного раствора Triton Х-100 в течение суток, 4.2 мМ раствора хлорида магния, содержащего 20 μg/ml ДНКазы в течение 2-3 часов, промывают эффективным количеством раствора фосфатно-солевого буфера, содержащим смесь антибиотиков - 300 МЕ/мл пенициллина, 300 МЕ/мл стрептомицина и 75 мкг/мл амфотерицина В в течение 1 часа и заселяют резидентными клетками, способными к спонтанному синтезу и секреции внеклеточного матрикса, что улучшает структуру клеточно-матричного конструкта, формируя таким образом готовую матрицу для замещения утраченного объема костной ткани. Изобретение обеспечивает улучшение приживаемости клеток, повышение их остеогенного потенциала. 5 ил., 1 табл., 2 пр.
Способ восстановления резорбированной альвеолярной костной ткани биоинженерной конструкцией, полученной из децеллюляризированных тканей зуба человека путем заселения бесклеточного эндогенно продуцированного внеклеточного матрикса резидентными клетками, заключающийся в том, что корень удаляемого зуба децеллюляризируют путем последовательной обработки раствором 100 мМ ЭДТА-Na2 /10 мМ NaOH в дистиллированной воде в течение суток, 1% водного раствора Triton Х-100 в течение суток, 4.2 мМ раствора хлорида магния, содержащего 20 μg/ml ДНКазы в течение 2-3 часов, промывают эффективным количеством раствора фосфатно-солевого буфера, содержащим смесь антибиотиков - 300 МЕ/мл пенициллина, 300 МЕ/мл стрептомицина и 75 мкг/мл амфотерицина В в течение 1 часа и заселяют резидентными клетками, способными к спонтанному синтезу и секреции внеклеточного матрикса, что улучшает структуру клеточно-матричного конструкта, формируя таким образом готовую матрицу для замещения утраченного объема костной ткани.
| Иванов A.A | |||
| и др | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Машина для изготовления проволочных гвоздей | 1922 |
|
SU39A1 |
| Ringe J et al | |||
| Human mastoid periosteum-derived stem cells: Promising candidates for skeletal tissue engineering/ J | |||
| Tissue Eng | |||
| Regen | |||
| Med | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| RU | |||
Авторы
Даты
2020-03-13—Публикация
2019-06-27—Подача