Настоящее изобретение относится к экспериментальной биологии, в частности к экспериментальной фармакологии и кардиологии, касается доклинических исследований кардиотропных антиаритмических средств и иных кардиотропных средств, определения безопасности, т.е. отсутствия аритмогенной активности лекарственных средств.
В настоящее время для лечения нарушений ритма различного типа широко применяются антиаритмические фармакологические препараты. Непрерывно ведется разработка значительного числа соединений, претендующих на роль новых антиаритмиков. Действие большинства антиаритмических препаратов является мультифакторным, реализуется на молекулярном, клеточном и тканевом уровнях: оно связано с влиянием на молекулярные мембранные и внутриклеточные комплексы, на биоэлектрическую активность отдельных кардиомиоцитов, электрические свойства сердечной ткани. Антиаритмические средства оказывают влияние на все отделы сердца, включая пейсмейкеры, рабочий миокард, проводящую систему, но в неравной степени.
Антиаритмические средства, как и другие кардиотропные средства, вызывают побочные эффекты, могут обладать нежелательными свойствами, например, при определенных условиях, могут приводить к нарушениям ритма, т.е. обладать аритмогенным действием.
В связи со сложностью механизмов действия и множественностью мишеней выявление и прогнозирование антиаритмического действия, а также побочных, аритмогенных свойств антиаритмических (и кардиотропных) препаратов является чрезвычайно сложной задачей.
Существуют факторы и области действия, критические для реализации различных типов антиаритмической активности. Наиболее распространенными формами аритмии являются трепетание и мерцание (фибрилляция) предсердий. Согласно наиболее распространенной в настоящее время концепции эктопическая активность в области миокардиальных обкладок («рукавов») легочных вен, взаимодействующая с электрической активностью в предсердиях, является причиной фибрилляции предсердий (ФП). Миокардиальная ткань в легочных венах отличается от предсердной, обладает целым рядом морфологических особенностей и особенностей биоэлектрической активности. Миокардиальные рукава легочных вен как в экспериментальных условиях, так и in vivo являются местом локализации очагов триггерной активности, аномальной автоматии, циркуляции возбуждения, т.е. факторов, приводящих к аритмиям различного типа, в частности к фибрилляции предсердий.
Изменение биоэлектрической активности в миокарде легочных вен при действии фармакологических препаратов является критическим, центральным элементом механизма инициации фибрилляции предсердий, а также ее предотвращения.
Известно несколько in vivo и in vitro способов выявления, прогнозирования антиаритмической активности. Это модели хлоридкальциевых аритмий, модель хлоридбариевых аритмий, адреналиновая, аконитиновая модель аритмий. Суть этих методов заключается во введении высоких доз кальция, бария, аконитина, оубаина или строфантина наркотизированным или бодрствующим животным.
(Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ, М.: Медицина, 2005.)
Инфузия кальция хлорида для моделирования желудочковых и суправентрикулярных нарушений ритма предложена в 1950-х годах. Модель «хлоридкальциевых аритмий» основана на генерализованной активации симпатического отдела вегетативной нервной системы и последующем выбросе норадреналина из симпатических терминалей, что, в свою очередь, приводит к развитию экстрасистолии и аномальной автоматии. Аналогичную природу имеет «адреналиновая модель аритмии», отличаясь от предыдущего подхода лишь непосредственным введением адреналина.
(Role of the sympathetic-adrenal system in the mechanisms of genesis of cardiac fibrillation induced by calcium chloride. Kardiologiia. 1974 Jun; 14 (6): 78-82.)
«Хлоридбариевая модель» нарушений ритма сердца основана на способности бария нарушать функционирование митохондрий, проводимость нескольких групп ионных каналов.
(Delfino G, Amerini S, Mugelli A. Barium cardiotoxicity: Relationship between ultrastructural damage and mechanical effects. Toxicol In Vitro. 1988; 2 (1): 49-55.)
«Аконитиновая модель» и «Строфантиновая модель» основаны на системном введении специфических токсинов: аконитина, подавляющего инактивацию натриевых потенциалчувствительных каналов кардиомиоцитов, оубаина, подавляющего активность Na/K-АТФазы кардиомиоцитов, соответственно.
(Chan TY. Aconite poisoning. Clin Toxicol (Phila). 2009 Apr; 47 (4): 279-85.)
Все вышеперечисленные подходы практически не имеют ничего общего с физиологическими механизмами, приводящими к возникновению аритмий in vivo, и, вызываемые ими нарушения ритма характерны для «агональных» состояний или острой интоксикации. Использование «аконитиновой» и «строфантиновой» моделей оправдано лишь в случае разработки средств для лечения крайне редких генетически обусловленных заболеваний. При использовании вышеперечисленных подходов невозможно установить механизмы и потенциал антиаритмического действия фармакологического средства, его безопасность. В настоящее время в мировой практике вышеописанные методы практически не применяются.
Известны способы, основанные на хирургическом и/или механическом нарушении кровоснабжения миокарда, направленные на выявление антиаритмической активности. У мелких млекопитающих, таких как крысы, верификация результатов при использовании данных подходов крайне затруднена вследствие хорошо развитого коллатерального кровообращения. При использовании крупных млекопитающих эксперименты становятся чрезвычайно затратными, техническое обеспечение экспериментов чрезмерно сложно.
Известны способы выявления антиаритмической активности фармакологических средств, которые основаны на электрической стимуляции сердца и принудительном задании ритма, самостоятельно или в комбинации с парасимпатической стимуляцией.
(Bhatt L.K., Nandakumar К., Bodhankar S.L. Experimental animal models to induce cardiac arrhythmias. Ind. J. Pharm. 2005. 37. 348-357.)
Данные методы эффективны для определения способности к подавлению персистирующей аритмии, но малоинформативны в аспекте прогнозирования предотвращающей способности и безопасности антиаритмических средств.
Наиболее близким способом того же назначения к заявляемому изобретению является способ прогнозирования эффективности и безопасности антиаритмических средств, при котором проводят определение биоэлектрических параметров в изолированных многоклеточных перфузируемых препаратах in vitro, представляющих собой участки рабочего миокарда сердца - предсердий, папиллярных мышц. При этом оценивают изменение длительности потенциалов действия (ПД), рефрактерность после применения исследуемых соединений. Изменение длительности ПД в рабочем миокарде является элементом регуляции сердечной деятельности и само по себе имеет малую предикативную ценность: может говорить как об уменьшении, так и об увеличении вероятности возникновения аритмий.
(Hondeghem L.M., Carlsson L., Duker G., Instability and triangulation of the action potential predict serious proarrhythmia, but action potential duration prolongation is antiarrhythmic. Circulation, 2001; 103, 2004-2013.)
Недостатками вышеуказанного способа являются низкая надежность и релевантность с действительными патофизиологическими процессами, обуславливающими нарушения ритма. Также следует указать, что используется нормальный рабочий миокард сердца и не оценивается влияние антиаритмических средств на «естественный аритмогенный субстрат», коим является миокард легочных вен.
Задачей настоящего изобретения является создание эффективного способа доклинических исследований кардиотропных антиаритмических средств, повышающего надежность прогнозирования антиаритмического действия, безопасности потенциальных фармакологических средств данного назначения, сокращающего длительность экспериментальной фазы и способствующего ускорению перехода к клиническим исследованиям.
Технический результат изобретения заключается в повышении надежности прогнозирования антиаритмического действия потенциальных фармакологических средств и сокращение длительности экспериментальной фазы.
Это достигается тем, что в заявляемом способе доклинических исследований кардиотропных антиаритмических средств, включающем определение биоэлектрических параметров в изолированных многоклеточных перфузируемых препаратах и оценку изменения длительности потенциалов действия согласно изобретению, в качестве изолированных многоклеточных перфузируемых препаратов используют миокард легочных вен крысы, причем изменения параметров получают в трех режимах работы многоклеточных препаратов, дополнительно оценивают потенциал покоя и по увеличению ДПД 90%, увеличению отношения ДПД 50%/ДПД 90%, снижению скорости спонтанного сдвига потенциала покоя, снижению наиболее положительного значения мембранного потенциала в покоящемся препарате, снижению частоты следования пачек спонтанной активности, снижению частоты и вариабельности следования спонтанных ПД в пачке, уменьшению количества и снижению интенсивности постдеполяризаций, смещению мембранного потенциала, соответствующего началу пачечной активности в отрицательную сторону, оценивают признаки антиаритмического действия, а по снижению ДПД 90%, снижению отношения ДПД 50%/ДПД 90%, увеличению скорости спонтанного сдвига потенциала покоя, увеличению наиболее положительного значения мембранного потенциала в покоящемся препарате, увеличению частоты следования пачек спонтанной активности, увеличению частоты и вариабельности следования спонтанных ПД в пачке, увеличению количества и увеличению интенсивности постдеполяризаций, смещению мембранного потенциала, соответствующего началу пачечной активности в положительную сторону, оценивают аритмогенную активность.
Технический результат достигается за счет использования структуры, обладающей повышенной аритмогенной активностью, а именно миокарда легочных вен крысы.
Миокардиальная обкладка легочных вен крысы имеет достаточную протяженность, вплоть до бифуркаций второго порядка и внутрилегочных участков, миокардиальная обкладка легочных вен крысы обладает свойствами, характерными для аритмогенных очагов.
Миокардиальная обкладка легочных вен морской свинки функционально неотличима от предсердного миокарда. Легочные вены кролика не имеют протяженной миокардиальной обкладки, соответственно, изолированные препараты, полученные от данных видов млекопитающих, обладают низкой аритмогенностью и не могут быть использованы для оценки антиаритмической активности.
Используют именно многоклеточные препараты, легочных вен, так как большое значение для реализации антиаритмического действия имеет тканевой уровень, фактор взаимосвязанности кардиомиоцитов в ткани.
Осуществление способа
Многоклеточные препараты легочных вен крысы получают следующим образом: некротизируют животное, вскрывают грудную клетку, извлекают сердце вместе с легкими и помещают в препаровальную ванночку (100 мл), наполненную перфузионным раствором комнатной температуры. Сердце промывают перфузионным раствором (интрааортально) содержащим гепарин (0,2 ед./мл). Отпрепаровывают левое предсердие и легочную вену левой доли легкого.
Легочную вену отделяют с проксимальной стороны в области устья, с дистальной стороны в области первой бифуркации, разрезают вдоль продольной оси и разворачивают в перфузионной камере, получая плоский препарат (площадь препарата ≈0,6-0,8 мм2). Препарат разворачивают и закрепляют в перфузионной камере эндокардиальной стороной вверх. Процедура выделения препарата 5 минут.
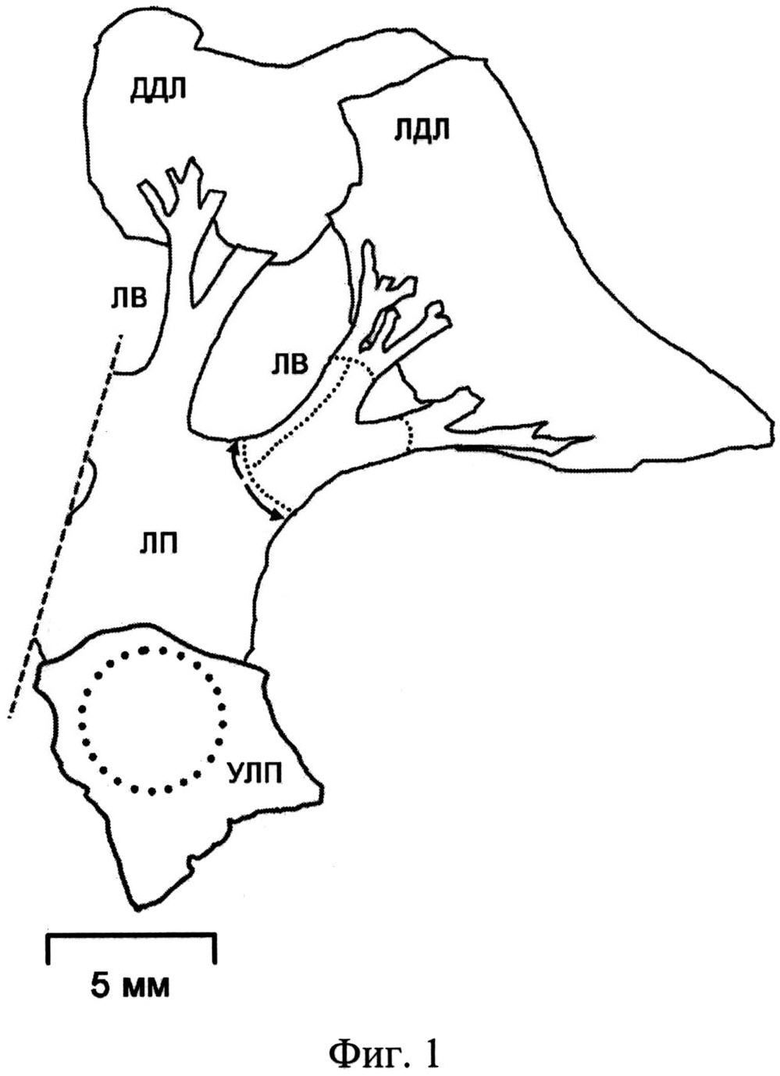
На фиг.1 показано схематическое изображение препарата левого предсердия, легочных вен и долей легких крысы, где УЛП - ушко левого предсердия, ЛП - свободная стенка левого предсердия, ЛВ - легочная вена, ЛДЛ - левая доля легкого, ДДЛ - добавочная доля легкого. Пунктиром обведены исследуемые области.
После выделения многоклеточных препаратов осуществляют перфузию. Перфузию проводят при температуре 37°C и скорости протока 15 мл/мин (3 объема камеры в 1 минуту, что необходимо для достаточной оксигенации препаратов). Перфузионный раствор непрерывно оксигенируют карбогеном (95% O2 и 5% CO2). Используют перфузионный раствор стандартного состава: (мМ): NaCl 133.47, KCl 4.69, NaH2PO4·2H2O 1.35, NaHCO3 16.31, MgSO4·7H2O 1.18, CaCl2·2H2O 2.5, глюкоза 7.77, pH 7,2 - 7,4. Воды бидистиллированой до 1 литра.
Регистрируют потенциал покоя, потенциалы действия. Потенциалы действия отводят с «эндокардиальной» стороны легочной вены. Для регистрации ПД используют стеклянные микроэлектроды, заполненные 3M KCl (сопротивление 1-30 МОм), подключенные к усилителю. Усиленный сигнал поступает на аналого-цифровой преобразователь и ЭВМ.
Для прогнозирования эффективности и безопасности потенциальных антиаритмических средств используют перфузию препаратов легочных вен крысы в трех режимах:
1. «Ритмически возбуждаемый препарат»
Препарат непрерывно стимулируют прямоугольными импульсами длительностью 2 мс с интервалом S=300 мс и амплитудой, равной двум пороговым значениям (1-3 B), что приводит к регулярному возникновению потенциалов действия в препаратах. В случае необходимости используют иные интервалы стимуляции. Стимулирующие серебряные электроды (D=0,5 мм) помещают в проксимальной области препарата.
Рассчитывают длительность ПД на уровне 50% и 90% реполяризации (ДПД 50%, ДПД 90%) при стимуляционном интервале S=300 мс. Определяют увеличение ДПД 90% в экспериментальных группах по сравнению с ДПД 90% в контрольной группе.
2. «Покоящийся препарат»
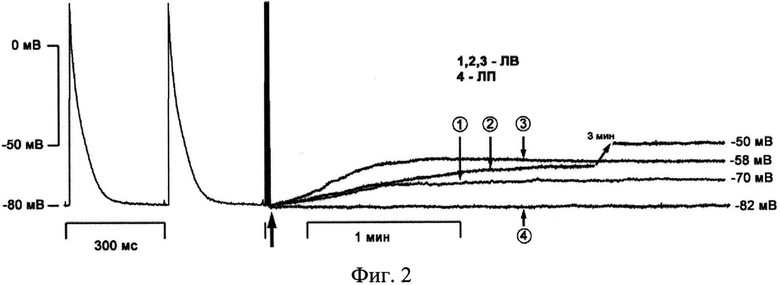
После 10-минутного периода непрерывной стимуляции и ритмической активности прекращают стимуляцию. Прекращение стимуляции в миокарде легочных вен крысы приводит к спонтанному сдвигу потенциала покоя в область более положительных значений (Фиг.2). Оценивают степень и скорость спонтанного сдвига потенциала покоя в контрольных группах, а также после действия исследуемых фармакологических соединений.
На фиг.2 показаны примеры потенциалов действия и спонтанный сдвиг потенциала покоя в миокарде легочных вен крысы при переходе препарата в покоящееся состояние. 1, 2, 3 - варианты изменения ПП при прекращении стимуляции в легочных венах (ЛВ), 4 - в предсердной части препарата (ЛП). Стрелкой указан момент прекращения стимуляции.
3. «Спонтанно активный препарат»
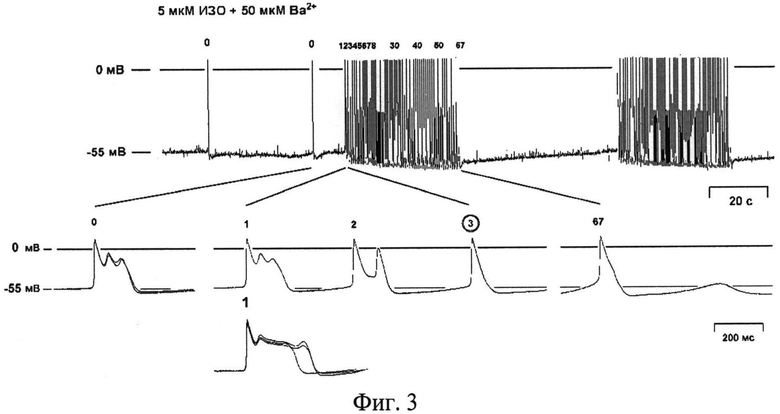
Препарат в течение эксперимента перфузируют 1 мкМ фенилэфрина, в результате чего в миокарде легочных вен крысы развивается периодическая пачечная спонтанная активность; спонтанные потенциалы действия в пачках сопровождаются ранними постдеполяризациями.
На фиг.3 показан циклический характер пачечной спонтанной активности и изменения потенциала в миокарде легочных вен крысы при действии фенилэфрина: периоды спонтанной активности сопровождаются гиперполяризацией, период покоя сопровождается деполяризацией, где снизу изображены единичные ПД, предшествующие пачечной активности (0), первые ПД в пачке, сопровождаемые ранними постдеполяризациями (1 и 2), типичные пачечные ПД (3), последний ПД пачки (67).
Оценивают влияние исследуемых фармакологических соединений на частоту следования пачек спонтанной активности, наиболее отрицательный потенциал в период покоя, частоту и вариабельность следования спонтанных ПД в пачке, интенсивность постдеполяризаций, значение мембранного потенциала, соответствующее началу пачечной активности.
Критериями для прогнозирования эффективности и безопасности потенциальных антиаритмических и других фармакологических средств служит оценка следующих биоэлектрических параметров, определение которых возможно только в легочных венах крысы.
А именно, в качестве признаков антиаритмической эффективности и безопасности принимают: увеличение ДПД 90%, увеличение отношения ДПД 50%/ДПД 90%, снижение скорости спонтанного сдвига потенциала покоя, снижение наиболее положительного значения мембранного потенциала в покоящемся препарате, снижение частоты следования пачек спонтанной активности, снижение частоты и вариабельности следования спонтанных ПД в пачке, уменьшения количества и снижение интенсивности постдеполяризаций, смещение мембранного потенциала, соответствующего началу пачечной активности в отрицательную сторону.
В качестве признаков аритмогенной активности принимают: снижение ДПД 90%, снижение отношения ДПД 50%/ДПД 90%, увеличение скорости спонтанного сдвига потенциала покоя, увеличение наиболее положительного значения мембранного потенциала в покоящемся препарате, увеличение частоты следования пачек спонтанной активности, увеличение частоты и вариабельности следования спонтанных ПД в пачке, увеличение количества и увеличение интенсивности постдеполяризаций, смещение мембранного потенциала, соответствующего началу пачечной активности в положительную сторону.
Таким образом, заявляемый способ является эффективным, повышает надежность прогнозирования антиаритмического действия, безопасность потенциальных фармакологических средств данного назначения, сокращает длительность экспериментальной фазы и способствует ускорению перехода к клиническим исследованиям.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ БЕНЗИЛАМИДА 4-ОКСИМАСЛЯНОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЕ МЕСТНО-АНЕСТЕЗИРУЮЩУЮ, АНТИАРИТМИЧЕСКУЮ, АНТИАНГИАЛЬНУЮ И АНТИНЕКРОТИЧЕСКУЮ АКТИВНОСТЬ | 1988 |
|
SU1601984A1 |
| АНТИАРИТМИЧЕСКИЙ ПРЕПАРАТ | 2002 |
|
RU2223759C1 |
| СРЕДСТВО, ПРОЯВЛЯЮЩЕЕ АНТИАРИТМИЧЕСКУЮ АКТИВНОСТЬ | 1992 |
|
RU2054938C1 |
| ЭФИР ЯНТАРНОЙ КИСЛОТЫ 5-ГИДРОКСИАДАМАНТАН-2-ОНА, ПРЕПЯТСТВУЮЩИЙ РАЗВИТИЮ СЕРДЕЧНЫХ АРИТМИЙ | 2020 |
|
RU2757477C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИАРИТМИЧЕСКИМ, АНТИФИБРИЛЛЯТОРНЫМ, ПРОТИВОИШЕМИЧЕСКИМ ДЕЙСТВИЕМ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2011 |
|
RU2477130C1 |
| АНТИАРИТМИЧЕСКОЕ СРЕДСТВО | 1983 |
|
RU2068261C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПАРОКСИЗМАЛЬНОЙ АРИТМИИ СЕРДЦА | 1997 |
|
RU2147382C1 |
| СПОСОБ ЛЕЧЕНИЯ НАРУШЕНИЙ РИТМА СЕРДЦА | 1991 |
|
RU2008903C1 |
| Способ тестирования химических соединений на кардиотропную активность | 1985 |
|
SU1244593A1 |
| СПОСОБ МОДЕЛИРОВАНИЯ АТРИОВЕНТРИКУЛЯРНОЙ ДИССОЦИАЦИИ | 1995 |
|
RU2128468C1 |
Изобретение относится к экспериментальной фармакологии и представляет собой способ доклинических исследований кардиотропных антиаритмических средств, включающий определение биоэлектрических параметров в изолированных многоклеточных перфузируемых препаратах и оценку изменения длительности потенциалов действия, отличающийся тем, что в качестве изолированных многоклеточных перфузируемых препаратов используют миокард легочных вен крысы, причем изменения параметров получают в трех режимах работы многоклеточных препаратов, дополнительно оценивают потенциал покоя и по изменениям ДПД 90%, отношения ДПД 50%/ДПД 90%, скорости спонтанного сдвига потенциала покоя, наиболее положительного значения мембранного потенциала в покоящемся препарате, частоты следования пачек спонтанной активности, частоты и вариабельности следования спонтанных ПД в пачке, количества и интенсивности постдеполяризаций, а также по смещению мембранного потенциала, соответствующего началу пачечной активности, оценивают признаки антиаритмического или аритмогенного действия. Изобретение обеспечивает повышение надежности прогнозирования антиаритмического действия потенциальных фармакологических средств и сокращение длительности экспериментальной фазы. 3 ил.
Способ доклинических исследований кардиотропных антиаритмических средств, включающий определение биоэлектрических параметров в изолированных многоклеточных перфузируемых препаратах и оценку изменения длительности потенциалов действия, отличающийся тем, что в качестве изолированных многоклеточных перфузируемых препаратов используют миокард легочных вен крысы, дополнительно оценивают потенциал покоя, а изменения параметров получают в трех режимах работы многоклеточных препаратов:
1) препарат непрерывно стимулируют прямоугольными импульсами длительностью 2 мс с интервалом S=300 мс и амплитудой, равной двум пороговым значениям (1-3 В), рассчитывают длительность потенциала действия на уровне 50% и 90% реполяризации (ДПД 50%, ДПД 90%) при стимуляционном интервале S=300 мс, определяют увеличение ДПД 90% в экспериментальных группах по сравнению с ДПД 90% в контрольной группе;
2) после 10-минутного периода непрерывной стимуляции и ритмической активности прекращают стимуляцию, оценивают степень и скорость спонтанного сдвига потенциала покоя в контрольных группах, а также после действия исследуемых фармакологических соединений;
3) препарат перфузируют 1 мкМ фенилэфрина для развития в миокарде легочных вен крысы периодической пачечной спонтанной активности, оценивают влияние исследуемых фармакологических соединений на частоту следования пачек спонтанной активности, наиболее отрицательный потенциал в период покоя, частоту и вариабельность следования спонтанных потенциалов действия (ПД) в пачке, интенсивность постдеполяризаций, значение мембранного потенциала, соответствующее началу пачечной активности;
по увеличению ДПД90%, увеличению отношения ДПД50%/ДПД90%, снижению скорости спонтанного сдвига потенциала покоя, снижению наиболее положительного значения мембранного потенциала в покоящемся препарате, снижению частоты следования пачек спонтанной активности, снижению частоты и вариабельности следования спонтанных ПД в пачке, уменьшению количества и снижению интенсивности постдеполяризаций, смещению мембранного потенциала, соответствующего началу пачечной активности в отрицательную сторону, оценивают признаки антиаритмического действия, а по снижению ДПД90%, снижению отношения ДПД50%/ДПД90%, увеличению скорости спонтанного сдвига потенциала покоя, увеличению наиболее положительного значения мембранного потенциала в покоящемся препарате, увеличению частоты следования пачек спонтанной активности, увеличению частоты и вариабельности следования спонтанных ПД в пачке, увеличению количества и увеличению интенсивности постдеполяризаций, смещению мембранного потенциала, соответствующего началу пачечной активности в положительную сторону, оценивают аритмогенную активность.
| Галенко-Ярошевский П.А., Каверина Н.В., Камкин А.Г., Турилова А.И., Богус С.К., Шейх-заде Ю.Р | |||
| Методические рекомендации по доклиническому изучению антиаритмических лекарственных средств | |||
| В книге: Руководство по проведению доклинических исследований лекарственных средств | |||
| Часть первая | |||
| - М.: Гриф и К, 2012 | |||
| Реактивная катушка | 1924 |
|
SU944A1 |
| Hondeghem LM, Carlsson L, Duker | |||
Авторы
Даты
2015-02-20—Публикация
2013-11-21—Подача