Область техники
Настоящее изобретение относится к антителам и их антиген-связывающим фрагментам, которые специфичны к ангиопоэтину-2 (Ang-2).
Уровень техники
Ангиогенез представляет собой биологический процесс, в результате которого образуются новые кровеносные сосуды.
Аберрантный ангиогенез ассоциирован с несколькими болезненными состояниями, включающими, например, пролиферативные ретинопатии, ревматоидный артрит и псориаз. Кроме того, хорошо известно, что ангиогенез является критическим для роста и поддержания опухоли. Ангиопоэтин-2 (Ang-2) является лигандом для рецептора Tie-2 (Tie-2), и, как было продемонстрировано, он играет роль в ангиогенезе. Ang-2 также обозначается в данной области техники как лиганд Tie-2 (США 5643755; Yancopoulos et al., 2000, Nature 407:242-248).
Антитела и другие пептидные ингибиторы, которые связываются с Ang-2, упомянуты в US 6166185; 7521053; 7205275; 2006/0018909 и 2006/0246071. Существует потребность в данной области техники в создании новых Ang-2-модулирующих агентов, включающих Ang-2-антитела, которые могут использоваться для лечения заболеваний и патологических состояний, вызванных или отягощенных ангиогенезом.
Краткое описание изобретения
В настоящем изобретении предлагаются человеческие антитела, которые связываются с человеческим Ang-2. Авторы настоящего изобретения ввиду различных очевидных сведений и исследований поняли необходимость создания Ang-2-ингибиторов, которые не связываются и не являются антагонистами родственной молекуле Ang-1. Например, предыдущие исследования продемонстрировали или предположили полезную роль Ang-1 в гемостазе (см., например, Li et al., 2001, Thrombosis and Haemostasis 85:191-374) и в защите сосудистой системы взрослого от просачивания плазмы (см., например, Thurston et al., 2000, Nature Medicine 6:460-463; Thurston et al., 1999, Science 286:2511-2514). Таким образом, авторам настоящего изобретения понятно, что в определенных анти-ангиогенных терапевтических случаях может быть полезным сохранение активности Ang-1. Соответственно, в настоящем изобретении предлагаются антитела, которые специфично связываются с Ang-2, но по существу не связываются с Ang-1. Настоящее изобретение также включает антитела, которые блокируют взаимодействие между Ang-2 и его рецептором Tie-2, но по существу не блокируют взаимодействие между Ang-1 и Tie-2. Антитела по изобретению применяются среди прочего для ингибирования ангиогенез-стимулирующих активностей Ang-2 и для лечения заболеваний и нарушений, вызванных или связанных с процессом ангиогенеза.
Антитела по изобретению могут быть полноразмерными (например, антитело IgG1 или IgG4) или могут включать только антиген-связывающую часть (например, фрагмент Fab, F(ab')2 или scFv), и могут быть модифицированы с воздействием на функциональность, например, с исключением остаточных эффекторных функций.
В одном воплощении, изобретение включает антитело или антиген-связывающий фрагмент антитела, включающего вариабельный участок тяжелой цепи (HCVR), имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 18, 22, 26, 42, 46, 50, 66, 70, 74, 90, 94, 98, 114, 118, 122, 138, 142, 146, 162, 166, 170, 186, 190, 194, 210, 214, 218, 234, 238, 242, 258, 262, 266, 282, 286, 290, 306, 310, 314, 330, 334, 338, 354, 358, 362, 378, 382, 386, 402, 406, 410, 426, 430, 434, 450, 454, 458, 474, 478, 482, 498, 502, 506, 514 и 516, или из по существу подобной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или, по меньшей мере, 99% идентичности последовательности. В одном воплощении, изобретение включает антитело или антиген-связывающий фрагмент антитела, включающие HCVR, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 18, 42, 66, 162, 210, 266 и 434.
В одном воплощении, изобретение включает антитело или антиген-связывающий фрагмент антитела, включающие вариабельный участок легкой цепи (LCVR), имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: SEQ ID NO: 10, 20, 24, 34, 44, 48, 58, 68, 72, 82, 92, 96, 106, 116, 120, 130, 140, 144, 154, 164, 168, 178, 188, 192, 202, 212, 216, 226, 236, 240, 250, 260, 264, 274, 284, 288, 298, 308, 312, 322, 332, 336, 346, 356, 360, 370, 380, 384, 394, 404, 408, 418, 428, 432, 442, 452, 456, 466, 476, 480, 490, 500 и 504, или из по существу подобной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или по меньшей мере, 99% идентичности последовательности. В одном воплощении, изобретение включает антитело или антиген-связывающий фрагмент антитела, включающие LCVR, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 20, 44, 68, 164, 212, 274 и 442.
В конкретных воплощениях, антитело или его антиген-связывающий фрагмент включают пары аминокислотных последовательностей HCVR и LCVR (HCVR/LCVR), выбранные из группы, состоящей из SEQ ID NO: 2/10, 18/20, 22/24, 26/34, 42/44, 46/48, 50/58, 66/68, 70/72, 74/82, 90/92, 94/96, 98/106, 114/116, 118/120, 122/130, 138/140, 142/144, 146/154, 162/164, 166/168, 170/178, 186/188, 190/192, 194/202, 210/212, 214/216, 218/226, 234/236, 238/240, 242/250, 258/260, 262/264, 266/274, 282/284, 286/288, 290/298, 306/308, 310/312, 314/322, 330/332, 334/336, 338/346, 354/356, 358/360, 362/370, 378/380, 382/384, 386/394, 402/404, 406/408, 410/418, 426/428, 430/432, 434/442, 450/452, 454/456, 458/466, 474/476, 478/480, 482/490, 498/500 и 502/504. В одном воплощении, антитело или его фрагмент включают HCVR и LCVR, выбранные из пар аминокислотных последовательностей SEQ ID NO: 18/20, 42/44, 66/68, 162/164, 210/212, 266/274 и 434/442.
В следующем аспекте, в изобретении предлагается антитело или антиген-связывающий фрагмент антитела, включающие домен тяжелой цепи CDR3 (HCDR3), имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 8, 32, 56, 80, 104, 128, 152, 176, 200, 224, 248, 272, 296, 320, 344, 368, 392, 416, 440, 464, 488 и 512, или из по существу подобной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или по меньшей мере, 99% идентичности последовательности; и домен легкой цепи CDR3 (LCDR3), выбранный из группы, состоящей из SEQ ID NO: 16, 40, 64, 88, 112, 136, 160, 184, 208, 232, 256, 280, 304, 328, 352, 376, 400, 424, 448, 472 и 496, или из по существу подобной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или, по меньшей мере, 99% идентичности последовательности.
В конкретных воплощениях, антитело или антиген-связывающий фрагмент антитела включают пару аминокислотных последовательностей HCDR3/LCDR3, выбранную из группы, состоящей из SEQ ID NO: 8/16, 32/40, 56/64, 80/88, 104/112, 128/136, 152/160, 176/184, 200/208, 224/232, 248/256, 272/280, 296/304, 320/328, 344/352, 368/376, 392/400, 416/424, 440/448, 464/472 и 488/496. В одном воплощении, антитело или антиген-связывающий фрагмент антитела включают пару аминокислотных последовательностей HCDR3/LCDR3, выбранную из группы, состоящей из SEQ ID NO: 8/16, 32/40, 56/64, 152/160, 200/208, 272/280 и 440/448. Не ограничивающие примеры анти-Ang-2 антител, содержащих эти пары HCDR3/LCDR3, представляют собой антитела, обозначенные H1 H685, H1 H690, H1 H691, H1 H696, H1 H706, H1 M724 и H2M744, соответственно.
В следующем воплощении, изобретение включает антитело или его фрагмент, дополнительно включающие домен HCDR1, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 4, 28, 52, 76, 100, 124, 148, 172, 196, 220, 244, 268, 292, 316, 340, 364, 388, 412, 436, 460, 484 и 508, или из по существу подобной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или, по меньшей мере, 99% идентичности последовательности; домен тяжелой цепи CDR2 (HCDR2), имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 6, 30, 54, 78, 102, 126, 150, 174, 198, 222, 246, 270, 294, 318, 342, 366, 390, 414, 438, 462, 486 и 510, или из по существу подобной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или, по меньшей мере, 99% идентичности последовательности; домен LCDR1, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 12, 36, 60, 84, 108, 132, 156, 180, 204, 228, 252, 276, 300, 324, 348, 372, 396, 420, 444, 468 и 492, или из по существу подобной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или, по меньшей мере, 99% идентичности последовательности; и домен LCDR2, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 14, 38, 62, 86, 110, 134, 158, 182, 206, 230, 254, 278, 302, 326, 350, 374, 398, 422, 446, 470 и 494, или из по существу подобной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или, по меньшей мере, 99% идентичности последовательности.
Конкретные не ограничивающие типичные антитела и антиген-связывающие фрагменты по изобретению включают домены HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3, соответственно, выбранные из группы, состоящей из: (i) SEQ ID NO: 4, 6, 8, 12, 14 и 16 (например, H1 H685); (ii) SEQ ID NO: 28, 30, 32, 36, 38 и 40 (например, H1 H690); (iii) SEQ ID NO: 52, 54, 56, 60, 62 и 64 (например, H1 H691 ); (iv) SEQ ID NO: 148, 150, 152, 156, 158 и 160 (например, H1 H696); (v) SEQ ID NO: 196, 198, 200, 204, 206 и 208 (например, H1 H706); (vi) SEQ ID NO: 268, 270, 272, 276, 278 и 280 (например, H1 M724); и (vii) SEQ ID NO: 436, 438, 440, 444, 446 и 448 (например, H2M744).
В родственном воплощении, изобретение включает антитело или антиген-связывающий фрагмент антитела, которые специфично связывается с Ang-2, где антитело или фрагмент включают домены тяжелой и легкой цепи CDR (т.e., CDR1, CDR2 и CDR3), содержащиеся в последовательностях вариабельных доменов тяжелой и легкой цепи, выбранных из группы, состоящей из SEQ ID NO: 2/10, 18/20, 22/24, 26/34, 42/44, 46/48, 50/58, 66/68, 70/72, 74/82, 90/92, 94/96, 98/106, 114/116, 118/120, 122/130, 138/140, 142/144, 146/154, 162/164, 166/168, 170/178, 186/188, 190/192, 194/202, 210/212, 214/216, 218/226, 234/236, 238/240, 242/250, 258/260, 262/264, 266/274, 282/284, 286/288, 290/298, 306/308, 310/312, 314/322, 330/332, 334/336, 338/346, 354/356, 358/360, 362/370, 378/380, 382/384, 386/394, 402/404, 406/408, 410/418, 426/428, 430/432, 434/442, 450/452, 454/456, 458/466, 474/476, 478/480, 482/490, 498/500 и 502/504. В одном воплощении, антитело или его фрагмент включают последовательности CDR, содержащиеся внутри HCVR и LCVR, выбранные из пар аминокислотных последовательностей SEQ ID NO: 18/20, 42/44, 66/68, 162/164, 210/212, 266/274 и 434/442.
В другом аспекте, в изобретении предлагаются молекулы нуклеиновой кислоты, кодирующие анти-Ang-2 антитела или их фрагменты. Также изобретением охватываются рекомбинантные экспрессирующие векторы, несущие нуклеиновые кислоты по изобретению, и клетки-хозяева, в которые вводятся такие векторы, а также способы получения антител путем культивирования клеток в условиях, дающих возможность продуцирования антител и извлечения полученных антител.
В одном воплощении, в изобретении предлагается антитело или его фрагмент, включающие HCVR, кодируемый последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 1, 17, 21, 25, 41, 45, 49, 65, 69, 73, 89, 93, 97, 113, 117, 121, 137, 141, 145, 161, 165, 169, 185, 189, 193, 209, 213, 217, 233, 237, 241, 257, 261, 265, 281, 285, 289, 305, 309, 313, 329, 333, 337, 353, 357, 361, 377, 381, 385, 401, 405, 409, 425, 429, 433, 449, 453, 457, 473, 477, 481, 497, 501, 505, 513 и 515, или по существу из идентичной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98%, или, по меньшей мере, 99% идентичности последовательности. В одном воплощении, антитело или его фрагмент включают HCVR, кодируемый последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 17, 41, 65, 161, 209, 265 и 433.
В одном воплощении, в изобретении предлагается антитело или его фрагмент, включающие LCVR, кодируемый последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 9, 19, 23, 33, 43, 47, 57, 67, 71, 81, 91, 95, 105, 115, 119, 129, 139, 143, 153, 163, 167, 177, 187, 191, 201, 211, 215, 225, 235, 239, 249, 259, 263, 273, 283, 287, 297, 307, 311, 321, 331, 335, 345, 355, 359, 369, 379, 383, 393, 403, 407, 417, 427, 431, 441, 451, 455, 465, 475, 479, 489, 499 и 503, или по существу из идентичной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98%, или, по меньшей мере, 99% идентичности последовательности. В одном воплощении, антитело или его фрагмент включают LCVR, кодируемый последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 19, 43, 67, 163, 211, 273 и 441.
В одном воплощении, в изобретении предлагается антитело или антиген-связывающий фрагмент антитела, включающие домен HCDR3, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 7, 31, 55, 79, 103, 127, 151, 175, 199, 223, 247, 271, 295, 319, 343, 367, 391, 415, 439, 463, 487 и 511, или из по существу идентичной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или по меньшей мере, 99% идентичности последовательности; и домен LCDR3, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 15, 39, 63, 87, 111, 135, 159, 183, 207, 231, 255, 279, 303, 327, 351, 375, 399, 423, 447, 471 и 495, или из по существу подобной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или по меньшей мере, 99% идентичности последовательности. В одном воплощении, антитело или его фрагмент включают последовательности HCDR3 и LCDR3, кодируемые парой последовательностей нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 7/15, 31/39, 55/63, 151/159, 199/207, 271/279 и 439/447.
В следующем воплощении, антитело или его фрагмент дополнительно включают: домен HCDR1, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 3, 27, 51, 75, 99, 123, 147, 171, 195, 219, 243, 267, 291, 315, 339, 363, 387, 411, 435, 459, 483 и 507, или из по существу идентичной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или, по меньшей мере, 99% идентичности последовательности; домен HCDR2, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 5, 29, 53, 77, 101, 125, 149, 173, 197, 221, 245, 269, 293, 317, 341, 365, 389, 413, 437, 461, 485 и 509, или из по существу подобной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или, по меньшей мере, 99% идентичности последовательности; домен LCDR1, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 11, 35, 59, 83, 107, 131, 155, 179, 203, 227, 251, 275, 299, 323, 347, 371, 395, 419, 443, 467 и 491, или из по существу идентичной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или, по меньшей мере, 99% идентичности последовательности; и домен LCDR2, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 13, 37, 61, 85, 109, 133, 157, 181, 205, 229, 253, 277, 301, 325, 349, 373, 397, 421, 445, 469 и 493, или из по существу подобной им последовательности, имеющей, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или, по меньшей мере, 99% идентичности последовательности.
В одном воплощении, антитело или его фрагмент включают последовательности CDR тяжелой и легкой цепи, кодируемые последовательностями нуклеиновых кислот SEQ ID NO: 17 и 19; SEQ ID NO: 41 и 43; SEQ ID NO: 65 и 67; SEQ ID NO: 161 и 163; SEQ ID NO: 209 и 211; SEQ ID NO: 265 и 273; или SEQ ID NO: 433 и 441.
Изобретение охватывает анти-Ang-2 антитела, имеющие модифицированный профиль гликозилирования. В некоторых применениях может использоваться модификация для удаления сайтов гликозилирования. Например, настоящее изобретение охватывает модифицированные варианты любого антитела, представленного в настоящем документе, где модифицированный вариант лишен фукозного компонента, присутствующего на олигосахаридной цепи, например, для увеличения функции антителозависимой клеточной цитотоксичности (ADCC) (см. Shield et al. (2002) JBC 277:26733). В других применениях, может быть осуществлена модификация галактозилирования с целью модификации комплементзависимой цитотоксичности (CDC).
В другом аспекте, в изобретении предлагается фармацевтическая композиция, включающая рекомбинантное человеческое антитело или его фрагмент, которые специфично связываются с Ang-2, и фармацевтически приемлемый носитель или разбавитель. В родственном аспекте, изобретение описывает композицию, которая представляет собой комбинацию ингибитора Ang-2 и второго терапевтического агента. В одном воплощении, ингибитор Ang-2 представляет собой антитело или его фрагмент. В одном воплощении, второй терапевтический агент представляет собой любой агент, который преимущественно объединяется с ингибитором Ang-2. Типичные агенты, которые могут преимущественно объединяться с ингибитором Ang-2, включают без ограничения любой агент, который ингибирует или уменьшает ангиогенез, другие противораковые терапевтические агенты, противовоспалительные агенты, ингибиторы цитокинов, ингибиторы факторов роста, противогемопоэтические факторы, нестероидные противовоспалительные лекарственные средства (NSAID), противовирусные агенты и антибиотики.
Еще в одном аспекте, в изобретении предлагаются способы ингибирования активности Ang-2 с применением анти-Ang-2 антитела или антиген-связывающего фрагмента антитела по изобретению, где терапевтические способы включают введение терапевтически эффективного количества фармацевтической композиции, включающей антитело или антиген-связывающий фрагмент антитела по изобретению. Нарушение, подвергаемое лечению, представляет собой любое заболевание или патологическое состояние, которое улучшается, ослабляется, ингибируется или предотвращается путем удаления, ингибирования или уменьшения активности Ang-2. Предпочтительно, анти-Ang-2 антитело или фрагмент антитела по изобретению применяются для лечения любого заболевания или патологического состояния, вызванного, ассоциированного или сохраняющегося с помощью процесса ангиогенеза. В конкретных воплощениях изобретения, анти-Ang-2 антитела или их антиген-связывающие участки применяются для лечения рака. В контексте противораковых терапий, анти-Ang-2 антитела по изобретению или их антиген-связывающие участки могут вводиться отдельно или в комбинации с другими противораковыми терапевтическими антителами, химиотерапевтическими агентами и/или с лучевой терапией. В других воплощениях настоящего изобретения анти-Ang-2 антитела или их антиген-связывающие фрагменты применяются для лечения одного или нескольких глазных нарушений, например, возрастной макулярной дегенерации, диабетической ретинопатии и т.д., и/или одного или нескольких воспалительных или инфекционных заболеваний.
Другие воплощения становятся очевидными в результате обзора подробного описания.
Краткое описание чертежей
Фиг.1 представляет собой выравнивание последних 88 C-концевых аминокислот человеческого Ang-2 (остатки 409-496 SEQ ID NO:518) с соответствующей аминокислотной последовательностью человеческого Ang-1 (SEQ ID NO:531). Остатки, которые отличаются у hAng-1 и hAng-2, отмечены белым шрифтом и черной штриховкой. Звездочками (*) отмечены аминокислоты hAng-2, которые, как было продемонстрировано с помощью анализа кристаллической структуры, взаимодействуют с человеческим Tie-2. См. Barton et al., Nat. Struct. Mol. Biol. 73:524-532 (2006). Треугольниками (▲^) отмечены положения аминокислот, взаимодействующих с Tie-2, которые отличаются у hAng-2 и hAng-1.
Фиг.2 (Панели A-C) изображает результаты Вестерн-блот анализов, которые иллюстрируют степень, до которой Ang-2-связывающие молекулы ингибируют или не способны ингибировать индуцированное с помощью Ang-1 фосфорилирование Tie-2.
Фиг.3 представляет собой краткое изложение эксперимента связывания с точечным мутантом Ang-2FD-mFc Примера 13, демонстрирующего аминокислотные замены, которые приводят в результате к более чем пятикратному уменьшению T1/2 диссоциации (изображено закрашенными кругами •) по отношению к дикому типу для различных тестированных антител и пептител (peptibodies).
Подробное описание
Перед тем как настоящее изобретение будет дополнительно описано, следует понимать, что это изобретение не ограничивается конкретными описанными методами и экспериментальными условиями, поскольку такие методы и условия могут варьироваться. Также следует понимать, что использованная в настоящем документе терминология необходима только для целей описания конкретных воплощений, и не предназначена для ограничения рамок настоящего изобретения, которые будут ограничены только прилагаемой формулой изобретения.
Если не определено иначе, все технические и научные термины, использованные в настоящем документе, имеют тот же смысл, который вкладывается в них обычным специалистом в области, к которой принадлежит данное изобретение. При использовании в настоящем документе, термин "примерно", когда он используется в отношении конкретного приведенного значения, обозначает, что значение может варьироваться относительно приведенного значения не более чем на 1%. Например, при использовании в настоящем документе, выражение "примерно 100" включает 99 и 101 и все значения между ними (например, 99,1, 99,2, 99,3, 99,4 и т.д.).
Хотя любые методы и материалы, подобные или эквивалентные тем, что описаны в настоящем документе, также могут использоваться на практике или при тестировании настоящего изобретения, далее будут описаны предпочтительные методы и материалы.
Определения
При использовании в настоящем документе, термин "ангиопоэтин-2" или "Ang-2", пока не определено, что он имеет происхождение из вида, отличного от человека, (например, "мышиный Ang-2", "обезьяний Ang-2" и т.д.), обозначает человеческий Ang-2 или его биологически активный фрагмент (например, фрагмент белка Ang-2, который способен индуцировать ангиогенез in vitro или in vivo). Человеческий Ang-2 кодируется последовательностью нуклеиновой кислоты, представленной в SEQ ID NO:517, и имеет аминокислотную последовательность SEQ ID NO:518. Аминокислотные последовательности мышиного и обезьяньего белков Ang-2 доступны из базы данных NCBI белковых последовательностей под Регистрационными номерами NP_031452 и BAE89705.1, соответственно.
Термин "ангиопоэтин-1" или "Ang-1 ", пока не определено, что он имеет происхождение из вида, отличного от человека, (например, "мышиный Ang-1", "обезьяний Ang-1" и т.д.), обозначает человеческий Ang-1 или его биологически активный фрагмент. Человеческий Ang-1 имеет аминокислотную последовательность, представленную в базе данных NCBI белковых последовательностей под Регистрационным номером AAB50557. Термин "Tie-2" (также обозначаемый в уровне техники как "TEK"), пока не определено, что он имеет происхождение из вида, отличного от человека, (например, "мышиный Tie-2", "обезьяний Tie-2" и т.д.), обозначает человеческий Tie-2 или его биологически активный фрагмент. Человеческий Tie-2 имеет аминокислотную последовательность, представленную в базе данных NCBI белковых последовательностей под Регистрационным номером AAA61130.
Термин "антитело", при использовании в настоящем документе, предназначен для обозначения молекул иммуноглобулинов, включающих четыре полипептидные цепи, две тяжелых (H) цепи и две легких (L) цепи, связанных между собой дисульфидными связями, а также их мультимеры (например, IgM). Каждая тяжелая цепь включает вариабельный участок тяжелой цепи (обозначенный в настоящем документе как HCVR или VH) и константный участок тяжелой цепи. Константный участок тяжелой цепи включает три домена, CH1, CH2 и CH3. Каждая тяжелая цепь включает вариабельный участок легкой цепи (обозначенный в настоящем документе как LCVR или VL) и константный участок легкой цепи. Константный участок легкой цепи включает один домен (CL1). Участки VH и VL могут быть дополнительно подразделены на участки гипервариабельности, называемыми участками, отвечающими за комплементарность связывания (CDR), перемежаясь участками, которые являются более консервативными, называемыми каркасными областями (FR). Каждый VH и VL состоит из трех CDR и четырех FR, расположенных от N-конца к С-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. В различных воплощениях изобретения, FR-участки анти-Ang-2 антитела (или его антиген-связывающего участка) могут быть идентичны с человеческими зародышевыми последовательностями или могут быть естественно или искусственно модифицированы. Консенсусная аминокислотная последовательность может определяться на основе параллельного анализа двух или нескольких CDR.
При использовании в настоящем документе, термин "антитело" также включает антиген-связывающие фрагменты полноразмерных молекул антитела. При использовании в настоящем документе, термины "антиген-связывающий участок" антитела, "антиген-связывающий фрагмент" антитела и тому подобные, включают любой естественный, получаемый ферментативно, синтетический или генетически сконструированный полипептид или гликопротеин, который специфично связывается с антигеном с образованием комплекса. Антиген-связывающие фрагменты антитела могут быть выделены, например, из полноразмерных молекул антитела с использованием любых подходящих стандартных методов, таких как протеолитический гидролиз или методы генетической инженерии, включающие манипуляцию и экспрессию ДНК, кодирующей вариабельные и необязательно константные домены антитела. Такая ДНК известна и общедоступна, например, из коммерческих источников, ДНК-библиотек (включающих, например, фаговые библиотеки антител), или может быть синтезирована. ДНК может быть секвенирована, и с ней проводят манипуляции с использованием химических методов или с использованием методов молекулярной биологии, например, для расположения одного или нескольких вариабельных и/или константных доменов в подходящей конфигурации или для введения кодонов, создания цистеиновых остатков, модификации, вставки или делеции аминокислот и т.д.
Не ограничивающие примеры антиген-связывающих фрагментов включают: (i) Fab-фрагменты; (ii) F(ab')2-фрагменты; (iii) Fd-фрагменты; (iv) Fv-фрагменты; (v) одноцепочечные молекулы Fv (scFv); (vi) dAb-фрагменты; и (vii) минимальные распознающие компоненты, состоящие из аминокислотных остатков, которые имитируют гипервариабельный участок антитела (например, выделенный участок, отвечающий за комплементарность связывания (CDR)). При использовании в настоящем документе, выражение "антиген-связывающий фрагмент" также охватывает другие сконструированные молекулы, такие как диатела, триатела, тетратела и минитела.
Антиген-связывающий фрагмент антитела также будет включать, по меньшей мере, один вариабельный домен. Вариабельный домен может быть любого размера или аминокислотного состава и, как правило, будет включать, по меньшей мере, один CDR, который расположен по соседству или находится в одной рамке с одной или несколькими каркасными последовательностями. В антиген-связывающих фрагментах, содержащих домен VH, ассоциированный с доменом VL, домены VH и VL могут находиться относительно друг друга в подходящем расположении. Например, вариабельный участок может быть димерным и может содержать димеры VH-VH, VH-VL или VL-VL. Альтернативно, антиген-связывающий фрагмент антитела может содержать мономерный домен VH или VL.
В конкретных воплощениях, антиген-связывающий фрагмент антитела может содержать, по меньшей мере, один вариабельный домен, ковалентно связанный, по меньшей мере, с одним константным доменом. Не ограничивающие типичные конфигурации вариабельных и константных доменов, которые могут обнаружиться внутри антиген-связывающего фрагмента антитела по настоящему изобретению, включают: (i) VH-CH1; (ii) VH-CH2; (iii) VH-CH3; (iv) VH-CH1-CH2; (V) VH-CH1-CH2-CH3; (vi) VH-CH2-CH3; (vii) VH-CL; (viii) VL-CH1; (ix) VL-CH2; (x) VL-CH3; (xi) VL-CH1-CH2; (xii) VL-CH1-CH2-CH3; (xiii) VL-CH2-CH3; и (xiv) VL-CL. В любой конфигурации вариабельных и константных доменов, включающей любую из типичных конфигураций, приведенных выше, вариабельные и константные домены могут быть связаны или непосредственно друг с другом, или могут быть связаны посредством полного или частичного шарнирного или линкерного участка. Шарнирный участок состоит, по меньшей мере, из 2 (например, 5, 10, 15, 20, 40, 60 или более) аминокислот, которые приводят в результате к получению гибкой или полугибкой связи между соседними вариабельными и/или константными доменами в одной полипептидной молекуле. Кроме того, антиген-связывающий фрагмент антитела по настоящему изобретению может включать гомодимер или гетеродимер (или другой мультимер) любой из конфигураций вариабельных и константных доменов, перечисленных выше, в нековалентной связи друг с другом и/или с одним или несколькими мономерными доменами VH или VL (например, с помощью дисульфидной связи(ей)).
Также как и полноразмерные молекулы антител, антиген-связывающие фрагменты могут быть моноспецифичными или мультиспецифичными (например, биспецифичными). Мультиспецифичный антиген-связывающий фрагмент антитела, как правило, будет включать, по меньшей мере, два различных вариабельных домена, где каждый вариабельный домен способен к специфичному связыванию с отдельным антигеном или с различными эпитопами на одном антигене. Любой мультиспецифичный формат антитела, включающий типичные биспецифичные форматы антител, раскрытых в настоящем документе, может быть адаптирован для применения в контексте антиген-связывающего фрагмента антитела по настоящему изобретению с использованием стандартных методов, доступных из уровня техники.
Константный участок антитела имеет значение для способности антитела фиксировать комплемент и опосредовать клеточно-опосредованную цитотоксичность. Таким образом, изотип антитела может быть выбран на основе того, целесообразно ли для антитела опосредование цитотоксичности.
При использовании в настоящем документе, подразумевается, что термин "человеческое антитело" включает антитела, содержащие вариабельные и константные участки, выделенные из последовательностей человеческих зародышевых иммуноглобулинов. Человеческие антитела по изобретению могут включать аминокислотные остатки, не кодируемые человеческими последовательностями зародышевых иммуноглобулинов (например, мутации, введенные неспецифическим или сайтспецифическим мутагенезом in vitro или соматическими мутациями in vivo), например, в участках CDR и особенно в CDR3. Однако, при использовании в настоящем документе, подразумевается, что термин "человеческое антитело" не включает антитела, в которых последовательности CDR, полученные из зародышевой линии других видов млекопитающих, таких как мыши, были пересажены в человеческие каркасные последовательности.
При использовании в настоящем документе, подразумевается, что термин "рекомбинантное человеческое антитело" включает все человеческие антитела, которые получают, экспрессируют, создают или выделяют с помощью рекомбинантных способов, такие как антитела, экспрессированные с использованием рекомбинантного экспрессирующего вектора, трансфицированного в клетку-хозяин (описано ниже), антитела, выделенные из рекомбинантной комбинаторной библиотеки человеческих антител (описано ниже), антитела, выделенные из животного (например, мыши), которые являются трансгенными для человеческих генов иммуноглобулинов (см., например, Taylor et al. (1992) Nucl. Acids Res. 20:6287-6295), или антитела, полученные, экспрессированные, созданные или выделенные с помощью любого другого способа, который включает сплайсинг последовательностей человеческих генов иммуноглобулинов с другими ДНК-последовательностями. Такие рекомбинантные человеческие антитела содержат вариабельные и константные участки, полученные из последовательностей человеческих зародышевых иммуноглобулинов. В некоторых воплощениях, однако, такие рекомбинантные человеческие антитела могут быть подвергнуты in vitro-мутагенезу (или, если используются трансгенные по отношению к человеку последовательности иммуноглобулинов животных, то соматическому мутагенезу in vivo), и, таким образом, аминокислотные последовательности участков VH и VL рекомбинантных антител являются последовательностями, которые хотя и происходят из и относятся к человеческим зародышевым последовательностям VH и VL, при этом не могут существовать в естественных условиях в зародышевом репертуаре человеческих антител in vivo.
Человеческие антитела могут существовать в двух формах, которые связаны с шарнирной гетерогенностью. В одной форме, молекула иммуноглобулина включает стабильную конструкцию из четырех цепей приблизительно 150-160 кДа, в которой димеры поддерживаются вместе с помощью взаимодействия дисульфидной связи тяжелой цепи. Во второй форме, димеры не связаны посредством дисульфидных связей между цепями, и образуется молекула с молекулярной массой примерно 75-80 кДа, состоящая из ковалентно связанных легкой и тяжелой цепи (полу-антитело). Эти формы очень трудно разделить даже после аффинной очистки.
Частота появления второй формы в различных интактных изотипах IgG ассоциирована в частности с изотипом шарнирного участка антитела. Единственная аминокислотная замена в шарнирном участке шарнира человеческого IgG4 может значительно уменьшать частоту появления второй формы (Angal et al. (1993) Molecular Immunology 30:105) до уровня, который, как правило, наблюдается с использованием шарнира человеческого IgG1. Настоящее изобретение охватывает антитела, содержащие одну или несколько мутаций в шарнирном участке, CH2 или CH3 участке, которые могут быть целесообразны, например, при получении антитела для улучшения выхода целевой формы антитела.
При использовании в настоящем документе, подразумевается, что "выделенное антитело" обозначает антитело, которое по существу свободно от других антител, обладающих отличными антигенными специфичностями (например, выделенное антитело, которое специфично связывается с человеческим Ang-2 или с фрагментом человеческого Ang-2, по существу свободно от антител, которые специфично связываются с антигенами, отличными от человеческого Ang-2). Термин "специфично связывается" или ему подобные означает, что антитело или его антиген-связывающий фрагмент образуют с антигеном комплекс, который относительно стабилен при физиологических условиях. Специфичное связывание может характеризоваться KD примерно 1×10-8 M или менее. Методы определения того, специфично ли связываются две молекулы, хорошо известны из уровня техники и включают, например, равновесный диализ, поверхностный плазмонный резонанс и тому подобные. Выделенное антитело, которое специфично связывается с человеческим Ang-2, может однако обладать перекрестной реактивностью с другими антигенами, такими как молекулы Ang-2 из других видов. Кроме того, выделенное антитело может быть по существу свободным от другого клеточного материала и/или химических веществ.
При использовании в настоящем документе, подразумевается, что "нейтрализующее" или "блокирующее" антитело обозначает антитело, связывание которого с Ang-2 блокирует взаимодействие между Ang-2 и его рецептором (Tie-2) и/или приводит в результате к ингибированию, по меньшей мере, одной биологической функции Ang-2. Ингибирование, вызванное антителом, нейтрализующим или блокирующим Ang-2, необязательно должно быть полным при условии, что оно детектируется при использовании подходящего анализа. Типичные анализы для детектирования ингибирования Ang-2 описаны в другом месте настоящего документа.
Полностью человеческие анти-Ang-2 антитела, раскрытые в настоящем документе, могут включать одну или несколько аминокислотных замен, вставок и/или делеций в каркасном и/или в участках CDR вариабельных доменов тяжелой и легкой цепи по сравнению с соответствующими зародышевыми последовательностями. Такие мутации легко могут быть идентифицированы путем сравнения аминокислотных последовательностей, раскрытых в настоящем документе, с зародышевыми последовательностями, доступными, например, из общедоступных баз данных последовательностей антител. Настоящее изобретение включает антитела и их антиген-связывающие фрагменты, которые получены из любой из аминокислотных последовательностей, раскрытых в настоящем документе, где одна или несколько аминокислот внутри одного или нескольких каркасных и/или участков CDR мутировали обратно по отношению к соответствующим зародышевым остаткам или к консервативной аминокислотной замене (естественной или искусственной) соответствующих зародышевых остатков (такие замены последовательности обозначаются в настоящем документе как "зародышевые обратные мутации"). Специалист в данной области, имея исходно последовательности вариабельных участков тяжелой и легкой цепей, раскрытых в настоящем документе, легко может получить множество антител и антиген-связывающих фрагментов, которые включают одну или несколько индивидуальных зародышевых обратных мутаций или их комбинацию. В некоторых воплощениях, каждый из остатков каркасных и/или CDR участков внутри доменов VH и/или VL мутируют обратно в зародышевую последовательность. В других воплощениях, только конкретные остатки мутируют обратно в зародышевую последовательность, например, только мутированные остатки обнаружены внутри первых 8 аминокислот FR1 или внутри последних 8 аминокислот FR4, или только мутированные остатки обнаружены внутри CDR1, CDR2 или CDR3. Кроме того, антитела по настоящему изобретению могут содержать любую комбинацию двух или нескольких зародышевых обратных мутаций внутри каркасных и/или CDR участков, т.e., где конкретные индивидуальные остатки мутируют обратно к зародышевой последовательности, в то время как некоторые другие остатки, которые отличаются от зародышевой последовательности, сохраняются. После получения, антитела и антиген-связывающие фрагменты, которые содержат одну или несколько зародышевых обратных мутаций, могут быть легко протестированы на предмет одного или нескольких целевых свойств, таких как улучшенная специфичность связывания, улучшенная аффинность связывания, улучшенные или усиленные антагонистические или агонистические биологические свойства (в зависимости от конкретного случая), уменьшенная иммуногенность, и т.д. Антитела и антиген-связывающие фрагменты, полученные этим общим способом, охвачены настоящим изобретением.
Настоящее изобретение также включает анти-Ang-2 антитела, включающие варианты любой из аминокислотных последовательностей HCVR, LCVR и/или CDR, раскрытых в настоящем документе и содержащих одну или несколько консервативных замен. Например, настоящее изобретение включает анти-Ang-2 антитела, содержащие аминокислотные последовательности HCVR, LCVR и/или CDR, включающие, например, 10 или менее, 8 или менее, 6 или менее, 4 или менее и т.д. консервативных аминокислотных замен по отношению к любой из аминокислотных последовательностей HCVR, LCVR и/или CDR, раскрытых в настоящем документе. В одном воплощении, антитело включает HCVR, имеющий аминокислотную последовательность SEQ ID NO: 18, включающую 8 или менее консервативных аминокислотных замен. В другом воплощении, антитело включает HCVR, имеющий аминокислотную последовательность SEQ ID NO: 18, включающую 6 или менее консервативных аминокислотных замен. В другом воплощении, антитело включает HCVR, имеющий аминокислотную последовательность SEQ ID NO: 18, включающую 4 или менее консервативных аминокислотных замен. В другом воплощении, антитело включает HCVR, имеющий аминокислотную последовательность SEQ ID NO: 18, включающую 2 или менее консервативных аминокислотных замен. В одном воплощении, антитело включает LCVR, имеющий аминокислотную последовательность SEQ ID NO: 20, включающую 8 или менее консервативных аминокислотных замен. В другом воплощении, антитело включает LCVR, имеющий аминокислотную последовательность SEQ ID NO: 20, включающую 6 или менее консервативных аминокислотных замен. В другом воплощении, антитело включает LCVR, имеющий аминокислотную последовательность SEQ ID NO: 20, включающую 4 или менее консервативных аминокислотных замен. В другом воплощении, антитело включает LCVR, имеющий аминокислотную последовательность SEQ ID NO: 20, включающую 2 или менее консервативных аминокислотных замен.
При использовании в настоящем документе, термин "поверхностный плазмонный резонанс" обозначает оптическое явление, которое предусматривает анализ взаимодействий в режиме реального времени путем детектирования изменений концентраций белка внутри биосенсорной матрицы, например, с использованием системы BIAcore™ (Biacore Life Sciences division of GE Healthcare, Piscataway, NJ).
При использовании в настоящем документе, подразумевается, что термин "KD" обозначает константу диссоциации при равновесии конкретного взаимодействия антитело-антиген.
Термин "эпитоп" обозначает антигенную детерминанту, которая взаимодействует со специфичным антиген-связывающим сайтом в вариабельном участке молекулы антитела, известном как паратоп. Один антиген может содержать более одного эпитопа. Таким образом, различные антитела могут связываться с различными областями на антигене и могут обладать различными биологическими эффектами. Эпитопы могут быть или конформационными или линейными. Конформационный эпитоп получают с помощью пространственно совмещенных аминокислот из различных сегментов линейной полипептидной цепи. Линейный эпитоп это эпитоп, полученный с помощью соседних аминокислотных остатков в полипептидной цепи. В определенных обстоятельствах, эпитоп может включать компоненты сахаридов, фосфорильных групп или сульфонильных групп на антигене.
Термин "существенная идентичность" или "по существу идентичный" по отношению к нуклеиновой кислоте или ее фрагменту обозначает, что когда нуклеиновая кислота, оптимально выравненная по соответствующим нуклеотидным вставкам или делециям с другой нуклеиновой кислотой (или ее комплементарной цепью), будет иметь место идентичность нуклеотидной последовательности у, по меньшей мере, примерно 95%, и более предпочтительно, по меньшей мере, примерно 96%, 97%, 98% или 99% нуклеотидных оснований, согласно измерениям с помощью хорошо известного алгоритма идентичности последовательности, такого как FASTA, BLAST или Gap, как обсуждается ниже. Молекула нуклеиновой кислоты, обладающая существенной идентичностью с эталонной молекулой нуклеиновой кислоты, может в определенных случаях, кодировать полипептид, имеющий по существу сходную аминокислотную последовательность как у полипептида, кодируемого эталонной молекулой нуклеиновой кислоты.
Применительно к полипептидам термин "существенное сходство" или "по существу сходные" означает, что две пептидные последовательности при оптимальном выравнивании, таком как с помощью программ GAP или BESTFIT с использованием параметров пропуска масс по умолчанию разделяют, по меньшей мере, 95% идентичности последовательности, еще более предпочтительно, по меньшей мере, 98% или 99% идентичности последовательности. Предпочтительно, положения остатков, которые не идентичны, отличаются консервативными аминокислотными заменами. "Консервативная аминокислотная замена" представляет собой замену, в которой аминокислотный остаток заменяют на другой остаток, имеющий боковую цепь (R-группу) со сходными химическими свойствами (например, заряд или гидрофобность). Вообще, консервативная аминокислотная замена по существу не изменит функциональных свойств белка. В случаях, когда две или несколько аминокислотных последовательностей отличаются друг от друга консервативными заменами, процент идентичности последовательности или степень сходства может регулироваться в сторону увеличения для коррекции с целью получения консервативной природы замены. Способы осуществления такой регуляции хорошо известны специалистам в данной области. См., например, Pearson (1994) Methods Mol. Biol. 24: 307-331. Примеры групп аминокислот, имеющих боковые цепи со сходными химическими свойствами, включают (1) алифатические боковые цепи: глицин, аланин, валин, лейцин и изолейцин; (2) алифатические гидроксильные боковые цепи: серин и треонин; (3) амидсодержащие боковые цепи: аспарагин и глутамин; (4) ароматические боковые цепи: фенилаланин, тирозин и триптофан; (5) основные боковые цепи: лизин, аргинин и гистидин; (6) кислотные боковые цепи: аспартат и глутамат и (7) серосодержащие боковые цепи: цистеин и метионин. Предпочтительными группами консервативных аминокислотных замен являются: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутумат-аспартат и аспарагин-глутамин. Альтернативно, консервативная замена представляет собой любую замену, имеющую положительное значение в матрице PAM250 логарифмического правдоподобия, раскрытой у Gonnet et al. (1992) Science 256: 1443-1445. "Умеренно консервативная" замена представляет собой любую замену, имеющую неотрицательное значение в матрице PAM250 логарифмического правдоподобия.
Сходство последовательностей полипептидов, которое также обозначают как идентичность последовательности, как правило, измеряют с использованием пакета программ анализа последовательностей. Пакет программ анализа белков находит сходные последовательности с использованием мер сходства, которые оценивают для различных замен, делеций и других модификаций, включающих консервативные аминокислотные замены. Например, пакет программ GCG содержит программы, такие как Gap и Bestfit, которые могут использоваться с параметрами по умолчанию для определения гомологии последовательностей или идентичности последовательностей между близкородственными полипептидами из различных видов организмов или между белком дикого типа и его мутантной формой. См., например, GCG Версия 6.1. Полипептидные последовательности также могут сравниваться с использованием FASTA с использованием параметров по умолчанию или с использованием рекомендованных параметров в программе GCG Версия 6.1. FASTA (например, FASTA2 и FASTA3) обеспечивает выравнивания и процент идентичности последовательности участков лучшего перекрывания между заданной и искомыми последовательностями (Pearson (2000) выше). Другим предпочтительным алгоритмом для сравнения последовательности по изобретению с базой данных, содержащей большое количество последовательностей из различных организмов, является компьютерная программа BLAST, особенно, BLASTP или TBLASTN, с использованием параметров по умолчанию. См., например, Altschul et al. (1990) J. Mol. Biol. 215:403-410 и Altschul et al. (1997) Nucleic Acids Res. 25:3389-402.
Получение человеческих антител
Методы генерирования моноклональных антител, включающих полностью человеческие моноклональные антитела, известны из уровня техники. Любые такие известные методы могут использоваться в контексте настоящего изобретения для получения человеческих антител, которые специфично связываются с человеческим Ang-2 и которые обладают одной или несколькими антиген-связывающими и/или функциональными характеристиками любого из типичных анти-Ang-2 антител, раскрытых в настоящем документе.
Используя технологию VELOCIMMUNE™ или любой другой известный метод генерирования моноклональных антител, изначально выделяют высокоаффинные химерные антитела к Ang-2, содержащие человеческий вариабельный участок и мышиный константный участок. Согласно экспериментальному разделу, представленному ниже, антитела характеризуются и выбираются с целью получения целевых характеристик, включающих аффинность, селективность, эпитоп и т.д. Мышиные константные участки заменяют на целевой человеческий константный участок с генерированием полностью человеческого антитела по изобретению, например, дикого типа или модифицированного IgG1 или IgG4. В то время как выбранный константный участок может варьироваться согласно конкретному применению, характеристики высокоаффинного антигенного связывания и целевая специфичность располагаются в вариабельном участке.
Биоэквиваленты
Анти-Ang-2 антитела и фрагменты антител по настоящему изобретению охватывают белки, имеющие аминокислотные последовательности, которые отличаются от последовательностей описанных антител, но которые сохраняют способность связываться с человеческим Ang-2. Такие вариантные антитела и фрагменты антител включают одну или несколько вставок, делеций или замен аминокислот по сравнению с родительской последовательностью, но демонстрируют биологическую активность, которая по существу эквивалентна активности описанных антител. Аналогично, ДНК-последовательности, кодирующие анти-Ang-2 антитело по настоящему изобретению, охватывают последовательности, которые включают одну или несколько вставок, делеций или замен нуклеотидов по сравнению с раскрытой последовательностью, но которые кодируют анти-Ang-2 антитело или фрагмент антитела, которые по существу биоэквивалентны анти-Ang-2 антителу или фрагменту антитела по изобретению. Примеры таких вариантных аминокислотных и ДНК-последовательностей раскрыты выше.
Два антиген-связывающих белка или антитела считаются биоэквивалентными, если они, например, являются фармацевтическими эквивалентами или фармацевтическими альтернативами, скорость и степень всасывания которых не демонстрирует значительного различия при введении в одинаковых молярных дозах при одинаковых экспериментальных условиях, как при однократной дозе, так и при многократных дозах. Некоторые антитела будут считаться эквивалентами или фармацевтическими альтернативами, если они эквивалентны по их степени всасывания, но не по скорости всасывания, и еще могут считаться биоэквивалентами, так как такие различия в скорости всасывания являются намеренными и отражаются в мечении, не являясь существенными в достижении эффективных концентраций лекарственного средства, например, при постоянном применении, и считаются незначимыми с медицинской точки зрения для конкретного исследуемого лекарственного продукта.
В одном воплощении, два антиген-связывающих белка являются биоэквивалентами, если нет клинически значимых различий в их безопасности, чистоте и эффективности.
В одном воплощении, два антиген-связывающих белка являются биоэквивалентными, если пациент может переключаться один или несколько раз между эталонным продуктом и биологическим продуктом без ожидаемого повышения риска побочных эффектов, включающих клинически значимые изменения иммуногенности или ослабление эффективности по сравнению с продолжающейся терапией без такого переключения.
В одном воплощении, два антиген-связывающих белка являются биоэквивалентными, если они оба действуют с помощью общего механизма или механизмов действия для условия или условий применения в такой степени, в какой такие механизмы известны.
Биоэквивалентность может демонстрироваться с помощью методов in vivo и in vitro. Измерения биоэквивалентности включают, например, (a) in vivo-тест у людей или других млекопитающих, для которых измеряют концентрацию антитела или его метаболитов как функцию от времени в крови, плазме, сыворотке или в другой биологической жидкости; (b) in vitro-тест, который коррелирует с обоснованно прогнозированными данными in vivo-биодоступности для человека; (c) in vivo-тест на людях или других млекопитающих, у которых соответствующий явный фармакологический эффект антитела (или его мишени) измеряют как функцию от времени; и (d) хорошо контролируемое клиническое испытание, которое проверяет безопасность, эффективность или биодоступность или биоэквивалентность антитела.
Биоэквивалентные варианты анти-Ang-2 антител по изобретению могут быть сконструированы, например, путем осуществления различных замен остатков или последовательностей или путем делеции внутренних остатков или последовательностей, которые не являются необходимыми для биологической активности. Например, остатки цистеина, не существенные для биологической активности, могут быть делетированы или заменены другими аминокислотами для предотвращения образования ненужных или некорректных внутримолекулярных дисульфидных мостиков при ренатурации.
Биологические и терапевтические характеристики антител
В целом, антитела по настоящему изобретению связываются с человеческим Ang-2 с KD, составляющей менее чем 100 пМ, как правило, с KD, составляющей менее чем 50 пМ, и в некоторых воплощениях, с KD, составляющей менее чем 40 пМ, согласно измерениям с помощью связывания с антигеном, который или иммобилизован на твердой подложке или находится в жидкой фазе.
Кроме того, некоторые типичные анти-Ang-2 антитела по изобретению могут демонстрировать одну или несколько из следующих характеристик: (1) способность связываться с человеческим Ang-2, но не с мышиным Ang-2; (2) способность связываться с человеческим Ang-2 и с мышиным Ang-2; (3) способность связываться с человеческим Ang-2, но не с человеческим Ang-1, -3 или -4; (4) способность связываться с человеческим Ang-2, но не с мышиным Ang-1, -3 или -4; (5) способность связываться с человеческим Ang-2 и с человеческим Ang-1, -3 или -4; (6) способность связываться с человеческим Ang-2 и с мышиным Ang-1, -3 или -4; (7) способность блокировать связывание человеческого Ang-2 с человеческим Tie-2; (8) способность блокировать связывание человеческого Ang-2 с мышиным Tie-2; (9) способность блокировать связывание мышиного Ang-2 с человеческим Tie-2; (10) способность блокировать связывание мышиного Ang-2 с мышиным Tie-2; (11) способность блокировать связывание человеческого Ang-1 с человеческим Tie-2; (12) способность блокировать связывание человеческого Ang-1 с мышиным Tie-2; (13) способность блокировать связывание мышиного Ang-1 с человеческим Tie-2; (14) способность блокировать связывание мышиного Ang-1 с мышиным Tie-2; (15) способность ингибировать фосфорилирование человеческого Tie-2, индуцированное человеческим Ang-2; (16) способность ингибировать фосфорилирование мышиного Tie-2, индуцированное человеческим Ang-2; (17) способность ингибировать фосфорилирование человеческого Tie-2, индуцированное мышиным Ang-2; (18) способность ингибировать фосфорилирование мышиного Tie-2, индуцированное мышиным Ang-2; (19) способность ингибировать фосфорилирование человеческого Tie-2, индуцированное человеческим Ang-1; (20) способность ингибировать фосфорилирование мышиного Tie-2, индуцированное человеческим Ang-1; (21) способность ингибировать фосфорилирование человеческого Tie-2, индуцированное мышиным Ang-1; (22) способность ингибировать фосфорилирование мышиного Tie-2, индуцированное мышиным Ang-1; (23) способность ингибировать in vivo ангиогенез в экспериментальной модели (например, ангиогенез, индуцированный цилиндром из Матригеля, содержащим клетки MCF-7, имплантированным подкожно голым мышам); и/или (24) способность ингибировать или уменьшать размер опухоли в мышиной модели ксенотрансплантата.
Настоящее изобретение также включает антитела, которые связываются с высокой аффинностью с конструкцией, включающей фибронектин-подобный домен Ang-2, но лишенным N-концевого суперспирального домена Ang-2 (такие конструкции обозначаются в настоящем документе как "Ang-2FD"). Типичные Ang-2FD конструкции включают человеческий Ang-2FD (SEQ ID NO;519), мышиный Ang-2FD (SEQ ID NO:520) и обезьяний Ang-2FD (SEQ ID NO:521). Человеческая, мышиная и обезьянья конструкции Ang-2FD могут быть мономерными или димерными. Конструкции Ang-2FD также могут включать другие, отличные от Ang-2, аминокислотные последовательности, такие как человеческий или мышиный Fc-домен, присоединенный к молекулам Ang-2FD. Другая типичная конструкция Ang-2FD обозначается в настоящем документе "hBA2" (или человеческий "складчатый-Ang2"), которая представляет собой тетрамер человеческих фибриногеноподобных доменов Ang-2, ассоциированных друг с другом посредством человеческих или мышиных Fc-доменов с образованием петлеобразной конфигурации. Как правило, hBA2 состоит из двух димеров Ang-2, где каждый димер Ang-2 содержит два фибронектиноподобных домена Ang-2, связанных друг с другом посредством Fc-домена. Типичные компоненты hBA2 включают полипептиды, обозначенные hBA2-hIgG1 (SEQ ID NO:522) и hBA2-mIgG2a (SEQ ID NO:523). Неожиданно обнаружили, что некоторые анти-Ang-2 антитела по настоящему изобретению связываются с конструкциями Ang-2FD с гораздо более высокой аффинностью, чем известное контрольное антитело к Ang-2 (см. Примеры, представленные в настоящем документе).
Высокоаффинное связывание в контексте связывания анти-Ang-2 антитела с димерной конструкцией человеческого или мышиного Ang-2FD, означает, что анти-Ang-2 антитело связывается с человеческим или мышиным димером Ang-2FD с KD, составляющей менее чем 300 пМ. Например, анти-Ang-2 антитела, которые связываются с высокой аффинностью с человеческим или мышиным димером Ang-2-FD, включают антитела, которые связываются с человеческим или мышиным димером Ang-2-FD с KD, составляющей менее чем 300 пМ, менее чем 250 пМ, менее чем 200 пМ, менее чем 190 пМ, менее чем 180 пМ, менее чем 170 пМ, менее чем 160 пМ, менее чем 150 пМ, менее чем 140 пМ, менее чем 130 пМ, менее чем 120 пМ, менее чем 110 пМ, менее чем 100 пМ, менее чем 90 пМ, менее чем 80 пМ, менее чем 70 пМ, менее чем 60 пМ или менее чем 50 пМ, согласно измерениям при 25°C с помощью анализа поверхностного плазмонного резонанса.
Высокоаффинное связывание в контексте связывания анти-Ang-2 антитела с димерной конструкцией обезьяньего Ang-2FD означает, что анти-Ang-2 антитело связывается с обезьяньим димером Ang-2FD с KD, составляющей менее чем 500 пМ. Например, анти-Ang-2 антитела, которые связываются с высокой аффинностью с обезьяньим димером Ang-2-FD, включают антитела, которые связываются с обезьяньим димером Ang-2-FD с KD, составляющей менее чем 500 пМ, менее чем 450 пМ, менее чем 400 пМ, менее чем 350 пМ, менее чем 300 пМ, менее чем 250 пМ, менее чем 200 пМ, менее чем 190 пМ, менее чем 180 пМ, менее чем 170 пМ, менее чем 160 пМ, менее чем 150 пМ, менее чем 140 пМ, менее чем 130 пМ, менее чем 120 пМ, менее чем 110 пМ, менее чем 100 пМ, менее чем 90 пМ, менее чем 80 пМ, согласно измерениям при 25°C с помощью анализа поверхностного плазмонного резонанса.
Высокоаффинное связывание в контексте связывания анти-Ang-2 антитела с мономерной конструкцией человеческого Ang-2FD, означает, что анти-Ang-2 антитело связывается с человеческим мономером Ang-2FD с KD, составляющей менее чем 40 пМ. Например, анти-Ang-2 антитела, которые связываются с высокой аффинностью с человеческим мономером Ang-2-FD, включают антитела, которые связываются с человеческим мономером Ang-2-FD с KD, составляющей менее чем 40 нМ, менее чем 30 нМ, менее чем 25 нМ, менее чем 20 нМ, менее чем 15 нМ, менее чем 10 нМ, менее чем 9 нМ, менее чем 8 нМ, менее чем 7 нМ, менее чем 6 нМ, менее чем 5 нМ, менее чем 4 нМ, менее чем 3 нМ, менее чем 2 нМ, менее чем 1 нМ, менее чем 0,9 нМ, менее чем 0,8 нМ, менее чем 0,7 нМ, менее чем 0,6 нМ, согласно измерениям при 25°C с помощью анализа поверхностного плазмонного резонанса.
Высокоаффинное связывание в контексте связывания анти-Ang-2 антитела с конструкцией hBA2, означает, что анти-Ang-2 антитело связывается с hBA2 с KD, составляющей менее чем 80 пМ. Например, анти-Ang-2 антитела, которые связываются с высокой аффинностью с hBA2, включают антитела, которые связываются с hBA2 с KD, составляющей менее чем 80 пМ, менее чем 75 пМ, менее чем 70 пМ, менее чем 65 пМ, менее чем 60 пМ, менее чем 55 пМ, менее чем 50 пМ, менее чем 45 пМ, менее чем 40 пМ, менее чем 35 пМ, менее чем 30 пМ, менее чем 25 пМ, менее чем 20 пМ, менее чем 18 пМ, менее чем 16 пМ, менее чем 14 пМ или менее чем 12 пМ, согласно измерениям при 25°C с помощью анализа поверхностного плазмонного резонанса.
Настоящее изобретение включает антитела, которые связываются с Ang-2, но по существу не связываются с Ang-1. При использовании в настоящем документе, антитело "по существу не связывается с Ang-1", если антитело при тестировании на связывание с Ang-1 с помощью анализа поверхностного плазмонного резонанса, и полноразмерный человеческий Ang-1 дикого типа в концентрации примерно 25 нМ инъецируется над поверхностью захваченного антитела со скоростью потока примерно 60 мкл/мин в течение примерно 3 минут при 25°C, и демонстрирует KD более чем примерно 1 нМ, например, KD, более чем примерно 5 нМ, более чем примерно 10 нМ, более чем примерно 50 нМ, более чем примерно 100 нМ, более чем примерно 150 нМ, более чем примерно 200 нМ, более чем примерно 250 нМ, более чем примерно 300 нМ, более чем примерно 350 нМ, более чем примерно 400 нМ, более чем примерно 450 нМ, более чем примерно 500 нМ, или более. (См. например, Пример 4). Кроме того, антитело "по существу не связывается с Ang-1", если антитело не способно демонстрировать какого-либо связывания с Ang-1, при тестировании в таком анализе или его эквиваленте.
Настоящее изобретение также включает антитела, которые блокируют взаимодействие между Ang-2 и Tie-2, но по существу не блокируют связывания Ang-1 с Tie-2. При использовании в настоящем документе, антитело "по существу не блокирует связывание Ang-1 с Tie-2", в случае если когда антитело предварительно смешивают с Ang-1-антигеном в соотношении примерно 100:1 (антитело:антиген) и инкубируют при 25°C в течение примерно 60 минут и затем уравновешенную смесь тестируют на связывание с Tie-2 с помощью поверхностного плазмонного резонанса над поверхностью, покрытой Tie-2 (5 мкл/мин в течение 5 мин при 25°C), количество Ang-1, связанного с Tie-2, составляет по меньшей мере, 50% количества Ang-1, связанного с Tie-2, в присутствии посторонней контрольной молекулы. (См. например, Пример 6). Например, если количество Ang-1, связанного с Tie-2, после предварительной инкубации с антителом составляет, по меньшей мере, примерно 50%, по меньшей мере, примерно 55%, по меньшей мере, примерно 60%, по меньшей мере, примерно 65%, по меньшей мере, примерно 70%, по меньшей мере, примерно 75%, по меньшей мере, примерно 80%, по меньшей мере, примерно 85%, по меньшей мере, примерно 90%, по меньшей мере, примерно 95%, или примерно 100% количества Ang-1, которое связывается с Tie-2, после предварительной инкубации с посторонней контрольной молекулой в вышеуказанных экспериментальных условиях, после чего считается, что антитело "по существу не блокирует связывание Ang-1 с Tie-2."
Кроме того, настоящее изобретение включает антитела, которые блокируют или по существу ослабляют биологическую активность Ang-2 (например, Ang-2-опосредованное фосфорилирование Tie-2; Ang-2-индуцированный ангиогенез; и т.д.), но не блокируют или по существу не ослабляют соответствующую биологическую активность Ang-1 (например, Ang-1-опосредованное фосфорилирование Tie-2; Ang-1-индуцированный ангиогенез; и т.д.). Анализы и тесты, применяемые для определения того, удовлетворяет ли антитело одной или нескольким вышеперечисленным характеристикам, будет легко понятно и легко осуществимо на практике специалистами в данной области и/или может быть полностью установлено из настоящего описания. Например, экспериментальные процедуры, подробно описанные ниже, могут использоваться для определения того, связывается или нет данное антитело с Ang-2 и/или Ang-1; блокирует или нет связывание Ang-2 и/или Ang-1 с Tie-2; ингибирует или нет Ang-2- и/или Ang-1-опосредованное фосфорилирование Tie-2; и т.д.
Картирование эпитопов и связанные с этим технологии
Для скрининга на предмет поиска антител, которые связываются с конкретным эпитопом (например, тех, которые блокируют связывание IgE с его высокоаффинным рецептором), может быть осуществлен обычный анализ перекрестного блокирования, такой как тот, что описан в "Antibodies," Harlow and Lane (Cold Spring Harbor Press, Cold Spring Harb., NY). Другие методы включают сканирующий аланином мутагенез, пептидные блоты (Reineke (2004) Methods Mol Biol 248:443-63), или анализ пептидного расщепления. Кроме того, могут применяться методы, такие как вырезание эпитопов, выделение эпитопов и химическая модификация антигенов (Tomer (2000) Protein Science 9: 487-496).
Термин "эпитоп" обозначает сайт на антигене, на который отвечают B- и/или T-клетки. В-клеточные эпитопы могут быть сформированы как из последовательно расположенных аминокислот, так и из не последовательно расположенных аминокислот, сближенных с помощью третичной структуры белка. Эпитопы, сформированные из последовательно расположенных аминокислот, как правило, остаются экспонированными при денатурации растворителями, тогда как эпитопы сформированные третичной структурой, как правило, теряются при обработке денатурирующими растворителями. Эпитоп, как правило, включает, по меньшей мере, 3 и более, и более часто, по меньшей мере, 5 или 8-10 аминокислот в уникальной пространственной конформации.
Метод Профилирования с Помощью Модификаций (Modification-Assisted ProfilingЪ) (MAP), также известный как Профилирование Антител на Основе Структуры (Antigen Structure-based Antibody Profiling) (ASAP), представляет собой метод, который разделяет на категории большое количество моноклональных антител (mAb), направленных против одного и того же антигена согласно сходства профиля связывания каждого антитела с химически и ферментативно модифицированными поверхностями антигенов (США 2004/0101920). Каждая категория может отражать уникальный эпитоп или существенно отличающийся или частично перекрывающийся с эпитопом, характеризующимся другой категорией. Эта технология дает возможность быстрой фильтрации генетически идентичных антител, так что характеризация может быть сфокусирована на генетически отдаленных антителах. При применении к гибридомному скринингу, MAP может облегчать идентификацию редких гибридомных клонов, которые продуцируют mAb, обладающие целевыми характеристиками. MAP может использоваться для сортировки анти-Ang-2 антител по изобретению в группы антител, связывающихся с различными эпитопами.
Анти-Ang-2 антитела могут связываться с эпитопом внутри N-концевого домена с двойной спиралью или внутри C-концевого фибриногеноподобного домена ("FD"). В предпочтительных воплощениях настоящего изобретения, анти-Ang-2 антитела и их антиген-связывающие фрагменты связываются с эпитопом внутри FD.
Аминокислоты внутри FD Ang-2, который взаимодействует с Tie-2, были установлены с помощью анализа кристаллической структуры. See Barton et al., Nat. Struct. Mol. Biol. 13:524-532 (May 2006). Что касается антител, которые блокируют связывание Ang-2 с Tie-2, но по существу не блокируют связывание Ang-1 с Tie-2 (например, H1 H685P, см. Примеры 5 и 6 ниже), эпитоп, с которым такие антитела связываются, может включать одну или несколько аминокислот Ang-2, которые (a) взаимодействуют с Tie-2 и (b) не являются идентичными соответствующей аминокислоте в Ang-1. (см. Фигуру 1). Таким образом, эпитоп, с которым связываются такие антитела, предпочитающие Ang-2, может включать одну или несколько из следующих аминокислот hAng-2 (SEQ ID NO:518): S-417; K-432; I-434; N-467; F-469; Y-475; или S-480. Например, авторы настоящего изобретения обнаружили, что антитела, которые взаимодействуют с аминокислотами F-469, Y-475 и S-480 из Ang-2 (SEQ ID NO:518), предпочтительно взаимодействуют с Ang-2 по сравнению с Ang-1, и это предпочтительное связывание может иметь терапевтическую пользу. Таким образом, настоящее изобретение включает анти-Ang-2 антитела, которые специфично связываются с человеческим ангиопротеином-2 (hAng-2), но по существу не связываются с hAng-1, где антитела связываются с эпитопом на hAng-2 (SEQ ID NO:518), включающим аминокислоты F-469, Y-475 и S-480. Таким образом, настоящее изобретение включает анти-Ang-2 антитела, которые специфично связываются с человеческим ангиопротеином-2 (hAng-2), но по существу не связываются с hAng-1, где антитела связываются с эпитопом на hAng-2 (SEQ ID NO:518), включающим аминокислоты F-469, Y-475 и S-480.
Настоящее изобретение включает анти-Ang-2 антитела, которые связываются с тем же эпитопом, что любые специфичные типичные антитела, описанные в настоящем документе (например, H1 H685, H1 H690, H1 H691, H1H696, H1 H706, H1 M724 и/или H2M744). Аналогично, настоящее изобретение также включает анти-Ang-2 антитела, которые конкурируют за связывание с Ang-2 с любыми из специфичных типичных антител, описанных в настоящем документе (например, H1 H685, H1 H690, H1 H691, H1 H696, H1 H706, H1 M724 и/или H2M744).
Специалист с помощью обычных методов, известных из уровня техники, может легко определить, связывается ли антитело с тем же эпитопом, что и эталонное анти-Ang-2 антитело, или конкурирует за связывание с ним с эталонным анти-Ang-2 антителом. Например, для определения того, связывается ли тестируемое антитело с тем же эпитопом, что и эталонное анти-Ang-2 антитело по изобретению, эталонному антителу предоставляется возможность связывания с Ang-2-белком или пептидом при условиях насыщения. Затем оценивается способность тестируемого антитела связываться с молекулой Ang-2. Если тестируемое антитело способно связываться с Ang-2 после связывания в условиях насыщения с эталонным анти-Ang-2 антителом, то можно заключить, что тестируемое антитело связывается с эпитопом, отличным от того, с которым связывается эталонное анти-Ang-2 антитело. С другой стороны, если тестируемое антитело не способно связываться с молекулой Ang-2 после связывания в условиях насыщения эталонным анти-Ang-2 антителом, то тестируемое антитело может связываться с тем же эпитопом, с каким связывается эталонное анти-Ang-2 антитело по изобретению. Затем могут проводиться дополнительные обычные эксперименты (например, анализы пептидных мутаций и связывания) для подтверждения того, что фактически, наблюдаемое отсутствие связывания тестируемого антитела происходит благодаря связыванию с тем же эпитопом, что у эталонного антитела, или если за отсутствие наблюдаемого связывания отвечает стерическое блокирование (или другое явление). Эксперименты такого типа могут осуществляться с использованием ELISA, RIA, Biacore, проточной цитометрии или любого другого количественного или качественного анализа, доступного из уровня техники. Согласно некоторым воплощениям настоящего изобретения, два антитела связываются с одним и тем же (или с перекрывающимися) эпитопом, если например, 1-, 5-, 10-, 20- или 100-кратный избыток одного антитела ингибирует связывание другого, по меньшей мере, на 50%, но предпочтительно на 75%, 90% или даже 99% по измерениям в конкурентном анализе связывания (см., например, Junghans et al., Cancer Res. 1990:50:1495-1502). Альтернативно, считается, что два антитела связываются с одним и тем же эпитопом, если по существу все аминокислотные мутации в антигене, которые уменьшают или исключают связывание одного антитела, при этом уменьшают или исключают связывание другого. Считается, что два антитела имеют "перекрывающиеся эпитопы", если только часть аминокислотных мутаций, которые уменьшают или исключают связывание одного антитела, при этом уменьшают или исключают связывание другого.
Для определения того, конкурирует ли антитело за связывание с эталонным анти-Ang-2 антителом, осуществляют вышеописанную методологию связывания в два действия: в первом действии эталонному антителу дают возможность связаться с молекулой Ang-2 при условиях насыщения с последующей оценкой связывания тестируемого антитела с молекулой Ang-2. Во втором действии тестируемому антителу дают возможность связаться с молекулой Ang-2 при условиях насыщения с последующей оценкой связывания эталонного антитела с молекулой Ang-2. если в обоих действиях только первое антитело (насыщающее) способно к связыванию с молекулой Ang-2, то заключают, что тестируемое антитело и эталонное антитело конкурируют за связывание с Ang-2. Специалисту в данной области понятно, что антитело, которое конкурирует за связывание с эталонным антителом, необязательно может связываться с тем же эпитопом, что и эталонное антитело, но может стерически блокировать связывание эталонного антитела путем связывания с перекрывающимся или с соседним эпитопом.
Видовая селективность и видовая перекрестная реактивность
Согласно некоторым воплощениям изобретения, анти-Ang-2 антитела связываются с человеческим Ang-2, но не с Ang-2 из других видов. Альтернативно, анти-Ang-2 антитела по изобретению в некоторых воплощениях связываются с человеческим Ang-2 и с Ang-2 из одного или нескольких видов, отличных от человека. Например, Ang-2-антитела по изобретению могут связываться с человеческим Ang-2 и могут связываться или не связываться в зависимости от конкретного случая с одним или несколькими из Ang-2 мыши, крысы, морской свинки, хомяка, песчанки, свиньи, кошки, собаки, кролика, козы, овцы, коровы, лошади, верблюда, макаки-крабоеда, игрунки, макаки-резус или шимпанзе.
Иммуноконъюгаты
Изобретение охватывает анти-Ang-2 моноклональные антитела, конъюгированные с терапевтическим компонентом ("иммуноконъюгатом"), таким как цитотоксин, химиотерапевтическое лекарственное средство, иммуноподавляющее средство или радиоизотоп. Цитотоксические агенты включают любой агент, который отрицательно сказывается на клетках. Примеры подходящих цитотоксических агентов и химиотерапевтических агентов для образования иммуноконъюгатов известны из уровня техники, см., например, WO 05/103081).
Полиспецифичные антитела
Антитела по настоящему изобретению могут быть моноспецифичными, биспецифичными или полиспецифичными антителами. Полиспецифичные mAb могут быть специфичны к различным эпитопам одного полипептида-мишени или могут содержать антиген-связывающие домены для более чем одного полипептида-мишени. См., например, Tutt et al. (1991) J. Immunol. 147:60-69. Анти-Ang-2 антитела по настоящему изобретению или их части могут быть связаны или могут совместно экспрессироваться с другой функциональной молекулой, например, с другим пептидом или белком с образованием полиспецифичной молекулы. Например, антитело или его фрагмент могут быть функционально связаны (например, с помощью химической конденсации, генетической сшивки, нековалентной ассоциации или по-другому) с одним или несколькими молекулярными компонентами, такими как другое антитело или фрагмент антитела, с получением биспецифичного или полиспецифичного антитела со второй специфичностью связывания.
Типичный биспецифичный формат антител, который может использоваться в контексте настоящего изобретения, включает использование первого CH3-домена иммуноглобулина (Ig) и второго CH3-домена иммуноглобулина Ig, где первый и второй CH3-домены Ig отличаются друг от друга, по меньшей мере, одной аминокислотой и где, по меньшей мере, одно аминокислотное отличие уменьшает связывание биспецифичного антитела с Протеином A по сравнению с биспецифичным антителом, лишенным аминокислотных отличий. В одном воплощении, первый CH3-домен Ig связывается с Протеином A, и второй CH3-домен Ig содержит мутацию, которая уменьшает или исключает связывание с Протеином A, такую как модификация H95R (при нумерации экзонов IMGT; H435R при EU-нумерации). Второй CH3 может дополнительно включать модификацию Y96F (по IMGT; Y436F по EU). Дополнительные модификации, которые могут быть обнаружены внутри второго CH3, включают: D16E, L18M, N44S, K52N, V57M и V82I (по IMGT; D356E, L358M, N384S, K392N, V397M и V422I по EU) в случае антител IgGI; N44S, K52N и V82I (IMGT; N384S, K392N и V422I по EU) в случае антител IgG2; и Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (по IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q и V422I по EU) в случае антител IgG4. Вариации формата биспецифичных антител, описанного выше, предполагаются в рамках настоящего изобретения.
Терапевтический состав и введение
В изобретении предлагаются терапевтические композиции, включающие анти-Ang-2 антитела или их антиген-связывающие фрагменты по настоящему изобретению. Терапевтические композиции про настоящему изобретению могут дополнительно включать один или несколько фармацевтически приемлемых носителей, вспомогательных веществ и других агентов, которые включены в составы для обеспечения улучшенного переноса, доставки, переносимости и так далее (в настоящем документе все вместе обозначаются как "фармацевтически приемлемые носители или разбавители"). Совокупность соответствующих составов можно обнаружить в справочнике, известном всем химикам-фармацевтам: Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, PA. Эти составы включают, например, порошки, пасты, мази, гели, воски, масла, липиды, липидосодержащие (катионные или анионные) носители (такие как LIPOFECTIN™), ДНК-конъюгаты, пасты безводного всасывания, эмульсии масло-в-воде и вода-в-масле, эмульсии карбовакса (полиэтиленгликоли различной молекулярной массы), полутвердые гели и полутвердые смеси, содержащие карбовакс. См., также Powell et al. "Compendium of excipients for parenteral formulations" PDA, 1998, J Pharm Sci Technol 52:238-311.
Доза антитела может варьироваться в зависимости от возраста объекта, которому осуществляют введение, целевого заболевания, состояния, пути введения, и так далее. Предпочтительную дозу, как правило, рассчитывают согласно массе тела или области поверхности тела. Когда антитело по настоящему изобретению используют для лечения патологического состояния или заболевания, ассоциированного с активностью Ang-2 у взрослого пациента, то может быть преимущественным внутривенное введение антитела по настоящему изобретению, как правило, в однократной дозе примерно от 0,01 примерно до 20 мг/кг массы тела, более предпочтительно, примерно от 0,02 примерно до 7, примерно от 0,03 примерно до 5, или примерно от 0,05 примерно до 3 мг/кг массы тела. В зависимости от тяжести патологического состояния, может регулироваться частота и продолжительность лечения. Эффективные дозировки и графики введения Ang-2-антител могут определяться эмпирически; например, с помощью периодической оценки может отслеживаться прогресс у пациента и соответственно регулируется доза. Кроме того, межвидовое масштабирование дозировок может осуществляться с использованием методов, хорошо известных из уровня техники (например, Mordenti et al., 1991, Pharmaceut. Res. 8:1351).
Известны различные системы доставки, и они могут использоваться для введения фармацевтической композиции по изобретению, например, инкапсулирование в липосомы, микрочастицы, микрокапсулы, использование рекомбинантных клеток, способных экспрессировать мутантные вирусы, рецептор-опосредованный эндоцитоз (см., например, Wu et al. 1987, J. Biol. Chem. 262:4429-4432). Способы введения включают, в частности, внутрикожный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный, эпидуральный или пероральный пути введения. Композиция может быть введена любым стандартным путем, например, инфузией или болюсной инъекцией, абсорбцией через эпителиальные или муко-слизистые выстилки (например, пероральную слизистую, ректальную и кишечную слизистую и т.д.) и могут быть введены вместе с другими биологически активными агентами. Введение может быть системным или местным.
Фармацевтическая композиция по настоящему изобретению может быть доставлена, например, подкожно или внутривенно с использованием стандартной иглы и шприца. Кроме того, по отношению к подкожной доставке, устройство доставки с инжектором в виде ручки легко осуществляет применения в виде доставки фармацевтической композиции по настоящему изобретению. Такое устройство доставки с инжектором в виде ручки может быть использовано повторно или может быть устройством однократного использования. Повторно используемое устройство доставки с инжектором в виде ручки, как правило, применяет заменяемый картридж, который содержит фармацевтическую композицию. После того как введена вся фармацевтическая композиция внутри картриджа, и картридж пустой, то он может быть легко или удален или заменен на новый картридж, который содержит фармацевтическую композицию. Устройство доставки с инжектором в виде ручки может затем повторно использоваться. В одноразовом устройстве доставки с инжектором в виде ручки нет заменяемого картриджа. Напротив, одноразовое устройство доставки с инжектором в виде ручки, уже предварительно наполненное фармацевтической композицией, которая находится внутри емкости внутри устройства. После того как из емкости удаляется фармацевтическая композиция, то все устройство выбрасывается.
Многочисленные повторно используемые устройства доставки с инжектором в виде ручки и с автоинжектором находят применение в подкожной доставке фармацевтической композиции по настоящему изобретению. Примеры включают в частности AUTOPEN™ (Owen Mumford, Inc., Woodstock, UK), DISETRONIC™ pen (Disetronic Medical Systems, Burghdorf, Switzerland), HUMALOG MIX 75/25™ pen, HUMALOG™ pen, HUMALIN 70/30™ pen (Eli Lilly and Co., Indianapolis, IN), NOVOPEN™ I, II и III (Novo Nordisk, Copenhagen, Denmark), NOVOPEN JUNIOR™ (Novo Nordisk, Copenhagen, Denmark), BD™ pen (Becton Dickinson, Franklin Lakes, NJ), OPTIPEN™, OPTIPEN PRO™, OPTIPEN STARLET™ и OPTICLIK™ (sanofi-aventis, Frankfurt, Germany), это немногие перечисленные из известных. Примеры одноразовых устройств доставки с инжектором в виде ручки, имеющих применение в подкожной доставке фармацевтической композиции по настоящему изобретению, включают, в частности, SOLOSTAR™ pen (sanofi-aventis), the FLEXPEN™ (Novo Nordisk) и KWIKPEN™ (EIi Lilly).
Для лечения глазных нарушений антитела и антиген-связывающие фрагменты по изобретению могут вводиться, например, с помощью глазных капель, подконъюктивальной инъекции, подконъюктивального имплантата, инъекции в стекловидное тело, имплантата в стекловидном теле, субтеноновой инъекции или субтенонового имплантата.
Фармацевтическая композиция может также доставляться в везикуле, в частности, в липосоме (см. Langer 1990 Science 249:1527-1533; Treat et al. (1989) in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp. 353-365; Lopez-Berestein, там же., pp. 317-327; см., в основном там же).
В некоторых воплощениях, фармацевтическая композиция может доставляться в системе с контролируемым высвобождением. В одном воплощении, может использоваться доставка с нагнетанием насосом (см. Langer, выше; Sefton 1987 CRC Crit. Ref. Biomed. Eng, 14:201). В другом воплощении, могут использоваться полимерные материалы. Еще в одном воплощении, система с контролируемым высвобождением может помещаться поблизости от мишени композиции, таким образом требуется только часть системной дозы (см., например, Goodson, 1984, in Medical Applications of Controlled Release, выше, vol. 2, pp. 115-138).
Инъецируемые препараты могут включать дозированные формы для внутривенных, подкожных, внутрикожных и внутримышечных инъекций, капельных инфузий и т.д. Эти инъецируемые препараты могут быть получены с помощью общеизвестных методов. Например, инъецируемые препараты могут быть получены, например, с помощью растворения, суспендирования или эмульгирования антитела или его соли, описанных выше, в стерильной водной среде или в масляной среде, стандартно используемых для инъекций. В качестве водной среды для инъекций используют, например, физиологический раствор, изотонический раствор, содержащий глюкозу и другие дополнительные агенты и т.д., которые могут использоваться в комбинации с соответствующим солюбилизирующим агентом. таким как спирт (например, этанол), полиспирт (например, пропиленгликоль, полиэтиленгликоль), неионное поверхностно активное вещество [например, полисорбат 80, HCO-50 (полиоксиэтиленовый аддукт (50 моль) гидрогенизированного касторового масла)] и т.д. В качестве масляной среды применяют, например, сезамовое масло, соевое масло и т.д., которые могут использоваться в комбинации с солюбилизирующим агентом, таким как бензилбензоат, бензиловый спирт и т.д. Таким образом, получают раствор для инъекции, предпочтительно заполненный в соответствующую ампулу.
Преимущественно, фармацевтические композиции для перорального или парентерального применения, описанные выше. получают в дозированных формах с единой дозировкой, подходящей для добавления дозы активных ингредиентов. Дозированные формы в единой дозировке включают, например, таблетки, пилюли, капсулы, инъекции (ампулы), суппозитории и т.д. Содержащееся количество вышеуказанного антитела, как правило, составляет примерно от 5 примерно до 500 мг на дозированную форму в единой дозировке; особенно в форме раствора для инъекции, предпочтительно, чтобы вышеуказанное антитело содержалось в количестве примерно от 5 примерно до 100 мг и в количестве примерно от 10 примерно до 250 мг для других дозированных форм.
Терапевтические применения антител
Антитела по изобретению применяют среди прочего для лечения, предотвращения и/или ослабления любого заболевания или нарушения, ассоциированного с активностью Ang-2, включая заболевания или нарушения, ассоциированные с ангиогенезом. Антитела или антиген-связывающие участки по настоящему изобретению могут использоваться для лечения, например, первичных и/или метастазирующих опухолей, появившихся в мозге и мягких мозговых оболочках, в ротовой части глотки, легком и в бронхиальном дереве, желудочно-кишечном тракте, мужском и женском репродуктивном тракте, в мышцах, костях, коже и придатках, соединительной ткани, в селезенке, иммунной системе, в кроветворных клетках и в костном мозге, в печени и в мочевыводящем пути, и в специальных органах чувств, таких как глаза. В некоторых воплощениях, антитела и антиген-связывающие фрагменты по изобретению используются для лечения одного или нескольких из следующих раковых заболеваний: почечноклеточной карциномы, панкреатической карциномы, рака груди, рака протсаты, злокачественной глиомы, остеосаркомы, колоректального рака, злокачественной мезотелиомы, множественной миеломы, рака яичников, мелкоклеточного рака легкого, немелкоклеточного рака легкого, синовиальной карциномы, рака щитовидной железы или меланомы.
Антитела и антиген-связывающие фрагменты по настоящему изобретению также могут применяться для лечения одного или нескольких глазных нарушений. Типичные глазные нарушения, которые могут быть подвергнуты лечению с помощью антител или антиген-связывающих фрагментов по изобретению, включают, например, возрастную макулярную дегенерацию, диабетическую ретинопатию и другие глазные нарушения, ассоциированные с хороидальной неоваскуляризацией, просачивание сосудов, эдема и воспаление сетчатки. Кроме того, анти-Ang-2 антитела по изобретению могут вводиться в качестве адъюванта при глаукомной хирургии для предотвращения раннего гемо- и лимфангиогенеза и вовлечения макрофагов к фильтрационной подушке после глаукомной хирургии и для улучшения клинического результата.
В других воплощениях настоящего изобретения, антитела или антиген-связывающие фрагменты используются для лечения, гипертензии, диабета (включая инсулин-независимый сахарный диабет), псориаза, артрита (включая ревматоидный артрит), астмы, сепсиса, заболевания почек и эдемы, ассоциированной с раной, инсультом или опухолью.
Было продемонстрировано, что экспрессия Ang-2 коррелирует с тяжестью различных воспалительных и/или инфекционных заболеваний (см., например, Siner et al., 2009, Shock 31: 348-353; Yeo et al., 2008, Proc. Natl. Acad. Sci. (USA): 105: 17097-17102). Соответственно, анти-Ang-2 антитела по настоящему изобретению могут использоваться для лечения, предотвращения или ослабления одного или нескольких воспалительных или инфекционных заболеваний. Типичные инфекционные заболевания, которые могут быть подвергнуты лечению, предотвращению или ослаблению с помощью введения анти-Ang-2 антител по изобретению, включают, в частности: малярию (инфекция Plasmodium falciparum), вирусные геморрагические лихорадки (например, лихорадка денге), инфекция риккетсии, синдром токсического шока, сепсис, гепатит C, инфекция Bartonella bacilliformis, лейшманиоз, микобактериальная инфекция и инфекция вирусом Эпштейна-Барра.
Комбинированные терапии
Комбинированные терапии могут включать анти-Ang-2 антитело по изобретению и, например, другой антагонист Ang-2 (например, анти-Ang-2 антитело, пептитело (peptibody), или CovX-тело, такое как CVX-060 (см., США 7521425)). Анти-Ang-2 антитела по изобретению также могут вводиться вместе с другим антиангиогенным агентом, таким как, например, антагонист VEGF (например, VEGF-Trap, см., например, США 7087411 (также обозначенный в настоящем документе как "VEGF-ингибирующий слитый белок"), анти-VEGF антитело (например, бевацизумаб), низкомолекулярный киназный ингибитор рецептора VEGF (например, сунитиниб, соравениб или пазопаниб), анти-DLL4 антитело (например, анти-DLL4 антитело, раскрытое в США 2009/0142354, такое как REGN421) и т.д.), или вместе с антагонистом рецептора фактора эпидермального роста (EGFR) (например, анти-EGFR антитело или низкомолекулярный ингибитор активности EGFR). Другие агенты, которые могут с пользой вводиться в комбинации с анти-Ang-2 антителами по изобретению, включают ингибиторы цитокинов, включающие низкомолекулярные ингибиторы цитокинов и антитела, которые связываются с цитокинами, такими как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, IL-9, IL-11, IL-12, IL-13, IL-17, IL-18, или с их соответствующими рецепторами. Настоящее изобретение также включает терапевтическую комбинацию, включающую любое из анти-Ang-2 антител, указанных в настоящем документе, и ингибитор одного или нескольких из VEGF, DLL4, EGFR, или любого из вышеуказанных цитокинов, где ингибитор представляет собой аптамер, антисмысловую молекулу, рибозим, миРНК, пептитело, нанотело или фрагмент антитела (например, Fab-фрагмент; F(ab')2-фрагмент; Fd-фрагмент; Fv-фрагмент; scFv; dAb-фрагмент; или другие сконструированные молекулы, такие как диатела, триатела, тетратела, минитела и минимальные распознающие элементы). Анти-Ang-2 антитела по изобретению также могут вводиться в комбинации с противовирусными агентами, антибиотиками, анальгетиками, кортикостероидами и/или с NSAID. Анти-Ang-2 антитела по изобретению также могут вводиться в виде части схемы лечения, которая также включает лучевую терапию и/или стандартную химиотерапию. При объединении с одним или несколькими дополнительными агентами, анти-Ang-2 антитела по изобретению могут вводиться перед введением другого агента (других агентов), одновременно с ним (например, в том же составе или в отдельных составах), или последовательно с введением другого агента (других агентов).
Диагностические применения антител
Анти-Ang-2 антитела по настоящему изобретению также могут использоваться для детектирования и/или измерения Ang-2 в образце, например, для диагностических целей. Например, анти-Ang-2 антитело или его фрагмент может использоваться для диагностирования патологического состояния или заболевания, характеризующегося аберрантной экспрессией (например, сверх-экспрессией, низкой экспрессией, отсутствием экспрессии и т.д.) Ang-2. Типичные диагностические анализы для Ang-2 могут включать, например, контакт образца, полученного от пациента, с анти-Ang-2 антителом по изобретению, где анти-Ang-2 антитело помечено с помощью детектируемой метки или репортерной молекулы. Альтернативно, немеченое анти-Ang-2 антитело может использоваться в диагностических применениях в комбинации с вторичным антителом, которое само помечено с помощью детектируемой метки. Детектируемая метка или репортерная молекула может представлять собой радиоизотоп, такой как 3H, 14C, 32P, 35S или 125I; флуоресцентный или хемилюминесцентный компонент, такой как флуоресцеина изотиоцианат, или родамин; или фермент, такой как щелочная фосфатаза, β-галактозидаза, пероксидаза хрена или люцифераза. Конкретные типичные анализы, которые могут использоваться для детектирования или измерения Ang-2 в образце, включают твердофазный иммуноферментный анализ (ELISA), радиоиммуноанализ (RIA), анализ с использованием клеточного сортера с активацией флуоресценции (FACS).
ПРИМЕРЫ
Следующие примеры использованы с тем, чтобы обеспечить специалиста в данной области полным раскрытием и описанием того, как сделать или применить способы и композиции по изобретению, и не предназначены для ограничения рамок того, что авторы рассматривают как свое изобретение. Были предприняты усилия для обеспечения точности в отношении используемых чисел (например, количеств, температуры и т.д.), но некоторые экспериментальные ошибки и отклонения должны быть приняты во внимание. Если не указано иное, части являются массовыми частями, молекулярная масса является среднемассовой молекулярной массой, температура представлена в градусах Цельсия, а давление является атмосферным или близким к нему.
Пример 1. Генерирование человеческих антител к человеческому Ang-2
Человеческий Ang-2-антиген вводили непосредственно, с адъювантом для стимуляции иммунной системы, мыши VELOCIMMUNE®, содержащей ДНК, кодирующую вариабельные участки тяжелой и легкой каппа-цепи иммуноглобулина человека. Антительный иммунный ответ отслеживали с помощью Ang-2-специфичного иммуноанализа. Когда достигали целевого иммунного ответа, спленоциты собирали и сливали с мышиными миеломными клетками для сохранения их жизнеспособности и образования гибридомных клеточных линий. Гибридомные клеточные линии скринировали и селектировали для идентификации клеточных линий, которые продуцируют Ang-2-специфичные антитела. С использованием данного метода было получено несколько анти-Ang-2 химерных антител (т.e., антител, обладающих человеческими вариабельными доменами и мышиными константными доменами); типичные антитела, генерированные таким способом, обозначали следующим образом: H1 M724, H1 M727, H1 M728, H2M730, H1 M732, H1 M737, H2M742, H2M743, H2M744, H1 M749, H2M750 и H1 M810.
Анти-Ang-2 антитела также выделяли непосредственно из антиген-положительных B-клеток без слияния с миеломными клетками, как описано в США 2007/0280945A1. С использованием данного метода было получено несколько человеческих анти-Ang-2 антител (т.e., антител, обладающих человеческими вариабельными доменами и человеческими константными доменами); типичные антитела, генерированные таким способом, обозначали следующим образом; H1 H685, H1 H690, H1 H691, H1 H693, H1 H694, H1 H695, H1 H696, H1 H704, H1 H706 и H1 H707.
Биологические свойства типичных анти-Ang-2 антител, генерированных согласно методам данного Примера, подробно описаны в Примерах, представленных ниже.
Пример 2. Анализ с применением вариабельного гена
Для анализа структуры полученных антител клонировали и секвенировали нуклеиновые кислоты, кодирующие вариабельные участки антител. На основании последовательности нуклеиновой кислоты и предсказанной аминокислотной последовательности антител идентифицировали применение гена для каждого вариабельного участка тяжелой цепи (HCVR) и вариабельного участка легкой цепи (LCVR) (Таблица 1).
В Таблице 2 представлены пары аминокислотных последовательностей вариабельных участков легкой цепи выбранных анти-Ang-2 антител и их соответствующие идентификаторы антител. Обозначения N, P и G обозначают антитела, содержащие тяжелые и легкие цепи с идентичными CDR-последовательностями, но с вариациями последовательности в участках, которые лежат вне CDR-последовательностей (например, в каркасных участках). Таким образом, варианты N, P и G конкретного антитела обладают идентичными CDR-последовательностями внутри их вариабельных участков тяжелой и легкой цепи, но содержат модификации внутри каркасных участков.
SEQ ID NO
SEQ ID NO
SEQ ID NO
Контрольные конструкции, используемые в следующих примерах
Различные контрольные конструкции (анти-Ang-2 антитела и анти-Ang-2 пептитела) были включены в следующие эксперименты для сравнительных целей. Контрольные конструкции обозначены следующим образом: Контроль I: человеческое анти-Ang-2 антитело, содержащее вариабельные домены тяжелой и легкой цепи, имеющие аминокислотные последовательности соответствующих доменов "Ab536(THW)", как представлено в США 2006/0018909 (см., также Oliner et al., 2004, Cancer Cell 6:507-516); Контроль II: пептитело, которое связывается с человеческим Ang-2, имеющее аминокислотную последовательность "2XCon4(C)", как представлено в США 7205275, (см., также Oliner et al., 2004, Cancer Cell 6:507-516); Контроль III: пептитело, которое связывается с человеческим Ang-2, имеющее аминокислотную последовательность "L1-7", как представлено в США 7138370; Контроль IV: человеческое анти-Ang-2 антитело, содержащее вариабельные участки тяжелой и легкой цепи, имеющие аминокислотные последовательности соответствующих доменов "3.19.3", как представлено в США 2006/0246071; и Контроль V: человеческое анти-Ang-2 антитело, содержащее вариабельные участки тяжелой и легкой цепи, имеющие аминокислотные последовательности соответствующих доменов "MEDI1/5", как представлено в WO 2009/097325. (Не все контрольные конструкции использовались в каждом Примере). В таблицах, представленных ниже, обозначения "Ab" и "Pb" включены для идентификации антительных и пептительных контролей, соответственно (т.e., Контроль I=Ab; Контроль II=Pb; Контроль III=Pb; Контроль IV=Ab; и Контроль V=Ab).
Пример 3. Определение антиген-связывающей аффинности
Константы диссоциации при равновесии (значения KD) для связывания выбранных очищенных Ang-2-антител с димерным фибриногеноподобным доменом человеческого (SEQ ID NO: 519), мышиного (Mus musculus; SEQ ID NO: 520) и обезьяньего (Macca fascicularis; SEQ ID NO: 521) Ang-2 (Ang-2FD), конъюгированного с человеческим IgG1 (SEQ ID NO:528), определяли с помощью поверхностной кинетики в режиме реального времени с использованием анализа поверхностного плазмонного резонанса с использованием биосенсора. Антитело захватывали на антительную поверхность поликлонального козьего антитела к мышиному IgG, козьего антитела к человеческому K (Southern Biotech, Birmingham, AL) или на антительную поверхность поликлонального козьего антитела к человеческому IgG (Jackson Immuno Research Lab, West Grove, PA), созданную через прямую аминоконденсацию с сенсорным чипом BIACORE™ CM5 с образованием захваченной антительной поверхности. Различные концентрации (в интервале от 50 нМ до 6,25 нМ) белка инъецировали со скоростью 100 мкл/мин поверх захваченной антительной поверхности в течение 90 секунд. Связывание и диссоциацию антигена-антитела отслеживали в режиме реального времени при комнатной температуре. Кинетический анализ осуществляли для расчета KD и периода полужизни диссоциации комплекса антиген/антитело. Результаты суммированы в Таблице 3 ниже.
Вышеописанный эксперимент повторяли с использованием выбранных очищенных анти-Ang-2 антител, клонированных на человеческих IgG1. Результаты суммированы в Таблице 4 ниже.
Дополнительные эксперименты связывания проводили с использованием выбранных анти-Ang-2 антител при двух различных температурах для дополнительной оценки межвидовой аффинности. Каждое выбранное антитело или контрольная конструкция захватывались со скоростью потока 40 мкл/мин в течение 1 минуты на антительную поверхность поликлонального козьего антитела к человеческой каппа цепи, созданной посредством непосредственной химической конденсации с чипом BIACORE™ с образованием захваченной антительной поверхности. Человеческий, обезьяний и мышиный Ang-2FD-Fc в концентрации 25 нМ или 0,78 нМ инъециовали поверх захваченной антительной поверхности со скоростью потока 60 мкл/мин в течение 3 минут, и диссоциацию антигена-антитела отслеживали в режиме реального времени в течение 20 минут или при 25°C, или при 37°C.
Результаты суммированы в Таблицах 5 (связывание при 25°C) и 6 (связывание при 37°C), представленных ниже.
Связывание при 25°C
Связывание при 37°C
В другом эксперименте определяли значения KD для выбранных очищенных антител, которые связываются с человеческим "bow-Ang-2" тетрамерной конструкцией ("hBA2") (с использованием методов, описанных выше). hBA2 состоит из двух димеров, причем каждый димер содержит два фибронектиноподобных домена Ang-2, связанных друг с другом с помощью человеческого Fc-домена. Аминокислотная последовательность димерных составляющих hBA2 представлена в SEQ ID NO:522. Результаты суммированы в Таблице 7 ниже.
Еще в одном эксперименте, определяли значения KD для выбранных очищенных антител, которые связываются с человеческим Ang-2 дикого типа (hAng-2-WT; SEQ ID NO: 518) и с фибриногеноподобным доменом человеческого Ang2 (hAng-2FD) (как описано выше). Результаты суммированы в Таблице 8 ниже.
Дополнительные эксперименты проводили для измерения свойств связывания выбранных анти-Ang-2 антител с мономерным hAng-2FD при 25°C и при 37°C. Каждое выбранное антитело или контрольная конструкция захватывались со скоростью потока 40 мкл/мин в течение 1 минуты на антительную поверхность поликлонального козьего антитела к человеческому IgG, созданной посредством непосредственной химической конденсации с чипом BIACORE™ с образованием захваченной антительной поверхности. Человеческий Ang-2FD в концентрации 500 нМ или 7,8 нМ инъециовали поверх захваченной антительной поверхности со скоростью потока 60 мкл/мин в течение 3 минут, и диссоциацию антигена-антитела отслеживали в режиме реального времени в течение 20 минут или при 25°C или при 37°C.
Результаты суммированы в Таблицах 9 (25°C) и 10 (37°C), представленных ниже. N/D=не определено.
Как продемонстрировано в данном Примере, некоторые из анти-Ang-2 антител, генерированных согласно методам Примера 1, связывались с конструкциями Ang-2 с эквивалентной или более высокой аффинностью, чем контроли. Например, антитела H1 H685, H1 H690, H1 H724 и H1 H744 связывались с димерным человеческим Ang-2-FD с KD 71,4, 79, 115 и 114 пМ, соответственно, тогда как антитело Контроль I связывалось с димерным человеческим Ang-2-FD с KD 339 пМ (см. Таблицу 4). Аналогично, антитела H1 H685, H1 H690, H1 H724 и H1 H744 связывались с человеческим BA2 (конструкция, содержащая тетрамерный фибриногеноподобный домен Ang-2) с KD 11,9, 17,9, 23,3 и 17,2 пМ, соответственно, тогда как антитело Контроль I связывалось с hBA2 с KD 83 пМ (см. Таблицу 7).
Таким образом, по сравнению с контрольными конструкциями, многие антитела по изобретению демонстрировали усиление связывания с Ang-2. Антитело H1 H685P демонстрировало свойства особенно сильного связывания с Ang-2 по сравнению с контрольными конструкциями.
Пример 4. Предпочтительное связывание с Ang-2 по сравнению с Ang-1
Эксперимент связывания (анализы плазмонного резонанса) проводили для проверки того, связываются ли выбранные антитела с обоими, Ang-2 и Ang-1, или они предпочтительно связываются только с Ang-2. Каждое выбранное антитело или контрольная конструкция захватывались со скоростью потока 40 мкл/мин в течение 1 минуты на антительную поверхность поликлонального козьего антитела к человеческому IgG, созданную посредством непосредственной химической конденсации с чипом BIACORE™ с образованием захваченной антительной поверхности. Полноразмерный человеческий Ang-1 или Ang-2 дикого типа в концентрации 25 нМ или 0,78 нМ инъецировали поверх захваченной антительной поверхности со скоростью потока 60 мкл/мин в течение 3 минут, и диссоциацию антигена-антитела отслеживали в режиме реального времени в течение 20 минут или при 25°C, или при 37°C.
Результаты данных экспериментов суммированы в Таблицах 11-14 ниже. N/D=не определено. "Нет связывания" означает, что не наблюдали детектируемого связывания в конкретных экспериментальных условиях, используемых в данных экспериментах.
Эти результаты демонстрируют, что H1 H685P является уникальным среди антител, тестированных в данном эксперименте в том, что оно связывается с высокой аффинностью с Ang-2, но не связывается с Ang-1. Другая единственная конструкция, которая демонстрирует связывание с Ang-2, но не с Ang-1, это Контроль III. Однако следует подчеркнуть, что Контроль III представляет собой пептитело и что все остальные антитела, тестированные в данном эксперименте, связывались с обоими, Ang-2 и Ang-1. Селективность в отношении связывания Ang-2 может придавать H1 H685P терапевтическую эффективность, которой не обладают антитела, которые связываются с обоими, Ang-2 и Ang-1.
Пример 5. Ингибирование связывания Ang-2 с человеческим Tie-2
Tie-2 является естественным рецептором Ang-2. Анти-Ang-2 антитела тестировали на предмет их способности блокировать связывание Ang-2 с человеческим Tie-2 (hTie-2). hTie-2-mFc (химерная конструкция, состоящая из человеческого Tie-2, конъюгированного с мышиным IgG; SEQ ID NO:525) наносили в виде покрытия на 96-луночные планшеты в концентрации 2 мкг/мл и инкубировали в течение ночи с последующим промыванием четыре раза в буфере для промывания (PBS вместе с 0,05% Tween-20). Планшет затем блокировали с помощью PBS (Irvine Scientific, Santa Ana, CA), содержащего 0,5% BSA (Sigma-Aldrich Corp., St. Louis, MO), в течение одного часа при комнатной температуре. В отдельном планшете очищенные анти-Ang-2 антитела в стартовой концентрации 50 нМ последовательно разводили в три раза в лунках планшета. Человеческий, мышиный или обезьяний белок Ang-2FD. конъюгированный с человеческим IgG (Ang-2FD-hFc), добавляли до конечной концентрации 2 нМ, 8 нМ или 2 нМ, соответственно, и инкубировали в течение одного часа при комнатной температуре.
Смесь антитело/Ang-2FD-Fc затем добавляли к планшету, содержащему hTie-2-mFc, и инкубировали в течение одного часа при комнатной температуре. Детектирование Ang-2FD-hFc, связанного с белком hTie-2-mFc, определяли с помощью Пероксидазы хрена (HRP), конъюгированной с человеческим IgG-антителом (Jackson lmmuno Research Lab, West Grove, PA), и проявляли с помощью стандартной колориметрической реакции с использованием тетраметилбензидинового (TMB) субстрата (BD Biosciences, San Jose, CA). Поглощение считывали при OD450 в течение 0,1 сек. процент блокирования связывания Ang-2FD-hFc с hTie-2-mFc с помощью 16,67 нМ выбранных анти-Ang-2 антител, представлен в Таблице 15.
Ang-2FD-hFc
Ang-2FD-hFc
Ang-2FD-hFc
В аналогичном эксперименте, выбранные очищенные анти-Ang-2 антитела, клонированные на человеческом IgG1, тестировали на предмет их способности блокировать связывание Ang-2FD с hTie-2 (как описано выше). Процент блокирования связывания Ang-2FD-hFc с hTie-2-mFc с помощью 16,67 нМ выбранных анти-Ang-2 антител, представлен в Таблице 16. NT: не тестировали.
Ang-2FD-hFc
Ang-2FD-hFc
В другом эксперименте, выбранные очищенные анти-Ang-2 антитела тестировали на предмет их способности блокировать связывание 20 пМ биотинилированного hBA2 с hTie-2 (как описано выше). Для этого эксперимента человеческий Tie-2, конъюгированный с гистидиновым тагом (hTie-2-His; SEQ ID NO:526), использовали аналогично с hTie-2-mFc, как описано выше. Концентрации антитела, начиная от 5 нМ, последовательно разводили в три раза. Значение IC50 (Ингибирующая Концентрация) генерировали путем расчета количества антитела, требуемое для блокирования 50% сигнала в результате связывания биотин-hBA2 с Tie-2. Среднее значение IC50 для каждого антитела рассчитывали на основании двух отдельных экспериментов. Результаты суммированы в Таблице 17. NB: не наблюдали блокирования при концентрации 5 нМ.
В аналогичном эксперименте, выбранные очищенные анти-Ang-2 антитела, клонированные на человеческом IgG1, тестировали на предмет их способности блокировать связывание биотинилированного hBA2 с hTie-2 (как описано выше). Результаты представлены в Таблице 18. NB: не наблюдали блокирования при концентрации 5 нМ.
Данный Пример иллюстрирует, что некоторые из анти-Ang-2 антител, генерированных согласно методам Примера 1, блокировали взаимодействие между фибриногеноподобным доменом Ang-2 и его рецептором (TIE-2) до эквивалентной или большей степени, чем у контрольного антитела. Например, каждое из антител H1 H690, H1 H691, H1 H695, H1 H696, H1 H704, H1 H706, H1 H707, H1 H724 и H1 H744 вызывало более чем 95% блокирования человеческой, мышиной и обезьяньей конструкции Ang-2FD с рецептором TIE-2, аналогично результатам, наблюдаемым для контрольных конструкций (см. Таблицу 16).
Пример 6: Ингибирование связывания полноразмерного Ang-2 и Ang-1 с человеческим Tie-2
Tie-2 является рецептором для Ang-1, также как и для Ang-2. Таким образом, в данном Примере измеряли и сравнивали способность некоторых анти-Ang-2 антител блокировать связывание Ang-2 или Ang-1 с человеческим Tie-2.
Эксперименты ELISA, представленные в данном Примере, проводили аналогично экспериментам Примера 5. Вкратце, hTie-2-mFc (химерная конструкция, состоящая из человеческого Tie-2, конъюгированного с мышиным IgG; SEQ ID NO:525) наносили в виде покрытия на 96-луночные планшеты в концентрации 2 мкг/мл и инкубировали в течение ночи с последующим промыванием четыре раза в буфере для промывания (PBS вместе с 0,05% Tween-20). Планшет затем блокировали с помощью PBS (Irvine Scientific, Santa Ana, CA), содержащего 0,5% BSA (Sigma-Aldrich Corp., St. Louis, MO), в течение одного часа при комнатной температуре. В отдельном планшете очищенные анти-Ang-2 антитела и контрольные конструкции в стартовой концентрации 300 нМ последовательно разводили в три раза в лунках планшета. Полноразмерный человеческий белок Ang-2 или Ang-1, конъюгированный с 6X гистидиновым тагом (R&D Systems, Minneapolis, MN), добавляли до конечной концентрации 0,6 нМ и инкубировали в течение одного часа при комнатной температуре. Смесь антитело/антиген затем добавляли к планшету, содержащему hTie-2-mFc, и инкубировали в течение одного часа при комнатной температуре. Детектирование Ang-2-His или Ang-1-His, связанного с белком hTie-2-mFc, определяли с помощью Пероксидазы хрена (HRP), конъюгированной с пента-His-антителом (Qiagen, Valencia, CA), и проявляли с помощью стандартной колориметрической реакции с использованием тетраметилбензидинового (TMB) субстрата (BD Biosciences, San Jose, CA).
Поглощение считывали при OD450 в течение 0,1 сек. Значение IC50 (Ингибирующая Концентрация) генерировали путем расчета количества антитела, требуемого для блокирования 50% сигнала в результате связывания человеческого Ang-2 или Ang-1 с Tie-2. Результаты, выраженные в виде IC50, представлены в Таблице 19, столбцы (1) и (2). Степень, до которой антитела или контрольные конструкции блокируют взаимодействие hAng-2/Tie-2 относительно взаимодействия hAng-1/Tie-2, отражается в кратном отличии IC50, представленных в столбце (3); то есть большее число в колонке (3) указывает на большую способность блокировать взаимодействие hAng-2/Tie-2 по сравнению с взаимодействием hAng-1/Tie-2.
Блокирование hAng-2 WT с Tie-2 IC50 (M)
Блокирование hAng-1 WT с Tie-2 IC50 (M)
Кратное различие IC50, блокирующей hAng-1, по сравнению с IC50*, блокирующей h-Ang-2
С целью дополнительной оценки способности выбранных анти-hAng-2 антител блокировать связывание Ang-1 с Tie-2, проводили эксперимент с использованием поверхностного плазмонного резонанса. В данном эксперименте конструкцию с полноразмерным внеклеточным доменом человеческого Tie-2 (hTie-2-mFc-ecto) конденсировали по N-концу на чип BIACORE™ для создания поверхности с покрытием в виде рецептора. Выбранные анти-hAng-2 антитела и контрольные конструкции в количестве 1 мкМ (100-кратный избыток по отношению к антигену) предварительно смешивали с 10 нМ hAng-1-WT, с последующей инкубацией в течение 60 минут при 25°C, чтобы дать возможность осуществления связывания антитело-антиген для достижения равновесия с образованием равновесных растворов. Равновесные растворы инъецировали над поверхностями рецептора при 5 мкл/мин в течение 5 минут при 25°C. Определяли изменения в единицах резонанса (ЕР), вызванное связыванием hAng-1-WT с hTie-2-mFc. Постороннюю конструкцию с пептителом, не связывающуюся с hAng-1, включали в такой эксперимент для установления 0% исходного блокирования, и конструкцию человеческого Tie-2-mFc использовали в качестве положительного контроля блокирования. Количество Ang-1, связанного с Tie-2 после предварительной инкубации с антителом, выраженное в проценте количества Ang-1, связанного с Tie-2 после предварительной инкубации отрицательного контроля, представлено в Таблице 20. (Большее количество связывания Ang-1 с Tie-2 означает меньшую степень блокирования антитела).
Вышеуказанный эксперимент повторяли с использованием различных количеств блокаторов Ang-2 и контролей. Конкретно, конструкцию с полноразмерным внеклеточным доменом человеческого Tie-2 (hTie-2-mFc-ecto) конденсировали по N-концу на чип BIACORE™ для создания поверхности с покрытием в виде рецептора. Выбранные анти-hAng-2 антитела и контрольные конструкции (50 или 150 нМ) смешивали с hAng-2-WT (25 нМ) с последующей инкубацией в течение 60 минут при 25°C, чтобы дать возможность связывания антитела-антигена с достижением равновесия. Равновесные растворы инъецировали над поверхностями рецептора при 10 мкл/мин в течение 5 минут при 25°C. Для оценки способности выбранных анти-hAng-2 антител блокировать связывание Ang-1-WT с hTie-2, проводили аналогичную процедуру за исключением того, что антитела тестировали при трех концентрациях (50, 100 или 1000 нМ) и инкубировали вместе с 10 нМ hAng-1-WT. Определяли изменения в единицах резонанса (ЕР), вызванное связыванием Ang-2-WT или hAng-1-WT с hTie-2-mFc. Постороннее антитело, не связывающееся ни с каким ангиопоэтином, включали в эти эксперименты для установления 0% исходного блокирования, и конструкцию человеческого Tie-2-mFc использовали в качестве положительного контроля блокирования. Результаты суммированы в Таблицах 21 (h.Ang-1 применяли к поверхности hTie-2) и 22 (hAng-2 применяли к поверхности hTie-2).
(hAng-1 WT)
(hAng-2 WT)
Результаты, полученные из этих экспериментов, согласуются с предыдущими результатами, которые продемонстрировали, что H1 H685P предпочтительно связывается с Ang-2 по сравнению с Ang-1 (см. Пример 4). Конкретно, результаты из данного Примера демонстрируют, что некоторые анти-Ang-2 антитела (например, H1H685P и H1 H706P) не блокируют в значительной степени связывание человеческого Ang-1 с человеческим Tie-2, не смотря на то, что в других экспериментах было продемонстрировано, что эти антитела существенно блокировали взаимодействие между Ang-2 и Tie-2 (см. Пример 5, Таблица 16). Кроме того, в этих экспериментах ни одна из контрольных конструкций, за исключением Контроля III, пептитела, не продемонстрировала такую же степень предпочтительного связывания/блокирования Ang-2 по сравнению с Ang-1, как и у типичных анти-Ang-2 антител по настоящему изобретению, таких как H1 H685P.
Пример 7. Ингибирование Ang-2-опосредованного фосфорилирования Tie-2 с помощью анти-Ang-2 антител
Авторы настоящего изобретения продемонстрировали, что экспрессия Ang-2 может индуцироваться в человеческих эндотелиальных клетках пупочной вены (HUVEC) с помощью транскрипционного фактора FOXO1 (Daly et al. 2006 PNAS 103:15491). Кроме того, авторы изобретения продемонстрировали, что инфекция HUVEC аденовирусом, кодирующим FOXO1, приводит в результате к экспрессии и секреции Ang-2, с последующей активацией фосфорилирования Tie-2 (Daly et al. 2006 PNAS 103:15491).
Анти-Ang-2 антитела тестировали на предмет их способности ингибировать фосфорилирование Tie-2. Вкратце, 7×105 HUVEC (Vec Technologies, Rensselaer, NY) высевали на 6 см культуральные чашки в 3,5 мл Полной среды MCDB131 (Vec Technologies, Rensselaer, NY). На следующий день клетки промывали с помощью Opti-MEM (Invitrogen Corp., Carlsbad, CA) и добавляли 2 мл Opti-MEM. Рекомбинантные аденовирусы, кодирующие или зеленый флуоресцентный белок (GFP; контроль), или человеческий FOXO1 (Daly et al. 2004 Genes Dev. 18:1060), добавляли к клеткам в концентрации 10 бое/клетку и инкубировали в течение четырех часов. Затем клетки промывали с помощью MCDB131 и добавляли 2 мл MCDB131, содержащей анти-Ang-2 антитела в концентрации 0,5 мкг/мл. Через двадцать четыре часа после инфекции клетки лизировали и подвергали Tie-2- иммунопреципитации, как описано у Daly et al., Proc. Natl. Acad. Sci. USA 103: 15491-15496 (2006). Иммуноглобулин собирали на гранулы с протеином A/G (Santa Cruz Biotechnology, Santa Cruz, CA) в течение одного часа. Гранулы промывали с помощью холодного лизирующего буфера и ресуспендировали в SDS-буфере для образца для анализа с помощью вестерн-блота с антителами, специфичными для фосфотирозина (Millipore, Billerica, MA) или Tie-2. Сигналы детектировали с использованием HRP-конъюгированных вторичных антител и реагентов ECL (GE Healthcare, Piscataway, NJ). Рентгеновскую пленку сканировали и оценивали количественно сигналы фосфо-Tie-2 и Tie-2 с использованием программного обеспечения ImageJ. Соотношения фосфо-Tie-2/Tie-2 использовали для определения % ингибирования для каждого анти-Ang-2 антитела (т.e. Процент ингибирования=Уменьшение фосфо-Tie-2/Tie-2 по сравнению с контролем). Например, считается, что уменьшение фосфорилирования Tie-2 до уровня, наблюдаемого в контрольном образце, соответствует 100% ингибированию. Относительное ингибирование (+, ++, +++) для каждого анти-Ang-2 антитела, тестированного согласно наблюдаемому проценту ингибирования (25-50%, 50-75%, 75-100%, соответственно), представлено в Таблице 23.
Как продемонстрировано в данном Примере, анти-Ang-2 антитела, генерированные согласно данным методам Примера 1, ингибировали фосфорилирование Tie-2 до большей степени, чем Контрольное антитело I. Особенно сильное ингибирование наблюдали с антителами H1 H685, H1 H690, H1 H691, H1 H693, H1 H695, H1 H696, H1 H704, H1 H706, H1 H707, H1 M724, H1 M744 и H1 M750.
Пример 8. Ингибирование Ang-1-опосредованного фосфорилирования Tie-2
Как представлено в предыдущем Примере, Ang-2 может опосредовать фосфорилирование Tie-2. Ang-1 также способен стимулировать фосфорилирование Tie-2. В настоящем Примере оценивали способность выбранных анти-Ang-2 антител блокировать Ang-1-опосредованное фосфорилирование Tie-2.
Клетки EA.hy926 (Edgell et al., Proc. Natl. Acad. Sci. USA 80:3734-3737 (1983)) высевали с плотностью 5×106 клеток на 10 см чашку в 10 мл DMEM, содержащей 10% FBS, HAT, L-глутамин и пенициллин/стрептомицин. Через 24 часа, клетки выдерживали без сыворотки в течение 1 часа в среде 10 мл DMEM + 1 мг/мл BSA. Затем клетки стимулировали в течение 10 минут с помощью 500 нг/мл рекомбинантного человеческого Ang-1 (R&D Systems) в присутствии или постороннего изотипического контрольного антитела ("9E10") в количестве 400 нМ, или в присутствии анти-Ang-2 антитела H1 H685P, или в присутствии контрольных агентов (Контроль I, Контроль II, Контроль IV или Контроль V) в концентрациях в интервале от 10 до 400 нМ.
После инкубации клетки лизировали и Tie-2 подвергали иммунопреципитации, как описано у Daly et al., Proc. Natl. Acad. Sci. USA 703:15491-15496 (2006). Иммунные комплексы собирали путем инкубации в присутствии гранул с белком A/G (Santa Cruz Biotechnology, Santa Cruz, CA) в течение 60 мин. Гранулы промывали с помощью холодного лизирующего буфера, и связанные белки элюировали путем нагревания в SDS-буфере для образцов. Затем образцы подвергали Вестерн-блот анализу с моноклональными антителами против Tie-2 или против фосфотирозина (клон 4G10, Millipore, Billerica, MA). Результаты представлены на Фигуре 2.
Сигналы детектировали с использованием HRP-конъюгированных вторичных антител и реагентов ECL (GE Healthcare, Piscataway, NJ). Рентгеновскую пленку сканировали и оценивали количественно сигналы фосфо-Tie-2 и Tie-2 с использованием программного обеспечения ImageJ. Соотношения фосфо-Tie-2/Tie-2 использовали для определения % ингибирования для каждого антитела или пептитела. Процент ингибирования=уменьшение фосфо-Tie-2/Tie-2 по сравнению с контрольным образцом (400 нМ изотипическое контрольное антитело).
В присутствии контрольного антитела 9E10, Ang-1 сильно активировал фосфорилирование Tie-2 (Фигура 2, панель A - сравнение дорожек 2 и 3 против дорожки 1). Все контрольные агенты, которые тестировали, значительно ингибировали фосфорилирование Tie-2 при полном ингибировании, наблюдаемом при 50 нМ для Контроля II (Фигура 2, панель B - дорожка 17), 100 нМ для Контроля IV (Фигура 2, панель A -дорожка 11) и 200 нМ для Контроля I (Фигура 2, панель B - дорожка 24) и Контроль V (Фигура 2, панель C - дорожка 9). Напротив, H1 H685P не обладало значительным ингибирующим эффектом даже при 400 нМ (Фигура 2, панель A - дорожки 4-8). Эти результаты обеспечивают дополнительное подтверждение специфичности H1 H685P для Ang-2 по сравнению с Ang-1.
Пример 9. Ингибирование опухолевого роста с помощью анти-Ang-2 антител
Влияние выбранных очищенных анти-Ang-2 антител на опухолевый рост определяли с использованием двух клеточных линий.
PC3 (клеточная линия рака простаты человека) Вкратце, 5×106 PC3 клеток в 100 мкл Matrigel с дефицитом фактора роста (BD Biosciences) инъецировали подкожно в бок 6-8-недельных самцов голых мышей NCr (Taconic, Hudson, NY). После того, как размер опухоли достигал в среднем примерно 200 мм3, мышей разделяли случайным образом по группам обработки. Мышам в каждой группе обработки вводили анти-Ang-2 антитело, Fc-белок или контрольную конструкцию в концентрации 10 мг/кг посредством внутрибрюшинной инъекции дважды в неделю в течение приблизительно трех недель (Таблица 24) или в концентрациях 2,5, 12,5, или 25 мг/кг посредством подкожной инъекции дважды в неделю в течение приблизительно трех недель (Таблица 25). Размеры опухоли измеряли дважды в неделю в течение всего хода эксперимента и массу опухоли измеряли при вырезании опухоли в заключении эксперимента. Средние значения (среднее +/- стандартное отклонение) массы опухоли и рост рассчитывали для каждой группы обработки. Процентное уменьшение массы и роста опухоли рассчитывали на основании сравнения с измерениями для белка Fc. Результаты суммированы в Таблицах 24 и 25.
(2,5 мг/кг)
(12,5 мг/кг)
(25 мг/кг)
(2,5 мг/кг)
(12,5 мг/кг)
(25 мг/кг)
Как представлено выше, антитела H1 H744N и H1 H685P демонстрировали особенно заметную противоопухолевую активность в мышиной модели опухоли PC3 по сравнению с контрольными конструкциями.
Результаты аналогичных экспериментов с использованием мышиной модели опухоли PC3 и различных экспериментальных антител (дозированных в количестве 2 мг/кг, дважды в неделю), представлены в Таблицах 26 и 27.
COLO 205 (Клеточная линия колоректальной аденокарциномы человека) Вкратце, 2×106 клеток COLO 205 в 100 мкл бессывороточной среды инъецировали подкожно в бок 6-8-недельных самцов голых мышей NCr (Taconic, Hudson, NY). После того, как размер опухоли достигал в среднем примерно 150 мм3, мышей разделяли случайным образом по группам обработки. Мышам в каждой группе обработки вводили анти-Ang-2 антитело или Fc-белок в концентрации 4 мг/кг посредством внутрибрюшинной инъекции дважды в неделю в течение приблизительно двух недель. Размеры опухоли измеряли дважды в неделю в течение всего хода эксперимента и массу опухоли измеряли при вырезании опухоли в заключении эксперимента. Средние значения (среднее +/- стандартное отклонение) массы опухоли и рост рассчитывали для каждой группы обработки. "Средн. Опухолевый Рост" характеризует средний рост с момента времени инициации обработки (когда размер опухоли был приблизительно 150 мм3). Процентное уменьшение массы и роста опухоли рассчитывали на основании сравнения с измерениями для белка Fc. Результаты суммированы в Таблице 28.
Аналогичный эксперимент проводили для оценки эффекта H1 H685P, конкретно, на опухолевый рост COLO 205. Вкратце, 2×106 клеток COLO 205 в 100 мкл бессывороточной среды имплантировали подкожно в заднюю часть правого бока 9-11-недельным самцам мышей SCID CB17. Когда размер опухоли достигал ~125 мм3, мышей разделяли случайным образом на 5 групп (n=7-8 мышей/группу) и обрабатывали дважды в неделю с помощью Fc-белка (15 мг/кг), H1 H685P (5 или 25 мг/кг) или с помощью Контроля II (5 или 25 мг/кг) в течение периода времени 19 дней. Размеры опухоли измеряли дважды в неделю в течение всего хода эксперимента и массу опухоли измеряли при вырезании опухоли по окончании эксперимента. Средние значения массы и роста опухолей с момента начала обработки рассчитывали для каждой группы. Процентное уменьшение массы опухоли и рост рассчитывали на основании сравнения с контрольной группой Fc. Результаты представлены в Таблице 29.
Также как с мышиной моделью опухоли PC3, некоторые из антител по изобретению, включающие H1 H685P, демонстрировали по существу противоопухолевые активности в мышиной модели опухоли COLO 205, которые были, по меньшей мере, эквивалентны противоопухолевым активностям, которые демонстрировали контрольные молекулы.
Пример 10. Ингибирование опухолевого роста и перфузии с помощью комбинации анти-Ang-2 антитела и ингибитора VEGF
Для определения эффекта комбинации анти-Ang-2 антитела вместе с ингибитором VEGF, оказываемого на рост ксенотрансплантатов COLO 205, 2×106 клеток имплантировали подкожно в заднюю часть правого бока 6-8-недельных самок мышей SCID. Когда опухоли достигали среднего размера ~350 мм3, мышей разделяли случайным образом на 4 группы (n=6 мышей/на группу) и обрабатывали с помощью: человеческого Fc-белка (7,5 мг/кг), H1 H685P (5 мг/кг), VEGF Trap (см. США 7087411) (2,5 мг/кг) или с помощью комбинации H1 H685P + VEGF Trap. Мыши получали в сумме 3 дозы в течение 10 дней обработки. Размер опухоли измеряли дважды в неделю в течении всего хода эксперимента. Средние значения роста опухолей с момента начала обработки (среднее значение +/- стандартное отклонение) рассчитывали для каждой группы обработки. Процентное уменьшение роста опухоли и рост рассчитывали на основании сравнения с контрольной группой Fc. Результаты представлены в Таблице 30. Следует отметить, что в группах VEGF Trap и H1 H685P + VEGF Trap средний размер опухоли был меньше к концу обработки, чем в ее начале, т.е., наблюдалась опухолевая регрессия.
Результаты данного эксперимента демонстрируют, что комбинация H1 H685P + VEGF Trap вызывает уменьшение опухолевого роста, которое выше, чем процент уменьшения опухолевого роста, вызванного каждым компонентом индивидуально.
Для обеспечения дополнительных доказательств эффективности комбинации, оценивали эффект комбинации H1H685P + VEGF Trap, оказываемый на рост опухолей MMT, 0,5×106 клеток MMT подкожно имплантировали в заднюю часть правого бока 6-8-недельных самок мышей SCID. Когда опухоли достигали среднего размера ~400 мм3, мышей разделяли случайным образом на 4 группы (n=11 мышей/на группу) и обрабатывали с помощью: человеческого Fc-белка (17,5 мг/кг), H1 H685P (12,5 мг/кг), VEGF Trap (5 мг/кг) или с помощью комбинации H1 H685P + VEGF Trap. Группы Fc и H1 H685P получали 3 дозы в течение 9 дней. Группа VEGF Trap и комбинированная группа получали 4 дозы в течение 12 дней. Размеры опухоли измеряли дважды в неделю в течение всего хода эксперимента и массу опухоли измеряли при вырезании опухоли в заключение эксперимента (из-за их большого размера опухоли из групп Fc и H1 H685P собирали за три дня до сбора опухолей из группы VEGF Trap и комбинированной группы). Средние значения (среднее +/- стандартное отклонение) роста опухоли с начала обработки и массу опухоли рассчитывали для каждой группы. Процентное уменьшение массы опухоли и рост рассчитывали на основании сравнения с контрольной группой Fc. Результаты представлены в Таблице 31.
Эти результаты подтверждают усиление эффекта ингибирования опухоли, оказываемого H1 H685P + VEGF Trap, относительно обработок одним агентом.
Для определения того, оказывает ли комбинация H1 H685P + VEGF Trap более сильный эффект на функцию опухолевых сосудов, чем индивидуальные агенты, использовали микроультразвук (система обработки изображений VisualSonics' Vevo 770) для оценки изменений опухолевой перфузии. Опухоли COLO 205 выращивали до ~125 мм3, и затем мышей обрабатывали в течение 24 часов с помощью H1 H685P, VEGF Trap или с помощью комбинации обоих агентов. После обработки, перфузию опухолевых сосудов определяли на основе извлечения плоского контрастно-усиленного ультразвукового изображения и на основе анализа кривой "wash-in", которая характеризует количество контрастного агента, входящего в опухоль. Средние значения (среднее +/- стандартное отклонение) опухолевой перфузии рассчитывали для каждой группы. Процентное уменьшение рассчитывали на основании сравнения с контрольной группой Fc. Результаты представлены в Таблице 32.
Согласно усиленному эффекту комбинированной обработки, оказываемому на перфузию, анти-CD31 окрашивание опухолевых срезов демонстрировало более сильный эффект, оказываемый комбинацией на плотность опухолевых кровеносных сосудов (данные не показаны). Повышенный эффект, оказываемый комбинацией H1 H685P + VEGF Trap на функцию опухолевой сосудистой системы, обеспечивает потенциальное объяснение повышенных эффектов комбинированной терапии, оказываемых на опухолевый рост.
Пример 11. Ингибирование опухолевого роста с помощью комбинации анти-Ang-2 антитела и химиотерапевтического агента
Для тестирования эффекта H1 H685P в комбинации с химиотерапевтическим агентом, оказываемого на опухолевый рост, 2,5×106 опухолевых клеток COLO 205 имплантировали подкожно в заднюю часть правого бока 8-9-недельных самцов мышей SCID. Когда опухоли достигали среднего размера ~150 мм3 (день 17 после имплантации), мышей разделяли случайным образом на 4 группы (n=5 мышей/на группу) и обрабатывали следующим образом: первую группу обрабатывали подкожно (sc) с помощью 15 мг/кг hFc и внутрибрюшинно (ip) с помощью носителя 5-FU; вторую группу обрабатывали подкожно (sc) с помощью 15 мг/кг H1 H685P; третью группу обрабатывали ip с помощью 75 мг/кг 5-FU; четвертую группу обрабатывали с помощью комбинации 15 мг/кг H1 H685P sc вместе с 75 мг/кг 5-FU ip. Мыши получали суммарно три обработки, которые вводили каждые 3-4 дня. Размер опухоли измеряли дважды в неделю в течении всего хода эксперимента. Средние значения (среднее +/- стандартное отклонение) роста опухоли с начала обработки и до 38 дня рассчитывали для каждой группы. Процентное уменьшение роста опухоли рассчитывали на основании сравнения с контрольной группой. Результаты представлены в Таблице 33.
Результаты данного эксперимента демонстрируют, что комбинация H1 H685P и 5-FU вызывала более сильное уменьшение опухолевого роста, чем каждый из агентов, при их индивидуальном введении.
Пример 12. Анти-Ang-2 антитела ослабляют глазной ангиогенез in vivo
В данном Примере оценивали эффекты анти-Ang-2 антител, оказываемые на васкуляризацию сетчатки в мышиной модели.
В одном наборе экспериментов использовали мышей дикого типа. В другом наборе использовали мышей, экспрессирующих человеческий Ang-2 вместо мышиного Ang-2 дикого типа (обозначенные как "мыши hu-Ang-2").
Мышам в возрасте двух дней (P2) подкожно инъецировали или с помощью контрольного Fc или с помощью выбранных анти-Ang-2 антител в дозах 12,5 мг/кг. Тремя днями позже (P5), мышат умерщвляли и глазные яблоки удаляли и фиксировали в 4% PFA в течение 30 минут. Сетчатку секционировали, окрашивали с помощью лектина-1 из Griffonia simplicifolia в течение 3 часов или в течение ночи при 4°C для визуализации сосудистой системы, и монтировали на предметные стекла. Изображения получали с использованием камеры микроскопа Nikon Eclipse 80i и анализировали с использованием программного обеспечения Adobe Photoshop CS3, Fovea 4.0 и Scion 1.63.
Измеряли области сетчатки, покрытые поверхностной сосудистой системой, и использовали для считывания активности антитела. Уменьшение размера васкулярной области у мышей, обработанных с помощью антитела, по сравнению с мышами, обработанными Fc-контролями, представлено в Таблице 34. Процент уменьшения васкулярной области отражает анти-ангиогенный эффект антитела. (N/D=не определено).
Как представлено в данном Примере, выбранные анти-Ang-2 антитела по настоящему изобретению по существу ингибировали глазной ангиогенез in vivo, таким образом отражая вероятный анти-ангиогенный потенциал этих антител в других терапевтических контекстах.
Пример 13. Аминокислоты Ang-2, важные для связывания антитела
Для дальнейшей характеризации связывания между hAng2 и анти-hAng2 mAb по изобретению, генерировали семь вариантов белков hAng2-FD-mFc, каждый из которых содержал одну точечную мутацию. Выбор аминокислот для мутации был основан на различии в последовательности между hAng-2 и hAng-1 в участке, который взаимодействует с hTie-2 (Фигура 1). Конкретно, аминокислоты внутри фибриногеноподобного домена (FD) Ang-2, которые, как считается, взаимодействуют с Tie-2, на основе анализа кристаллической структуры, но которые отличаются от соответствующих аминокислот в Ang-1, были подвергнуты индивидуальному мутагенезу до соответствующих остатков hAng-1. Результаты данного примера выявляют аминокислотные остатки hAng-2, с которыми взаимодействуют антитела, предпочитающие связывание с Ang-2. То есть, если конкретный остаток (или остатки) hAng-2 изменяют до соответствующего остатка hAng-1, и связывание антитела, предпочитающего связывание с Ang-2, по существу уменьшается, то можно заключить, что антитело взаимодействует с этим конкретным остатком(ами) hAng-2.
В данном эксперименте, каждый из семи мутантных белков hAng-2FD-mFc захватывался (-147-283 RU) на поверхность анти-мышиного-Fc, созданную посредством прямой химической конденсации с чипом BIACORE™. Затем каждое Ang-2-антитело (или пептитело, в зависимости от конкретного случая) в количестве 100 нМ инъецировали поверх захваченной поверхности белка hAng-2FD с mFc-тагом со скоростью потока 50 мкл/мин в течение 180 сек, и диссоциацию варианта hAng2-FD-mFc и антитела отслеживали в режиме реального времени в течение 20 мин при 25°C. Результаты суммированы в Таблицах 35a-35d и на Фигуре 3.
(постороннее антитело)
[2] WT=конструкция Ang-2FD-mFc дикого типа.
N/B=связывания не наблюдали.
Для целей настоящего изобретения считается, что анти-Ang-2 антитело взаимодействует с конкретным аминокислотным остатком Ang-2, в случае когда остаток подвергают мутагенезу до соответствующего остатка Ang-1, то T1/2 диссоциации составляет, по меньшей мере, в 5-раз меньше, чем T1/2 диссоциации, наблюдаемой для конструкции дикого типа, при экспериментальных условиях, используемых в данном Примере. Ввиду данного определения, антитело H1 H685P, по-видимому, является уникальным среди тестированных антител в том, что оно взаимодействует с F469, Y475 и S480. Так как H1 H685P также является уникальным из-за его сильного предпочтительного связывания с Ang-2 по сравнению с Ang-1, то можно заключить, что F469, Y475 и S480 включают эпитоп, который дает возможность иммунологического отличия Ang-2 от Ang-1. Другие антитела/пептитела, тестированные в данном эксперименте, по-видимому, взаимодействуют по большей части с одним или двумя из этих остатков; т.e., H1H744N и Контроль I взаимодействуют с Y475; Контроль III взаимодействует с Y475 и S480; и Контроль V взаимодействует с F469. Интересно, что Контроль II, который, как было продемонстрировано, блокирует связывание обоих, Ang-1 и Ang-2, с Tie-2 с равной силой, при этом не взаимодействует ни с одной из Ang-2-специфичных аминокислот, идентифицированных в данном эксперименте.
Рамки настоящего изобретения не ограничиваются конкретными воплощениями, описанными в настоящем документе. Фактически на основании приведенного выше описания специалисту в данной области будут очевидны различные модификации изобретения дополнительно к тем, что описаны в настоящем документе. Подразумевается, что такие модификации находятся в рамках прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ АНГИОПОЭТИНА-2 И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2394839C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИ-VEGF/АНТИ-ANG-2 АНТИТЕЛА | 2009 |
|
RU2542382C2 |
| НОВЫЕ БЕЛКИ, СПЕЦИФИЧЕСКИЕ В ОТНОШЕНИИ АНГИОГЕНЕЗА | 2016 |
|
RU2720688C2 |
| АНГИОПОЭТИН-2-СПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ АГЕНТЫ | 2005 |
|
RU2404992C2 |
| СПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ АГЕНТЫ ПРОТИВ В7-Н1 | 2010 |
|
RU2571204C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИ-VEGF/АНТИ-ANG-2 АНТИТЕЛА | 2014 |
|
RU2640253C2 |
| СПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ АГЕНТЫ ПРОТИВ В7-Н1 | 2010 |
|
RU2706200C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ БОЛИ | 2009 |
|
RU2522493C2 |
| Антитело против PD-1 и его применение | 2017 |
|
RU2739610C1 |
| АНТИТЕЛА ПРОТИВ АНГИОПОЭТИНА-2 ЧЕЛОВЕКА | 2009 |
|
RU2569461C2 |















































































































































































































































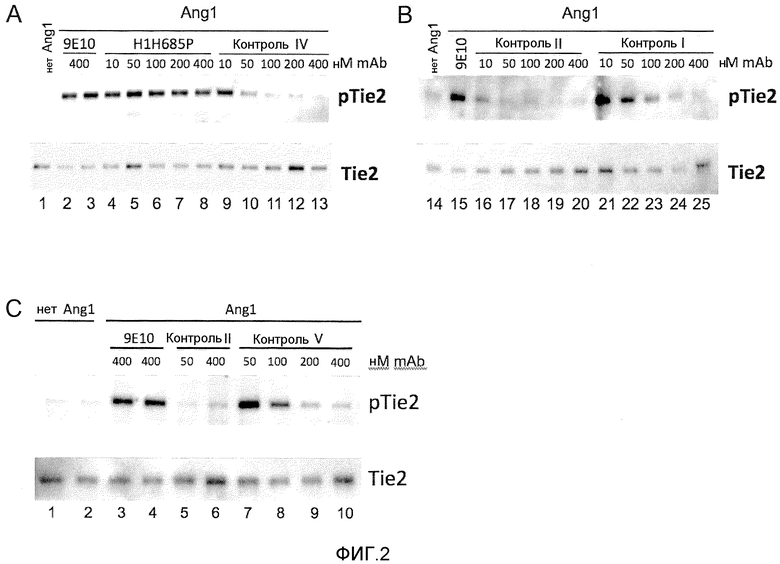
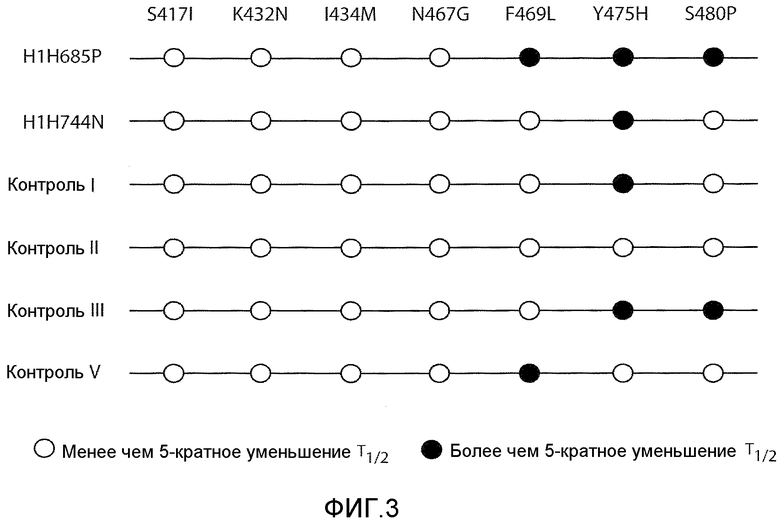
Изобретение относится к биотехнологии. Предложено выделенное человеческое антитело или его антиген-связывающий фрагмент, который специфично связывается с человеческим ангиопоэтином-2 (hAng-2), но по существу не связывается с hAng-1, характеризующееся наличием CDR вариабельной области тяжёлой и лёгкой цепи. Описана фармацевтическая композиция на основе терапевтически эффективного количества антитела. Раскрыты: варианты применения выделенного антитела или его антиген-связывающего фрагмента в производстве лекарственного средства для применения в лечении пациента, имеющего различные заболевания, включая опухоль. Описаны варианты способа лечения различных заболеваний. Использование изобретения обеспечивает антитело, высокоспецифичное к человеческому ангиопоэтину-2 (hAng-2) с константой аффинности порядка 10-11, которое по существу не связывается с hAng-1, что может найти применение в лечении различных заболеваний, связанных с повышенной активностью hAng-2. 6 н. и 13 з.п. ф-лы, 35 табл., 3 ил., 13 пр.
1. Выделенное человеческое антитело или его антиген-связывающий фрагмент, который специфично связывается с человеческим ангиопоэтином-2 (hAng-2), но по существу не связывается с hAng-1, где антитело или антиген-связывающий фрагмент включает гипервариабельные участки (CDR) вариабельного участка тяжелой цепи (HCVR), имеющего аминокислотную последовательность SEQ ID NO:18, и участки CDR вариабельного участка лёгкой цепи (LCVR), имеющего аминокислотную последовательность SEQ ID NO:20.
2. Выделенное антитело или антиген-связывающий фрагмент по п.1, где антитело или антиген-связывающий фрагмент связывается с эпитопом на hAng-2 (SEQ ID NO:518), включающим, по меньшей мере, одну аминокислоту, выбранную из F-469, Y-475 и S-480.
3. Выделенное антитело или антиген-связывающий фрагмент по п.2, где антитело или антиген-связывающий фрагмент связывается с эпитопом на hAng-2, включающим аминокислоты F-469, Y-475 и S-480.
4. Выделенное антитело или антиген-связывающий фрагмент по любому из пп.1-3, где антитело или антиген-связывающий фрагмент связывается с hAng-2 с KD, составляющей менее чем примерно 80 пМ, менее чем примерно 40 пМ, менее чем примерно 20 пМ или менее чем примерно 10 пМ согласно измерениям с помощью анализа поверхностного плазмонного резонанса.
5. Выделенное антитело или антиген-связывающий фрагмент по любому из пп.1-3, где антитело или антиген-связывающий фрагмент связывается с hAng-1 с KD, составляющей более чем примерно 1 нМ, более чем примерно 10 нМ, более чем примерно 50 нМ или более чем примерно 100 нМ согласно измерениям с помощью анализа поверхностного плазмонного резонанса.
6. Выделенное антитело или антиген-связывающий фрагмент по любому из пп.1-3, где антитело или антиген-связывающий фрагмент не демонстрирует какого-либо связывания с hAng-1 при тестировании с помощью анализа поверхностного плазмонного резонанса.
7. Выделенное антитело или антиген-связывающий фрагмент по п.2, где антитело или антиген-связывающий фрагмент: (a) связывается с эпитопом на hAng-2, включающим аминокислоты F-469, Y-475 и S-480; (b) связывается с hAng-2 с KD, составляющей менее чем примерно 80 пМ согласно измерениям с помощью анализа поверхностного плазмонного резонанса; и (c) не демонстрирует какого-либо связывания с hAng-1 при тестировании с помощью анализа поверхностного плазмонного резонанса.
8. Выделенное антитело или антиген-связывающий фрагмент по пп.1-3 или 7, где антитело или антиген-связывающий фрагмент включает CDR-1 тяжелой цепи (HCDR1), имеющий аминокислотную последовательность SEQ ID NO:4, HCDR-2, имеющий аминокислотную последовательность SEQ ID NO:6, HCDR-3, имеющий аминокислотную последовательность SEQ ID NO:8, CDR-1 легкой цепи (LCDR-1), имеющий аминокислотную последовательность SEQ ID NO:12, LCDR-2, имеющий аминокислотную последовательность SEQ ID NO:14, и LCDR-3, имеющий аминокислотную последовательность SEQ ID NO:16.
9. Выделенное антитело или антиген-связывающий фрагмент по п.8, где антитело или антиген-связывающий фрагмент включает HCVR, имеющий аминокислотную последовательность SEQ ID NO:18, и LCVR, имеющий аминокислотную последовательность SEQ ID NO:20.
10. Выделенное антитело или антиген-связывающий фрагмент по любому из пп.1-3 или 7, где антитело или антиген-связывающий фрагмент блокирует связывание hAng-2 c hTie-2, но по существу не блокирует связывание hAng-2 c hTie-2.
11. Фармацевтическая композиция, включающая терапевтически эффективное количество антитела или антиген-связывающего фрагмента по любому из пп.1-3 или 7 и фармацевтически приемлемый носитель или разбавитель, где фармацевтическая композиция применяется при лечении пациента, имеющего опухоль, гипертензию, диабет, астму, сепсис, заболевание почек, эдему или глазное заболевание, связанное с ангиогенезом.
12. Фармацевтическая композиция по п.11, дополнительно включающая антагонист фактор роста эндотелия сосудов (VEGF).
13. Фармацевтическая композиция по п.12, где антагонист VEGF выбран из анти-VEGF антитела, низкомолекулярного ингибитора киназы рецептора VEGF и VEGF-ингибирующего слитого белка.
14. Выделенное антитело или антиген-связывающий фрагмент по любому из пп.1-3 или 7 для применения в лечении пациента, имеющего опухоль.
15. Выделенное антитело или антиген-связывающий фрагмент по любому из пп.1-3 или 7 для применения в лечении пациента, имеющего гипертензию, диабет, астму, сепсис, заболевание почек, эдему или глазное заболевание, связанное с ангиогенезом.
16. Применение выделенного антитела или антиген-связывающего фрагмента по любому из пп.1-3 или 7 в производстве лекарственного средства для применения в лечении пациента, имеющего опухоль.
17. Применение выделенного антитела или антиген-связывающего фрагмента по любому из пп.1-3 или 7 в производстве лекарственного средства для применения в лечении пациента, имеющего гипертензию, диабет, астму, сепсис, заболевание почек, эдему или глазное заболевание, связанное с ангиогенезом.
18. Способ лечения опухоли, включающий введение нуждающемуся в таком лечении пациенту выделенного антитела или его антиген-связывающего фрагмента по любому из пп.1-3 или 7.
19. Способ лечения заболевания или нарушения, выбранного из гипертензии, диабета, астмы, сепсиса, заболевания почек, эдемы или глазного заболевания, включающий введение нуждающемуся в таком лечении пациенту выделенного антитела или его антиген-связывающего фрагмента по любому из пп.1-3 или 7.
| WO 2006045049 A1, 27.04.2006 | |||
| OLINER et al., "Suppression of angiogenesis and tumor growth by selective inhibition of angiopoietin-2", Cancer cell, vol.6, no.5, стр | |||
| Способ получения олифы или массы для приготовления лаков | 1913 |
|
SU507A1 |
| RU 2007127842 A, 27.01.2009 | |||
| РОЙТ и др | |||
| "Иммунология", пер | |||
| с англ.-М.: Мир, 2000, стр | |||
| Прибор, автоматически записывающий пройденный путь | 1920 |
|
SU110A1 |
Авторы
Даты
2015-03-27—Публикация
2010-07-27—Подача