Изобретение относится к биотехнологии, а именно к сублимационной сушке биологических материалов во флаконах в камерных сублимационных установках, и может найти применение в медицинской и микробиологической и фармацевтической промышленности.
Весь процесс сублимационной сушки биопрепаратов обычно разделяют на три этапа: этап замораживания биопрепарата; этап сублимации, при котором из биопрепарата путем возгонки при отрицательной температуре из биопрепарата удаляется свободная вода, и этап досушивания, проходящий при положительной температуре. На этом этапе удаляется связанная с молекулами биопрепарата вода. Процесс досушивания ведут до тех пор, пока остаточная влажность биопрепарата не достигнет величины оптимальной остаточной влажности для этого биопрепарата, которая обеспечивает наиболее длительное сохранение его активности.
Известен способ контроля и управления процессом сублимационной сушки на этапе сублимации путем изменения теплоподвода к высушиваемому материалу по сигналу датчика удельного сопротивления [1]. В этом случае с помощью двух электродов, расположенных в высушиваемом материале, измеряют удельное сопротивление материала и с помощью регулирования теплоподвода к материалу поддерживают сопротивление постоянным, предполагая, что в этом случае доля жидкой фазы в замороженном материале остается неизменной.
Недостатком способа [1] является то, что с понижением температуры удельное сопротивление материала резко возрастает до трудноизмеримых величин и управление процессом сушки становится невозможным. Другим недостатком этого способа является то, что невозможно установить однозначное соответствие между количеством жидкой фазы в замороженном материале и величиной удельного сопротивления из-за того, что на величину удельного сопротивления влияет не только количество жидкой фазы, но и концентрация растворенных в ней солей.
Наиболее близким техническим решением (прототипом) является способ контроля процессом сублимационной сушки, описанный в патенте Великобритании GB 2480299 [2]. В описываемом в [2] способе на наружную поверхность одного из флаконов с высушиваемым биопрепаратом прикрепляют электроды емкостного датчика, прикладывают к электродам переменное электрическое напряжение изменяющейся частоты и с помощью чувствительного элемента измеряют реакцию датчика в диапазоне частот 102…106 Гц. По измеренным параметрам датчика вычисляют комплексную диэлектрическую проницаемость ε* биопрепарата (подвижность электрических зарядов в биопрепарате) и по величине и скорости изменения ε* определяют текущую скорость процесса сушки и количество препарата, в котором еще не закончился процесс сублимации льда. Полученные данные позволяют управлять процессом сублимации льда и определить момент окончания этапа сублимации.
К недостаткам прототипа относятся невозможность контроля количества незамерзшей жидкой фазы в биопрепарате, что не позволяет контролировать биопрепарат на этапе замораживания и оптимальным образом проводить процесс сушки на этапе сублимации. Часто процесс сублимации ведут так, что его скорость ограничена возможностью вспенивания биопрепарата. Скорость процесса сублимации регулируется подводом тепла к дну флаконов, поэтому вблизи дна флакона температура биопрепарата максимальна, и в этом же месте вспенивание биопрепарата наиболее вероятно. Вспененный биопрепарат бракуется, поэтому контроль количества незамерзшей жидкой фазы у дна флаконов является весьма актуальной задачей. Другим недостатком способа-прототипа является невозможность контроля этим способом этапа досушивания биопрепарата с тем, чтобы завершить процесс сушки при оптимальной влажности биопрепарата, обеспечивающей его наиболее длительную сохранность его активных свойств. Эта невозможность обусловлена как способом измерения диэлектрической проницаемости биопрепарата через слой стекла флакона, которое снижает точность измерений, так и самой методикой измерения ε* с помощью генератора качающейся частоты и чувствительного элемента, которая имеет недостаточную чувствительность.
Целью предполагаемого изобретения является расширение области контроля состояния высушиваемого биопрепарата на этап замораживания, сокращение времени высушивания на этапе сублимации и определение момента времени окончания сушки на этапе досушивания.
Поставленная цель достигается тем, что контроль сушки осуществляют с помощью емкостного датчика, расположенного вместе с другими флаконами на полке сублимационной установки или в морозильной камере и заполненного высушиваемым биопрепаратом до того же уровня, что и во флаконах. Новым в предлагаемом способе является то, что в процессе замораживания и последующего высушивания измеряют частоту автогенератора, в частотозадающий контур которого включены электроды емкостного датчика, контролирующие часть биопрепарата, находящегося у его дна, а высота этой части составляет от 0,05 до 0,2 высоты биопрепарата в датчике. На этапах замораживания и сублимации по частоте автогенератора определяют величину диэлектрической проницаемости биопрепарата между электродами датчика и по ней оценивают долю жидкой фазы в замороженном биопрепарате у дна датчика. На этапе досушивания по частоте автогенератора контролируют подвижность зарядов макромолекул высушиваемого биопрепарата, что позволяет прекратить процесс досушивания в момент времени, когда частота автогенератора пройдет через максимум и начнет убывать, при этом максимум частоты автогенератора соответствует минимуму подвижности зарядов макромолекул биопрепарата и его оптимальной остаточной влажности.
Использование автогенераторного метода позволяет существенно повысить точность измерения диэлектрической проницаемости биопрепарата по сравнению с прототипом. Это связано с тем, что измерение частоты в автогенераторном методе - это подсчет импульсов в определенном временном интервале. Процесс сублимационной сушки обычно длится 1-3 суток, и интервал времени счета можно сделать весьма большим, до 103 сек, в результате чего существенно снижаются шумы при измерении частоты. Точность измерения частоты в предлагаемом способе по сравнению с прототипом повышается также из-за того, что электроды емкостного датчика расположены непосредственно в высушиваемом биопрепарате, а не снаружи флакона, как в прототипе.
Для автогенераторного метода измерений связь между частотой автогенератора емкостного датчика f и диэлектрической проницаемостью ε материала между электродами датчика дается следующей формулой:
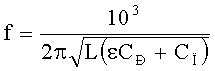
где f - частота автогенератора в МГц, L - известная индуктивность контура автогенератора в мкГн, CÐ и CÏ - известные рабочая и паразитная емкости датчика в пФ.
Предлагаемый способ основан на том, что величина диэлектрической проницаемости жидкой фазы, имеющейся в замороженном материале, практически не зависит от концентрации растворенных в ней солей, поэтому по величине диэлектрической проницаемости замороженного биопрепарата можно объективно оценивать долю жидкой фазы в нем. Для оценки доли жидкой фазы в замороженном материале обычно используют то, что диэлектрические проницаемости жидкой фазы и твердой фазы значительно отличаются и применяют теорию диэлектрической проницаемости бинарных систем, которая позволяет выразить диэлектрическую проницаемость смеси через диэлектрические проницаемости компонентов. Для диэлектрической проницаемости замороженного биопрепарата в линейном приближении можно применить формулу Зильберштейна-Ньютона [3]:
ε=ε1(1-P)+ε2P,
где ε, ε1, и ε2 - диэлектрические проницаемости замороженного препарата, льда и воды соответственно, а P - доля жидкой фазы в замороженном биопрепарате, т.е. отношение объема жидкой фазы в биопрепарате к объему биопрепарата во флаконе. Диэлектрическая проницаемость твердой фазы (льда) принималась равной 3,12, а диэлектрическая проницаемость жидкой фазы (воды) - 80. Отметим, что некоторые исследователи допускают меньшее значение для диэлектрической проницаемости воды при небольших значениях P [4]. Контроль диэлектрической проницаемости у части биопрепарата, прилегающего к дну флакона, дает возможность осуществлять контроль процесса сушки практически в течение всего этапа сублимации, а также дает возможность определить момент окончания этого этапа, т.к. после удаления замороженной фазы между электродами датчика, его емкость резко уменьшается, и частота автогенератора возрастает. Если высота части биопрепарата в датчике, в которой контролируется доля жидкой фазы, меньше 0,05 полной высоты биопрепарата в датчике, то на результаты измерений начинают влиять помехи, которые снижают точность измерений. С другой стороны, если высота части биопрепарата в датчике, в которой контролируется доля жидкой фазы, больше 0,2 полной высоты биопрепарата в датчике, то нарушается условие, что контроль биопрепарата осуществляют у дна датчика. В этом случае будет невозможно полностью контролировать процесс сублимации, т.к. фронт сублимации, движущийся сверху вниз, достигнет электродов датчика, что затруднит дальнейший контроль биопрепарата на этапе сублимации.
Отметим, что предлагаемый способ контроля позволяет, в частности, более корректно реализовать процесс проведения процесса сублимации, согласно которому для предотвращения вспенивания биопрепарата следует поддерживать постоянной некоторую долю жидкой фазы в замороженном препарате в процессе сушки, при которой еще не начинается вспенивание. В этом случае сокращается время этапа сублимации и отсутствует необходимость проводить дополнительные сушки для подбора оптимального режима сублимации.
Нами была исследована возможность использования метода диэлькометрии для контроля процесса сублимационной сушки биопрепаратов на этапе досушивания. Наши исследования показали, что на этом этапе величина диэлектрической проницаемости биопрепарата с течением времени сначала убывает, затем достигает максимума и начинает медленно возрастать. Кривая зависимости диэлектрической проницаемости от времени на этапе досушивания с минимумом наблюдалась нами всегда, когда этап сублимации был достаточно продолжительным и составлял, например, для защитной среды на основе обезжиренного молока не менее 20-25 часов. При сокращении времени сублимации (за счет повышения температуры замороженного препарата) до 10-12 часов и менее кривая с минимумом не наблюдалась, и частота с течением времени монотонно росла, постепенно приближаясь к максимальному значению.
Из полученных результатов следует, что использовать метод диэлькометрии для количественного контроля текущей влажности биопрепаратов на стадии досушивания не представляется возможным, так как кривая зависимости выходного сигнала датчика от времени сушки, а значит и от влажности, носит неоднозначный характер. Более того, форма этой кривой зависит от режима сушки биопрепарата на этапе сублимации. Тем не менее, мы считаем, что диэлькометрический метод можно использовать для определения непосредственно в процессе сушки оптимальной остаточной влажности биопрепаратов, обеспечивающей его длительное хранение. Для объяснения этой возможности мы воспользуемся подходами, разработанными в физике полимеров, где диэлькометрия и другие современные физические методы (ЯМР спектроскопия, ЭПР спектроскопия и т.д.) широко используются для изучения структуры и молекулярного движения макромолекул полимеров [5]. Так по величине диэлектрической проницаемости полимера оценивают подвижность заряженных частей молекул: рост диэлектрической проницаемости свидетельствует об усилении внутримолекулярного движения, а уменьшение - о торможении. Теперь учтем, что лиофилизированные биопрепараты представляют собой дисперсные капиллярно-пористые тела, состоящие в основном из биологических макромолекул, связанных между собой и молекулами воды различными химическими связями. В этом случае уменьшение диэлектрической проницаемости биопрепарата на начальной стадии досушивания можно объяснить тем, что на этой стадии из биопрепарата удаляется слабосвязанная вода, молекулы которой имеют большой дипольный момент, вносящая заметный вклад в суммарную диэлектрическую проницаемость биопрепарата. Кроме того, свободные молекулы воды могут играть роль смазки для биологических макромолекул, увеличивая подвижность их заряженных частей. Дальнейшее удаление влаги из биопрепарата приводит к тому, что слабо связанные молекулы воды из биопрепарата полностью удаляются, а оставшиеся молекулы воды встроены в каркас биологических макромолекул, обеспечивая их стабильность. Диэлектрическая проницаемость биопрепарата в этом случае минимальна. Дальнейшее удаление молекул воды приводит к частичному разрушению каркаса биологических макромолекул, увеличивая их подвижность их зарядов и диполей и возрастанию диэлектрической проницаемости биопрепарата. Можно предположить, что ослабление каркаса биологических макромолекул будет увеличивать скорость их деградации в процессе хранения биопрепарата. Наличие минимума внутримолекулярной подвижности макромолекул при определенной влажности биопрепарата согласуется с результатами, полученными другими авторами. Так, в [6] при исследовании подвижности протонов в системе модельные биологические макромолекулы - вода методом спинового эха ядерного магнитного резонанса (ЯМР) было показано, что при определенной степени гидратации существует минимум подвижности протонов системы.
Таким образом, мы полагаем, что чем менее подвижны макромолекулы биопрепарата, тем дольше сохраняется в нем активное начало, то наличие минимальной подвижности зарядов макромолекул, обнаруженной нами у исследуемого биопрепарата и существование диапазона оптимальных значений остаточной влажности, в границах которого наилучшим образом сохраняется активность биопрепарата, косвенно подтверждают эту гипотезу. С учетом того, что остаточная влажность биопрепарата, высушенного нами данным способом, всегда попадала в требуемый диапазон оптимальной остаточной влажности для этого биопрепарата, можно считать, что использование предлагаемого способа для определения момента окончания процесса сублимационной сушки позволяет более точно определять этот момент и, таким образом, повышает качество выпускаемых препаратов.
Для осуществления предложенного способа контроля процесса сублимационной сушки биопрепаратов во флаконах проводилась следующая последовательность операций. При расфасовке жидкого биопрепарата по флаконам емкостной датчик заполнялся биопрепаратом до того же уровня, что и в остальных флаконах и размещался вместе с ними на поддоне. Датчик представлял собой емкость, аналогичную флаконам с высушиваемым биопрепаратом, с пробкой, не которой был смонтирован автогенератор. Электроды автогенератора контролировали состояние биопрепарата от дна датчика до уровня 0,12 высоты биопрепарата в датчике. Напряжение питания на автогенератор датчика подавалось с помощью коаксиального кабеля. По этому же кабелю выходной сигнал автогенератора поступал на измеритель частоты. Время одного измерения на этапах замораживания и сублимации составляло 20 сек, а на этапе досушивания 200 сек. В процессе замораживания по описанной выше методике контролировалась доля жидкой фазы в биопрепарате. После завершения этапа замораживания поддоны перемещались в сушильную камеру сублимационной установки. На этапе сублимации также контролировалось количество жидкой фазы. Завершение этапа сублимации определяли по началу быстрого роста частоты автогенератора. Этап сублимации считался законченным, когда скорость увеличения частоты резко уменьшалась. При переходе на этап досушивания время одного измерения увеличивали до 200 сек, и продолжали регистрировать частоту автогенератора.
В качестве примеров, подтверждающих возможность осуществления предложенного способа контроля сублимационной сушки биопрепаратов на фиг.1-5 приведены результаты испытаний предлагаемого способа на всех трех этапах сублимационной сушки.
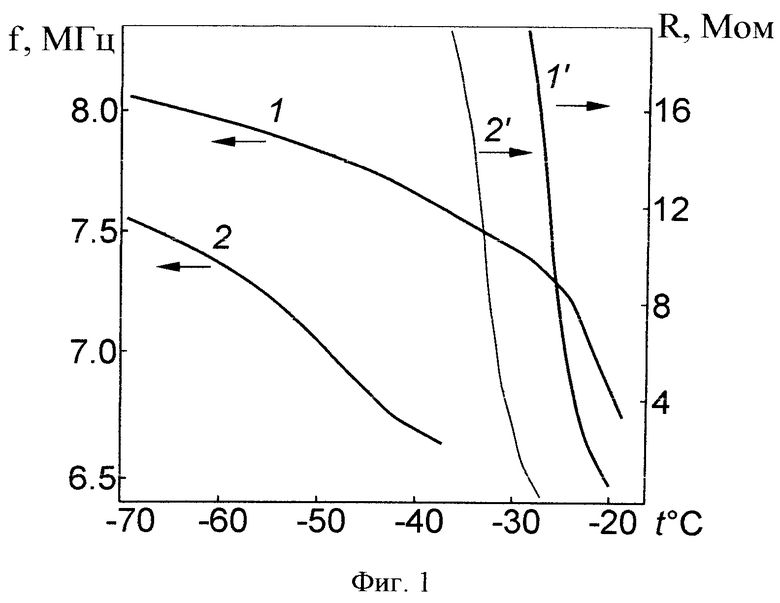
Этап замораживания. В качестве тестовых биопрепаратов на этапе замораживания использовались защитные среды на основе обезжиренного молока и на основе пептона. На фиг.1 показана зависимость частоты f автогенератора емкостного датчика (кривые 1 и 2) и сигнал R датчика удельного сопротивления (кривые 1' и 2') от температуры при оттаивании. Кривые 1 и 1' получены для датчиков, заполненных обезжиренным молоком, а кривые 2 и 2' - для датчиков, заполненных защитной средой на основе пептона. Из приведенных графиков видно, что с понижением температуры удельное сопротивление замороженных материалов резко возрастает до значений, которые трудно измерить, что ограничивает применение датчика удельного сопротивления для управления процессом сублимационной сушки. В то же время изменение сигнала емкостного датчика регистрируется вплоть до температуры -70°, что позволяет управлять процессом сублимации до этой температуры.
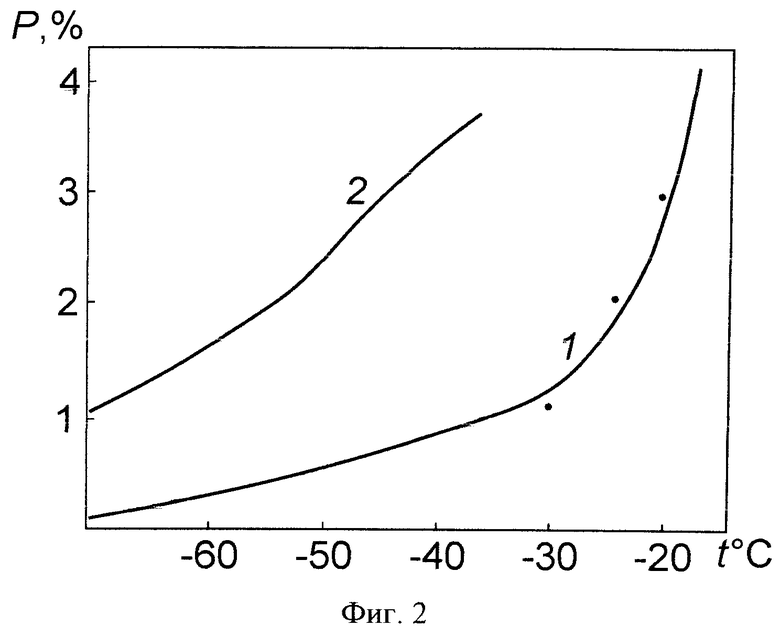
На фиг.2 показаны зависимости доли P жидкой фазы в процентах в замороженном молоке (кривая 1) и защитной среде на основе пептона (кривая 2) от температуры, рассчитанные по кривым 1 и 2 на фиг.1. Точками рядом с кривой 1 отмечены результаты, полученные в опытах по определению доли жидкой фазы в замороженном обезжиренном молоке на спектрометре ЯМР. Относительная ошибка определения доли жидкой фазы в этом случае не превышала 6%. Таким образом, по величине удельной емкости замороженного биопрепарата можно объективно оценивать количество содержащейся в нем жидкой фазы.
Этап сублимации. В качестве тестового биопрепарата на этапах сублимации и досушивания нами использовалась вакцина против Ньюкаслской болезни птиц из штамма Бор-74 ВГНКИ птиц с защитной средой на основе обезжиренного молока. Жидкая вакцина расфасовывалась по 6 мл во флаконы емкостью 20 мл. Датчик размещался на кассете вместе с флаконами и заполнялся жидкой вакциной до того же уровня, что и в остальных флаконах.
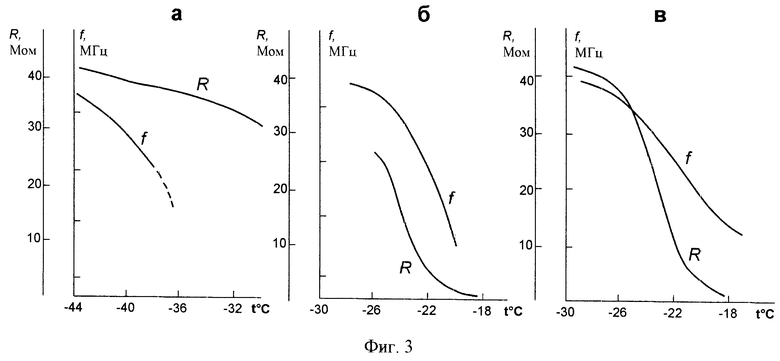
На фиг.3 показаны результаты, которые демонстрируют сравнительную чувствительность емкостного датчика и датчика удельного сопротивления к наличию жидкой фазы в различные моменты этапа сублимации. С этой целью в начале, середине и конце этапа сублимации осуществляли нагрев высушиваемого материала и регистрировали показания емкостного датчика и датчика удельного сопротивления. Первый нагрев осуществляли после 1-го часа сушки. На фиг.3a показаны зависимости частоты емкостного датчика и величины удельного сопротивления от температуры. Видно, что частота емкостного датчика понижается с ростом температуры, а затем происходит срыв генерации. В то же время величина удельного сопротивления в этом диапазоне температур изменяется незначительно. На фиг.3б и 3в показаны зависимости частоты емкостного датчика и удельного сопротивления материала от температуры, когда нагрев осуществляли после 11,5 часа и 20,3 часа сублимации соответственно. Из приведенных зависимостей видно, что и частота емкостного датчика и удельное сопротивление материала уменьшаются с ростом температуры, причем уменьшение удельного сопротивления при нагреве в конце этапа сублимации идет более быстро, чем в случае, когда нагрев осуществляли в начале этапа сублимации. Из полученных результатов следует, что чувствительность емкостного датчика и датчика удельного сопротивления разные в различные моменты этапа сублимации. В начале этапа сублимации емкостной датчик более чувствителен к появлению жидкой фазы в продукте чем датчик удельного сопротивления, в то время как в середине и в конце этапа сублимации более чувствительным становится датчик удельного сопротивления. Такую закономерность поведения показаний обоих датчиков можно объяснить тем, что в середине и конце этапа сублимации помимо льда и жидкой фазы в датчиках присутствует материал, в котором сублимация льда закончилась. Жидкая фаза может растворять этот материал, при этом ее проводимость возрастает, что приводит к росту чувствительности датчика удельного сопротивления, реагирующего на проводимость материала. В отличие от него емкостной датчик реагирует лишь на количество жидкой фазы в материале и его частота не зависит от проводимости.
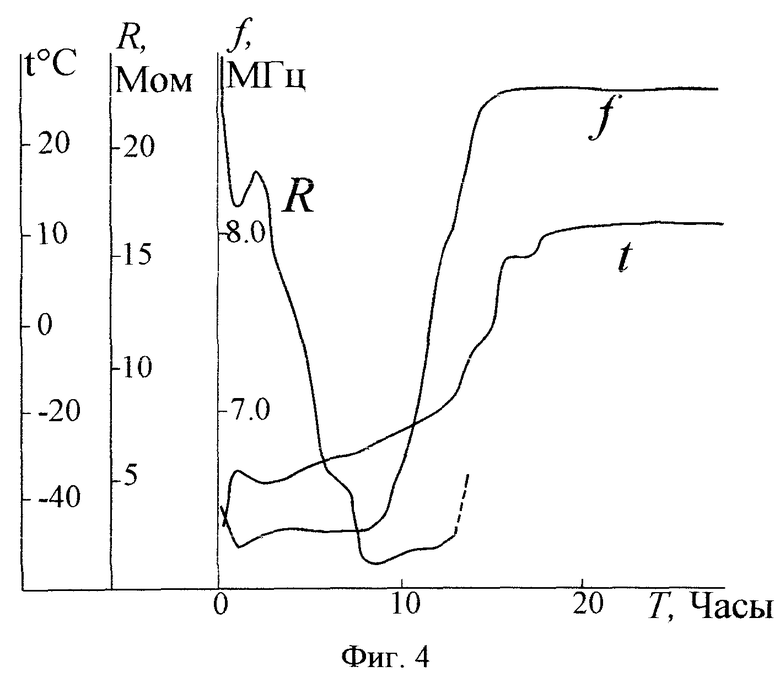
На фиг.4 приведены графики частоты f емкостного датчика, температуры t высушиваемого биопрепарата в нем и величины удельного сопротивления R препарата в зависимости от времени T с начала сушки. Управление сушкой на этапе сублимации осуществляли следующим образом. В начальный момент сушки путем изменения температуры высушиваемого биопрепарата его удельное сопротивление устанавливали равным 20 МОм и определялась частота емкостного датчика. Далее, путем изменения теплоподвода к высушиваемому материалу частота емкостного датчика поддерживалась постоянной. Заметим, что при постоянной частоте емкостного датчика удельное сопротивление высушиваемого материала уменьшается с 20 МОм в начале сушки до 0,8 МОм в конце этапа сублимации. Отметим, что как видно из фиг.4, частота f емкостного датчика резко начинает возрастать после 13-го часа сушки, что свидетельствует об окончании сублимации льда и переходу к этапу досушивания.
Сравнительные испытания предложного способа и способа-прототипа показали, что время сублимации при высушивании под контролем по предложенному способу сокращается с 27 часов у прототипа до 14 часов. Было проверено изменение активности вакцины при хранении при высушивании ее по предложенному способу и по способу-прототипу. Оказалось, что отличие в изменении активностей вакцины при хранении, высушенной по предложенному способу и способу-прототипу, статистически недостоверно.
Таким образом, предложенный способ контроля процесса сублимационной сушки позволяет расширить диапазон управления процессом сушки и уменьшить время сублимации при неизменном качестве высушиваемого продукта.
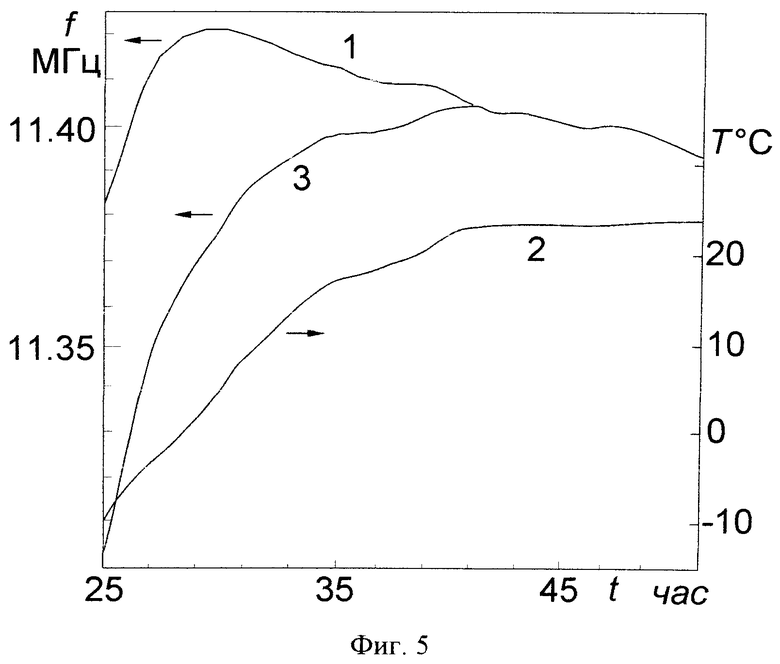
Этап досушивания. На фиг.5 показана одна из полученных нами зависимостей частоты емкостного датчика (кривая 1) и температуры препарата в нем (кривая 2) от времени начиная с 25-го часа сушки, т.е. на этапе досушивания. Из рисунка видно, что частота достигает максимума к 30-му часу сушки и затем начинает уменьшаться. Можно предположить, что спад частоты после 30-го часа сушки обусловлен влиянием температуры на параметры колебательного контура автогенератора, однако, как видно из рисунка, после 40-го часа сушки температура высушиваемого биопрепарата практически не изменяется, в то время как частота автогенератора продолжает уменьшаться. Для того, чтобы учесть влияние температуры на параметры колебательного контура автогенератора был проведен дополнительный эксперимент и найден температурный коэффициент частоты (ТКЧ) автогенератора, который оказался равным -2.4 кГц/°С. Результаты, представленные на кривой 1, были пересчитаны с учетом найденного ТКЧ. Кривая 3 на фиг.2 демонстрирует скорректированную с учетом ТКЧ зависимость частоты емкостного датчика от времени. Видно, что кривая 3 достигает максимума на 41-м часу сушки. Остаточная влажность вакцины на момент окончания сушки, который определялся по максимуму сигнала емкостного датчика, составляла 1,4%, что лежит в пределах оптимальной остаточной влажности для этой вакцины (1-3%).
Таким образом, предложенный способ позволяет контролировать состояние биопрепарата на всех этапах сублимационной сушки, сократить продолжительность этапа сублимации и определить время окончания сушки на этапе досушивания, т.е. время, когда остаточная влажность биопрепарата достигнет оптимального значения.
Источники информации
1. Патент ФРГ №1178787 кл. 82а - 1/05, 1965 г.
2. Патент Великобритании GB 2480299 МКИ G01N 27/22 2006 г. (прототип).
3. Теория и практика экспрессного контроля влажности твердых и жидких материалов. Под общ. ред. Е.С. Кричевского. М., Энергия, 1980.
4. Эмме Ф. Диэлектрические измерения. М., Химия, 1967.
5. И.И. Перепченко. Введение в физику полимеров. М., "Химия", 1978.
6. С.И. Аксенов. "Состояние воды и ее роль в динамике биологических структур". Автореферат диссертации на соискание ученой степени доктора физико-математических наук. Издательство МГУ, 1979.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛИОФИЛЬНОЙ СУШКИ БИОПРЕПАРАТА | 1995 |
|
RU2111426C1 |
| СПОСОБ КОНСЕРВИРОВАНИЯ (СУБЛИМАЦИОННОЙ СУШКИ) ЖИДКИХ И ПАСТООБРАЗНЫХ БИОПРЕПАРАТОВ | 2009 |
|
RU2413147C1 |
| УСТРОЙСТВО ДЛЯ ВАКУУМНОЙ СУБЛИМАЦИОННОЙ СУШКИ | 2017 |
|
RU2671258C2 |
| СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИЙНОГО ПРЕПАРАТА | 2006 |
|
RU2322161C1 |
| Способ определения влажности | 1977 |
|
SU1296915A1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОГО ПРЕПАРАТА ИЗ ПРЕИМАГИНАЛЬНЫХ ФАЗ ТРУТНЕЙ | 2006 |
|
RU2312670C1 |
| СПОСОБ ЛИОФИЛЬНОЙ СУШКИ ЭРИТРОЦИТАРНОГО ДИАГНОСТИКУМА | 2011 |
|
RU2476791C1 |
| СПОСОБ ЛИОФИЛИЗАЦИИ ЭРИТРОЦИТАРНЫХ ДИАГНОСТИКУМОВ ТУЛЯРЕМИЙНЫХ | 2020 |
|
RU2749355C1 |
| СПОСОБ ВАКУУМНОГО ОБЕЗВОЖИВАНИЯ БЕЛОГО МЯСА ПТИЦЫ В УСЛОВИЯХ СОЧЕТАНИЯ ПРОЦЕССОВ ВАКУУМНОГО ИСПАРЕНИЯ И СУБЛИМАЦИИ В ЕДИНОМ ЦИКЛЕ | 2011 |
|
RU2490914C1 |
| Способ измерения влажности продуктов биосинтеза и медпрепаратов в вакууме и устройство для его осуществления | 1990 |
|
SU1744649A1 |
Изобретение относится к способам контроля процесса сублимационного высушивания медицинских, ветеринарных и других препаратов во флаконах в камерных сублимационных установках, в которых теплоподвод осуществляется к дну флаконов, и может найти применение в медицинской, микробиологической и фармацевтической промышленности. Контроль сушки осуществляют путем измерения частоты автогенератора, в частотозадающий контур которого включены электроды емкостного датчика, контролирующие часть биопрепарата, находящуюся у его дна, а высота этой части составляет от 0,05 до 0,2 высоты биопрепарата в датчике. На этапах замораживания и сублимации по частоте автогенератора определяют величину диэлектрической проницаемости биопрепарата между электродами датчика и по ней контролируют долю жидкой фазы в замороженном биопрепарате у дна. На этапе досушивания по частоте автогенератора контролируют подвижность зарядов макромолекул высушиваемого биопрепарата, что позволяет прекратить процесс досушивания в момент времени, когда частота автогенератора пройдет через максимум и начнет убывать. Максимум частоты автогенератора соответствует минимуму подвижности зарядов макромолекул биопрепарата и его оптимальной остаточной влажности. 5 ил.
Способ контроля процесса сублимационной сушки биопрепаратов во флаконах по сигналу емкостного датчика, расположенного вместе с остальными флаконами на полке сублимационной установки и заполненного биопрепаратом до того же уровня, что и в остальных флаконах, отличающийся тем, что, с целью расширения области контроля на этапы замораживания и досушивания биопрепарата, сокращения времени этапа сублимации и определения времени окончания сушки на этапе досушивания, в процессе замораживания биопрепарата и последующей его сушки измеряют частоту автогенератора, в частотозадающий контур которого включены электроды емкостного датчика, контролирующие часть биопрепарата, находящегося у его дна, а высота этой части составляет от 0,05 до 0,2 высоты биопрепарата в датчике, причем на этапах замораживания и сублимации по частоте автогенератора определяют величину диэлектрической проницаемости биопрепарата между электродами датчика, и по ней контролируют долю жидкой фазы в замороженном биопрепарате у дна датчика, а на этапе досушивания по частоте автогенератора контролируют подвижность зарядов макромолекул высушиваемого биопрепарата, что позволяет прекратить процесс досушивания в момент времени, когда частота автогенератора пройдет через максимум и начнет убывать, при этом максимум частоты автогенератора соответствует минимуму подвижности зарядов макромолекул биопрепарата и его оптимальной остаточной влажности.
| СПОСОБ ПРОИЗВОДСТВА ХОЛОДНОКАТАНОЙ НАГАРТОВАННОЙ ЛИСТОВОЙ СТАЛИ | 2012 |
|
RU2480299C1 |
| СПОСОБ ЛИОФИЛИЗАЦИОННОЙ СУШКИ ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТОВ | 2011 |
|
RU2476790C2 |
| US 20050281737 A1, 22.12.2005 | |||
| СПОСОБ СУБЛИМАЦИОННОЙ СУШКИ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1997 |
|
RU2116590C1 |
Авторы
Даты
2015-04-10—Публикация
2013-08-05—Подача