Область техники
Настоящее изобретение относится к микробиологической промышленности, в частности, к микробиологическому синтезу L-треонина с использованием бактерии вида Escherichia coli.
Уровень техники
Традиционно L-аминокислоты в промышленном масштабе получают методом ферментации с использованием штаммов микроорганизмов, выделенных из природных источников, или их мутантов с генетическими модификациями, направленными увеличение продукции L-аминокислот.
В настоящее время известны штаммы-продуценты треонина с различным уровнем продукции аминокислоты. Известен штамм Е. coli Н-8460, полученный в результате мутагенеза и последовательной селекции на резистентность к нескольким аналогам, который продуцирует 75 г/л L-треониназа 70 ч (US 5474918). Другой штамм Е. coli KYI0935, отобранный селективно, является ауксотрофом по метионину и продуцирует 100 г/л L-треонина через 77 ч культивирования при наличии метионина (0,9 г/л) в ферментационной среде (Bioscience, biotechnology, and biochemistry 61.11 (1997): 1877-1882).
Рекомбинантный штамм Е. coli MDS-205, содержащий модификации генов треонинового оперона, генов, ответственных за деградацию и транспорт L-треонина, а также геном редуцированный за счет удаления несущественных участков генома, продуцирует 40,1 г/л L-треонина (Microbial cell factories 8.1 (2009): 1-12).
Описан устойчивый к боррелидину рекомбинантный штамм Е. coli, ADM kat-13, в котором мутантный треониновый оперон в составе хромосомы находится под контролем сильного промотора ptac, функционирующего конститутивно за счет инактивации гена-репрессора lad. Штамм продуцирует 102 г/л L-треонина за 48 ч культивирования, конверсия 33,1% (US 5939307).
Описан высокопродуктиный штамм Е. coli ВКПМ В-12204, в котором гены треонинового оперона экспрессированы под сильным конститутинвым промотором, инактивирован путь синтеза ацетата и усилен транспорт глюкозы в клетку. Штамм несет десенсибилизирующую мутацию в гене thrA. В оптимальных условиях ферментации за 36 ч штамм накапливает в КЖ L-треонин до 105 г/л, при этом конверсия составляет 43%, скорость синтеза 2,91 г/л/ч (RU 2697499).
Известен штамм Е. coli ВКПМ В-13240, имеющий генотип Δtdh PH207-thrAfbrBC-TrrnB ΔlacI supE ΔpoxB-ltaE ΔsstT ΔtdcBCDE ΔytfG-Ptrc-pycA PLtetO1-rhtA ΔyifK-attL-aadA-attR и обладающий высоким уровнем продукции. При культивировании в ферментере в течение 36 часов данный штамм накапливает треонин в культуральной жидкости в концентрации свыше 100 г/л (RU 2697499).
Технической проблемой, на решение которой направлено заявляемое изобретение является, расширение арсенала штаммов Escherichia coli, способных к продукции треонина.
Раскрытие сущности изобретения
Техническим результатом является конструирование на основе бактерий Escherichia coli штамма-продуцента треонина, обладающего высокими биотехнологическими характеристиками: продукцией и конверсией глюкозы в треонин.
Технический результат достигнут тем, что получен штамм ВКПМ В-14344 продуцент незаменимой аминокислоты треонина, имеющий генотип Δtdh PH207-thrAfbrBC-TrrnB ΔlacI supE ΔpoxB-ltaE ΔsstT ΔtdcBCDE ΔytfG-Ptrc-pycA PLtetO1-rhtA ΔyifK ΔlivKHMGF ΔbrnQ ΔilvA ΔlysP ΔyjeM::PH207-thrAfbrBC-TrrnB ΔychE::Ptac-thrBC-TrrnB mmiMu[pntAB-aspC-asd-pycA-scrKYABR-gdhA-rhtA]. При культивировании в ферментере в течение 36 ч полученный штамм способен синтезировать до 110 г/л с и конверсией глюкозы в L-треонин 53%.
Краткое описание чертежей
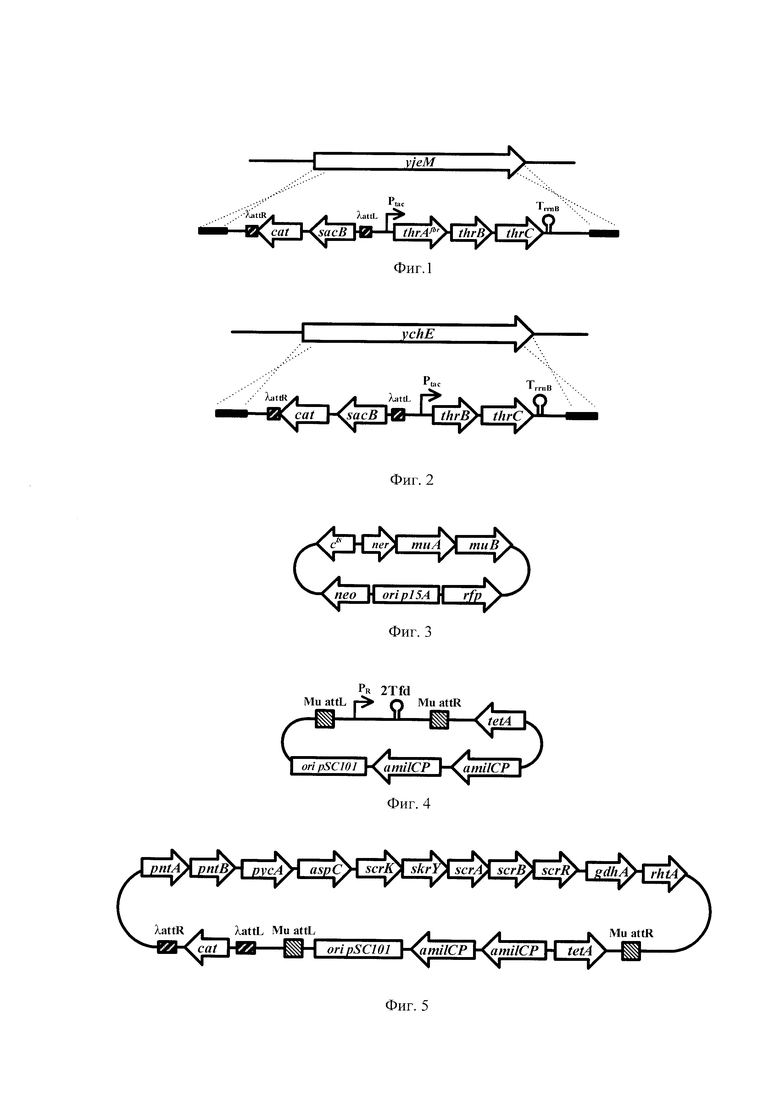
На фигуре 1 показана схема интеграции кассеты cat-sacB-Ptac-thrAfbrBC-TrrnB в локус yjeM.
На фигуре 2 показана схема интеграции кассеты cat-sacB-Ptac-thrBC-TrrnB в локус ychE.
На фигуре 3 показана схема плазмиды pMH10-rfp.
На фигуре 4 показана схема плазмиды pM17-Tc-amilCP.
На фигуре 5 показана схема плазмиды pPASPAGR.
Осуществление изобретения
Заявленный штамм получен на основе ранее созданного штамма Escherichia coli ВКПМ В-13240 в несколько этапов, путем введения направленных модификаций.
Генетические модификации бактерии Е. coli ВКПМ В-13240 осуществляют любым подходящим способом с использованием различных модельных штаммов, векторов, бактериофагов, транспозонов, хелперных и экспрессионных плазмид.
Трансформацию бактерий линейными фрагментами ДНК осуществляют с использованием штаммов с мутациями в генах рекомбинационного комплекса RecBCD (Journal of Bacteriology 171.5 (1989): 2609-2613) с последующим переносом данной делеции в штамм-хозяин методом трансдукции, или с использованием гомологичной системы рекомбинации бактериофага λ (λRed). Гены Red-системы рекомбинации фага λ системы экспрессируют в хромосоме штамма-реципиента или в составе автономных хелперных плазмид, например, pKD46, pDL17, pCD31 (Proceedings of the National Academy of Sciences 97.12 (2000): 6640-6645; Journal of microbiological methods 158 (2019): 86-92).
Перенос генетического материала в хромосому штамма реципиента осуществляют методом неспецифической трансдукции с использованием фагов P1, Р22, Т4 и их производных. Трансформацию бактерий осуществляют методом электропорации или химическим методом.
Генетические конструкции получают стандартными методами клонирования, методом Gap-Repair Cloning, методом OE-PCR (Overlap extension polymerase chain reaction), сборкой методом Gibson или искусственным синтезом генов. В качестве маркеров прямой селекции в генетических конструкциях используют широкий арсенал генов антибиотикорезистентности, например, гены устойчивости к ампициллину, тетрациклину, хлорамфениколу, канамицину, стрептомицину, спектиномицину, гентамицину и др. Репортерные флуоресцентные белки и белки биолюминесценции также применяют в качестве селективных маркеров. Для маркеров обратной селекции используют, например, гены rpsL, sacB {Bacillus subtillis) или систему негативной селеции VL-cat // PRM-cI hok (Nucleic Acids Research 50.15 (2022): 8947-8960). Для вырезания селективных маркеров из хромосомы кодирующие их гены фланкируют сайтами узнавания рекомбиназ, например, FRT-сайтамами рекомбиназы flp, att-сайты системы сайт-направленной рекомбинации фага λ (Gene 158.1 (1995): 9-14). С использованием селектиных маркеров получают конструкции для инактивации и экспрессии генов.
Термин «инактивация гена», то же что «нокаут гена», означает целенаправленную модификацию определенного гена в геноме, в результате которой в организме не синтезируется белок, кодируемый геном, или синтезируется мутантный белок со сниженной активностью, или полностью неактивный белок. Под термином «делеция гена» понимают мутацию, при которой из хромосомы исключается полная или частичная последовательность гена. Инактивацию гена выполняют путем делеции целевого гена или его части, сдвига рамки считывания данного гена или введения missense/nonsense мутации или модификации прилегающей к гену областей, которые включают последовательности, контролирующие экспрессию гена, такие как промотор(ы), энхансер(ы), аттенуатор(ы), сайт(ы) связывания рибосомы, и т.д. Инактивацию гена осуществляют любым известным способом, например, такими как мутагенез с использованием УФ излучения или мутагенных агентов, сайт-направленный мутагенез, с помощью гомологичной рекомбинации, или/и инсерционно-делеционного мутагенеза, CRISPR-Cas9 редактирования гена и др.
Задачу по повышению уровня экспрессии генов решают путем замены промотора на более сильный, амплификации гена в составе автономных плазмид, а также путем множественной интеграции гена в хромосому. Для экспрессии генов в бактериях Е. coli используют различные промоторы: собственные, фаговые, а также синтетические, гибридные промоторы, состоящие из участков различных промоторных последовательностей. В качестве промоторов могут быть использованы, например, PT7, PA1, P1(rrnB), PD/E20, PH207, PL, PN25, PA3, PL-tac, PA2, PG25, PL-trc, Ptac, Ptrc, PLtetO-1, Ptic, Ptacl1, Ptac3, PompA, PtetA, PBAD, PlacUV5, Plac, PlacL8UV5, Plpp, PnlpD. Для многокопийного встраивания фрагментов ДНК в хромосому Е. coli, применяют различные системы на основе транспозонов, например, систему, основанную на транспозоне фага Mu.
Конструирование высокопродуктивного штамма-продуцента незаменимой аминокислоты треонина проводят путем введения в геном штамма ВКПМ В-13240 (RU2697499). следующих модификаций:
- инактивация генов: livKHMGF, brnQ, ilvA, lysP, yjeM, ychE,
- введение дополнительных копий генов thrAfbrBC и thrBC под контролем сильных промоторов;
- экспрессия генов pntAB, aspC, asd, русА, gdhA, rhtA.
Показано, что именно введение указанных модификаций в хромосому позволило увеличить продуктивность штамма более, чем на 10% и конверсию на 8%.
Сочетания модификаций, использованного в заявляемом изобретении, в источниках информации нами не обнаружено.
Пример 1. Конструирование штамма Escherichia coli ВКПМ В-14344.
1.1 Инактивация генов livKHMGF
Инактивацию генов livKHMGF проводят в родительском штамме ВКПМ В-13240, в геноме которого присутствует ген устойчивости к спектиномицину aadA, фланкированный последовательностями attL- и attR-сайтами узнавания системы рекомбинации Int/Xis фага λ. С целью возможности повторного использования данного селективного маркера ген aadA удаляют из хромосомы штамма ВКПМ-13240 посредством трансформации плазмидой pINT-xis (Gene 150.1 (1994): 51-56), несущей гены системы Int/Xis фага λ. Отбор трансформантов проводят на чашках с L-агаром (мас. %: агар-агар - 2, триптон - 1, NaCl - 1, дрожжевой экстракт - 0,5, вода - остальное, рН 7,0) с добавлением ампициллина (125 мг/л) при 30°С. Три колонии рассевают на чашках с L-агаром без добавления антибиотиков, чашки инкубируют при повышенной температуре 42°С для элиминации плазмиды pINT-xis. Полученные клоны проверяют на селективных средах на потерю устойчивости к спектиномицину (75 мг/л) и ампициллину (125 мг/л). Один клон с подтвержденным генотипом и фенотипом отбирают для дальнейшей трансформации вспомогательной плазмидой pKD46 (Proceedings of the National Academy of Sciences 97.12 (2000): 6640-6645). Плазмида несет pKD46 гены Red-зависиой ситемы рекомбинации фага λ, необходимые для интеграции линейной молекулы ДНК в хромосому.
Инактивацию livKHMGF осуществляют путем делеции оперона и замены его (номер по базе данных GenBank NC_000913.3 5393437…3597560) на селективный маркер устойчивости к хлорамфениколу, ген cat, фланкированной attL- и attR-сайтами фага λ. Последовательность ДНК амплифицируют с плазмиды pICA (Applied biochemistry and microbiology 53 (2017): 859-866) с использованием следующих праймеров:
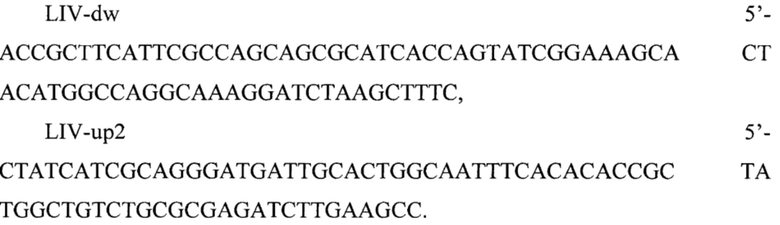
Амлифицированным продуктом ДНК трансформируют электрокомпетентные клетки родительского штамма, несущие плазмиду pKD46. Селекцию трансформантов, несущих делецию в опероне livKHMGF, проводят на чашках с L-агаром (мас. %: агар-агар - 2, триптон - 1, NaCl - 1, дрожжевой экстракт - 0,5, вода -остальное, рН 7,0) с добавлением хлорамфеникола (10 мг/л). Элиминацию вспомогательной плазмиды pKD46 проводят пересевом на чашках с L-агаром с добавлением хлорамфеникола (10 мг/л) при 42°С. Полученные колонии проверяют на чувствительность к ампициллину (125 мг/л). Маркер устойчивости к хлорамфениколу удаляют из хромосомы трансформацией плазмидой pINT-xis, несущей гены системы сайт-специфической системы Int/Xis фага λ.
1.2 Инактивация гена brnQ
Инактивацию гена brnQ получают путем замены его ORF (номер по базе данных GenBank Ь0401 NC_000913.3 419591..420910) на селективный маркер устойчивости к спектиномицину aadA, фланкированный attL- и attR-сайтами фага λ. Последовательность ДНК амплифицируют с плазмиды pISA (Journal of microbiological methods 158 (2019): 86-92) с использованием следующих праймеров:
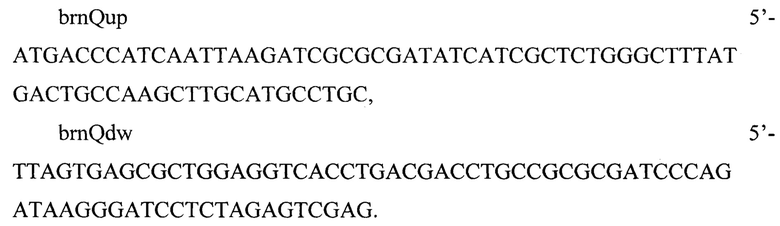
Электрокомпетентные клетки реципиента, несущего вспомогательную плазмиду pKD46, трансформируют амлифицированным ДНК продуктом. Отбор трансформантов, несущих делецию гена brnQ, проводят на чашках с L-агаром с добавлением спектиномицина (75 мг/л). Отбирают один трансформант, несущий целевую делецию. Следующим этапом удаляют селективный маркер трансформацией плазмидой pINT-xis.
1.3 Инактивация гена ilvA
Инактивацию гена ilvA (номер последовательности по базе данных GenBank Ь3772 NC_000913.3 3955331..3956875) выполняют посредством неспецифической трансдукции фагом PI vir. В качестве донора ДНК используют штамм В926 (Биотехнология 35.4 (2019): 42-54), несущий замену рамки считывания гена ilvA на ген устойчивости к спекциномицину aadA, фланкированный attL- и attR-сайтами узнавания системы рекомбинации Int/Xis фага А,. После внесения делеции в локус ilvA с целью возможности повторного использования селектиного маркера из хромосомы удаляют ген устойчивости к спекцитноцицину, посредством трансформаци хелперной плазмидой pINT-xis.
1.4 Инактивация гена lysP
Инактивацию гена lysP (номер последовательности по базе данных GenBank Ь2156 NC_000913.3 2247063..2248532) выполняют посредством неспецифической трансдукции фагом PI vir. В качестве донора ДНК используют штамм ВКПМ В-13774 (RU 2758269), несущий замену рамки считывания гена lysP на ген устойчивости к спекциномицину aadA, фланкированный attL- и attR-сайтами узнавания системы рекомбинации Int/Xis фага λ. Последующее удаление маркеров селекции из хромосомы осуществляют трансформацией штамма хелперной плазмиды pINT-xis.
1.5 Введение дополнительных копий треонинового оперона
Амплифицировать гены треонинового оперона thrABC возможно как в составе автономных плазмид, так и в хромосоме. Однако технологически применение плазмид в промышленных штаммах-продуцентах затруднительно, поэтому на данном этапе работ гены thrABC интегрируют в хромосому. В качестве локусов для интеграции выбирают гены yjeM и ychE,
В хромосоме родительского штамма ВКПМ В-13240 в ген thrA введена десенсибилизирующая мутация, снимающая ретроингибирование треонином. Из генома удалена последовательность thrL и нативный промотор треонинового оперона заменен на прототор PH207. Дополнительную, вторую, копию генов треонинового оперона интегрируют в локус yjeM (номер последовательности по базе данных GenBank b4156 NC_000913.3 4383839..4385341).
Последовательность гена yjeM амплифицируют с хромосомы штамма MG1655 с использованием праймеров
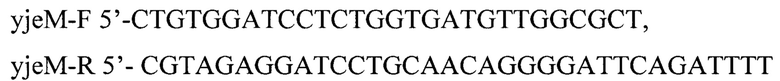
и клонируют в плазмиду pBR322, линеаризованную по BamHI. В результате получают плазмиду pBR- yjeM.
Гены треонинового оперона thrB и thrC амплифицируют с хромосомы штамма дикого типа MG1655 и клонируют в плазмиду pKK233-2 (Pharmacia, Uppsala). Заменяют промотор Ptrc на промотор Ptoc и клонируют мутантный ген thrAfbr, амплифицированный с хромосомы штамма ВКПМ В-13207 (Биотехнология, 2022, том 38. 6 (2022): 47-53). Затем клонируют ген cat, фланкированный att-сайтами фага λ, из плазмиды pMW118-λattL-CmR-λattR (Molekuliarnaia biologiia 39.5 (2005): 823-831), и ген sacB, амплифицированный с хромосомы В. subtilis 768. В результате получают плазмиду pKK-up-SC-dw-thrAtbrBC.
Из полученной плазмиды pKK-up-SC-dw-thrAfbrBC вырезают PaeI / PagI фрагмент, и лигируют с фрагментом плазмиды pBR-yjeM, расщепленной по KpnI. Таким образом конструируют плазмиду, несущую маркеры прямой и обратной селекции, гены cat и sacB, attL- и attR-сайты фага λ, гены треонинового оперона thrAtbrBC с десенсибилизирующей мутацией под промотором Ptoc, терминатор транскрипции Тгтв и области гомологии к локусу yjeM. Схема интеграции кассеты cat-sacB-Ptac-rthrAfbrBC-TrrnB в локус yjeM представлена на фиг. 1.
Генетические манипуляции по интеграции линейных фрагментов ДНК в хромососу проводят с использованием хелперной плазмиды pDL17 (Journal of microbiological methods 158 (2019): 86-92), несущей гены системы рекомбинации Red фага λ. Следующим этапом в полученном штамме заменяют индуцируемый промотор Ptac на конститутивный промотор PH207 и удаляют из хромосомы селективные маркеры, гены cat и sacB.
ДНК фрагмент, несущий промотор PH207 амплифицируют методом ПНР с хромосомы ранее ВКПМ В-13207 с использованием праймеров:
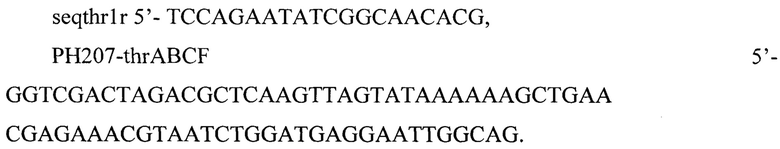
Третью копию генов thrB и thrC треонинового оперона интегрируют в локус ychE (номер последовательности по базе данных GenBank b1242 NC_000913.3 1298598..1299245).
Последовательность гена ychE амплифицируют с хромосомы штамма MG1655 с использованием праймеров

и клонируют в плазмиду pBR322, линеаризованную по BamHI. В результате получают плазмиду pBR-ychE.
Из плазмиды pKX-up-SC-dw-thrAfbrBC вырезают PaeI / PagI фрагмент, и лигируют с фрагментом плазмиды pBR-yjeM, расщепленной по MluI. Из полученной плазмиды удаляют последовательность мобильного элемента путем рестрикции по Eco72I и самолигирования, затем вырезают фрагмент AdeI /BshTI, несущий, ген thrA, Таким образом конструируют плазмиду, несущую маркеры прямой и обратной селекции, гены cat и sacB, attL- и attR-сайты фага λ, гены треонинового оперона thrB и thrC под промотором Ptac, терминатор транскрипции TrrnB и области гомологии к локусу ychE. Схема интеграции кассеты cat-sacB-Ptac-thrBC-TrrnB представлена на фиг. 2.
1.6 Получение генетических конструкций для индуцируемой экспрессии генов, контролирующих транспозицию
В плазмиду рМН10 (Biotechnology in Russia 4 (2007): 1-23) клонируют удобный фенотипический маркер rfp Discosoma coral, кодирующий красный флюоресцентный белок RFP. Ген rfp амплифицируют с плазмиды pGR-Blue (Journal of Visualized Experiments 110 (2016): e54064) (номер в коллекции Addgene Plasmid #68374) с ипользованием плаймеров:
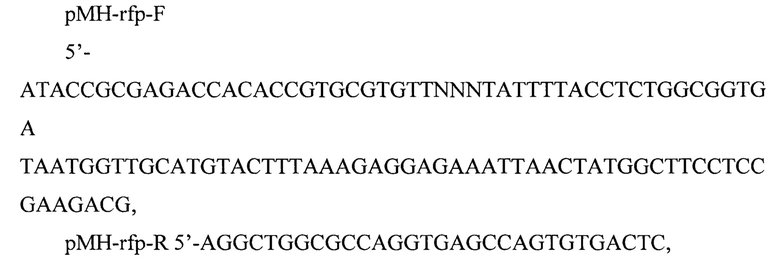
и клонируют в составе рМН10 по сайтам рестрикции Eco31I, EheI. Полученная плазмида рМН10-rfp (фиг. 3) содержит; гены muA и muB, контролирующие синтез транспозазы и кофактора транспозиции; репрессоры cts и ner; маркер устойчивости к канамицину, neo; ген rfp; ориджин репликации р15а.
1.7 Конструирование генетических конструкций способных к транспозиции в клетках Е. coli
На основе вектора рМ17 (Biotechnology in Russia 4 (2007): 1-23) получают пазмиду pM17-Tc-amilCP, которая в своем составе несет attL- и attR-сайты фага Ми; две копии гена amilCP Acropora millepora, кодирующего хромогенный белок; промотор Pr; терминатор транскрипции 2Tfd; селективный маркер tetA; ориджин репликации pSC101 (фиг. 4).
Ген tetA амлпифицируют с хромосомы штамма XL 1-Blue по следующим праймерам:
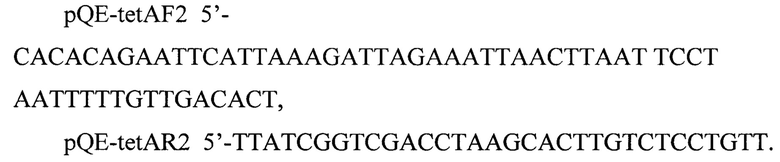
Амлифицированный фрагмент ДНК лигируют с продуктом рестрикции PvuII/EheI плазмиды рМ17. Полученную плазмиду линеаризуют по PvuI и используют в качестве вектора для клонирования amilCP. Ген amilCP амплифицируют с плазмиды pGR-Blue (номер в коллекции Addgene Plasmid #68374) с использованием следующих праймеров:


Первичный ПЦР продукт получают по праймерам TL-amylCPI, PR-amylCPI, и используют далее в качестве матрицы для амплификации по праймерам TL-amylCP2, PR-amylCP2. Последняя пара праймеров содержит сайт узнавания Pvul для клонирования в вектор. В результате проделанных работ получают плазмиду pM17-Tc-amilCP.
1.8 Экспрессия генов pntAB, aspC, asd, русА, gdhA, rhtA
Повышения продукции треонина достигают за счет модификации путей центрального метаболизма, биосинтеза треонина, пути аминирования, регенерации НАДФН и экспорта треонина. Для этих целей конструируют плазмиду pPASPAGR (фиг. 5), которая в своем составе несет интегративную кассету mmiMu[attL-cat-aUR-pntAB-aspC-asd-pycA-scrKYABR-gdhA-rhtA]. Указанная кассета включает следующие генетические элементы: ген asd, кодирующий аспартатсемиальдегиддегидрогеназу; ген ррс, кодирующий фосфоенолпируаткарбоксилазу, гетерологичный ген русА S.meliloti, кодирующий пируваткарбоксилазу; ген aspC, кодирующий аспартатаминотрансферазу; ген gdhA, кодирующий глутаматдегидрогеназу; гены pntAB, кодирующие трансгидрогеназу и ген rhtA, кодирующий основной транспортер треонина из клетки; оперон scrKYABR, который обеспечивает утилизацию сахарозы и служит фенотипическим маркером. Кроме того, в состав интегративной кассеты введен ген устойчивости к хлорамфениколу cat, фланкированный последовательностями attL- и attR-сайтами узнавания системы рекомбинации Int/Xis фага λ.
Плазмиду pPASPAGR конструируют методом Gibson assembly (Methods in enzymology. Vol. 498. Academic Press, 2011. 349-361) из нескольких фрагментов. Плазмиду pM17-Tc-amilCP, расщепленную по KpnI и Mph11031 используют в качестве вектора на следующей стадии клонирования. Вставку с маркером cat аплифицируют с плазмиды pICA по праймерам:

Вставку с геном rhtA (номер последовательности по базе данных GenBank b0813 NC_000913.3 849210..850097) аплифицируют с хромосомы штамма ВКПМ В-13207 штамма по праймерам:

Вставку pntAB-gdhA длиной 22 т.п.н., содержащую гены pntAB, gdhA, aspC, asd, scrKYABR, русА, получают из плазмиды pMW-pntAB-aspC-asd-pycA-scrKYABR-gdhA (Nucleic Acids Research 50.15 (2022): 8947-8960) рестрикцией no ScaIl.
Вставки в вектор собирают методом Gibson assembly, в результате получают плазмиду pPASPAGR.
Для интеграции кассеты mmiMu[attL-cat-attR-pntAB-aspC-asd-pycA-scrKYABR-gdhA-rhtA] в геном реципиента штамм предварительно трансформируют хелперной плазмидой pMH10-rfp. Трансформанты отбирают на L-агаре с добавлением канамицина (100 мг/л) при 30°С. Из одного трансформанта выращивают ночную культуру в среде LB (мас. %: триптон - 1, NaCl - 1, дрожжевой экстракт - 0,5, вода -остальное, рН 7,0) с добавлением канамицина (100 мг/л) при 30°С в течение 24 часов. Ночную культуру разводят в 100 раз при помощи 20 мл LB с добавлением канамицина (100 мг/л) и растят с перемешиванием при 30°С до достижения оптической плотности ОП660 0,4 ед. Затем колбу с клетками помещают на водяную качалку с установленной температурой 42°С и инкубируют 20 минут. Далее готовят электрокомпетентные клетки. Электропорацию проводят с использованием 40 мкл клеток и 100 нг плазмидной ДНК pPASPAGR. После электропорации клетки инкубируют в 1 мл среды LB в течение 20 минут при 44°С, затем 40 минут при 37°С, после чего высевают на чашки с L-агаром с добавлением хлорамфеникола (10 мг/л). Чашки инкубируют в течение суток при 37°С.
После трансформации на чашках Петри с селективным антибиотиком вырастают колонии нескольких фенотипов: красные колонии несут только хелперную плазмиду (pMHIO-rfp); синие колонии несут только матричную плазмиду (автономную pPASPAGR), красно-синие колонии несут автономно реплицирующиеся матричную и хелперную плазмиды, в белых колониях произошла интеграция и транспозиция кассеты miniMu[aUL-cat-attR-pntAB-aspC-asd-pycA-scrKYABR-gdhA-rhtA], и также они не содержат автономных матричной и хелперной плазмид.
Белые колонии отбирают и повторно рассевают на чашках Петри с L-агаром с добавлением хлорамфеникола (10 мг/л), чашки инкубируют в течение суток при 37°С. Клоны сравнивают по продукции треонина в условиях пробирочной ферментации в питательной среде на основе кукурузного экстракта (RU 2758269). Отбирают клон с наибольшей продукцией треонина и вырезают из его генома селективный маркер с использованием хелперной плазмиды pINT-xis. Удаление маркера из хромосомы подтверждают фенотипически по чувствительности к хлорамфениколу (10 мг/л).
В результате проделанных работ получают штамм с генотипом Δtdh PH207-thrAfbrBC-TrrnB ΔlacI supE ΔpoxB-ltaE ΔsstT ΔtdcBCDE ΔytfG-Ptrc-pycA PLtetO1-rhtA ΔyifK ΔlivKHMGF ΔbrnQ ΔilvA ΔlysP ΔyjeM::PH207-thrAfbrBC-TrrnB ΔychE::Ptac-thrBC-TrrnB mmiMu[pntAB-aspC-asd-pycA-scrKYABR-gdhA-rhtA] и депонируют его Биоресурсном центре Всероссийская Коллекция Промышленных Микроорганизмов (БРЦ ВКПМ) НИЦ «Курчатовский институт» под номером ВКПМ В-14344.
Пример 2. Синтез треонина штаммом ВКПМ В-14344 в ферментере Для оценки биотехнологического потенциала штамма ВКПМ В-14344 проводят ферментацию в течение 36 часов в 3 л ферментере в питательной среде на основе дрожжевого экстракта с подпиткой глюкозой В качестве контрольного штамма используют родительский штамм ВКПМ В-13240.
Для выращивания инокулята в колбах используют среду ИСК следующего состава (мас. %):

Для выращивания посевной культуры в ферментере используют среду ПСФ следующего состава (мас. %):


Для проведения основного процесса биосинтеза используют среду ОСФ следующего состава (мас. %):

Вода Остальное Значение рН всех сред до стерилизации - естественный. Глюкозу моногидрат вносят асептически в среды ПСФ и ОСФ после стерилизации сред в виде стерильного запасного раствора с концентрацией 770 г/л.
Подпитку углеводным субстратом в ходе основного процесса биосинтеза осуществляют 51,9%-ным (масс), раствором глюкозы. Все среды, подпиточный и запасной растворы стерилизуют автоклавированием при 1.0 атм в течение 30 мин. Поддержание рН среды в ходе выращивания посевной культуры и проведения основного процесса биосинтеза осуществляют 25%-ным (масс.) водным аммиаком.
Подготовку рабочего банка культуры (РБК) проводят следующим образом. Культуру клеток выращивают на чашках со средой L-агаре (мас. %: агар-агар - 2, триптон - 1, NaCl - 1, дрожжевой экстракт - 0,5, вода -остальное, рН 7,0) в течение 24 ч при 37°С.Из биомассы, выросшей на чашках, готовят клеточную суспензию в дистиллированной воде. В качалочные колбы объемом 750 мл с 15 мл среды ИСК вносят суспензию клеток до получения оптической плотности (ОП660) 0.1 ед. Колбы инкубируют на качалке при скорости 220 об./мин и температуре 37°С до достижения ОП660 5-6 ед. В полученную культуру вносят стерильный раствор глицерина с концентрацией 500 г/л до его конечной концентрации 150 г/л. Аликвоты РБК штамма-продуцента объемом 1.0 мл хранят при -70°С.
Инокулят готовят следующим образом. В качалочные колбы объемом 750 мл с 15 мл среды ИСК вносят суспензию клеток из РБК до получения ОП660 0.1 ед. Колбы инкубируют на качалке при скорости 220 об./мин и температуре 37°С до достижения ОП660 5-6 ед.
Выращивание посевной культуры проводят в 3 л ферментере КФ-103/4 (ООО-фирма «Проинтех», Пущино), оснащенном контроллером Merabit («KЕKLАВ», Москва-Пущино), системой термостатирования, перистальтическими насосами для титрования, а также датчиками контроля рН- и р02. Культивирование осуществляют на среде ПСФ с автоматическим поддержанием рН 6.9. Рабочий объем КЖ составляет 1.0 л; инокуляцию проводят до получения ОП660 0.002 ед. Культивирование проводят при перемешивании со скоростью 700 об/мин, поддерживая температуру на уровне 39°С. Аэрацию проводят стерильным воздухом из расчета 1.0 л/л/мин. Культивирование проводят до достижения ОП660 25 ед.
Проведение основного процесса биосинтеза треонина. Биосинтез целевой аминокислоты проводят в 3 л ферментерах КФ-103/4 с начальным рабочим объемом КЖ 1.0 л. на среде ОСФ с автоматическим поддержанием рН 6.9. Доля посевной культуры составляет 8-9%. Аэрацию осуществляют стерильным воздухом из расчета 1.0 л/л/мин в начале процесса, с последующим увеличением на 24 час роста до 4.0 л/л/мин. Минимальная скорость перемешивания составляет 500 об/мин. В ферментационной среде поддерживают концентрацию растворенного кислорода на уровне 20% от насыщения воздухом путем каскадной регулировки скорости мешалки до 1100 об./мин, температуру культивирования - на уровне 33°С.По исчерпании исходной глюкозы в среде ОСФ, которое определяют по резкому скачку показаний р02-датчика, начинают подпитку глюкозой. При увеличении концентрации растворенного кислорода на 10% в среду автоматически подается 2.3 г раствора подпитки, такой способ подачи подпитки поддерживают до окончания процесса. Культивирование продолжают в течение 36 час. Количество накопленного в среде треонина определяют методом ВЭЖХ (Waters 2695, Alliance).

Как видно из табл. 1, сконструированный штамм-продуцент ВКПМ В-14344, накапливает большее количество треонина по сравнению с родительским штаммом ВКПМ В-13240. Среднее значение накопления треонина в культуральной жидкости повышено со 100 до 110 г/л, при этом уровень конверсии глюкозы в треонин увеличен с 43 до 53% (вес).
Штамм Escherichia coli ВКПМ В-14344 характеризуется следующими признаками:
Культурально-морфологические признаки. Грамм-отрицательная бактерия. Суточная культура в жидкой LB представлена слабо подвижными клетками округлой формы 1 мкм в диаметре. При культивировании на L-агаре в течение 18-24 часов при 37°С образует круглые, беловатые, полупрозрачные на свет колонии 1-2 мм, поверхность колонии гладкая, края ровные или слегка волнистые, центр колонии приподнят, структура однородная, консистенция пастообразная, легко эмульгируется. При культивировании на агаризованной среде Эндо (мас. %: пептон - 1, лактоза - 1, Na2SO3 - 0,33, K2HPO4 - 0,25, фуксин основной - 0,03, агар-агар - 2%, вода -остальное) при 37°С образуются колонии, круглой формы с ровным четко очерченным краем малиново-красного цвета с металлическим блеском. Диаметр колоний 0,5-1,5 мм.
Физиолого-биохимические признаки. Факультативный анаэроб. Сахара не сбраживает. Ассимилирует: D-глюкозу, L-арабинозу, D-маннитол, D-ксилозу, в меньшей мере: D-галактозу, D-лактозу. Отсутствует способность к гидролизу крахмала. Отстутствует потребность в факторах роста. Заявляемый штамм продуцирует треонин. Оптимальное значение рН для роста 7,2-7,4. Не растет при температурах свыше 45°С.Оптимальная температура роста 37°С.Штамм не патогенен.
Таким образом, путем введения направленных модификаций в геном бактерий Е. coli ВКПМ В-13240 сконструирован штамм ВКПМ В-14344 продуцент незаменимой аминокислоты треонина, обладающий следующим генотипом Δtdh PH207-thrAfbrBC-TrrnB ΔlacI supE ΔpoxB-ltaE ΔsstT ΔtdcBCDE ΔytfG-Ptrc-pycA PLtetO1-rhtA ΔyifK ΔlivKHMGF ΔbrnQ ΔilvA ΔlysP ΔyjeM::PH207-thrAfbrBC-TrrnB ΔychE::Ptac-thrBC-TrrnB mmiMu[pntAB-aspC-asd-pycA-scrKYABR-gdhA-rhtA], способный синтезировать до 110 г/л треонина при культивировании в ферментере.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм Escherichia coli - продуцент L-треонина | 2019 |
|
RU2728242C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ESCHERICHIA COLI-ПРОДУЦЕНТ L-ТРЕОНИНА | 2013 |
|
RU2546237C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА И L-АРГИНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН cpxR | 2005 |
|
RU2320723C2 |
| Бактерия вида Escherichia coli - продуцент L-треонина, способ микробиологического синтеза L-треонина с ее использованием. | 2018 |
|
RU2697499C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН hipA | 2005 |
|
RU2320718C2 |
| БАКТЕРИЯ, ПРИНАДЛЕЖАЩАЯ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН pnp, - ПРОДУЦЕНТ L-ТРЕОНИНА, И СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА | 2005 |
|
RU2330883C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА И L-АРГИНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН ybiV | 2005 |
|
RU2320719C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-треонина С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia | 2006 |
|
RU2351646C2 |
| ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ФУМАРОВОЙ КИСЛОТЫ И СПОСОБ ПОЛУЧЕНИЯ ФУМАРОВОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ ЭТОГО ШТАММА | 2014 |
|
RU2573936C1 |
| СПОСОБ КОНСТРУИРОВАНИЯ РЕКОМБИНАНТНЫХ БАКТЕРИЙ, ПРИНАДЛЕЖАЩИХ К РОДУ PANTOEA, И СПОСОБ ПРОДУКЦИИ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ, ПРИНАДЛЕЖАЩИХ К РОДУ PANTOEA | 2006 |
|
RU2418069C2 |
Изобретение относится к биотехнологии. Предложен штамм Escherichia coli ВКПМ В-14344, имеющий генотип Δtdh PH207-thrAfbrBC-TrrnB ΔlacI supE ΔpoxB-ltaE ΔsstT ΔtdcBCDE ΔytfG-Ptrc-pycA PLtetO1-rhtA ΔyifK ΔlivKHMGF ΔbrnQ ΔilvA ΔlysP ΔyjeM::PH207-thrAfbrBC-TrrnB ΔychE::Ptac-thrBC-TrrnB miniMu[pntAB-aspC-asd-pycA-scrKYABR-gdhA-rhtA] и являющийся продуцентом L-треонина. Изобретение обеспечивает высокую продукцию и конверсию глюкозы в треонин. 5 ил., 1 табл., 2 пр.
Штамм Escherichia coli ВКПМ В-14344, имеющий генотип Δtdh PH207-thrAfbrBC-TrrnB ΔlacI supE ΔpoxB-ltaE ΔsstT ΔtdcBCDE ΔytfG-Ptrc-pycA PLtetO1-rhtA ΔyifK ΔlivKHMGF ΔbrnQ ΔilvA ΔlysP ΔyjeM::PH207-thrAfbrBC-TrrnB ΔychE::Ptac-thrBC-TrrnB miniMu[pntAB-aspC-asd-pycA-scrKYABR-gdhA-rhtA] - продуцент L-треонина.
| Бактерия вида Escherichia coli - продуцент L-треонина, способ микробиологического синтеза L-треонина с ее использованием. | 2018 |
|
RU2697499C1 |
| Штамм Escherichia coli - продуцент L-треонина | 2019 |
|
RU2728242C1 |
| Штамм Escherichia coli с инактивированным геном yjeM - продуцент L-треонина | 2021 |
|
RU2775206C1 |
| Штамм Escherichia coli с инактивированным геном ychE - продуцент L-треонина | 2019 |
|
RU2728251C1 |
| ФЕДОРОВ А.С | |||
| и др | |||
| Использование автолизированной биомассы культуры штамма-продуцента при микробиологическом синтезе L-треонина | |||
| Биотехнология, 2022, том 38, N 6, с | |||
| Способ очищения сернокислого глинозема от железа | 1920 |
|
SU47A1 |
| BUBNOV D.M | |||
| ET AL | |||
| Robust counterselection and advanced λRed | |||
Авторы
Даты
2024-04-12—Публикация
2023-09-20—Подача