Область изобретения
Настоящее изобретение относится к фармацевтическому препарату, содержащему высокую нагрузку активного лекарства.
В частности, оно относится к фармацевтическому препарату в форме частиц, содержащему высокую нагрузку (то есть с высоким массовым % активного лекарства) 5-аминосалициловой кислоты (5-АСК, месаламин, месалазин) для перорального введения, а также к способу его изготовления и к саше для этого препарата.
Заявляется приоритет по заявке на патент Дании РА 2003 00612, европейской патентной заявке ЕР 03388023 и предварительной заявке на патент США 60/464649.
Предшествующий уровень техники
Известны пероральные фармацевтические препараты, содержащие месалазин, которые представляют собой либо таблетки, либо гранулят. Гранулят может быть упакован в саше. Для целей настоящего изобретения термин «саше» относится к конверту или пакету для гранулята, тогда как термин «гранулят» относится к частицам, гранулированным или сферонизированным частицам.
В настоящее время известны таблетки, содержащие 250 или 500 мг месалазина. Таблетки с содержанием 250 мг обычно весят примерно 540 мг, то есть они имеют нагрузку лекарства (250/540) % по массе=46% по массе. Таблетки, содержащие вплоть до 84% по массе месалазина, описаны в заявке на патент WO 00/44353 с названием «Pharmazeutische Zusammensetzungen».
Что касается саше, Dr. Falk Pharma выпустил на рынок продукт, который содержит, как утверждается, 500 мг месалазина в саше массой 930 мг, что соответствует нагрузке лекарства, составляющей 54% по массе.
В настоящее время для ежедневного лечения заболеваний желудочно-кишечного тракта, таких как болезнь Крона или неспецифический язвенный колит, часто прописывают вплоть до 4 г месалазина.
Если вводить 4 г месалазина в таблетках с содержанием 250 мг, то пациенту нужно проглатывать 16 таблеток в день. С другой стороны, можно вводить таблетки с содержанием 500 мг, но при нагрузке лекарства порядка 50% каждая таблетка будет весить примерно 1 г, и для многих пациентов они окажутся слишком большими для глотания.
Существует необходимость в создании продукта, который обеспечит возможность введения больших ежедневных доз лекарства без негативного влияния на соблюдение пациентом схемы лечения.
Известны способы изготовления пероральных фармацевтических препаратов, содержащих месалазин, в промышленном масштабе. Однако в известных способах изготовления для получения продукта, имеющего желательные характеристики высвобождения, требуется большое количество производственных стадий, что делает такое производство громоздким и дорогим (например, как в W097/23199, являющейся ближайшим аналогом изобретения).
Описание изобретения
Аспекты данного изобретения касаются указанных проблем, а также других проблем, упомянутых ниже.
Согласно одному аспекту настоящее изобретение относится к пероральному фармацевтическому препарату, предпочтительно для саше, содержащему количество месалазина, выбранное из группы, состоящей из 55; 60; 65; 70; 75; 80; 85; 90; 92; 94 и 96% по массе. Согласно предпочтительному аспекту, препарат содержит 92-98, предпочтительно 94-96% по массе месалазина.
Эти аспекты предлагают фармацевтическую композицию с высокой нагрузкой.
Для целей настоящего изобретения термин «месалазин» также включает его фармацевтически приемлемые соли и сложные эфиры, такие как соли и эфиры, упомянутые в WO 97/23199, стр.15, строка 17 - стр.6, строка 12, а также как пролекарства, такие как балсалазид.
Препарат предпочтительно находится в виде материала в форме частиц, например гранулята, сфер, пеллет, частиц, предпочтительно гранулята.
Согласно одному аспекту настоящее изобретение относится к фармацевтическому препарату, дополнительно содержащему фармацевтически приемлемое связывающее вещество, предпочтительно повидон, в количестве, выбранном из группы, состоящей из 1; 2; 3; 4; 5; 6; 7; 8; 9; 10 и 12% по массе. Согласно предпочтительному аспекту, препарат содержит 1-10, предпочтительно 2-8; более предпочтительно 3-7; предпочтительно 4-6; наиболее предпочтительно 5% по массе повидона.
Фармацевтически приемлемое связывающее вещество может включать любое приемлемое связывающее вещество, такое как аравийская камедь, желатин, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, метилцеллюлоза, полиэтиленгликоль (ПЭГ), повидон, сахароза, крахмал или смесь любых из числа вышеперечисленного. Повидон (поливинилпирролидон, ПВП) является предпочтительным.
Согласно одному аспекту настоящее изобретение относится к фармацевтическому препарату, дополнительно включающему оболочку.
Оболочка предпочтительно должна содержать агент, модифицирующий высвобождение, такой как этилцеллюлоза, карнаубский воск, шеллак или смесь любых из числа вышеперечисленных. Этилцеллюлоза является предпочтительной.
Выбранная оболочка зависит среди прочего от желательного характера высвобождения. Она может быть выбрана из лимитирующих скорость барьерных материалов, например из энтеросолюбильного материала или оболочечного материала отсроченного действия, таких как полиметакрилат, коммерчески доступный в форме эудрагитов, например Eudragit NE 40 D или Eudragit L 100. В случае использования полупроницаемого полимера наиболее предпочтительной оболочкой является этилцеллюлоза.
Согласно одному аспекту препарат является препаратом с модифицированным высвобождением, предпочтительно препаратом с пролонгированным высвобождением.
Согласно одному аспекту препарат включает оболочку, причем отношение массы указанной оболочки к массе указанного месалазина или указанной фармацевтически приемлемой соли выбирают из 0,1-10%; 0,3-7%; 0,5-5%; 0,7-3%; 0,8-2% и 0,9-1,5%. Количество оболочки может быть отрегулировано для достижения желательного профиля высвобождения. Очень большое количество оболочки может препятствовать высвобождению активного ингредиента.
Согласно еще одному аспекту настоящее изобретение относится к фармацевтическому препарату, по существу состоящему из месалазина, фармацевтически приемлемого связывающего вещества и оболочки.
Согласно одному аспекту настоящее изобретение относится к фармацевтическому препарату, имеющему характеристики высвобождения месалазина in vitro, составляющие по меньшей мере 40, 50, 60, 70, 80 или 90% высвобожденного через 240 минут месалазина от общего количества месалазина в препарате, измеренные в модельной системе с использованием USP Paddle System 2, работающей при 37°С с перемешиванием при скорости 100 об/мин. Обычно для обеспечения эффективного высвобождения в кишечнике предпочтительным является более быстрое высвобождение.
Согласно одному аспекту настоящее изобретение относится к фармацевтическому препарату, имеющему следующие характеристики высвобождения мезалазина in vitro:
а) 5-25% высвобожденного месалазина через 15 мин;
б) 30-70%, предпочтительно 40-60%, высвобожденного месалазина через 90 мин и
в) 75-100% высвобожденного месалазина через 240 мин;
от общего количества мезалазина в препарате, измеренные в модельной системе с использованием USP Paddle System 2, работающей при 37°С с перемешиванием при скорости 100 об/мин.
Параметры растворения для этой модельной системы были следующими:
среда растворения: 1000 мл деаэрированного 0,1 М натрий-фосфатного буфера с pH 7,5;
Прибор: USP 23 Paddle (Apparatus 2)
Скорость вращения вала: 100 об/мин. Для экспериментов использовали саше массой 1 г.
Согласно первому предпочтительному аспекту настоящее изобретение относится к фармацевтическому препарату, имеющему фактор подобия f2 выше числа, выбранного из 25, 30, 35, 40, 45, 50, 55, 60, 65 и 70, при сравнении со стандартом, имеющим следующие характеристики высвобождения месалазина in vitro:
а) 12% высвобожденного месалазина через 15 мин;
б) 50% высвобожденного месалазина через 90 мин и
в) 85% высвобожденного месалазина через 240 мин; измеренные в условиях, указанных выше.
Фактор подобия f2 определяют как
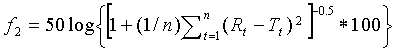
где n представляет собой число временных точек, R(t) представляет собой средний процент растворенного активного ингредиента из стандарта, a T(t) представляет собой средний процент растворенного активного ингредиента из препарата по изобретению. Фактор подобия обычно считают удовлетворительным, если он находится в интервале от 50 до 100, но для целей настоящего изобретения он может быть даже меньше.
Согласно второму предпочтительному аспекту настоящее изобретение относится к фармацевтическому препарату, имеющему фактор подобия f2 выше числа, выбранного из 25, 30, 35, 40, 45, 50, 55, 60, 65 и 70, при сравнении со стандартом, имеющим следующие характеристики высвобождения месалазина in vitro:
г) 21% высвобожденного месалазина через 15 мин;
д) 68% высвобожденного месалазина через 90 мин и
е) 94% высвобожденного месалазина через 240 мин,
измеренные в условиях, указанных выше.
Согласно еще одному аспекту настоящее изобретение относится к фармацевтическому препарату, который упакован в саше.
Согласно одному аспекту настоящее изобретение относится к способу изготовления гранулята, включающему стадии:
а) смешивания месалазина с гранулирующей жидкостью;
б) получения гранулята путем гранулирования, прессования или экструдирования;
в) сушки гранулята;
г) доведения размера гранулята до нужной величины и
д) просеивания гранулята как необходимо; отличающемуся дополнительной стадией:
е) покрытия гранулята оболочкой;
и возможно дополнительно:
ж) просеивания гранул, покрытых оболочкой;
з) продувки гранул, покрытых оболочкой, воздухом.
Согласно еще одному аспекту настоящее изобретение относится к способу, при котором гранулят, покрытый оболочкой, упаковывают в саше.
Другими подходящими формами упаковки являются контейнеры, обычно используемые для пероральных препаратов.
Данный способ представляет собой простой способ изготовления фармацевтических препаратов.
Согласно одному аспекту изобретения, предложена фармацевтическая композиция, производимая без сферонизации. Таким образом, данную композицию можно получить без сферонизации. Посредством этого исключается необходимость во вспомогательном средстве для сферонизации, что обеспечивает возможность получения фармацевтической композиции с высокой нагрузкой лекарства.
Сферонизацию использовали для получения в промышленном масштабе воспроизводимого продукта, привлекательного визуально и удобного для введения, что приводит к высокой степени соблюдения пациентом схемы лечения.
До создания настоящего изобретения месалазиновые лекарства считали необходимым сферонизировать для того, чтобы получать привлекательный визуально и легко вводимый продукт в виде саше. Сферонизация подразумевает применение вспомогательного средства или усилителя сферонизации, такого как микрокристаллическая целлюлоза. Присутствие вспомогательного средства для сферонизации имеет результатом нагрузки лекарства, более низкие по сравнению с нагрузками, получаемыми согласно настоящему изобретению.
Существует потребность в фармацевтической композиции с высокой нагрузкой, свободной от пыли. Фармацевтический препарат, отвечающий этим критериям, получают согласно аспекту данного изобретения без сферонизации. Такую композицию можно создать путем получения гранулята. Для того чтобы произвести продукт, который является привлекательным визуально для субъекта, которому вводят указанный фармацевтический препарат, гранулят можно получать путем гранулирования, прессования или экструдирования. Прессование можно осуществлять, например, с помощью вальцов. Гранулят предпочтительно получают путем экструдирования.
Согласно одному предпочтительному аспекту настоящего изобретения фармацевтическую композицию получают согласно находящейся на совместном рассмотрении заявки на патент PCT/DК01/00677 с названием «Способ получения фармацевтической композиции, содержащей 5-аминосалициловую кислоту, для применения в лечении неспецифического язвенного колита и болезни Крона», с рядом модификаций. Эти модификации заключаются в том, что оболочка должна быть адаптирована согласно настоящему изобретению, а также в том, что после покрытия оболочкой, просеивания и продувки азотом полученный гранулят упаковывают в саше без необходимости в дополнительных эксципиентах (сравн. Пример 3 и Фиг.4 указанной заявки). Особенно предпочтительным является то, что гранулирующая жидкость содержит по меньшей мере 50%, более предпочтительно 60%, предпочтительно 70%, более предпочтительно 80%, предпочтительно 85%, более предпочтительно 90% масс/масс. воды.
Согласно одному аспекту настоящее изобретение относится к способу, где гранулирующая жидкость состоит из повидона, растворенного в воде.
Согласно еще одному аспекту настоящее изобретение относится к способу, при котором указанную стадию сушки (в) проводят в сушилке с псевдоожиженным слоем.
Согласно еще одному аспекту настоящее изобретение относится к способу, при котором указанную стадию доведения размера (г) осуществляют путем размалывания.
Согласно еще одному аспекту настоящее изобретение относится к способу, при котором стадию просеивания (д) осуществляют путем отбора гранулята, проходящего через сито с размером отверстий 1,8 мм, но не проходящего через сито с размером отверстий 0,5 мм.
Для отбора желательного гранулята можно использовать другие подходящие сита, например имеющие размеры, выбранные из группы, состоящей из 4,0; 3,15; 2,5; 2,0; 1,8; 1,6; 1,4; 1,25; 1,18; 1,0; 0,9; 0,8; 0,71; 0,6; 0,5 и 0,4 мм. Можно выбирать сита для определения верхнего и/или нижнего пределов размеров частиц.
Согласно другому аспекту, получающиеся гранулы после размалывания имеют гранулометрический состав, измеренный при помощи ситового анализа, где основная фракция составляет от 850 мкм до 1000 мкм. Для получения желательного размера частиц можно варьировать отверстия в экструдере. Согласно одному аспекту, более 75%, предпочтительно более 85% и наиболее предпочтительно более 90% гранул имеют размер частиц от 850 мкм до 1000 мкм.
Согласно одному аспекту, настоящее изобретение относится к способу, при котором стадию покрытия оболочкой (е) осуществляют с использованием этилцеллюлозы.
Согласно еще одному аспекту, настоящее изобретение относится к способу, при котором стадию покрытия оболочкой (е) осуществляют путем нанесения количества материала оболочки, отрегулированного согласно удельной поверхности так, чтобы оно находилось в интервале 0,09-0,17 мг/см2, предпочтительно 0,11-0,15 мг/см2, наиболее предпочтительно 0,12-0,14 мг/см2, с последующей сушкой. Было установлено, что эти количества подходят для нанесения оболочки из этилцеллюлозы.
Было установлено, что желательный профиль высвобождения может быть получен путем регулирования количества материала оболочки, используемого согласно удельной поверхности. Удельную поверхность можно измерить с помощью пермеаметрии согласно «Evaluation of a permeametry technique for surface area measurement of coarse particulate materials, International Journal of Pharmaceutics, Eriksson etal., 1990, 63, p.189-199».
Гранулят, полученный согласно находящейся на совместном рассмотрении заявке на патент PCT/DK01/00677, предпочтительно с модификациями согласно настоящему изобретению, является особенно предпочтительным, так как имеет гладкую поверхность, облегчающую измерение удельной поверхности, а также последующее нанесение оболочки.
Для того чтобы было возможным определить количество оболочки, которое необходимо нанести на гранулы, измеряют площадь поверхности. Основываясь на измеренной корреляции между количеством оболочки на площадь поверхности и профилем скорости растворения, можно спрогнозировать необходимое количество оболочки, исходя из измеренной площади поверхности гранул. Это количество регулируют методом проб и ошибок, так как оно зависит от точных использованных условий, например от установки и эксципиентов.
Согласно одному аспекту настоящее изобретение относится к способу, при котором стадию просеивания (ж) осуществляют на ротационном сите, предпочтительно с размером отверстий 2,5 мм, для того чтобы получить покрытый оболочкой гранулят с размером, меньшим или равным 2,5 мм.
Для отбора желательного размера покрытого оболочкой гранулята могут быть использованы другие подходящие сита, например имеющие размеры отверстий, выбранные из группы, состоящей из 4,0, 3,15, 2,5, 2,0, 1,8, 1,6, 1,4, 1,25, 1,18, 1,0, 0,9, 0,8, 0,71, 0,6, 0,5 и 0,4 мм.
Согласно одному аспекту настоящее изобретение относится к фармацевтическому препарату, предпочтительно согласно любому из упомянутых выше аспектов, получаемому согласно данному способу.
Согласно одному аспекту изобретение относится к фармацевтическим препаратам для применения в медицине.
Согласно еще одному аспекту настоящее изобретение относится к применению месалазина для изготовления фармацевтического препарата согласно изобретению, содержащего общее количество месалазина, выбранное из группы, состоящей из 0,5 г, 1,0 г, 1,5 г, 2 г, 3 г, 4 г, 5 г, 6 г, 8 г и 10 г.
Согласно еще одному аспекту настоящее изобретение относится к применению, где лекарство предназначено для лечения заболевания желудочно-кишечного тракта (ЗЖКТ), предпочтительно болезни Крона или неспецифического язвенного колита.
Препараты согласно изобретению подходят для лечения ЗЖКТ.
Согласно одному аспекту изобретение относится к способу лечения ЗЖКТ, включающему введение пациенту препарата согласно изобретению, предпочтительно 1, 2, 3 или 4 раза ежедневно.
Препараты согласно изобретению могут быть упакованы в различные контейнеры, которые обеспечивают возможность их введения пациентам, такие как капсулы, блистерные упаковки, дозаторы, стеклянные или пластиковые контейнеры и саше.
Согласно одному аспекту настоящее изобретение относится к саше для фармацевтического препарата, предпочтительно согласно изобретению.
Настоящее саше может быть использовано для любого фармацевтического препарата, но оно особенно подходит для хранения фармацевтических препаратов, содержащих чувствительные вещества, такие как месалазин.
Согласно еще одному аспекту настоящее изобретение относится к саше, содержащему следующие слои:
1) бумага;
2) связывающий слой, предпочтительно связывающее вещество, такое как полиэтилен;
3) барьерный слой, предпочтительно алюминиевая фольга; и
4) изолирующий слой, предпочтительно полиэтилен низкой плотности.
Месалазин чувствителен к влажности, атмосферному воздуху и/или свету. Саше для продукта, содержащего месалазин, поэтому должно предпочтительно обеспечивать барьер для влажности, атмосферного воздуха и света. Саше также должно быть удобным для открывания пациентом, предпочтительно без применения дополнительных инструментов, таких как ножницы. Существовала проблема создания саше с необходимыми барьерными свойствами без ущерба для возможности открытия саше путем разрыва пальцами человека. Кроме того, существующие саше имеют тенденцию накапливать статическое электричество. Предпочтительно саше должно быть легким в изготовлении, удобным для наполнения и для опорожнения, и оно должно иметь внешний вид, привлекательный для пациента для улучшения соблюдения им схемы лечения.
В этом аспекте предложено саше, обеспечивающее долговременную стабильность при хранении содержащейся в нем фармацевтической композиции, например, когда активным фармацевтическим ингредиентом является месалазин. Кроме того, это саше удобно надрывать и статическое электричество в нем элиминировано, что обеспечивает возможность его полного опорожнения. Сочетание саше и перорального препарата согласно настоящему изобретению обеспечивает малое накопление статического электричества.
Согласно одному аспекту настоящее изобретение относится к саше, где связывающий слой (2) предпочтительно имеет величину массы на единицу площади, составляющую 6-20 г/м2, предпочтительно 9-15 г/м2, более предпочтительно 12 г/м2; барьерный слой (3) предпочтительно имеет толщину 6-30 мкм, более предпочтительно 7-25 мкм, предпочтительно 9-25 мкм, более предпочтительно 8-20 мкм, предпочтительно 9-15 мкм, более предпочтительно 12 мкм; и/или изолирующий слой (4) предпочтительно имеет величину массы на единицу площади, составляющую 10-100 г/м2, более предпочтительно 15-75 г/м2, предпочтительно 20-50 г/м2, более предпочтительно 30-40 г/м2, наиболее предпочтительно 35 г/м2.
Наружная бумага (1) в предпочтительном воплощении имеет величину массы на единицу площади, составляющую 10-100 г/м2, предпочтительно 30-70 г/м2, наиболее предпочтительно 50 г/м2.
Согласно еще одному аспекту настоящее изобретение относится к применению саше для фармацевтической композиции согласно изобретению.
Саше продемонстрировало пригодность для хранения фармацевтических композиций по изобретению.
Согласно еще одному аспекту настоящее изобретение относится к применению саше в медицинских целях.
Согласно аспекту настоящего изобретения оно не ограничено применением месалазина в качестве активного ингредиента, а также относится к другим активным ингредиентам, таким как ингредиенты, упомянутые в WO 00/44353, стр.12-16. Для настоящего изобретения подходят другие менее эффективные активные ингредиенты. В качестве замены месалазина наиболее перспективным представляется ибупрофен.
Согласно одному аспекту настоящего изобретения в состав композиции по изобретению могут входить дополнительные эксципиенты, такие как наполнители, разрыхлители, регуляторы pH или поверхностно-активные вещества. Такие эксципиенты хорошо известны из литературы, например о ряде подходящих эксципиентов смотри WO 00/44353, стр.16-20.
Примеры
Если не указано иначе, все проценты указаны как % по массе.
Пример 1
Партия для изготовления 180000 саше с гранулами пролонгированного высвобождения имела следующий состав.
∗∗ Выпаривается в процессе производства.
∗∗∗ Количество этилцеллюлозы регулировали таким образом, чтобы обеспечить желательный профиль растворения конечного продукта.
Ph. Eur. (Европейская Фармакопея) относится к текущему изданию на дату подачи настоящей заявки.
Способ изготовления имеет большое сходство со способом изготовления, описанным в находящейся на совместном рассмотрении заявке на патент PCT/DK01/00677, с некоторыми исключениями. Регулируют количество и тип ингредиентов, и, в частности, количество этилцеллюлозы уменьшают таким образом, чтобы получить желательный профиль растворения. В этом примере таблетки не изготавливали, поэтому необходимых для этой цели эксципиентов не включали. Также не осуществляют сухое смешивание после воздушной продувки и не проводят таблетирование. Поэтому гранулированный продукт, получаемый в настоящем способе, отличается от таблетки в указанной заявке.
Способ изготовления препарата можно разделить на 9 стадий:
1. Приготовление гранулирующей жидкости
2. Гранулирование месалазина с водой и ПВП
3. Экструдирование
4. Сушка в псевдоожиженном слое
5. Размалывание
6. Просеивание
7. Нанесение оболочки
8. Просеивание
9. Продувка воздухом
Стадия 1:
Для приготовления одной партии гранулирующей жидкости заполняют водой барабан Мюллера (
Стадии 2 и 3:
Месалазин помещают в вибрирующий бункер Prodima и посредством конвейера транспортируют его в весовой ленточный дозатор, дозирующий месалазин в линию непрерывного действия Niro. В первой части линии Niro месалазин и водный раствор ПВП смешивают до влажной массы перед транспортировкой в экструдер. После продавливания влажной массы месалазина и ПВП/вода через сито с ячейками 0,9 мм гранулы падают прямо в сушилку с псевдоожиженным слоем.
Стадия 4:
Сушилка с псевдоожиженным слоем разделена на две основные секции. В первой секции гранулы сушат с поверхности, чтобы предотвратить их слипание. В этой секции сушилки с псевдоожиженным слоем происходит беспорядочное смешивание гранул. После обработки в течение определенного времени гранулы перемещают во вторую часть сушилки, где происходит настоящая сушка. В этой второй части сушилки гранулы обрабатывают путем пропускания осушающего воздуха через сушилку (специальный вид отверстий в жаберной пластине). Когда гранулы становятся сухими, им дают упасть в барабан, расположенный под сушилкой с псевдоожиженным слоем. Сушилка с псевдоожиженным слоем сконструирована таким образом, что общее время пребывания в сушилке составляло приблизительно 2,5 часа.
Стадия 5:
Барабаны, содержащие сухие гранулы, помещают перевернутыми вверх дном в верхней части мельницы и мягко размалывают гранулы, используя сито, которое ломает только слишком длинные гранулы. После прохождения через мельницу гранулы падают в барабан.
Стадия 6:
Из-за того, что процесс размалывания приводит к образованию небольшого количества гранул недостаточного размера, гранулы просеивают, используя вибрационное сито Могенсена (Mogensen). Гранулы, которые проходят сито 0,8 мм, отбрасывают, либо они могут быть собраны для повторной переработки при хранении в воздухонепроницаемых помеченных контейнерах.
Стадия 7:
200 кг просеянных гранул покрывают оболочкой в установке Кюгеля (Kugel) для нанесения оболочки (система с псевдоожиженным слоем) с помощью пленкообразующей жидкости, состоящей из этилцеллюлозы, растворенной в ацетоне.
Для того чтобы было возможно определить точное количество этилцеллюлозы, необходимое для нанесения на гранулы с получением желательного профиля скорости растворения, перед операцией нанесения оболочки измеряют площадь поверхности гранул. Методика предсказания количества оболочки, которое нужно нанести на гранулы, была разработана на основании того факта, что имеется корреляция между количеством оболочки на площадь поверхности и скоростью растворения гранул.
Когда стадию нанесения оболочки проводили в установке для нанесения оболочки НКС 400 Huttlin Kugel с последующим просеиванием по размеру, характеристики высвобождения согласно изобретению, измеренные как высвобожденный % от общего количества месалазина, или согласно первому предпочтительному аспекту, определенные посредством фактора подобия, получали тогда, когда количество этилцеллюлозы было доведено до 0,13 мг/см2.
После завершения процесса нанесения оболочки гранулы, покрытые оболочкой, загружают в барабан для дальнейшей обработки.
Стадия 8:
После нанесения на них оболочки гранулы, покрытые оболочкой, просеивают в ротационном сите Prodima. Крупные комки отбрасывают.
Стадия 9:
После просеивания партии гранул, покрытых оболочкой, их распределяют в два барабана для продувки сжатым воздухом или азотом. Гранулы продувают в течение 6-14 часов. Этот процесс продувки необходим для снижения количества остаточного растворителя (ацетона) в гранулах, покрытых оболочкой.
Эта партия давала гранулят со следующим приблизительным составом:
Далее этим гранулятом наполняли саше.
Материал саше имел следующий состав:
Для настоящего примера 12 г/м2 ПЭ соответствует 13 мкм, а 35 г/м2 ПЭ соответствует 38 мкм. Материал имеет массу 1 м2, составляющую 129 г/м2. Проницаемость для водяного пара составляла менее 0,05 г/м2, 24 ч, 25°С, ОВ (относительная влажность) 75%, а для O2 - менее 0,05 мл/м2, 24 ч, атм (101325 Па), 23°С, ОВ 75%.
Саше складывали вокруг подающего патрубка заполняющей/упаковывающей установки таким образом, чтобы бумага была на внешней стороне саше, и затем склеивали в продольном направлении полиэтиленом низкой плотности в качестве изолирующего слоя. После образования поперечного шва в нижней части саше его наполняли гранулятами и затем вновь склеивали в верхней части и, наконец, отрезали.
Все процитированные документы включены во всей своей полноте посредством ссылки.
Настоящее изобретение относится к пероральной фармацевтической композиции в форме гранулята, полученного без сферонизации. Композиция содержит 92-98% по массе месалазина или его фармацевтически приемлемой соли, 2-8% по массе поливинилпирролидона и оболочку, содержащую этилцеллюлозу, где отношение массы указанной оболочки к массе месалазина составляет 0,3-1,5% и масса оболочки из этилцеллюлозы составляет 0,11-0,15 мг/см2. Гранулят упакован в саше, капсулу или блистерную упаковку. Также описан способ изготовления фармацевтической композиции. Покрытый оболочкой из этилцеллюлозы гранулят месалазина сочетает высокую нагрузку лекарственного средства и необходимый профиль высвобождения месалазина, а именно, 5-25% высвобожденного месалазина через 15 мин, 30-70% высвобожденного месалазина через 90 мин и 75-100% высвобожденного месалазина через 240 мин. 2 н. и 8 з.п. ф-лы, 1 пр.
1. Пероральная фармацевтическая композиция в форме гранулята, полученного без сферонизации, содержащая
- 92-98% по массе месалазина или его фармацевтически приемлемой соли и
- 2-8% по массе поливинилпирролидона,
причем указанная композиция дополнительно включает оболочку, содержащую этилцеллюлозу, где отношение массы указанной оболочки к массе месалазина (или его соли) составляет 0,3-1,5% и масса оболочки из этилцеллюлозы составляет 0,11-0,15 мг/см2,
и имеет следующие характеристики высвобождения месалазина in vitro:
а) 5-25% высвобожденного месалазина через 15 мин,
б) 30-70% высвобожденного месалазина через 90 мин и
в) 75-100% высвобожденного месалазина через 240 мин;
от общего количества месалазина в композиции, измеренные в модельной системе с использованием USP Paddle System 2, работающей при 37°C с перемешиванием при скорости 100 об/мин,
где указанная композиция упакована в саше, капсулу или блистерную упаковку.
2. Фармацевтическая композиция по п.1, имеющая фактор подобия f2, вычисленный по формуле
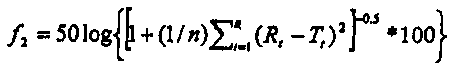
где n представляет собой число временных точек, R(t) представляет собой средний процент растворенного активного ингредиента из стандарта, a T(t) представляет собой средний процент растворенного активного ингредиента из композиции,
выше 30 при сравнении со стандартом, имеющим следующие характеристики высвобождения месалазина in vitro:
а) 12% высвобожденного месалазина через 15 мин,
б) 50% высвобожденного месалазина через 90 мин и
в) 85% высвобожденного месалазина через 240 мин,
измеренные в условиях, указанных в п. 1.
3. Фармацевтическая композиция по п.1 или 2, по существу состоящая из месалазина, поливинилпирролидона и оболочки.
4. Способ изготовления фармацевтической композиции по п.1, включающий стадии:
а) смешивания месалазина с гранулирующей жидкостью, содержащей поливинилпирролидон;
б) получения гранулята путем гранулирования, прессования или экструдирования без сферонизации;
в) сушки гранулята;
г) доведения размера гранулята до нужной величины и
д) просеивания гранулята как необходимо;
е) покрытия гранулята оболочкой из этилцеллюлозы, где отношение массы указанной оболочки к массе месалазина (или его соли) составляет 0,3-1,5% и масса оболочки из этилцеллюлозы составляет 0,11-0,15 мг/см2; и
ж) упаковки указанных покрытых оболочкой гранул в саше, капсулу или блистерную упаковку.
5. Способ по п. 4, включающий дополнительные стадии:
ж) просеивания гранул, покрытых оболочкой;
з) продувки гранул, покрытых оболочкой, воздухом.
6. Способ по п.4 или 5, где указанная гранулирующая жидкость состоит из поливинилпирролидона, растворенного в воде.
7. Способ по п.4 или 5, где указанную стадию сушки (в) осуществляют в сушилке с псевдоожиженным слоем.
8. Способ по п.4 или 5, где указанную стадию доведения размера (г) осуществляют путем размалывания.
9. Способ по п.4 или 5, где указанную стадию просеивания (д) осуществляют путем отбора гранулята, проходящего через сито с размером отверстий 1,8 мм, но не проходящего через сито с размером отверстий 0,5 мм.
10. Способ по п.5, где указанную стадию просеивания (ж) осуществляют на ротационном сите.
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| "Фармацевтические и медико-биологические аспекты лекарств", под ред | |||
| И.М.Перцева "НФАУ", Харьков, 1999, том 2, с.360-362 | |||
| "Промышленная технология лекарств" под ред | |||
| проф | |||
| В.И.Чуешова, том 2, с.383-392 | |||
| СПОСОБ МОДИФИКАЦИИ ПРИВИТЬ^Х СОПОЛИМЕРОВ | 0 |
|
SU166094A1 |
| Бетонная смесь | 1980 |
|
SU1004297A1 |
| US 5731302 A, 24.03.1998 | |||
| БОРШТАНГА ДЛЯ РАСТОЧКИ УЧАСТКОВ ГЛУБОКИХ СТУПЕНЧАТЫХ ОТВЕРСТИЙ | 0 |
|
SU217887A1 |
| US 4496553 A, 29.01.1985 | |||
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ ФАРМАЦЕВТИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА И СПОСОБ ВЫСВОБОЖДЕНИЯ ФАРМАЦЕВТИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА | 1999 |
|
RU2259826C2 |
Авторы
Даты
2015-04-10—Публикация
2004-04-23—Подача