Настоящая заявка заявляет приоритет по Предварительной заявке США №61/265823, поданной 2 декабря 2009, Предварительной заявке США №61/354575, поданной 14 июня 2010, каждая из которых включена в настоящий документ по ссылке в ее полном объеме для всех целей.
ПРЕДПОСЫЛКИ
Наиболее широко используемые лекарственные формы для перорального введения включают таблетки и капсулы. Однако такие лекарственные формы имеют некоторые недостатки. Например, по оценкам, 50% популяции имеют проблемы в проглатывании таблеток (смотри Seager, 50 J. Pharmacol. and Pharm. 375-382 (1998)). В частности, для некоторых пожилых людей является сложным проглотить таблетки или капсулы или дать лекарства детям, которые неспособны или не желают проглатывать таблетки или капсулы. Это ведет к слабому соблюдению или несоблюдению лечения и, таким образом, имеет отрицательное влияние на эффективность лечения.
Горький вкус многих активных компонентов также препятствует тому, чтобы рассыпать препараты просто на пищу, что является широко распространенным способом введения препаратов детям. Лекарственные средства с горьким вкусом, введенные в жевательные таблетки, типично густо покрыты, главным образом, нерастворимыми в воде полимерами, такими как этилцеллюлоза, для маскировки вкуса лекарственных средств благодаря сопротивлению растрескиванию покрытых лекарственных средств во время прессования таблеток и/или во время жевания и сопутствующей утечки горького активного компонента. Следовательно, по сути, полное высвобождение лекарственного средства из таких жевательных таблеток в желудочно-кишечный тракт может занимать 2 часа или дольше. Совсем недавно были введены лекарственные формы перорально распадающихся таблеток (ODT), которые быстро растворяются или распадаются в ротовой полости, и следовательно, могут приниматься без воды. Другие традиционные пероральные лекарственные формы включают саше и дисперсии микрочастиц. Такие препараты являются традиционными, особенно для пожилых людей и детей.
Фексофенадина гидрохлорид представляет собой антагонист H1-гистаминового рецептора и является одобренным для лечения сезонного аллергического ринита и хронической идиопатической крапивницы. Однако приготовление составов фексофенадина усложняется его низкой растворимостью при условиях низкого рН (т.е. желудочном рН). Один типичный путь, направленный на низкую растворимость - это составление лекарственного средства в форме ODT (перорально распадающаяся таблетка). Однако этот подход усложняется горьким вкусом фексофенадина гидрохлорида.
Патент США №6723348 описывает получение распадающейся во рту таблетки (ODT), содержащей фексофенадин в форме фексофенадина, гранулированного с дополнительными наполнителями, затем покрытого в псевдоожиженном слое полимерным покрытием. Однако способ производства является относительно сложным и требует множества этапов грануляции, покрытия и смешивания.
Целью настоящего изобретения является обеспечение микроинкапсулированного фексофенадина простым способом в форме немедленного высвобождения с замаскированным вкусом.
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает микрокапсулы немедленного высвобождения с замаскированным вкусом, которые содержат фексофенадин и нерастворимое в воде полимерное покрытие, и фармацевтическую композицию, содержащую их. Совместно гранулированные микрокапсулы фексофенадина также раскрываются в настоящих изобретениях. Эти микрокапсулы и фармацевтические композиции, содержащие их, имеют подходящее содержание лекарственного средства и необходимые фармацевтические свойства, включая быструю скорость растворения фексофенадина, комбинированную с эффектом маскировки вкуса.
Настоящее изобретение также обеспечивает способ получения микрокапсулы и совместно гранулированных микрокапсул и фармацевтических композиций, содержащих микрокапсулы с замаскированным вкусом немедленного высвобождения, которые содержат фексофенадин и нерастворимое в воде полимерное покрытие. Способ для получения микрокапсул включает этапы: (а) растворения нерастворимого в воде полимера в органическом растворителе; (b) суспендирования фексофенадина в органическом растворителе; (с) нанесения покрытия нерастворимого в воде полимера на фексофенадин с помощью разделения фаз; и (d) отделения микрокапсул от органического растворителя.
Фармацевтические композиции настоящего изобретения являются пригодными для лечения состояний, связанных с воспалением, таких как сезонный аллергический ринит и хроническая идиопатическая крапивница. Соответственно, настоящее изобретение также обеспечивает способ для лечения состояния, связанного с воспалением, у индивидуума. Способ включает введение индивидууму, нуждающемуся в этом, фармацевтической композиции, содержащей микрокапсулы немедленного высвобождения с замаскированным вкусом, где микрокапсулы содержат фексофенадин и нерастворимое в воде полимерное покрытие.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Все документы, цитируемые здесь, включены ссылкой для всех целей.
Как используется в настоящем документе, выражение «вес покрытия» относится к сухому весу покрытия микрокапсулы, разделенному на вес целой микрокапсулы, умноженному на 100. Например, вес покрытия 20% означает, что для данной микрокапсулы, покрытие составляет 20% от веса микрокапсулы.
Как используется в настоящем документе, выражение «средний вес покрытия» относится к средней величине веса покрытия для группы микрокапсул. Например, если половина микрокапсул в данной группе имеет вес покрытия 10% и другая половина имеет вес покрытия 20%, то средний вес покрытия для данной группы микрокапсул составляет 15%.
Как используется в настоящем документе, выражение «микрокапсулы» относится к лекарственному средству (например, фексофенадину или его фармацевтической соли, сложному эфиру и/или сольвату, или его полиморфу), покрытому нерастворимым в воде полимерным покрытием.
Как используется в настоящем документе, выражение «микроинкапсулирование» относится к способу покрытия лекарственного средства с помощью нерастворимого в воде полимера.
Как используется в настоящем документе, и если не определено обратное, ссылки на «фексофенадин» или его фармацевтически приемлемую соль, сложный эфир и/или сольват, или его полиморф.
Как используется в настоящем документе, выражение «API» означает «активный фармацевтический ингредиент», например, фексофенадин или его фармацевтическая соль, сложный эфир и/или сольват или его полиморфы.
Настоящее изобретение обеспечивает микрокапсулы фексофенадина, фармацевтическую композицию, содержащую микрокапсулы немедленного высвобождения с замаскированным вкусом, которые содержат фексофенадин и нерастворимое в воде полимерное покрытие. Микрокапсулы фексофенадина могут быть в форме совместно гранулированных микрокапсул и могут содержать дополнительные неактивные ингредиенты и вспомогательные вещества. В одном варианте осуществления настоящего изобретения фексофенадин представляет собой фексофенадина гидрохлорид.
Фексофенадин настоящего изобретения может быть кристаллическим или аморфным или их комбинациями. Любые кристаллические формы фексофенадина включены и могут использоваться в получении микрокапсул, гранулята микрокапсул и совместно гранулированных микрокапсул настоящего изобретения.
Нерастворимый в воде полимер настоящего изобретения может быть любым подходящим, фармацевтически приемлемым нерастворимым в воде полимером, который формирует покрытие вокруг частиц фексофенадина и, таким образом, дает на выходе микрокапсулы фексофенадина, проявляющие свойства замаскированного вкуса и немедленного высвобождения. Примеры нерастворимых в воде полимеров, которые могут быть использованы в настоящем изобретении, включают этилцеллюлозу, поливинилацетат, ацетилцеллюлозу, ацетилцеллюлозы бутират, поливинилацетат, сополимеры аммония метакрилата и их смеси. В одном варианте осуществления нерастворимый в воде полимер настоящего изобретения представляет собой этилцеллюлозу.
Количество и тип полимера в покрытии содействует регулированию высвобождения фексофенадина, делая возможным модулировать степень маскировки вкуса и/или высвобождения фексофенадина. В настоящем изобретении полимер покрытия является нерастворимым в воде. Средний вес покрытия микрокапсул настоящего изобретения составляет от приблизительно 2% до приблизительно 40%, включая приблизительно 5%, приблизительно 10%, приблизительно 13%, приблизительно 15%, приблизительно 17%, приблизительно 18%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35% или приблизительно 40%. Типично, средний вес покрытия микрокапсул настоящего изобретения составляет от приблизительно 10% до приблизительно 20%. Более типично, средний вес покрытия составляет от приблизительно 13% до приблизительно 18%. В одном варианте осуществления настоящего изобретения микрокапсулы имеют средний вес покрытия приблизительно 15%.
Смачиваемость нерастворимого в воде покрытия микрокапсул может быть улучшена обработкой поверхностно-активными веществами. Слой поверхностно-активного вещества может быть нанесен на микрокапсулы путем суспендирования их в растворе, содержащем поверхностно-активное вещество, или с помощью способа распыления псевдоожиженного слоя. Раствор поверхностно-активного вещества включает по меньшей мере одно поверхностно-активное вещество и необязательно другие ингредиенты, такие как средства, способствующее скольжению, или средства, уменьшающие липкость. Поверхностно-активное вещество должно быть растворимым в растворителе, в котором полимер покрытия является практически нерастворимым при соответствующих условиях, таких как, например, при комнатной температуре. Подходящие поверхностно-активные вещества включают докузат натрия (DOSS), лаурилсульфат натрия, сложный эфир сахарозы и жирной кислоты, Tween, Lutrol F68, сорбитан олеат, сорбитан лаурат и т.д. Другие смачивающее средства могут быть выбраны среди: гидроксипропилцеллюлозы, полиэтиленгликоля 600, 1000, 3350 и 6000. В одном варианте осуществления поверхностно-активное вещество составляет в одном смысле вес./вес.% до приблизительно 10 вес./вес.%. Типично, концентрация поверхностно-активного вещества в растворе составляет между приблизительно 0,25 вес./вес.% и приблизительно 2 вес./вес.%, или между приблизительно 0,5 вес./вес.% и приблизительно 1,5 вес./вес.% или между 0,45 и 0,75 вес./вес.%. В одном варианте осуществления концентрация поверхностно-активного вещества в растворе составляет приблизительно 0,45, в другом приблизительно 0,6 вес./вес.%, в другом приблизительно 0,75%, в другом приблизительно 1 вес./вес.%, в еще одном приблизительно 1,5 вес./вес.%. Способы увлажнения также описаны в US 6509034. Конкретное средство, уменьшающее липкость, представляет собой диоксид кремния.
При необходимости, один или несколько дополнительных защитных слоев покрытия (например, Opadry Clear и т.д.) могут быть нанесены на микрокапсулы настоящего изобретения.
Дополнительный вариант осуществления настоящего изобретения представляет собой гранулят микрокапсул фексофенадина с замаскированным вкусом, покрытых нерастворимым в воде полимером.
В настоящем изобретении не менее чем 80% микрокапсул фексофенадина немедленного высвобождения с замаскированным вкусом имеют распределение частиц по размерам (PSD) ниже 500 микрон; предпочтительно не менее чем 80% микрокапсул имеют PSD ниже 355 микрон; даже предпочтительно, что не менее чем 80% микрокапсул имеют PSD ниже 250 микрон. В дополнительном варианте осуществления не менее чем 80% микрокапсул имеют распределение частиц по размерам ниже 200 микрон. Микрокапсулы немедленного высвобождения с замаскированным вкусом также используются для получения совместно гранулированных микрокапсул немедленного высвобождения с замаскированным вкусом.
Дополнительный вариант осуществления представляет собой совместный гранулят микрокапсул с нерастворимым в воде покрытием и по меньшей мере одного неактивного ингредиента. Совместные грануляты получают, когда микрокапсулы гранулируют с частью по меньшей мере одного неактивного ингредиента.
Неактивные ингредиенты могут быть выбраны, например из группы, включающей сахарный спирт и сахариды, такие как сахароза, ксантановая камедь, бета-циклодекстрин, ксилит, сорбит, маннитол, лактоза, арабит, изомальт, глицерин, альгинат, микрокристаллическая целлюлоза, карбоксиметилцеллюлоза или их смесь. Разрыхлители в комбинации с сахарными спиртами или сахаридами могут также быть подходящими неактивными ингредиентами для добавления к микрокапсулам фексофенадина или совместным гранулятам.
Совместный гранулят микрокапсул, раскрытый в данном документе, состоит из микрокапсул фексофенадина, имеющих нерастворимое в воде покрытие и по меньшей мере один неактивный ингредиент. Конкретные варианты осуществления соотношений микрокапсула : неактивный ингредиент(ы) находятся между 1:3 и 1:10, между 1:5 и 1:8 и между 1:6 или 1:7.
Совместный гранулят микрокапсул фексофенадина настоящего изобретения имеет растворение высвобождение, сравнимое с таковым увлажненных микрокапсул. В одном варианте осуществления размер частиц совместного гранулята предпочтительно менее 600 мкм с малым количеством гранул менее 125 мкм. Уменьшенное количество тонкой фракции является относительным, так как эта фракция почти полностью состоит из негранулированных микрокапсул, и присутствие высоких уровней этой фракции может коррелировать с низкой гомогенностью совместного гранулята.
В одном варианте осуществления совместный гранулят имеет следующие характеристики: соотношение 1:7; отклонение гомогенности <5,0%; тонкая фракция менее 125 мкм <5,0%; фракция выше 600 мкм <10,0%; выход способа приблизительно 97,0%. Другой конкретный вариант осуществления настоящего изобретения представляет собой случай, когда эти совместные грануляты имеют следующие характеристики: соотношение 1:7; отклонение гомогенности <5,0%; тонкая фракция менее 125 мкм <5,0%; фракция выше 600 мкм <5,0%; выход способа приблизительно 97,0%.
Дополнительный вариант осуществления настоящего изобретения представляет собой смесь совместного гранулята микрокапсул фексофенадина и по меньшей мере гранулята неактивного ингредиента. Гранулят неактивного ингредиента содержит один или несколько неактивных ингредиентов и может быть выбран, например, из группы, включающей сахарный спирт и сахарид, такой как сахароза, ксантановая камедь, бета-циклодекстрин, ксилит, сорбит, маннитол, лактоза, арабитол, изомальт, глицерин, альгинат, микрокристаллическая целлюлоза, карбоксиметилцеллюлоза или их смесь. Разрыхлители в комбинации с сахарными спиртами или сахаридами могут также быть подходящими неактивными ингредиентами для добавления к совместным-гранулятам.
Предпочтительно смесь (также имеющая название нерасфасованная смесь) имеет совместный гранулят микрокапсул и гранулированный неактивный ингредиент(ы) в соотношении 1:1. Предпочтительный совместный гранулят содержит микрокапсулу фексофенадина, сахарозу и ксантановую камедь, и гранулированный неактивный ингредиент содержит сахарозу.
Дополнительный вариант осуществления настоящего изобретения представляет собой фармацевтическую композицию, содержащую микрокапсулы фексофенадина с замаскированным вкусом, покрытые нерастворимым в воде полимером. Указанная композиция содержит микрокапсулы фексофенадина и дополнительный по меньшей мере один неактивный ингредиент, который может быть гранулированным или негранулированным, и/или по меньшей мере одно вспомогательное вещество.
В одном варианте осуществления настоящего изобретения фармацевтическая композиция настоящего изобретения содержит совместный гранулят микрокапсул фексофенадина, смешанный с по меньшей мере одним неактивным ингредиентом, который может быть гранулированным или негранулированным. Конкретный вариант осуществления настоящего изобретения представляет собой такой, где фармацевтическая композиция имеет совместные грануляты микрокапсул и по меньшей мере один гранулированный неактивный ингредиент в соотношении 1:1.
Фармацевтические композиции настоящего изобретения обеспечивают немедленное высвобождение активного ингредиента, например, фексофенадина гидрохлорида. В одном варианте осуществления композиции настоящего изобретения высвобождают по меньшей мере, приблизительно 60% фексофенадина гидрохлорида в пределах 15 минут в жидкости с pH 6,8 по 2-му изданию фармакопеи Японии (Фармакопея Японии). В другом варианте осуществления композиции настоящего изобретения высвобождают по меньшей мере приблизительно 65% фексофенадина гидрохлорида в пределах 15 минут в жидкости с pH 6,8 по 2-му изданию фармакопеи Японии. В еще одном варианте осуществления композиции настоящего изобретения высвобождают по меньшей мере приблизительно 70% фексофенадина гидрохлорида в пределах 15 минут в жидкости с pH 6,8 по 2-му изданию фармакопеи Японии. В еще одном варианте осуществления композиции настоящего изобретения высвобождают по меньшей мере приблизительно 75% фексофенадина гидрохлорида в пределах 15 минут в жидкости с pH 6,8 по 2-му изданию фармакопеи Японии. В еще одном варианте осуществления композиции настоящего изобретения высвобождают по меньшей мере приблизительно 80% фексофенадина гидрохлорида в пределах 15 минут в жидкости с pH 6,8 по 2-му изданию фармакопеи Японии. В еще одном варианте осуществления композиции настоящего изобретения высвобождают по меньшей мере приблизительно 85% фексофенадина гидрохлорида в пределах 15 минут в жидкости с pH 6,8 по 2-му изданию фармакопеи Японии. В еще одном варианте осуществления композиции настоящего изобретения высвобождают по меньшей мере приблизительно 90% фексофенадина гидрохлорида в пределах 15 минут в жидкости с pH 6,8 по 2-му изданию фармакопеи Японии. В другом варианте осуществления композиции настоящего изобретения высвобождают по меньшей мере приблизительно 95% фексофенадина гидрохлорида в пределах 15 минут в жидкости с pH 6,8 по 2-му изданию фармакопеи Японии.
В другом варианте осуществления композиции, описанные выше, могут быть скомбинированы с по меньшей мере одним дополнительным фармацевтическим вспомогательным веществом. Вспомогательные вещества для применения в композициях или лекарственных формах настоящего изобретения включают наполнители, разбавители, средства, способствующее скольжению, разрыхлители, связующие средства, скользящие вещества и т.д. Другие фармацевтически приемлемые вспомогательные вещества включают подкисляющие средства, подщелачивающие средства, консерванты, антиоксиданты, буферные средства, хелатирующие средства, красящие вещества, комплексообразующие средства, эмульгирующие и/или солюбилизирующие средства, ароматизаторы и отдушки, увлажняющие средства, подсластители, смачивающие средства и т.д.
Примеры подходящих наполнителей, разбавителей и/или связующих средств включают без ограничения лактозу (например, лиофилизированная лактоза, α-лактоза, β-лактоза. Tabletose®, различные сорта Pharmatose®, Microtose® или Fast-Floc®), микрокристаллическую целлюлозу (например Avicel PH101, Avicel PH102, Ceolus KG-802, Ceolus KG-1000, Prosolv SMCC 50 или SMCC90, различные сорта Elcema®, Vivacel®, Ming Tai® или Solka-Floc®), гидроксипропилцеллюлозу, L-гидроксипропилцеллюлозу (слабозамещенная), гидроксипропилметилцеллюлозу (HPMC) (например, Methocel E, F и K, Metolose SH от Shin-Etsu, Ltd, такая как, например, 4000 сП (сантипуаз) сорта Methocel E и Metolose 60 SH, 4000 сП сорта Methocel F и Metolose 65 SH, 4000, 15000 и 100000 сП сорта Methocel K; и 4000, 15000, 39000 и 100000 сорта Metolose 90 SH), полимеры метилцеллюлозы (такие как, например, Methocel A, Methocel А4С, Methocel А15С, Methocel A4M), гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу натрия, карбоксиметилгидроксиэтилцеллюлозу и другие производные целлюлозы, сахарозу, ксантановую камедь, циклодекстрин (например, бета-циклодекстрин), агарозу, сорбит, маннит, декстрины, мальтодекстрины, крахмалы или модифицированные крахмалы (включая картофельный крахмал, маисовый крахмал и рисовый крахмал), фосфат кальция (например, основной фосфат кальция, гидрофосфат кальция, гидрат фосфата дикальция), сульфат кальция, карбонат кальция, альгинат натрия, коллаген и т.д. или их комбинации.
Специфические примеры разбавителей включают, например, карбонат кальция, двухосновный фосфат кальция, трехосновный фосфат кальция, сульфат кальция, микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстраны, декстрин, декстрозу, фруктозу, каолин, лактозу, маннитол, сорбит, крахмал, прежелатинизированный крахмал, сахарозу, ксантановую камедь, бета-циклодекстрин и т.д. и их комбинации.
Специфические примеры средств, способствующих скольжению, и скользящих веществ включают, например, диоксид кремния, стеариновую кислоту, стеарат магния, стеарат кальция или другие металлические стеараты, тальк, воск и глицериды, легкое минеральное масло, ПЭГ, глицерил бегенат, коллоидную окись кремния, гидрогенизованные растительные масла, кукурузный крахмал, стеарил фумарат натрия, полиэтиленгликоли, алкилсульфаты, бензоат натрия, ацетат натрия и т.д.
Другие вспомогательные вещества включают, например, ароматизирующие средства, красящие вещества, маскирующие вкус средства, pH-регулирующие средства, буферные средства, консерванты, стабилизирующие средства, антиоксиданты, смачивающие средства, регулирующие влажность средства, поверхностно-активные средства, суспендирующие средства, усиливающие абсорбцию средства, средства для модифицированного высвобождения и т.д.
Неограничивающие примеры ароматизирующих средств включают, например, вишневый, апельсиновый, банановый, клубничный или другие приемлемые фруктовые ароматизаторы или смеси вишневого, апельсинового и других приемлемых фруктовых ароматизаторов в концентрации до, например, приблизительно 3% на основе веса таблетки. Дополнительно композиции настоящего изобретения могут также включать один или несколько подсластителей, таких как аспартам, сукралоза или другие фармацевтически приемлемые подсластители, или смеси таких подсластителей, в концентрации до приблизительно 2% по весу на основе веса таблетки. Кроме того, композиции настоящего изобретения могут включать один или несколько FD&C красителей в концентрации до, например, 0,5% по весу на основе веса таблетки.
Антиоксиданты включают, например, аскорбиновую кислоту, аскорбил пальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, гипофосфорную кислоту, монотиоглицерол, метабисульфит калия, пропил галлат, формальдегид сульфоксилат натрия, метабисульфит натрия, тиосульфат натрия, диоксид серы, токоферол, токоферол ацетат, токоферол гемисукцинат, TPGS или другие производные токоферола и т.д.
Микрокапсулы фексофенадина или совместно гранулированные микрокапсулы настоящего изобретения могут быть составлены в разнообразные конечные лекарственные формы, включая таблетки (например, перорально распадающиеся жевательные, диспергируемые, быстрого растворения, шипучие), твердые желатиновые капсулы и опрыскивание, суспензии, саше для стабильных или приготовленных для немедленного приема суспензий, и саше для прямого введения в рот.
Микрокапсулы или совместно гранулированные микрокапсулы настоящего изобретения или их смесь могут также быть составлены в виде сухого сиропа в присутствии подходящих неактивных ингредиентов и возможных дополнительных вспомогательных веществ. Состав сухого сиропа представляет собой порошок быстрого растворения, который составлен для простоты проглатывания. Он может быть введен непосредственно в форме порошка или вначале гидратирован с помощью жидкости, например, 3-5 мл воды в столовой ложке или 15-50 мл воды в стакане. Способы осуществления составов сухого сиропа описаны в Публикации США №2008/0064713, включенной в данный документ ссылкой для всех целей.
Предпочтительный сухой сироп состоит из совместного гранулята микрокапсул фексофенадина с замаскированным вкусом в соотношении 1:1 к гранулированным неактивным ингредиентам; совместный гранулят имеет следующие характеристики: микрокапсулы находятся в соотношении 1:7 к неактивному ингредиенту; совместные грануляты содержат сахарозу и ксантановую камедь, гранулированный неактивный ингредиент содержит сахарозу. Сухой сироп фексофенадина по настоящему изобретению имеет физико-химические свойства, такие как размер частиц, скорость растворения, маскировка вкуса, на которые этап фасовки влияет очень в малой степени. Этот сухой сироп имеет высокую гомогенность. В одном варианте осуществления настоящего изобретения совместный гранулят имеет отклонение гомогенности <5,0%; тонкую фракцию менее 125 мкм <5,0%; фракцию более 600 мкм <5,0%; выход способа приблизительно 97,0%.
Сухой сироп расфасован в саше или пакет-трубочку. Саше выбрано согласно способности точно дозировать продукт, минимальному достижимому весу фасовки, устойчивости к механическому давлению на гранулят; применению различной конфигурации упаковки. Для плоского саше и различных весов фасовки любая известная упаковка может быть использована. Конкретные веса фасовки составляют 300 и 600 мг, они здесь применены в получении очень низких концентраций дозировок лекарственного препарата (15 и 30 мг). Конечная упаковка может иметь различные конфигурации, такие как пакет-трубочка или плоский пакет; один пример упаковки может состоять в пяти коробках в линию, соединенных вместе с помощью PE пленки.
Микрокапсулы фексофенадина с замаскированным вкусом настоящего изобретения могут быть получены путем коацервации, которая представляет собой эффективную технологию для получения микрокапсул с замаскированным вкусом. Способ коацервации включает высаливание макромолекул в жидкоподобные коллоидные капли, а не в твердые или гелевые агрегаты. Коацервация может быть проведена, как описано в Патентах США №№5252337, 5639475, 6139865 и 6495160, полное содержание которых точно включено ссылкой в данный документ для всех целей.
Микрокапсулы настоящего изобретения могут быть получены путем обеспечения гомогенного раствора нерастворимого в воде полимера в подходящем растворителе, в котором активный ингредиент и, необязательно, добавки покрытия диспергированы в суспензии. Разделение фаз может затем быть проведено для того, чтобы вызвать инсолюбилизацию нерастворимого в воде полимера, который образует гель (коацервирует) вокруг частиц активного ингредиента для формирования микрокапсул. Разделение фаз может быть проведено, например, посредством изменения температуры или в рН или путем добавления к органическому растворителю средства, индуцирующего разделение фаз (т.е. средства-индуктора фаз), что вызывает инсолюбилизацию нерастворимого в воде полимера. В итоге, полученные микрокапсулы подвергают затвердению, при необходимости, и восстанавливают.
Более конкретно, способ получения частиц немедленного высвобождения с замаскированным вкусом по настоящему изобретению включает следующие этапы: (а) растворение нерастворимого в воде полимера в органическом растворителе; (b) суспендирование фексофенадина в органическом растворителе; (с) нанесение покрытия нерастворимого в воде полимера на фексофенадин путем разделения фаз; и (d) отделение микрокапсул от указанного органического растворителя, например, путем фильтрования, центрифугирования; и (е) удаление остаточного органического растворителя путем высушивания микрокапсул.
Как обсуждается выше, этап разделения фаз может быть проведен путем изменения температуры или pH, или путем добавления к органическому растворителю средства-индуктора фаз, которое вызывает инсолюбилизацию нерастворимого в воде полимера. В одном варианте осуществления этап разделения фаз проводят путем добавления к органическому растворителю средства-индуктора фаз. Подходящие средства-индукторы фаз, которые могут быть использованы в настоящем изобретении, включают полиэтилен, полиизобутилен, бутилкаучук, полибутадиен, изопрен метакриловые полимеры, кремнийорганические полимеры, такие как полидиметил силоксан, парафин и т.д. В одном варианте осуществления средство-индуктор фаз представляет собой полиэтилен.
Органический растворитель может быть отдельным органическим растворителем, или он может включать смесь органических растворителей. В соответствии со способом коацервации органический растворитель выбран так, чтобы растворять полимер покрытия, но не активный ингредиент. Подходящие органические растворители включают циклогексан или другие углеводородные растворители. В одном варианте осуществления органический растворитель представляет собой циклогексан.
Не ограничивающие примеры подходящих нерастворимых в воде полимеров включают этилцеллюлозу, ацетилцеллюлозу, ацетилцеллюлозы бутират, поливинилацетат, нейтральные сополимеры метакриловой кислоты и метилметакрилата и их смеси. В одном варианте осуществления способа получения частиц немедленного высвобождения с замаскированным вкусом по настоящему изобретению нерастворимый в воде полимер представляет собой этилцеллюлозу, средство-индуктор фаз представляет собой полиэтилен, растворитель представляет собой циклогексан, и фексофенадин представляет собой фексофенадина гидрохлорид.
Совместные грануляты микрокапсул фексофенадина с замаскированным вкусом получают путем совместного гранулирования микрокапсул (полученных, как описано выше) с неактивным ингредиентом (например, сахарным спиртом и/или сахаридом) в форме тонкого порошка в псевдоожиженном слое путем распыления связующего раствора. Способ включает следующие этапы: 1) микроинкапсулирование фексофенадина; 2) необязательное увлажнение микрокапсул; 3) добавление увлажненных или неувлажненных микрокапсул фексофенадина к неактивному ингредиенту(ам); 4) распыление связующего раствора; 5) высушивание гранул; и 6) просеивание гранул.
Грануляция может быть проведена в традиционном грануляторе согласно традиционным техникам. Связующий раствор состоит из одного или нескольких неактивных ингредиентов, предпочтительно состоит из двух неактивных ингредиентов; это является особенно подходящим для получения эффективной грануляции микрокапсулы с сахарозой. Связующий раствор предпочтительно состоит из сахарозы и ксантановой камеди. Другие неактивные ингредиенты могут быть выбраны из группы, включающей сахара, сахарные спирты, сахариды, сахар/сахарный спирт в комбинации с разрыхлителями.
Следующие параметры находятся под контролем во время этого способа: количество связующего раствора; соотношение между влажными микрокапсулами и неактивным ингредиентом(ами); скорость распыления связующего раствора; давление распыления; поток воздуха. Высушивание гранул проводят при таких же контролируемых условиях в температуре входящего воздуха, входящем потоке воздуха и т.д. Гранулы просеивают через сетку из нержавеющей стали с 840 мкм.
Совместный гранулят затем смешивают с гранулятом неактивного ингредиента(ов). Конечная смесь содержит вышеназванный совместный гранулят и гранулят неактивного ингредиента(ов). В конкретном варианте осуществления эта фармацевтическая композиция имеет совместный гранулят и гранулированный неактивный ингредиент(ы) в соотношении 1:1.
Конкретный гранулят неактивного ингредиента(ов) состоит из сахарозы. Гранулят получают способом, включающим следующие этапы: 1) добавление неактивного ингредиента(ов); 2) распыление связующего раствора; 3) высушивание гранул; и 4) просеивание и калибровку. Во время этого способа контролируются следующие экспериментальные условия: количество гранулируемого порошка; скорость распыления раствора; давление распыления; и влажность входящего воздуха. Поток воздуха поддерживают постоянным. Все этапы высушивания проводят в таких же условиях (температура входящего воздуха, поток входящего воздуха и т.д.). Гранулы просеивают через сетку из нержавеющей стали 600 мкм или 840 мкм. Гранулы, большие чем 840 мкм, продавливаются через гранулятор с 600 мкм ситом.
Смешивание совместного гранулята, гранул неактивного ингредиента(ов), вместе с дополнительными ингредиентами (такими как ароматизатор, средства, способствующее скольжению) проводят при контролируемой скорости вращения в течение подходящего времени смешивания.
Способ получения сухого сиропа фексофенадина включает следующие различные этапы: 1) микроинкапсулирование фексофенадина; 2) необязательное увлажнение микрокапсул; 3) совместное гранулирование увлажненных или неувлажненных микрокапсул с по меньшей мере одним неактивным ингредиентом (таким как сахароза); 4) отдельное гранулирование неактивного ингредиента(ов) (такого как сахароза); 5) смешивание совместного гранулята фексофенадина, полученного на этапе 3), вместе с гранулированным неактивным ингредиентом(ами) (таким как сахароза), полученным на этапе 4), и с необязательными дополнительными ингредиентами (такими как ароматизаторы и диоксид кремния); и 6) фасовка нерасфасованной смеси сухого сиропа фексофенадина этапа 5) в саше.
Настоящее изобретение дополнительно обеспечивает способ лечения состояния, связанного с воспалением, у индивидуума. Способ включает введение индивидууму, нуждающемуся в этом, фармацевтической композиции, содержащей микрокапсулы немедленного высвобождения с замаскированным вкусом, где микрокапсулы содержат фексофенадин и нерастворимое в воде полимерное покрытие. Состояния, связанные с воспалением, которые можно лечить согласно настоящему изобретению, включают сезонный аллергический ринит и хроническую идиопатическую крапивницу.
Доза фексофенадина гидрохлорида, подлежащая введению индивидууму, может изменяться в зависимости от возраста индивидуума, подлежащего лечению, а также назначения. Обычные дозы фексофенадина гидрохлорида составляют 15 мг дважды в день, 30 мг дважды в день, 60 мг дважды в день и 180 мг один раз в день. Следовательно, конечные лекарственные формы, полученные с композициями настоящего изобретения, могут включать, например, 15 мг фексофенадина гидрохлорида, 30 мг фексофенадина гидрохлорида, 60 мг фексофенадина гидрохлорида или 180 мг фексофенадина гидрохлорида.
Следующие примеры обеспечиваются для целей иллюстрации, и ни в коем случае не должны рассматриваться как ограничивающие настоящее изобретение.
КРАТКОЕ ОПИСАНИЕ ФИГУР
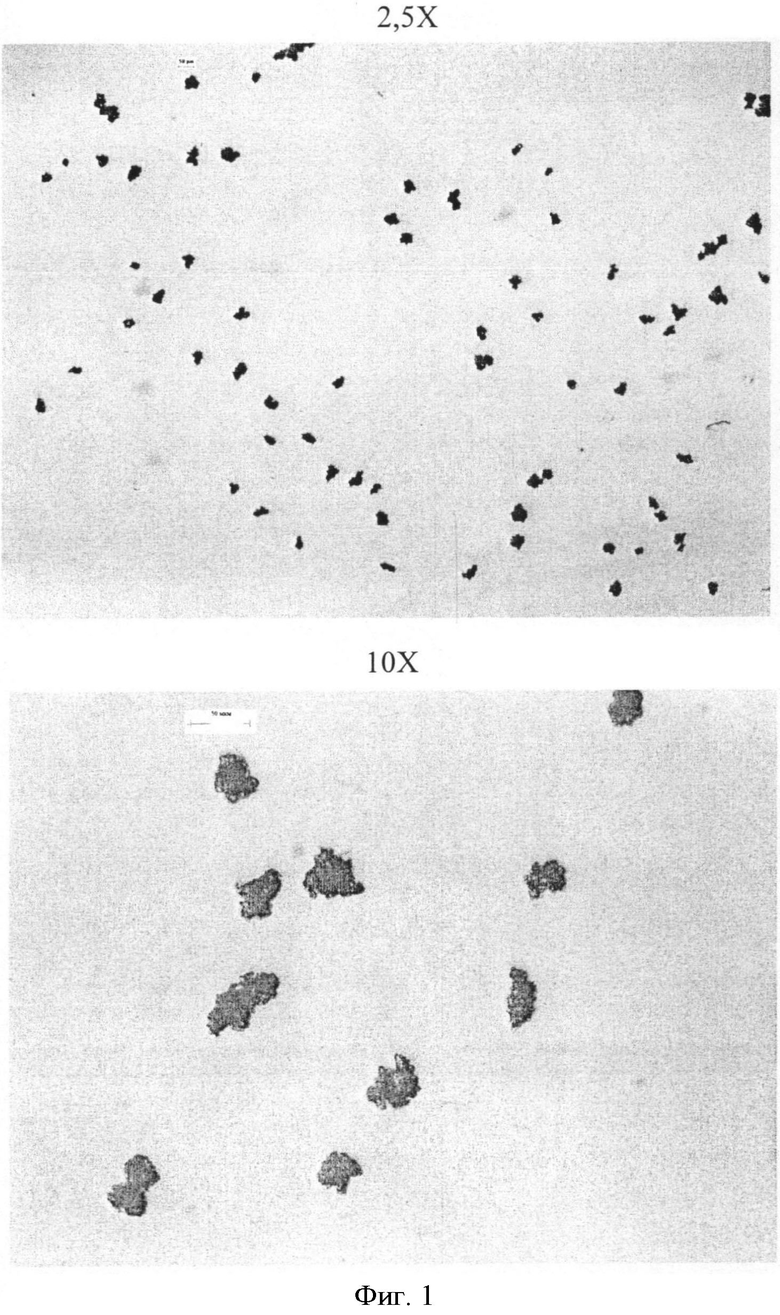
Фигура 1: Микрофотографии микрокапсул фексофенадина в циклогексане Образца 1 (средний вес этилцеллюлозы 10%).
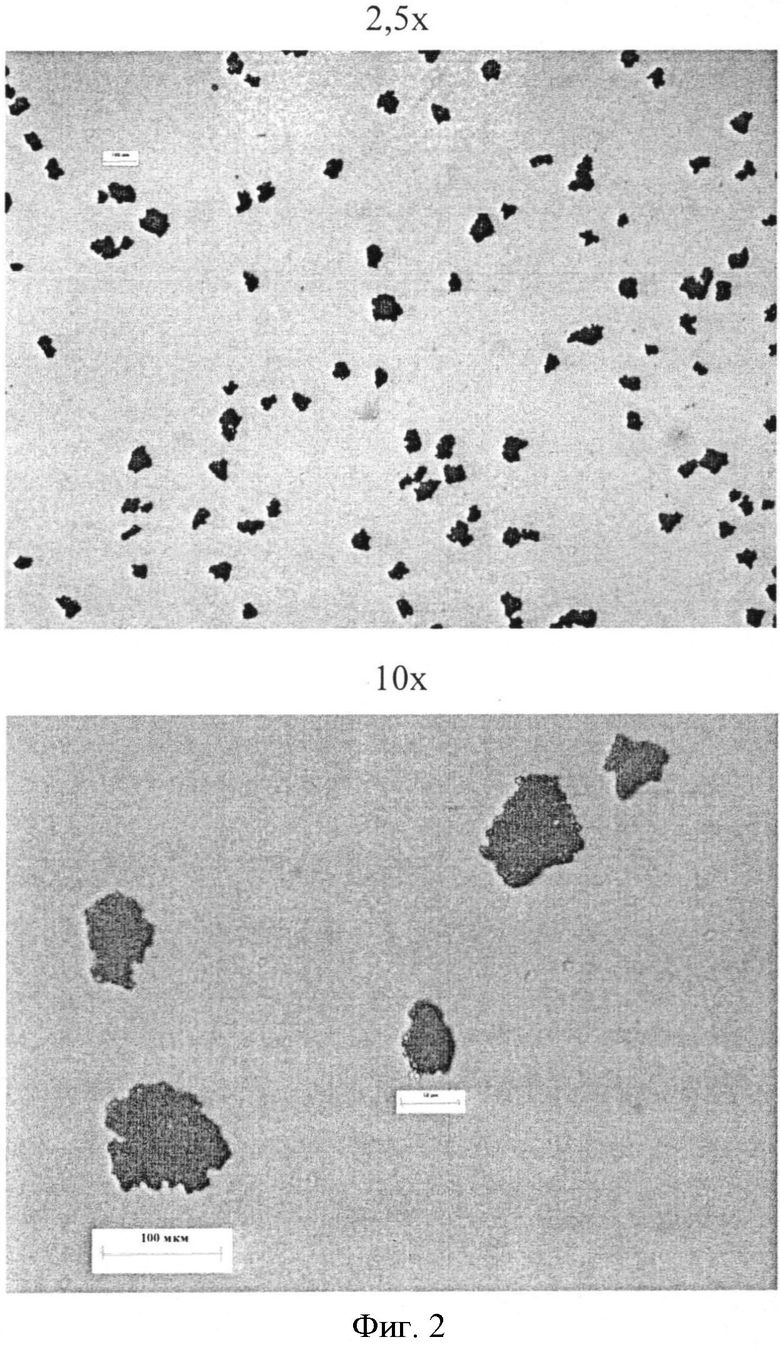
Фигура 2: Микрофотографии микрокапсул фексофенадина в циклогексане Образца 2 (средний вес этилцеллюлозы 13%).
Фигура 3: Микрофотографии микрокапсул фексофенадина в циклогексане Образца 3 (средний вес этилцеллюлозы 15%).
Фигура 4: Микрофотографии микрокапсул фексофенадина в циклогексане Образца 5 (средний вес этилцеллюлозы 17%).
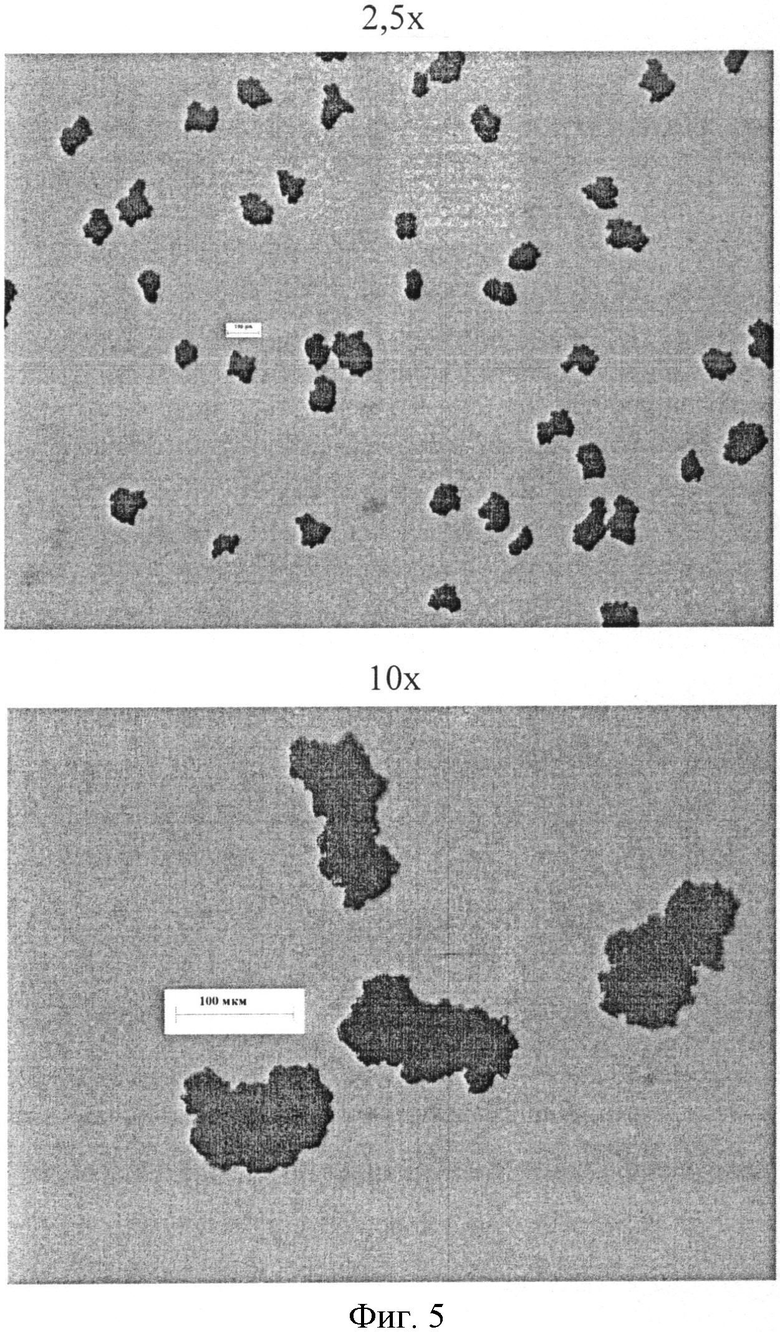
Фигура 5: Микрофотографии микрокапсул фексофенадина в циклогексане Образца 6 (средний вес этилцеллюлозы 20%).
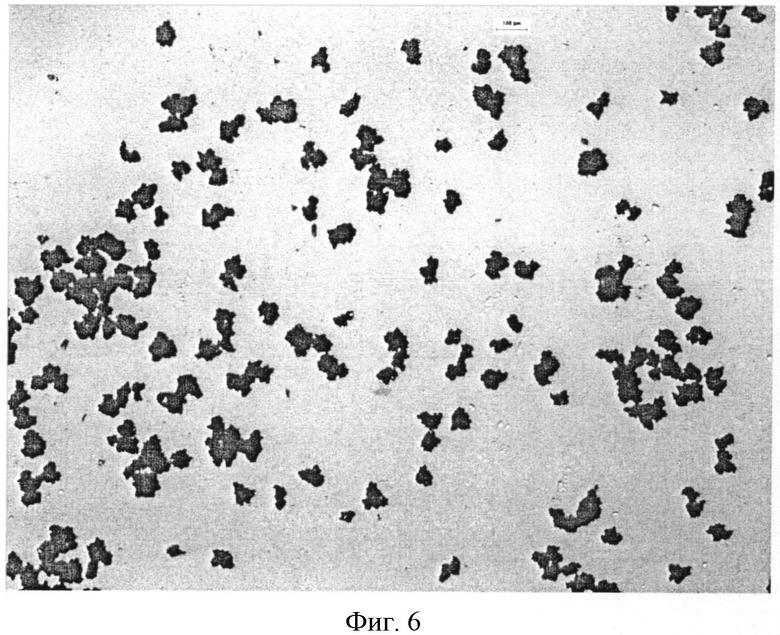
Фигура 6: Микрофотоснимок микрокапсулы Образца 4 - 15% этилцеллюлозы (увеличение в 2,5 раза).
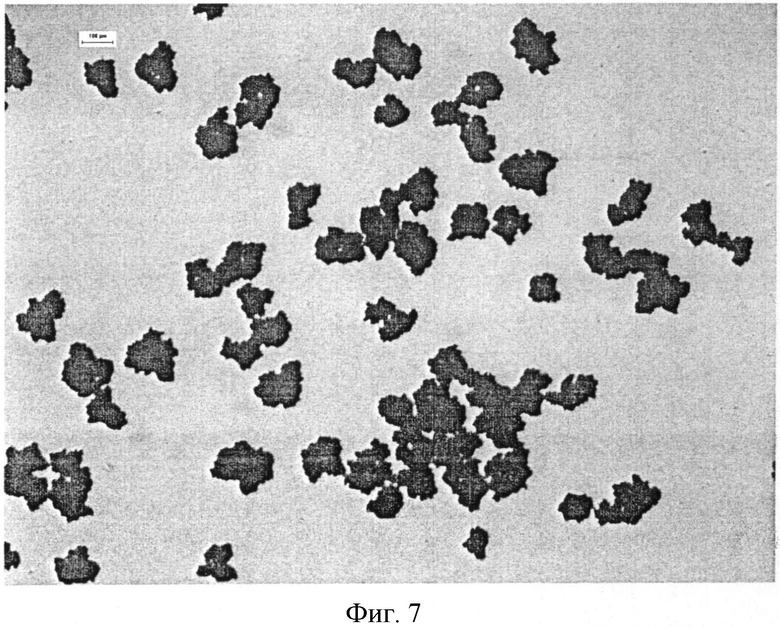
Фигура 7: Микрофотоснимок микрокапсулы Образца 7 - 20% этилцеллюлозы (увеличение в 2,5 раза).
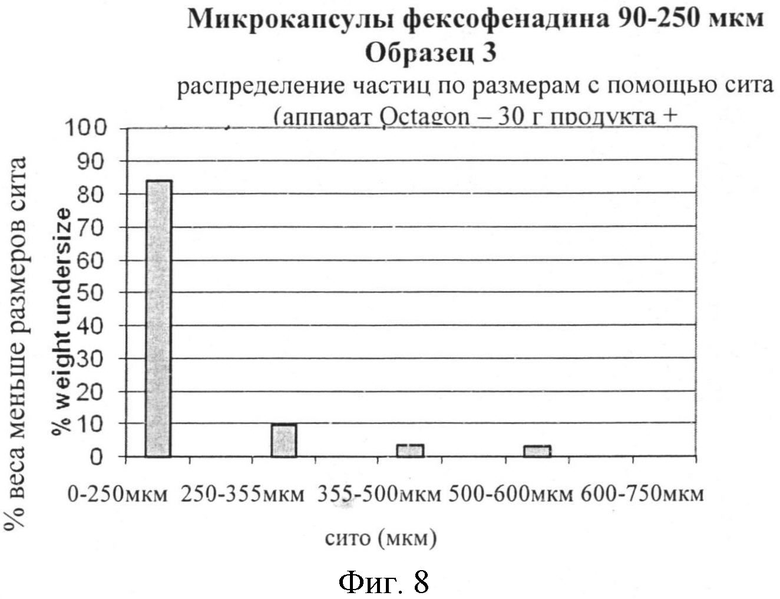
Фигура 8: Распределение частиц но размерам (PSD) микрокапсул с 15% этилцеллюлозы.
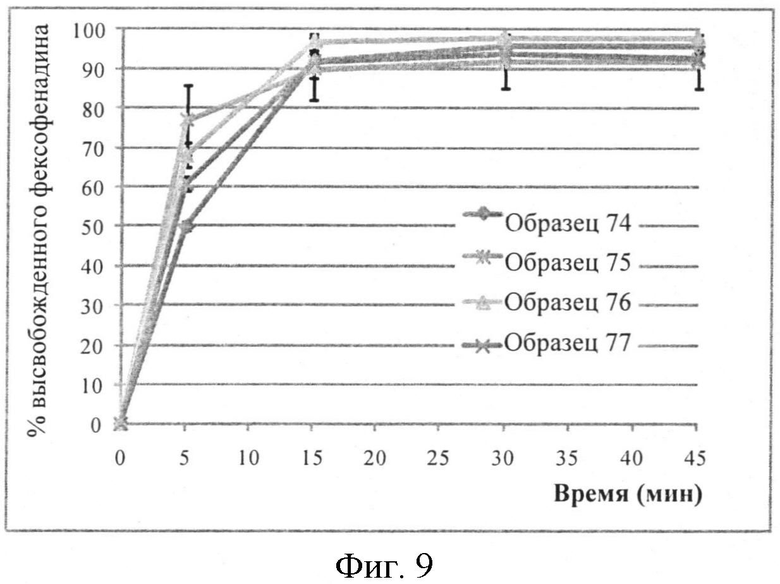
Фигура 9: Профили растворения микрокапсул фексофенадина, этилцеллюлозы 15%, в буферной жидкости с pH 6,8 по 2-му изданию фармакопеи Японии (n=6).
Фигура 10: Профили растворения микрокапсул фексофенадина с или без 0,5 мл DOSS 0,01M в средах растворения.
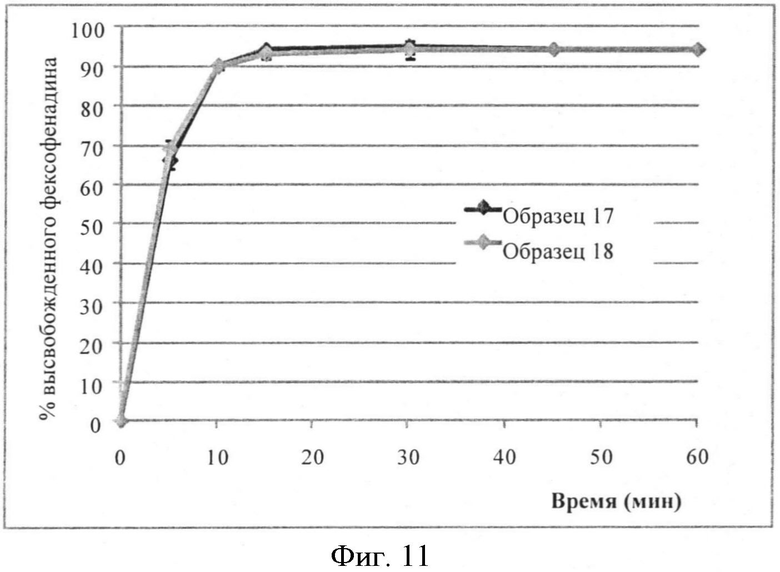
Фигура 11: Профили растворения фексофенадина из промышленных увлажненных микрокапсул, буферная жидкость с pH 6,8 по 2-му изданию фармакопеи Японии (n=6).
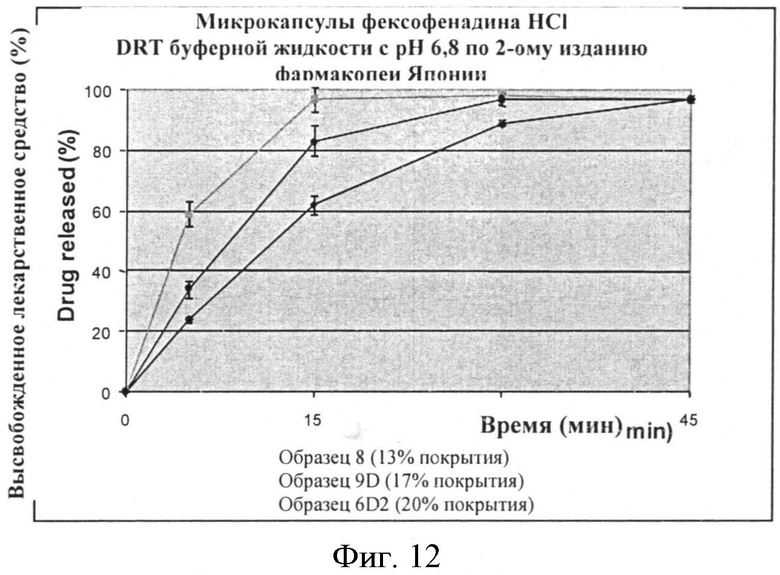
Фигура 12: Скорость растворения фексофенадина из микрокапсул с тремя различными средними весовыми уровнями этилцеллюлозы.
Фигура 13: Профили растворения в жидкости с pH 6,8 по 2-му изданию фармакопеи Японии увлажняемых микрокапсул при различных уровнях этилцеллюлозы.
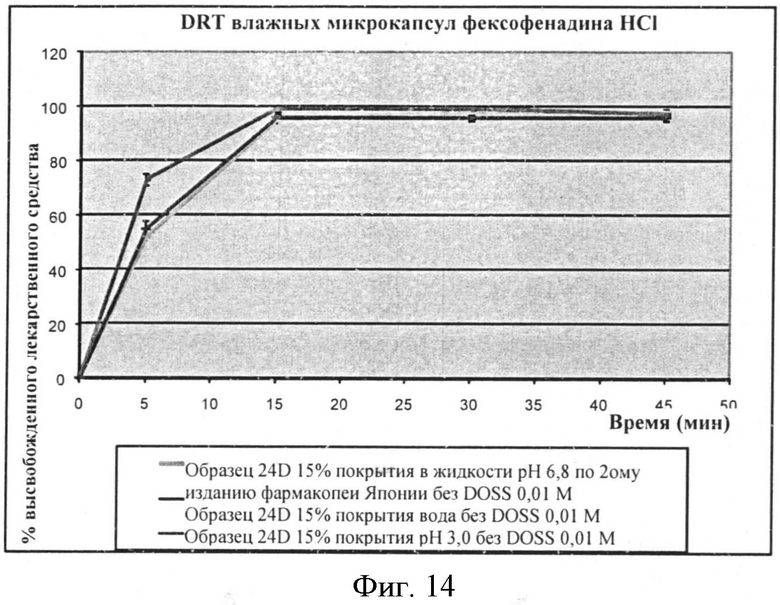
Фигура 14: Профили растворения микрокапсул фексофенадина в различных средах растворения.
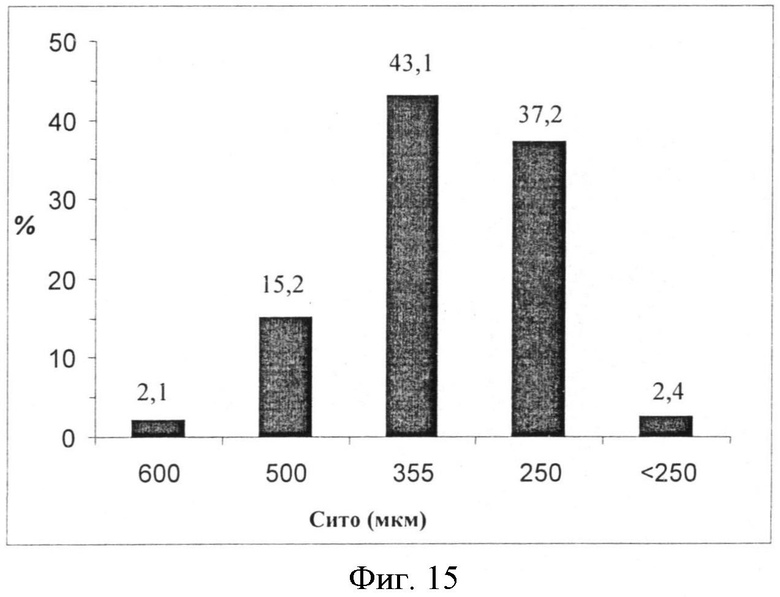
Фигура 15: Анализ размера частиц SG гранулята (ОБРАЗЕЦ 68), выбранная фракция 250-600 мкм.
Фигура 16: Анализ размера частиц SGX гранулята (ОБРАЗЕЦ 69), выбранная фракция 250-600 мкм.
Фигура 17: Анализ размера частиц SβCD гранулята (ОБРАЗЕЦ 70), выбранная фракция 250-600 мкм.
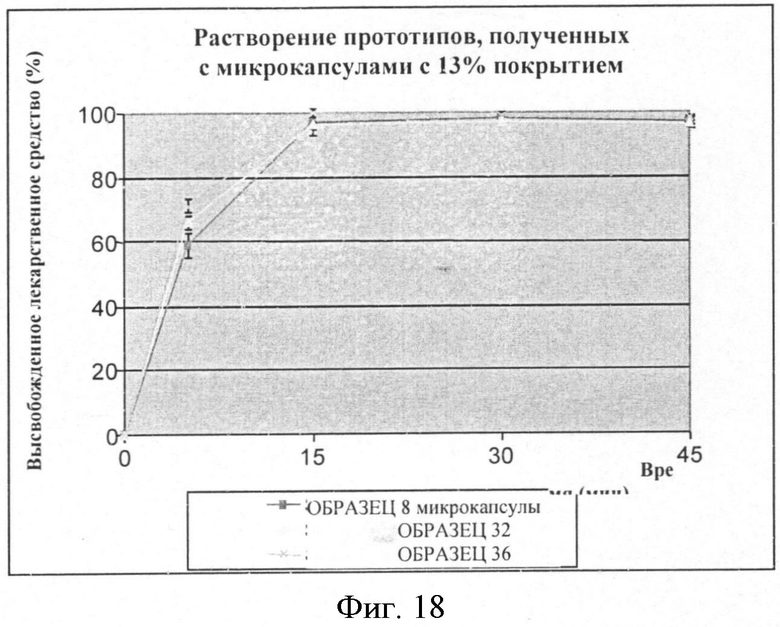
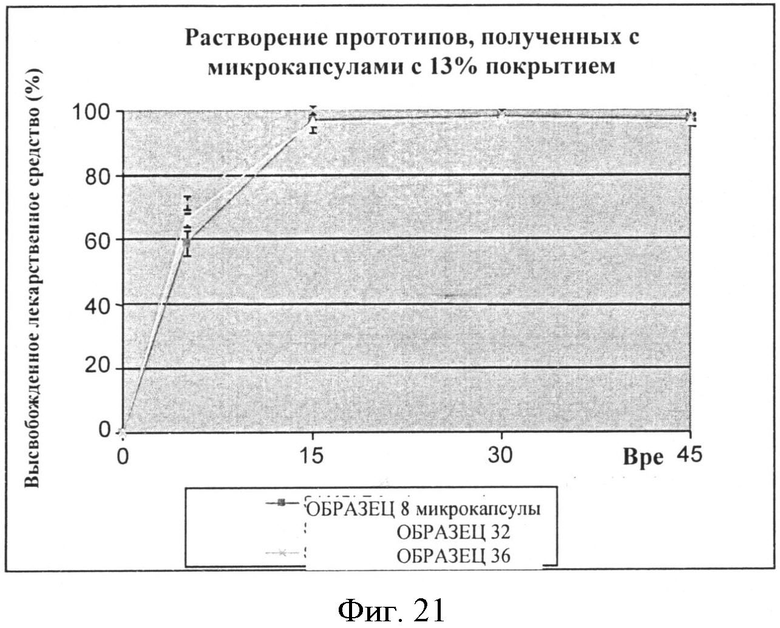
Фигура 18: Скорость растворения фексофенадина из микрокапсул со средним весом этилцеллюлозы 13%.
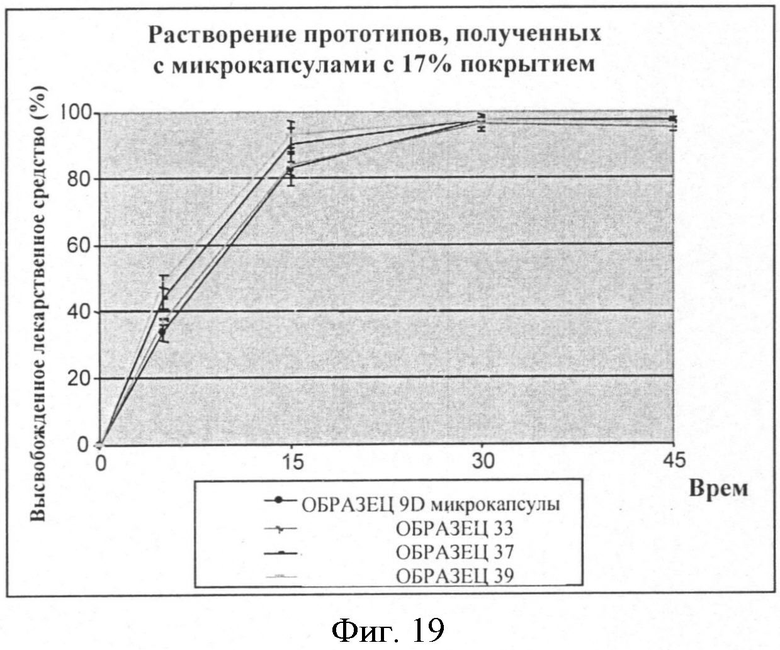
Фигура 19: Скорость растворения фексофенадина из составов, содержащих микрокапсулы со средним весом этилцеллюлозы 17%.
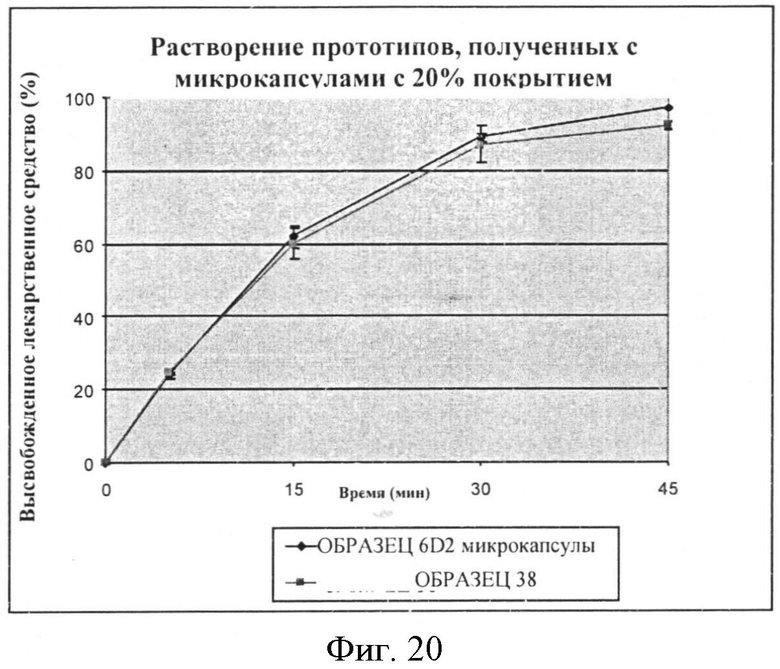
Фигура 20: Скорость растворения фексофенадина из составленных и без добавок микрокапсул со средним весом этилцеллюлозы 20%.
Фигура 21: Профили растворения при pH 6,8 (жидкость по 2-му изданию фармакопеи Японии) микрокапсул с 13% этилцеллюлозы (ОБРАЗЕЦ 8) и соответствующих прототипов ОБРАЗЕЦ 36 - ОБРАЗЕЦ 32.
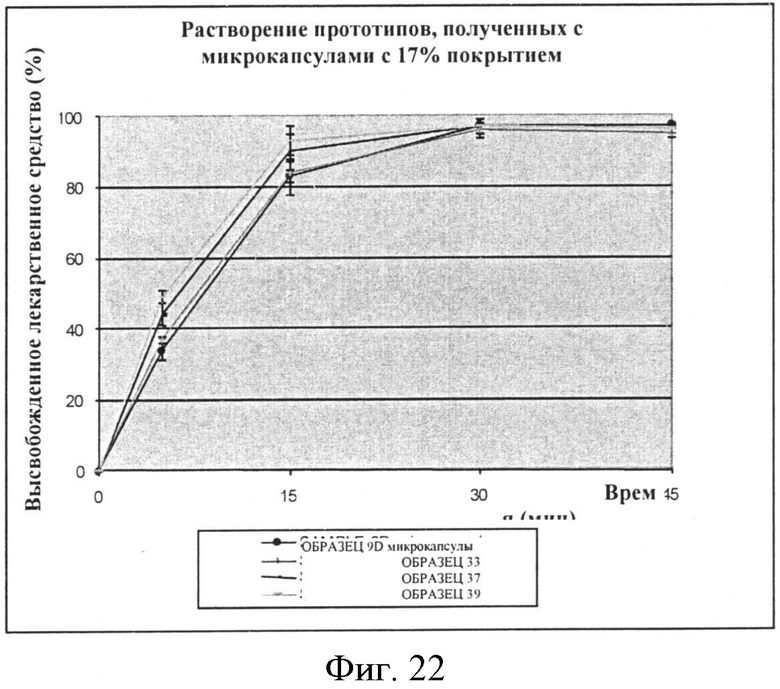
Фигура 22: Профили растворения при pH 6,8 (жидкость по 2-му изданию фармакопеи Японии) микрокапсул с 17% этилцеллюлозы (ОБРАЗЕЦ 9-D) и соответствующих прототипов ОБРАЗЕЦ 37 - ОБРАЗЕЦ 39 - ОБРАЗЕЦ 33.
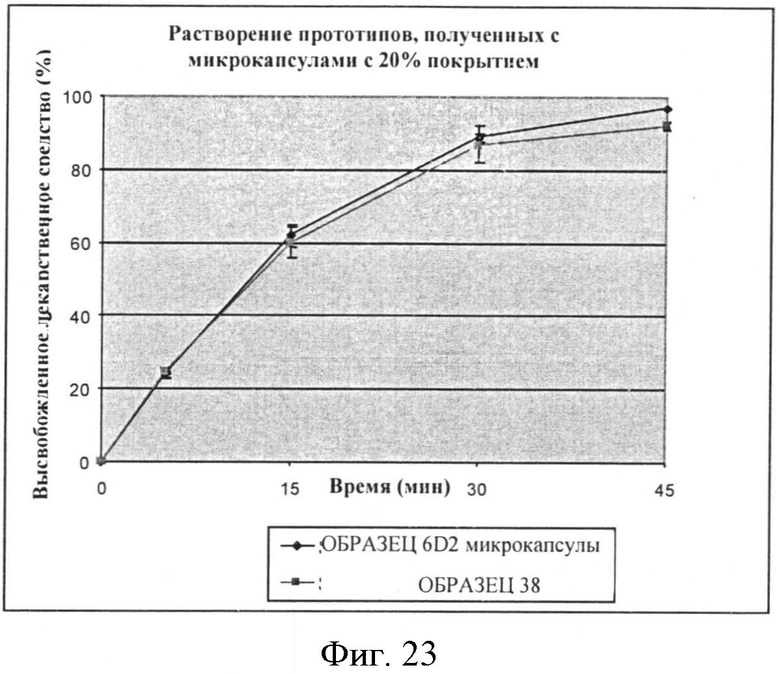
Фигура 23: Профили растворения при pH 6,8 (жидкость по 2-му изданию фармакопеи Японии) микрокапсул с 20% этилцеллюлозы (ОБРАЗЕЦ 6-D2) и соответствующего прототипа ОБРАЗЕЦ 38.
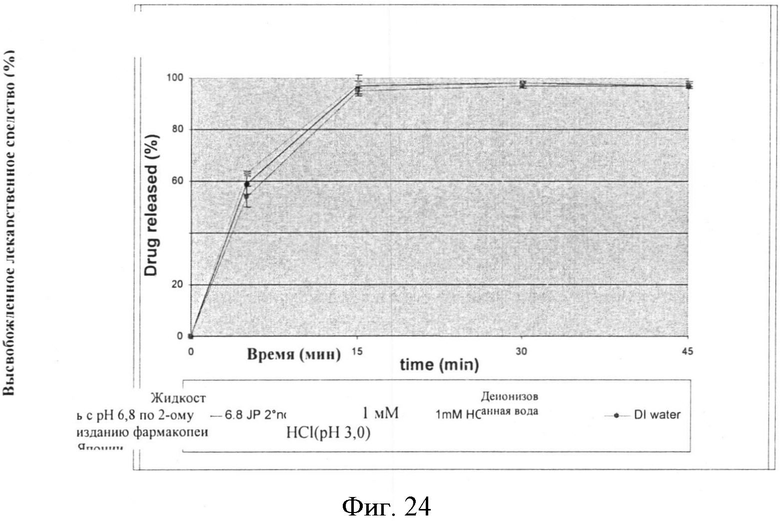
Фигура 24: Скорость растворения микрокапсул со средним весом покрытия 13% (ОБРАЗЕЦ 8) в различных средах растворения.
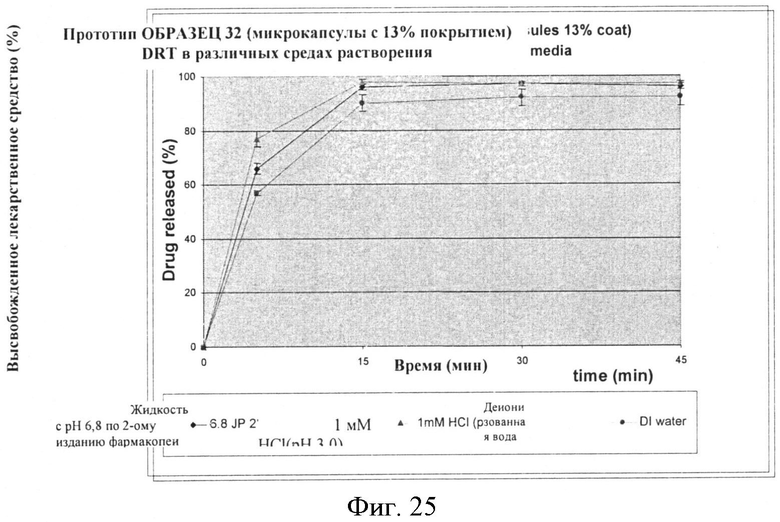
Фигура 25: Скорости растворения составленного продукта, содержащего микрокапсулы со средним весом этилцеллюлозы 13% (ОБРАЗЕЦ 32), в различных средах растворения.
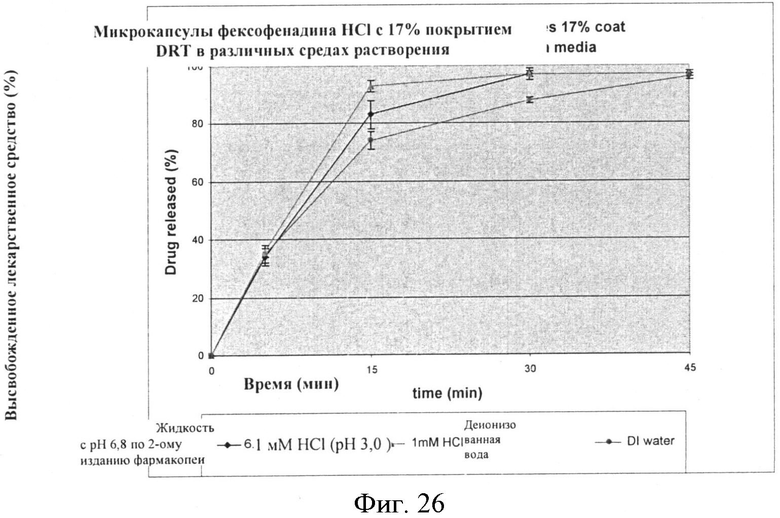
Фигура 26: Скорости растворения микрокапсул со средним весом покрытия 17% (ОБРАЗЕЦ 9-D) в различных средах растворения.
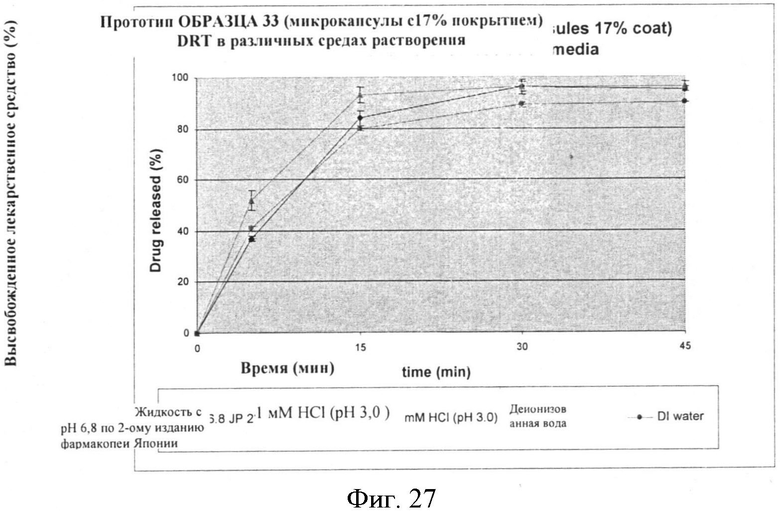
Фигура 27: Скорости растворения составленного продукта, содержащего микрокапсулы со средним весом этилцеллюлозы 17% (ОБРАЗЕЦ 33), в различных средах растворения.
Фигура 28: Радарный график описывает влияние параметров способа на образование малых частиц.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1. Микрокапсулы фексофенадина
1.1 Способы и оборудование для получения микрокапсул фексофенадина
Циклогексан наливают в реактор для микроинкапсулирования. Затем при постоянном перемешивании добавляют фексофенадин HCl, этилцеллюлозу (EC) и полиэтилен. Смесь нагревают и затем охлаждают. Микрокапсулы извлекают, и затем отмывают (один или несколько раз), фильтруют и высушивают в течение ночи (приблизительно 16 часов) в сушильном шкафу или в колпаке при 40°C. Порошок просеивают через сито с отверстиями 300 мкм.
2удаляется во время этапа высушивания.
Получают несколько партий микрокапсул; количество покрытия этилцеллюлозы (% вес./вес., рассчитанное как увеличение веса микрокапсулы) в конечных микрокапсулах суммировано в Таблице 2.
Микрокапсулы характеризуются внешним видом, распределением частиц по размерам, остаточным содержанием растворителя и скоростью растворения. Микроскопия в конце способа микроинкапсулирования пяти партий показывает приемлемое наслоение полимерного покрытия вокруг частиц фексофенадина в соответствии с количеством полимера, который используется для получения различных партий (смотри Фигуры 1-5).
Как показано на Фигурах 6 и 7, обнаружено, что увеличение размера частиц и уровня агломерации микрокапсул пропорционально количеству полимерного покрытия, которое наносят. Очень маленькие частицы фексофенадина подвергаются процессу, сходному с грануляцией, и формируют кластеры дискретных частиц в диапазоне размеров 50-200 микрон; как наблюдается, размер кластера увеличивается с уровнем полимера.
Измеряют распределение частиц по размерам (PSD) микрокапсул с 15% покрытием (полученные из ОБРАЗЦА 3). Количество микрокапсул в диапазоне 25 г - 50 г наливают в 100 мл HDPE бутылку, 0,2% (вес/вес) Syloid 244 (коллоидный диоксид кремния, WR Grace, Колумбия, Мэриленд) просеивают через 150 мкм сита, добавляют к микрокапсулам и вручную перемешивают в течение 2 минут. Смесь микрокапсул и Syloid 244 просеивают с помощью цифрового аппарата Octagon в течение 10 минут при амплитуде 7. Результаты сообщаются на Фигуре 8. Тонкая фракция микрокапсул более 250 микрон составляет не менее чем 80%.
Как показано в Таблице 3, результаты анализа микрокапсул являются близкими к теоретическим величинам (98-99%).
Количество остаточного растворителя (циклогексан) всегда менее 100 частей на миллион для всех микрокапсул, которые получают в лабораторных масштабах.
1.2 Микроинкапсулирование промышленного масштаба
Микрокапсулы фексофенадина при различных уровнях этилцеллюлозы (15, 18 и 20%) получают способом коацервации в 80 галлонном реакторе из нержавеющей стали, и, используя аппарат с псевдоожиженным слоем для этапа высушивания. Фексофенадин НСl (код 1) и фексофенадин НСl (код 2)) используют для получения микрокапсул. Получают микрокапсулы с 15% этилцеллюлозы (Образец 71); «in vitro» растворение ОБРАЗЦА 72 и ОБРАЗЦА 73 (оба получают с различным начальным фексофенадином (код 2). Никаких существенных различий не отмечается между микрокапсулами, которые получают с различными партиями API (непараметрический статистический анализ Манна-Уитни, p=0,05).
Получают микрокапсулы с уровнями этилцеллюлозы 15, 18 и 20%. Испытания микроинкапсулирования проводят путем помещения API и неактивного ингредиента(ов) в 80 галлонный реактор, затем добавления свежего циклогексана. Параметры температуры и условия перемешивания цикла устанавливают, как описано ранее. В конце термического цикла вращение лопастей останавливают и продукту позволяют осесть. Супернатант удаляют, используя вакуумный насос, и добавляют свежий растворитель. Смесь кратковременно перемешивают. Впоследствии микрокапсулам позволяют снова осесть и часть циклогексана удаляют в течение второго промежутка времени. Микрокапсулы затем фильтруют в псевдоожиженном слое, оснащенном 70 мкм ситом из нержавеющей стали на дне в атмосфере инертного азота и под вакуумом. После удаления растворителя взвесь микрокапсул высушивают в том же псевдоожиженном слое до уровня остаточного циклогексана менее 3000 частей на миллион. Продукт, который получают, вручную выгружают из камеры с псевдоожиженным слоем и просеивают через 840 мкм сито из нержавеющей стали.
Профили растворения микрокапсул фексофенадина в буферной жидкости с pH 6,8 но 2-му изданию фармакопеи Японии (уровень этилцеллюлозы 15%) показаны на Фигуре 9.
1.3 Испытания на растворимость микрокапсул
Прототипы микрокапсул имеют улучшенную смачиваемость, когда небольшое количество поверхностно-активного вещества, такого как DOSS, добавляют к средам растворения.
Испытания на растворимость на микрокапсулах проводят путем добавления небольшого количества поверхностно-активных веществ к средам растворения.
Фигура 10 показывает профиль растворения микрокапсул, имеющих 15% ЕС (ОБРАЗЕЦ 4) с или без 0,5 мл DOSS 0,01М в средах растворения.
Сравнение со скоростями растворения коммерческих составов таблеток Allegra® проведено, используя USP лопасть, и приведено в Таблице 5.
Это сравнение показывает, что при уровнях этилцеллюлозы 15% и 10% растворение микроинкапсулированного фексофенадина является сходным с таковым составов таблетки. Оценка вкуса показывает, что 15% покрытие обеспечивает приемлемые вкусовые характеристики.
Величины растворения, используя официальный аналитический способ растворения, используя pH 6,8 буфер (жидкость для испытания на растворимость по 2-ому изданию фармакопеи Японии, 15JP) и анализы различных партий микрокапсул суммированы в Таблицах 6-8.
Получают микрокапсулы с 15% этилцеллюлозы (ОБРАЗЕЦ 71) и увлажняют (с помощью in-situ способа лабораторного масштаба, ОБРАЗЕЦ 71/А) и растворение сравнивают в Таблице.
1.4 Получение увлажненных микрокапсул
Гидрофобная природа этилцеллюлозы приводит к возникновению некоторых недостатков, когда микрокапсулы используются в водном окружении. Когда конечную лекарственную форму, содержащую такие микрокапсулы, помещают в стакан воды, гидрофобные микрокапсулы имеют тенденцию всплывать и образовывать агрегаты (например, скопления или кластер) и некоторую тенденцию прикрепляться к стеклянной стенке.
Улучшенная смачиваемость микрокапсул достигается путем обработки микрокапсул минимальным количеством поверхностно-активного вещества (увлажняющая обработка). Исследуются некоторые различные увлажняющие ингредиенты (например, лаурил сульфат натрия; докузат натрия; сложный эфир сахарозы и жирной кислоты; гидроксипропилцеллюлоза и полиэтиленгликоль 600, 1000. 3350 и 6000, Lutrol F68; и т.д.).
Увлажняющая обработка микрокапсул, которую проводят с помощью поверхностно-активных веществ, проводят либо путем суспендирования микрокапсул в растворе поверхностно-активного вещества или путем распыления микрокапсул с раствором поверхностно-активного вещества, используя, например, покрытие псевдоожиженным слоем, как описано ниже, или другое подходящее оборудование.
Способ увлажнения путем суспендирования. Способ проводят путем суспендирования микрокапсул (например, ОБРАЗЕЦ 3, 15% средний вес покрытия) в разведенных растворах докузата натрия (DOSS) в циклогексане. Суспензию смешивают в течение приблизительно 15 мин при 200 об/мин и Syloid 244 затем добавляют к смеси с перемешиванием. Микрокапсулы извлекают путем фильтрации, используя стандартное оборудование. Микрокапсулы затем высушивают при комнатной температуре в течение приблизительно 16 часов и просеивают, используя 300-микронное сито. Раствор DOSS, который добавляют к микрокапсулам, предпочтительно содержит более чем 0,25% DOSS. Получают следующие партии: ОБРАЗЕЦ 8 (13% средний вес покрытия), ОБРАЗЕЦ 19-D (15% средний вес покрытия) ОБРАЗЕЦ 9-D (17% средний вес покрытия) и ОБРАЗЕЦ 6-D (20% средний вес покрытия).
Способ увлажнения с помощью псевдоожиженного слоя. Способ проводят, используя устройство для нанесения покрытий с псевдоожиженным слоем, которое оснащено Wurster Insert, и покрывают микрокапсулы с помощью раствора поверхностно-активного вещества согласно стандартным процедурам распыления. Обработанные микрокапсулы затем просеивают через 300-микронное сито. Получают ОБРАЗЕЦ 20-D, имеющий 15% средний вес EC. Увлажненные микрокапсулы, которые получают, легко суспендируются в водном окружении, не приводя к существенной агрегации и водоотталкивающей способности. Воспроизводимость увлажняющей обработки проверяют путем испытания на растворимость. «In vitro» величины растворения, анализ и примесь партий микрокапсул проверяют, как сообщается в следующей части.
Увлажняющая обработка лабораторного масштаба. Способ увлажнения проводят в аппарате с подачей псевдоожиженного слоя сверху путем нанесения водного раствора докузата натрия и осаждения диоксида кремния. Три различных уровня поверхностно-активных веществ: 0,45, 0,60 и 0,75% наносят на 400 г микрокапсул ОБРАЗЦА 78 (15% EC). Результаты, которые получают, приведены в Таблице 8.
Увлажняющая обработка промышленного масштаба. Увлажняющую обработку проводят в промышленном масштабе непосредственно на 18 дюймовом аппарате псевдоожиженного слоя и производят серию партий увлажненных микрокапсул ОБРАЗЦА 17 и ОБРАЗЦА 18. Увлажняющую дисперсию загружают в псевдоожиженный слой, используя насос Уотсона-Марлоу, оснащенный трубкой Маrprene©. Теоретическая композиция представлена в Таблице 9 и профили растворения показаны в Таблице 10 и Фигуре 11, соответственно. Дополнительно измеряют содержание воды (анализ Карла Фишера) ОБРАЗЦА 18 (0,38%).
1.5 Анализ и испытание на растворимость увлажненных микрокапсул
Анализ и примеси анализируют для различных образцов.
Как показано в Таблице 11, результаты анализа увлажненных микрокапсул являются близкими к теоретическим величинам (98-99%) и общий уровень примесей ниже чем 0,1% для всех испытуемых образцов.
Растворение увлажненных микрокапсул проводят, используя жидкость с pH 6,8 но 2-му изданию фармакопеи Японии. Эти результаты суммированы в Таблице 12 ниже и некоторые из них также представлены в виде графика на Фигуре 12.
Образцы со средними уровнями веса покрытия 13%, 15% и 17% высвобождают 80% фексофенадина в пределах 15 минут. Скорость растворения согласуется с уровнем EC; т.е. образцы с более высокими уровнями покрытия проявляют более медленную скорость растворения, в то время как образцы с более низкими уровнями покрытия проявляют более быструю скорость высвобождения. Примечательно, что партия, которую обрабатывают поверхностно-активным веществом, нанесенным с помощью псевдоожиженного слоя (ОБРАЗЕЦ 20-D), имеет более быстрые скорости высвобождения (80% высвобождение в пределах 5 минут) (смотри также Фигуру 13).
Анализ партий увлажненных микрокапсул и их «in vitro» величин растворения суммированы в Таблицах 13-20.
«In vitro» величины растворения согласуются с количеством этилцеллюлозы, которую наносят. Изменчивость от партии к партии среди образцов с одинаковым уровнем покрытия существенно снижается из-за улучшенной смачиваемости и способности к образованию дисперсии микрокапсул. Путем сравнения профиля растворения этих увлажненных микрокапсул с соответствующими неувлажненными микрокапсулами, было показано, что эти увлажненные микрокапсулы в среде без поверхностно-активного вещества проявляют более высокий профиль растворения (Таблицы 21-24).
Увлажненные микрокапсулы демонстрируют приемлемую смачиваемость и диспергируемость во всех средах, которые исследовали, без необходимости добавления поверхностно-активного вещества к буферу сред растворения. Фигура 14 сравнивает профили растворения микрокапсул фексофенадина в различных средах с или без увлажняющей обработки.
Из представленных выше данных можно сделать вывод, что небольшие микрокапсулы с замаскированным вкусом (приблизительно 200 мкм) являются легко диспергируемыми в воде; более того, достигается подходящий профиль высвобождения.
1.6 Анализ остаточного растворителя партии микрокапсул
Измеряют остаточный циклогексан на увлажненных и неувлажненных микрокапсулах, которые получают с различными уровнями покрытия при менее чем 100 частях на миллион, на основе веса микрокапсул. Данные суммированы в Таблице 25:
Из вышесказанного ясно, что остаточный циклогексан находится в пределах ICH границ, как сообщается в Q3C(R3) руководстве.
2. Получение составленных микрокапсул фексофенадина
Микрокапсулы фексофенадина составляют с рядом дополнительных неактивных ингредиентов и/или вспомогательных веществ для получения и снятия характеристик прототипных гранулятов, которые: 1) являются сопоставимыми с микрокапсулами; 2) дополнительно уменьшают горький вкус фексофенадина; 3) делают микрокапсулы более легкими для проглатывания; 4) делают микрокапсулы более легкими для диспергирования в воде; и/или 5) получают микрокапсулы, которые легко диспергируются и суспендируются в воде.
2.1 Выбор неактивного ингредиента(ов)
Производят выбор неактивного ингредиента(ов) и бинарные смеси фексофенадина и оцененного неактивного ингредиента(ов) получают в различных соотношениях лекарственное средство - неактивный ингредиент(ы) и хранят при 50°C влажные и сухие состояния в герметически закрытых стеклянных ампулах. В фиксированные моменты времени химическую стабильность смесей оценивают с помощью ВЭЖХ анализа. В общем результаты показывают, что API с выбранным неактивным ингредиентом(ами) являются приемлемо стабильными при стандартных условиях температуры и влажности.
Другой неактивный ингредиент(ы) также используются для оценки способности микрокапсул диспергироваться/суспендироваться (20 мл дистиллированной воды, 36 мг микрокапсул), они сообщаются в Таблице 26):
Проводят два подхода к составлению: Прямое смешивание микрокапсул фексофенадина с гранулированным продуктом (вспомогательные вещества) и грануляция в псевдоожиженном слое фексофенадина с частью сахарозы, которая должна быть дополнительно смешана с дополнительной гранулированной сахарозой до конечного разведения.
2.2 Получение и анализ гранулятов
Три типа гранулятов производят в помощью псевдоожиженного слоя, распыляемого сверху: 1) гранулят сахарозы (SG); 2) гранулят сахарозы-ксантановой камеди (SXG); и 3) гранулят сахарозы-β-циклодекстрина (SRCD). Технику грануляции в псевдоожиженном слое выбирают для получения мягких гранул с однородным размером частиц и со способностью быстро растворяться в воде.
SG получают гранулированием сахарозы с водным раствором сахарозы (5% вес/вес). Полученный продукт высушивают и выбирают фракцию гранул 250-600 мкм. Определяют характеристики размера частиц и насыпной массы (0,5 г/мл) полученных гранул (Фигура 15).
SXG получают путем гранулирования сахарозы сначала с водным раствором сахарозы (5% вес/вес) и затем с водно-спиртовой суспензией ксантановой камеди. Полученный продукт высушивают и выбирают фракцию гранул 250-600 мкм. Определяют характеристики размера частиц, насыпной массы (0,5 г/мл) и содержания остаточного этанола (<100 частей на миллион) полученного гранулята (Фигура 16)
SβCD получают путем гранулирования порошковой смеси сахарозы и β-циклодекстрина (2:1 вес/вес) с водным раствором сахарозы (5% вес/вес). Полученный продукт высушивают и выбирают фракцию гранул 250-600 мкм. Оценивают размер частиц и насыпную массу (0,4 г/мл) полученного продукта (Фигура 17).
Композиции этих трех гранулятов описаны в Таблице 27.
2.3 Получение смесей микрокапсула фексофенадина/грануляты
2.3.1 Первый набор примеров микрокапсулы фексофенадина, смешанной с SGX, SG и SBCD гранулятами)
Образцы получают, используя микрокапсулы фексофенадина HCl при трех различных средних уровнях веса EC (13%, 17% и 20%). Все образцы содержат совместную гранулу ксантановой камеди и сахарозы (400 мг). В дополнение к этим материалам каждый образец содержит количество гранул сахарозы (150 мг) либо отдельно, либо в комбинации с дополнительным неактивным ингредиентом(ами), таким как, например, β-циклодекстрин (бета CDX). Единственным исключением из этого является ОБРАЗЕЦ 39, которые не содержит каких-либо дополнительных гранул сахарозы.
Дополнительные вспомогательные вещества добавляют в ОБРАЗЕЦ 30, ОБРАЗЕЦ 31, ОБРАЗЕЦ 32, ОБРАЗЕЦ 33 и ОБРАЗЕЦ 34. Ароматизаторы добавляют к ОБРАЗЦУ 30 и ОБРАЗЦУ 31, тогда как β-циклодекстрин (BCD) добавляют к ОБРАЗЦУ 32, ОБРАЗЦУ 33 и ОБРАЗЦУ 34.
Также получают образец плацебо (ОБРАЗЕЦ 35). Он содержит микроинкапсулированный тальк вместо фексофенадина HCl. Таблица 28 ниже суммирует качественные и количественные композиции партий.
Гомогенность дисперсии полученных гранул определяется до и после встряхивания/перемешивания в 20 мл воды.
Дополнительно также оценивают критерии, такие как седиментация/осаждение/плавание на поверхности, ресуспендирующая способность, остаток после выливания и растворение при pH 6,8 JP, 1 мМ НСl (pH 3,0) и дистиллированной воды смеси микрокапсула фексофенадина/гранулят.
Исследование смачиваемости и дисперсности проводят в 50 мл аналитическом стакане с 20 мл деминерализованной воды при комнатной температуре (20-25°C). В частности, количество микрокапсул, соответствующее 30 мг фексофенадина HCl, и выбранный неактивный ингредиент(ы) взвешивают и выливают в стакан. Смесь аккуратно перемешивают в течение 10 секунд и тенденцию формировать агломераты, плавание на поверхности, осаждение, погружение наблюдают в течение 30 секунд. В итоге, суспензию перемешивают снова в течение 2 секунд и выливают, и оценивают любой остаток в стакане. В итоге характеристики вкусового впечатления и маскировки вкуса смеси микрокапсула фексофенадина/гранулят оценивают путем введения порошка в рот или на столовую ложку с несколькими миллилитрами воды. Максимальное количество дополнительного неактивного ингредиента(ов) и/или вспомогательных веществ, которое добавляют к этим партиям микрокапсул фексофенадина (≅36 мг), составляет 550 мг.
2.3.1.1 Растворение смесей микрокапсулы фексофенадина/грануляты
Ряд испытаний проводят, используя микрокапсулы фексофенадина, покрытые количеством этилцеллюлозы в диапазоне от 13% до 20%, и смешивают с тремя различными типами гранул, как описано выше в Таблице 28. Испытания на смачиваемости/дисперсность показывают, что комбинация гранулятов с микрокапсулами фексофенадина не имела отрицательного влияния на их смачиваемость и дисперсность в воде. Кроме того, хорошая диспергируемость показана для составов, используя ограниченное количество жидкости (столовая ложка).
ОБРАЗЕЦ 35 представляет собой плацебо, полученное с микрокапсулами талька вместо фексофенадина HCl. ОБРАЗЕЦ 34 имеет такую же композицию, как ОБРАЗЕЦ 32, и его получают для подтверждения способности маскировать вкус микрокапсул с наименьшим уровнем покрытия. Все прототипы получают с гранулами SXG. SβCD гранулят используют в некоторых образцах (ОБРАЗЕЦ 32, ОБРАЗЕЦ 33, ОБРАЗЕЦ 34) для оценки влияния этого неактивного ингредиента(ов) на снижение горечи. ОБРАЗЕЦ 39 получают со сниженным уровнем неактивного ингредиента(ов) для оценки эффектов уровня неактивного ингредиента(ов) на вкусовое впечатление. Прототипы с ароматизаторами ОБРАЗЕЦ 30 и ОБРАЗЕЦ 31 также оценивают. Профили растворения образцов приведены в следующих таблицах и Фигурах.
Испытания маскировки вкуса показали, что все образцы создают немедленное сладкое ощущение, с последующей легкой горечью (через 20-30 сек). Однако этот горький вкус не распознается как неприятный.
Результаты растворения смесей микрокапсулы фексофенадина/грануляты с 13%, 17%, 20% полимера проводят, используя жидкость с pH 6,8 по 2-му изданию фармакопеи Японии, и они суммированы в Таблицах 29-31 и также представлены в виде графика на Фигурах 18, 19, 20. Эти результаты сравнивают с таковыми, полученными с несоставленными микрокапсулами.
Характеристики растворения продуктов являются сходными с таковыми у микрокапсул с небольшим увеличением в скорости растворения, зарегистрированным для всех.
Характеристики растворения продуктов являются сходными с таковыми у микрокапсул с небольшим увеличением в скорости растворения, зарегистрированным для всех.
Растворение составленного продукта, содержащего микрокапсулы со средним весом ЕС 20% проводят, используя жидкость с pH 6,8 по 2-му изданию фармакопеи Японии. Эти результаты сравнивают с несоставленными микрокапсулами. Эти результаты суммированы в Таблице 31 ниже и также представлены в виде графика на Фигуре 20.
Для каждого уровня покрытия скорость растворения прототипов составленных микрокапсул сходна со скоростью растворения микрокапсул отдельно (смотри Фигуры 21-23). Выбранный неактивный ингредиент(ы) очевидно не влияет на профиль растворения микрокапсул.
Скорость растворения для партий составленного продукта также проводят, используя микрокапсулы с 13% и 17% покрытиями, и исследуют с 1 мМ HCl; и деионизованной водой. Результаты представлены в нижеследующих Таблицах, которые также включают величины для растворения в жидкости с pH 6,8 по 2-ому изданию фармакопеи Японии, как сообщается выше и представлены графически на Фигурах 24-27.
Скорости растворения прототипа саше ОБРАЗЦА 33, содержащего микрокапсулу ОБРАЗЦА 9-D (17% средний вес этилцеллюлозы), представлены ниже в Таблице 35.
Скорости растворения составленных прототипов сходны с профилем растворения соответствующих микрокапсул. Неактивный ингредиент(ы), который используется, не проявил влияния на профиль растворения микрокапсул.
2.3.2 Второй набор примеров составленных микрокапсул фексофенадина, смешанных с SC и SGX гранулятами)
Получают второй ряд продуктов фексофенадина (Таблица 36). Эти композиции получают на основе следующих критериев: 1) прототипы составляют, используя микрокапсулы с 13% или 15% покрытием; 2) β-циклодекстрин не используют; 3) индивидуальное количество ароматизатора, бананового или клубничного, используют для всех прототипов; 4) ароматизатор вводят в состав, смешанный с SG гранулятом и небольшим количеством диоксида кремния.
Фексофенадин высвобождается с помощью быстрого механизма (т.е. ≥80% высвобождения за 15 мин.) (Таблица 37).
2.3.3 Третий набор примеров составленных микрокапсул фексофенадина, смешанных с SGX гранулятами
Дополнительные прототипы получают следующим образом. Микрокапсулы фексофенадина комбинируют с SGX гранулами, и количество ксантановой камеди снижают от 1,5 до 1,1% вес/вес в SGX грануляте так, чтобы концентрация ксантановой камеди оставалась равной 1,0% вес/вес.
2.4 Получение примеров гранул фексофенадина
2.4.1 Грануляция микрокапсул фексофенадина первого набора с сахарозой и ксантановой камедью
Одну часть микрокапсул фексофенадина (15% по весу этилцеллюлозы) гранулируют вместе с 6 частями порошка сахарозы в псевдоожиженном слое, оснащенном верхними разбрызгивателями (Glatt GPCG3). Связующий раствор, который состоит из водного раствора сахарозы (15% вес/вес) и ксантановой камеди (0,5% вес/вес), распыляют при комнатной температуре. В конце способа грануляции гранулы высушивают, затем высушенные гранулы удаляют из псевдоожиженного слоя и просеивают. Гранулы характеризуются по распределению частиц по размерам (испытание с помощью вибросита), профилю высвобождения фексофенадина (испытание на растворимость в USP аппарате II, используя 900 мл pH 6,8 буфер, 2-е издание фармакопеи Японии, при 37°C и скорости лопасти 50 об/мин), однородности содержания активного ингредиента и внешнему виду (испытание с помощью оптической микроскопии).
Испытания на однородность состава показывают, что микрокапсулы фексофенадина гомогенно распределены в гранулах: измеренное среднее содержание (n=15) и относительный % OCO составляют соответственно 111 мг/г (теоретически доведенное согласно анализам микрокапсул: 114 мг/г) и 3,2%. Оптическая микроскопия показывает, что способ грануляции приводит к погружению микрокапсул в гранулы сахарозы или адгезии микрокапсул на гранулах сахарозы.
2.4.2 Второй набор примеров грануляции микрокапсул фексофенадина с сахарозой и ксантановой камедью
Одну часть микрокапсул фексофенадина (15% по весу этилцеллюлозы) гранулируют вместе с 14 частями порошка сахарозы в псевдоожиженном слое, оснащенном верхним разбрызгивателем (Glatt GPCG3). Связующий раствор, который состоит из водного раствора сахарозы (15% вес/вес) и ксантановой камеди (0,5% вес/вес), распыляют при комнатной температуре. В конце способа грануляции гранулы высушивают, затем высушенные гранулы удаляют из псевдоожиженного слоя и просеивают.
Гранулы, которые собирают, характеризуются по распределению частиц по размерам (испытание с помощью вибросита), профилю высвобождения фексофенадина (испытание на растворимость в USP аппарате II, используя 900 мл pH 6,8 буфера, 2-е издание фармакопеи Японии, при 37°C и скорости лопасти 50 об/мин), однородности содержания активного ингредиента и внешнему виду (испытание с помощью оптической микроскопии).
Испытания на однородность состава показывают, что гранулы гомогенно распределены: среднее содержание и % OCO соответственно 53,5 мг/г (Теоретическая величина, доведенная согласно анализу микрокапсул: 54,5 мг/г) и 2,8%.
Внешний вид гранул (оптическая микроскопия) является близким к таковому у гранул, полученных в первом наборе, используя такую же партию микрокапсул.
Успешность грануляции подтверждается также с помощью данных распределения по размерам (испытание с помощью вибросита): агрегация сахарозы и микрокапсул приводит к существенному повышению размера частиц (Таблица 41). Более того, распределение по размерам гранул сравнимо с таковым у гранул, полученных в первом наборе (весовое соотношение микрокапсулы / сахароза 1:6)
Задержанное количество
2.4.3 Третий набор примеров грануляции микрокапсул фексофенадина с сахарозой и ксантановой камедью
Гомогенную конечную смесь получают путем гранулирования микрокапсул фексофенадина с частью вспомогательных веществ, затем впоследствии смешивают с оставшимися неактивными ингредиентами в гранулированной форме. Смеси со сходными размерами частиц смешивают в соотношении 1:1 вес/вес. Этот способ совместной грануляции проводят в псевдоожиженном слое с верхним разбрызгиванием лабораторного масштаба (GPCG 3, 7 дюймов). Микрокапсулы комбинируют в соотношении 1:6 вес/вес с сахарозой и гранулируют, используя водный раствор связующего раствора сахарозы (5% вес./вес.), содержащий 0,5% вес/вес ксантановой камеди.
Одну партию гранулятов, ОБРАЗЕЦ 45, производят путем комбинирования микрокапсул в соотношении 1:6 вес/вес с сахарозой, используя связующий раствор водного раствора сахарозы (5% вес./вес.) без ксантановой камеди. Добавление ксантановой камеди и одновременное увеличение количества сахарозы в связующем растворе улучшает способ совместной грануляции микрокапсул с сахарозой. Таблица 43 указывает PSD полученных гранулятов и анализ лекарственного средства как f(PSD):
Теоретические результаты анализа составляют всегда приблизительно 100 мг/г для всех произведенных гранулятов. Наблюдение под микроскопом показывает, что тонкой фракции (<125 микрон) больше по сравнению с большими фракциями.
«In vitro» величины растворения даны ниже для некоторых из произведенных гранулятов.
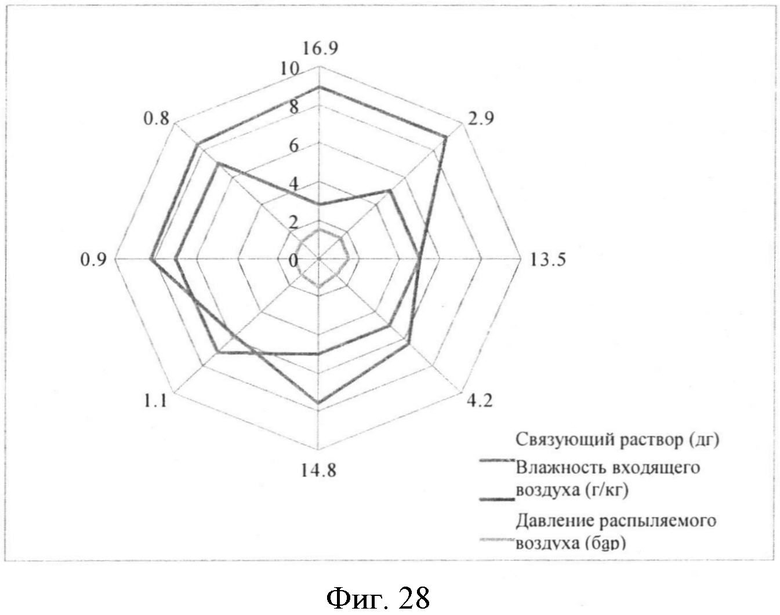
Для того чтобы контролировать фракцию небольших частиц, могут быть отрегулированы параметры способа грануляции и количество связующего раствора.
График, показанный на Фигуре 28, коррелирует с тремя параметрами способа: количество связующего раствора, распыленное на порошок, влажность входящего воздуха и давление распыляемого воздуха. Грануляты с более низким процентным соотношением тонкой фракции (величины представлены на углах восьмиугольника на Фигуре) создают, используя самое низкое давление распыления, самое высокое количество связующего раствора и приемлемую влажность входящего воздуха. Совместный гранулят, который получают, имеет тонкую фракцию <3% и содержание лекарственного средства с ОСО (относительное стандартное отклонение) менее чем 3,0%.
2.4.4 Четвертый набор примеров грануляции микрокапсул фексофенадина с сахарозой и ксантановой камедью. Промышленный масштаб
Увлажненные микрокапсулы совместно гранулируют с мелким порошком сахарозы, используя тот же связующий раствор, используемый во время исследований лабораторного масштаба. В частности, 14,70 кг влажных микрокапсул гранулируют с 102,90 кг мелкого порошка сахарозы (соотношение 1:7), используя 29,40 кг связующего раствора. Полученный гранулят просеивают через 840 мкм сито из нержавеющей стали. Просеянный продукт помещают в двойном РЕ пакете в пластиковые бутыли.
Полученный совместный гранулят характеризуют в отношении PSD, анализа лекарственного средства как f(PSD), содержания воды (0,13%) и «in vitro» величин растворения в жидкости с pH 6,8 по 2-му изданию фармакопеи Японии. Данные представлены в следующих Таблицах.
Количество мелких частиц является низким. ОСО находится между 1,8% и 6,0%.
2.4.5 Получение гранулятов сахарозы и ксантана
Получают гранулы сахарозы с PSD, сходным с таковым у тех, которые получают с совместным гранулятом. Этот способ в увеличенном масштабе проводят непосредственно на промышленном псевдоожиженном слое с верхним разбрызгиванием Glatt FB500, 500 л. Способ проводят в один этап: ксантановую камедь непосредственно гранулируют с сахарозой путем распыления того же связующего раствора, используемого для способа совместной грануляции, однако этанол устраняют.
В частности, 147,0 кг мелкого порошка сахарозы и 3,0 кг ксантановой камеди гранулируют с 20,0 кг связующего раствора. В конце способа грануляции продукт просеивают через 840 мкм сито из нержавеющей стали и получают 149,1 кг гранулята (выход способа 97,4%).
Характеризуются PSD и содержание воды (0,48%) полученных гранулятов.
Два гранулята получают путем применения таких же параметров способа и получают композиции со сходным PSD по сравнению с совместным гранулятом (это является важным требованием для того, чтобы подтвердить, что последующий этап смешивания может быть проведен успешно).
2.5 Смешивание гранул фексофенадина и гранул сахарозы
Две предыдущие партии совместных гранулятов и гранулятов сахарозы смешивают с двумя партиями гранул плацебо на основе сахара, имеющих очень сходный PSD, в соотношении 1:1 вес./вес. с размерами партии приблизительно 200 кг. Комбинация ОБРАЗЦА 51 и плацебо ОБРАЗЦА 55 обозначена как ОБРАЗЕЦ 56 после смешивания.
Таблицы ниже описывают композицию партий.
Гомогенность смеси (n=10) смеси ОБРАЗЦА 57 составляет: первый анализ: 50,5 мг/г (ОСО 5,1%); второй анализ: 50,7 мг/г (ОСО 5,5%). Проведенные исследования показывают, что средний анализ является самым близким к теоретической величине (50 мг/г).
Эффективность растворения нефасованной смеси фексофенадина (ОБРАЗЕЦ 57) в буферной жидкости с pH 6,8 по 2-му изданию фармакопеи Японии (по сравнению с соответственным совместным гранулятом (ОБРАЗЕЦ 52) (n=6)) и при pH 3,0 представлены ниже.
Способ смешивания показывает небольшое увеличение скорости растворения во время первых пяти минут, этот эффект может быть, вероятно, связан с механическим стрессом, который применяется во время смешивания.
Данные растворения для ОБРАЗЦА 57 подтверждают быстрое высвобождение.
2.6 Фасовка саше
Концентрацию действующего вещества 15 мг получают в соответствии с 300 мг смеси. Машина для фасования производит 2 саше параллельно (7,0 мм × 5,8 мм). Максимальная производительность составляет 170 саше/мин (скорость 85 об/мин). Материал, который используют для получения саше, представляет собой 3LAMINET/M AL12960 (PET 12 мкм, алюминий 9 мкм, антистатический РЕ 60 мкм).
Подающий шнек находится между пакетом и сырьевым бункером вместе с датчиком для определения количества порошка для того, чтобы поддерживать количество смеси в бункере постоянным (когда объем смеси снижается, шнек питает бункер). Бункер является двухсторонним, имеющим левую и правую систему фасования, каждая сторона оснащена отдельным дозирующим шнеком. Внутри имеется две системы перемешивания (левая и правая), которые поддерживают смесь при аккуратном перемешивании во время способа.
Испытания фасовки саше проводят, начиная со смеси, которую получают с совместным гранулятом с различными уровнями мелких частиц и PSD. В некоторых случаях теоретический результат анализа смеси является ниже и, следовательно, целевая концентрация содержания каждого лекарственного средства может быть переменной.
Саше ОБРАЗЦА 58 получают путем использования нефасованной смеси ОБРАЗЦА 57 (50,0 мг/г ОСО 5,6%). PSD нефасованной смеси ОБРАЗЦА 57 представлено в Таблице 51. Параметры машины выставляют, как представлено в Таблице ниже.
Результаты показывают, что 300 мг саше, имеющее изменение массы между 6,3 и 7,8 и однородность содержания между 6,5 и 8,0, получают с совместным гранулятом микрокапсул фексофенадина настоящего изобретения.
2.6.2 Фасовка саше со смесью ОБРАЗЦА 57 >125 мкм
Нефасованную смесь ОБРАЗЦА 57 >125 микрон получают из ОБРАЗЦА 57 путем удаления тонкой фракции (<125 микрон); это проводят путем просеивания. Данные PSD смеси представлены в Таблице 59.
Испытания фасовки саше проводят на саше с дозой 15 мг, используя эту нефасованную смесь. Получают ряд партий саше ОБРАЗЦА 79. Следующая Таблица суммирует результаты:
Получают хорошие результаты в отношении веса фасовки и более того, анализ саше практически равен теоретической величине (13,8 мг/г); не возникает никаких явлений сегрегации.
2.6.3 Фасовка саше со смесью ОБРАЗЦА 56
Испытания проводят на саше с дозой 15 мг, используя нефасованную смесь ОБРАЗЦА 56. PSD нефасованной смеси представлено в Таблице 61.
Анализ согласуется с весом фасования, всегда выше теоретического 300 мг; наблюдается полное отсутствие явлений сегрегации, анализ остается очень постоянным во время всего производства и главным образом его изменчивости.
2.6.4 Фасовка саше с оборудованием промышленного масштаба
Дополнительные испытания проводят, используя оборудование промышленного масштаба; включенные размеры партий находятся в диапазоне сотен килограммов для конечной нефасованной смеси и порядка сотен тысяч единиц дозировки.
Совместные грануляты фексофенадина получают, начиная с увлажненных микрокапсул. Примеры распределения частиц по размерам увлажненных микрокапсул представлены в Таблице 62.
Получают совместные грануляты и смешивают с гранулированными ингредиентами; три партии, которые получают, имеют такую же композицию, как и партии Таблицы 51. Испытания проводят для этих трех партий.
Следующая таблица показывает данные, относящиеся к распределению частиц по размерам смесей, и анализ, и соответствующее стандартное отклонение саше, полученных для 3 партий:
Каждая партия смеси используется для получения двух партий саше, одна для каждой предусмотренной дозировки лекарственного средства: 15 и 30 мг, где 30 мг соответствует 600 мг веса фасовки и 15 мг - 300 мг.
Детально, каждая партия смеси дает в результате следующие партии саше:
Смесь образца 59 ⇒ Саше 62 (300 мг) и 63(600 мг)
Смесь образца 60 ⇒ Саше 64 (300 мг) и 65 (600 мг)
Смесь образца 61 ⇒ Саше 66 (300 мг) и 67 (600 мг)
Следующая таблица показывает экспериментальные величины анализа для каждой полученной партии саше:
Кроме того, саше, содержащие 600 мг сухого сиропа, анализируют также в отношении «in vitro» скорости растворения, испытание на растворимость проводят при pH=3,0, используя n=12 образцов. Следующая таблица представляет данные, выраженные для % высвобождения через 15 минут, стандартного отклонения и относительного стандартного отклонения:
Из вышесказанного можно сделать вывод, что дополнительные веса фасовки (600 и 300 мг на единицу) и дополнительные концентрации действующего вещества (15 мг и 30 мг фексофенадина HCl на единицу) саше, содержащего сухой сироп, успешно производят.
Будет понятно, что хотя специфические варианты осуществления настоящего изобретения описаны в настоящем документе для целей иллюстрации, различные модификации могут быть произведены, не отклоняясь от сущности и объема настоящего изобретения.






Данное изобретение относится к области фармацевтики и представляет собой фармацевтическую композицию, содержащую суспендирующийся в воде совместный гранулят микрокапсул немедленного высвобождения и неактивных ингредиентов, где указанные микрокапсулы являются микрокапсулами с замаскированным вкусом и представляют собой фексофенадин, покрытый нерастворимым в воде полимерным покрытием; а также способ получения данной композиции и способ лечения состояния, связанного с воспалением, включающий введение пациенту данной композиции. Осуществление изобретения обеспечивает улучшенную маскировку вкуса фексофенадина наряду с немедленным высвобождением активного ингредиента. 3 н. и 19 з.п. ф-лы, 65 табл., 28 ил.
1. Фармацевтическая композиция, содержащая суспендирующийся в воде совместный гранулят микрокапсул немедленного высвобождения и неактивных ингредиентов, где указанные микрокапсулы являются микрокапсулами с замаскированным вкусом и представляют собой фексофенадин, покрытый нерастворимым в воде полимерным покрытием.
2. Фармацевтическая композиция по п. 1, где указанный фексофенадин представляет собой фексофенадина гидрохлорид.
3. Фармацевтическая композиция по п. 1, где указанный нерастворимый в воде полимер выбирают из группы, включающей этилцеллюлозу, поливинилацетат, ацетилцеллюлозу, ацетилцеллюлозы бутират, поливинилацетат, сополимеры аммония и метакрилата и их смеси.
4. Фармацевтическая композиция по п. 1, где вес нерастворимого в воде полимера указанных микрокапсул составляет от приблизительно 2% до приблизительно 40%.
5. Фармацевтическая композиция по п. 4, где указанная композиция высвобождает по меньшей мере приблизительно 60% указанного фексофенадина гидрохлорида в течение 15 минут в буферной жидкости с pH 6,8.
6. Фармацевтическая композиция по п. 1, где указанные микрокапсулы дополнительно содержат поверхностно-активное вещество.
7. Фармацевтическая композиция по п. 6, где указанные микрокапсулы дополнительно содержат средство, способствующее скольжению, или средство, уменьшающее липкость.
8. Фармацевтическая композиция по п. 1, дополнительно содержащая дополнительные неактивные ингредиенты, которые являются необязательно гранулированными, и/или вспомогательные вещества.
9. Фармацевтическая композиция по п. 1, где указанная композиция находится в форме таблетки, капсулы или саше.
10. Фармацевтическая композиция по п. 1, где совместно гранулированные микрокапсулы содержат микрокапсулы немедленного высвобождения с замаскированным вкусом, ксантановую камедь и сахарозу, где весовое соотношение микрокапсул и порошка сахарозы составляет 1:7.
11. Фармацевтическая композиция по п. 8, где соотношение совместно гранулированных микрокапсул к гранулированному неактивному ингредиенту составляет 1:1.
12. Способ получения фармацевтической композиции по п. 1, где фармацевтическая композиция содержит микрокапсулы немедленного высвобождения с замаскированным вкусом, содержащие фексофенадин, покрытый нерастворимым в воде полимером, где указанный способ включает этапы: (а) растворения нерастворимого в воде полимера в органическом растворителе; (b) суспендирования фексофенадина в указанном органическом растворителе; (с) нанесения покрытия указанного нерастворимого в воде полимера на указанный фексофенадин с помощью разделения фаз; (d) отделения указанных микрокапсул от указанного органического растворителя; (е) необязательного увлажнения микрокапсул; (f) совместной грануляции микрокапсул по меньшей мере с одним неактивным ингредиентом; (g) отдельной грануляции по меньшей мере одного неактивного ингредиента; и h) смешивания совместного гранулята, полученного на этапе (f), вместе с гранулированным неактивным ингредиентом, полученным на этапе (g).
13. Способ по п. 12, где указанный фексофенадин представляет собой фексофенадина гидрохлорид.
14. Способ по п. 13, дополнительно содержащий этап сушки указанных отделенных микрокапсул после этапа (d).
15. Способ по п. 14, дополнительно содержащий этап добавления средства-индуктора фаз к указанному органическому растворителю для стимулирования этапа (с).
16. Способ по п. 12, дополнительно включающий следующий этап: (i) фасовка нефасованной смеси этапа (h) в саше.
17. Способ лечения состояния, связанного с воспалением, у индивидуума, включающий введение индивидууму, нуждающемуся в этом, фармацевтической композиции по п. 1.
18. Способ по п. 17, где вес нерастворимого в воде полимера указанных микрокапсул составляет от приблизительно 2% до приблизительно 40%.
19. Способ по пп. 17-18, где указанное состояние, связанное с воспалением, представляет собой сезонный аллергический ринит или хроническую идиопатическую крапивницу.
20. Способ по п. 17, где указанная композиция высвобождает по меньшей мере приблизительно 80% указанного фексофенадина гидрохлорида в течение 15 минут в буферной жидкости с pH 6,8.
21. Способ по п. 17, где указанные микрокапсулы дополнительно содержат поверхностно-активное вещество.
22. Способ по п. 17, дополнительно содержащий по меньшей мере один неактивный ингредиент, который является необязательно гранулированным, и/или по меньшей мере одно вспомогательное вещество.
| WO 03041683 A2, 22.05.2003 | |||
| US 2009263480 A1, 22.10.2009 | |||
| Солодовник В.Д | |||
| Микрокапсулирование / М.: Химия, 1980 | |||
| Приспособление для подвешивания тележки при подъемках сошедших с рельс вагонов | 1920 |
|
SU216A1 |
| US 5543099 A, 06.08.1996 | |||
| WO 2008014175 A2, 31.01.2008 | |||
| US 2003170310 A1, 11.09.2003 | |||
Авторы
Даты
2015-09-20—Публикация
2010-12-01—Подача