Предлагаемое изобретение относится к ветеринарии и может быть использовано для экспресс-диагностики генитальной формы инфекционного ринотрахеита у коров.
Известно несколько способов диагностики инфекционного ринотрахеита (ИРТ) у крупного рогатого скота по клинической картине протекания заболевания и по результатам лабораторных исследований.
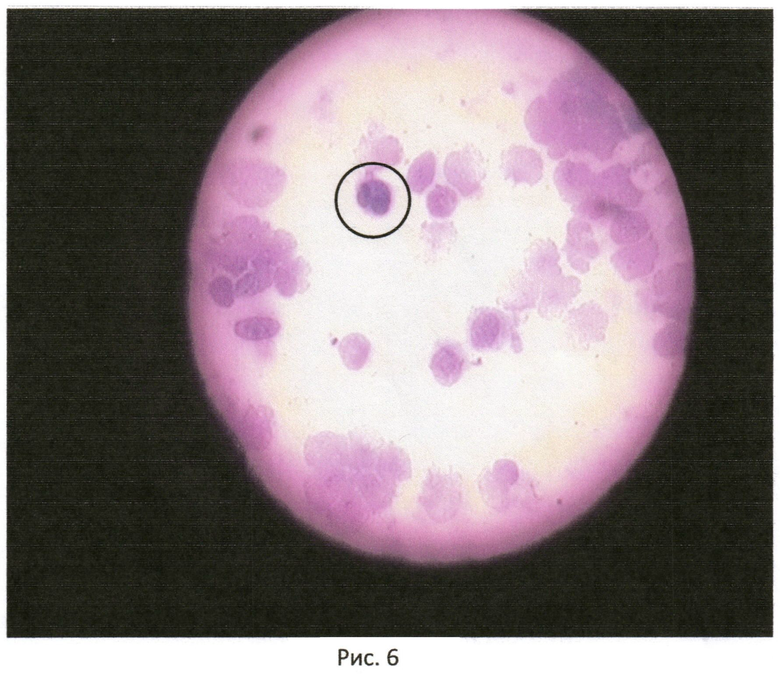
Попав в организм, вирус инфекционного ринотрахеита крупного рогатого скота, относящийся к семейству Herpesviridae, инфицирует базальный слой эпителия, причем наиболее пораженным участком является зона перехода многослойного плоского эпителия в цилиндрический эпителий, находящаяся в области переходя шейки матки во влагалище животного. В пораженных вирусом ИРТ тканях обнаруживают характерные гигантские многоядерные клетки с внутриядерными включениями (см. рис.6)
Генитальная форма инфекционного ринотрахеита у коров протекает с признаками воспаления слизистой оболочки с последующей некротизацией эпителия и образованием пустул и язв; если вирус проникает в более глубокие части полового аппарата, возникают цервициты, эндометриты и сальпингиты. Отмечают кратковременное повышение температуры тела, уменьшение аппетита, снижение лактации, частое мочеиспускание. Слизистая оболочка вульвы и преддверия влагалища отечна, гиперемирована, покрыта светло- и темно-красными узелками величиной с булавочную головку, которые окружены алой зоной. В последующем развиваются везикулы, пустулы, дифтероидные налеты, после отторжения - слизисто-гнойный экссудат. У беременных коров часто бывают аборты, сопровождающиеся метритами и задержанием последа. Вульвовагиниты могут протекать и субклинически. Латентное инфицирование обуславливает возможность выделения вируса из влагалища до 570 дней. (http://mypets.by/infekcionnyj-rinotraxeit-krupnogo-rogatogo-skota)
Недостатком способа постановки диагноза по клинической картине является то, что часто животные имеют латентную форму течения заболевания, при которой клиническая картина не характерна либо совсем отсутствует, при этом животные страдают бесплодием. Инфекционный ринотрахеит крупного рогатого скота наносит большой экономический ущерб в хозяйствах, который складывается из недополучения приплода вследствие абортов и мертворождений (5-30%); рождения нежизнеспособных телят (около 10%); снижения удоя во время болезни (до 50-60%); гибели молодняка от серозной пневмонии (20%); недополучения привесов живой массы у молодняка (50-70%); увеличения на 30% коров с многократными неоплодотворенными осеменениями. (Мищенко В.А., Джаилиди Г.А. Проблема борьбы и профилактики инфекционного ринотрахеита - инфекционного пустулезного вульвовагинита крупного рогатого скота// Ветеринария Кубани №6, 2012). Кроме того, симптоматика вагинальной формы инфекционного ринотрахеита крупного рогатого скота часто бывает схожа с бактериальными и микозными вагинозами, цервицитами, эндометритами и сальпингитами, поэтому необходима дифференциальная экспресс-диагностика, которая существует на данный момент только в виде лабораторных способов, занимающих много времени и реактивов. В условиях ферм быстро поставить диагноз и начать принимать меры по ликвидации заболевания практически невозможно.
В качестве лабораторной диагностики используют реакцию непрямой гемагглютинации (РИГА) (ГОСТ 25755-91 «Крупный рогатый скот методы диагностики инфекционного ринотрахеита» Комитет стандартизации и метрологии СССР Москва).
Сущность метода заключается в способности антител исследуемой сыворотки вызывать агглютинацию эритроцитов с адсорбированным на их поверхности специфическим ИРТ антигеном.
Способ выполняется следующим образом. В лунки микропанели с помощью капельницы вносят по 0,05 см3 разбавителя. В первые лунки специальной петлей или пипеткой вносят исследуемые сыворотки в количестве 0,05 см3. На каждую исследуемую сыворотку используют два ряда лунок. Последующими переносами получают двукратные разведения сывороток от 1:2 до 1:256. Затем в первый ряд лунок вносят по 0,025 см3 рабочего разведения специфического эритроцитарного антигена, а во второй ряд - по 0,025 см3 рабочего разведения контрольного эритроцитарного антигена. Панель осторожно встряхивают, закрывают крышкой и ставят в холодильник при температуре от 4 до 6°C на 16-24 ч.
Одновременно проводят контроль на активность специфического эритроцитарного антигена со специфической сывороткой. Для этого в ряд лунок микропанели вносят разбавитель (по 0,05 см3), в первую лунку вносят 0,05 см3 специфической сыворотки и последующими переносами получают двукратные разведения сывороток от 1:2 до 1:1024. Затем во все лунки вносят по 0,025 см3 специфического эритроцитарного антигена.
Контроль на отсутствие агглютинации специфического и контрольного эритроцитарных антигенов отрицательной сывороткой крупного рогатого скота проводят следующим образом.
В два ряда лунок микропанели вносят по 0,05 см3 разбавителя (в первые лунки по 0,05 см3 отрицательной сыворотки) и делают двукратные разведения. Затем в первый ряд вносят по 0,025 см3 специфического эритроцитарного антигена, а во второй ряд по 0,025 см3 контрольного эритроцитарного антигена.
Контроль на отсутствие спонтанной агглютинации специфического и контрольного эритроцитарных антигенов проводят следующим образом.
В лунки микропанели вносят разбавитель по 0,05 см3, а затем добавляют в один ряд по 0,025 см3 специфического, а во второй ряд по 0,025 см3 контрольного эритроцитарного антигена (в рабочем разведении).
Оценку результатов проводят на следующий день. За титр в РНГА принимают наивысшее разведение сыворотки, дающее четкую агглютинацию, проявляющуюся и виде зонта. Оценку реакции проводят только при условии четких результатов контроля.
При контроле реакции титр специфической сыворотки со специфическим вирусом ИРТ эритроцитарным антигеном должен быть не ниже 1:128 с контрольным эритроцитарным антигеном не выше 1:4.
Титр отрицательной сыворотки со специфическим и контрольным эритроцитарным антигеном не должен превышать 1:4.
При наличии в испытуемых сыворотках антител к контрольному эритроцитарному антигену в титрах не выше 1:4 положительными считают сыворотки, дающие по специфическим к вирусу ИРТ эритроцитарным антигенам титры 1:16 и выше.
При наличии в испытуемых сыворотках антител с контрольным эритроцитарным антигеном в титрах более 1:4 положительными считают сыворотки, которые со специфическим к вирусу ИРТ эритроцитарным антигеном дают титры в четыре и более раз выше. Увеличение титров антител в парных сыворотках в четыре раза и выше свидетельствует о наличии инфекции.
Аналогом является также способ иммуноферментного анализа (ИФА) (ГОСТ 25755-91 «Крупный рогатый скот методы диагностики инфекционного ринотрахеита» Комитет стандартизации и метрологии СССР Москва).
Сущность способа заключается во взаимодействии антител и антигена с последующим присоединением к полученному комплексу антивидового иммуноглобулина, меченного ферментом, способным вызывать разложение субстрата с образованием цветного продукта. Способ заключается в последовательном выполнении нескольких этапов исследований: сорбция антигена на микропанели, разведение сывороток, внесение конъюгата.
Сорбция антигена на микропанели. В лунки микропанелей вносят по 0,1 см3 рабочего раствора специфического антигена, приготовленного, как указано в п.2.7.2.2, закрывают крышкой и выдерживают при 4°C в течение 16-18 м.
Лунки микропанели промывают инкубационным буферным раствором три раза по 5 мин путем заполнения лунок и удаления раствора сливанием или отсасыванием с помощью вакуумного насоса или специального промывающего устройства. Промывочный раствор используют однократно.
Неиспользованные микропанели с адсорбированным антигеном высушивают при комнатной температуре и хранят при 4-6°C не более 3 месяцев.
Во все лунки вносят по 0,1 см3 раствора инертного белка и помещают в термостат на 30 мин.
Микропанели повторно промывают инкубационным буферным раствором три раза по 5 мин.
Разведение сывороток
Каждую лунку микропанели заполняют инкубационным буферным раствором в объеме 0,1 см3.
В первую лунку первого горизонтального ряда, предназначенную для контроля качества субстрата, добавляют дополнительно 0,1 см3 указанного буферного раствора (отрицательный контроль).
В первую лунку второго горизонтального ряда вносят 0,1 см3 отрицательной сыворотки (отрицательный контроль).
В первую лунку третьего горизонтального ряда вносят 0,1 см3 специфической положительной сыворотки (положительный контроль).
В первую и пятую лунки остальных горизонтальных рядов вносят по 0,1 см3 исследуемых парных проб сывороток, предварительно разведенных 1:100 в инкубационном буферном растворе в отдельных пробирках или планшетах.
Содержимое всех рядов титруют методом двукратных разведений в объеме 0,1 см3 в четырех лунках; используя при этом пипетки или сменные наконечники к микропипеткам, и получают разведения сывороток от 1:200 до 1:1600. Из последних лунок каждого ряда по 0,1 см3 содержимого удаляют.
Микропанели закрывают крышкой и выдерживают при 37°C в термостате 1-1,5 ч.
Внесение конъюгата
Все лунки микропанелей промывают три раза по 5 мин инкубационным буферным раствором, вносят по 0,1 см3 рабочего раствора иммуноферментного конъюгата и инкубируют в термостате при 37°C 1 ч.
Промывают три раза по 5 мин инкубационным буферным раствором.
Вносят субстратный буферный раствор по 0,1 см3 во все лунки микропанелей и выдерживают их в темноте при комнатной температуре 10-30 мин.
Затем реакцию останавливают, добавляя в каждую лунку раствор серной кислоты в объеме 0,05 см3.
Оценка результатов
Результаты оценивают визуально или при помощи спектрофотометра не позднее 3 ч после остановки реакции.
Визуальная оценка. При наличии специфических антител (положительная проба) ряд лунок с исследуемыми сыворотками имеет оранжево-коричневое окрашивание в разведениях сыворотки 1:200, сравнимое с цветом раствора в положительном контроле (3-й горизонтальный ряд микропанели).
Отрицательными считают пробы, не изменившие окраску или имеющие слабое пожелтение, аналогичное цвету отрицательных контролей.
Основанием для постановки диагноза на ИРТ является увеличение титра антител в парных пробах сывороток в 2 и более раз. При этом учитывают эпизоотическую ситуацию в хозяйстве, наличие клинических и патологоанатомических признаков заболевания.
Обнаружение положительных проб при эпизоотологическом обследовании животных, ранее не вакцинированных против ИРТ, свидетельствует о циркуляции в стаде возбудителя болезни и служит основанием для произведения дополнительных исследований по уточнению диагноза.
Сыворотки, давшие сомнительную реакцию, подлежат повторному исследованию и при подтверждении первоначального результата считаются положительными.
Недостатками этих способов диагностики является то, что они трудоемкие, на постановку диагноза уходит несколько дней, точность диагностики зависит от правильности консервации биологического материала, крови, слизи и т.п. (Сельское хозяйство. Большой энциклопедический словарь. - М.: Большая Российская энциклопедия, 1998. - 656 с. - 100000 экз. - ISBN 5-85270-263-3; 12; ГОСТ 25755-91 «Крупный рогатый скот. Методы диагностики инфекционного ринотрахеита» Комитет стандартизации и метрологии СССР Москва).
Ближайшим аналогом по экспресс-диагностике к предложенному способу является диагностика инфекционного ринотрахеита крупного рогатого скота с помощью ДНК-зонда. Сущность способа заключается в индикации и идентификации ДНК вируса ИРТ в исследуемом материале 32Р-ДНК-зондом, который обладает способностью гибридизироваться (связываться) с комплементарным участком ДНК вируса ИРТ. Результаты гибридизации учитывают по радиоавтографу на рентгеновской пленке. (ГОСТ 25755-91 «Крупный рогатый скот методы диагностики инфекционного ринотрахеита» Комитет стандартизации и метрологии СССР Москва).
Способ выполняется следующим образом. Из кусочков органов готовят 10-20%-ную суспензию в 0,5 см3 растворе Хенкса или физраствора.
Добавляют к суспензии 0,15 см3 раствора додецилсульфата натрия, выдерживают 1 ч при 8°C, центрифугируют 10 мин с частотой вращения 2000 /мин отсасывают 0,5 см3 раствора фенола и перемешивают в течение 1 мин, после чего центрифугируют с частотой вращения 2000. Верхний слой переносят в отдельную пробирку и добавляют к нему 0,6 см3 хлороформа, закрывают пробкой, перемешивают 20 с, центрифугируют 10 мин с частотой вращения 2000/мин, отсасывают верхний слой и переносят в другую пробирку. Добавляют 0,06 см3 раствора ацетата натрия и 0,2 см3 96%′ этилового спирта, выдерживают от 8 до 10 ч при температуре от минус 10 до минус 20°C. Пробирки центрифугируют, сливают надосадочную жидкость, осадок промывают центрифугированием в 0,5 см3 96% этилового спирта и высушивают 30 мин при 68°C в открытой пробирке. Сухие осадки растворяют в 0,04 см3 раствора гидроокиси натрия концентрацией 0,5 моль/дм3, выдерживают 10 мин при 68°C, охлаждают 3-5 мин, помещая пробирку в лед, добавляют 0,02 см3 буфера.
Подготовленные для исследования пробы наносят в объеме 0,005 см3 на капроновый фильтр начиная с клетки №5. На клетках №1-2 адсорбирована ДНК вируса ИРТ (положительный контроль), на клетках №3-4 отрицательный контроль.
После нанесения исследуемого материала фильтры высушивают при 68°C в течение 10 мин. Затем замачивают в течение 10 мин при 20°C в 100 см3 раствора A и помещают в полиэтиленовый пакет с 10 см3 буферного раствора №1. Пакет с капроновым фильтром запаивают и помещают на 1 ч в термостат при 68°C.
На обезжиренные стекла размером 15×15 см наносят 0,6 см3 рабочего разведения 32Р-ДНК-зонда. Извлеченный из полиэтиленового пакета фильтр помещают лицевой стороной на стекло с нанесенным зондом и аккуратно протирают его для удаления пузырьков воздуха.
Стекло с притертым фильтром помещают в стерилизатор с подогретым до 80°C вазелиновым маслом так, чтобы масло покрыло фильтр. Стерилизатор выдерживают 20 мин в сушильном шкафу при 80°C, затем шкаф отключают и, не открывая, оставляют остывать до 55°C. После этого шкаф открывают и охлаждают до комнатной температуры.
Отделяют фильтр от стекла, обезжиривают его в хлороформе, ополаскивают в 50 см3 раствора Б и выдерживают 10 мин при 20°C в новой порции (150 см3) раствора R. Далее капроновый фильтр промывают при 20°C в 200 см3 раствора В и трехкратно в течение 15 мин (со сменой раствора) в 160 см3 раствора Г при 68°C. Затем высушивают между листами фильтровальной бумаги при (t 8°C в течение 15 мин).
Для получения радиоавтографа капроновый обработанный фильтр накладывают лицевой поверхностью на эмульсионный слой рентгеновской пленки, помещают в металлическую кассету и экспонируют 14-16 ч при 20°C.
Удаляют капроновый фильтр, а рентгеновскую пленку общепринятым способом проявляют, фиксируют, высушивают на воздухе. Работы с рентгеновской пленкой проводят в темной комнате при красном свете.
Результаты исследования учитывают визуально. Положительный результат характеризуется наличием темного пятна на рентгеновской пленке в месте контакта ее с нанесенным на капроновый фильтр исследуемым материалом, сопоставимого по контрастности с положительным контролем (клетки 1-2) и отсутствием потемнения пленки при отрицательном контроле (клетки 3-4). При отрицательном результате на месте контакта с исследуемым материалом пленка остается прозрачной.
Получение положительного результата свидетельствует о контаминации исследуемого материала вирусом ИРТ. В комплексе с клиническими и эпизоотологическими данными служит основанием для постановки диагноза на инфекционный ринотрахеит.
Недостатками данного способа является то, что способ труднодоступен, его невозможно воссоздать в условиях фермы, т.к. необходимо дорогостоящее оборудование и реактивы, а также специально обученный высококвалифицированный персонал.
Задачи: обеспечение доступности предлагаемого способа, возможность его применения на ферме, сокращение себестоимости использования способа, сокращение трудозатрат с условием сохранения достоверности диагностики.
Сущностью предлагаемого способа экспресс-диагностики генитальной формы инфекционного ринотрахеита у коров является обработка поверхности шейки матки 3% уксусной кислотой в дозе 10-15 мл, удаление поверхностной слизи и выявление участков слизистой с атипичными клетками, которые становятся белыми при проведении пробы. Цвет изменяется в результате временной коагуляции белков и межклеточной дегидратации происходят набухание клеток, сокращение подэпителиальных сосудов, приводя к обратимой анемизации тканей. Появление атипичных клеток говорит о поражении их вирусом инфекционного ринотрахеита. При условии появления окрашенных белым цветом пятен выполняют лабораторные исследования пробы крови коровы для подтверждения наличия или отсутствия вируса ИРТ у животных по известным методикам.
Технический результат. Предлагаемый способ позволяет в течение 5 минут и с высокой достоверностью поставить диагноз на наличие генитальной формы инфекционного ринотрахеита у коров.
Способ экспресс-диагностики осуществляют следующим образом. После проведения у коровы туалета наружных половых органов животному во влагалище вводят влагалищное зеркало с осветителем. Проводят предварительный кольпоскопический осмотр, затем с помощью шприца и пластиковой пипетки для осеменения орошают шейку матки 3%-уксусной кислотой в дозе 10-15 мл. После 3-4-минутной экспозиции с поверхности шейки матки удаляют влагалищную слизь и повторяют кольпоскопический осмотр, обращая внимание на атипичные клетки, которые становятся белыми при проведении пробы. При условии появления окрашенных белым цветом пятен выполняют лабораторные исследования пробы крови коровы для подтверждения или отсутствия вируса ИРТ у животных по известным методикам.
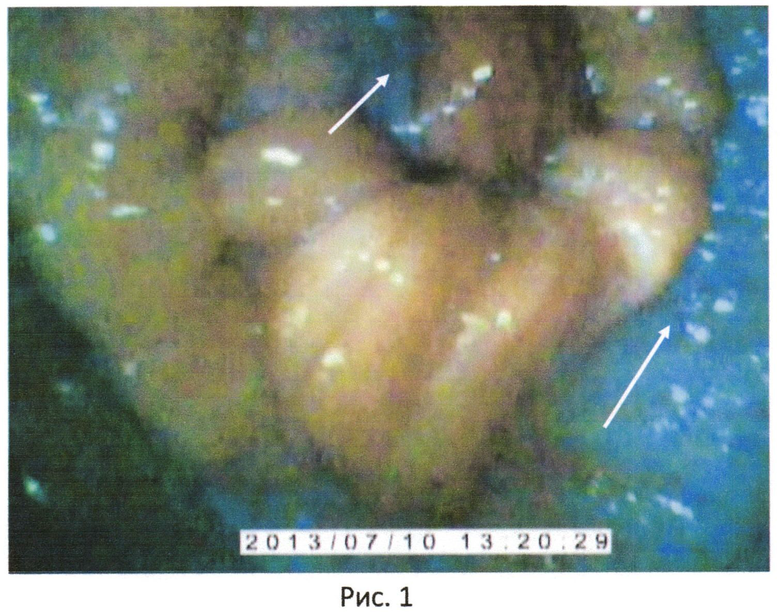
Проведенная апробация экспресс-диагностики на 20 коровах показала, что у коров с титром (1:1024) (проверенная по методике ГОСТ 25755-91, реакция непрямой гемагглютинации диагностический титр 1:16 и выше) на шейке матки были выявлены атипичные клетки, которые проявляются в виде белых пятен на шейке матки на всей площади шейки матки (см. рис.1).
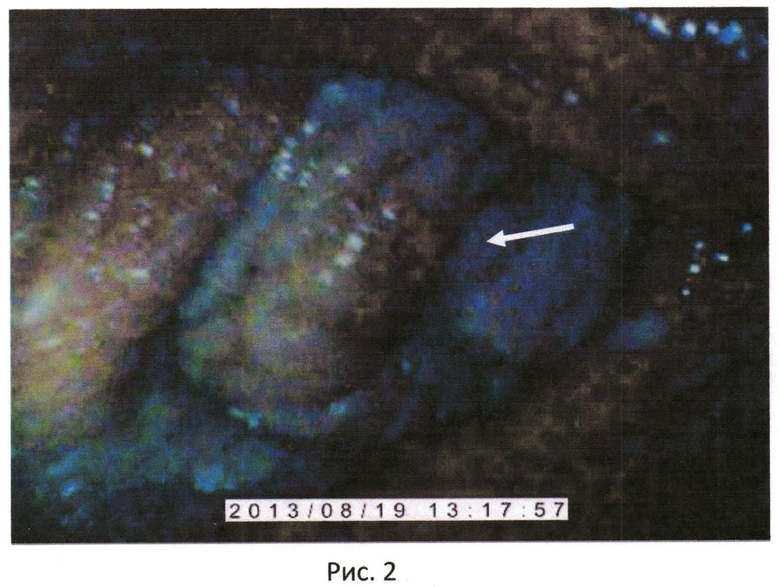
Животное, у которого титр составлял (1:512), на шейке матки были выявлены атипичные клетки, которые проявляются в виде белых пятен на 70% площади шейки матки (рис.2).
У коровы с титром 1:256 атипичные клетки выявлялись на 40% площади шейки матки (рис.3).
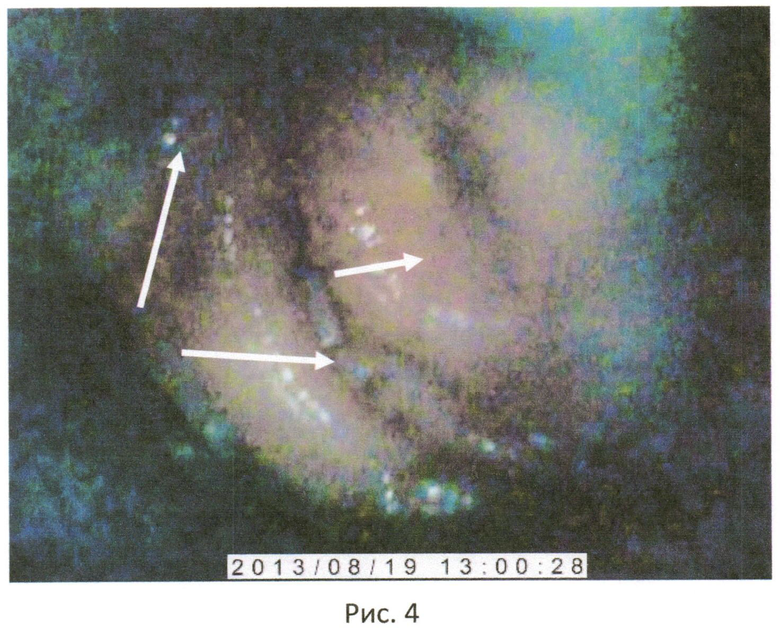
Атипичные клетки на шейке матки коровы с титром антител к вирусу ИРТ 1:128 выявлялись в виде отдельных небольших белых пятен на поверхности шейки матки (Рис 4).
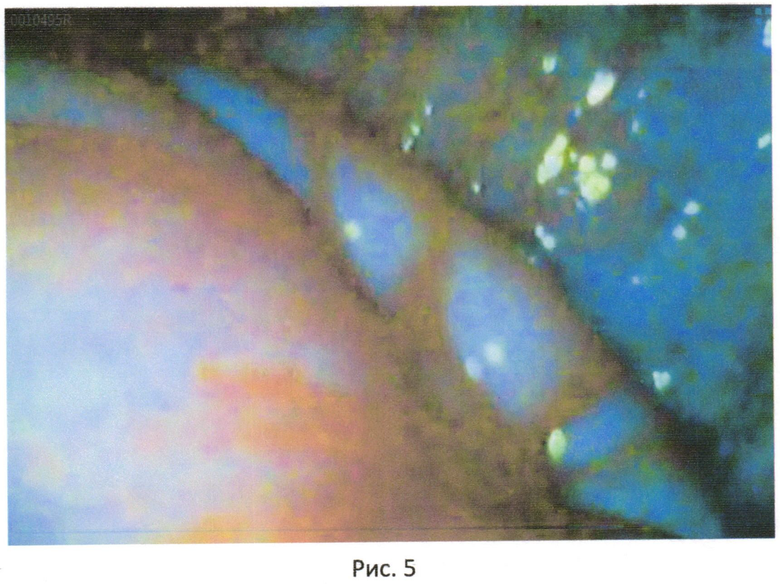
На шейке матки здорового животного атипичных клеток не выявлено (рис.5).
В результате было отмечено 100% визуализация заболевания животных, которая была подтверждена при помощи дополнительно проведенных лабораторных исследований гостированной лабораторной методикой экспертиза №3932 (экспертиза приведена в приложении, рис.6).
Пример. Корова Маня, 2010 года рождения. Слизистая оболочка вульвы и преддверия влагалища отечна, наблюдались слизисто-гнойные выделения из влагалища, у коровы отмечали многократные перегулы. Шейку матки животного обработали 15 мл 3% раствора уксусной кислоты, удалили слизь. При кольпоскопии у коровы через 4 минуты наблюдали многочисленные белые пятна на шейке матки и влагалище. Поставили корове предварительный диагноз: инфекционный ринотрахеит крупного рогатого скота. Взяли кровь для подтверждения диагноза на наличие вируса. Результат лабораторных исследований показал, что титр антител к вирусу ИРТ составляет 1:512, что подтверждает диагноз ИРТ КРС. После постановки диагноза на ИРТ корове сделали вакцинацию вакциной хипрабовис-4, а через 21 день ревакцинацию той же вакциной. Затем через месяц после ревакцинации сделали анализ сыворотки крови на наличие антител к вирусу ИРТ, который показал, что титр антител к вирусу составил 1:16, что говорит о выздоровлении коровы Мани и наличии у нее поствакцинальных антител к вирусу ИРТ.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПЛЕКСНАЯ ТЕСТ-СИСТЕМА ИММУНОФЕРМЕНТНОГО АНАЛИЗА (ИФА) ДЛЯ ОПРЕДЕЛЕНИЯ УРОВНЯ АНТИТЕЛ К ВИРУСНЫМ РЕСПИРАТОРНЫМ ЗАБОЛЕВАНИЯМ КРУПНОГО РОГАТОГО СКОТА | 2008 |
|
RU2371726C1 |
| НАБОР ДЛЯ РАННЕЙ ИММУНОФЕРМЕНТНОЙ ДИАГНОСТИКИ ИНФЕКЦИОННОГО РИНОТРАХЕИТА ЖИВОТНЫХ | 2001 |
|
RU2196336C2 |
| НАБОР ДЛЯ РЕТРОСПЕКТИВНОЙ ИММУНОФЕРМЕНТНОЙ ДИАГНОСТИКИ ИНФЕКЦИОННОГО РИНОТРАХЕИТА ЖИВОТНЫХ | 2001 |
|
RU2196609C2 |
| СПОСОБ ВЫЯВЛЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ К ВИРУСНЫМ РЕСПИРАТОРНЫМ ИНФЕКЦИЯМ КРУПНОГО РОГАТОГО СКОТА | 2008 |
|
RU2421731C2 |
| ВАКЦИНА ИНАКТИВИРОВАННАЯ КОМБИНИРОВАННАЯ ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА, ВИРУСНОЙ ДИАРЕИ И ЛЕПТОСПИРОЗА КРУПНОГО РОГАТОГО СКОТА | 2009 |
|
RU2395297C1 |
| Тест-система ИФА для серологической диагностики нодулярного дерматита крупного рогатого скота - Dermatitis nodularis bovum | 2016 |
|
RU2640192C1 |
| ВАКЦИНА ИНАКТИВИРОВАННАЯ КОМБИНИРОВАННАЯ ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА, ВИРУСНОЙ ДИАРЕИ, РОТА-, КОРОНАВИРУСНОЙ БОЛЕЗНЕЙ И ЛЕПТОСПИРОЗА КРУПНОГО РОГАТОГО СКОТА | 2009 |
|
RU2395299C1 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ МАСТИТА У КОРОВ В ПЕРИОД ЛАКТАЦИИ | 2014 |
|
RU2560277C1 |
| СПОСОБ ПОЛУЧЕНИЯ СТАНДАРТНОЙ ПОЛОЖИТЕЛЬНОЙ ПАНЕЛИ СЫВОРОТОК КРОВИ ДЛЯ КОНТРОЛЯ КАЧЕСТВА ИММУНОФЕРМЕНТНЫХ ТЕСТ-СИСТЕМ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ ВЫЯВЛЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ К ВИРУСНЫМ РЕСПИРАТОРНЫМ ИНФЕКЦИЯМ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ ОРГАНИЗМА КРУПНОГО РОГАТОГО СКОТА | 2008 |
|
RU2392331C2 |
| Вакцина ассоциированная против парагриппа-3, инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота инактивированная эмульсионная | 2018 |
|
RU2696007C1 |

Изобретение относится к ветеринарии и может быть использовано для экспресс-диагностики генитальной формы инфекционного ринотрахеита у коров. Сущностью предлагаемого способа экспресс-диагностики генитальной формы инфекционного ринотрахеита (ИРТ) у коров является обработка поверхности шейки матки 3% уксусной кислотой в дозе 10-15 мл, удаление поверхностной слизи и выявление участков слизистой с атипичными клетками, которые становятся белыми при проведении пробы. При условии появления окрашенных белым цветом пятен выполняют лабораторные исследования пробы крови коровы для подтверждения наличия или отсутствия вируса ИРТ у животных по известным методикам. Способ позволяет в течение 4-5 минут и с высокой достоверностью поставить диагноз на наличие генитальной формы инфекционного ринотрахеита у коров. 6 ил.
Способ экспресс-диагностики генитальной формы инфекционного ринотрахеита у коров, включающий исследование пробы биологического материала, отличающийся тем, что осуществляют предварительную пробу: шейку матки коровы обрабатывают 10-15 мл 3% уксусной кислоты, с поверхности шейки матки удаляют слизь и по проявлению на шейке матки белых участков определяют присутствие атипичных клеток, после чего в пробе крови коровы лабораторным путем уточняют наличие или отсутствие вируса ринотрахеита.
| СИНТЕТИЧЕСКИЕ ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ И СПОСОБ ВЫЯВЛЕНИЯ ДНК ВИРУСА ИНФЕКЦИОННОГО РИНОТРАХЕИТА КРУПНОГО РОГАТОГО СКОТА С ПОМОЩЬЮ СПЕЦИФИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ В ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ (ПЦР) | 2003 |
|
RU2259398C1 |
| НАБОР ДЛЯ РЕТРОСПЕКТИВНОЙ ИММУНОФЕРМЕНТНОЙ ДИАГНОСТИКИ ИНФЕКЦИОННОГО РИНОТРАХЕИТА ЖИВОТНЫХ | 2001 |
|
RU2196609C2 |
| Станок для нанесения рисунков на фарфоровую посуду | 1929 |
|
SU19515A1 |
Авторы
Даты
2015-04-20—Публикация
2013-12-02—Подача