Изобретение относится к биотехнологии, в частности к антителам, связывающим интерлейкин-6 и блокирующих его биологическую активность, а также к технологии их получения.
Интерлейкин-6 (ИЛ-6) представляет собой цитокин, продуцируемый многими типами клеток, стимулирующий пролиферацию активированных антигеном В-лимфоцитов и Т-лимфоцитов, усиливающий активность Т-киллеров, стимулирующий гранулоцитарный росток кроветворения, синтез в печени большинства белков острой фазы воспаления, рост кератиноцитов и нервных клеток (Кетлинский С.А., Симбирцев А.С. Цитокины. С-Пб, 2008). Вместе с тем, при ряде заболеваний, таких как ревматоидный артрит, остеопороз, болезнь Альцгеймлера, инфаркт миокарда, ряд онкологических заболеваний (почечно-клеточная карцинома, рак предстательной железы и мочевого пузыря, злокачественные заболевания, связанные с пролиферацией В-клеток, в частности множественная миелома, хронический лимфоцитарный лейкоз) и другие, наблюдается повышение уровня продукции ИЛ-6. Так как ИЛ-6 участвует в патогенезе многих из перечисленных выше заболеваний, связывание избытка ИЛ-6 и/или блокирование его биологической активности представляются перспективными для их лечения.
ИЛ-6 может связываться с рецептором ИЛ-6, экспрессируемым на активируемых митогеном В-клетках, Т-клетках, периферических моноцитах и некоторых опухолях (Ishimi Y. et al., Immunology 145:3297-3303 (1990)). Рецептор ИЛ-6 имеет по меньшей мере две различные формы и состоит из альфа-цепи, называемой gp80, которая ответственна за связывание с IL-6, и из бета-цепи, называемой gp130, которая необходима для передачи сигнала (Adebanjo О. et al., Cell Biology 142:1347-1356 (1998) и Poli V. et al., EMBO 13:1189-1196 (1994)).
Известны по меньшей мере две главные биологические функции ИЛ-6: опосредование белков острой фазы воспаления и действие в качестве фактора дифференцировки и активации (Avvisti G. et al., Baillieres Clinical Hematology 8:815-829 (1995) и Poli V. et al., EMBO 13:1189-1196 (1994)). Известно, что белки острой фазы регулируют иммунные ответы, опосредуют воспалительные процессы и играют определенную роль в ремоделировании ткани. ИЛ-6, в качестве фактора дифференцировки и активации, индуцирует дифференцировку В-клеток и секрецию антител, индуцирует дифференцировку Т-клеток в цитотоксические Т-клетки, активирует факторы передачи клеточных сигналов и стимулирует гемопоэз (Ishimi Y. et al., J. Immunology 145:3297-3303 (1990)). Очевидно, что ИЛ-6 участвует во многих важных функциях организма и в протекающих в нем процессах. В результате этого физиологические процессы, включая метаболизм костной ткани, опухолевую трансформацию и иммунные и воспалительные ответы, могут усиливаться, подавляться или предотвращаться путем модификации биологической активности ИЛ-6 in vivo под действием специфического антитела (Adebanjo О. et al., J. Cell Biology 142:1347-1356 (1998)).
Было показано, что антитело против ИЛ-6 может ингибировать in vivo рост опухолей предстательной железы (Smith Р.С. & Keller E.T. The Prostate in press & Okatomo M. et al., Cancer Research 57:141-146 (1997) и карциномы почек (Weissglas M. et al., The Journal of Urology 153:554-557 (1995)). Помимо прямого влияния на рост опухоли, блокирование продуцирования ИЛ-6 может также ингибировать деградацию костей и кахексию при раке.
Были получены мышиные, крысиные и кроличьи моноклональные антитела, а также химерные и гуманизированные антитела к ИЛ-6 человека, в частности, нейтрализующие его биологическую активность, однако ни одно из них в настоящее время не внедрено в клиническую практику. Так, известны мышиные моноклональные антитела против ИЛ-6, например CLB-8, которое обладает высокой аффинностью ((Brakenhoff et al., J. Immunol. (1990) p.145-561); US 5618700, 1988). Однако, мышиное антитело является в высокой степени иммуногенным для человека, а поэтому оно имеет ограниченное терапевтическое применение.
В патенте США №5856135, 1999 описаны реконструированные человеческие антитела против человеческого ИЛ-6, происходящие от мышиного моноклонального антитела SK2, в котором гипервариабельные области (CDR) из вариабельной области мышиного антитела SK2 были перенесены в вариабельную область человеческого антитела и присоединены к константной области человеческого антитела. Недостатком данных антител также является их иммуногенность для человека.
Наиболее близким по технической сущности к заявляемому изобретению является химерное (мышь-человек) антитело CLB8 к ИЛ-6 человека и технология его получения (RU2318829, 2008). Антитело CLB8 нейтрализует 50% активности ИЛ-6 человека (измеренной по пролиферации клеток В-клеточной миеломы мыши, индуцированной ИЛ-6 человека) при молярном соотношении антитело/ИЛ-6, равном 1,8.
Задачей настоящего изобретения являлось расширение спектра антител к ИЛ-6 человека с целью получения антител, обладающих более высокой способностью к ингибированию биологической активности ИЛ-6 человека, на основе которых можно создать антитела, пригодные для клинического применения, т.е. химерные и гуманизированные антитела.
Технический результат был достигнут получением мышиного моноклонального антитела (авторское название антитела 6ИЛ-9), специфично и с высокой аффинностью связывающегося с ИЛ-6 человека и ингибирующего его биологическую активность, а также получением гибридомы мышей 6ИЛ-9, продуцирующей данное моноклональное антитело.
Было установлено, что полученное антитело связывается с ИЛ-6 человека специфично и с высокой аффинностью и ингибирует его биологическую активность.
Полученное моноклональное антитело против ИЛ-6 человека содержит гипервариабельные участки тяжелой цепи с последовательностями SEQ ID NO 5-7 и гипервариабельные участки легкой цепи с последовательностями SEQ ID NO 8-10.
Указанные гипервариальные участки могут, в частности, входить в последовательности вариабельной области тяжелой цепи по SEQ ID NO 3 и последовательности вариабельной области легкой цепи по SEQ ID NO 4.
Анализ последовательностей гипервариабельных участков (участков CDR) вариабельных частей легкой и тяжелой цепей полученного моноклонального антитела 6ИЛ-9 показал, что они существенно отличаются от аналогичных участков CDR всех известных моноклональных антител к ИЛ-6 человека, включая RU 2318829, 2008.
Как правило, указанное моноклональное антитело против интерлейкина-6 человека получают с помощью ДНК, содержащей последовательности нуклеотидов по SEQ ID NO 1 и SEQ ID NO 2. Данная ДНК экспрессируется в клетках мышиной гибридомы, штамм которой (авторское наименование штамма - 6ИЛ-9), был депонирован в Российской коллекции клеточных культур под номером РККК(П) 751 Д.
Родословная штамма: Родительские клетки гибридомы SP2/0, антиген - интерлей-кин-6 человека, сливающий агент - ПЭГ/ДМСО, система селекции гибридных клеток -HAT, кратность клонирования - 4, процент позитивных клонов - 100%.
Культуральные свойства: культивирование в матрасах, посевная доза 200000 клеток/мл, кратность рассева 1:3, требует фидерных макрофагов при разморозке.
Стандартные условия выращивания: среда RPMI-1640, 10% фетальной сыворотки, 37°С, 5% CO2.
Характеристика культивирования гибридомы в организме животного: Мыши Balb/c или F2 (Balb/c×DBA) 1,5-2,0×106 клеток, 14-20 дней, перевиваемая.
Штамм продуцирует моноклональное антитело 6ИЛ-9 к интерлейкину-6 человека. Изотип IgG1, каппа. Антитело, специфически связываясь, нейтрализует биологическую активность интерлейкина-6 человека в тесте на клеточной линии В 9. 50% нейтрализация ИЛ-6 человека наблюдается при молярном соотношении антигена и антитела 1 к 1,48.
Моноклональное антитело 6ИЛ-9 накапливается в асцитной жидкости в концентрации не менее 1,0 мг/мл. Стабильность продукции антител сохраняется на протяжении 25 пассажей в культуре и 5 пассажей на животных.
Способ криоконсервирования: фетальная сыворотка с 10% DMSO, заморозка до -70°С со скоростью 1°С/мин, далее помещение в жидкий азот, жизнеспособность после размораживания и отмывки от криоконсерванта 80% (с трипановым синим).
Изобретение поясняется следующими чертежами и последовательностями.
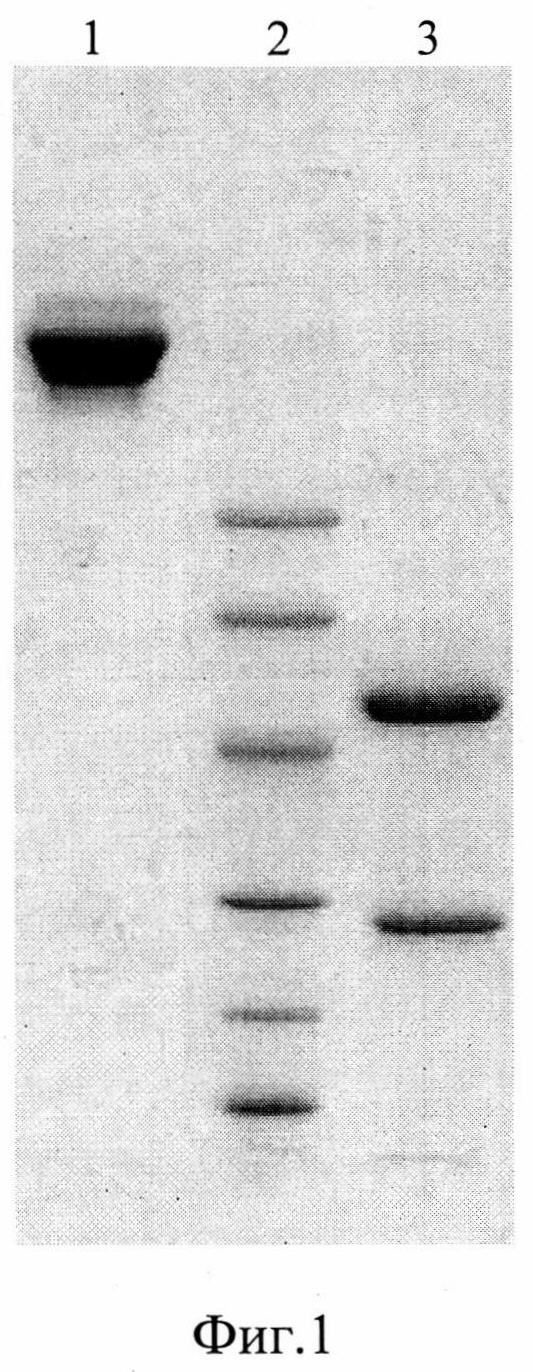
На фиг.1 показан электрофорез очищенного антитела 6ИЛ-9 в полиакриламидном геле 4-20% полиакриламидный гель с ДДС-Na, где дорожки:
1 - антитело 6ИЛ-9 (1 мкг/мл) 5 мкл, нативные условия;
2 - белки-маркеры молекулярного веса 97, 66, 45, 30, 20, 14 кДа;
3 - антитело 6ИЛ-9 (1 мкг/мл) 5 мкл, восстановленные условия.
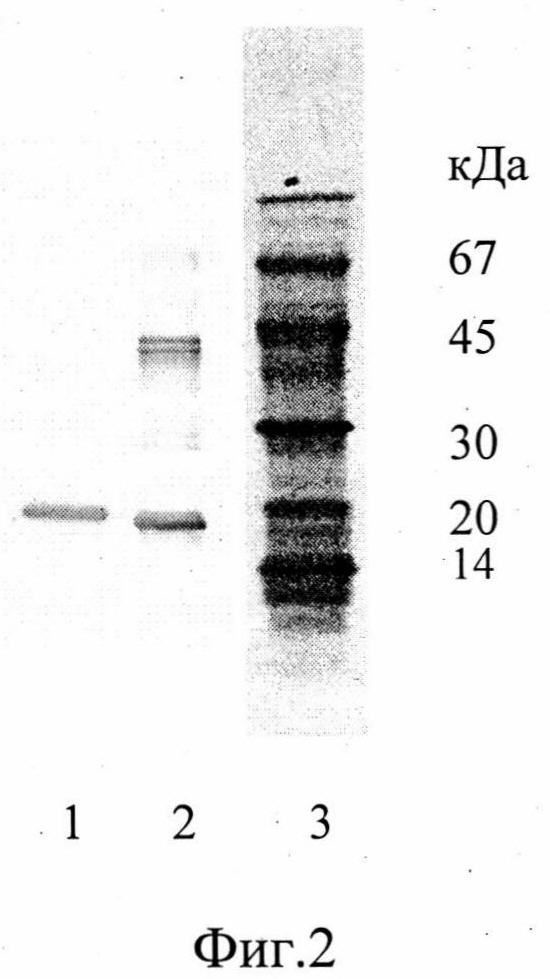
На фиг.2 показано связывание антитела 6ИЛ-9 с интерлейкином-6 (ИЛ-6) человека в иммуноблоте (электрофорез в 4-20% полиакриламидном геле с Na ДДС, иммуноблот с антителом ИЛ-6-9). Дорожки:
1 - ИЛ-6 человека (5 мкг), восстановленные условия;
2 - ИЛ-6 человека (5 мкг), нативные условия;
3 - маркеры молекулярного веса, окраска Кумасси R250.
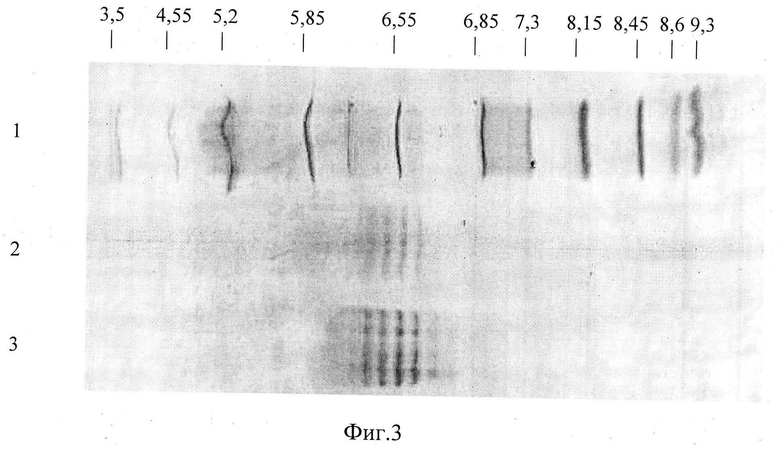
На фиг.3 показано определение изоэлектрической точки антитела 6ИЛ-9 (изофокусирование в полиакриламидном геле Pharmalyte 3-10). Использованы следующие обозначения:
1 - маркеры изоэлектрической точки;
2 - антитело 6ИЛ-9 (1 мкг/мкл) 5 мкл;
3 - антитело 6ИЛ-9 (1 мкг/мкл) 15 мкл.
Перечень последовательностей:
Seq ID NO:1 Последовательность нуклеотидов, кодирующая вариабельную область тяжелой цепи моноклонального антитела 6ИЛ-9
Seq ID NO:2 Последовательность нуклеотидов, кодирующая вариабельную область легкой цепи антитела 6ИЛ-9
Seq ID NO:3 Последовательность аминокислот вариабельной области тяжелой цепи моноклонального антитела 6ИЛ-9
Seq ID NO:4 Последовательность аминокислот вариабельной области легкой цепи моноклонального антитела 6ИЛ-9
Seq ID NO:5 Последовательность аминокислот участка CDRH-1 моноклонального антитела 6ИЛ-9
Seq ID NO:6 Последовательность аминокислотучастка CDRH-2 моноклонального антитела 6ИЛ-9
Seq ID NO:7 Последовательность аминокислот участка CDRH-3 моноклонального антитела 6ИЛ-9
Seq ID NO:8 Последовательность аминокислот участка CDRL-1 моноклонального антитела 6ИЛ-9
Seq ID NO:9 Последовательность аминокислот участка CDRL-2 моноклонального антитела 6ИЛ-9
Seq ID NO:10 Последовательность аминокислот участка CDRL-3 моноклонального антитела 6ИЛ-9
Существо изобретения демонстрируется следующими примерами.
Пример 1. Иммунизация мышей и получение гибридомы
Мышей линии Balb/c иммунизировали очищенным рекомбинантным ИЛ-6 человека, для чего 15 мкг ИЛ-6 в объеме 50 мкл смешивали с 50 мкл полного адъюванта Фрейнда и вводили в подушечки лап задних конечностей. Через 30 дней и через 51 день производили вторую и третью иммунизации, отличавшиеся от первой заменой полного адъюванта Фрейнда на неполный. Еще через 21 день проводили бустирование внутривенным введением ИЛ-6 в дозе 10 мкг/мышь, через 4 дня после бустирования животных забивали и из их селезенок и периферических лимфоузлов выделяли лимфоциты. Слияние полученных лимфоцитов с клетками миеломы Sp2/0 проводили с помощью полиэтиленгликоля по стандартной методике. После селекции на селективной питательной среде, содержащей HAT, из 5300 ячеек с растущими клетками отбирали образцы культуральной жидкости для скрининга антител к ИЛ-6 человека с помощью твердофазного иммуноферментного анализа. Полученные три позитивных клона подвергали дальнейшему клонированию и размножению. В результате нескольких циклов выращивания и скрининга был отобран клон гибридных клеток 6ИЛ-9, стабильно секретирующих высокоаффинное антитело 6ИЛ-9 к ИЛ-6 человека.
Пример 2. Очистка моноклонального антитела и его свойства
Антитело 6ИЛ-9 из асцитной жидкости мышей линии Balb/c внутрибрюшинно привитой гибридомой 6ИЛ-9 выделяли с помощью гель-проникающей и ионообменной хроматографии для его дальнейшей характеризации.
По результатам электрофореза в 4-20% полиакриламидном геле с ДДС натрия молекулярный вес антитела 6ИЛ-9 в нативных (невосстановленных) условиях соответствует ожидаемому для нативного IgG мыши (160 кДа), в восстановленных условиях антитело диссоциирует на тяжелую (52 кДа) и легкую (28 кДа) цепи (фиг.1). Для изучения связывания ИЛ-6 антителом 6ИЛ-9 препарат ИЛ-6 человека подвергали электрофорезу в полиакриламидном геле в тех же условиях. После окончания электрофореза материал переносили на нитроцеллюлозу, которую инкубировали с раствором антитела 6ИЛ-9, а затем с антителами козы против иммуноглобулинов мыши, конъюгированными с пероксидазой хрена. Дорожку с белками-маркерами молекулярного веса окрашивали Кумасси (фиг.2). Антитело 6ИЛ-9 взаимодействует в иммуноблоте с рекомбинантным ИЛ-6, который в восстановленных условиях обладает молекулярным весом в 18 кД, а в невосстановленных условиях представлен двумя полосами с молекулярными весами 18 кД и 40 кД, что соответствует мономеру и димеру ИЛ-6 человека.
С помощью иммуноферментного набора фирмы Sigma ISO-2 kit 072K4849 был установлен изотип тяжелой цепи антитела 6ИЛ-9 - G1 и легкой цепи - λ. С помощью иммуноферментного анализа было установлено, что антитело 6ИЛ-9 не связывается с белками сыворотки крови и селезенки мышей, а также с белками сыворотки крови человека и растворимыми белками гомогената культивируемых клеток яичников китайского хомячка (СНО). Изоэлектрическая точка находится в диапазоне рН 6,4-6,8 (фиг.3).
Константа диссоциации по ИЛ-6 человека, определенная с помощью иммуноферментного анализа и вычисленная по Скэтчарду, составляет 1×10-10 М.
Пример 3. Ингибирование антителом 6ИЛ-9 биологической активности ИЛ-6 и определение 1С50%
Антитела 6ИЛ-9 в серийных разведениях в диапазоне от 1,25×10-7 М до 1,25×10-12 М инкубировали с 8,4×10-12 М ИЛ-6 человека в течение 2 часов, после чего по 100 мкл смеси антитело-ИЛ-6 вносили к клеткам В9 (по 5×103 клеток в среде RPMI 1640 на пробу, контроль - клетки без ИЛ-6 и с ИЛ-6 без антитела). Клетки культивировали в течение 72 часов при 37ºС и 5% СО2, за 6 часов до окончания культивирования к клеткам добавляли Н-тимидин. Пролиферацию клеток, индуцированную ИЛ-6, оценивали по включению в кислотонерастворимый остаток Н-тимидина и выражали числом импульсов в минуту, а ингибирование биологической активности ИЛ-6 выражали в процентах подавления включения Н-тимидина (табл.1).
Из приведенных данных следует, что 50% ингибирование активности ИЛ-6 наступает при молярном соотношении 6ИЛ-9/ИЛ-6, равном 1,48, что указывает на высокую нейтрализующую активность антитела 6ИЛ-9.
Пример 4. Синтез и секвенирование кДНК, кодирующих вариабельные части легкой и тяжелой цепей моноклонального антитела 6ИЛ-9
Из клеток гибридомы 6ИЛ-9 выделяли РНК, на матрице которой с помощью наборов синтетических праймеров (Immunogenetics Information System http://www.imgt.org) были амплифицированы фрагменты генов, кодирующие вариабельные области тяжелой (VH) и легкой (VL) цепей антитела. Полученные фрагменты генов были клонированы в вектор pALTA (Евроген) и сиквенированы с внешних праймеров (М13). Последовательности фрагментов генов, кодирующих VH и VL, представлены на SEQ ID No:1 и SEQ ID No:2, вычисленные аминокислотные последовательности VH и VL представлены на SEQ ID No 3 и SEQ ID No 4. Анализ последовательностей аминокислот вариабельных областей тяжелой и легкой цепей моноклонального антитела 6ИЛ-9 производили по методу Кэбота (Kabat E.A., Wu, T.T., Perry, H., Gottesman, K. and Foeller, C. (1991) Sequences of Proteins oflm-munological Interest, Fifth Edition. NIH Publication No.91-3242), что позволило выделить участки CDR, определяющие комплементарность антитела антигену (табл.2).
Последовательности аминокислот Seq ID NO:5-10 с помощью программы BLAST (National Center for Biotechnology Information http://www.ncbi.rilm.nih.gov) сравнивали с последовательностями вариабельных областей тяжелых и легких цепей известных моноклональных антител к ИЛ-6 человека. Участков гомологии не обнаружено.
Гибридома 6ИЛ-9 была помещена в Российскую коллекцию клеточных культур под номером РККК(П)751 Д.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО К ЭРИТРОПОЭТИНУ ЧЕЛОВЕКА (ВАРИАНТЫ) И ПРОДУЦИРУЮЩИЙ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К ЭРИТРОПОЭТИНУ ШТАММ ГИБРИДОМЫ | 2012 |
|
RU2513689C1 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО СС3-4 К КОНФОРМАЦИОННОМУ ЭПИТОПУ С3 ЧЕЛОВЕКА, ШТАММ ГИБРИДНОЙ ДНК МЫШИ РККК(П)764Д - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА СС3-4 | 2015 |
|
RU2584582C1 |
| Моноклональное антитело к С-концевому фрагменту антимюллерова гормона | 2021 |
|
RU2770003C1 |
| Моноклональное антитело к С-концевому фрагменту антимюллерова гормона | 2021 |
|
RU2764795C1 |
| Моноклональное антиидиотипическое антитело АИ-G1, обладающее антигенными свойствами морфина | 2019 |
|
RU2717989C1 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К КОНФОРМАЦИОННОМУ ЭПИТОПУ С3 КОМПОНЕНТА КОМПЛЕМЕНТА ЧЕЛОВЕКА, ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК (ВАРИАНТЫ), ЭКСПРЕССИОННЫЙ ВЕКТОР, СОДЕРЖАЩИЙ ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК (ВАРИАНТЫ), И ШТАММ КЛЕТОК ЯИЧНИКОВ КИТАЙСКОГО ХОМЯЧКА CHO-humC34-ПРОДУЦЕНТ ДАННОГО ГУМАНИЗИРОВАННОГО АНТИТЕЛА | 2016 |
|
RU2630647C1 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К С-КОНЦЕВОМУ ФРАГМЕНТУ АНТИМЮЛЛЕРОВА ГОРМОНА | 2018 |
|
RU2765689C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО 6G1 К ПРОИЗВОДНЫМ МОРФИНА | 2018 |
|
RU2703494C1 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К IL-5Rα | 2017 |
|
RU2698048C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО 3К11 К ПРОИЗВОДНЫМ МОРФИНА | 2018 |
|
RU2702002C1 |




Изобретение относится к биотехнологии. Представлено моноклональное антитело против интерлейкина-6 человека, содержащее гипервариабельные участки тяжелой цепи CDRH-1: GFSLSTSGMGVG; CDRH-2: HIWWDDDKYYNPSLKS; и CDRH-3: RANYGTSYDYGMDY; и гипервариабельные участки легкой цепи CDRL-1: KASQSVSDVLT; CDRL-2: YASNRYT; и CDRL-3: QQGYRSPYT. Кроме того, изобретение относится также к штамму гибридомы, депонированному в Российской коллекции клеточных культур под номером РККК(П) 751Д и продуцирующему указанное антитело. Изобретение позволяет расширить арсенал антител против IL-6 человека, обладающих высокой способностью к ингибированию IL-6. 2 н. и 2 з. п. ф-лы, 3 ил., 2 табл., 4 пр.
1. Моноклональное антитело против интерлейкина-6 человека, содержащее гипервариабельные участки тяжелой цепи с последовательностями SEQ ID NO: 5-7 и гипервариабельные участки легкой цепи с последовательностями SEQ ID NO: 8-10.
2. Моноклональное антитело против интерлейкина-6 человека по п. 1, имеющее последовательность вариабельной области тяжелой цепи по SEQ ID NO: 3 и последовательность вариабельной области легкой цепи по SEQ ID NO: 4.
3. Моноклональное антитело против интерлейкина-6 человека по п. 2, кодируемое ДНК, содержащей последовательности нуклеотидов по SEQ ID NO: 1 и SEQ ID NO: 2.
4. Штамм гибридомы, продуцирующий моноклональное антитело против интерлейкина-6 человека по п. 1, депонированный в Российской коллекции клеточных культур под номером РККК(П) 751Д.
| АНТИТЕЛА ПРОТИВ IL-6, КОМПОЗИЦИИ, СПОСОБЫ И ПРИМЕНЕНИЕ | 2002 |
|
RU2318829C2 |
| WO 2006119115 A2, 09.11.2006 | |||
| БЛОК ГОРЕЛКИ С ВОСПЛАМЕНЯЮЩИМ УСТРОЙСТВОМ (ВАРИАНТЫ), СПОСОБ ОБЕСПЕЧЕНИЯ ВОЗГОРАНИЯ В ГОРЕЛКЕ ЗАЖИГАЛКИ (ВАРИАНТЫ), СПОСОБ ИЗГОТОВЛЕНИЯ ГОРЕЛКИ, ГОРЕЛКА С ВОСПЛАМЕНЯЮЩИМ УСТРОЙСТВОМ | 2004 |
|
RU2324115C2 |
| С.В | |||
| СКУРКОВИЧ и др | |||
| "Антицитокиновая терапия - новый подход к лечению аутоиммунных заболеваний и цитокиновых нарушений", Вопросы гематологии/онкологии и иммунопатологии в педиатрии, 2003, т | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Контрольный стрелочный замок | 1920 |
|
SU71A1 |
| Штамм гибридных культивируемых клеток животных MUS мUSсULUS L. - продуцент моноклонального антитела к антигену мембран жировых глобул женского молока | 1989 |
|
SU1698287A1 |
Авторы
Даты
2015-05-10—Публикация
2014-02-28—Подача