Область техники
Настоящее изобретение направлено на область стимуляции роста растений и всхожести растений. Более конкретно, настоящее изобретение направлено на новый штамм Pseudomonas azotoformans, обозначаемый F30A, депонированный в Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH с присвоенным номером доступа DSM 22077, его применение в качестве стимулятора всхожести растений и роста растений, и композиции и способы для подобного применения.
Предшествующий уровень техники
Ризосферные бактерии (ризобактерии) с благоприятными воздействиями на рост растений часто называют PGPR (стимулирующие рост растений ризобактерии), и они приносят пользу сельскохозяйственному растению во время различных стадий его роста от посева/посадки до сбора урожая. Многочисленные исследования показали, что флуоресцентные псевдомонады в почве и ризосфере демонстрируют стимулирующее действие на рост растений в нескольких сельскохозяйственных культурах (Kloepper et al., 1980 a, b; Brisbane et al., 1989; DeFreitas and 1991 Germida), и также подавляют заболевания растений (Hemning, 1990, O'Sullivan and O'Gara, 1992, Weller, 1988, Hokeberg et al., 1997).
В условиях эксперимента несколько флуоресцентных псевдомонад зарекомендовали себя как потенциальные агенты для увеличения всхожести и урожая сельскохозяйственных культур, таких как пшеница (Kropp et al., 1996), горчица (Deshwal et al., 2006), сахарная свекла (Suslow and Schroth, 1982), картофель (Kloepper et al., 1980; Howie and Echandi, 1983), редис (Kloepper and Schroth, 1978; Davies and Whitbread, 1989) и шпинат (Urashima et al., 2006). Несколько механизмов, связанных с их стимулирующим действием на рост растений, хорошо изучены и описаны. Они, среди других, включают способность к колонизации корней (Benizri et al., 2001), способность образовывать широкий ряд ферментов и гормонов (Vivekananthan et al., 2004; Lucy et al., 2004, Patten and Glick, 1996; Garcia de Salamone et al., 2001) так же, как другие метаболиты зачастую с антибактериальным действием (Loper and Buyer, 1991; Dowling and O'Gara 1994). Примеры патентов/патентных заявок, покрывающих различные области их действия, также доступны и включают, главным образом, штаммы/изоляты со свойствами биологического контроля. Патент/патентные заявки о флуоресцентных псевдомонадах со стимулирующими рост растения свойствами охватывают чаще всего активную компоненту (бактериальный штамм) настоящего изобретения в комбинации с описанием скрининга и способов тестирования, необходимых для выбора желательного изолята(ов). Следующие патентные заявки, которые тем самым включены в настоящее описание, описывают некоторые примеры по изобретениям, охватывающим флуоресцентные псевдомонады со свойствами стимуляции роста растений и/или биологического контроля:
WO/1987/000194, US1996/5503652, WO0051435, US1996/5503651, US2002/6447770 и US2002/6495362.
Несмотря на литературу и перечисленные выше патенты/патентные заявки, до сих пор нет другого изолята, принадлежащего к виду Pseudomonas azotoformans, влияние которого на устойчивое улучшение всхожести, роста и урожая многих важных сельскохозяйственных культур в течение нескольких лет полевых экспериментов показано и доказано. Наоборот, ранее изученный изолят Pseudomonas azotoformans почвенного происхождения не показал значительного стимулирующего действия на рост в экспериментах с рисом (Piao et al., 2005). Единственная краткая информация о стимулирующем действии изолятов Pseudomonas azotoformans на рост растений, которая касается связанных с ризомой бактериальных сообществ сильных тростниковых зарослей в озере Веленце, Венгрия (Micsinai et al., 2003), не основана ни на каких экспериментальных данных, подтверждающих их стимулирующие рост растения свойства.
Сущность настоящего изобретения
Цель настоящего изобретения состоит в том, чтобы описать новый штамм флуоресцентной псевдомонады, который проявляет стимуляцию всхожести растений и/или роста растений у нескольких ценных с точки зрения сельского хозяйства культур. Эта цель достигается посредством исключительного изолята флуоресцентных псевдомонад вида Pseudomonas azotoformans, обозначаемого штаммом F30A. Ранее никогда не сообщалось о стимулирующих свойствах штаммов Pseudomonas azotoformans на рост растений. Этот изолят обеспечивает значительную всхожесть растений и стимуляцию роста после его применения к различным сельскохозяйственным культурам, выращиваемым как в оранжерее, так и в полевых условиях. Кроме того, на основе доступных литературных данных, их эффект систематически более стабилен и повторяем, чем любой другой ранее зарегистрированный стимулирующий эффект микробного агента на рост растения. Биологически чистый штамм Pseudomonas azotoformans, штамм F30A, был депонирован в Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH с присвоенным номером доступа DSM 22077.
Поэтому настоящее изобретение направлено на биологически чистый штамм Pseudomonas azotoformans, штамм F30A, депонированный в Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH с присвоенным номером доступа DSM 22077. Настоящее изобретение также направлено на надосадочную жидкость, получаемую из культуры биологически чистого штамма Pseudomonas azotoformans, штамма F30A, депонированного в Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH с присвоенным номером доступа DSM 22077.
Настоящее изобретение также направлено на применение биологически чистого штамма Pseudomonas azotoformans, штамма F30A, или его надосадочной жидкости для увеличения прорастания семян, всхожести растений и/или роста растений. Указанное семя и/или растение могут быть, например, двудольными или однодольными.
Настоящее изобретение также направлено на продукт ферментации биологически чистого штамма Pseudomonas azotoformans, штамма F30A.
Настоящее изобретение также направлено на сельскохозяйственную композицию, включающую биологически чистый штамм Pseudomonas azotoformans, штамм F30A, или его надосадочную жидкость, необязательно, в комбинации с одним или несколькими жидкими и/или твердыми носителями. Сельскохозяйственная композиция может дополнительно включать один или несколько дополнительных микроорганизмов, стимулирующих рост растения, микроорганизмов биологического контроля, органических удобрений и/или агрохимикатов.
Настоящее изобретение дополнительно направлено на способ для увеличения прорастания семян, всхожести растений и/или роста растений, включающий стадию применения продукта ферментации или сельскохозяйственной композиции, как определено в настоящем описании, к семени, растению и/или среде, окружающей указанное семя или растение. Применение может быть, например, осуществлено к корням растения. Применение может быть осуществлено до и/или после появления корней растения. Продукт ферментации или сельскохозяйственная композиция могут альтернативно быть применены к единицам вегетативного размножения растения. Продукт ферментации или сельскохозяйственная композиция могут также быть применены к единицам вегетативного размножения растения или к среде выращивания растения, окружающей семена и/или растения. Растением может быть однодольное растение или двудольное растение, или семя может развиться в однодольное растение или двудольное растение.
Настоящее изобретение также направлено на способ получения сельскохозяйственной композиции, как определено в настоящем описании, включающий стадию смешивания указанной Pseudomonas azotoformans, штамма F30A, или указанной надосадочной жидкости с одним или несколькими жидкими или твердыми носителями и, необязательно, одним или несколькими дополнительными микроорганизмами, стимулирующими рост растения, микроорганизмами биологического контроля, органическими удобрениями и/или агрохимикатами.
Краткое описание фигур
Фиг.1. Таксономическое положение изолята F30A по отношению к штаммам, представляющим 25 различных видов Pseudomonas, и к одному референсному штамму E. coli (номер доступа в Gene Bank J01695) на основе выравнивания последовательностей из 1390 нуклеотидов 16S рДНК.
Фиг.2. Всхожесть (A) и сухая масса (B) яровой пшеницы (незараженная партия семян) после обработки семян продуктом ферментации F30A и его надосадочной жидкостью в различных концентрациях. Эксперимент в оранжерее. Квадраты обозначают КОЕ на мл. Величины ошибки представляют собой стандартную ошибку среднего (n=4).
Фиг.3. Всхожесть (A) и сухая масса (B) яровой пшеницы (незараженная партия семян) после обработки семян продуктом ферментации F30A в различных концентрациях и клетками F30A, суспендированными в физиологическом растворе соли. Эксперимент в оранжерее. Квадраты обозначают КОЕ на мл. Величины ошибки представляют собой стандартную ошибку среднего (n=4).
Фиг.4. Всхожесть шпината после обработки семян продуктом ферментации F30A в различных концентрациях, клетками F30A, суспендированными в водопроводной воде, и надосадочной жидкостью изолята. Результаты двух различных партий продукта ферментации: партия FOM115 (A) и партия FOM139 (B). Эксперимент в оранжерее. Квадраты обозначают КОЕ на мл. Величины ошибки представляют собой стандартную ошибку среднего (n=4).
Фиг.5. Масса зеленого урожая кочанного салата после обработки корней/почвы продуктом ферментации F30A в различных концентрациях и после применения его надосадочной жидкости. Применяли две различные партии продукта ферментации: партию FOM173 (A) и партию FOM176 (B). (A) и (B) представляют собой два независимых эксперимента в оранжерее. Квадраты обозначают КОЕ на мл. Величины ошибки представляют собой стандартную ошибку среднего (n=12).
Фиг.6. Масса зеленого урожая кочанного салата после обработки корней/почвы сохраненными партиями продукта ферментации F30A. Партию FOM203 хранили при 4°C в течение 2 недель, партию FOM196 в течение 6 недель и партию FOM192 в течение 14 недель. Эксперимент в оранжерее. Квадраты обозначают КОЕ на мл. Величины ошибки представляют собой стандартную ошибку среднего (n=12).
Фиг.7. Урожай плода перца после обработки корней/почвы продуктом ферментации F30A (партия FOM076) в различных концентрациях. Эксперимент в оранжерее. Квадраты обозначают КОЕ на мл. Величины ошибки представляют собой стандартную ошибку среднего (n=8).
Фиг.8. Обработка почвы/корней кочанного салата. Левый резервуар: контрольная вода; правый резервуар: продукт ферментации F30A.
Фиг.9. Всхожесть шпината в полевом эксперименте после обработки семян продуктом ферментации F30A (партия FOM233). Всхожесть регистрировали в трех отдельных случаях. Процент увеличения/уменьшения всхожести по сравнению с необработанным контролем указан на рисунке. Величины ошибки представляют собой стандартную ошибку среднего (n=4).
Фиг.10. Урожай шпината в полевом эксперименте после обработки семян продуктом ферментации F30A (партия FOM233). Урожай измеряли в два различных момента времени. Величины ошибки представляют собой стандартную ошибку среднего (n=4).
Фиг.11. Урожай рукколы (столбики) в двух случаях и всхожесть (квадраты) после обработки семян продуктом ферментации F30A (партия FOM154) в полевом эксперименте. Величины ошибки представляют собой стандартную ошибку среднего (n=12).
Фиг.12. Урожай гороха сорта Vining после обработки семян продуктом ферментации F30A (партия FOM150) в полевом эксперименте. Величины ошибки представляют собой стандартную ошибку среднего (n=4).
Фиг.13. Урожай моркови после обработки семян продуктом ферментации F30A (партия FOM076) в полевом эксперименте. Величины ошибки представляют собой стандартную ошибку среднего (необработанные: n=9; вода: n=12; F30A: n=6).
Фиг.14. Урожай кочанного салата после обработки корней/почвы продуктом ферментации F30A (партия FOM233) в полевом эксперименте. Величины ошибки представляют собой стандартную ошибку среднего (n=5).
Фиг.15. Количество цветков клубники после обработки корней/почвы продуктом ферментации F30A (партия FOM095 и FOM147) в полевом эксперименте. Темные столбики: F30A; светлые столбики: обработанные водой контроли. Величины ошибки представляют собой стандартную ошибку среднего (n=4).
Фиг.16. Урожай клубники после обработки корней/почвы продуктом ферментации F30A (партия FOM095 и FOM147) в полевом эксперименте. Темные столбики: F30A; светлые столбики: обработанные водой контроли. Величины ошибки представляют собой стандартную ошибку среднего (n=4).
Фиг.17. Урожай брокколи после обработки корней/почвы продуктом ферментации F30A (партия FOM076) в полевом эксперименте. Темные столбики: F30A; светлые столбики: обработанные водой контроли. Величины ошибки представляют собой стандартную ошибку среднего (n=5).
Фиг.18. Урожай летней капусты после обработки корней/почвы продуктом ферментации F30A в полевом эксперименте. Темные столбики: F30A; светлые столбики: обработанные водой контроли; квадраты: процент рыночного урожая (>350 граммов). Величины ошибки представляют собой стандартную ошибку среднего (n=50).
Фиг.19. Развитие растения и урожай клубня раннего картофеля после обработки клубня продуктом ферментации F30A в полевом эксперименте. Средние значения с различными буквами являются значимо различными по многоранговому тесту Дункана (p=0,05).
Фиг.20. Относительный урожай клубней одного сорта раннего картофеля и одного сорта позднего картофеля после обработки клубней продуктом ферментации F30A и мокрой композицией изолята. Данные из полевых экспериментов. Средние значения с различными буквами являются значимо различными по многоранговому тесту Дункана (p=0,05).
Фиг.21. Улучшение роста корней и побегов 10-недельных сеянцев сосны обыкновенной после обработки продуктом ферментации изолята F30A (справа) по сравнению с необработанным сеянцем (слева).
Подробное описание настоящего изобретения
Ускоряющий рост растения агент по настоящему изобретению
Настоящее изобретение направлено на новый штамм Pseudomonas azotoformans, штамм F30A, депонированный 3 декабря 2008 в Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (Inhoffenstrasse 7B; D-38124 Брауншвейг; Германия) с присвоенным номером доступа DSM 22077. Лицом, представляющим для регистрации, является Lantmannen BioAgri AB (P.O. Box 914; 751 09 Упсала; Швеция). Штамм F30A по настоящему изобретению является биологически чистым штаммом.
Новый штамм Pseudomonas azotoformans, штамм F30A, ниже также обозначается как "изолят", "агент" или Pseudomonas azotoformans F30A. Pseudomonas azotoformans ниже может быть сокращено до P. azotoformans. Также Pseudomonas azotoformans, штамм F30A, ниже может быть просто обозначен как "F30A".
Стимулирующий рост растения Pseudomonas azotoformans F30A по настоящему изобретению включает биологически чистый штамм флуоресцентной псевдомонады, который обладает следующими специфическими идентифицирующими характеристиками: (i) изолят является ассоциированной с корнями грамотрицательной бактерией, членом линии P. fluorescens, и он имеет специфичный профиль обмена по Biolog GM, отличный от самых ближайших родственников; характеристики выбора и идентификации будут приведены ниже; (ii) изолят обладает другими уникальными морфологическими, биохимическими и метаболическими характеристиками, описанными ниже, так же как способностью фиксировать азот, растворять фосфор и растворять/окислять серу; (iii) изолят увеличивает прорастание семян, рост растения и/или урожай, по меньшей мере, сельскохозяйственных культур, принадлежащих следующим семействам растений: Amaranthaceae, Brassicaceae, Solanaceae, Astraceae, Apiaceae, Fabaceae, Rosacea, Cucurbitaceae, Lamiaceae, Aliaceae, так же как и увеличивает образование корней и рост сеянцев деревьев в растительных питомниках. Подробные примеры таких эффектов будут приведены ниже.
Изолят по настоящему изобретению обладает следующими дополнительными идентифицирующими характеристиками: в присутствии активно растущего изолята ярко темно-зеленые до почти черного пигменты накапливаются в органических культуральных средах (PF агарах, жидких средах с соевым пептоном, пшеничном пептоне и других растительных пептонах в качестве основных субстратов), и/или сине-зеленые пигменты накапливаются в минеральных культуральных средах с добавлением глицерина (например, среда Лемна (Maeng and Khudairi, 1973)). О таком накоплении пигмента не сообщалось ни для каких других известных псевдомонад. Кроме того, изолят обладает уникальной биохимической характеристикой со специфичным профилем углеводного обмена, тестированным системой Biolog GN, который отличается от таковых у типовых штаммов Pseudomonas azotoformans и других самых близкородственных флуоресцентных псевдомонад.
Выбор изолята по настоящему изобретению начинали путем сбора целых растительных образцов, включая корни. Разведения образца получали из кусочков корня и высевали на среду, подходящую для выделения бактерий. Бактериальные колонии с различными морфологическими признаками собирали и сохраняли при -80°C в качестве исходных культур. Жидкие культуры на подходящих микробиологических субстратах получали из исходных культур, и селекцию на предмет стимулирующих рост растений свойств проводили в оранжерее путем биоанализа(ов) с пшеницей и семенами сахарной свеклы, инокулированными индивидуальными изолятами. Изоляты, увеличивающие прорастание и рост растения, отбирали, идентифицировали, и проводили первичную оценку безопасности для подтверждения их применимости для экспериментов большего масштаба в оранжерее и в поле.
На основе набора морфологических, биохимических и генетических характеристик, отобранный изолят по настоящему изобретению является грамотрицательной жгутиковой бактерией и членом линии P. fluorescens, идентифицированной как вид Pseudomonas azotoformans (фиг.1). Однако она обладает уникальным профилем обмена по системе Biolog GN по сравнению со штаммом типа Pseudomonas azotoformans IAM1603 и другими близкородственными видами Pseudomonas (таблица 1). В комбинации с признаками, перечисленными в таблице 1, следующие особенности являются очень специфичными для штамма по настоящему изобретению: он использует сахарозу и себациновую кислоту, в то время как члены трех самых близкородственных видов не используют их, и он не использует ксилитол и путресцин, которые используют члены трех самых близкородственных видов.
аДанные взятые из Dabboussi et al. (1999) основаны на характеристиках нескольких штаммов, а не только штамма LMG2190, который применяли в качестве контроля для Biolog теста, выполненного в лабораториях MASE; (-) отрицательно, (+) положительно, (d) расходящийся, nt (не тестировано)
IAM1603
CCM4841
LMG2190
Другими полезными характеристиками, позволяющими идентифицировать изолят по настоящему изобретению, являются специфическая морфология колонии на обыкновенных бактериологических культуральных средах, таких как: VPA - растительно-пептонный агар (10 г растительно-пептонного бульона (Oxoid Ltd), 15 г гранулированного агара (Difco Ltd) в 1000 мл дистиллированной/деминерализованной воды); PF агар (Difco Ltd, 38 г PF среды из готовой смеси, 10 г глицерина в 1000 мл дистиллированной/деминерализованной воды), накопление ранее описанных уникальных пигментов.
Характерный вид колонии изолята по настоящему изобретению наилучшим образом проявляется через 24 ч инкубации при температуре 30°C с последующей дополнительной инкубацией в течение 24-48 ч при комнатной температуре (приблизительно 20-22°C). При выращивании на VPA, края колонии обычно неровные, и колония немного выше и плотнее в середине. Колонии являются компактными, прозрачными, не слизистыми, более плотными и коричневатыми в середине с более светлым синеватым цветом на краях и имеют типичную форму, напоминающую раковистую структуру.
Уникальные характеристики колонии, дифференцирующие изолят по настоящему изобретению от других изолятов флуоресцентных псевдомонад, также наблюдаются на PF агаре через 5-8 дней инкубации при комнатной температуре. Колонии являются бело-сероватыми с очень четким маленьким желто-коричневым кончиком в середине и с довольно правильными краями.
Во время культивирования изолята по настоящему изобретению на PF агаре, в агаре накапливается ярко-зеленый до почти черного пигмент(ы).
В лабораторных анализах изолят по настоящему изобретению растет в модифицированной жидкой минеральной среде для Pseudomonas (Stanier et al., 1966) без какого-либо доступного азота, но с добавлением 2% подходящего источника углерода (например, глицерина), что указывает на его способность связывать атмосферный азот. Жидкую среду инокулируют петлей выращенных за ночь бактериальных клеток изолята по настоящему изобретению, или клетки суспендируют в 0,01М сульфате магния, и суспензию клеток (0,1 мл на 5 мл жидкой среды) добавляют к минеральной среде. Рост наблюдали путем измерения оптической плотности (600 нм) в течение 5 дней после инокуляции. Оптическая плотность через 5 дней составляла, соответственно, 0,108 (инокуляция петлей) по сравнению с 0,069 в начале культивирования и 0,087 (клеточная суспензия) по сравнению с 0,046 в начале культивирования. Измерения указывают на способность изолята медленно разрастаться в отсутствии азота, что в свою очередь указывает способность изолята по настоящему изобретению фиксировать азот.
Также изолят по настоящему изобретению делает растворимым фосфор, так же как окисляет тиосульфат и делает растворимым элементную серу. Анализы выполняют путем инокуляции изолятом по настоящему изобретению чашек с агаровой средой, с добавлением или нерастворимого фосфора (Ca3(PO4)2), или тиосульфата/элементной серы. В результате растворения/окисления нерастворимых элементов образуются чистые зональные области вокруг колоний изолята по настоящему изобретению.
Преимущество применения изолята PGPR по настоящему изобретению, принадлежащего к виду Pseudomonas azotoformans, вместо применения изолятов вида Pseudomonas fluorescens, состоит в том, что о членах вида P. azotoformans никогда не сообщалось как о возможных патогенных микроорганизмах для человека. Напротив, существуют сообщения о патогенности P. fluorescens для человека (см. например, Franzetti et al., 1992, Hsueh et al., 1998; Wei et al., 2002).
Рост и хранение изолята по настоящему изобретению
Флуоресцентный изолят псевдомонады по настоящему изобретению (Pseudomonas azotoformans F30A) может быть выращен на любой обыкновенной подходящей бактериологической среде (как твердой, так и жидкой). Некоторыми примерами подходящей отвердевающей среды являются растительно-пептонный агар (VPA) и Pseudomonas F агар (PF агар). Примерами жидких сред являются растительно-пептонный бульон и все среды с соевым пептоном в качестве главного источника органического углерода. В лабораторных условиях изолят по настоящему изобретению растет хорошо при любой температуре, подходящей для типичных экологических флуоресцентных псевдомонад, т.е. от 15°C до 30°C; предпочтительно, в диапазоне температур от 23°С до 27°C. Их рост замедляется на более чем 90% при температуре 37°C. pH питательной среды, предпочтительно, является нейтральной в пределах от pH 7,0 до 7,5.
Несколько органических субстратов, как, например, триптический соевый бульон, растительно-пептонный бульон, так же как растительный пептон, пшеничный пептон и соево-пептонные бульоны поддерживают превосходное действие, так же как получение большой биомассы изолята по настоящему изобретению. Испытания в оранжерее проводили с двумя системами биоанализа; применение к корням/почве (кочанный салат) и применение к семенам (шпинат); позволяли выбор субстрата MPS0 (Levenfors et al., 2008), который являлся самым легко приспосабливаемым для применения в этих различных сельскохозяйственных системах. Однако для изолята по настоящему изобретению время ферментации должно составлять 40-48 ч и не менее. Для обнаружения биологической активности изолята по настоящему изобретению, другие органические субстраты, тем не менее, также подходящие для его ферментации, и изолят по настоящему изобретению могут быть также культивированы на роторном встряхивателе (120 об/мин, 40-48 ч, комнатная температура). Для получения удовлетворительного действия, ферментацию биологически активного продукта изолята по настоящему изобретению, однако, рекомендуют проводить в диапазоне pH 7,0-7,5 и в диапазонах температур приблизительно 15-30°C, таких как 20-28°C, наиболее предпочтительно, приблизительно 23-27°C.
Для испытаний на действие обычно продукт ферментации изолята по настоящему изобретению ферментировали согласно стандартному протоколу ферментации (pH 7,0; 20°C) или согласно оптимизированному протоколу ферментации (pH 7,25 и 25°C) в течение всего способа ферментации (см. экспериментальную часть соответствующих протоколов). Дополнительно, бактериальные клетки, полученные посредством центрифугирования стандартного или оптимизированного продукта ферментации изолята по настоящему изобретению (8000 об/мин, 15 мин) и впоследствии, составленные в композицию с соответствующими неорганическими или органическими носителями, совместимыми с точки зрения сельского хозяйства, также тестировали в выбранных испытаниях. Все эти типы получения продукта ферментации являются подходящими в применении для увеличения прорастания семян или роста растений и в способах по настоящему изобретению.
Чтобы гарантировать сохранение устойчивости, изолят по настоящему изобретению можно хранить или в виде лиофилизированной исходной культуры, или в виде глубокозамороженной исходной культуры при -80°C в смеси 20% VPB и 30% глицерина. Для ферментации и для получения жидкой культуры, в целом, переносят приблизительно 100 мкл глубокозамороженной исходной культуры в 100 мл любой органической жидкой среды 50% концентрации, подходящей для бактериального роста, т.е. 50% концентрации TSB, и выращивают на роторном встряхивателе (120 об/мин; 22-25°C; наибольшая длительность 24 ч). Для других экспериментальных целей небольшое количество глубокозамороженной исходной культуры изолята F30A также можно высевать в чашки с любым твердым органическим субстратом, подходящим для бактериального роста, и хранить в течение периода не более двух недель при +4°C.
Стимулирующее действие на рост растений
Биологически чистый изолят Pseudomonas azotoformans F30A по настоящему изобретению обладает способностью увеличивать прорастание семян, всхожесть растений и приживаемость, стимулировать приживаемость и образование цветков и/или увеличивать рост растения, таким образом, увеличивая урожаи сельскохозяйственных культур. Один аспект настоящего изобретения поэтому относится к применению изолята по настоящему изобретению для увеличения прорастания семян, всхожести растений и/или роста растений. Растения могут быть однодольными или двудольными растениями, или семя может развиваться в любое из этих двух типов растений.
Изолят по настоящему изобретению увеличивает прорастание, всхожесть, цветение и/или улучшает рост и урожай вышеуказанных сельскохозяйственных культур в диапазоне приблизительно от 4 до более 50%.
Примеры, представленные ниже, демонстрируют стимулирующее действие Pseudomonas azotoformans F30A по настоящему изобретению на рост растений. В таблице 2 показаны данные полевых испытаний по среднему суммарному увеличению урожая после применения изолята по настоящему изобретению как в виде обработки семян, корней/почвы (сеянец) или клубней у интересующих сельскохозяйственных культур в ряде полевых или коммерческих оранжерейных испытаний, выполненных в Швеции во время четырех последовательных сельскохозяйственных сезонов. Примеры 1-18 ясно показывают исключительный стимулирующий рост растения потенциал изолята по настоящему изобретению в коммерческих полевых/оранжерейных испытаниях или в экспериментах в вегетационных камерах (пшеница, Poaceae) при применении в виде обработки семян, клубней, корней и пропитки почвы в незараженных растительных системах. Кроме того, стимулирующее действие изолята по настоящему изобретению на рост растений наблюдается после применения к семенам, зараженным патогенными микроорганизмами, передающимися с семенами, например, Fusarium spp., в пшенице (пример 1). Такой эффект может приводить к избавлению от инфекции посредством стимуляции прорастания семени и роста недавно появившегося проростка. Таким образом, восприимчивая фаза для растения преодолевается быстрее и инфекции можно избежать. Кроме того, широкий диапазон стимулирующего действия изолята по настоящему изобретению на рост растений не зависит от типа почвы (все полевые и оранжерейные испытания проводили с различными типами почв и оранжерейных субстратов) и также не зависит от условий окружающей среды, таких как климат (подтверждено, что изолят по настоящему изобретению эффективен в стимуляции роста растений для широкого ряда сельскохозяйственных культур в течение нескольких сельскохозяйственных сезонов при различной температуре и характере атмосферных осадков).
Также, надосадочная жидкость изолята по настоящему изобретению (бесклеточный продукт брожения, вызываемого P. azotoformans F30A, получаемый после центрифугирования (8000 об/мин или более, 20 минут или дольше) и дополнительной стерилизации фильтрованием (0,2 мкм), увеличивает прорастание, всхожесть, рост растения и/или урожай.
Примеры 1, 2 и 4 показывают потенциал надосадочной жидкости изолята по настоящему изобретению для значительного увеличения всхожести яровой пшеницы и шпината, так же как и урожая яровой пшеницы и кочанного салата.
Применение и спецификации применения изолята по настоящему изобретению
Кроме того, целью настоящего изобретения является сделать доступными эффективные препараты/композиции, включающие Pseudomonas azotoformans F30A по настоящему изобретению и/или его надосадочную жидкость, которые эффективны в увеличении прорастания семян и/или улучшении роста растений и/или урожая важных сельскохозяйственных культур, при применении в виде обработки семян, единиц вегетативного размножения, корней, почвы и/или другой среды выращивания растений и/или в виде пропитки. Таким образом, настоящее изобретение описывает также сельскохозяйственные композиции, которые включают штамм Pseudomonas azotoformans F30A по настоящему изобретению, ускоряющий рост растений, и/или его надосадочную жидкость, по желанию, в комбинации с одним или несколькими носителями, совместимыми с точки зрения сельского хозяйства, позволяющими составление изолята по настоящему изобретению в жидкую композицию, или носителем(ями), совместимым с точки зрения сельского хозяйства, позволяющим составление изолята по настоящему изобретению в сухие или твердые препараты/композиции.
Изолят по настоящему изобретению полезен для увеличения прорастания семян и всхожести растений, улучшения плотности насаждений сельскохозяйственной культуры, стимуляции цветения растений и роста растений и улучшения урожаев оранжерейных и полевых двудольных и однодольных сельскохозяйственных культур, например, из следующих семейств растений: Amaranthaceae (например, сахарная свекла, шпинат, мангольд), Solanaceae (например, картофель, перец), Fabaceae (например, горох), Brassicaceae (например, руккола, брокколи, различные сорта капусты, турнепс, масличный рапс), Astraceae (например, различные сорта салата), Apiaceae (например, морковь), Rosacea (например, клубника) и Poaceae (например, пшеница), Cucurbitaceae (например, огурец), Lamiaceae (например, ореган), Aliaceae (например, шнитт-лук). Изолят по настоящему изобретению также полезен для улучшения формирования корней и/или роста саженцев деревьев в различных растительных питомниках (например, сосны обыкновенной из семейства Pinaceae).
Для увеличения прорастания семян и/или всхожести растений, улучшения плотности насаждений сельскохозяйственной культуры, стимуляции цветения растения и/или роста и/или, наконец, улучшения урожая, сельскохозяйственные культуры выращивают в присутствии определенного количества стимулирующего рост растений изолята по настоящему изобретению, т.е. Pseudomonas azotoformans F30A, где определенное количество стимулирующего рост растений изолята описано как количество изолята, которое значительно увеличивает прорастание семян, улучшает плотность насаждения сельскохозяйственной культуры, стимулирует цветение растения и рост и, наконец, улучшает урожай, по сравнению с необработанным контролем. Количество изолята по настоящему изобретению, необходимое для получения желаемых эффектов, отличается между сельскохозяйственными культурами и зависит от способа применения изолята по настоящему изобретению (обработка семян высеваемых семенами двудольных и однодольных сельскохозяйственных культур, обработка единиц вегетативного размножения (клубней, луковиц, ризом и т.д.), обработка картофеля и других вегетативно размножающихся сельскохозяйственных культур, так же как обработка почв/корней/пропитка рассады овощных культур и сеянцев других сельскохозяйственных культур). Десять на 100 мл продукта Pseudomonas azotoformans F30A (между 7,5×108 и 7,5×109 колониеобразующих единиц на мл) на один килограмм семян, 10-20 мл на каждый пересаженный сеянец (корень/почва/пропитка) и от 100 мкл до 1 мл на каждую единицу вегетативного размножения, например, клубень картофеля, обычно рекомендуется для получения желаемого эффекта стимуляции роста растений. Однако количество изолята по настоящему изобретению следует, предпочтительно, определять в зависимости от конкретного случая для различных комбинаций сельскохозяйственной культуры/способа применения.
По желанию, 10-100 мл бесклеточной надосадочной жидкости Pseudomonas azotoformans F30A на один килограмм семян, 10-20 мл на каждый пересаженный сеянец (корень/почва/пропитка) и от 100 мкл до 1 мл на каждую единицу вегетативного размножения, например, клубень картофеля, обычно рекомендуется для получения желаемого эффекта стимуляции роста растений. Однако количество изолята по настоящему изобретению следует, предпочтительно, определять в зависимости от конкретного случая для различных комбинаций сельскохозяйственной культуры/способа применения.
Клетки Pseudomonas azotoformans F30A по настоящему изобретению могут быть применены к семенам, растениям и/или среде, окружающей семя или растение (например, к почве) в форме продукта ферментации или в форме сельскохозяйственной композиции для увеличения прорастания семян и/или роста растения.
Поэтому один аспект настоящего изобретения направлен на продукт ферментации (т.е. бактериальные клетки вместе с примененной для них средой роста) биологически чистого штамма Pseudomonas azotoformans F30A.
Другой аспект настоящего изобретения направлен на надосадочную жидкость, получаемую из культуры биологически чистого штамма Pseudomonas azotoformans, штамма F30A, депонированного в Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH с присвоенным номером доступа DSM 22077. Такая надосадочная жидкость может быть применена во всех аспектах настоящего изобретения вместо бактериальных клеток или продукта ферментации клеток.
Поэтому еще один аспект настоящего изобретения направлен на сельскохозяйственную композицию, включающую биологически чистый штамм Pseudomonas azotoformans F30A, или надосадочную жидкость его культуры, по желанию, в комбинации с одним или несколькими жидкими и/или твердыми носителями. Сельскохозяйственной композицией является композиция, которая, не подвергая риску биологический эффект активного ингредиента, делает возможным практическое применение и применение в сельскохозяйственных системах. Сельскохозяйственная композиция по настоящему изобретению включает чистую культуру/продукт ферментации Pseudomonas azotoformans F30A, его клетки (например, полученные путем удаления культуральной среды центрифугированием и, по желанию, промыванием клеток, например, подходящим буфером) и/или его бесклеточную надосадочную жидкость, по желанию, составленные в композицию с любым подходящим допустимым с точки зрения сельского хозяйства жидким и/или твердым носителем, который не влияет отрицательно на действие изолята и рост сельскохозяйственной культуры, к которой планируется применение. Дополнительно необязательные составляющие такой сельскохозяйственной композиции иллюстрируются в других местах в настоящем описании.
Кроме того, среда для выращивания может также быть удалена из бактериальной культуры Pseudomonas azotoformans F30A, например, посредством центрифугирования, и бактериальные клетки могут быть повторно суспендированы в воде или других жидких средах или буферах, известных в области техники, перед применением к растениям, семенам или почве. Поскольку сама надосадочная жидкость включает активные вещества, образуемые Pseudomonas azotoformans F30A, надосадочная жидкость также может быть применена вместо бактериальных клеток во всех аспектах настоящего изобретения.
Еще один аспект настоящего изобретения направлен на способ получения сельскохозяйственной композиции, включающей Pseudomonas azotoformans F30A, включающий стадию смешивания указанного Pseudomonas azotoformans F30A или надосадочной жидкости, полученной из его культуры, с одним или несколькими жидкими и/или твердыми носителями и, по желанию, одним или несколькими дополнительными микроорганизмами, стимулирующими рост растения, микроорганизмами биологического контроля, органическими удобрениями и/или агрохимикатами. Специалисту в области техники хорошо известны подобные подходящие агенты.
Клетки Pseudomonas azotoformans F30A также могут быть доставлены к семенам, растениям и/или среде, окружающей семя или растение (например, в почву), в форме высушенных клеток, таких как лиофилизированные, высушенные распылением, высушенные под вакуумом или клетки, высушенные в псевдоожиженном слое. Такая композиция может дополнительно включать один или несколько подходящих носителей.
Сельскохозяйственная композиция, включающая Pseudomonas azotoformans F30A или надосадочную жидкость его культуры, может также включать дополнительные микроорганизмы, такие как микроорганизмы биологического контроля, добавки и/или вспомогательные средства, обладающие, например, стимулирующим действием на рост растений, защитным действием для растений (т.е. биологическим контролем) или технически благоприятными действиями для дополнительного увеличения эффективности сельскохозяйственной композиции.
Чистая культура/продукт ферментации/надосадочная жидкость Pseudomonas azotoformans F30A по настоящему изобретению могут быть непосредственно применены к семенам, клубням или сеянцам сельскохозяйственных культур и/или среде, окружающей семя или растение (например, к почве), предназначенным для обработки, также они могут составлять часть сельскохозяйственной композиции, подходящей для вышеуказанных применений.
Чистая культура/продукт ферментации Pseudomonas azotoformans F30A, его клетки (например, полученные путем удаления культуральной среды центрифугированием и, по желанию, промыванием клеток, например, подходящим буфером) или его бесклеточная надосадочная жидкость может быть, по желанию, смешана и составлена в композицию с любым подходящим, допустимым с точки зрения сельского хозяйства носителем, который не влияет отрицательно на действие изолята и рост сельскохозяйственной культуры, которую планируется обрабатывать. Примерами подходящих носителей являются органические вещества на основе соевого пептона или другие подходящие соединения, смешанные с физиологическими солями, метилцеллюлозой, декстрином, так же как с полезными неорганическими веществами. Специалисту в области техники известны подходящие носители для сельскохозяйственного применения в обработке растений бактериями. Когда Pseudomonas azotoformans F30A применяют в форме суспензии или эмульсии, эта суспензия или эмульсия также может включать одну или несколько коммерчески доступных добавок, таких как поверхностно-активные вещества, смачивающие агенты и т.д. Кроме того, Pseudomonas azotoformans F30A может, предпочтительно, быть применен вместе с другими агентами, улучшающими рост растений (см., например, Lugtenberg and Kamilova, 2009 для подходящих улучшающих рост растений агентов), агентами биологического контроля (см., например, Compant et al., 2005 для подходящих агентов биологического контроля), органическими удобрениями и/или агрохимикатами. Поэтому дополнительный аспект настоящего изобретения направлен на сельскохозяйственную композицию, включающую Pseudomonas azotoformans F30A, дополнительно включающую один или несколько дополнительных микроорганизмов, стимулирующих рост растений, микроорганизмов биологического контроля и/или агрохимикатов.
Агенты биологической борьбы и агрохимикаты могут обладать, например, фунгицидным, бактерицидным, нематоцидным, инсектицидным, гербицидным или реппелентным действием на птиц. Агрохимикаты также могут быть удобрениями для растений или регуляторами растений. Примеры полной совместимости между изолятом по настоящему изобретению и некоторыми выбираемыми агрохимикатами, органическими удобрениями и агентами биологического контроля приведены в примере 18, ниже.
Примеры областей применения изолята по настоящему изобретению, спецификаций применения и определенные эффективные количества приведены ниже. Количество изолята по настоящему изобретению, эффективное для конкретного применения и конкретной сельскохозяйственной культуры, предпочтительно, определяется в каждом конкретном случае.
Для применения к семенам, предпочтительно, бактериальные клетки, продукт ферментации (т.е. бактериальные клетки вместе с примененной для их выращивания средой) или сельскохозяйственную композицию, включающую Pseudomonas azotoformans F30A (включающую, например, приблизительно 107-1010 колониеобразующих единиц мл-1), применяют посредством коммерчески доступного оборудования для обработки семян в подходящих дозах в зависимости от сельскохозяйственной культуры. Подходящие носители, добавки и/или вспомогательные средства (хорошо известные специалисту в области техники) могут быть добавлены в соответствующих концентрациях для улучшения действия, адгезии, устойчивости при хранении и технической эффективности композиции во время и после покрытия семян. Кроме того, клетки Pseudomonas azotoformans F30A могут быть составлены в композицию с носителями или комбинациями носителей традиционными доступными способами для получения твердых препаратов. Такие препараты затем суспендируют в жидких носителях с получением концентраций клеток приблизительно 107-1010 колониеобразующих единиц на мл.
Для применения к почве, торфу или другим средам для выращивания растений или для обработки корней/почвы саженцев/сеянцев могут быть применены полив, распыление или пропитывание рассадных конструкций для распределения Pseudomonas azotoformans F30A на желательные участки. Бактерии также могут быть распределены через полив, распыление или системы снабжения питательными веществами при применении для обработки коммерческих сельскохозяйственных оранжерейных культур. Чистую культуру или продукт ферментации, или разведения любого из них, или сельскохозяйственную композицию, включающую Pseudomonas azotoformans F30A (предпочтительно, приблизительно 106-1010 колониеобразующих единиц мл-1), применяют в дозировках, подходящих для каждой сельскохозяйственной культуры и способа применения. Подходящие носители могут быть добавлены в соответствующих концентрациях, чтобы, например, улучшить адгезию бактерий к корням растений.
Для применения к различным клубням, луковицам и т.д., применимо покрытие распылением обыкновенными машинами (централизованное покрытие во время сортировки) или пропитывание клубней/луковиц и т.д. до посадки или на месте посадки. Чистую культуру или продукт ферментации Pseudomonas azotoformans F30A (предпочтительно, приблизительно 109-1010 колониеобразующих единиц мл-1) применяют в дозировках приблизительно 0,1-10 мл на один клубень. Подходящие носители могут быть добавлены в соответствующих концентрациях, чтобы, например, улучшить адгезию бактерий к клубням.
Pseudomonas azotoformans F30A по настоящему изобретению увеличивает прорастание семян и/или клубней/единиц вегетативного размножения растения, улучшает плотность насаждений сельскохозяйственной культуры, стимулирует рост растения и/или значительно улучшает оранжерейные урожаи и полевые урожаи двудольных и/или однодольных сельскохозяйственных культур. Способность стимулировать рост и улучшать урожай, кроме того, не зависит от типа почвы и климатических условий и типа субстрата, применяемого для культивирования растения. Проведено более 60 полевых испытаний на различных почвах (от песка до глины) в течение четырех лет, представляя различные климатические условия. Кроме того, проведено 10 коммерческих оранжерейных тестов, плюс многочисленные другие оранжерейные эксперименты, с применением почвы для выращивания на основе торфа.
Настоящее изобретение дополнительно включает описание специфичных идентифицирующих характеристик. Результаты идентификации и характеристики изолята по настоящему изобретению описаны в настоящем описании.
Дополнительный аспект настоящего изобретение включает специфичные параметры ферментации, применимые для ряда лабораторных и промышленных субстратов, которые могут быть применены для культивирования стимулирующего рост растения агента по настоящему изобретению.
Настоящее изобретение также относится к способу для увеличения прорастания семян, всхожести растений и/или роста растений, включающему стадию применения бактериальных клеток Pseudomonas azotoformans F30A или продукта ферментации или сельскохозяйственной композиции, включающей Pseudomonas azotoformans F30A, к семени, растению и/или среде, окружающей семя или растение. Pseudomonas azotoformans F30A в таком способе может быть, например, применен к корням растения. Альтернативно, Pseudomonas azotoformans F30A в таком способе может быть применен к почве до и/или после появления корней растения или к среде для выращивания растений, окружающей семена и/или растения. Бактериальные клетки Pseudomonas azotoformans F30A или продукт ферментации или сельскохозяйственная композиция, включающая Pseudomonas azotoformans F30A, могут быть альтернативно применены к единицам вегетативного размножения растения или внесены в среду для выращивания растений, окружающую семена и/или растения. Конечно, может быть применена комбинация любого из вышеуказанных способов применения. Семя или растение, обрабатываемое бактериальными клетками Pseudomonas azotoformans F30A или продуктом ферментации или сельскохозяйственной композицией, включающей Pseudomonas azotoformans F30A, могут быть однодольными растениями или двудольными растениями или семенами, которые развиваются в такие растения.
Дополнительные цели и преимущества настоящего изобретения, несомненно, будут очевидны из следующего подробного описания настоящего изобретения. Однако подробное описание и конкретные примеры приведены только для иллюстрации предпочтительных вариантов осуществления настоящего изобретения, и различные изменения и модификации в рамках настоящего изобретения относительно предмета настоящего изобретение будут очевидны специалистам в области техники.
Экспериментальная секция
Следующие примеры дополнительно иллюстрируют преимущества настоящего изобретения и не должны ограничивать объем настоящего изобретения, как определено формулой изобретения.
Для применения во всех описанных примерах, если не указано иначе, изолят по настоящему изобретению ферментировали либо согласно стандартному (pH 7,0, 20°C), либо оптимизированному (pH 7,25, 25°C) протоколу ферментации с культуральной средой MPS0 (Levenfors et al., 2008) в качестве субстрата для выращивания. Перед ферментацией культуральную среду стерилизовали. Соответствующее количество источника углерода (например, глицерина, фруктозы, сахарозы, глюкозы) добавляли и калибровали кислородный и pH электроды. Затем ферментер инокулировали соответствующим количеством исходной культуры изолята по настоящему изобретению, выращенного в любом соответствующем жидком бактериальном субстрате. Параметры ферментации (подачу кислорода и pH) контролировали в течение всей процедуры ферментации. При необходимости добавляли подходящий противопенный субстрат. Продукт ферментации собирали через 2-3 ч после того, как измеренное потребление кислорода показывало сдвиг во вторичном метаболизме (в целом, через 40-48 ч). Неразбавленный или разбавленный водопроводной водой продукт ферментации, включающий клетки изолята в культуральной среде MPS0, или его бесклеточную надосадочную жидкость, и, предпочтительно, не более чем через 3 месяца хранения, применяли к семенам, клубням картофеля или к корням/почве тестированной сельскохозяйственной или плодовой культуры. Определенные испытания также проводили с неразбавленными или разбавленными бактериальными клетками изолята по настоящему изобретению, полученными центрифугированием продукта его стандартной или оптимизированной ферментации (8000 об/мин, 15 минут), и впоследствии составляли в композицию с соответствующими неорганическими или органическими, совместимыми с сельскохозяйственной точки зрения носителями.
Первые семь примеров описывают испытания в оранжерее/вегетационной камере, включая коммерческие испытания, демонстрирующие улучшение прорастания семян и всхожести растений пшеницы, шпината и масличного рапса, так же как увеличение урожая зеленой массы кочанного салата, увеличение массы плодов перца, увеличение урожая выборочных горшечных трав и увеличение урожая огурца после применения изолята по настоящему изобретению.
Пример 1
Улучшение всхожести растений и роста растений - оранжерейные испытания с яровой пшеницей
Перед посевом семена яровой пшеницы (30 г) обрабатывали продуктом ферментации изолята по настоящему изобретению, ферментированного согласно стандартному протоколу ферментации, его бактериальными клетками, разбавленными водопроводной водой или бесклеточной надосадочной жидкостью, разбавленной водопроводной водой (300 мл/кг семян), с последующим смешиванием семян с продуктом ферментации/бактериальными клетками/надосадочной жидкостью в течение приблизительно 2 мин и высушиванием в течение ночи. При необходимости затем семена хранили в течение периода до 2 недель перед началом испытаний.
Затем для каждой обработки засеивали четыре горшка, в каждый по 50 семян, соответственно, и помещали в вегетативную камеру с температурой 18-20°C (ни одна партия семян не была заражена) или 10-12°C (партия семян, зараженная Fusarium и грибами Microdochium) и световым периодом 14 часов. Во всех испытаниях применяли нестерильную коммерческую торфовую смесь "Enhetsjord" (Gerhardson et al., 1985). Всходы растений подсчитывали через 5-6 дней после размещения горшков при температуре 18-20°C и 12-14 дней при 10-12°C. Через дополнительные 12-18 дней растения срезали на расстоянии приблизительно 0,5 см от поверхности почвы, и сухую массу проростков измеряли после высушивания в течение ночи при 105°C для того, чтобы оценить увеличение массы растения после обработки изолятом по настоящему изобретению.
Фиг.2 и 3 показывают улучшение всхожести растений яровой пшеницы после обработки изолятом по настоящему изобретению в различных концентрациях и эффект его применения на сухую массу пшеницы, тестированные в экспериментах в вегетационных камерах с соответственно незараженными (фиг.2) и зараженными партиями семян (фиг.3) яровой пшеницы. При соответствующих концентрациях всхожесть увеличивалась на 10-15% (незараженная партия семян) и на 12-35% (зараженная партия семян). Сухая масса, оцененная через приблизительно 20 дней после посева, также была значительно увеличена; 13-18% (незараженная партия семян) и 10-36% (зараженная партия семян). Кроме того, фиг.2 показывает увеличение всхожести яровой пшеницы и сухой массы после применения надосадочной жидкости изолята по настоящему изобретению в различных концентрациях. При соответствующих концентрациях всхожесть увеличивалась на 5-10% и сухая масса на 8-15%.
Представленные результаты подтверждают полезность изолята в применении как к незараженным, так и к зараженным партиям семян в качестве самостоятельного стимулирующего рост растений агента. Уникальное свойство изолята F30A сильно увеличивать прорастание семян и всхожесть в результате приводит к способу избавления от заболевания, улучшает зерновой рост и общее состояние растения, выраженное количеством сухого вещества растения, образующегося за период эксперимента (приблизительно 20 дней).
Пример 2
Улучшение всхожести растений - оранжерейные испытания со шпинатом
До посева семена шпината (3-5 г) обрабатывали продуктами ферментации изолята по настоящему изобретению или его бесклеточной надосадочной жидкостью, ферментированной согласно стандартному протоколу (партия номер FOM115) или оптимизированному протоколу (партия номер FOM139), или бактериальными клетками, которые получали из соответствующих продуктов ферментации и затем повторно увлажняли водопроводной водой (300 мл/кг семян). Затем семена смешивали с соответствующими бактериальными обработками в течение приблизительно 2 мин и высушивали в течение ночи. При необходимости затем семена хранили в течение 2 недель перед началом испытаний.
Затем для каждой обработки засеивали четыре горшка, в каждый по 25 семян, соответственно, и помещали в вегетативную камеру с температурой 12-14°C со световым периодом 14 часов. Во всех испытаниях применяли нестерильную коммерческую торфовую смесь "Enhetsjord" (Gerhardson et al., 1985). Всходы растения шпината непрерывно подсчитывали в течение приблизительно 8-10 дней, начиная с 7 дня после посева. Подсчет растений, полученный на 9 день, применяли во всех нижеприведенных результатах.
Фиг.4 показывает увеличение всхожести шпината после обработки изолятом по настоящему изобретению в различных концентрациях и его надосадочной жидкостью (фиг.4A) и после обработки выбранным твердым препаратом изолята (фиг.4B). Обработка семян продуктом ферментации в соответствующих концентрациях приводила к увеличению всхожести до 35%. Применение неразбавленной надосадочной жидкости приводило к увеличению всхожести на 13% по сравнению с необработанным контролем. Применение твердого клеточного препарата было также эффективно для увеличения всхожести; при тестированных концентрациях до 15% больше растений взошло после обработки семян этим препаратом, повторно увлажненным физиологическим раствором соли.
Примеры оранжерейных испытаний ясно показывают значительную способность штамма по настоящему изобретению увеличивать прорастание и всхожесть шпината. Увеличение проявляется в присутствии продукта ферментации изолята, так же как в присутствии клеток, суспендированных в физиологическом растворе соли, или водных или сухих клеточных препаратов, повторно увлажненных физиологическим раствором соли. Обнаруживаемое увеличение всхожести, как показано приведенными примерами, обычно находилось в диапазоне 10-40% и зависит от концентрации продуктов, примененных к семенам шпината.
Пример 3
Улучшение всхожести растений - оранжерейные испытания с масличным рапсом
Перед посевом семена масличного рапса сорта Джоплин (10-20 г) обрабатывали продуктом ферментации изолята по настоящему изобретению, ферментированным согласно модифицированному протоколу, и высушивали в течение ночи. Семена обрабатывали четырьмя дозами (10, 20, 40 и 60 мл на кг семена) продукта ферментации, содержащего, соответственно, 5,0×107, 5,0×108 и 5,0×109 КОЕ на мл изолята по настоящему изобретению.
Затем для каждой обработки засеивали шесть горшков, в каждый по 25 семян, соответственно, и помещали в вегетативную камеру с температурой 12-14°C со световым периодом 14 часов. Во всех испытаниях применяли нестерильную коммерческую торфовую смесь.
Всходы растения масличного рапса непрерывно подсчитывали в течение приблизительно 4-5 дней, начиная с 5 дня после посева. Подсчет растений, полученный на 6 день, применяли для оценки увеличения всхожести. Применение продукта ферментации с 5,0×107 КОЕ на мл (0,5%) давало самое однородное увеличение всхожести масличного рапса независимо от дозы, с увеличением всхожести в среднем 31%. Большую вариацию обнаруживали при применении к семенам доз продукта ферментации 20, 40 и 60 мл на кг, концентраций 5,0×108 КОЕ на мл (5%) и 5,0×109 КОЕ на мл (50%) (таблица 3).
Пример 4
Увеличение урожая кочанного салата - применение к корням, оранжерейные испытания
Лотки помещали в оранжерею/вегетационные камеры (18°C и световой период 14 ч) и приблизительно через 2 недели сеянцы пересаживали в горшки (1 сеянец/горшок) с тем же субстратом на основе торфа. Горшки помещали в оранжерею/вегетационную камеру дополнительно на 4-6 дней, и затем 10-20 мл продукта ферментации изолята по настоящему изобретению, ферментированного согласно стандартному или оптимизированному протоколу ферментации, так же как другие бактериальные растворы, включающие Pseudomonas azotoformans F30A (например, бактериальные клетки, повторно увлажненные соответствующими неорганическими и органическими растворителями), и его надосадочную жидкость применяли вблизи корней. Горшки держали в течение следующих приблизительно 2-3 недель в оранжерее/вегетационной камере. Растения салата затем срезали на расстоянии приблизительно 0,5 см от поверхности почвы и взвешивали, чтобы измерить зеленую массу, образовавшуюся за время испытания.
Применение 10 мл продуктов ферментации или других препаратов изолята по настоящему изобретению (5×109-4×1010 колониеобразующих единиц (КОЕ) на мл) в качестве обработки корней/почвы у сеянцев кочанного салата при пересадке приводило к исключительному увеличению роста салата и, наконец, к образованию большей зеленой массы обработанных растений по сравнению с необработанными контрольными сеянцами.
Фиг.5 показывает примеры из двух отдельных оранжерейных экспериментов с двумя продуктами ферментации изолята по настоящему изобретению и его надосадочной жидкостью (партия FOM173 и партия FOM176), где оба ферментированы согласно оптимизированному протоколу. Обнаруженное увеличение зеленой массы кочанного салата составляло в диапазоне 19-68% (испытание в оранжерее с партией ферментации 173) и 3-32% (испытание в оранжерее с партией ферментации 176). Применение надосадочной жидкости приводило к увеличению зеленой массы, соответственно, на 56% (партия 173) и 36% (партия 176).
Кроме того, продукты ферментации изолята по настоящему изобретению обладают хорошей устойчивостью при хранении; действие продуктов ферментации, со сроком хранения до 14 недель при 4°C, не изменилось в результате хранения продукта. Типовое испытание в оранжерее, демонстрирующее стимуляцию роста кочанного салата, обработанного продуктами ферментации изолята по настоящему изобретению со сроком хранения 2, 6, 14 недель, все из которых были ферментированы согласно оптимизированному протоколу, показано на фиг.6. В этом оранжерейном испытании, независимо от срока хранения продукта ферментации, зеленая масса растений, обработанных изолятом по настоящему изобретению, увеличивалась приблизительно на 40%. Кроме того, количество жизнеспособных клеток в 14-недельном продукте ферментации составляло приблизительно 1×1010 КОЕ на мл по сравнению с 1,3 и 1,5×1010 КОЕ на мл в, соответственно, 6- и 2-недельных продуктах ферментации.
Пример 5
Увеличение урожая перца - применение к корням, испытание в оранжерее
Чтобы обнаружить эффект стимуляции роста после применения к корню/почве саженцев/сеянцев, применяли перец в качестве дополнительной испытательной сельскохозяйственной культуры. Семена перца высевали в горшечные лотки с коммерческим субстратом на основе торфа. Лотки помещали в оранжерею/вегетационные камеры (25°C днем; 20°C ночью и световой период 14 ч), и через приблизительно 3 недели сеянцы пересаживали в горшки (1 сеянец/горшок) с тем же субстратом на основе торфа. Горшки помещали в оранжерею/вегетационную камеру дополнительно на 4-6 дней, и затем 10 мл продукта ферментации изолята по настоящему изобретению, ферментированного согласно стандартному или оптимизированному протоколу ферментации, так же как другие бактериальные растворы, включающие Pseudomonas azotoformans F30A (например, бактериальные клетки, повторно увлажненные соответствующими неорганическими и органическими растворителями), применяли вблизи корней. Горшки хранили в течение следующего периода до 4 месяцев в оранжерее/вегетационной камере. Плоды перца собирали два раза и взвешивали, чтобы оценить общую массу плодов для каждого растения.
Применение 10 мл продуктов ферментации изолята по настоящему изобретению в различных концентрациях от 3,5×107 до 3,5×1010 КОЕ на мл в качестве обработки корня/почвы в гнездах сеянцев перца при их пересадке приводило к большему среднему урожаю плодов перца по сравнению с необработанными контрольными растениями. Фиг.7 показывает увеличение урожая плодов перца после обработки сеянцев перца продуктом ферментации изолята по настоящему изобретению партии FOM076. Увеличение урожая на 6-30% по сравнению с необработанным контролем обнаруживали в зависимости от концентрации изолята по настоящему изобретению при обработке сеянцев перца.
Пример 6
Увеличение урожая мангольда, кориандра, орегана и шнитт-лука - применение к почве, испытание в оранжерее
Следующие горшечные травы: мангольд, кориандр, ореган и шнитт-лук, - высевали в горшки с коммерческим почвенным субстратом и применяли коммерчески доступную посевную систему. Затем поверхность почвы в горшках (25 на каждую горшечную траву) разбрызгивали по 10 мл продукта ферментации изолята по настоящему изобретению (приблизительно 1-3×109 КОЕ на мл) на один литр почвенного субстрата. Горшки помещали в коммерческую оранжерею, применяемую для культивирования горшечных трав, и условия роста были такими, как нормальные условия для культивирования горшечных трав. Зеленую массу растений измеряли приблизительно через один - два месяца в зависимости от горшечной травы.
Зеленая масса горшечных трав, обработанных изолятом по настоящему изобретению, составляла в среднем приблизительно на 7% больше, чем зеленая масса трав, собранных с необработанных горшков (таблица 4). Дополнительно, растения выглядели зеленее и сильнее.
Пример 7
Увеличение урожая огурца - применение к корню/почве, коммерческое испытание в оранжерее
Перед обработкой изолятом по настоящему изобретению огуречную рассаду выращивали в коммерческой оранжерее площадью 4600 м2, в соответствии с требованиями для культивирования огурцов. Затем ферментационную культуру изолята по настоящему изобретению (20 литров; приблизительно 2-3×109 КОЕ на мл) смешивали с 80 литрами воды в поливном контейнере, и растения обрабатывали смесью с применением коммерческой поливной системы. Контролями служили огурцы, выращенные в таком же типе оранжереи; площадь культивирования 5400 м2; обработанные водой. Обе обработки начинали и заканчивали в один и тот же день, все параметры роста и другие необходимые практические меры, такие как удобрение, поддерживали одинаковыми в обеих оранжереях. Урожай огурцов измеряли в кг на квадратный метр оранжереи, и дополнительно считали количество собранных огурцов с квадратного метра. В период сбора урожая собрали 13,75 кг/м2 и 344 огурцов/м2 в оранжерее, обработанной изолятом по настоящему изобретению, по сравнению с 13,03 кг/м2 и 326 огурцов/м2 в оранжерее, обработанной водой. Числа соответствуют увеличению урожая на 5,5% на м2 в оранжерее с применением изолята по настоящему изобретению.
Полевые испытания
Коммерческие полевые и оранжерейные испытания с изолятом по настоящему изобретению имели целью оценку его потенциала увеличивать прорастание семян и всхожесть растений, так же как улучшать растительный покров, рост растения, цветение и/или урожай в естественных условиях. Полевые эксперименты (всего 82 полевых испытаний/коммерческих оранжерейных испытаний), включая некоторые эксперименты большего масштаба (до 1 га), проводили в течение четырех сельскохозяйственных сезонов для широком ряда двудольных культур, важных для сельского хозяйства (см. таблицу 2), с фокусом на оценке свойств стимуляции роста растений с применением различных параметров измерения. Данные средних величин увеличения урожаев сельскохозяйственных культур, для которых обработка изолятом по настоящему изобретению приводила к значительному улучшению урожая, представлены в таблице 2.
Продукты стандартной и оптимизированной ферментации изолята по настоящему изобретению применяли в большом числе полевых испытаний. Три различных способа применения применяли для обработки целевой сельскохозяйственной культуры изолятом F30A. Ими были обработка семян, обработка сменных клубней (картофель) и обработка корня/почвы у саженцев. Способ применения зависел от и был приспособлен к традиционным практикам, применяемым для каждой сельскохозяйственной культуры, и большинство полевых испытаний находилось в южной Швеции, главной области растительного и картофельного производства в Швеции. Кроме того, во всех полевых экспериментах традиционную сельскохозяйственную практику применяли для того, чтобы протестировать полезность применения изолята по настоящему изобретению в комбинации с другими необходимыми мерами, которые необходимо предпринимать, чтобы гарантировать рентабельный сбор урожая. Большинство испытаний проводили, следуя схеме рандомизированных делянок с четырьмя или, в некоторых экспериментах, пятью повторностями. Данные анализировали при помощи дисперсионного анализа (ANOVA) и обобщенной линейной модели (GLM) в SAS/Stat (система статистических анализов). В испытаниях регистрировали всхожесть/приживаемость растений, количество цветков (клубника) и урожай/рыночный урожай.
Обработка семян различных сельскохозяйственных культур изолятом F30A приводила к увеличению урожая между 6 и 19% (таблица 2). Кроме того, урожаи были часто значительно большими или больше, чем получаемые после обработки стандартными химикатами (см. пример 8 шпинат и пример 10 горох). Всхожесть растений явно увеличивалась по сравнению со всхожестью растений на участках с необработанным контролем, и эффект сохранялся в течение всего сельскохозяйственного сезона до сбора урожая. Увеличение урожая до 40% измеряли в некоторых индивидуальных полевых испытаниях. Также обработка корня/почвы изолятом F30A у рассады способом промачивания приводило к резкому и видимому увеличению роста обработанных саженцев, очевидному уже через несколько дней (пример действия на рост салата в оранжерейном испытании показан на фиг.8).
Эти эффекты сохранялись в течение всего сельскохозяйственного сезона, приводили к более раннему сбору урожая и намного более высоким урожаям, чем в контрольных обработках. Увеличения урожаев после обработки корня/почвы изолятом по настоящему изобретению зависели от сельскохозяйственной культуры и составляли в среднем между 17 и 52% (таблица 2). Обработка клубней картофеля приводила к увеличению урожая на 4-9% (таблица 2), с самым большим относительным увеличением урожая вплоть до 25%, зарегистрированным в некоторых индивидуальных полевых испытаниях с ранним картофелем.
Отдельные примеры (примеры 8-18), представленные ниже, дополнительно продемонстрируют полезность применения изолята по настоящему изобретению для улучшения урожая у ряда важных сельскохозяйственных культур. Эффекты применения изолята по настоящему изобретению к другим сельскохозяйственным культурам в настоящее время тестируются или будут впоследствии оценены. Поэтому, представленные примеры не предназначены для ограничения охвата настоящего изобретения, определенного формулой изобретения.
Пример 8
Увеличение всхожести растений и урожая - пример из полевых испытаний со шпинатом
В полевых испытаниях со шпинатом за исключением крупномасштабных испытаний для закладки экспериментов применяли схему рандомизированных делянок с 4-5 повторностями. Семена высевали в ряды, и каждый участок имел площадь, как правило, 15 м2. Урожай оценивали два раза после сбора урожая с репрезентативных участков по 0,25 м2. До начала полевых испытаний партии семян коммерчески примененных сортов шпината обрабатывали продуктом ферментации изолята по настоящему изобретению, ферментированным согласно стандартному или оптимизированному протоколу ферментации, и другими соответствующим обработками, такими как, например, коммерческие фунгициды, также примененные к семенам. Как правило, в полевых испытаниях применяли две дозировки изолята по настоящему изобретению: 300 мл/кг семян или 10 мл/кг семян. Регулирование дозировок проводили после оранжерейных экспериментов на эффект дозы и оно является подходящим для промышленных применений. Перед посевом семена могли храниться согласно стандартам, применяемым в обычной практике. Типовое полевое испытание, представленное здесь, которое демонстрирует увеличение всхожести растений, так же как улучшение урожая, проводили в южной Швеции. Семена шпината обрабатывали дозировкой продукта ферментации изолята по настоящему изобретению (партия FOM233) 10 мл/кг; контролями служили необработанные семена и семена, обработанные стандартной дозой химического фунгицида Apron. Фиг.9 показывает данные по увеличению всхожести растений. Увеличение всхожести было особенно значительным в случаях двух первых подсчетов, когда было обнаружено увеличение всхожести на 33 и 32%, соответственно (фиг.9).
Увеличение всхожести растений визуально улучшало ранний растительный покров, который был явно лучше, чем покрытие, полученное из необработанных семян и семян, обработанных стандартным фунгицидом Apron. Дополнительно, растения после обработки изолятом по настоящему изобретению были сильнее и крупнее, чем таковые, проросшие из необработанных семян или семян, обработанных посредством Apron. Это приводило к значительно более высоким урожаям. Фиг.10 показывает увеличение урожая в представленном примере, в котором урожай увеличился на 24% (ранний сбор урожая) и на 14% (последний сбор урожая), соответственно.
Пример 9
Увеличение всхожести растений и урожая - пример полевых испытаний с рукколой
Полевые испытания с рукколой проводили схожим образом, как и испытания со шпинатом. Закладка эксперимента была скорректирована согласно агрономической практике на испытательных участках. Семена высевали в ряды с промежутком в 6 см, и в качестве стандарта были выбраны участки площадью приблизительно 4 м2. Урожай оценивали два раза после рандомизированного сбора урожая рукколы в рядах, соответствующих каждой обработке; растения с 2 метров (n=2 или n=4) общей длины ряда до 55 метров собирали и взвешивали. Обработку семян проводили схожим образом, как и шпината; в полевых испытаниях, как правило, применяли две дозировки изолята по настоящему изобретению: 300 мл/кг семян или 100 мл/кг семян. Типовое полевое испытание, демонстрирующее увеличение всхожести растений, так же как улучшение урожая рукколы, проводили в южной Швеции. В этом полевом испытании семена рукколы обрабатывали дозировкой продукта ферментации изолята по настоящему изобретению (партия FOM154) 300 мл/кг, ферментированного согласно оптимизированному протоколу; контролем служили необработанные семена. Фиг.11 показывает данные по увеличению всхожести растений рукколы и увеличению урожая после применения изолята по настоящему изобретению. Всхожесть увеличивалась приблизительно на 13%, что приводило к увеличению урожая на 8-18% в зависимости от события сбора урожая (фиг.11).
Пример 10
Увеличение всхожести растений и урожая - пример полевых испытаний с горохом
Те же принципы, что и в полевых испытаниях с обработкой семян других сельскохозяйственных культур, применяли в экспериментах с горохом. Полевые испытания происходили в южной Швеции в коммерческих фермерских хозяйствах, выращивающих горох сорта Vining. Как правило, применяли 50 мл продуктов ферментации на килограмм семян, и наиболее часто применяли участок площадью 15 м2. Урожай оценивали после сбора урожая гороха с участка площадью 10 м2. Урожай повторно пересчитывали при значении тендерометра, равном 100 (T 100), представляющем одинаковую стадию спелости для всего собранного гороха сорта Vining. Типовое полевое испытание, демонстрирующее увеличение всхожести растений и улучшение урожая гороха, проводили в южной Швеции. Семена гороха обрабатывали дозировкой продукта ферментации изолята по настоящему изобретению 50 мл/кг, ферментированного согласно оптимизированному протоколу (партия FOM150; около 9,25×109 КОЕ на мл); контролями служили необработанные семена и семена, обработанные химическим фунгицидом Wakil. Фиг.12 показывает данные по увеличению урожая, который составлял немного больше (3%), чем после применения Wakil, и на 12% больше по сравнению с необработанным контролем. Также всхожесть растений увеличивалась на 4% по сравнению с необработанным контролем.
Пример 11
Увеличение урожая - пример из полевых испытаний с морковью
В экспериментах с морковью применяли такие же принципы, как в полевых испытаниях с обработкой семян других сельскохозяйственных культур. Полевые испытания происходили в южной Швеции в коммерческих фермерских хозяйствах по выращиванию моркови; как правило, применяли 300 или 100 мл продуктов ферментации на килограмм семян, и площадь участка изменялась от 20 до 30 м2 в зависимости от испытания. Урожай измеряли после рандомизированного сбора урожая моркови с 0,5 или 1-метрового ряда (n=3) каждой обработки. Собирали морковь из каждой обработки и каждой повторности, подсчитывали и взвешивали отдельно. Типовое полевое испытание, демонстрирующее улучшение урожая моркови, проводили в южной Швеции. В этих полевых испытаниях семена моркови обрабатывали дозировкой продукта ферментации изолята по настоящему изобретению (партия FOM076, ферментированный согласно стандартному протоколу) 300 мл/кг; контролями служили необработанные семена и семена, обработанные водой. Фиг.13 показывает данные по увеличению урожая (приблизительно на 19% по сравнению с контролем) после применения изолята по настоящему изобретению.
Пример 12
Увеличение урожая - пример из полевых испытаний с обработкой корня/почвы у кочанного салата
В полевых испытаниях с обработкой корня/почвы кочанного салата каждый коммерчески выращенный сеянец обрабатывали 10 мл продукта ферментации изолята по настоящему изобретению, ферментированного согласно стандартному или оптимизированному протоколу. Обработку, как правило, проводили во время пересадки сеянца на поле. До обработки продукт(ы) ферментации, как правило, разбавляли в соотношении 1 часть продукта ферментации (от 5,0×109 до 1,0×1010 КОЕ на мл, в зависимости от партии продукта ферментации) на 1 часть водопроводной воды. По желанию, сеянцы можно также обрабатывать различными препаратами бактериальных клеток изолята по настоящему изобретению, повторно увлажненных соответствующими неорганическими или органическими, совместимыми с точки зрения сельского хозяйства растворами. Перед пересадкой рассадные лотки с сеянцами (150-300 растений на каждую обработку) пропитывали соответствующим объемом продукта ферментации, или тем же объемом воды - для контроля, и затем пересаживали в поле. При необходимости сеянцы можно также обрабатывать за несколько дней до пересадки и хранить согласно коммерческой сельскохозяйственной практике. Стандарты, примененные для культивирования кочанного салата в поле (пространство 30 см между рядами и пространство 27 см между растениями), сохраняли во время пересадки. Салат собирали согласно общей сельскохозяйственной практике, и увеличение урожая измеряли в граммах увеличения массы на каждый кочан.
Фиг.14 показывает данные из полевого эксперимента, выполненного в южной Швеции. В этом испытании урожай кочанного салата (г на один кочан салата) увеличивался в среднем на 41% по сравнению со средним урожаем, получаемым от обработанных водой растений.
Пример 13
Увеличение цветения и урожая - пример из полевых испытаний с обработкой корня/почвы клубники
В полевых испытаниях с обработкой корня/почвы клубники каждый коммерчески выращенный сеянец обрабатывали 10 мл продукта ферментации изолята по настоящему изобретению (партия FOM095, ферментированный согласно стандартному протоколу, приблизительно 1,2×1010 КОЕ на мл) при пересадке сеянцев на поле в течение лета. За этим следовала вторая обработка, выполненная в виде полива растений в течение следующей весны с 20 мл продукта ферментации (партия FOM147, ферментированная согласно оптимизированному протоколу, около 3,1×109 КОЕ на мл). При необходимости доведение до подходящей концентрации продуктов ферментации осуществляли путем разведения водопроводной водой. При обеих обработках такой же объем воды применяли в качестве контроля. В испытании применяли коммерческие сеянцы, которые высаживали согласно стандартам, примененным для культивирования клубники в поле (пространство 90 см между рядами и пространство 30 см между растениями). Измерения количества появившихся цветков проводили в 7 отдельных случаях, и созревшую клубнику собирали для измерения урожая в 6 отдельных случаях. Фигуры 15 и 16 показывают улучшение образования цветков и улучшение урожая ягод, зарегистрированных во время второго сельскохозяйственного сезона. Как улучшение цветения, так и улучшение урожая очевидны во время всех случаев наблюдения за исключением первого сбора урожая ягод, и значительны в течение всего сезона цветения и сбора урожая. В зависимости от момента наблюдения цветение улучшалось от 20% (наблюдение 30 мая) до 142% (наблюдение 12 мая), показанные на фиг.15.
Улучшение цветения также приводило к значительному увеличению урожая ягод. Суммарный урожай за весь сезон сбора урожая был в целом выше на 43% по сравнению с урожаем ягод, полученных из обработанных водой контрольных растений (фиг.16).
Пример 14
Улучшение созревания брокколи и ее раннего урожая - пример из полевых испытаний обработкой корня/почвы у брокколи
В полевых испытаниях обработки корня/почвы у брокколи коммерчески выращенные саженцы обрабатывали 10 мл на саженец продукта ферментации изолята по настоящему изобретению, ферментированного согласно стандартному или оптимизированному протоколу. Обработку, как правило, проводили во время пересадки саженцев на поле. До обработки продукт(ы) ферментации разбавляли водопроводной водой, чтобы привести концентрацию клеток к приблизительно 2,5-7,5×109 КОЕ на мл. До пересадки лотки с рассадой пропитывали соответствующим объемом продукта ферментации, или тем же объемом воды в качестве контроля, и затем пересаживали в поле. При необходимости рассаду можно также обрабатывать за несколько дней до пересадки и хранить согласно коммерческой сельскохозяйственной практике. Стандарты, примененные для культивирования брокколи в поле (пространство 30 см между рядами и пространство 30 см между растениями или пространство 50 см между рядами и пространство 50 см между растениями), сохраняли при пересадке. Брокколи собирали несколько раз согласно общей сельскохозяйственной практике. Увеличение урожая сначала регистрировали в граммах на участок; как правило, применяли участки площадью 20 м2, и затем пересчитывали в соответствующий урожай в килограммах на гектар. Фиг.17 показывает данные по суммарному урожаю брокколи, собранной в пяти отдельных случаях в течение полевого эксперимента, проведенного в южной Швеции; с продуктом ферментации партии FOM076 (ферментированный согласно стандартному протоколу, около 6,5×109 КОЕ на мл). Эффект применения изолята по настоящему изобретению был потрясающим особенно во время начала периода сбора урожая. Количество спелых и готовых к сбору брокколи увеличилось более чем на 200% во время первого сбора урожая и более чем на 20% во время второго и третьего сборов урожая по сравнению с урожаем, полученным из обработанных водой контрольных саженцев (фиг.17). Несмотря на то, что увеличение сбора урожая не было таким сильным в конце сезона сбора урожая, экономически ускоренное раннее созревание имеет исключительное значение для потенциальных пользователей/фермеров, поскольку в среднем с растений, обработанных изолятом по настоящему изобретению, можно было собирать урожай на 5 дней раньше по сравнению с растениями, которые были обработаны водой.
Пример 15
Увеличение урожая и улучшение качества капусты - пример из полевых испытаний с обработкой корня/почвы у капусты
В полевых испытаниях с обработкой корня/почвы у капусты коммерчески выращенные саженцы обрабатывали между 5 и 10 мл на саженец продукта ферментации изолята по настоящему изобретению, ферментированного согласно стандартному или оптимизированному протоколу, и обработку обычно проводили во время пересадки саженца на поле. Перед обработкой продукт(ы) ферментации разбавляли водопроводной водой, чтобы привести концентрацию клеток к приблизительно 5,0-7,0×109 КОЕ на мл. Перед пересадкой лотки с рассадой пропитывали соответствующим объемом продукта ферментации, или тем же объемом воды в качестве контроля, и затем пересаживали в поле. При необходимости саженцы можно обрабатывать за несколько дней до пересадки и хранить согласно коммерческой сельскохозяйственной практике. Стандарты, примененные для культивирования капусты в поле (пространство 50 см между рядами и пространство 50 см между растениями), сохраняли при пересадке. Капусту собирали согласно общей сельскохозяйственной практике, и оценивали массу каждого кочана капусты. Фиг.18 показывает данные по улучшению урожая ранней летней капусты (крупномасштабное испытание; 50 саженцев капусты на обработку, 5 делянок) после обработки продуктом ферментации партии FOM154 (5 мл, ферментированным согласно оптимизированному протоколу, около 6,5×109 КОЕ на мл). В этом испытании масса кочанов капусты увеличивалась на 53% (фиг.18) после применения изолята по настоящему изобретению.
Кроме того, также регистрировали увеличение урожая, значительное увеличение рыночной фракции капусты (одобренной для продажи) (фиг.18; +38% по сравнению с обработанными водой саженцами). Это имеет значительное экономичное значение для потенциальных пользователей/фермеров.
Пример 16
Увеличение урожая и улучшение качества клубней - пример из полевых испытаний с обработкой клубней картофеля
Полевые эксперименты с картофелем за исключением одного крупномасштабного испытания были заложены по рандомизированной схеме расположения делянок с 5 повторностями. Каждая повторность каждой обработки включала 60 семенных клубней, которые были посеяны в два или три ряда. Интервалы для рядов и семян соблюдались согласно традиционной практике в картофелеводстве. Картофельные испытания происходили в Skane и в Uppland/Dalarna (средняя часть Швеции). Испытания проводили как на ранних, так и на поздних сортах картофеля. Все полевые испытания с ранним картофелем были покрыты после посадки до тех пор, пока растения полностью не развились, согласно нормальной практике культивирования. В один из первых полевых экспериментов с ранним картофелем была включена одна обработка без покрытия. Клубни картофеля обрабатывали напрямую при посадке или до десяти дней заранее. В целом, продукт ферментации, ферментированный согласно стандартному или оптимизированному протоколу, разбавляли до 50% с применением обыкновенной водопроводной воды для обработки клубней, но также оценивали действие 10% продукта ферментации. Клубни погружали в соответствующие бактериальные препараты на 20-30 минут и затем их высаживали при помощи коммерческой картофелепосадочной машины. В случае проведения обработки за несколько дней до посадки, инокулированные клубни сушили на воздухе, прежде чем помещать в картофелехранилище. Путем погружения каждая картофелина получала приблизительно от 0,75 до 1 мл суспензии бактерий. Кроме того, другой способ применения бактерий проводили с применением стандартного разбрызгивающего устройства, которое коммерчески применяют для химической обработки клубней картофеля. С применением этого устройства на клубни распылялась суспензия бактерий в дозировке 4 литра на тонну, обозначая, что каждый клубень получал приблизительно 0,2 мл суспензии. Эффективность этого способа инокуляции также оценивали путем обрызгивания клубней в различные моменты времени, от одного до трех месяцев перед посадкой. Чтобы улучшить прикрепление и увеличить защиту бактерий на семенных клубнях картофеля, разработали влажную композицию, включающую комбинацию совместимого с точки зрения сельского хозяйства клейкого вещества и поверхностно-активного вещества, где оба обладают хорошими экологическими характеристиками. Эту композицию применяли в полевых экспериментах, как при обработке погружением, так и разбрызгиванием. Всхожесть/приживаемость растений, время цветения, возможные признаки заболевания и урожай/рыночный урожай регистрировали и измеряли во всех полевых испытаниях.
Действие изолята по настоящему изобретению в сорте раннего картофеля 'Rocket' показано на фиг.19. Бактериологическая обработка значительно улучшала развитие появившихся растений и увеличивала общий урожай, со средним увеличением урожая 24%.
Применение влажной композиции изолята по настоящему изобретению в ранних и поздних сортах картофеля улучшало итоговый урожай клубней на 17% (ранний картофель) и на 4% (поздний картофель) по сравнению с соответствующим увеличением урожая на 8% и 3% после применения не составленного в композицию продукта ферментации (фиг.20).
Пример 17
Увеличение роста корней и деревьев в питомниках для растений
Для того чтобы протестировать эффект применения изолята по настоящему изобретению на улучшение роста саженцев деревьев в питомниках для растений, продукт ферментации изолята по настоящему изобретению, культивированного согласно оптимизированному протоколу ферментации, применяли для обработки недавно появившихся сеянцев сосны обыкновенной. Семена высевали и обрабатывали согласно коммерческой практике и способам, применяемым в питомниках для растения. Каждый сеянец поливали водой с содержанием 5 мл продукта ферментации (2-3,5×109 КОЕ на мл) через 9 дней после посева; контролями служили сеянцы, обработанные тем же количеством воды. Рост сеянцев визуально проверяли через 3, 6 и 10 недель после обработки. Через тринадцать недель после обработки измеряли сухую массу корней и отростков после сбора репрезентативных образцов сеянцев. Результаты, суммированные в таблице 5, показывают, что применение изолята по настоящему изобретению приводит к образованию большей сухой массы корней и отростков сеянцев сосны обыкновенной, что также проиллюстрировано на фиг.21. Сухая масса корней составляет до 14%, и сухая масса надземной части растения до 31% больше по сравнению с контролем, обработанным водой. Общая масса сеянцев, обработанных изолятом по настоящему изобретению, таким образом, вплоть до 25% больше, чем масса контрольных сеянцев, обработанных водой. Pseudomonas azotoformans, штамм F30A, по настоящему изобретению, поэтому, может также быть применен для улучшения роста деревьев и/или сеянцев деревьев.
Пример 18
Совместимость с сельскохозяйственными продуктами. Примеры из роста изолята по настоящему изобретению вместе с активными ингредиентами из биологических, органических и химических сельскохозяйственных продуктов
Во всех приведенных выше примерах изолят по настоящему изобретению не проявил какого-либо признака ослабленного роста и, следовательно, был полностью совместим со всеми коммерчески доступными активными ингредиентами в концентрациях, рекомендуемых для обработки семян.
Ссылки:
1. Benizri, E., Baudoin, E. Guckert, A., 2001: Root Colonization by Inoculated Plant Growth-Promoting Rhizobacteria. Biocontrol Science and Technology 11: 557-574 Brisbane, P.G., Harris, J.R., and Moen, R. 1989: Inhibition of fungi from wheat roots by Pseudomonas fluorescens 2-79. Soil Biol. Biochem. 21: 1019-1026.
2. Compant, S., Duffy, B, Nowak, J., Clement, C. and d Ait Barka, E., 2005: Use of Plant Growth-Promoting Bacteria for Biocontrol of Plant Diseases: Principles, Mechanisms of Action, and Future Prospects. Appl. and Environ. Microbiol., Sept. 2005, p. 4951-4959 Vol. 71, No. 9.
3. Dabboussi, F., Hamze, M., Elomari, M., Verhille, S., Baida, N., Izard, D. and Leclerc, H., 1999: Pseudomonas libanensis sp. nov., a new species isolated from Lebanese spring waters. Int J Syst Bacteriol. 49: 1091 -1101.
4. Davies, K.G., and Whitbread, R., 1989: Factors affecting the colonisation of a root system by fluorescent Pseudomonads: The effects of water, temperature and soil microflora. Plant and Soil 116: 247-256.
5. Deshwal, V.K., Kumar, T., Dubey, R.C. and Maheshwari, D.K., 2006: Long-term effect of Pseudomonas aeruginosa GRC1 on yield of subsequent crops of paddy after mustard seed bacterization. Current Science 91: 423-424.
6. DeFreitas, R.J. and Germida, J.J., 1991: Pseudomonas cepacia and Pseudomonas putida as winter wheat inoculants for biocontrol of Rhizoctonia solani. Canadian journal of microbiology 37: 780-784.
7. Dowling, D.N. and Gara F.O'., 1994: Metabolites of Pseudomonas involved in the biocontrol of plant disease. Trends Biotechnol. 12: 133-141.
8. Garcia de Salamone, I.E., Hynes, R.K. and Nelson, L.M., 2001: Cytokinin production by plant growth promoting rhizobacteria and selected mutants. Can. J. Microbiol. 47: 404-411.
9. Gerhardson, B., Alstrom, S. and Ramert, B., 1985: Plant reactions to inoculation of roots with fungi and bacteria. Phytopathol. Z. 114: 108-117.
10. Hemming, BC. 1990: Bacteria as antagonists in biological control of plant pathogens. In: Baker RR, Dunn PE, eds. New directions in biological control: Alternatives for suppressing agricultural pests and diseases. New York: Alan R. Liss. 223-242.
11. Hokeberg, M., Gerhardson, B. and Johnsson, L., 1997: Biological control of cereal seed-borne diseases by seed bacterization with greenhouse selected bacteria. European Journal of Plant Pathology 103, 25-33.
12. Howie, W.J. and Echandi, E., 1983: Rhizobacteria: Influence of cultivar and soil type on plant growth and yield of potato. Science 4:8 6.
13. Kloepper, J.W., Leong, J., Teintze, M., and Schroth, M.N., 1980a: Enhanced plant growth by siderophores produced by plant growth promoting rhizobacteria. Nature 286:885-886.
14. Kloepper, J.W., Scrhoth, M.N., Miller, T.D., 1980b: Effects of rhizosphere colonization by plant growth-promoting rhizobacteria on potato plant development and yield. Phytopathology 70: 1078-1082.
15. Kloepper, J.W. and Schroth, M.N., 1978: Plant growth promoting rhizobacteria on radishes. Proc. 4th Int. Conference on Plant Pathogenic bacteria. Angrs 879-882.
16. Kropp, B.R., Thomas, E., Pounder, J.I., Anderson A.J., 1996: Increased emergence of spring wheat after inoculation with Pseudomonas chlororaphis isolate 2E3 under field and laboratory conditions. Biology and fertility of soils. 23: 200-206.
17. Levenfors, J.P., Eberhard, T.H., Levenfors, J.J., Gerhardson, B. and Hokeberg, M., 2008: Biological control of snow mould (Microdochium nivale) in winter cereals by Pseudomonas brassicacearum, MA250. BioControl 53: 651-665.
18. Micsinai, A., Borsodi, A.K., Csengeri, V., Horvath, A., Oravecz, O., Nikolausz, M., Reskone, M.N. and Marialigeti, K., 2003: Rhizome-associated bacterial communities of healthy and declining reed stands in Lake Velencei, Hungary. Hydrobiologia 506: 707-713.
19. Maeng, J. and Khudairi, A.K., 1973: Studies on the flowering mechanism in Lemna. I. Amino acids changes during flower induction. Physiol. Plant 28: 264-270.
20. Loper, J.E. and Buyer, J.S., 1991: Siderophores in microbial interactions on plant surfaces. Molecular Plant-Microbe Interactions 4: 5-13.
21. Lucy, M., Reed, E. and Glick, B.R., 2004: Applications of free living plant growth-promoting rhizobacteria. Antonie van Leeuwenhoek 86: 1-25.
22. Lugtenberg, B and Kamilova, F., 2009: Plant-Growth-Promoting Rhizobacteria. Annual Review of Microbiology Vol. 63: 541-556.
22. Patten, C. and Glick, B.R., 1996: Bacterial biosynthesis of indole-3-acetic acid. Can. J. Microbiol. 42: 207-220.
23. Piao, Z., Cui, Z., Yin, B., Hu, J., Zhou, C., Xie, G., Su, B. and Yin, S., 2005: Changes in acetylene reduction activities and effects of inoculated rhizosphere nitrogen-fixing bacteria on rice. Biology and Fertility of Soils 41: 371-378.
24. Stanier, R.Y., Palleroni, N.J. and Doudoroff, M., 1966: The aerobic pseudomonads: a taxonomic study. Journal of General Microbiology 43: 159-271.
25. Suslow, T.V. and Schroth, M.N., 1982: Rhizobacteria of sugar beets: Effects of seed application and root colonization on yield. Phytopathology 72: 199-206.
26. O'Sullivan, D.J. and O'Gara F., 1992: Traits of fluorescent Pseudomonas spp. involved in suppression of plant root pathogens. Microbiol Mol Biol Rev. 56: 662-676.
27. Urashima, Y., Suga, Y. and Hori, K., 2006: Growth Promotion of Spinach by Fluorescent Pseudomonas Strains under Application of Organic Materials. Soil Science & Plant Nutrition 51: 841-847.
28. Vivekananthan, R., Ravia, M., Saravanakumara, D., Kumarb, N., Prakasama V. and Samiyappana, R., 2004: Microbially induced defense related proteins against postharvest anthracnose infection in mango. Crop Protection 23: 11, 1061-1067.
29. Weller, D.M., 1988: Biological Control of Soilborne Plant Pathogens in the Rhizosphere with Bacteria. Annual Review of Phytopathology 26: 379-407.
30. Kloepper, J.W., Scher, W. and Murphy, F., 1986: Emergence-promoting rhizobacteria PCT/US1986/001375, WO/1987/000194.
31. Kloepper, J.W. and Scher, F., 1996: Plant growth-promoting rhizobacteria for agronomic, nonroot crops US1996/5503651.
32. Kloepper, J.W., Simonson, C. and Lifshitz, R., 1996: Bacterial cultures for root-colonizing plants. US1996/5503652.
33. Nautiyal, C.S., 2002: Biologically pure culture of bacteria, which suppresses diseases caused by pathogens in chickpea crops and a culture of bacteria comprising a strain of Pseudomonas fluorescens. US2002/6495362.
34. Raaijmakers, J.M., Weller, D.M., Tomashow, L.S. and Cook, R.J., 2002: Biocontrol agents for take-all. US2002/6447770.
35. Tuzun, S., Kloepper, J.W., Rodrigues-Kabana, R., and Kenney, D.S. Biological compositions and methods for enhancing plant growth and health and producing disease-suppressive plants 2000: PCT/US2000/005147, WO0051435.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм Phialocephala fortinii шт. F-833МКС661Ч1Н - продуцент комплекса биологически активных веществ, обладающих рострегуляторными свойствами | 2023 |
|
RU2803623C1 |
| Консорциум микроорганизмов для стимуляции роста растений и защиты от фитопатогенных грибов и способ повышения продуктивности растений | 2023 |
|
RU2822893C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКОГО ПРЕПАРАТА ДЛЯ СТИМУЛЯЦИИ РОСТА РАСТЕНИЙ НА ФРУКТОЗНОЙ СРЕДЕ | 2021 |
|
RU2776301C1 |
| Биологический агент для стимуляции ростовых процессов в растениях | 2018 |
|
RU2678755C1 |
| ПРИМЕНЕНИЕ ЛИПОХИТООЛИГОСАХАРИДОВ И/ИЛИ ХИТООЛИГОСАХАРИДОВ В КОМБИНАЦИИ С МИКРООРГАНИЗМАМИ, ПРИДАЮЩИМИ РАСТВОРИМОСТЬ ФОСФАТАМ, ДЛЯ УСИЛЕНИЯ РОСТА РАСТЕНИЙ | 2012 |
|
RU2621554C2 |
| ПРОТИВОГРИБКОВОЕ СРЕДСТВО, ПРОТИВОГРИБКОВАЯ СЕЛЬСКОХОЗЯЙСТВЕННАЯ КОМПОЗИЦИЯ, СПОСОБ ПОДАВЛЕНИЯ ГРИБКОВОГО ПОРАЖЕНИЯ РАСТЕНИЙ | 1992 |
|
RU2104645C1 |
| БАКТЕРИАЛЬНОЕ УДОБРЕНИЕ | 2019 |
|
RU2735429C1 |
| МИКРОБНЫЙ СПОСОБ И КОМПОЗИЦИЯ ДЛЯ СЕЛЬСКОХОЗЯЙСТВЕННОГО ПРИМЕНЕНИЯ | 2011 |
|
RU2583294C2 |
| ПРИМЕНЕНИЕ ЛИПОХИТООЛИГОСАХАРИДОВ И/ИЛИ ХИТООЛИГОСАХАРИДОВ В КОМБИНАЦИИ С МИКРООРГАНИЗМАМИ, ПРИДАЮЩИМИ РАСТВОРИМОСТЬ ФОСФАТАМ, ДЛЯ УСИЛЕНИЯ РОСТА РАСТЕНИЙ | 2012 |
|
RU2658362C1 |
| МИКРООРГАНИЗМЫ - СТИМУЛЯТОРЫ РОСТА РАСТЕНИЙ И ИХ ИСПОЛЬЗОВАНИЕ | 2012 |
|
RU2664863C2 |
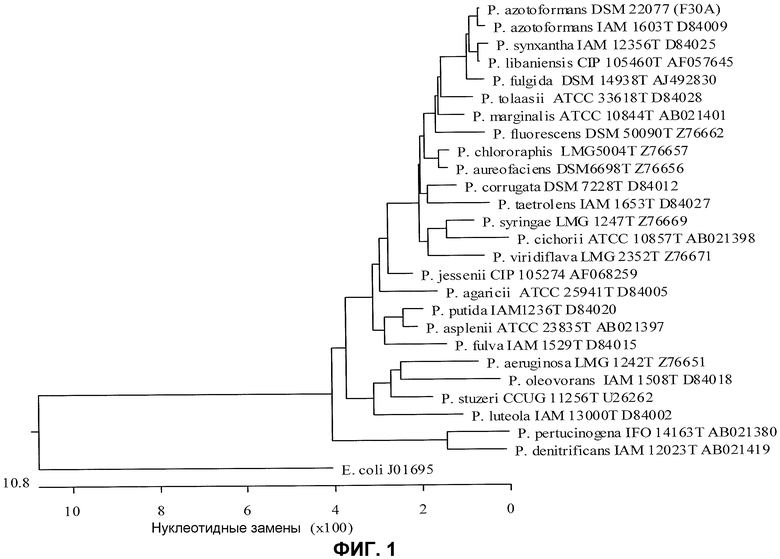
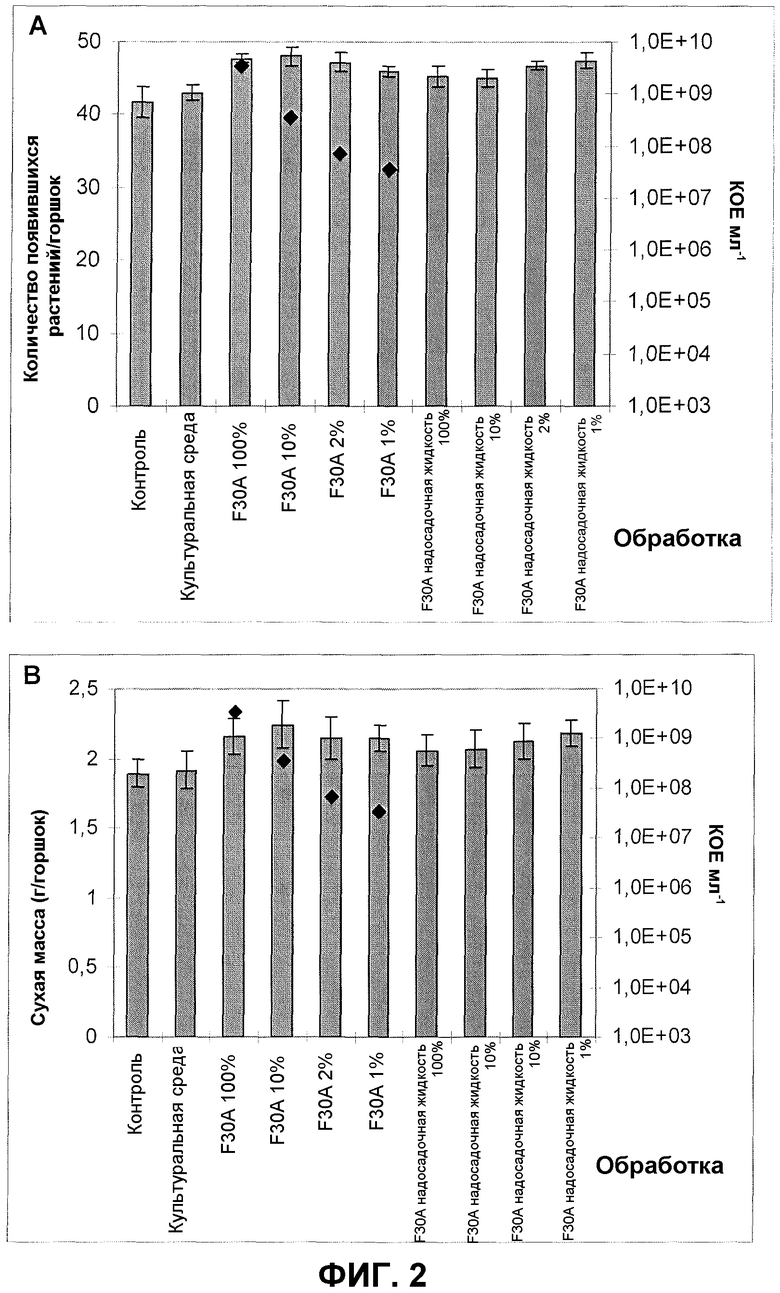
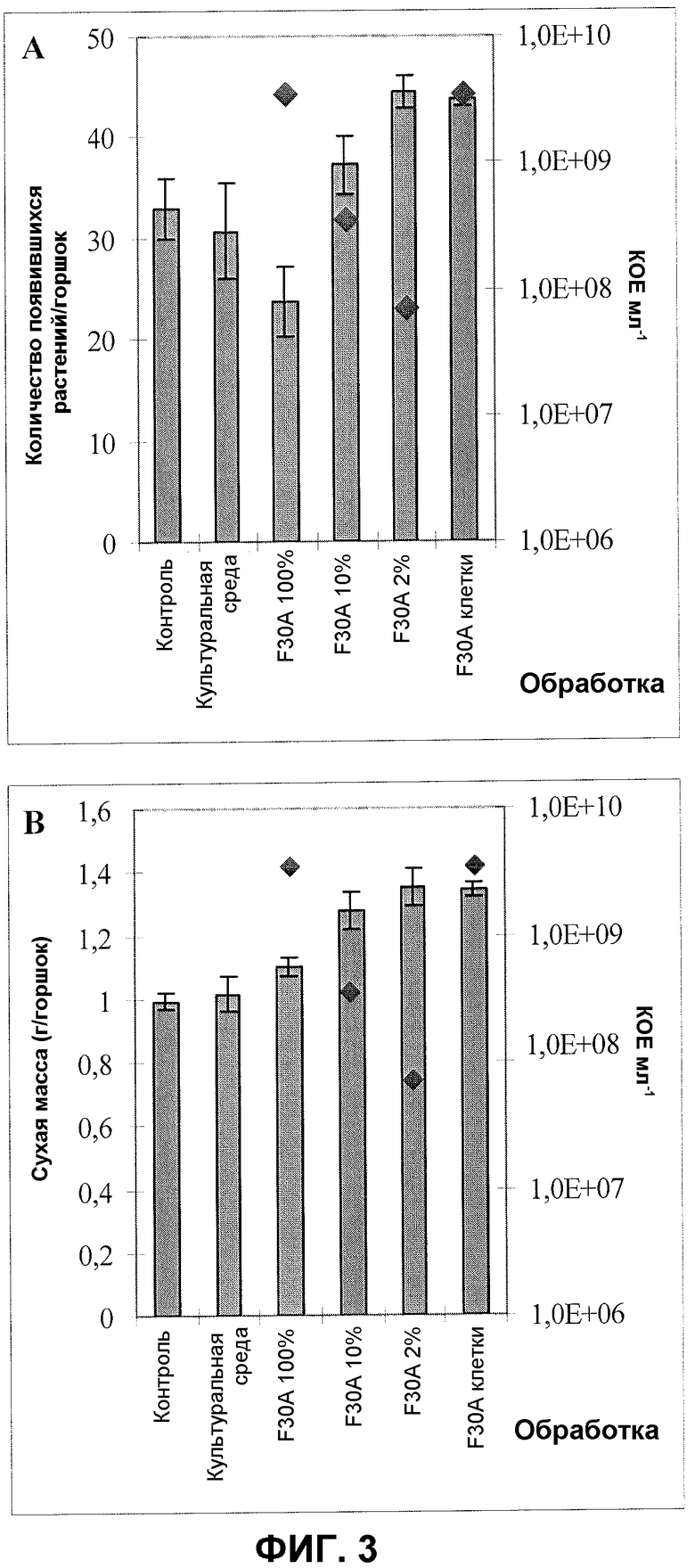
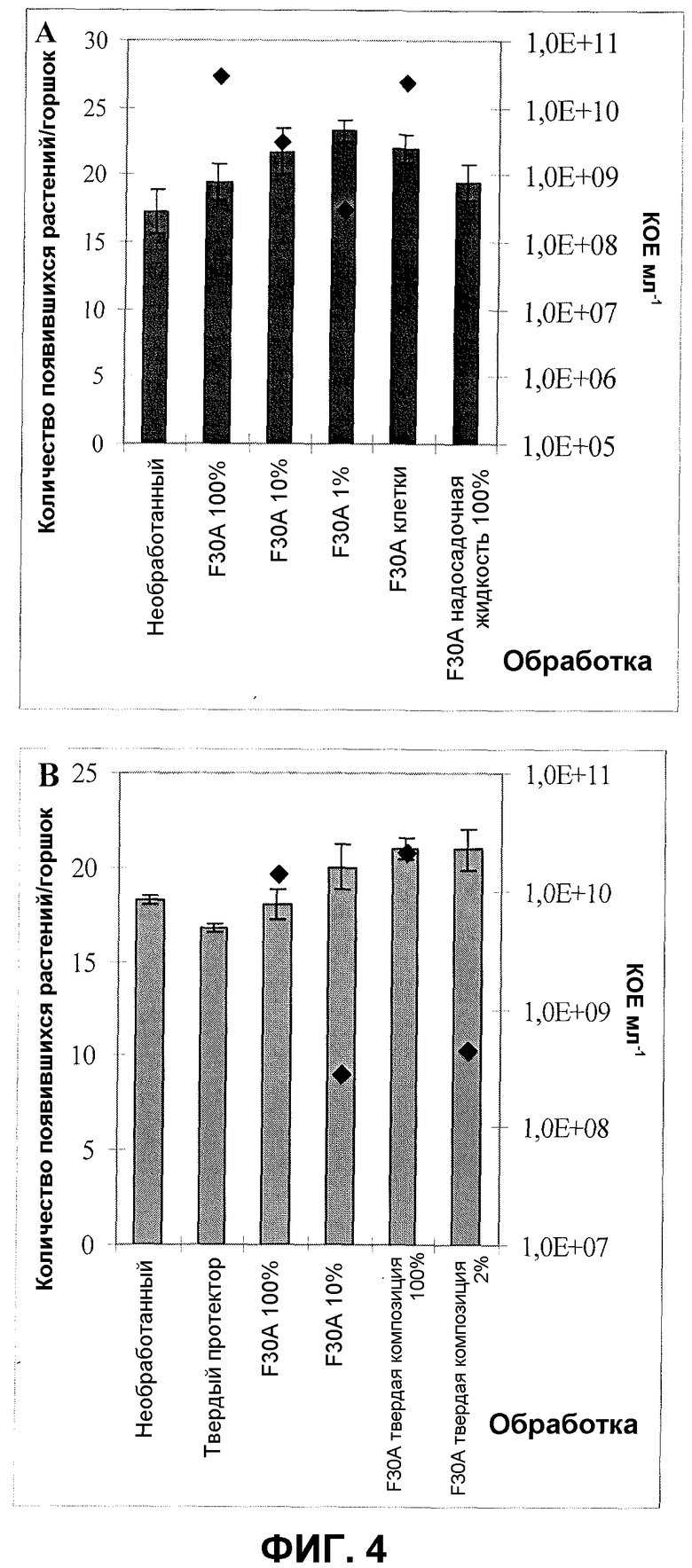
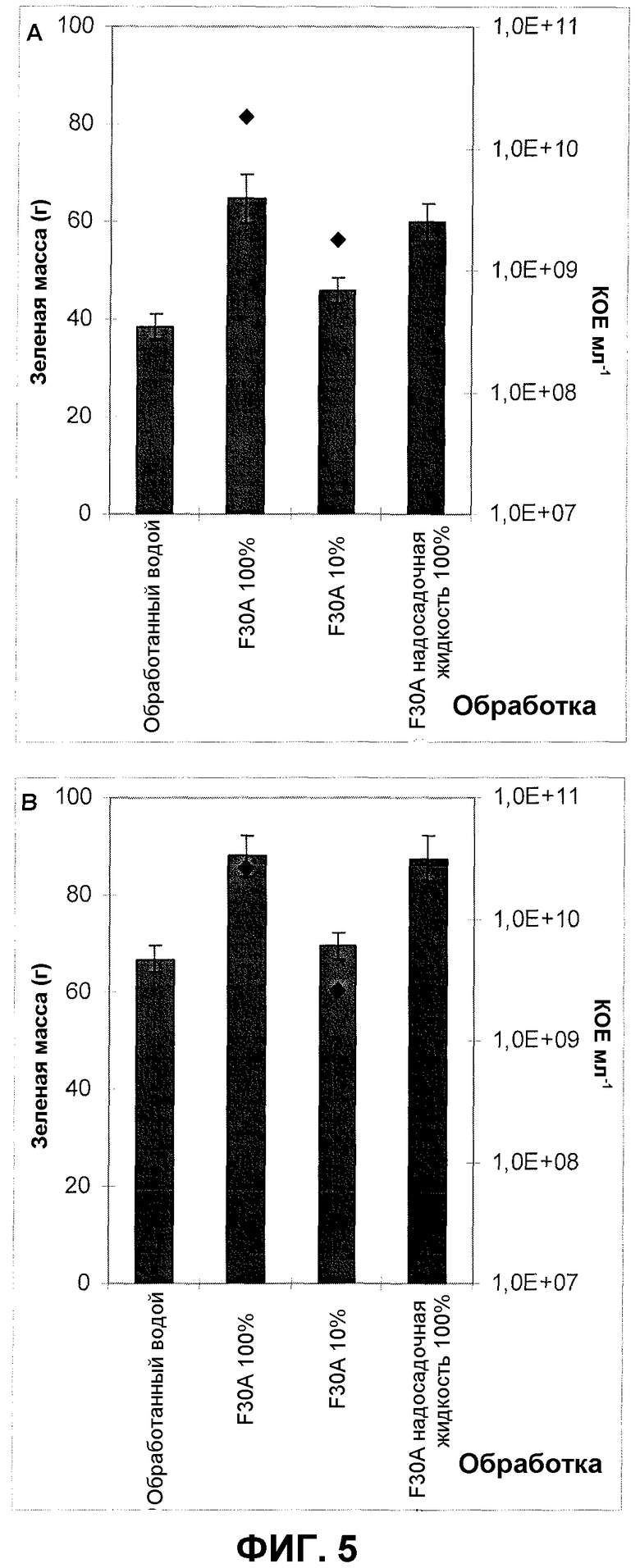
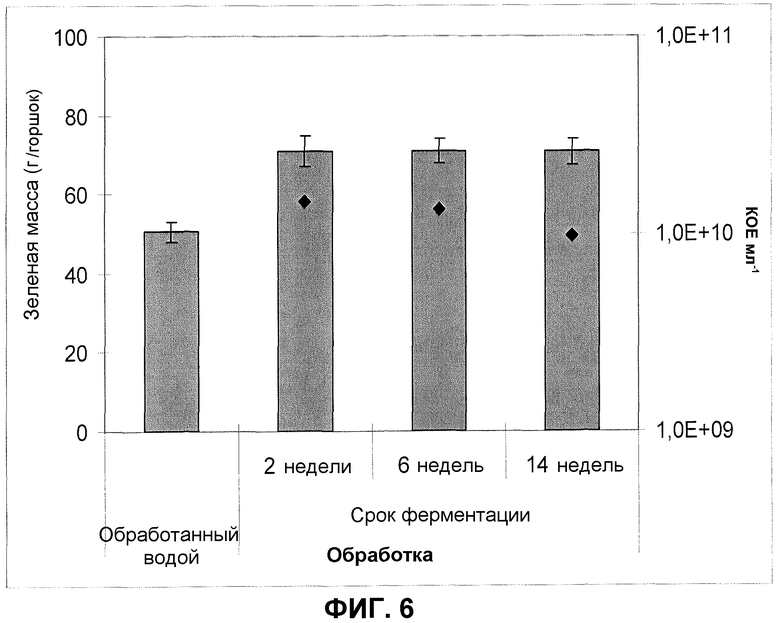
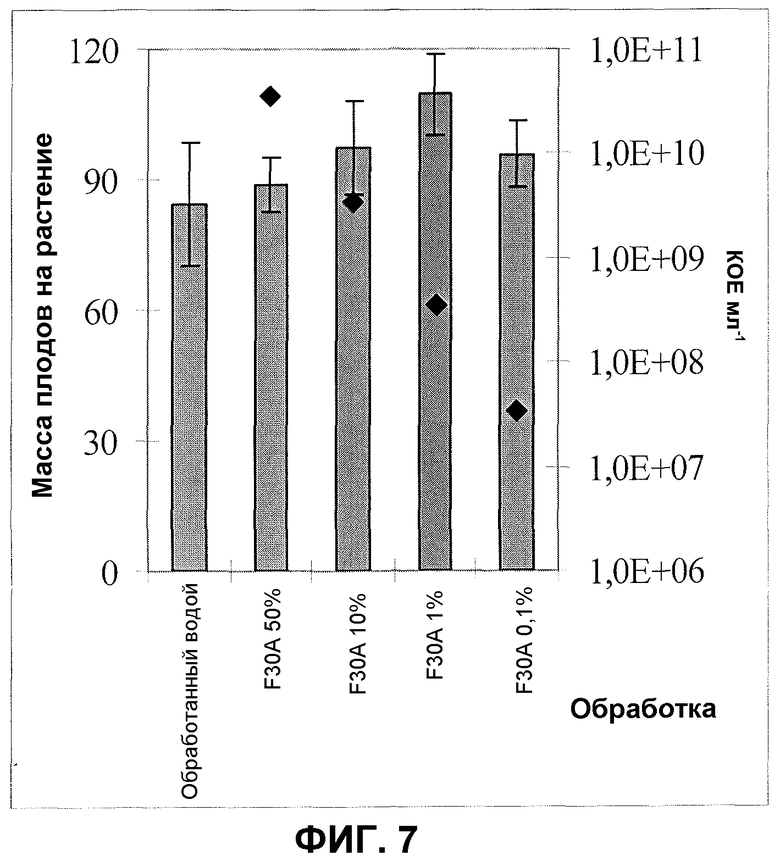

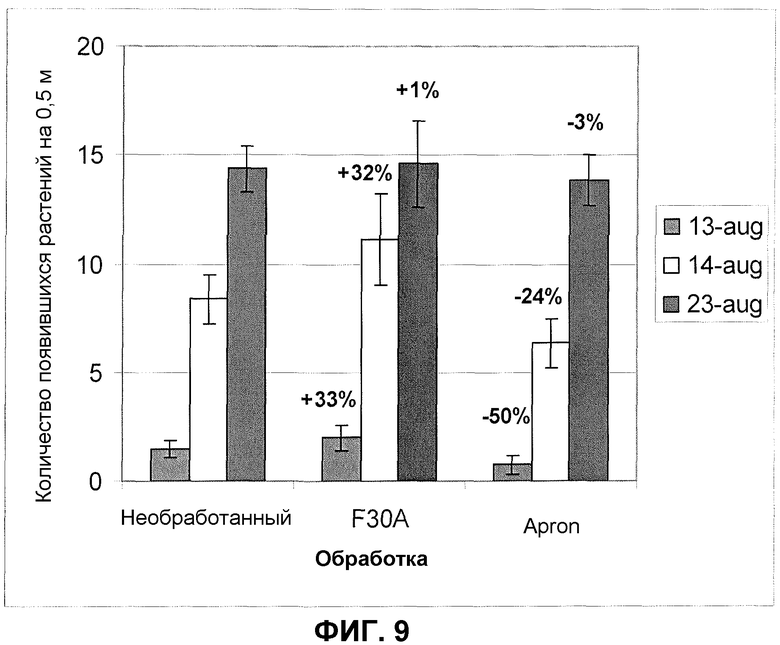
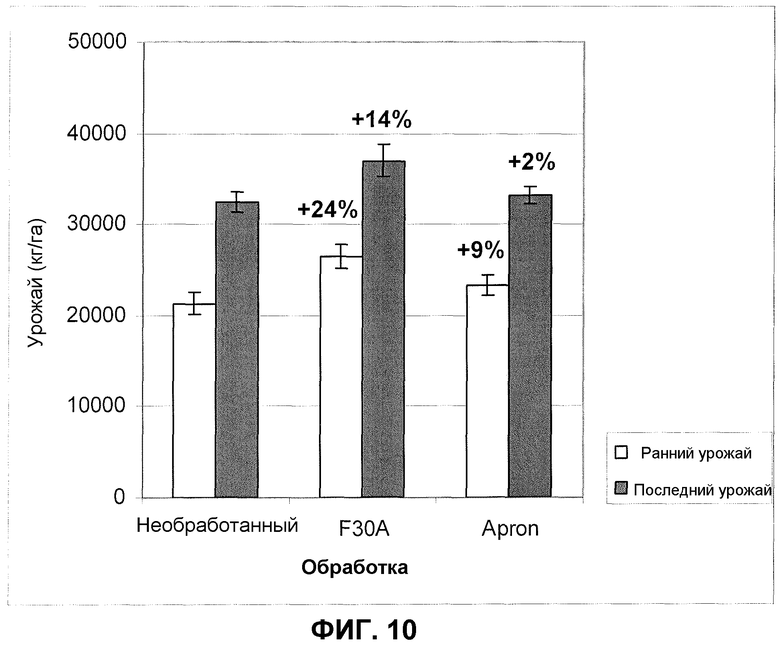
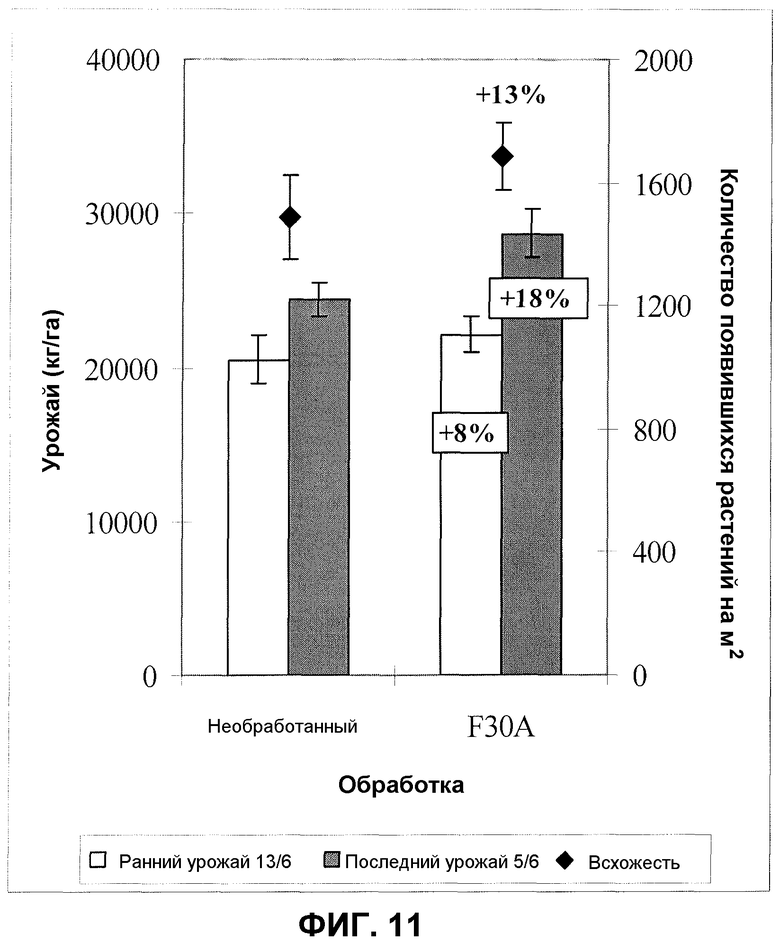
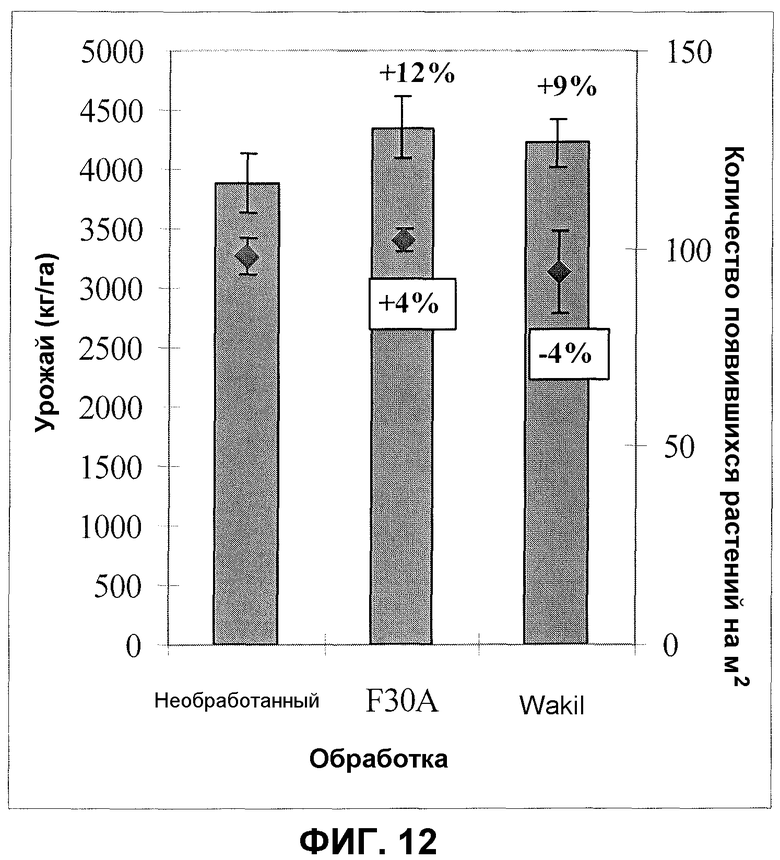
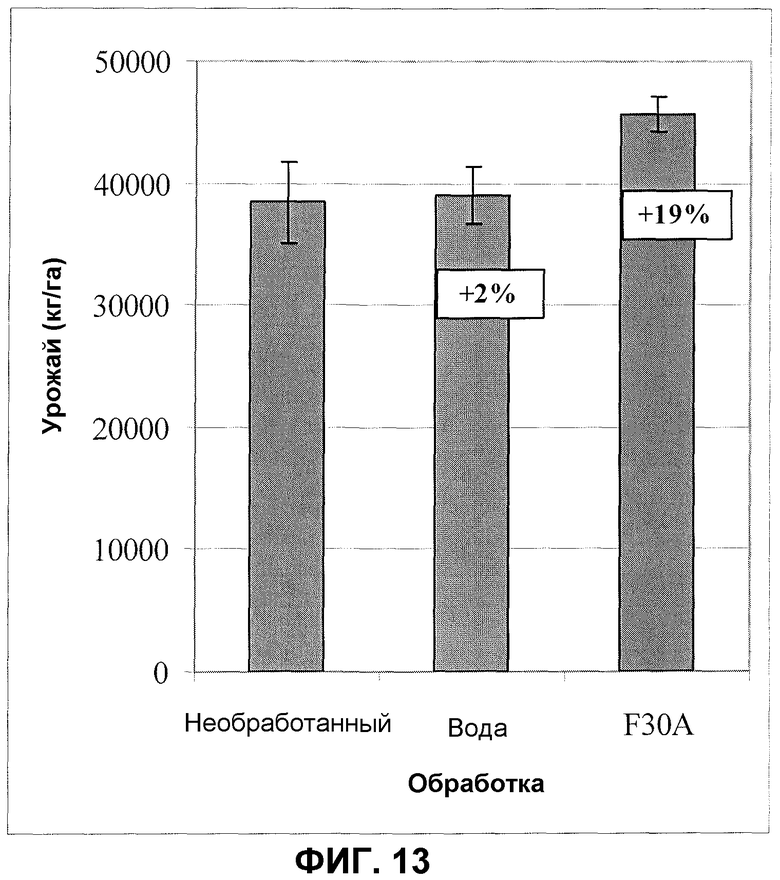
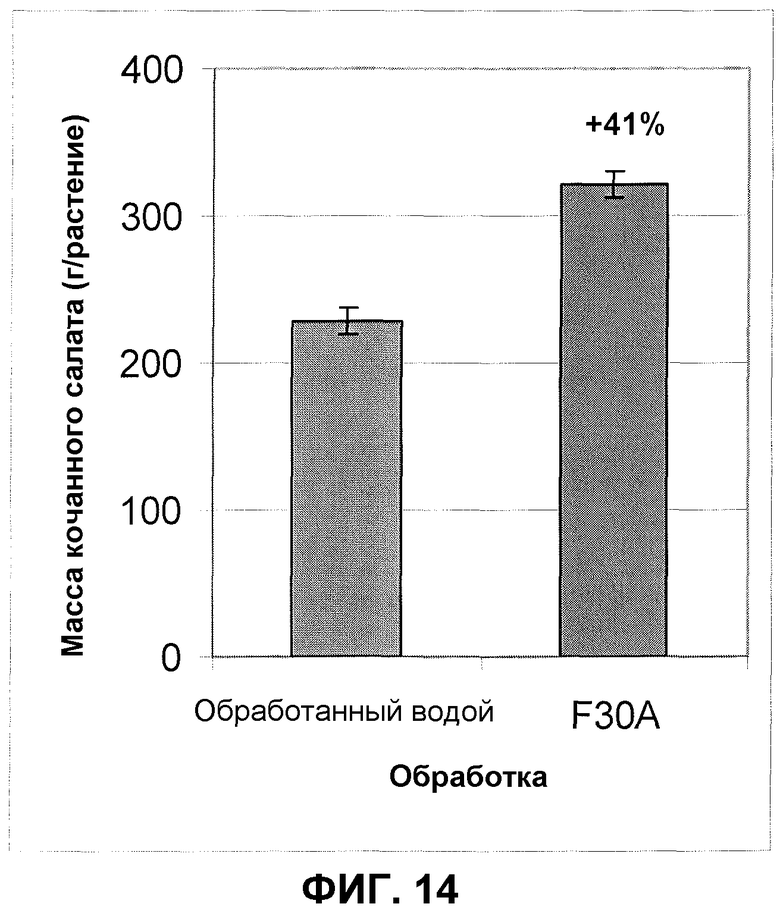
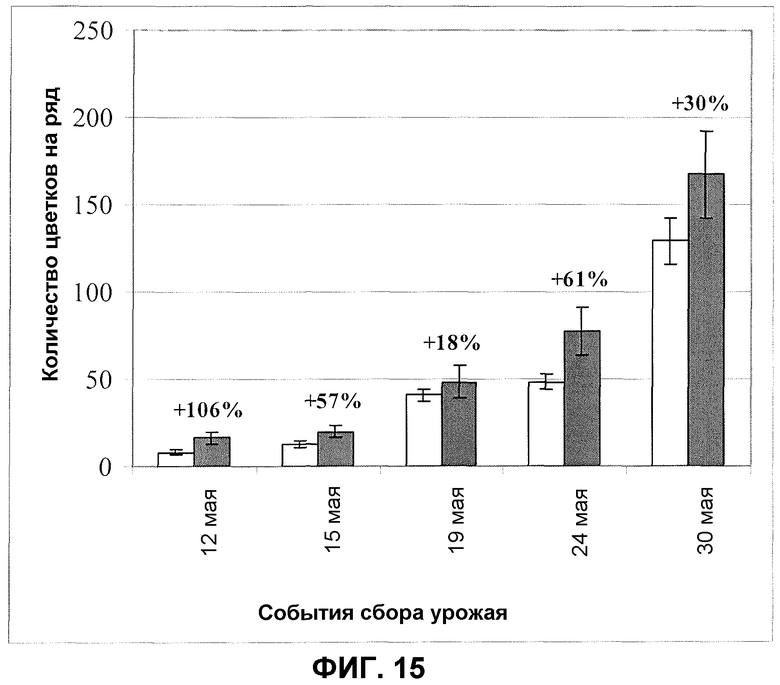
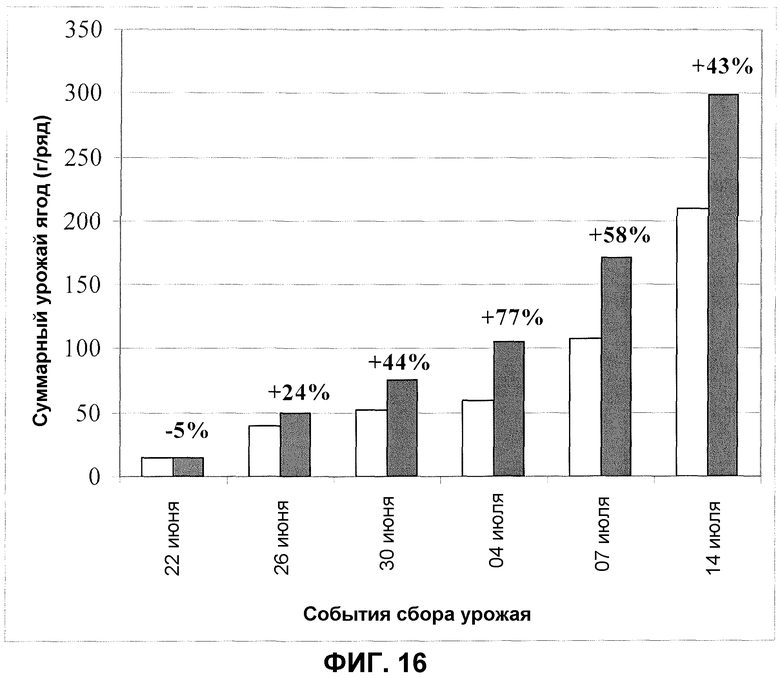
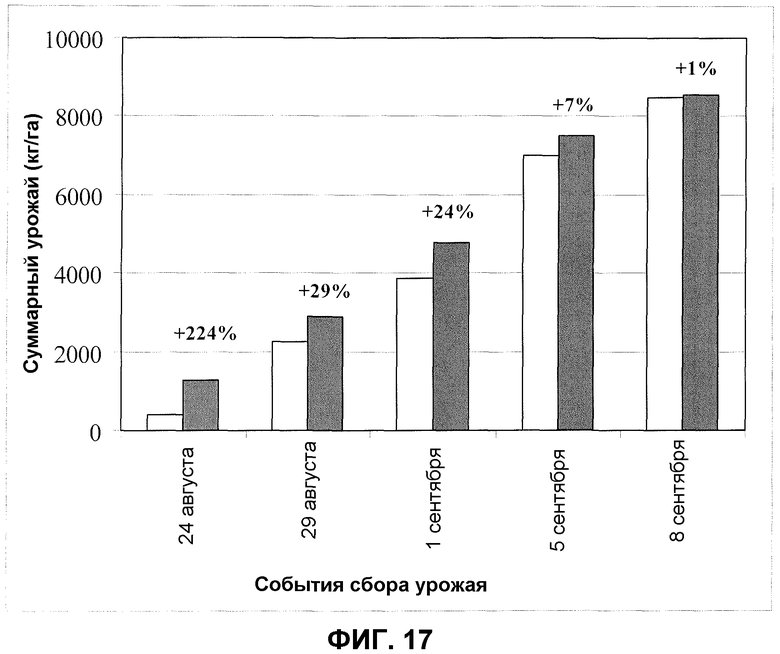
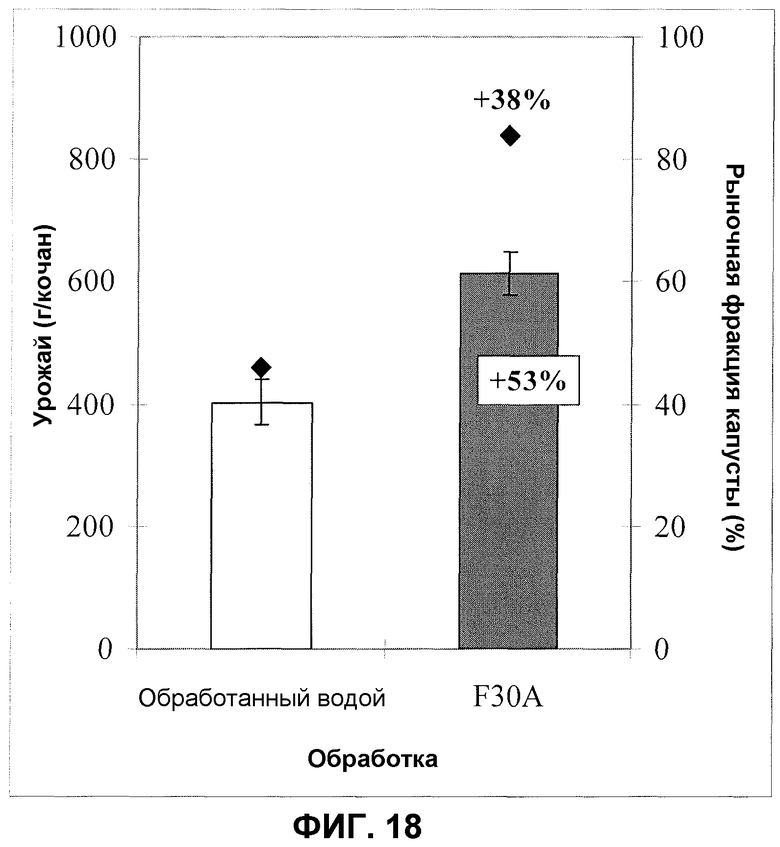
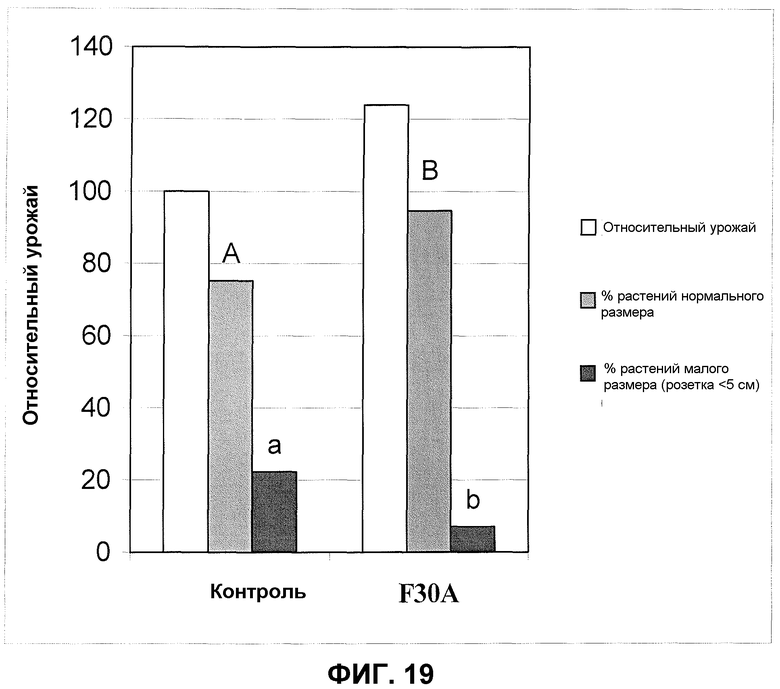
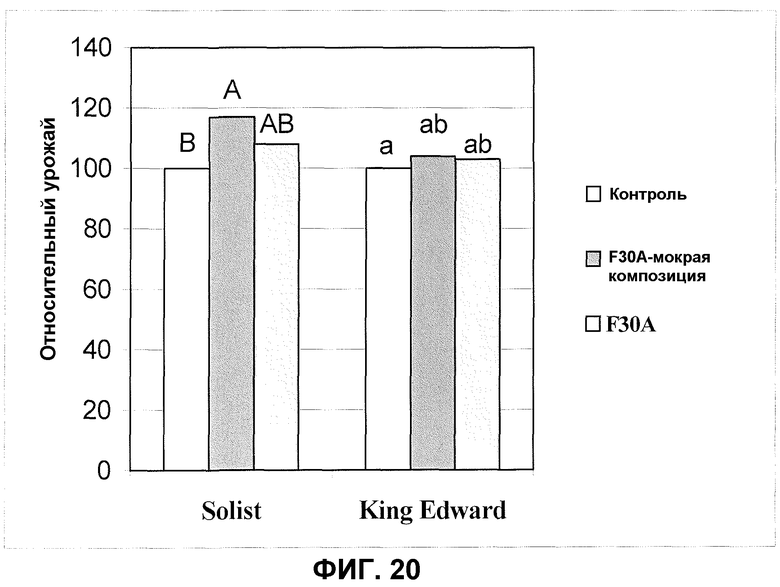

Заявленная группа изобретений относится к биотехнологии. Предложена группа изобретений - псевдомонада вида Pseudomonas azotoformans, штамма F30A, депонированного под регистрационным номером DSM 22077, надосадочная жидкость, ферментативный продукт и сельскохозяйственная композиция на основе штамма Pseudomonas azotoformans F30A, применение штамма Pseudomonas azotoformans F30A или его надосадочной жидкости для увеличения прорастания семян, всхожести растений и/или роста растений, способ увеличения прорастания семян и способ получения сельскохозяйственной композиции. Способ получения сельскохозяйственной композиции предусматривает смешивание штамма Pseudomonas azotoformans F30A или его надосадочной жидкости с одним или несколькими жидкими и/или твердыми носителями, а также с одними или несколькими микроорганизмами, стимулирующими рост растений, микроорганизмами биологического контроля, органическими удобрениями и/или агрохимикатами в эффективном количестве. Способ увеличения прорастания семян, всхожести растений и/или роста растений предусматривает внесение ферментативного продукта или сельскохозяйственной композиции на семя, растение и/или окружающую их среду в эффективном количестве. Группа изобретений позволяет повысить прорастание семян, приживаемость сеянцев, всхожесть растений и/или урожай сельскохозяйственных культур. 8 н. и 9 з.п. ф-лы, 21 ил., 7 табл., 18 пр.
1. Биологически чистый штамм Pseudomonas azotoformans, штамм F30A, депонированный в Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH с присвоенным номером доступа DSM 22077 для увеличения прорастания семян, всхожести растений и/или роста растений.
2. Надосадочная жидкость для увеличения прорастания семян, всхожести растений и/или роста растений, где указанная надосадочная жидкость получена центрифугированием культуры биологически чистого штамма Pseudomonas azotoformans, штамма F30A, депонированного в Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH с присвоенным номером доступа DSM 22077.
3. Применение биологически чистого штамма Pseudomonas azotoformans, штамма F30A, как определено в п.1, для увеличения прорастания семян, всхожести растений и/или роста растений.
4. Применение надосадочной жидкости, как определено в п.2, для увеличения прорастания семян, всхожести растений и/или роста растений.
5. Применение по п.3 или 4, где указанное семя и/или растение является двудольным.
6. Применение по п.3 или 4, где указанное семя и/или растение является однодольным.
7. Продукт ферментации, содержащий бактериальные клетки биологически чистого штамма Pseudomonas azotoformans F30A, депонированного в Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH с присвоенным номером доступа DSM 22077, вместе с примененной для них средой роста, для увеличения прорастания семян, всхожести растений и/или роста растений.
8. Сельскохозяйственная композиция для увеличения прорастания семян, всхожести растений и/или роста растений, содержащая эффективное количество биологически чистого штамма Pseudomonas azotoformans, штамма F30A, как определено в п.1, или надосадочной жидкости, как определено в п.2, необязательно в комбинации с одним или несколькими жидкими и/или твердыми носителями.
9. Сельскохозяйственная композиция по п.8, дополнительно содержащая один или несколько дополнительных микроорганизмов, стимулирующих рост растений, микроорганизмов биологического контроля, органических удобрений и/или агрохимикатов.
10. Способ увеличения прорастания семян, всхожести растений и/или роста растений, включающий стадию нанесения продукта ферментации по п.7 или сельскохозяйственной композиции по любому из пп.8 или 9 на семя, растение и/или окружающую среду указанного семени или растения, где указанные продукт ферментации или сельскохозяйственная композиция содержат приблизительно 106-1010 колониеобразующих единиц мл-1.
11. Способ по п.10, где указанный продукт ферментации по п.7 или указанную сельскохозяйственную композицию по любому из пп.8 или 9 наносят на корни растения.
12. Способ по п.10, где указанный продукт ферментации по п.7 или указанную сельскохозяйственную композицию по любому из пп.8 или 9 наносят на почву до и/или после появления корней растения.
13. Способ по п.10, где указанный продукт ферментации по п.7 или указанную сельскохозяйственную композицию по любому из пп.8 или 9 наносят на части вегетативно-размножающегося растения.
14. Способ по п.10, где указанный продукт ферментации по п.7 или указанную сельскохозяйственную композицию по любому из пп.8 или 9 наносят на среду для выращивания растения, окружающую семена и/или растения.
15. Способ по любому из пп.10-14, где растение или семя развивается в однодольное растение.
16. Способ по любому из пп.10-14, где растение или семя развивается в двудольное растение.
17. Способ получения сельскохозяйственной композиции по любому из пп.8 или 9, включающий стадию смешивания эффективного количества указанного Pseudomonas azotoformans, штамма F30A, или указанной надосадочной жидкости с одним или несколькими жидкими или твердыми носителями и, необязательно, с одним или несколькими дополнительными микроорганизмами, стимулирующими рост растения, микроорганизмами биологического контроля, органическими удобрениями и/или агрохимикатами.
| WO 2003016241 A1, 27.02.2003 | |||
| CA 23777054 A1, 16.09.2002 | |||
| WO 2007056848 A1, 24.05.2007 | |||
| US 5935839 A, 10.08.1999 | |||
| US 4849008 A, 18.06.4989 | |||
| US 6048713 A, 11.04.2000 | |||
| Преобразователь кода | 1980 |
|
SU1168922A1 |
Авторы
Даты
2015-05-10—Публикация
2010-12-22—Подача