Область техники
Настоящее изобретение относится к способу индукции гибели плюрипотентных стволовых клеток и дифференцированных клеток, отличных от кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, таких как эмбриональные стволовые клетки и индуцированные плюрипотентные стволовые клетки, в качестве средства очистки кардиомиоцитов в способе индукции дифференциации кардиомиоцитов из плюрипотентных стволовых клеток.
Предшествующий уровень техники
Кардиомиоциты у взрослых утратили пролиферативную активность и единственным путем лечения заболеваний, таких как острый инфаркт миокарда и кардиомиопатия, является трансплантация сердца. Однако в настоящее время нехватка доноров еще препятствует широкому применению трансплантации сердца и существует настоятельная потребность в поиске способа лечения, отличного от трансплантации сердца. Напротив, ожидается, что получение и очистка кардиомиоцитов ex vivo и их использование в качестве замены кардиомиоцитов при лечении заболевания представляет собой один из наиболее перспективных способов спасения пациентов с сердечными заболеваниями, которым ничего не остается, кроме как прибегнуть к трансплантации сердца.
Известно, что кардиомиоциты могут быть получены различными способами, включая дифференциацию стволовых клеток (например, эмбриональных стволовых клеток и разнообразных взрослых стволовых клеток) и получение из эмбрионов. В зависимости от подлежащих использованию плюрипотентых стволовых клеток подходящий ингибирующий дифференциацию фактор (например, клетка-фидер или фактор, ингибирующий лейкоз (LIF) в случае использования мышиных плюрипотентых стволовых клеток, или клетка-фидер, основной фактор роста фибробластов (bFGF) или трансформирующий фактор роста (TGF) в случае использования человеческих плюрипотентных клеток) удаляют из культуральной среды для индукции посредством образования клеточных масс (эмбриоидных телец), и это известно как способ, который может инициировать дифференциацию стволовых клеток в кардиомиоциты.
Тип дифференциации ex vivo стволовых клеток в кардиомиоциты имитирует некоторые из стадий физиологического развития in vivo и, в частности, в отношении событий во время раннего развития, типы физиологического развития, которые происходят в клетках оплодотворенного яйца, и дифференциация in vitro имеют много общего. Хронология дифференциации в кардиомиоциты ex vivo такая же, как хронология дифференциации физиологического развития, начиная с дифференциации стволовых клеток в недифференцированные мезодермальные клетки, некоторые из которых дифференцируются в программируемые кардиомиоциты (прекардиальную мезодерму), которые, в свою очередь, дифференцируются в кардиомиоциты.
Поскольку плюрипотентные клетки представляют собой клетки, которые способны дифференцироваться во все клетки, составляющие орган, технически трудно дифференцировать их только в кардиомиоциты. Также очень трудно обеспечить, чтобы плюрипотентные стволовые клетки были одновременно индуцированы в стадию дифференциации, так что вполне обычно, что стволовые клетки остаются недифференцированными в эмбриоидных тельцах.
Таким образом, попытка индуцировать дифференциацию стволовых клеток в кардиомиоциты ex vivo проводит к проблеме, вредной для клинического применения, заключающейся в том, что любые типы стволовых клеток могут в результате развиться в продуцирующие клетки, отличные от кардиомиоцитов, в качестве побочного продукта или что некоторые клетки могут оставаться недифференцированными. В частности, остаточные недифференцированные клетки обладают пролиферативной активностью и способны дифференцироваться в большое разнообразие клеток, и, таким образом, если используемые при лечении клетки, трансплантированные в живой организм, содержат любые остаточные недифференцированные клетки, крайне высока вероятность того, что из таких недифференцированных клеток образуется тератома. По этой причине клеточная популяция, содержащая кардиомиоциты, полученные индукцией дифференциации плюрипотентных стволовых клеток, может быть непосредственно трансплантирована в живой организм для лечения без особой сложности. Поэтому для обеспечения того, чтобы лечение с использованием кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, выполнялось безопасно при обеспечении идеального терапевтического эффекта, необходимо отыскать способ, которым плюрипотентные стволовые клетки полностью исключаются и кардиомиоциты являются высокоочищенными (а именно способ удаления клеток, отличных от кардиомиоцитов).
Известный в настоящее время способ очистки кардиомиоцитов заключается в предварительном введении определенного маркерного гена (например, GFP (зеленый флуоресцентный белок)) в геном стволовой клетки (непатентный документ 1). Однако данный способ требует геномного изменения, которое само по себе является эстетической проблемой, и оно также приводит к непрогнозируемым серьезным рискам в отношении безопасности, таким как изменение частоты развития раковой опухоли (непатентный документ 2). Также сообщалось о способе, включающем геномное изменение в качестве пути безусловного удаления недифференцированных плюрипотентных стволовых клеток (непатентный документ 3). Сообщалось о способе, использующем другой подход, при котором церамидные аналоги, которые, как известно, оказывают действие, вызывающее гибель клеток, используются для индукции гибели эмбриональных стволовых клеток сравнительно специфическим путем (непатентный документ 4). Однако этот способ не обеспечивает удовлетворительного удаления плюрипотентных стволовых клеток, поскольку группа клеток, культивированных после обработки церамидными аналогами, содержащимися (Oct-положительные клетки) в количестве, достигающем трети количества, обнаруживаемого в группе необработанных клеток (контроль). А в отношении удаления человеческих эмбриональных стволовых клеток, то только в непатентном документе 4 упоминается, что были обнаружены клетки, подвергшиеся апоптозу, но в нем не идет речь о том, что было осуществлено удовлетворительное удаление плюрипотентных стволовых клеток. Сообщалось о способе применения цитотоксических антител (непатентный документ 5), но в указанном документе указано, что даже после обработки антителами этим способом оставалось удалить еще приблизительно 20% эмбриональных стволовых клеток. В качестве еще одной проблемы использование способа приводит к нескольким ограничениям, таким как необходимость избегания антигенности антител перед тем как они могут использоваться для терапевтического лечения. Таким образом имеется возможность для усовершенствования известных способов индукции гибели клеток в качестве пути очистки кардиомиоцитов, который может использоваться при лечении заболеваний миокарда, и таким образом желательна разработка нового и еще более эффективного способа индукции гибели клеток.
Список ссылок
Непатентная литература
Непатентный документ 1: Müller, M. et al., FASEB J. 2000; 14: 2540-2548
Непатентный документ 2: Schröder, A.R. et al., Cell 2002; 110: 521-529
Непатентный документ 3: Schuldiner, M. et al., Stem Cells 2003; 21: 257-265
Непатентный документ 4: Bieberich, E. et al., J. Cell Biol. 2004; 167: 723-734
Непатентный документ 5: CHOO, A.B. et al., Stem Cells 2008; 26: 1454-1463
Краткое изложение сущности изобретения
Технические проблемы
Целью настоящего изобретения является разработка способа, который не вовлекает геномную модификацию и который, тем не менее, способен индуцировать гибель плюрипотентных стволовых клеток, таких как эмбриональные стволовые клетки и индуцированные плюрипотентные стволовые клетки, а также дифференцированных клеток, отличных от кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, но некардиомиоцитов. Целью настоящего изобретения является также разработка способа получения безопасных и высокоочищенных кардиомиоцитов, которые не связаны с риском развития тератом из плюрипотентных стволовых клеток в соответствии с настоящим способом.
Решение проблем
В результате интенсивных исследований, проведенных для решения указанных выше проблем, авторы настоящего изобретения обнаружили, что путем создания способа, способного индуцировать гибель дифференцированных клеток, отличных от кардиомиоцитов, в течение короткого периода времени и путем добавления вещества, не имеющего установленной присущей токсичности или вызывающего гибель клеток действия на условия культивирования плюрипотентных стволовых клеток и некардиомиоцитов, указанные проблемы могут быть очень эффективным образом решены, не прибегая к геномной модификации. Данный способ также обеспечивает эффективную очистку кардиомиоцитов, поскольку он не вызывает гибель клеток кардиомициотив.
В частности, настоящее изобретение относится к способу, который включает культивирование клеточной популяции, включающей плюрипотентные стволовые клетки, дифференцированные клетки, отличные от кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, и кардиомиоциты, происходящие из плюрипотентных стволовых клеток, в гипертоническом растворе, имеющем осмотическое давление 370 мОсм/кг или выше, благодаря чему плюрипотентные стволовые клетки и дифференцированные клетки, отличные от кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, доводятся до гибели, и стало ясно, что указанные выше проблемы могут быть решены путем предоставления данного способа. Таким образом, настоящее изобретение конкретно относится к следующему:
(1) Способу индукции гибели плюрипотентных стволовых клеток и клеток, отличных от кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, путем культивирования клеточной популяции, включающей плюрипотентные стволовые клетки, клетки, отличные от кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, и кардиомиоциты, происходящие из плюрипотентных стволовых клеток, в гипертоническом растворе, имеющем осмотическое давление 370 мОсм/кг или выше.
(2) Способу по указанному выше пункту (1), где культивирование проводят в гипертоническом растворе в течение 2 часов или дольше.
(3) Способу по указанному выше пункту (1) или (2), где гипертонический раствор, имеющий осмотическое давление 370 мОсм/кг или выше, получают добавлением сахаридов (углеводов) к культуральной среде.
(4) Способу по указанному выше пункту (3), где гипертонический раствор, имеющий осмотическое давление 370 мОсм/кг или выше, содержит 0,1-1 М сахаридов.
(5) Способу по указанному выше пункту (3) или (4), где сахариды представляют собой сахарные спирты, сахара или бетаины.
(6) Способу по указанному выше пункту (5), где сахарные спирты, сахара или бетаины выбраны из группы, состоящей из маннита, сорбита, ксилита, глицерина, сахарозы, глюкозы и триметилглицина.
(7) Способу по указанному выше пункту (4), где гипертонический раствор, имеющий осмотическое давление 370 мОсм/кг или выше, содержит 0,1-0,6 М глицерина.
(8) Способу по указанному выше пункту (7), где культивирование проводят в течение 10 часов или дольше.
(9) Способу по любому из указанных выше пунктов (1)-(8), где клеточную популяцию после культивирования в гипертоническом растворе возвращают в культуральную среду, имеющую нормальное осмотическое давление 200-300 мОсм/кг, и подвергают дальнейшему культивированию.
Обеспечивающий преимущество эффект изобретения
Когда клеточная популяция, включающая плюрипотентные стволовые клетки, дифференцированные клетки, отличные от кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, и кардиомиоциты, происходящие из плюрипотентных стволовых клеток, обрабатывается способом по настоящему изобретению, то любые недифференцированные плюрипотентные стволовые клетки и некардиомиоциты эффективно удаляются, в то же время обеспечивая возможность селективного выживания кардиомиоцмитов, следовательно, способ по настоящему изобретению обеспечивает эффективное обогащение и очистку кардиомиоцитов.
Краткое описание чертежей
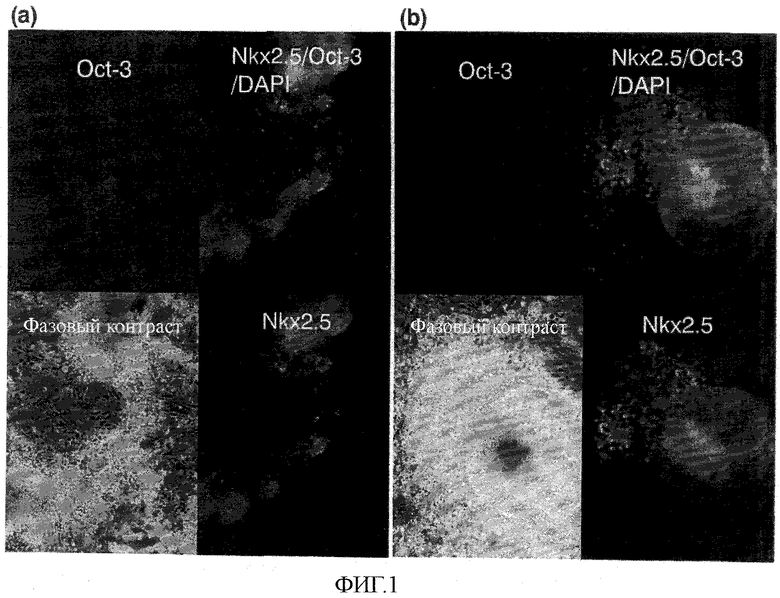
На фиг.1 показаны результаты иммуноокрашивания кардиомиоцитов, происходящих из эмбриональных стволовых клеток (ES-клеток), и остаточных недифференцированных эмбриональных стволовых клеток.
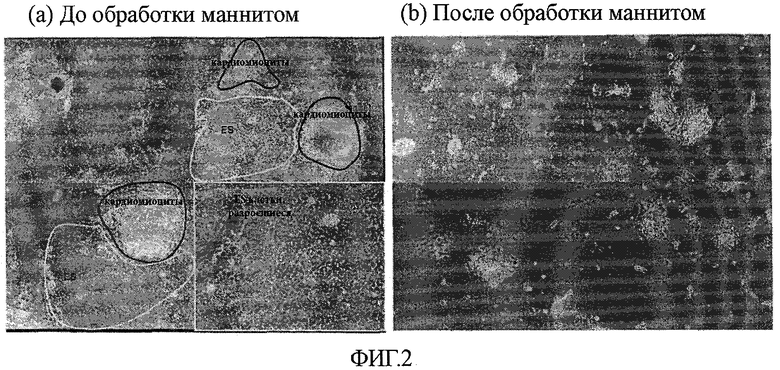
На фиг.2 показаны результаты обработки маннитом культуральной системы, содержащей как кардиомиоциты, происходящие из эмбриональных стволовых клеток (ES-клеток), так и остаточные недифференцированные эмбриональные стволовые клетки.
На фиг.3 показаны результаты иммуноокрашивания антителом против Nkx 2.5 и антителом против Oct-3/4 в клетках после обработки маннитом.
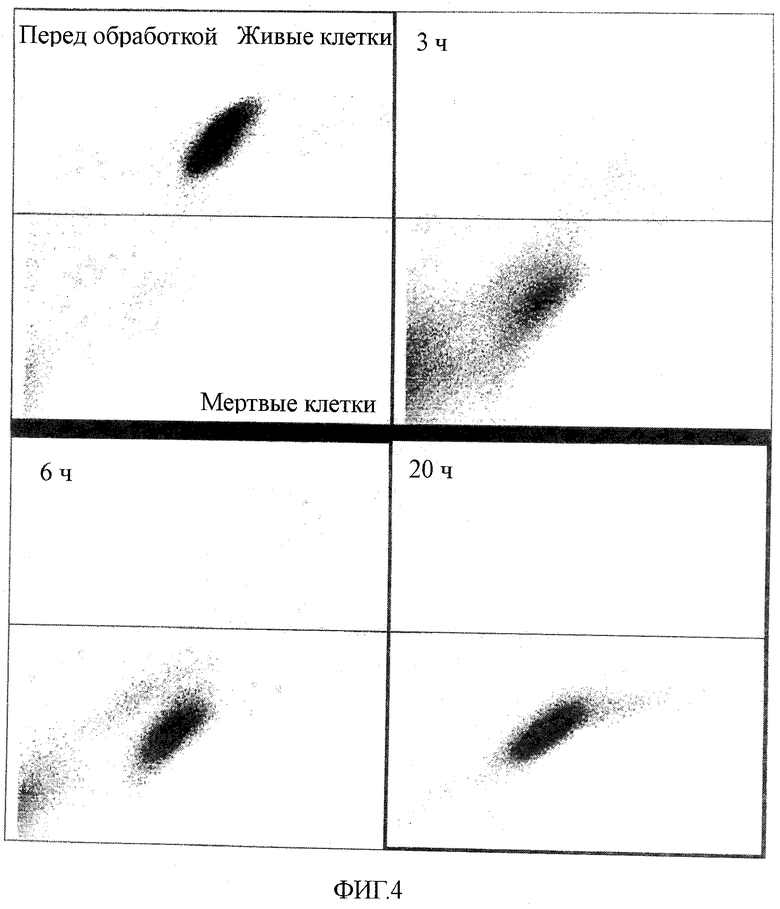
На фиг.4 показан вызывающий гибель клеток эффект 0,45 М маннита на мышиные эмбриональные стволовые клетки.
На фиг.5 показано действие маннита на эмбриональные стволовые клетки игрунка, которые по данным определения чувствительным к митохондриальному мембранному потенциалу красителем TMRM были или живыми, или мертвыми.
На фиг.6 показан эффект маннита на эмбриональные стволовые клетки игрунка.
На фиг.7 показан эффект маннита на человеческие эмбриональные стволовые клетки (анализом FACS).
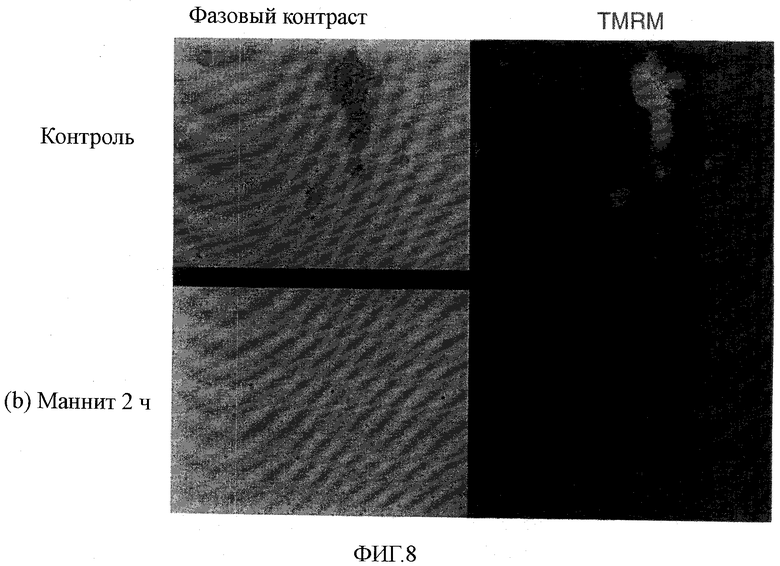
На фиг.8 показан эффект маннита на человеческие эмбриональные стволовые клетки (непосредственно после обработки).
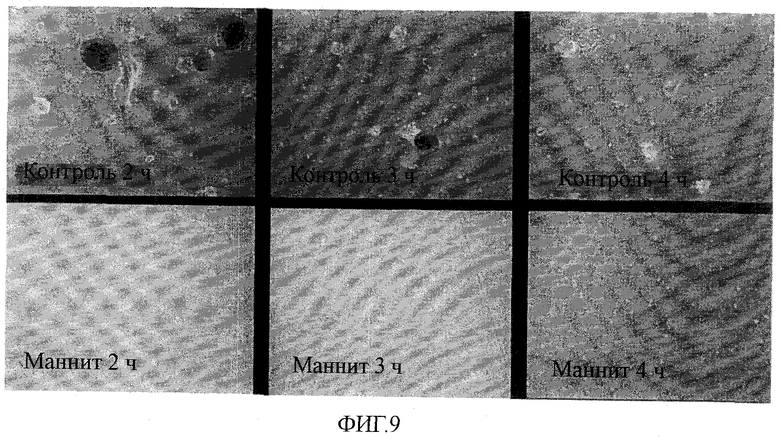
На фиг.9 показан эффект маннита на человеческие эмбриональные стволовые клетки (через 5 часов после обработки).
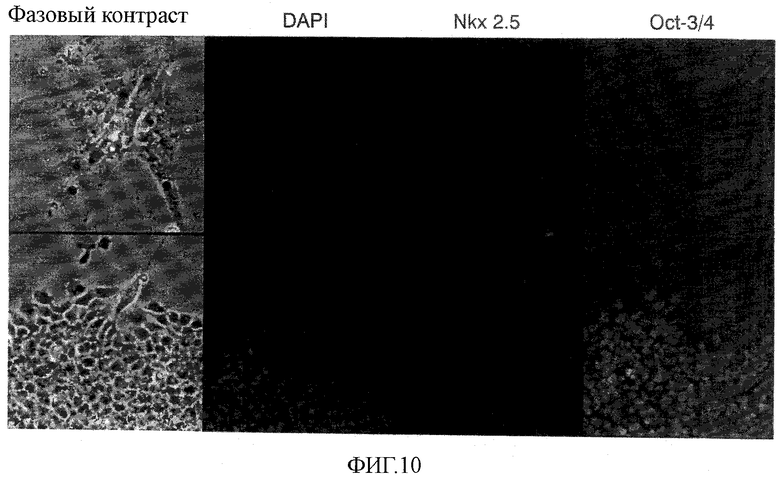
На фиг.10 показаны результаты обработки маннитом эмбриоидных телец из человеческих эмбриональных стволовых клеток.
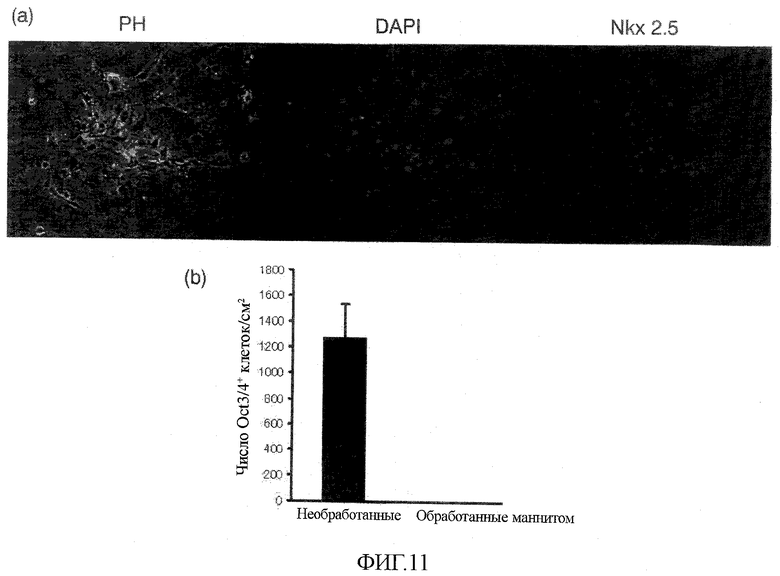
На фиг.11 оказана индукция гибели Oct-3/4-положительных клеток благодаря обработке маннитом эмбриоидных телец из человеческих эмбриональных стволовых клеток.
На фиг.12 показано действие маннита на человеческие индуцированные эмбриональные стволовые клетки (анализом FACS).
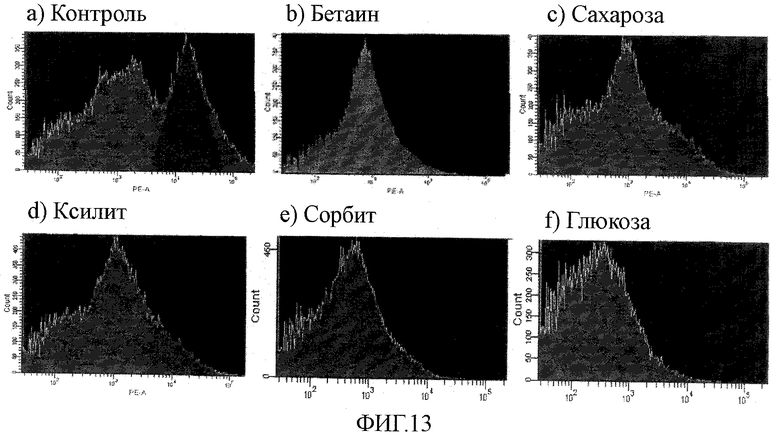
На фиг.13 показано вызывающее гибель клеток действие различных сахаридов, кроме маннита, на человеческие эмбриональные стволовые клетки.
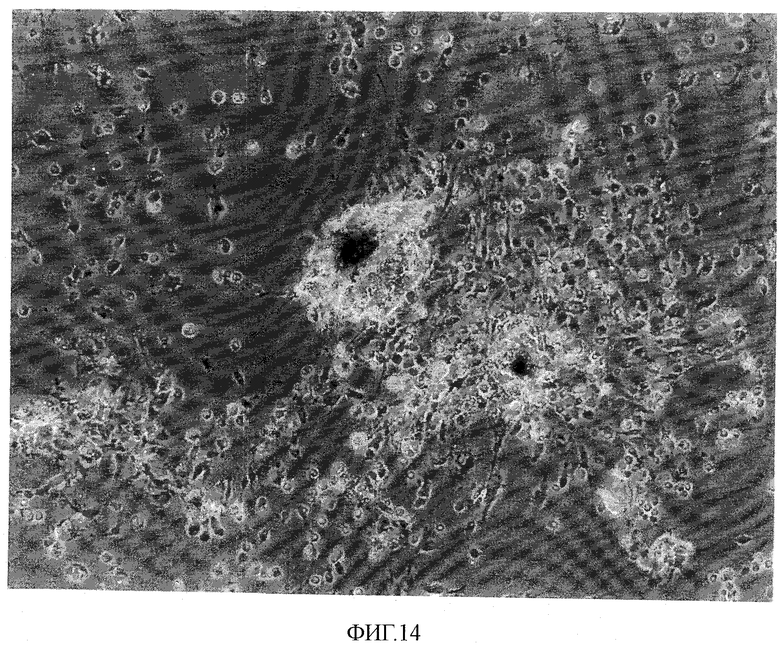
На фиг.14 показано действие глицерина на происходящие из человеческих эмбриональных стволовых клеток кардиомиоциты и некардиомиоциты.
На фиг.15 показано состояние клеток, подвергнутых 48- или 72-часовой обработке культуральной средой, содержащей 0,2 М маннита, изображениями соответствующих колоний, увеличенных на нижних панелях для визуализации типичной клеточной морфологии.
Описание вариантов осуществления изобретения
Авторы настоящего изобретения приготовили гипертонические растворы, содержащие растворенный в них маннит в высоких концентрациях, и наносили указанные гипертонические растворы на смешанную клеточную систему, содержащую эмбриональные стволовые клетки, а также кардиомиоциты и некардиомиоциты; они обнаружили, что после воздействия гипертонических растворов, гибели клеток были более вероятно подвергнуты эмбриональные стволовые клетки и некардиомиоциты. Учитывая эти данные, авторы настоящего изобретения провели более тщательное исследование того, как концентрация маннита и длительность воздействия маннита связаны с гибелью эмбриональных стволовых клеток и некардиомиоцитов; в результате авторы настоящего изобретения обнаружили, что продолжительное воздействие низких концентраций маннита эффективно вызывало гибель эмбриональных стволовых клеток и некардиомиоцитов и что в концентрации 1 М, которая была по существу насыщенной концентрацией, маннит вызывал гибель эмбриональных стволовых клеток в пределах короткого периода времени.
В то же самое время авторы настоящего изобретения обнаружили, что на протяжении полного диапазона концентраций маннита были условия коцентрации и времени, которые вызывали гибель эмбриональных стволовых клеток и некардиомиоцитов, но которые, тем не менее, не вызывали гибель кардиомиоцитов, дифференцированных из эмбриональных стволовых клеток. Следовательно, способ по настоящему изобретению, при котором выполняется культивирование в таких условиях, не только достигает эффективного удаления эмбриональных стволовых клеток и некардиомиоцитов, но также обеспечивает эффективное обогащение и очистку кардиомиоцитов.
Следовательно, в одном варианте осуществления настоящего изобретения оно относится к способу индукции гибели плюрипотентных стволовых клеток и дифференцированных клеток, отличных от кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, культивированием клеточной популяции, включающей плюрипотентные стволовые клетки и дифференцированные клетки, отличные от кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, и кардиомиоциты, происходящие из плюрипотентных стволовых клеток, в гипертоническом растворе, имеющем осмотическое давление 370 мОсм/г или выше.
Когда мышиные эмбриональные стволовые клетки индуцируются для дифференциации способом образования эмбриоидных телец, считается, что эмбриоидные тельца через 3-6 дней после начала индукции для дифференциации включают мезодермы или запрограммированные кардиомиоциты. Кардиомиоциты появляются через 7 дней после начала дифференциации (10 дней для человеческих эмбриональных стволовых клеток). Эмбриоидные тельца также включают недифференцированные клетки, клетки, подобные эндотелиальному эпителию, и нейронные клетки. После более тщательного исследования клеток, которые составляют эмбриоидные тельца, 70-80% клеточных популяций, которые составляют их, заняты дифференцированными клетками, отличными от кардиомиоцитов, изредка недифференцированными эмбриональными стволовыми клетками. Эти загрязняющие клетки активно пролиферируют и их относительное изобилие увеличивается с течением времени. Авторы настоящего изобретения обнаружили, что, когда эмбриоидные тельца, имеющие такой клеточный состав, подвергались воздействию соответствующего диапазона высокого осмотического давления в клеточной среде, остаточные эмбриональные стволовые клетки и дифференцированные клетки, отличные от кардиомиоцитов, в эмбриоидных тельцах подвергаются гибели клеток. Авторы настоящего изобретения также обнаружили, что даже в указанных условиях культивирования кардиомиоциты не подвергались гибели клеток и возобновляли автономную пульсацию, когда культуральную среду заменяли средой, имеющей физиологическое осмотическое давление.
В способе по настоящему изобретению источником подачи клеток может быть клеточная популяция, происходящая из любого источника подачи, пока он содержит кардиомиоциты. Например, способ по настоящему изобретению может быть осуществлен путем использования клеточной популяции, включающей кардиомиоциты, дифференцированные из плюрипотентных стволовых клеток (включая эмбриональные стволовые клетки (ES-клетки), взрослые стволовые клетки, индуцированные плюрипотентные стволовые клетки (iPS-клетки) и т.д.) в известных условиях для индукции кардиомиоцитов или путем использования клеточной популяции, происходящей из эмбриональной ткани. Кроме кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, клеточная популяция, содержащая кардиомиоциты, таким образом дифференцированные из плюрипотентных стволовых клеток, может содержать плюрипотентные стволовые клетки и дифференцированные клетки, отличные от кардиомиоцитов, происходящих из плюрипотентных стволовых клеток.
Способ по настоящему изобретению характеризуется культивированием определенной выше клеточной популяции гипертоническим раствором, имеющим осмотическое давление 370 мОсм/кг или выше. Осмотическое давление, используемое в способе по настоящему изобретению, представляет собой давление, которое вызывает гибель клеток, отличных от кардиомиоцитов (т.е. плюрипотентных стволовых клеток и дифференцированных клеток, отличных от кардиомиоцитов), но некардиомиоцитов. Осмотическое давление, которое удовлетворяет требованиям, составляет 370 мОсм/кг и выше, предпочтительно от 370 мОсм/кг до 1600 мОсм/кг, более предпочтительно от 370 мОсм/кг до 1000 мОсм/кг, еще более предпочтительно от 480 мОсм/кг до 1000 мОсм/кг и наиболее предпочтительно от 700 мОсм/кг до 1000 мОсм/кг. Учитывая, что осмотическое давление в условиях культивирования in vitro обычно составляет примерно 200-300 мОсм/кг (также называемое нормальным или физиологическим осмотическим давлением), указанные величины являются необычно высокими, и при культивировании в указанных условиях все клетки, отличные от кардиомиоцитов, подвергнутся гибели клеток.
В случае когда используется гипертонический раствор, имеющий осмотическое давление 370 мОсм/кг или выше, полученный добавлением сахарида к культуральной среде, способ по настоящему изобретению характеризуется выполнением культивирования в таком гипертоническом растворе в течение 2 часов или дольше, предпочтительно в течение от 2 до 72 часов, более предпочтительно в течение от 2 до 48 часов, еще более предпочтительно в течение от 2 до 24 часов и наиболее предпочтительно в течение от 4 до 12 часов.
В способе по настоящему изобретению условие, которое может селективно вызвать гибель недифференцированных плюрипотентных стволовых клеток, включая человеческие ES-клетки и iPS-клетки или дифференцированные клетки, отличные от кардиомиоцитов, определяется связью между степенью осмотического давления, оказываемого гипертоническим раствором, и длительностью периода времени, в течение которого на клетки воздействует гипертонический раствор. Кратко, независимо от вида клеток, подлежащих использованию для индукции кардиомиоцитов, чем выше осмотическое давление гипертонического раствора, тем короче период времени, в течение которого клетки должны подвергаться его воздействию, и чем ниже величина, на которую установлено осмотическое давление гипертонического раствора, тем длительнее период времени, в течение которого клетки должны подвергаться воздействию гипертонического раствора.
Когда клеточная популяция подвергается воздействию гипертонического раствора в способе по настоящему изобретению, то могут быть доведены до гибели клетки, отличные от кардиомиоцитов (недифференцированные плюрипотентные стволовые клетки или некардиомиоциты) (а именно вызывается гибель клеток или подается сигнал для вызова гибели клеток). Таким образом, клетки, доведенные до гибели, или подвергаются гибели клеток в гипертоническом растворе, или подвергаются гибели клеток после того, как их извлекают из гипертонического раствора и помещают обратно в нормальную культуральную среду.
В способе по настоящему изобретению гибель клеток вызывается воздействием на клетки физиологического стресса таким образом, чтобы можно было селективно вызвать гибель клеток, отличных от желательных клеток, не вызывая какое-либо генетическое повреждение выживших клеток; в этом отношении настоящее изобретение предпочтительно при сравнении с индукцией гибели клеток посредством физического воздействия (например, радиационного стресса или окислительного стресса) или химического воздействия (стресса, вызванного химическим соединением), которые вызывают непосредственное повреждение генов. Для большей определенности клетки, выжившие после физиологического стресса, восстанавливают свою первоначальную функцию и могут проявить нормальную функцию, если они возвращаются в условия культивирования, которые не оказывают физиологического стресса, применяемого для индукции гибели клеток. Данный признак представляет собой признак, который достаточно легко использовать в условиях восстановительной медицины, которые включают получение ткани или составляющих ткань клеток ex vivo и их трансплантацию в живой организм.
Термин «гипертонический раствор, имеющий осмотическое давление 370 мОсм/кг или выше», используемый в настоящем описании, означает гипертонический раствор, в котором произведено только доведение осмотического давления до 370 мОсм/кг или выше, без воздействия на метаболизм клеток, и это может быть проиллюстрировано раствором, который получен добавлением сахарида (углевода) к культуральной среде. Сахарид, который может использоваться в настоящем изобретении, может быть проиллюстрирован сахаридами, которые способны увеличивать осмотическое давление культуральной среды, не воздействуя на метаболизм клеток; определенные примеры включают, но без ограничения, сахариды (моносахариды, олигосахариды и полисахариды), гликозаминогликаны, аминогликозиды, сахарные спирты и бетаины. Более конкретными примерами являются вещества, которые перечислены в таблице 1.
Эффект настоящего изобретения был также признан в случае использования сорбита (пример сахарного спирта), триметилглицина (пример бетаинов) и других веществ, которые физиологически вовлечены в регуляцию осмотического давления в живом организме; следовательно, бетаин, таурин, инозитол, глицерофосфохолин и т.д. могут быть использованы в качестве органических осмолитов.
Когда гипертонический раствор, имеющий осмотическое давление 370 мОсм/кг или выше, получают добавлением сахарида к культуральной среде, то способ по настоящему изобретению отличается тем, что гипертонический раствор содержит сахарид в концентрации 0,1-1 М (моль/л), предпочтительно 0,1-0,6 М (моль/л). Связь между концентрацией сахарида (моль/л) и осмотическим давлением (мОсм/кг) может быть аппроксимирована по существу прямой линией; гипертонический раствор, содержащий 0,1 М сахарида, соответствует раствору, имеющему осмотическое давление приблизительно 370 мОсм/кг, и гипертонический раствор, содержащий 1 M сахарида, соответствует раствору, имеющему осмотическое давление приблизительно 1300-1600 мОсм/кг.
Если глицерин используется в качестве сахарида, то способ по настоящему изобретению отличается тем, что гипертонический раствор содержит от 0,1 до 0,6 М глицерина, предпочтительно 0,1-0,5 М глицерина, и может, кроме того, характеризоваться выполнением культивирования в данном гипертоническом растворе в течение 10 часов или более, обычно в течение 10-24 часов, предпочтительно в течение 10-18 часов.
Гипертонические растворы получали с использованием различных сахаридов, и связь между концентрацией сахарида и осмотическим давлением показана в следующей таблице для конкретных сахаридов.
Концентрация сахарида и осмотическое давление (измеренные величины)
В способе по настоящему изобретению после культивирования клеточной популяции в гипертоническом растворе, имеющем осмотическое давление 370 мОсм/кг или выше, для индукции гибели плюрипотентных стволовых клеток и некардиомиоцитов ее предпочтительно возвращают в культуральную среду, имеющую нормальное осмотическое давление (т.е. осмотическое давление 200-300 мОсм/кг) и подвергают дальнейшему культивированию. Когда клеточную популяцию культивируют в гипертоническом растворе в способе по настоящему изобретению, то кардиомиоциты не подвергаются гибели клеток, но они могут испытать временную остановку пульсации. Даже в этом случае, если клеточную популяцию возвращают в культуральную среду, имеющую нормальное осмотическое давление, кардиомиоциты будут восстанавливать пульсацию до нормального функционирования. В качестве еще одной проблемы, клеточная популяция, культивируемая в гипертоническом растворе, также содержит клетки, которые получили сигнал для гибели клеток, но которые представляются еще живыми. Для удаления таких клеток из популяции культивированных клеток, предпочтительно, чтобы клеточная популяция была возвращена в культуральную среду, имеющую нормальное осмотическое давление, и подвергнута дальнейшему культивированию.
Способ по настоящему изобретению может проявлять одинаковые результаты при всех видах клеток, которые были тестированы в следующих ниже примерах (т.е. эмбриональных стволовых клетках, полученных у мышей, эмбриональных стволовых клетках, полученных у игрунков, эмбриональных стволовых клетках, полученных у людей, и iPS-клетках, полученных у людей). Поскольку способ по настоящему изобретению не зависим от вида животных, было показано, что способ по настоящему изобретению применим к клеткам, полученным из всех млекопитающих в диапазоне от мыши до человека. Кроме того, способ по настоящему изобретению может решить обозначенную проблему как в эмбриональных стволовых клетках, так и в индуцированных плюрипотентных стволовых клетах, и таким образом было показано, что способ по настоящему изобретению применим независимо от того, являются ли плюрипотентные стволовые клетки клетками, которые не подвергались генной манипуляции (например, эмбриональные стволовые клетки), или клетками, которые были подвергнуты генной манипуляции (например, iPS-клетками).
Ниже описан определенный пример применения способа по настоящему изобретению к клеточной популяции, содержащей кардиомиоциты, происходящие из эмбриональных стволовых клеток или iPS-клеток. Сначала эмбриональные стволовые клетки или iPS-клетки подвергают суспензионному культивированию способом висячей капли или подобным в дифференцирующей культуральной среде (включающей, например, α-MEM (минимальную эссенциальную среду) (SIGMA), дополненную 10% FBS (фетальной телячьей сыворотки) (EQUITEC BIO), 100 единиц/мл пенициллина и 50 мкг/л стрептомицина (GIBCO)), посредством чего была выполнена соответствующая индукция дифференциации в кардиомиоциты для образования эмбриоидных телец, содержащих кардиомиоциты. После дифференциации в кардиомиоциты созревание осуществлялось в течение дополнительного периода, по меньшей мере, 2 дня; затем культуральную среду заменяли средой, подходящей для культивирования эмбриоидных телец, т.е. бессывороточной α-MEM или культуральной средой D-MEM, содержащей 0,1-1 М маннита, сорбита, глюкозы, сахарозы или ксилита (данная культуральная среда представляет собой гипертонический раствор), и эмбриоидные тельца подвергали воздействию новой культуральной среды (гипертонического раствора) в течение дополнительного определенного периода времени. Это воздействие гипертонического раствора было способно вызвать гибель клеток в растворе или передать сигнал для гибели клеток, отличных от кардиомиоцитов (недифференцированных плюрипотентных стволовых клеток или некардиомиоцитов).
Когда культивирование, включающее воздействие гипертонического раствора, заканчивается, то культуральную среду заменяют средой, имеющей нормальное осмотическое давление, и обработанные клетки подвергают непрерывному культивированию в течение дополнительного периода, благодаря чему может быть обеспечена возможность селективного выживания кардиомиоцитов в условиях культуры. Если необходимо, то клетки могут быть промыты ферментативной дисперсией, заменой культуральной среды, центрифугированием или любыми другими подходящими методиками, которые используются или независимо, или в комбинации для обеспечения того, чтобы наверняка были удалены некардиомиоциты, подвергнутые гибели клеток.
Если клеточную популяцию, содержащую и кардиомиоциты, и клетки, отличные от кардиомиоцитов, которые включают недифференцированные клетки, подвергают воздействию гипертонического раствора способом по настоящему изобретению, то гибель клеток может быть вызвана, по меньшей мере, у 90%, предпочтительно, по меньшей мере, у 95%, более предпочтительно, по меньшей мере, у 98% и наиболее предпочтительно, по меньшей мере, у 100% клеток, отличных от кардиомиоцитов, которые содержатся в клеточной популяции.
ПРИМЕРЫ
Настоящее изобретение описано более подробно посредством следующих примеров. Однако следует отметить, что следующие примеры служат для иллюстрации настоящего изобретения и ни в коей мере не предназначены для его ограничения.
Пример 1: Иммуноокрашивание происходящих из эмбриональных стволовых клеток кардиомиоцитов и остаточных недифференцированных эмбриональных стволовых клеток
В данном примере клеточные массы (эмбриоидные тельца), содержащие кардиомиоциты, были образованы из стволовых клеток и их проверяли на присутствие в них как кардиомиоцитов, так и недифференцированных клеток.
Мышиные эмбриональные стволовые клетки (линия клеток: EB3, Nat Genet 2000; 24: 372-376) были любезно предоставлены Dr. Hitoshi Niwa в RIKEN. Эти мышиные эмбриональные стволовые клетки дифференцировали в клеточные массы, содержащие кардиомиоциты, известным способом (Bader, A. et al., Differentiation 2001, 68, pp. 31-43); а именно культивированием 75 эмбриональных стволовых клеток на эмбриоидное тельце (EB) в качестве клеточных масс всего в течение 7 дней методом висячей капли с использованием культуральной среды [α-MEM (минимальной эссенциальной среды) (SIGMA), дополненной 10% FBS (EQUITEC BIO), 100 единиц/мл пенициллина и 50 кг/мл стрептомицина (GIBCO)]); затем эмбриоидные тельца прикрепляли к чашке для культивирования и культивировали еще в течение 3-5 дней в условиях 37°C и атмосферы 5% CO2.
Полученные таким путем эмбриоидные тельца фиксировали 4% параформальдегидом и затем обрабатывали 0,1% Triton X100 для придания клеточной мембране полурастворимости. После блокирования 4% раствором BSA (бычий сыворотосный альбумин) антитело против Nkx 2.5 (козье анти-Nkx 2.5 антитело; No. N-19 от Santacruz), в целом удерживаемое для появления в программированных кардиомиоцитах на самой ранней стадии развития, и антитело против транскрипционного фактора Oct-3/4 (мышиное моноклональное анти-Oct-3/4 антитело; No. 084720 от BD Transduction Laboratories), в целом известное как играющее важную роль в поддержании способности мышиных эмбриональных стволовых клеток оставаться недифференцированными, причем оба использовались в качестве первичных антител, разводили в 100 раз блокирующим раствором и давали возможность проникнуть в клетки при 4°C в течение 12 часов. После промывания четыре раза и меченое Alexa Flow 488 ослиное анти-козье антитело (Molecular Probe), и меченое TRITC кроличье анти-мышиное антитело (DAKO), выбранные в качестве вторичных антител, разводили 1/200 и давали возможность проникнуть в клетки при комнатной температуре в течение 1 часа. После промывания ядерное окрашивание выполняли при комнатной температуре в течение 5 минут, используя раствор, содержащий реагент DAPI (Molecular Probe). После промывания проводили наблюдение под флуоресцентным микроскопом. Результаты показаны на фиг.1. Для двух эмбриоидных телец ((a) и (b) на фиг.1) верхняя левая панель относится к Oct-3 (красная), нижняя правая панель относится к Nkx 2.5 (зеленая), верхняя правая панель показывает слитое изображение Oct-3 (красное) и Nkx 2.5 (зеленое) при окраске DAPI (синяя), кроме того, слитой с ним, и нижняя левая панель показывает фазоконтрастное изображение.
Как показано на фиг.1, было обнаружено, что каждое из эмбриоидных телец (a) и (b) включает как Oct-3/4-положительные недифференцированные клетки, так и Nkx 2.5-положительные кардиомиоциты внутри одного эмбриоидного тела.
Пример 2: Обработка сахаридами (сахарными спиртами) культуральной системы, содержащей как происходящие из эмбриональных стволовых клеток кардиомиоциты, так и остаточные эмбриональные стволовые клетки
В данном примере клеточные массы (эмбриоидные тельца), содержащие кардиомиоциты, образованные из эмбриональных стволовых клеток, обрабатывали сахаридами (сахарными спиртами) и затем проверяли на состояние культуры кардиомиоцитов и культуры других клеток.
Полученные у мышей эмбриональные стволовые клетки обрабатывали способом примера 1 для образования эмбриоидных телец, которые были дифференцированы до стадии, содержащей программированные кардиомиоциты (прекардиальные мезодермы). Полученные таким образом эмбриоидные тельца тщательно обрабатывали ферментами рестрикции (трипсином и коллагеназой) для обеспечения того, чтобы не было вызвано повреждение клеток, и полученные частично диспергированные эмбриоидные тельца подвергали другому культивированию в прикрепленной к субстрату культуре. После 5-дневного непрерывного культивирования наблюдали вместе популяции кардиомиоцитов, пульсирующих автономно (клеточные популяции, окруженные красными линиями), клеточные популяции, имеющие признаки клеток, подобных эмбриональным стволовым клеткам (клеточные популяции, окруженные желтыми линиями), и другие популяции (см. фиг.2(a)).
На следующей стадии культуральную среду для смешанной культуры заменяли бессывороточной культуральной средой α-MEM, содержащей маннит в концентрации 0,45 М (приблизительно эквивалентной 720 мОсм/кг) и ITS {инсулин (10 мг/л), трансферрин (5,5 мг/л) и селенит натрия (6,7 мг/л)} (GIBCO), и культивирование проводили в течение 36 часов. Как оказалось, большое число клеток уже проявили типичные признаки типичной гибели клеток на этой стадии. Затем культуральную среду заменяли культуральной средой α-MEM, дополненной 20% фетальной телячьей сывороткой, и культивирование продолжали, после чего кардиомиоциты восстанавливали автономную пульсацию через 1 или 2 дня. Напротив, по существу все клетки, отличные от кардиомиоцитов, были обнаружены мертвыми (см. фиг.2(b)), включая недифференцированные клетки (эмбриональные стволовые клетки), которые распространились на чашке для культивирования таким образом, что образовали монослой (см. нижнюю правую панель фиг.2(a).)
Культуру, изображенную на фиг.2, подвергали иммуноокрашиванию антителами против Nkx 2.5 и Oct-3/4 таким же способом, как использовано в примере 1, и результаты показаны на фиг.3. Для клеток, ограниченных прямоугольником на фазоконтрастном изображении, показанном на верхней левой панели фиг.3, левая нижняя панель показывает окрашивание антителом против Nkx 2.5 (зеленое), верхняя правая панель показывает окрашивание DAPI (синее) и нижняя правая панель показывает слитое изображение окрашивания Nkx 2.5 (зеленое) и окрашивание DAPI (синее). В результате стало ясно, что 98% и более полученных клеток представляли собой Nxk 2.5-положительные кардиомиоциты (см. нижнюю левую и нижнюю правую панель на фиг.3), и Oct-3/4-положительные недифференцированные клетки не были включены в них.
Пример 3: Вызывающий гибель клеток эффект сахаридов (сахарных спиртов) на мышиные эмбриональные стволовые клетки
В данном примере мышиные эмбриональные стволовые клетки обрабатывали сахаридами (сахарными спиртами) и затем проверяли для выявления состояния их выживания.
В мертвых клетках потенциал митохондриальной мембраны утрачен, поэтому если клетки окрашиваются чувствительным к потенциалу митохондриальной мембраны реагентом TMRM (Molecular Probe), который испускает флуоресценцию после выявления мембранного потенциала, являющегося индикатором выживания, то сигнал флуоресценции, полученной от данного реагента, является высоким у живых клеток, но низким у мертвых клеток.
Указанный признак был использован в примере 3; эмбриональные стволовые клетки, культивированные способом примера 3, далее культивировали в культуральной среде α-MEM, содержащей 0,45 М маннита (приблизительно эквивалент 720 мОсм/кг) и 1 мкМ TMRM в течение периода 0 ч (Pre), 3 ч, 6 ч или 20 ч; культивированные эмбриональные стволовые клетки собирали, промывали и подвергали FACS анализу для проверки состояния их выживания на основании интенсивности флуоресценции чувствительного к потенциалу митохондриальной мембраны реагента TMRM; результаты показаны на фиг.4. На фиг.4, изображающей результаты FACS анализа для 0 ч (Pre), 3 ч, 6 ч и 20 ч, клетки, лежащие выше линии границы на точечных графиках, представляют собой живые клетки, а клетки ниже линии границы представляют собой мертвые клетки.
Как показано на фиг.4, по существу все клетки были активны перед обработкой (Pre), но после 3-часовой обработки маннитом приблизительно 90% клеток погибло, и после 6-часовой обработки погибло 98% клеток; после 20-часовой обработки погибли все клетки (фиг.4).
Пример 4: Вызывающий гибель клеток эффект сахаридов (сахарных спиртов) на эмбриональные стволовые клетки игрунков
В данном примере эмбриональные стволовые клетки игрунков обрабатывали сахаридами (сахарными спиртами) и затем проверяли на состояние их выживания.
Эмбриональные стволовые клетки игрунков получали из Центрального Института Экспериментальных Животных (Stem Cells, 2005 Oct; 23(9): 1304-13). Клетки культивировали в основном в соответствии со способом, описанным в указанном документе. Более конкретно, эмбриональные стволовые клетки игрунков культивировали для поддержания их недифференцированного состояния с использованием мышиных эмбриональных фибробластов (MEF), которые были инактивированы в отношении роста обработкой митомицином C. Использовали культуральную среду KO-DMEM (GIBCO), дополненную 20% KO-SERUM (GIBCO), 1,6 мМ L-глутамина, 0,1 мМ не незаменимых аминокислот (MEM), 0,2 мМ β-меркаптоэтанола (2-ME; Sigma), 100 МЕ/мл пенициллина, 100 мкг/мл сульфата стрептомицина и 8 нг/мл рекомбинантного человеческого фактора, ингибирующего лейкоз (LIF; Chemicon) или рекомбинантного человеческого основного фактора роста фибробластов (bFGF; Peprotech). После пассирования клетки обрабатывали 0,1% коллагеназы типа III (Wortington) при 37°C в течение 10 минут для отделения колоний ES.
После пассирования клетки диспергировали друг с другом с использованием TE (0,25% трипсин (GIBCO) и 1 мМ EDTA (этилендиаминтетрауксусной кислоты)) и в соответствии с опубликованным документом (Watanabe, K. et al., Nat. Biotechnol., 2007, 25: 681-686, Epub 2007 May 27) добавляли 10 мкМ ингибитора селективной связанной с Rho киназы (ROCK) (Y27632) для подавления гибели клеток. В то же самое время митохондрии в живых клетках окрашивали 50 нМ TMRM.
Часть окрашенных клеток обрабатывали культуральной средой α-MEM, содержащей 0,45 М маннита (приблизительно эквивалентным 720 мОсм/кг) в течение 2 часов и образец получали из этих клеток; остальные окрашенные клетки обрабатывали не содержащей маннит культуральной средой α-MEM в течение 2 часов, и из указанных клеток получали образец в качестве контроля. В контроле клетки агрегировали друг с другом с образованием масс, поэтому перед FACS анализом проводили другую обработку TE для диспергирования клеток. Затем клетки обрабатывали маннитом в течение 2 часов и контрольные клетки анализировали FACS для выявления уровня митохондриального мембранного потенциала на основании интенсивности флуоресценции TMRM для проверки состояния выживания стволовых клеток; результаты показаны на фиг.5. Как ясно из сравнения с контролем (фиг.5(a)), почти все клетки, обработанные маннитом в течение 2 часов, утратили мембранный потенциал (фиг.5(b)).
Кроме того, окрашенные клетки фотографировали как для случая 2-часовой обработки маннитом, так и для контроля (фиг.6(a)). Затем эти два типа клеток подвергали культивированию в течение 5 дней с использованием культуральной среды [KO-DMEM (GIBCO), дополненной 20% KO-SERUM (GIBCO), 1,6 мМ L-глутамина, 0,1 мМ не незаменимых аминокислот (MEM), 0,2 мМ β-меркаптоэтанола (2-ME; Sigma), 100 МЕ/мл пенициллина, 100 мкг/мл сульфата стрепотимицина и 8 нг/мл рекомбинантного человеческого фактора, ингибирующего лейкоз (LIF; Chemicon)]; в результате была обнаружена живой большая популяция контрольных клеток (т.е. клеток, не обработанных маннитом) (нижняя панель фиг.6(b)), но не была обнаружена ни одна живая клетка из клеток, подвергнутых воздействию маннита (верхняя панель фиг.6(b)).
Пример 5: Вызывающий гибель клеток эффект сахаридов (сахарных спиртов) на человеческие эмбриональные стволовые клетки
В данном примере человеческие эмбриональные стволовые клетки обрабатывали сахаридами (сахарными спиртами) и затем проверяли для выявления состояния их выживания.
Человеческие эмбриональные стволовые клетки получали из Исследовательского Центра Стволовых Клеток, Института пограничных медицинских наук Киотского университета (центра клеток ES, спонсируемого Проектом Национальных Биоресурсов) (Suemori, H et al., Biochem. Biophys. Res. Commun., Vol. 345, 2006, pp. 926-932). Клетки культивировали в основном в соответствии со способом, описанным в указанном документе. Более конкретно, человеческие эмбриональные стволовые клетки культивировали для поддержания их недифференцированного состояния с использованием мышиных эмбриональных фибробластов (MEF), которые были инактивированы в отношении роста обработкой митомицином C. Использовали культуральную среду F12/DMEM (1:1) (SIGMA; Product No. D6421), дополненную 20% KO-SERUM (GIBCO), 1,6 мМ L-глутамина, 0,1 мМ не незаменимых аминокислот (MEM), 0,1 мМ β-меркаптоэтанола (2-ME; Sigma), 100 МЕ/мл пенициллина, 100 мкг/мл сульфата стрептомицина и рекомбинантного человеческого основного фактора роста фибробластов (bFGF; Reprotech). После пассирования клетки обрабатывали 0,1% коллагеназой типа III (Wortington) при 37°C в течение 10 минут для отделения колоний эмбриональных стволовых клеток.
После пассирования клетки диспергировали друг с другом, используя TE (0,25% трипсин (GIBCO) и 1 мМ EDTA) и в соответствии с опубликованным документом (Watanabe, K. et al., Nat. Biotechnol., 2007, 25: 681-686, Epub 2007 May 27), добавляли 10 мкМ ROCK ингибитора (Y27632) для подавления гибели клеток. В то же самое время митохондрии в живых клетках окрашивали 50 нМ TMRM.
Часть окрашенных клеток обрабатывали культуральной средой α-MEM, содержащей 0,45 М маннита (приблизительно эквивалентным 720 мОсм/кг), в течение 2, 3 или 4 часов и 3 образца получали из этих клеток; остальные окрашенные клетки обрабатывали не содержащей маннит культуральной средой α-MEM в течение 2 часов и из указанных клеток получали образец в качестве контроля. В контроле клетки агрегировали друг с другом с получением масс, поэтому перед FACS анализом в обработанных группах и в контроле проводили другую обработку трипсином и EDTA для диспергирования клеток. Клетки обрабатывали маннитом в течение 2, 3 или 4 часов и контрольные клетки анализировали FACS для выявления уровня митохондриального мембранного потенциала на основании интенсивности флуоресценции TMRM для проверки состояния выживания стволовых клеток; результаты показаны на фиг.7. Как ясно из сравнения с контролем (фиг.7(a)), почти все клетки, обработанные маннитом в течение 2 часов, утратили мембранный потенциал (фиг.7(b)).
Кроме того, клетки, окрашенные TMRM, фотографировали как для случая 2-часовой обработки маннитом, так и для контроля (фиг.8)). Клетки, не обработанные маннитом (верхняя панель фиг.8), агрегировались друг с другом с образованием самоагрегирующихся масс посредством межклеточного прикрепления, но клетки, обработанные маннитом (нижние панели фиг.8) оставались диспергированными (фиг.8).
Затем группы обработанных и контрольных клеток подвергали культивированию в прикрепленной к субстрату культуре в течение 5 дней с использованием культуральной среды [F12/DMEM (1:1) (SIGMA; Product No. D6421), дополненной 20% KO-SERUM (GIBCO), 1,6 мМ L-глутамина, 0,1 мМ не незаменимых аминокислот (MEM), 0,1 мМ β-меркаптоэтанола (2-ME; Sigma), 100 МЕ/мл пенициллина, 100 мкг/мл сульфата стрептомицина и человеческого основного фактора роста фибробластов (bFGF; Peprotech)]; в результате были обнаружены большие пропорции контрольных клеток (т.е. клеток, не обработанных маннитом) (верхние панели фиг.9), но не была обнаружена ни одна живая клетка из клеток, подвергнутых воздействию маннита (нижние панели фиг.9).
Пример 6: Вызывающий гибель клеток эффект сахаридов (сахарных спиртов) на остаточные стволовые клетки в происходящих из человеческих эмбриональных стволовых клеток эмбриоидных тельцах и обогащение кардиомиоцитов
В данном примере содержащие кардиомиоциты клеточные массы (эмбриоидные тельца), образованные из человеческих эмбриональных стволовых клеток, обрабатывали сахаридами (сахарными спиртами) и затем проверяли для определения состояния кардиомиоцитов и состояния других клеток.
После пассирования человеческие эмбриональные стволовые клетки подвергали суспензионному культивированию в культуральной среде [α-MEM (минимальной эссенциальной среде) (SIGMA), дополненной 10% FBS (EQUITEC BIO), 100 единиц/мл пенициллина и 50 мкг/мл стрептомицина (GIBCO)] для индукции образования эмбриоидных телец. Через 14-18 дней после начала дифференциации (начало суспензионного культивирования) автономно пульсирующие клетки начинали дифференцироваться, и на отдельной стадии было подтверждено, что они представляют собой кардиомиоциты.
Эмбриоидные тельца еще сохраняли способность автономной пульсации после 3-месячного пассирования от начала дифференциации. Их частично обрабатывали 0,1% коллагеназой (Wortington) и 0,1% трипсином (DIFCO) для дисперсии в виде мелких клеточных масс. Клеточные массы делили на две группы; одну группу обрабатывали 0,45 М маннита (приблизительно эквивалентного 720 мОсм/кг) в течение 2 часов, а другую группу (контроль) не обрабатывали маннитом, но обрабатывали таким же количеством раствора, имеющего физиологическое осмотическое давление, буфер Ads (116,4 мМ NaCl, 5,4 мМ KCl, 5,6 мМ декстрозы, 10,9 мМ NaH2PO4, 405,7 мкМ MgSO4, 20 мМ Hepes, pH 7,3), в течение 2 часов. После обработки обе группы клеток подвергали культивированию в прикрепленной к субстрату культуре в течение 3 дней в растворе DMEM, дополненной 10% фетальной телячьей сывороткой.
Через три дня обе группы клеток наблюдали под микроскопом и в чашке для культивирования клеток из контрольной группы было обнаружено большое число колоний, каждая из которых состояла из популяции клеток, которые предположительно были недифференцированными клетками, в которых ядро занимало бо′льшую площадь, по сравнению с цитоплазмой. С другой стороны, такие клеточные популяции вообще не были обнаружены в чашке для культивирования клеток, обработанных маннитом.
Вместо этого популяции автономно пульсирующих клеток и автономно пульсирующие одиночные клетки были обнаружены прикрепленными или суспендированными в чашке для культивирования клеток, обработанных маннитом. Обработанные маннитом клетки и контрольные клетки анализировали в соответствии с экспериментальной методикой примера 1, используя мышиное анти-Oct-3/4 моноклональное антитело (№ 084720 трансдукционных лабораторий BD Transduction Laboratories) и козье анти-Nkx 2.5 антитело (No. N-19 of Santacruz), в качестве первичных антител для выявления экспрессии белка Oct-3/4, который являлся как маркером эмбриональных стволовых клеток, так и внутриядерным транскрипционным фактором, и экспрессии белка Nkx 2.5, который являлся соответственно и маркером кардиомиоцитов, и внутриядерным транскрипционным фактором. Результаты по контрольной группе одному из двух разделенных образцов показаны на фиг.10, а результаты по тестируемой группе, подвергнутой 2-часовой обработке маннитом, показаны на фиг.11. На верхней панели фиг.10 показаны результаты по кардиомиоцитам, и на нижней панели показаны результаты по эмбриональным стволовым клеткам.
Как следствие, колонии клеток, подобных эмбриональным стволовым клеткам, которые были обнаружены в больших количествах в контроле, были Oct-3/4-положительными, свидетельствуя о том, что они состоят из эмбриональных стволовых клеток (нижняя панель фиг.10). Автономно пульсирующие клетки, которые были обнаружены в опытной группе, обработанные 0,45 М маннита (приблизительно эквивалентным 720 мОсм/кг), были Nkx 2.5-положительными и идентифицировались как кардиомиоциты (фиг.11(a)). Данные результаты являются веским свидетельством того, что обработка маннитом вызывает гибель недифференцированных стволовых клеток, но не проявляет значимой токсичности в отношении кардиомиоцитов (фиг.10 и 11).
Было показано, что рассматриваемый способ обработки способен эффективно вызывать гибель человеческих эмбриональных стволовых клеток. С другой стороны, данный способ не вызывал гибель клеток кардиомиоцитов, показывая его применимость в качестве способа обогащения кардиомиоцитов. Через одну неделю после обработки маннитом тип и число выживших клеток определяли иммуногистохимической методикой; в отличие от контрольных клеток (группа без обработки) подавляющее большинство выживших клеток представляло собой Nkx 2.5-положительные кардиомиоциты и Oct-3/3-отрицательные клетки выявлялись с трудом (фиг.11(b)).
Пример 7: Вызывающий гибель клеток эффект сахаридов (сахарных спиртов) на человеческие индуцированные плюрипотентные стволовые клетки (iPS-клетки)
В данном примере человеческие индуцированные плюрипотентные стволовые клетки (iPS-клетки) обрабатывали сахаридами (сахарными спиртами) и затем проверяли на состояние их выживания.
Человеческие iPS-клетки получали в Центре исследования стволовых клеток Института пограничных медицинских наук Киотского университета (центра ES-клеток, спонсируемого Проектом Национальных Биоресурсов). Клетки культивировали в основном в соответствии с таким же способом, как способ в случае человеческих эмбриональных стволовых клеток, т.е. в соответствии со способом, аналогично описанным в примере 5. После пассирования, клетки диспергировали друг с другом, используя TE (0,25% трипсин (GIBCO) и 1 мМ EDTA), и в соответствии с опубликованным документом (Watanabe, K. et al., Nat. Biotechnol., 2007, 25: 681-686, Epub 2007 May 27) добавляли 10 мкМ ROCK ингибитора (Y27632) для подавления гибели клеток. В то же самое время митохондрии в живых клетках окрашивали 50 нМ TMRM.
Часть окрашенных клеток обрабатывали культуральной средой α-MEM, содержащей 0,45 М маннита (приблизительно эквивалентым 720 мОсм/кг) в течение 2 часов, и образец получали из этих клеток; остальные окрашенные клетки обрабатывали не содержащей маннит культуральной средой α-MEM в течение 2 часов и из указанных клеток получали образец в качестве контроля. В контроле клетки агрегировали друг с другом с образованием масс, поэтому перед FACS анализом оба образца подвергали другой обработке трипсином и EDTA для диспергирования клеток; после этого образцы анализировали FACS для выявления уровня митохондриального мембранного потенциала на основании интенсивности флуоресценции TMRM для проверки состояния выживания стволовых клеток; результаты показаны на фиг.12. Как ясно из сравнения с контролем (фиг.12(a)) почти все клетки, обработанные маннитом в течение 2 часов, утратили мембранный потенциал (фиг.12(b)). Указанные клетки были, вероятно, мертвыми, как и человеческие эмбриональные стволовые клетки.
Пример 8: Вызывающий гибель клеток эффект различных сахаридов (сахарных спиртов, сахаров, бетаинов) на человеческие эмбриональные стволовые клетки
В данном примере человеческие эмбриональные стволовые клетки обрабатывали сахаридами, отличными от маннита (сахарными спиртами, сахарами, бетаинами), и затем проверяли на состояние их выживания.
Изменения митохондриального мембранного потенциала наблюдали с использованием экспериментальной методики примера 5 при условии, что человеческие эмбриональные стволовые клетки обрабатывали не маннитом, а 0,45 М различных других сахаридов (сахарных спиртов: сорбита и ксилита; сахаров: сахарозы и глюкозы; бетаинов: триметилглицина) (приблизительно эквивалентного 750-780 мОсм/кг) в течение 2 часов. Результаты показаны на фиг.13. Как ясно из сравнения с контролем (фиг.13(a)), все клетки, обработанные указанными выше сахаридами в течение 2 часов, утратили мембранный потенциал (фиг.13(b)-(f)).
Пример 9: Вызывающий гибель клеток эффект различных сахаридов (сахарных спиртов, сахаров, бетаинов) на остаточные стволовые клетки в происходящих из человеческих эмбриональных стволовых клеток эмбриоидных тельцах и обогащение кардиомиоцитов
В данном примере содержащие кардиомиоциты клеточные массы (эмбриоидные тельца), образованные из человеческих эмбриональных стволовых клеток, обрабатывали сахаридами, отличными от маннита (сахарными спиртами, сахарами, бетаинами) и затем проверяли на состояние культуры кардиомиоцитов и культуры других клеток.
После пассирования человеческие эмбриональные стволовые клетки повергали суспензионному культивированию в культуральной среде [α-MEM (минимальной эссенциальной среде) (SIGMA), дополненной 10% FBS (EQUITEC BIO), 100 единиц/мл пенициллина и 50 мкг/мл стрептомицина (GIBCO)] для индукции образования эмбриоидных телец. Через 12-14 дней после начала дифференциации (начала суспензионного культивирования) автономно пульсирующие клетки начинали дифференцироваться, и на отдельной стадии было подтверждено, что они являются кардиомиоцитами.
Эмбриоидные тельца еще сохраняли способность автономной пульсации после 3-месячного пассирования от начала дифференциации. Их частично обрабатывали 0,1% коллагеназой (Wortington) и 0,1% трипсином (DIFCO) для дисперсии в виде мелких клеточных масс. Клеточные массы делили на две группы; одну группу обрабатывали сахаридами (сахарными спиртами: сорбитом, ксилитом и глицерином; сахарами: сахарозой и глюкозой; бетаинами: триметилглицином) в течение 12 часов в количестве 0,45 М (приблизительно эквивалентном 700-780 мОсм/кг) или 0,6 М (приблизительно эквивалентном 850-1000 мОсм/кг), а другую группу (контроль) не обрабатывали указанными сахаридами, но обрабатывали таким же количеством раствора, имеющего физиологическое осмотическое давление, буфер Ads (116,4 мМ NaCl, 5,4 мМ KCl, 5,6 мМ декстрозы, 10,9 мМ NaH2PO4, 405,7 мкМ MgSO4, 20 мМ Hepes, pH 7,3), в течение 2 часов. После обработки обе группы клеток подвергали культивированию в течение 12 часов в растворе DMEM, дополненной 10% фетальной телячьей сывороткой.
Через 12 часов обе группы клеток наблюдали под микроскопом, и в чашке для культивирования клеток из контрольной группы было обнаружено большое число колоний, каждая из которых состояла из популяции клеток, которые предположительно были недифференцированными клетками, в которых ядро занимало бо′льшую площадь по сравнению с цитоплазмой. С другой стороны, такие клеточные популяции вообще не были обнаружены в чашках для культивирования клеток, обработанных сахаридами. Вместо этого популяции автономно пульсирующих клеток и автономно пульсирующие одиночные клетки были обнаружены прикрепленными или суспендированными в чашках для культивирования клеток, обработанных сахаридами.
Пример 10: Гистологический анализ вызывающего гибель клеток эффекта сахаридов (сахарных спиртов) на остаточные стволовые клетки в происходящих из человеческих эмбриональных стволовых клеток эмбриоидных тельцах
В данном примере клеточные массы (эмбриоидные тельца), содержащие кардиомиоциты, образованные из человеческих эмбриональных стволовых клеток, обрабатывали сахаридами (сахарными спиртами) и затем проверяли для определения морфологии клеток в условиях культивирования в отношении кардиомиоцитов.
Образцы дифференцированных клеток, происходящих из человеческих эмбриональных стволовых клеток, обработанных 0,45 М глицерина (приблизительно эквивалентным 710 мОсм/кг) или 0,6 М глицерина (приблизительно эквивалентным 870 мОсм/кг), исследовали в отношении их морфологии в условиях культивирования. Как оказалось, почти все дифференцированные клетки, отличные от кардиомиоцитов, были мертвыми. Вызывающий гибель клеток эффект был заметен, когда клетки подвергали воздействию глицерина в течение 10 часов и больше (фиг.14).
Из представленных выше результатов было обнаружено, что продолжительная обработка глицерином будет эффективно вызывать гибель плюрипотентных стволовых клеток (эмбриональных стволовых клеток/iPS-клеток) и дифференцированных клеток, отличных от кардиомиоцитов.
Пример 11: Вызывающий гибель клеток эффект сахарида в низкой концентрации (маннит) на мышиные эмбриональные стволовые клетки
В данном примере мышиные эмбриональные стволовые клетки обрабатывали маннитом в низкой концентрации и затем проверяли в отношении состояния их выживания.
Эмбриональные стволовые клетки, культивированные способом, описанным в примере 1, культивировали еще в течение 48 и 72 часов в культуральной среде α-MEM, содержащей 0,2 М маннит (количество, приблизительно эквивалентное 480 мОсм/кг); затем стволовые клетки проверяли в отношении состояния их выживания с точки зрения наличия или отсутствия клеточной адгезии и морфологическим наблюдением; результаты показаны на фиг.15.
Как показано на фиг.15, после 48 часов обработки почти все колонии уже открепились от чашки для культивирования, демонстрируя таким образом характерную морфологию гибели клеток. После 72 часов данная ситуация была более выражена и клетки были полностью мертвыми. Дискретные точки, показанные на фотографии, сделанной после 48 часов обработки (отмеченные 48 ч), и фотография, сделанная после 72 часов обработки (отмеченные 72 ч), представляют отдельные клетки. На каждой фотографии также показаны массы мертвых клеток, происходящих из колонии ES-клеток. Конкретный пример таких масс мертвых клеток показан в увеличенном виде под каждой фотографией.
Кроме того, подобно способу, описанному в примере 1, 75 мышиных эмбриональных стволовых клеток на EB культивировали в виде клеточных масс в целом в течение 7 дней методом висячей капли с использованием культуральной среды [α-MEM (минимальной эссенциальной среде) (SIGMA), дополненной 10% FBS (EQUITEC BIO), 100 единиц/мл пенициллина и 50 мкг/мл стрептомицина (GIBCO)], благодаря чему стволовые клетки дифференцировались в клеточные массы, содержащие кардиомиоциты; затем эмбриоидные тельца прикрепляли к чашке для культивирования и культивировали в течение еще 3-5 дней в условиях 37°C и атмосферы 5% CO2. Таким образом, содержащие кардиомиоциты мышиные эмбриоидные тельца были получены индукцией дифференциации, и затем прикрепленную к субстрату культуру обрабатывали 0,2 М маннита в течение периода до 72 часов; по прохождении 72 часов почти все клетки, отличные от кардиомиоцитов, погибли и наблюдалось селективное выживание только кардиомиоцитов, что подтверждает индукцию гибели дифференцированных клеток, отличных от кардиомиоцитов.
Промышленная применимость
Путем применения способа по настоящему изобретению для обработки клеточной популяции, включающей плюрипотентные клетки, клетки, отличные от кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, и происходящие из плюрипотентных стволовых клеток кардиомиоциты, эмбриональные стволовые клетки и кардиомиоциты в популяции клеток могут быть эффективно удалены, и в то же самое время только кардиомиоциты могут выжить, обеспечивая возможность эффективного обогащения и очистки кардиомиоцитов.






Изобретение относится к области биотехнологии. Предложен способ индукции в культуре in vitro гибели плюрипотентных стволовых клеток и клеток, отличных от кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, путем культивирования клеточной популяции, включающей плюрипотентные стволовые клетки, клетки, отличные от кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, и кардиомиоциты, происходящие из плюрипотентных стволовых клеток, в гипертоническом растворе, содержащем сахариды (углеводы) и имеющем осмотическое давление от 370 мОсм/кг до 1000 мОсм/кг. Способ позволяет быстро очистить кардиомиоциты от плюрипотентных стволовых клеток без гибели кардиомиоцитов. 7 з.п. ф-лы, 15 ил., 2 табл., 11 пр.
1. Способ индукции в культуре in vitro гибели плюрипотентных стволовых клеток и клеток, отличных от кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, путем культивирования клеточной популяции, включающей плюрипотентные стволовые клетки, клетки, отличные от кардиомиоцитов, происходящих из плюрипотентных стволовых клеток, и кардиомиоциты, происходящие из плюрипотентных стволовых клеток, в гипертоническом растворе, содержащем сахариды (углеводы) и имеющем осмотическое давление от 370 мОсм/кг до 1000 мОсм/кг.
2. Способ по п. 1, где культивирование проводят в гипертоническом растворе в течение 2 часов или дольше.
3. Способ по п. 1, где гипертонический раствор содержит 0,1-1 М сахаридов.
4. Способ по п. 1 или 2, где сахариды представляют собой сахарные спирты, сахара или бетаины.
5. Способ по п. 4, где сахарные спирты, сахара или бетаины выбраны из группы, состоящей из маннита, сорбита, ксилита, глицерина, сахарозы, глюкозы и триметилглицина.
6. Способ по п. 3, где гипертонический раствор содержит 0,1-0,6 Μ глицерина.
7. Способ по п. 6, где культивирование проводят в течение 10 часов или дольше.
8. Способ по любому из пп. 1 или 2, где клеточную популяцию после культивирования в гипертоническом растворе возвращают в культуральную среду, имеющую нормальное осмотическое давление 200-300 мОсм/кг, и подвергают дальнейшему культивированию.
| Прибор для производства вассермановской реакции | 1928 |
|
SU12433A1 |
| US 20070122881, 31.05.2007 | |||
| US 0007157079 B2, 02.01.2007 | |||
| RU 94040386 A1, 10.05.1996 | |||
Авторы
Даты
2015-05-27—Публикация
2010-03-29—Подача