ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к стволовым клеткам, а более конкретно к способу получения клеток эндодермы с применением стволовых клеток.
УРОВЕНЬ ТЕХНИКИ
В ходе эмбрионального развития ткани организма формируются из трех основных клеточных популяций: эктодермы, мезодермы и дефинитивной эндодермы. Эти клеточные популяции, также известные как первичные зародышевые листки, формируются посредством процесса, известного как гаструляция. В результате гаструляции каждый первичный зародышевый листок формирует определенный набор клеточных популяций и тканей. Мезодерма дает начало клеткам крови, эндотелиальным клеткам, сердечной и скелетной мышце и адипоцитам. Дефинитивная эндодерма образует печень, поджелудочную железу и легкое. Эктодерма дает начало нервной системе, коже и тканям надпочечников.
Эмбриональные стволовые клетки человека (ES) представляют собой плюрипотентные клетки, которые могут дифференцироваться в обширный набор типов клеток. При инъекции иммунодефицитным мышам эмбриональные стволовые клетки формируют дифференцированные новообразования (тератомы). Однако эмбриональные стволовые клетки, которые индуцируют для формирования эмбриоидных телец (EB) in vitro, служат источником линии эмбриональных стволовых клеток, поддающихся дифференциации в многочисленные типы клеток, характерных для некоторых тканей при определенных условиях роста. Например, клетки ES дифференцируются в нейроны в присутствии фактора роста нервов и ретиноевой кислоты.
Клетки ES человека и их дифференцированные потомки представляют собой важный источник нормальных клеток человека для терапевтической трансплантации и для исследований и разработки лекарственных средств. Для обеих этих целей необходимо предоставление соответствующих клеток, дифференцированных в типы тканей, подходящих для нужд пациента или соответствующих фармакологических испытаний. С этим связана необходимость в эффективном и надежном способе получения дифференцированных клеток из эмбриональных стволовых клеток.
В настоящее время эмбриональные стволовые клетки человека (hES) получают из трех источников: бластоцист, остающихся после лечения бесплодия и переданных для исследований, бластоцист, полученных из донорских гамет (ооцитов и спермы) и продуктов переноса ядер (NT). Трупная ткань плода представляет собой единственный источник эмбриональных половых клеток человека (hEG). Клетки hES и hEG предоставляют значительные научные и терапевтические возможности, включая возможность получения более специализированных клеток или тканей. Однако этические вопросы, касающиеся источников клеток hES и hEG, и опасения, что применение NT для исследований может привести к применению NT для создания человека, способствовали появлению многочисленных общественных обсуждений и споров.
Партеногенетическую активацию ооцитов млекопитающих можно использовать в качестве альтернативы оплодотворению спермой/NT для подготовки ооцитов к получению эмбриональных стволовых клеток. Партеногенетическая активация представляет собой получение эмбриональных клеток из женской гаметы в отсутствие какого бы то ни было вклада мужской гаметы с последующим развитием во взрослую клетку или без него.
Первые партеногенетические стволовые клетки человека (hpSC) получали из внутренней клеточной массы бластоцист, полученных из неоплодотворенных ооцитов, которые активировали химическим стимулом. Эти клетки демонстрировали характеристики, типичные для эмбриональных стволовых клеток человека (hESC), например, обширное самообновление и дифференциация в клетки всех трех зародышевых листков in vitro и in vivo. Клетки pSC человека, гистосовместимые со значительной частью человеческой популяции вследствие наличия гомозиготных генотипов HLA, получали посредством альтернативного способа активации ооцитов (гомозиготных по всем локусам) или посредством спонтанной активации ооцитов с исключительной гомозиготностью HLA (гетерозиготные по большинству локусов, кроме HLA). Эти hpSC, совместимые по типичному HLA-гаплотипу, могут снижать риск иммунного отторжения после трансплантации их дифференцированных производных; таким образом, они предоставляют значительные преимущества в области клеточных терапий с применением hESC, полученных из оплодотворенных ооцитов, содержащих уникальные наборы генов HLA. Кроме того, создание hpSC преодолевает этические препятствия, связанные с hESC, поскольку hpSC получают из неоплодотворенных ооцитов.
Две многообещающих области применения плюрипотентных стволовых клеток включают заместительную клеточную терапию для лечения диабета или определенных заболеваний печени, связанных с недостаточностью гепатоцитов. Получение дефинитивной эндодермы (DE) высокой степени чистоты является критическим первым этапом получения терапевтически полезных клеток линии DE, таких как гепатоциты и панкреатические эндокринные клетки.
Дефинитивная эндодерма образуется в ходе гаструляции наряду с двумя другими основными зародышевыми листками - эктодермой и мезодермой, и в ходе развития дает начало желудочно-кишечному тракту и дыхательным путям, а также другим органам, включая печень и поджелудочную железу. Для эффективного получения DE из hESC необходимы два условия: активация членами семейства трансформирующих факторов роста β, таких как активин A или Nodal, а также освобождение от сигналов плюрипотентности и самообновления, которые образуются из инсулина/инсулиноподобного фактора роста, передающего сигнал через фосфатидилинозитол 3-киназу (PI3K). Кроме того, добавление Wnt3a вместе с активином A повышает эффективность спецификации мезэндодермы, бипотенциального прекурсора DE и мезодермы, и повышает синхронию, с которой hESC вступают на путь формирования DE.
Возможности развития DE, производных от hESC, демонстрировали как in vitro, так и in vivo. Различные протоколы дифференциации hESC, которые в качестве первого этапа применяют дифференциацию в обогащенные популяции DE, привели к получению гепатоцитоподобных клеток, которые демонстрируют некоторые характеристики зрелых гепатоцитов, или к получению островковых эндокриноподобных клеток, способных синтезировать панкреатические гормоны. Трансплантация клеток DE, полученных из hESC, под капсулу почки мышам с тяжелым комбинированным иммунодефицитом (SCID) привела к их дифференциации в более зрелые клетки эндодермальных органов, экспрессирующие CDX2, виллин и гепатоцит-специфичный антиген. В моделях на мышах с острым поражением печени показали, что полученные из hESC DE, которые далее дифференцировались в гепатоциты, заново заселяли поврежденную печень. Кроме того, показали, что клетки панкреатической эндодермы, дифференцировавшиеся из производных от hESC DE, развивались in vivo в глюкозо-зависимые эндокринные клетки, морфологически и функционально сходные с клетками панкреатических островков и защищающие мышей от вызванной стрептозотоцином гипергликемии.
Многочисленные исследования способствовали пониманию общих закономерностей экспрессии генов в плюрипотентных стволовых клетках и их вариаций, которые могут частично определять способность к дифференциации. Контроль экспрессии генов частично регулируется эпигенетическими механизмами, включая посттрансляционные модификации гистонов и метилирование ДНК. Молекулярные инструменты, нарушающие общие эпигенетические механизмы, могут способствовать пониманию генетических циклов, действующих в стволовых клетках. Одним кандидатом для общей эпигенетической модуляции является фармацевтическое средство TSA, эффективный ингибитор деацетилазы гистонов. Показано, что обработка TSA эмбриональных стволовых клеток мыши вызывает супрессию важных факторов плюрипотентности, включая Nanog, основной регулятор идентичности стволовых клеток, и активацию генов, связанных с дифференциацией. Интересно, что в этом исследовании эффект TSA не способствовал ходу или продвижению дифференциации; при удалении TSA клетки возвращались к недифференцированному фенотипу.
В настоящем документе предоставлен способ дифференциации стволовых клеток в клетки дефинитивной эндодермы, которые образуют высоко обогащенные культуры дифференцированных клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на фундаментальном открытии, что определенные условия являются оптимальными для образования клеток дефинитивной эндодермы клетки из стволовых клеток.
В связи с этим настоящее изобретение относится к способу получения клеток дефинитивной эндодермы, мезодермы, эктодермы или эндодермы посредством культивирования стволовых клеток в присутствии агента, где агент изменяет эпигенетический статус клетки; и последующее культивирование стволовых клеток в отсутствие агента, с получением таким образом, клеток дефинитивной эндодермы, мезодермы, эктодермы или эндодермы. В одном из аспектов получают клетки дефинитивной эндодермы.
В некоторых аспектах агент, изменяющий эпигенетический статус клетки, представляет собой агент, модифицирующий метилирование и/или агент, модифицирующий ацетилирование. В конкретных вариантах осуществления агент, изменяющий эпигенетический статус клетки, представляет собой деметилирующий агент или ингибитор деацетилазы гистонов (HDAC).
В некоторых вариантах осуществления стволовые клетки представляют собой эмбриональные стволовые клетки, партеногенетические стволовые клетки, соматические стволовые клетки или индуцированные плюрипотентные клетки (iPS). В определенных вариантах осуществления стволовые клетки представляют собой партеногенетические клетки. В одном из аспектов партеногенетические клетки представляют собой клетки клеточных линий LLC-6p, LLC-12ph, LLC-2p или LLC-15ph. В другом варианте осуществления стволовые клетки представляют собой клетки iPS.
В другом варианте осуществления культивирование стволовых клеток в отсутствие агента происходит в присутствии активина A, Wnt3a или их сочетания.
В некоторых вариантах осуществления клетки дефинитивной эндодермы экспрессируют один или несколько маркеров, выбранных из группы, состоящей из FoxA2, Sox17, CXCR4, брахиурии и CER1. В определенных вариантах осуществления клетки дефинитивной эндодермы не экспрессируют один или несколько маркеров, выбранных из группы, состоящей из E-кадгерина и Oct4, или экспрессируют пониженные уровни по сравнению с необработанными стволовыми клетки. В одном из аспектов этапы культивирования проводят в условиях сред определенного состава.
В некоторых вариантах осуществления клетки дефинитивной эндодермы дополнительно обрабатывают с формированием клеток желудочно-кишечного тракта, дыхательных путей или эндокринной системы. В других вариантах осуществления клетки дополнительно обрабатывают с формированием клеток печени или поджелудочной железы.
В другом варианте осуществления настоящего изобретения предоставлены культуры клеток дефинитивной эндодермы, полученных способом по изобретению. В одном из аспектов предоставлены культуры клеток печени или панкреатические клетки, дифференцированные из клеток эндодермы, полученных способами по изобретению.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 представлена схема предварительной обработки TSA наряду с процедурами дифференциации и экспрессией генов для некоторых ключевых маркеров дифференциации дефинитивной эндодермы.
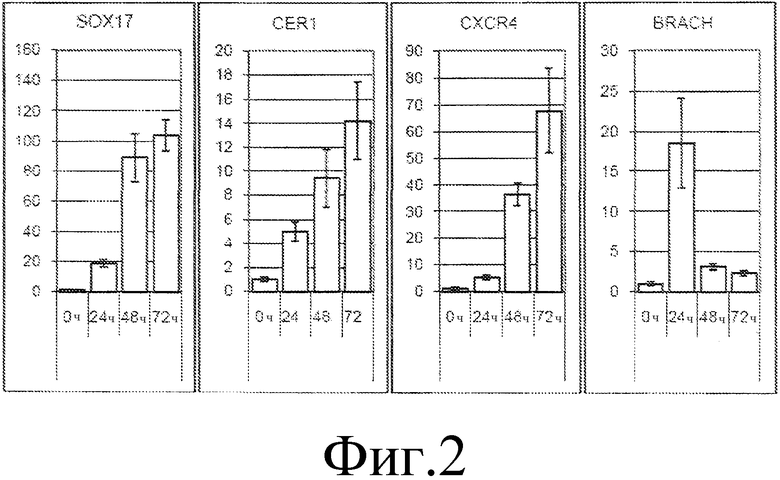
На фиг. 2 представлены графики временной динамики экспрессии маркерных генов в ходе дифференциации hpSC в дефинитивную эндодерму, определенной посредством количественной ПЦР в реальном времени. Обработка hpSC активином A и Wnt3a вызывает пиковую экспрессию гена брахиурии (BRACH), экспрессирующегося в первичной полоске, через 24 часа. Экспрессия SOX17, CER1 и CXCR4 является максимальной через 72 часа; 0 ч, плюрипотентные hpSC перед началом протокола дифференциации. На оси Y указана относительная экспрессия генов, нормированная на момент времени 0 ч.
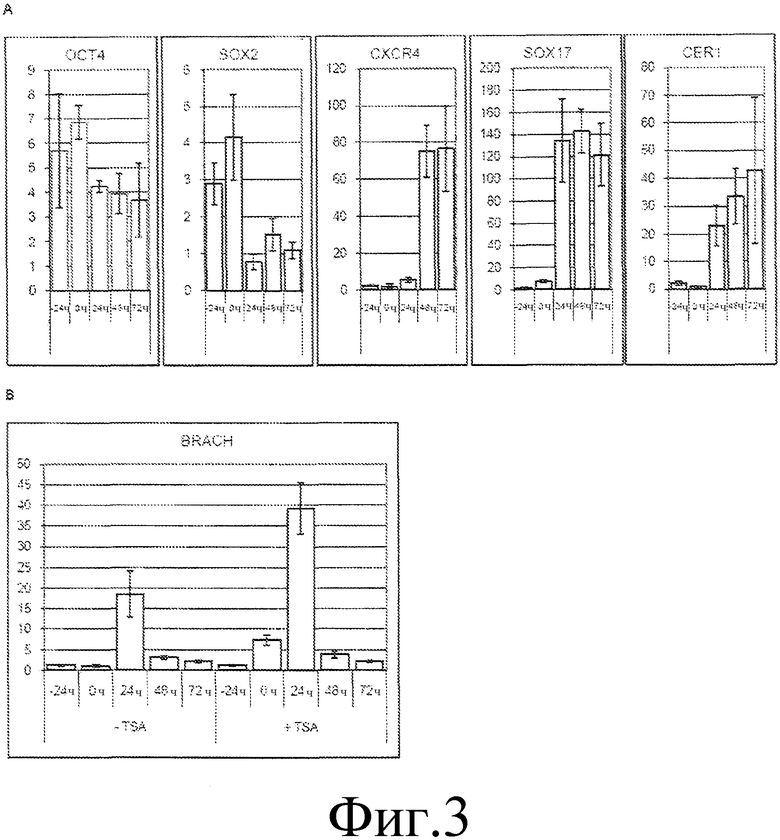
На фиг. 3 представлены графики временной динамики экспрессии маркерных генов в ходе дифференциации hpSC, предварительно обработанных TSA, в дефинитивную эндодерму, определенной посредством количественной ПЦР в реальном времени. Фиг. 4A показывает график эффекта предварительной обработки TSA на экспрессию генов плюрипотентности OCT4, SOX2, а также маркеров стадии дифференциации CER1, SOX17, CXCR4 в динамике по времени. Фиг. 4B показывает график экспрессии гена брахиурии (BRACH) с предварительной обработкой TSA и без нее.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Перед описанием настоящей композиции, способов и методик культивирования следует понимать, что данное изобретение не ограничено конкретными описанными композициями, способами и экспериментальными условиями, поскольку такие композиции, способы и условия могут варьировать. Также следует понимать, что терминология, применяемая в настоящем документе, предназначена только для описания конкретных вариантов осуществления и не предназначена для ограничения, поскольку объем настоящего изобретения будет ограничен только прилагаемой формулой изобретения.
В настоящем описании изобретения и прилагаемой формуле изобретения, формы единственного числа включают формы множественного числа, за исключением случаев, когда контекст ясно указывает на иное. Таким образом, например, ссылки на "способ" включают один или несколько способов, и/или этапов типа, описываемого в настоящем документе, что будет очевидно специалистам в данной области при чтении этого изобретения и т.д.
Если не указано иное, все технические и научные термины, применяемые в настоящем документе, имеют то же значение, что и общепринятое у специалистов в области, к которой относится настоящее изобретение. Любые способы и материалы, сходные или эквивалентные описываемым в настоящем документе, можно применять в практическом осуществлении или испытаниях по изобретению, поскольку следует понимать, что модификации и вариации включены в сущность и объем настоящего изобретения. Все публикации, упомянутые в настоящем документе, включены в настоящий документ в качестве ссылок в полном объеме.
Критический этап раннего развития человека, называемый гаструляцией, происходит через 2-3 недели после оплодотворения. Гаструляция имеет важнейшее значение, поскольку именно в это время впервые формируются и специализируются три первичных зародышевых листка. Эктодерма отвечает за окончательное формирование внешних покровов тела и всей нервной системы, тогда как сердце, кровь, кости, скелетные мышцы и другие соединительные ткани образуются из мезодермы. Как применяют в настоящем документе, "дефинитивная эндодерма" относится к зародышевому листку, который отвечает за формирование всей кишечной трубки, включая пищевод, желудок и тонкую и толстую кишку, и органов, которые образуются из кишечной трубки, таких как легкие, печень, тимус, паращитовидная железа и щитовидная железа, желчный пузырь и поджелудочная железа. Очень важно различать дефинитивную эндодерму и совершенно отдельную линию клеток, называемую примитивной эндодермой. "Примитивная эндодерма" главным образом отвечает за формирование внезародышевой ткани, в основном париетального и висцерального эндодермальных участков плацентарного желточного мешка и материала внеклеточного матрикса мембраны Рейхерта.
В ходе гаструляции процесс формирования дефинитивной эндодермы начинается с клеточной миграции, при которой клетки мезэндодермы (клетки, способные формировать мезодерму или эндодерму) мигрируют через структуру, называемую первичной полоской. Дефинитивная эндодерма образуется из клеток, которые мигрируют через передний участок полоски и через узел (специализированная структура в самом переднем участке полоски).
В ходе миграции дефинитивная эндодерма заселяет в первую очередь самый передний конец кишечной трубки и в завершение формирует задний конец кишечной трубки.
Исследования формирования дефинитивной эндодермы in vivo, такие как работы на данио и Xenopus Conlon et al., 1994; Feldman et al, 1998; Zhou et al., 1993; Aoki et al., 2002; Dougan et al., 2003; Tremblay et al., 2000; Vincent et al., 2003; Alexander et al., 1999; Alexander и Stainier, 1999; Kikuchi et al., 2001; Hudson et al., 1997 и на мышах Kanai-Azuma et al., 2002, закладывают основу того, как можно пытаться подходить к развитию типа клеток определенного зародышевого листка в чашке для культивирования с применением эмбриональных стволовых клеток человека. Существует два аспекта, связанных с культивированием ESC in vitro, которые представляют собой основные препятствия при попытках повторить развитие в чашке для культивирования. Во-первых, не образуются организованные структуры зародышевого листка или органа. Основная часть специфических для зародышевых листков и органов генетических маркеров неоднородно экспрессируется в дифференцирующейся культуре клеток hESC. Таким образом, из-за отсутствия точных границ органов сложно оценить формирование конкретной ткани или типа клеток. Почти все гены, экспрессирующиеся в одном типе клеток в пределах определенного зародышевого листка или типа ткани, экспрессируются также в других клетках другого зародышевого листка или типа ткани. В отсутствие точных границ остается значительно меньше способов определить специфичность экспрессии генов на маленьком образце из 1-3 генов. Таким образом, необходимо исследовать значительно больше генов, некоторые из которых должны быть в наличии, а также некоторые, которые не должны экспрессироваться в конкретном типе клеток органа или ткани, представляющих интерес. Во-вторых, временные паттерны экспрессии генов являются критическими для продвижения по определенному пути развития.
Чтобы еще больше усложнить предмет, следует отметить, что дифференциация стволовых клеток in vitro является довольно асинхронной, вероятно, значительно более асинхронной, чем in vivo. В связи с этим одна группа клеток может экспрессировать гены, связанные с гаструляцией, в то время как другая группа может вступать в конечную дифференциацию. Кроме того, воздействие на монослои hESC или эмбриоидные тельца (EB) с применением экзогенного фактора или без него может привести к сильным расхождениям в отношении всего паттерна экспрессии генов и этапа дифференциации. В связи с этим применение экзогенного фактора необходимо согласовывать во времени с паттернами экспрессии генов в смеси гетерогенных клеток для эффективного продвижения культуры по конкретному пути дифференциации. Также полезно учитывать морфологическую ассоциацию клеток в сосуде для культивирования. Способность оказывать равномерное воздействие на hESCs при их превращении в так называемые эмбриоидные тельца может быть менее оптимальной, чем выращивание и дифференцировка hESCs как монослоев и/или колоний hESC в сосуде для культивирования.
В связи с необходимостью эффективной дифференциации плюрипотентных клеток в клетки дефинитивной эндодермы некоторые аспекты по настоящему изобретению относятся к методикам in vitro, которые приводят к превращению приблизительно 75-99% плюрипотентных клеток в клетки дефинитивной эндодермы. Как правило, такие способы включают применение условий культивирования и факторов роста определенным способом с заданными временными рамками. Дальнейшее обогащение клеточной популяции для клеток дефинитивной эндодермы можно достигать посредством изоляции и/или очистки клеток дефинитивной эндодермы от других клеток в популяции посредством реагента, который специфически связывается с клетками дефинитивной эндодермы.
В связи с этим настоящее изобретение относится к способу получения клеток дефинитивной эндодермы, мезодермы, эктодермы или эндодермы посредством культивирования стволовых клеток в присутствии агента, где агент изменяет эпигенетический статус клетки; и затем культивирование стволовых клеток в отсутствие агента и, таким образом, получение клеток дефинитивной эндодермы, мезодермы, эктодермы или эндодермы. В одном аспекте получают клетки дефинитивной эндодермы.
В некоторых вариантах осуществления агент, изменяющий эпигенетический статус клетки, представляет собой агент, модифицирующий метилирование и/или агент, модифицирующий ацетилирование. В конкретных вариантах осуществления агент, изменяющий эпигенетический статус клетки, представляет собой деметилирующий агент или ингибитор деацетилазы гистонов (HDAC). Деметилирующий агент может представлять собой ингибитор метилтрансферазы ДНК, ингибитор метилирования гистонов и/или ингибитор деметилирования гистонов. В некоторых аспектах деметилирующий агент выбран из группы, состоящей из 5-азацитидина, 5-аза-2'-дезоксицитидина, 5-фторцитозина, псевдоизоцитозина, зебуларина, прокаинамида, полифенол (-)-эпигаллокатехин-3-галлата (EGCG) и псаммаплина. В определенных аспектах деметилирующий агент представляет собой 5-аза-2'-дезоксицитидин (DAC) или 5-азацитидин. В других вариантах осуществления модифицирующий ацетилирование агент представляет собой ингибитор деацетилазы гистонов (HDAC), ингибитор ацетилтрансферазы гистонов (HAT), деацетилазу гистонов и ацетилтрансферазу гистонов.
В некоторых вариантах осуществления ингибитор деацетилазы гистонов (HDAC) может представлять собой гидроксамовую кислоту, такую как трихостатин A, вориностат (SAHA), белиностат (PXD101) и LAQ824/LBH589; циклический тетрапептид (такой как трапоксин B), депсипептиды; бензамиды, такие как энтиностат (MS275), CI994 и моцетиностат (MGCD0103); электрофильный кетон; композицию из алифатических кислот, такую как фенилбутират и вальпроевая кислота, изовалерат, валерат или вальпроат, никотинамид, а также производные NAD, дигидрокумарин, нафтопиранон и 2-гидроксинафальдегиды; апицидин, FK228 и натрий бутират. В одном из вариантов осуществления ингибитор HDAC представляет собой гидроксамовую кислоту; в одном из аспектов, HDI представляет собой трихостатин A. В другом аспекте HDI представляет собой соединение, отличное от натрий бутирата. В некоторых аспектах ингибитор деацетилазы гистонов (HDAC) представляет собой трихостатин A (TSA), натрий бутират, субероиланилид гидроксамовой кислоты (SAHA) или N-нитрозо-n-метилмочевину. В других аспектах ингибитор ацетилтрансферазы гистонов (HAT) представляет собой полиизопренилированный бензофенон (гарцинол) и set/TAF-1 бета. В одном из аспектов применяют ингибитор деацетилазы гистонов трихостатин (TSA). В еще одном аспекте применяют комбинацию из 5-аза-2'-дезоксицитидина и трихостатина (TSA).
В одном из вариантов осуществления изобретения предоставлен способ получения клеток дефинитивной эндодермы в культуре посредством дифференциации стволовых клеток в мультипотентные клетки дефинитивной эндодермы при наличии предварительной обработки. В связи с этим в одном из вариантов осуществления способы по изобретению включают культивирование стволовых клеток в присутствии агента, где агент выбран из группы, состоящей из натрий бутирата, трихостатина A (TSA), их функциональных эквивалентов и их сочетания, и далее культивирование стволовых клеток в отсутствие агента с получением клеток дефинитивной эндодермы.
В некоторых вариантах осуществления стволовые клетки представляют собой эмбриональные стволовые клетки, партеногенетические стволовые клетки или индуцированные плюрипотентные стволовые (iPS) клетки или соматические стволовые клетки. В некоторых вариантах осуществления применяют гематопоэтические стволовые клетки (HSC), стволовые клетки, полученные из жировой ткани, мезенхимальные стволовые клетки (MSC), нейральные стволовые клетки, эндотелиальные стволовые клетки, стволовые клетки нервного валика или эмбриональные стволовые клетки (ESC). В определенных вариантах осуществления стволовые клетки представляют собой партеногенетические клетки. В одном из аспектов партеногенетические клетки представляют собой клетки клеточных линий LLC-6p, LLC-12ph, LLC-2p или LLC-15ph. В другом варианте осуществления стволовые клетки представляют собой клетки iPS.
В другом варианте осуществления культивирование стволовых клеток в отсутствие агента проводят в присутствии активина A, Wnt3a или их сочетания.
Стволовые клетки предварительно обрабатывают агентом в количестве, достаточном для изменения эпигенетического статуса стволовой клетки. Необходимое количество агента варьирует в зависимости от силы конкретного агента. Это количество легко определить способами, известными специалистам в данной области и предоставленными в настоящем документе. В одном из аспектов предварительное культивирование клеток в присутствии TSA проводят в течение приблизительно 12-48 часов и предпочтительно в течение приблизительно 24 часов. В другом аспекте культивирование в отсутствие TSA проводят в течение приблизительно 6-96 часов или приблизительно 6-72 часов, предпочтительно в течение приблизительно 24-72 часов. В другом варианте осуществления TSA присутствует в концентрации приблизительно от 1 нМ до 1 мкМ или приблизительно от 100 нМ до 1 мкМ. В другом варианте осуществления этапы культивирования проводят в условиях сред определенного состава.
В соответствии с определенными вариантами осуществления получают клетки дефинитивной эндодермы. Эти клетки могут представлять собой клетки млекопитающих, такие как клетки человека. В некоторых вариантах осуществления настоящего изобретения клетки дефинитивной эндодермы экспрессируют или не экспрессируют определенные маркеры. В одном неограничивающем аспекте один или несколько маркеров выбраны из SOX17, CXCR4, MIXL1, GATA4, HNF3b, GSC, FGF17, VWF, CALCR, FOXQ1, CMKOR1 и CRIP1, которые экспрессируются в клетках дефинитивной эндодермы. В другом варианте осуществления клетки дефинитивной эндодермы экспрессируют FoxA2 и/или Sox17. В другом варианте осуществления один или несколько маркеров, выбранных из OCT4, альфа-фетопротеина (AFP), тромбомодулина (TM), SPARC и SOX7, незначительно экспрессируются в клетках дефинитивной эндодермы. В другом варианте осуществления клетки дефинитивной эндодермы не экспрессируют E-кагерин и/или Oct4.
В некоторых вариантах осуществления клетки обрабатывают с получением клеток желудочно-кишечного тракта, дыхательных путей или эндокринной системы. Например, эндодермальные клетки могут дифференцироваться в клетки органов желудочно-кишечной системы, дыхательных путей или эндокринной системы. В определенных аспектах клетки далее обрабатывают с получением клеток печени или клеток поджелудочной железы. В некоторых вариантах осуществления изобретения предшественники гепатоцитов, которые начинают экспрессировать AFP (7 суток или 8 суток с начала дифференциации), можно использовать в трансплантации.
В других вариантах осуществления получают клетки мезодермы. Эти клетки можно далее обрабатывать с получением любых клеток, производных от линии мезодермы. В некоторых вариантах осуществления клетки мезодермы можно дифференцировать способами, известными в данной области, в костные клетки, мышечные клетки, соединительную ткань или клетки крови.
В других вариантах осуществления получают клетки эктодермы. Эти клетки можно далее обрабатывать с получением любых клеток, производных от линии эктодермы. В некоторых вариантах осуществления клетки эктодермы можно дифференцировать способами, известными в данной области, в клетки нервной системы или кожи.
В соответствии с другими вариантами осуществления настоящего изобретения описаны способы получения дефинитивной эндодермы из плюрипотентных клеток. В одном из вариантов осуществления плюрипотентные клетки получают из морулы. В другом варианте осуществления плюрипотентные стволовые клетки представляют собой стволовые клетки. Стволовые клетки, которые применяют в этих способах, могут включать в качестве неограничивающих примеров эмбриональные стволовые (ES) клетки. Клетки ES можно получать из эмбриональной внутренней клеточной массы или из эмбриональных половых гребней. Эмбриональные стволовые клетки можно получать от ряда видов животных, включая в качестве неограничивающих примеров различные виды млекопитающих, включая человека. В одном из вариантов осуществления для получения дефинитивной эндодермы используют эмбриональные стволовые клетки человека.
Клеточные культуры и композиции дефинитивной эндодермы, включающие клетки дефинитивной эндодермы, описываемые в настоящем документе, можно получать из плюрипотентных клеток, таких как эмбриональные стволовые клетки. Как применяют в настоящем документе, "эмбриональный" относится к ряду этапов развития организма, начиная с отдельной зиготы и заканчивая многоклеточной структурой, которая больше не содержит плюрипотентных или тотипотентных клеток, кроме сформировавшихся половых клеток. В дополнение к эмбрионам, полученным в результате слияния гамет, термин "эмбриональный" относится к эмбрионам, полученным в результате переноса ядер соматических клеток. В предпочтительном способе получения клеток дефинитивной эндодермы в качестве исходного вещества для получения дефинитивной эндодермы применяют эмбриональные стволовые клетки человека (hESC). Эмбриональные стволовые клетки, которые применяют в этом способе, могут представлять собой клетки, полученные из морулы, эмбриональной внутренней клеточной массы или клетки, полученные из эмбриональных половых гребней. Стволовые клетки человека можно поддерживать в культуре в плюрипотентном состоянии посредством способов, известных в данной области. Такие способы описаны, например, в патентах США №№ 5453357, 5670372, 5690926 5843780, 6200806 и 6251671, описания которых включены в настоящий документ в качестве ссылок в полном объеме.
Эмбриональные стволовые клетки человека, используемые в настоящем документе, можно поддерживать в культуре как с сывороткой, так и без нее. В некоторых вариантах осуществления используют заменитель сыворотки. В других вариантах осуществления используют бессывороточные способы культивирования, такие как описанные в патентной заявке США № 2003/0190748, описание которой включено в настоящий документ в качестве ссылки в полном объеме.
Стволовые клетки посредством стандартного пассирования поддерживают в культуре в плюрипотентном состоянии до тех пор, пока не потребуется их дифференциация в дефинитивную эндодерму. В одном из вариантов осуществления дифференциацию в дефинитивную эндодерму вызывают добавлением в культуру стволовых клеток фактора роста суперсемейства TGFβ в количестве, достаточном для активации дифференциации в дефинитивную эндодерму. Факторы роста суперсемейства TGFβ, которые применяют для получения дефинитивной эндодермы, выбраны из супергрупп Nodal/активин или BMP. В одном из вариантов осуществления фактор роста выбран из группы, состоящей из Nodal, активина A, активина B и BMP4. Дополнительно, для получения клеток дефинитивной эндодермы применяют фактор роста Wnt3a и другие члены семейства Wnt. В другом варианте осуществления можно применять комбинации любых указанных выше факторов роста.
Как применяют в настоящем документе, "партеногенез" относится к процессу, посредством которого активация ооцита происходит в отсутствие проникновения спермы, и относится к ранней стадии развития эмбриона, содержащего трофэктодерму и внутреннюю клеточную массу, который получают посредством активации ооцита или эмбриональной клетки, например, бластомера, содержащей ДНК только женского происхождения. В связи с этим "партенот" относится к конечной клетке, полученной посредством такой активации. Далее, "бластоциста" относится к стадии дробления оплодотворенного или активированного ооцита, которая представляет собой полый шар клеток, составленный из внешних клеток трофобласта и внутренней клеточной массы (ICM). Таким образом, "формирование бластоцисты" относится к процессу, происходящему после оплодотворения или активации ооцита, где ооцит затем культивируют в среде в течение времени, позволяющего ему развиться в полый шар клеток, составленный внешними клетками трофобласта и ICM (например, от 5 до 6 суток).
Как применяют в настоящем документе, "активация" относится к процессу, где оплодотворенный или неоплодотворенный ооцит, находящийся, в качестве неограничивающих примеров, в метафазе II мейоза, претерпевает процесс, как правило, включающий расхождение пар хроматид и выталкивание второго полярного тельца, в результате чего ооцит содержит гаплоидное число хромосом, каждая из которых состоит из одной хроматиды. Активация включает способы, посредством которых клетку, содержащую ДНК только мужского или женского происхождения, стимулируют к развитию в эмбрион, содержащий видимую внутреннюю клеточную массу и трофэктодерму, который применяют для получения плюрипотентных клеток, но который сам по себе, видимо, не способен к развитию в жизнеспособного потомка. Активацию можно проводить, например, при одном из следующих условий: (1) условия, которые не вызывают выталкивание второго полярного тельца; (ii) условия, которые вызывают выталкивание полярного тельца, но при которых ингибируют выталкивание полярного тельца; или (iii) условия, которые сдерживают первое клеточное деление гаплоидного ооцита.
В то время как патогенез является нередкой формой размножения в природе, у млекопитающих такая форма размножения неизвестна. Однако в ооцитах самок инбредной линии мышей LT/Sv можно обнаружить 10% случаев спонтанного партеногенеза (Ozil and Huneau, Development (2001) 128:917-928; Vrana et al., Proc Natl Acad Sci USA (2003) 100(Suppl 1):11911-11916; Berkowitz and Goldstein, New Eng J Med (1996) 335(23): 1740-1748). Ооциты плацентарных млекопитающих можно стимулировать к прохождению партеногенеза in vitro; однако эмбриональное развитие не является успешным.
Как применяют в настоящем документе, "мультипотентный" или "мультипотентная клетка" относится к типу клеток, которые могут давать начало ограниченному количеству других определенных типов клеток. Как описано выше, клетки дефинитивной эндодермы не дифференцируются в ткани, производные от эктодермы или мезодермы, а дифференцируются в кишечную трубку, а также органы, производные от кишечной трубки. В одном из вариантов осуществления клетки дефинитивной эндодермы получают из hESC. Такие способы могут служить основой для эффективного получения тканей человека, производных от эндодермы, таких как поджелудочная железа, печень, легкое, желудок, кишечник и щитовидная железа. Например, получение дефинитивной эндодермы может являться первым этапом дифференциации стволовой клетки в функциональную инсулин-продуцирующую β-клетку. Для получения эффективного количества инсулин-продуцирующих β-клеток желательна высокая эффективность дифференциации на всех этапах дифференциации, которые происходят перед дифференциацией в клетку панкреатического островка/β-клетку. Поскольку дифференциация стволовых клеток в клетки дефинитивной эндодермы представляет собой, по-видимому, самый ранний этап на пути получения клеток панкреатического островка/β-клеток, крайне желательна высокая эффективность дифференциации на этом этапе.
Как применяют в настоящем документе, "плюрипотентная клетка" относится к клетке, полученной от эмбриона, образованного посредством активации клетки, содержащей ДНК только женского или мужского происхождения, которую можно поддерживать в недифференцированном состоянии in vitro в течение длительного, теоретически бесконечного периода времени и которая может давать начало различным дифференцированным типам тканей, т.е. эктодерме, мезодерме и эндодерме. Плюрипотентное состояние клеток предпочтительно поддерживают посредством культивирования внутренней клеточной массы или клеток, полученных из внутренней клеточной массы эмбриона, образованного посредством андрогенетических или гиногенетических способов при соответствующих условиях, например, посредством культивирования на фидерном слое фибробласта или другом фидерном слое или культуре, которая включает лейкоз-ингибирующий фактор (LIF). Плюрипотентное состояние культивированных таким образом клеток можно подтверждать различными способами, например, (i) подтверждением экспрессии маркеров, характерных для плюрипотентных клеток; (ii) получением химерных животных, которые имеют клетки, экспрессирующие набор генов плюрипотентных клеток; (iii) введением клеток животным, например, мышам SCID, с получением различных дифференцированных типов клеток in vivo; и (iv) наблюдением за дифференциацией клеток (например, при культивировании в отсутствие фидерного слоя или LIF) в эмбриоидные тельца и другие дифференцированные типы клеток in vitro.
Как применяют в настоящем документе, "дифференциация" относится к изменению, которое происходит в клетках, заставляя эти клетки выполнять определенные специализированные функции и терять способность к превращению в другие определенные специализированные функциональные единицы. Клетки, способные к дифференциации, могут являться тотипотентными, плюрипотентными или мультипотентными клетками. В отношении зрелых взрослых клеток дифференциация может являться частичной или полной.
Чтобы определить количество клеток дефинитивной эндодермы в клеточной культуре или клеточной популяции, желательно применять способ различения этого типа клеток с другими клетками в культуре или в популяции. Таким образом, в одном из вариантов осуществления способы далее относятся к клеточным маркерам, присутствие, отсутствие и/или относительные уровни экспрессии которых являются специфичными для дефинитивной эндодермы. Как применяют в настоящем документе, "экспрессия" относится к образованию вещества или продукта, а также к уровню или количеству производства вещества или продукта. Таким образом, определение экспрессии конкретного маркера относится к измерению относительного или абсолютного количества экспрессирующегося маркера или просто выявлению присутствия или отсутствия маркера. Как применяют в настоящем документе, "маркер" относится к любой молекуле, которую можно заметить или обнаружить. Например, маркер может включать в качестве неограничивающих примеров нуклеиновую кислоту, такую как транскрипт определенного гена, полипептидный продукт гена, полипептид, не являющийся продуктом гена, гликопротеин, углевод, гликолипид, липид, липопротеин или низкомолекулярное соединение.
Например, в одном из вариантов осуществления присутствие, отсутствие и/или уровень экспрессии маркера определяют посредством количественной ПЦР (Q-ПЦР). Примеры генетических маркеров включают в качестве неограничивающих примеров такие как FoxA2, Sox17, CXCR4, Oct4, AFP, TM, SPARC, Sox7, MIXL1, GATA4, HNF3b, GSC, FGF17, VWF, CALCR, FOXQ1, CMKOR1, CRIP1, E-кадгерин и другие маркеры, которые можно обнаружить посредством количественной Q-ПЦР. В другом варианте осуществления для обнаружения белков, экспрессирующихся на указанных выше генах, применяют иммуногистохимию. В другом варианте осуществления для идентификации и определения количества или относительных пропорций таких маркеров применяют как Q-ПЦР, так и иммуногистохимические способы.
В связи с этим возможна идентификация клеток дефинитивной эндодермы, а также определение доли клеток дефинитивной эндодермы клетки в клеточной культуре или клеточной популяции. Например, в одном из вариантов осуществления полученные клетки дефинитивной эндодермы или клеточные популяции экспрессируют FoxA2 и/или Sox17, но не экспрессируют Oct4 и/или E-кадгерин.
В другом варианте осуществления изобретение предоставляет клеточные культуры, содержащие дефинитивную эндодерму, а также клеточные популяции, обогащенные клетками дефинитивной эндодермы. Так, в одном из вариантов осуществления приблизительно 50-99%, 60-99%, 70-99%, 75-99%, 80-99%, 85-99%, 90-99% или 95-99% клеток в культуре являются клетками дефинитивной эндодермы. В другом варианте осуществления предполагается превращение популяции плюрипотентных клеток, такой как популяция стволовых клеток, в по существу чистую популяцию клеток дефинитивной эндодермы.
Как применяют в настоящем документе, "условия сред определенного состава" относятся к средам для культивирования клеток, для которых определена концентрация компонентов, необходимая для оптимального роста. Например, в зависимости от области применения клеток (например, терапевтическое применение), важно удаление клеток из условий, содержащих ксеногенные белки; т.е. условия культивирования представляют собой условия, лишенные животных организмов или лишенные не относящихся к человеку животных белков.
В некоторых вариантах осуществления условия культивирования после предварительной обработки включают применение больших количеств активина A на 1, 2 и 3 сутки дифференциации. Другие варианты осуществления включают применение Wnt3a на первые сутки дифференциации, после этапа предварительной обработки. В других вариантах осуществления условия культивирования включают применение FGF4 и BMP2 с 4 до 8 сутки дифференциации. В дополнительных вариантах осуществления с 1 до 8 суток дифференциации можно применять основную среду для дифференциации: RPMI 1640, дополненную Glutamax I и 5% сывороточным альбумином человека. Однако другие варианты осуществления включают применение среды без сыворотки на 1 сутки дифференциации. В одном из аспектов применяют среду с низким содержанием сыворотки (0,2% сыворотки) на 2 и 3 сутки дифференциации. В другом аспекте применяют 2% сыворотку в среде для дифференциации в течение четырех суток с 4 до 8 суток дифференциации.
"Дифференцированная клетка" относится к неэмбриональной клетке, которая находится в определенном дифференцированном, т.е. неэмбриональном, состоянии. Три самых ранних типа дифференцированных клеток представляют собой эндодерму, мезодерму и эктодерму.
Плюрипотентное состояние клеток, которое применяют в настоящем изобретении, можно подтверждать различными способами. Например, клетки можно проверять на наличие или отсутствие характерных маркеров клеток ES. В случае клеток ES человека примеры таких маркеров приведены выше и включают SSEA-4, SSEA-3, TRA-1-60, TRA-1-81 и OCT 4 и являются известными в данной области.
Также плюрипотентность можно подтверждать посредством введения клеток подходящим животным, например, мышам SCID, и наблюдения за образованием дифференцированных клеток и тканей. Еще один способ подтверждения плюрипотентности заключается в применении представляющих интерес плюрипотентных клеток для получения химерных животных и наблюдении за вкладом введенных клеток в различные типы клеток. Способы получения химерных животных хорошо известны в данной области и описаны в патенте США № 6642433, включенном в настоящий документ посредством ссылки.
Еще один способ подтверждения плюрипотентности заключается в наблюдении за дифференциацией клеток ES в эмбриоидные тельца и другие дифференцированные типы клеток при культивировании в условиях, способствующих дифференциации (например, удаление фидерных слоев фибробласта). Этот способ применяли и подтвердили, что представляющие интерес плюрипотентные клетки дают начало эмбриоидным тельцам и различным дифференцированным типам клеток в культуре ткани.
Получаемые плюрипотентные клетки и клеточные линии, предпочтительно плюрипотентные клетки и клеточные линии человека, производные от ДНК полностью женского происхождения, имеют многочисленные терапевтические и диагностические области применения. Такие плюрипотентные клетки можно применять в клеточной трансплантации или генотерапии (если они являются генетически модифицированными) для лечения многочисленных болезненных состояний.
В связи с этим известно, что эмбриональные стволовые (ES) клетки мыши способны к дифференциации почти в любой тип клеток. Таким образом, плюрипотентные (ES) клетки человека, полученные по изобретению, должны иметь сходные способности к дифференциации. Плюрипотентные клетки по изобретению стимулируют к дифференциации для получения желаемых типов клеток согласно известным способам. Например, клетки ES человека, получаемые по изобретению, можно стимулировать к дифференциации в гематопоэтические стволовые клетки, мышечные клетки, клетки сердечной мышцы, клетки печени, островковые клетки, клетки сетчатки, хрящевые клетки, эпителиальные клетки, клетки мочевыводящих путей и т.д., посредством культивирования таких клеток в среде для дифференциации и при условиях, которые обеспечивают дифференциацию клеток. Среда и способы, которые приводят к дифференциации клеток ES, известны в данной области как подходящие условия культивирования.
Например, Palacios et al, Proc. Natl. Acad. SdL, USA, 92:7530-7537 (1995) сообщают о получении гематопоэтических стволовых клеток из эмбриональной клеточной линии посредством применения к стволовым клеткам процедуры индукции, которая вначале включает культивирование агрегатов таких клеток в суспензионной среде для культивирования, лишенной ретиноевой кислоты, с последующим культивированием в той же среде, содержащей ретиноевую кислоту, с последующим переносом клеточных агрегатов на субстрат, который обеспечивает прикрепление клеток.
Кроме того, Pedersen, J. Reprod. Fertil. Dev., 6:543-552 (1994) представляет собой обзорную статью, которая ссылается на многочисленные статьи, раскрывающие способы дифференциации эмбриональных стволовых клеток in vitro для получения различных дифференцированных типов клеток, включая, помимо прочего, гематопоэтические клетки, мышцы, сердечную мышцу, нервные клетки.
В настоящем документе предоставлено исследование, которое демонстрирует, что применение предварительно обработанных TSA недифференцированных hpSC может повышать эффективность дифференциации дефинитивной эндодермы (DE) с применением протокола дифференциации для hESC. Эта предварительная обработка приводит к увеличению количества клеток дефинитивной эндодермы до 70% по сравнению с максимальным 45% для hpSC без предварительной обработки. Не связываясь с какой-либо конкретной теорией, предполагают, что подавление деацетилаз гистонов, вызванное обработкой TSA, вызывает реорганизацию структуры хроматина недифференцированных hpSC, что повышает способность недифференцированных клеток отвечать на воздействие активина A и Wnt3a, которое обеспечивается средой. Показано, что основные архитектурные белки хроматина являются гипердинамичными и неплотно связываются с хроматином в эмбриональных стволовых клетках, однако при дифференциации гипердинамичные белки иммобилизуются на хроматине (Meshorer et al., Dev Cell 10(1):105-16, 2006). Karanzali et al (Genome Biol 9(4):R65, 2008) предположили, что перед окончательным переходом к дифференцированному фенотипу может возникать окно "сверх-доступности" хроматина, и обработка недифференцированных ESC TSA может способствовать этому переходному этапу.
Одним из возможных следствий реорганизации структуры хроматина может являться измененная способность к экспрессии гена брахиурии. В культурах hpSC, обработанных TSA в течение 24 часов, наблюдали существенно более высокие уровни транскриптов гена брахиурии. Кроме того, культуры, обработанные TSA, демонстрировали более быстрое исчезновение брахиурии на 2 сутки дифференциации. Эти наблюдения подтверждались для всех четырех изученных линий hpSC. Ранее показано, что высоко обогащенная дефинитивная эндодерма образуется в культурах, которые осуществляют экспрессию гена брахиурии в форме пика: положительная генная регуляция изменяется посредством быстрой нисходящей регуляции в течение первых 48 часов воздействия активина A (D'Amour et al, Nat. Biotechnol 23:1534-41, 2005). Не связываясь с какой-либо конкретной теорией, мы предполагаем, что наблюдаемый эффект брахиурии, вызванный TSA, может способствовать синхронному переходу hpSC через промежуточный этап первичной полоски, что приводит к получению большего количества дефинитивной эндодермы.
Наши наблюдения показывают, что тип клеток, полученный от hpSC, обработанных TSA, является настоящей дефинитивной эндодермой. Маркерный анализ уровней белка и РНК соответствует формированию DE и исключает возможность получения значительных уровней внезародышевой эндодермы или других линий. Кроме того, DE, производные от hpSC, перед экспрессией маркеров, таких как CER1, SOX17 и CXCR4, сначала проходят через пик экспрессии гена брахиурии. Это напоминает о развитии DE из промежуточного этапа первичной полоски в эмбрионе позвоночных. Наблюдения, что экспрессия SOX17 инициируется в прямых предшественниках брахиурии, далее подтверждает вывод, что SOX17-позитивные клетки представляют собой дефинитивную эндодерму, а не примитивную эндодерму, поскольку экпрессия гена брахиурии в линии примитивной эндодермы не обнаружена (Wilkinson D.G. et al., Nature 343:657-9, 1990). Как ранее описано для формирования DE из hESC, мы наблюдали снижение экспрессии E-кадгерина после обработки активином A, соответствующее дифференциации, связанной с превращением эпителия в мезенхиму, таким же, как в первичной полоске (D'Amour et al, Nat. Biotechnol 23:1534-41, 2005).
Другие отчеты описывают применение различных ингибиторов деацетилазы гистонов, натрий бутирата (NaB), во время получения типов эндодермальных клеток из hESC. В отличие от нашего протокола, ингибитор деацетилазы гистонов применяли в течение длительного времени одновременно с добавлением активина A (Jiang J. et al., Stem Cells 25(8): 1940-53, 2007; Hay D. et al., PNAS 105(34):12301-6, 2008; и Hay D. et al., Stem Cells 26(4):894-902, 2008). Мы обнаружили, что так же, как для TSA, применение предварительной обработки NaB hpSC также увеличивало долю DE, полученных из hpSC. Однако NaB или TSA, добавленные одновременно с активином A, не приводили к повышению доли DE, полученных из hpSC. Не связываясь с какой-либо конкретной теорией, возможно, что hpSC и hESC различаются по структуре хроматина в базальном состоянии и, таким образом, различаются по своей чувствительности к ингибиторам деацетилазы гистонов.
О способности hpSC к дифференциации известно очень немногое, поскольку все раннее опубликованные данные демонстрируют только их способность к спонтанной дифференциации in vitro и in vivo (Revazova et al, Cloning Stem Cells 9(3):432-49, 2007; Revazova et al, Cloning Stem Cells 10(1): 11-24, 2008; Lin et al, Клетка Research 17:999-1007, 2007; Mai et al, Клетка Research 17:1008-1019, 2007). Некоторые данные, касающиеся партеногенетических стволовых клеток, полученных от животных, позволяют предположить, что партеногенетические плюрипотентные стволовые клетки способны к полноценному развитию и могут дифференцироваться в зрелые и функциональные клетки тела. Дофаминовые нейроны, полученные от партеногенетических стволовых клеток приматов, демонстрировали стабильную экспрессию специфичных для среднего мозга и клеточно-специфичных факторов транскрипции, что подтверждает их правильную идентичность и способствует их выживанию; далее, трансплантация этих партеногенетических дофаминовых нейронов восстанавливает двигательные функции у крыс с гемипаркинсонизмом, лишенных 6-гидрокси-дофамина. Кроме того, из культивированных in vitro партеногенетических стволовых клеток мышей получали живых потомков-партенотов посредством тетраплоидной комплементации эмбриона, что способствовало развитию плаценты.
Данные, приведенные в настоящем документе, показывают, что hpSC могут отвечать на сигналы прямой дифференциации, по меньшей мере, в направлении DE, и образовывать обогащенную популяцию дифференцированных клеток того же типа. Выявлено, что обработка недифференцированных hpSC ингибитором деацетилазы гистонов TSA перед добавлением воздействия активина A усиливает развитие DE. Эта работа предоставляет первый этап получения терапевтически полезных, гистосовместимых клеток линии дефинитивной эндодермы, таких как гепатоциты и панкреатические эндокринные клетки, из hpSC.
Следующие примеры предназначены для иллюстрации, а не для ограничения объема изобретения.
ПРИМЕР 1
ПОЛУЧЕНИЕ КЛЕТОК ДЕФИНИТИВНОЙ ЭНДОДЕРМЫ
Следующий пример демонстрирует получение эндодерма-подобных клеток, производных от партеногенетических клеточных линий LLC-12ph и LLC-6p. Эти эндодерма-подобные клетки получали согласно протоколу различных сред для культивирования (D1 - активин A+Wnt3a; D2 - активин A; D3 - активин A; см. табл. 1-4, ниже). Однако перед культивированием партеногенетические клетки подвергали воздействию агента для предварительной обработки (трихостатин A (TSA)).
Таким образом, протокол получения клеток дефинитивной эндодермы является следующим: (i) добавление 100 мкМ трихостатина A (TSA) в среду для культивирования (среда для культивирования phSC+TSA) и культивирование клеток в течение приблизительно 24 часов; (ii) культивирование клеток в среде phSC для культивирования + TSA в течение приблизительно 24 часов; (iii) удаление TSA из культуры (т.е., культивирование клеток в среде для культивирования D1 в течение приблизительно 24 часов); (iv) культивирование клеток в среде для культивирования D2 в течение приблизительно 24 часов; и (v) культивирование клеток в среде для культивирования D3 в течение приблизительно 24 часов.
Иммуноокрашивание показало поверхностный маркер экспрессии FoxA2 (фактор транскрипции) для партеногенетически полученных клеток LLC-6p и отсутствие экспрессии E-кадгерина, маркера недифференцированных клеток. Действительно, подавляющее большинство клеток экспрессировало FoxA2.
Иммуноокрашивание колонии дифференцированных клеток, производных от линии партеногенетических стволовых клеток LLC-6p, показало экспрессию Sox17 (фактор транскрипции), одного из маркеров дефинитивной эндодермы, но не экспрессию Oct4, маркера недифференцированных клеток. В примерном эксперименте большая часть клеток экспрессировала Sox17, и только единичные клетки экспрессировали Oct4. Oct4-позитивные клетки оставались в колонии в виде маленькой "шапочки". Эксперименты по колонизации показали, что большая часть клеток экспрессирует либо Sox17, либо Oct4. В связи с этим, клетки либо становятся дефинитивной эндодермой, либо не дифференцируются, т.е., других типов клеток не обнаружили.
ПРИМЕР 2
ПАРТЕНОГЕНЕТИЧЕСКИЕ СТВОЛОВЫЕ КЛЕТКИ ЧЕЛОВЕКА ОБРАЗУЮТ ОБОГАЩЕННЫЕ ПОПУЛЯЦИИ КЛЕТОК ДЕФИНИТИВНОЙ ЭНДОДЕРМЫ ПОСЛЕ ПРЕДВАРИТЕЛЬНОЙ ОБРАБОТКИ ТРИХОСТАТИНОМ A
Следующий пример иллюстрирует направленную дифференциацию партеногенетических стволовых клеток человека (hpSC) для получения обогащенных популяций дефинитивной эндодермы. Кроме того, показано, что обработка недифференцированных hpSC трихостатином A (TSA) перед применением протокола направленной дифференциации значительно увеличивает долю клеток дефинитивной эндодермы в конечной популяции. Предварительно обработанные TSA, а также не обработанные TSA hpSC, претерпевавшие дифференциацию в дефинитивную эндодерму, демонстрировали сходную временную последовательность экспрессии генов с той, что наблюдается в ходе дифференциации дефинитивной эндодермы во время гаструляции позвоночных и дифференциации hESC в дефинитивную эндодерму. Получение линий дефинитивной эндодермы из hpSC представляет собой важнейший первый этап на пути развития клеточных терапий заболеваний печени и поджелудочной железы, например, начиная с hpSC.
Клеточная культура. Недифференцированные hpSC и hESC поддерживали на фидерных слоях фибробласта эмбриона мыши в KnockOut DMEM/F12 (Invitrogen), дополненной 15% заменителем сыворотки KnockOut (Invitrogen), 0,05 мМ заменимых аминокислот (NEAA) (Invitrogen), 2 мМ Glutamax-I (Invitrogen), пенициллином/стрептомицином (Invitrogen), 55 мкМ 2-меркаптоэтанолом (Invitrogen), 5 нг/мл рекомбинантного основного FGF человека (PeproTech) и 20 нг/мл рекомбинантного активина A человека (R&D Systems); для предварительной обработки TSA среду для культивирования дополняли 100 нМ TSA (Sigma) в течение 24 часов. Культуры вручную пересевали при индексе разведения 1:4-1:6 каждые 5-7 суток. Дифференциацию проводили в RPMI 1640 (Invitrogen), дополненном Glutamax-I, пенициллином/стрептомицином, 0,5 мг/мл сывороточного альбумина человека (Sigma), 100 нг/мл рекомбинантного активина A человека, 75 нг/мл рекомбинантного Wnt3a мыши (R&D Systems) в течение только первых 24 часов. В последующие сутки дифференциации применяли среду RPMI 1640, дополненную 0,2% сывороткой AB человека (Fisher BioReagents) и 100 нг/мл рекомбинантного активина A человека. Перед инициацией дифференциации стволовые клетки кратковременно промывали в DPBS (HyClone). На фиг. 1 представлена схема предварительной обработки TSA наряду с процедурами дифференциации и экспрессией генов для некоторых ключевых маркеров дифференциации дефинитивной эндодермы. Протокол разделен на два этапа: этап предварительной обработки TSA (оранжевый цвет) и этап дифференциации DE (зеленый цвет). Предварительную обработку TSA проводили при условиях культивирования, которые поддерживают состояние плюрипотентности hpSC в течение временного интервала от "-24" часов до "0" часов. Дифференциацию начинают с момента времени "0" часов посредством добавления воздействия активина A- и Wnt3a- и удаления TSA из среды для культивирования. Приведено несколько маркеров, характерных для каждой клеточной популяции. Знак "+" обозначает динамику экспрессии генов в ходе дифференциации и не отражает точное количество маркерной мРНК/белка.
Иммуноокрашивание. Культуры фиксировали в течение 20 минут при комнатной температуре в 4% масс./об. параформальдегиде в PBS и пермеабилизировали в течение 40 минут в 0,1% Triton X-100 в PBS. Применяли следующие антитела и разбавления: анти-Sox17 крысы, 1:500 (D'Amour et al, Nat. Biotechnol 23:1534-41, 2005); анти-брахиурия козы (AF 2085, R&D Systems), 1:100; анти-Oct-4 кролика (sc-9081, Santa Cruz Biotechnology); анти-E-кадгерин мыши (13-700, Invitrogen), 1:100; конъюгированные антитела осла к мыши Alexa-488 и Alexa-546, козе, крысе и кролику (Invitrogen), 1:1000. Препараты помещали в заливочную среду Vectashield, содержащую DAPI (Vector Laboratories).
Количественная ПЦР в реальном времени. Сбор образцов, обратная транскрипция и реакции ПЦР в реальном времени описаны ранее (D'Amour et al, Nat. Biotechnol 23:1534-41, 2005).
Проточная цитометрия. Клетки разделяли с применением TrypLE (Invitrogen) в течение 5 минут, затем осаждали и ресуспендировали в PBS с 3% FBS (буфер). Мечение проводили посредством CXCR4-PE (555976, BD Biosciences) при 10 мкл на 1·106 клеток в течение 30 минут при комнатной температуре. Клетки промывали в буфере и ресуспендировали в 1% масс./об. параформальдегиде. Данные проточной цитометрии получали на Beckton Dickinson FACS Caliber и анализировали с применением программного обеспечения FACSDiva (BD Bioscience).
Предварительная обработка TSA увеличивает долю дефинитивной эндодермы. Согласно ранее описанным протоколам (D'Amour et al, Nat Biotechnol 23:1534-41, 2005; и D'Amour et al, Nat Biotechnol 24:1392-401, 2006), hpSC дифференцировали в дефинитивную эндодерму (DE) с применением условий с низким содержанием сыворотки, содержащей активин A, в течение 3 суток. Кроме того, в течение первых 24 часов дифференциации добавляли Wnt3a с целью синхронизировать начало дифференциации hpSC и улучшения характеристик мезэндодермы. При применении этого подхода наблюдали ассоциированную с дефинитивной эндодермой позвоночных экспрессию генов, включая SOX17 и CXCR4, а экспрессия CER1 предполагает, что получали DE раннего типа (фиг. 2). Наблюдали кратковременное повышение экспрессии гена брахиурии через 24 часа, указывающее на переход через промежуточный этап мезэндодермы. В то время как через 3 суток часть hpSC дифференцировалась в DE, экспрессирующие SOX17, также наблюдалась значительная часть клеток, которые поддерживали экспрессию маркера плюрипотентности OCT4 и не экспрессировали SOX17. После дифференциации в течение 72 часов, клетки, иммунореактивные к SOX17, являлись самыми многочисленными в культурах hpSC, обработанных TSA перед применением условий дифференциации. Относительная доля клеток SOX17+ являлась меньшей, чем доля клеток, иммунореактивных к OCT4, в необработанных культурах hpSC, подвергавшихся той же процедуре дифференциации.
На фиг. 2 представлены графики временной динамики экспрессии маркерных генов в ходе дифференциации hpSC в дефинитивную эндодерму, определенной посредством количественной ПЦР в реальном времени. Обработка hpSC активином A и Wnt3a вызывает пиковую экспрессию гена брахиурии (BRACH), экспрессирующегося в первичной полоске, через 24 часа. Экспрессия SOX17, CER1 и CXCR4 является максимальной через 72 часа; 0 ч, плюрипотентные hpSC перед началом протокола дифференциации. На оси Y указана относительная экспрессия генов, нормированная на момент времени 0 ч.
Для повышения эффективности получения дефинитивной эндодермы и снижения числа остающихся OCT4-позитивных клеток рассмотрели несколько различных подходов к изменению способности hpSC отвечать на стимулы дифференциации. Показано, что обработка hpSC TSA в течение 24 часов значительно увеличила долю экспрессирующей SOX17 дефинитивной эндодермы. Относительная доля производной от hpSC дефинитивной эндодермы, полученной с предварительной обработкой TSA или без нее, определена посредством иммунолокализации SOX17. Доли SOX17-позитивных клеток, производных от предварительно обработанных TSA hpSC, превышали 70% через 72 часа дифференциации. Кроме того, посредством проточной цитометрии для рецептора хемокина клеточной поверхности CXCR4 определили долю клеток дефинитивной эндодермы. В отличие от hpSC, не подвергавшихся предварительной обработке, которые через 3 суток дифференциации всегда образовывали менее 45% CXCR4-позитивных клеток, предварительно обработанные TSA hpSC демонстрировали значительно улучшенную дифференциацию в дефинитивную эндодерму, что подтверждается долями CXCR4-позитивных клеток, составлявшими 70%.
hpSC дифференцируются в дефинитивную эндодерму через промежуточный этап первичной полоски. Показано, что предварительная обработка TSA недифференцированных hpSC вызывала некоторую гибель клеток, а также изменения в морфологии клеток. Однако значительных изменений в экспрессии генов плюрипотентности OCT4 и SOX2 или в экспрессии генов, ассоциированных с DE, включая CER1, SOX17 и CXCR4, не обнаружили, в то время как мы наблюдали слабую положительную регуляцию экспрессии гена брахиурии (фиг. 3A, 3B). Инициация выраженной дифференциации посредством добавления активина A и Wnt3a вызывала быструю индукцию экспрессии гена брахиурии одновременно со снижением экспрессии генов SOX2 и OCT4 (фиг. 3A, 3B). Кроме того, предварительно обработанные TSA hpSC показывали более высокий пиковый уровень экспрессии гена брахиурии через 24 часа и более резкую динамику пониженной экспрессии через 48 часов по сравнению с культурами, не обработанными TSA (фиг. 3B). Транскрипты CER1 и SOX17 также демонстрировали быстрое усиление экспрессии в течение первых 24 часов, в то время как экспрессия CXCR4 задерживалась на следующие 24 часа, и экспрессия этих маркеров DE сохранялась вплоть до 3 суток, когда брахиурию больше не обнаруживали (фиг. 3A). Ранее показали, что дифференциация hESC в DE происходит посредством процесса, напоминающего процесс, происходящий во время гаструляции, во время которого hESC претерпевают превращение из эпителия в мезенхиму, совпадающее во времени с началом экспрессии гена брахиурии и образованием SOX17-позитивных клеток из брахиурия-позитивных предшественников. Чтобы проследить происхождение экспрессирующих SOX17 клеток во время дифференциации hpSC, оценивали иммунореактивность к SOX17 и брахиурии в динамике по времени. Через 24 часа SOX17-позитивных клеток не оставалось, однако на периферии колоний наблюдали значительное количество брахиурия-позитивных ядер. Однако через 48 часов дифференциации больше половины клеток, экспрессирующих SOX17, являлись также иммунореактивными к брахиурии, а через 72 часа большая часть клеток экспрессировала SOX17, тогда как белок брахиурии больше не обнаруживали. Кроме того, через 24 часа после начала дифференциации мы наблюдали пониженную иммунолокализацию E-кадгерина на клеточной поверхности, особенно на периферии колоний, где обнаруживали брахиурия-позитивные клетки. В частности, иммунофлуоресцентное мечение дифференцирующихся культур показало коэкспрессю SOX17 с геном брахиурии (BRACH). После предварительной обработки TSA перед началом протокола дифференциации (0 ч) заметной иммунореактивности к SOX17 и брахиурии не обнаружили. Таким образом, во время дифференциации предварительно обработанных TSA hpSC в дефинитивную эндодерму динамика экспрессии генов мезэндодермы и экспрессии E-кадгерина и локализация были сходными с теми, что наблюдаются во время дифференциации hESC.
На фиг. 3 представлены графики временной динамики экспрессии маркерных генов в ходе дифференциации hpSC, предварительно обработанных TSA, в дефинитивную эндодерму, определенной посредством количественной ПЦР в реальном времени. Фиг. 3A показывает, что предварительная обработка TSA hpSC не вызывала значительных изменений в экспрессии генов плюрипотентности OCT4, SOX2, а также маркеров стадии дифференциации CER1, SOX17, CXCR4 (-24 ч, перед обработкой TSA; 0 ч, после предварительной обработки TSA, перед началом протокола дифференциации). Применение условий дифференциации вызывало подавление экспрессии SOX2 и OCT4 одновременно с активацией экспрессии SOX17, CER1 и CXCR4, которая достигала максимума через 72 часа. (На оси Y указана относительная экспрессия генов, нормированная на момент времени 0 ч.) Фиг. 3B показывает, что предварительно обработанные TSA hpSC демонстрировали более высокий уровень экспрессии гена брахиурии (BRACH) через 24 часа и более резкую динамику исчезновения мРНК брахиурии через 48 часов (+TSA) по сравнению с культурами, не обработанными TSA (-TSA). (-24 ч, перед обработкой TSA; 0 ч, после предварительной обработки TSA, перед началом протокола дифференциации. На оси Y указана относительная экспрессия генов, нормированная на момент времени 0 ч.)
Предварительная обработка TSA повышает эффективность получения дефинитивной эндодермы из многочисленных линий hpSC. Настоящую процедуру предварительной обработки TSA, наряду с описанным протоколом дифференциации, применяли к четырем линиям партеногенетических стволовых клеток человека: phESC-1, phESC-3, phESC-5 (Revazova et al., Cloning Stem Cells 9(3):432-49, 2007) и hpSC- Hhom-1 (Revazova et al., Cloning Stem Cells 10(1 ):11-24, 2008); все представленные данные до настоящего времени получали с применением линии phESC-3. Как показала количественная оценка CXCR4-позитивных клеток посредством проточной цитометрии, для всех 4 изученных линий применение процедуры предварительной обработки TSA повышало количество клеток дефинитивной эндодермы в 1,4-1,8 раз по сравнению с предварительно не обработанными культурами. Кроме того, динамика экспрессии генов в ходе дифференциации в дефинитивную эндодерму всех линий hpSC, предварительно обработанных TSA, показала, что клетки проходили через такие же соответствующие промежуточные стадии развития и экспрессировали соответствующие маркеры дефинитивной эндодермы.
Хотя изобретение описано со ссылками на приведенные выше примеры, следует понимать, что модификации и варианты включены в сущность и объем изобретения. Таким образом, изобретение ограничено только следующей формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИФФЕРЕНЦИРОВАНИЕ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА | 2011 |
|
RU2620938C2 |
| ДИФФЕРЕНЦИРОВКА ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА | 2008 |
|
RU2465323C2 |
| ДИФФЕРЕНЦИРОВКА ЧЕЛОВЕЧЕСКИХ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК | 2008 |
|
RU2473685C2 |
| ДИФФЕРЕНЦИРОВАНИЕ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА | 2011 |
|
RU2627168C2 |
| ДИФФЕРЕНЦИРОВАНИЕ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК | 2011 |
|
RU2673946C1 |
| ДИФФЕРЕНЦИРОВКА ЧЕЛОВЕЧЕСКИХ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК | 2010 |
|
RU2610176C2 |
| ИСПОЛЬЗОВАНИЕ ЛИГАНДОВ ЭПИНЕФРИНА ДЛЯ ДИФФЕРЕНЦИРОВАНИЯ КЛЕТОК ПАНКРЕАТИЧЕСКОЙ ЭНДОДЕРМЫ | 2013 |
|
RU2650813C2 |
| ДИФФЕРЕНЦИРОВАНИЕ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК | 2011 |
|
RU2599420C2 |
| КУЛЬТИВИРОВАНИЕ ОТДЕЛЬНЫХ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК | 2008 |
|
RU2473687C2 |
| СПОСОБЫ ПРОДУЦИРОВАНИЯ КЛЕТОК ДЕФИНИТИВНОЙ ЭНТОДЕРМЫ И ПАНКРЕАТИЧЕСКОЙ ЭНТОДЕРМЫ | 2013 |
|
RU2668814C2 |

Изобретение относится к области биотехнологии. Предложен способ получения клеток дефинитивной эндодермы, включающий культивирование стволовых клеток, полученных из партеногенетических клеток в присутствии трихостатина A в условиях отсутствия активина А, где TSA изменяет эпигенетический статус клетки, последующее культивирование стволовых клеток в отсутствие TSA, с получением таким образом клеток дефинитивной эндодермы, где TSA присутствует в концентрации 100 нМ-100 мкМ и где культивирование в присутствии TSA проводят в течение 24-72 часов и культивирование в отсутствие TSA проводят в течение 6-72 часов. 8 з.п. ф-лы, 4 табл., 3 ил., 2 пр.
1. Способ получения клеток дефинитивной эндодермы, включающий:
a) культивирование стволовых клеток, полученных из партеногенетических клеток в присутствии трихостатина A (TSA) и в условиях отсутствия активина А, где TSA изменяет эпигенетический статус клетки; и
b) последующее культивирование стволовых клеток в отсутствие TSA с получением таким образом клеток дефинитивной эндодермы,
где TSA присутствует в концентрации 100 нМ-100 мкМ и где культивирование в присутствии TSA проводят в течение 24-72 часов и культивирование в отсутствие TSA проводят в течение 6-72 часов.
2. Способ по п. 1, где стадию культивирования стволовых клеток в отсутствие TSA проводят в присутствии Активина A, Wnt3a или их сочетания.
3. Способ по п. 1, где культивирование в присутствии TSA проводят в течение по крайней мере 24 часов.
4. Способ по п. 1, где стволовые клетки, полученные из партеногенетических клеток, представляют собой клетки LLC-6р или LLC-12ph.
5. Способ по п. 1, где клетки дефинитивной эндодермы экспрессируют один или несколько маркеров, выбранных из группы, состоящей из FoxA2, Sox17, CXCR4, брахиурии и CER1.
6. Способ по п. 1, где клетки дефинитивной эндодермы не экспрессируют или экспрессируют пониженные уровни Е-кадгерина, Oct4 или обоих по сравнению с необработанными стволовыми клетками.
7. Способ по п. 1, где этапы культивирования проводят в условиях сред определенного состава.
8. Способ по п. 1, где клетки дефинитивной эндодермы дополнительно обрабатывают с получением клеток желудочно-кишечного тракта, дыхательных путей или эндокринной системы.
9. Способ по п. 1, где клетки дефинитивной эндодермы дополнительно обрабатывают с получением клеток печени или панкреатических клеток.
| US 20050170506 A1, 04.08.2005 | |||
| US 20070254359 A, 01.11.2007 | |||
| СПОСОБ ПОЛУЧЕНИЯ РОСТОВЫХ ФАКТОРОВ БЕЛКОВОЙ ПРИРОДЫ, РОСТОВОЙ ФАКТОР БЕЛКОВОЙ ПРИРОДЫ И ИНГИБИТОР ПРОЛИФЕРАЦИИ ФИБРОБЛАСТОВ | 2005 |
|
RU2283654C1 |
Авторы
Даты
2016-02-27—Публикация
2009-12-02—Подача