ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу получения мезенхимальных стволовых клеток из плюрипотентных стволовых клеток человека, к мезенхимальным стволовым клеткам, полученным данным способом, и средствам клеточной терапии, включающим мезенхимальные стволовые клетки.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Стволовые клетки представляют собой клетки, которые способны к дифференцированию в различные клетки, составляющие ткани организма, и, как правило, до дифференцировки относятся к недифференцированным клеткам, которые можно получать из соответствующих тканей эмбриона, плода и взрослого тела. Стволовые клетки дифференцируются в определенные клетки под воздействием стимула дифференцировки (внешние условия); обеспечивают пролиферацию (рост) клеток посредством образования клеток, аналогичных им самим, путем клеточного деления (самоподдержания), в отличие от клеток, для которых клеточное деление прекращено в результате завершения дифференцировки; и характеризуются пластичностью дифференцировки, поскольку могут дифференцироваться в другие клетки под воздействием различных условий или различных стимулов дифференцировки.
Среди стволовых клеток в соответствии с их способностью к дифференцировке можно выделить плюрипотентные, мультипотентные и унипотентные стволовые клетки. Плюрипотентные стволовые клетки представляют собой плюрипотентные клетки, характеризующиеся тотипотентностью - способностью к дифференциации во все виды клеток, и такие клетки включают эмбриональные стволовые клетки (клетки ES) и индуцированные плюрипотентные стволовые клетки (клетки iPS) и т.д. Зрелые стволовые клетки могут представлять собой примеры мультипотентных и/или унипотентных стволовых клеток.
Эмбриональные стволовые клетки образуются из внутренней клеточной массы бластоцисты в раннем эмбриогенезе; характеризуются тотипотентностью, дифференцируясь во все типы клеток и, таким образом, обладая способностью дифференцироваться в любой тип клеток ткани; их можно культивировать в иммортальном и недифференцированном состоянии; они могут передаваться следующему поколению посредством образования половых клеток, в отличие от зрелых стволовых клеток (Thomson et al., Science, 282; 1145-1147, 1998; Reubinoff et al., Nat. Biotechnol., 18; 399-404, 2000).
Эмбриональные стволовые клетки человека получают посредством изоляции и культивирования только внутренней клеточной массы во время формирования эмбриона человека, и в настоящее время эмбриональные стволовые клетки человека получают из замороженных эмбрионов, остающихся после операций по стерилизации. Предпринимались различные попытки применять плюрипотентные эмбриональные стволовые клетки человека, обладающие способностью к дифференциации во все типы клеток, в качестве средства клеточной терапии; однако пока не удалось полностью преодолеть серьезные трудности, такие как риск канцерогенеза и иммунного отторжения.
Кроме того, недавно сообщали об индуцированных плюрипотентных стволовых клетках (iPS). Клетки iPS, которые относят к плюрипотентным стволовым клеткам, представляют собой клетки, которые получают посредством дедифференциации зрелых клеток, для которых различными способами останавливают дифференцировку и, таким образом, возвращают их в эмбрионально-подобное состояние ранних стадий дифференцировки. На сегодняшний день опубликовано, что дедифференцированные клетки обладают почти теми же свойствами, что и эмбриональные стволовые клетки, которые представляют собой плюрипотентные стволовые клетки, с точки зрения генной экспрессии и способности к дифференцировке. Эти клетки iPS также можно применять как аутологичные клетки и, таким образом, исключать риск иммунного отторжения, однако риск образования опухоли остается проблемой, требующей решения.
Недавно мезенхимальные стволовые клетки, выполняющие иммунорегуляторную функцию и не характеризующиеся риском образования опухоли, предложили в качестве альтернативы для решения таких проблем. Мезенхимальные стволовые клетки представляют собой мультипотентные клетки, способные к дифференциации в адипоциты, остеоциты, хондроциты, миоциты, нейроциты, кардиомиоциты и т.д., и показано, что они выполняют функцию регуляции иммунного ответа. Мезенхимальные стволовые клетки можно изолировать из различных тканей и затем культивировать, но их свойства и маркеры клеточной поверхности различаются в зависимости от их происхождения. Таким образом, четко охарактеризовать мезенхимальные стволовые клетки непросто. Однако мезенхимальные стволовые клетки, как правило, определяют как клетки, которые способны дифференцироваться в остеоциты, хондроциты и миоциты; имеют спиральную форму; и экспрессируют CD73(+), CD105(+), CD34(-) и CD45(-), которые представляют собой основные маркеры клеточной поверхности.
При этом для применения мезенхимальных стволовых клеток в качестве средств клеточной терапии необходимо обеспечивать минимальное количество клеток, составляющее приблизительно 1×109 клеток, которое требуется в области регенеративной медицины и/или клеточной терапии. Однако необходимое количество клеток далее увеличивается с учетом экспериментов по установке условий и стандартов. Таким образом, для эксперимента in vitro требуется по меньшей мере 10 пассажей, чтобы получить такое количество клеток из существующих мезенхимальных стволовых клеток, полученных из различных источников. В этом случае клетки становятся зрелыми и модифицированными и, таким образом, могут не подходить для применения в качестве средств клеточной терапии. Хотя условия и стандарты установлены с применением этих клеток, могут возникать некоторые проблемы, например, клетки могут становиться изношенными еще до применения их в терапии, и в этом случае может потребоваться применение мезенхимальных стволовых клеток из других источников, что приводит к необходимости проведения дополнительных экспериментов из-за применения различных клеток.
Самая оптимальная альтернатива для решения указанных проблем системы культивирования существующих мезенхимальных стволовых клеток заключается в применении плюрипотентных стволовых клеток человека для получения мезенхимальных стволовых клеток. Однако до настоящего времени индукция дифференцировки плюрипотентных стволовых клеток человека в мезенхимальные стволовые клетки подразумевала проведение индукции посредством определенных цитокинов (например, BMP, bFGF), что требовало больших затрат и контроля концентрации, или индукцию с применением чужеродных фидерных клеток (клеточные линии мыши OP9), что приводит к риску заражения чужеродным патогеном, и последующую сортировку по определенному маркеру (например, CD73).
Кроме того, для мезенхимальных стволовых клеток, которые получают посредством указанных способов, трудно поддерживать их основное состояние, и эффективность их получения остается невысокой. Кроме того, плюрипотентные стволовые клетки человека с различным генетическим фоном характеризуются различными физиологическими механизмами, и, таким образом, применение известных способов индукции дифференцировки мезенхимальных стволовых клеток, ранее установленных для определенных линий, становится невозможным. Таким образом, проблема заключалась в том, что для получения мезенхимальных стволовых клеток из плюрипотентных стволовых клеток человека различного генетического происхождения необходимо разрабатывать и применять отдельные способы индукции дифференцировки. По этим причинам существуют ограничения в применении мезенхимальных стволовых клеток в качестве оптимальных средств клеточной терапии в области регенеративной медицины и клеточной терапии.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к высокоэффективному способу промышленного получения мезенхимальных стволовых клеток, который применяют для плюрипотентных стволовых клеток человека с различным генетическим фоном. Кроме того, настоящее изобретение относится к мезенхимальным стволовым клеткам, полученным данным способом, средствам клеточной терапии, включающим мезенхимальные стволовые клетки, и стандартизированной системе культивирования для получения мезенхимальных стволовых клеток из плюрипотентных стволовых клеток человека.
Для решения указанной выше проблемы настоящее изобретение предоставляет способ получения мезенхимальных стволовых клеток из плюрипотентных стволовых клеток человека, где способ включает: а) получение эмбриоидных телец из плюрипотентных стволовых клеток человека; b) помещение эмбриоидных телец в чашку Петри и последующую индукция спонтанной дифференцировки эмбриоидных телец в мезенхимальные стволовые клетки; и c) проведение длительного культивирования с пролиферацией мезенхимальных стволовых клеток при поддержании идентичности мезенхимальных стволовых клеток. В частности, индукция дифференцировки может включать индукцию спонтанной дифференцировки посредством образования петель аутологичного цитокина, и характеризуется применением среды, включающей эпидермальный фактор роста человека (hEGF), фактор роста эндотелия сосудов (VEGF), основной фактор роста фибробластов человека (hFGF-B), инсулиноподобный фактор роста (IGF-1), гидрокортизон, аскорбиновую кислоту и т.д., которую можно использовать для поддержания и культивирования с пролиферацией индуцированных к дифференцировке мезенхимальных стволовых клеток.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1a показана индукция дифференцировки плюрипотентных стволовых клеток человека в мезенхимальные стволовые клетки и их культивирование с пролиферацией.
На фиг.1b показаны количественные показатели различий генной экспрессии, связанной с мезенхимальной дифференцировкой эмбриоидных телец возраста 7 суток и эмбриоидных телец возраста 14 суток, установленные с применением полимеразной цепной реакции.
На фиг.1c представлены показатели белковой экспрессии генов на ранней стадии мезенхимальной дифференцировки, установленные с применением окрашивания эмбриоидных телец возраста 14 суток.
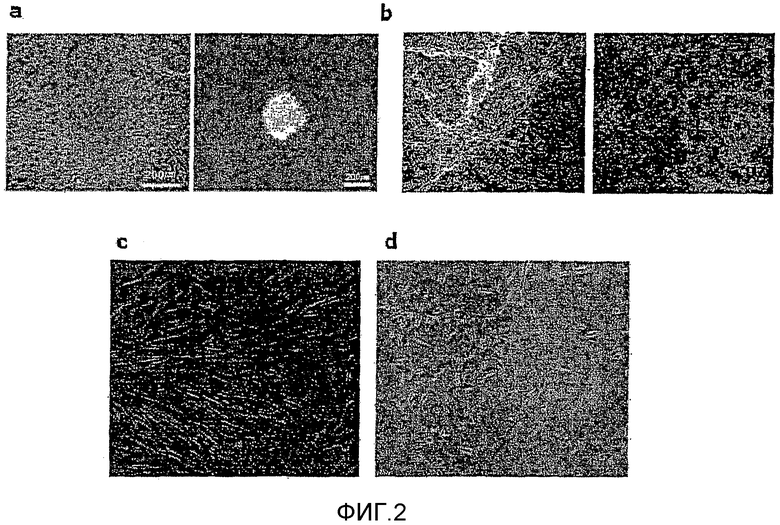
На фиг.2a показана сортировка эмбриоидных телец на 14 сутки во время их прикрепления.
На фиг.2b показано, что индукция дифференцировки в мезенхимальные стволовые клетки начинается при культивировании эмбриоидных телец в основной среде для культивирования, к которой не добавляют внешний цитокин.
На фиг.2c и 2d представлен процесс индукции дифференцировки в мезенхимальные стволовые клетки в группах, обработанных Noggin и не обработанных Noggin, который представляет собой антагонист BMP.
На фиг.3 показаны различия в эффективности между средой EGM-2MV и средой α-MEM, которая представляет собой традиционную среду для культивирования мезенхимальных стволовых клеток, установленные посредством окраски на бета-галактозидазу, ассоциированной со старением клеток.
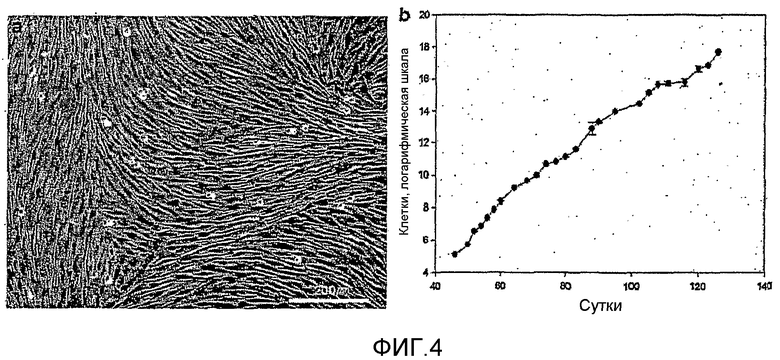
На фиг.4a показана картина роста мезенхимальных стволовых клеток, культивированных в среде EGM-2MV в течение 140 суток или более.
На фиг.4b представлена кривая роста мезенхимальных стволовых клеток по настоящему изобретению, которая показывает, что при культивировании in vitro они растут при сохранении длительной активности.
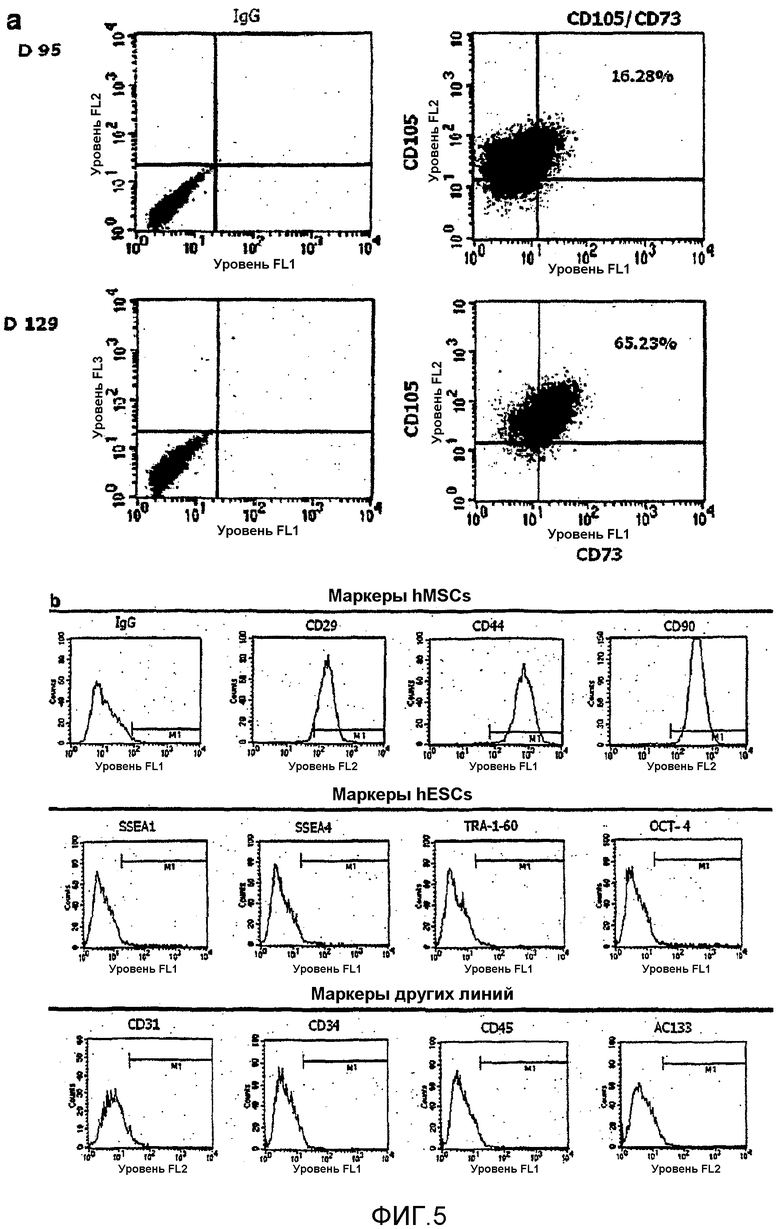
На фиг.5a и 5b показано, что мезенхимальные стволовые клетки, полученные способом по настоящему изобретению, экспрессируют специфичные для мезенхимы маркеры.
На фиг.6 представлены результаты хромосомного анализа мезенхимальных стволовых клеток по настоящему изобретению после их длительного культивирования in vitro.
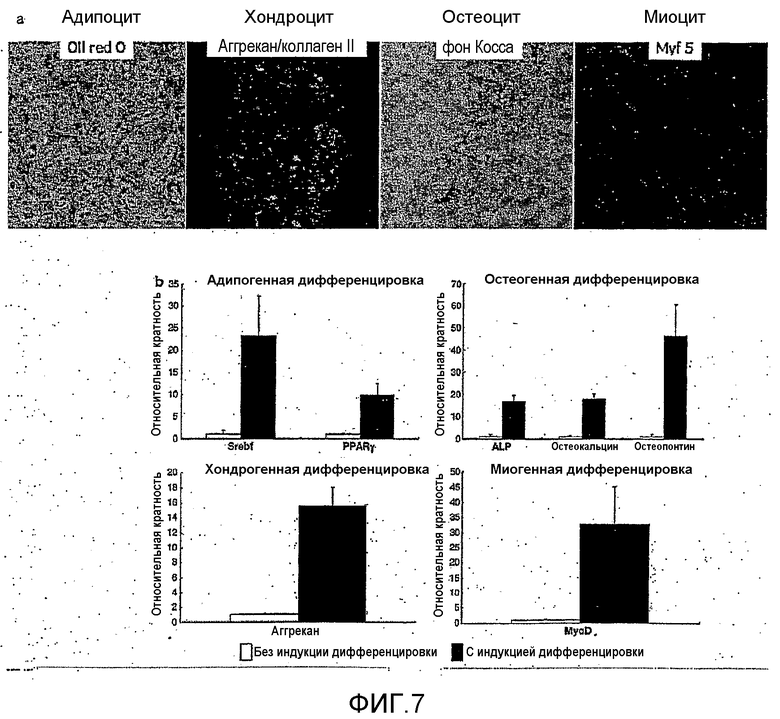
На фиг.7a и 7b показаны результаты анализа способности к дифференцировке мезенхимальных стволовых клеток, полученных способом по настоящему изобретению.
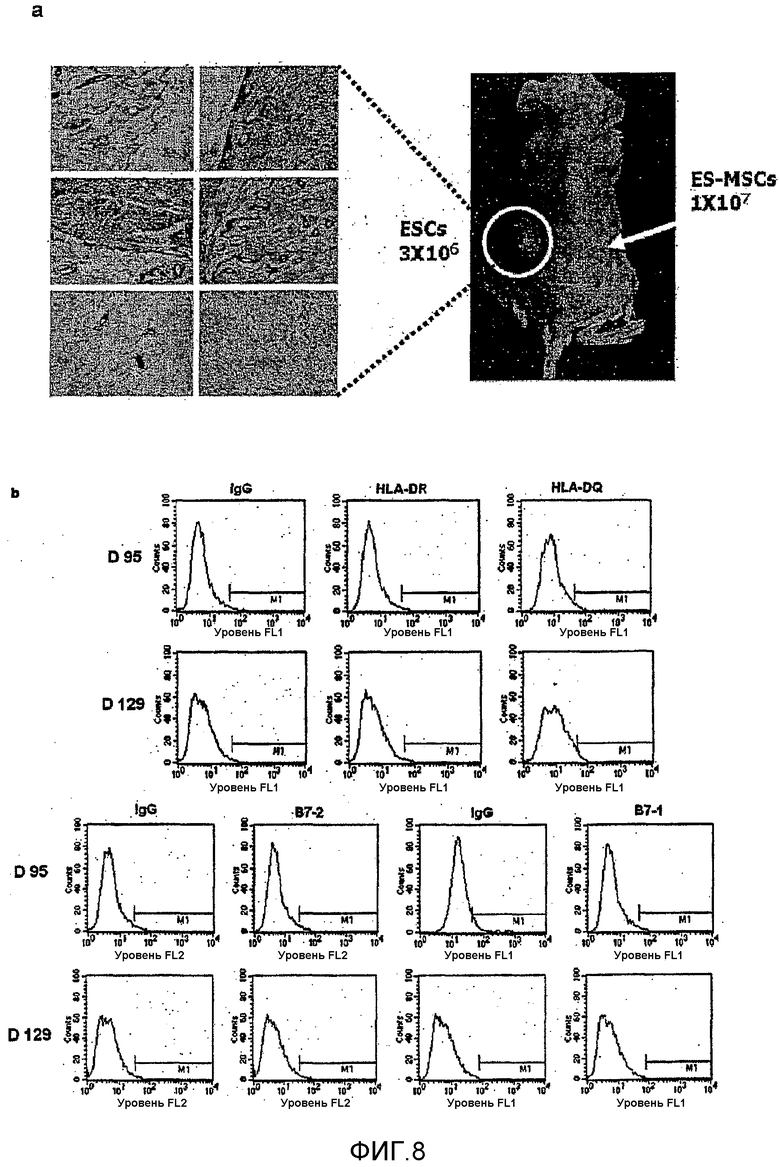
На фиг.8a и 8b показано, формируется ли тератома и экспрессируются ли факторы, ассоциированные с иммунной индукцией, для мезенхимальных стволовых клеток, полученных способом по настоящему изобретению.
На фиг.9 представлены результаты, полученные посредством анализа функции с применением мышиной модели ишемического сердечно-сосудистого заболевания, для определения функциональности мезенхимальных стволовых клеток, полученных способом по настоящему изобретению.
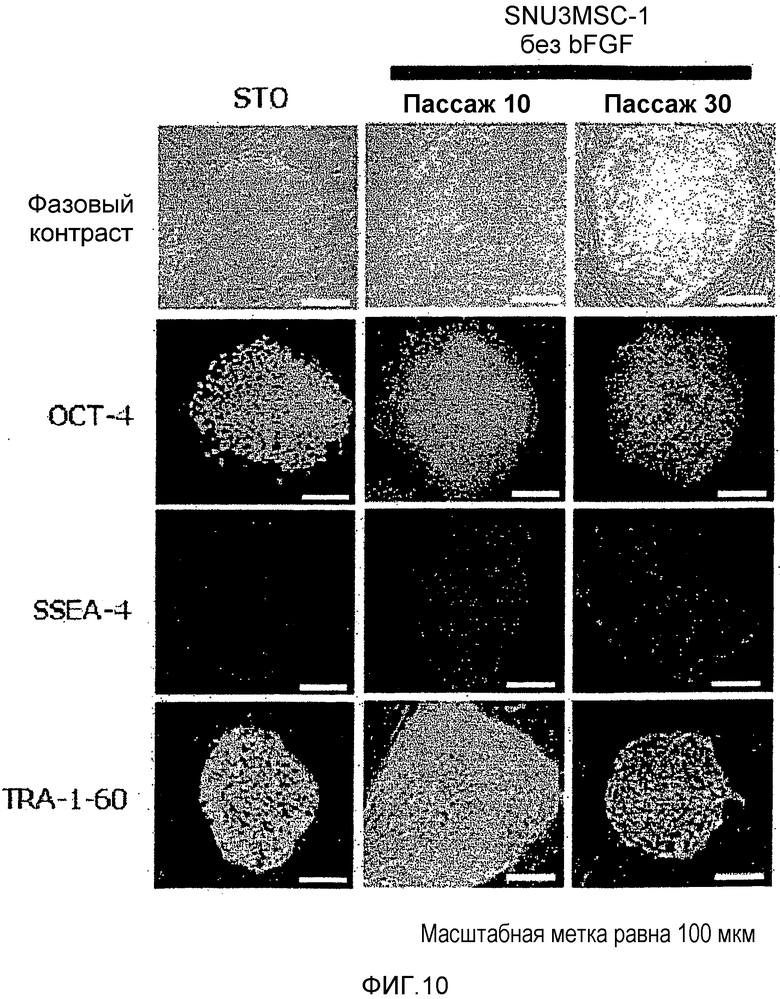
На фиг.10 показаны результаты эксперимента по оценке способности мезенхимальных стволовых клеток, полученных способом по настоящему изобретению, выполнять роль аутологичных фидерных клеток.
На фиг.11 показаны результаты анализа воспроизводимости настоящего изобретения с применением линии эмбриональных стволовых клеток человека № 3 из Медицинского Центра Ча (CHA3-hESC) и линии эмбриональных стволовых клеток человека H9, генетический фон и условия культивирования которых отличаются от таковых для эмбриональных стволовых клеток человека из Госпиталя Сеульского Национального Университета.
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение относится к способу получения мезенхимальных стволовых клеток с применением плюрипотентных стволовых клеток человека, где способ включает: a) получение эмбриоидных телец из плюрипотентных стволовых клеток человека; b) помещение эмбриоидных телец в чашку Петри и последующую индукцию спонтанной дифференцировки эмбриоидных телец в мезенхимальные стволовые клетки; и c) поддержание и культивирование с пролиферацией индуцированных к дифференцировке мезенхимальных стволовых клеток. В частности, настоящее изобретение может включать получение эмбриоидных телец из плюрипотентных стволовых клеток человека, которое можно проводить известным в данной области способом. Например, плюрипотентные стволовые клетки человека можно обрабатывать протеазой и затем культивировать во взвешенном состоянии в среде для эмбриональных стволовых клеток, свободной от основного фактора роста фибробластов (bFGF).
Как применяют в настоящем документе, термин "стволовые клетки" относится к основным клеткам, которые способны неограниченно обновляться, формируя определенные клетки тканей и органов. Стволовые клетки представляют собой способные к развитию мультипотентные или плюрипотентные клетки. Стволовая клетка может делиться на две дочерних стволовых клетки или одну дочернюю стволовую клетку и переходную клетку, и затем они пролиферируют, образуя определенные зрелые типы клеток тканей. Эти стволовые клетки можно классифицировать различными способами. Один из наиболее широко используемых способов основан на способности стволовых клеток к дифференцировке. Согласно данному способу, стволовые клетки можно разделять на плюрипотентные стволовые клетки, которые могут дифференцироваться в клетки трех зародышевых листков, мультипотентные стволовые клетки, которые способны ограниченно дифференцироваться в клетки одного или более определенных зародышевых листков, и унипотентные стволовые клетки, которые способны дифференцироваться только в клетки определенного зародышевого листка.
Как применяют в настоящем документе, термин "плюрипотентные стволовые клетки" относится к стволовым клеткам, которые характеризуются плюрипотентностью и способны к дифференциации в клетки всех трех зародышевых листов, составляющих живой организм, и их примеры включают эмбриональные стволовые клетки и индуцированные плюрипотентные стволовые клетки (iPS). Зрелые стволовые клетки могут представлять собой мультипотентные или унипотентные стволовые клетки.
Как применяют в настоящем документе, термин "дифференцировка" относится к процессу, в ходе которого клетки становятся специализированными по структуре или функциям во время деления, пролиферации и роста клеток, то есть происходит изменение морфологии или функций клеток, в результате чего клетки, ткани и т.д. организма могут выполнять свои функции. В целом, это процесс, в ходе которого относительно простая система разделяется на две или более качественно других частичных систем. Дифференцировка относится к состоянию, в котором части определенной биологической системы, бывшие изначально гомогенными, становятся качественно отличными друг от друга, или в результате они делятся на качественно различимые части или частичные системы, так как, например, происходит в онтогенезе яйца, которое изначально является гомогенным, после чего в нем обособляются голова, тело и т.д., или клетки, такие как миоциты, нейроциты и т.д., становятся отличными друг от друга.
Как применяют в настоящем документе, термин "эмбриоидные тельца (EB)" относится к комплексу, образованному в результате индукции дифференцировки плюрипотентных стволовых клеток. Эмбриоидные тельца можно получать посредством культивирования плюрипотентных стволовых клеток во взвешенном состоянии в отсутствии фидерных клеток в среде для эмбриональных стволовых клеток, свободной от основного фактора роста фибробластов (bEGF). Показано, что эмбриоидное тельце, полученное указанным способом, способно дифференцироваться во все типы клеток, необходимые для формирования организма из эндодермы, мезодермы и эктодермы, и это относится к одному из способов in vitro, который обеспечивает плюрипотентность плюрипотентных стволовых клеток.
Настоящее изобретение может включать отбор эмбриоидных телец на 14 сутки культивирования и индукцию дифференцировки эмбриоидных телец в мезенхимальные стволовые клетки. Более конкретно, на 14 сутки культивирования можно отбирать эмбриоидные тельца, которые образуются посредством культивирования плюрипотентных стволовых клеток человека во взвешенном состоянии в среде для эмбриональных стволовых клеток, свободной от bFGF, и затем применять их для получения мезенхимальных стволовых клеток. Эмбриоидные тельца на 7 сутки культивирования, как правило, применяли в известных способах индукции дифференцировки плюрипотентных стволовых клеток человека в мезенхимальные стволовые клетки (в общем смысле, эмбриональные стволовые клетки человека). Однако авторы настоящего изобретения обнаружили, что отбор эмбриоидных телец на 14 сутки культивирования вместо отбора эмбриоидных телец на 7 сутки культивирования может повышать эффективность индукции дифференцировки при получении мезенхимальных стволовых клеток из плюрипотентных стволовых клеток человека. В частности, результаты анализа генной экспрессии эмбриоидных телец на 7 сутки и на 14 сутки культивирования показали, что экспрессия генов, ассоциированных с ранней мезенхимальной дифференцировкой (брахиурия, BMPR и т.д.), и Sox 17, которые представляют собой важный ген ранних стадий развития сердечных мезенхимальных клеток, значительно выше в эмбриоидных тельцах на 14 сутки культивирования по сравнению с экспрессией в эмбриоидных тельцах на 7 сутки культивирования (смотрите фиг.1b). Приведенные выше результаты показывают, что отбор эмбриоидных телец на 14 сутки культивирования может индуцировать избирательную дифференцировку в мезенхимальные стволовые клетки.
Кроме того, настоящее изобретение может включать прикрепление эмбриоидных телец на 14 сутки культивирования к чашке Петри, а затем индукцию спонтанной дифференцировки эмбриоидных телец в мезенхимальные стволовые клетки. При проведении индукции дифференцировки в мезенхимальные стволовые клетки из плюрипотентных стволовых клеток человека инициацию индукции дифференцировки можно проводить посредством дополнительного внесения морфогенетического белка кости (BMP)-2 и т.д. Авторы настоящего изобретения обнаружили, что индукция спонтанной дифференцировки в мезенхимальные стволовые клетки происходила при культивировании эмбриоидных телец с применением основной среды для культивирования клеток, такой как модифицированная по Дульбекко среда Игла (DMEM) и т.д., без дополнительного внесения BMP-2 и т.д. (смотрите фиг.2b). В соответствии с этим механизмом авторы настоящего изобретения рассмотрели возможность формирования петель BMP, который представляет собой фактор индукции мезенхимальных стволовых клеток, известный специалистам в связанных областях, а затем, с целью подтверждения этого, наблюдали процесс индукции дифференцировки мезенхимальных стволовых клеток посредством обработки Noggin, который представляет собой антагонист BMP (смотрите фиг.2c и 2d). Дифференцировку в мезенхимальные стволовые клетки индуцировали в группе, не обработанной Noggin (смотрите фиг.2c). Однако обнаружили, что мезенхимальные клетки-предшественники не появляются в группе, обработанной Noggin (смотрите фиг.2d), а также что во время пассажирования культуры культивирование клеток невозможно, поскольку клетки не могут заново прикрепиться. Приведенные выше результаты показывают, что когда эмбриоидные тельца на 14 сутки культивирования культивируют в основной среде для культивирования после их прикрепления, спонтанная дифференцировка в мезенхимальные стволовые клетки индуцируется даже без дополнительного внесения цитокина, и это происходит благодаря саморегуляции посредством системы петель BMP.
Кроме того, настоящее изобретение может включать поддержание и культивирование с пролиферацией индуцированных к дифференцировке мезенхимальных стволовых клеток с применением среды, содержащей цитокин. В настоящем изобретении в качестве среды для культивирования мезенхимальных стволовых клеток применяли среду для культивирования (EGM-2MV, Lonza; Basel, Switzerland), содержащую эпидермальный фактор роста человека (hEGF), фактор роста эндотелия сосудов (VEGF), основной фактор роста фибробластов человека (hFGF-B), инсулиноподобный фактор роста (IGF-1), гидрокортизон, аскорбиновую кислоту и т.д. Авторы настоящего изобретения обнаружили, что активность мезенхимальных стволовых клеток относительно дольше сохранялась в культуре in vitro при применении среды EGM-2MV вместо среды α-MEM, которую традиционно применяли в качестве среды для культивирования мезенхимальных стволовых клеток.
Чтобы применять мезенхимальные стволовые клетки в качестве средств клеточной терапии, в первую очередь необходимо предоставлять достаточное количество клеток, как указано выше, и для этой цели необходимо осуществлять пассажирование культуры мезенхимальных стволовых клеток. Однако повторное пассажирование культуры может вызывать старение мезенхимальных стволовых клеток, что приводит к уменьшению их способности к делению, и, таким образом, их активность (способность к дифференцировке) может быть утрачена. В отношении этого подтверждали, что среда EGM-2MV по настоящему изобретению характеризуется более высокой способностью сохранять активность клеток по сравнению со средой α-MEM, которую применяли в качестве традиционной среды для культивирования мезенхимальных стволовых клеток (смотрите фиг.3). В частности, результаты окрашивания на бета-галактозидазу, при котором клетки окрашивают в период их старения, показали, что среди мезенхимальных стволовых клеток, культивированных в среде α-MEM, окрашиванию на бета-галактозидазу подверглось большее число клеток, и размер клеток стал значительно больше, чем среди мезенхимальных стволовых клеток, культивированных в среде EGM-2MV. Известно, что в период культивирования in vitro стволовых клеток отсутствие их роста, связанное со старением клеток, ассоциировано с увеличением клеток. Это означает, что при культивировании мезенхимальных стволовых клеток в среде α-MEM старение мезенхимальных стволовых клеток ускоряется, и, таким образом, способность к дифференцировке мезенхимальных стволовых клеток теряется.
Кроме того, настоящее изобретение относится к мезенхимальным стволовым клеткам, которые получают способом по настоящему изобретению. Мезенхимальные стволовые клетки могут дифференцироваться в остеоциты, хондроциты, миоциты и т.д., и определяются по их спиральной форме и степени экспрессии маркеров клеточной поверхности, SH2(+), SH3(+), CD34(-) и CD45(-). Мезенхимальные стволовые клетки, происходящие от эмбриональных стволовых клеток человека из Госпиталя Сеульского Национального Университета (Asian #1, мужчина, фидерный слой STO), полученные способом по настоящему изобретению, демонстрировали одинаковые результаты в трех различных экспериментах, что подтверждали с применением флуоресцентного клеточного сортера, а также посредством функциональной дифференцировки.
Настоящее изобретение относится к стандартизированному способу индукции дифференцировки и культивированию с пролиферацией, которые можно использовать для получения мезенхимальных стволовых клеток из плюрипотентных стволовых клеток человека различного генетического происхождения. В отношении этого способ по настоящему изобретению применяли для эмбриональных стволовых клеток человека из Медицинского Центра Ча (Asian #2, мужчина, фидерный слой MEF) и эмбриональных стволовых клеток человека H9 (Westerner, женщина, фидерный слой MEF), которые имели различное генетическое происхождение от эмбриональных стволовых клеток человека из Госпиталя Сеульского Национального Университета, и результаты для этих клеток совпадали. Другими словами, стандартизированный способ по настоящему изобретению можно использовать для индукции дифференцировки мезенхимальных стволовых клеток из плюрипотентных стволовых клеток человека, имеющих различный генетический фон и/или подвергающихся различным условиям культивирования.
Кроме того, настоящее изобретение относится к средствам клеточной терапии, включающим мезенхимальные стволовые клетки, полученные способом по настоящему изобретению. В частности, средства клеточной терапии можно использовать для получения адипоцитов, остеоцитов, хондроцитов, миоцитов, нейроцитов и кардиомиоцитов и дифференцировки в различные клетки в соответствии с условиями.
Как применяют в настоящем документе, термин "средство клеточной терапии" относится к лекарственному средству для лечения, диагностики и предотвращения заболеваний, включающему клетки или ткани, полученные от человека посредством изоляции, культивирования и специальных манипуляций (Рекомендации Управления по контролю качества пищевых продуктов и лекарственных препаратов США), более конкретно, к лекарственному средству для лечения, диагностики и предотвращения заболеваний, полученных любым способом, включая пролиферацию или сортировку аутологичных, гомологичных или гетерологичных живых клеток in vitro, или модифицирование биологических характеристик клеток посредством других способов, с целью восстановления функции клеток или ткани. Средства клеточной терапии в целом классифицируют на средства клеточной терапии с применением соматических клеток и средства клеточной терапии с применением стволовых клеток согласно степени клеточной дифференцировки, и настоящее изобретение направленно на средства клеточной терапии с применением стволовых клеток.
Кроме того, настоящее изобретение относится к системе получения мезенхимальных стволовых клеток из плюрипотентных стволовых клеток человека, имеющих различное генетическое происхождение. Система включает: a) культивирование плюрипотентных стволовых клеток человека и отбор эмбриоидных телец на 14 сутки культивирования; b) прикрепление эмбриоидных телец к чашке Петри и культивирование эмбриоидных телец с применением среды DMEM+FBS для индукции дифференцировки эмбриоидных телец; c) поддержание и культивирование с пролиферацией мезенхимальных стволовых клеток с применением среды, содержащей эпидермальный фактор роста человека (hEGF), фактор роста эндотелия сосудов (VEGF), основной фактор роста фибробластов человека (hFGF-B), инсулиноподобный фактор роста (IGF-1), гидрокортизон и аскорбиновую кислоту.
Кроме того, настоящее изобретение относится к фидерным слоям для культивирования плюрипотентных стволовых клеток человека. Фидерный слой необходим для длительного поддержания недифференцированного состояния плюрипотентных стволовых клеток человека в культуре. Фибробласты, полученные из эмбриона мыши, предпочтительно применяли в качестве традиционных фидерных клеток для плюрипотентных стволовых клеток человека. Однако поскольку межвидовой обмен патогенами признан проблемой при применении плюрипотентных стволовых клеток в клинических целях, было показано, что некоторые клетки, полученные от человека, можно применять в качестве альтернативных фидерных клеток. Однако это не помогло решить все проблемы: полное исключение гетерологичных патогенов было невозможно; существует необходимость внесения внешних факторов для поддержания недифференцированного состояния клеток (например, bFGF, IGF, активин и т.д.); и непрерывная поставка клеток для длительного культивирования невозможна. С другой стороны, полученные по настоящему изобретению мезенхимальные стволовые клетки, происходящие от плюрипотентных стволовых клеток человека, могут обеспечивать непрерывную поставку клеток, имеющих идентичный генетический фон, а также исключают риск иммунного отторжения и/или проникновения других патогенов, поскольку представляют собой аутологичные фидерные клетки. Кроме того, авторы настоящего изобретения обнаружили, что внешние факторы, поддерживающие недифференцированное состояние, не требуются при использовании полученных по настоящему изобретению мезенхимальных стволовых клеток, происходящих от плюрипотентных стволовых клеток человека, в качестве фидерных клеток. Другими словами, подтверждали, что недифференцированное состояние можно поддерживать даже без добавления факторов, поддерживающих недифференцированное состояние, в течение 30 или более пассажей (смотрите фиг.10), и этот примечательный эффект, "поддержание недифференцированного состояния в течение длительного времени", нельзя получить даже при применении нескольких традиционных фидерных слоев, полученных от человека, и при добавлении избыточных количеств факторов, поддерживающих недифференцированное состояние.
Далее в настоящем документе настоящее изобретение будет описано детально со ссылками на приведенные ниже примеры. Однако приведенные ниже примеры предназначены только для иллюстрации настоящего изобретения, и, таким образом, объем настоящего изобретения не ограничен приведенными примеры. Очевидно, что различные модификации, произведенные специалистами в данной области, включены в объем настоящего изобретения.
ПРИМЕРЫ
Пример 1: Получение мезенхимальных стволовых клеток из эмбриональных стволовых клеток человека из Госпиталя Сеульского Национального Университета
(1) Получение эмбриоидных телец
Эмбриональные стволовые клетки человека из Госпиталя Сеульского Национального Университета (Asian #1, мужчина, фидерный слой STO), которые поддерживали в недифференцированном состоянии, обрабатывали диспазой (2 мг/мл) с последующей аккуратной изоляцией, а затем культивировали во взвешенном состоянии в среде для эмбриональных стволовых клеток, свободной от bFGF, в течение 14 суток.
На 7 сутки и на 14 сутки культивирования проводили анализ генной экспрессии эмбриоидных телец, и различия в генной экспрессии, ассоциированной с мезенхимальной дифференцировкой соответствующих эмбриоидных телец, количественно определяли посредством полимеразной цепной реакции (ПЦР). Подтверждали, что брахиурия и BMPR, которые представляют собой гены, ассоциированные с ранней мезенхимальной дифференцировкой, и Sox 17, который представляет собой важный ген ранних стадий развития мезенхимальных клеток сердца, значительно больше экспрессируются в эмбриоидных тельцах на 14 сутки культивирования по сравнению с эмбриоидными тельцами на 7 сутки культивирования (смотрите фиг.1b). Кроме того, экспрессию белка брахиурии и участок экспрессии определяли посредством окрашивания эмбриоидных телец на 14 сутки культивирования (смотрите фиг.1c).
(2) Индукция дифференцировки в мезенхимальные стволовые клетки
Эмбриоидные тельца, полученные в суспензионной культуре в течение 14 суток, прикрепляли к чашке Петри, а затем индуцировали естественную дифференцировку в мезенхимальные стволовые клетки. Сортировка эмбриоидных телец на 14 сутки в период прикрепления показана на фиг.2a. После прикрепления некоторые эмбриоидные тельца демонстрировали хороший рост (левое изображение на фиг.2a), а другие эмбриоидные тельца не демонстрировали хорошего роста (правое изображение на фиг.2a). Наблюдали индукцию дифференцировки в мезенхимальные стволовые клетки при культивировании эмбриоидных телец в среде, содержащей модифицированную Дульбекко среду Игла (DMEM) и эмбриональную телячью сыворотку (10% об./об.), в течение 16 суток. Результаты наблюдений на 3 сутки и на 7 сутки после прикрепления эмбриоидных телец представлены на фиг.2b.
Как видно из фиг.2b, подтверждали, что индукция спонтанной дифференцировки эмбриоидных телец в мезенхимальные стволовые клетки начиналась при культивировании эмбриоидных телец в основной среде для культивирования (DMEM+FBS) без цитокина. Для понимания механизма индукции дифференцировки сравнивали и наблюдали процесс индукции дифференцировки в мезенхимальные стволовые клетки с применением обработки Noggin, который представляет собой антагонист BMP (смотрите фиг.2c и 2d). Подтверждали, что дифференцировка в мезенхимальные стволовые клетки индуцировалась в группе, не обработанной Noggin (смотрите фиг.2c), в то время как в группе, обработанной Noggin, мезенхимальные клетки-предшественники не наблюдались (смотрите фиг.2d). Приведенные выше результаты показывают, что при культивировании эмбриоидных телец в основной среде для культивирования без дополнительного внесения цитокина индукция спонтанной дифференцировки в мезенхимальные стволовые клетки происходила благодаря системе петель ВМР.
(3) Поддержание и культивирование с пролиферацией индуцированных к дифференцировке мезенхимальных стволовых клеток
Мезенхимальные стволовые клетки, индуцированные к дифференцировке посредством культивирования эмбриоидных телец в течение 16 суток после их прикрепления в (2) примера 1, обрабатывали ферментами (Трипсин-ЭДТА, 0,25% Трипсин с ЭДТА 4Na) и разделяли на отдельные клетки, которые затем снова прикрепляли к чашке Петри. Затем клетки поддерживали и культивировали с пролиферацией при 37°С с применением 500 мл среды для культивирования, содержащей 0,5 мл эпидермального фактора роста человек (hEGF), 0,5 мл фактора роста эндотелия сосудов (VEGF), 2 мл основного фактора роста фибробластов человека (hFGF-B), 0,5 мл инсулиноподобного фактора роста (IGF-1), 0,2 мл гидрокортизона и 0,5 мл аскорбиновой кислоты, а также 470 мл основной среды.
В отношении сохранения или утраты активности мезенхимальных стволовых клеток во время пролиферации культуры экспериментально сравнивали способность поддерживать активность в среде EGM-2MV, применяемой в настоящем изобретении, и в среде α-MEM, которая представляет собой традиционную среду для культивирования мезенхимальных стволовых клеток. В частности, ассоциированное со старением окрашивание на бета-галактозидазу проводили для групп клеток, культивированных с применением соответствующей среды, и результаты представлены на фиг.3 (культивирование и сравнение проводили в течение месяца, причем применяли клетки 7 пассажа).
На фиг.3 показано, что среди мезенхимальных стволовых клеток, культивированных с применением среды α-МЕМ, окрашиванию на бета-галактозидазу подверглось большее количество клеток, чем среди мезенхимальных стволовых клеток, культивированных с применением среды EGM-2MV. Это означает, что при культивировании мезенхимальных стволовых клеток с применением среды α-МЕМ старение мезенхимальных стволовых клетки ускоряется, и, таким образом, способность к дифференцировке мезенхимальных стволовых клеток утрачивается, в результате чего мезенхимальные стволовые клетки не могут выступать в качестве средств клеточной терапии. При этом применение среды EGM-2MV по настоящему изобретению обеспечивает сохранение активности мезенхимальных стволовых клеток в течение долгого времени, несмотря на последовательное пассажирование культуры, и таким образом, может улучшать их эффективность в качестве средств клеточной терапии по сравнению с применением среды α-МЕМ.
Кроме того, изучали, можно ли в течение длительного времени поддерживать идентичность и активность мезенхимальных стволовых клеток при длительном культивировании мезенхимальных стволовых клеток с применением среды EGM-2MV, и результаты анализа представлены на фиг.4. На фиг.4a показаны клетки после культивирования в течение 140 суток или более с применением среды EGM-2MV, где видно, что характер роста клеток все же имеет паттерн «отпечаток пальцев», типичный для мезенхимальных стволовых клеток. На фиг.4b показано, что клетки непрерывно и активно делятся вплоть до 140 суток культивирования, и показано, что активность мезенхимальных стволовых клеток можно поддерживать непрерывно. В заключение необходимо отметить, что идентичность и активность мезенхимальных стволовых клеток можно поддерживать в течение долгого времени, когда индуцированные к дифференцировке мезенхимальные стволовые клетки поддерживают и культивируют с пролиферацией в среде EGM-2MV по настоящему изобретению.
Пример 2: Характеристики мезенхимальных стволовых клеток
(1) Анализ маркеров клеточной поверхности
Анализировали экспрессию маркеров клеточной поверхности, специфичных для мезенхимальных стволовых клеток, полученных в примере 1. Результаты, полученные с применением флуоресцентного клеточного сортера после реакции антиген-антитело, представлены на фиг.5. IgG применяли в качестве контроля.
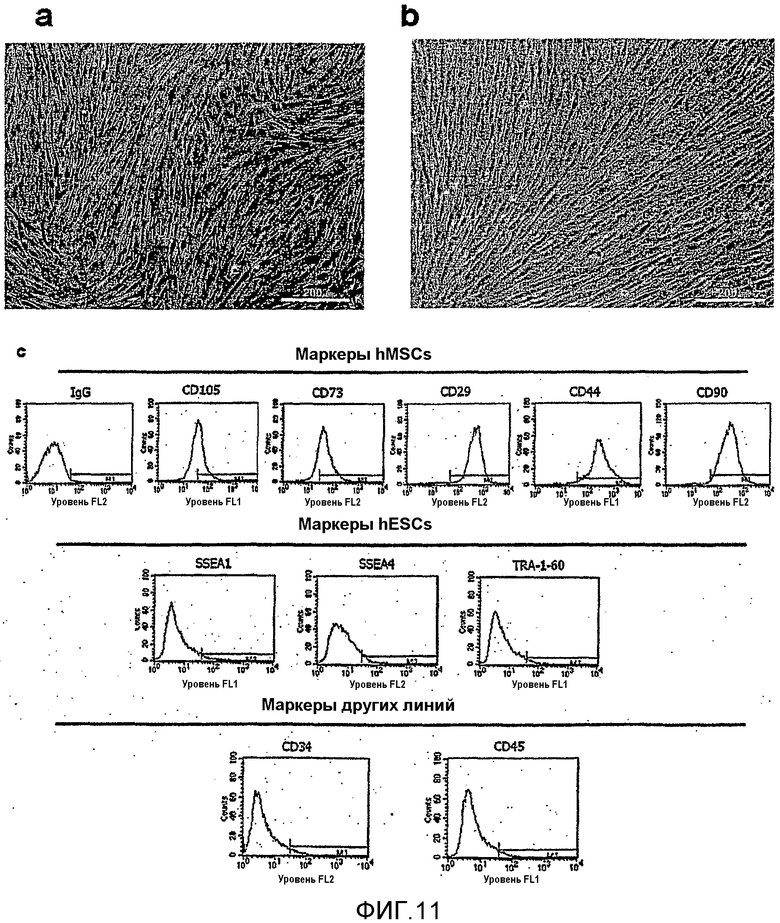
Фиг.5a подтверждает, что CD73 и CD105, которые представляют собой маркеры, специфичные для мезенхимальных стволовых клеток, экспрессировались в большом количестве в клетках на 95 сутки культивирования (D95) и на 129 сутки культивирования (D129). Кроме того, проводили анализ маркеров клеточной поверхности мезенхимальных стволовых клеток на 129 сутки культивирования, и результаты показаны на фиг.5b. Фиг.5b подтверждает наличие экспрессии CD29, CD44 и CD90, которые представляют собой маркеры мезенхимальнх стволовых клеток человека (hMSC), но ни маркеры SSEA1, SSEA4, TRA-1-60 и ОСТ-4, которые представляют собой маркеры эмбриональных стволовых клеток человека (hESC), ни маркеры эндодермы и эктодермы (маркеры других линий) не экспрессировались.
Наконец, согласно способу по настоящему изобретению, ясно показано, что дифференцировка только мезенхимальных стволовых клеток избирательно индуцируется для плюрипотентных стволовых клеток человека, и, кроме того, идентичность мезенхимальных стволовых клеток можно далее поддерживать в период длительного культивирования клеток с пролиферацией.
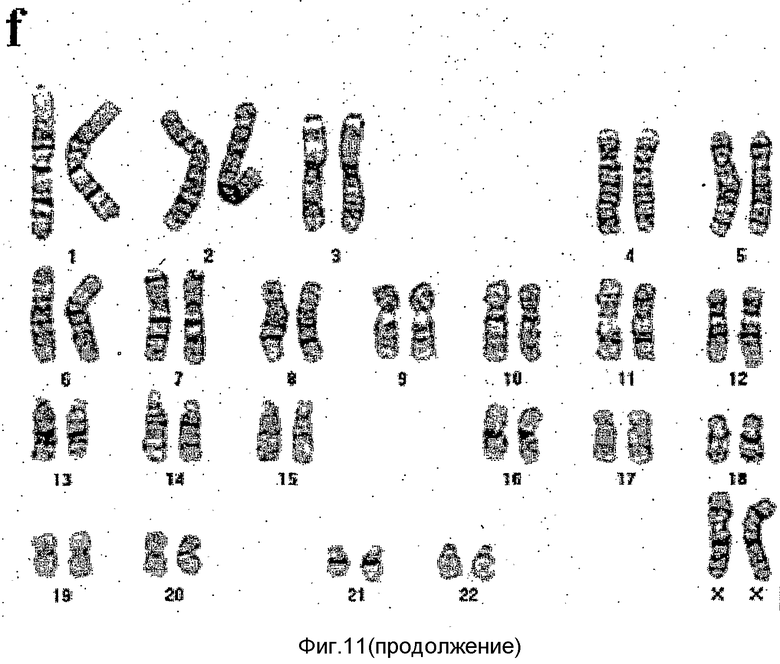
(2) Анализ кариотипа
Кариотип мезенхимальных стволовых клеток (на 160 сутки культивирования), полученных в примере 1, анализировали с применением G-окрашивания (Saccone et al., Proc. Natl. Acad. Sci. USA, 89: 10 4913-4917, 1992), и результаты представлены на фиг.6. Фиг.6 подтверждает, что мезенхимальная стволовая клетка имеет нормальный кариотип XY+44.
(3) Подтверждение функции (способности к дифференцировке) мезенхимальных стволовых клеток
Для подтверждения способности к дифференцировке мезенхимальных стволовых клеток (на 129 сутки культивирования), полученных в примере 1, проводили анализ с применением ранее описанного способа (Tiziano Barberi et al., PLoS Medicine, 2:0554-0560, июнь 2005; и Kitsie J.Penick et al., Biotechniques, 39:687-691, 2005). В частности, индуцировали дифференцировку мезенхимальных стволовых клеток в адипоциты, хондроциты, остеоциты и миоциты, а затем анализировали генную экспрессию, специфичную для соответствующих клеток, посредством реакции иммуноокрашивания. Результаты клеточной дифференцировки показаны на фиг.7a.
Адипоциты окрашивали красителем Oil Red O, который окрашивает вкрапления адипоцитов, а хондроциты окрашивали на аггрекан и коллаген II, которые представляют собой специфичные для них белки, с применением реакции антиген-антитело. Кроме того, дифференцировку остеоцитов подтверждали посредством окрашивания по фон Коссу, которое выявляет образование минералов, а дифференцировку миоцитов подтверждали посредством MYF 5, который представляет собой специфичный для них белок, с применением реакции антиген-антитело.
Кроме того, уровни экспрессии соответствующих генов, специфичных для адипоцитов, хондроцитов, остеоцитов и миоцитов, оценивали посредством ПЦР в период дифференцировки мезенхимальных стволовых клеток в соответствующие клетки, и результаты показаны на фиг.7b. Фиг.7b подтверждает экспрессию Serbf и PPARγ в адипоцитах, ALP, остеокальцина и остеопонтина в остеоцитах, аггрекана в хондроцитах и MyoD в миоцитах, соответственно. Приведенные выше результаты ясно показывают, какие из мезенхимальных стволовых клеток, полученных согласно способу по настоящему изобретению, сохраняют плюрипотентность - способность дифференцироваться в адипоциты, хондроциты, остеоциты и миоциты.
(4) Подтверждение образования опухоли с применением иммунодефицитных мышей
Анализировали образование опухолей для мезенхимальных стволовых клеток по настоящему изобретению, полученных с применением иммунодефицитных мышей в примере 1. Эмбриональные стволовые клетки человека применяли для контроля эксперимента. В частности, иммунодефицитным мышам инъецировали 1×107 мезенхимальных стволовых клеток и 3×106 эмбриональных стволовых клеток человека из Госпиталя Сеульского Национального Университета, результаты аутопсии через 12 недель показаны на фиг.8a. Фиг.8a подтверждает, что тератома развивалась у мышей, которым инъецировали эмбриональные стволовые клетки человек из Госпиталя Сеульского Национального Университета, и тератома не развивалась у мышей, которым инъецировали мезенхимальные стволовые клетки по настоящему изобретению. Кроме того, подтверждали посредством FACS, что факторы, ассоциированные с индукцией иммунного ответа, не экспрессировались, и результаты показаны на фиг.8b. В качестве контроля применяли IgG. Фиг.8b подтверждает, что HLA-DR и HLA-DQ, которые представляют собой молекулы МНС II, экспрессирующиеся при наличии иммуногенности, не экспрессировались в качестве поверхностных факторов, и также не экспрессировались B7-2 и B7-1, которые представляют собой костимуляторы, ассоциированные с индукцией иммунного ответа.
В заключение подтверждали, что образование опухоли не индуцировалось даже при пересадке мезенхимальных стволовых клеток по настоящему изобретению мышам в количестве, приблизительно в три или более раз превышающем число эмбриональных стволовых клеток контроля, и факторы, ассоциированные с индукцией иммунного ответа, не экспрессировались даже в период длительного культивирования в течение 12 недель. Таким образом, ясно показано, что мезенхимальные стволовые клетки по настоящему изобретению не характеризуются риском образования опухоли.
(5) Оценка функциональности с применением модели ишемического сердечно-сосудистого заболевания
Для оценки функциональности мезенхимальных стволовых клеток по настоящему изобретению, полученных в примере 1, в отношении ишемического сердечно-сосудистого заболевания, применяли мышиную модель ишемического сердечно-сосудистого заболевания. После пересадки мышам с указанным выше заболеванием 5×104 мезенхимальных стволовых клеток на одну мышь (на 129 сутки культивирования) определяли функциональность мезенхимальных стволовых клеток на 8 неделе, и результаты показаны на фиг.9.
На фиг.9a и 9b показано сердце, в которое пересаживали мезенхимальные стволовые клетки, и сердце, в которое не пересаживали мезенхимальные стволовые клетки. Фиброз визуализировали посредством окрашивания MT, и синие участки на изображении соответствуют фиброзу. На фиг.9a и 9b показано, что утончение сердечной стенки, вызванное фиброзом, было меньше в сердечной ткани, в которую пересаживали клетки (фиг.9a), чем в сердечной ткани, в которую не пересаживали клетки (фиг.9a). Другими словами, фиброз сердечной стенки возникает при ишемическом сердечном заболевании, и вследствие этого сердечная стенка утончается. Однако при пересадке мезенхимальных стволовых клеток по настоящему изобретению утончение сердечной стенки, возникающее вследствие фиброза, можно предотвратить. Кроме того, на фиг.9c представлены результаты численно выраженной оценки фиброзного участка сердечной стенки в поврежденной области, которые ясно показывают, что фиброзный участок уменьшался в группе, которой пересаживали клетки, по сравнению с контрольной группой, которой не пересаживали клетки. На фиг.9d представлены результаты проведения Эхо-КГ с последовательными измерениями в течение 8 недель. Показатели эхокардиограммы на 4 неделе и 8 неделе подтверждают, что движения сердечной стенки были лучше в группе, которой пересаживали клетки, по сравнению с контрольной группой. LVEDD соответствует диастоле, LVFS соответствует систоле, и поскольку значение LVEDD меньше, а значение LVFS больше, это означает, что сердечная функция лучше.
Результаты подтверждают, что при пересадке мезенхимальных стволовых клеток по настоящему изобретению модельным мышам с сердечно-сосудистым ишемическим заболеванием сердечная стенка не утончалась, мезенхимальные стволовые клетки замещали мертвую ткань, и, таким образом, фиброзный участок, вызывающий нарушение функции сердца, сокращался, тем самым помогая лечению сердечно-сосудистого заболевания.
(6) Изучение функциональности клеток в качестве аутологичных фидерных клеток
Изучали возможность применения мезенхимальных стволовых клеток по настоящему изобретению, полученных в примере 1, в качестве фидерных клеток для поддержания плюрипотентных стволовых клеток человека в недифференцированном состоянии. В настоящем эксперименте культивирование проводили в отсутствие bFGF, который представляет собой фактор, поддерживающий недифференцированное состояние плюрипотентных стволовых клеток человека.
В частности, культивировали линию эмбриональных стволовых клеток человека № 3 из Госпиталя Сеульского Национального Университета (SNUhES3) с применением в качестве фидерных клеток мезенхимальных стволовых клеток (SNU3MSC-1) по настоящему изобретению, полученных посредством индукции дифференцировки линии эмбриональных стволовых клеток человека № 3 из Госпиталя Сеульского Национального Университета (SNUhES3). Подтверждали, что при культивировании эмбриональных стволовых клеток человека в отсутствие фактора bFGF, поддерживающего недифференцированное состояние, недифференцированное состояние эмбриональных стволовых клеток человека сохранялось даже спустя 30 или более пассажей (смотрите фиг.10). Фиг.10 показывает, что ОСТ-4, SSEA-4 и TRA-1-60, которые представляют собой маркеры плюрипотентных стволовых клеток человека, экспрессировались даже спустя 30 пассажей, и это подтверждает, что их недифференцированное состояние сохранялось. В заключение подтверждали, что при применении мезенхимальных стволовых клеток по настоящему изобретению в качестве аутологичных фидерных клеток при культивировании плюрипотентных стволовых клеток человека недифференцированное состояние плюрипотентных стволовых клеток можно поддерживать в течение длительного времени даже без добавления bFGF, который традиционно добавляли по мере необходимости для подержания недифференцированного состояния плюрипотентных стволовых клеток во время их культивирования.
Пример 3: Получение мезенхимальных стволовых клеток из эмбриональных стволовых клеток человека из Медицинского Центра Ча и эмбриональных стволовых клеток человека H9 и их характеристики
Проводили эксперименты для подтверждения того, можно ли применять способ получения мезенхимальных стволовых клеток по настоящему изобретению к плюрипотентным стволовым клеткам человека с различным генетическим фоном и/или условиями культивирования, то есть проверяли его воспроизводимость. Эксперимент проводили способом, аналогичным способу в примере 1 по настоящему изобретению, за исключением того, что применяли линию эмбриональных стволовых клеток человека № 3 из Медицинского Центра Ча (CHA3-hESC) и эмбриональные стволовые клетки человека H9 с различным генетическим фоном и/или условиями культивирования из эмбриональных стволовых клеток человека из Госпиталя Сеульского Национального Университета. В частности, после прикрепления эмбриоидных телец на 14 сутки культивирования индуцировали спонтанную дифференцировку в мезенхимальные стволовые клетки в основной среде для культивирования без дополнительного внесения цитокина, а затем получали мезенхимальные стволовые клетки посредством поддержания и культивирования с пролиферацией с применением среды EGM-2MV.
На фиг.11 представлены результаты оценки воспроизводимости способа получения мезенхимальных стволовых клеток по настоящему изобретению с применением линии эмбриональных стволовых клеток человека № 3 из Медицинского Центра Ча (CHA3-hESC) и эмбриональных стволовых клеток человека H9 с различным генетическим фоном и/или условиями культивирования из эмбриональных стволовых клеток человека из Госпиталя Сеульского Национального Университета.
Как видно из фиг.11a и 11b, мезенхимальные стволовые клетки, полученные из Медицинского Центра Ча (на 90 сутки культивирования), и мезенхимальные стволовые клетки, полученные из клеток H9 (на 90 сутки культивирования), имели фенотип, типичный для мезенхимальных стволовых клеток. Кроме того, результаты анализа белковой экспрессии, полученные с применением флуоресцентного клеточного сортера, подтвердили наличие экспрессии CD105, CD73, CD29, CD44 и CD90, которые представляют собой белки, специфичные для мезенхимальных стволовых клеток, и отсутствие экспрессии SSEA-1, SSEA-4 и TRA-1-60, которые представляют собой маркеры, специфичные для эмбриональных стволовых клеток, и CD45 и CD34, которые представляют собой маркеры, полученные из других зародышевых листков [смотрите фиг.11c (D90, мезенхимальные стволовые клетки, полученные из клеток из Медицинского Центра Ча, и фиг.11 (D90, мезенхимальные стволовые клетки, полученные из клеток H9)].
Кроме того, результаты анализа кариотипов мезенхимальных стволовых клеток, полученных из клеток из Медицинского Центра Ча (на 90 сутки культивирования) и мезенхимальных стволовых клеток, полученных из клеток H9 (на 90 сутки культивирования) с применением G-окрашивания (Saccone et al., Proc. Natl. Acad. Sci. USA, 89:4913-4917, 1992), подтверждают, что эти клетки имеют нормальный кариотип XY+44 (смотрите фиг.11e и 11f, соответственно).
Приведенные выше результаты подтверждают, что способ получения мезенхимальных стволовых клеток из плюрипотентных стволовых клеток человека по настоящему изобретению может быть стандартизированным способом культивирования мезенхимальных стволовых клеток, который можно применять к плюрипотентным стволовым клеткам человека с различным генетическим фоном и/или условиями культивирования.
Настоящее изобретение относится к стандартизированному способу индукции дифференцировки и культивирования с пролиферацией мезенхимальных стволовых клеток, который можно широко применять ко всем плюрипотентным стволовым клеткам человека независимо от различий их генетического фона. Кроме того, настоящее изобретение относится к промышленному получению мезенхимальных стволовых клеток как лучших источников для средств клеточной терапии, позволяющему сохранять идентичность мезенхимальных стволовых клеток. Далее, настоящее изобретение помогает избежать риска заражения чужеродными патогенами вследствие индукции чужеродных фидерных клеток и повреждений клеток, которое может возникать вследствие сортировки посредством флуоресцентного клеточного сортера (FACS), и обеспечивает высокоэффективное получение мезенхимальных стволовых клеток при низкой стоимости. Наконец, настоящее изобретение обеспечивает удобное промышленное получение мезенхимальных стволовых клеток, которые оптимальны для применения в регенеративной медицине и клеточной терапии, посредством применения плюрипотентных стволовых клеток человека, тем самым реализуя практическое применение средств клеточной терапии. Кроме того, ожидают, что настоящее изобретение внесет большой вклад в лечение неизлечимых заболеваний, таких как сердечно-сосудистые заболевания и неврологические нарушения.
По настоящему изобретению мезенхимальные стволовые клетки можно промышленно получать как лучший источник средств клеточной терапии с низкой стоимостью, сохраняя при этом их идентичность. Наконец, настоящее изобретение можно применять для удобного промышленного получения мезенхимальных стволовых клеток, которые оптимальны для применения в регенеративной медицине и клеточной терапии посредством применения плюрипотентных стволовых клеток человека, тем самым реализуя практическое применение клеток в качестве средств лечения. Кроме того, ожидают, что настоящее изобретение внесет большой вклад в лечение неизлечимых заболеваний, таких как сердечно-сосудистые заболевания и неврологические нарушения.





Изобретение относится к области генетической инженерии, тканевых технологий и медицины. Способ получения мезенхимальных стволовых клеток из плюрипотентных линий стволовых клеток человека включает получение эмбриоидных телец из плюрипотентных стволовых клеток человека, прикрепление эмбриоидных телец к чашке Петри для индукции спонтанной дифференцировки эмбриоидных телец в мезенхимальные стволовые клетки, культивирование с пролиферацией мезенхимальных стволовых клеток при сохранении идентичности мезенхимальных стволовых клеток, и где индукция спонтанной дифференцировки стадии происходит путем формирования петель аутологичного цитокина без добавления внешнего цитокина, также соответствующие клетки, их применение, набор и способ культивирования. Изобретение может быть использовано для получения мезенхимальных стволовых клеток в регенеративной медицине и клеточной терапии. 7 н. и 8 з.п. ф-лы, 11 ил., 3 пр.
1. Способ получения мезенхимальных стволовых клеток из линий плюрипотентных стволовых клеток человека, где способ включает:
а) получение эмбриоидных телец из плюрипотентных стволовых клеток человека;
b) прикрепление эмбриоидных телец к чашке для культивирования для индукции спонтанной дифференцировки эмбриоидных телец в мезенхимальные стволовые клетки; и
c) культивирование с пролиферацией мезенхимальных стволовых клеток при сохранении идентичности мезенхимальных стволовых клеток, и где индукция спонтанной дифференцировки стадии b) происходит путем формирования петель аутологичного цитокина без добавления внешнего цитокина.
2. Способ по п.1, где линии плюрипотентных стволовых клеток человека стадии a) культивируют в течение 14 суток с получением эмбриоидных телец.
3. Способ по п.1, где эмбриоидные тельца стадии b) культивируют в основных компонентах модифицированной по Дульбекко среды Игла (DMEM), содержащей эмбриональную телячью сыворотку (FBS), тем самым индуцируя их дифференцировку.
4. Способ по п.1, где аутологичный цитокин представляет собой морфогенетический белок кости (ВМР).
5. Способ по п.1, где мезенхимальные стволовые клетки стадии с) культивируют с применением среды, содержащей эпидермальный фактор роста человека (hEGF), фактор роста эндотелия сосудов (VEGF), основной фактор роста фибробластов человека (hFGF-B), инсулиноподобный фактор роста (IGF-1), гидрокортизон и аскорбиновую кислоту.
6. Мезенхимальные стволовые клетки, полученные способом по любому из пп.1-5, и где мезенхимальные стволовые клетки экспрессируют один или более маркер, выбранный из группы, состоящей из CD73(+), CD105(+), CD34(-), CD45(-).
7. Применение средства клеточной терапии, содержащего мезенхимальные стволовые клетки по п.6 для клеточной терапии.
8. Применение по п.7, где мезенхимальные стволовые клетки образуют клетки, выбранные из группы, состоящей из адипоцитов, остеоцитов, хондроцитов, миоцитов, нейроцитов и кардиомиоцитов.
9. Применение мезенхимальных стволовых клеток, полученных способом по любому из пп.1-5, в качестве фидерных клеток для культивирования клеток человека.
10. Применение по п.9, где клетки представляют собой линии плюрипотентных стволовых клеток.
11. Применение по п.10, где линии плюрипотентных стволовых клеток человека проходят 30 пассажей.
12. Фидерные клетки для культивирования клеток человека, содержащие мезенхимальные стволовые клетки, полученные способом по любому из пп.1-5.
13. Фидерные клетки по п.12, где клетки человека представляют собой линию плюрипотентных стволовых клеток человека.
14. Набор для получения мезенхимальных стволовых клеток человека из линий плюрипотентных стволовых клеток человека, содержащий:
а) среду для эмбриональных стволовых клеток, без основного фактора роста фибробластов (bFGF);
b) модифицированную по Дульбекко среду Игла (DMEM), содержащую 10% (об./об.) эмбриональную телячью сыворотку (FBS) без добавления внешнего цитокина; и
c) среду, содержащую эпидермальный фактор роста человека (hEGF), фактор роста эндотелия сосудов (VEGF), основной фактор роста фибробластов человека (hFGF-В), инсулиноподобный фактор роста (IGF-1), гидрокортизон и аскорбиновую кислоту.
15. Способ получения мезенхимальных стволовых клеток из линий плюрипотентных стволовых клеток человека, включающий:
а) культивирование линий плюрипотентных стволовых клеток человека и отбор эмбриоидных телец на 14 сутки культивирования;
b) прикрепление эмбриоидных телец к чашке для культивирования и культивирование эмбриоидных телец с применением модифицированной по Дульбекко среды Игла (DMEM), содержащей эмбриональную телячью сыворотку (FBS), с индукцией спонтанной дифференцировки эмбриоидных телец в мезенхимальные стволовые клетки путем формирования петель аутологичного цитокина без добавления внешнего цитокина; и
c) поддержание и культивирование с пролиферацией мезенхимальных стволовых клеток с применением среды, содержащей эпидермальный фактор роста человека (hEGF), фактор роста эндотелия сосудов (VEGF), основной фактор роста фибробластов человека (hFGF-B), инсулиноподобный фактор роста (IGF-1), гидрокортизон и аскорбиновую кислоту.
| US 7592176 B2, 22.09.2009 | |||
| Установка для определения влагосодержания губчатых и волокнистых материалов | 1986 |
|
SU1627913A1 |
| WO 2008098184 A2, 14.08.2008 | |||
| US 0007592176 B2, 22.09.2009 | |||
| СПОСОБ СОЗДАНИЯ РЕКОМБИНАНТНОГО АДЕНОВИРУСА ПТИЦ ДЛЯ ВАКЦИНАЦИИ И ГЕННОЙ ТЕРАПИИ | 2007 |
|
RU2326942C1 |
Авторы
Даты
2014-09-10—Публикация
2009-10-28—Подача