Изобретение относится к медицине, а именно к экспериментальной хирургии, и может быть использовано с целью профилактики кровотечений на фоне применения стрептокиназы в эксперименте.
Стрептокиназа широко используется при лечении инфаркта миокарда, тромбоэмболии легочной артерии (Савельев B.C., Чазов Е.И., Гусев Е.И., Кириенко А.И., Акчурин Р.С, Андрияшкин В.В., Арутюнов Г.П., Бицадзе В.О. и др. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений. Флебология. 2010; 4(1): 2-37; Torbicki A., Perrier A., Konstantinides S., Agnelli G., Galie N., Pruszczyk P. et al. Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). European Heart Journal 2008; 29(18): 2276-2315.). По данным различных исследований, одним из жизнеугрожающих осложнений при лечении стрептокиназой являются кровотечения различной локализации, развивающиеся вследствие избыточной активации плазминогена, образования большого количества плазмина, что приводит к распаду не только фибриновых сгустков, но и факторов свертывания крови -фибриногена (фактор I), факторов V и VIII. Частота тяжелых кровотечений при лечении стрептокиназой, по данным рандомизированных исследований, колеблется от 3,5% до 7,2%. (A Prospective Trial of Intravenous Streptokinase in Acute Myocardial Infarction (I.S.A.M.) // New England Journal of Medicine // 1986; 314: 1465-71).
В настоящее время нет единого подхода к профилактике кровотечений на фоне применения стрептокиназы. Существующие методы направлены только на коррекцию гемостаза при состоявшемся случае кровотечении. Поэтому поиск способов профилактики кровотечений на фоне применения стрептокиназы в настоящее время является актуальным.
Известен способ лечения кровотечений, вызванных применением стрептокиназы, путем использования транексамовой кислоты. Транексамовая кислота обладает способностью ингибировать активацию плазминогена в плазмин, благодаря чему оказывает гемостатическое действие при активации фибринолитических реакций (Транексам (Tranexamic acid): инструкция, применение и формула //Код СAS 1197-18-8// Регистр лекарственных средств, РЛС // 2013 г.). Показания к ее применению: кровотечения или риск их развития на фоне генерализованного усиления фибринолиза (кровотечения во время операций и в послеоперационном периоде, послеродовые кровотечения, ручное отделение последа, отслойка хориона, кровотечение при беременности, злокачественные новообразования поджелудочной и предстательной желез, гемофилия, геморрагические осложнения фибринолитической терапии, тромбоцитопеническая пурпура, лейкозы, заболевания печени, предшествующая терапия стрептокиназой).
При генерализованном фибринолизе препарат вводят внутривенно капельно в разовой дозе 15 мг/кг массы тела каждые 6-8 ч, скорость введения 1 мл/мин.
При простатэктомии или операции на мочевом пузыре вводят внутривенно во время операции 1 г, затем по 1 г каждые 8 ч в течение 3 дней, после чего переходят на прием внутрь до исчезновения макрогематурии.
При высоком риске развития кровотечения, при системной воспалительной реакции вводят внутривенно в дозе 10-11 мг/кг за 20-30 мин до вмешательства.
Однако применение транексамовой кислоты сопряжено с развитием побочных явлений, таких как сыпь, кожный зуд, снижение аппетита, тошнота, диарея, изжога, сонливость, нарушение цветового зрения, судорожные припадки и острая почечная недостаточность (Montes FR, Pardo DF, Carreno M, Arciniegas С, Dennis RJ, Umana JP // Risk factors associated with postoperative seizures in patients undergoing cardiac surgery who received tranexamic acid: a case-control study. Annals of Cardiac Anaesthtsia. 2012 Jan-Mar; 15(1): 6-12).
Кроме того, при сочетанном применении транексамовой кислоты с другими гемостатическими препаратами возможна активация свертывания крови и тромбообразование (Royston D. Tranexamic acid in cardiac surgery: is there a cause for concern?// Critical Care Journal. 2010; 14(5): 194; Sander M, Spies CD, Martiny V, Rosenthal C, Wernecke KD, von Heymann C. Mortality associated with administration of high-dose tranexamic acid and aprotinin in primary open-heart procedures: a retrospective analysis. Critical Care Journal. 2010; 14(4):R148).
Известен способ лечения кровотечений, возникших при лечении стрептокиназой, путем применения апротинина. Апротинин - поливалентный ингибитор сериновых протеиназ, получаемый из внутренних органов крупного рогатого скота, ингибируя плазмин, способен снижать фибринолитическую активность крови и уменьшать тяжесть кровотечений. При кровотечениях начальная доза составляет 300000 АТрЕ (225564 КИЕ), последующие - 140000 АТрЕ (105263 КИЕ) каждые 4 ч внутривенно медленно.
(Апротинин (Aprotinin): инструкция, применение и формула // Код С AS 9087-70-1 // Регистр лекарственных средств, РЛС //2013 г.).
Однако известный способ обладает большим количеством побочных эффектов: инфаркта миокарда, инсульта, анафилактического шока, острой почечной недостаточности, психотических реакций (Апротинин (трасилол): возможные серьезные побочные реакции. // Безопасность лекарств и фармаконадзор. - 2011. -№3. - С.29-28; Mouton R, Finch D, Davies I, et al. Effect of aprotinin on renal dysfunction in patients undergoing on-pump and off-pump cardiac surgery: a retrospective observational study. Lancet 2008; 371:475-482).
Авторы предлагают безопасный и эффективный способ профилактики кровотечений, вызванных применением стрептокиназы, в эксперименте, позволяющий клинически значимо предотвращать кровотечения.
Техническим результатом заявляемого изобретения является создание эффективного способа профилактики кровотечений, вызванных применением стрептокиназы, перед хирургическими вмешательствами.
Технический результат достигается путем внутривенного введения раствора фибрин-мономера в дозе 0,25 мг/кг за один час до оперативного вмешательства.
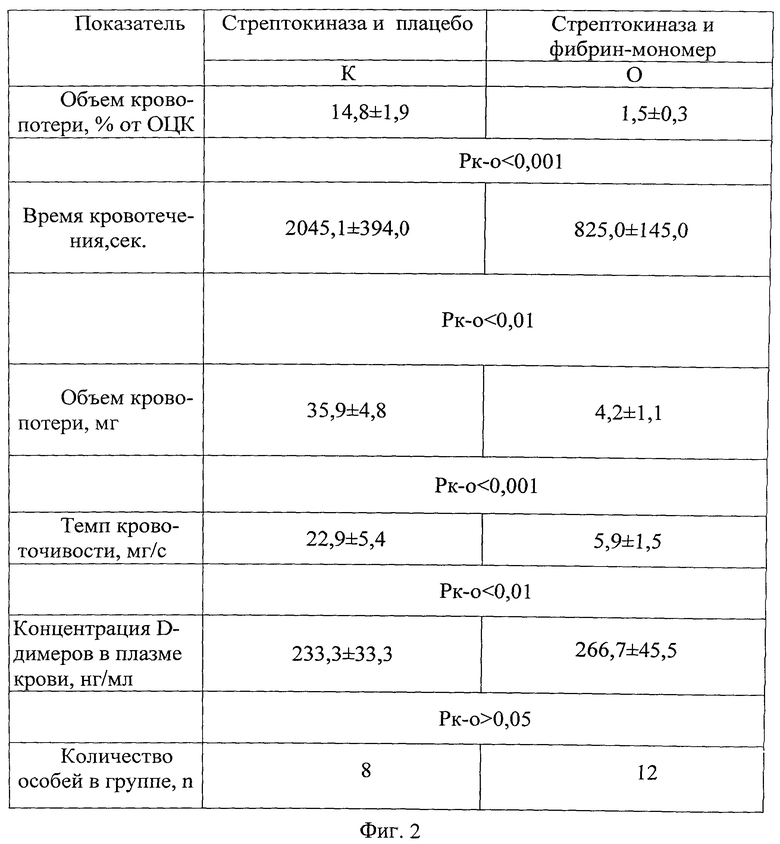
Эффективность заявляемого способа подтверждена фигурами 1 и 2 в виде таблиц.
На фигуре 1 представлен подбор эффективной и безопасной дозы фибрин-мономера.
На фигуре 2 проиллюстрированы показатели кровоточивости у животных контрольной и опытной групп.
На фигурах 1 и 2 даны следующие обозначения:
1. 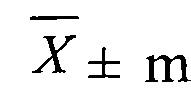 , где
, где 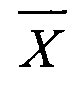 - выборочное среднее; m - стандартная ошибка выборочного среднего.
- выборочное среднее; m - стандартная ошибка выборочного среднего.
2. Объем кровопотери (в % от объема циркулирующей крови - ОЦК)- часть потерянной крови от общего ее циркулирующего объема (ОЦК), выраженная в процентах.
3. Концентрация D-димеров (в нг/мл) - содержание продуктов деградации стабилизированного фибрина в плазме крови, являющихся маркерами образования фибрина и его растворения под действием плазмина.
4. Темп кровоточивости (в мг/с) - объем кровопотери (в мг) в минуту (с).
5. p - уровень статистической значимости различий сравниваемых показателей.
6. n - количество животных в группе. Способ осуществляют следующим образом.
В эксперименте используют кроликов-самцов породы «Шиншилла» средней массой 2-4 кг.
Для профилактики кровотечения используют производное фибриногена из плазмы крови человека - фибрин-мономер (ООО фирма «Технология-Стандарт»), представляющий собой лиофильно высушенный растворимый порошок белого цвета с мочевиной, расфасованный в пенициллиновом флаконе, закрытом резиновой пробкой и обжатом алюминиевым колпачком, в количестве 22 мг во флаконе. Раствор готовят следующим образом: во флакон с лиофильно высушенным фибрин-мономером с мочевиной добавляли 2 мл стерильной дистиллированной воды для инъекций, перемешивали аккуратным покачиванием без образования пены до полного растворения вещества в течение 2-3 минут. Полученный раствор содержал фибрин-мономер в концентрации 11 мг/мл и мочевину в концентрации 150 мг/мл.
В качестве контроля используют плацебо - раствор мочевины, не содержащий активного вещества фибрин-мономера в концентрации 150 мг/кг. Во флакон с лиофильно высушенной мочевиной добавляют 2 мл стерильной дистиллированной воды для инъекций, перемешивают аккуратным покачиванием до полного растворения вещества в течение 2-3 минут.
Наиболее эффективная дозировка фибрин-мономера была подобрана экспериментально. В эксперименте было использовано 68 кроликов-самцов. Все животные были поделены на 7 групп. Доза фибрин-мономера была подобрана из диапазона дозировок от 0,1 мг/кг до 5,0 мг/кг массы тела. Данные подтверждены фигурой 1.
Схема эксперимента
Первая группа состояла из 8 животных, которым внутривенно вводили плацебо в объеме 0,5 мл. Спустя один час после введения раствора плацебо проводили забор крови из краевой вены уха для оценки концентрации D-димеров в плазме крови. Описано, что увеличение концентрации D-димеров в плазме крови сопровождает венозный тромбоз и тромбоэмболию легочной артерии (Савельев B.C., Чазов Е.И., Гусев Е.И., Кириенко А.И. и др. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений // Флебология. - 2010. - Т.4, №1, выпуск 2. - С.2-37). После этого животных наркотизировали и им выполняли срединную лапаротомию по белой линии живота под общим обезболиванием. В рану выводили левую долю печени и на ее диафрагмальной поверхности наносили стандартной по площади и глубине травму при помощи специального приспособления-ограничителя (металлической пластины с круглым отверстием в центре). Срезанный сегмент в вертикальной проекции имел вид круга или эллипса, его размеры и форма были постоянны (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / под ред. Р.Ю. Хабриева. - 2 изд., перераб. и доп. - М.: ОАО Издательство «Медицина», 2005. - 828 с.). Образовавшаяся кровоточащая рана с ровными краями и равномерной кривизной имела диаметр примерно 1,5 см, глубину примерно 0,5 см. После нанесения стандартной травмы замеряли объем кровопотери. Данный показатель определяли путем промакивания предварительно взвешенных сухих стерильных салфеток кровью из раны печени до полной остановки кровотечения с формированием стабильного сгустка. Салфетки взвешивали на электронных весах сразу же после промакивания. Вес всех салфеток суммировали и учитывали объем потерянной крови. Объем кровопотери рассчитывали в процентах от общего ее циркулирующего объема.
Вторая группа состояла из 9 животных, которой внутривенно вводили фибрин-мономер в дозе 0,1 мг/кг.
Третья группа состояла из 11 животных, которым внутривенно вводили фибрин-мономер в дозе 0,25 мг/кг.
Четвертая группа состояла из 10 животных, которым внутривенно вводили фибрин-мономер в дозе 0,5 мг/кг.
Пятая группа состояла из 10 животных, которым внутривенно вводили фибрин-мономер в дозе 1,0 мг/кг.
Шестая группа состояла из 11 животных, которым вводили внутривенно вводили фибрин-мономер в дозе 2,5 мг/кг.
Седьмая группа состояла из 9 животных, которым внутривенно вводили фибрин-мономер в дозе 5,0 мг/кг.
Спустя один час после введения раствора фибрин-мономера у животных каждой из групп проводили забор крови из краевой вены уха для оценки концентрации D-димеров в плазме крови. После этого животных наркотизировали и им выполняли срединную лапаротомию по белой линии живота под общим обезболиванием с травмой печени и определением объема кровопотери по описанной выше схеме.
Как видно из фигуры 1, наиболее эффективными дозами фибрин-мономера для статистически значимого уменьшения кровопотери являются 0,25 мг/кг и 2,5 мг/кг. В то же время дозы фибрин-мономера выше 1,0 мг/кг обладают значительной тромбогенностью, которая оценивалась по нарастанию концентрации D-димеров в плазме крови, являющихся классическим маркером фибринообразования и фибринолиза. Таким образом в качестве наиболее эффективной и безопасной для дальнейших экспериментов была определена доза фибрин-мономера 0,25 мг/кг.
Для исследования эффективности заявляемого способа все животные были разделены на две группы. Первая группа животных - контрольная (n=12; получала внутривенно стрептокиназу и плацебо. Вторая группа животных - опытная (n=8) получала внутривенно стрептокиназу и фибрин-мономер.
Схема эксперимента
1. Контрольная группа: Перед введением стрептокиназы проводится забор крови из краевой вены уха (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под ред. Р.Ю. Хабриева, 2 изд., перераб. и доп. М.: ОАО «Издательство «Медицина», 2005, 828 с.) для исследования исходных показателей системы гемостаза. Препарат стрептокиназа вводится внутривенно в дозе 10000 МЕ/кг в течение 5 минут. Далее через 1 час внутривенно вводится раствор плацебо в дозе 0,5 мл. Экспозиция 1 час. После чего проводится повторный забор крови для проведения анализа показателей системы гемостаза.
После забора крови животные наркотизируются, и им выполняется срединная лапаротомия по белой линии живота под общим обезболиванием. В рану выводится левая доля печени и на ее диафрагмальной поверхности наносится стандартная по площади и глубине травма при помощи специального приспособления-ограничителя (металлической пластины с круглым отверстием в центре). Срезанный сегмент в вертикальной проекции имел вид круга или эллипса, его размеры и форма были постоянны (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под ред. Р.Ю. Хабриева, 2 изд., перераб. и доп. М.: ОАО «Издательство «Медицина», 2005, 828 с.). Образовавшаяся кровоточащая рана с ровными краями и равномерной кривизной имела диаметр примерно 1,5 см, глубину примерно 0,5 см.
После нанесения стандартной травмы замеряется объем кровопотери. Данный показатель определяется путем промакивания предварительно взвешенных сухих стерильных салфеток кровью из раны печени до полной остановки кровотечения с формированием стабильного сгустка. Салфетки взвешиваются на электронных весах сразу же после промакивания. Вес всех салфеток суммируется, и учитывается объем потерянной крови. Объем кровопотери рассчитывается в процентах от общего ее циркулирующего объема.
2. Опытная группа: Перед введением стрептокиназы проводится забор крови из краевой вены уха (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под ред. Р.Ю. Хабриева, 2 изд., перераб. и доп. М.: ОАО «Издательство «Медицина», 2005, 828 с.) для исследования исходных показателей системы гемостаза.
Препарат стрептокиназа вводится внутривенно в дозе 10000 МЕ/кг в течение 5 минут. Далее через 1 час внутривенно вводится препарат фибрин мономер в дозировке 0,25 мг/кг. Экспозиция 1 час. После чего проводится повторный забор крови для проведения анализа показателей системы гемостаза.
После забора крови животные наркотизируются и им выполняется срединная лапаротомия по белой линии живота под общим обезболиванием. В рану выводится левая доля печени и на ее диафрагмальной поверхности наносится стандартная по площади и глубине травма при помощи специального приспособления-ограничителя (металлической пластины с круглым отверстием в центре). Срезанный сегмент в вертикальной проекции имел вид круга или эллипса, его размеры и форма были постоянны (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под ред. Р.Ю. Хабриева, 2 изд., перераб. и доп. М.: ОАО «Издательство «Медицина», 2005, 828 с.). Образовавшаяся кровоточащая рана с ровными краями и равномерной кривизной имела диаметр примерно 1,5 см, глубину примерно 0,5 см.
После нанесения стандартной травмы замеряется объем кровопотери. Данный показатель определяется путем промакивания предварительно взвешенных сухих стерильных салфеток кровью из раны печени, до полной остановки кровотечения с формированием стабильного сгустка. Салфетки взвешиваются на электронных весах сразу же после промакивания. Вес всех салфеток суммируется и учитывается объем потерянной крови. Объем кровопотери рассчитывается в процентах от общего ее циркулирующего объема.
Способ проиллюстрирован фигурой 2, где приведены сравнительные данные объема кровопотери (в % от ОЦК), времени кровотечения, темпа кровоточивости, позволяющие продемонстрировать эффективность заявляемого способа.
На фигуре 2 видно, что объем кровопотери (в % от ОЦК) в опытной группе меньше аналогичного показателя контрольной группы в 9,87 раза. Время кровотечения в опытной группе меньше показателя контрольной группы в 2,48 раза, темп кровоточивости меньше показателя контрольной группы в 3,88 раза.
Кроме того, гемостатический эффект препарата фибрин-мономер не сопровождался усилением фибринообразования и опасностью формирования тромбоза, на что указывает отсутствие увеличения уровня D-димеров в плазме крови.
Проведенное исследование показывает, что использование препарата фибрин-мономер на фоне предварительного введения стрептокиназы является эффективным способом профилактики кровотечений. Заявляемый способ приводит не только к значительному уменьшению объема, темпа и времени кровопотери в эксперименте у животных, но и не повышает вероятность возникновения внутрисосудистого тромбоза.
Заявляемый способ найдет широкое применение в практической медицине.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОФИЛАКТИКИ ИНТРАОПЕРАЦИОННЫХ КРОВОТЕЧЕНИЙ, ВЫЗВАННЫХ ВВЕДЕНИЕМ ГЕПАРИНА ДО ОПЕРАЦИИ | 2013 |
|
RU2544805C1 |
| СПОСОБ ПРОФИЛАКТИКИ КРОВОТЕЧЕНИЙ, ВЫЗВАННЫХ ПРИМЕНЕНИЕМ ДАБИГАТРАНА ЭТЕКСИЛАТА, В ЭКСПЕРИМЕНТЕ | 2013 |
|
RU2552331C1 |
| Способ профилактики кровотечений, вызванных применением антиагрегантов, в эксперименте | 2017 |
|
RU2645630C1 |
| Способ профилактики кровотечений, вызванных применением варфарина в эксперименте | 2016 |
|
RU2645414C1 |
| КОМБИНАТОРНАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ГЕМОРРАГИЧЕСКОГО ШОКА | 2015 |
|
RU2651778C2 |
| КОМБИНАТОРНАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ГЕМОРРАГИЧЕСКОГО ШОКА | 2018 |
|
RU2663464C1 |
| СПОСОБ ЛЕЧЕНИЯ ОТРАВЛЕНИЯ АНТИКОАГУЛЯНТАМИ МЕЛКИХ ДОМАШНИХ ЖИВОТНЫХ | 2023 |
|
RU2830182C1 |
| ИММОБИЛИЗИРОВАННЫЙ ПРОДУЦИРУЕМЫЙ БАКТЕРИЯМИ BACILLUS LICHENIFORMIS СУБТИЛИЗИН, ОБЛАДАЮЩИЙ ТРОМБОЛИТИЧЕСКИМ И АНТИКОАГУЛЯНТНЫМ СВОЙСТВАМИ | 2008 |
|
RU2416643C2 |
| Способ лечения кровотечений из верхних отделов желудочно-кишечного тракта | 2016 |
|
RU2657756C2 |
| ИСПОЛЬЗОВАНИЕ АКТИВИРОВАННОГО ФАКТОРА VII СВЕРТЫВАНИЯ КРОВИ ДЛЯ ЛЕЧЕНИЯ ОБШИРНЫХ КРОВОТЕЧЕНИЙ, ВЫЗВАННЫХ ТРОМБОЛИТИЧЕСКОЙ ТЕРАПИЕЙ | 2001 |
|
RU2286796C2 |
(57) Изобретение относится к области ветеринарии и предназначено для профилактики кровотечений, вызванных применением стрептокиназы, в эксперименте. Кроликам-самцам породы шиншилла за один час до хирургического вмешательства внутривенно вводят раствор. Ратсвор готовят следующим образом: в лиофильно высушенный фибрин-мономер с мочевиной добавляют стерильную дистиллированную воды для инъекций, так чтобы полученный раствор содержал фибрин-мономер в концентрации 11 мг/мл и мочевину в концентрации 150 мг/мл, и перемешивают до полного растворения вещества. При этом доза фибрин-мономера составляет 0,25 мг/кг. Способ высокоэффективен для профилактики кровотечений, вызванных применением стрептокиназы, перед хирургическими вмешательствами. 1 пр., 2 ил.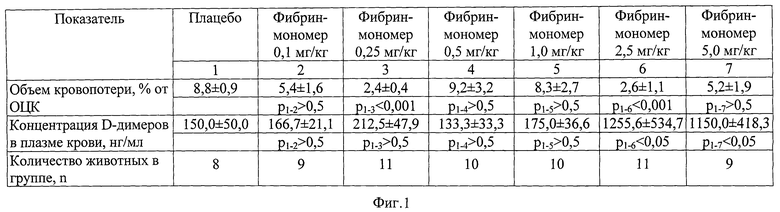
Способ профилактики кровотечений, вызванных применением стрептокиназы, в эксперименте, заключающийся в том, что кроликам-самцам породы шиншилла за один час до хирургического вмешательства внутривенно вводят раствор, который готовят следующим образом: в лиофильно высушенный фибрин-мономер с мочевиной добавляют стерильную дистиллированную воду для инъекций, так чтобы полученный раствор содержал фибрин-мономер в концентрации 11 мг/мл и мочевину в концентрации 150 мг/мл, и перемешивают до полного растворения вещества, при этом доза фибрин-мономера составляет 0,25 мг/кг.
| WO 2008092656 A1, 07.08.2008 | |||
| RU 2005140621 A, 26.12.2005 | |||
| ГЕМОСТАТИЧЕСКОЕ СРЕДСТВО | 2005 |
|
RU2308287C2 |
| RU 2003122362 А, 10.02.2005 | |||
Авторы
Даты
2015-06-10—Публикация
2014-02-19—Подача