Изобретение относится к области медицины, а именно к экспериментальной хирургии, и может быть использовано с целью профилактики кровотечения на фоне применения гепарина.
Гепарин повсеместно используют у больных кардиологического и хирургического профиля с целью профилактики и лечения тромбозов, однако его применение влечет за собой риск возможных осложнений в виде кровотечений из операционной раны и других источников (Савельев B.C., Чазов Е.И., Гусев Е.И., Кириенко А.И. и др. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений // Флебология. - 2010. - Т. 4, №1. - Выпуск 2. - С. 2-37.).
Одной из малорешенных проблем клинической хирургии является необходимость оперативного вмешательства у больных, получающих антикоагулянты, что опасно развитием интраоперационного кровотечения, поэтому создание эффективных способов профилактики кровотечений с использованием новых современных препаратов является актуальным.
Известен способ профилактики кровотечений, позволяющий эффективно нейтрализовать антикоагулянтный эффект гепарина, с помощью внутривенного введения протамина сульфата (Морозов Ю.А., Чарная М.А., Гладышева В.Г. Нарушения гемостаза как причина повышенной кровоточивости после операций на сердце в условиях искусственного кровообращения. Анестезиологи и реаниматология 2004; 2: 30-32) Протамина сульфат представляет собой пептид, получаемый из семенников промысловых видов рыб в виде сульфата, и используется для нейтрализации антикоагулянтного эффекта гепарина благодаря своему аминокислотному составу - 67% аминокислотного состава протамина составляет аргинин, который делает его сильно щелочным поликатионным веществом. Механизм действия протамина сульфата объясняется образованием неактивного стехиометрического комплекса «гепарин-протамин».
Однако применение протамина сульфата для блокирования антикоагулянтного эффекта гепарина приводит к ряду негативных последствий: нарушает структуру фибринового сгустка, снижает функцию тромбоцитов (Mochizuka Т., Olson P.J., Szlam F. et al. Protamine reversal of heparin affects platelet aggregation and activated clotting time after cardiopulmonary bypass. Anesth Analg 1998; 87: 4: 781-785.); вызывает тяжелые гемодинамические осложнения, способные привести к летальному исходу (Seifer Н.А., Jobes D.R., Ten Have Т. et al. Adverse events after protamine administration following cardiopulmonary bypass in infants and children. Anesth Analg 2003;. 97: 2: 383-389; Welsby I.J., Newman M.F., Phillips-Bute B. et al. Hemodynamic changes after protamine administration: association with mortality after coronary artery bypass surgery. Anesthesiology 2005; 102). Кроме того, протамина сульфат является чужеродным для человека белком и вызывает тяжелые аллергические реакции (Трекова Н.А., Соловова Л.Е., Кузнецов Р.В., Асмангулян Е.Т. Эпидемиология и профилактика анафилактоидных реакций у кардиохирургических больных. Анестезиология и реаниматология 2000; 5: 21-25). Большой проблемой, связанной с применением протамина сульфата, является отсутствие единого подхода к подбору оптимальной дозы препарата, необходимой для адекватной нейтрализации гепарина (Svenarud Р., Ovrum Ε. Clinical effects of different protamine doses after cardiopulmonary bypass. Asisan Cardiovasc. Thorac. Ann. 2002; 10:2:119-123). Авторы предлагают эффективный способ профилактики интраоперационных кровотечений, вызванных введением гепарина до операции, позволяющий клинически значимо предотвращать кровотечение. Техническим результатом заявляемого изобретения является создание эффективного способа профилактики интраоперационных кровотечений, вызванных введением гепарина до операции.
Технический результат достигается путем внутривенного введения кроликам-самцам за один час до оперативного вмешательства в эксперименте раствора, содержащего фибрин-мономер в концентрации 11 мг/мл и мочевин в концентрации 150 мг/мл, при этом доза фибрин-мономера составляет 0,25 мг/кг.
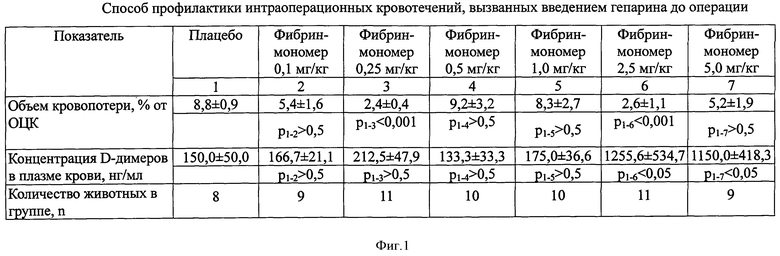
Способ осуществляют следующим образом. Эффективность заявляемого способа подтверждена фигурами 1 и 2 в виде таблиц. На фигуре 1 представлены данные подбора эффективной и безопасной дозы фибрин-мономера. На фигуре 2 даны показатели кровоточивости и системы гемостаза у животных контрольной и опытной групп. На фигурах 1 и 2 даны следующие обозначения:
1. 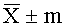
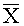
2. Объем кровопотери (в % от ОЦК) - часть потерянной крови от общего ее циркулирующего объема (ОЦК), выраженная в процентах.
3. Концентрация D-димеров (в нг/мл) - содержание продуктов деградации стабилизированного фибрина в плазме крови, являющихся маркерами образования фибрина и его растворения под действием плазмина.
4. АПТВ - активированное парциальное тромбопластиновое время.
5. p - уровень статистической значимости различий сравниваемых показателей.
6. n - количество животных в группе.
В эксперименте используют кроликов-самцов породы шиншилла массой 2-4 кг.
Для профилактики кровотечения используют производное фибриногена из плазмы крови человека - фибрин-мономер (ООО фирма «Технология-Стандарт»), представляющий собой лиофильно высушенный растворимый порошок белого цвета с мочевиной, расфасованный в пенициллиновом флаконе, закрытом резиновой пробкой и обжатом алюминиевым колпачком, в количестве 22 мг во флаконе. Раствор фибрин-мономера для внутривенного введения готовят следующим образом: во флакон с лиофильно высушенным фибрин-мономером с мочевиной добавляют 2 мл стерильной дистиллированной воды для инъекций, перемешивают аккуратным покачиванием без образования пены до полного растворения вещества в течение 2-3 минут. Полученный раствор содержит фибрин-мономер в концентрации 11 мг/мл и мочевину в концентрации 150 мг/мл.
В качестве контроля используют раствор плацебо, представляющий собой раствор мочевины в концентрации 150 мг/мл, не содержащий активного вещества фибрин-мономера. Во флакон с лиофильно высушенным раствором мочевины (мочевина-производитель) добавляют 2 мл стерильной дистиллированной воды для инъекций, перемешивают аккуратным покачиванием до полного растворения вещества в течение 2-3 минут.
Наиболее эффективная дозировка фибрин-мономера была подобрана экспериментально. В эксперименте было использовано 68 кроликов-самцов. Все животные были поделены на 7 групп. Доза фибрин-мономера была выбрана из диапазона дозировок от 0,1 мг/кг до 5,0 мг/кг массы тела. Данные подтверждены фигурой 1.
Подбор эффективной и безопасной дозировки фибрин-мономера осуществляют следующим образом.
Экспериментальных животных поделили на семь групп.
Первая группа состояла из 8 животных, которым внутривенно вводили плацебо в объеме 0,5 мл. Спустя один час после введения раствора плацебо проводили забор крови из краевой вены уха для оценки концентрации D-димеров в плазме крови. Описано, что повышение уровня D-димеров в плазме крови сопровождает венозные тромбозы и тромбоэмболию легочной артерии (Савельев B.C., Чазов Е.И., Гусев Е.И., Кириенко А.И. и др. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений // Флебология. - 2010. - Т. 4, №1. - выпуск 2. - С.2-37.). После этого животных наркотизировали и им выполнялась срединная лапаротомия по белой линии живота под общим обезболиванием. В рану выводили левую долю печени и на ее диафрагмальной поверхности наносили стандартную по площади и глубине травму при помощи специального приспособления-ограничителя (металлической пластины с круглым отверстием в центре). Срезанный сегмент в вертикальной проекции имеет вид круга или эллипса, его размеры и форма постоянны (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под ред. Р.Ю. Хабриева, 2 изд., перераб. и доп.; М.; ОАО «Издательство «Медицина», 2005, - 828 с). Образовавшаяся кровоточащая рана с ровными краями и равномерной кривизной имеет диаметр 1,5 см, глубину 0,5 см. После нанесения стандартной травмы замеряется объем кровопотери. Данный показатель определяется путем промакивания предварительно взвешенных сухих стерильных салфеток кровью из раны печени до полной остановки кровотечения с формированием стабильного сгустка. Салфетки взвешиваются на электронных весах сразу же после промакивания. Вес всех салфеток суммируется, и учитывается объем потерянной крови. Объем кровопотери рассчитывается в процентах от общего ее циркулирующего объема.
Вторая группа состояла из 9 животных, которым внутривенно вводится фибрин-мономер в дозе 0,1 мг/кг.
Третья группа - из 11 животных, которым внутривенно вводится фибрин-мономер в дозе 0,25 мг/кг.
Четвертая группа - из 10 животных, которым внутривенно вводится фибрин-мономер в дозе 0,5 мг/кг.
Пятая группа - из 10 животных, которым внутривенно вводится фибрин-мономер в дозе 1,0 мг/кг.
Шестая группа - из 11 животных, которым внутривенно вводится фибрин-мономер в дозе 2,5 мг/кг.
Седьмая группа - из 9 животных, которым внутривенно вводится фибрин-мономер в дозе 5,0 мг/кг.
Спустя один час после введения раствора фибрин-мономера у животных каждой из групп проводился забор крови из краевой вены уха для оценки концентрации D-димеров в плазме крови. После этого животных наркотизировали и им выполнялась срединная лапаротомия по белой линии живота под общим обезболиванием с травмой печени и определением объема кровопотери по описанной выше схеме.
Как видно из фигуры 1, наиболее эффективными дозами фибрин-мономера для статистически значимого уменьшения кровопотери являются 0,25 мг/кг и 2,5 мг/кг. В то же время дозы фибрин-мономера выше 1,0 мг/кг обладают значительной тромбогенностью, которая оценивалась по нарастанию концентрации D-димеров в плазме крови, являющихся классическим маркером фибринообразования и фибринолиза. Таким образом, в качестве наиболее эффективной и безопасной для дальнейших экспериментов была выбрана доза фибрин-мономера 0,25 мг/кг.
Для исследования эффективности заявляемого способа все животные были разделены на две группы: контрольную и опытную. Первая группа - контрольная, состоящая из 9 животных, получала гепарин и плацебо. Вторая группа животных - опытная, состоящая из 14 животных, получала гепарин и фибрин-мономер в дозе 0,25 мг/кг. Данные подтверждены фигурой 2.
Схема эксперимента.
За 1 час до выполнения лапаротомии у животных контрольной группы из краевой вены уха забирают кровь (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под ред. Р.Ю. Хабриева, 2 изд., перераб. и доп.; М.; ОАО «Издательство «Медицина», 2005, - 828 с. ) для исследования исходных показателей системы гемостаза и вводят в краевую вену уха плацебо в объеме 0,5 мл. За 15 минут до выполнения лапаротомии в краевую вену уха вводят гепарин из расчета 150 ЕД/кг массы тела кролика. Непосредственно перед выполнением лапаротомии проводится повторный забор крови из краевой вены уха для оценки системы гемостаза. Спустя один час после введения раствора плацебо животные наркотизируются и им выполняется срединная лапаротомия по белой линии живота под общим обезболиванием. В рану выводится левая доля печени и на ее диафрагмальной поверхности наносится стандартная по площади и глубине травма при помощи специального приспособления-ограничителя (металлической пластины с круглым отверстием в центре). Срезанный сегмент в вертикальной проекции имеет вид круга или эллипса, его размеры и форма постоянны (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под ред. Р.Ю. Хабриева, 2 изд., перераб. и доп.; М.; ОАО «Издательство «Медицина», 2005, - 828 с.). Образовавшаяся кровоточащая рана с ровными краями и равномерной кривизной имеет диаметр 1,5 см, глубину 0,5 см. После нанесения стандартной травмы замеряется объем кровопотери. Данный показатель определяли путем промакивания предварительно взвешенных сухих стерильных салфеток кровью из раны печени, до полной остановки кровотечения с формированием стабильного сгустка. Салфетки взвешиваются на электронных весах сразу же после промакивания. Вес всех салфеток суммируется, и учитывается объем потерянной крови. Объем кровопотери рассчитывается в процентах от общего ее циркулирующего объема.
За 1 час до выполнения лапаротомии у животных опытной группы из краевой вены уха забирается кровь (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под ред. Р.Ю. Хабриева, 2 изд., перераб. и доп.; М.; ОАО «Издательство «Медицина», 2005, - 828 с. ) для исследования исходных показателей системы гемостаза и вводится в краевую вену уха фибрин-мономер в дозировке 0,25 мг/кг массы тела кролика. За 15 минут до выполнения лапаротомии в краевую вену уха вводят гепарин из расчета 150 ЕД/кг массы тела кролика. Непосредственно перед выполнением лапаротомии проводится повторный забор крови из краевой вены уха для оценки системы гемостаза. Спустя один час после введения фибрин-мономера животные наркотизируются и им выполняется срединная лапаротомия по белой линии живота под общим обезболиванием. В рану выводится левая доля печени и на ее диафрагмальной поверхности наносится стандартная по площади и глубине травма при помощи специального приспособления-ограничителя (металлической пластины с круглым отверстием в центре). Срезанный сегмент в вертикальной проекции имеет вид круга или эллипса, его размеры и форма постоянны (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под ред. Р.Ю. Хабриева, 2 изд., перераб. и доп.; М.; ОАО «Издательство «Медицина», 2005, - 828 с.). Образовавшаяся кровоточащая рана с ровными краями и равномерной кривизной имеет диаметр 1,5 см, глубину 0,5 см. После нанесения стандартной травмы замеряется объем кровопотери. Данный показатель определяют путем промакивания предварительно взвешенных сухих стерильных салфеток кровью из раны печени, до полной остановки кровотечения с формированием стабильного сгустка. Салфетки взвешивают на электронных весах сразу же после промакивания. Вес всех салфеток суммируется и учитывается объем потерянной крови. Объем кровопотери рассчитывается в процентах от общего ее циркулирующего объема.
Как видно из фигуры 2, объем кровопотери (в % от объема циркулирующей крови) в опытной группе по сравнению с контрольной был ниже в 5,7 раз (p<0,001).
По представленным данным при сравнении показателей системы гемостаза в обеих группах животных был продемонстрирован эффект действия гепарина в виде резкого удлинения активированного парциального тромбопластинового времени.
Таким образом, заявляемый способ обладает высокой эффективностью, так как не только снижает объем кровопотери, но и не вызывает тяжелые гемодинамические нарушения и аллергические реакции.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОФИЛАКТИКИ КРОВОТЕЧЕНИЙ, ВЫЗВАННЫХ ПРИМЕНЕНИЕМ ДАБИГАТРАНА ЭТЕКСИЛАТА, В ЭКСПЕРИМЕНТЕ | 2013 |
|
RU2552331C1 |
| Способ профилактики кровотечений, вызванных применением антиагрегантов, в эксперименте | 2017 |
|
RU2645630C1 |
| СПОСОБ ПРОФИЛАКТИКИ КРОВОТЕЧЕНИЙ, ВЫЗВАННЫХ ПРИМЕНЕНИЕМ СТРЕПТОКИНАЗЫ, В ЭКСПЕРИМЕНТЕ | 2014 |
|
RU2552339C1 |
| Способ профилактики кровотечений, вызванных применением варфарина в эксперименте | 2016 |
|
RU2645414C1 |
| СПОСОБ ЛЕЧЕНИЯ ИШЕМИЧЕСКИХ НАРУШЕНИЙ ПЕЧЕНИ | 2014 |
|
RU2563796C1 |
| ГЕМОСТАТИЧЕСКОЕ СРЕДСТВО | 2005 |
|
RU2308287C2 |
| Способ моделирования "шокового легкого | 1988 |
|
SU1603425A1 |
| ИММОБИЛИЗИРОВАННЫЙ ПРОДУЦИРУЕМЫЙ БАКТЕРИЯМИ BACILLUS LICHENIFORMIS СУБТИЛИЗИН, ОБЛАДАЮЩИЙ ТРОМБОЛИТИЧЕСКИМ И АНТИКОАГУЛЯНТНЫМ СВОЙСТВАМИ | 2008 |
|
RU2416643C2 |
| Модель закрытой тупой тяжелой травмы печени с коагулопатией у мелких лабораторных животных | 2018 |
|
RU2674379C1 |
| СПОСОБ ГЕМОСОРБЦИИ У СОБАК | 2007 |
|
RU2363420C2 |
Изобретение относится к медицине, в частности к экспериментальной хирургии, и может быть использовано для профилактики интраоперационных кровотечений на фоне введения гепарина до операции. При проведении эксперимента кроликам-самцам за один час до оперативного вмешательства осуществляют внутривенное введение раствора, содержащего фибрин-мономер в концентрации 11 мг/мл и мочевину в концентрации 150 мг/мл. При этом доза фибрин-мономера составляет 0,25 мг/кг. Способ обладает высокой эффективностью, так как не только снижает объем кровопотери, но и не вызывает тяжелые гемодинамические нарушения и аллергические реакции. 2 ил.
Способ профилактики интраоперационных кровотечений, вызванных введением гепарина до операции, включающий внутривенное введение кроликам-самцам за один час до оперативного вмешательства в эксперименте раствора, содержащего фибрин-мономер в концентрации 11 мг/мл и мочевину в концентрации 150 мг/мл, при этом доза фибрин-мономера составляет 0,25 мг/кг.
| МОРОЗОВ Ю.А | |||
| и др | |||
| Нарушения гемостаза как причина повышенной кровоточивости после операций на сердце в условиях искусственного кровообращения | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| СПОСОБ ТРОМБОПРОФИЛАКТИКИ ПОСЛЕ РЕКОНСТРУКТИВНЫХ ВМЕШАТЕЛЬСТВ НА МАГИСТРАЛЬНЫХ ВЕНАХ МЕЗЕНТЕРИКО-ПОРТАЛЬНОЙ СИСТЕМЫ | 2007 |
|
RU2353305C2 |
| СПОСОБ ВЫБОРА ПРИМЕНЕНИЯ ГЕПАРИНА ДЛЯ ПРОФИЛАКТИКИ ТРОМБОТИЧЕСКИХ ОСЛОЖНЕНИЙ | 2009 |
|
RU2408288C1 |
| Способ индивидуального подбора лечебной дозы при гепаринотерапии | 1985 |
|
SU1410984A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ДИФФЕРЕНЦИРОВАННОГО НАЗНАЧЕНИЯ ОРАЛЬНЫХ АНТИКОАГУЛЯНТОВ БОЛЬНЫМ С ОСТРЫМ КОРОНАРНЫМ СИНДРОМОМ БЕЗ ПОДЪЕМА СЕГМЕНТА ST | 2004 |
|
RU2275639C1 |
| JP 5122562 B2,16.01.2013 | |||
| КУДРЯШОВ Б | |||
| А. | |||
Авторы
Даты
2015-03-20—Публикация
2013-12-30—Подача