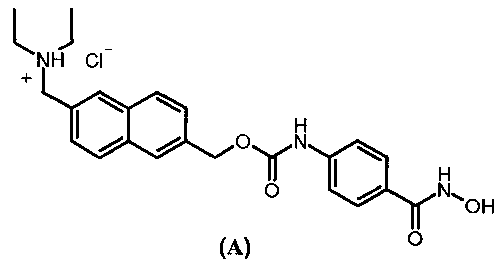
Гидрохлорид (6-диэтиламинометил-2-нафталенил)метилового эфира (4-гидроксикарбамоилфенил)-карбаминовой кислоты, также известный как ITF 2357 с Международным непатентованным названием (INN) Givinostat®, представляет собой органическое соединение с иммуносупрессивной и противовоспалительной активностью, в настоящее время проходящее клинические испытания на эффективность в лечении некоторых заболеваний, касательно ингибирующей способности данного соединения в отношении гистонной дезацетилазы.
Структура данной молекулы приведена ниже.

ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Заявка US 6034096 раскрывает приготовление соединения по формуле (А), в то время как заявка US 7329689 описывает характеристики и приготовление моногидратной полиморфной формы соединения (А), названной полиморфной формой I.
Заявка US 6034096, пример 12, в частности, раскрывает приготовление соединения (А), при котором продукт изолируют в виде белого твердого вещества с температурой плавления 162-165°С (с разложением). В заявке US 7329689, со ссылкой на US 6034096, указано, что продукт, получаемый в соответствии с патентом US 6034096, представляет собой безводный, аморфный, гигроскопичный и растворяющийся продукт, который трудно удерживать в стабильном состоянии. В заявке US 7329689 описана новая моногидратная кристаллическая форма соединения (А), в особенности эффективная в промышленном применении благодаря стабильности формы и простоте удержания в стабильном состоянии по сравнению с описанным выше безводным продуктом.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью данного изобретения является новая полиморфная форма соединения (А), а также способы ее получения. Новая кристаллическая форма, являющаяся целью заявленного изобретения, далее по тексту указывается как полиморфная форма II соединения (А) и характеризуется наличием более высокой водорастворимости по сравнению с моногидратом, описанным в патенте US 7329689, т.е. полиморфной формой I соединения (А).
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет профиль порошковой рентгеновской дифракции (PXRD) формы II соединения ITF 2357.
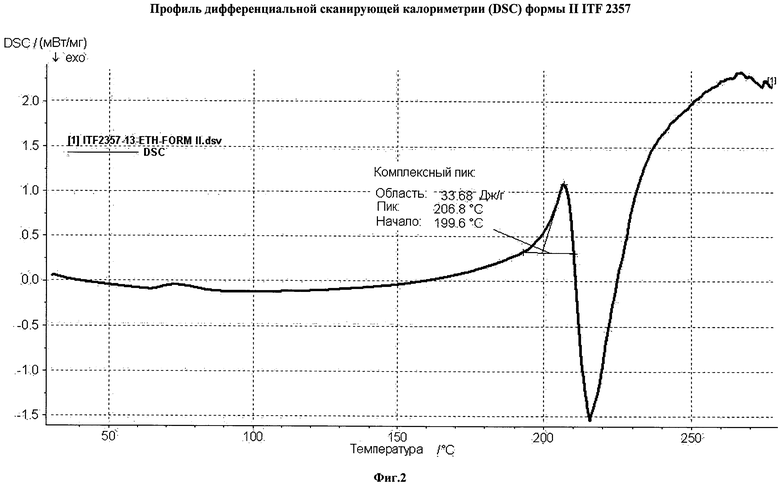
Фиг. 2 представляет профиль дифференциальной сканирующей калориметрии (DSC) формы II соединения ITF 2357.
Фиг. 3 представляет профиль термогравиметрии ТГА (TGA) формы II ITF 2357.
Фиг. 4 представляет профиль Фурье-ИК спектроскопии (FTIR) формы II ITF 2357.
Фиг. 5 представляет профиль дифрактограмм стабильности ITF 2357 формы II при 40°С, относительной влажности 75% в различных временных точках. В частности, первая снизу дифрактограмма выполнена во временной точке 0, вторая снизу дифрактограмма выполнена через 2 дня, третья снизу дифрактограмма выполнена через 7 дней и четвертая снизу дифрактограмма выполнена через 15 дней.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Во время испытаний, направленных на выявление новых твердых форм соединения (А), случайно обнаружили новую кристаллическую форму II данного соединения, причем параметры растворимости данной формы более предпочтительны по сравнению с известной моногидратной формой I, а именно новая форма II обладает большей растворимостью по сравнению с формой I. Данные параметры нового полиморфа представляют особенный интерес, учитывая то, что водная растворимость соединения оказывает влияние на биодоступность упомянутого соединения (см. Pharmaceutical Research, Vol. 12, n. 3, 1995, стр. 413 "correlations between in vitro dissolution and in vivo bioavailability are extensive…"), определяя, таким образом, возможные пути введения соединения (А) в более биодоступной форме, повышая потенциал применения активного ингредиента и возможность варьирования его дозировки.
А именно провели сравнительный эксперимент формы I соединения (А) (моногидрат, приготовленный в соответствии с описанием в US 7329689) и формы II соединения (А), являющегося целью заявленного изобретения.
10 мг соединения (А) в кристаллической форме I взболтали в 10 мл 0,9% раствора хлорида натрия (изотонический раствор) при 37°С в течение 24 часов. В конце измерили концентрацию продукта в жидкой фазе.
Таблица 1 представляет полученные данные растворимости.
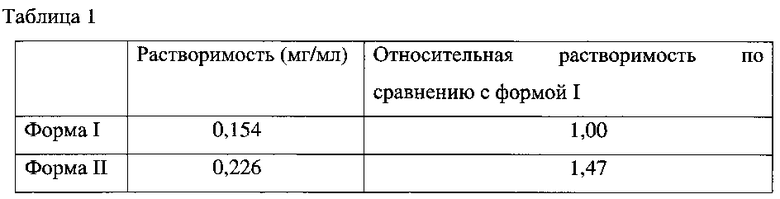
Приведенные данные подтверждают, что растворимость новой формы II в 1.47 раз выше, чем растворимость противопоставленной известной формы I. Кристаллическая форма II ITF 2357 характеризуется наличием профиля порошковой рентгеновской дифракции (PXRD) в соответствии с фиг.1, и/или профиля дифференциальной сканирующей калориметрии (DSC) в соответствии с фиг.2, и/или ТГ-профиля (термогравиметрия, ТГА) в соответствии с фиг. 3, и/или профиля Фурье-ИК спектроскопии (FTIR) в соответствии с фиг. 4. Ниже обозначены характерные пики, которые различают вышеупомянутые графики PXRD, DSC, TGA и FTIR.
Таким образом, целью заявленного изобретения является гидрохлорид (6-диэтиламинометил-2-нафталенил)метилового эфира (4-гидроксикарбамоилфенил)-карбаминовой кислоты в кристаллической форме II, характеризующейся наличием спектра порошковой рентгеновской дифракции (PXRD) в соответствии с фиг. 1, причем отличительные пики зафиксированы в следующих положениях 2 тета: 5.10; 10.07; 14.90; 15.15; 15.67; 17.24; 17.84; 18.51; 19.23; 20.25; 20.37; 22.01; 22.63; 23.12; 24.76; 25.40; 27.78; 28.97; 31.02 градусов, с пределом погрешности по значению, указанному для каждого пика ±0.20 градусов (2 тета).
Таблица 2 представляет данные по пикам, наблюдаемым на дифрактограмме PXRD.
Кристаллическая форма II характеризуется наличием профиля дифференциальной сканирующей калориметрии DSC, представленным на фиг.2. Такой график показывает эндотермический пик - вследствие плавления продукта - с началом пика при 199.6°С, пиком при 206.8°С и энтальпией плавления при 33.7 Дж/г.Таким образом, предпочтительным вариантом практического воплощения заявленного изобретения является кристаллическая форма II ITF 2357 с профилем DSC, показывающим эндотермический пик с началом пика в пределах между 199 и 201°С, пиком между 206 и 207°С и энтальпией плавления между 15 и 40 Дж/г. Кристаллическая форма II гидрохлорид (6-диэтиламинометил-2-нафталенил)метилового эфира (4-гидроксикарбамоилфенил)-карбаминовой кислоты характеризуется наличием ТГ-профиля, представленного на фиг. 3. Данный график не отражает значительных изменений в потере массы до достижения температуры 200°С, выше которой имеет место прогрессирующая потеря массы, вероятно, вследствие распада образца.
Кристаллическая форма II гидрохлорид (6-диэтиламинометил-2-нафталенил)метилового эфира (4-гидроксикарбамоилфенил)-карбаминовой кислоты характеризуется наличием Фурье-ИК спектра, представленным на фиг.4 (дисперсия в вазелиновом масле), причем отличительные пики наблюдали в следующих частотах: 3265; 3117; 2578; 1731; 1640; 1556; 1504; 1471; 1406; 1314; 1272; 1259; 1212; 1167; 1151; 1128; 1055; 1021; 1010; 999; 894; 859; 816; 762; 740; 714 см-1, с пределом погрешности по значению, указанному для каждого пика ±2 (см-1).

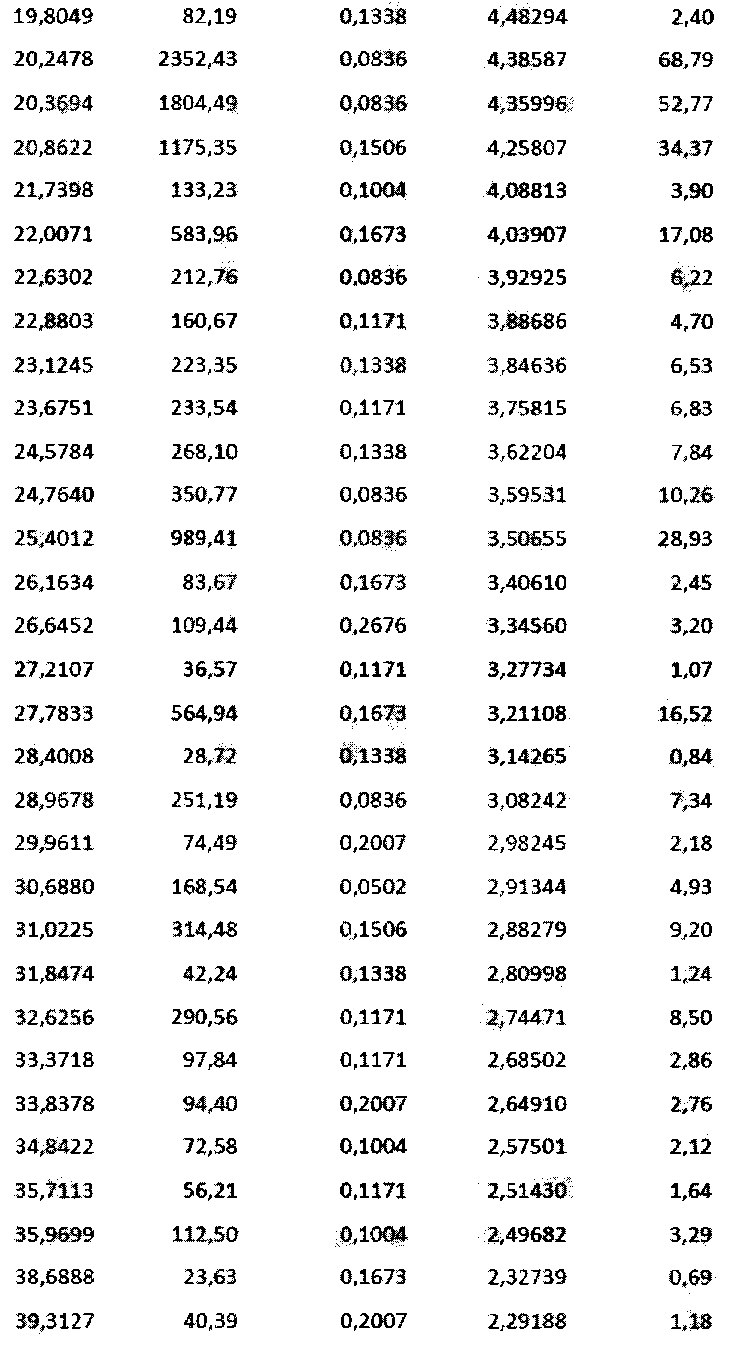
В таблицу 2 включены следующие обозначения: pos. - положение, Height - высота, FWHM - полная ширина на половине высоты, d-spacing - в-расстояние в ангстремах, rel. int. - отн. инт. (прим. переводчика).
Кристаллическую форму II ITF 2357, являющуюся целью заявленного изобретения, можно получить при помощи различных методов кристаллизации. Например, ее могут получить путем кристаллизации аморфного продукта, полученного по примеру 12 в заявке US 6034096, из растворителей, как, например, спирты, сложные эфиры, кетоны, простые эфиры, амиды, ароматические углеводороды, лифатические углеводороды, нитрилы и/или их смеси. В частности, предпочтительны спиртовые растворители С1-С6, сложные алкиловые эфиры С1-С6 карбоновых кислот С1-С6. Более предпочтительным вариантом практического воплощения является получение формы II посредством кристаллизации ITF 2357 из метанола, этанола, н-пропанола, изопропанола, н-бутанола, 2-метоксиэтанола, изобутанола и смеси метанола со сложными эфирами, как, например, метиловым эфиром муравьиной кислоты, этилацетатом, изопропилацетатом, н-пропил ацетатом, диэтилкарбонатом, этилбензоатом, смеси метанола с простыми эфирами, предпочтительно 1,4-диоксаном, тетрагидрофураном, 1,2-диметоксиэтаном, диизопропил эфиром, т-бутилметиловым эфиром, смеси ацетона с амидами, предпочтительно диметилформамидом или диметилацетамидом, смеси метанола и бензонитрила, смеси бензилового спирта и метилциклогексана, смеси метанола и толуена.
Испытания на стабильность провели на образцах формы II ITF 2357, причем результаты подтвердили стабильность. В частности, образец формы II ITF 2357 распределили тонким слоем толщиной примерно 0,5 см в чашку Петри и поместили в среду с постоянной влажностью 75%, при постоянной температуре 40°С в течение двух недель. Образцы взяли через 2, 7 и 15 дней и подвергли порошковой рентгеновской дифракции (PXRD). Результаты проведенных экспериментов представлены на фиг. 5, причем дифрактограммы, полученные на образцах различных партий, обозначены с наложением. Фиг. 5 однозначно показывает, что в ни в одном из исследованных образцов не наблюдали каких-либо модификаций, и, таким образом, кристаллическая форма II ITF 2357 показывает высокую стабильность даже в условиях хранения.
Также целью заявленного изобретения являются фармацевтические композиции, содержащие гидрохлорид (6-диэтиламинометил-2-нафталенил)метилового эфира (4-гидроксикарбамоилфенил)-карбаминовой кислоты в кристаллической форме II и фармацевтически приемлемый эксципиент и/или адъювант, причем упомянутые фармацевтические композиции предпочтительны в твердой форме, наиболее предпочтительны в форме таблеток.
Следующие примеры, подробно разъясняющие условия получения формы II ITF 2357, тем не менее не носят ограничительного характера относительно сути и объема правовой охраны заявленного изобретения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Выявление характеристик ITF 2357 в кристаллической форме II осуществили при помощи следующих методов спектроскопии, в соответствии с нижеприведенными условиями экспериментов.
Порошковая рентгеновская дифракция PXRD
Условия экспериментов
Фурье-ИК спектроскопия
Условия эксперимента
Шум фона по среднеквадратичному значению RMS
Дифференциальная сканирующая калориметрия DSC / термогравиметрия TGA
Условия эксперимента
Управление газовым потоком: 2 мгновенно выделяющийся газ и 1 защитный газ
DSC диапазон изменения температуры при нагревании: 30°С до 280°С
TGA диапазон изменения температуры при нагревании: 40°С до 500°С
ПРИМЕРЫ
Приготовление ITF 2357 с применением в качестве исходного материала в нижеприведенных примерах можно осуществить при помощи способов, описанных в заявках US6034096 или US7329689.
ПРИМЕР 1
Приготовление ITF2357 в кристаллической форме II путем кристаллизации из метанола
4,0 г ITF 2357 ввели в мерную колбу объемом 250 мл, затем добавили 80 мл метанола. Смесь перемешали и довели до (температуры) флегмы до полного растворения твердого вещества. Флегму поддерживали в течение 15′, затем смесь охладили до 25°С, оставив при помешивании при данных условиях в течение 1 часа. Затем полученный твердый остаток отфильтровали через бюхнеровскую воронку, промывая с 10 мл метанола. Получили 3,1 г влажного твердого вещества, которое высушили в ротационном испарителе при 45°С в течение ночного времени суток в вакууме (45 мм рт.ст.). Получили 2,1 г ITF 2357 в кристаллической форме II, что подтверждено порошковой рентгеновской дифракцией.
ПРИМЕР 2
Приготовление ITF 2357 в кристаллической форме II путем ресуспендирования в этаноле
4,0 г ITF 2357 и 180 мл абсолютизированного метанола добавили в мерную колбу объемом 250 мл. Смесь довели до (температуры) флегмы при помешивании, нерастворимый осадок отфильтровали при данной температуре, отмыли в этанолом и высушили при 45°С под вакуумом (45 мм рт.ст.) в течение 10 часов, получив 2,8 г ITF 2357 в кристаллической форме II.
ПРИМЕР 3
Приготовление ITF 2357 в кристаллической форме II путем ресуспендирования в изопропаноле
Добавили 4,0 г ITF 2357 и 40 мл изопропанола в мерную колбу объемом 250 мл. Смесь выдерживали при помешивании при 25°С в течение 8 часов, затем результирующий твердый остаток отфильтровали и отмыли в использованием 10 мл изопропанола. Полученный продукт высушивали в течение 16 часов при 40°С в вакууме (50 мм рт.ст.), получив 3,7 г ITF 2357 в кристаллической форме II.
ПРИМЕР 4
Приготовление ITF 2357 в кристаллической форме II путем кристаллизации из метанола - ацетона
Добавили 5,0 г ITF 2357 и 70 мл метанола в мерную колбу объемом 250 мл и довели до температуры флегмы (65°С); при данной температуре наблюдали полное растворение. Затем, примерно через 20 мин, к раствору добавили 44 мл ацетона. Наблюдали осаждение некоторого количества кристаллов. Температуру снизили до 25°С, с образованием обильного количества осадка (выделившейся фазы), который затем охладили до 5°С и оставили при помешивании при данных условиях в течение 30 минут. Затем твердое вещество отфильтровали через бюхнеровскую воронку, промывая с 10 мл ацетона. Получили 5,4 г влажного твердого вещества, которое высушили в вакууме (50 мм рт.ст.) при 45°С в течение 12 часов. Таким образом, получили 4,2 г ITF 2357 в кристаллической форме II.
ПРИМЕР 5
Приготовление ITF 2357 в кристаллической форме II путем кристаллизации из метанола - метил-трет-бутилового эфира
5,0 г ITF 2357 и 70 мл метанола добавили в мерную колбу объемом 250 мл и довели до температуры флегмы (65°С); при данной температуре наблюдали полное растворение. Затем, примерно через 10 мин, к раствору добавили 14 мл метил-трет-бутилового эфира.
Температуру снизили до 25°С, с образованием обильного количества осадка (выделившейся фазы), который оставили в состоянии помешивания при указанных условиях в течение 30 мин. Затем твердое вещество отфильтровали через бюхнеровскую воронку, промывая с 10 мл метил-трет-бутилового эфира. Получили 4,9 г влажного твердого вещества и высушили в вакууме (50 мм рт.ст.) при 45°С в течение 12 часов. Таким образом, получили 4,5 г ITF 2357 в кристаллической форме II.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ КРИСТАЛЛИЧЕСКИЕ ФОРМЫ НАТРИЕВОЙ СОЛИ(4-{ 4-[5-(6-ТРИФТОРМЕТИЛ-ПИРИДИН-3-ИЛАМИНО) ПИРИДИН-2-ИЛ] ФЕНИЛ} ЦИКЛОГЕКСИЛ) УКСУСНОЙ КИСЛОТЫ | 2011 |
|
RU2612556C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-[5-(3,5-ДИФТОРБЕНЗИЛ)-1Н-ИНДАЗОЛ-3-ИЛ]-4-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-2-(ТЕТРАГИДРОПИРАН-4-ИЛАМИНО)БЕНЗАМИДА | 2013 |
|
RU2602071C2 |
| СОЛИ ДАСАТИНИБА В АМОРФНОЙ ФОРМЕ | 2014 |
|
RU2655435C2 |
| СОЛИ ДАСАТИНИБА В КРИСТАЛЛИЧЕСКОЙ ФОРМЕ | 2014 |
|
RU2662805C2 |
| ФОРМА IV ИВАБРАДИНА ГИДРОХЛОРИДА | 2012 |
|
RU2619121C2 |
| Аморфная форма производного тиоколхицина | 2015 |
|
RU2684925C2 |
| СПОСОБ МОДИФИКАЦИИ ПРОЦЕССА ФОРМИРОВАНИЯ КРИСТАЛЛОВ ЛЕКАРСТВЕННОГО ВЕЩЕСТВА | 2004 |
|
RU2388757C2 |
| S-КРИСТАЛЛИЧЕСКАЯ ФОРМА ХЛОРИСТОВОДОРОДНОГО ИВАБРАДИНА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ЭТОЙ ФОРМЫ | 2014 |
|
RU2658824C2 |
| ПОЛИМОРФНЫЕ И АМОРФНЫЕ ФОРМЫ {2-ФТОР-5-[3-((Е)-2-ПИРИДИН-2-ИЛВИНИЛ)-1Н-ИНДАЗОЛ-6-ИЛАМИНО]ФЕНИЛ}АМИДА 2,5-ДИМЕТИЛ-2Н-ПИРАЗОЛ-3-КАРБОНОВОЙ КИСЛОТЫ | 2005 |
|
RU2324692C1 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 1-(5'-(5-(3,5-ДИХЛОРО-4-ФТОРФЕНИЛ)-5-(ТРИФТОРМЕТИЛ)-4,5-ДИГИДРОИЗОКСАЗОЛ-3-ИЛ)-3'Н-СПИРО[АЗЕТИДИН-3,1'-ИЗОБЕНЗОФУРАН]-1-ИЛ)-2-(МЕТИЛСУЛЬФОНИЛ)ЭТАНОНА | 2013 |
|
RU2614978C2 |




Изобретение относится к новой кристаллической форме соединения формулы (А), которая обладает более высокой растворимостью в воде и стабильностью при хранении. Новая кристаллическая форма II соединения формулы (А) характеризуется наличием профиля порошковой рентгеновской дифракции со следующими пиками ±0,20° (2 тета): 5,10; 10,07; 14,90; 15,15; 15,67; 17,24; 17,84; 18,51; 19,23; 20,25; 20,37; 22,01; 22,63; 23,12; 24,76; 25,40; 27,78; 28,97; 31,02. Изобретение относится также к способу получения соединения формулы (А) в кристаллической форме II и твердым фармацевтическим композициям, содержащим указанную кристаллическую форму. 3 н. и 8 з.п. ф-лы, 2 табл., 5 ил., 5 пр.
1. Соединение формулы (А):

в кристаллической форме II, характеризующееся наличием профиля порошковой рентгеновской дифракции со следующими пиками ±0,20° (2 тета): 5,10; 10,07; 14,90; 15,15; 15,67; 17,24; 17,84; 18,51; 19,23; 20,25; 20,37; 22,01; 22,63; 23,12; 24,76; 25,40; 27,78; 28,97; 31,02.
2. Соединение по п.1, характеризующееся наличием профиля дифференциальной сканирующей калориметрии (DSC), показывающим эндотермический пик с началом при 199-201°С, пиком при 206-207°С и энтальпией плавления 15-40 Дж/г.
3. Соединение по п.1, характеризующееся наличием профиля дифференциальной сканирующей калориметрии (DSC), показывающим эндотермический пик с началом при 199,6°С, пиком при 206,8°С и энтальпией плавления 33,7 Дж/г.
4. Соединение по п.1, характеризующееся наличием ТГ-профиля (термогравиметрия, TGA), причем до достижения температуры примерно 200°С не наблюдают сколь-нибудь значительных изменений в потере массы.
5. Соединение по п.1, имеющее Фурье-ИК спектр (FTIR) со следующими пиками (±2 см-1): 3265; 3117; 2578; 1731; 1640; 1556; 1504; 1471; 1406; 1314; 1272; 1259; 1212; 1167; 1151; 1128; 1055; 1021; 1010; 999; 894; 859; 816; 762; 740; 714 см-1.
6. Способ получения соединения формулы (А) в кристаллической форме II по любому из пп.1-5, характеризующийся тем, что осуществляют кристаллизацию соединения формулы (А)

из растворителей, таких как спирты, сложные эфиры, кетоны, простые эфиры, амиды, ароматические углеводороды, алифатические углеводороды, нитрилы, и/или из смесей, включающих компоненты из вышеперечисленного.
7. Способ по п.6, характеризующийся тем, что растворители представляют собой спирты С1-С6 и/или алкиловые эфиры С1-С6 карбоновых кислот С1-С6.
8. Способ по п.7, характеризующийся тем, что растворитель представляет собой метанол, этанол, н-пропанол, изопропанол, н-бутанол, 2-метоксиэтанол, изобутанол.
9. Способ по п.6, характеризующийся тем, что растворитель представляет собой смесь метанола со сложными эфирами, предпочтительно метиловым эфиром муравьиной кислоты, этилацетатом, изопропилацетатом, н-пропил ацетатом, диэтилкарбонатом, этилбензоатом, смесь метанола с простыми эфирами, предпочтительно 1,4-диоксаном, тетрагидрофураном, 1,2-диметоксиэтаном, диизопропил эфиром, т-бутилметиловым эфиром, смесь ацетона с амидами, предпочтительно диметилформамидом или диметилацетамидом, смесь метанола и бензонитрила, смесь бензилового спирта и метилциклогексана, смесь метанола и толуола.
10. Твердые фармацевтические композиции, содержащие соединения формулы (А) в кристаллической форме II по любому из пп.1-5 и, как минимум, один фармацевтически приемлемый эксципиент и/или адъювант.
11. Твердые фармацевтические композиции по п.10, характеризующиеся тем, что представлены в форме таблеток.
| СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ И ИММУНОДЕПРЕССИВНОЙ АКТИВНОСТЬЮ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1997 |
|
RU2177473C2 |
Авторы
Даты
2015-06-10—Публикация
2010-12-03—Подача