Дасатиниб, который также известен под названием BMS-354825, был описан в международной заявке WO 00/62778 и в патенте США 6,596,746. Дасатиниб, химически представляющий собой N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамид, имеет следующую структуру:
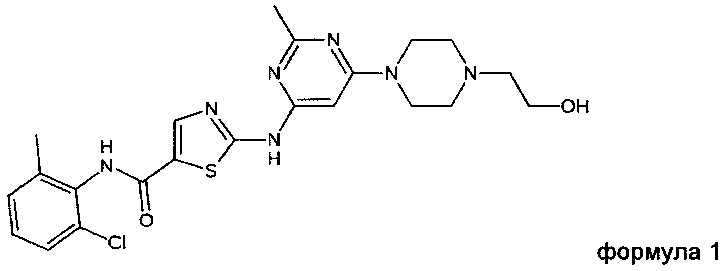
Дасатиниб представляет собой лекарственное средство, производимое компанией Bristol-Myers Squibb и продаваемое под торговым названием Sprycel® (которое содержит дасатиниба моногидрат в качестве действующего вещества). Дасатиниб представляет собой пероральный двойной ингибитор BCR/ABL и семейства тирозинкиназ Src, одобренный для применения на пациентах с хроническим миелогенным лейкозом (CML) после лечения иматинибом и острого лимфобластного лейкоза, осложненного филадельфийской хромосомой (Ph+ALL).
Настоящее изобретение, в первую очередь, касается соли дасатиниба, где соль находится в аморфной форме. Описанная аморфная соль дасатиниба является твердой в стандартных условиях (300K, атмосферное давление); она в типичном случае формируется с фармацевтически приемлемым кислотным органическим соединением, таким как карбоновая кислота или амид сульфокислоты, и обычно не требует присутствия других соединений, таких как тектоны или комплексообразователи, для стабилизации аморфной формы и/или предотвращения кристаллизации. Предпочтительно, указанная соль представляет собой соль, выбранную из группы, состоящей из дасатиниба никотината, дасатиниба глутарата и дасатиниба сахарината.
Настоящее изобретение также касается фармацевтических композиций, включающих указанную соль. Кроме того, настоящее изобретение касается также способов получения указанной соли. Настоящее изобретение касается также нескольких аспектов применения указанной соли или фармацевтической композиции для лечения заболевания. Дополнительные подробности, а также другие аспекты настоящего изобретения будут описаны ниже в настоящем тексте.
Для дасатиниба известно почти 60 твердых форм: моногидрат, четыре безводных и несольватированных формы, которые описаны в патенте США US 7491725 В2, патентной заявке на патент US 2006/0004067 А1, патенте США US 7973045 В2 и международной заявке WO 2010/067374, и обозначены в указанных источниках как формы N-6, Т1Н1-7, В и I. Другие формы (такие как 52 сольвата) известны из международной заявки WO 2007/035874, патентной заявки США US 2006/0004067 А, международной заявки WO 2009/053854 A2, патента США US 8067423 В, международной заявки WO 2010/062715 и патента Китая CN 102030745. В частности, международная заявка WO 2010/062715 включает растворители диметиловый эфир изосорбида, N,N'-диметилэтиленмочевину и N,N'-диметил-N,N'-пропиленмочевину. Диметиловый эфир изосорбида применяется в косметических и фармацевтических составах.
Некоторые соли дасатиниба в кристаллической форме, такие как дасатиниба гидрохлорид, были описаны в WO 2007/035874.
В WO 2010/081443 предложены определенные комплексы ингибиторов тирозинкиназ с тектонами, такими как альгиновые кислоты, пектины или бета-глюкан, которые могут содержать ингибитор тирозинкиназы в форме соли. В сообщении об исследовании 538 от 01 февраля 2009 года на странице 127 описан общий способ получения аморфных форм действующих веществ.
Открытие новых форм фармацевтически полезного соединения открывает возможности улучшения профиля рабочих характеристик фармацевтического продукта. Это расширяет спектр веществ, которые специалист по разработке препаратов имеет в своем распоряжении при разработке новой дозированной формы лекарственного средства с улучшенными характеристиками. Одной из наиболее важных характеристик действующего фармацевтического вещества, такого как дасатиниб, является биодоступность, которая часто определяется растворимостью в воде.
Существующие твердые формы дасатиниба все еще оставляют пространство для улучшения физических и биологических характеристик, поскольку растворимость дасатиниба моногидрата в воде очень низкая. Имеется постоянная потребность разработки других, улучшенных твердых форм N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида. Другой задачей является разработка твердых форм дасатиниба для оптимизации производства, препаратов, стабильности и биологической эффективности. Предпочтительно, новые твердые формы должны обладать преимуществами в плане растворимости, более низкой сложности их полиморфного профиля, в частности меньшей склонностью к образованию сольватов, и/или улучшенным поведением при фильтровании, сушке и кристаллизации.
Краткое изложение изобретения
В изобретении описывается неизвестная ранее соль дасатиниба в аморфной форме, т.е. твердая соль дасатиниба, практически не содержащая кристаллической формы дасатиниба или, соответственно, совсем не содержащая кристаллического дасатиниба. Аморфная соль по изобретению, таким образом, в типичном случае формирует аморфную фазу, главным образом состоящую из катионов соединения формулы 1 (в типичном случае протонированная форма дасатиниба), и второго компонента, который обычно выбирают из фармацевтически приемлемых кислотных органических соединений, таких как карбоновая кислота или амид сульфокислоты (в типичном случае в форме депротонированного аниона). В случае присутствия какого-либо дополнительного компонента в аморфной соли по изобретению, и, таким образом, в содержащей ее аморфной фазе, его масса в целом меньше массы описываемой аморфной соли; предпочтительно общая масса такого дополнительного компонента (такого как вода) или компонентов не превышает 20 масс. % от общей массы аморфной фазы, которая содержит аморфную соль по изобретению.
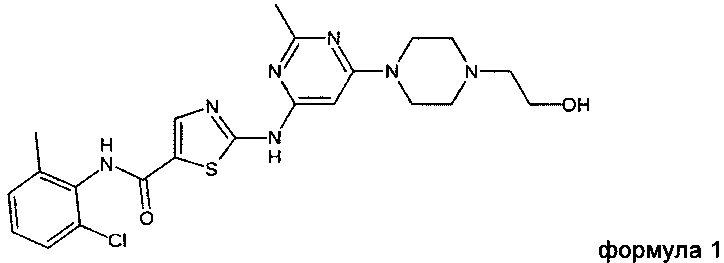
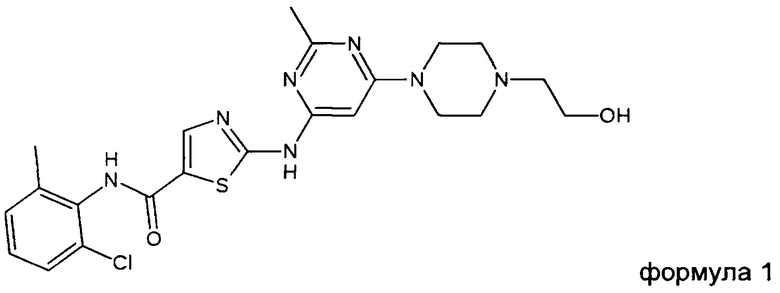
Предпочтительно такая соль содержит катион соединения формулы 1 (INN: дасатиниб)
и
анион второго соединения, выбранного из группы, состоящей из глутаровой кислоты, никотиновой кислоты и сахарина.
Новые фармацевтические композиции, содержащие указанные соли, и способы производства таких солей, а также аспекты применения указанных солей или композиций для лечения заболеваний, также описаны в настоящем тексте.
Соль предпочтительно выбирают из группы, состоящей из дасатиниба никотината, дасатиниба глутарата и дасатиниба сахарината, где, особенно предпочтительно, мольное соотношение катиона соединения формулы 1 и соответствующего противоиона находится в диапазоне от 0.5 до 2.0, предпочтительно около 1:1.
Новые твердые формы по изобретению обладают особым преимуществом в плане улучшенной растворимости, высокой температуры стеклования, хорошей устойчивости при хранении.
Подробное описание настоящего изобретения
Настоящее изобретение касается соли дасатиниба в аморфной форме, предпочтительно без присутствия кристаллической формы, которая в типичном случае сформирована с фармацевтически приемлемым кислотным органическим соединением, таким как фармацевтически приемлемая карбоновая кислота или фармацевтически приемлемый амид сульфокислоты. Соль по настоящему изобретению состоит главным образом из катионов дасатиниба и анионов второго компонента, предпочтительно выбранного из фармацевтически приемлемых карбоновых кислот и амидов сульфокислот. Таким образом, описанная в настоящем тексте соль практически не содержит кристаллической формы дасатиниба или, соответственно, совсем не содержит кристаллического дасатиниба.
Она предпочтительно содержит менее 5 масс. %, предпочтительно менее 3 масс. %, предпочтительно менее 2 масс. %, предпочтительно менее 1 масс. %, предпочтительно менее 0.5 масс. %, предпочтительно менее 0.1 масс. % кристаллических форм.
Кислотное органическое соединение, содержащееся в описываемой аморфной соли, обычно выбрано из группы, состоящей из карбоновых кислот и амидов сульфокислот, предпочтительно из веществ, принадлежащих к указанной группе, которые являются твердыми при нормальных условиях (300 K, атмосферное давление). Предпочтительно, указанная соль представляет собой соль, выбранную из группы, состоящей из дасатиниба никотината, дасатиниба глутарата и дасатиниба сахарината.
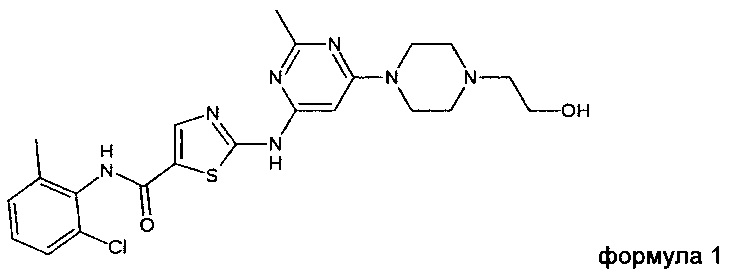
Предпочтительно, соль по настоящему изобретению содержит или состоит из катиона соединения формулы 1 (INN: дасатиниб)
и
аниона второго соединения, выбранного из группы, состоящей из глутаровой кислоты, никотиновой кислоты и сахарина.
Описываемая аморфная соль, в целом, практически не содержит тектонов или комплексообразователей, таких как олиго- или полисахариды, альгиновые кислоты, пектины, бета-глюкан. Термин "практически не содержит тектонов или комплексообразователей" означает, что она в целом содержит менее 3 масс. %, предпочтительно менее 2 масс. %, более предпочтительно менее 1 масс. %, наиболее предпочтительно менее 0.5 масс. % и наиболее предпочтительно менее 0.1 масс. % какого-либо тектона или комплексообразователя.
Предпочтительно, соль по изобретению отличается тем, что мольное соотношение дасатиниба и соответствующей органической кислоты (т.е. глутаровой кислоты, никотиновой кислоты или сахарина) находится в диапазоне от 0.5 до 2.0, предпочтительно около 1:1.
Как отмечено выше, аморфная соль по изобретению, а следовательно и сформированное из него аморфное твердое вещество, главным образом состоит из катионов соединения формулы 1 (в типичном случае протонированная форма дасатиниба) и второго компонента (далее по тексту именуется также солеобразователем), который обычно выбран из фармацевтически приемлемых кислотных органических соединений, таких как карбоновая кислота или амид сульфокислоты (обычно в форме его депротонированного аниона). Термин "главным образом состоит из" в настоящем тексте означает содержание по меньшей мере 80 масс. %, предпочтительно по меньшей мере 90 масс. %, более предпочтительно по меньшей мере 95 масс. % и наиболее предпочтительно по меньшей мере 99 масс. %, соединения формулы 1 и его солеобразователя.
В предпочтительном варианте осуществления, соль по изобретению является водорастворимой, где растворимость соли в воде при 25°С больше 0.01 мг соли на мл воды, предпочтительно больше 0.1 мг соли на мл воды, в частности больше 1.0 мг соли на мл воды, где замеры предпочтительно проводят после двух часов перемешивания и, соответственно, уравновешивания.
В другом предпочтительном варианте осуществления, соль по изобретению после хранения при условиях окружающей среды, предпочтительно при 25°С и 100 кПа, в закрытом стеклянном сосуде в течение 8 месяцев или больше, предпочтительно 10 месяцев или больше, в частности 11 месяцев, практически не содержит кристаллической формы дасатиниба. Она предпочтительно содержит менее 5 масс. %, предпочтительно менее 3 масс. %, предпочтительно менее 2 масс. %, предпочтительно менее 1 масс. %, предпочтительно менее 0.5 масс. %, предпочтительно менее 0.1 масс. % кристаллических форм. Более предпочтительно, она совсем не содержит кристаллического дасатиниба.
Предпочтительно, отсутствие или присутствие, соответственно, кристаллического вещества определяют с помощью рентгеновской дифракции на порошке (XRD).
Неожиданно оказалось, что соли по изобретению имеют высокие температуры стеклования, обычно выше 50°С. Высокие температуры стеклования облегчают работу с аморфными твердыми веществами и повышают физическую и химическую устойчивость, тем самым отменяя или уменьшая потребность в больших количествах вспомогательных компонентов (таких, как полимеры, стабилизаторы, комплексообразователи и т.д.). Кроме того, уменьшается склонность частиц к слипанию при хранении. В предпочтительном варианте осуществления, соль по изобретению, в частности соль, выбранная из группы, состоящей из дасатиниба никотината, дасатиниба глутарата и дасатиниба сахарината, имеет температуру стеклования 70°С или выше.
В еще более предпочтительном варианте осуществления, соль по изобретению, в частности дасатиниба сахаринат, имеет температуру стеклования выше 80°С. Температура стеклования определяют с применением дифференциальной сканирующей калориметрии.
Другим объектом настоящего изобретения является способ получения соли по изобретению (описанной в настоящем тексте), включающий стадии:
а) получение соединения формулы 1 (INN: дасатиниб)
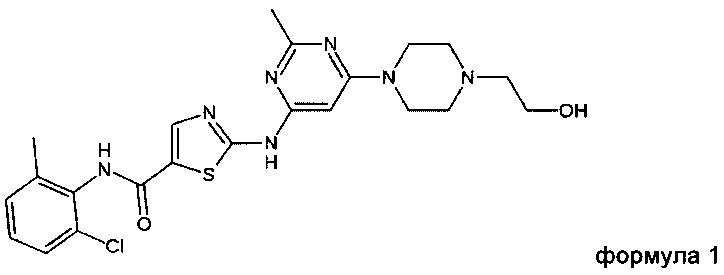
в подходящем растворителе или смеси растворителей
b) добавление глутаровой кислоты или никотиновой кислоты или сахарина в смесь со стадии a);
c) необязательно, смешивание композиции со стадии b) с нерастворителем (таким как вода) и/или, необязательно, упаривание композиции со стадии b);
d) необязательно, упаривание досуха, например методом лиофильной сушки, распылительной сушки и т.д.
Предпочтительно, мольное соотношение соединения формулы 1 (на стадии a)) и второго соединения (глутаровой кислоты или никотиновой кислоты или сахарина) (на стадии b)) находится в диапазоне от 0.5 до 2.0, предпочтительно около 1:1.
На стадии b) обычно используют глутаровую кислоту или никотиновую кислоту или сахарин, в твердой форме или в виде раствора, обычно в воде, спирте, кетоне, ацетате или в смеси растворителей, предпочтительно в метаноле, этаноле или воде или в смеси перечисленных подходящих растворителей.
Предпочтительно, растворителем, используемым на стадии a), является вода или смешивающийся с водой органический растворитель, такой как спирт (например, метанол или, в особенности, этанол) или апротонный полярный органический растворитель, такой как ДМСО, ДМФА или NMP, или их смесь. Особенно предпочтительно использование метанола, этанола, воды или смеси подходящих растворителей.
Растворы или суспензии на стадиях a) и/или b) предпочтительно представляют собой концентрированные растворы.
Концентрация дасатиниба на стадии a) может находиться в диапазоне от 0.1 до примерно 1000 мг/мл растворителей, предпочтительно от 5 до 300 мг/мл. Концентрация глутаровой кислоты или никотиновой кислоты или сахарина на стадии b) может находиться в диапазоне от 0.1 до примерно 500 мг/мл растворителей, предпочтительно от 5 до 200 мг/мл.
Описанный способ предпочтительно осуществляют в диапазоне температур от 15 до 120°С. В предпочтительном способе, стадии a), b) и/или c) осуществляют в диапазоне температур от 40 до 90°С, в особенности от 50 до 90°С. Технически важен также метод лиофильной сушки на стадии d), который обычно осуществляют в диапазоне температур от -80°С до температуры ниже комнатной; лиофильную сушку обычно проводят без добавления дополнительных компонентов (таких как твердый CO2).
Дополнительные детали можно узнать из приведенных ниже примеров (см., например, пример 1).
Соли по изобретению (описанные в настоящем тексте), например дасатиниба глутарат или дасатиниба никотинат, можно также получить способом, включающим стадию получения, например, кристаллического дасатиниба глутарата или, соответственно, дасатиниба никотината, и превращения кристаллического дасатиниба глутарата или, соответственно, дасатиниба никотината в аморфный дасатиниба глутарат или, соответственно, дасатиниба никотинат (подробности см. в примерах 2 и 3).
Соли по настоящему изобретению обычно получают в виде тонкого порошка с типичным распределением размера частиц с медианным размером от 0.1 до 100 мкм, предпочтительно от 1 до 50 мкм, предпочтительно от 1 до 10 мкм. Указанный диапазон размера частиц гарантирует быстрое растворение, в то же время сохраняя благоприятную пригодность к обработке в процессе приготовления препаратов.
Важным преимуществом солей по изобретению является резкое улучшение растворимости в воде (для примеров значений, см. примеры 1-3). В целом, соли по настоящему изобретению демонстрируют растворимость в воде, которая предпочтительно по меньшей мере в 2 раза, предпочтительно в 10 раз, предпочтительно в 50 раз, в частности в 100 раз, особенно предпочтительно по меньшей мере в 500 раз, в особенности примерно в 1000 (или больше) раз выше, чем растворимость свободного основания дасатиниба. Таким образом, описанные в настоящем тексте соли предпочтительно обладают более высокой растворимостью в воде, чем известные кристаллические формы дасатиниба.
Кроме того, соли по настоящему изобретению предпочтительно отличаются высокой температурой стеклования в сухом состоянии. Поэтому можно рассчитывать на прекрасную кинетическую устойчивость при хранении в сухих условиях.
Соли по настоящему изобретению можно применять в фармацевтических композициях таким же образом, как другие, ранее известные, формы дасатиниба. Кроме того, описанные в настоящем тексте соли можно использовать в качестве промежуточных продуктов или исходных веществ для производства чистого действующего вещества.
Другим аспектом настоящего изобретения является фармацевтическая композиция, содержащая в качестве действующего вещества соль по настоящему изобретению, предпочтительно соль, описанную выше как предпочтительная, и предпочтительно дополнительно содержащая один, два, три или больше фармацевтически приемлемых носителей и/или разбавителей и/или других ингредиентов, в частности одно, два, три или больше фармацевтических вспомогательных веществ.
Количество соли в композиции зависит от типа препарата и целевого режима дозирования во время периода введения. Количество в каждом препарате для перорального введения может составлять от 0.1 до 300 мг, предпочтительно от 1.0 до 250 мг, в частности от 5.0 до 200 мг. Предпочтительно, композиция (практически) не содержит дасатиниб в кристаллической форме. Она предпочтительно содержит менее 5 масс. %, предпочтительно менее 3 масс. %, предпочтительно менее 2 масс. %, предпочтительно менее 1 масс. %, предпочтительно менее 0.5 масс. %, предпочтительно менее 0.1 масс. % кристаллических форм.
Препараты для перорального введения (как предпочтительные фармацевтические композиции по настоящему изобретению) могут представлять собой твердые препараты, такие как капсулы, таблетки, пилюли и пастилки, или жидкие суспензионные препараты.
Соли по изобретению можно применять непосредственно в форме порошков, гранул, суспензий, или их можно комбинировать с другими фармацевтически приемлемыми ингредиентами, путем смешивания компонентов и, необязательно, их тонкого измельчения, с последующим заполнением ими капсул, состоящих, например, из твердого или мягкого желатина, прессованием таблеток, пилюлей или пастилок, или суспендированием в суспензиях. После прессования в таблетки можно наносить покрытие.
Фармацевтически приемлемые ингредиенты хорошо известны для разных типов препаратов и могут представлять собой, например, связующие вещества, такие как природные или синтетические полимеры, вспомогательные вещества, разрыхлители, лубриканты, поверхностно-активные вещества, подсластители и другие ароматизирующие добавки, материалы покрытия, консерванты, красители, загустители, адъюванты, антимикробные агенты и носители, для разных типов препаратов.
Примерами связующих веществ являются трагакантовая камедь, смола акации, крахмал, желатин и биоразлагаемые полимеры, такие как гомо- или со-полиэфиры дикарбоновых кислот, алкиленгликолей, полиалкиленгликолей и/или алифатических гидроксикарбоновых кислот; гомо- или со-полиамиды дикарбоновых кислот, алкилендиаминов и/или алифатических аминокарбоновых кислот; соответствующие полиэфир-полиамидные сополимеры; полиангидриды, полиортоэфиры, полифосфазены и поликарбонаты. Биоразлагаемые полимеры могут быть линейными, разветвленными или сшитыми. Частными примерами являются полигликолевая кислота, полимолочная кислота и поли-d,l-лактид/гликолид. Другими примерами полимеров являются водорастворимые полимеры, такие как полиоксаалкилены (полиоксаэтилен, полиоксапропилен и их смешанные полимеры), полиакриламиды и гидроксиалкилированные полиакриламиды, полималеиновая кислота и ее сложные эфиры или амиды, полиакриловая кислота и ее сложные эфиры или амиды, поливиниловый спирт и его сложные или простые эфиры, поливинилимидазол, поливинилпирролидон и природные полимеры, такие как хитозан, каррагенан или гиалуроновая кислота.
Примерами вспомогательных веществ являются фосфаты, такие как дикальция фосфат.
Примерами разрыхлителей являются кроскармелоза натрия, кросповидон, низкозамещенная гидроксипропилцеллюлоза, натрия крахмал-гликолят или альгиновая кислота.
Поверхностно-активные вещества могут быть анионогенными, катионогенными, амфотерными или нейтральными. Примерами поверхностно-активных веществ являются лецитин, фосфолипиды, октил сульфат, децил сульфат, додецил сульфат, тетрадецил сульфат, гексадецил сульфат и октадецил сульфат, Na олеат или Na капрат, 1-ациламиноэтан-2-сульфоновые кислоты, такие как 1-октаноиламиноэтан-2-сульфоновая кислота, 1-деканоиламиноэтан-2-сульфоновая кислота, 1-додеканоиламиноэтан-2-сульфоновая кислота, 1-тетрадеканоиламиноэтан-2-сульфоновая кислота, 1-гексадеканоиламиноэтан-2-сульфоновая кислота и 1-октадеканоиламиноэтан-2-сульфоновая кислота, и таурохолевая кислота и тауродеоксихолевая кислота, желчные кислоты и их соли, такие как холиевая кислота, деоксихолиевая кислота и натрия гликохолаты, капрат натрия или лаурат натрия, олеат натрия, лаурилсульфат натрия, цетилсульфат натрия, сульфированное касторовое масло и натрия диоктилсульфосукцинат, кокамидопропилбетаин и лаурилбетаин, жирные спирты, холестерины, моно- или дистеарат глицерина, моно- или диолеат глицерина и моно- или дипальмитат глицерина, и полиоксиэтилен стеарат.
Примерами подсластителей являются сахароза, фруктоза, лактоза или аспартам.
Примерами ароматизаторов являются мята, винтергриновое масло или фруктовые ароматизаторы, такие как вишневый или апельсиновый ароматизатор.
Примерами материалов покрытия являются желатин, воск, шеллак, сахар или биоразлагаемые полимеры.
Примерами консервантов являются метил или пропилпарабены, сорбиновая кислота, хлорбутанол, фенол и тимеросал.
Примерами адъювантов являются отдушки.
Примерами загустителей являются синтетические полимеры, жирные кислоты и соли и сложные эфиры жирных кислот, и жирные спирты.
Примерами твердых носителей являются тальк, глина, микрокристаллическая целлюлоза, оксид кремния, оксид алюминия и т.п.
Препарат по изобретению может также содержать изотонические агенты, такие как сахара, буферные добавки или хлорид натрия.
Композиции по настоящему изобретению могут также вводиться в состав шипучих таблеток или порошков, которые могут растворяться в водной среде с получением растворов для питья.
Наиболее предпочтительным способом введения является пероральное введение. Дозировки могут представлять собой дозированные формы, и их можно готовить любым из способов, хорошо известных в области фармакологии.
Дозированные формы в виде капсул, разумеется, будут содержать твердую композицию внутри капсулы, которая может быть изготовлена из желатина или другого подходящего инкапсулирующего материала. На таблетки и порошки можно наносить покрытие. На таблетки и порошки можно наносить энтеросолюбильное покрытие. Порошковые формы с энтеросолюбильным покрытием могут иметь покрытия, содержащие фталевую кислоту-ацетат целлюлозы, гидроксипропилметилцеллюлоза-фталат, поливиниловый спирт-фталат, карбоксиметилэтилцеллюлозу, сополимер стирола и малеиновой кислоты, сополимер метакриловой кислоты и метилметакрилата, и подобные материалы, и, при необходимости, с ними можно использовать подходящие пластификаторы и/или наполнители. Таблетка с нанесенным покрытием может иметь покрытие на поверхности таблетки или она может представлять собой таблетку, содержащую порошок или гранулы с энтеросолюбильным покрытием.
Соли по настоящему изобретению и содержащие их препараты или композиции, соответственно, можно также вводить в комбинации с другими терапевтическими агентами, эффективными для лечения определенного состояния и/или для обеспечения комбинированной терапии.
Соли по настоящему изобретению и фармацевтические композиции по настоящему изобретению подходят для эффективного лечения нарушений, связанных с необходимостью ингибирования тирозинкиназ семейства BCR/ ABL и Src. Соли по настоящему изобретению и соответствующие фармацевтические композиции могут применяться для лечения хронической миелогенной лейкемии, а также распространенного рака предстательной железы.
Соли по настоящему изобретению и фармацевтические композиции по настоящему изобретению можно также применять в терапевтическом методе достижения эффекта ингибирования Abl тирозинкиназы у млекопитающих, включающем введение млекопитающему, нуждающемуся в такой терапии.
Соли по настоящему изобретению могут применяться в качестве единственного компонента или как смеси с другими твердыми формами.
В свете вышесказанного, настоящее изобретение касается также солей по настоящему изобретению и фармацевтических композиций по настоящему изобретению для применения в качестве лекарственного средства, предпочтительно для применения в лечении рака, в частности хронической миелогенной лейкемии (CML) и/или острого лимфобластного лейкоза, осложненного филадельфийской хромосомой (Ph+ALL).
Далее настоящее изобретение будет описано более подробно посредством отдельных примеров, иллюстрирующих настоящее изобретение.
Далее по тексту, под комнатной температурой понимается температура в диапазоне 22-25°С, и проценты приведены по весу, если не указано иное.
Сокращения
Приборы
Порошковая рентгеновская дифракция:
Измерения проводили на рентгеновском дифрактометре для порошков Bruker D8 Advance с Cu Kα излучением в геометрии отражения по Бреггу-Брентано. Точность значений 2θ находится в пределах ошибки ±0.1-0.2°. Относительные интенсивности пиков могут значительно варьироваться для разных образцов одной и той же кристаллической формы вследствие разных предпочтительных ориентаций кристаллов. Образцы готовили без специальной обработки, за исключением приложения небольшого давления для получения плоской поверхности. Обычно применяют держатели для образцов из монокристаллического кремния глубиной 0.1 мм, 0.5 мм или 1.0 мм. Напряжение и сила тока на лампе составляют 40 кВ и 40 мА, соответственно. Рентгеновский дифрактометр оснащен детектором LynxEye. Применяют различную щель расходимости с окном 3°. Размер шага составляет 0.02°2θ при времени шага 37 секунд. Образцы вращают во время измерения со скоростью 0.5 об/сек.
Термогравиметрия с инфракрасной спектрометрией (TG-FTIR)
Термогравиметрия с инфракрасной спектрометрией является хорошо известным методом, позволяющим отслеживать потерю массы у исследуемого образца при нагревании, с одновременной идентификацией летучих соединений методом инфракрасной спектроскопии. Благодаря этому, TG-FTIR является подходящим методом для идентификации сольватов или гидратов.
TG-FTIR проводили на приборе Netzsch Thermo-Microbalance TG 209, совмещенным с Bruker FT-IR спектрометром Vector 22 или IFS 28. Измерения проводят в алюминиевых тиглях с микроотверстием, в атмосфере азота и при скорости нагрева 10°С/мин в диапазоне 25-250°С.
1Н-ЯМР
Спектры 1Н-ЯМР записывали на спектрометре Bruker DPX 300. Растворитель: дейтеро-ДМСО.
Дифференциальная сканирующая калориметрия: ДСК проводили на приборе ТА Instruments DSC Q2000 с герметично закрывающимися золотыми тиглями для образцов. Скорость нагрева составляла 10°С в минуту. Образцы сушили в атмосфере азота перед закрытием тиглей в атмосфере азота.
Определение растворимости
Определение растворимости проводили в чистой воде при 25±2°С. Готовили суспензии, содержащие примерно 10 мг соли в 0.5 мл воды, и уравновешивали их в течение двух часов, после чего отфильтровывали жидкую фазу и анализировали ее методом ВЭЖХ.
ВЭЖХ
Анализ методом ВЭЖХ проводили на ВЭЖХ-хроматографе Agilent 1100, оснащенном детектором в УФ и видимой области. Данный метод описан в работе Mhaske, D.V. and Dhaneshwar, S.R. Chromatographia 2007, 66(1/2), 95-102. Использовали колонку Waters XTerra MS C18, 250×4.6 мм, 5 мкм (FK-CC14). Указанный выше метод представляет собой изократический метод с применением водного ацетата аммония/уксусной кислоты и метанола в соотношении 55/45. Скорость потока 1.0 мл в минуту, объем ввода пробы 20 микролитров, длина волны детектора 321 нм.
Растворители Для всех экспериментов использовали растворители стандартной степени очистки.
Примеры
Сравнительный пример 1. Получение кристаллического дасатиниба сахарината (гидрат)
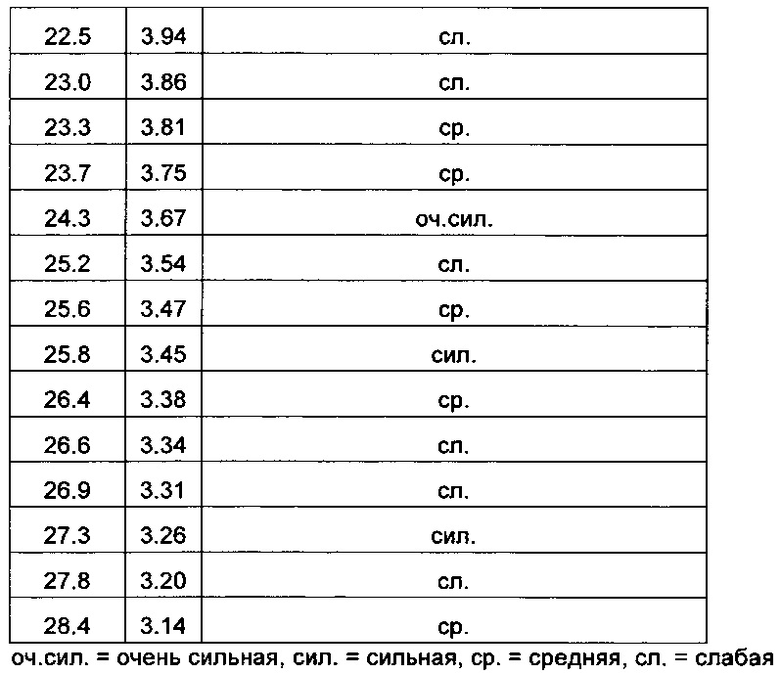
126 мг дасатиниба (моногидратная форма) и 46 мг сахарина суспендировали в 5 мл воды. Суспензию нагревали до 70°С и перемешивали при 70°С в течение 45 минут. Полученную смесь оставляли охлаждаться до комнатной температуры и перемешивали 6 дней при комнатной температуре. Каждый день в ходе эксперимента смесь обрабатывали ультразвуком в течение примерно 1 минуты в обычной ультразвуковой бане. После шести дней перемешивания, полученную суспензию фильтровали, и осадок сушили на воздухе при комнатной температуре. После сушки при комнатной температуре, полученный твердый продукт анализировали методом порошковой рентгеновской дифракции и получали PXRD диаграмму, аналогичную представленной на Фиг. 1 (см. верхнюю кривую), имеющую пики со значениями, приведенными в Таблице 1. Продукт дополнительно сушили примерно при 60°С/30 мбар в течение 1 часа, и проводили анализ методами 1Н-ЯМР спектрометрии, TG-FTIR и порошковой рентгеновской дифракции. 1Н-ЯМР показал мольное соотношение дасатиниба и сахарина 1:1, и получали PXRD диаграмму, изображенную на Фиг. 1, имеющую пики со значениями, приведенными в Таблице 1. Анализ методом TG-FTIR показал потерю массы около 2.3%, что отнесено к потере воды, так что можно сделать вывод, что полученное твердое вещество представляет собой кристаллический гидрат.
Пример 1. Получение аморфного дасатиниба сахарината
126.9 мг дасатиниба (моногидратная форма) и 45.9 мг сахарина растворяли в 10 мл метанола при 60°С и перемешивали 0.5 часа при 60°С. Растворитель упаривали в токе сухого азота при 60°С в течение примерно 1.5 часов, и высушенный образец выдерживали при 60°С в течение 1 часа. Полученный образец охлаждали и выдерживали в течение ночи при комнатной температуре, и снова сушили при 50°С / примерно 30 мбар в течение 17 часов. Получали примерно 150 мг твердого вещества, которое характеризовали методом 1Н-ЯМР спектроскопии, ДСК и порошковой рентгеновской дифракции. 1Н-ЯМР спектроскопия показала мольное соотношение дасатиниба и сахарина 1:1. Диаграмма порошковой рентгеновской дифракции, изображенная как нижняя кривая на Фиг. 1, не имеет острых отражений. Дифференциальная сканирующая калориметрия показала небольшой уступ около 130°С, который отнесен к переходу в стеклообразное состояние, что является отличительным признаком аморфного вещества. Значение ΔCp при переходе в стеклообразное состояние составляет около 0.4 Дж/г/K, и не было обнаружено точки плавления с энтальпией плавления.
Растворимость в воде после двух часов уравновешивания при 25°С определена равной 1.33 мг/мл при финальном значении pH, которое составило 4.6.
Аморфный дасатиниба сахаринат по Примеру 1 хранили при комнатной температуре в закрытой стеклянной пробирке в течение 11 месяцев. Порошковая рентгеновская дифракция после 11 месяцев хранения показала, что в аморфном образце не содержится кристаллического вещества. Исследование другого образца из той же серии методом PXRD после 24 месяцев хранения при комнатной температуре дало такой же результат.
Сравнительный пример 2. Получение кристаллического дасатиниба глутарата
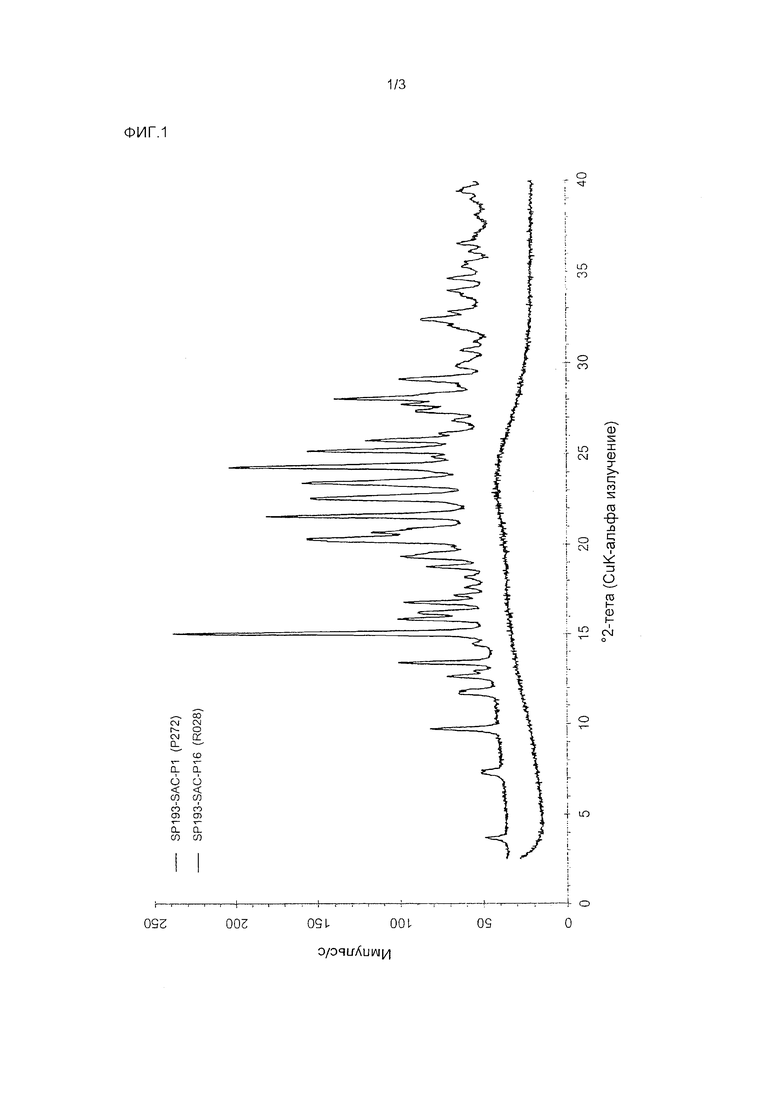
127 мг дасатиниба (моногидратная форма) и 34 мг глутаровой кислоты растворяли в 10 мл метанола при 60°С и перемешивали 0.5 часа при 60°С. Растворитель упаривали в токе сухого азота при 60°С в течение примерно 2.5 часов, и высушенный образец выдерживали при 60°С в течение 1 часа. Полученный образец охлаждали и выдерживали в течение ночи при комнатной температуре. 1Н-ЯМР спектроскопия показала мольное соотношение дасатиниба и глутаровой кислоты около 1:1. Полученное твердое вещество дополнительно характеризовали методом порошковой рентгеновской дифракции. На полученной PXRD диаграмме, изображенной на Фиг. 2 (см. верхнюю кривую) имеются острые пики. Расположение пиков на PXRD диаграмме перечислено в Таблице 2.
Пример 2. Получение аморфного дасатиниба глутарата
92 мг образца кристаллического дасатиниба глутарата из Сравнительного примера 2 суспендировали в 0.8 мл воды, обрабатывали ультразвуком 1 минуту и перемешивали при комнатной температуре в течение 2.5 часов.
Воду упаривали в токе сухого азота при комнатной температуре в течение 1 дня. К полученному стеклообразному веществу добавляли 0.1 мл воды. Образец обрабатывали ультразвуком 1 минуту и перемешивали при комнатной температуре в течение 18 часов. Полученную вязкую массу сушили при комнатной температуре в токе сухого азота в течение 1 дня и получали аморфное вещество (см. Фиг. 2, нижняя кривая).
Образец аморфного дасатиниба глутарата из Примера 2 хранили 11 месяцев при комнатной температуре. Порошковая рентгеновская дифракция после 11 месяцев хранения показала отсутствие кристаллического вещества в аморфном образце. Исследование другого образца из той же серии методом PXRD после 24 месяцев хранения при комнатной температуре дало такой же результат.
Сравнительный пример 3. Получение кристаллического дасатиниба никотината
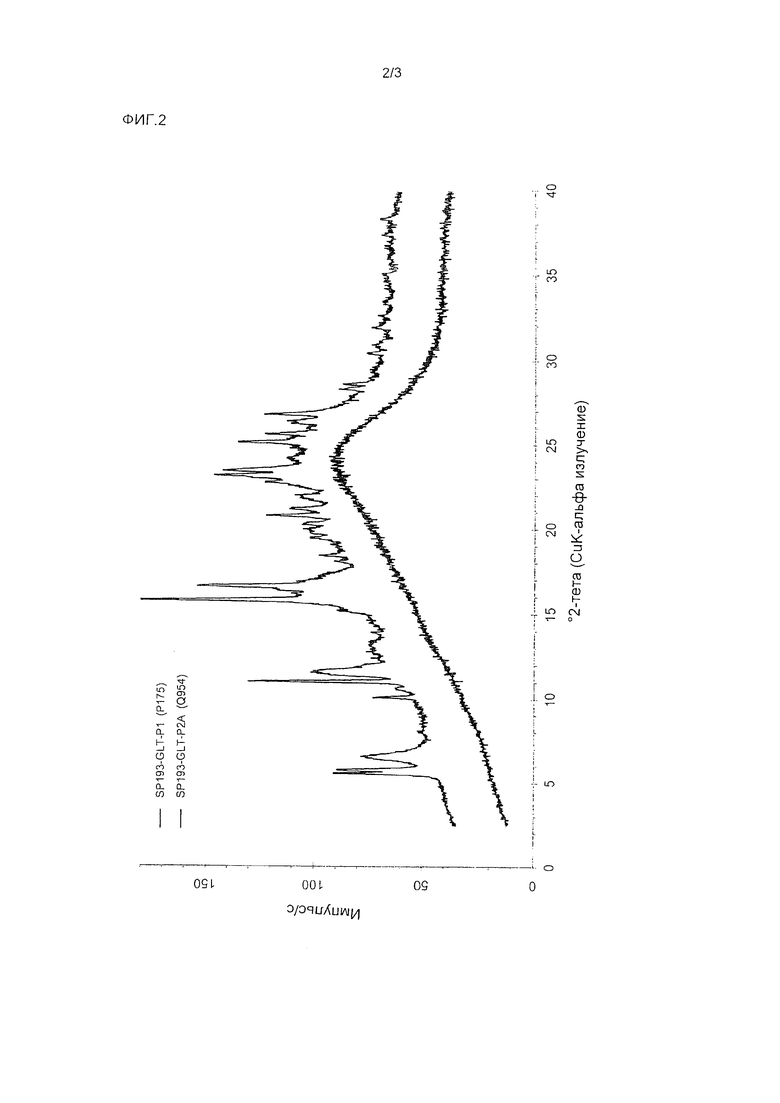
127 мг дасатиниба (моногидратная форма) и 31 мг никотиновой кислоты растворяли в 10 мл метанола при 60°С и перемешивали 0.5 часа при 60°С. Растворитель упаривали в токе сухого азота при 60°С в течение примерно 2.5 часов, и высушенный образец выдерживали при 60°С в течение 1 часа. Полученный образец охлаждали и выдерживали в течение ночи при комнатной температуре. 1Н-ЯМР спектроскопия показала мольное соотношение дасатиниба и никотиновой кислоты 1:1. Полученное твердое вещество дополнительно характеризовали методом порошковой рентгеновской дифракции. На полученной PXRD диаграмме, изображенной на верхней кривой Фиг. 3, имеются острые пики. Расположение пиков на PXRD диаграмме перечислено в Таблице 3.
Пример 3. Получение аморфного дасатиниба никотината
105 мг образца кристаллического дасатиниба никотината из Сравнительного примера 3 суспендировали в 0.8 мл воды, обрабатывали ультразвуком 1 минуту и перемешивали при комнатной температуре в течение 2.5 часов. Воду упаривали в токе сухого азота при комнатной температуре в течение 1 дня. К полученному стекловидному веществу добавляли 0.1 мл воды. Образец обрабатывали ультразвуком 1 минуту и перемешивали при комнатной температуре в течение 18 часов. Полученный продукт сушили при комнатной температуре в токе сухого азота 1 день и получали аморфное вещество (см. Фиг. 3, нижняя кривая).
Образец аморфного дасатиниба никотината из Примера 3 хранили 11 месяцев при комнатной температуре. Порошковая рентгеновская дифракция после 11 месяцев хранения показала отсутствие кристаллического вещества в аморфном образце.
Пример 4. Получение аморфного дасатиниба сахарината
2.535 г дасатиниба (моногидратная форма) и 0.921 г сахарина помещали в виалу Supelco объемом 22 мл, суспендировали в 10 мл смеси этанол/вода 1:1 об/об, обрабатывали ультразвуком 1 минуту и перемешивали при комнатной температуре в течение 15 минут. Полученный слегка мутный раствор затем добавляли при комнатной температуре в 80 мл воды в течение примерно 5 минут при интенсивном перемешивании на магнитной мешалке. Получали суспензию белого цвета. Виалу Supelco промывали 10 мл смеси этанол/вода 1:1 об/об, и промывную жидкость добавляли в полученную белую суспензию. Суспензию перемешивали при комнатной температуре в течение 2 минут и переносили в стеклянную колбу объемом 1 литр. Колбу вращали в ходе замораживания суспензии в смеси сухого льда и 2-пропанола, получая тонкую пленку замерзшего вещества. Полученный образец лиофилизовали в течение ночи (вакуум примерно 0.4 мбар). Полученный образец сушили при комнатной температуре / примерно 30 мбар в течение 15 минут, поэтапно нагревали до 60°С в течение примерно 1 часа и сушили при 60°С / примерно 30 мбар в течение 30 минут. Выход: 1.689 г. Полученное вещество анализировали методами 1Н-ЯМР спектроскопии, ДСК и порошковой рентгеновской дифракции. 1Н-ЯМР спектроскопия показала мольное соотношение дасатиниба и сахарина 1:1. Порошковая рентгеновская дифракция показала, что вещество является аморфным. Дифференциальная сканирующая калориметрия показала небольшой уступ примерно при 113°С, который отнесен к переходу в стеклообразное состояние, что является отличительным признаком аморфного вещества. Значение ΔCp при переходе в стеклообразное состояние составляет около 0.6 Дж/(г K), и не было обнаружено точки плавления с энтальпией плавления.
Краткое описание чертежей
Фиг. 1: PXRD диаграммы аморфного и кристаллического дасатиниба сахарината.
Фиг. 2: PXRD диаграммы аморфного и кристаллического дасатиниба глутарата.
Фиг. 3: PXRD диаграммы аморфного и кристаллического дасатиниба никотината.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЛИ ДАСАТИНИБА В КРИСТАЛЛИЧЕСКОЙ ФОРМЕ | 2014 |
|
RU2662805C2 |
| ГЛУТАРАТ 3-[1,2,3,6-ТЕТРАГИДРОПИРИДИН-2-ИЛ]ПИРИДИНА ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЙ СОЛЬВАТ | 2019 |
|
RU2823979C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-[5-(3,5-ДИФТОРБЕНЗИЛ)-1Н-ИНДАЗОЛ-3-ИЛ]-4-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-2-(ТЕТРАГИДРОПИРАН-4-ИЛАМИНО)БЕНЗАМИДА | 2013 |
|
RU2602071C2 |
| ПОЛИМОРФНЫЕ И АМОРФНЫЕ ФОРМЫ {2-ФТОР-5-[3-((Е)-2-ПИРИДИН-2-ИЛВИНИЛ)-1Н-ИНДАЗОЛ-6-ИЛАМИНО]ФЕНИЛ}АМИДА 2,5-ДИМЕТИЛ-2Н-ПИРАЗОЛ-3-КАРБОНОВОЙ КИСЛОТЫ | 2005 |
|
RU2324692C1 |
| СОЛИ И ПОЛИМОРФЫ 8-ФТОР-2-{4-[(МЕТИЛАМИНО)МЕТИЛ]ФЕНИЛ}-1,3,4,5-ТЕТРАГИДРО-6Н-АЗЕПИНО[5,4,3-cd]ИНДОЛ-6-ОНА | 2011 |
|
RU2570198C2 |
| ФОРМА IV ИВАБРАДИНА ГИДРОХЛОРИДА | 2012 |
|
RU2619121C2 |
| СОЛИ 1-(4-(2-((1-(3,4-ДИФТОРФЕНИЛ)-1Н-ПИРАЗОЛ-3-ИЛ)МЕТОКСИ)ЭТИЛ)ПИПЕРАЗИН-1-ИЛ)ЭТАНОНА | 2016 |
|
RU2727974C2 |
| НОВЫЕ КРИСТАЛЛИЧЕСКИЕ ФОРМЫ НАТРИЕВОЙ СОЛИ(4-{ 4-[5-(6-ТРИФТОРМЕТИЛ-ПИРИДИН-3-ИЛАМИНО) ПИРИДИН-2-ИЛ] ФЕНИЛ} ЦИКЛОГЕКСИЛ) УКСУСНОЙ КИСЛОТЫ | 2011 |
|
RU2612556C2 |
| ИЗОЛИРОВАННАЯ ОРТОРОМБИЧЕСКАЯ КРИСТАЛЛИЧЕСКАЯ ФОРМА 4-[6-АЦЕТИЛ-3-[3-(4-АЦЕТИЛ-3-ГИДРОКСИ-2-ПРОПИЛФЕНИЛТИО)ПРОПОКСИ]-2-ПРОПИЛ-ФЕНОКСИ]МАСЛЯНОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЕ ОСНОВЕ | 2004 |
|
RU2317979C2 |
| МНОГОКОМПОНЕНТНЫЕ КРИСТАЛЛЫ, СОДЕРЖАЩИЕ ДАЗАТИНИБ И ОПРЕДЕЛЕННЫЕ СОКРИСТАЛЛОБРАЗОВАТЕЛИ | 2013 |
|
RU2650524C2 |
Настоящее изобретение относится к солям дасатиниба в аморфной форме. Соль дасатиниба содержит катион соединения формулы 1, известного как дасатиниб, и анион второго соединения, выбранного из группы, состоящей из сахарина, глутаровой кислоты и никотиновой кислоты. Соль дасатиниба по изобретению применяют в качестве лекарственного средства для лечения рака, в частности хронической миелогенной лейкемии и/или острого лимфобластного лейкоза, осложненного филадельфийской хромосомой. 4 н. и 3 з.п. ф-лы, 3 ил., 3 табл., 7 пр.
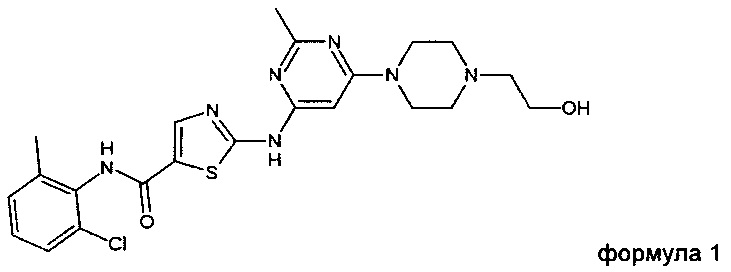
1. Соль дасатиниба, где соль находится в аморфной форме и выбрана из группы, состоящей из дасатиниба сахарината, дасатиниба глутарата и дасатиниба никотината.
2. Соль по п. 1, содержащая катион соединения формулы 1, также известного как дасатиниб
и
анион второго соединения, выбранного из группы, состоящей из сахарина, глутаровой кислоты и никотиновой кислоты.
3. Соль по любому из пп. 1, 2, где мольное соотношение дасатиниба к сахарину, к глутаровой кислоте или к никотиновой кислоте находится в диапазоне от 0.5 до 2.0, предпочтительно около 1:1.
4. Применение соли по любому из пп. 1-3 в качестве лекарственного средства для лечения рака, в частности хронической миелогенной лейкемии и/или острого лимфобластного лейкоза, осложненного филадельфийской хромосомой.
5. Фармацевтическая композиция для применения в лечении рака, в частности хронической миелогенной лейкемии и/или острого лимфобластного лейкоза, осложненного филадельфийской хромосомой, содержащая в качестве действующего вещества соль по любому из пп. 1-3, и один, два, три или более фармацевтически приемлемых носителей и/или разбавителей.
6. Фармацевтическая композиция по п. 5, где общее количество аморфной соли дасатиниба в композиции находится в диапазоне от 0.1 до 300 мг, предпочтительно от 1.0 до 250 мг, в частности от 5.0 до 200 мг.
7. Применение фармацевтической композиции по п. 5 или 6 в качестве лекарственного средства для лечения рака, в частности хронической миелогенной лейкемии и/или острого лимфобластного лейкоза, осложненного филадельфийской хромосомой.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| "Amorphous active pharmaceutical ingredients having special characteristics and methods for their preparation", RESEARCH DISCLOSURE, 2009, vol.538, no.1, p.127 | |||
| RAHUL BANERJEE et al.: "Saccharin salts of active pharmaceutical ingredients | |||
| Their crystal structures, and increased water solubilities", CRYSTAL GROWTH & DESIGN, 2005, vol.5, no.6, p.2299-2309 | |||
| RODRIGUEZ-SPONG BARBARA et al: "General principles of pharmaceutical solid polymorphism: a supramolecular perspective", ADVANCED DRUG DELIVERY REVIEWS, 2004, vol.56, no.3, p.241-274 | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-АМИНОТИАЗОЛ-5-АРОМАТИЧЕСКИХ КАРБОКСАМИДОВ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2005 |
|
RU2382039C2 |
Авторы
Даты
2018-05-29—Публикация
2014-07-22—Подача