Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к форме IV ивабрадина гидрохлорида, способу ее получения, ее применению в качестве терапевтически активного ингредиента и содержащим ее фармацевтическим композициям.
Предшествующий уровень техники настоящего изобретения
Ивабрадин, (+)-3-[3-[N-[4,5-диметоксибензоциклобутан-1(S)-илметил]-N-метиламино]пропил]-7,8-диметокси-2,3,4,5-тетрагидро-1Н-3-бензазепин-2-он, представлен структурной формулой (I):
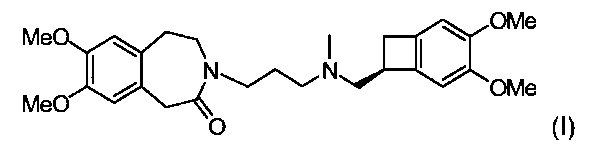
Ивабрадин и его соли присоединения с фармацевтически приемлемой кислотой, и более предпочтительно его гидрохлорид, характеризуются очень ценными фармакологическими и терапевтическими свойствами, особенно брадикардическими свойствами, делающими эти соединения пригодными в лечении или профилактике различных клинических состояний миокардиальной ишемии, таких как стенокардия, инфаркт миокарда и сопутствующие нарушения сердечного ритма, а также при различных патологиях, связанных с нарушениями сердечного ритма, в особенности суправентрикулярными нарушениями ритма, и при сердечной недостаточности.
Ивабрадин в настоящее время продается под торговыми названиями Corlentor® и Procolaran® для лечения хронической стабильной стенокардии у пациентов с ишемической болезнью сердца с нормальным синусовым ритмом.
Получение и терапевтическое применение ивабрадина и его солей присоединения с фармацевтически приемлемой кислотой, и более предпочтительно его гидрохлорида, были описаны в описании европейского патента EP 0534859.
В европейском патенте № EP 0534859 описан способ синтеза ивабрадина и его гидрохлоридной соли. В нем раскрыт продукт, перекристаллизованный в ацетонитриле с температурой его плавления Тпл: 135-140°C.
В европейском патенте № EP 1589005 раскрыта кристаллическая форма α ивабрадина гидрохлорида, характеризующаяся PXRD (порошковой рентгеновской дифракцией), и способ ее получения.
В европейском патенте № ЕР 1695965 раскрыта кристаллическая форма β, тетрагидратная форма ивабрадина гидрохлорида, характеризующаяся PXRD, и способ ее получения.
В европейском патенте № ЕР 1695710 раскрыта кристаллическая форма βd ивабрадина гидрохлорида, характеризующаяся PXRD, и способ ее получения.
В европейском патенте № ЕР 1707562 раскрыта кристаллическая форма γ, моногидратная форма ивабрадина гидрохлорида, характеризующаяся PXRD, и способ ее получения.
В европейском патенте № ЕР 1695709 раскрыта кристаллическая форма γd ивабрадина гидрохлорида, характеризующаяся PXRD, и способ ее получения.
В европейском патенте № ЕР 1775288 раскрыта кристаллическая форма δ, гидратированная форма ивабрадина гидрохлорида, характеризующаяся PXRD, и способ ее получения.
В европейском патенте № ЕР 1775287 раскрыта кристаллическая форма δd ивабрадина гидрохлорида, характеризующаяся PXRD, и способ ее получения.
В международной патентной публикации № WO 2008/125006 раскрыта кристаллическая форма ивабрадина гидрохлорида, характеризующаяся PXRD, и способ ее получения.
В патенте Китая № CN 101768117 раскрыта кристаллическая форма ивабрадина гидрохлорида, характеризующаяся PXRD, и способ ее получения.
В патенте Китая № CN 101805289 раскрыта кристаллическая форма ω ивабрадина гидрохлорида, характеризующаяся PXRD, и способ ее получения.
В международной патентной публикации № WO 2011/098582 раскрыты кристаллические формы ивабрадина гидрохлорида, характеризующиеся PXRD, и способ их получения.
В международной патентной публикации № WO 2008/146308, в патентах Китая №№ CN 101463008, CN 101597261 и CN 102050784 раскрыта аморфная форма ивабрадина гидрохлорида и способ ее получения.
Полиморфное поведение лекарственных средств может иметь ключевое значение в фармации и фармакологии. Полиморфизм представляет собой способность вещества кристаллизоваться в различные кристаллические модификации, каждая из которых характеризуется одинаковой химической структурой, но различными конфигурациями или конформациями молекул в кристаллической решетке. Различия в физических свойствах, проявляемых полиморфами, оказывают влияние на такие фармацевтические параметры, как стабильность при хранении, прессуемость и плотность (важные в производстве состава и продукта) и скорости растворения (важный фактор в определении биодоступности). Различия в стабильности могут являться результатом изменений химической реакционной способности или механических изменений или и того, и другого. Например, полученная из одного полиморфа лекарственная форма может обесцветиться намного быстрее при смешивании с другой лекарственной формой, полученной из другого полиморфа. Или же таблетки могут крошиться при хранении, поскольку кинетически преимущественный полиморф спонтанно превращается в термодинамически более стабильную полиморфную форму. В результате различий в растворимости/растворении, в крайнем случае, некоторые полиморфные переходы могут приводить к отсутствию эффективности или, напротив, к токсичности. Кроме того, физические свойства кристалла могут быть важными в отношении обработки: например, возможно, один полиморф более вероятно будет формировать сольваты, или может представлять трудности в фильтровании и отмывке от примесей.
Наиболее важное свойство твердого состояния фармацевтического вещества заключается в скорости его растворения в жидкости на водной основе. Скорость растворения активного ингредиента в желудочном соке пациента может иметь терапевтические последствия, поскольку этот параметр задает верхний предел скорости, с которой перорально вводимый активный ингредиент достигает кровотока. Полиморфная форма соединения в твердом состоянии также может оказывать влияние на его поведение при прессовании и его стабильность при хранении.
На эти практические физические характеристики воздействует конформация и ориентация молекул в элементарной ячейке, которая определяет конкретную полиморфную форму вещества. Полиморфная форма может приводить к термическому поведению, отличному от термического поведения аморфного материала (или) другой полиморфной формы.
Открытие новых полиморфных форм фармацевтически применимого соединения предоставляет новую потенциальную возможность улучшить технические характеристики фармацевтического продукта. Оно увеличивает арсенал материалов, которые доступны производящему состав специалисту для разработки, например, фармацевтической лекарственной формы лекарственного средства с целевым профилем высвобождения или другой требуемой характеристикой.
Как правило, наиболее стабильная полиморфная форма предпочтительна в выведенном на рынок составе, поскольку любые другие полиморфы являются метастабильными и, следовательно, могут трансформироваться в более стабильную форму. Невнимательный поиск наиболее стабильного полиморфа может вызвать неудачу выведенного на рынок продукта вследствие фазовой трансформации в ходе хранения. Поздно возникающий стабильный полиморф может оказывать существенное влияние на разработку сроков реализации. Хотя метастабильные формы могут существовать годами, если необходимо преодолеть значительный барьер энергии активации в продвижении от метастабильного состояния к стабильному состоянию, этот барьер энергии активации может быть снижен за счет влажности, катализаторов, примесей, вспомогательных веществ или температуры, и трансформация в стабильную форму происходит спонтанно. Затравки стабильной формы также могут ускорять трансформации. Следовательно, применение термодинамически нестабильной модификации в производстве таблетки в некоторых случаях представляют собой причину того, почему в таких составах происходят нежелательные изменения после окончания срока хранения. Следовательно, существует потребность в термодинамически стабильной полиморфной форме ивабрадина гидрохлорида и способах его получения.
Описанный Haleblian и McCrone способ может использоваться для определения наиболее стабильного полиморфа при комнатной температуре. В указанном способе используется тот факт, что наиболее стабильный полиморф также будет наименее растворимым при указанной температуре и давлении. Если в насыщенном растворе присутствуют кристаллы обоих полиморфов, наиболее стабильная форма будет расти в ущерб менее стабильной формы. Указанный способ называют трансформацией жидкой фазы или опосредованной растворителем трансформацией.
Следовательно, существует потребность в альтернативных чистых и кристаллических формах ивабрадина гидрохлорида, которые будут подходящими для применения в фармацевтической промышленности и, в частности, обеспечат возможность легкого получения препаратов ивабрадина в твердой форме, соответствующих строгим фармацевтическим стандартам, таких как таблетки, капсулы, жевательные таблетки, порошки и т.д. для перорального введения.
Для получения фармацевтических композиций, содержащих форму IV ивабрадина гидрохлорида для введения млекопитающим согласно строгим требованиям о регистрации в сфере здравоохранения органов регистрации в сфере здравоохранения США и международных органов регистрации в сфере здравоохранения, например, требованиям надлежащей медицинской практики Управления по контролю качества пищевых продуктов и лекарственных средств (США) ("GMP"), существует потребность в получении формы IV ивабрадина гидрохлорида в виде по возможности чистой формы, в частности, в виде формы с постоянными физическими свойствами.
Краткое раскрытие настоящего изобретения
Заявители обнаружили, что лекарственное вещество ивабрадина гидрохлорид существует в термодинамически стабильной полиморфной форме при определенных экспериментальных условиях выделения или очистки (форма IV ивабрадина гидрохлорида). Указанная кристаллическая форма является стабильной и легкой в обращении. Улучшенные физические характеристики указанной стабильной кристаллической формы по сравнению с описанным в настоящей области техники ивабрадина гидрохлоридом, включают в себя улучшенные технологические возможности и обеспечение соединения, подходящего для применения в получении фармацевтических составов.
Заявители обнаружили, что ивабрадина гидрохлорид существует в виде менее термодинамически стабильного полиморфа или смеси полиморфов. Такая смесь могла приводить к получению продукта формы IV ивабрадина гидрохлорида, который будет существовать в виде переменной смеси переменного состава (т.е., переменные процентные количества полиморфов), характеризующейся переменными физическими свойствами, что является неприемлемым в виду строгих требований GMP.
Заявители удивительным образом и неожиданно получили новую термодинамически стабильную и чистую кристаллическую форму ивабрадина гидрохлорида (форму IV ивабрадина гидрохлорида), характеризующуюся постоянными физическими свойствами.
Форму IV ивабрадина гидрохлорида по настоящему изобретению получают с высокими выходами и повышенной насыщенностью. Более того, используемые условия сушки не воздействуют на стабильность способа, способ ее получения является стабильно воспроизводимым и надежным, и, следовательно, его легко перевести в промышленное производство. Кроме того, используемые в способе получения растворители, такие как толуол, могут быть удалены без наблюдаемых изменений в полученной кристаллической форме (форме IV) или других свойствах.
Более того, заявители обнаружили, что форма IV ивабрадина гидрохлорида демонстрирует подходящий профиль растворения. Форма IV ивабрадина гидрохлорида является особенно подходящей для получения таблеток немедленного высвобождения. Указанные таблетки могут быть получены известными и общепринятыми способами, предусматривающими прямое прессование, сухое гранулирование и/или влажное гранулирование. Способ влажного гранулирования проводят с использованием органических растворителей, ацетона или спиртов (таких как этанол, метанол и изопропиловый спирт), или их комбинации.
Более того, указанные таблетки могут быть покрыты различными общепринятыми вспомогательными веществами. Широко используемые образующие оболочку средства представляют собой такие производные целлюлозы, как гидроксипропилметилцеллюлоза (НРМС) и гидроксипропилцеллюлоза (НРС), такие производные полиметилметакрилата (РММА), как Eudragit®, поливиниловый спирт (PVA) и производные поливинилового спирта.
Таким образом, один аспект настоящего изобретения относится к форме IV ивабрадина гидрохлорида.
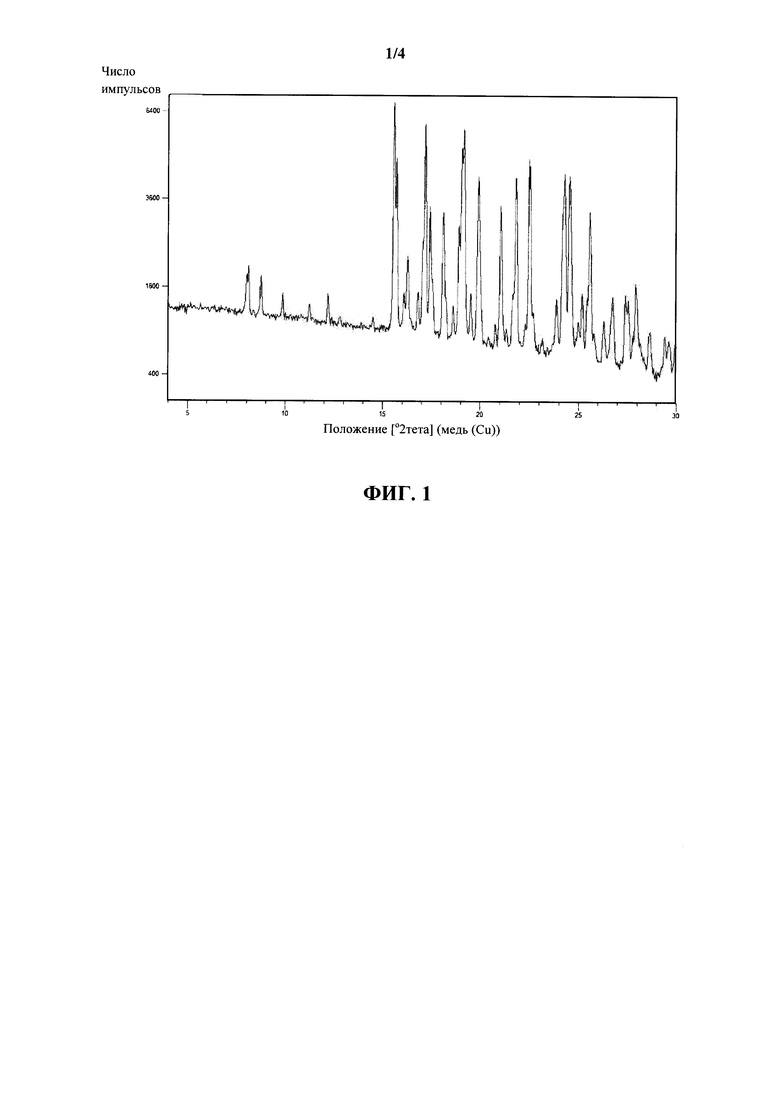
Согласно другому варианту осуществления настоящее изобретение относится к определенной выше форме IV ивабрадина гидрохлорида с порошковой рентгеновской дифракцией, содержащей следующие пики 2 тета (±0,2): 8,74, 15,55, 17,17, 19,89 и 24,29, причем рентгеновскую дифракцию измеряют с использованием CuKα-излучения.
Согласно другому варианту осуществления настоящее изобретение относится к определенной выше форме IV ивабрадина гидрохлорида с порошковой рентгеновской дифракцией, содержащей следующие пики 2 тета (±0,2): 8,11, 8,74, 15,55, 17,17, 19,18, 19,89, 21,82, 22,49, 24,29 и 24,53, причем рентгеновскую дифракцию измеряют с использованием CuKα-излучения.
Согласно другому варианту осуществления настоящее изобретение относится к определенной выше форме IV ивабрадина гидрохлорида с порошковой рентгеновской дифракцией, по существу представленной на фигуре 1.
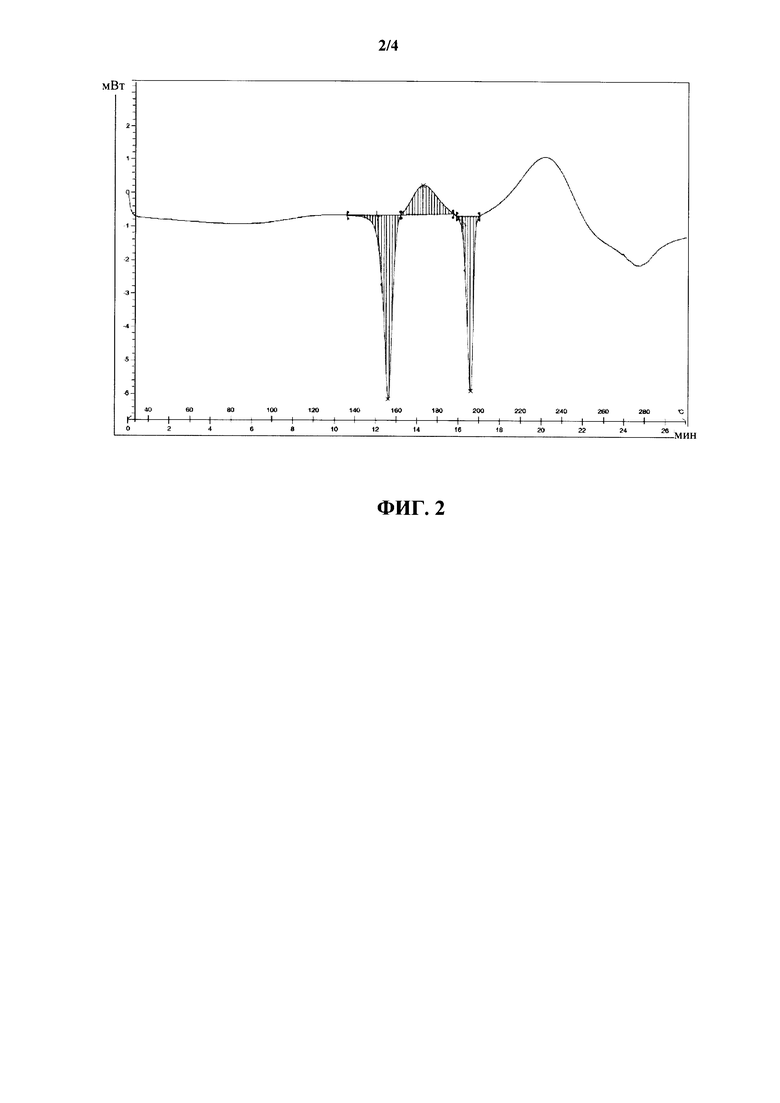
Согласно другому варианту осуществления настоящее изобретение относится к определенной выше форме IV ивабрадина гидрохлорида, характеризующейся термограммой дифференциальной сканирующей калориметрии, которая демонстрирует один эндотермический пик от 153°C до 157°C.
Согласно другому варианту осуществления настоящее изобретение относится к определенной выше форме IV ивабрадина гидрохлорида, характеризующейся термограммой дифференциальной сканирующей калориметрии, по существу представленной на фигуре 2.
Согласно другому варианту осуществления настоящее изобретение относится к определенной выше форме IV ивабрадина гидрохлорида со средним размером частиц от 0,1 до 600 мкм, предпочтительно от 10 до 100 мкм, определенным лазерной дифракцией с использованием прибора для лазерной дифракции Malvern Mastersizer 2000.
Другой аспект по настоящему изобретению относится к гидрохлоридной форме ивабрадина, которая по существу представляет собой раскрытую выше кристаллическую форму.
Другой аспект по настоящему изобретению относится к способу получения определенной выше формы IV ивабрадина гидрохлорида, который предусматривает стадию:
a) суспендирования ивабрадина гидрохлорида в системе растворителей, причем система растворителей содержит толуол, этанол, ацетон, метилэтилкетон, метилизобутилкетон, этилацетат, изопропилацетат и их смеси.
Согласно другому варианту осуществления настоящее изобретение относится к определенному выше способу, причем система растворителей содержит по меньшей мере два растворителя.
Согласно другому варианту осуществления настоящее изобретение относится к определенному выше способу, при котором система растворителей содержит толуол и второй растворитель, выбранный из этанола, ацетона и этилацетата.
Согласно другому варианту осуществления настоящее изобретение относится к определенному выше способу, в котором температура стадии (а) составляет ниже 60°C, предпочтительно от 10°C до 60°C, предпочтительно составляет ниже 40°C, более предпочтительно от 10°C до 30°C и даже более предпочтительно от 20°C до 25°C.
Согласно другому варианту осуществления настоящее изобретение относится к определенному выше способу, в котором время реакции для проведения стадии (а) составляет меньше 48 ч, предпочтительно составляет меньше 24 ч.
Согласно другому варианту осуществления настоящее изобретение относится к определенному выше способу, в котором соотношение на стадии (а) литра системы растворителей на килограмм формы IV ивабрадина гидрохлорида составляет от 5 до 50, предпочтительно от 8 до 12.
Согласно другому варианту осуществления настоящее изобретение относится к определенному выше способу, в котором система растворителей на стадии (а) представляет собой преимущественно толуол.
Согласно другому варианту осуществления настоящее изобретение относится к определенному выше способу, дополнительно предусматривающему после проведения стадии (а) стадию:
b) выделения формы IV ивабрадина гидрохлорида.
Согласно другому варианту осуществления настоящее изобретение относится к определенному выше способу, дополнительно предусматривающему после проведения стадии (b) стадию:
c) высушивания выделенной формы IV ивабрадина гидрохлорида при вакуумметрическом давлении, предпочтительно при давлении от 25 мм рт. ст. до, но не включительно, 760 мм рт. ст., и более предпочтительно от 50 мм рт. ст. до 200 мм рт. ст., и при температуре от 45°C до 70°C.
Другой аспект настоящего изобретения относится к способу получения определенной выше формы IV ивабрадина гидрохлорида, предусматривающему стадии:
a) суспендирования ивабрадина гидрохлорида в системе растворителей, причем система растворителей содержит толуол, этанол, ацетон, метилэтилкетон, метилизобутилкетон, этилацетат, изопропилацетат и их смеси;
b) выделения формы IV ивабрадина гидрохлорида, и
c) высушивания выделенной формы IV ивабрадина гидрохлорида при вакуумметрическом давлении, предпочтительно при давлении от 25 мм рт. ст. до, но не включительно, 760 мм рт. ст., и более предпочтительно от 50 мм рт. ст. до 200 мм рт. ст., и при температуре от 45°C до 70°C.
Другой аспект настоящего изобретения относится к способу получения определенной выше формы IV ивабрадина гидрохлорида, предусматривающему стадии:
i) перемешивания раствора свободного основания ивабрадина в системе растворителей, причем система растворителей содержит толуол, этанол, ацетон, метилэтилкетон, метилизобутилкетон, этилацетат, изопропилацетат и их смеси;
ii) поддержания температуры раствора ниже 60°C, предпочтительно от 10°C до 60°C, более предпочтительно ниже 40°C и более предпочтительно от 10°C до 40°C.
iii) добавления раствора соляной кислоты для получения ивабрадина гидрохлорида;
iv) затравливания формой IV ивабрадина гидрохлорида;
v) выделения формы IV ивабрадина гидрохлорида; и
vi) высушивания выделенной формы IV ивабрадина гидрохлорида при вакуумметрическом давлении, предпочтительно при давлении от 25 мм рт. ст. до, но не включительно, 760 мм рт. ст., и более предпочтительно от 50 мм рт. ст. до 200 мм рт. ст., и при температуре от 45°C до 70°C.
Согласно другому варианту осуществления настоящее изобретение относится к определенному выше способу, в котором система растворителей стадии (i) представляет собой толуол.
Согласно другому варианту осуществления настоящее изобретение относится к определенному выше способу, в котором раствор соляной кислоты стадии (iii) представляет собой раствор соляной кислоты в этаноле.
Другой аспект настоящего изобретения относится к способу получения определенной выше формы IV ивабрадина гидрохлорида, предусматривающему стадии:
i') перемешивания раствора свободного основания ивабрадина в системе растворителей, причем система растворителей содержит толуол, этанол, ацетон, метилэтилкетон, метилизобутилкетон, этилацетат, изопропилацетат и их смеси;
ii') поддержания температуры раствора ниже 60°C, предпочтительно от 10°C до 60°C, более предпочтительно ниже 40°C и более предпочтительно от 10°C до 40°C.
iii') затравливания формой IV ивабрадина гидрохлорида;
iv') добавления раствора соляной кислоты для получения ивабрадина гидрохлорида;
v') выделения формы IV ивабрадина гидрохлорида; и
vi') высушивания выделенной формы IV ивабрадина гидрохлорида при вакуумметрическом давлении, предпочтительно при давлении от 25 мм рт. ст. до, но не включительно, 760 мм рт. ст., и более предпочтительно от 50 мм рт. ст. до 200 мм рт. ст., и при температуре от 45°C до 70°C.
Согласно другому варианту осуществления настоящее изобретение относится к определенному выше способу, причем система растворителей стадии (i') представляет собой толуол.
Согласно другому варианту осуществления настоящее изобретение относится к определенному выше способу, причем раствор соляной кислоты стадии (iv') представляет собой раствор соляной кислоты в этаноле.
Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей определенную выше форму IV ивабрадина гидрохлорида и по меньшей мере фармацевтически приемлемое вспомогательное вещество.
Согласно другому варианту осуществления настоящее изобретение относится к определенной выше фармацевтической композиции для перорального введения.
Согласно другому варианту осуществления настоящее изобретение относится к определенной выше фармацевтической композиции в форме таблеток.
Согласно другому варианту осуществления настоящее изобретение относится к определенной выше фармацевтической композиции в форме покрытых пленочной оболочкой таблеток.
Согласно другому варианту осуществления настоящее изобретение относится к образующим оболочку средствам, причем предпочтительно указанные средства представляют собой производные целлюлозы, более предпочтительно гидроксипропилметилцеллюлозу (НРМС) и гидроксипропилцеллюлозу (НРС), производные полиметилметакрилата (РММА), более предпочтительно Eudragit®, поливиниловый спирт (PVA) и производные поливинилового спирта.
Согласно другому варианту осуществления настоящее изобретение относится к определенной выше фармацевтической композиции, которая содержит 5-9 мг формы IV ивабрадина гидрохлорида.
Согласно другому варианту осуществления настоящее изобретение относится к покрытой пленочной оболочкой таблетке, которая содержит приблизительно 5 мг ивабрадина в виде свободного основания (что эквивалентно 5,390 мг формы IV ивабрадина гидрохлорида).
Согласно другому варианту осуществления настоящее изобретение относится к покрытой пленочной оболочкой таблетке, которая содержит приблизительно 7,5 мг ивабрадина в виде свободного основания (что эквивалентно 8,085 мг формы IV ивабрадина гидрохлорида).
Другой аспект настоящего изобретения относится к способу производства определенной выше фармацевтической композиции, в котором используют техники прямого прессования, сухого гранулирования и/или влажного гранулирования.
Другой аспект настоящего изобретения относится к способу влажного гранулирования, предусматривающему использование органических растворителей, предпочтительно ацетона или спиртов (таких как этанол, метанол и изопропиловый спирт) или их комбинации.
Другой аспект настоящего изобретения относится к определенной выше форме IV ивабрадина гидрохлорида или определенной выше фармацевтической композиции, для применения в терапии.
Другой аспект настоящего изобретения относится к определенной выше форме IV ивабрадина гидрохлорида или определенной выше фармацевтической композиции, для применения в лечении форм брадикардиии, миокардиальной ишемии, суправентрикулярных нарушений ритма, хронической стабильной стенокардии у взрослых с ишемической болезнью сердца с нормальным синусовым ритмом, инфаркта миокарда, сердечной недостаточности и сопутствующих нарушений сердечного ритма.
В приведенных выше определениях термин "в вакууме" относится к условиям, когда давление окружающего субстрат воздуха (газа) было снижено ниже атмосферного давления. Предпочтительно "в вакууме" относится к давлению от 25 мм рт. ст. до 760 мм рт. ст. (при условии, что 760 мм рт. ст. не включено в диапазон) и более предпочтительно от 50 мм рт. ст. до 200 мм рт. ст.
Подробное раскрытие настоящего изобретения
В одном варианте осуществления настоящего изобретения предусмотрена термодинамически стабильная полиморфная форма ивабрадина гидрохлорида. Указанная форма может характеризоваться диаграммой рентгеновской дифракции, измеренной с помощью источника рентгеновского излучения с медным анодом, проявляющей характерные пики, выраженные в градусах 2 тета, приблизительно при следующих значениях:
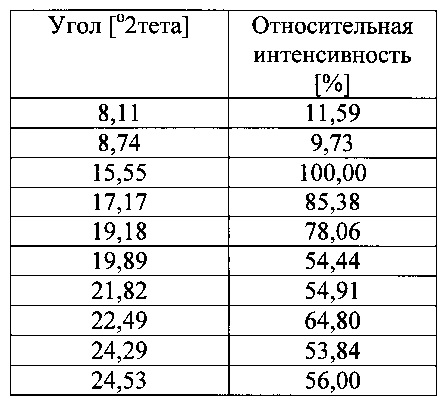
и дополнительно, одним эндотермическим пиком приблизительно при 155°C, измеренным с помощью дифференциальной сканирующей калориметрии (DSC).
Настоящее изобретение также предусматривает способ получения заявленной кристаллической формы ивабрадина гидрохлорида, который предусматривает стадию суспендирования ивабрадина гидрохлорида в растворителе суспензии, выбранном из толуола, этанола, ацетона, метилэтилкетона, метилизобутилкетона, этилацетата, изопропилацетата и их смеси. Толуол представляет собой предпочтительный растворитель суспензии и может использоваться отдельно или со вторым растворителем, выбранным из этанола, ацетона и этилацетата.
Настоящее изобретение также раскрывает способ получения заявленной кристаллической формы ивабрадина гидрохлорида, который дополнительно предусматривает стадию высушивания выделенного ивабрадина гидрохлорида после стадии суспендирования при давлении, составляющем меньше 760 мм рт. ст., и температуре, составляющей приблизительно 65°C.
Раскрытые в настоящем изобретении способы получения заявленной кристаллической формы ивабрадина гидрохлорида необязательно могут предусматривать стадию затравливания с помощью раскрытой в настоящем изобретении новой кристаллической формы ивабрадина гидрохлорида.
Анализы дифференциальной сканирующей калориметрии (DSC) проводили с использованием калориметра Mettler-Toledo DSC-822e. Экспериментальные условия: алюминиевые тигли объемом 40 мкл, атмосфера сухого азота с объемной скоростью потока, составляющей 50 мл/мин, скорость нагревания, составляющая 10°C/мин. Калориметр калибровали с помощью индия с чистотой 99,99%. Прибор мог давать в результате различные термограммы. Настоящее изобретение характеризуется значениями термограммы, представленными в настоящем документе, полученными с использованием указанного прибора для DSC, а также эквивалентными значениями термограммы, полученной с использованием других типов приборов для проведения DSC.
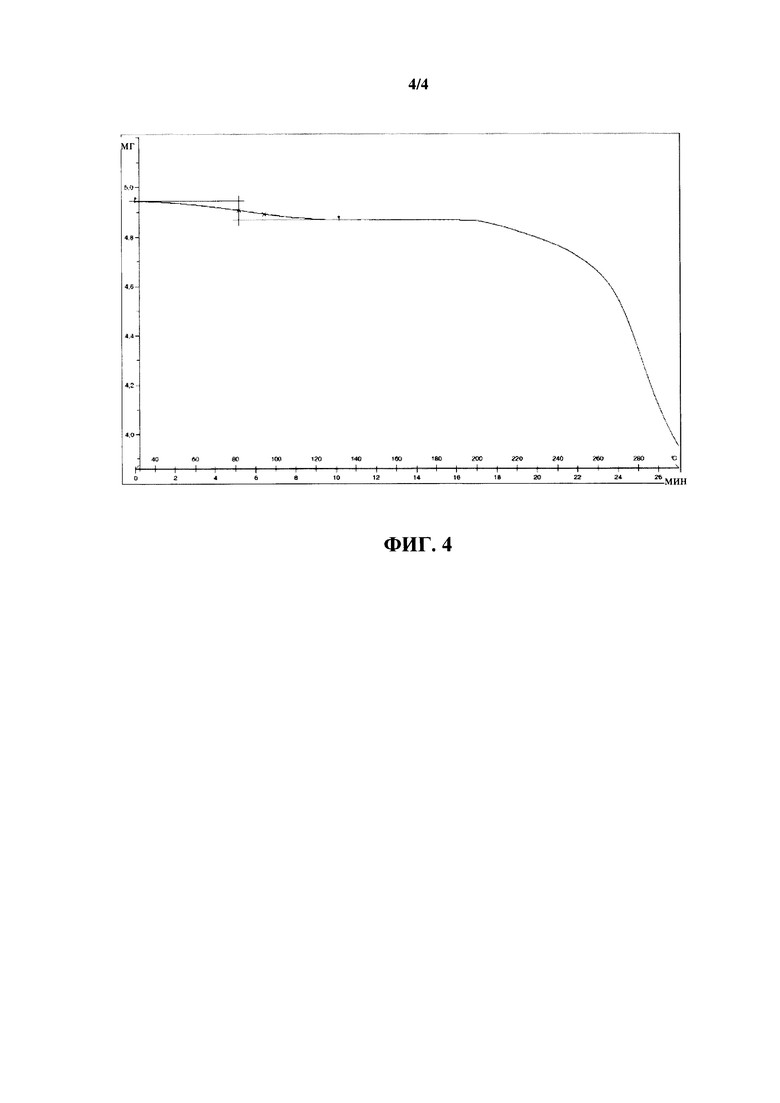
Термические гравиметрические анализы (TGA) проводили на термовесах Mettler-Toledo TGA-851e. Экспериментальные условия: тигли из оксида алюминия объемом 70 мл, атмосфера сухого азота с объемной скоростью потока, составляющей 50 мл/мин, скорость нагревания, составляющая 10°C/мин.
Анализы PXRD формы IV ивабрадина гидрохлорида: Образцы порошка помещали между пленками из сложного полиэфира толщиной 20 мкм и анализировали в порошковом дифрактометре PANalytical X'Pert PRO MPD θ/θ радиусом 240 мм, в конфигурации сходящегося пучка с фокусирующим зеркалом и геометрией пропускания через плоский образец в следующих экспериментальных условиях: Cu Kα-излучение (I=1,5418 Ã); рабочая мощность: 45 кВ и 40 мА; щели падающего пучка, определяющие высоту пучка 0,4 мм; щели Соллера 0,02 радиана для падающего и дифрагированного пучков; датчик PIXcel: активная длина = 3,347 °; сканирования 2θ/θ от 2 до 40°2θ с размером шага, составляющим 0,026°2θ и временем измерения, составляющим 75 секунд на шаг.
Термин "приблизительно" при использовании в контексте настоящего изобретения относится к ±10% от определенного количества. В контексте настоящего изобретения для паттернов рентгеновской дифракции, в зависимости от калибровки, образца или прибора, пики при 2q могут сдвигаться вплоть до ±0,2° (погрешность). Согласно одному варианту осуществления все пики в паттерне рентгеновской дифракции сдвигаются вплоть до +0,2°, или до -0,2°. Паттерн или пики рентгеновской дифракции в пределах указанной погрешности рассматриваются в качестве одинаковых или по существу аналогичных.
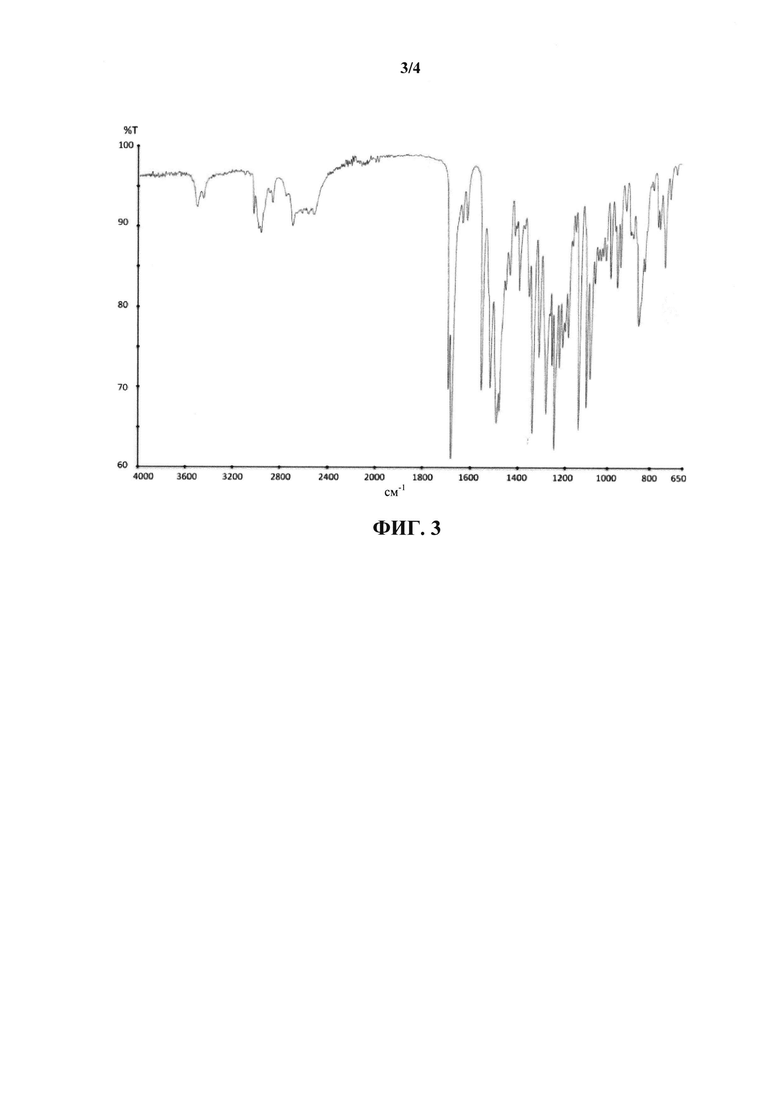
Спектры инфракрасной (IR) Фурье-спектроскопии нарушенного полного внутреннего отражения (FT-IR-ATR) регистрировали на спектрометре Perkin Elmer Spectrum One/100 FT-IR с универсальным вспомогательным устройством для взятия образцов для исследования нарушенного полного внутреннего отражения (ATR) (SPECTRUM 100 с UATR1 BOUNCE). Образец помещают на пластину ATR и измерение проводят в диапазоне 650-4000 см-1. Термин "IR или спектр/спектры IR" при использовании в настоящем контексте относится к спектрам, регистрируемым в указанных выше условиях.
Термин "MiBK" при использовании в контексте настоящего изобретения относится к метилизобутилкетону.
Термин "MEK" при использовании в контексте настоящего изобретения относится к метилэтилкетону.
Для целей настоящего изобретения любые приведенные диапазоны включают в себя как нижнюю, так и верхнюю границы диапазона.
Представленные ниже графические материалы и примеры иллюстрируют объем настоящего изобретения.
Краткое описание графических материалов
На фигуре 1 показана рентгеновская дифрактограмма для новой кристаллической формы ивабрадина гидрохлорида.
На фигуре 2 показана термограмма DSC для новой кристаллической формы ивабрадина гидрохлорида.
На фигуре 3 показан спектр IR для новой кристаллической формы ивабрадина гидрохлорида.
На фигуре 4 показан анализ TGA для новой кристаллической формы ивабрадина гидрохлорида.
ПРИМЕРЫ
Препаративный пример 1.
Кристаллический ивабрадина гидрохлорид.
Кристаллический ивабрадина гидрохлорид получали согласно описанному в патенте ЕР 0534859 способу.
Препаративный пример 2.
Форма α ивабрадина гидрохлорида.
Форму α ивабрадина гидрохлорида получали согласно описанному в патенте ЕР 1589005 способу.
Препаративный пример 3.
Форма δ ивабрадина гидрохлорида.
Форма δ получали согласно описанному в патенте ЕР 1956005 способу.
Препаративный пример 4.
Форма δd ивабрадина гидрохлорида.
Форма δd получали согласно описанному в патенте ЕР 1775287 способу.
Препаративный пример 5.
Ивабрадин.
Ивабрадин получали согласно описанному в патенте ЕР 0534859 способу.
Пример 1.
Форма IV ивабрадина гидрохлорида.
15,0 г кристаллического ивабрадина гидрохлорида препаративного примера 1 со значением согласно титрованию по методу Карла Фишера, составляющим 1,6%, суспендировали с 750 мл толуола при температуре 20-25°C в течение 4 дней. Твердый продукт выделяли и высушивали в вакууме при температуре 45°C. Полученный кристаллический продукт характеризовался PXRD, подтверждающей его структуру (чистота согласно ВЭЖХ: 99,8%, выход: 86%).
Примеры 2-7.
Форма IV ивабрадина гидрохлорида.
Примеры 2-7 проводили согласно описанному в примере 1 способу. Во всех случаях получение формы IV подтверждали с помощью PXRD.

Пример 8.
Форма IV ивабрадина гидрохлорида.
15,0 г ивабрадина гидрохлорида суспендировали с 750 мл толуола при Т: 20-25°C в течение 1 дня. Твердый продукт выделяли и высушивали в вакууме при температуре 45°C. Полученный кристаллический продукт характеризовался PXRD, подтверждающей его структуру (выход: 85%).
Пример 9.
Форма IV ивабрадина гидрохлорида.
0,5 г ивабрадина гидрохлорида перемешивали с 25 мл этилацетата при температуре 20-25°C. После затравливания продуктом, полученным в примере 1, суспензию перемешивали в течение 4 дней. Твердый продукт выделяли и высушивали в вакууме при температуре 45°C. Полученный кристаллический продукт характеризовался PXRD, подтверждающей его структуру (выход: 88%).
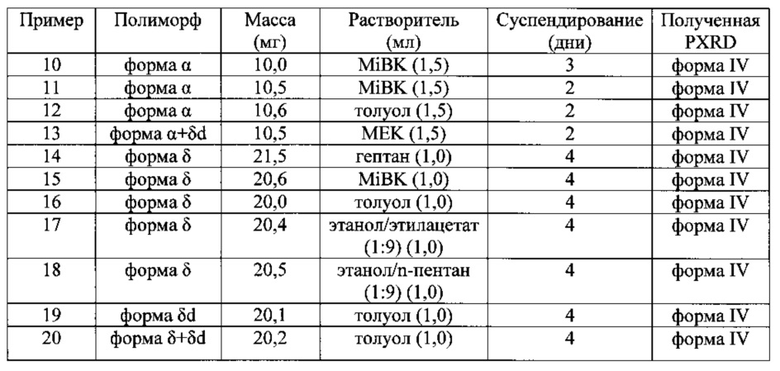
Примеры 10-20.
Форма IV ивабрадина гидрохлорида.
Ивабрадин HCI, полученный согласно его препаративному примеру, суспендировали в растворителе при комнатной температуре. Суспензию перемешивали при температуре 20-25°C. Твердое вещество фильтровали, высушивали в вакууме и анализировали с помощью PXRD.
Пример 21.
Форма IV ивабрадина гидрохлорида.
11,2 мг ивабрадина HCI формы α и 10,0 мг полученной согласно примеру 1 формы IV суспендировали в MiBK при комнатной температуре. Суспензию перемешивали в течение 3 дней при температуре 20-25°C. Твердое вещество фильтровали, высушивали в вакууме. Анализ с помощью PXRD подтвердил, что выделенный кристаллический ивабрадина гидрохлорид находился в своей новой кристаллической форме.
Примеры 22-24.
Форма IV ивабрадина гидрохлорида.
Примеры 22-24 проводили согласно способу, описанному в примере 21. Во всех случаях получение новой кристаллической формы подтверждали с помощью PXRD.

Пример 25.
Форма IV ивабрадина гидрохлорида.
Раствор, который содержал 6,9 г ивабрадина в 90 мл толуола, перемешивали, поддерживая температуру ниже приблизительно 40°C. Добавляли 16 мл раствора соляной кислоты в этаноле 1,75 М. Раствор затравливали продуктом, полученным в примере 1. Рост кристаллов стимулировали перемешиванием в течение 20 часов при поддержании температуры ниже приблизительно 40°C. Полученный твердый продукт выделяли и высушивали в вакууме при температуре 65°C.
Полученный кристаллический продукт характеризовался PXRD, подтверждающей его структуру (чистота согласно ВЭЖХ: 99,17%, выход: 68%).
Пример 26.
Таблетки формы IV ивабрадина гидрохлорида.
Таблетки формы IV ивабрадина гидрохлорида получали с использованием ингредиентов, перечисленных в следующей таблице.

Смешивали все компоненты, за исключением стеарата магния и коллоидного безводного диоксида кремния. В итоге, добавляли коллоидный безводный диоксид кремния и стеарат магния и перемешивали. Смесь прессовали в эксцентриковой таблеточной машине. Подтверждали отсутствие какой-либо трансформации кристаллической формы IV ивабрадина гидрохлорида.
Пример 27.
Покрытые пленочной оболочкой таблетки формы IV ивабрадина гидрохлорида.
Таблетки получали с указанными соотношениями ингредиентов, представленных в следующей таблице.

Все компоненты, за исключением стеарата магния и коллоидного безводного диоксида кремния, смешивали и гранулировали с использованием этанола в качестве гранулирующего растворителя. Затем проводили влажную калибровку гранул. Полученные гранулы высушивали с последующей сухой калибровкой гранул. После этого добавляли коллоидный безводный диоксид кремния и стеарат магния и перемешивали. Гранулят с добавленным смазывающим средством прессовали в эксцентриковой таблеточной машине.
В итоге, таблетки покрывали с использованием общепринятых образующих оболочку средств до повышения веса приблизительно на 3%.
Подтверждали отсутствие какой-либо трансформации кристаллической формы IV ивабрадина гидрохлорида.
Изобретение относится к форме IV ивабрадина гидрохлорида с порошковой рентгеновской дифракцией, содержащей следующие пики, выраженные в градусах 2 тета (±0,2): 8,74, 15,55, 17,17, 19,89 и 24,29, причем рентгеновская дифракция измерена с использованием CuKα-излучения, а также к фармацевтической композиции на ее основе, способам ее получения и ее применению в качестве терапевтически активного ингредиента. Технический результат: получена новая термодинамически стабильная кристаллическая форма ивабрадина гидрохлорида, характеризующаяся постоянными физическими свойствами. 6 н. и 25 з.п. ф-лы, 4 ил., 2 табл., 32 пр.
1. Форма IV ивабрадина гидрохлорида с порошковой рентгеновской дифракцией, содержащей следующие пики, выраженные в градусах 2 тета (±0,2): 8,74, 15,55, 17,17, 19,89 и 24,29, причем рентгеновская дифракция измерена с использованием CuKα-излучения.
2. Форма IV ивабрадина гидрохлорида по п. 1 с порошковой рентгеновской дифракцией, содержащей следующие пики, выраженные в градусах 2 тета (±0,2): 8,11, 8,74, 15,55, 17,17, 19,18, 19,89, 21,82, 22,49, 24,29 и 24,53, причем рентгеновская дифракция измерена с использованием CuKα-излучения.
3. Форма IV ивабрадина гидрохлорида по любому из пп. 1 или 2, характеризующаяся термограммой дифференциальной сканирующей калориметрии, которая демонстрирует один эндотермический пик от 153°С до 157°С.
4. Способ получения формы IV ивабрадина гидрохлорида по любому из пп. 1 или 2, который предусматривает стадию:
а) суспендирования ивабрадина гидрохлорида в системе растворителей, причем система растворителей содержит растворитель, выбранный из толуола, этанола, ацетона, метилэтилкетона, метилизобутилкетона, этилацетата, изопропилацетата и их смесей.
5. Способ по п. 4, в котором система растворителей стадии (а) содержит по меньшей мере два растворителя.
6. Способ по п. 4, в котором система растворителей стадии (а) содержит толуол и второй растворитель, выбранный из этанола, ацетона и этилацетата.
7. Способ по п. 4, в котором система растворителей стадии (а) представляет собой толуол.
8. Способ по п. 4, в котором температура стадии (а) составляет ниже 60°С, предпочтительно от 10°С до 60°С.
9. Способ по п. 8, в котором температура стадии (а) составляет от 10°С до 30°С.
10. Способ по п. 9, в котором температура стадии (а) составляет от 20°С до 25°С.
11. Способ по п. 4, в котором время реакции для проведения стадии (а) составляет меньше 48 ч.
12. Способ по п. 11, в котором время реакции для проведения стадии (а) составляет меньше 24 ч.
13. Способ по любому из пп. 5-12, в котором соотношение на стадии (а) литра системы растворителей на килограмм формы IV ивабрадина гидрохлорида составляет от 5 до 50.
14. Способ по п. 13, в котором соотношение на стадии (а) литра системы растворителей на килограмм формы IV ивабрадина гидрохлорида составляет от 8 до 12.
15. Способ по любому из пп. 5-12 или 14, дополнительно предусматривающий стадию: b) выделения формы IV ивабрадина гидрохлорида.
16. Способ по п. 15, дополнительно предусматривающий стадию:
с) высушивания выделенной формы IV ивабрадина гидрохлорида при вакуумметрическом давлении и при температуре от 45°С до 70°С.
17. Способ получения формы IV ивабрадина гидрохлорида по любому из пп. 5-12, 14 или 16, предусматривающий стадии:
i) перемешивания раствора свободного основания ивабрадина в системе растворителей, причем система растворителей содержит толуол, этанол, ацетон, метилэтилкетон, метилизобутилкетон, этилацетат, изопропилацетат и их смеси;
ii) поддержания температуры раствора ниже 60°С, предпочтительно от 10°С до 60°С, более предпочтительно ниже 40°С и более предпочтительно от 10°С до 40°С;
iii) добавления раствора соляной кислоты для получения ивабрадина гидрохлорида;
iv) затравливания формой IV ивабрадина гидрохлорида;
v) выделения формы IV ивабрадина гидрохлорида; и
vi) высушивания выделенной формы IV ивабрадина гидрохлорида при вакуумметрическом давлении и при температуре от 45°С до 70°С.
18. Способ получения формы IV ивабрадина гидрохлорида по любому из пп. 5-12, 14 или 16, предусматривающий стадии:
i’) перемешивания раствора свободного основания ивабрадина в системе растворителей, причем система растворителей содержит толуол, этанол, ацетон, метилэтилкетон, метилизобутилкетон, этилацетат, изопропилацетат и их смеси;
ii’) поддержания температуры раствора ниже 60°С, предпочтительно от 10°С до 60°С, более предпочтительно ниже 40°С и более предпочтительно от 10°С до 40°С;
iii’) затравливания формой IV ивабрадина гидрохлорида;
iv’) добавления раствора соляной кислоты для получения ивабрадина гидрохлорида;
v’) выделения формы IV ивабрадина гидрохлорида; и
vi’) высушивания выделенной формы IV ивабрадина гидрохлорида при вакуумметрическом давлении и при температуре от 45°С до 70°С.
19. Фармацевтическая композиция, содержащая эффективное количество формы IV ивабрадина гидрохлорида по любому из пп. 1 или 2 и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
20. Фармацевтическая композиция по п. 19 для перорального введения.
21. Фармацевтическая композиция по п. 20, причем указанная композиция представлена в форме таблетки.
22. Фармацевтическая композиция по п. 20, причем указанная композиция представлена в форме покрытой пленочной оболочкой таблетки.
23. Фармацевтическая композиция по п. 22, в которой образующее оболочку средство выбрано из производных целлюлозы, производных полиметилметакрилата, поливинилового спирта и производных поливинилового спирта.
24. Фармацевтическая композиция по п. 23, в которой образующее оболочку средство представляет собой гидроксипропилметилцеллюлозу и гидроксипропилцеллюлозу.
25. Фармацевтическая композиция по любому из пп. 20-24, причем указанная композиция содержит от приблизительно 5 мг до приблизительно 9 мг формы IV ивабрадина гидрохлорида.
26. Композиция по п. 25, причем указанная композиция содержит приблизительно 5,390 мг формы IV ивабрадина гидрохлорида.
27. Композиция по п. 25, причем указанная композиция содержит приблизительно 8,085 мг формы IV ивабрадина гидрохлорида.
28. Способ производства композиции по любому из пп. 20-24, 26 или 27, отличающийся тем, что способ предусматривает применение техник прямого прессования, сухого гранулирования и/или влажного гранулирования.
29. Способ по п. 28, отличающийся тем, что способ влажного гранулирования предусматривает применение органических растворителей, предпочтительно ацетона, спиртов или их комбинации.
30. Применение формы IV ивабрадина гидрохлорида по любому из пп. 1 или 2 в лечении форм брадикардии, миокардиальной ишемии, суправентрикулярных нарушений ритма, хронической стабильной стенокардии у взрослых с ишемической болезнью сердца с нормальным синусовым ритмом, инфаркта миокарда, сердечной недостаточности и сопутствующих нарушений ритма.
31. Применение фармацевтической композиции по любому из пп. 20-24 в лечении форм брадикардии, миокардиальной ишемии, суправентрикулярных нарушений ритма, хронической стабильной стенокардии у взрослых с ишемической болезнью сердца с нормальным синусовым ритмом, инфаркта миокарда, сердечной недостаточности и сопутствующих нарушений ритма.
| Контактный термометр | 1928 |
|
SU10296A1 |
| Приспособление для установки винта, в частности для летательных аппаратов | 1928 |
|
SU10286A1 |
| Приспособление к плоской типографской машине для получения двухкрасочного отпечатка за один оттиск | 1927 |
|
SU8465A1 |
| WO2008125006 A1, 23 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2017-05-12—Публикация
2012-09-21—Подача