Область техники, к которой относится изобретение
В данном описании раскрываются пролекарства метилгидрофумарата, фармацевтические композиции, включающие пролекарства метилгидрофумарата, и способы применения пролекарств метилгидрофумарата и фармацевтических композиций с ними для лечения таких заболеваний, как псориаз, астма, рассеянный склероз, воспалительное заболевание кишечника и артрит.
Уровень техники
Эфиры фумаровой кислоты (РАЕ), одобренные в Германии для лечения псориаза, проходят оценку в Соединенных Штатах для лечения псориаза и рассеянного склероза и предложены для применения при лечении широкого ряда иммунологических, аутоиммунных и воспалительных заболеваний и состояний.
FAE и другие производные фумаровой кислоты предложены для применения при лечении самых разных заболеваний и состояний, в том числе, иммунологических, аутоиммунных и воспалительных процессов, включая псориаз (Joshi and Strebel, WO 1999/49858; US 6277882; Mrowietz and Asadullah, Trends Mol. Med., 2005, 111(1), 43-48; и Yazdi and Mrowietz, Clinics Dermatology, 2008, 26, 522-526); астму и хронические обструктивные болезни легких (Joshi et al., WO 2005/023241 и US 2007/0027076); сердечную недостаточность, в том числе, левожелудочковую недостаточность, инфаркт миокарда и стенокардию (Joshi., WO 2005/023241; Joshi et al., US 2007/0027076); митохондриальные и нейродегенеративные заболевания, такие как болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона, пигментная ретинопатия и митохондриальная энцефаломиопатия (Joshi and Strebel, WO 2002/055063, US 2006/0205659. US 6509376, US 6858750 и US 7157423); трансплантацию (Joshi and Strebel, WO 2002/055063, US 2006/0205659, US 6359003, US 6509376 и US 7157423; и Lehmann et al.. Arch. Dermatol. Res., 2002, 294, 399-404); аутоиммунные заболевания (Joshi and Strebel, WO 2002/055063, US 6509376, US 7157423 и US 2006/0205659), включая рассеянный склероз (MS) (Joshi and Strebel, WO 1998/52549 и US 6436992; Went and Lieberburg, US 2008/008986; Schimrigk et al., Eur. J. Neurology, 2006, 13, 604-610; и Schilling et al., Clin. Experimental Immunology, 2006, 145, 101-107); ишемию и реперфузионное повреждение (Joshi et al., US 2007/0027076); AGE-индуцированное повреждение генома (Heidland, WO 2005/027899); воспалительные заболевания кишечника, такие как болезнь Крона и неспецифический язвенный колит; артрит и другие заболевания (Nilsson et al., WO 2006/037342, и Nilsson and Muller, WO 2007/042034).
Полагают, что механизм действия эфиров фумаровой кислоты опосредуется путями, связанными с иммунологической реакцией. Например, FAE вызывают смещение иммунной реакции от Th1 к Th2, благоприятно изменяя цитокиновый профиль; ингибируют вызванную цитокинами экспрессию факторов адгезии, таких как VCAM-1, ICAM-1 и Е-отбора, причем посредством этого уменьшается выхождение иммунных клеток; и снижают лимфоциты через апоптозные механизмы (Lehmann et al., J. Investigative Dermatology, 2007, 127, 835-845; Gesser et al., J. Investigative Dermatology, 2007, 127, 2129-2137; Vandermeeren et al., Biochem. Biophys. Res. Commun., 1997, 234, 19-23; и Treumer et al., J. Invest. Dermatol., 2003, 121, 1383-1388).
Последние исследования приводят к мысли, что FAE являются ингибиторами активации NF-κВ - фактора транскрипции, который регулирует индуцибельную экспрессию медиаторов провоспаления (D'Acquisto et al., Molecular Interventions, 2002, 2(1), 22-35). Соответственно, FAE предложены для применения при лечении NF-кВ-опосредуемых заболеваний (Joshi et al., WO 2002/055066; и Joshi and Strebel, WO 2002/055063, US 2006/0205659, US 7157423 и US 6509376). Также показано, что ингибиторы активации NF-κВ применимы в ангиостатической терапии (Tabruyn and Griffioen, Angiogenesis, 2008, 11, 101-106), при воспалительном заболевании кишечника (Atreya et al., J. Intern. Med., 2008, 263(6), 591-6); и, на животных моделях, заболеваний, включая воспаление, включая нейтрофильный альвеолит, астму, гепатит, воспалительное заболевание кишечника, нейродегенерации, ишемию/реперфузию, септический шок, гломерулонефрит и ревматоидный артрит (D'Acquisto et al., Molecular Interventions, 2002, 2(1), 22-35).
Исследования также предполагают, что ингибирование NF-κВ FAE может быть опосредовано взаимодействием с передачей сигнала фактора некроза опухоли (TNF). Диметилфумарат ингибирует индуцированную TNF экспрессию мРНК тканевого фактора и белка и индуцированное TNF связывание ДНК белков NF-κВ, и ингибирует индуцированное TNF поступление активированных белков NF-κВ, причем посредством этого ингибируется активация генов воспаления (Loewe et al., J. Immunology, 2002, 168, 4781-4787). Пути передачи сигналов TNF вовлечены в патогенез иммуноопосредуемых воспалительных заболеваний, таких как ревматоидный артрит, болезнь Крона, псориаз, псориатический артрит, ювенильный идиопатический артрит и анкилозирующий спондилит (Tracey et al., Pharmacology & Therapeutics, 2008, 117, 244-279).
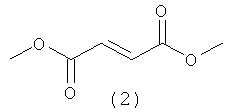
Таблетка с энтеросолюбильным покрытием Fumaderm®, содержащая смесь солей моноэтилфумарата и диметилфумарата (DMF) (2), который быстро гидролизуется до монометилфумарата (МНР) (1), рассматриваемого как основной биоактивный метаболит, одобрена в Германии в 1994 для лечения псориаза.

Fumaderm® дозируют TID по 1-2 г/сутки, вводимых для лечения псориаза. Fumaderm® обнаруживает высокую степень изменчивости от пациента к пациенту в отношении абсорбции лекарственного средства, и пища сильно уменьшает биологическую доступность. Полагают, что абсорбция происходит в тонкой кишке с максимальными уровнями, достигаемыми через 5-6 часов после перорального введения. Существенное побочное действие имеет место у 70-90% пациентов (Brewer and Rogers, Clin. Expt'l Dermatology, 2007, 32, 246-49; и Hoefhagel et al., Br. J. Dermatology, 2003, 149, 363-369). Побочное действие современной терапии FAE включает желудочно-кишечные расстройства, включая тошноту, рвоту и диарею, и транзиторное покраснение кожи. Также DMF показывает плохую растворимость в воде.
В попытках преодолеть недостатки современной терапии FAE разработаны производные фумаровой кислоты (Joshi and Strebel, WO 2002/055063, US 2006/0205659 и US 7157423 (амиды и белковофумаратные конъюгаты); Joshi et al., WO 2002/055066, и Joshi and Strebel, US 6355676 (моно- и диалкилэфиры); Joshi and Strebel, WO 2003/087174 (карбоциклические и оксакарбоциклические соединения); Joshi et al., WO 2006/122652 (тиосукцинаты);); Joshi et al., US 2008/0233185 (диалкил- и диарилэфиры) и соли (Nilsson et al., US 2008/0004344). Фармацевтические композиции с регулируемым высвобождением, включающие эфиры фумаровой кислоты, раскрыты Nilsson and Muller, WO 2007/042034. Пролекарства циклоамидные эфиры описаны Nielsen and Bundgaard, J. Pharm. Sci, 1988, 77(4), 285-298.
Раскрытие изобретения
Необходимы Пролекарства МНР с высокой гастроинтестинальной просачиваемостью и/или абсорбцией, улучшенной растворимостью, упорядоченным гидролизом (т.е. предпочтительное отщепление прогрупп) и минимальным гидролизом в просвете кишки или энтероцитной цитоплазмы. Такие Пролекарства МНР, которые обеспечивают более высокую пероральную биодоступность и уровни в плазме MHF, DMF и/или других метаболитов, могут увеличить эффективность/пропорцию респондеров по сравнению с существующими эфирами фумаровой кислоты; облегчить использование меньших доз, пониженную частоту дозирования и стандартизованные схемы приема; уменьшить действие пищи; уменьшить желудочно-кишечное побочное действие/токсичность и уменьшить изменчивость лечения от пациента к пациенту. В первом аспекте изобретение относится к соединениям формулы (I)
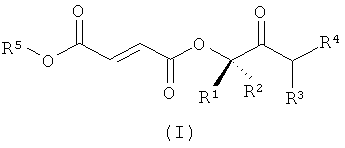
или их фармацевтически приемлемым солям, где в указанной формуле
R1 и R2 выбирают независимо из водорода, C1-6-алкила и замещенного C1-6-алкила;
R3 и R4 выбирают независимо из водорода, C1-6-алкила, замещенного C1-6-алкила, C1-6-гетероалкила, замещенного C1-6-гетероалкила, С4-12-циклоалкилалкила, замещенного С4-12-циклоалкилалкила, С7-12-арилалкила и замещенного С7-12-арилалкила; или R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из C5-10-гетероарила, замещенного С5-10-гетероарила, С5-10-гетероциклоалкила и замещенного С5-10-гетероциклоалкила; и
R5 выбирают из метила, этила и С3-6-алкила;
где каждую группу-заместитель выбирают независимо из галогена, -ОН, -CN, -CF3, -О, - NO2, бензила, - C(O)NR11 2, - R11, - OR11, - C(O)R11, - COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и С1-4-алкила;
при условии, что когда R5 представляет собой этил, тогда R3 и R4 выбирают независимо из водорода, C1-6-алкила и замещенного C1-6-алкила.
Во втором аспекте изобретение относится к соединениям формулы (II)
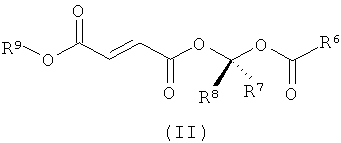
или их фармацевтически приемлемым солям, где в указанной формуле R6 выбирают из C1-6-алкила, замещенного C1-6-алкила, C1-6-гетероалкила, замещенного C1-6-гетероалкила, С3-8-циклоалкила, замещенного С3-8-циклоалкила, С6-8-арила, замещенного С6-8-арила и -OR10, где R10 выбирают из C1-6-алкила, замещенного C1-6-алкила, С3-10-циклоалкила, замещенного С3-10-циклоалкила, С6-10-арила и замещенного С6-10-арила;
R7 и R8 выбирают независимо из водорода, С1-6-алкила и замещенного С1-6-алкила;
и
R9 выбирают из С1-6-алкила и замещенного С1-6-алкила;
где каждую группу-заместитель выбирают независимо из галогена, -ОН, -CN, -CF3, -О, -NO2, бензила, -C(O)NR11 2, -R11, -OR11, -C(O)R11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила.
В третьем аспекте изобретение относится к соединениям формулы (III)

или их фармацевтически приемлемым солям, где в указанной формуле
R1 и R2 выбирают независимо из водорода, С1-6-алкила и замещенного С1-6-алкила;
и
R3 и R4 выбирают независимо из водорода, С1-6-алкила, замещенного С1-6-алкила, C1-6-гетероалкила, замещенного C1-6-гетероалкила, С4-12-циклоалкилалкила, замещенного С4-12-циклоалкилалкила, С7-12-арилалкила и замещенного С7-12-арилалкила; или R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С5-10-гетероарила, замещенного С5-10-гетероарила, С5-10-гетероциклоалкила и замещенного C5-10-гетероциклоалкила;
где каждую группу-заместитель выбирают независимо из галогена, -ОН, -CN, -CF3,=O, -NO2, бензила, -C(O)NR11 2, -R11, -OR11, -C(O)R11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила.
В четвертом аспекте изобретение относится к соединениям формулы (IV)

или их фармацевтически приемлемым солям, где в указанной формуле R6 выбирают из С1-6-алкила, замещенного С1-6-алкила, C1-6-гетероалкила, замещенного C1-6-гетероалкила, С3-8-циклоалкила, замещенного С3-8-циклоалкила, С6-8-арила, замещенного С6-8-арила и -OR10, где R10 выбирают из С1-6-алкила, замещенного C1-6-алкила, С3-10-циклоалкила, замещенного С3-10-циклоалкила, С6-10-арила и замещенного С6-10-арила; и
R7 и R8 выбирают независимо из водорода, С1-6-алкила и замещенного С1-6-алкила;
где каждую группу-заместитель выбирают независимо из галогена, -ОН, -CN, -CF3,=O, -NO2, бензила, -C(O)NR11 2, -R11, -OR11, -C(O)R11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила;
при условии, что
когда один из R7 и R8 выбран из этила и метила, а другой из R7 и R8 представляет собой водород, тогда R не является -С(СН3)=СН2; и
когда каждый из R7 и R8 представляет собой водород, тогда R6 не выбирают из -СН=СН2 и 4-карбоксифенила.
В пятом аспекте изобретение относится к фармацевтическим композициям, включающим соединение формул (I)-(IV) и, по меньшей мере, один фармацевтически приемлемый носитель.
В шестом аспекте изобретение относится к способам лечения заболевания у пациента, включающим введение пациенту, нуждающемуся в таком лечении, фармацевтической композиции, включающей терапевтически эффективное количество соединения формул (I)-(IV). В некоторых воплощениях заболевание выбирают из псориаза, рассеянного склероза, воспалительного заболевания кишечника, астмы, хронической обструктивной болезни легких и артрита.
В седьмом аспекте изобретение относится к способам ингибирования активации NF-κВ у пациента, включающим введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество соединения формул (I)-(IV).
В восьмом аспекте изобретение относится к способам ингибирования функции TNF у пациента, включающим введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество соединения формул (I)-(IV).
Осуществление изобретения
Определения
Черточка («-»), которая не находится между двумя буквами или символами, используется для указания точки присоединения для группы-заместителя. Например, -CONH2 присоединяется через атом углерода.
Термин «алкил» относится к насыщенному или ненасыщенному разветвленному или линейному одновалентному углеводородному радикалу, полученному удалением одного атома водорода от одного атома углерода исходного алкана, алкена или алкина. Примеры алкильных групп включают, но не ограничиваются перечисленным, метил; этилы, такие как этанил, этенил и этинил; пропилы, такие как пропан-1-ил, пропан-2-ил, проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), проп-1-ин-1-ил, проп-2-ин-1-ил и т.д.; бутилы, такие как бутан-1-ил, бутан-2-ил, 2-метил-пропан-1-ил, 2-метил-пропан-2-ил, бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метил-проп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.д., и подобные группы.
Термин «алкил» специфически предназначен для включения групп с любой степенью или уровнем замещения, т.е., групп с исключительно одинарными углерод-углеродными связями, групп с одной или несколькими двойными углерод-углеродными связями, групп с одной или несколькими тройными углерод-углеродными связями и групп с комбинациями одинарной, двойной и тройной углерод-углеродных связей. Когда предполагается определенный уровень насыщения, используют термины «алканил», «алкенил» и «алкинил». В некоторых воплощениях алкильная группа может иметь от 1 до 20 атомов углерода (C1-20), в некоторых воплощениях от 1 до 10 атомов углерода (С1-10), в некоторых воплощениях от 1 до 8 атомов углерода (C1-8), в некоторых воплощениях от 1 до 6 атомов углерода (C1-6), в некоторых воплощениях от 1 до 4 атомов углерода (C1-4) и в некоторых воплощениях от 1 до 3 атомов углерода (C1-3)
Термин «арил» относится к одновалентному ароматическому углеводородному радикалу, полученному удалением одного атома водорода от одного атома углерода исходной ароматической циклической системы. Арил включает моноциклические системы, например, бензол; бициклические системы, в которых, по меньшей мере, один цикл является карбоциклическим и ароматическим, например, нафталин, индан и тетралин; и трициклические системы, в которых, по меньшей мере, один цикл является карбоциклическим и ароматическим, например, флуорен. Арил охватывает полициклические системы с, по меньшей мере, одним карбоциклическим ароматическим циклом, конденсированным с, по меньшей мере, одним карбоциклическим ароматическим циклом, циклоалкильным циклом или гетероциклоалкильным циклом. Например, арил включает фенильный цикл, конденсированный с 5-7-членным гетероциклоалкильным циклом, содержащим один или несколько гетероатомов, выбранных из N, О и S. В случае таких конденсированных бициклических систем, в которых только один из циклов является карбоциклическим ароматическим циклом, атом углерода радикала может находиться в карбоциклическом ароматическом цикле или гетероциклоалкильном цикле. Примеры арильных групп включают, но не ограничиваются перечисленным, группы, образованные от ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, флуорена, гексацена, гексафена, гексалена, as-индацена, s-индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плейадена, пирена, пирантрена, рубицена, трифенилена, тринафталена и т.п.. В некоторых воплощениях арильная группа может иметь от 6 до 20 атомов углерода (С6-20), от 6 до 12 атомов углерода (С6-12), от 6 до 10 атомов углерода (С6-10), и в некоторых воплощениях от 6 до 8 атомов углерода (С6-8). Однако арил не охватывает и никоим образом не перекрывает гетероарил, имеющий в данном описании отдельное определение.
Термин «арилалкил» относится к ациклическому алкильному радикалу, в котором один из атомов водорода, связанных с атомом углерода, типично, концевого или sp3 атома углерода, заменен арильной группой. Примеры арилалкильных групп включают, но не ограничиваются перечисленным, бензил, 2-фенилэтан-1-ил, 2-фенилэтен-1-ил, нафтилметил, 2-нафтилэтан-1-ил, 2-нафтилэтен-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и подобные. Когда предполагаются определенные алкильные группы, используют номенклатуру арилалканил, арилалкенил или арилалкинил. В некоторых воплощениях арилалкильная группа представляет собой С7-30-арилалкил, например, алканильная, алкенильная или алкенильная часть арилалкильной группы является C1-10, и арильная часть является С6-20, в некоторых воплощениях арилалкильная группа представляет собой С6-18-арилалкил, например, алканильная, алкенильная или алкенильная часть арилалкильной группы является C1-8, и арильная часть является С6-10. В некоторых воплощениях арилалкильная группа представляет собой С7-12-арилалкил.
«Соединения» формул (I)-(IV), раскрытые в данном описании, включают любые специфические соединения в пределах указанных формул. Соединения можно идентифицировать или по их химической структуре и/или химическому названию. Соединения называют с использованием Chemistry 4-D Draw Pro, версия 7.01 с (Chemlnnovation Software, Inc., San Diego, CA). Когда химическая структура и химическое название вступают в противоречие, определяющей для идентификации соединения является химическая структура. Соединения, описанные в данном описании, могут включать один или несколько хиральных центров и/или двойных связей и поэтому могут существовать в виде стереоизомеров, таких как изомеры по двойной связи (т.е., геометрические изомеры), энантиомеры или диастереомеры. Соответственно, любые химические структуры в пределах объема представленного описания, в целом или в части с родственной конфигурацией, охватывают все возможные энантиомеры и стереоизомеры иллюстрированных соединений, включая стереохимически чистую форму (например, геометрически чистую, энантиомерно чистую или диастереомерно чистую) и энантиомерные и стереоизомерные смеси. Энантиомерные и стереоизомерные смеси можно разделить на составляющие их энантиомеры или стереоизомеры с использованием методов разделения или методов хирального синтеза, хорошо известных специалистам в данной области техники. Соединения формул (I)-(IV) включают, но не ограничиваются перечисленным, оптические изомеры соединений формул (I)-(IV), их рацематы и другие их смеси. В таких воплощениях отдельный энантиомер или диастереомер, т.е. оптически активную форму, можно получить асимметричным синтезом или расщеплением рацематов. Расщепление рацематов можно осуществить, например, обычными методами, такими как кристаллизация в присутствии расщепляющего агента или хроматография с использованием, например, хиральных неподвижных фаз. Безотносительно к вышеизложенному, в соединениях формул (I)-(IV) конфигурация у показанной двойной связи представляет собой только Е-конфигурацию (т.е., транс-конфигурацию).
Соединения формул (I)-(IV) также могут существовать в нескольких таутомерных формах, включая енольную форму, кетоформу и их смеси. Соответственно, химические структуры, отображенные в данном описании, охватывают все возможные таутомерные формы показанных соединений. Соединения формул (I)-(IV) также включают меченные изотопами соединения, когда один или несколько атомов имеют атомную массу, отличающуюся от атомной массы, обычно обнаруживаемой в природе. Примеры изотопов, которые могут быть введены в соединения, раскрытые в данном описании, включают, но не ограничиваются перечисленным, 2H, 3Н, 11С, 13С, 14С, 15N, 18О, 17О и т.д.. Соединения могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы и N-оксиды. Вообще соединения, упоминаемые в данном описании, могут представлять собой свободные кислоты, могут быть гидратированными, сольватированными или N-оксидами. Некоторые соединения могут существовать в нескольких кристаллических, сокристаллических или аморфных формах. Соединения формул (I)-(IV) включают их фармацевтически приемлемые соли или фармацевтически приемлемые сольваты формы свободной кислоты любой из вышеуказанных форм, а также кристаллические формы любой из вышеуказанных форм.
Соединения формул (I)-(IV) также включают сольваты. Термин «сольват» относится к комплексу соединения с одной или несколькими молекулами растворителя в стехиометрическом или нестехиометрическом количестве. Такие молекулы растворителя представляют собой растворители, обычно используемые в области фармации, о которых известно как о безвредных для пациентов, например, воду, этанол и т.п.. Молекулярный комплекс соединения или части соединения и растворителя может быть стабилизирован нековалентными внутримолекулярными силами, такими как, например, электростатические силы, ван-дер-ваальсовы силы или водородные связи. Термин «гидрат» относится к сольвату, в котором одна или несколько молекул растворителя являются молекулами воды.
Кроме того, когда приводятся структуры соединений, звездочка (*) указывает точку присоединения части структуры к остальной молекуле.
Термин «циклоалкил» относится к насыщенному или частично ненасыщенному циклическому алкильному радикалу. Когда предполагается определенный уровень насыщения, используют номенклатуру «циклоалканил» или «циклоалкенил». Примеры циклоалкильных групп включают, но не ограничиваются перечисленным, группы, образованные от циклопропана, циклобутана, циклопентана, циклогексана и т.п.. В некоторых воплощениях циклоалкильная группа представляет собой С3-15-циклоалкил, С3-12-циклоалкил, и в некоторых воплощениях С3-8-циклоалкил.
Термин «циклоалкилалкил» относится к ациклическому алкильному радикалу, в котором один из атомов водорода, связанных с атомом углерода, типично, концевым или sp3 атомом углерода, заменен циклоалкильной группой. Когда предполагаются определенные алкильные части, используют номенклатуру «циклоалкилалканил», «циклоалкилалкенил» или «циклоалкилалкинил». В некоторых воплощениях циклоалкилалкильная группа представляет собой С4-30-циклоалкилалкил, например, алканильная, алкенильная или алкинильная группа циклоалкилалкильной группы представляет собой группу C1-10, а циклоалкильная группа представляет собой группу С3-20, и в некоторых воплощениях циклоалкилалкильная группа представляет собой С3-20-циклоалкилалкил, например, алканильная, алкенильная или алкинильная группа циклоалкилалкильной группы представляет собой группу C1-8, а циклоалкильная группа представляет собой группу С3-12. В некоторых воплощениях циклоалкилалкильная группа представляет собой С4-12-циклоалкилалкил.
Термин «заболевание» относится к заболеванию, расстройству, состоянию или симптому любого из вышеуказанных заболеваний.
Термин «лекарство», определенный в 21 U.S.С, § 321(g)(l), означает «(А) изделия, признанные в официальной фармакопеи Соединенных Штатов, официальной гомеопатической фармакопеи Соединенных Штатов или в официальном National Formulary или любом их приложении; и (В) изделия, предназначенные для применения при диагностике, излечивании, смягчении, лечении или предупреждении заболевания у людей или других животных; и (С) изделия (иные, чем пищевые продукты), предназначенные для воздействия на любую функцию организма людей или других животных…»
Термин «галоген» относится к атому фтора, хлора, брома или иода. В некоторых воплощениях термин «галоген» относится к атому хлора.
Термин «гетероалкил» сам по себе или как часть другого заместителя относится к алкильной группе, в которой один или несколько атомов углерода (и некоторые ассоциированные атомы водорода) заменены независимо одинаковыми или разными гетероатомными группами. Примеры гетероатомных групп включают, но не ограничиваются перечисленным, -O-, -S-,-O-O-, -S-S-, -O-S-, -NR13, =N-N=, -N=N-, -N=N-NR13, -PR13, -P(O)2-, -POR13, -OP(O)2-, -SO-, -SO2-,-Sn(R13)2- и т.п., где каждый R13 выбирают независимо из водорода, C1-6-алкила, замещенного C1-6-алкила, С6-12-арила, замещенного С6-12-арила, С7-18-арилалкила, замещенного С3-7-арилалкила, С3-7-циклоалкила, замещенного С3-7-циклоалкила, С3-7-гетероциклоалкила, замещенного С1-6гетероциклоалкила, C1-6-гетероалкила, замещенного C1-6-гетероалкила, С6-12-гетероарила, замещенного С6-12-гетероарила, С7-18-гетероарилалкила или замещенного C7-18-гетероарилалкила. Ссылка на, например, C1-6-гетероалкил означает C1-6-алкильную группу, в которой, по меньшей мере, один из атомов углерода (и некоторые ассоциированные атомы водорода) заменен гетероатомом. Например, С1-6-гетероалкил включает группы, имеющие пять атомов углерода и один гетероатом, группы, имеющие четыре атомов углерода и два гетероатома, и т.д.. В некоторых воплощениях каждый R13 выбирают независимо из водорода и C1-3-алкила. В некоторых воплощениях гетероатомную группу выбирают из -O-, -S-, -NH-,-Н(СН3)- и -SO2-; и в некоторых воплощениях гетероатомная группа представляет собой -О-.
Термин «гетероарил» относится к одновалентному гетероароматическому радикалу, образованному удалением одного атома водорода от одного атома исходной гетероароматической циклической системы. Гетероарил охватывает несколько циклических систем, имеющих, по меньшей мере, один гетероароматический цикл, конденсированный с, по меньшей мере, одним другим циклом, который может быть ароматическим или неароматическим. Например, гетероарил охватывает бициклические системы, в которых один цикл является ароматическим, и второй цикл является гетероциклоалкильным циклом. В случае таких конденсированных гетероарильных циклических систем, в которых только один из циклов содержит один или несколько гетероатомов, углерод радикала может находиться в ароматическом цикле или в гетероциклоалкильном цикле. В некоторых воплощениях, когда общее число атомов N, S и О в гетероарильной группе превышает единицу, гетероатомы не являются соседними друг для друга. В некоторых воплощениях общее число гетероатомов в гетероарильной группе составляет не более двух.
Примеры гетероарильных групп включают, но не ограничиваются перечисленным, группы, образованные от акридина, арсиндола, карбазола, β-карболина, хромана, хромена, циннолина, фурана, имидазола, индазола, индола, индолина, индолизина, изобензофурана, изохромена, изоиндола, изоиндолина, изохинолина, изотиазола, изоксазола, нафтиридина, оксадиазола, оксазола, перимидина, фенантридина, фенантролина, феназина, фталазина, птеридина, пурина, пирана, пиразина, пиразола, пиридазина, пиридина, пиримидина, пиррола, пирролизина, хиназолина, хинолина, хинолизина, хиноксалина, тетразола, тиадиазола, тиазола, тиофена, триазола, ксантена, тиазолидина, оксазолидина и т.п.. В некоторых воплощениях гетероарильная группа представляет собой 4-20-членный гетероарил (C4-20), и в некоторых воплощениях 4-12-членный гетероарил (C4-12). В некоторых воплощениях гетероарильные группы представляет собой группы, образованные от тиофена, пиррола, бензотиофена, бензофурана, индола, пиридина, хинолина, имидазола, оксазола или пиразина. Например, в некоторых воплощениях С5-гетероарил может представлять собой фурил, тиенил, пирролил, имидазолил, пиразолил, изотиазолил, изоксазолил.
Термин «гетероциклоалкил» относится к насыщенному или ненасыщенному циклическому алкильному радикалу, в котором один или несколько атомов углерода (и некоторых ассоциированных атомов водорода) заменены независимо одинаковыми или разными гетероатомами; или к исходной ароматической циклической системе, в которой один или несколько атомов углерода (и некоторых ассоциированных атомов водорода) заменены независимо одинаковыми или разными гетероатомами так, что циклическая система более не содержит, по меньшей мере, один ароматический цикл. Примеры гетероатомов для замены атома(ов) углерода включают, но не ограничиваются перечисленным, N, Р, О, S, Si и т.д. Примеры гетероциклоалкильных групп включают, но не ограничиваются перечисленным, группы, образованные от эпоксидов, азиринов, тииранов, имидазолидина, морфолина, пиперазина, пиперидина, пиразолидина, пирролидина, хинуклидина и т.п.. В некоторых воплощениях гетероциклоалкильная группа представляет собой С5-10-гетероциклоалкил, С5-8-гетероциклоалкил, и в некоторых воплощениях С5-6-гетероциклоалкил.
«Уходящая группа» имеет значение, обычно связанное с ней в синтетической органической химии, т.е., представляет собой атом или группу, способные заменяться нуклеофилом, и включает галоген, такой как хлор, бром, фтор и иод, ацилокси (алкоксикарбонил), такой как ацетокси и бензилокси, арилоксикарбонил, мезилокси, тозилокси, трифторметансульфонилокси, арилокси, такой как 2,4-динитрофенокси, метокси, N,O-диметилгидроксиламино, п-нитрофенолят, имидазолил и т.п..
Определение «исходная ароматическая циклическая система» относится к ненасыщенной циклической или полициклической системе с системой конъюгированных π-(пи)-электронов. В определение «исходная ароматическая циклическая система» включены конденсированные циклические системы, в которых один или несколько циклов являются ароматическими и один или несколько циклов являются насыщенными или ненасыщенными, такие как, например, флуорен, индан, инден, фенален и т.д.. Примеры исходных ароматических циклических систем включают, но не ограничиваются перечисленным, ацеантрилен, аценафтилен, ацефенантрилен, антрацен, азулен, бензол, хризен, коронен, флуорантен, флуорен, гексацен, гексафен, гексален, as-индацен, s-индацен, индан, инден, нафталин, октацен, октафен, октален, овален, пента-2,4-диен, пентацен, пентален, пентафен, перилен, фенален, фенантрен, пицен, плейаден, пирен, пирантрен, рубицин, трифенилен, тринафтален и т.п.
Определение «исходная гетероароматическая циклическая система» относится к ароматической циклической системе, в которой один или несколько атомов углерода (и любых ассоциированных атомов водорода) независимо заменены одинаковыми или различными гетероатомами таким образом, что сохраняется непрерывная система π-электронов, характеризующая ароматические системы, и ряд π-электронов вне плоскости, соответствующих правилу Хюккеля (4n+2). Примеры гетероатомов для замены атомов углерода включают, но не ограничиваются перечисленным, N, Р, О, S, Si и т.д.. В определение «исходная гетероароматическая циклическая система» конкретно включены конденсированные циклические системы, в которых один или несколько циклов являются ароматическими и один или несколько циклов являются насыщенными или ненасыщенными, такие как, например, арсиндол, бензодиоксан, бензофуран, хроман, хромен, индол, индолин, ксантен и т.д. Примеры исходных гетероароматических циклических систем включают, но не ограничиваются перечисленным, арсиндол, карбазол, β-карболин, хроман, хромен, циннолин, фуран, имидазол, индазол, индол, индолин, индолизин, изобензофуран, изохромен, изоиндол, изоиндолин, изохинолин, изотиазол, изоксазол, нафтиридин, оксадиазол, оксазол, перимидин, фенантридин, фенантролин, феназин, фталазин, птеридин, пурин, пиран, пиразин, пиразол, пиридазин, пиридин, пиримидин, пиррол, пирролизин, хиназолин, хинолин, хинолизин, хиноксалин, тетразол, тиадиазол, тиазол, тиофен, триазол, ксантен, тиазолидин, оксазолидин и т.п..
Термин «пациент» относится к млекопитающему, например, человеку.
Определение «фармацевтически приемлемый» относится к (материалу), одобренному или достойному одобрения регулирующим государственным органом или правительством или внесенному в фармакопею США или другую одобренную фармакопею для использования для животных, и в частности, для людей.
Определение «фармацевтически приемлемая соль» относится к соли соединения, которая обладает нужной фармакологической активностью исходного соединения. Такие соли включают соли присоединения кислот, образованные с неорганическими кислотами, такими как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.; или образованные с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, виноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2,2,2]окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутамовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и т.п.; и соли, образованные замещением кислотного протона, присутствующего в исходном соединении, ионом металла, например, ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; или координацией с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин и т.п.. В некоторых воплощениях фармацевтически приемлемая соль представляет собой гидрохлорид. В некоторых воплощениях фармацевтически приемлемая соль представляет собой натриевую соль.
Термин «фармацевтически приемлемый носитель» относится к фармацевтически приемлемому разбавителю, фармацевтически приемлемому адъюванту, фармацевтически приемлемому эксципиенту, фармацевтически приемлемому носителю или сочетанию любых из вышеуказанных материалов, с которыми соединение по настоящему изобретению можно вводить пациенту, и которые не разрушают его фармакологическую активность, и которые являются нетоксичными при введении в дозах, достаточных для обеспечения терапевтически эффективного количества соединения.
Термин «фармацевтическая композиция» относится к соединению формул (I)-(IV) и, по меньшей мере, одному фармацевтически приемлемому носителю, с которым соединение формул (I)-(IV) вводят пациенту.
Определение «замещенный» относится к группе, в которой один или несколько атомов водорода независимо заменены одинаковыми или раличными группами-заместителями. В некоторых воплощениях каждую группу-заместитель выбирают независимо из галогена, -ОН, -CN, -CF3, =О, -NO2, бензила, -C(O)NH2, -R11, -OR11, -C(O)R11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и С1-4-алкила. В некоторых воплощениях каждую группу-заместитель выбирают независимо из галогена, -ОН, -CN, -CF3, -NO2, бензила, -R11, -OR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и С1-4-алкила. В некоторых воплощениях каждую группу-заместитель выбирают независимо из галогена, -ОН, -CN, -CF3, =O, -NO2, бензила, -C(O)NR11 2, -R11, -OR11, -C(O)R11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и С1-4-алкила. В некоторых воплощениях каждую группу-заместитель выбирают независимо из -ОН, C1-4-алкила и -NH2.
Термин «лечить» или «лечение» любого заболевания относится к реверсии, облегчению, остановке или уменьшению интенсивности заболевания или, по меньшей мере, одного из клинических симптомов заболевания, уменьшению опасности приобретения заболевания или, по меньшей мере, одного из клинических симптомов заболевания, подавлению развития заболевания или, по меньшей мере, одного из клинических симптомов заболевания, или уменьшению опасности развития заболевания или, по меньшей мере, одного из клинических симптомов заболевания. Термин «лечить» или «лечение» также относится к подавлению заболевания физически (например, стабилизация явного симптома), физиологически (например, стабилизация физического параметра) или обоим вариантам и к подавлению, по меньшей мере, одного физического параметра, который может быть или не быть различимым для пациента. В некоторых воплощениях «лечить» или «лечение» относится к задержке возникновения заболевания или, по меньшей мере, одного или нескольких его симптомов у пациента, на которого может воздействовать или который предрасположен к заболеванию, даже если такой пациент пока не испытывает или не проявляет симптомов заболевания.
Определение «терапевтически эффективное количество» относится к количеству соединения, которое, когда введено субъекту для лечения заболевания или, по меньшей мере, одного из клинических симптомов заболевания, является достаточным для воздействия такого лечения на заболевание или его симптом. «Терапевтически эффективное количество» может изменяться в зависимости от, например, соединения, заболевания и/или симптомов заболевания, тяжести заболевания и/или симптомов заболевания или расстройства, возраста, массы и/или здоровья пациента, которого лечат, и решения лечащего врача. Соответствующее количество в любом данном случае может быть установлено специалистами в данной области техники или может быть определено обычными экспериментами.
Определение «терапевтически эффективная доза» относится к дозе, которая обеспечивает эффективное лечение заболевания или расстройства у пациента. Терапевтически эффективная доза может изменяться от соединения к соединению и от пациента к пациенту и может зависеть от таких факторов, как состояние пациента и способ доставки. Терапевтически эффективную дозу можно определить согласно обычным фармакологическим процедурам, известным специалистам в данной области техники.
Теперь следует обращение к подробностям некоторых воплощений соединений, композиций и способов. Раскрытые воплощения не предназначены для ограничения формулы изобретения. Напротив, предполагается, что формула изобретения охватывает все альтернативы, модификации и эквиваленты.
Соединения
Некоторые воплощения относятся к соединению формулы (I)

или его фармацевтически приемлемой соли, где в указанной формуле
R1 и R2 выбирают независимо из водорода, C1-6-алкила и замещенного C1-6-алкила;
R3 и R4 выбирают независимо из водорода, C1-6-алкила, замещенного C1-6-алкила, C1-6-гетероалкила, замещенного C1-6-гетероалкила, С4-12-циклоалкилалкила, замещенного С4-12-циклоалкилалкила, С7-12-арилалкила и замещенного С7-12-арилалкила; или R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С5-10-гетероарила, замещенного С5-10-гетероарила, С5-10-гетероциклоалкила и замещенного С5-10-гетероциклоалкила; и
R5 выбирают из метила, этила и С3-6-алкила;
где каждую группу-заместитель выбирают независимо из галогена, -ОН, -CN, -CF3, =O, -NO2, бензила, - C(O)NR11 2, -R11, -OR11, -C(O)R11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила;
при условии, что когда R5 представляет собой этил, тогда R3 и R4 выбирают из водорода, C1-6-алкила и замещенного C1-6-алкила.
В некоторых воплощениях соединения формулы (I) каждую группу-заместитель выбирают независимо из галогена, -ОН, -CN, -CF3, - R11, - OR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила. В некоторых воплощениях каждую группу-заместитель выбирают независимо из -ОН и -СООН.
В некоторых воплощениях соединения формулы (I) каждую группу-заместитель выбирают независимо из =O, C1-4-алкила и -COOR11, где каждый R11 выбирают из водорода и C1-4-алкила.
В некоторых воплощениях соединения формулы (I) каждый из R1 и R2 представляет собой водород.
В некоторых воплощениях соединения формулы (I) один из R1 и R2 представляет собой водород, и другой из R1 и R2 представляет собой С1-4-алкил.
В некоторых воплощениях соединения формулы (I) один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила.
В некоторых воплощениях соединения формулы (I) один из R1 и R2 представляет собой водород, и другой из R1 и R2 представляет собой метил.
В некоторых воплощениях соединения формулы (I) R3 и R4 выбирают независимо из водорода и C1-6-алкила.
В некоторых воплощениях соединения формулы (I) R3 и R4 выбирают независимо из водорода и C1-4-алкила.
В некоторых воплощениях соединения формулы (I) R3 и R выбирают независимо из водорода, метила и этила.
В некоторых воплощениях соединения формулы (I) каждый из R3 и R4 представляет собой водород; в некоторых воплощениях каждый из R3 и R4 представляет собой метил; и в некоторых воплощениях каждый из R3 и R4 представляет собой этил.
В некоторых воплощениях соединения формулы (I) R3 представляет собой водород, и R4 выбирают из C1-4-алкила, замещенного C1-4-алкила, где группу-заместитель выбирают из =O, -OR11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила.
В некоторых воплощениях соединения формулы (I) R3 представляет собой водород, и R4 выбирают из С1-4-алкила, бензила, 2-метоксиэтила, карбоксиметила, карбоксипропила, 1,2,4-тиадоксолила, метокси, 2-метоксикарбонила, 2-оксо(1,3-оксазолидинила), 2-(метилэтокси)этила, 2-этоксиэтила, (трет-бутоксикарбонил)метила, (этоксикарбонил)метила, карбоксиметила, (метилэтил)оксикарбонилметила и этоксикарбонилметила.
В некоторых воплощениях соединения формулы (I) R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С5-6-гетероциклоалкила, замещенного С5-6-гетероциклоалкила, С5-6-гетероарила и замещенного С5-6-гетероарила. В некоторых воплощениях соединения формулы (I) R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С5-гетероциклоалкила, замещенного С5-гетероциклоалкила, С5-гетероарила и замещенного С5-гетероарила. В некоторых воплощениях соединения формулы (I) R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С6-гетероциклоалкила, замещенного С6-гетероциклоалкила, С6-гетероарила и замещенного С6-гетероарила. В некоторых воплощениях соединения формулы (I) R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из пиперазинового, 1,3-оксазолидинильного, пирролидинового и морфолинового цикла.
В некоторых воплощениях соединения формулы (I) R3 и R4 вместе с атомом азота, с которым они связаны, образуют С5-10-гетероциклоалкил.
В некоторых воплощениях соединения формулы (I) R5 представляет собой метил.
В некоторых воплощениях соединения формулы (I) R5 представляет собой этил.
В некоторых воплощениях соединения формулы (I) R5 представляет собой С3-6-алкил.
В некоторых воплощениях соединения формулы (I) R5 выбирают из метила, н-пропила, изопропила, н-бутила, втор-бутила, изобутила и трет-бутила.
В некоторых воплощениях соединения формулы (I) R5 выбирают из метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, изобутила и трет-бутила.
В некоторых воплощениях соединения формулы (I) один из R1 и R2 представляет собой водород, и другой из R1 и R2 представляет собой C1-6-алкил; R3 представляет собой водород; R4 выбирают из водорода, C1-6-алкила и бензила.
В некоторых воплощениях соединения формулы (I) один из R1 и R2 представляет собой водород, и другой из R1 и R2 представляет собой C1-6-алкил; R3 представляет собой водород; R4 выбирают из водорода, C1-6-алкила и бензила; и R5 представляет собой метил.
В некоторых воплощениях соединения формулы (I) один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из водорода и C1-6-алкила; и каждый из R3 и R4 представляет собой C1-6-алкил.
В некоторых воплощениях соединения формулы (I) один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из водорода и C1-6-алкила; каждый из R3 и R4 представляет собой C1-6-алкил; и R5 представляет собой метил. В некоторых воплощениях соединения формулы (I) каждый из R1 и R2 представляет собой водород; каждый из R3 и R4 представляет собой C1-6-алкил; и R5 представляет собой метил.
В некоторых воплощениях соединения формулы (I) один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из водорода и С1-4-алкила; R3 представляет собой водород; R4 выбирают из C1-4-алкила, замещенного С1-4-алкила, где группу-заместитель выбирают из =O, -OR11, - COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и С1-4-алкила; и R5 представляет собой метил. В некоторых воплощениях соединения формулы (I) один из R1 и R2 представляет собой водород, и другой из R1 и R2 представляет собой метил; R3 представляет собой водород; R4 выбирают из C1-4-алкила, замещенного C1-4-алкила, где группу-заместитель выбирают из =O, - OR11, - COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила; и R5 представляет собой метил. В некоторых воплощениях соединения формулы (I) каждый из R1 и R2 представляет собой водород; R3 представляет собой водород; R4 выбирают из C1-4-алкила, замещенного C1-4-алкила, где группу-заместитель выбирают из =O, - OR11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила; и R5 представляет собой метил.
В некоторых воплощениях соединения формулы (I) R3 и R4 вместе с атомом азота, с которым они связаны, образуют С5-10-гетероциклоалкил.
В некоторых воплощениях соединения формулы (I) один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из водорода и C1-6-алкила; R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С5-6-гетероциклоалкила, замещенного С5-6-гетероциклоалкила, С5-6-гетероарила и замещенного С5-6-гетероарила; и R5 представляет собой метил. В некоторых воплощениях соединения формулы (I) один из R1 и R2 представляет собой водород, и другой из R1 и R2 представляет собой метил; R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С5-6-гетероциклоалкила, замещенного С5-6-гетероциклоалкила, С5-6-гетероарила и замещенного С5-6-гетероарила; и R5 представляет собой метил. В некоторых воплощениях соединения формулы (I) каждый из R1 и R2 представляет собой водород; R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С5-6-гетероциклоалкила, замещенного С5-6-гетероциклоалкила, С5-6-гетероарила и замещенного С5-6-гетероарила; и R5 представляет собой метил.
В некоторых воплощениях соединения формулы (I) один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из водорода и C1-6-алкила; и R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из морфолина, пиперазина и N-замещенного пиперазина.
В некоторых воплощениях соединения формулы (I) один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из водорода и C1-6-алкила; и R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из морфолина, пиперазина и N-замещенного пиперазина; и R5 представляет собой метил.
В некоторых воплощениях соединения формулы (I) R5 не представляет собой метил.
В некоторых воплощениях соединения формулы (I) R1 представляет собой водород, и в некоторых воплощениях R2 представляет собой водород.
В некоторых воплощениях соединения формулы (I) соединение выбирают из группы, в которую входят
(N,N-диэтилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат;
метил-[N-бензилкарбамоил]метил(2Е)бут-2-ен-1,4-диоат;
метил-2-морфолин-4-ил-2-оксоэтил(2Е)бут-2-ен-1,4-диоат;
(N-бутилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат;
[N-(2-метоксиэтил)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат;
2-{2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]ацетиламино}уксусная кислота;
4-{2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]ацетиламино}бутановая кислота;
метил-(N-(1,3,4-тиадиазол-2-ил)карбамоил)метил(2Е)бут-2-ен-1,4-диоат;
(N,N-диметилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат;
(N-метокси-N-метилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат;
бис[(2-метоксиэтиламино)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат;
[N-(метоксикарбонил)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат;
4-{2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]ацетиламино}бутановой кислоты, натриевая соль;
метил-2-оксо-2-пиперазинилэтил(2Е)бут-2-ен-1,4-диоат;
метил-2-оксо-2-(2-оксо-1,3-оксазолидин-3-ил)этил(2Е)бут-2-ен-1,4-диоат;
{N-[2-(диметиламино)этил]карбамоил}метил-метил(2Е)бут-2-ен-1,4-диоат;
метил-2-(4-метилпиперазинил)-2-оксоэтил(2Е) бут-2-ен-1,4-диоат;
метил-{N-[(пропиламино)карбонил]карбамоил}метил(2Е)бут-2-ен-1,4-диоат;
2-(4-ацетилпиперазинил)-2-оксоэтил-метил(2Е)бут-2-ен-1,4-диоат;
{N,N-бис[2-(метилэтокси)этил]карбамоил}метил-метил(2Е)бут-2-ен-1,4-диоат;
метил-2-(4-бензилпиперазинил)-2-оксоэтил(2Е)бут-2-ен-1,4-диоат;
[N,N-бис(2-этоксиэтил) карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат;
2-{(2S)-2-[(трет-бутил)оксикарбонил]пирролидинил}-2-оксоэтил-метил(2Е)бут-2-ен-1,4-диоат;
1-{2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]ацетил}-(2S)-пирролидин-2-карбоновая кислота;
(N-{[(трет-бутил)оксикарбонил]метил}-N-метилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат;
{N-[(этоксикарбонил)метил]-N-метилкарбамоил}метил-метил(2Е)бут-2-ен-1,4-диоат;
метил-1-метил-2-морфолин-4-ил-2-оксоэтил(2Е)бут-2-ен-1,4-диоат;
(N,N-бис(2-метоксиэтил)карбамоил]этил-метил(2Е)бут-2-ен-1,4-диоат;
(N,N-диметилкарбамоил)этил-метил(2Е)бут-2-ен-1,4-диоат;
2-{2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]-N-метилацетиламино}уксусная кислота;
(N-{[(трет-бутил)оксикарбонил]метил}карбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат;
метил-(N-метил-N-{[(метилэтил)оксикарбонил]метил}карбамоил)метил(2Е)бут-2-ен-1,4-диоат;
{N-[(этоксикарбонил)метил]-N-бензилкарбамоил}метил-метил(2Е)бут-2-ен-1,4-диоат;
{N-[(этоксикарбонил)метил]-N-бензилкарбамоил}этил-метил(2Е)бут-2-ен-1,4-диоат;
{N-[(этоксикарбонил)метил]-N-метилкарбамоил}этил-метил(2Е)бут-2-ен-1,4-диоат;
(1S)-1-метил-2-морфолин-4-ил-2-оксоэтил-метил(2Е)бут-2-ен-1,4-диоат;
(1S)-1-[N,N-бис(2-метоксиэтил)карбамоил]этил-метил(2Е)бут-2-ен-1,4-диоат;
(1R)-1-(N,N-диэтилкарбамоил)этил-метил(2Е)бут-2-ен-1,4-диоат и фармацевтически приемлемая соль любого из вышеуказанных соединений.
В некоторых воплощениях соединения формулы (I) соединение выбирают из группы, в которую входят
(N,N-диэтилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат;
метил-[N-бензилкарбамоил]метил(2Е)бут-2-ен-1,4-диоат;
метил-2-морфолин-4-ил-2-оксоэтил(2Е)бут-2-ен-1,4-диоат;
(N-бутилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат;
[N-[-(2-метоксиэтил)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат;
2-{2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]ацетиламино}уксусная кислота;
ХР24-{2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]ацетиламино}бутановая кислота;
метил-(N-(1,3,4-тиадиазол-2-ил)карбамоил)метил(2Е)бут-2-ен-1,4-диоат;
(N,N-диметилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат;
(N-метокси-N-метилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат;
бис(2-метоксиэтиламино)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат;
[N-(метоксикарбонил)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат;
метил-2-оксо-2-пиперазинилэтил(2Е)бут-2-ен-1,4-диоат;
метил-2-оксо-2-(2-оксо-1,3-оксазолидин-3-ил)этил(2Е)бут-2-ен-1,4-диоат;
{N-[2-(диметиламино)этил]карбамоил}метил-метил(2Е)бут-2-ен-1,4-диоат;
{N-[(метоксикарбонил)этил]карбамоил}метил-метил(2Е)бут-2-ен-1,4-диоат;
2-{2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]ацетиламино}пропановая кислота и
фармацевтически приемлемая соль любого из вышеуказанных соединений. В некоторых воплощениях соединения формулы (I) R3 и R4 выбирают независимо из водорода, C1-6-алкила, замещенного C1-6-алкила, С6-10-арила, замещенного С6-10-арила, С4-12-циклоалкилалкила, замещенного С4-12-циклоалкилалкила, С7-12-арилалкила, замещенного С7-12-арилалкила, C1-6-гетероалкила, замещенного C1-6-гетероалкила, С6-10-гетероарила, замещенного С6-10-гетероарила, С4-12-гетероциклоалкилалкила, замещенного С4-12-гетероциклоалкилалкила, С7-12-гетероарилалкила, замещенного C7-12-гетероарилалкила; или R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С5-10-гетероарила, замещенного С5-10-гетероарила, С5-10-гетероциклоалкила и замещенного С5-10-гетероциклоалкила.
Некоторые воплощения относятся к соединению формулы (II)

(II) или его фармацевтически приемлемой соли, где в указанной формуле
R6 выбирают из C1-6-алкила, замещенного C1-6-алкила, C1-6-гетероалкила, замещенного C1-6-гетероалкила, С3-8-циклоалкила, замещенного С3-8-циклоалкила, С6-8-арила, замещенного С6-8-арила и -OR10, где R10 выбирают из C1-6-алкила, замещенного C1-6-алкила, С3-10-циклоалкила, замещенного С3-10-циклоалкила, С6-10-арила и замещенного С6-10-арила;
R7 и R8 выбирают независимо из водорода, C1-6-алкила и замещенного C1-6-алкила;
и
R9 выбирают из C1-6-алкила и замещенного C1-6-алкила;
где каждую группу-заместитель выбирают независимо из галогена, -ОН, -CN, -CF3, =O, -NO2, бензила, -C(O)NR11 2, -R11, -OR11, -C(O)R11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила.
В некоторых воплощениях соединения формулы (II) каждую группу-заместитель выбирают независимо из галогена, -ОН, -CN, -CF3, -R11, -OR11 и -NR11 2, где каждый R11 выбирают независимо из водорода, C1-4-алкила.
В некоторых воплощениях соединения формулы (II) каждую группу-заместитель выбирают независимо из =O, C1-4-алкила и -COOR11, где R11 выбирают из водорода и С1-4-алкила.
В некоторых воплощениях соединения формулы (II) один из R7 и R8 представляет собой водород, и другой из R7 и R8 представляет собой C1-6-алкил. В некоторых и воплощениях соединения формулы (II) один из R7 и R8 представляет собой водород, и другой из R7 и R8 представляет собой C1-4-алкил.
В некоторых воплощениях соединения формулы (II) один из R7 и R8 представляет собой водород, и другой из R7 и R8 выбирают из метила, этила, н-пропила и изопропила. В некоторых воплощениях соединения формулы (II) каждый из R7 и R8 представляет собой водород.
В некоторых воплощениях соединения формулы (II) R9 выбирают из замещенного C1-6-алкила и -OR11, где R11 представляет собой независимо C1-4-алкил.
В некоторых воплощениях соединения формулы (II) R9 представляет собой C1-6-алкил, в некоторых воплощениях R9 представляет собой C1-3-алкил; и в некоторых воплощениях R9 выбирают из метила и этила.
В некоторых воплощениях соединения формулы (II) R9 представляет собой метил.
В некоторых воплощениях соединения формулы (II) R9 выбирают из этила, н-пропила, изопропила, н-бутила, втор-бутила, изобутила и трет-бутила.
В некоторых воплощениях соединения формулы (II) R выбирают из метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, изобутила и трет-бутила.
В некоторых воплощениях соединения формулы (II) R6 представляет собой C1-6-алкил; один из R7 и R8 представляет собой водород, и другой из R7 и R8 представляет собой C1-6-алкил; и R9 выбирают из C1-6-алкила и замещенного C1-6-алкила.
В некоторых воплощениях соединения формулы (II) R6 представляет собой -OR10.
В некоторых воплощениях соединения формулы (II) R10 выбирают из C1-4-алкила, циклогексила и фенила.
В некоторых воплощениях соединения формулы (II) R6 выбирают из метила, этила, н-пропила и изопропила; один из R7 и R8 представляет собой водород, и другой из R7 и R8 выбирают из метила, этила, н-пропила и изопропила.
В некоторых воплощениях соединения формулы (II) R6 представляет собой замещенный C1-2-алкил, где каждую из одной или нескольких групп-заместителей выбирают из -COOH, -NHC(O)CH2NH2 и -NH2.
В некоторых воплощениях соединения формулы (II) R6 выбирают из этокси, метилэтокси, изопропила, фенила, циклогексила, циклогексилокси, -CH(NH2)CH2COOH, -CH2CH(NH2)COOH, -CH(NHC(O)CH2NH2)-CH2COOH и -CH2CH(NHC(O)CH2NH2)-COOH.
В некоторых воплощениях соединения формулы (II) R9 выбирают из метила и этила; один из R7 и R8 представляет собой водород, и другой из R7 и R8 выбирают из водорода, метила, этила, н-пропила и изопропила; и R6 выбирают из C1-3-алкила, замещенного C1-2-алкила, где каждую из одной или нескольких групп-заместителей выбирают из -COOH, -NHC(O)CH2NH2 и -NH2, -OR10, где R10 выбирают из C1-3-алкила и циклогексила и фенила.
В некоторых воплощениях соединения формулы (II) соединение выбирают из группы, в которую входят
этоксикарбонилоксиэтил-метил(2E)бут-2-ен-1,4-диоат;
метил-(метилэтоксикарбонилокси)этил(2E)бут-2-ен-1,4-диоат;
(циклогексилоксикарбонилокси)этил-метил(2E)бут-2-ен-1,4-диоат и
фармацевтически приемлемая соль любого из вышеуказанных соединений.
В некоторых воплощениях соединения формулы (II) соединение выбирают из группы, в которую входят
метил-(2-метилпропаноилокси)этил(2E)бут-2-ен-1,4-диоат;
метил-фенилкарбонилоксиэтил(2E)бут-2-ен-1,4-диоат;
циклогексилкарбонилоксибутил-метил(2E)бут-2-ен-1,4-диоат;
[(2E)-3-(метоксикарбонил)проп-2-еноилокси]этил-метил(2E)бут-2-ен-1,4-диоат;
метил-2-метил-1-фенилкарбонилоксипропил(2E)бут-2-ен-1,4-диоат и
фармацевтически приемлемая соль любого из вышеуказанных соединений.
В некоторых воплощениях соединения формулы (II) соединение выбирают из группы, в которую входят
этоксикарбонилоксиэтил-метил(2E)бут-2-ен-1,4-диоат;
метил-(метилэтоксикарбонилокси)этил(2E)бут-2-ен-1,4-диоат;
метил-(2-метилпропаноилокси)этил(2E)бут-2-ен-1,4-диоат;
метил-фенилкарбонилоксиэтил(2E)бут-2-ен-1,4-диоат и
циклогексилкарбонилоксибутил-метил(2E)бут-2-ен-1,4-диоат;
[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]этил-метил(2Е)бут-2-ен-1,4-диоат;
(циклогексилоксикарбонилокси)этил-метил(2Е)бут-2-ен-1,4-диоат;
метил-2-метил-1-фенилкарбонилоксипропил(2Е)бут-2-ен-1,4-диоат;
3-({[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]метил}оксикарбонил)(3S)-3-аминопропановой кислоты, 2,2,2-трифторацетат;
3-({[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]метил}оксикарбонил)(2S)-2-аминопропановой кислоты, 2,2,2-трифторацетат;
3-({[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]метил}оксикарбонил)(3S)-3-(2-аминоацетиламино)пропановой кислоты, 2,2,2-трифторацетат;
3-{[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]этоксикарбонилокси}(2S)-2-аминопропановой кислоты, хлорид; и
фармацевтически приемлемая соль любого из вышеуказанных соединений.
Соединения, представленные в раскрытии настоящего изобретения, включают соединения формулы (III) и формулы (IV). Соединения формулы (III) и формулы (IV) можно получить при метаболизме in vivo соединений формулы (I) и формулы (II), соответственно; или их можно ввести пациенту.
Соответственно, некоторые воплощения относятся к соединению формулы (III)

или его фармацевтически приемлемой соли, где в указанной формуле
R1 и R2 выбирают независимо из водорода, C1-6-алкила и замещенного C1-6-алкила; и
R3 и R4 выбирают независимо из водорода, C1-6-алкила, замещенного C1-6-алкила, C1-6-гетероалкила, замещенного C1-6-гетероалкила, С4-12-циклоалкилалкила, замещенного С4-12-циклоалкилалкила, С7-12-арилалкила и замещенного С7-12-арилалкила; или R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С5-10-гетероарила, замещенного С5-10-гетероарила, С5-10-гетероциклоалкила и замещенного С5-10-гетероциклоалкила;
где каждую группу-заместитель выбирают независимо из галогена, -ОН, -CN, -CF3, =O, -NO2, бензила, -C(O)NR11 2, -R11, -OR11, -C(O)R11, -COOR11 и -NR11 2, где каждый R" выбирают независимо из водорода и C1-4-алкила.
В некоторых воплощениях соединения формулы (III) каждую группу-заместитель выбирают независимо из галогена, -ОН, -CN, -CF3, -R11, -OR11, -C(O)R11 и NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила.
В некоторых воплощениях соединения формулы (III) каждую группу-заместитель выбирают независимо из =O, C1-4-алкила и -COOR11, где каждый R11 выбирают из водорода и C1-4-алкила.
В некоторых воплощениях соединения формулы (III) каждый из R1 и R2 представляет собой водород.
В некоторых воплощениях соединения формулы (III) один из R1 и R2 представляет собой водород, и другой из R1 и R представляет собой С1-4-алкил.
В некоторых воплощениях соединения формулы (III) один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила.
В некоторых воплощениях соединения формулы (III) один из R1 и R2 представляет собой водород, и другой из R1 и R2 представляет собой метил.
В некоторых воплощениях соединения формулы (III) R3 и R4 выбирают независимо из водорода и C1-6-алкила.
В некоторых воплощениях соединения формулы (III) R3 и R4 выбирают независимо из водорода и C1-4-алкила.
В некоторых воплощениях соединения формулы (III) R3 и R4 выбирают независимо из водорода, метила и этила.
В некоторых воплощениях соединения формулы (III) каждый из R3 и R4 представляет собой водород; в некоторых воплощениях соединения формулы (III) каждый из R3 и R4 представляет собой метил; и в некоторых воплощениях соединения формулы (III) каждый из R3 и R4 представляет собой этил.
В некоторых воплощениях соединения формулы (III) R3 представляет собой водород; и R4 выбирают из C1-4-алкила, замещенного C1-4-алкила, где группу-заместитель выбирают из =O, -OR11, -COOR11 и NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила.
В некоторых воплощениях соединения формулы (III) R3 представляет собой водород; и R4 выбирают из C1-4-алкила, бензила, 2-метоксиэтила, карбоксиметила, карбоксипропила, 1,2,4-тиадоксолила, метокси, 2-метоксикарбонила, 2-оксо(1,3-оксазолидинила), 2-(метилэтокси)этила, 2-этоксиэтила, (трет-бутилоксикарбонил)метила, (этоксикарбонил)метила, карбоксиметила, (метилэтил)оксикарбонилметила и этоксикарбонилметила.
В некоторых воплощениях соединения формулы (III) R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С5-6-гетероциклоалкила, замещенного С5-6-гетероциклоалкила, С5-6-гетероарила и замещенного С5-6-гетероарила. В некоторых воплощениях соединения формулы (III) R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С5-гетероциклоалкила, замещенного С5-гетероциклоалкила, С5-гетероарила и замещенного С5-гетероарила. В некоторых воплощениях соединения формулы (III) R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С6-гетероциклоалкила, замещенного С6-гетероциклоалкила, С6-гетероарила и замещенного С6-гетероарила. В некоторых воплощениях соединения формулы (III) R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из пиперазинового, 1,3-оксазолидинильного, пирролидинового и морфолинового цикла.
В некоторых воплощениях соединения формулы (III) R3 и R4 вместе с атомом азота, с которым они связаны, образуют С5-10-гетероциклоалкил.
В некоторых воплощениях соединения формулы (III) один из R1 и R2 представляет собой водород, и другой из R1 и R2 представляет собой C1-6-алкил; R3 представляет собой водород; R4 выбирают из водорода, C1-6-алкила и бензила.
В некоторых воплощениях соединения формулы (III) один из R1 и R2 представляет собой водород, и другой из R41 и R2 представляет собой C1-6-алкил; и каждый из R3 и R4 представляет собой C1-6-алкил. В некоторых воплощениях соединения формулы (III) каждый из R1 и R2 представляет собой водород; и каждый из R3 и R4 представляет собой C1-6-алкил. В некоторых воплощениях соединения формулы (III) один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из водорода и C1-4-алкила; R3 представляет собой водород; и R4 выбирают из C1-4-алкила, замещенного C1-4-алкила, где группу-заместитель выбирают из =O, -OR11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила. В некоторых воплощениях соединения формулы (III) один из R1 и R2 представляет собой водород, и другой из R1 и R2 представляет собой метил; R3 представляет собой водород; и R4 выбирают из C1-4-алкила, замещенного C1-4-алкила, где группу-заместитель выбирают из =O, - OR11, - COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила. В некоторых воплощениях соединения формулы (III) каждый из R1 и R2 представляет собой водород; R3 представляет собой водород; и R4 выбирают из C1-4-алкила, замещенного C1-4-алкила, где группу-заместитель выбирают из =O, -OR11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила.
В некоторых воплощениях соединения формулы (III) R3 и R4 вместе с атомом азота, с которым они связаны, образуют С5-10-гетероциклоалкил.
В некоторых воплощениях соединения формулы (III) один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из водорода и C1-6-алкила; и R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С5-6-гетероциклоалкила, замещенного С5-6-гетероциклоалкила, С5-6-гетероарила и замещенного С5-6-гетероарила. В некоторых воплощениях соединения формулы (III) один из R1 и R2 представляет собой водород, и другой из R1 и R2 представляет собой метил; и R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С5-6-гетероциклоалкила, замещенного С5-6-гетероциклоалкила, С5-6-гетероарила и замещенного С5-6-гетероарила. В некоторых воплощениях соединения формулы (III) каждый из R1 и R2 представляет собой водород; и R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С5-6-гетероциклоалкила, замещенного С5-6-гетероциклоалкила, С5-6-гетероарила и замещенного С5-6-гетероарила.
В некоторых воплощениях соединения формулы (III) один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из водорода и C1-6-алкила; и R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из морфолина, пиперазина и N-замещенного пиперазина.
В некоторых воплощениях соединения формулы (III) R3 и R4 выбирают независимо из водорода, C1-6-алкила, замещенного C1-6-алкила, С6-10-арила, замещенного С6-10-арила, С4-12-циклоалкилалкила, замещенного С4-12-циклоалкилалкила, С7-12-арилалкила, замещенного С7-12-арилалкила, C1-6-гетероалкила, замещенного C1-6-гетероалкила, С6-10-гетероарила, замещенного С6-10-гетероарила, С4-12-гетероциклоалкилалкила, замещенного С4-12-гетероциклоалкилалкила, С7-12-гетероарилалкила, замещенного C7-12-гетероарилалкила; или R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из С5-10-гетероарила, замещенного С5-10-гетероарила, С5-10-гетероциклоалкила и замещенного С5-10-гетероциклоалкила.
В некоторых воплощениях соединения формулы (III) R1 представляет собой водород, и в некоторых воплощениях R2 представляет собой водород.
В некоторых воплощениях соединения формулы (III) соединение выбирают из группы, в которую входят
(2Е)-3-[(2-морфолин-4-ил-2-оксоэтил)оксикарбонил]проп-2-еновая кислота;
(2Е)-3-{[(N,N-диэтилкарбамоил)метил]оксикарбонил}проп-2-еновая кислота;
(2Е)-3-({[N-бензилкарбамоил]метил}оксикарбонил)проп-2-еновая кислота;
(2Е)-3-{[(N-бутилкарбамоил)метил]оксикарбонил}проп-2-еновая кислота;
(2Е)-3-{[(N-метокси-N-метилкарбамоил)метил]оксикарбонил}проп-2-еновая кислота;
бис[(2-метоксиэтиламино)карбамоил]метилпроп-2-еновая кислота;
(N,N-диметилкарбамоил)метилпроп-2-еновая кислота;
(2Е)-3-({[N-(3-карбоксипропил)карбамоил]метил} оксикарбонил)проп-2-еновая кислота;
метил(N-(1,3,4-тиадиазол-2-ил)карбкамоил)метилпроп-2-еновая кислота;
(2Е)-3-[(2-{(2S)-2-[(трет-бутил)оксикарбонил]пирролидинил}-2-оксоэтил)оксикарбонил]проп-2-еновая кислота;
1-[2-((2Е)-3-карбоксипроп-2-еноилкси)ацетил]-(2S)-пирролидин-2-карбоновая кислота;
(2Е)-3-[({N-[(этоксикарбонил)метил]-N-метилкарбамоил}метил)оксикарбонил]проп-2-еновая кислота;
(2Е)-3-{[(N-{[(трет-бутил)оксикарбонил]метил}-N-метилкарбамоил)метил]оксикарбонил}проп-2-еновая кислота;
(2Е)-3-[(1-метил-2-морфолин-4-ил-2-оксоэтил)оксикарбонил]проп-2-еновая кислота;
(2Е)-3-({[N,N-бис(2-метоксиэтил)карбамоил]этил}оксикарбонил)проп-2-еновая кислота;
(2Е)-3-{[(N,N-диметилкарбамоил)этил]оксикарбонил}проп-2-еновая кислота;
(2Е)-3-[({N,N-бис[(2-метилэтокси)этил]карбамоил}метил)оксикарбонил]проп-2-еновая кислота;
(2Е)-3-({[N,N-бис(2-этоксиэтил)карбамоил]метил}оксикарбонил)проп-2-еновая кислота;
(2Е)-3-{[2-(4-ацетилпиперазинил)-2-оксоэтил]оксикарбонил}проп-2-еновая кислота;
(2Е)-3-({2-оксо-2-[4-бензилпиперазинил]этил}оксикарбонил)проп-2-еновая кислота;
(2E)-3-{[(N-{[(трет-бутил)оксикарбонил]метил}карбамоил)метил]оксикарбонил}проп-2-еновая кислота;
(2Е)-3-{[(N-метил-N-{[(метилэтил)оксикарбонил]метил}карбамоил)метил]оксикарбонил}проп-2-еновая кислота;
(2Е)-3-[({N-[(этоксикарбонил)метил]-N-бензилкарбамоил}метил)оксикарбонил]проп-2-еновая кислота;
(2Е)-3-[({N-[(этоксикарбонил)метил]-N-бензилкарбамоил} этил)оксикарбонил]проп-2-еновая кислота;
(2Е)-3-[({N-[(этоксикарбонил)метил]-N-метилкарбамоил}этил)оксикарбонил]проп-2-еновая кислота и
фармацевтически приемлемая соль любого из вышеуказанных соединений.
Некоторые воплощения относятся к соединению формулы (IV)

или его фармацевтически приемлемой соли, где в указанной формуле
R6 выбирают из C1-6-алкила, замещенного C1-6-алкила, C1-6-гетероалкила, замещенного C1-6-гетероалкила, С3-8-циклоалкила, замещенного С3-8-циклоалкила, С6-8-арила, замещенного С6-8-арила и -OR10, где R10 выбирают из C1-6-алкила, замещенного C1-6-алкила, С3-10-циклоалкила, замещенного С3-10-циклоалкила, С6-10-арила и замещенного С6-10-арила; и
R7 и R8 выбирают независимо из водорода, C1-6-алкила и замещенного C1-6-алкила; где каждую группу-заместитель выбирают независимо из галогена, -ОН, -CN, -CF3, -О, -NO2, бензила, -C(O)NR11 2, -R11, -OR11, -C(O)R11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила;
при условии, что
когда один из R7 и R8 выбран из этила и метила, а другой из R7 и R8 представляет собой водород, тогда R6 не является -С(СН3)=СН2; и
когда каждый из R7 и R8 представляет собой водород, тогда R6 не выбирают из -СН=СН2 и 4-карбоксифенила.
В некоторых воплощениях соединения формулы (IV) каждую группу-заместитель выбирают независимо из галогена, -ОН, -CN, -CF3, -R11, -OR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила.
В некоторых воплощениях соединения формулы (IV) каждую группу-заместитель выбирают независимо из =O, C1-4-алкила и -COOR11, где R11 выбирают из водорода и C1-4-алкила.
В некоторых воплощениях соединения формулы (IV) один из R7 и R8 представляет собой водород, и другой из R7 и R8 представляет собой C1-6-алкил. В некоторых воплощениях соединения формулы (IV) один из R7 и R8 представляет собой водород, и другой из R7 и R8 представляет собой С1-4-алкил.
В некоторых воплощениях соединения формулы (IV) один из R7 и R8 представляет собой водород, и другой из R7 и R8 выбирают из метила, этила, н-пропила и изопропила. В некоторых воплощениях соединения формулы (IV) каждый из R7 и R8 представляет собой водород.
В некоторых воплощениях соединения формулы (IV) R6 представляет собой C1-6-алкил; и один из R7 и R8 представляет собой водород, и другой из R7 и R8 представляет собой C1-6-алкил.
В некоторых воплощениях соединения формулы (IV) R6 представляет собой -OR10.
В некоторых воплощениях соединения формулы (IV) R10 выбирают из C1-4-алкила, циклогексила и фенила.
В некоторых воплощениях соединения формулы (IV) R6 выбирают из метила, этила, н-пропила и изопропила; один из R7 и R8 представляет собой водород, и другой из R7 и R8 выбирают из метила, этила, н-пропила и изопропила.
В некоторых воплощениях соединения формулы (IV) R6 представляет собой замещенный C1-2-алкил, где каждую из одной или нескольких групп-заместителей выбирают из -СООН, -NHC(O)CH2NH2 и -NH2.
В некоторых воплощениях соединения формулы (IV) R6 выбирают из этокси, метилэтокси, изопропила, фенила, циклогексила, циклогексилокси, -CH(NH2)CH2COOH, -CH2CH(NH2)COOH, -CH(NHC(O)CH2NH2)-CH2COOH и -CH2CH(NHC(O)CH2NH2)-СООН.
В некоторых воплощениях соединения формулы (IV) один из R7 и R8 представляет собой водород, и другой из R7 и R8 выбирают из водорода, метила, этила, н-пропила и изопропила; и R6 выбирают из C1-3-алкила, замещенного C1-2-алкила, где каждую из одной или нескольких групп-заместителей выбирают из -СООН, -NHC(O)CH2NH2 и -NH2, -OR10, где R10 выбирают из C1-3-алкила и циклогексила и фенила.
В некоторых воплощениях соединения формулы (IV) соединение выбирают из группы, в которую входят
(2Е)-3-{[(2-метилпропаноилокси)этил]оксикарбонил}проп-2-еновая кислота;
(2Е)-3-({[(метилэтил)оксикарбонилокси]этил}оксикарбонил)проп-2-еновая кислота;
2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]уксусная кислота и фармацевтически приемлемая соль любого из вышеуказанных соединений.
Синтез
Соединения, раскрытые в данном описании, можно получить синтетическими методами, показанными на схемах 1-9. Общие методы синтеза, применимые при синтезе соединений, описанных в данном описании, имеются в технике. Исходные вещества, применимые при получении соединений и промежуточных соединений для них и/или способов осуществления, описанных в данном описании, коммерчески доступны или могут быть получены хорошо известными методами синтеза. Способы, представленные на схемах, являются пояснительными, а не исчерпывающими. Для специалистов в данной области техники должно быть очевидно, что на практике можно осуществить множество модификаций как материалов, так и способов без отхода от объема раскрытия.
Некоторые незамещенные, 1-монозамещенные или 1,1-бисзамещенные галогенацетамиды, применимые для получения соединений формулы (I), доступны из коммерческих источников. Коммерчески недоступные незамещенные, 1-монозамещенные или 1,1-бисзамещенные галогенацетамиды, применимые для получения соединений формулы (I), и промежуточные соединения для них можно получить хорошо известными методами синтеза, такими, какие описаны на схемах 1 и 2.
Содержащие функциональные группы 1-галогенацетамиды, применимые для получения пролекарств ацетамидов МНР формулы (I), можно получить согласно схеме 1
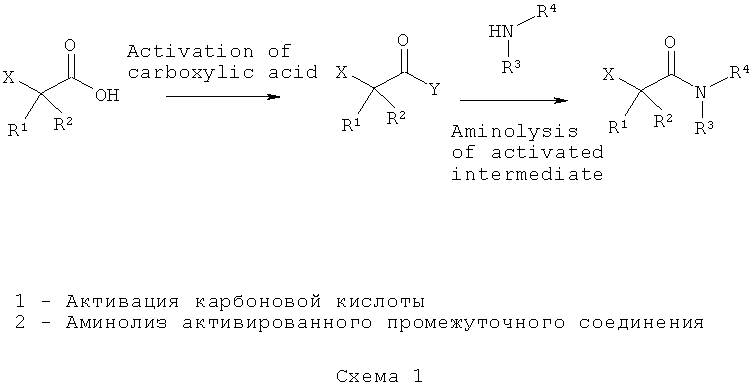
на которой Х и Y представляют собой уходящие группы, такие как галоген, и R1, R2, R3 и R4 имеют значения, указанные в данном описании. В некоторых воплощениях схемы 1 Х представляет собой хлор, и Y представляет собой хлор или O-ацилизомочевину.
Химическая активация карбоновой кислоты до соответствующего хлорангидрида карбоновой кислоты, как показано на схеме 1, может быть достигнута взаимодействием с агентами хлорирования, такими как тионилхлорид (SOCl2), оксалилхлорид (C2O2Cl2) или пентахлорид фосфора (PCl5), необязательно в присутствии подходящего катализатора, такого как N,N-диметилформамид (ДМФА), и или в веществе (отсутствие растворителя) или в инертном органическом растворителе, таком как дихлорметан (DCM), при соответствующей температуре, такой как от примерно 0°С до примерно 70°С. Химическую активацию карбоновой кислоты можно осуществить in situ и без выделения активированного субстрата перед последующей стадией аминолиза. Необязательно активированную карбоновую кислоту можно выделить и/или очистить с использованием способов, хорошо известных в технике, например, фракционной перегонкой.
С другой стороны, для образования активированного производного карбоновой кислоты можно использовать агенты дегидратации карбодиимиды, такие как N,N'-диизопропилкарбодиимид (DIC), N,N'-дициклогексилкарбодиимид (DCC) или 1-этил-3-(3-диметиламинопропил)карбодиимид (EDAC, EDC), необязательно в присутствии каталитического или стехиометрического количества подходящей добавки, такой как 4-(N,N-диметиламино)пиридин (DMAP) (условия этерификации по Стегличу), 1-гидроксибензотриазол (HOBt), 1-гидрокси-7-азабензотриазол (HOAt) или N-гидроксисукцинимид (NHS); соли урония или фосфония с ненуклеофильными анионами, такие как гексафторфосфат N-[(1Н-бензотриазол-1-ил)(диметиламино)метилен]-N-метилметанаминия (HBTU), N-оксид гексафторфосфата N-[(диметиламино)-1Н-1,2,3-триазоло[4,5-b]пиридин-1-илметилен]-N-метилметанаминия (HATU), тетрафторборат N-[(1Н-бензотриазол- -ил)(диметиламино)метилен]-N-метилметанаминия (TBTU) или гексафторфосфат бензотриазол-1-илокситрипирролидинофосфония (PyBOP). Также необязательно можно использовать органические третичные основания, такие как триэтиламин (TEA) или диизопропилэтиламин (DIEA). Образование активированного производного карбоновой кислоты может происходить в инертном растворителе, таком как дихлорметан (DCM), N,N-диметилформамид (ДМФА), N-метилпирролидон (NMP), N,N-диметилацетамид (DMA, DMAc), или смесях любых из вышеуказанных растворителей при соответствующей температуре, такой как от примерно 0°С до примерно 40°С.
Аминолиз in situ полученных или выделенных производных карбоновых кислот с помощью аминопроизводного с соответствующими функциональными группами (HNR3R4) (схема 2) может происходить в присутствии подходящего основания, такого как органическое третичное основание, т.е., триэтиламин (TEA), диэтиламиноэтиламин (DIEA), пиридин или смесь любых из вышеуказанных растворителей, необязательно в присутствии подходящих добавок, таких как нуклеофильные катализаторы ацилирования, т.е., 4-(N,N-диметиламинопиридин (DMAP), и в другом или том же инертном растворителе, который использовался на стадии активации, таком как дихлорметан (DCM), N,N-диметилформамид (ДМФА), N-метилпирролидон (NMP), N,N-диметилацетамид (DMA, DMAc) или смеси любых из вышеуказанных растворителей, при соответствующей температуре, такой как от примерно 0°С до примерно 70°С.
Функционализированные 1-гидроксиацетамиды, применимые для получения пролекарств ацетамидов МНР формулы (I), можно получить согласно схеме 2
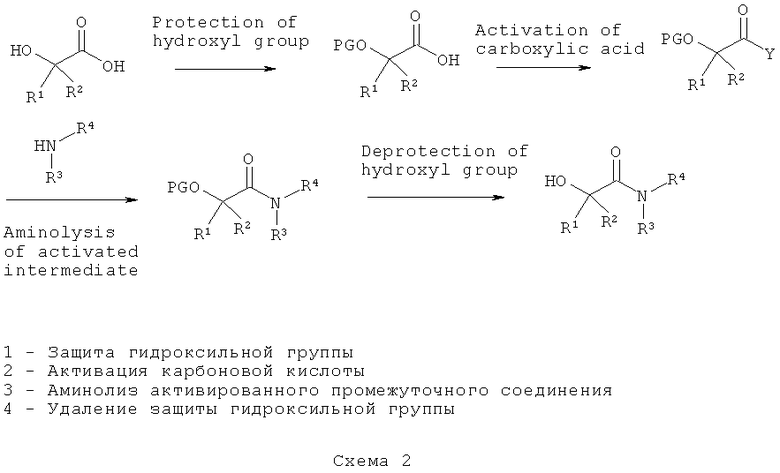
на которой PG представляет собой защитную группу для гидроксильной группы; Y представляет собой уходящую группу, такую как хлор или радикал, образованный от O-изомочевины; и R1, R2, R3 и R4 имеют значения, указанные в данном описании.
Некоторые из функционализированных и активированных производных 1-гидроксиуксусной кислоты коммерчески доступны, например, бензилоксиуксусная кислота и трет-бутилоксимолочная кислота. Способы введения защитных групп для гидроксила (PG) хорошо известны в технике. Применимые защитные группы для временного блокирования гидроксильной группы функционализированных 1-гидроксиуксусных кислот включают некоторые алкилы, такие как (замещенные) бензиловые эфиры, трет-бутиловые эфиры, тритиловый эфир или различные силиловые эфиры, такие как трет-бутилдиметилсилиловый эфир, триизопропилсилиловый эфир или трет-бутилдифенилсилиловый эфир.
Некоторые содержащие защитные группы функционализированные и активированные производные 1-гидроксиуксусной кислоты коммерчески доступны, например, бензилоксиацетилхлорид. С другой стороны, химической активации содержащего защитные группы функционализированного производного 1-гидроксиуксусной кислоты до соответствующего активированного производного 1-гидроксиуксусной кислоты, т.е., хлорангидрида карбоновой кислоты, O-ацилмочевины,. активированных эфиров и т.д., можно достичь с использованием реакционных процедур и условий, схожих с описанными на схеме 1 для активации функционализированных производных 1-галогенуксусной кислоты.
Аминолиз in situ полученных или выделенных производных содержащих защитные группы функционализированных и активированных производных 1-гидроксиуксусной кислоты функционализированными аминами (HNR3R4) может происходить с использованием реакционных процедур и условий, схожих с описанными на схеме 1 для аминолиза функционализированных и активированных производных 1-галогенуксусной кислоты с защитными группами.
Ортогональное (или упорядоченное) удаление защитной группы из содержащего защитную группу производного 1-гидроксиуксусной кислоты освобождает соответствующую гидроксильную группу. Способы, процедуры и практическое осуществление удаления защитной группы хорошо известны в технике.
В некоторых воплощениях защитная группа может представлять собой алкильную группу, такую как трет-бутильная группа. Удаление защитной группы можно осуществить контактированием содержащего защитную трет-бутильную группу ацетамидного производного с избытком сильной кислоты Бренстеда, такой как трифторуксусная кислота (ТФК) или хлороводородная кислота (HCl), в инертном растворителе, таком как дихлорметан (DCM), диэтиловый эфир (Et2O), 1,4-диоксан или смесь любых из вышеуказанных растворителей, при соответствующей температуре, такой как от примерно 0°С до примерно 40°С.
В некоторых воплощениях защитную группу можно выбрать из алкильной группы, такой как бензильная группа. Когда защитная группа представляет собой бензильную группу, удаление защитной группы можно осуществить взаимодействием функционал нзированного 1-гидроксиацетамидного производного с газом водородом (Hi) в присутстнии гетерогенного катализатора, например, 5-10 мас.% палладия на (активированном или влажном) угле, в растворителе, таком как метанол (МеОН), этанол (EtOH), этилацетат (EtOAc) или смесь любых из вышеуказанных растворителей, необязательно в присутствии небольшого количества активатора, такого как 1 N соляная кислота, при соответствующей температуре, такой как от примерно 0°С до примерно 40°С, и в атмосфере водорода при давлении от примерно 103,4 кПа (15 ф/д2) до примерно 413,7 кПа (60 ф/д2).
Пролекарства ацетамидов МНР формулы (I) можно получить согласно схеме 3
на которой Х представляет собой уходящую группу, такую как галоген, и R1, R2, R, R и R5 имеют значения, указанные в данном описании. В некоторых воплощениях схемы 3 Х представляет собой хлор, и R5 представляет собой алкил, такой как метил.
Нуклеофильное замещение моноалкилфумаровой кислоты функционализированным 1-галогенацетамидом (схема 1), показанное на схеме 3, может происходить в присутствии неорганического основания, такого как карбонат щелочного металла, такой как гидрокарбонат цезия (CsHCO3), карбонат цезия (Cs2CO6) или карбонат калия (K2CO3). Необязательно можно использовать органические третичные основания, такие как триэтиламин (TEA), диизопропилэтиламин (DIEA) или амидин; основания на основе гуанидина, такие как 1,5-диазабицикло[4.3.0]нон-5-ен (DBN) или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), 1,1,3,3-тетраметилгуанидин (TMG); соли серебра, такие как оксид серебра(1) (Ag2O) или карбонат серебра(1) (Ag2CO3); или другие акцепторы шлогенида, известные в технике. Соответствующие соли щелочных металлов, три- и тетраалкиламмония, амидина или гуанидина моноалкилфумарата можно получить in situ или, с другой стороны, можно получить отдельно. Взаимодействие может происходить в инертном растворителе, таком как N,N-диметилформамид (ДМФА), N-метилпирролидон (NMP), N,N-диметилацетамид (DMA, DMAC), диметилсульфоксид (ДМСО), тгтрагидрофуран (ТГФ), толуол или смеси любых из вышеуказанных растворителей, при соответствующей температуре, такой как от примерно комнатной температуры до примерно 70°С.
Пролгкарства ацетамидов MHF формулы (I) также можно получить согласно схеме 4
на которой Y представляет собой соответствующую уходящую группу, такую как галоген, O-ацилизомочевина, различные триазолэфирные группы или другие группы; и R1, R2, R3, R4 и R5 имеют значения, указанные в данном описании. В некоторых воплощениях схемы 4 Y представляет собой хлор, и R5 представляет собой алкил, такой как метил.
Химическую активацию карбоновой кислоты до соответствующего хлорангидрида карбоновой кислоты, как показано на схеме 4, можно осуществить взаимодействием с агентом хлорирования, таким как тионилхлорид (SOCl2), оксалилхлорид (C2O2Cl2), пентахлорид фосфора (РСУ или другим, необязательно в присутствии катализатора, такого как N,N-диметилформамид (ДМФА), и или в веществе (отсутствие растворителя) или в инертном органическом растворителе, таком как дихлорметан (DCM), при соответствующей температуре, такой как от примерно 0°С до примерно 70°С. Химическую активацию карбоновой кислоты, как показано на схеме 4, можно осуществить in situ без выделения активированного субстрата перед последующей стадией аминолиза. Необязательно активированный хлорангидрид карбоновой кислоты можно выделить и/или очистить с использованием способов, хорошо известных в технике, например, фракционной перегонки.
С другой стороны, для образования активированного производного моноалкилфумарарта можно использовать агенты дегидратации карбодиимиды, такие как N,N'-диизопропилкарбодиимид (DIC), N,N'-дициклогексилкарбодиимид (DCC) или 1-этил-3-(3-диметиламинопропил)карбодиимид (EDAC, EDC), необязательно в присутствии каталитического или стехиометрического количества добавки, такой как 4-(N,N-диметиламипо)пиридин (DMAP) (условия этерификации по Стегличу), 1-гидроксибенютриазол (HOBt), 1-гидрокси-7-азабензотриазол (HOAt) или N-гидроксисукцинимид (HOSu); соль урония или фосфония с ненуклеофильными анионами, такая как гексафторфосфат N-[(1Н-бензотриазол-1-ил)(диметиламино)метилен]-N-метилметанаминия (HBTU), N-оксид гексафторфосфата N-[(диметиламино)-1Н-1,2,3-триазоло[4,5-b]пиридин-1-илметилен]-N-метилметанаминия (HATU), тетрафторборат N-[(1Н-бензотр иазол-1-ил)(диметиламино)метилен]-N-метилметанаминия (TBTU) или гексафторфосфат бензотриазол-1-илокситрипирролидинофосфония (PyBOP). Также необязательно можно использовать органические третичные основания, такие как триэтиламин (TEA) или диэтиламиноэтиламин (DIEA). Образование активированного моноалкилфумарата может происходить в инертном растворителе, таком как дихлорметан (DCM), N,N-диметилформамид (ДМФА), N-метилпирролидон (NMP), N,N-диметилацетамид (DMA, DMAc), или смесях любых из вышеуказанных растворителей при соответствующей температуре, такой как от примерно комнатной температуры до примерно 70°С.
Алкоголиз активированного производного моноалкилфумарата с помощью функционал пзированного гидроксиацетамидного производного (схема 2) может происходить в присутствии основания, например, органического третичного основания, такого как триэтиламин (TEA), диэтиламиноэтиламин (DIEA) или пиридин, необязательно в присутствии добавок, таких как нуклеофильный катализатор ацилирования, например, 4-(N,N-диме гиламино)пиридин (DMAP) (условия этерификации по Стегличу), и в другом или том же инертном растворителе, который использовался на стадии активации, таком как дихлорметан (DCM), N,N-диметилформамид (ДМФА), N-метилпирролидон (NMP), N,N-диметилацетамид (DMA, DMAc) или смеси любых из вышеуказанных растворителей, при соответствующей температуре, такой как от примерно 0°С до примерно 70°С.
Пролскарства ацетамидов МНР формулы (I) также можно получить согласно схеме 5
на которой А представляет собой или уходящую группу, такую как галоген, или группу нуклеофильного сочетания, такую как гидроксил; Y представляет собой соответствующую уходящую группу, такую как галоген, O-ацилизомочевина, различные триазолэфирные группы или другие группы; PG представляет собой защитную группу для карбоксильной группы; и R1, R2, R3, R4 и R5 имеют значения, указанные в данном описании. В некоторых воплощениях схемы 5 Х представляет собой бром, PG представляет собой трет-бутил, каждый из R1 и R2 представляет собой водород, и электрофилом является трет-бутилбромацетат. В некоторых воплощениях схемы 5 Y представляет собой хлор или O-ацилизомочевину, полученную из 1-этил-3-(3-диметиламииопропил)карбодиимида (EDAC), и R5 представляет собой алкил, такой как метил.
Реакция нуклеофильного замещения моноалкилфумаровой кислоты содержащим защитную и функциональную группы производным 1-галогенуксусной кислоты, например, коммерчески доступным трет-бутилбромацетатом или другими производными, может происходить с использованием реакционных процедур и условий, схожих с описанными на схеме 3 для прямого образования функционализированных пролекарств ацетамидов IVTHF формулы (I) из моноалкилфумаровой кислоты и соответствующим образом фун кционализированного 1-галогенацетамида.
Алкоюлиз промежуточного активированного производного моноалкилфумаровой кислоты и содержащего защитную и функциональную группы производного 1-гидроксиуксусной кислоты может происходить с использованием реакционных процедур и условий, схожих с описанными на схеме 4 для прямого образования функционализированных пролекарств MHF-ацетамидов формулы (I) из моноалкилфумаровой кислоты и соответствующим образом функционализированного 1-гидроксиаце гамида.
Ортогональное (или упорядоченное) удаление защитной группы из содержащего защитную группу производного моноалкилфумаровой кислоты функционализированного производного уксусной кислоты высвобождает соответствующий свободный промежуточный эфир моноалкилфумарат, содержащий свободную карбоксильную группу. Когда защитная группа представляет собой трет-бутильную группу, удаление защитной группы можно осуществить контактированием содержащего защитную трет-бутильную группу производного фумаровой кислоты с избытком сильной кислоты Бренстеда, такой как трифторуксусная кислота (ТФК) или хлороводородная кислота (HCl), в инертном растворителе, таком как дихлорметан (DCM), диэтиловый эфир (Et2O), 1,4-диоксан или смеси любых из вышеуказанных растворителей, при соответствующей температуре, такой как от примерно 0°С до примерно 40°С.
Химическую активацию освобожденного производного моноалкилфумарата -функционал изированной гидроксиуксусной кислоты (карбоновой кислоты) до соответствующего активированного производного карбоновой кислоты, т.е., хлорангидрида карбоновой кислоты, 0-ацилизомочевины, активированных эфиров и т.д., можно осуществить с использованием реакционных процедур и условий, схожих с описанными на схеме 4 для активации моноалкилфумаровой кислоты, прямого образования функционализированных пролекарств ацетамидов МНР формулы (I) из моноалкилфумаровой кислоты и соответствующим образом функционализированного гидроксилацетамида.
Аминолиз in situ полученных или выделенных активированных функционализированных производных гидроксиуксусной кислоты моноалкилфумарата с помощью функционализированных аминов (HNR^4) может происходить с использован нем реакционных процедур и условий, схожих с описанными на схемах 1 и 2 для аминолиза содержащих защитные группы соответственно функционализированных и активированных производных гидроксиуксусной кислоты.
Некоторые из функционализированных 1-галогеналкилкарбоксилатов (1-ацилоксиалкилгалогенидов) или функционализированных 1-алкоксикарбонилоксиалкилгалогенидов, применимых для получения соединений формулы (II), доступны из коммерческих источников. Коммерчески недоступные 1-галогенаклилкарбоксилаты (1-ацилоксиалкилгалогениды) или функционализированные 1-алкоксикарбонилоксиалкилгалогениды можно получить способами, хорошо известными в технике и кратко описанными на схемах 6 и 7.
1-Ацилоксиалкилгалогениды, применимые для получения пролекарств МНР формулы (II), можно получить согласно схеме 6
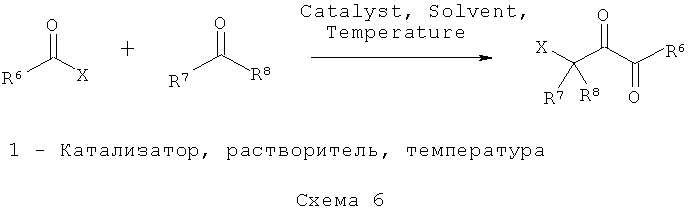
на которой Х представляет собой уходящую группу, такую как галоген; и R6, R7 и R8 имеют значения, указанные в данном описании. В некоторых воплощениях схемы 6 Х представляет собой хлор, и R6 представляет собой 2-[метил-(2Е)-бут-2-ен-4-ат]ил; один из R7 и R8 представляет собой водород, и другой из R7 и R8 представляет собой алкил.
Функционализированные 1-галогенаклилкарбоксилаты (1-ацилоксиалкилгалогениды) можно получить контактированием функционализированного галогенида карбоновой кислоты, такого как хлорангидрид карбоновой кислоты, с функционал пзированным карбонильным соединением, таким как альдегид, в присутствии катализатора кислоты Льюиса, такой как безводный хлорид цинка (ZnCl2), в инертном растворителе, таком как дихлорметан (DCM), при температуре от примерно -10°С до комнатной температуры. 1-Хлораклилкарбоксилаты (1-ацилоксиалкилхлориды) можно использовать непосредственно или можно выделить и очистить способами, хорошо известными в технике, такими как фракционная перегонка или колоночная хроматография на силикагеле.
1-Алкокси- и 1-арилоксикарбонилоксиалкилгалогениды, применимые для получения пролекарств MHF формулы (II), можно получить согласно схеме 7

на которой Х представляет собой уходящую группу, такую как галоген; и R7, R8 и R10 имеют значения, указанные в данном описании. В некоторых воплощениях схемы 7 Х представляет собой хлор, и R10 вместе с атомом кислорода, с которым он связан, эквивалентен R6, имеющему значения, указанные в данном описании.
Функционализированные 1-алкокси- или 1-арилоксикарбонилоксиалкилгалогениды можно получить контактированием функционализированного галогеналкилгалогенформиата, такого как функционализированный хлоралкил- или арилхлорформиат, с функционализированным спиртом или фенолом (HOR10) в присутствии основания, такого как органическое вторичное и третичное основание, например, дициклогексиламин (DCHA), триэтиламин (TEA), диизопропилэтиламин (DIEA, основание Хюнига), пиридин, в инертном растворителе, таком как дихлорметан (DCM), при температуре от примерно -10°С до комнатной температуры. 1-Алкокси- и 1-арилоксикароонилоксиалкилгалогениды можно использовать непосредственно или можно выделить и очистить способами, хорошо известными в технике, такими как фракционная перегонка или колоночная хроматография на силикагеле.
Пролекарства ацилоксиалкильных и алкоксикарбонилоксиалкильных МНР формулы (II) можно получить получить согласно схеме 8
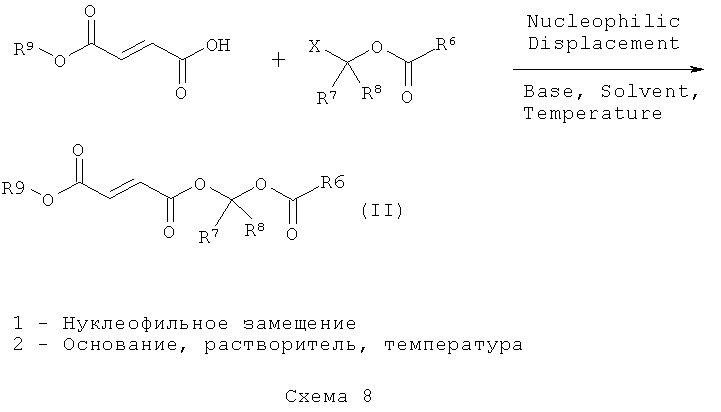
на которой Х представляет собой уходящую группу, такую как галоген; и R7, R, R9 и R10 имеют значения, указанные в данном описании.
Нуклеофильное замещение моноалкилфумаровой кислоты функционал изированным 1-галоген… (схема 1), как показано на схеме 8, может происходить в присутствии неорганического основания, такого как карбонат щелочного металла, например, гидрокарбонат цезия (CsHCO3), карбонат цезия (Cs2CO3) или карбонат калия (K2CO3). С другой стороны, можно использовать органические вторичные и третичные основания, такие как дициклогексиламин (DCHA), триэтиламин (TEA), диизопропилэтиламин (DIEA), амидин, или основания на основе гуанидина, такие как 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) или 1,1,3,3-тетраметилгуанидин (TMG); соли серебра, такие как оксид серебра(1) (Ag2O) или карбонат серебра(1) (Ag2CO3); или другие акцепторы галогенида, известные в технике. Соответствующие соли щелочных металлов, три- и тетраалкиламмония, амидина или гуанидина моноалкилфумарата можно получить in situ или, с другой стороны, можно получить отдельно. Взаимодействие может происходить в инертном растворителе, таком как N,N-диметилформамид (ДМФА), N-метилпирролидон (NMP), N,N-диметилацетамид (DMA, DMAC), диметилсульфоксид (ДМСО) или тетрагидрофуран (ТГФ), толуол или смеси любых из вышеуказанных растворителей, при соответствующей температуре, такой как от примерно комнатной температуры до примерно 70°С.
Монофиры амидов гликолевой кислоты фумаровой кислоты формулы (III) или моноэфиры ацилоксиалкил- и алкокси- или арилоксикарбонилоксиалкилфумаровой кислоты формулы (IV) можно получить согласно схеме 9
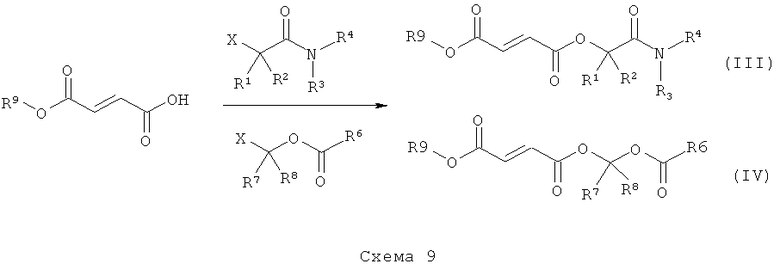
на которой Х представляет собой соответствующую уходящую группу, такую как галоген; и R1, R2, R3, R4, R6, R7, R8 и R9 и имеют значения, указанные в данном описании. В некоторых воплощениях схемы 9 Х представляет собой хлор, и R9 выбирают из водорода или трет-бутила (трет-Bu), и производное фумаровой кислоты представляет собой или фумаровую кислоту или трет-бутилфумарат.
Сочетание фумаровой кислоты или моноалкилфумаратов, например, моно-трет-бутилфумарата, с функционализированными 1-галогенацетамидными производными, функционал изированными 1-галогенкарбоксилатами (1-ацилоксиалкилгалогенидами) или 1-алкокси- или арилоксикарбонилоксиалкилгалогенидами может происходить с использованием реакционных процедур и условий, схожих с описанными на схемах 3 и 8 для прямого образования функционализированных пролекарств ацетамидных МНР формулы (I) (схема 3) или пролекарств ацилоксиалкил- или алкоксиарилоксикарбонилоксиалкильных MHF формулы (II) (схема 8).
В некоторых воплощениях, где R9 представляет собой алкил, такой как трет-бутил, ортогональное (или упорядоченное) удаление защитной группы (или высвобождение свободной карбоновой кислоты) из соответствующего функционализированного ацетамид- или ацилоксиалкил- или алкокси-/арилоксикарбонилоксиалкил-трет-бутилфумарятов можно осуществить с использованием реакционных процедур и условий, схожих с описанными на схеме 5.
Фармацевтические композиции
Фармацевтические композиции по настоящему изобретению могут включать терапевтически эффективное количество соединения формул (I)-(IV) вместе с подходящим количеством одного или нескольких фармацевтически приемлемых носителей с тем, чтобы предоставить композицию для надлежащего введения пациенту. Подходящие фармацевтические носители описаны в технике.
В некоторых воплощениях соединение формул (I)-(IV) может быть включено в фармацевтические композиции для перорального введения. Пероральное введение таких фармацевтических композиций может привести к поглощению соединения формул (I)-(IV) через кишечник и поступлению в системное кровообращение. Такие пероральные композиции можно получить способом, известным в области фармации, и они включают соединение формул (I)-(IV) и, по меньшей мере, один фармацевтически приемлемый носитель. Пероральные фармацевтические композиции могут включать терапевтически эффективное количество соединения формул (I)-(IV) и подходящее количество фармацевтически приемлемого носителя с тем, чтобы предоставить соответствующую форму для введения пациенту.
Соединения формул (I)-(IV) могут быть включены в фармацевтические композиции, вводимые любым другим подходящим путем введения, включая интрадермальный, внутримышечный, интраперитонеальный, внутривенный, подкожный, интраназальный, эпидуральный, пероральный, сублингвальный, интрацеребральный, интравагинальный, трансдермальный, ректальный, ингаляцию или местное введение.
Фармацевтические композиции, включающие соединение формул (I) - (IV), могут быть получены посредством обычных процессов смешивания, растворения, грануляции, получения драже, измельчения, эмульгирования, инкасулирования, захвата или лиофилизацни. Фармацевтические композиции могут быть составлены обычным образом с использованием включения одного или нескольких физиологически приемлемых носителей, разбавителей, эксципиентов или вспомогательных веществ, которые облегчают обработку соединений формул (I)-(IV) или их кристаллических форм и одной или нескольких фармацевтически приемлемых сред в препарат, которые можно использовать для фармацевтических целей. Нужный препарат зависит от выбранного способа введения. Фармацевтические композиции по настоящему изобретению могут принимать форму растворов, суспензий, эмульсий, таблеток, пилюль, гранул, капсул, капсул, содержащих жидкости, порошков, препаратов с отсроченным высвобождением, суппозиториев, аэрозолей, спреев или любую другую форму, подходящую для введения пациенту.
Фармацевтические композиции по настоящему изобретению могут быть получены в стандартной лекарственной форме. Определение «стандартная лекарственная форма» относится к физически дискретной единице, подходящей в качестве единичной дозы для пациентов, проходящих лечение, причем каждая единица содержит предварительно установленное количество соединения формул (I)-(IV), рассчитанное на получение предполагаемого терапевтического эффекта. Стандартная лекарственная форма может быть для дозы на один прием в сутки, для введения 2 раза в день или одной из нескольких суточных доз, например, 3 или более раз в день. Когда используют несколько суточных доз, стандартная лекарственная форма может быть одной и той же или различной для каждой дозы. Одна или несколько лекарственных форм могут включать дозу, которую можно вводить пациенту в один момент времени или на протяжении временного интервала.
Фармацевтические композиции, включающие соединение формул (I)-(IV), могут быть получены для немедленного высвобождения.
В некоторых воплощениях пероральная лекарственная форма по настоящему изобретению может представлять собой лекарственную форму с регулируемым высвобождением. Технологии регулируемой доставки могут улучшить абсорбцию лекарственного средства в определенном участке или участках желудочно-кишечного тракта. Системы регулируемой доставки лекарственного средства могут быть созданы для доставки лекарственного средства таким путем, что уровень лекарственного средства поддерживается в терапевтически эффективном окне, и эффективные и безопасные уровни в крови сохраняются в течение периода такой длительности, пока система продолжает доставлять лекарственное средство с определенным профилем высвобождения в желудочно-кишечном тракте. Регулируемая доставка лекарственного средства может давать по существу постоянные уровни лекарственного средства в крови в течение некоторого периода времени в сравнении с колебаниями, наблюдаемыми с лекарственными формами с немедленным высвобождением. Для некоторых лекарственных форм сохранение постоянной концентрации в крови и тканях в ходе лечения является наиболее желательным способом лечения. Немедленное высвобождение лекарственных средств может являться причиной уровней в крови, превышающих требуемый для выявлений нужной реакции, что может стать непроизводительным расходом лекарственного средства и может вызвать или усилить токсичное побочное действие. Регулируемая доставка лекарственного средства может привести к оптимальному лечению и может не только уменьшить частоту введения доз, но также может снизить тяжесть побочного действия. Примеры лекарственных форм с регулируемым высвобождением включают системы с регулируемым растворением, системы с регулируемой диффузией, ионообменные смолы, осмотически регулируемые системы, системы с разрушаемой матрицей, pH-независимые препараты, системы удерживания в желудке и подобные системы.
Соответствующая пероральная лекарственная форма для определенной фармацетической композиции по настоящему изобретению может зависеть, по меньшей мере, частично, от свойств абсорбции в желудочно-кишечном тракте соединения формул (I)-(IV), устойчивости соединения формул (I)-(IV) в желудочно-кишечном тракте, фармакокинетики соединения формул (I)-(IV) и предполагаемого терапевтического профиля. Для определенного соединения формул (I)-(IV) может быть выбрана соответствующая пероральная лекарственная форма с регулируемым высвобождением. Например, пероральные лекарственные формы с удерживанием в желудке могут подойти для соединений, абсорбируемых главным образом из верхнего отдела желудочно-кишечного тракта, а пероральные лекарственные формы с пролонгированным высвобождением могут подойти для соединений, абсорбируемых главным образом из нижнего отдела желудочно-кишечного тракта. Некоторые соединения абсорбируются главным образом из тонкой кишки. Вообще, соединения проходят тонкую кишку за примерно 3-5 часов. В случае соединений, которые с трудом абсорбируются в тонкой кишке или которые с трудом растворяются, окно для абсорбции активного вещества в тонкой кишке может быть слишком кратковременным для получения нужного терапевтического действия.
В некоторых воплощениях фармацевтические композиции по настоящему изобретению могут применяться с помощью лекарственных форм, адаптированных для обеспечения пролонгированного высвобождения соединения формул (I-(IV) после перорального введения. Пероральные лекарственные формы с пролонгированным высвобождением могут использоваться для высвобождения лекарства в течение длительного периода времени и применимы, когда желательно, чтобы лекарственное средство или лекарственная форма доставлялись в нижний отдел желудочно-кишечного тракта. Пероральные лекарственные формы с пролонгированным высвобождением включают любую лекарственную форму, которая поддерживает терапевтические концентрации лекарственного средства в биологической жидкости, такой как плазма, кровь, спинномозговая жидкость, или ткани или органе в течение длительного периода времени. Пероральные лекарственные формы с пролонгированным высвобождением включают системы с регулируемой диффузией, такие как устройства с резервуаром и устройства с матрицей, системы с регулируемым растворением, осмотические системы и системы с регулируемым разрушением. Пероральные лекарственные формы с пролонгированным высвобождением и способы их получения хорошо известны в технике.
Соответствующая доза соединения формул (I)-(IV) или фармацевтической композиции, включающей соединение формул (I)-(IV), может быть определена согласно любому из ряда общепринятых протоколов. Например, для определения соответствующей дозы фармацевтического соединения можно использовать исследования на животных, такие как исследования с использованием мышей, крыс, собак и/или обезьян. Результаты исследований на животных можно экстраполировать для определения доз для использования другими видами, такими как, например, люди.
Применения
Соединения формул (I)-(IV) являются пролекарствами МНР. Таким образом, соединения формул (I)-(IV) и фармацевтические композиции, включающие их, можно вводить пациенту, страдающему от любого заболевания, включая расстройство, состояние или симптомы, для которых известно, что МНР является терапевтически эффективным, или это будет открыто позднее. Показания, в случае которых предписан MHF, и, следовательно, в случае которых также ожидается, что соединение формул (I)-(IV) или фармацевтические композиции, включающие его, будут эффективны, включают псориаз. Другие показания, в случае которых соединения формул (I)-(IV) могут быть терапевтически эффективны, включают рассеянный склероз, воспалительное заболевание кишечника, астму, хроническую обструктивную болезнь легких и артрит.
Способы лечения заболевания у пациента по настоящему изобретению включают введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества пролекарства МНР формул (I)-(IV). Соединения формул (I)-(IV) или фармацевтические композиции с ними после введения пациенту могут обеспечить терапевтические или профилактические концентрации MHF в плазме и/или крови.
Пролекарства MHF формул (I)-(IV) могут быть включены в фармацевтическую композицию и/или лекарственную форму, адаптированную для перорального введения, хотя пролекарство MHF формул (I)-(IV) также можно вводить любым другими соответствующим путем, таким как, например, инъекция, инфузия, ингаляция, трансдермальный путь или абсорбция через эпителиальные или слизистые оболочки (например, слизистую оболочку полости рта, прямой кишки и/или кишечника).
Пролекарства MHF формул (I)-(IV) можно вводить в количестве и с использованием схемы приема, соответствующих для лечения определенного заболевания. Суточные дозы пролекарства MHF формул (I)-(IV) могут колебаться от примерно 0,01 мг/кг до примерно 50 мг/кг, от примерно 0,1 мг/кг до примерно 50 мг/кг, от примерно 1 мг/кг до примерно 50 мг/кг, и в некоторых воплощениях, от примерно 5 мг/кг до примерно 25 мг/кг. В некоторых воплощениях пролекарства MHF формул (I)-(IV) можно вводить за указанными пределами в дозе от 1 мг до примерно 5 г в сутки, от примерно 10 мг до примерно 4 г в сутки, и в некоторых воплощениях, от примерно 20 мг до примерно 2 г в сутки. Соответствующую дозу пролекарства MHF формул (I)-(IV) можно определить на основании нескольких факторов, включая, например, массу тела и/или состояние пациента, которого лечат, тяжесть заболевания, от которого лечат, случаи и/или тяжесть побочного действия, способ введения и решение лечащего врача. Соответствующие дозировочные интервалы можно определить способами, известными специалистам в данной области техники.
Пролекарства MHF формул (I)-(IV) перед применением для людей можно анализировать in vtro и in vivo на нужную терапевтическую или профилактическую активность. Анализы in vivo, например, с использованием соответствующих животных моделей, также можно использовать для определения того, является ли введение пролекарства MHF формул (I)-(IV) терапевтически эффективным.
В некоторых воплощениях терапевтически эффективная доза пролекарства MHF формул (I)-(IV) может обеспечить благоприятное лечебное действие, не вызывая существенной токсичности, в том числе, побочного действия. Токсичность пролекарств MHF формул (I)-(IV) и/или их метаболитов можно определить с использованием стандартных фармацевтических процедур и может быть установлена специалистами в данной области техники. Соотношение для дозы между токсичным и терапевтическим действием представляет собой терапевтический индекс. Доза пролекарства MHF формул (I)-(IV) может находиться в интервале, в котором возможно установление и поддержание терапевтически эффективной концентрации в циркулирующей плазме и/или крови пролекарства MHF формул (I)-(IV), которая проявляет небольшую токсичность или отсутствие токсичности.
Пролекарства MHF формул (I)-(IV) можно использовать для лечения любых вышеуказанных заболеваний, расстройств, состояний и симптомов, для которых известно, что MHF обеспечивает терапевтическое благоприятствие или это обнаружится позднее. Известно, что MHF является эффективным при лечении псориаза, рассеянного склероза, воспалительного заболевания кишечника, астмы, хронической обструктивной болезни легких и артрита. Следовательно, пролекарства MHF формул (I)-(IV) можно использовать для лечения любого из указанных заболеваний и расстройств. Этиология, лежащая в основе любого из вышеуказанных заболеваний, от которых лечат, может иметь множество источников. Кроме того, в некоторых воплощениях терапевтически эффективное количество одного или нескольких соединений формул (I)-(IV) может быть введено пациенту, такому как человек, как профилактическая мера против различных заболеваний или расстройств. Таким образом, терапевтически эффективное количество одного или нескольких соединений формул (I)-(IV) может быть введено как профилактическая мера для пациента с предрасположенностью к и/или наличием в истории болезни иммунологических, аутоиммунных и/или воспалительных заболеваний, включая псориаз, астму и хроническую обструктивную болезнь легких, сердечную недостаточность, включая левожелудочковую недостаточность, инфаркт миокарда и стенокардию, митохондриальные и нейродегенеративные заболевания, такие как болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона, пигментную ретинопатию и митохондриальную энцефалопатию, отторжение трансплантата, аутоиммунные заболевания, включая рассеянный склероз, ишемию и реперфузионное повреждение, повреждение генома, вызванное AGE, воспалительные заболевания кишечника, такие как болезнь Крона и неспецифический язвенный колит; и заболевания, опосредуемые NF-κВ.
Псориаз
Псориаз характеризуется гиперкератозом и утолщением эпидермиса, а также увеличенным наличием кровеносных сосудов и инфильтрацией клеток зоны воспаления в дерму. Псориаз вульгарный проявляется в виде серебристых чешуеобразных эритематозных бляшек типично на волосистой части кожи головы, локтях, коленях и ягодицах. Каплевидный псориаз имеет место в виде повреждений как прерывающиеся капли.
Эфиры фумаровой кислоты общепризнаны для лечения псориаза, и диметилфумират одобрен в Германии для системного лечения псориаза (Mrowietz and Asadullah, Trends Mol. Med., 2005, 11(1), 43-48; и Mrowietz et al., Br. J.Dermatology, 1999, 141,424-429).
Эффективность пролекарств MHF для лечения псориаза можно определить с использованием животных моделей и клинических испытаний.
Воспалительный артрит
Воспалительный артрит включает такие заболевания, как ревматоидный артрит, ювенильный ревматоидный артрит (ювенильный идиопатический артрит), псориатический артрит и анкилозирующий спондилит, вызывающие воспаление суставов. Полагают, что патогенез иммуноопосредованных заболеваний, включая воспалительный артрит, вовлекает пути передачи сигналов TNF и NF-κВ (Tracey et al., Pharmacology & Therapeutics, 2008, 117, 244-279). Показано, что DMF ингибирует TNF и, так как полагают, что воспалительные заболевания, включая воспалительный артрит, вовлекают передачу сигналов TNF и NF-κВ, поэтому может быть полезен при лечении воспалительного артрита (Lowewe et al., J.Immunology, 2002, 168, 4781-4787).
Эффективность пролекарств MHF для лечения воспалительного артрита можно определить с использованием животных моделей и в клинических испытаниях.
Рассеянный склероз
Рассеянный склероз (MS) представляет собой воспалительное аутоиммунное заболеваний центральной нервной системы, вызванное аутоиммунной атакой против изолирующих аксонных миелиновых слоев центральной нервной системы. Демиелинизация приводит к разрушению проводимости и тяжелому заболеванию с разрушением локальных аксонов и необратимым некрозом нейронов. Симптомы MS сильно изменяются с каждым отдельным пациентом, показывая определенную картину расстройств движения, ощущений и чувствительности. MS типично патологически проявляется многими очагами воспаления, бляшками демиелинизации, глиозом и аксонной литологией в головном и спинном мозгу, которые все вносят вклад в клинические проявления неврологической нетрудоспособности (см., например, Wingerchuk, Lab. Invest, 2001, 81, 263-281; и Virley, NeuroRx, 2005, 2(4), 638-649). Хотя случайные события, которые ускоряют MS, полностью не выяснены, факты связывают аутоиммунную этиологию с факторами окружающей среды, а также специфическими генетическими предрасположенностями. Функциональное ухудшение, потеря трудоспособности и недостатки выражаются в виде паралича, сенсорных и октинитивных (octinitive) расстройств, спастичности, треморе, отсутствии координации и видимом ухудшении, которые оказывают воздействие на качество жизни индивидуума. Клиническое течение MS может изменяться от индивидуума к индивидууму, но неизменно заболевание может быть классифицировано в трех формах; рецидивирующей-ремиттирующей, вторичной прогрессирующей и первичной прогрессирующей.
Исследования подтверждают эффективность FAE для лечения MS и находятся в фазе II клинической проверки (Schimrigk et al., Eur. J. Neurology, 2006, 13, 604-610; и Wakkee and Thio, Current Opinion Investigational Drugs, 2007, 8(11), 955-962).
Оценку эффективности лечения MS при клинических испытаниях можно осуществить с использованием таких инструментов, как Expanded Disability Status Scale and MS Functional, а также получения изображений патологической нагрузки методом магнитного резонанса, биомеркеров и самооценки качества жизни. Животные модели MS, показанные как применимые для идентификации и подтверждения потенциальных терапевтических средств, включают эксперименталльные модели грызунов аутоиммунного/аллергического энцефаломиелита (ЕАЕ), которые имитируют клинические и патологические проявления MS, и модели ЕАЕ приматов, не являющихся людьми.
Воспалительное заболевание кишечника (болезнь Крона, неспецифический язвенный колит)
Воспалительное заболевание кишечника (IBD) представляет собой группу воспалительных состояний толстой кишки и в некоторых случаях тонкой кишки, которые включают болезнь Крона и неспецифический язвенный колит. Болезнь Крона, которая характеризуется зонами воспаления с зонами здоровой выстилки между ними, может поразить любую часть желудочно-кишечного тракта от рта до ануса. Основными гастроинтестинальными симптомами являются абдоминальная боль, диарея, констипация, рвота, потеря массы и/или прирост массы. Болезнь Крона также может вызвать покраснения кожи, артрит и воспаление глаз. Неспецифический язвенный колит характеризуется язвами или открытыми поражениями в толстой кишке или ободочной кишке. Основным симптомом неспецифического язвенного колита типично является постоянная диарея с примесями крови, начинающаяся постепенно. Другие типы воспалительного заболевания кишечника включают коллагеновый колит, лимфоцитарный колит, ишемический колит, diversion колит, колит Бехчета и недетерминированный колит.
FAE являются ингибиторами активации NF-κВ и поэтому могут применяться при лечении воспалительных заболеваний, таких как болезнь Крона и неспецифический язвенный колит (Atreya et al., J. Intern. Med., 2008,263(6), 59106).
Эффективность пролекарств MHF для лечения воспалительного заболевания кишечника можно оценить с использованием животных моделей и клинических испытаний. Применимые животные модели воспалительного заболевания кишечника известны.
Астма
Астма представляет собой обратимую обструкцию дыхательных путей, при которой дыхательные пути временами сжимаются, становятся воспаленными и покрываются избыточным количеством слизи. Симптомы астмы включают одышку, стридор, стеснение в области грудной клетки и кашель. Эпизоды астмы могут вызываться находящимися в воздухе аллергенами, пищевой аллергией, лекарственными препаратами, вдыхаемыми раздражающими веществами, физической нагрузкой, респираторной инфекцией, психологическим стрессом, гормональными изменениями, холодной погодой или другими факторами.
Как ингибиторы активации NF-κВ, и как показано в исследованиях на животных (Joshi et al., US 2007/0027076), FAE могут применяться при лечении болезней легких, таких как астма и хроническая обструктивная болезнь легких.
Эффективность пролекарств MHF формул (I)-(IV) для лечения астмы можно оценить с использованием животных моделей и клинических испытаний.
Хроническая обструктивная болезнь легких
Хроническая обструктивная болезнь легких (COPD), также известная как хроническая обструктивная болезнь дыхательных путей, представляет собой группу заболеваний, характеризующихся патологическим ограничением потока воздуха в дыхательных путях, которое не является полностью обратимым, и включает состояния, такие как хронический бронхит, эмфизема, а также легочные расстройства, такие как асбестоз, пневмокониоз и новообразования в легких (см., например, Bames, Pharmacological Reviews, 2004, 56(4), 515-548). Ограничение воздушного потока, как правило, прогрессирует и ассоциируется с анормальной воспалительной реакцией легких на вредные частицы и газы. COPD характеризуется одышкой, длящейся месяцами или годами, возможно, сопровождаемой стридором, и постоянным кашлем с образованием мокроты. COPD наиболее часто вызывается курением, хотя она также может быть вызвана другими находящимися в воздухе раздражающими веществами, такими как угольная пыль, асбест, городские загрязнения или растворители. COPD охватывает хронический обструктивный бронхиолит с.фиброзом и обструкцию мелких дыхательных путей и эмфизему с расширением просветов и деструкцией паренхимы легких, потерей эластичности легких и закрытием мелких дыхательных путей.
Эффективность введения, по меньшей мере, одного соединения формул (I)-(IV) для лечения хронической обструктивной болезни легких можно оценить с использованием животных моделей хронической обструктивной болезни легких и клинических исследований. Например, известны мышиные модели хронической обструктивной болезни легких.
Нейродегенеративные расстройства
Нейродегенеративные заболевания, такие как болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона и боковой амиотрофический склероз, характеризуются прогрессирующей дисфункцией и некрозом нейронов. В качестве терапевтической цели в случае нейродегенеративных заболеваний предложено ингибирование NF-кВ (Camandola and Mattson, Expert. Opin. Ther. Targets, 2007, 11(2), 123-32).
Болезнь Паркинсона
Болезнь Паркинсона представляет собой постепенно прогрессирующее дегенеративное расстройство нервной системы, характеризующееся тремором, когда мышцы находятся в покое (тремор покоя), замедленностью произвольных движений и повышенным мышечным тонусом (ригидность). При болезни Паркинсона нервные клетки в базальных ядрах, например, черном веществе, дегенерируют и посредством этого уменьшают выработку дофамина и число соединений между нервными клетками в базальных ядрах. В результате базальные ядра неспособны к движению гладких мышц и координации изменений в положении тела как нормальным, что ведет к тремору, дискоординации и замедленному ослабленному движению (брадикинезия) (Blandini et al., Mol. Neurobiol., 1996, 12, 73-94).
Эффективность соединений формул (I)-(IV) для лечения болезни Паркинсона можно оценить с использованием животных и человеческих моделей болезни Паркинсона и в клинических исследованиях.
Болезнь Альцгеймера
Болезнь Альцгеймера представляет собой прогрессирующую утрату психической функции, характеризующуюся дегенерацией ткани головного мозга, включая потерю нервных клеток и развитие сенильных бляшек и нейрофибриллярных переплетений. При болезни Альцгеймера части головного мозга дегенерируют, причем нервные клетки разрушаются, и уменьшается чувствительность оставшихся нейронов к нейротрансмиттерам. Анормальности в ткани головного мозга состоят из сенильных или старческих бляшек, например, агрегатов погибших нервных клеток, содержащих анормальный нерастворимый белок, называемый амилоидом, и нейрофибриллярных переплетений перекрученных цепей нерастворимых белков в нервной клетке.
Эффективность соединений формул (I)-(IV) для лечения болезни Альцгеймера можно оценить с использованием животных и человеческих моделей болезни Альцгеймера и в клинических исследованиях.
Болезнь Гентингтона
Болезнь Гентингтона представляет собой аутосомное доминантное нейродегенеративное расстройство, при котором в новом полосатом теле (neostriatum) и коре головного мозга происходит специфический некроз клеток (Martin, N.Engl. J.Med., 1999, 340, 1970-80). Начало обычно приходится на четвертое или пятое десятилетие жизни со средним сроком периода начала 14-20 лет. Болезнь Гентингтона обычно фатальна, и эффективного лечения не существует. Симптомы включают характерное расстройство движения (хорея Гентингтона), когнитивную дисфункцию и психические симптомы. Болезнь вызывается мутацией, кодирующей анормальное наращивание кодированных CAG полиглутаминовых повторов в белке гентингтине.
Эффективность соединений формул (I)-(IV) для лечения болезни Гентингтона можно оценить с использованием животных и человеческих моделей болезни Гентингтона и в клинических исследованиях.
Боковой амиотрофический склероз
Боковой амиотрофический склероз (ALS) представляет собой прогрессирующее нейродегенеративное расстройство, характеризующееся прогрессирующей и специфической утратой двигательных нейронов в головном мозгу, стволе головного мозга и спинном мозгу (Rowland and Schneider, N.Engl. J.Med., 2001, 344, 1688-1700). ALS начинается со слабости, часто в кистях рук и менее часто в стопах, которая, как правило, прогрессирует до плеча или голени. Со временем слабость усиливается, и спастичность развивается, характеризуясь мышечными судорогами и напряженностью, с последующими спазмами мышц и возможным тремором. Средний возраст начала составляет 55 лет, и средняя продолжительность жизни после клинического начала составляет 4 года. Единственным признанным лечением ALS является рилузол, который может продлить жизнь только примерно на три месяца.
Эффективность соединений формул (I)-(IV) для лечения ALS можно оценить с использованием животных и человеческих моделей ALS и в клинических исследованиях.
Другие заболевания
Другие заболевания и состояния, для лечения которых можно применять соединения формул (I)-(IV), включают ревматические заболевания, гранулему кольцевидную, волчанку, аутоиммунный кардит, экзему, саркоидоз и аутоиммунные заболевания, включая острый диссиминирующий энцефаломиелит, болезнь Аддисона, гнездную алопецию, анкилозирующий спондилит, антифосфолипидный синдром, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунную болезнь внутреннего уха, буллезный пемфигоид, болезнь Бехчета, глютеновую болезнь, болезнь Шагаса, хроническую обструктивную болезнь легких, болезнь Крона, дерматомиозит, сахарный диабет I типа, эндометриоз, синдром Гудпасчера, болезнь Грейвса, синдром Гиллайна-Барра, болезнь Хасимото, гнойный гидраденит, болезнь Кавасаки, IgA-невропатию, идиопатическую тромбоцитопеническую пурпуру, интерстициальный цистит, красную волчанку, смешанную болезнь соединительной ткани, кольцевидную склеродермию, рассеянный склероз, тяжелую псевдопаралитическую миастению, нарколепсию, нейромиотонию, пузырчатку вульгарную, злокачественную анемию, псориаз, псориатический артрит, полимиозит, первичный билиарный цирроз, ревматоидный артрит, шизофрению, склеродермию, синдром Шегрена, синдром негнущегося человека, височный артрит, неспецифический язвенный колит, васкулит, витилиго и гранулематоз Вегенера.
Введение
Пролекарства МНР формул (I)-(IV) и фармацевтические композиции с ними можно вводить перорально или любым соответствующим путем, например, ингаляцией или болюсной инъекцией, посредством поглощения через эпителиальные или слизисто-кожные оболочки (например, слизистые оболочки полости рта, прямой кишки и тонкой кишки, и т.д.). Другие подходящие пути введение включают, но не ограничиваются перечисленным, интрадермальный, внутримышечный, интраперитонеальный, внутривенный, подкожный, интраназальный, эпидуральный, сублингвальный, интрацеребральный, интравагинальный, трансдермальный, ректальный, ингаляцию или местное введение.
Введение может быть системным или местным. Известны различные системы доставки, например, инкапсуляция в липосомах, микрочастицы, микрокапсулы, капсулы и т.д.), которые можно использовать для введения соединения и/или фармацевтической композиции.
Количество пролекарства MHF формул (I)-(IV), которое будет эффективным при лечении заболевания у пациента, будет зависеть, частично, от природы состояния, и может быть определено стандартными клиническими методами, известными в технике. Кроме того, в помощь идентификации оптимальных дозировочных интервалов можно использовать анализы in vitro или in vivo. Терапевтически эффективное количество пролекарства MHF формул (I)-(IV) для введения также может зависеть от, среди прочих факторов, субъекта, которого лечат, массы субъекта, тяжести заболевания, способа введения и решения лечащего врача.
Для системного введения терапевтически эффективную дозу можно сначала прикинуть в анализах in vitro. Например, на животных моделях можно прикинуть дозу для достижения благоприятного интервала концентраций в кровотоке. Начальные дозы также можно оценить из данных in vivo, например, для животных моделей, с использованием методов, которые известны в технике. Такую информацию можно использовать для более точного определения применимых доз для людей. Специалист в данной области техники может оптимизировать введение людям на основании результатов для животных.
Дозу можно вводить в одной лекарственной форме или нескольких лекарственных формах. Когда используют несколько лекарственных форм, количество соединения, содержащееся в каждой лекарственной форме, может быть одним и тем же или различным. Количество пролекарства MHF формул (I)-(IV), содержащееся в дозе, может зависеть от способа введения и того, лечится ли заболевание у пациента эффективно срочным или постоянным введением или сочетанием срочного и постоянного введения.
В некоторых воплощениях вводимая доза меньше, чем токсичная доза. Токсичность композиций, описанных в данном описании, можно определить стнадартными фармацевтическими процедурами в клеточных культурах или на подопытных животных, например, определяя LD50 (доза, летальная для 50% популяции) или LD100 (доза, летальная для 100% популяции). Соотношение для дозы между токсичным и терапевтическим действием представляет собой терапевтический индекс. В некоторых воплощениях пролекарство МНР может показывать высокий терапевтический индекс. Данные, полученные из таких анализов в клеточных культурах и исследованиях на животных, можно использовать при составлении дозировочного интервала, который не является токсичным для использования людьми. Доза пролекарства MHF по настоящему изобретению может находиться в интервале циркулирующих концентраций в, например, крови, плазме или центральной нервной системе, которые включают эффективную дозу и которые показывают слабую токсичность или ее отсутствие. Доза может изменяться в указанном интервале в зависимости от используемой лекарственной формы и используемого способа введения. В некоторых воплощениях может вводиться возрастающая доза.
Комбинированная терапия
Способы по настоящему изобретению также включают введение одного или нескольких фармацевтически активных соединений в дополнение к пролекарству MHF формул (I)-(IV). Такие соединения могут предоставляться для лечения того же заболевания, от которого лечат пролекарством MHF формул (I)-(IV), или другого заболевания.
В некоторых воплощениях пролекарство MHF формул (I)-(IV) можно использовать в комбинации с, по меньшей мере, одним другим терапевтическим средством. В некоторых воплощениях пролекарство MHF формул (I)-(IV) можно вводить пациенту вместе с другим соединением для лечения заболеваний и состояний, включающих иммунологические, аутоиммунные и/или воспалительные процессы, включая псориаз; астму; хронические обструктивные болезни легких и артрит; сердечную недостаточность, включая левожелудочковую недостаточность, инфаркт миокарда и стенокардию; митохондриальные и нейродегенеративные заболевания, такие как болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона, пигментная ретинопатия и митохондриальная энцефалопатия; отторжение трансплантата; аутоиммунные заболевания, включая рассеянный склероз (MS); ишемию и реперфузионное повреждение (повреждение генома, вызванное AGE); и другие. В некоторых воплощениях пролекарство MHF формул (I)-(IV) можно вводить пациенту вместе с другим соединением для лечения псориаза, рассеянного склероза, воспалительного заболевания кишечника, астмы, хронической обструктивной болезни легких и артрита.
Пролекарство MHF формул (I)-(IV) и, по меньшей мере, одно другое терапевтическое средство могут действовать аддитивно или, в некоторых воплощениях, синергично. По меньшей мере, одно дополнительное терапевтическое средство может быть включено в ту же лекарственную форму, что и пролекарство MHF формул (I)-(IV), или может быть предоставлено в отдельной лекарственной форме. Способы по настоящему изобретению также могут включать, кроме введения пролекарства MHF формул (I)-(IV), введение одного или нескольких терапевтических средств, эффективных для лечения того же заболевания, от которого лечат пролекарством MHF формул (I)-(IV), или другого заболевания. Способы по настоящему изобретению включают введение пролекарства MHF формул (I)-(IV) и одного или нескольких терапевтических средств, при условии, что комбинированное введение не подавляет терапевтическую эффективность пролекарства MHF и/или типично не приводит к существенному и/или значительному побочному действию комбинации.
В некоторых воплощениях лекарственные формы, включающие пролекарство MHF формул (I)-(IV), можно вводить одновременно с введением другого терапевтического средства, которое может являться частью той же лекарственной формы или лекарственной формы иной, чем форма, включающая пролекарство MHF формул (I)-(IV). Пролекарство MHF формул (I)-(IV) можно вводить до или после введения другого терапевтического средства. В некоторых воплощениях комбинированная терапия может включать чередование введения пролекарства MHF формул (I)-(IV) и композиции, включающей другое терапевтическое средство, например, для минимизации побочного действия лекарственного средства, связанного с определенным лекарственным средством. Когда пролекарство MHF формул (I)-(IV) вводят одновременно с другим терапевтическим средством, которое потенциально может вызывать побочное действие лекарственного средства, в том числе, но не только, токсичность, другое терапевтическое средство можно выгодно вводить в дозе, которая находится ниже порогового значения, при котором выявляется побочная реакция лекарственного средства.
В некоторых воплощениях лекарственные формы, включающие пролекарство MHF формул (I)-(IV), можно вводить с одним или несколькими веществами для усиления, модуляции и/или регулирования высвобождения, биологической доступности, терапевтической эффективности, терапевтической действенности, устойчивости и т.п. пролекарства MHF формул (I)-(IV). Например, для усиления терапевтической эффективности лиганда пролекарства MHF формул (I)-(IV) лекарственная форма, включающая пролекарство MHF формул (I)-(IV), может включать, или пролекарство MHF формул (I)-(IV) можно вводить совместно с одним или несколькими активными веществами, которые усиливают адсорбцию или диффузию пролекарства MHF формул (I)-(IV) из желудочно-кишечного тракта в общий кровоток или ингибируют разложение пролекарства MHF формул (I)-(IV) в крови пациента. В некоторых воплощениях пролекарство MHF формул (I)-(IV) можно вводить совместно с активным веществом, обладающим фармакологическим действием, которое усиливает терапевтическую эффективность пролекарства MHF формул (I)-(IV).
В некоторых воплощениях пролекарство MHF формул (I)-(IV) или фармацевтическую композицию с ним можно вводить пациенту для лечения псориаза в сочетании с терапией или другим терапевтическим средством, о которых известно или предполагается, что они эффективны при лечении псориаза. Лекарственные средства, применимые для лечения псориаза, включают стероиды, такие как флурандренолид, флуоцинонид, алклометазон, амцинонид, дезонид, галцинонид, триамцинолон, клобетазол, клокортолон, мометазон, дезоксиметазон и галобетазол; противоревматические средства, такие как этанерцепт, инфликсимаб и адалимумаб; иммуносупрессивные средства, такие как циклоспорин, алефацет и эфализумаб; псоралены, такие как метокссален; и другие средства, такие как кальципотриен, метотрексат, гидрокортизон/прамоксин, ацитретин, бетаметазон/кальципотриен, тазараотен, бензокаин/пириламин/оксид цинка и устекинумаб.
В некоторых воплощениях пролекарство MHF формул (I)-(IV) или фармацевтическую композицию с ним можно вводить пациенту для лечения воспалительного артрита, такого как ревматоидный артрит, ювенильный ревматоидный артрит, псориатический артрит и анкилозирующий спондилит, в сочетании с терапией или другим терапевтическим средством, о которых известно или предполагается, что они эффективны при лечении воспалительного артрита, такого как ревматоидный артрит, ювенильный ревматоидный артрит, псориатический артрит и анкилозирующий спондилит.
Лекарственные средства, применимые для лечения артрита, включают нестероидные противовоспалительные средства, такие как ибупрофен, кетопрофен, салицилат, диклофенак, набуметон, напроксен, мелоксикам, сулиндак, флурбипрофен, индометацин, толметин, пироксикам, фенопрофен, оксапрозин и этодолак; противоревматические средства, такие как этанерцепт, адалимумаб, инфликсимаб, гидроксихлорокин, лефлуномид, азатиоприн, пеницилламин, метотрексат, анакинра, ауранофин, ритуксимаб, ауротиоглюкозу, тоцилизумаб и голимумаб; ингибиторы сох-2, такие как целекоксиб и вадекгоксиб; кортикостероиды, такие как триамцинолон; глюкокортикоиды, такие как метилпреднизолон и преднизон; и другие средства, такие как сульфазалазин.
Лекарственные средства, применимые для лечения ювенильного ревматоидного артрита, включают адалимумаб, абатацепт и инфликсимаб.
Лекарственные средства, применимые для лечения псориатического артрита, включают этанерцепт, адалимумаб, триамцинолон, кортизон, инфликсимаб и голимумаб.
Лекарственные средства, применимые для лечения анкилозирующего спондилита, включают адалимумаб, целекоксиб, диклофенак, этанерцепт, голимумаб, индометацин, инфликсимаб, наптоксен, олсалазин, салицилаты, сульфиндак и триамцинолон.
В некоторых воплощениях пролекарство MHF формул (I)-(IV) или фармацевтическую композицию с ним можно вводить пациенту. для лечения псориатического артрита в сочетании с терапией или другим терапевтическим средством, о которых известно или предполагается, что они эффективны при лечении псориатического артрита. Лекарственные средства, применимые для лечения псориатического артрита, включают этанерцепт, адалимумаб, триамцинолон, кортизон, инфликсимаб и голимумаб.
В некоторых воплощениях пролекарство MHF формул (I)-(IV) или фармацевтическую композицию с ним можно вводить пациенту для лечения аутоиммунных заболеваний, таких как волчанка, в сочетании с терапией или другим терапевтическим средством, о которых известно или предполагается, что они эффективны при лечении аутоиммунных заболеваний, таких как волчанка. Лекарственные средства, применимые для лечения волчанки, включают гидроксихлукин, триамцинолон, салицилат, азатиоприн и абетимус.
В некоторых воплощениях пролекарство MHF формул (I)-(IV) или фармацевтическую композицию с ним можно вводить пациенту для лечения рассеянного склероза в сочетании с терапией или другим терапевтическим средством, о которых известно или предполагается, что они эффективны при лечении рассеянного склероза. Лекарственные средства, применимые для лечения рассеянного склероза, включают интерферон-β-1a, интерферон-β-1b, татарам ер, модафинил, азатиоприн, предизолон, микофенолатмофетил, митоксантрон и натализумаб. Другие примеры лекарственных средств, применимых для лечения MS, включают кортикостероиды, такие как метилпреднизолон, IFN-β, такие как IFN-β1a и IFN-β1b; ацетат глатирамера; моноклональные антитела, которые связываются с интегрином очень позднего антигена-4 (VLA-4), такие как натализумаб; иммуномодулирующие средства, такие как модулятор сфиногозин-1 -фосфата FTY 720, и ингибиторы СОХ-2, такие как BW755c, пироксикам и фенидон; и нейропротекторы, включая ингибиторы excitotoxicity и iNOS, поглотители свободных радикалов и блокаторы катионных каналов; мемантин; антагонисты АМРА, такие как топирамат; и антагонисты сайта NMDA глицина.
В некоторых воплощениях пролекарство MHF формул (I)-(IV) или фармацевтическую композицию с ним можно вводить пациенту для лечения воспалительного заболевания кишечника в сочетании с терапией или другим терапевтическим средством, о которых известно или предполагается, что они эффективны при лечении воспалительного заболевания кишечника. Лекарственные средства, применимые для лечения воспалительного заболевания кишечника, включают хромолин и меркаптопурин; и, особенно для лечения болезни Крона, включают цертолизумаб, будезонид, азатиоприн, сульфазалазин, метронидазол, адалимумаб, меркаптопурин, инфликсимаб, мезаламин и натализумаб; и для лечения неспецифического язвенного колита включают бальсалазид, инфликсимаб, азатиоприн, мезаламин и циклоспорин.
В некоторых воплощениях пролекарства MHF по настоящему изобретению и фармацевтические композиции с ними можно вводить пациенту для лечения астмы в сочетании с терапией или другим терапевтическим средством, о которых известно или предполагается, что они эффективны при лечении астмы или, в некоторых воплощениях, заболевания, расстройства или состояния, связанного с астмой. Примеры лекарственных средств, применимых для лечения астмы, включают альбутерол, аминофиллин, беклометазон, битолтерол, будезонид, кромолин, эфедрин, эпирефрин, флунизолид, флутиказон, формотерол, гидрокортизон, изопротеренол, левалбутерол, метилпреднизолон, преднизолон, преднизон, пирбутерол, метапротеренол, раципинефрин, омализумаб, окситрифиллин, мометузон, монтелукаст, недоскромил, окстрифиллин, сальметерол, тербуталин, теофиллин, триамцинолон, зафирлукаст и зилейтон.
В некоторых воплощениях пролекарства MHF по настоящему изобретению и фармацевтические композиции с ними можно вводить пациенту для лечения хронической обструктивной болезни легких в сочетании с терапией или другим терапевтическим средством, о которых известно или предполагается, что они эффективны при лечении хронической обструктивной болезни легких или, в некоторых воплощениях, заболевания, расстройства или состояния, связанного с обструктивной болезнью легких. Примеры лекарственных средств, применимых для лечения обструктивной болезни легких, включают альбутерол, арформотерол, азитромицин, битолтерол, эпинефрин, флутиказон, формотерол, ипратропий, изопротеренол, левабутерол, метапротеренол, пирбутерол, рацепинефрин, сальметерол и тиотропий. Лекарственные средства, применимые для лечения хронической обструктивной болезни легких, также включают бронходилататоры, такие как агонисты β2, такие как сальбутамол, бамбутерол, кленбутерол, фенотерол и формотерол; средства против мускарина М3, такие как ипратропий; антагонисты лейкотриена, такие как монтелукаст, пранлукаст и зафирлукаст; кромоны, такие как кромогликат и недокромил; ксантины, такие как теофиллин; кортикостероиды, такие как беклометазон, мометазон и флутиказон; и антагонисты TNF, такие как инфликсимаб, адалимумаб и этанерцепт. Другие способы лечения хронической обструктивной болезни легких включают кислородную терапию и реабилитацию легких.
В некоторых воплощениях пролекарства по настоящему изобретению и фармацевтические композиции с ними можно вводить пациенту для лечения ангиогенеза в сочетании с терапией или другим терапевтическим средством, о которых известно или предполагается, что они эффективны при лечении ангиогенеза. Лекарственные средства, применимые для лечения ангиогенеза, включают ангиостатин, эндостатин, витаксин, бевацизумаб, талидомид, батимастат, маримастст, карбоксиамидотриазол, TNP-470, СМ 101, IFN-a, IL-12, фактор тромбоцитов 4, сурамин, SU5416, тромбоспондин, VEGFR, ангиостатические стероиды, фактор ингибирования ангиогенеза из хряща, ингибитоы металлопротеиназ матрикса, 2-метоксиэстрадиол, текогалан, пролактин, ингибиторы αvβ3 и линомид.
В некоторых воплощениях пролекарства по настоящему изобретению и фармацевтические композиции с ними можно вводить пациенту для лечения отторжения трансплантата в сочетании с терапией или другим терапевтическим средством, о которых известно или предполагается, что они эффективны при лечении отторжения трансплантата. Лекарственные средства, применимые для лечения отторжения трансплантата, включают ингибиторы кальцинеурина, такие как циклоспорин и такролимус, ингибиторы mTOR, такие как сиролимус и эверолимус, антипролиферативные средства, такие как азатиопирин и микофеноловая кислота; кортикостероиды, моноклональные антитела против рецептора IL2Rα, включая базиликсимаб и даклизумаб; и поликлоанльные анти-T-клеточные антитела, включая антитимоцитарный глобулин и антилимфоцитарный глобулин.
В некоторых воплощениях пролекарства по настоящему изобретению и фармацевтические композиции с ними можно вводить пациенту для лечения отторжения трансплантата в сочетании с терапией или другим терапевтическим средством, о которых известно или предполагается, что они эффективны при лечении отторжения трансплантата. Лекарственные средства, применимые для лечения отторжения трансплантата, включают кортикостероиды, такие как дексаметазон, преднизолон и преднизон; глобулины, такие как антитимоцитарный глобулин и антилимфоцитарный глобулин; макролидные иммунодеперссанты, такие как сиролимус, ткролимус и эверолимус; ингибиторы митоза, такие как азатиприн, циклофосфамид и метотрексат; моноклональные антитела, такие как бизиликсимаб, даклизумаб, инфликсимаб, муромоноаб; грибковые метаболиты, такие как циклоспорин; и другие средства, такие как глатирамер и микофенолат.
В некоторых воплощениях пролекарства по настоящему изобретению и фармацевтические композиции с ними можно вводить пациенту для лечения сердечной недостаточности в сочетании с терапией или другим терапевтическим средством, о которых известно или предполагается, что они эффективны при лечении сердечной недостаточности. Лекарственные средства, применимые для лечения сердечной недостаточности, включают антитензинмодулирующие средства, диуретики, такие как фуросемид, буметания, гидрохлортиазид, хлортиалидон, хлоритиазид, спиронолактон, эплеренон; бета-блокаторы, такие как бисопролол, карведилол и метропролол; положительные инотропы, такие как дигоксин, милринон и добутамин; альтернативные вазодилататоы, такиекак динитрат изосорбида/гидралазин; антагонисты альдостероновых рецепторов; рекомбинантные нейроэндокринные гормоны, такие как незиритид; и антагонисты вазопрессиновых рецепторов, такие как толваптан и кониваптан.
В некоторых воплощениях пролекарства по настоящему изобретению и фармацевтические композиции с ними можно вводить пациенту для лечения митохондриального заболевания, такого как нейродегенеративное расстройство, в сочетании с терапией или другим терапевтическим средством, о которых известно или предполагается, что они эффективны при лечении митохондриального заболевания, такого как нейродегенеративное расстройство. В некоторых воплощениях нейродегенеративное расстройство выбирают из болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона и бокового амиотрофического склероза.
Терапевтические средства для лечения болезни Паркинсона включают предшественники дофамина, такие как левопода, агонисты дофамина, такие как бромокриптин, перголид, прамипексол и ропинирол, ингибиторы МАО-В, такие как селегилин, антихолинергические лекарственные средства, такие как бензотропин, тригексифенидил, трициклические антидепрессанты, такие как амитриптилин, амоксапин, кломипрамин, дезипрамин, доксепин, имипрамин, мапротилин, нортриптилин, протриптилин, амантадин и тримипрамин, некоторые антигистаминные средства, такие как дифенгидрамин; противовирусные лекарственные средства, такие как амантадин; и бета-блокаторы, такие как пропранолол.
Применимые лекарственные средства для лечения болезни Альцгеймера включают розиглитазон, ролоксифен, витамин Е, донепезил, такрин, ривастигмин, галантамин и мемантин.
Применимые лекарственные средства для лечения болезни Гентингтона включают антипсихотические средства, такие как галоперидол, хлорпромазин и оланзапин, для борьбы с галлюцинациями, бредом и буйными вспышками; антидепрессанты, такие как флуоксетин, сертралин и нортриптилин, для борьбы с депрессией и обсессивно-компульсивным поведением; транквилизаторы, такие как бензодиазепины, пароксетин, венфлаксин и бета-блокаторы, для борьбы с тревогой и хореей; стабилизаторы настроения, такие как литий, валпроат и карбамзепин, для борьбы с маниями и биполярным расстройством; и ботулинический токсин для борьбы с дистонией и стискиванием челюстей. Применимые лекарственные средства для лечения симптомов болезни Гентингтона также включают селективные ингибиторы повторного поглощения серотонина (SSRI), такие как флуоксетин, сертралин, эскиталопрам, циталопрам, флувозамин; ингибиторы повторного поглощения норэпинефрина и серотонина (NSRI), такие как венлафаксин и дулоксетин, бензодиазепины, такие как клоназепам, альпразолам, диазепам и лоразепам, трициклические антидепрессанты, такие как амитриптилин, нортриптилин и имипрамин; и атипичные антидепрессанты, такие как бузипирон, буприопин и миртазепин, для лечения симптомов тревоги и депрессии; атомоксетин, декстроамфетамин и модафинил для лечения симптомов апатии; амантадин, мемантин и тетрабеназин для лечения симптомов хореи; циталопрам, атомоксетин, мемантин, ривастигмин и донепезил для лечения когнитивных симптомов; лоразепам и тразедон для лечения инсомнии; вальпроат, карбамазепин и ламотригин для лечения симптомов разражимости; антидепрессанты SSRI, такие как флуоксетин, пароксетин, серталин и флувоксамин, антидепрессанты NSRI, такие как венлафаксин, и другие средства, такие как миртазепин, кломипрамин, ломотригин, габапентин, вальроат, карбамазепин, оланзапин, риспиридон и кветипин, для лечения симптомов обсессивно-компульсивного расстройства; галоперидол, кветиапин, клозапин, риспиридон, оланзапин, зипразидон и арипипразол для лечения психоза; и прамипексол, леводопа и амантадин для лечения ригидности.
Применимые лекарственные средства для лечения ALS включают рилузол. Другие лекарственные средства, потенциальные для применения при лечении ALS, включают мемантин, тамоксифен, талидомид, цефтриаксон, фенилбутират натрия, целекоксиб, ацетат глатирамера, бузипирон, креатин, миноциклин, коэнзим Q10, оксандролон, IGF-1, топирамат, ксалипроден и индинавир. Лекарственные средства, такие как баклофен и диазепам, могут применяться при лечении спастичности, ассоциированной с ALS.
В некоторых воплощениях пролекарство MHF формул (I)-(IV) или фармацевтическую композицию с ним можно вводить пациенту в сочетании с терапией или другим терапевтическим средством, о которых известно или предполагается, что они эффективны при ингибировании функции TNF.
Примеры лекарственных средств, известных для ингибирования функции TNF, включают инфликсимаб, адалимумаб. Этанерцепт, цертолизумаб, голимумаб, пентоксифиллин, кванилгидрозон, талидомид, флавониды, такие как наригенин, ресвератол и квецетин, алалоиды, такие как ликорин, терпены, такие как акантовая кислота, жирные кислоты, такие как 13-НОА, и ретиноиды, такие как ретиноевая кислота.
Примеры
Приведенные далее примеры подробно описывают синтез пролекарств MHF формул (I)-(IV), свойства пролекарств MHF формул (I)-(IV) и применение пролекарств MHF формул (I)-(IV). Для специалистов в данной области техники будет очевидно, что на практике можно осуществить множество модификаций как материалов, так и способов, без отхода от объема раскрытия.
Общие протоколы экспериментов
Все реагенты и растворители, которые закупают у коммерческих поставщиков, используют без дополнительной очистки или процедур манипуляций.
Спектры протонного ЯМР (400 МГц) и углеродного ЯМР (125 МГц) регистрируют на ЯМР-спектрометре Varian AS 400, снабженном автоматическим пробоотборником и программой обработки данных. В качестве растворителей используют CDCl3 (99,8% D), ДМСО-d6 (99,9% D) или MeOH-d4 (99,8+% D) и ацетонитрил-d3, если не указано иное. Сигналы растворителей CHCl3, ДМСО-d5 или MeOH-d3 используют для калибровки отдельных спектров. Аналитическую тонкослойную хроматографию (ТСХ) осуществляют с использованием ТСХ Whatman, Schleicher & Schuell, и силикагелевых пластинок MK6F (2,5×7,5 см, толщина слоя 250 мкм). Температуры плавления регистрируют в стеклянных капиллярах с использованием системы Stanford Research Systems (SRS) Optimelt Automated Melting Point, S/N 78047. Аналитическую ЖХ/МС осуществляют на модуле разделения Waters 2790, снабженном масс-спектрометром Waters Micromass QZ, фотодиодным детектором Waters 996 и аналитической колонкой Merck Chromolith UM2072-027 или Phenomenex Luna С-18. Очистку массовой (mass-guided) препаративной ВЭЖХ конечных соединений осуществляют с использованием прибора, снабженного контроллером Waters 600, микромасс-спектрометром ZMD, детектором с фотодиодной матрицей Waters 2996 и устройством управления образцами Waters 2700. Смеси ацетонитрил/вода с градиентом, содержащие 0,05% муравьиной кислоты, используют в экспериментах в качестве элюентов как в аналитической, так и препаративной ВЭЖХ. Выделение соединений из водных смесей растворителей, например, ацетонитрил/вода/0,05% муравьиной кислоты, выполняют путем первичной лиофилизации (сушка вымораживанием) замороженных растворов при пониженном давлении при комнатной температуре с использованием различных сублимационных сушилок, таких как Heto Drywinner DW 6-85-1, Heto FD4 или VIRTIS Freezemobile 25 ES, снабженных высоковакуумными насосами. Когда выделяемое соединение имеет ионизируемые функциональные группы, такие как аминогруппа или карбоксильная группа, лиофилизацию осуществляют в присутствии небольшого избытка одномолярной (1 М) хлороводородной кислоты, и получают очищенные соединения в виде соответствующих гидрохлоридов (соли HCl) или соответствующих протонированных свободных карбоновых кислот. Когда выделяемое соединение имеет ионизируемые функциональные группы, такие как карбоксильная группа, лиофилизацию осуществляют в присутствии эквимолярных количеств гидрокарбоната натрия (NaHCO3), и получают очищенные соединения в виде соответствующих натриевых солей (соли Na). Необязательно выделенные вещества дополнительно очищают колоночной флэш-хроматографией на силикагеле, необязательно, с использованием предварительно заполненных силикагелем картриджей Biotage. Подходящие органические растворители, такие как этилацетат (EtOAc), гексан (HXN), н-гептан (Hptn) или их смеси и/или градиенты используют в качестве элюентов, и после выпаривания растворителей получают целевые соединения в виде бесцветных вязких масел или твердых веществ. Химические названия получают с помощью программы Chemistry 4-D Draw Pro Version 7.01 с (Draw Chemical Structures Intelligently® 1993-2002) от Chemilnnovation Software, Inc., San Diego, USA.
Коммерчески недоступные соответственно функционализированные или замещенные 2-галогенацетамиды, производные 2-галогенуксусной кислоты, 2-гидроксиацетамиды, производные 2-гидроксиуксусной кислоты, ацилоксиалкилгалогениды или алкокси- или арилоксикарбонилоксиалкилгалогениды синтезируют из коммерчески доступных исходных веществ и с адаптированием способов, хорошо известных в технике.
Общие синтетические способы
Общий способ А: нуклеофильное замещение 1-галогенацетамидов или производных 1-галогенуксусной кислоты монометилфумаратом
(2Е)-3-(Метоксикарбонил)проп-2-еновую кислоту (метилгидрофумарат, МНР), (2Е)-3-(трет-бутоксикарбонил)проп-2-еновую кислоту (трет-бутилгидрофумарат) или фумаровую кислоту (FA) (1,0 эквивалент) растворяют в 5-10 мл/3,0 ммоль инертного растворителя, такого как N-метилпирролидон (NMP), N,N-диметилфомамид (ДМФА), N,N-диметилацетамид (DMA, DMAc), ацетонитрил (MeCN), диметилсульфоксид (ДМСО), тетрагидрофуран (ТГФ), толуол или их смеси. К раствору добавляют 0,8-1,2 эквивалентов соответствующего неорганического основания, такого как гидрокарбонат цезия (CsHCO3), карбонат цезия (Cs2CO3) или карбонат калия (K2CO3). С другой стороны, можно использовать 0,8-1,2 эквивалента соли серебра, такой как оксид серебра(1) (Ag2O) или карбонат серебра(1) (Ag2CO3); органическое вторичное или третичное основание, такое как дициклогексиламин (DCHA), триэтиламин (TEA), диизопропилэтиламин (DIEA), гидроксид тетрабутиламмония (ТВАОН), амидин; или основание на основе гуанидина, такое как 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) или 1,1,3,3-тетраметилгуанидин (TMG). Также можно получить соответствующую соль щелочного металла, серебра, ди-, три- и тетраалкиламмония, амидина или гуанидина моноалкилфумарата. Раствор перемешивают в течение 10-60 мин при комнатной температуре, и затем добавляют 0,8-1,2 эквивалента соответственно фунционализированного 1-галогенацетамида, производного 1-галогенуксусной кислоты, ацилоксиалкилгалогенида или алкил- или арилоксикарбонилоксиалкилгалогенида. Реакционную смесь перемешивают в течение ночи при температуре от 40 до 100°С. После охлаждения до комнатной температуры нерастворимые вещества можно, необязательно, отфильтровать, и реакционную смесь разбавляют одномолярной (1 М) хлороводородной кислотой (HCl) и соответствующим органическим растворителем, таким как метил-трет-бутиловый эфир (МТВЕ), диэтиловый эфир (Et2O), этилацетат (EtOAc) или их смеси. После разделения фаз водную фазу экстрагируют несколько раз тем же растворителем. Объединенные органические экстракты промывают водой и рассолом и сушат над безводным сульфатом магния (MgSO4). После фильтрации органические растворители удаляют при пониженном давлении с использованием роторного испарителя. При необходимости сырые продукты реакции дополнительно очищают хорошо известными способами очистки, такими как колоночная флэш-хроматография на силикагеле (т.е., на Biotage), массовая препаративная ВЭЖХ с обращенной фазой/лиофилизация, осаждение или кристаллизация.
Общий способ В1: активация производных карбоновой кислоты агентами дегидратации для аминолиза или алкоголиза
(2Е)-3-(Метоксикарбонил)проп-2-еновую кислоту (метилгидрофумарат, MHF), [(2Е)-3-(метоксикарбонил)проп-2-еноилокси]уксусную кислоту (23) или [(2Е)-3-(метоксикарбонил)проп-2-еноилокси]пропановую кислоту (24) (1,0 эквивалент) при температуре от ca. 0°С (ледяная баня) до комнатной температуры вводят во взаимодействие с агентом дегидратации карбодиимидом, таким как 1-этил-3-(3-диметиламинопропил)карбодиимид (EDAC, EDC), N,N'-диизопропилкарбодиимид (DIC), N,N-дициклогексилкарбодиимид (DCC), в инертном растворителе, таком как дихлорметан (DCM), N,N-диметилформамид (ДМФА), N-метилпирролидон (NMP или N,N-диметилацетамид (DMA, DMAc) (ca. 3 мл/ммоль). При температуре от ca. 0°С до комнатной температуры добавляют 1,0-1,5 эквивалента соответственно функционализированного амина или 2-гидроксиацетамида, растворенного в том же растворителе, и, необязательно, в присутствии каталитического или стехиометрического количества 4-(N,N-диметиламино)пиридина (DMAP). Когда амин находится в солевой форме, можно добавить эквимолярное количество органического третичного основания, такого как триэтиламин (TEA) или диизопропиламин (DIEA), для освобождения основания-амина перед стадией сочетания. Реакционную смесь перемешивают в течение 4-12 часов при комнатной температуре. Необязательно, органические основания удаляют при пониженном давлении с использованием роторного испарителя, и остаток разбавляют подходящим для экстракции растворителем, таким как диэтиловый эфир (Et2O), метил-трет-бутиловый эфир (МТВЕ), этилацетат (EtOAc), или другим растворителем. Для выделения и очистки продукта реакции можно использовать процедуры, описанные в способе А.
Общий способ В2: активация производных карбоновой кислоты хлорирующими агентами и аминолиз
[(2Е)-3-(Метоксикарбонил)проп-2-еноилокси]уксусную кислоту (23) или [(2Е)-3-(метоксикарбонил)проп-2-еноилокси]пропановую кислоту (24) (1,0 эквивалент) при температуре ca. 0°С (ледяная баня) вводят во взаимодействие с оксалилхлоридом (1,0-1,5 эквивалента) в безводном дихлорметане (DCM), ca. 3 мл/ммоль, в присутствии каталитического количества N,N-диметилформамида (ДМФА) в течение 1-3 часов. Растворители удаляют при пониженном давлении с использованием роторного испарителя, и сырой материал растворяют в безводном дихлорметане (DCM), ca. 3 мл/ммоль. При ca. 0°С (ледяная баня) добавляют по каплям раствор 1,0-1,5 эквивалентов соответственно функционализированного нуклеофила (первичного или вторичного амина или спирта) в безводном дихлорметане (DCM), ca. 3 мл/ммоль, необязательно в присутствии каталитического количества 4-(N,N-диметиламино)пиридина (DMAP). Когда аминный компонент находится в солевой форме, добавляют эквимолярное количество основания, такого как триэтиламин (TEA), диизопропиламин (DIEA) или другое, для освобождения основания-амина перед стадией сочетания. Реакционную смесь перемешивают в течение ночи с нагреванием до комнатной температуры, необязательно, растворители удаляют при пониженном давлении с использованием роторного испарителя, и затем остаток разбавляют подходящим для экстракции растворителем, таким как диэтиловый эфир (Et2O), метил-трет-бутиловый эфир (МТВЕ), этилацетат (EtOAc), или другим растворителем. Для выделения и очистки продукта реакции можно использовать процедуры, описанные в способе А.
Пример 1
(N,N-Диэтилкарбамоил)метил(2Е)бут-2-ен-1,4-диоат (1)
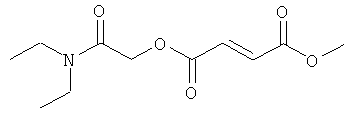
Следуя общему способу А, метилгидрофумарат (МНР) (0,39 г, 3,00 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с 2-хлор-N,N-диэтилацетамидом (0,44 г, 3,00 ммоль) в присутствии CsHCO3 (0,69 г, 3,60 ммоль), и после очистки колоночной хроматографией на силикагеле (Biotage) с использованием в качестве элюента смеси этилацетата (EtOAc) и гексана (1:1) получают 0,37 г (выход 51%) названного в заголовке соединения (1). Т.пл. 53-56°С. 1Н ЯМР (CDCl3, 400 МГц): δ 6,99-6,90 (м, 2Н), 4,83 (с, 2Н), 3,80 (с, 3Н), 3,39 (к, J=7,2 Гц, 2Н), 3,26 (к, J=7,2 Гц, 2Н), 1,24 (т, J=7,2 Гц, 3Н), 1,14 (т, J=7,2 Гц, 3Н). MS (ESI): m/z 244,13 (М+Н)+.
Пример 2 Метил[N-бензилкарбамоил]метил(2Е)бут-2-ен-1,4-диоат (2)

Следуя общему способу А, метилгидрофумарат (MHF) (0,50 г, 3,85 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с N-бензилхлорацетамидом (0,84 г, 4,61 ммоль) в присутствии CsHCO3 (0,89 г, 4,61 ммоль), и после очистки массовой препаративной ВЭЖХ (Biotage) и лиофилизации получают 0,56 г (выход 53%) названного в заголовке соединения (2) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц): δ 7,36-7,26 (м, 5Н), 6,94-6,88 (м, 2Н), 6,19 (ушс, 1Н), 4,73 (с, 2Н), 4,51 (д, J=5,6 Гц, 2Н), 3,81 (с, 3Н). MS (ESI): m/z 278,04 (М+Н)+.
Пример 3
Метил-2-морфолин-4-ил-2-оксоэтил(2Е)бут-2-ен-1,4-диоат (3)
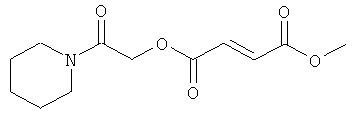
Следуя общему способу А, метилгидрофумарат (MHF) (0,50 г, 3,84 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с 4-(хлорацетил)морфолином (0,75 г, 4,61 ммоль) в присутствии CsHCO3 (0,89 г, 4,61 ммоль), и после очистки массовой препаративной ВЭЖХ (Biotage) и лиофилизации получают 0,34 г (выход 35%) названного в заголовке соединения (3) в виде белого твердого вещества. Т.пл. 124-126°С. 1Н ЯМР (CDCl3, 400 МГц): δ 6,97-6,91 (м, 2Н), 4,84 (с, 2Н), 3,82 (с, 3Н), 3,72-3,70 (м, 4Н), 3,64-3,62 (м, 2Н), 3,46-3,41 (м, 2Н). MS (ESI): m/z 258,04 (М+Н)+.
Пример 4
(N-Бутилкарбамоил)метилметил(2Е)бут-2-ен-1,4-диоат (4)
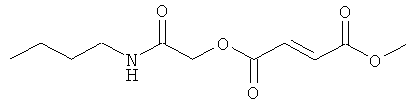
Следуя общему способу А, метилгидрофумарат (MHF) (0,50 г, 3,84 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с N-бутилхлорацетамидом (0,69 г, 4,61 ммоль) в присутствии CsHCO3 (0,89 г, 4,61 ммоль), и после очистки массовой препаративной ВЭЖХ (Biotage) и лиофилизации получают 0,19 г (выход 21%) названного в заголовке соединения (4) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц): δ 6,98-6,92 (м, 2Н), 6,09 (ушс, 1Н), 4,68 (с, 2Н), 3,82 (с, 3Н), 3,34-3,29 (к, 2Н, J=6,4 Гц), 1,54-1,48 (м, 2Н), 1,38-1,32 (м, 2Н), 0,956-0,920 (т, J=7,6 Гц, 3Н). MS (ESI): m/z 244,04 (М+Н)+.
Пример 5
[N-(2-Метоксиэтил)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат (5)

Следуя общему способу А, метилгидрофумарат (MHF) (0,50 г, 3,84 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с N-(2-метоксиэтил)хлорацетамидом (0,69 г, 4,60 ммоль) в присутствии CsHCO3 (0,89 г, 4,61 ммоль), и после очистки массовой препаративной ВЭЖХ и лиофилизации получают 0,07 г (выход 8%) названного в заголовке соединения (5) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц): δ 6,94-6,92 (м, 2Н), 6,46 (ушс, 1Н), 4,68 (с, 2Н), 3,83 (с, 3Н), 3,52-2,46 (м, 4Н), 3,36 (с, 3Н). MS (ESI): m/z 245,98 (М+Н)+.
Пример 6
2-{2-[(2Е)-3-(Метоксикарбонил)проп-2-еноилокси1ацетиламино} уксусная кислота (6)
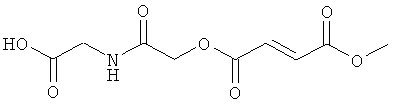
Следуя общему способу А, метилгидрофумарат (MHF) (0,68 г, 5,26 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с трет-бутил-2-(2-хлорацетиламино)ацетатом (0,91 г, 4,38 ммоль) в присутствии CsHCO3 (1,19 г, 6,13 ммоль) (с образованием) промежуточного соединения с защитной трет-бутильной группой, с последующей очисткой колоночной хроматографией на силикагеле (Biotage) с использованием в качестве элюента смеси этилацетата (EtOAc) и гексана (1:2-2:3-1:1). Очищенный продукт обрабатывают 50% трифторуксусной кислотой (ТФК) в дихлорметане (DCM). Удаление растворителей дает 0,13 г (выход 12%) названного в заголовке соединения (6). 1Н ЯМР (CD3OD, 400 МГц): δ 6,96-6,93 (м, 2Н), 4,74 (с, 2Н), 3,98-3,95 (м, 2Н), 3,81 (с, 3Н). MS (ESI): m/z 246,00 (M+H)+, 244,02 (М-Н)-.
Пример 7
4-{2-[(2E)-3-(метоксикарбонил)проп-2-еноилокси]ацетиламино}бутановая кислота (7)

Следуя общему способу A, метилгидрофумарат (MHF) (0,56 г, 4,33 ммоль), растворенный в NMP, при са. 55°C вводят во взаимодействие с трет-бутил-4-(2-хлорацетиламино)бутаноатом (0,85 г, 3,61 ммоль) в присутствии CsHCO3 (0,98 г, 5,05 ммоль) (с образованием) промежуточного соединения с защитной трет-бутильной группой, с последующей очисткой колоночной хроматографией на силикагеле (Biotage) с использованием в качестве элюента смеси этилацетата (EtOAc) и гексана (1:1). Очищенный продукт обрабатывают 50% трифторуксусной кислотой (ТФК) в дихлорметане (DCM). Удаление растворителей дает 0,45 г (выход 46%) названного в заголовке соединения (7). 1H ЯМР (CD3OD, 400 МГц): δ 6,94-6,91 (м, 2H), 4,65 (с, 2H), 3,81 (с, 3H), 3,28 (т, J=6,8 Гц, 2Н), 2,33 (т, J=7,2 Гц, 2Н), 1,81 (п, J=7,1 Гц, 2Н). MS (ESI): m/z 274,03 (M+H)+, 272,06 (M-H)-.
Пример 8
Метил(N-(1,3,4-тиадиазол-2-ил)карбамоил)метил(2E)бут-2-ен-1,4-диоат (8)
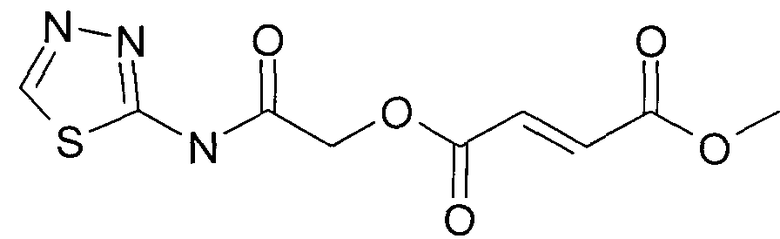
Следуя общему способу A, метилгидрофумарат (MHF) (0,50 г, 3,84 ммоль), растворенный в NMP, при са. 55°C вводят во взаимодействие с 2-хлор-N-1,3,4-тиадиазол-2-илацетамидом (0,81 г, 4,61 ммоль) в присутствии CsCHO3 (0,89 г, 4,61 ммоль). Выпавший в осадок сырой материал несколько раз промывают дихлорметаном (DCM) для дополнительной очистки, и получают 0,12 г (выход 12%) названного в заголовке соединения (8) в виде белого твердого вещества. 1H ЯМР (CD3OD, 400 МГц): δ 9,06 (с, 1H), 6,95-6,91 (м, 2H), 4,99 (с, 2H), 3,82 (с, 3H). MS (ESI): m/z 272,07 (M+H)+.
Пример 9
(N,N-Диметилкарбамоил)метил-метил(2E)бут-2-ен-1,4-диоат (9)

Следуя общему способу А, метилгидрофумарат (MHF) (0,50 г, 3,84 ммоль), растворенный в NMP, при са. 55C вводят во взаимодействие с N,N-диметилхлорацетамидом (0,56 г, 4,61 ммоль) в присутствии CsHCO3 (0,89 г, 4,61 ммоль). Сырой материал высаживают из смеси этилацетат (EtOAc) и гексана (Hxn) (1:1), и получают белое твердое вещество. Затем полученное твердое вещество растворяют в дихлорметане (DCM), и органический слой промывают водой. После удаления растворителей получают 0,55 г (выход 67%) названного в заголовке соединения (9) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц): 5 6,98-6,90 (м, 2Н), 4,84 (с, 2Н), 3,80 (с, 3Н), 2,99-2,97 (2 с, 6Н). MS (ESI): m/z 216 (М+Н)+.
Пример 10
(N-Метокси-N-метилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат (10)
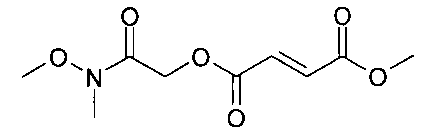
Следуя общему способу А, метилгидрофумарат (MHF) (0,50 г, 3,84 ммоль), растворенный в NMP, при са. 55C вводят во взаимодействие с N-метил,N-гидроксиметилхлорацетамидом (0,63 г, 4,61 ммоль) в присутствии CsHCO3 (0,89 г, 4,61 ммоль). Сырой материал высаживают из концентрированного раствора в этилацетате (EtOAc). Твердое вещество отфильтровывают и сушат в вакууме, и получают 0,54 г (выход 61%) названного в заголовке соединения (10) в виде белого твердого вещества. 1Н ЯМР (CD3OD, 400 МГц): 6 6,92-6,89 (м, 2Н), 5,01 (с, 2Н), 3,80 (с, 3Н), 3,78 (с, 3Н), 3,20 (с, 3Н).
MS (ESI): m/z 232,06 (М+Н)+.
Пример 11
Бис-[(2-метоксиэтил)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат (11)
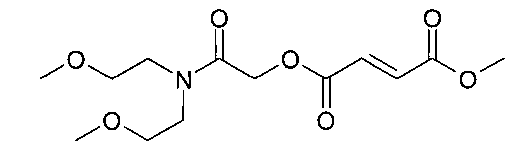
Следуя общему способу А, метилгидрофумарат (MHF) (0,50 г, 3,84 ммоль), растворенный в NMP, при са. 55C вводят во взаимодействие с бис-(2-метоксиэтил)хлорацетамидом (0,96 г, 4,61 ммоль) в присутствии CsHCO3 (0,89 г, 4,61 ммоль), и после очистки массовой препаративной ВЭЖХ и лиофилизации получают 0,53 г (выход 46%) названного в заголовке соединения (11) в виде белого твердого вещества. Т.пл. 79-82C. 1Н ЯМР (CDCl3, 400 МГц): 5 6,98-6,88 (м, 2Н), 4,98 (с, 2Н), 3,8 (с, 3Н), 3,57-
3,50 (м, 8Н), 3,41 (с, 3Н), 3,31 (с, 3Н). MS (ESI): m/z 304,14 (М+Н)+.
Пример 12
[N-(Метоксикарбонил)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат (12)
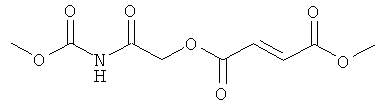
Следуя общему, способу А, метилгидрофумарат (MHF) (0,50 г, 3,84 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с метил-N-(2-хлорацетил)карбаматом (0,69 г, 4,61 ммоль) в присутствии CsHCO3 (0,89 г, 4,61 ммоль). Сырой материал высаживают из раствора в диэтиловом эфире (Et2O). Твердое вещество отфильтровывают, промывают несколько раз дихлорметаном (DCM) и сушат в вакууме, и получают 0,19 г (выход 21%) названного в заголовке соединения (12) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц): δ 6,99-6,91 (м, 2Н), 5,23 (с, 2Н), 3,81 (с, 6Н). MS (ESI): m/z 246,09 (М+Н)+, 268,00 (M+Na)+.
Пример 13
[N-(2-{2-[(2Е)-3-(Метоксикарбонил)проп-2-еноилокси]ацетиламино}этил)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат (13)

Следуя общему способу А, метилгидрофумарат (MHF) (0,73 г, 5,61 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие N-(2-[2-хлорацетил]аминоэтил)-2-хлоацетамидом (0,50 г, 2,34 ммоль) в присутствии CsHCO2 (1,08 г, 5,61 ммоль). Сырой материал высаживают из концентрированного раствора в диэтиловом эфире (Et2O). Твердое вещество отфильтровывают, промывают несколько раз дихлорметаном (DCM) и сушат в вакууме, и получают 0,90 г (выход 96%) названного в заголовке соединения (13) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДМСО-d6): δ 8,23 (ушс, 2Н), 6,96-6,92 (м, 4Н), 4,58 (с, 4Н), 3,79 (с, 6Н), 3,16 (м, 4Н). MS (ESI): m/z 401,05(M+H)+.
Пример 14
Гидрохлорид метил-2-оксо-2-пиперазинэтил(2Е)бут-2-ен-1,4-диоата (14)
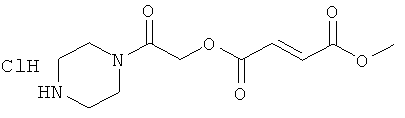
Следуя общему способу А, метилгидрофумарат (MHF) (1,00 г, 7,68 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с 1-(трет-бутилоксикарбонил)-4-хлорацетилпиперазином (2,42 г, 9,22 ммоль) в присутствии CsHCO3 (1,78 г, 9,22 ммоль). После обработки и удаления растворителя получают сырой материал в виде белого твердого вещества. Твердое вещество при комнатной температуре вводят во взаимодействие с 15 мл 4-молярного (4 М) раствора хлороводорода (HCl) в 1,4-диоксане. После удаления растворителей твердый гидрохлорид дополнительно очищают массовой препаративной ВЭЖХ, и после лиофилизации растворителей в присутствии избытка 1-нормальной (1 N) соляной кислоты получают 0,93 г (выход 41%) названного в заголовке соединения (14) в виде белого твердого вещества. 1Н ЯМР (D2O, 400 МГц): δ 6,93-6,86 (м, 2Н), 4,92 (с, 2Н), 3,70-3,63 (м, 7Н), 3,32 (т, J=5,2 Гц, 2Н), 3,17 (т, J=6 Гц, 2Н). MS (ESI): m/z 257,13 (M+H)+.
Пример 15
Метил-2-(4-бензилпиперазинил)-2-оксоэтил(2Е)бут-2-ен-1,4-диоат (15)
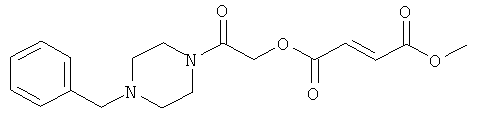
Гидрохлорид метил-2-оксо-2-пиперазинэтил-(2Е)бут-2-ен-1,4-диоата (14) (0,50 г, 1,71 ммоль) при ca. 0°С вводят во взаимодействие с бензилбромидом (BnBr) (0,243 мл, 0,35 г, 2,05 ммоль) и диизопропилэтиламином (DIEA) (1,00 мл, 0,74 г, 5,76 ммоль) в дихлорметане (DCM) с последующим нагреванием до комнатной температуры. После обработки водой сырой продукт реакции очищают массовой препаративной ВЭЖХ, и получают 0,18 г (выход 27%) названного в заголовке соединения (15) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц): δ 7,08-7,01 (м, 5Н), 6,72-6,71 (м, 2Н), 4,60 (с, 2Н), 3,58-3,57 (с, 3Н), 3,23-3,19 (ушс, 2Н), 3,30 (с, 2Н), 3,19-3,11 (ушс, 2Н), 2,23 (ушс, 4Н); MS (ESI): m/z 347,13 (М+Н)+.
Пример 16
2-(4-Ацетилпиперазинил)-2-оксоэтилметил(2Е)бут-2-ен-1,4-диоат (16)
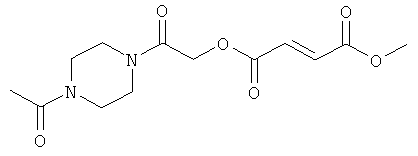
Гидрохлорид метил-2-оксо-2-пиперазинэтил-(2Е)бут-2-ен-1,4-диоата (14) (0,20 г, 0,68 ммоль) вводят во взаимодействие с ацетихлоридом (AcCl) (0,60 мл, 0,66 г, 0,84 ммоль) и диизопропилэтиламином (0,70 мл, 0,52 г, 4,0 ммоль) в дихлорметане (DCM). После обработки водой сырой продукт реакции очищают флэш-хроматографией на силикагеле, и получают 0,12 г (выход 54%) названного в заголовке соединения (16) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц): δ 6,98-6,93 (м, 2Н), 4,86 (с, 2Н), 3,83 (с, 3Н), 3,66-3,63 (м, 4Н), 3,50-3,40 (м, 4Н), 2,14 (с, 3Н). MS (ESI): m/z 299,12 (М+Н)+.
Пример 17
Метил-2-оксо-2-(2-оксо-1.3-оксазолидин-3-ил)этил(2Е)бут-2-ен-1.4-диоат (17)
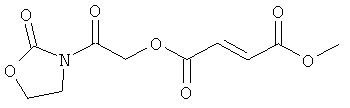
Следуя общему способу А, метилгидрофумарат (MHF) (0,50 г, 3,84 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с 3-(хлорацетил)-1,3-оксазолидин-2-оном (0,75 г, 4,61 ммоль) в присутствии CsHCO3 (0,89 г, 4,61 ммоль), и после очистки массовой препаративной ВЭЖХ и лиофилизации получают 0,30 г (выход 30%) названного в заголовке соединения (17) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц): δ 6,97-6,92 (м, 2Н), 5,32 (с, 2Н), 4,53 (т, J=8 Гц, 2Н), 4,05 (т, J=8,0 Гц, 2Н), 3,82 (с, 3Н). MS (ESI): m/z 258,20 (M+H)+.
Пример 18
{N-[2-(Диметиламино)этил] карбамоил} метил-метил(2Е)бут-2-ен-1,4-диоат (18)

Следуя общему способу А, метилгидрофумарат (MHF) (0,50 г, 3,84 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с N,N-диметилэтилендиаминохлорацетамидом (0,75 г, 4,61 ммоль) в присутствии CsHCO3 (0,89 г, 4,61 ммоль), и после очистки массовой препаративной ВЭЖХ и лиофилизации получают 0,02 г (выход 2%) названного в заголовке соединения (18) в виде белого твердого вещества. 1Н ЯМР (D2O, 400 МГц): δ 8,27 (с, 1Н), 6,87-6,78 (м, 2Н), 4,63 (с, 2Н), 3,68 (с, 3Н), 3,51 (т, J=6,2 Гц, 2Н), 3,17 (т, J=6,0 Гц, 2Н), 2,76 (с, 6Н). MS (ESI): m/z 259,14(M+H)+.
Пример 19
Метил-{N-[(пропиламино)карбонил]карбамоил}метил(2Е)бут-2-ен-1,4-диоат (19)
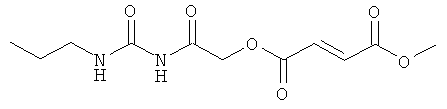
Следуя общему способу А, метилгидрофумарат (MHF) (0,50 г, 3,84 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с 1-(2-хлорацетил)-3-пропилмочевиной (0,82 г, 4,60 ммоль) в присутствии CsHCO3 (0,89 г, 4,61 ммоль), и получают 0,02 г (выход 2%) названного в заголовке соединения (19) в виде белого твердого вещества. Добавление метанола (МеОН) дает 0,49 г (выход 49%) белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц): δ 6,90-6,99 (м, 2Н), 4,77 (с, 2Н), 3,82 (с, 3Н), 3,25-3,24 (к, 2Н, J=5,6 Гц), 1,57-1,55 (к, 2Н, J=7,2 Гц), 0,95-0,91 (т, 3Н, 7=7,6 Гц). MS (ESI): m/z 273,08 (M+H)+.
Пример 20
2-{(2S)-2-[(трет-Бутил)оксикарбонил]пирролидинил}-2-оксоэтилметил(2E)бут-2-ен-1,4-диоат (20)
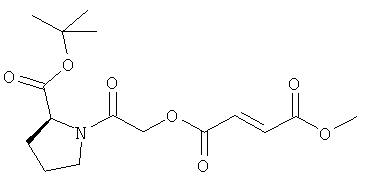
Следуя общему способу А, метилгидрофумарат (MHF) (0,50 г, 3,84 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с трет-бутил-(2S)-1-(2-хлорацетил)пирролидин-2-карбоксилатом (0,82 г, 4,60 ммоль) в присутствии CsHCO3 (0,89 г, 4,61 ммоль), и после очистки массовой препаративной ВЭЖХ и лиофилизации получают 0,44 г (выход 34%) названного в заголовке соединения (20) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц, все ротамеры): δ 6,97-6,90 (м, 2Н), 4,91-4,55 (м, 2Н), 4,44-4,29 (м, 1Н), 3,80 (с, 3Н), 3,61-3,58 (м, 2Н), 2,23-2,03 (ушм, 4Н), 1,54-1,46 (с, 9Н). MS (ESI): m/z 342,16 (М+Н)+, 364,09 (M+Na)+.
Пример 21
N-{[(трет-Бутил)оксикарбонил]метил}-N-метилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат(21)
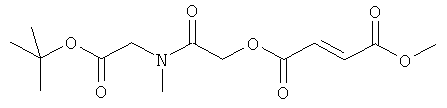
Следуя общему способу А, метилгидрофумарат (MHF) (0,50 г, 3,84 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с трет-бутил-2-(2-хлор-N-метилацетиламино)ацетатом (1,02 г, 4,60 ммоль) в присутствии CsHCO3 (0,89 г, 4,61 ммоль), и после очистки флэш-хроматографией на силикагеле (Biotage) получают 0,24 г (выход 21%) названного в заголовке соединения (21) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц, все ротамеры): δ 7,00-6,93 (м, 2Н), 4,90-4,79 (2с, 2Н), 4,03-3,89 (2с, 2Н), 3,80 (с, 3Н), 3,04-2,99 (2с, 3Н), 1,45 (с, 9Н). MS (ESI): m/z 316,13 (М+Н)+.
Пример 22 N-[(Этоксикарбонил)метил]-N-метилкарбамоил))метил-метил(2Е)бут-2-ен-1.4-диоат(22)

Следуя общему способу А, метилгидрофумарат (МНР) (0,50 г, 3,84 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с этил-2-(2-хлор-N-метилацетиламино)ацетатом (0,89 г, 4,60 ммоль) в присутствии CsHCO3 (0,89 г, 4,61 ммоль), и после очистки флэш-хроматографией на силикагеле (Biotage) получают 0,30 г (выход 27%) названного в заголовке соединения (22) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц, все ротамеры): δ 7,00-6,93 (м, 2Н), 4,90-4,79 (2с, 2Н), 4,03-3,89 (2с, 2Н), 3,80 (с, 3Н), 3,04-2,99 (2с, 3Н), 1,45 (с, 9Н). MS (ESI): m/z 316,13 (М+Н)+.
Пример 23 2-[(2Е)-3-ГМетоксикарбонил)проп-2-еноилокси]уксусная кислота (23)
Следуя общему способу А, метилгидрофумарат (МНР) (6,91 г, 53,12 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с трет-бутил-2-хлоруксусной кислотой (9,48 мл, 10,0 г, 66,4 ммоль) в присутствии CsHCO3 (15,41 г, 79,68 ммоль), и после осаждения из концентрированного раствора в диэтиловом эфире (Et2O) получают 13,11 г (выход 81%) промежуточного эфира в виде белого твердого вещества. Вещество имеет достаточную чистоту для использования на следующей стадии. 1Н ЯМР (CDCl3, 400 МГц): δ 6,95-6,92 (м, 2Н), 4,61 (с, 2Н), 3,81 (с, 3Н), 1,47 (с, 9Н). Вещество растворяют в 50 мл 50 об.% трифторуксусной кислоты (ТФК) в дихлорметане (DCM), и проводят реакцию в течение ночи при комнатной температуре. После удаления растворителей сырой материал переосаждают из смеси ацетона и гексана (1:3), и получают 12,3 г (выход 92%) названного в заголовке соединения (23) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц): δ 7,02-6,90 (м, 2Н), 4,79 (с, 2Н), 3,82 (с, 3Н). MS (ESI): m/z 189,07 (М+Н)+.
Пример 24 рац-2-[(2Е)-3-(Метоксикарбонил)проп-2-еноилокси]пропановая кислота (24) Следуя общему способу А, метилгидрофумарат (МНР) (4,68 г, 36,0 ммоль), растворенный в NMP, при ca. 55°С вводят во взаимодействие с рац-трет-бутил-2-бромпропионовой кислотой (4,98 мл, 6,27 г, 30,0 ммоль) в присутствии CsHCOs (6,40 г, 33,0 ммоль), и получают промежуточный эфир. Вещество имеет достаточную чистоту для использования на следующей стадии. 1Н ЯМР (CDCh, 400 МГц): δ 6,93-6,88 (м, 2Н), 5,02 (к, J=7,2 Гц, 2Н), 3,79 (с, 3Н), 1,49 (д,.7=7,2 Гц, 3Н), 1,44 (с, 9Н). Вещество растворяют в 25 мл 50 об.% трифторуксусной кислоты (ТФК) в дихлорметане (DCM), и проводят реакцию в течение ночи при комнатной температуре. После удаления растворителей получают названное в заголовке соединение (24) в виде белого твердого вещества, которое является достаточно чистым для использования на последующих стадиях. 1Н ЯМР (CDCl3, 400 МГц): δ 6,97-6,92 (м, 2Н), 5,22 (к, J=7,2 Гц, 2Н), 3,82 (с, 3Н), 1,60 (д, J=7,2 Гц, ЗН).
Пример 25 Метил-2-(4-метилпиперазинил)-2-оксоэтил(2Е)бут-2-ен-1,4-диоат (25)
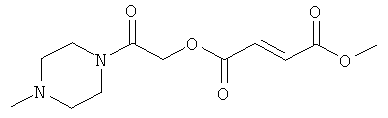
Следуя общему способу В2, 2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]уксусную кислоту (23) (0,50 г, 2,65 ммоль) при ca. 0°С активируют гидрохлоридом N-(3-диметиламинопропил)-N-этилкарбодиимида (EDAC) (0,60 г, 3,18 ммоль) в 10 мл дихлорметана (DCM). К активированной карбоновой кислоте добавляют N-метилпиперазин (0,353 мл, 0,31 г, 3,18 ммоль) и 4-(N,N-диметил)аминопиридин (DMAP) (0,40 г, 3,18 ммоль). После обработки и выделения и очистки массовой препаративной ВЭЖХ, и после лиофилизации, получают 0,09 г (выход 13%) названного в заголовке соединения (25) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц): δ 6,93-6,78 (м, 2Н), 4,77 (с, 2Н), 3,73 (с, 3Н), 3,56-3,54 (м, 2Н), 3,35-3,25 (м, 2Н), 2,37-2,33 (м, 4Н), 2,31 (с, 3Н). MS (ESI): m/z 271,13 (М+Н)+.
Пример 26 {N,N-Бис[2-(метил)этоксиэтил]карбамоил}метил-метил(2Е)бут-2-ен-1,4-диоат (26)
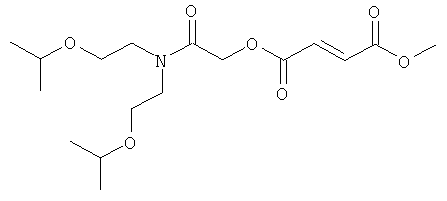
Следуя общему способу В2, 2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]уксусную кислоту (23) (0,50 г, 2,65 ммоль) при ca. 0°С активируют гидрохлоридом N-(3-диметиламинопропил)-N-этилкарбодиимида (EDAC) (0,60 г, 3,18 ммоль) в 10 мл дихлорметана (DCM). К активированной карбоновой кислоте добавляют бис(2-изопропоксиэтил)амин (0,60 г, 3,18 ммоль) и 4-(N,N-диметил)аминопиридин (DMAP) (0,40 г, 3,18 ммоль). После обработки и выделения и очистки колоночной флэш-хроматографией на силикагеле (Biotage) с использованием этилацетата (EtOAc) и гексана (1:1), и после вымораживания, получают 0,30 г (выход 32%) названного в заголовке соединения (26) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц): δ 6,95-6,86 (м, 2Н), 4,98 (с, 2Н), 3,76 (с, 3Н), 3,50-3,47 (м, 10Н), 1,10-1,05 (м, 12Н). MS (ESI): m/z 360,16 (М+Н)+.
Пример 27 [N,N-Бис(2-этоксиэтил)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат (27)

Следуя общему способу В2, 2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]уксусную кислоту (23) (0,80 г, 6,14 ммоль) при ca. 0°С активируют гидрохлоридом N-(3-диметиламинопропил)-N-этилкарбодиимида (EDAC) (1,40 г, 7,37 ммоль) в 20 мл дихлорметана (DCM). К активированной карбоновой кислоте добавляют гидрохлорид бис(2-этоксиэтил)амина (1,18 г, 7,37 ммоль) и диизопропилэтиламин (DIEA) (1,34 мл, 0,99 г, 7,67 ммоль). После обработки и выделения и очистки колоночной флэш-хроматографией на силикагеле (Biotage) с использованием этилацетата (EtOAc) и гексана (1:1) получают 0,30 г (выход 15%) названного в заголовке соединения (27) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц): δ 6,97 (д, J=1,6 Гц, 1Н), 5,01 (с, 2Н), 3,80 (с, 3Н), 3,56-3,43 (м, 12Н), 1,19 (к, J=7,6 Гц, 6Н). MS (ESI): m/z 332,20 (M+H)+.
Пример 28 Метил-1-метил-2-морфолин-4-ил-2-оксоэтил(2Е)бут-2-ен-1,4-диоат
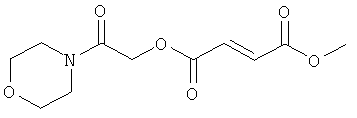
Следуя общему способу В2, 2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]пропановую кислоту (24) (0,48 г, 2,40 ммоль) при ca. 0°С активируют гидрохлоридом N-(3-диметиламинопропил)-N-этилкарбодиимида (EDAC) (0,64 г, 3,36 ммоль) в 10 мл дихлорметана (DCM). К активированной карбоновой кислоте добавляют морфолин (0,25 мл, 0,25 г, 2,88 ммоль). После обработки и выделения и очистки массовой препаративной ВЭЖХ, и после лиофилизации, получают 0,22 г (выход 33%) названного в заголовке соединения (28) в виде белого твердого вещества. Т.пл. 70-73°С. 1Н ЯМР (CDCl3, 400 МГц): δ 6,95-6,89 (м, 2Н), 5,45 (к, J=6,8 Гц, 1Н), 3,80 (с, 3Н), 3,71-3,68 (м, 4Н), 3,58-3,54 (м, 4Н), 1,48 (д, J=7,2 Гц, 3Н). MS (ESI): m/z 272,13 (М+Н)+.
Пример 29 N,N-Бис(2-метоксиэтил)карбамоил]этил-метил(2Е)бут-2-ен-1,4-диоат (29)
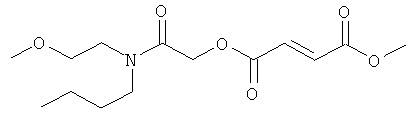
Следуя общему способу В2, 2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]пропановую кислоту (24) (0,48 г, 2,40 ммоль) при ca. 0°С активируют гидрохлоридом N-(3-диметиламинопропил)-N-этилкарбодиимида (EDAC) (0,64 г, 3,36 ммоль) в 10 мл дихлорметана (DCM). К активированной карбоновой кислоте добавляют бис(2-метоксиэтил)амин (0,42 мл, 0,37 г, 2,88 ммоль). После обработки и выделения и очистки массовой препаративной ВЭЖХ, и после лиофилизации, получают 0,29 г (выход 38%) названного в заголовке соединения (29) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц): δ 6,94-6,88 (м, 2Н), 5,52 (к, J=6,8 Гц, 1Н), 3,80-3,79 (с, 3Н), 3,57-3,49 (м, 8Н), 3,33-3,31 (2с, 6Н), 1,48 (д,7=6,4 Гц, 3Н). MS (ESI): m/z 318,13 (M+H)+.
Пример 30 (N-Диметилкарбамоил)этил-метил(2Е)бут-2-ен-1N-диоат (30)
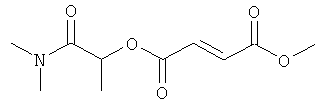
Следуя общему способу В2, 2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]пропановую кислоту (24) (0,48 г, 2,40 ммоль) при ca. 0°С активируют гидрохлоридом N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDAC) (0,64 г, 3,36 ммоль) в 10 мл дихлорметана (DCM). К активированной карбоновой кислоте добавляют гидрохлорид N,N-диметиламина (0,23 г, 2,88 ммоль) и диизопропилэтиламин (DIEA) (0,63 мл, 0,467 г, 3,61 ммоль). После обработки и выделения и очистки массовой препаративной ВЭЖХ, и после лиофилизации, получают 0,25 г (выход 46%) названного в заголовке соединения (30) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц): δ 6,93-6,86 (м, 2Н), 5,46 (к, J=6,8 Гц, 1Н), 3,79. (с, 3Н), 3,06-2,97 (2с, 6Н), 1,47 (д, J=6,4 Гц, 3Н). MS (ESI): m/z 2230,13 (М+Н)+.
Пример 31
(1S)-1-Метил-2-морфолин-4-ил-2-оксоэтил-метил(2Е)бут-2-ен-1,4-диоат (31)
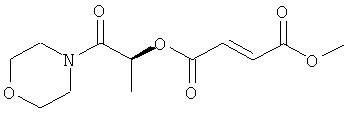
Следуя общему способу В2, (2Е)-3-(метоксикарбонил)проп-2-еновую кислоту (метилгидрофумарат, MHF) (0,50 г, 3,84 ммоль) при ca. 0°С активируют гидрохлоридом N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDAC) (0,81 г, 4,20 ммоль) в 10 мл дихлорметана (DCM). К активированной карбоновой кислоте добавляют (28)-2-гидрокси-1-морфолин-4-илпропан-1-он (0,48 г, 3,07 ммоль) и 4-(N,N-диметил)аминопиридин (DMAP) (0,40 г, 3,18 ммоль). После обработки и выделения и очистки колоночной флэш-хроматографией на силикагеле (Biotage) с использованием этилацетата (EtOAc) и гексана (ca. 3:2) получают 0,42 г (выход 51%) названного в заголовке соединения (31) в виде белого твердого вещества. Т.пл. 79-82°С; 1Н ЯМР (CD3CN, 400 МГц): δ 6,90-6,81 (м, 2Н), 5,44 (к, J=6,8 Гц, 1Н), 3,78 (с, 3Н), 3,65-3,60 (м, 4Н), 3,51-3,50 (м, 4Н), 1,42 (д, J=6,8 Гц. 3Н). MS (ESI): m/z 272,05 (М+Н)+.
Пример 32
(1S)-1-[N,N-Бис(2-метоксиэтил)карбамоил]этил-метил(2Е)бут-2-ен-1,4-диоат (32)
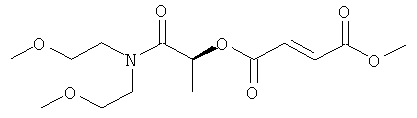
Следуя общему способу В2, (2Е)-3-(метоксикарбонил)проп-2-еновую кислоту (метилгидрофумарат, МНР) (0,50 г, 3,84 ммоль) при са. 0°С активируют гидрохлоридом N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDAC) (0,88 г, 4,60 ммоль) в 20 мл дихлорметана (DCM). К активированной карбоновой кислоте добавляют (2S)-2-гидрокси-N,N-бис(2-метоксиэтил)пропанамид (0,63 г, 3,07 ммоль) и 4-(N,N-диметил)аминопиридин (DMAP) (0,40 г, 3,18 ммоль). После обработки и выделения и очистки колоночной флэш-хроматографией на силикагеле (Biotage) с использованием этилацетата (EtOAc) и гексана (2:1) получают 0,16 г (выход 14%) названного в заголовке соединения (32) в виде прозрачного масла. 1Н ЯМР (CDCl3, 400 МГц): δ 6,93-6,77 (м, 2Н), 5,53 (к, J=6,4 Гц, 1Н), 3,80 (с, 3Н), 3,58-3,50 (м, 8Н), 3,47-3,32 (2 с, 6Н), 1,49 (д, J=6,8 Гц, 3Н). MS (ESI): m/z 318,05 (М+Н)+.
Пример 33
(1S)-1-(N,N-Диэтилкарбамоил)этил-метил(2Е)бут-2-ен-1,4-диоат (33)
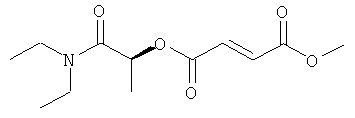
Следуя общему способу В2, (2Е)-3-(метоксикарбонил)проп-2-еновую кислоту (метилгидрофумарат, MHF) (0,50 г, 3,84 ммоль) при ca. 0°С активируют гидрохлоридом N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDAC) (0,88 г, 4,60 ммоль) в 12 мл дихлорметана (DCM). К активированной карбоновой кислоте добавляют (2S)-N,N-диэтил-2-гидроксипропанамид (0,44 г, 3,07 ммоль) и 4-(N,N-диметил)аминопиридин (DMAP) (0,40 г, 3,18 ммоль). После обработки и выделения и очистки массовой препаративной ВЭЖХ/лиофилизацией и колоночной флэш-хроматографией на силикагеле (Biotage) с использованием этилацетата (EtOAc) и гексана получают 0,17 г (выход 18%) названного в заголовке соединения (33) в виде прозрачного масла. 1Н ЯМР (CDCl3, 400 МГц): δ 6,95-6,87 (м, 2Н), 5,43 (к, J=6,8 Гц, 1Н), 3,80 (с, 3Н), 3,50-3,26 (м, 4Н), 1,49 (д, J=6,4 Гц, 3Н), 1,26 (т, J=6,8 Гц, 3Н), 1,12 (т, J=7,6 Гц, 3Н). MS (ESI): m/z 258,06 (M+H)+.
Пример 34
(N-{[(трет-Бутил)оксикарбонил]метил}карбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат (34)
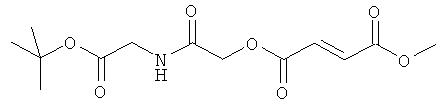
Следуя общему способу В2, 2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]уксусную кислоту (23) (0,50 г, 2,65 ммоль) при ca. 0°С активируют оксалилхлоридом (0,30 мл, 0,40 г, 3,18 ммоль) в дихлорметане (DCM) и в присутствии каталитического количества N,N-диметилформамида (ДМФА). Раствор только что полученного неочищенного хлорангидрида в DCM при ca. 0°С (ледяная баня) вводят во взаимодействие с трет-бутиловым эфиром глицина (H-GlyO-трет-Bu) (0,53 г, 3,18 ммоль) в DCM и в присутствии 4-(N,N-диметил)аминопиридина (DMAP) (0,40 г, 3,18 ммоль). После обработки водой и выделения и очистки флэш-хроматографией на силикагеле получают 0,16 г (выход 20%) названного в заголовке соединения (34) в виде полутвердого вещества. 1Н ЯМР (CDCl3, 400 МГц, все ротамеры): δ 6,95-6,69 (м, 2Н), 6,63 (ушм, 1Н), 4,73 (с, 2Н), 3,99 (д, J=4,8 Гц, 2Н), 3,83 (с, 3Н), 1,48 (с, 9Н). MS (ESI): m/z 324,05 (M+Na)+.
Пример 35
Метил-[N-метил-N-{[(метилэтил)оксикарбонил]метил} карбамоил)метил(2Е)бут-2-ен-1,4-диоат (35)
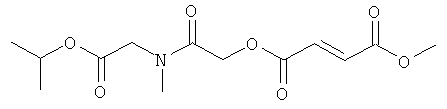
Следуя общему способу В2, 2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]уксусную кислоту (23) (0,50 г, 2,65 ммоль) при са. 0°С активируют оксалилхлоридом (0,30 мл, 0,40 г, 3,18 ммоль) в дихлорметане (DCM) и в присутствии каталитического количества N,N-диметилформамида (ДМФА). Раствор только что полученного неочищенного хлорангидрида в DCM при са. 0°С (ледяная баня) вводят во взаимодействие с изопропиловым эфиром саркозина (H-Sar-O-изоPr) (0,41 г, 3,18 ммоль) и диизопропилэтиламином (DIEA) (0,41 мл, 0,304 г, 2,35 ммоль) в DCM и в присутствии 4-(N,N-диметил)аминопиридина (DMAP) (0,10 г, 0,82 ммоль). После обработки водой и выделения и очистки флэш-хроматографией на силикагеле получают 0,214 г (выход 27%) названного в заголовке соединения (35) в виде бледно-желтого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц, все ротамеры): δ 6,94-6,90 (м, 2Н), 5,09-4,99 (м, 1Н), 4,89-4,79 (2с, 2Н), 4,07-3,95 (2с, 2Н), 3,78 (с, 3Н), 3,04-2,98 (2 с, 3Н), 1,27-1,21 (м, 6Н). MS (ESI): m/z 302,04 (М+Н)+.
Пример 36
{N-[(Этоксикарбонил)метил]-N-бензилкарбамоил}метил-метил(2Е)бут-2-ен-1,4-диоат (36)
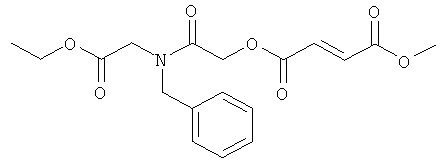
Следуя общему способу В2, 2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]уксусную кислоту (23) (0,50 г, 2,65 ммоль) при са. 0°С активируют оксалилхлоридом (0,27 мл, 0,40 г, 3,15 ммоль) в дихлорметане (DCM) и в присутствии каталитического количества N,N-диметилформамида (ДМФА). Раствор только что полученного неочищенного хлорангидрида в DCM при са. 0°С (ледяная баня) вводят во взаимодействие с этиловым эфиром N-бензилглицина (Bn-Gly-OEt) (0,61 г, 3,18 ммоль) в DCM и избытке диизопропилэтиламина (DIEA) в присутствии каталитического количества 4-(N,N-диметил)аминопиридина (DMAP). После обработки водой и выделения и очистки флэш-хроматографией на силикагеле получают 0,12 г (выход 13%) названного в заголовке соединения (36) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц, все ротамеры): δ 7,37-7,20 (м, 5Н), 6,97-6,86 (м, 2Н), 4,94-4,83 (2с, 2Н), 4,63-4,55 (2с, 2Н), 4,18-4,14 (м, 2Н), 4,04-3,88 (2 с, 2Н), 3,79 (с, 3Н), 1,24-1,20 (м, 3Н). MS (ESI): m/z 364,15 (М+Н)+.
Пример 37
{N-[(Этоксикарбонил)метил]-N-бензилкарбамоил}этил-метил(2Е)бут-2-ен-1,4-диоат (37)

Следуя общему способу В2, 2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]пропановую кислоту (24) (0,50 г, 2,47 ммоль) при са. 0°С активируют оксалилхлоридом (0,25 мл, 0,35 г, 2,71 ммоль) в дихлорметане (DCM) и в присутствии каталитического количества N,N-диметилформамида (ДМФА). Раствор только что полученного неочищенного хлорангидрида в DCM при са. 0°С (ледяная баня) вводят во взаимодействие с этиловым эфиром N-бензилглицина (Bn-Gly-OEt) (0,56 г, 2,90 ммоль) в DCM и диизопропилэтиламине (DIEA) (0,506 мл, 0,376 г, 2,90 ммоль) в присутствии каталитического количества 4-(N,N-диметил)аминопиридина (DMAP). После обработки водой и выделения и очистки флэш-хроматографией на силикагеле получают 0,31 г (выход 33%) названного в заголовке соединения (37) в виде белого твердого вещества. 1H ЯМР (CDCl3, 400 МГц, все ротамеры): δ 7,37-7,17 (м, 5Н), 6,88-6,77 (м, 2Н), 5,49 (к, J=6,4 Гц, 0,75Н), 5,33 (к, J=6,4 Гц, 0,25Н), 4,7-4,27 (м, 3Н), 4,16-4,13 (м, 2Н), 3,83-3,63 (м, 4Н), 1,53 (д, J=6,8 Гц, 3Н), 1,21 (т, J=4,0 Гц, 3Н). MS (ESI): m/z 378,10 (М+Н)+.
Пример 38
{N-[(Этоксикарбонил)метил]-N-метилкарбамоил}этил-метил(2Е)бут-2-ен-1,4-диоат (38)

Следуя общему способу В2, 2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]пропановую кислоту (24) (0,50 г, 2,47 ммоль) при са. 0°С активируют оксалилхлоридом (0,25 мл, 0,35 г, 2,71 ммоль) в дихлорметане (DCM) и в присутствии каталитического количества N,N-диметилформамида (ДМФА). Раствор только что полученного неочищенного хлорангидрида в DCM при са. 0°С (ледяная баня) вводят во взаимодействие с этиловым эфиром саркозина (H-Sar-OEt) (0,43 г, 2,90 ммоль) и диизопропилэтиламином (DIEA) (0,506 мл, 0,376 г, 2,90 ммоль) в DCM в присутствии каталитического количества 4-(N,N-диметил)аминопиридина (DMAP). После обработки водой и выделения и очистки флэш-хроматографией на силикагеле получают 0,30 г (выход 39%) названного в заголовке соединения (38) в виде белого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц, все ротамеры): δ 6,88-6,81 (м, 2Н), 5,47 (к, 0,75Н, J=6,8 Гц), 5,32 (к, 0,25H, J=6,8 Гц), 4,40-4,33 (м, 1Н), 4,16-4,11 (м, 2Н), 3,94-3,75 (м, 4Н), 3,10 (с, 2,25Н), 2,96 (с, 0,75Н), 1,50-1,44 (дд, 3Н), 1,26-1,20 (м, 3Н). MS (ESI): m/z 302,09 (М+Н)+.
Пример 39
Этоксикарбонилоксиэтил-метил(2Е)бут-2-ен-1,4-диоат (39)
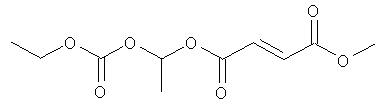
Следуя общему способу А, метилгидрофумарат (0,39 г, 3,0 ммоль) в NMP (8 мл) вводят во взаимодействие с CsHCO3 (0,69 г, 3,6 ммоль) и этил(хлорэтокси)формиатом (0,64 г, 4,2 ммоль), и после выделения и очистки получают 0,63 г (выход 85%) названного в заголовке соединения (39). 1Н ЯМР (CDCl3, 400 МГц): δ 6,89 (д, J=15,6 Гц, 1Н), 6,82 (д, J=15,6 Гц, 1Н), 6.84 (к, J=5,6 Гц, 1Н), 4,23 (к, J=7,2 Гц, 3Н), 3,81 (с, 3Н), 1,58 (д, J=5,6 Гц, 3Н), 1,32 (т, J=7,2 Гц, 3Н). MS (ESI): m/z 247,01 (M+H)+.
Пример 40
Метил-(метилэтоксикарбонилокси)этил(2Е)бут-2-ен-1,4-диоат (40)
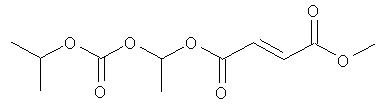
Следуя общему способу А, метилгидрофумарат (0,39 г, 3,0 ммоль) в NMP (8 мл) вводят во взаимодействие с CsHCO3 (0,69 г, 3,6 ммоль) и метилэтил(хлорэтокси)формиатом (0,70 г, 4,2 ммоль), и после выделения и очистки получают 0,71 г (выход 91%) названного в заголовке соединения (40). 1Н ЯМР (CDCl3, 400 МГц): δ 6,89 (д, J=15,6 Гц, 1Н), 6,84 (к, J=5,2 Гц, 1Н, наложение), 6,82 (д, J=15,6 Гц, 1Н, наложение). 4,90 (гептет, J=6,2 Гц, 3Н), 3,81 (с, 3Н), 1,57 (д, J=5,2 Гц, 3Н), 1,32 (д, J=6,2 Гц, 3Н), 1,31 (д, J=6,2 Гц, 3Н). MS (ESI): m/z 261,02 (М+Н)+.
Пример 41
(Циклогексилоксикарбонилокси)этил-метил(2Е)бут-2-ен-1,4-диоат(41)
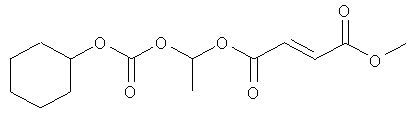
Следуя общему способу А, метилгидрофумарат (0,50 г, 3,85 ммоль) в NMP (8 мл) при са. 55°С вводят во взаимодействие с CsHCO3 (1,1 г, 5,716 ммоль) и хлорэтилциклогексанкарбоксилатом (1,03 г, 4,99 ммоль), и после очистки массовой препаративной ВЭЖХ и лиофилизации получают 0,94 г (выход 821%) названного в заголовке соединения (41). 1Н ЯМР (CDCl3, 400 МГц): δ 6,91-6,79 (м, 3Н), 4,67-4,62 (м, 1Н), 3,81 (с, 3Н), 1,94-1,91 (м, 2Н), 1,77-1,73 (м, 2Н), 1,57 (д, J=5,6 Гц, 3Н). 1,53-1,46 (м, ЗН), 1,39-1,33 (м, 3Н). MS (ESI): m/z 301,10 (М+Н)+.
Пример 42
Метил-(2-метилпропаноилокси)этил(2Е)бут-2-ен-1,4-диоат (42)
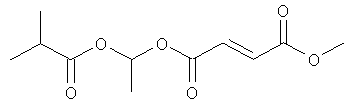
Следуя общему способу А, метилгидрофумарат (0,39 г, 3,0 ммоль) в NMP (8 мл) вводят во взаимодействие с CsHCO3 (0,69 г, 3,6 ммоль) и хлорэтил-2-метилпропаноатом (0,63 г, 4,2 ммоль), и после выделения и очистки получают 0,65 г (выход 89%) названного в заголовке соединения (42). 1Н ЯМР (CDCl3, 400 МГц): δ 6,93 (к, J=5,2 Гц, 1Н), 6,88 (д, J=16,0 Гц, 1Н), 6,81 (д, J=15,6 Гц, 1Н), 3,81 (с, 3Н), 2,55 (гептет, J=6,8 Гц, 3Н), 1,54 (д, J=5,2 Гц, 3Н), 1,18 (д, J=6,8 Гц, 6Н). MS (ESI): m/z 245,05 (М+Н)+.
Пример 43
Метилфенилкарбонилоксиэтил(2Е)бут-2-ен-1,4-диоат (43)

Следуя общему способу А, метилгидрофумарат (0,42 г, 3,3 ммоль) в NMP (6 мл) вводят во взаимодействие с CsHCO3 (0,69 г, 3,6 ммоль) и хлорэтилбензоатом (0,55 г, 3,0 ммоль), и после очистки колоночной флэш-хроматографией на силикагеле (Biotage) с использованием в качестве элюента смеси этилацетата (EtOAc) и гексана (1:8) получают 0,2 г (выход 24%) названного в заголовке соединения (43). 1Н ЯМР (CDCl3, 400 МГц): 5 8,08-8,02 (м, 2Н), 7,63-7,56 (м, 1Н), 7,49-7,42 (м, 2Н), 7,21 (к, J=5,2 Гц, 1Н), 6,92 (д, J=16,0 Гц, 1Н), 6,85 (д, J=16,0 Гц, 1Н), 3,81 (с, 3Н), 1,69 (д, J=5,2 Гц, 3Н). MS (ESI): m/z 278,99 (M+H)+.
Пример 44
Циклогексилкарбонилоксибутил-метил(2Е')бут-2-ен-1,4-диоат (44)
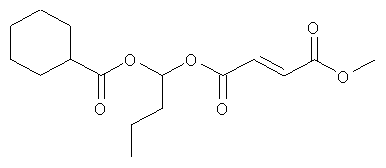
Следуя общему способу А, метилгидрофумарат (1,00 г, 7,68 ммоль) при са. 55°С вводят во взаимодействие с CsHCO30 (2,22 г, 11,52 ммоль) и хлорбутилциклогексанкарбоксилатом (2,16 г, 9,98 ммоль), и после очистки массовой препаративной ВЭЖХ и лиофилизации получают 1,2 г (выход 50%) названного в заголовке соединения (44) в виде прозрачного масла. 1Н ЯМР (CDCl3, 400 МГц): δ 6,90-6,77 (м, 3Н), 3,81 (с, 3Н), 2,34-2,28 (м, 1Н), 1,91-1,88 (м, 2Н), 1,82-1,73 (м, 4Н), 1,65-1,62 (м, 2Н), 1,47-1,39 (м, 4Н), 1,29-1,23 (м, 2Н), 0,98-0,94 (т, 3Н). MS (ESI): m/z 313,09 (M+H)+.
Пример 45
[(2Е)-3-(Метоксикарбонил)проп-2-еноилокси]этил-метил(2Е)бут-2-ен-1,4-диоат (45)
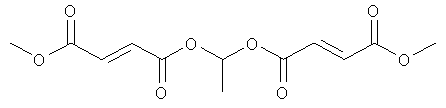
Адаптируя способы и процедуры согласно Iyer et al., Synth. Commun., 1995, 25(18), 2739, получают хлорэтил-метил(2Е)бут-2-ен-1,4-диоат из метилгидрофумарата (MHF), ацетальдегида и безводного хлорида цинка(П) в безводном дихлорметане (DCM). 1Н ЯМР (CDCl3, 400 МГц): δ 6,95 (д, J=16,0 Гц, 1Н), 6,85 (д, J=16,0 Гц, 1Н), 6,60 (к, J=5,2 Гц, 1Н), 3,81 (с, 3Н), 1,83 (д, J=5,2 Гц, 3Н).
Следуя общему способу А, метилгидрофумарат (0,22 г, 1,7 ммоль) в NMP (4 мл) вводят во взаимодействие с CsHCO3 (0,38 г, 1,9 ммоль) и хлорэтилметил-(2Е)бут-2-ен-1,4-диоатом (0,27 г, 1,4 ммоль), и после очистки флэш-хроматографией на силикагеле (Biotage) с использованием смеси этилацетата (EtOAc) и гексана (1:3) получают 0,068 г (выход 17%) названного в заголовке соединения (45). 1Н ЯМР (CDCl3, 400 МГц): δ 7,03 (к, J=5,2 Гц, 1Н), 6.90 (д, J=16,0 Гц, 1Н), 6,82 (д, J=16,0 Гц, 1Н), 3,82 (с, 3Н), 1,60 (д, J=5,2 Гц, 3Н).
Пример 46
Метил-2-метил-1-фенилкарбонилоксипропил(2Е)бут-2-ен-1,4-диоат (46)

Следуя общему способу А, метилгидрофумарат (0,50 г, 3,82 ммоль) при са. 55°С вводят во взаимодействие с CsHCO3 (5,76 ммоль) и хлоризобутилбензоатом (1,1 г, 5,17 ммоль), и после очистки флэш-хроматографией на силикагеле (Biotage) с использованием смеси этилацетата (EtOAc) и гексана (1:7) получают 0,18 г (выход 15%) названного в заголовке соединения (46). 1Н ЯМР (CDCl3, 400 МГц): δ 8,04-8,01 (м, 2Н), 7,58-7,55 (м, 1Н), 7,45-7,41 (м, 2Н), 6,98 (д, J=4,8 Гц, 1Н), 6,90 (д, J=16,0 Гц, 1Н), 6,84 (д, J=16,0 Гц, 1Н), 3,78 (с, 3Н), 2,25-2,21 (м, 1Н), 1,10-1,07 (м, 6Н). MS (ESI): m/z 307,11 (М+Н)+.
Пример 47
(2Е)-3-[(2-Морфолин-4-ил-2-оксоэтил)оксикарбонил]проп-2-еновая кислота (47)

Следуя общему способу А, фумаровую кислоту (1,00 г, 8,60 ммоль) при са. 100°С вводят во взаимодействие с хлорацетилморфолином (1,4 г, 8,6 ммоль) и Ag2O (4,2 г, 9,47 ммоль) в N-метилпирролидиноне. Реакционую смесь охлаждают до комнатной температуры, фильтруют через целит®, и остаток на фильтре промывают этилацетатом (EtOAc). Объединенные органические фильтраты подвергают обработке водной кислотой, и сырой материал очищают массовой препаративной ВЭЖХ, и получают 0,50 г (выход 24%) названного в заголовке соединения (47) в виде белого твердого вещества. 1Н ЯМР (CD3CN, 400 МГц): δ 6,85-6,80 (м, 2Н), 4,85 (с, 2Н), 3,64-3,60 (м, 4Н), 3,57-3,54 (т, J=4,8 Гц, 2Н), 3,42-3,39 (т, J=5,2 Гц, 2Н). MS (ESI): m/z 244,06 (M+H)+ 242,07 (М-Н)-.
Пример 48
(2Е)-3-{[(N,N-Диэтилкарбамоил)метокси] оксикарбонил} проп-2-еновая кислота (48)
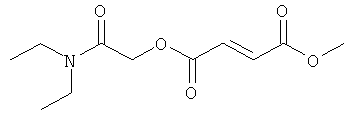
Следуя общему способу А, моно-трет-бутилфумаровую кислоту (0,70 г, 4,06 ммоль) при са. 55°С вводят во взаимодействие с N,N-диэтилхлорацетамидом (0,55 мл, 0,60 г, 4,06 ммоль) и CsHCO3 (0,93 г, 4,87 ммоль) в N-метилпирролидиноне (NMP). После выделения и очистки сырое вещество вводят во взаимодействие с 50 об.% трифторуксусной кислотой (ТФК) в дихлорметане (DCM). Свободную кислоту очищают массовой препаративной ВЭЖХ, и получают 0,051 г (выход 6%) названного в заголовке соединения (48) в виде белого твердого вещества. 1Н ЯМР (CD3CN, 400 МГц): δ 6,90-6,82 (м, 2Н), 4,88 (с, 2Н), 3,40-3,32 (к, J=6,8 Гц, 2Н), 3,31-3,27 (к, J=6,8 Гц, 2Н), 1,22-1,18 (т, J=7,6 Гц, 3Н), 1,11-1,07 (т, J=6,8 Гц, 3Н). MS (ESI): m/z 230,03 (M+H)+ 228,07 (М-Н)-.
Пример 49
(2Е)-3-{[[Метилпропаноилокси)этокси]оксикарбонил}проп-2-еновая кислота (49)
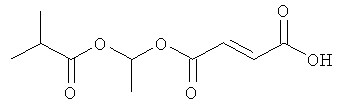
Следуя общему способу А, хлорэтил-2-метилпропаноат (0,24 г, 1,58 ммоль) при са. 100°С вводят во взаимодействие в течение ночи с предварительно полученной солью бисдициклогексиламина (DCHA) фумаровой кислоты (FA) (0,50 г, 1,26 ммоль) в N-метилпирролидиноне (NMP). Сырое вещество очищают массовой препаративной ВЭЖХ, и получают (0,035 г, выход 12%) названное в заголовке соединение (49) в виде воскообразного полутвердого вещества. 1Н ЯМР (CD3CN, 400 МГц): δ 6,89-6,83 (к, J=5,6 Гц, 1Н), 6,82-6,81 (д, J=16,0 Гц, 1Н), 6,73-6,69 (д, J=16,0 Гц, 1Н), 2,58-2,49 (гептет, J=6,8 Гц, 1Н), 1,49-1,47 (д, J=5,6 Гц, 3Н), 1,12 (д, J=7,2 Гц, 3Н), 1,09 (д, J=6,8 Гц, 6Н); MS (ESI): ь/z 239,0 l(M-H)-.
Пример 50
(2Е)-3-({[(Метилэтил)оксикарбонилокси]этил}оксикарбонил)проп-2-еновая кислота (50)
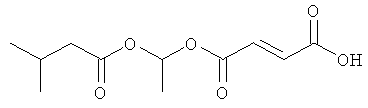
Следуя общему способу А, хлорэтил(метилэтокси)формиат (0,25 г, 1,50 ммоль) при са. 100°С вводят во взаимодействие в течение ночи с предварительно полученной солью бисдициклогексиламина (DCHA) фумаровой кислоты (FA) (0,50 г, 1,26 ммоль) в N-метилпирролидиноне (NMP). Сырое вещество очищают массовой препаративной ВЭЖХ, и получают (0,030 г, выход 10%) названное в заголовке соединение (50) в виде воскообразного полутвердого вещества. 1Н ЯМР (CD3CN, 400 МГц): δ 6,86 (к, J=5,6 Гц, 1Н), 6,81 (д, J=16,0 Гц, 1Н), 6,73 (д, J=16,0 Гц, 1Н), 2,57-2,50 (гептет, J=7,2 Гц, 1Н), 1,48 (д, J=5,6 Гц, ЗН), 1,13 (м, 6Н). MS (ESI): m/z=244,99 (M-H)-.
Пример 51
Алкилокси- и арилоксикарбонилоксиалкил-алкилгидрофумараты Перечисленные далее алкилокси- и арилоксикарбонилоксиалкилгидрофумараты получают с использованием способов, описанных в примерах 1-50 и адаптируя общие синтетические способы А, В1 и В2:
(2Е)-3-({[N-бензилкарбамоил]метил}оксикарбонил)проп-2-еновая кислота;
(2Е)-3-[(2-морфолин-4-ил-2-оксоэтил)оксикарбонил]проп-2-еновая кислота;
(2Е)-3-{[(N-бутилкарбамоил)метил]оксикарбонил}проп-2-еновая кислота;
(2Е)-3-{[(N-метокси-N-метилкарбамоил)метил]оксикарбонил}проп-2-еновая кислота;
бис[(2-метоксиэтиламино)карбамоил]метилпроп-2-еновая кислота;
(N,N-диметилкарбамоил)метилпроп-2-еновая кислота;
2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]уксусная кислота;
(2Е)-3-({[N-(3-карбоксипропил)карбамоил]метил} оксикарбонил)проп-2-еновая кислота;
метил-(N-(1,3,4-тиадиазол-2-ил)карбамоил)метилпроп-2-еновая кислота;
(2Е)-3-[(2-{(28)-2-[(трет-бутил)оксикарбонил]пирролидинил}-2-оксоэтил)оксикарбонил]проп-2-еновая кислота;
1-[2-((2Е)-3-карбоксипроп-2-еноилокси)ацетил]-(2S)-пирролидин-2-карбоновая кислота;
(2Е)-3-[({N-[(этоксикарбонил)метил]-N-метилкарбамоил}метил)оксикарбонил]проп-2-еновая кислота;
(2Е)-3-{[(N-{[(трет-бутил)оксикарбонил]метил}-N-метилкарбамоил)метил]оксикарбонил}проп-2-еновая кислота;
(2Е)-3-[(1-метил-2-морфолин-4-ил-2-оксоэтил)оксикарбонил]проп-2-еновая кислота;
(2Е)-3-({[N,N-бис(2-метоксиэтил)карбамоил]этил}оксикарбонил)проп-2-еновая кислота;
(2Е)-3-{[(N,N-диметилкарбамоил)этил]оксикарбонил}проп-2-еновая кислота;
(2Е)-3-[({N,N-бис[(2-метилэтокси)этил]карбамоил}метил)оксикарбонил]проп-2-еновая кислота;
(2Е)-3-({N,N-бис(2-этоксиэтил)карбамоил]метил}оксикарбонил)проп-2-еновая кислота;
(2Е)-3-{[2-(4-ацетилпиперазинил)-2-оксоэтил]оксикарбонил}проп-2-еновая кислота;
(2Е)-3-({2-оксо-2-[4-бензилпиперазинил]этил}оксикарбонил)проп-2-еновая кислота;
(2Е)-3-{[(N-{[(трет-бутил)оксикарбонил]метил}карбамоил)метил]оксикарбонил}проп-2-еновая кислота;
(2Е)-3-{[(N-метил-N-{[(метилэтил)оксикарбонил]метил}карбамоил)метил]оксикарбонил}проп-2-еновая кислота;
(2Е)-3-[({N-[(этоксикарбонил)метил]-N-бензилкарбамоил}метил)оксикарбонил]проп-2-еновая кислота;
(2Е)-3-[({N-[(этоксикарбонил)метил]-N-бензилкарбамоил}этил)оксикарбонил]проп-2-еновая кислота и
(2Е)-3-[({N-[(этоксикарбонил)метил]-N-метилкарбамоил}этил)оксикарбонил]проп-2-еновая кислота.
Пример 52
Способы определения устойчивости пролекарств in vitro
В случае пролекарства может быть желательно, чтобы пролекарство оставалось интактным (т.е. негидролизованным) пока находится в кровотоке и гидролизовалось (т.е. высвобождалось исходное лекарственное средство) в ткани-мишени. С другой стороны, может быть желательно, чтобы пролекарство оставалось интактным (т.е. неагидролизованным) пока находится в желудочно-кишечном тракте и гидролизовалось (т.е. высвобождалось исходное лекарственное средство) после всасывания или поглощения из желудочно-кишечного просвета, например, или в энтероцитах, выстилающих желудочно-кишечный просвет, или в крови. Применимый уровень устойчивости можно, по меньшей мере, частично определить по механизму и фармакокинетике пролекарства. Как правило, пролекарства, которые более устойчивы в анализе панкреатина или смывов толстой кишки и более лабильны в препаратах плазмы крысы, плазмы человека, печени крысы S9 и/или печени человека S9, могут применяться в качестве пролекарства, вводимого перорально. Как правило, пролекарства, которые более устойчивы в препаратах плазмы крысы, плазмы человека, печени крысы S9 и/или печени человека S9, и которые более лабильны в препаратах клеточного гомогената, таких как препараты СаСо2 S9, могут применяться в качестве пролекарств, вводимых системно, и/или могут быть более эффективными при доставке пролекарства к ткани-мишени. Как правило, пролекарства, которые более устойчивы в интервале рН физиологических буферов (pH 6,0-pH 8,5), могут быть более применимыми в качестве пролекарств. Как правило, пролекарства, которые более лабильны в препаратах клеточного гомогената, таких как препараты СаСо2 S9, могут гидролизоваться внутриклеточно с высвобождением исходного лекарственного средства для ткани-мишени. Результаты таких испытаний, как описанные в данном примере, для определения ферментативного или химического гидролиза пролекарств in vitro можно использовать для выбора пролекарств дли испытания in vivo.
Устойчивость пролекарств можно оценить в одной или нескольких системах in vitro с использованием различных препаратов, следуя способам, известным в технике. Например, в данном описании описываются способы, используемые для определения устойчивости пролекарств в препаратах гомогената Сасо2 S9, печени крысы S9, плазмы крысы, свиного панкреатина, смыва толстой кишки крысы и буфере рН 8,0.
Гомогенат СаСо2 S9 получают с использованием следующей процедуры. Клетки СаСо2 выращивают в культуре в течение 21 дня до сбора. Культуральную среду удаляют из культурального сосуда, и монослой дважды промывают 10-15 мл охлажденного буфера PBS. Буфер PBS (7-10 мл) добавляют в колбу, и клетки соскребают с поверхности, на которой они росли, и переносят в центрифужную пробирку. Клетки осаждают центрифугированием при 1500 об/мин в течение 5 мин при 4°С. Супернатант удаляют, и клеточный осадок промывают охлажденным на льду PBS и повторно осаждают центрифугированием. Супернатант удаляют, и клеточный осадок ресуспендируют в буфере для лизиса клеток (0,15 М KCl и 10 мМ натрийфосфатный буфер, рН 7,4). Клетки лизируют обработкой ультразвуком при 4°C с использованием ультразвукового дезинтегратора образцов. Затем лизированные клетки переносят во флаконы и центрифугируют при 1600 об/мин в течение 10 мин при 4°С для удаления интактных клеток, ядер и крупного клеточного дебриса. Супернатант удаляют и переносят в пробирку для центрифугирования при 8600 об/мин в течение 20 мин при 4°С. После центрифугирования полученный Супернатант, представляющий собой фракцию S9 гомогената клеток СаСо2, осторожно удаляют и распределяют аликвотами по флаконам для хранения при -80°С до использования. Во время использования лизат СаСо2 S9 разбавляют до 0,5 мг/мл в 0,1 М трис-буфере, рН 7,4.
S9 печени крысы (XenoTech, Lenexa, K.S; R1000.S9, 20 мг/мл) разбавляют до 0,5 мг на мл в 0,1 М калийфосфатном буфере при рН 7,4 и 1 мМ кофакторе NADPH.
Плазму крысы (Pel-Freez Biologicals, Rogers, AR; 36150) используют такой, какую получают от поставщика.
Свиной панкретин (Sigma Aldrich, St. Louis, МО; P1625-100G) разбавляют до 10 мг/мл в 0,1 М трис-буфере, рН 7,4.
Для того, чтобы получить смыв с толстой кишки крысы, у умерщвленной крысы иссекают толстую кишку между ceacum и прямой кишкой. При 0°С (ледяная баня) вливают пять-10 мл буфера PBS, рН 7,4 (в зависимости от массы крысы) в просвет толстой кишки и собирают в 250-мл стеклянный стакан. Смыв толстой кишки переносят в 10-мл конические пробирки с использованием шприца, снабженного фильтром. Образцы в 0,5 мл смыва толстой кишки хранят при -80°С до использования. Их используют без разбавления.
Анализы на ферментативную устойчивость пролекарства в СаСо2 S9, S9 печени крысы, плазме крысы, свином панкреатине и толстой кишке крысы выполняют с использованием следующей процедуры. Лизат распределяют аликвотами по девяносто (90) мкл в обозначенные пробирки (tubes) на многолуночных планшетах. Лизат предварительно инкубируют в течение 10 мин при 37°С. За исключением времени t(0) в несколько лунок, представляющих различное время инкубации, добавляют 10 мкл 400-мкМ раствора испытываемого соединения в 0,1 М трис-буфере, рН 7,4. Образцы инкубируют при 37°С. В каждый момент времени реакцию гасят, добавляя 300 мкл 100% этанола. Образцы тщательно перемешивают, пробирки переносят в планшет с лунками с V-образным дном и хранят при -20°С. Для времени t(0) лизат гасят 300 мкл охлажденного на льду 100% этанола, тщательно перемешивают, добавляют 10 мкл 400-мкМ раствора испытываемого соединения и перемешивают, и пробирку с образцом переносят в планшет с лунками с V-образным дном и хранят при -20°С. Для анализа 180 мкл каждого образца переносят в 96-луночный планшет с лунками с V-образным дном и герметично закрывают. После сбора образцов для всех моментов времени планшет центрифугируют в течение 10 мин при 5600 об/мин при 4°С. Затем сто пятьдесят (150) мкл из каждой лунки переносят в 96-луночный планшет с круглодонными лунками. Образцы анализируют с использованием ЖХ/МС/МС для определения концентраций пролекарства и исходного лекарственного средства.
Для исследований устойчивости при рН 8,0 190 мкл 150 мМ NaH2PO4 буфера, рН 8,0, добавляют в каждую пробирку с образцом. В каждую пробирку добавляют десять (10) мкл 10 мМ раствора испытываемого соединения и смешивают. Образцы инкубируют в течение 60 мин при 37°С. После инкубации образцы переносят в условия комнатной температуры, и в каждую пробирку добавляют 800 мкл 50% раствора ACN в воде. Образцы анализируют с использованием ЖХ/МС/МС для определения концентраций пролекарства и исходного лекарственного средства.
Анализ ЖХ-МС/МС для МНР выполняют с использованием API 4000, снабженного Agilent 1100 ВЭЖХ и автоматическим пробоотборником Leap Technologies. Используют колонку ВЭЖХ Phenomenex Onyx Monolithic С 18 (СНО-7644) при температуре 35°С, скорость потока 2,0 мл/мин, объем впрыска 30 мкл и время прохода 3 мин. Подвижная фаза AI представляет собой 0,1% муравьиную кислоту воде, и подвижная фаза АН представляет собой 0,1% муравьиную кислоту в ацетонитриле. Градиент составляет 98% AI/2% AII на время 0; 98% AI/2% AII на время 0,1 мин; 5% AI/95% AII на время 1,4 мин; 5% AI/95% AII на время 2,2 мин; 98% AI/2% АН на время 2,3 мин; и 98% AI/2% AII на время 3,0 мин. Содержание MHF определяют с использованием ионов по отрицательному типу (01 128,94; Q2 71).
Устойчивость пролекарств DMF и некоторых MHF по настоящему изобретению в различных средах приводится в таблице 1.
Пример 53
Биологическая доступность метилгидрофумарата после перорального введения пролекарств метилгидрофумарата
Крыс получают из коммерческих источников и предварительно канюлируют в яремной вене. Животные во время эксперимента находятся в сознании. Всех животных не кормят в течение ночи и в течение 4 часов после дозирования пролекарства формулы (I).
Образцы крови крыс (0,3 мл/образец) собирают у всех животных перед дозированием и в различные моменты времени до 24 час после дачи дозы в пробирки, содержащие ЭДТК. Две аликвоты (по 100 мкл каждая) гасят 300 мкл метанола и хранят при -20°С до анализа.
Для того чтобы получить стандарты для анализа, 90 мкл крови крысы гасят 300 мкл метанола, затем 10 мкл закрепляющего (spiking) стандарта и/или 20 мкл внутреннего стандарта. Пробирки с образцами встряхивают в течение, по меньшей мере, 2 мин и затем центрифугируют при 3400 об/мин в течение 20 мин. Затем супернатант переносят в инжекционную склянку или планшет для анализа ЖХ-МС-МС.
Для того чтобы получить образцы для анализа, 20 мкл внутреннего стандарта добавляют в каждую пробирку с погашенным образцом. Пробирки с образцами встряхивают в течение, по меньшей мере, 2 мин и затем центрифугируют при 3400 об/мин в течение 20 мин. Затем супернатант переносят в инжекционную склянку или планшет для анализа ЖХ-МС-МС.
Анализ ЖХ-МС-МС осуществляют с использованием API 4000 (MS 12), снабженного Agilent 1100 ВЭЖХ и автоматическим пробоотборником Leap Technologies. Используют следующие колонки: колонка ВЭЖХ, Onyx Monolithic С 18 Phenomenex (PN СНО-7644), 35°С; скорость потока 2,0 мл/мин; объем впрыска 30 мкл; время прохода 3 мин; подвижная фаза А: 0,1% муравьиная кислота в воде; подвижная фаза В: 0,1% муравьиная кислота в ацетонитриле (ACN): градиент составляет 98% А/2% В на время 0,0 мин; 98% А/2% В на время 0,1 мин; 5% А/95% В на время 1,4 мин; 5% А/95% В на время 2,2 мин; 98% А/2% В на время 2,3 мин; и 98% А/2% В на время 3,0 мин. МНР контролируют с использованием ионов по отрицательному типу.
Некомпартментальный анализ осуществляют с использованием программного обеспечения WinNonlin (v.3.1 Professional Version, Pharsight Corporation, Mountain View, California) по индивидуальным профилям животных. Суммарную статистику по оценке основных параметров выполняют для Cmax (пик концентрации, наблюдаемый после дозирования), Tmax (время до максимальной концентрации представляет собой время, при котором наблюдают максимальную концентрацию), AUC(0-t) (площадь под кривой зависимости концентрации в плазме от времени от времени ноль до времени последнего отбора, оценивают с использованием трапезоидального log-линейного метода), AUC(0-∞) (площадь под кривой зависимости концентрации в плазме от времени от времени ноль до бесконечности, оценивают с использованием трапезоидального log-линейного метода до времени последнего отбора с экстраполяцией до бесконечности) и t1/2,z (конечный период полураспада).
Пролекарства МНР или DMF вводят перорально через желудочный зонд группам из шести взрослых самцов крыс Sprague-Dawley (примерно 250 г). Животные во время эксперимента находятся в сознании. Пролекарства МНР или DMF вводят перорально или через толстую кишку в 3,4% фозале в дозе 70 мг-эквивалентов MHF на кг массы тела.
Относительную биологическую доступность МНР, в процентах (Р%), определяют, сравнивая площади под кривой зависимости концентрации МНР от времени (AUC) после введения перорально или через толстую кишку Пролекарства МНР или DMF с AUC под кривой зависимости концентрации MHF после внутривенного введения МНР в нормализованной дозе.
Пролекарства MHF (41), (3), (9) и (11), когда их вводят перорально крысам в дозе 30 мг/кг MHF-эквивалентов в 50 мМ растворе ацетата натрия, рН 4,6, обнаруживают абсолютную биологическую доступность (относительно IV), колеблющуюся от примерно 43% до примерно 60% при средней биодоступности примерно 51%.
Пример 54
Животная модель ЕАЕ для оценки терапевтической эффективности пролекарств MHF для Лечения рассеянного склероза
Животные и индукция ЕАЕ
Самок мышей C57BL/6 в возрасте 8-10 недель (Harlan Laboratories, Livermore, CA) иммунизируют подкожно в бока и средне-лопаточную область 200 мкг пептида гликопротеина миелина олигодендроцитов (MOG35-55) (синтезирован Invitrogen), эмульгированного (объемное соотношение 1:1) с полным адъювантом Фрейнда (CFA) (содержащим 4 мг/мл Mycobacterium tuberculosis). Эмульсию получают методом экструзии через шприц с помощью двух стеклянных шприцов Luer-Lock, соединенных 3-ходовым запорным краном. Мышам также дают интраперитонеальную инъекцию 200 нг коклюшного токсина (List Biological Laboratories, Inc., Campbell, CA) в день иммунизации и день второй после иммунизации. Мышей взвешивают и проверяют ежедневно на клинические признаки экспериментального аутоиммунного энцефаломиелита (ЕАЕ). Пищу и воду дают ad libitum, и как только животные начинают показывать заболевание, пищу подают на дно клетки. Все эксперименты санкционированы Instititional Animal Care и Use Committee.
Клиническая оценка
Мышей оценивают ежедневно, начиная с дня 7 после иммунизации. Шкала клинических оценок следующая (Miller and Karplus, Current Protocols in Immunology, 2007, 15.1.1-15.1.18): 0 = нормальная; 1 = вялый хвост или слабость задних конечностей (определяется по скольжению лап между прутками верха клетки во время передвижения); 2 = вялый хвост и слабость задних конечностей; 3 = частичный паралич задних конечностей (определяется по отсутствию нагрузки на задние конечности, но все еще до некоторой степени имеется способность к движению одной или обеих задних конечностей); 4 = полный паралич задних конечностей; 5 = состояние агонии (включает паралич передних конечностей) или гибель.
Лечение
Пролекарство DMF или MHF растворяют в смеси 0,5% метоцеллюлозы/0,1% твина 80 в дистиллированной воде и вводят перорально через желудочный зонд дважды в день, начиная с 3 дня после иммунизации и до окончания. Дексаметазон растворяют в IX буфере PBS и вводят подкожно один раз в день. Группы обработки следующие: один носитель, 15 мг/кг пролекарства DMF, 20 мг/кг пролекарства MHF и 1 мг/кг дексаметазона.
Описание 1
Использование животной модели для оценки эффективности при лечении псориаза
Мышиную модель тяжелого комбинированного иммунодефицита (SCID) можно использовать для оценки эффективности соединений для лечения псориаза у людей (Boehncke, Ernst Shering Res. Found Workshop, 2005, 50, 213-14; и Bhagavathula et al., J.Pharmacol. Expt'l Therapeutics, 2008, 324(3), 938-947).
Мышей SCID используют в качестве реципиентов ткани. Одну биопсию каждого здорового добровольца или с псориазом пересаживают на поверхность спины мыши. Лечение начинают через 1-2 недели после трансплантации. Животных с трансплантатами человеческой кожи разделяют на группы обработки. Животных обрабатывают дважды в день в течение 14 дней. По окончании обработки животных фотографируют и затем умерщвляют. Трансплантированную человеческую ткань вместе с окружающей мышиной кожей удаляют хирургически и фиксируют в 10% формалине, и получают образцы для микроскопии. Измеряют толщину эпидермиса. Срезы тканей окрашивают антителами к ассоциированному с пролиферацией антигену Ki-67 и моноклональными античеловеческими антителами CD3+ для детекции человеческих Т-лимфоцитов в трансплантированной ткани. Срезы также зондируют антителами к с-myc и β-катенину. Положительная реакция на лечение отражается в уменьшении средней толщины эпидермиса трансплантатов псориатических кожных трансплантатов. Положительная реакция также ассоциируется с уменьшенной экспрессией Ki-67 в кератиноцитах.
Описание 2
Животная модель для оценки терапевтической эффективности пролекарств MHF для Лечения рассеянного склероза
Эксперименты проводят на самках мышей в возрасте 4-6 недель, принадлежащих к линии C57BL/6, массой 17-20 г.Экспериментальный аутоиммунный энцефаломиелит (ЕАЕ) активно вызывают с использованием синтетического пептида гликопротеина миелина олигодендроцитов (MOG35-55, MEVGWYRSPFSRWHLYRNGK). Каждой мыши дают наркоз и она получает 200 мкг пептида MOG и 15 мкг экстракта сапонина из вторичной коры Quilija, эмульгированного в 100 мкл забуференного фосфатом физиологического раствора. Объем 25 мкл инъецируют подкожно над four flank областями. Мышей также инъецируют интраперитонеально 200 нг кашлевого токсина в 200 мкл PBS. Вторую идентичную инъекцию кашлевого токсина дают через 48 час.
Пролекарство MHF вводят в различных дозах. Контрольные животные получают 25 мкл ДМСО. Ежедневное лечение длится от дня 26 до дня 36 после иммунизации. Клинические оценки получают ежедневно от дня 0 после иммунизации до дня 60.
Клинические признаки оценивают с использованием следующего протокола: 0 - нет заметных признаков; 0,5 - вялость кончика хвоста, сгорбленность и неподвижность; 1 - полная вялость хвоста; 1,5 - вялость хвоста и слабость задних конечностей (нетвердая походка и плохой контроль над задними конечностями); 2 - односторонний частичный паралич задних конечностей; 2,5 - двусторонний паралич задних конечностей; 3 - полный двусторонний паралич задних конечностей; 3,5 - полный паралич задних конечностей и односторонний паралич передних конечностей; 4 - общий паралич задних конечностей и передних конечностей (Eugster et al., Eur. J. ImmunoL, 2001, 31, 2302-2312).
Воспаление и демиелинизацию оценивают гистологически на срезах ЦНС мышей с ЕАЕ. Мышей умерщвляют через 30 или 60 дней, у всех животных извлекают спинной мозг и помещают в 0,32 М раствор сахарозы при 4°С на ночь. Ткани препарируют и делают срезы. Краситель быстрый голубой Luxol используют для наблюдения за демиелинизацией. Окрашивание гематоксилином и эозином используют для подчеркивания областей воспаления путем более темного окрашивания ядер мононуклеарных клеток. Иммунные клетки, окрашенные Н&Е, подсчитывают в светлом поле в оптическом микроскопе. Срезы разделяют в сером и белом веществе, и каждый сектор обсчитывают вручную перед объединением для получения общего результата для среза. Метят Т-клетки иммунным методом моноклональными антителами против CD3+. После промывки срезы инкубируют с козьими антикрысиными вторичными антителами HPR. Затем срезы промывают и контрокрашивают метиловым зеленым. Спленоциты, извлеченные из мышей на 30 и 60 день после иммунизации, обрабатывают буфером для лизиса для удаления красных клеток крови. Затем клетки ресуспендируют в PBS и считают. Клетки при плотности примерно 3×106 клеток/мл инкубируют в течение ночи с 20 мкг/мл пептида MOG. Супернатанты от стимулированных клеток оценивают на уровни белка IFN-y с использованием соответствующей системы иммуноанализа мышиного IFN-Y.
Описание 3
Использование животной модели для оценки эффективности при лечении
воспалительного заболевания кишечника
Животные модели воспалительного заболевания кишечника описаны в Jurjus et al., J. Pharmacol. Toxicol. Methods, 2004, 50, 81-92; Villegas et al., Int'l Immunopharmacol., 2003, 3, 1731-1734; и в Murakami et al.. Biochemical. Pharmacol., 2003, 66, 1253-1261. Например, для оценки эффективности соединения для лечении воспалительного заболевания кишечника можно использовать следующий протокол.
Используют самок мышей ICR. Мышей делят на группы обработки. Группы получают или воду (контроль), дают 5% DSS в водопроводной воде для начала эксперимента для индуцирования колита или различные концентрации испытываемого соединения. После введения испытываемого соединения в течение 1 недели также вводят 5% DSS в водопроводной воде группам, получающим испытываемое соединение, в течение 1 недели. По окончании эксперимента всех мышей умерщвляют, и извлекают толстую кишку. Получают образцы слизистой оболочки толстой кишки и гомогенизируют их. Количественно определяют провоспалительные медиаторы (например, IL-1α, IL-1β, TNF-α, PGE2 и PGF2α) и концентрации белка. Каждую иссеченную толстую кишку проверяют гистологически и оценивают повреждение толстой кишки.
Описание 4
Клиническое испытание для оценки эффективности при лечении астмы Регистрируют взрослых субъектов (некурящих) с устойчивой слабой-умеренной астмой (см., например. Van Schoor and Pauwels, Eur. Respir. J., 2002, 19, 997-1002). Используют рандомизированный с двойным слепым методом и контролем плацебо двухпериодический перекрестный план. В день скрининга 1 пациенты подвергаются введению метахолина (<8 мг/мл). Базовый объем форсированного выдоха за 1 секунду (FEV1) перед каждым последующим введением должен быть в пределах 15% от скринированного базового FEV1, полученного в первое посещение. Спустя 24-72 часа в день скрининга 2 вводят нейрокинин (1×10-6 мол/мл). Период исследования после второго посещения продолжается в пределах 10 дней. Сначала введение метахолина и нейрокинина-А (NKA) выполняют в дни 1 и 0, соответственно. В четвертое посещение вводят испытываемое соединение в соответствующей дозе и в течение соответствующего периода времени. В последние 2 дня периода лечения повторяют введение метахолина и NKA. После периода лечения один имеется период отмены примерно в 5 недель, после которого пациенты переходят к другому лекарственному препарату или плацебо в период исследования два, который идентичен периоду один. Испытания функции легких выполняют с использованием спирометра. Введение метахолина осуществляют ингаляцией удвоенных концентраций метахолина до тех пор, пока FEV1 не станет >20% от postdiluent базового FEV1 указанного дня, как описано в Cockcroft et al., Clin. Allergy, 1977, 7, 235-243. Введение NKA выполняют ингаляцией возрастающими концентрациями NKA, как описано в Van Schoor et al., Eur. Respir. J., 1998, 12, 17-23. Действие лечения на чувствительность дыхательных путей определяют с использованием соответствующих статистических методов.
Описание 5
Использование животной модели для оценки эффективности при лечении хронической обструктивной болезни легких
Животную модель с использованием мышей, хронически подвергающихся воздействию от курения сигарет, можно использовать для оценки эффективности при лечении эмфиземы (см., например, Martorana et al.. Am. J. Respir. Crit. Care Med., 2005, 172, 848-835; и Cavarra et al., Am. J. Respir. Crit. Care Med., 2001, 164, 886-890). Используют шестинедельных самцов мышей C57B1/6J. В исследовании с резким воздействием мышей подвергают воздействию или комнатного воздуха или дыма от пяти сигарет в течение 20 минут. В исследовании с хроническим воздействием мышей подвергают воздействию или комнатного воздуха или дыма от трех сигарет в день в течение 5 дней в неделю в течение 7 месяцев.
Для исследования с резким воздействием мышей делят на три группы по 40 животных в каждой. Затем такие группы делят на четыре подгруппы по 10 мышей в каждой следующим образом: (1) без лечения/воздействие воздуха; (2) без лечения/воздействие дыма; (3) первая доза испытываемого соединения плюс воздействие дыма; (4) вторая доза испытываемого соединения. В первой группе по окончании воздействия в промывной бронхоальвеолярной жидкости оценивают антиоксидантную способность, эквивалентную тролоксу. Во второй группе в промывной бронхоальвеолярной жидкости определяют цитокины и хемокины за 4 часа с использованием коммерческой панели цитокинов; и в третьей группе оценивают число клеток в промывной бронхоальвеолярной жидкости за 24 часа.
Для исследования с хроническим воздействием используют пять групп животных: (1) без лечения/воздействие воздуха; (2) первая доза испытываемого соединения плюс воздействие воздуха; (3) без лечения/воздействие дыма; (4) вторая доза испытываемого соединения плюс воздействие дыма; и (5) первая доза испытываемого соединения плюс воздействие дыма. После семи месяцев постоянного воздействия комнатного воздуха или сигаретного дыма по 5-12 животных из каждой группы умерщвляют, и легкие фиксируют интратекально формалином. Объем легких измеряют по вытеснению воды. Легкие окрашивают. Оценка эмфиземы включает средний линейный intercept и площадь внутренней поверхности. Объемную плотность макрофагов, помеченных иммуногистохимически антимышиными моноклональными антителами Мас-3, определяют точечным подсчетом. Мышь рассматривают как имеющую бокаловидноклеточную дисплазию, когда, по меньшей мере, один или несколько среднего размера бронхов/легких показывают положительное периодическое окрашивание кислым красителем по Шиффу. Для определения десмозина свежие легкие гомогенизируют, обрабатывают и анализируют высокоэффективной жидкостной хроматографией.
Описание 6
Животные модели для оценки терапевтической эффективности пролекарств MHF для лечения болезни Паркинсона
Нейротоксичность, вызванная МРТР
МРТР или 1-метил-4-фенил-1,2,3,6-тетрагидропиридин представляет собой нейротоксин, который вызывает паркинсоновский синдром как у людей, так и у подопытных животных. Исследования механизма нейротоксичности МРТР показывают, что он предполагает генерацию основного метаболита МРР+ образовавшегося за счет активности моноаминоксидазы в отношении МРТР. Ингибиторы моноаминоксидазы блокируют нейротоксичность МРТР как для мышей, так и для приматов. Оказывается, что специфичность нейротоксического действия МРР+ в отношении дофаминергических нейронов имеет место из-за поглощения МРР+ синаптическим переносчиком дофамина. Блокаторы такого переносчика предотвращают нейротоксичность МРР+. Показано, что MPP+ является относительно специфическим ингибитором активности митохондриального комплекса I, связываясь с комплексом I в сайте связывания ретенона и уменьшая окислительное фосфорилирование. Исследования in vivo показывают, что МРТР может снижать концентрации АТФ в полосатом теле у мышей. Показано, что МРР+ введенный интрастриатально крысам, вызывает значительное обеднение АТФ, а также повышенную концентрацию лактата, удерживаемого в полосатом теле, в месте инъекции. Соединения, которые усиливают выработку АТФ, могут защищать мышей от токсического действия МРТР.
Пролекарство формул (I)-(IV) вводят животным, таким как мыши или крысы, в течение трех недель перед обработкой МРТР. МРТР вводят в соответствующих дозе, с соответствующим интервалом дозирования и соответствующим способом введения в течение 1 недели перед умерщвлением. Контрольные группы получают или нормальный физиологический раствор или один гидрохлорид МРТР. После умерщвления быстро иссекают два полосатых тела и помещают в охлажденную 0,1 М перхлорную кислоту. Затем ткань обрабатывают ультразвуком, и анализируют аликвоты на содержание белка с использованием флуорометрического анализа. Также определяют количественно дофамин, 3,4-дигидроксифенилуксусную кислоту (DOPAC) и гомованилиновую кислоту (HVA). Концентрации дофамина и метаболитов выражают в нмоль/мг белка.
Пролекарства формул (I)-(IV), которые защищают от истощения DOPAC, вызываемого МРТР, истощения HVA и/или дофамина, являются нейропротекторами и поэтому могут применяться для лечения болезни Паркинсона.
Гиполокомоция, вызванная галоперидолом
Рассматриваются способность соединения реверсировать у грызунов поведенческое депрессирующее действие антагонистов дофамина, таких как галоперидол, и действенный способ скрининга лекарственных средств на возможное антипаркинсонное действие (Mandhane et al., Eur. J. Pharmacol., 1997, 328, 135-141). Отсюда способность пролекарств формул (I)-(IV) блокировать вызываемые галоперидолом недостатки в локомоторной активности у мышей можно использовать для оценки эффективности как in vivo, так и потенциальной антипаркинсонной эффективности.
Мышей, используемых в экспериментах, содержат в регулируемых условиях и позволяют акклиматизироваться перед использованием в опытах. За полтора (1,5) часа до испытания мышам вводят 0,2 мг/кг галоперидола - дозу, которая снижает базовую локомоторную активность, по меньшей мере, на 50%. Испытываемое соединение вводят за 5-60 мин до испытания. Затем животных помещают по отдельности в чистые прозрачные клетки из поликарбоната с плоской крышкой с отверстиями. Горизонтальную локомоторную активность определяют, помещая клетки в раму, содержащую матрицу 3×6 фотоэлементов, связанную с компьютером, для табуляции прерываний луча. Мышей не беспокоят с целью исследования в течение 1 часа, и число прерываний луча, совершенных в течение указанного периода, служит в качестве показателя локомоторной активности, которую сравнивают с данными для контрольных животных на статистически значимые различия.
Животная модель с 6-гидроксидофамином
Нейрохимические недостатки, видимые при болезни Паркинсона, можно воспроизвести местной инъекцией дофаминергического нейротоксина 6-гидроксидофамина (6-OHDA) в участки головного мозга, содержащие или клеточные тела или аксонные волокна нейронов эфферентной связи черного вещества с полосатым телом. За счет одностороннего повреждения пути эфферентной связи черного вещества с полосатым телом только на одной стороне головного мозга наблюдают поведенческую асимметрию в подавлении движения. Хотя животные с односторонним повреждением все еще мобильны и способны к самостоятельности, остальные чувствительные к дофамину нейроны на поврежденной стороне становятся сверхчувствительными к раздражению. Это демонстрируется тем наблюдением, что после системного введения агонистов дофамина, таких как апоморфин, животные показывают отчетливый поворот в направлении, противоположном стороне повреждения. Показано, что способность соединений вызывать контралатеральные повороты у крыс, поврежденных 6-OHDA, является чувствительной моделью для предсказания эффективности лекарственного средства при лечении болезни Паркинсона.
Самцов крыс Sprague-Dawley содержат в регулируемой среде и позволяют акклиматизироваться перед использованием в опытах. За пятнадцать минут до операции животным дают интраперитонеальную инъекцию ингибитора повторного поглощения норадреналина десипрамина (25 мг/кг) для предотвращения повреждения недофаминовых нейронов. Затем животных помещают в камеру для наркоза и дают наркоз с использованием смеси кислорода и изофлурана. Как только животные теряют сознание, их переносят в стереотаксическую раму, где наркоз поддерживают через маску. Верхнюю часть головы бреют и стерилизуют с использованием раствора иода. Как только высохнет, делают разрез диной 2 см вдоль средней линии скальпа, и кожу оттягивают и закрепляют на спине для воздействия на череп. Затем сверлят небольшое отверстие в черепе выше места инъекции. Для того чтобы повредить путь эфферентной связи черного вещества с полосатым телом, инъекционную канюлю постепенно опускают до положения выше правого среднего пучка переднего мозга на -3,2 мм еще вперед, -1,5 мм вбок посередине от брегмы и на глубину 7,2 мм ниже твердой мозговой оболочки. Через две минуты после погружения канюли дают инфузию 6-OHDA со скоростью 0,5 мкл/мин в течение 4 мин для обеспечения конечной дозы 8 мкг. Канюлю, перед тем, как ее вынут, оставляют на месте еще в течение 5 мин для облегчения диффузии. Затем кожу соединяют швом, животное извлекают из стереотаксической рамы и возвращают на место его содержания. Крысам дают восстановиться после операции в течение двух недель перед поведенческим испытанием.
Ротационное поведение измеряют с использованием ротаметрической системы с роликами из нержавеющей стали (диам. 45 см×15 см высотой), закрытыми прозрачным плексигласом вокруг конца ролика и продолжающимся на высоту 29 см. Для того, чтобы оценить вращение, крыс помещают в тканевый чехол, присоединенный к эластичному фалу, соединенному с расположенным выше ролика оптическим ротаметром, оценивающим движение влево или вправо или как частичный (45°) или как полный (360°) поворот.
Для того чтобы уменьшить стресс во время введения испытываемого соединения, крыс сначала помещают в аппарат на 15 мин четыре дня подряд. В день испытания крысам дают испытываемое соединение, например, пролекарство формул (I)-(IV). Непосредственно перед испытанием животным дают подкожную инъекцию субпороговой дозы апоморфина и затем помещают в крепление, и регистрируют число поворотов в течение одного часа. Общее число полных контралатеральных поворотов на протяжении часового периода испытания служит в качестве индекса антипаркинсонной эффективности лекарственного средства.
Описание 7
Животная модель для оценки эффективности пролекарств MHF для лечения болезни Альцгеймера
В качестве животной модели болезни Альцгеймера используют гетерозиготных трансгенных мышей, экспрессирующих мутантный ген Swedish AD hAPPK670N, M671L (Tg2576; Hisao, Learning & Memory, 2001, 8, 301-308). Животных содержат в стандартных условиях со световым циклом свет/темнота 12:12 и свободным доступом к корму и воде. Начиная с возраста 9 месяцев, мышей делят на две группы. Первые две группы животных получают возрастающие дозы пролекарства MHF в течение шести недель. Оставшаяся контрольная группа получает в течение шести недель инъекции физиологического раствора ежедневно.
Поведенческое испытание проводят при каждой дозе лекарственного средства с использованием одной и той же последовательности в течение двух недель во всех экспериментальных группах: (1) изменение обучения в пространстве, (2)локомоция, (3) боязнь кондиционирования и (4) чувствительность к шоку.
Приобретение примера пространственного обучения и изменения обучения проверяют в течение первых пяти дней введения испытываемого соединения с использованием водного Т-лабиринта, как описано в Bardgett et al., Brain Res. Bull., 2003, 60, 131-142. Мышей помещают в водный Т-лабиринт на 1-3 дня, и восприятие задачи начинается в день 4. В день 4 мышей обучают искать спасательную платформу в одном выбранном ответвлении лабиринта до тех пор, пока не будет сделано 6-8 правильных выборов в последовательных испытаниях. Затем в день 5 проводят фазу изменения обучения. Во время фазы изменения обучения мышей обучают искать спасательную платформу в выбранном ответвлении, противоположном местоположению спасательной платформы в день 4. Используют те же исполнительные критерии и интервалы между испытаниями, что и во время восприятия задачи.
Большие перемещения оценивают для того, чтобы определить, что на результаты изменения обучения в пространстве не влияет способность передвигаться после операции. После периода отдыха в два дня горизонтальные перемещения, исключая вертикальные движения и мелкую моторику, оценивают в день 8 в камере, снабженной решеткой из чувствительных к перемещению детекторов. Число движений, сопровождаемых одновременной блокировкой и деблокировкой детектора в горизонтальном направлении, измеряют за период в один час.
Способность животного к контекстуальному и примерному запоминанию проверяют с использованием примера боязни кондиционирования, начиная со дня 9. Испытание проводят в камере, в которой содержится кусок абсорбирующей хлопчатобумажной ткани, смоченной в испускающим запах растворе, таком как экстракт мяты, помещенный ниже решетчатого пола. Для обучения животных в день 9 вводят на лапы звуковой шоковый цикл из 3 испытаний по 5 мин при 80 дБ, 2800 Гц. В день 10 проверяют запоминание контекста, возвращая каждую мышь в камеру без воздействия звука и шока на лапы, и регистрируют наличие или отсутствие поведения скованности каждые 10 секунд в течение 8 минут. Скованность определяют как отсутствие движения, такого как способность передвигаться, сопение или стереотипия, иные, чем дыхание.
В день 11 проверяют реакцию животного на измененный контекст и на слуховые примеры. Экстракт кокосового ореха помещают в чашку и представляют звук в 80 дБ, но шок на лапы не подают. Затем определяют наличие или отсутствие скованности в ответ на измененный контекст в течение первых 2 минут испытания. Затем звук представляют непрерывно в течение остальных 8 минут испытания, и определяют наличие или отсутствие скованности.
В день 12 животных испытывают для оценки их чувствительности к кондиционирующему раздражителю, т.е., шоку на лапы.
После последнего дня поведенческого испытания животным дают наркоз, и затем извлекают головной мозг, фиксирую его в течение ночи, и делают срезы через гиппокамп. Срезы окрашивают для получения изображения β-амилоидных бляшек.
Данные анализируют с использованием соответствующих статистических методов.
Описание 8
Животная модель терапевтической эффективности пролекарств MHF для лечения болезни Гентингтона
Нейрозащитное действие на трансгенной мышиной модели болезни Гентингтона
Трансгенных мышей HD линии N171-82Q и нетрансгенных детенышей в возрасте 10 недель обрабатывают пролекарством формул (I)-(IV) или носителем. Мышей помещают на вращающийся брус («ротарод» («rotarod»)). Длительность периода, через который мышь падает с ротарода, регистрируют как меру координации движений. Общее расстояние, прошедшее мышью, также регистрируют как меру общей локомоции. Мыши, которым ввели пролекарства формул (I)-(IV), которые являются нейропротекторами на трансгенной мышиной модели HD N171-82Q, остаются на ротароде в течение более длительного периода времени и «путешествуют» дальше, чем мыши, которым вводили носитель.
Малонатная модель болезни Гентингтона
Ряд обратимо и необратимо действующих ингибиторов ферментов, вовлеченных в пути генерации энергии, используют для получения животных моделей для нейродегенеративных заболеваний, таких как болезни Паркинсона и Гентингтона. В частности, для получения модели болезни Гентингтона используют ингибиторы сукцинатдегидрогеназы - фермента, который оказывает воздействие на гомеостаз клеточной энергии.
Для того чтобы оценить действие пролекарств MHF формул (I)-(IV) на данной малонатной модели болезни Гентингтона, пролекарство формул (I)-(IV) вводят самцам крыс Spargue-Dawley в соответствующих дозах, с соответствующим дозировочном интервалом и соответствующим способом. Пролекарство вводят в течение двух недель перед введением малоната и затем еще в течение недели перед умерщвлением. Малонат растворяют в дистиллированной деионизованной воде, и доводят рН до 7,4 0,1 М HCl. Интрастриатальные инъекции 1,5 мкл 3 мкмоль раствора малоната делают в левое полосатое тело на уровне брегмы на 2,4 мм вбок от средней линии и на 4,5 мм вентрально к твердой мозговой оболочке. Животных умерщвляют в 7 дней декапитацией, и головной мозг быстро удаляют и помещают в охлажденный льдом 0,9% солевой раствор. Мозги иссекают с интервалом 2 мм в соответствующей форме. Затем срезы помещают задней стороной вниз в 2% раствор хлорида 2,3,5-трифенилтетразолия. Срезы окрашивают в темноте при комнатной температуре в течение 30 мин и затем извлекают и помещают в 4% параформальдегид, рН 7,3. Повреждения, отмечаемые по слабому окрашиванию, оценивают на задней поверхности каждого среза. Измерения подтверждают сравнением с измерениями, полученными на соседних участках, окрашенных Nissl. Соединения, обнаруживающие нейрозащитное действие и поэтому потенциально применимые при лечении болезни Гентингтона, показывают уменьшение повреждений, вызванных малонатом.
Описание 9
Животная модель терапевтической эффективности пролекарств MHF для лечения бокового амиотрофического склероза
Разработана мышиная модель ALS, ассоциированного с мутацией SOD1, при которой мыши экспрессируют супероксиддисмутазную (SOD) мутацию человека глицин→аланин в остатке 93 (SOD1). Такие мыши с SOD1 обнаруживают доминантный прирост вредного свойства SOD, и у них развивается дегенерация двигательных нейронов и дисфункция, схожая с дисфункцией у людей с ALS. Трансгенные мыши с SOD1 показывают признаки слабости задних конечностей в возрасте примерно 3 месяцев и погибают в 4 месяца. Признаки, обычные для ALS человека, включают астроцитоз, микроглиоз, окислительный стресс, возросшие уровни циклооксигеназы/простагландина и, как развитие болезни, основательную потерю двигательных нейронов.
Исследования выполняют на трансгенных мышах, сверхэкспрессирующих мутации человека Cu/Zn-SOD G93F (B6SJL-TgN (SOD1-G93A) 1 Gur) и нетрансгенных мышах B6/SJL и их детенышах дикого типа. Мышей содержат при 12-час цикле дневного света и (начиная с возраста 45 дней) обеспечивают свободный доступ или к корму с добавлением испытываемого соединения или, в качестве контроля, к холодному прессованному корму обычного состава, переработанному в идентичные гранулы. Генотипирование можно проводить в возрасте 21 дня, как описано в Gumey et al., Science, 1994, 264(5166), 1772-1775. Мышей с SOD1 делят на группы и обрабатывают испытываемым соединением, например, пролекарством МНР, или используют в качестве контроля.
Мышей осматривают ежедневно и раз в неделю взвешивают. Для того чтобы оценить состояние здоровья, мышей еженедельно взвешивают и проверяют на изменения лакримации/саливации, закрытия век, подергивания ушей и зрачковых реакций, ориентации шерстинок, постуральных и установочных рефлексов и общей оценки состояния организма. Общую патологическую проверку проводят во время умерщвления.
Действия по координации движений животных можно оценить одним или несколькими способами, известными специалистам в данной области техники. Например, координацию движений можно оценить с использованием метода неврологической оценки. При неврологической оценке контролируют неврологический показатель каждой конечности и регистрируют согласно принятой 4 - позиционной шкале: 0 - нормальный рефлекс у задних конечностей (животное будет разворачивать свои задние конечности, когда поднимается с помощью хвоста); 1 - анормальный рефлекс задних конечностей (утрата способности разворачивать задние конечности, когда животное поднимается с помощью хвоста); 2 - анормальный рефлекс задних конечностей и признаки паралича; 3 - утрата рефлекса и полный паралич; и 4 - неспособность выпрямляться, когда лежит на боку, за 30 секунд, или обнаруживается погибшим. Первичная конечная точка является выживанием с вторичными конечными точками неврологической оценки и массой тела. Наблюдают за неврологическими оценками и массой тела и регистрируют их пять раз в неделю. Анализ данных осуществляют с использованием соответствующих статистических методов.
В испытании на ротадоре оценивают способность животного оставаться на вращающемся штыре, давая возможность оценить координацию движений и проприоцептивную чувствительность. Прибор представляет собой стержень диаметром 3 см с автоматическим вращением, например, со скоростью 12 оборотов в мин. В испытании на ротадоре определяют как долго мышь может сама оставаться на стержне и не падать. Испытание можно прекратить после произвольного предела в 120 с.Животное может упасть ранее 120 с, действие регистрируют и выполняют два дополнительных испытания. Вычисляют среднее время из 3 испытаний. Недостаток моторики показывают по снижению времени прогулки.
В испытании с решеткой мышей помещают на решетку (длина 37 см, ширина 10,5 см, размер отверстий 1×1 см2), установленную выше плоской опоры. Число раз, когда мышь попадает своими лапами в решетку, отмечают, и это служит в качестве меры координации движений.
В испытании с подвешиванием оценивают способность животного висеть на проволоке. Прибор представляет собой проволоку, натянутую горизонтально на высоте 40 см над столом. Животное присоединяют к проволоке передними лапами. Время, которое требуется животному для того, чтобы ухватиться за струну своими задними лапами, регистрируют (макс.60 с) в трех последовательных опытах.
Электрофизиологические измерения (EMG) также можно использовать для оценки состояния двигательной активности. Электромиографические показатели регистрируют с использованием прибора электромиографа. Во время контроля EMG мышам дают наркоз. Измеренные параметры представляют собой амплитуду и латентный период потенциала действия соединения на мышцы (СМАР). СМАР измеряют в икроножной мышце после стимуляции седалищного нерва. Электрод сравнения вставляют вблизи ахиллова сухожилия, и активную иглу помещают в основание хвоста. Иглу заземления вставляют в нижнюю часть спины мыши. Седалищный нерв раздражают одним импульсом в 0,2 мс при чрезвычайной интенсивности (12,9 мА). Измеряют амплитуду (мВ) и латентный период реакции (мс). Амплитуда является показателем единиц активного движения, в то время как дистальный латентный период отражает скорость проводимости двигательного нерва.
Эффективность испытываемых соединений также можно оценить с использованием биомаркерного анализа. Для оценки регуляции белковых биомаркеров у мышей SOD1 во время появления ухудшения моторики образцы поясничной части спинного мозга (белковые экстракты) наносят на матрицы ProteinChip с изменяющимися химическими/биохимическими свойствами поверхности и анализируют, например, времяпролетной масс-спектрометрией с ионизацией поверхности, усиленной лазерной десорбцией. Затем данные, с использованием методов анализа интегрированного профиля белковой массы, используют для сравнения профилей экспрессии белка различных групп обработки. Анализ можно выполнить с использованием соответствующих статистических методов.
Наконец, следует отметить, что имеются альтернативные пути выполнения воплощений, раскрытых в данном описании. Соответственно, представленные воплощения следует рассматривать как иллюстративные, а не ограничительные, и притязания не должны ограничивается подробностями, приведенными в данном описании, которые могут быть модифицированы в пределах их объема и эквивалентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ ИЛИ ПРЕДУПРЕЖДЕНИЕ СИНДРОМА БЕСПОКОЙНЫХ НОГ С ИСПОЛЬЗОВАНИЕМ ПРОЛЕКАРСТВ АНАЛОГОВ ГАМК | 2004 |
|
RU2458049C2 |
| ЛЕЧЕНИЕ ИЛИ ПРЕДУПРЕЖДЕНИЕ СИНДРОМА БЕСПОКОЙНЫХ НОГ С ИСПОЛЬЗОВАНИЕМ ПРОЛЕКАРСТВ АНАЛОГОВ ГАМК | 2004 |
|
RU2377234C2 |
| ИНГИБИТОРЫ СЕРИН/ТРЕОНИНОВЫХ КИНАЗ | 2013 |
|
RU2650501C2 |
| СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩИЕ СВОЙСТВАМИ ВЫСВОБОЖДЕНИЯ ГОРМОНА РОСТА, СПОСОБ СТИМУЛЯЦИИ ВЫДЕЛЕНИЯ ГОРМОНА РОСТА ИЗ ГИПОФИЗА МЛЕКОПИТАЮЩЕГО | 1999 |
|
RU2298547C2 |
| ПРОЛЕКАРСТВА ЛЕВОДОПА, КОМПОЗИЦИИ НА ИХ ОСНОВЕ И ИХ ПРИМЕНЕНИЯ | 2005 |
|
RU2365580C2 |
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2769696C2 |
| ТРИЦИКЛИЧЕСКИЕ ТРИАЗОЛЬНЫЕ СОЕДИНЕНИЯ | 2014 |
|
RU2666728C2 |
| СОЕДИНЕНИЯ ДИГИДРОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ | 2014 |
|
RU2678990C1 |
| Соединение, ингибирующее активности киназ ВТК и/или JAK3 | 2014 |
|
RU2650512C2 |
| β-D-2'-ДЕЗОКСИ-2'-α-ФТОР-2'-β-С-ЗАМЕЩЕННЫЕ-2-МОДИФИЦИРОВАННЫЕ-N6-ЗАМЕЩЕННЫЕ ПУРИНОВЫЕ НУКЛЕОТИДЫ ДЛЯ ЛЕЧЕНИЯ ВЫЗВАННЫХ HCV ЗАБОЛЕВАНИЙ | 2016 |
|
RU2764767C2 |
Изобретение относится к соединению формулы (I), являющемуся пролекарством метилгидрофумарата (МHF). В формулы (I) радикалы и символы имеют значения, указанные в формуле изобретения. Изобретение также относится к фармацевтической композиции, включающей заявленные пролекарства метилгидрофумарата, к применению заявленных пролекарств метилгидрофумарата и фармацевтической композиции, включающих их, для лечения заболеваний, таких как псориаз, астма, рассеянный склероз, воспалительное заболевание кишечника и артрит, и к способам лечения указанных заболеваний. Технический результат - более высокая пероральная биодоступность и уровни в плазме МHF, диметилфумарата и/или других метаболитов. 10 н. и 37 з.п. ф-лы, 1 табл., 54 пр.
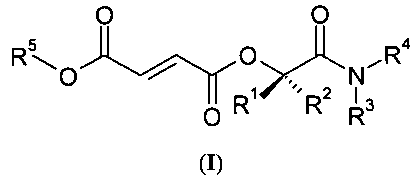
1. Соединение формулы (I)

или его фармацевтически приемлемая соль, где в указанной формуле
R1 и R2 выбирают независимо из водорода, C1-6-алкила и замещенного C1-6-алкила;
R3 и R4 выбирают независимо из водорода, C1-6-алкила, замещенного С1-6-алкила, метокси, метоксикарбонила, метоксиэтила, С4-12-циклоалкилалкила, замещенного С4-12-циклоалкилалкила, С7-12-арилалкила, замещенного С7-12-арилалкила, тиадиазолила и группы -CH2CH2NHC(O)CH2OC(O)CH=CHCOOCH3;
или R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из замещенного оксазолидина, замещенного пирролидина, морфолина, пиперазина и N-замещенного пиперазина; и
R5 представляет собой метил,
где каждую группу-заместитель выбирают независимо из галогена, -CN, -CF3,=O, -NO2, бензила, - C(O)NR11 2, -R11, -OR11, -C(O)R11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и С1-4-алкила.
2. Соединение по п. 1, где каждый из R1 и R2 представляет собой водород.
3. Соединение по п. 1, где один из R1 и R2 представляет собой водород и другой из R1 и R2 выбирают из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила.
4. Соединение по п. 1, где R3 и R4 выбирают независимо из водорода и C1-6-алкила.
5. Соединение по п. 1, где R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл морфолина.
6. Соединение по п. 1, где один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из водорода и С1-6-алкила, и R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из морфолина, пиперазина и N-замещенного пиперазина.
7. Соединение по п. 1, где один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из водорода и C1-6-алкила, R3 представляет собой водород; R4 выбирают из водорода, С1-6-алкила и бензила.
8. Соединение по п. 1, выбранное из группы, в которую входят
(N,N-диэтилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат;
метил-[N-бензилкарбамоил]метил(2Е)бут-2-ен-1,4-диоат;
метил-2-морфолин-4-ил-2-оксоэтил(2Е)бут-2-ен-1,4-диоат;
(N-бутилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат;
[N-(2-метоксиэтил)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат;
2-{2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]ацетиламино}уксусная кислота;
4-{2-[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]ацетиламино}бутановая кислота;
(N,N-диметилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат;
бис[(2-метоксиэтил)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат;
[N-(метоксикарбонил)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат;
метил-2-оксо-2-(2-оксо-1,3-оксазолидин-3-ил)этил(2Е)бут-2-ен-1,4-диоат;
{N-[2-(диметиламино)этил]карбамоил}метил-метил(2Е)бут-2-ен-1,4-диоат;
метил-2-(4-метилпиперазинил)-2-оксоэтил(2Е)бут-2-ен-1,4-диоат;
метил-{N-[(пропиламино)карбонил]карбамоил}метил(2Е)бут-2-ен-1,4-диоат;
2-(4-ацетилпиперазинил)-2-оксоэтил-метил(2Е) бут-2-ен-1,4-диоат;
{N,N-бис[2-(метилэтокси)этил]карбамоил}метил-метил(2Е)бут-2-ен-1,4-диоат;
метил-2-(4-бензилпиперазинил)-2-оксоэтил(2Е)бут-2-ен-1,4-диоат;
[N,N-бис(2-этоксиэтил)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат;
2-{(2S)-2-[(трет-бутил)оксикарбонил]пирролидинил}-2-оксоэтил-метил(2Е)бут-2-ен-1,4-диоат;
(N-{[(трет-бутил)оксикарбонил]метил}-N-метилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат;
{N-[(этоксикарбонил)метил]-N-метилкарбамоил}метил-метил(2Е)бут-2-ен-1,4-диоат;
метил-1-метил-2-морфолин-4-ил-2-оксоэтил(2Е)бут-2-ен-1,4-диоат;
[N,N-бис(2-метоксиэтил)карбамоил]этил-метил(2Е)бут-2-ен-1,4-диоат;
(N,N-диметилкарбамоил)этил-метил(2Е)бут-2-ен-1,4-диоат;
(N-{[(трет-бутил)оксикарбонил]метил}карбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат;
метил-(N-метил-N-{[(метилэтил)оксикарбонил]метил}карбамоил)метил(2Е)бут-2-ен-1,4-диоат;
{N-[(этоксикарбонил)метил]-N-бензилкарбамоил}метил-метил(2Е)бут-2-ен-1,4-диоат;
{N-[(этоксикарбонил)метил]-N-бензилкарбамоил}этил-метил(2Е)бут-2-ен-1,4-диоат;
{N-[(этоксикарбонил)метил]-N-метилкарбамоил}этил-метил(2Е)бут-2-ен-1,4-диоат;
(1S)-1-метил-2-морфолин-4-ил-2-оксоэтил-метил(2Е)бут-2-ен-1,4-диоат;
(1S)-1[N,N-бис(2-метоксиэтил)карбамоил]этил-метил(2Е)бут-2-ен-1,4-диоат;
(1S)-1-(N,N-диэтилкарбамоил)этил-метил(2Е)бут-2-ен-1,4-диоат.
9. Соединение формулы (II)
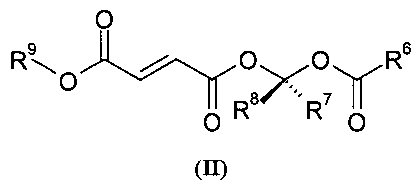
или его фармацевтически приемлемая соль, где в указанной формуле R6 выбирают из C1-6-алкила, замещенного C1-6-гетероалкила, С3-8-циклоалкила, С6-8-арила и -OR10, где R10 выбирают из С1-6-алкила и С3-10-циклоалкила;
R7 и R8 выбирают независимо из водорода и С1-6-алкила; и R9 представляет собой метил,
где каждую группу-заместитель выбирают независимо из галогена, -CN, -CF3,=O, -NO2, бензила, -C(O)NR11 2, -R11, -OR11, -C(O)R11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и C1-4-алкила.
10. Соединение по п. 9, где один из R7 и R8 представляет собой водород и другой из R7 и R8 выбирают из метила, этила, н-пропила и изопропила.
11. Соединение по п. 9, где каждая группа-заместитель представляет собой -OR11, где каждый R11 представляет собой С1-4-алкил.
12. Соединение по п. 9, где R6 представляет собой C1-6-алкил, и один из R7 и R8 представляет собой водород, другой из R7 и R8 представляет собой C1-6-алкил.
13. Соединение по п. 9, где R6 представляет собой -OR10, где R10 выбирают из С1-4-алкила и циклогексила.
14. Соединение по п. 9, где R6 выбирают из метила, этила, н-пропила и изопропила, и один из R7 и R8 представляет собой водород, и другой из R7 и R8 выбирают из метила, этила, н-пропила и изопропила.
15. Соединение по п. 9, выбранное из группы, в которую входят
этоксикарбонилоксиэтилметил(2Е)бут-2-ен-1,4-диоат;
метил-(метилэтоксикарбонилокси)этил(2Е)бут-2-ен-1,4-диоат;
метил-(2-метилпропаноилокси)этил(2Е)бут-2-ен-1,4-диоат;
метил-фенилкарбонилоксиэтил(2Е)бут-2-ен-1,4-диоат;
циклогексилоксикарбонилоксибутил-метил(2Е)бут-2-ен-1,4-диоат;
[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]этил-метил(2Е)бут-2-ен-1,4-диоат;
(циклогексилоксикарбонилокси)этил-метил(2Е)бут-2-ен-1,4-диоат;
метил-2-метил-1-фенилкарбонилоксипропил(2Е)бут-2-ен-1,4-диоат; и
3-({[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]метил}оксикарбонил)(2S)-2-аминопропановой кислоты, 2,2,2-трифторацетат.
16. Соединение по п. 1, где R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из пиперазина, замещенного 1,3-оксазолидинила, замещенного пирролидина и морфолина.
17. Соединение по п. 1, где один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из водорода и C1-6-алкила, и каждый из R3 и R4 представляет собой C1-6-алкил.
18. Соединение по п. 1, где каждый из R1 и R2 представляет собой водород и каждый из R3 и R4 представляет собой C1-6-алкил.
19. Соединение по п. 1, где один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из водорода и С1-4-алкила, R3 представляет собой водород и R4 выбирают из С1-4-алкила и замещенного С1-4-алкила, где группу-заместитель выбирают из =O, -OR11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и С1-4-алкила.
20. Соединение по п. 1, где один из R1 и R2 представляет собой водород, и другой из R1 и R2 представляет собой метил, R3 представляет собой водород и R4 выбирают из С1-4-алкила и замещенного С1-4-алкила, где группу-заместитель выбирают из =O, -OR11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и С1-4-алкила.
21. Соединение по п. 1, где каждый из R1 и R2 представляет собой водород, R3 представляет собой водород; и R4 выбирают из С1-4-алкила и замещенного С1-4-алкила, где группу-заместитель выбирают из =O, -OR11, -COOR11 и -NR11 2, где каждый R11 выбирают независимо из водорода и С1-4-алкила.
22. Соединение по п. 1, где один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из водорода и C1-6-алкила и R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из замещенного оксазолидина, замещенного пирролидина, морфолина, пиперазина и N-замещенного пиперазина.
23. Соединение по п. 1, где один из R1 и R2 представляет собой водород, и другой из R1 и R2 является метилом, и R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из замещенного оксазолидина, замещенного пирролидина, морфолина, пиперазина и N-замещенного пиперазина.
24. Соединение по п. 1, где каждый из R1 и R2 представляет собой водород и R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из замещенного оксазолидина, замещенного пирролидина, морфолина, пиперазина и N-замещенного пиперазина.
25. Соединение по п. 1, где один из R1 и R2 представляет собой водород, и другой из R1 и R2 выбирают из водорода и C1-6-алкила, и R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из морфолина, пиперазина и N-замещенного пиперазина.
26. Соединение по п. 1, где R3 и R4 вместе с атомом азота, с которым они связаны, образуют цикл, выбранный из пиперазина, замещенного 1,3-оксазолидинила, пирролидина и морфолина.
27. Соединение по п. 1, которое представляет собой (N,N-диэтилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат.
28. Соединение по п. 1, которое представляет собой метил-2-морфолин-4-ил-2-оксоэтил(2Е)бут-2-ен-1,4-диоат.
29. Соединение по п. 1, которое представляет собой (N,N-диметилкарбамоил)метил-метил(2Е)бут-2-ен-1,4-диоат.
30. Соединение по п. 1, которое представляет собой бис(2-метоксиэтил)карбамоил]метил-метил(2Е)бут-2-ен-1,4-диоат.
31. Соединение по п. 9, выбранное из группы, в которую входят:
метил-(2-метилпропаноилокси)этил(2Е)бут-2-ен-1,4-диоат;
метил-фенилкарбонилоксиэтил(2Е)бут-2-ен-1,4-диоат;
циклогексилоксикарбонилоксибутил-метил(2Е)бут-2-ен-1,4-диоат;
[(2Е)-3-(метоксикарбонил)проп-2-еноилокси]этил-метил(2Е)бут-2-ен-1,4-диоат; и
метил-2-метил-1-фенилкарбонилоксипропил(2Е)бут-2-ен-1,4-диоат.
32. Соединение по п. 9, выбранное из группы, в которую входят:
этоксикарбонилоксиэтил-метил(2Е)бут-2-ен-1,4-диоат;
метил-(метилэтоксикарбонилокси)этил(2Е)бут-2-ен-1,4-диоат; и
(циклогексилоксикарбонилокси)этил-метил(2Е)бут-2-ен-1,4-диоат.
33. Соединение по п. 9, которое представляет собой
метил-2-метил-1-фенилкарбонилоксипропил(2Е)бут-2-ен-1,4-диоат.
34. Соединение по п. 9, которое представляет собой [(2Е)-3-(метоксикарбонил)проп-2-еноилокси]этил-метил(2Е)бут-2-ен-1,4-диоат.
35. Фармацевтическая композиция для изготовления лекарственного средства для лечения иммунологических заболеваний и состояний, аутоиммунных заболеваний и состояний и воспалительных заболеваний и состояний, содержащая терапевтически эффективное количество соединения по любому из пп. 1-34 и по меньшей мере один фармацевтически приемлемый носитель.
36. Фармацевтическая композиция по п. 35, представляющая собой пероральную лекарственную форму.
37. Фармацевтическая композиция по п. 35, представляющая собой пероральную лекарственную форму с регулируемым высвобождением.
38. Фармацевтическая композиция по п. 35, представляющая собой пероральную лекарственную форму с пролонгированным высвобождением.
39. Фармацевтическая композиция по п. 35, где заболевания и состояния выбирают из группы, в которую входят: псориаз, рассеянный склероз, воспалительное заболевание кишечника, астма, хроническая обструктивная болезнь легких и артрит.
40. Фармацевтическая композиция по п. 35, где заболевания и состояния выбирают из группы, в которую входят: псориаз, астма, хроническая обструктивная болезнь легких, сердечная недостаточность, левожелудочковая недостаточность, инфаркт миокарда, стенокардия, болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона, пигментная ретинопатия, митохондриальная энцефалопатия, отторжение трансплантата, рассеянный склероз, ишемия, реперфузионное повреждение, повреждение генома, вызванное AGE, воспалительное заболевание кишечника, болезнь Крона и неспецифический язвенный колит.
41. Способ лечения заболевания у пациента, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции по любому из пп. 35-40, где заболевание выбирают из группы, в которую входят: псориаз, рассеянный склероз, воспалительное заболевание кишечника, астма, хроническая обструктивная болезнь легких и артрит.
42. Способ лечения заболевания у пациента, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции по любому из пп. 35-40, где заболевание выбирают из группы, в которую входят: псориаз, астма, хроническая обструктивная болезнь легких, сердечная недостаточность, левожелудочковая недостаточность, инфаркт миокарда, стенокардия, болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона, пигментная ретинопатия, митохондриальная энцефалопатия, отторжение трансплантата, рассеянный склероз, ишемия, реперфузионное повреждение, повреждение генома, вызванное AGE, воспалительное заболевание кишечника, болезнь Крона и неспецифический язвенный колит.
43. Применение соединения по любому из пп. 1-34 или фармацевтической композиции по любому из пп. 35-40 для изготовления лекарственного средства для лечения псориаза, рассеянного склероза, воспалительного заболевание кишечника, астмы, хронической обструктивной болезни легких или артрита.
44. Применение соединения по любому из пп. 1-34 или фармацевтической композиции по любому из пп. 35-40 для изготовления лекарственного средства для лечения псориаза, астмы, хронической обструктивной болезни легких, сердечной недостаточности, левожелудочковой недостаточности, инфаркта миокарда, стенокардии, болезни Паркинсона, болезни Альцгеймера, болезни Гентингтона, пигментной ретинопатии, митохондриальной энцефалопатии, отторжения трансплантата, рассеянного склероза, ишемии, реперфузионного повреждения, повреждения генома, вызванного AGE, воспалительного заболевания кишечника, болезни Крона или неспецифического язвенного колита.
45. Применение соединения по любому из пп. 1-34 или фармацевтической композиции по любому из пп. 35-40 для изготовления лекарственного средства для лечения псориаза.
46. Применение соединения по любому из пп. 1-34 или фармацевтической композиции по любому из пп. 35-40 для изготовления лекарственного средства для лечения рассеянного склероза.
47. Применение соединения по любому из пп. 1-34 или фармацевтической композиции по любому из пп. 35-40 для изготовления лекарственного средства для лечения гнездной алопеции.
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ ФУМАРОВОЙ КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ И АСТМЫ | 2004 |
|
RU2313339C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ ФУМАРОВОЙ КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ МИТОХОНДРИАЛЬНЫХ ЗАБОЛЕВАНИЙ | 2000 |
|
RU2218918C1 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ ФУМАРОВОЙ КИСЛОТЫ В ТРАНСПЛАНТАЦИОННОЙ МЕДИЦИНЕ | 1999 |
|
RU2210364C2 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| US 20060205659 A1, 14.09.2006 | |||
| US 6509376 B1, 21.01.2003 | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
Авторы
Даты
2015-06-27—Публикация
2009-08-19—Подача