ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к солям азилсартана с органическими аминами, способу их получения, фармацевтическим композициям, содержащим терапевтически эффективное количество указанных соединений, и к их применению для получения антигипертензивных лекарственных средств.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Азилсартан принадлежит к селективным антагонистам рецептора гипертензина II1 (ангиотензина, АТ1), он снижает кровяное давление посредством селективного блокирования связывания гипертензина II с рецептором гладких мышц кровеносных сосудов АТ1, которое останавливает сокращение вен, индуцированное гипертензином II.
В молекулярной структуре азилсартана присутствует карбоксильная группа, что приводит к слабому всасыванию азилсартана in vivo, поэтому азилсартан не может быть легко получен в виде фармацевтических лекарственных форм. В целях улучшения биодоступности получен сложный эфир азилсартана путем химической модификации, но его биодоступность все же не является удовлетворительной, и его молекулярная структура в результате такой модификации становится сложной, что повышает трудность при синтезе.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном изобретении доказано, что соли, образованные азилсартаном и органическими аминами, обладают лучшими фармакокинетическими свойствами, более высокой биодоступностью, и эти соли более пригодны для обычного способа получения.
В настоящем изобретении предложены соли азилсартана с органическим амином, представленные формулой (I)
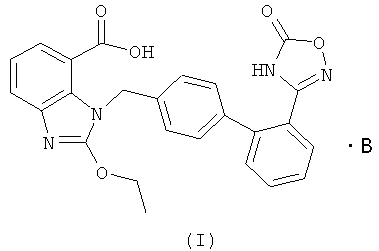
где В представляет собой органический амин, выбранный из метиламина, диметиламина, триметиламина, этиламина, диэтиламина, триэтиламина, этаноламина, пиперазидина, дибензилэтилендиамина, меглумина, трометамина, четвертичного тетраметиламмония, четвертичного тетраэтиламмония или холина; предпочтительно этаноламина  или холина
или холина 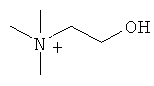
В настоящем изобретении также предложен способ получения вышеупомянутых соединений, который включает добавление кислотной формы азилсартана и органического амина В по отдельности в органические растворители, такие как спирт, с получением соответствующих солей при комнатной температуре или при нагревании, где растворители выбраны из группы, состоящей из метанола, этанола, пропанола или изопропанола.
В настоящем изобретении также предложена фармацевтическая композиция для применения при лечении гипертензии, содержащая терапевтически эффективное количество солей азилсартана с органическим амином в качестве активного ингредиента и фармацевтически приемлемые носители.
Кроме того, в изобретении также предложено применение солей азилсартана с органическим амином и их фармацевтических композиций при получении антигипертензивного лекарственного средства.
В способе получения фармацевтических композиций важно удобно получить лекарство в соответствующей лекарственной форме, не только в свете получения коммерчески доступного препарата, но также в свете получения фармацевтических лекарственных форм, содержащих активные соединения.
В другом аспекте важно предложить надежную, воспроизводимую и постоянную кривую концентрации лекарства в плазме после введения субъекту.
Другие важные факторы включают химическую стабильность, стабильность твердого состояния и срок хранения активного ингредиента. Лекарства и композиции, содержащие их, можно предпочтительно хранить в течение относительно длительного времени без видимых изменений физических и химических свойств их активных ингредиентов, таких как химический состав, плотность, гигроскопичность и растворимость.
Важно также предложить лекарство, насколько возможно чистое.
Типично это лекарство может обеспечить нижеописанные преимущества: удобное обращение, легкость получения соответствующих стандартных лекарственных форм и надежная растворимость, если это лекарство может быть получено в стабильной форме, такой как стабильная кристаллическая форма, которая хорошо известна специалистам в данной области техники.
Эффективное количество активного ингредиента в фармацевтической стандартной дозе, как описано выше, нетоксично, предпочтительно выбрано из диапазона 0,001-100 мг/кг общей массы, более предпочтительно 0,001-50 мг/кг. При лечении субъекта солью азилсартана с органическим амином выбранную дозу вводят предпочтительно перорально или парентерально. Предпочтительные парентеральные формы включают формы местного, ректального, чрескожного введения, инъекции и непрерывной инфузии. Пероральные лекарственные формы для введения человеку предпочтительно содержат от 0,05 до 3500 мг активного ингредиента, наиболее предпочтительно от 0,5 до 1000 мг активного ингредиента. Пероральное введение, при котором используют более низкую дозировку, более предпочтительно. Парентеральное введение при высоких дозах, однако, также можно применять, когда оно безопасно и удобно для пациента. Вышеуказанные дозы относятся к предпочтительному количеству активного ингредиента в пересчете на свободную кислоту.
Специалистам в данной области техники понятно, что оптимальное количество и периодичность дозирования активного ингредиента для каждого индивидуума зависит от природы и степени состояния конкретного пациента, подлежащего лечению, от формы, пути и сайта введения, и такие оптимумы могут быть определены общепринятыми методами. Специалистам в данной области техники также понятно, что оптимальный курс лечения, то есть число доз активного ингредиента, даваемых в сутки, в течение определенного числа суток, может быть подтверждено специалистами в данной области техники с использованием общепринятых способов тестирования.
Соединения, заявленные в настоящем изобретении, можно вводить перорально или парентерально, где эти соединения могут быть получены в виде таблеток, пилюль, порошка и гранул, используемых в различных путях введения. В вышеуказанных твердых лекарственных формах активные ингредиенты смешаны по меньшей мере с одним видом инертного разбавителя. В соответствии с общепринятым методом пероральные лекарственные формы также включают, кроме инертного разбавителя, другие вещества, такие как смазывающие вещества, глиданты и антиоксиданты. При изготовлении в виде капсул, таблеток и пилюль лекарственные формы содержат буферные агенты. Таблетки и пилюли можно также готовить в виде лекарственных форм пролонгированного высвобождения.
Хотя можно использовать неводные эмульсии, парентеральные лекарственные формы по настоящему изобретению, содержат стерильный водный раствор, и эти лекарственные формы также содержат адъюванты, например, антисептики, увлажняющие агенты, агенты, усиливающие проницаемость, буферные агенты, эмульгирующие агенты и диспергирующие агенты. Композицию стерилизуют с помощью фильтра, задерживающего бактерии, стерилизующего агента, облучения или нагревания.
По сравнению с азилсартаном и сложными эфирами азилсартана соли по настоящему изобретению, в основном, обладают нижеописанными преимуществами:
(1) Соли по настоящему изобретению легко растворяются в общепринятых растворителях, таких как вода, метанол, 0,1% соляная кислота, и приспособлены к приготовлению в общепринятых лекарственных формах.
(2) Соли по настоящему изобретению обладают улучшенной стабильностью.
(3) Соли по настоящему изобретению обладают лучшей биодоступностью.
(4) Способ получения солей по настоящему изобретению обладает преимуществами высокого выхода, высокой чистоты, скорости, удобства и низких затрат, где соль этаноламина, соль холина более предпочтительны в ходе этого способа.
ПРЕДПОЧТИТЕЛЬНЫЕ ФОРМЫ ОСУЩЕСТВЛЕНИЯ
Пример 1
Получение азилсартана этаноламина
Азилсартан (форма кислоты) (1,37 г) добавляли в метанол (30 мл), затем к смеси добавляли этаноламин (0,183 г) при комнатной температуре, нагревали до образования флегмы. Нерастворимое вещество отфильтровывали, и фильтрат концентрировали при пониженном давлении для удаления растворителя. В остаток добавляли ацетон (20 мл), затем смесь перемешивали в течение 2 ч, фильтровали, высушивали с получением белого твердого вещества 1,45 г.
1H ЯМР (ДМСО-d6+D2O) δ: 1.35 (t, 3H, СН3), 2.83 (t, 2H, CH2), 3.55 (t, 2Н, CH2), 4.52 (q, 2H, CH2), 5.65 (s, 2H, CH2), 7.03-7.51 (m, 11H).
Пример 2
Получение азилсартана холина
Азилсартан (1,37 г) и 46% водный раствор холина (0,79 г) добавляли в этанол (20 мл), и смесь нагревали до образования флегмы в течение 2 ч, перемешивали в течение одних суток при комнатной температуре, высушивали при пониженном давлении. Добавляли этилацетат (20 мл), затем смесь перемешивали в течение 2 ч, фильтровали с получением белого твердого вещества.
1Н ЯМР (ДМСО-d6+D2O) δ: 1.35 (t, 3H, СН3), 3.83 (t, 2H, CH2), 3.55 (t, 2Н, СН2), 3.06 (s, 9Н), 4.52 (q, 2Н, СН2), 5.65 (s, 2Н, СН2), 7.05-7.50 (m, 11Н).
Экспериментальный пример 1
Эффект соединений по настоящему изобретению на кровяное давление у крыс с гипертензией, индуцированной ангиотензином II.
Самцов крыс линии Спраг-Доули (в возрасте 9-11 недель, CLEA Japan, Inc.) анестезировали раствором пентобарбитала (50 мг/кг, ip.) и готовили к операции. Процедура операции была такой, как описано ниже: делали разрез через кожу на животе и абдоминальной стенке, отделяли аорту и вену от полой вены, закупоривали кровоток, чтобы дать возможность введения полиэтиленовой (РЕ) трубки, заполненной нормальным физиологическим раствором, содержащим гепарин (200 ед/мл), в кровеносный сосуд, пропускали РЕ трубку через подкожные щели и фиксировали РЕ трубку на задней стороне шеи. После восстановительного периода у крыс индуцировали гипертензию внутривенным введением 100 нг/кг ангиотензина II (AII). РЕ трубку соединяли с датчиком кровяного давления, соединенным с усилителем монитора для контроля кровяного давления (2238, NEC San-ei Instruments). Животных включали в исследование на основании среднего систолического кровяного давления за 24 ч. Всех животных со средним систолическим кровяным давлением, меньшим 140 мм Hg, исключали из данного исследования, а других делили на 2 группы. Эти группы перорально однократно дозировали эквимолярным количеством тестируемых веществ. Крысам снова инъецировали внутривенно AII спустя 24 часа, и их кровяное давление измеряли с помощью монитора. Вычисляли показатели ингибирования кровяного давления у крыс после дозирования. Препараты тестируемых веществ готовили в 0,5% метил целлюлозе, и объем дозирования для всех животных составлял 2 мл/кг. Результаты выражали в виде среднего ±СО (таблица 1).
По той же методике получали данные, относящиеся к сравнительным соединениям, таким как азилсартана камедоксомил, азилсартана триметиламин, азилсартана диэтаноламин и азилсартана пиридин. Таблица 1 отражает эффект соединений, полученных в соответствии с примерами 1 и 2, и сравнительных соединений на кровяное давление у крыс с гипертензией, индуцированной ангиотензином II.

Результаты эксперимента: Кровяное давление значимо снижалось после обработок соединениями по настоящему изобретению, и ингибирование могло сохраняться в течение длительного времени.
Экспериментальный пример 2
Эффект соединений по настоящему изобретению на кровяное давление у собак с гипертензией, индуцированной ангиотензином II
В данном исследовании использовали самцов собак породы бигль (массой 12,0-14,7 кг, KITAYAMA LABES, CO., LTD.). Собак анестезировали раствором пентобарбитала (50 мг/кг, ip.) и готовили к операции. Процедура операции была такой, как описано ниже: проводили эндотрахеальную интубацию для контроля дыхания, выбривали бедренную область и область задней стороны шеи, фиксировали собаку в положении лежа на спине, использовали раствор изодина (MEIJI SEIKA KAISHA, LTD.) для стерилизации кожи, делали разрез через кожу в области правого бедра, отделяли бедренную артерию, закупоривали кровоток, чтобы дать возможность введения зеркального катетера (5 F, MILLER INDUSTRIES) и полиуретановой трубки в артерию и вену, соответственно, пропускали трубки через подкожные щели и фиксировали трубки на спине, закрывали стенку и зашивали кожу, и инъецировали внутримышечно пенициллин G калий (MEIJI SEIKA KAISHA, LTD., 40000 единиц) для стерилизации. Для послеоперационного ухода животным вводили 40000 единиц пенициллина G калия один раз в сутки в течение 3 суток. Началу исследования предшествовал восстановительный период.
Животных помещали по одному в небольшую метаболическую клетку, и в течение эксперимента они голодали. Зеркальный катетер был соединен с блоком датчиков (MILLER INDUSTRIES). Через усилитель постоянного тока (N4777, NEC San-ei Instruments) и усилитель монитора для контроля кровяного давления (N4441, NEC San-ei Instruments) кровяное давление регистрировали с помощью регистрирующего устройства (RECTI-HORIZ 8 К, NEC San-ei Instruments). С целью установления модели гипертензии животным инъецировали внутривенно 100 нг/кг AII 3 или 4 раза перед дозированием тестируемых веществ. Тестируемые вещества в эквимолярной дозе суспендировали в 0,5% метилцеллюлозе, и объем дозирования для всех животных составлял 2 мл/кг. После введения кровяное давление измеряли с помощью монитора. Вычисляли показатели ингибирования кровяного давления собак после дозирования, и результаты выражали в виде среднего ±СО (таблица 2).
По той же методике получали данные, относящиеся к сравнительным соединениям, таким как азилсартана камедоксомил, азилсартана триметиламин, азилсартана диэтаноламин и азилсартана пиридин. Таблица 2 отражает эффект соединений, полученных в соответствии с примерами 1 и 2, и сравнительных соединений на кровяное давление у собак с гипертензией, индуцированной ангиотензином II.
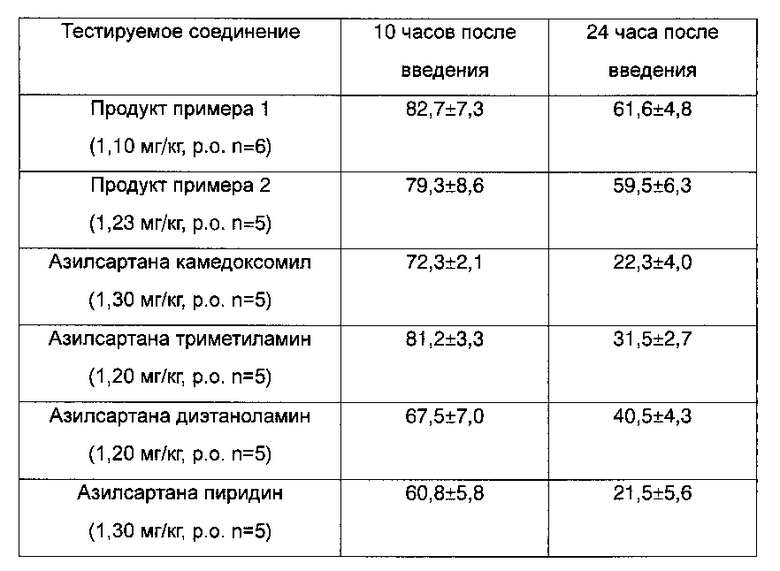
Результаты эксперимента: Кровяное давление значимо снижалось после обработок соединениями по настоящему изобретению. Ингибирование также продолжалось в течение длительного времени.
Данные таблиц 1 и 2 показывают, что соединения по настоящему изобретению обладают более длительным и сильным фармакологическим действием по сравнению с другими соединениями похожей структуры.
Экспериментальный пример 2
Ингибиторные эффекты соединений по настоящему изобретению на прессорную реакцию, индуцированную ангиотензином II, у собак
Для эксперимента использовали самцов собак породы бигль (масса тела 12,0-14,7 кг, KITAYAMA LABES, CO., LTD.). Собак анестезировали пентобарбиталом натрием (50 мг/кг, i.p.) и вставляли трахеальную трубку для контроля дыхания. Бедренную область и заднюю сторону шеи брили и дезинфицировали (раствор изодина, MEIJI SEIKA KAISHA, LTD.). Собаку фиксировали в положении лежа на спине и делали разрез в области правого бедра. Зеркальный катетер (5 F, MILLER INDUSTRIES) вставляли и помещали в бедренную артерию, а полиуретановую трубку помещали в бедренную вену. Катетер и трубку пропускали под кожей и фиксировали на спине. Затем область разреза зашивали и вводили внутримышечно пенициллин G калий (MEIJI SEIKA KAISHA, LTD., 40000 единиц) для предупреждения инфекции. Начиная со следующих суток, пенициллин G калий (40000 единиц) вводили один раз в сутки в течение 3 суток. После 3 суток восстановления собаку подвергали эксперименту.
Во время эксперимента собаку помещали в небольшую метаболическую клетку. Для измерения зеркальный катетер, вставленный в бедренную артерию, соединяли с блоком датчиков (MILLER INDUSTRIES), и системное кровяное давление (среднее кровяное давление) регистрировали на регистрирующем устройстве (RECTI-HORIZ 8 К, NEC San-ei Instruments) посредством усилителя постоянного тока (N4777, NEC San-ei Instruments) и усилителя монитора для контроля кровяного давления (N4441, NEC San-ei Instruments). Полиуретановую трубку, вставленную в бедренную вену, фиксировали снаружи клетки и использовали для введения AII (PEPTIDE INSTITUTE, INC.). Эксперимент проводили натощак, и AII (100 нг/кг, i.v.) вводили 3 или 4 раза перед введением тестируемого соединения, чтобы подтвердить стабилизацию вазопрессорной реакции. Дозу тестируемого соединения, соответствующую эквимолярному количеству соединения А, суспендировали в 0,5% метилцеллюлозе и вводили перорально в объеме 2 мл/кг. После введения лекарства AII вводили в каждый момент времени измерения и измеряли повышение кровяного давления, на основании которого вычисляли показатель ингибирования против значения кровяного давления перед введением. Результаты представлены в виде среднего ±СКО (таблица 2).
Результаты эксперимента: соединения по настоящему изобретению обладали значимо длительным и сильным фармакологическим действием.
Изобретение относится к солям азилсартана с этаноламином и холином формулы (I). Также изобретение относится к способу получения солей формулы (I), фармацевтической композиции, содержащей их, и применению для получения антигипертензивного лекарственного средства. Технический результат - соли азилсартана с этаноламином и холином, обладающие значительно более длительным и сильным фармакологическим действием. В формуле (I) B представляет собой этаноламин или холин. 5 н. и 3 з.п. ф-лы, 2 табл., 4 пр.
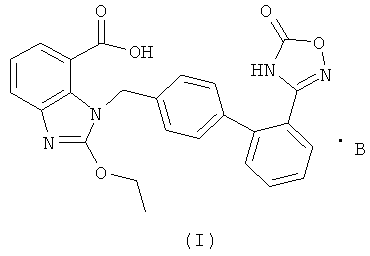
1. Соли азилсартана с органическим амином формулы (I)
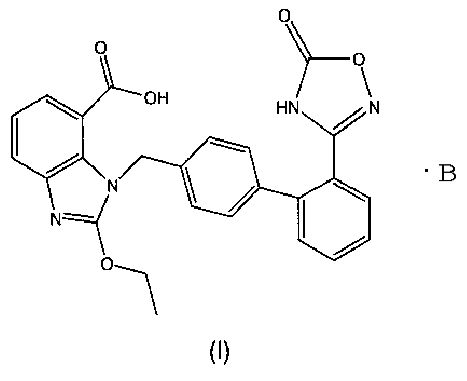
где В представляет собой органический амин, выбранный из группы, состоящей из этаноламина и холина.
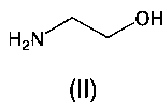
2. Соли азилсартана с органическим амином по п.1, где В представляет собой этаноламин формулы (II)
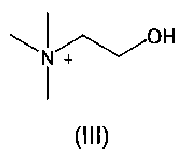
3. Соли азилсартана с органическим амином по п.1, где В представляет собой холин формулы (III)
4. Способ получения солей азилсартана с органическим амином, выбранным из группы, состоящей из этаноламина и холина, по любому из пп.1-3, включающий добавление кислоты азилсартана и органического амина В по отдельности в спиртовые органические растворители с получением соответствующих солей при комнатной температуре или при нагревании.
5. Способ по п.4, где спиртовые органические растворители выбраны из группы, состоящей из метанола, этанола, пропанола или изопропанола.
6. Фармацевтическая композиция для применения при лечении гипертензии, содержащая терапевтически эффективное количество солей азилсартана с органическим амином по любому из пп.1-3 в качестве активного ингредиента и фармацевтически приемлемые носители.
7. Применение солей азилсартана с органическим амином по любому из пп.1-3 или фармацевтической композиции по п. 6 для получения антигипертензивного лекарственного средства.
8. Соли азилсартана с органическим амином, полученные способом по п.4 или 5.
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОЯВЛЯЮЩАЯ АКТИВНОСТЬ АНТАГОНИСТА АНГИОТЕНЗИНА II И СПОСОБ АНТАГОНИЗИРОВАНИЯ АНГИОТЕНЗИНА II У МЛЕКОПИТАЮЩИХ | 1992 |
|
RU2104276C1 |
| ЕР 1452176 А1, 10.09.2004 | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| YASUHISA KOHARA et al., Synthesis and angiotensin II receptor antagonistic activities of benzimidazole derivatives bearing acidic heterocycles as novel tetrazole bioisosteres, Journal of Medicinal Chemistry, 1996, vol.39, p.5228-5235 | |||
Авторы
Даты
2015-07-10—Публикация
2010-11-29—Подача