Область техники
Настоящее изобретение относится к органическим аминным солям азилсартана, способу их получения и фармацевтической композиции, содержащей их терапевтически эффективное количество, а также к их применению для получения гипотензивных лекарственных препаратов.
Предшествующий уровень техники
Гипертония представляет собой распространенное сердечно-сосудистое заболевание, основным клиническим проявлением которого является постоянно повышенное артериальное давление, часто гипертония приводит к повреждению сердца, мозга, почек и других жизненно важных органов и соответствующим последствиям. КНР является одной из стран, обеспокоенных проблемой гипертонии в мире. В течение последних нескольких десятилетий число случаев гипертонии у взрослых возросло с 30 миллионов в 1960 до 59 миллионов в 1980, и достигло 94 миллионов людей в 1991. В настоящее время это число составляет более 200 миллионов. Среди 3 миллионов пациентов с сердечно-сосудистыми заболеваниями, умирающих ежегодно, 50% ассоциировано с гипертонией. В США 1/3 взрослых страдает от гипертонии. Поэтому существует срочная необходимость развития эффективных гипотензивных лекарственных средств с меньшими побочными эффектами.
В соответствии с механизмом действия лекарственного средства, обычные гипотензивные лекарственные средства могут быть классифицированы на гипотензивные лекарственные средства центрального действия, ганглио-блокаторы, ингибиторы симпатических нервных окончаний, адренергические блокаторы, сосудорасширяющие средства, диуретики, ингибиторы ангиотензин-1-превращающего фермента (АПФ1), антагонисты рецепторов ангиотензина. Ренин-ангиотензиновая система (РАС) представляет собой группу гормонов или предшественников, взаимодействующих с или регулирующих друг друга, секретируемых почками и печенью, включая ренин, ангиотензиноген, ангиотензин 1 (Анг I), ангиотензин II (Анг II), ангиотензинпревращающий фермент (АПФ), рецептор ангиотензина и т.д., в которой Анг II представляет собой один из сосудосуживающих факторов, обладающих многочисленными биологическими активностями.
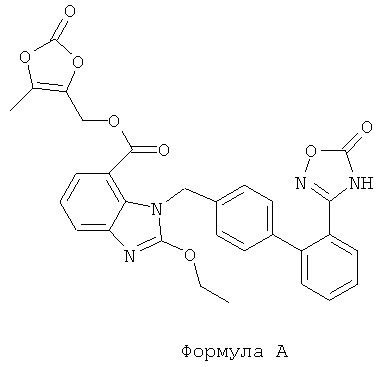
Азилсартан медоксимил (структура формулы А) представляет собой лекарственное средство, антагонист рецептора ангиотензина II, для лечения гипертонии, разработанное Takeda, относящееся к лекарственному средству антагонисту рецептора ангиотензина II (сартаны). Калиевая соль азилсартан медоксимила, торговая марка Edabi, было утверждено FDA (Федеральное управление США по контролю качества продуктов питания, напитков и лекарственных препаратов).
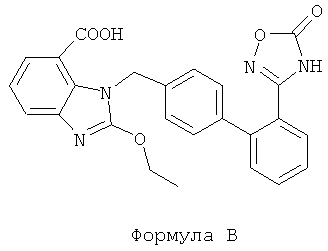
Это лекарственное средство представляет собой пероральный лекарственный препарат, который может быть применен сам по себе или в сочетании с гипотензивными агентами для лечения гипертонии и связанных с ней осложнений. Азилсартан медоксимил оказывает более значительный эффект в отношении понижения артериального давления. По сравнению с лозартаном и олмесартан медоксимилом, азилсартан медоксимил является более эффективным в отношении снижения кровяного давления (WHITE W В. Effects of the angiotensin receptor blocker azilsartan medoxomil versus olmesartan and valsartan on ambulatory and clinic blood pressure in patients with stages 1 and hypertension [J]. Hypertension, 2011, 57(3):413-420). Азилсартан медоксимил представляет собой пролекарственное средство, которое может быть быстро гидролизовано до азилсартана и начинает действовать в течение абсорбции в желудочно-кишечном тракте. Азилсартан (структура формулы В), химическое название которого 1-[[2'-(4,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил)[1,1'-бифенил]-4-ил]метил]-2-этокси-1Н-бензимидазол-7-карбоновая кислота, снижает кровяное давление за счет селективного блокирования связывания ангиотензина II с рецептором АТ1 гладкой мускулатуры сосудов, что приводит к блокированию сосудосуживающего эффекта ангиотензина II in vivo.
EP 1992110668, US 5243054 A, US 20050187269 раскрывают способ получения азилсартана и его аналогов; патент КНР CN 100503605 C раскрывает калиевую соль азилсартан медоксимила, ее получение и фармакодинамический эффект; WO 2010075347 раскрывает фармацевтическое применение и фармакологическую активность азилсартан медоксимила и калиевой соли азилсартан медоксимила; CN 101381366 В раскрывает азилсартан и калиевую соль азилсартан медоксимила.
Однако последующее исследование показало, что поскольку в молекулярной структуре непосредственного активного ингредиента азилсартана присутствует карбоксильная группа, абсорбция in vivo является слабой и влияет на эффективность лекарственного средства, поэтому азилсартан не так легко получить в виде лекарственной формы. Для улучшения биодоступности азилсартан должен быть получен в виде сложного эфира посредством химической модификации, т.е. азилсартан медоксимила, но его биодоступность еще не подтверждена и его молекулярная структура становится комплексной за счет такой модификации, которая усложняет синтез продукта и повышает его стоимость.
Краткое описание изобретения
Согласно исследованию, настоящее изобретение доказывает, что соли, сформированные азилсартаном и органическими аминами, обладают лучшими фармакокинетическими характеристиками, более высокой биодоступностью, более низкой лекарственной токсичностью и являются более приемлемыми для обычного способа получения.
Целью настоящего изобретения является предложение органических аминных солей азилсартана, где отношение азилсартана к органическим аминам составляет m:1, в котором m представляет собой целое число, выбранное из 2~10, предпочтительно m представляет собой 2.
Предпочтительно органические аминные соли азилсартана существуют в виде единичной молекулы или комплекса. Упомянутая комплексная форма представляет собой молекулярное состояние, хорошо известное специалистам в области техники, которое обычно относится (но не ограничено) к связанному состоянию, образованному за счет силы межмолекулярных взаимодействий, такому как комплексное (составное) состояние, образованное за счет силы межмолекулярного взаимодействия, в том числе за счет водородной связи, ионной связи, переноса зарядов и сил Ван-дер-Ваальса; комплексообразующее состояние формируется за счет нековалентной связи; и ковалентный конъюгат образуется за счет ковалентной связи.
Предпочтительно упомянутый органический амин выбран из группы, состоящей из метиламина, диметиламина, триметиламина, этиламина, диэтиламина, триэтиламина, этаноламина, пиперазидина, дибензил этилендиамина, меглумина, трометамина, тетраметилчетвертичного аммония, тетраэтилчетвертичного аммония или холина.
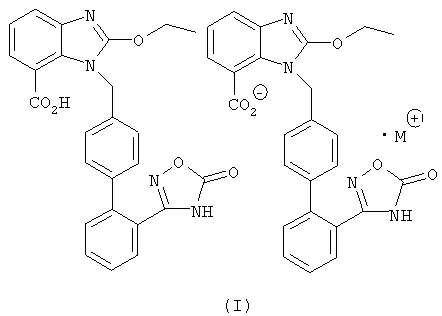
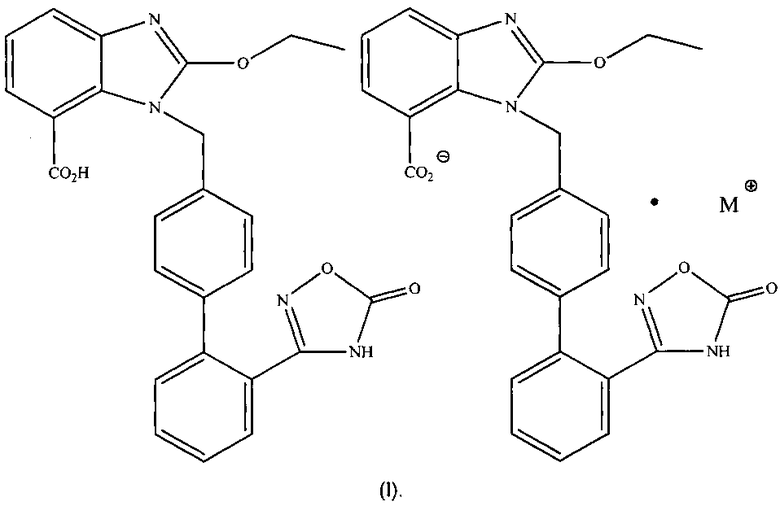
Предпочтительно упомянутая органическая аминная соль азилсартана обладает структурой формулы (I) или (II), где М представляет собой органический амин, выбранный из группы, состоящей из метиламина, диметиламина, триметиламина, этиламина, диэтиламина, триэтиламина, этаноламина, пиперазидина, дибензилэтилендиамина, меглумина, трометамина, тетраметилчетвертичного аммония, тетраэтилчетвертичного аммония или холина.
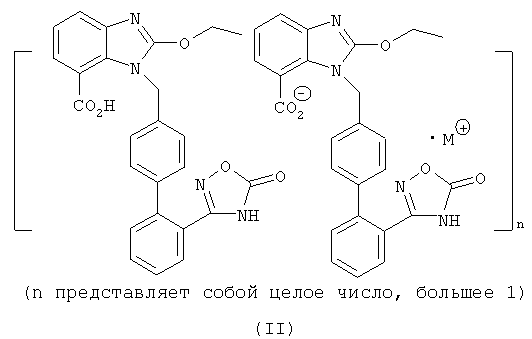
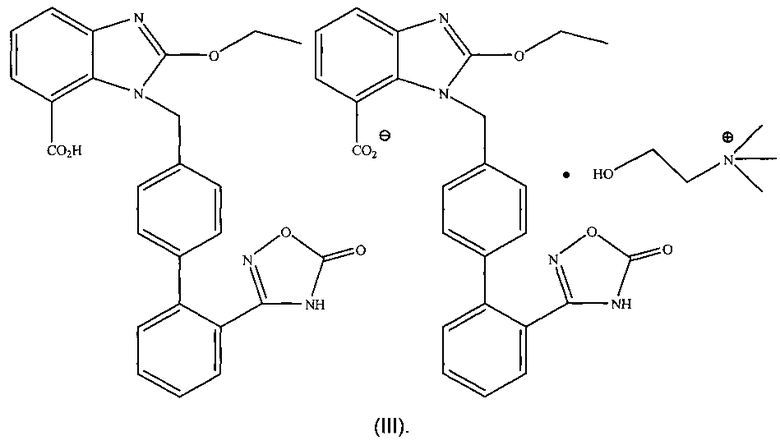
Предпочтительно структуру упомянутой органической аминной соли азилсартана отображает формула (III) или (IV)
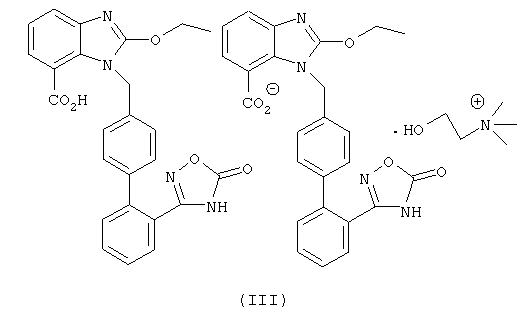
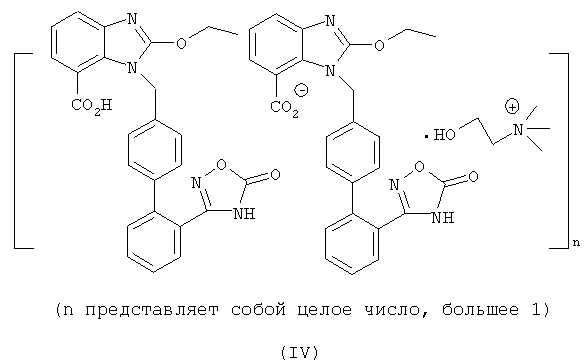
Настоящее изобретение также предлагает способ получения вышеупомянутых соединений, который содержит добавление кислотной формы азилсартана и органического амина в спиртовые органические растворители, соответственно для получения соответствующих солей при комнатной температуре или нагревании, предпочтительно упомянутый способ осуществляют в безводных условиях.
В случае, когда органический амин представляет собой холин, спиртовой раствор холина предпочтительно добавляют при получении соответствующей холиновой соли азилсартана, более предпочтительно концентрация упомянутого спиртового раствора холина составляет 45%, еще предпочтительнее молярное отношение упомянутого азилсартана к холину составляет 1:1-2:1.
В случае, когда органический амин выбран из группы, состоящей из метиламина, диметиламина, триметиламина, этиламина, диэтиламина, триэтиламина, этаноламина, пиперазидина, дибензилэтилендиамина, меглумина, трометамина, тетраметилчетвертичного аммония или тетраэтилчетвертичного аммония, предпочтительно в случае получения соответствующих органических аминных солей азилсартана, молярное отношение азилсартана к органическому амину, добавляемому в спиртовой органический растворитель, составляет 2:1.
Упомянутый спиртовой органический растворитель выбран из группы, состоящей из метанола, этанола, пропанола или изопропанола.
Настоящее изобретение также предлагает фармацевтическую композицию для применения при лечении гипертонии, содержащую терапевтически эффективное количество органических аминных солей азилсартана в качестве активного ингредиента и фармацевтически приемлемые носители.
Более того, настоящее изобретение предлагает применение органических аминных солей азилсартана или его фармацевтической композиции при получении гипотензивных лекарственных препаратов.
При способе получения фармацевтических композиций важно получить лекарственное средство в соответствующей удобной форме, не только с точки зрения коммерческой доступности способа получения, но и с точки зрения получения лекарственных форм, содержащих активные вещества.
Более того, важно обеспечить достоверную, воспроизводимую и постоянную кривую концентрации лекарственного средства в плазме после введения субъекту.
Другие важные факторы включают химическую устойчивость, стабильность в твердом состоянии и срок хранения активного ингредиента. Лекарственные средства и композиции, содержащие одно и тоже, предпочтительно должны храниться в течение относительно долгого времени без видимых изменений физических и химических свойств их активных ингредиентов, таких как химическая композиция, плотность, гигроскопичность и растворимость.
Более того, также важно предложить лекарственное средство настолько чистое, насколько возможно.
Специалисты в области техники поймут, что обычно, в случае, когда лекарственное средство может быть получено в стабильной форме, лекарственное средство может обеспечить следующие преимущества: удобство в обращении, легкость получения в виде соответствующих лекарственных форм и достаточную растворимость.
Эффективное количество активного ингредиента подразумевает эффективные нетоксичные дозы, предпочтительно выбранные из диапазона 0,001~100 мг/кг общей массы, более предпочтительно 0,001-50 мг/кг. В случае, когда субъект, подлежащий лечению, нуждается в органической аминной соли азилсартана, путь введения предпочтительно представляет собой пероральный или парентеральный, включая местные, ректальные, трансдермальные формы введения, инъекцию или продолжительную инфузию. Пероральная лекарственная форма для человека предпочтительно содержит от 0,05 до 3500 мг активного ингредиента, наиболее предпочтительно от 0,5 до 1000 мг активного ингредиента. Более предпочтительно пероральное введение более низкой дозы. Однако парентеральное введение высокой дозы также может быть применено в случае, когда оно безопасно и приемлемо для пациента. Вышеупомянутая доза относится к предпочтительному количеству активного ингредиента, относящемуся к свободной кислоте.
Специалистам в области техники будет понятно, что оптимальное количество и период применения лекарственной формы активного ингредиента для каждого индивидуума будет зависеть от природы и степени заболевания, лекарственной формы, пути и места введения и состояний отдельного пациента, подлежащего лечению, и такие оптимальные количества могут быть определены при помощи обычных способов. Также специалистами в области техники будет оценено, что оптимальный курс лечения, т.е. количество дозы активного ингредиента, даваемое каждый день, в течение определенного числа дней, может быть определено специалистами в области техники при помощи обычного теста.
Настоящие соединения могут быть введены перорально или парентерально и могут быть получены в виде таблеток, пилюль, порошка и гранул для различных путей введения. В этих твердых препаратах активный ингредиент смешан с по меньшей мере одним типом инертного разбавителя. Согласно обычному способу пероральный препарат также содержит другие вещества, такие как лубрикант, глидант и антиоксидант помимо инертного разбавителя. В случае капсулы, таблетки или пилюли препарат содержит буферные вещества. Таблетка и пилюля также могут быть изготовлены в виде лекарственной формы с замедленным высвобождением.
Хотя могут быть применены неводные эмульсии, парентеральный препарат по настоящему изобретению содержит стерильный водный раствор. Эти препараты также содержат адъювант, такой как консервант, увлажняющее вещество, смачивающее вещество, буферное вещество, эмульсию и диспергирующее вещество. Композицию стерилизуют при помощи фильтра, удерживающего бактерии, стерилизующего вещества, облучения или нагревания.
По сравнению с азилсартаном и его сложным эфиром органические аминные соли азилсартана по настоящему изобретению в основном обладают следующими преимуществами:
1) растворимость солей по настоящему изобретению в обычном растворителе существенно повышена, и они приемлемы для получения в виде обычных препаратов;
2) соли по настоящему изобретению обладают лучшим значением применимости препарата;
3) соли по настоящему изобретению обладают лучшей биодоступностью и лучшим терапевтическим эффектом;
4) соли по настоящему изобретению обладают более низкой токсичностью;
5) способ получения солей по настоящему изобретению обладает преимуществом высокого выхода, высокой чистоты, быстротой, удобством и низкой стоимостью, где соль этаноламина и соль холина являются более предпочтительными при технологическом способе и могут быть непосредственно осаждены в кристаллическую форму.
Подробное описание изобретения
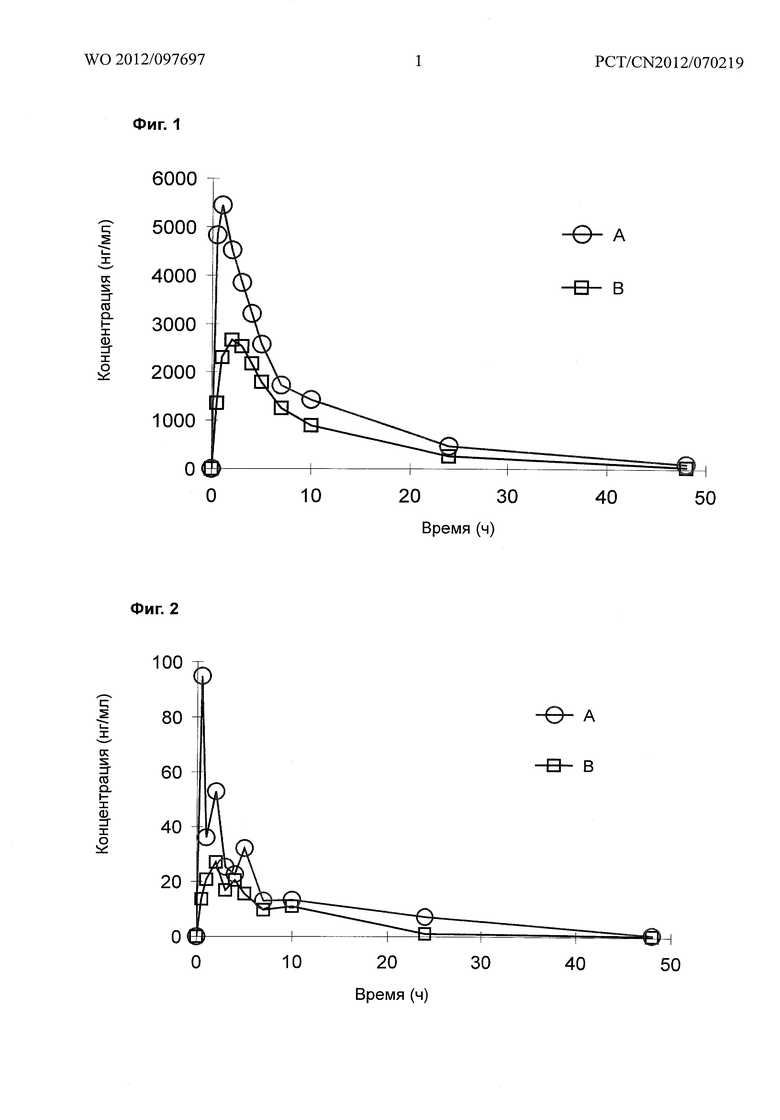
На фигуре 1 изображена концентрация азилсартана у крыс после введения 3,0 мг/кг соединения (А), полученного по примеру 2, и 3,58 мг/кг азилсартан медоксимила (В).
На фигуре 2 изображена концентрация М1 у крыс после введения 3,0 мг/кг соединения (А), полученного по примеру 2, и 3,58 мг/кг азилсартан медоксимила (В).
На фигуре 3 изображена концентрация of M2 у крыс после введения 3,0 мг/кг соединения (А), полученного по примеру 2, и 3,58 мг/кг азилсартан медоксимила (В).
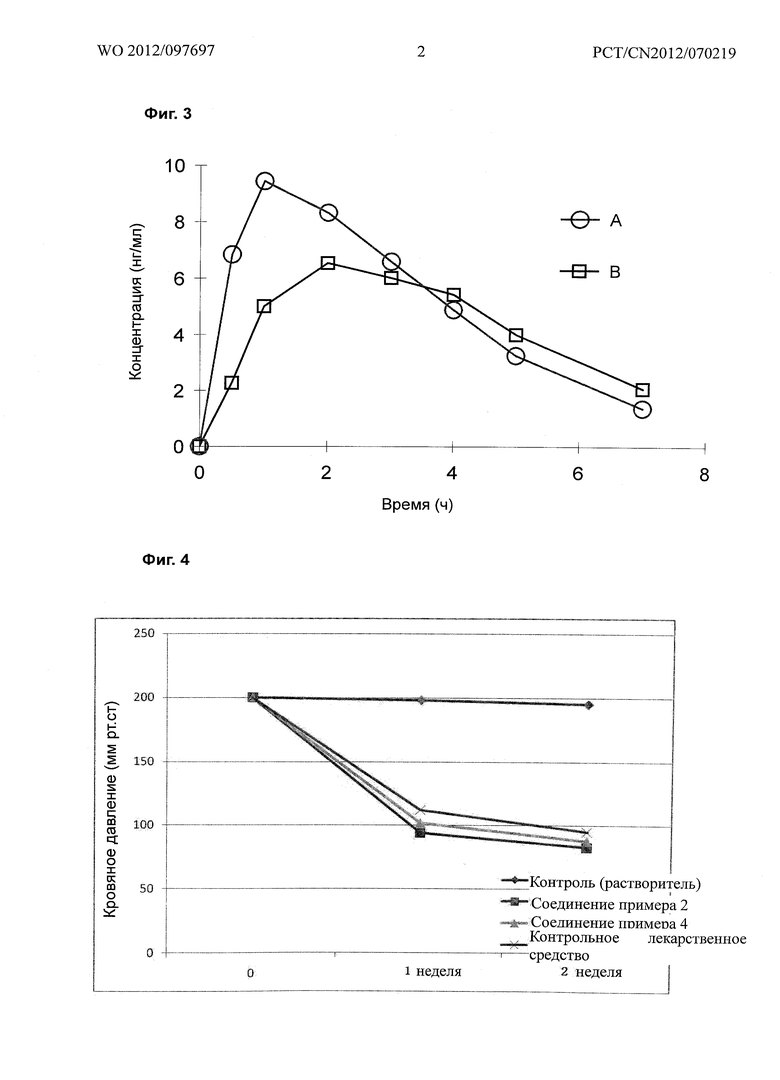
На фигуре 4 изображено влияние на кровяное давление СГК-крыс (спонтанно-гипертензивных крыс) после последовательного введения в течение двух недель соединения, полученного по примеру 2.
Пример 1
Соль, образованная азилсартаном и холином в молярном соотношении 1:1.
Азилсартан (20,00 г, 0,0439 моль) добавляли к метанолу (600,0 мл). К раствору добавляли 46% водный раствор холина (11,80 г, 0,0439 моль) и перемешивали до прозрачности. Реакционную смесь концентрировали под действием пониженного давления. Изопропиловый эфир (100,0 мл) добавляли к остаткам, и смесь перемешивали до кристаллизации. После фильтрования и высушивания под действием вакуума получали 18 г белого твердого вещества.
1H ЯМР (ДМСО-d6) δ: 1,32 (t, 3H, CH3), 3,30 (s, 9H), 3,43 (t, 2H, CH2), 3,97 (t, 2H, CH2), 4,29 (q, 2H, CH2), 5.46 (s, 2H, CH2), 7,29~7,87 (m, 11H), 11,21 (br, 2H, NH, OH).
Элементный анализ (%): C, 64,30; H, 6,02; N, 12,49.
Пример 2
Соль, образованная азилсартаном и холином в молярном соотношении 2:1
Азилсартан (10,00 г, 0,022 моль) и этанол (100,0 мл) добавляли в реакционную колбу и нагревали до оттока. К смеси добавляли 45% раствор холина и метанола (5,90 г, 0,022 моль) и перемешивали в течение 3 часов при той же температуре до возвращения смеси к прозрачному раствору. Реакционную смесь охлаждали до комнатной температуры и перемешивали до кристаллизации. После фильтрования и высушивания под действием вакуума получали 6,80 г белого твердого вещества.
1H ЯМР (ДМСО-d6) δ: 1,38 (t, 6H, CH3), 3,09 (s, 9H), 3,39 (t, 2H, CH2), 3,82 (t, 2H, CH2), 4,58 (q, 4H, CH2), 5,69 (s, 4H, CH2), 7,05-7,61 (m, 22H), 11,07 (br, 4H, NH, OH, CO2H).
Элементный анализ (%): C, 65,22; H, 5,42; N, 12,23.
Пример 3
Соль, образованная азилсартаном и этаноламином в молярном соотношении 1:1
Азилсартан (10,00 г, 0,0219 моль) добавляли к метанолу (300,0 мл). К раствору добавляли этаноламин (1,34 г, 0,0219 моль) и перемешивали до прозрачности. Реакционную смесь концентрировали под действием пониженного давления. Изопропиловый эфир (100 мл) добавляли к остаткам, и смесь перемешивали до кристаллизации. После фильтрования и высушивания под действием вакуума получали 10,30 г белого твердого вещества.
1H ЯМР (ДМСО-d6) δ: 1,30 (t, 3H, CH3), 3,52 (t, 2H, CH2), 4,27 (t, 2H, CH2), 4.29 (q, 2H, CH2), 5,52 (s, 2H, CH2), 7,26-7,89 (m, 11H), 11,32 (br, 5H, NH, OH, NH3).
Элементный анализ (%): C, 62,59; H, 5,32; N, 13,54.
Пример 4
Соль, образованная азилсартаном и этаноламином в молярном соотношении 2:1
Азилсартан (10,00 г, 0,0219 моль) добавляли к метанолу (300,0 мл). К раствору добавляли этаноламин (0,67 г, 0,0110 моль) и перемешивали до прозрачности. Реакционную смесь концентрировали под действием пониженного давления. Изопропиловый эфир (100 мл) добавляли к остаткам, и смесь перемешивали до кристаллизации. После фильтрования и высушивания под действием вакуума получали 8,93 г белого твердого вещества.
1H ЯМР (ДМСО-d6) δ: 1,33 (t, 6H, CH3), 3,09 (t, 2H, CH2), 3,60 (t, 2H, CH2), 4.30 (q, 4H, CH2), 5,46 (s, 4H, CH2), 7,28-7,93 (m, 22H), 11,0-13,0 (br, 7H, NH, CO2H, ON).
Элементный анализ (%): C, 64,07; H, 4,79; N, 13,12.
Пример 5
Соль, образованная азилсартаном и пиперазидином в молярном соотношении 2:1
Азилсартан (10,00 г, 0,0219 моль) добавляли к метанолу (300,0 мл). К раствору добавляли пиперазидин (0,94 г, 0,0109 моль) и перемешивали до прозрачности. Реакционную смесь концентрировали под действием пониженного давления. Изопропиловый эфир (100 мл) добавляли к остаткам, и смесь перемешивали до кристаллизации. После фильтрования и высушивания под действием вакуума получали 9,45 г белого твердого вещества.
1H ЯМР (ДМСО-d6) δ: 1,34 (t, 6H, CH3), 2,68 (s, 8H, CH2), 4,31 (q, 4H, CH2), 5,47 (s, 4H, CH2), 7,27~7,92 (m, 22H), 11,20 (br, 6H, NH, CO2H).
Элементный анализ (%): C, 64,79; H, 5,12; N, 14,15.
Экспериментальный пример 1
Испытание на растворимость
Заключение: растворимость соединения примера 1 сравнима с растворимостью соединения примера 2.
Более того, "1:40" относится к 1 г образца растворенного в 40 мл метанола при комнатной температуре, также как "1:80"; "1:120" относится к 1 г образца, растворенного в 40 мл этанола при комнатной температуре, также как "1:200".
Экспериментальный пример 2
Испытание гигроскопичности
Способы эксперимента
1. Высушенный стеклянный бюкс (внешний диаметр 50 нм, высота 15 нм) с пробкой днем раньше помещали в искусственную климатическую камеру при температуре 25±1°C и относительной влажности (OB) 80±2%, а затем точно взвешивали (m1).
2. Тестируемый образец точно взвешивали (m2) и помещали в бюкс. Толщина образца составляла приблизительно 1 мм.
3. Незакрытый бюкс и его пробку помещали в условия вышеупомянутой постоянной температуры и влажности на 24 ч.
4. Бюкс накрывали и точно взвешивали (m3).
Формула для вычисления: процента увеличения массы = (m3-m2)/(m2-m1)∗100%
5. Определение увеличения массы за счет гигроскопичности.
Поглощение влаги из воздуха: адсорбция достаточного количества воды для образования жидкости.
Высокая гигроскопичность: увеличение массы за счет гигроскопичности составляет не менее 15%.
Имеющаяся гигроскопичность: увеличение массы за счет гигроскопичности составляет 15-2%.
Незначительная гигроскопичность: увеличение массы за счет гигроскопичности составляет 2-0,2%.
Отсутствие или практическое отсутствие гигроскопичности: увеличение массы за счет гигроскопичности составляет менее 0,2%.
6. Результаты теста
Заключение: соединение примера 2 и соединение примера 4 оба гигроскопичны и приемлемы для получения медицинских препаратов и благоприятны для стабильности препарата.
Экспериментальный пример 3
Испытание метаболизма лекарственного средства SD-крыс (крысы породы Спраг-Доули) после введения
Двенадцать SD-крыс массой 200-250 г были случайным образом поделены на две группы в каждой по 6 крыс, половина самцов и половина самок. Эквивалентная молярная концентрация 3 мг/кг соединения примера 2 (холин азилсартан) или 3,58 мг/кг азилсартан камедоксимила (API, Edarbi) вводили взрослым крысам посредством орального гаважа. 0,5 мл крови собирали из орбиты до введения и через 0,5, 1,0, 2,0, 3,0, 4,0, 5,0, 7,0, 10, 24 и 48 ч после введения. Измеряли концентрацию в плазме азилсартана (ТАК-536), М1 (продукт декарбоксилирования азилсартана) и М2 (продукт O-деалкилирования). Результаты приведены в таблице и на фигурах 1-3 ниже.
Результаты показывают, что по сравнению с эквимолярной концентрацией азилсартанового эфира, Cmax и AUC азилсартановой кислоты в плазме повышена на 98% и 70% после введения соединения примера 2, и эта разница является статистически значимой. Это иллюстрирует, что концентрация азилсартановой кислоты может быть существенно повышена посредством модификации азилсартанового эфира в холиновые соли.
Экспериментальный пример 4
Изучение гипотензивного эффекта у SHR-крыс (спонтанно-гипертензивные крысы)
38 из 25-недельных самцов SHR-крыс были случайным образом поделены на 4 группы согласно изначальному кровяному давлению, по 6 крыс в контрольной группе (растворитель) и 8 в других группах. 10 мг/кг соединения примера 2 (холин азилсартан), соединения примера 4 (соли азилсартан этаноламина) и контроль (калиевая соль азилсартан медоксимила), соответственно, непрерывно вводили. Контрольной группе (растворитель) вводили растворитель. Вводимый объем составлял 5 мл/кг и период составлял 2 недели.
На фигуре 4 изображено, что по сравнению с контролем (растворитель) соединения примера 2 и примера 4 могут существенно снижать кровяное давление у SHR-крыс после непрерывного введения в течение одной или двух недель. При одинаковой дозе эффект соединения примера 2 является оптимальным, соединение примера 4 менее эффективно, но оба соединения превосходят контроль по гипотензивному эффекту.
Экспериментальный пример 5
Влияние на крыс с гипертонией, индуцированной ангиотензинном II
1. Экспериментальное оборудование и другие материалы
(1) Оборудование
Система дистанционного измерения давления DSI
Тип имплантов для измерения кровяного давления: ТА11РА-С40, Data Sciences International.
Программное обеспечение для анализа данных кровяного давления: Ponemah Software 5.0, Data Sciences International.
Микроосмотический насос Alzet: Alzet, model 2002, Alzet US.
(2) Тестируемый образец и агент
Количество тестируемого образца: HS-10149 (соединение примера 2); серия: 20110324; обеспеченный JIANGSU HANSOH PHARMACEUTICAL CO., LTD.; чистота: 99,5%; физическое состояние: белый порошок; условия хранения: герметичность, 4-8°C, сухость, защита от света.
Растворитель: Ceolus; серия: В063; физическое состояние: белый порошок; условия хранения: герметичность, комнатная температура, сухость.
Ангиотензин II: серия: 041M5062V; чистота ≥93%; условия хранения: -20°C, защита от света.
Поставщик: Sigma-Aldrich, Inc.
2. Получение соединений
(1) Ангиотензин II
Дозу ангиотензина II определяли согласно литературе (Harrison-Bernard LM, Zhuo J, Kobori H, Ohishi M, Navar LG. Внутрипочечный AT (1) receptor and ACE binding in ANG II-induced hypertensive rats. Am J Physiol Renal Physiol. 2002 Jan; 282(1):F19-25; Diz DI, Baer PG, Nasjietti A. Angiotensin II-induced hypertension in the rat. Effects on the plasma concentration, renal excretion, and tissue release of prostaglandins. J Clin Invest. 1983 Aug; 72(2):466-77). Ангиотензин II точно взвешивали и добавляли к нему стерильный солевой раствор до концентрации 14,4 мг/мл, затем слегка перемешивали до прозрачности и хранили при -20°C в темноте.
(2) Тестируемый образец
HS-10149 суспензия: соединения точно взвешивали и разводили при помощи 2% суспензии Ceolus в градиенте до 0,20 мг/мл, 0,06 мг/мл, 0,02 мг/мл, затем суспензию перемешивали до растворения и хранили при 4°C в темноте. Образец нагревали до комнатной температуры заранее перед введением и перемешивали до однородности.
3. Экспериментальные животные
37 крыс породы Спраг-Доули (SHANGHAI SLAC LABORATORY ANIMAL CO. LTD), 17 самок крыс и 20 самцов крыс, номер сертификата на животных: 2007000524884, 2007000525715, 2007000526632.
4. Способ исследования
(1) Индуцирование гипертонии и имплантация имплантов для измерения кровяного давления
Животных требуемой массы (самки: 230-250 г, самцы: 200-220 г) отбирали после адаптации в течение одной недели. Самцов крыс подвергали комбинированной анестезии кетамином (44 мг/кг, в/м.) и 2% раствора пентобарбитала натрия (30 мг/кг, и/п), и самок крыс наркотизировали при помощи 2% раствора пентобарбитала натрия (40 мг/кг, и/п). Имплантаты имплантировали на день 0 и кровяное давление непрерывно мониторировали в течение 24 часов с 7-го дня после имплантации микроосмотического насоса. Животных с САД (среднее систолическое артериальное давление) до 140 мм рт.ст. более 24 часов рассматривали как стандартных животных для скрининга. Подходящих животных использовали в испытании, неподходящих животных исключали.
(2) Группы
Подготовленных животных делили на группы согласно их САД свыше 24 часов, 8 животных для каждой группы, половина самок и половина самцов. 8 животных для каждой группы удовлетворяет требованиям статистических исследований и требованию основополагающих принципов фармакодинамики.
(3) Введение
После группирования животным группы контроля (растворитель), низкой, средней и высокой дозы внутрижелудочно вводили 2% Ceolus, 0,1 мг/кг, 0,3 мг/кг и 1,0 мг/кг HS-10149, соответственно. Время введения: 10:00 и 10:30 утра, и вводимый объем составлял 5 мл/кг.
План эксперимента
Контроль (растворитель) представляет собой 2% суспензию Ceolus.
(4) Течение эксперимента
Здоровому животному имплантировали имплантат на день 0 и на 8 день подкожно имплантировали микроосмотический насос. Кровяное давление контролировали в течение 24 часов с 15-го дня, и животных с подходящим кровяным давлением отбирали для исследования. Положительное лекарственное средство или тестируемый образец вводили однократно в 10:00 на 16-й день и кровяное давление мониторировали после введения в течение 24 часов. В конце исследования животных умерщвляли при повышенной концентрации углекислого газа.
5. Манипуляции и анализ данных
Данные регистрировали каждые 5 с автоматически при помощи системы дистанционного измерения давления DSI. Среднее значение, вычисленное внутри часа в качестве единицы при помощи программного обеспечения рассматривали в качестве начальных данных. P<0,05 показывает значительную разницу между группой, получавшей лекарственное средство, и контрольной группой (растворитель), и ∗∗P<0,05 показывает высокую степень отличия между группой, получавшей лекарственное средство, и контрольной группой (растворитель).
6. Результаты
(1) Эффект повышения кровяного давления
На 6-й день после имплантации микроосмотического насоса, заполненного ангиотензинном II, амбулаторно мониторировали кровяное давление у животных в течение 24 часов. САД до 140 мм рт.ст. свыше 24 часов являлось стандартом успешного моделирования. Подходящих животных включали в исследование, а неподходящих животных исключали. 5 животных (4 самцов и 1 самку) исключили из данного исследования. Среднее значение САД подходящих животных на протяжении более 24 часов составляло 167 мм рт.ст.
(2) Влияние HS-10149 на кровяное давление модельных животных
Данные показывают, что растворитель не влияет на уровень кровяного давления у животных. Среднее кровяное давление (среднее значение после введения свыше 23 часов) животных в трех дозовых группах (0,1 мг/кг, 0,3 мг/кг, 1,0 мг/кг) HS-10149 существенно снижено по сравнению с таковым контрольной группы (растворитель) (p<0,01). Средний показатель снижения составляет 24,7%, 39,3%, 44,9% соответственно. HS-10149 показывает положительную корреляцию дозы и эффекта в диапазоне дозы. Все среднее кровяное давление между исследуемыми группами на 23, 13, 3 часа после введения и 1 часа после введения не показывает значительной разницы между группами (p>0,05). По сравнению с контрольной группой (растворитель) среднее кровяное давление трех дозовых групп (низкой, средней и высокой дозовой группы) of HS-10149 на 2, 7, 13, 18, 23 часу после введения показывало очень значительную разницу (P<0,01), и среднее кровяное давление трех дозовых групп (низкой, средней и высокой дозовых групп) HS-10149 на 23 час после введения было сильно понижено. Таким образом, эффект HS-10149 после однократного введения может длиться приблизительно 23 часа.
Сравнение среднего САД свыше 23 часов до введения и 23 часов после введения
(среднее ± с.о., N=8)
7. Заключение
Результаты исследования показывают, что HS-10149 проявляет значительный гипотензивный эффект на модели крыс с гипертонией, индуцированной ангиотензином II. Эффект лекарственного средства и доза положительно скоординированы между 0,1 мг/кг и 1,0 мг/кг. Минимальная эффективная доза составляет 0,1 мг/кг, и после введения в течение 23 часов, все три дозы показывают сильный гипотензивный эффект.
Экспериментальный пример 6
Исследование острой токсичности на собаках породы Бигль
Цель: для наблюдения острого токсического ответа животных в исследовании применяли способ сублетальных доз, включающий внутрижелудочное введение соединения примера 2 или калиевой соли азилсартан медоксимила собакам породы Бигль для исследования токсичности соединения примера 2 после введения и сравнения токсичности соединения примера 2 и калиевой соли азилсартан медоксимила, которые могут обеспечить ссылочное соответствие для оценки токсичности соединения примера 2.
Способ (способ сублетальных доз): использовали 6 собак породы Бигль, 3 для группы примера 2 и 3 для группы калиевой соли азилсартан медоксимила. Вводимая доза составляла 0,09, 0,13, 0,19, 0,28, 0,42, 0,63, 0,95, 1,42, 2,13, 3,20 г·кг-1 соответственно, где 3,20 г·кг-1 представлял собой максимальную вводимую дозу (относящуюся к 1081-разовой данной дозе для клинического пациента). Кровь собирали до введения и на 2, 7, 14 день после введения для исследования соответствующих биохимических показателей. Электрокардиограмму, массу тела и температуру тела определяли до введения на 7, 14 сутки после введения.
Результаты исследования
Группа калиевой соли азилсартан медоксимила: в дозовой группе 3,20 г·кг-1, у животных наблюдались рвота, слюнотечение, меньшая подвижность; снижение подвижности на 2-8 день, упадок сил на 5-8 день, смерть на 9 день; в дозовой группе 2,13 г·кг-1 в день введения у животных наблюдались рвота, слюнотечение, пониженная подвижность; пониженная подвижность на 2 день после введения, подвижность восстанавливалась на 3 день и ненормальная подвижность после 3 дня не наблюдалась; в дозовой группе 1,42 г·кг-1, в день введения у животных наблюдались рвота, меньшая подвижность; снижение подвижности на 2 день введения, восстановление подвижности на 3 день и отсутствие ненормальной подвижности после 3 дня.
Группа соединения примера 2: в дозовой группе 3,20 г·кг-1, в день введения у животных наблюдался частый стул, жидкий стул, рвота до конца наблюдения и жидкий стул, снижение подвижности на 2 день после введения, жидкий стул на 3 день и подвижность, экскрет восстанавливался до нормального на 4 день и ненормальный после этого не наблюдался; в дозовой группе 2,13 г·кг-1, в день введения не наблюдалось нарушений, и у животных наблюдались рвота, снижение подвижности на 2 день введения, частый стул и восстановленная подвижность на 3 день, восстановленный экскрет до нормального на 4 день и отсутствие нарушений после 4 дня; в дозовой группе 1,42 г·кг-1 в день введения у животных наблюдался жидкий стул и меньшая подвижность, снижение подвижности на 2 день после введения, восстановленная нормальная подвижность на 3 день и отсутствие ненормальной подвижности после 3 дня.
Масса тела всех животных в группе, которой вводили калиевую соль азилсартан медоксимила и соединение примера, 2 была снижена на 7 день после введения по сравнению с массой до введения, и все выжившие животные начали набирать массу на 14 день после введения.
Температура тела всех животных в группе калиевой соли азилсартана и соединения примера 2 была нормальной на 7 день после введения, и у всех выживших животных наблюдалась нормальная температура тела на 14 день после введения.
Электрокардиограмма и гематологический показатель всех животных в группе, в которой вводили калиевую соль азилсартан медоксимила и соединение примера 2, были нормальными на 7 день после введения, и у всех выживших животных на 14 день после введения была нормальная электрокардиограмма и гематологический показатель.
Систолическое кровяное давление и диастолическое кровяное давление 5 животных в группе, в которой вводили калиевую соль азилсартан медоксимила и соединение примера 2, были снижены более или менее на 2 день после введения, и у всех выживших животных на 14 день после введения наблюдалось нормальное систолическое и диастолическое кровяное давление.
Группа калиевой соли азилсартан медоксимила: у собак, которым вводили дозу 3,20 г·кг-1, наблюдались повышенные АЛТ, ACT, КК, КРЕ, мочевина и ОАМ на 2 день и на 7 день после введения, и смерть на 9 день; АЛТ, КРЕ, мочевина и ОАМ собак с дозой 2,13 г·кг-1 были значительно повышены на 2 день после введения, и АЛТ, КК, КРЕ и ОАМ были значительно повышены на 7 день и восстанавливались до нормальных на 14 день; АЛТ, КРЕ, ОАМ собак с дозой 1,42 г·кг-1 были значительно повышены на 2 день после введения, и КРЕ, ОАМ были значительно повышены на 7 день и восстанавливались до нормальных на 14 день, другие показатели не проявляли явного отклонения от нормы.
Группа соединения примера 2: КРЕ, мочевина и ОАМ всех собак, которым вводили соединение примера 2, были значительно повышены на 2 день после введения, КРЕ и ОАМ были значительно повышены на 7 день после введения и возвращались к нормальным на 14 день, АЛТ собак с дозой 3,20 г·кг-1 был повышен на 2 день и восстановился до нормального на 7 день, другие показатели не проявляли явного отклонения от нормы.
Значения ПВ (протромбиновое время) всех животных, которым вводили калиевую соль азилсартан медоксимила и соединение примера 2, были значительно снижены после введения по сравнению со значениями до введения. Fib (уровень фибриногена) группы с дозой 3,20 г·кг-1 калиевой соли азилсартан медоксимила был значительно повышен на день 2 и день 7 после введения, и Fib группы с дозой 2,13 г·кг-1 был значительно повышен на день 2 после введения. Fib группы с дозой 3.20 г·кг-1 соединения примера 2 был значительно повышен на день 2 после введения. Другие показатели не проявляли явного отклонения от нормы.
Группа калиевой соли азилсартан медоксимила: животные группы с дозой 3,20 г·кг-1 умирали на 9 день после введения. Животных препарировали, чтобы показать, что перианальная область загрязнена и имеет кровянистые выделения; левая доля легкого была темно-красного цвета, и правая доля легкого была нормальной; на дне желудка присутствовали белые с металлическим блеском бородавки, содержимое тонкого кишечника от тощей кишки до ободочной кишки красновато-коричневое и цвет темнеет к нижним отделам кишечника, слизистая явно эрозирована, и на слизистой кишечника присутствуют единичные темно-красные участки; другие внутренние органы не видоизменены. Животных дозовой группы 2,13 г·кг-1 препарировали на 15 день, чтобы показать, что в области дна и кардиального отдела желудка присутствуют красные пятна, слизистая красная, и в желудке присутствует лимфоподобная пища; другие внутренние органы не видоизменены. Животных дозовой группы 1,42 г·кг-1 препарировали на 15 день, чтобы показать, что единичные темно-красные участки присутствуют на слизистой желудка, и немного лимфоподобной пищи присутствует в желудке; другие внутренние органы не видоизменены.
Группа соединения примера 2: животных дозовой группы 3,20 г·кг-1 препарировали на 15 день; каждую ткань окрашивали при помощи гематоксилин-эозина (ГЭ) и обследовали под световым микроскопом; животные не проявляли явного отклонения от нормы. Животных дозовой группы 2,13 г·кг-1 препарировали на 15 день и показали, что желудок наполнен и в нем присутствуют частицы пищи; слизистая кардиального отдела красная и имеет единичные красные пятна; другие внутренние органы не видоизменены. Животных дозовой группы 1,42 г·кг-1 препарировали и показали, что желудок наполнен и содержит частицы пищи; слизистая кардиального отдела красная и имеет единичные красные пятна; другие внутренние органы не видоизменены.
Записи анатомического обследования группы с дозой 3,20 г·кг-1 калиевой соли азилсартан медоксимила: каждую ткань окрашивали при помощи гематоксилин-эозина (ГЭ) и наблюдали под микроскопом; диффузное разрастание кровеносного синуса печени и разрушение части ткани печени (аутолиз); число лимфоцитов в красной и белой пульпе селезенки существенно снижено и наблюдается гиперплазия фиброзной ткани в красной пульпе; средний гиперемированный отек диффузной ткани легкого; почечная ткань гиперемирована и разрушена (аутолиз); слизистый эпителий желудка некротизирован и подслизистый слой отечен; наблюдается гиперплазия фибробластов и новые капилляры; слизистый эпителий двенадцатиперстной кишки, тощей кишки, подвздошной кишки, толстой кишки, слепой кишки и прямой кишки некротизирован или гиперемирован с кровотечением.
Заключение
В условиях настоящего эксперимента собаке породы Бигль внутрижелудочно вводили соединение примера 2 или калиевую соль азилсартан медоксимила, сублетальная доза соединения примера 2 составляет более 3,20 г·кг-1 и сублетальная доза калиевой соли азилсартан медоксимила составляет 2,13~3,20 г·кг-1, таким образом, острая токсичность соединения примера 2 ниже, чем острая токсичность калиевой соли азилсартан медоксимила.
Изобретение относится к органической аминной соли азилсартана, где соотношение азилсартана к органическому амину составляет 2:1, и органический амин представляет собой этаноламин или холин. Органическая аминная соль азилсартана существует в виде комплекса и представлена формулами (I) и (III), где М⊕ представляет собой катион холина или катион, образованный этаноламином и Н+. Также изобретение относится к способам получения органических аминных солей азилсартана. Органическую аминную соль азилсартана формулы (I) получают путем добавления кислоты азилсартана и органического амина к спиртовому растворителю, в указанном порядке, для получения соответствующих солей при комнатной температуре или под действием нагревания, причем упомянутую реакцию проводят в безводных условиях, а молярное соотношение кислоты азилсартана к органическому амину составляет 2:1. Органическую аминную соль азилсартана формулы (III) получают путем добавления кислоты азилсартана и спиртового раствора холина в спиртовом растворителе, причем упомянутый спиртовой раствор холина представляет собой раствор холина в метаноле с концентрацией 45%, и молярное соотношение азилсартана к холину составляет 1:1-2:1. Органические аминные соли азилсартана предназначены для изготовления фармацевтической композиции или лекарственного препарата для лечения гипертонии. Технический результат - органическая аминная соль азилсартана с органическим амином, обладающая хорошими фармакокинетическими характеристиками, высокой биодоступностью, низкой лекарственной токсичностью. 5 н. и 4 з.п. ф-лы, 4 ил., 1 табл., 11 пр.
1. Органическая аминная соль азилсартана, где соотношение азилсартана к органическому амину составляет 2:1 и органический амин представляет собой этаноламин или холин.
2. Органические аминные соли азилсартана по п. 1, где органические аминные соли азилсартана существуют в виде комплекса.
3. Органические аминные соли азилсартана по п. 1, структура которых изображена в виде формулы (I), где М⊕ представляет собой катион холина или катион, образованный этаноламином и Н+,

4. Органическая аминная соль азилсартана по п.1, где структура органической аминной соли азилсартана изображена в виде формулы (III)

5. Способ получения органических аминных солей азилсартана п. 3, включающий добавление кислоты азилсартана и органического амина к спиртовому растворителю, в указанном порядке, для получения соответствующих солей при комнатной температуре или под действием нагревания, причем упомянутую реакцию проводят в безводных условиях, а молярное соотношение кислоты азилсартана к органическому амину составляет 2:1.
6. Способ получения органической аминной соли азилсартана по п. 4, включающий добавление кислоты азилсартана и спиртового раствора холина в спиртовом растворителе, причем упомянутый спиртовой раствор холина представляет собой раствор холина в метаноле с концентрацией 45% и молярное соотношение азилсартана к холину составляет 1:1-2:1.
7. Способ по п. 5 или 6, где спиртовой растворитель выбран из группы, состоящей из метанола, этанола, пропанола или изопропанола.
8. Фармацевтическая композиция для лечения гипертонии, включающая терапевтически эффективное количество органических аминных солей азилсартана по любому из пп. 1-4 в качестве активного ингредиента и фармацевтически приемлемые носители.
9. Применение органических аминных солей азилсартана по любому из пп. 1-4 или фармацевтической композиции по п. 8 для получения гипотензивного лекарственного препарата.
| СПОСОБ И УСТРОЙСТВО ВЗРЫВНОЙ УТИЛИЗАЦИИ БОЕПРИПАСОВ В ЖИДКОЙ СРЕДЕ | 2012 |
|
RU2508522C1 |
| ЕР 1452176 А1, 10.09.2004 | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| CN 101921264 A, 22.12.2010. | |||
Авторы
Даты
2016-10-27—Публикация
2012-01-11—Подача