Область техники настоящего изобретения относится к области биологического анализа. Более конкретно, настоящее изобретение относится, во-первых, к устройству для лизиса микроорганизмов, имеющихся в пробе из окружающей среды или в клинической пробе, для извлечения и для очистки нуклеиновых кислот указанных микроорганизмов. Кроме того, изобретение относится к автоматической системе для лизиса микроорганизмов для извлечения и для очистки нуклеиновых кислот указанных микроорганизмов с целью анализа.
В течение нескольких лет в больницах наблюдается рост назокомиальных инфекций. Данные инфекции объясняются контаминацией госпитализируемых людей, имеющих, вследствие этого, выявленную иммунодепрессию, за счет болезнетворных микроорганизмов, присутствующих в больничной среде и не уничтожаемых несмотря на значительные усилия, постоянно прикладываемые для дезинфекции оборудования и поверхностей и для обработки воздуха. Ввиду этих все более и более частых случаев окружающей микробиологической контаминации, разработка устройств и способов улучшения и облегчения мероприятий по охране окружающей среды становится основной проблемой для работников здравоохранения.
В дополнение к проблеме назокомиальных инфекций, контроль за окружающими условиями в течение многих лет также был текущей проблемой в промышленности, в частности в пищевой промышленности и фармацевтической и косметической промышленности. В пищевой промышленности хорошо известны катастрофические последствия для здоровья потребителей, которые могут произойти из-за заражения продуктов или даже сырья болезнетворными микроорганизмами. Действительно, пищевое отравление по причине бактерий, таких как бактерии рода Listeria или Salmonella, в настоящее время стало обычным явлением. Контроль за качеством воздуха также является ключевым процессом в регулировании качества в фармацевтической и косметической промышленности.
Более того, меры контроля должны соответствовать все более повышающимся требованиям, поскольку нормативные документы все время становятся более жесткими.
В распоряжении работников здравоохранения или производителей, среди инструментов для осуществления мер по контролю за окружающими условиями, приборы для отбора микробиологических проб воздуха являются предпочтительными решениями для обнаружения микроорганизмов, содержащихся в воздухе. Данные устройства помещают в подходящие точки в местах, где требуется измерение микробиологического заражения воздуха. В общем, они состоят из прибора для отбора проб воздуха, соединенного с культуральной средой. Воздух, отобранный посредством прибора для отбора проб воздуха, входит в контакт с культуральной средой; любые микроорганизмы, содержащиеся в отобранном воздухе, будут помещены в культуральную среду. Затем культуральную среду извлекают и помещают в термостат, чтобы способствовать помочь росту микроорганизмов. Таким образом, становится возможным обнаружение и идентифицирование указанных микроорганизмов с помощью общепризнанных микробиологических методик.
Тем не менее, данные устройства имеют основной недостаток, который связан с используемой технологией. Данным недостатком является время, необходимое для получения результата анализа. Действительно, чтобы обеспечить возможность идентификации, использование общепризнанных методик микробиологии, в частности бактериологии, требует инкубационных периодов, необходимых для клеточного роста, или даже фаз повторного посева на специфической культуральной среде. В результате время, требующееся для получения результата, является относительно долгим или даже очень долгим, при попытке обнаружения и идентифицирования патогена, который является ответственным за назокомиальную инфекцию или за пищевое отравление.
Еще один недостаток устройства данного типа состоит в том, что хотя использование культуральной среды делает возможным провести различие между родами и видами бактерий, в общем, это не позволяет проводить различие между штаммами одного и того же вида бактерий. В настоящее время известно, что патогенность микроорганизма может в значительной степени варьировать в зависимости от изучаемого штамма.
Более того, данный тип устройства имеет недостаток, что оно неспособно обнаруживать микроорганизмы, содержащиеся в воздухе, являющиеся жизнеспособными, но которые нельзя культивировать.
Более того, существуют устройства, предназначенные для извлечения взвешенных в воздухе частиц, в частности микроорганизмов. Так, документ GB-2 254024 описывает устройство для отбора взвешенных в воздухе частиц, принцип которого основан на циклонном эффекте. Как обнаружено, несмотря на то что данное устройство подходит для отбора взвешенных в воздухе частиц, включая микроорганизмы, оно никогда не рассматривалось для обработки полученных таким образом образцов, в частности для выделения генетического материала, предназначенного для использования для анализа.
В более общем смысле, методики, которые наиболее релевантны для целей идентификации микроорганизмов и/или скорости доставки результатов, по отношению либо к клиническим пробам, либо пробам из окружающей среды, несомненно, являются методиками молекулярной диагностики. Данные методики, основанные на анализе генетического материала микроорганизмов и, в частности, определенных интересующих специфических последовательностей, делают возможным получение очень точной идентификации микроорганизмов во время регистрации, поскольку они предоставляют возможность исключения стадий культивирования.
Тем не менее, использование подобных методик имеет определенные ограничения, наиболее важным из которых является потенциально ограниченное количество микроорганизмов, которые присутствуют в воздухе и, вследствие этого, могут быть извлечены для проведения анализа. В действительности, известно, что пробы из окружающей среды, а также некоторые клинические пробы содержат относительно небольшое количество микроорганизмов. Следовательно, из такого исходного материала получают только небольшое количество генетического материала. Вследствие этого, критическим параметром становится эффективность методики, используемой для выделения нуклеиновых кислот, на основании выхода.
Более того, большинство существующих методик для лизиса микроорганизмов не имеют общего применения для всех микроорганизмов и/или требуют вмешательства квалифицированного персонала обслуживания стадий, выполняемых вручную.
Документ WO-A-2005/038025 описывает способ выделения нуклеиновых кислот из микроорганизмов, в частности из проб воздуха. Данный способ включает использование трех различных способов лизиса, а именно химического лизиса, лизиса за счет теплового удара и механического лизиса. Несмотря на то что подобный способ, несомненно, предоставляет возможность оптимизации эффективности выделения нуклеиновых кислот и, вследствие этого, увеличения количества генетического материала, доступного для анализа, данная эффективность все-таки зависит от количества извлекаемых микроорганизмов. Кроме того, в данном документе ничего не описано для оптимизации выделения указанных микроорганизмов.
Документ US-5707861 описывает устройство для разрушения живых клеток, таких как микроорганизмы. Данное устройство делает возможным лизис клеток посредством использования стеклянных шариков, но в дополнение посредством действия колебания благодаря зазору, который имеется между пробирками, содержащими микроорганизмы, и отверстиями в опоре, поддерживающей указанные пробирки. Таким образом, устройство данного типа обеспечивает возможность оптимизации клеточного лизиса и, вследствие этого, оптимизации выделения генетического материала. Указанное устройство и способ, используемый последним, имеют те же ограничения, которые упомянуты выше, а именно, они все-таки зависят от количества выделяемых микроорганизмов. Более того, они имеют дополнительный недостаток, состоящий в необходимости последующей стадии концентрирования нуклеиновых кислот для того, чтобы изолировать их от продуктов распада клеток. В заключение, они требуют ручного выделения нуклеиновых кислот в конце стадии концентрирования.
Данные проблемы также возникают с устройством, описанным в документе US-5567050.
Также были описаны системы, которые являются более интегрированными. Так, документ WO-А-2004/018704 описывает устройство и связанный с ним способ, использующий методику ПЦР (Полимеразной Цепной Реакции) усиления, для отбора микроорганизмов из воздуха и их идентификации. Данная система особенно подходит для борьбы с попытками нападения посредством биологического заражения в почтовых сортировочных центрах. Данная система состоит из пробоотборника воздуха, расположенного вдоль контура для транспортировки почты, устройства для фильтрации/сепарации частиц с помощью циклонного действия, устройства для концентрирования/выделения частиц в пробе жидкости и устройства для переноса фракции пробы в картридж GeneXpertTM для ПЦР анализа от компании Cepheid. Затем картридж вручную переносят в отдельный автоматический биологический анализатор для идентификации микроорганизма или микроорганизмов, отобранных из воздуха.
Несмотря на то что данная система обеспечивает возможность решения многих технических проблем, связанных с устройствами и способами, описанными выше, тем не менее, она имеет несколько основных недостатков. Первый из данных недостатков состоит в том, что система для обработки пробы (отбор, сепарация, концентрация/выделение) до переноса в картридж для анализа является относительно сложной и дорогой. Еще один недостаток состоит в том, что не существует картриджа GeneXpertTM, который может выполнять как лизис, так и очистку нуклеиновых кислот. Дополнительный второй недостаток состоит в том, что отобранные микроорганизмы, выделяются в пробе жидкости, только часть которой анализируется. Это означает, что риск выделения не всех микроорганизмов и, вследствие этого, не всех нуклеиновых кислот является очень большим, значительно ограничивая релевантность анализа. Более того, несмотря на сложность, данная система требует ручного переноса картриджа в автоматический анализатор GeneXpertTM.
Таким образом, первая цель настоящего изобретения состоит в том, чтобы предоставить устройство, систему и универсальный способ лизиса, который является эффективным для проб как из окружающей среды, так и клинических, для большого многообразия микроорганизмов, являются ли они бактериями, вирусами или грибами, по выбору в состоянии вегетативного развития, либо в виде спор.
Еще одна цель настоящего изобретения состоит в том, чтобы предоставить устройство, подходящее для эффективного лизиса указанных микроорганизмов, содержащихся в пробе из окружающей среды, например из воздуха, или в клинической пробе, для того чтобы выделить из нее нуклеиновые кислоты с целью анализа интегрированным образом.
Еще одна цель настоящего изобретения состоит в том, чтобы предоставить устройство, подходящее для отбора всех микроорганизмов, содержащихся в пробе воздуха.
Еще одна цель настоящего изобретения состоит в том, чтобы предоставить устройство простой конструкции, с минимизацией количества и сложности ручных стадий.
Еще одна цель настоящего изобретения состоит в том, чтобы предоставить устройство, являющееся чрезвычайно компактным.
Еще одна цель настоящего изобретения состоит в том, чтобы предоставить замкнутое устройство, в котором различные стадии, перечисленные выше, происходят без риска внешнего заражения.
Еще одна цель настоящего изобретения состоит в том, чтобы предоставить устройство, в котором указанные стадии происходят без переноса пробы оператором, предотвращая, таким образом, заражения последнего.
Еще одна цель настоящего изобретения состоит в том, чтобы предоставить устройство и систему, которая ограничивает вмешательство человека и улучшает возможность отслеживания обработки пробы.
В заключение, еще одна цель настоящего изобретения состоит в том, чтобы предоставить устройство и автоматическую систему, допускающие подачу намеченных нуклеиновых кислот в буфер, который может быть использован непосредственно на стадиях молекулярной диагностики, включающих, например, стадии амплификации и обнаружения, без дополнительных стадий предварительной обработки, таких как центрифугирование или фильтрация.
Данные цели, среди прочих, достигаются с помощью настоящего изобретения, которое относится, во-первых, к устройству для отбора микроорганизмов, содержащихся в воздухе, при этом указанное устройство имеет:
- модуль для забора воздуха, включающий:
1) верхний элемент, имеющий проход для впуска воздуха, обеспечивающий поступление воздушной струи в указанный модуль, причем указанный проход снабжен в своем основании средством возмущения воздушной струи,
2) нижний элемент, имеющий средство выпуска воздуха, обеспечивающее выход созданной воздушной струи,
при этом указанные верхний и нижний элементы могут быть изготовлены в виде единого целого друг с другом таким образом, чтобы внутри указанного модуля для забора воздуха могла создаваться воздушная струя;
- картридж ориентировочно цилиндрической формы, имеющий зону задерживания микроорганизмов, при этом указанная зона задерживания имеет лизирующее средство микроорганизмов, причем указанный картридж расположен внутри указанного модуля для забора воздуха.
Предпочтительно, зона задерживания микроорганизмов картриджа устройства для отбора микроорганизмов дополнительно включает материал, который способен задерживать микроорганизмы, удерживать на своем месте лизирующее средство и растворяться в присутствии жидкости.
В устройстве согласно изобретению, средство возмущения воздушной струи включает конус стрельчатой формы, расположенный в центре высверленного отверстия прохода для впуска воздуха, и, по меньшей мере, одну лопасть, соединяющую указанную стрелообразную деталь с внутренней поверхностью канала для впуска воздуха.
Преимущественно, модуль для забора воздуха предназначен для соединения с контуром циркуляции воздуха или с устройством для аспирации воздуха.
Настоящее изобретение также относится к устройству для лизиса микроорганизмов, при этом указанное устройство имеет:
- картридж ориентировочно цилиндрической формы, имеющий зону задерживания для микроорганизмов, при этом указанный картридж выполняет роль статора;
- ротор, который может быть установлен в картридже, при этом указанный ротор имеет средство вращения.
Согласно предпочтительному варианту осуществления, данное устройство дополнительно включает крышку, предназначенную для удерживания ротора в виде единого целого с картриджем.
Преимущественно, средство вращения состоит из желобков, сделанных в стенке сплошного прохода, при этом указанные желобки являются диаметрально противоположными и предназначены для приема конца трансмиссионного вала средства вращения указанного ротора.
Согласно заслуживающей упоминания характеристике устройства для лизиса микроорганизмов, внутренний диаметр картриджа больше, чем наружный диаметр ротора, так что, когда ротор вставляют в картридж, расстояние, отделяющее внутреннюю стенку картриджа от наружной стенки ротора, является достаточно большим, чтобы предоставить возможность расположения лизирующего средства в данном промежуточном пространстве, и достаточно маленьким для того, чтобы лизирующее средство находилось в контакте с одной или другой из указанных стенок.
Кроме того, настоящее изобретение относится к системе для лизиса микроорганизмов и очистки нуклеиновых кислот указанных микроорганизмов, имеющей:
- средство позиционирования устройства для лизиса микроорганизмов согласно изобретению;
- средство вращения ротора, когда устройство для лизиса устанавливают на средство позиционирования;
- по меньшей мере, один контейнер для приема нуклеиновых кислот;
- по меньшей мере, одно средство для аспирации/выпускания жидкости;
- многоходовой клапан, в жидкостном сообщении с устройством для лизиса микроорганизмов, контейнером для приема очищенных нуклеиновых кислот и средством для аспирации/выпускания жидкости.
Предпочтительно, данная система лизиса согласно предшествующему пункту дополнительно включает средство намагничивания. Она может включать также нагревающее средство.
Согласно особому варианту осуществления изобретения, многоходовой клапан включает средство аспирации-выталкивания.
Изобретение также относится к способу сбора микроорганизмов, содержащихся в воздухе, при этом указанный способ включает стадии, состоящие из:
а) установки картриджа внутри модуля для забора воздуха для того, чтобы получить устройство для отбора микроорганизмов согласно изобретению, при этом зона задерживания внутри указанного картриджа находится в сообщении с проходом для впуска воздуха модуля для забора воздуха,
b) вызывания прохождения воздуха в указанный модуль для забора воздуха посредством любого подходящего средства,
с) накапливания микроорганизмов, содержащихся в воздухе, в зоне задерживания картриджа.
Изобретение также относится к способу лизиса микроорганизмов, содержащихся в воздухе, при этом указанный способ имеет стадии, состоящие из:
а) установки картриджа внутри модуля для забора воздуха для того, чтобы получить устройство для отбора микроорганизмов согласно изобретению, при этом зона задерживания внутри указанного картриджа находится в сообщении с проходом для впуска воздуха модуля для забора воздуха,
b) вызывания прохождения воздуха в указанный модуль для забора воздуха посредством любого подходящего средства,
с) накапливания микроорганизмов, содержащихся в воздухе, в зоне задерживания картриджа,
d) извлечения картриджа из модуля для забора воздуха,
е) установки ротора в картридже для того, чтобы получить устройство для лизиса микроорганизмов,
f) позиционирования устройства для лизиса микроорганизмов в системе для лизиса микроорганизмов и очистки нуклеиновых кислот,
g) введения элюирующей жидкости в картридж для суспендирования лизирующего средства, расположенного в зоне задерживания микроорганизмов картриджа, и
h) механического лизиса микроорганизмов посредством вращения ротора внутри картриджа с помощью средства вращения указанного ротора, при этом указанный ротор вызывает вращение лизирующего средства микроорганизмов.
«Элюирующая жидкость» подразумевает любую жидкость, подходящую для осуществления лизиса или даже выделения и извлечения нуклеиновых кислот в хорошем состоянии. Указанная жидкость, в общем, представляет собой буфер. В случае, когда применение способа согласно изобретению происходит с целью выделения нуклеиновых кислот и извлечения их с целью анализа, указанный буфер должен предоставлять возможность сохранения указанных нуклеиновых кислот. Жидкости данного типа хорошо известны квалифицированным специалистам в данной области.
Изобретение также относится к способу выделения нуклеиновых кислот из микроорганизмов, содержащихся в воздухе, при этом указанный способ имеет стадии, состоящие из:
а) установки картриджа внутри модуля для забора воздуха для того, чтобы получить устройство для отбора микроорганизмов согласно изобретению, при этом зона задерживания внутри указанного картриджа находится в сообщении с проходом для впуска воздуха модуля для забора воздуха,
b) вызывания прохождения воздуха в указанный модуль для забора воздуха посредством любого подходящего средства,
с) накапливания микроорганизмов, содержащихся в воздухе, в зоне задерживания картриджа,
d) извлечения картриджа из модуля для забора воздуха,
е) установки ротора в картридже,
f) введения элюирующей жидкости в картридж с помощью средства аспирации-выпускания для суспендирования лизирующего средства, содержащегося в картридже, и
g) механического лизиса микроорганизмов посредством вращения ротора внутри картриджа с помощью средства вращения указанного ротора, при этом указанный ротор вызывает вращение лизирующего средства, и
h) аспирации элюирующей жидкости, заключающей в себе нуклеиновые кислоты указанных микроорганизмов, высвобожденные в процессе лизиса, и
i) переноса элюирующей жидкости в контейнер для приема и очистки нуклеиновых кислот.
Предпочтительно, способы лизиса микроорганизмов и выделения нуклеиновых кислот, описанные выше, включают дополнительную стадию d'), состоящую из выращивания микроорганизмов, локализованных в зоне задерживания картриджа.
Предпочтительно, выращивание достигается посредством инкубирования картриджа в термостате в течение периода времени в диапазоне от 2 до 24 часов.
Предпочтительно, стадии с f) по i) способов лизиса микроорганизмов и выделения нуклеиновых кислот, описанные выше, осуществляют в системе для лизиса микроорганизмов и очистки нуклеиновых кислот.
Изобретение также относится к способу лизиса микроорганизмов, при этом указанный способ имеет стадии, состоящие из:
а) получения картриджа, в котором микроорганизмы локализованы в зоне задерживания указанного картриджа,
b) установки ротора в картридже,
с) введения интересующей жидкости в картридж для суспендирования лизирующего средства, расположенного в зоне задерживания микроорганизмов картриджа, и
d) механического лизиса микроорганизмов посредством вращения ротора внутри картриджа, при этом указанный ротор вызывает вращение лизирующего средства микроорганизмов.
Изобретение также относится к способу выделения нуклеиновых кислот из микроорганизмов, при этом указанный способ имеет стадии, состоящие из:
а) получения картриджа, в котором микроорганизмы локализованы в зоне задерживания,
b) установки ротора в картридже,
с) введения элюирующей жидкости в картридж для суспендирования лизирующего средства, расположенного в зоне задерживания микроорганизмов картриджа, и
d) механического лизиса микроорганизмов посредством вращения ротора внутри картриджа, при этом указанный ротор вызывает вращение лизирующего средства микроорганизмов, и
е) аспирации элюирующей жидкости, содержащей нуклеиновые кислоты указанных микроорганизмов, высвобожденные в процессе лизиса, и
f) переноса элюирующей жидкости в контейнер для приема и очистки нуклеиновых кислот.
Кроме того, настоящее изобретение относится к способу лизиса микроорганизмов, содержащихся в пробе жидкости, при этом указанный способ имеет стадии, состоящие из:
а) введения пробы жидкости, содержащей указанные микроорганизмы, в картридж поблизости от зоны задерживания таким образом, чтобы указанная проба жидкости приводила к суспендированию лизирующего средства, расположенного в указанной зоне задерживания микроорганизмов картриджа,
b) установки ротора в картридже,
с) механического лизиса микроорганизмов посредством вращения ротора внутри картриджа, при этом указанное вращение приводит к суспендированию лизирующего средства, расположенного в указанной зоне задерживания микроорганизмов картриджа, причем указанный ротор вызывает вращение лизирующего средства, на котором задерживаются микроорганизмы.
«Проба жидкости» подразумевает любую пробу жидкости, которая может содержать в себе микроорганизмы. Она может представлять собой пробу жидкости человеческого или животного происхождения. Указанной пробой может быть, например, моча, цельная кровь, плазма или любая другая текучая среда организма. Проба жидкости может быть пищевого происхождения, как, например, напиток. Также она может иметь происхождение из окружающей среды, как, например, вода. Более того, проба жидкости может также представлять собой так называемую переносящую жидкость, в которой любые микроорганизмы, присутствующие на поверхности устройства для взятия проб, типа тампона на стержне, такого как тампоны на стержне, продаваемые компанией COPAN под названием flockedSWABS, были ресуспендированы посредством встряхивания указанного тампона на стержне в указанной переносящей жидкости.
Изобретение также относится к способу выделения нуклеиновых кислот из микроорганизмов, содержащихся в пробе жидкости, при этом указанный способ имеет стадии, состоящие из:
а) введения пробы жидкости, содержащей указанные микроорганизмы, в картридж, поблизости от зоны задерживания, таким образом, чтобы указанная проба жидкости приводила к суспендированию лизирующего средства, расположенного в указанной зоне задерживания микроорганизмов картриджа,
b) установки ротора в картридже,
с) механического лизиса микроорганизмов посредством вращения ротора внутри картриджа, при этом указанное вращение приводит к суспендированию лизирующего средства, расположенного в указанной зоне задерживания микроорганизмов указанного картриджа, причем указанный ротор вызывает вращение лизирующего средства, на котором задерживаются микроорганизмы,
d) аспирации пробы жидкости, содержащей нуклеиновые кислоты указанных микроорганизмов, высвобожденные в процессе лизиса, и
е) переноса пробы жидкости в контейнер для приема нуклеиновых кислот.
Кроме того, настоящее изобретение относится к способу выделения нуклеиновых кислот из пробы клеточной ткани, при этом указанный способ имеет стадии, состоящие из:
а) введения пробы клеточной ткани в картридж в присутствии элюирующей жидкости,
b) установки ротора в картридже,
с) механического лизиса клеток клеточной ткани посредством вращения ротора внутри картриджа, при этом указанный ротор вызывает вращение лизирующего средства, содержащегося в картридже,
d) аспирации элюирующей жидкости, содержащей нуклеиновые кислоты, из указанных клеток, высвобожденные в процессе лизиса, и
е) переноса элюирующей жидкости в контейнер для приема и очистки нуклеиновых кислот.
«Тканевая проба» подразумевает любую тканевую пробу человеческого или животного происхождения, из которой есть возможность выделить нуклеиновые кислоты. Подобный образец может быть получен посредством биопсии, например, органа, мышцы или кожи. Данные ткани могут быть здоровыми или патологическими, а именно опухолевыми.
Необходимо заметить, что все способы выделения нуклеиновых кислот согласно изобретению могут иметь, согласно предпочтительному варианту осуществления, дополнительную стадию очистки данных нуклеиновых кислот с целью последующей обработки, такой как амплификация. Данная стадия очистки обеспечивает возможность разделения между нуклеиновыми кислотами и другими клеточными составляющими, обессоленными на стадии лизиса. Данная стадия в целом делает возможным концентрирование нуклеиновых кислот и может быть приспособлена для очистки ДНК и РНК. Она может быть выполнена посредством магнитных частиц. В качестве примера, можно использовать магнитные частицы, необязательно покрытые олигонуклеотидами, за счет адсорбции или ковалентных связей (см. патенты США 4675040 и 5750338), и таким образом очищать нуклеиновые кислоты, которые прилипли к данным магнитным частицам, посредством стадии очистки. Данная стадия очистки нуклеиновых кислот особенно полезна, если требуется последующая амплификация указанных нуклеиновых кислот. Особенно любопытный вариант осуществления данных магнитных частиц описан в патентных заявках WO-A-97/45202 и WO-A-99/35500. Еще одним любопытным примером способа очистки нуклеиновых кислот является использование диоксида кремния либо в виде колонны, либо в виде инертных частиц (Boom R. Et al., J. Clin. Microbiol., 1990, № 28(3), p. 495-503) или магнитных частиц (Merck: MagPrep® Silica, Promega: MagneSilTM Paramagnetic particles). Другие широко используемые способы основаны на ионообменных смолах в колонне или в формате парамагнитных частиц (Whatman: DEAE-Magarose) (Levison PR et al., J. Chromatography, 1998, p. 337-344). Еще одним способом, который является очень подходящим, но не эксклюзивным для изобретения, является адсорбция на подложке из оксида металла (от компании Xtrana: Xtra-BindTM matrix).
Более того, в различных способах, описанных выше, все стадии, следующие за воссозданием устройства для лизиса микроорганизмов, т.е. как только ротор был установлен в картридже, могут преимущественно быть использованы в системе для лизиса микроорганизмов и очистки нуклеиновых кислот.
Кроме того, настоящее изобретение относится к использованию устройства для лизиса микроорганизмов согласно изобретению для лизиса клеток пробы клеточной ткани.
Кроме того, настоящее изобретение относится к использованию системы для лизиса микроорганизмов и очистки нуклеиновых кислот указанных микроорганизмов согласно изобретению для лизиса клеток пробы клеточной ткани и очистки нуклеиновых кислот указанных клеток с целью анализа.
Микроорганизмы взяты из группы, включающей бактерии, вирусы, дрожжи, плесень и паразитов.
Пробы, из которых изолируют микроорганизмы, имеют происхождение из окружающей среды. Таким образом, это может быть проба воздуха или жидкости, такой как вода; или пробы с поверхности. Пробы также могут иметь клиническое происхождение, т.е. любая проба человеческого или животного происхождения, которая может являться объектом анализа для обнаружения и идентификации микроорганизма, необязательно болезнетворного.
Наличие намеченных нуклеиновых кислот может быть продемонстрировано с помощью визуализации реакций гибридизации. Реакция гибридизации подразумевает любую реакцию между зарегистрированной нуклеиновой кислотой и намеченной нуклеиновой кислотой, выделенной или созданной на стадии транскрипции, обратной транскрипции или амплификации типа NASBA (Амплификация, Основанная на Последовательности Нуклеиновых Кислот) или ПЦР (Полимеразная Цепная Реакция).
Нуклеиновая кислота подразумевает олигонуклеотиды, деоксирибонуклеиновые кислоты и рибонуклеиновые кислоты, а также их производные. Термин олигонуклеотид обозначает последовательность, по меньшей мере, двух нуклеотидов (деоксирибонуклеотидов, или рибонуклеотидов, или обоих), натуральных или модифицированных, допускающую гибридизацию, в подходящих условиях гибридизации, с олигонуклеотидом, который является, по меньшей мере, частично комплементарным. Модифицированный нуклеотид подразумевает, например, нуклеотид, имеющий модифицированное основание и/или имеющий модификацию межнуклеотидной связи и/или остова. В качестве примера модифицированного основания можно привести инозин, метил-5-деоксицитидин, диметиламино-5-деоксиуридин, диамино-2,6-пурин и бромо-5-деоксиуридин.
Для иллюстрации модифицированной межнуклеотидной связи можно привести фосфоротиоат, N-алкилфосфорамидат, алкилфосфонат и алкилфосфодиэфирные связи.
Альфа-олигонуклеотиды, такие как альфа-олигонуклеотиды, описанные в FR-A-2 607507, ЗНК, такие как фосфоротиоат-ЗНК и 2'-тио-ЗНК, описанные в Bioorganic & Medicinal Chemistry Letters, Volume 8, Issue 16, 18 August 1998, pages 2219-2222, и PNA (пептид-нуклеиновые кислоты), обсуждавшиеся в статье M. Egholm et al., J. Am. Chem. Soc. (1992), 114, 1895-1897, являются примерами олигонуклеотидов, составляющих нуклеотиды с модифицированным остовом.
Реакции гибридизации могут быть наглядно представлены с помощью любого средства обнаружения, такого как прямое или опосредованное средство.
В случае прямого обнаружения, т.е. без применения введения меток, реакции гибридизации наблюдают посредством плазмонного резонанса или посредством циклической вольтамперометрии на электроде, несущем проводящий полимер.
В случае опосредованного обнаружения, т.е. посредством введения меток, введение метки может быть осуществлено либо непосредственно на намеченных нуклеиновых кислотах, либо через специфического связывающего партнера указанных нуклеиновых кислот, которые были заблаговременно помечены.
Специфический связывающий партнер намеченных нуклеиновых кислот подразумевает любой партнер, допускающий связывание с намеченной нуклеиновой кислотой, а в качестве примера можно привести нуклеиновые кислоты, олигонуклеотиды или полинуклеотиды и ферментные субстраты.
«Введение метки» подразумевает прикрепление маркера, допускающего генерирование, непосредственно или опосредованно, различимого сигнала. Неисчерпывающий список данных маркеров включает: энзимы, которые продуцируют сигнал, который может быть обнаружен, например, с помощью электрохимии, колориметрии, флуоресценции, люминесценции, энзимов, таких как пероксидаза хрена (HRP), щелочная фосфатаза (ALP), α-галактозидаза, глюкоза-6-фосфатдегидрогеназа; ингибиторов энзимов; кофакторов энзимов; частиц, таких как частицы золота, магнитные латексы, липосомы; хромофоров, таких как люминесцентные соединения, красителей, радиоактивных молекул, таких как 32P, 35S или 125I, флуоресцентных молекул, таких как флуоросцеин, родамин, Alexa®, умбеллиферон, люминол или фикоцианины. В случае флуоресценции, это может быть флуоресцентный продукт реакции энзим-субстрат, комбинация флуорофор-тушитель флуоресценции, затухание флуоресценции или любая другая система, основанная на свойствах флуоресценции.
Также могут быть использованы непрямые системы, например, посредством еще одной пары лиганд/антилиганд. Пары лиганд/антилиганд хорошо известны квалифицированным специалистам в данной области, и можно привести, например, следующие пары: биотин/стрептавидин, сахар/лектин, полинуклеотид/комплементарный полинуклеотид. В данном случае, это лиганд, который несет связывающий агент. Антилиганд может быть обнаружен непосредственно с помощью маркеров, описанных в предшествующем параграфе, или может сам быть различимым посредством лиганда/антилиганда.
Данные непрямые системы обнаружения в определенных условиях могут приводить к усилению сигнала. Данная методика усиления сигнала хорошо известна квалифицированным специалистам в данной области, и можно сослаться на предыдущую патентную заявку заявителей FR-A-2 781802 или WO-A-95/08000 или на статью J. Histochem. Cytochem. 45: 481-491,1997.
Намеченные нуклеиновые кислоты могут быть заблаговременно помечены посредством прямого или опосредованного включения маркера с помощью полимеразы, киназы, случайно или определенным образом, на концах или посредством включения «внутрь» молекул.
Введение метки специфичным связывающим партнерам намеченных веществ, определяемых при анализе, широко известно квалифицированным специалистам в данной области и описано, например, Greg T. Hermanson в Bioconjugate Techniques, 1996, Academic Press Inc, 525B Street, San Diego, CA92101 USA.
В зависимости от типа введения метки используемого конъюгата, например, с использованием энзима, квалифицированный специалист в данной области добавит реагенты, предоставляющие возможность визуализации введения метки. Данная стадия соответствует обнаружению. Она предшествует использованию промывающего буфера для извлечения фракций веществ, определяемых при анализе, или элементов, не вовлеченных в реакцию или присоединенных слабо и неспецифично, для того, чтобы ограничить фоновые помехи.
Цели и преимущества устройства согласно настоящему изобретению будут лучше понятны из примера, приведенного ниже, который никоим образом не является ограничением, со ссылкой на чертежи, на которых:
Фиг.1 показывает изображение в продольном сечении картриджа, используемого для отбора и лизиса микроорганизмов;
Фиг.2 показывает изображение в продольном сечении устройства для отбора содержащихся в воздухе микроорганизмов согласно отдельному варианту осуществления;
Фиг.3 показывает увеличенное частичное изображение в продольном сечении устройства для отбора микроорганизмов, которое показано на Фиг.1;
Фиг.4 показывает перспективное изображение внутренней части верхнего элемента устройства для отбора микроорганизмов;
Фиг.5 показывает частичное перспективное изображение внутренней части верхнего элемента устройства для отбора микроорганизмов, которое показано на Фиг.3;
Фиг.6 показывает изображение в продольном сечении устройства для лизиса микроорганизмов;
Фиг.7 показывает изображение в продольном сечении узла, состоящего из устройства для лизиса микроорганизмов и многоходового клапана;
Фиг.8А показывает частичное изображение в продольном сечении системы для лизиса микроорганизмов на уровне многоходового клапана, в первой конфигурации последнего;
Фиг.8B показывает частичное изображение в продольном сечении системы для лизиса микроорганизмов на уровне многоходового клапана, во второй конфигурации последнего.
Картридж 10, показанный в продольном сечении на Фиг.1, имеет общую форму цилиндра ориентировочно круглого поперечного сечения. Верхний конец цилиндра является свободным, тогда как нижний конец состоит из стенки с отверстием в ее центре, на протяжении которого имеется проход 12, тянущийся в картридж 10. Можно видеть, что внутреннее сечение прохода имеет тенденцию к уменьшению по мере приближения к его верхнему концу.
Как можно видеть на Фиг.1, внутренняя поверхность нижней стенки 14 картриджа 10 является наклонной, при этом самая нижняя точка наклона расположена там, где она входит в контакт с проходом 12, а самая верхняя точка находится в контакте с вертикальной стенкой 16 картриджа 10. Данная стенка 14 служит в качестве опоры для лизирующего средства 18 и составляет зону задерживания микроорганизмов. Данное лизирующее средство состоит в данном случае из шариков одинакового размера. Согласно предпочтительному варианту осуществления, данные шарики являются стеклянными. Однако они могут состоять из любого другого равноценного материала, такого как железо. Данные шарики преимущественно имеют диаметр между 200 и 800 микрометров (мкм).
Согласно предпочтительному варианту осуществления, шарики могут иметь различные размеры. Таким образом, может быть особенно уместно использовать, смесь шариков с диаметром между 200 и 300 мкм со слоями, чей диаметр находится между 400 и 600 мкм. Подобные шарики продаются, например, компанией SIGMA под названием кислотопромытые стеклянные шарики, 425-600 мкм, ссылка: G8772.
Шарики удерживаются на своем месте в виде одного или более наложенных слоев посредством слоя желированного материала 19, предпочтительно расположенного на шариках. Желированный материал должен соответствовать некоторым требованиям. Первое состоит в том, что он должен быть инертным, для того чтобы не оказывать влияние на процессы, которые происходят внутри картриджа. Второе состоит в том, что он должен обладать способностью растворения в жидкости для осуществления лизиса микроорганизмов. Указанным материалом, например, может быть агарозный гель (Sigma Aldrich, Agarose-Type I-B Low EEO, ссылка: A0576-25G). Желированный материал может также иметь в своем составе глицерол.
В качестве альтернативы, желированный материал может предпочтительно являться культуральной средой для микроорганизмов. Действительно, агаровая культуральная среда долго общепризнанно использовалась в области диагностики in vitro. Использование указанной культуральной среды предлагает несколько преимуществ. Основным преимуществом является то, что она предоставляет возможность фазы роста микроорганизмов перед проведением лизиса. Даже если устройство согласно изобретению ставит целью соответствие необходимости, связанной с быстрым обнаружением болезнетворных микроорганизмов, тем не менее, ростовая фаза от нескольких минут до нескольких часов должна предоставлять возможность размножения микроорганизмов, что имеет непосредственный эффект, состоящий в том, что в распоряжение пользователя попадает большее количество нуклеиновых кислот (это делает возможным использование с выгодой неизбежных перерывов в выделении и передаче воздушных проб, собираемых в помещениях, нуждающихся в контроле, до начала собственно анализа). Вторым преимуществом использования культуральной среды является то, что последняя может быть селективной для одного или более заданных видов. В результате, использование данных сред может предоставить возможность селективного роста и, вследствие этого, обнаружения определенных болезнетворных микроорганизмов за счет других микроорганизмов, которые не представляют интереса и которые, возможно, могут являться помехой для анализа. Таким образом, может быть предусмотрено предоставление нескольких различных картриджей, причем каждый выполнен с возможностью обнаружения специфичных видов микроорганизмов.
Размеры картриджа 10, например, могут составлять от 8 до 16 мм для внутреннего диаметра, предпочтительно 12 мм. Общая толщина слоев шариков, как правило, находится между 1 и 2 мм, что соответствует количеству стеклянных шариков между 0,1 и 1 г, предпочтительно 0,3 г.
Картридж 10 предпочтительно изготавливают посредством технологии инжекционного формования. Используемым материалом является, например, полипропилен, полистирол, поликарбонат, циклические циклоолефины (CCOs) или ПММА; причем предпочтительным является поликарбонат.
На Фиг.2 показано устройство 20 сбора микроорганизмов. Данное устройство состоит из модуля для отбора воздуха, в котором установлен картридж 10. Данный модуль для отбора воздуха состоит из верхнего элемента 22 и нижнего элемента 24.
Верхний элемент 22 в целом имеет цилиндрическую форму. Его перспективное изображение также показано на Фигурах 4 и 5. Нижний конец данного цилиндра является свободным, тогда как верхний конец частично плотно закрыт с помощью горизонтальной стенки 26. Данная стенка 26 имеет в своем центре высверленное отверстие, которое простирается в верхний элемент 22 за счет прохода 28. Данная часть в действительности составляет проход для введения воздуха в модуль 20 для отбора воздуха. Согласно отдельному варианту осуществления, данный проход для впуска воздуха может быть связан с каналом контура циркуляции воздуха с помощью любого подходящего средства. В центре основания данного прохода расположен стрелообразный конус 30. Данный конус 30 объединен со стенкой прохода 28 с помощью лопастей 32. Данные лопасти 32 можно ясно видеть на Фигурах 4 и 5. В варианте осуществления, который представлен на данных схематических изображениях, их количество составляет три. Однако их число может изменяться. Как показано на Фиг. 2, роль узла конус 30 - лопасти 32 состоит в создании в основании прохода 28, возмущения воздушной струи, входящей в устройство для отбора микроорганизмов таким образом, чтобы данная возмущенная струя входила в контакт с желированным материалом зоны задерживания микроорганизмов, приводя к углублению последнего. Данное выгибание значительно улучшает улавливание содержащихся в воздухе микроорганизмов.
Как показано на Фигурах 2 и 4, верхний элемент 22 также имеет три центрирующих штыря 34 и три стопорных фиксатора 38. Центрирующие штыри 34 предназначены для обеспечения правильного центрирования картриджа 10 относительно верхнего элемента 22. Стопорные фиксаторы 38 обеспечивают блокирование картриджа в центрированном положении, на верхнем элементе 22. Это четко показано на Фиг.2.
Верхний элемент 22 имеет в своей нижней части плечо и желобок, сделанные по всему периметру вертикальной стенки и предназначенные для облегчения соединения вместе верхнего элемента 22 и нижнего элемента 24.
Нижний элемент 24 также имеет в целом цилиндрическую форму. Верхний конец данного цилиндра является свободным, тогда как нижний конец частично плотно закрыт посредством горизонтальной стенки 40, имеющей в своей центральной части ориентировочно цилиндрические отверстия 42 для выпуска воздуха. Нижний элемент 24 дополнительно включает штырь для поддержки и позиционирования картриджа 10. Нижний элемент 24 затем будет помещен на верхний элемент 22. Картридж 10 также располагают с опорой на нижний элемент 24 посредством штыря 44. В действительности, когда картридж 10 устанавливают в нижнем элементе 24, элемент 44 входит в проход 12 картриджа, устанавливая и фиксируя, таким образом, последний в правильном положении.
Верхний конец вертикальной округлой стенки нижнего элемента 24 может иметь на своей внутренней поверхности выступ, сделанный по всему периметру данной стенки. Данный выступ предназначен для взаимодействия с плечом и желобком, представленными в верхнем элементе 22, для того чтобы обеспечить фиксацию между верхним элементом 22 и нижним элементом 24. Пригонка вместе верхнего 22 и нижнего 24 элементов становится возможной за счет комплементарной формы их нижнего и верхнего конца, соответственно. Необходимо, чтобы подобное соединение вместе было обратимым.
Альтернативным средством для соединения вместе элементов 22 и 24 может быть соединение вместе за счет навинчивания одного элемента на другой. С этой целью, конец стенки одного из элементов 22 или 24 может иметь внешнюю резьбу, а конец стенки второго элемента - соответствующую внутреннюю резьбу.
Важным является то, чтобы средство для отбора было герметично закрытым для того, чтобы избежать всякого паразитарного проникновения воздуха.
Согласно особому способу использования воздухозаборного средства, нижний конец прохода 22 для выпуска воздуха может быть соединен с насосом для аспирации воздуха (не показан) или любым равноценным насосным средством. Данный насос используют для аспирации окружающего воздуха в воздухозаборное средство, когда, например, необходимо выполнить анализ окружающего воздуха в отдельном окружающем пространстве, таком как больничное помещение или помещение для изготовления лекарственных средств или продуктов питания. С этой целью может быть предпочтительным иметь насосное средство, действующее автономно и непрерывно.
Модуль 22 и 24 для отбора воздуха может, например, иметь наружный диаметр между 10 и 40 мм, предпочтительно 20 мм. Внутренний диаметр прохода для впуска воздуха составляет, например, 6 мм.
Модуль 10 для отбора воздуха может предпочтительно быть изготовлен из материала, который может быть простерилизован, в частности, посредством автоклавирования. Таким образом, он может быть металлическим, например из алюминия или стали. Также он может быть из полимера, такого как поликарбонат, циклические циклоолефины (CCO) или ПММА.
На Фиг.2 стрелками показан путь, по которому следует воздух, при включении циркуляции воздуха в устройстве для отбора микроорганизмов. Таким образом, можно видеть, что воздух входит в устройство для отбора микроорганизмов по проходу 28 для впуска воздуха. Проход 12 картриджа 10 частично помещен в проход 28 для впуска воздуха, более конкретно в конус 30. Воздушная струя в основании прохода 28 трансформируется, на вершине конуса 30, в круговой поток. Более того, наличие конуса также предотвращает поступление воздуха в проход 12. Как описано выше, возмущенная воздушная струя достигает желированного материала 19 (шарики 18 не показаны), что приводит к задерживанию в данной точке за счет ударения микроорганизмов, переносимых в воздушной струе. Данный процесс, таким образом, относительно похож на то, что происходит в микробиологических пробоотборниках воздуха.
Что касается воздуха, он продолжает свое движение за счет аспирации насосным средством. Он поднимается вдоль внутренней поверхности вертикальной стенки 16 картриджа 10. Далее он снова идет вниз вдоль наружной поверхности той же самой стенки и покидает модуль 20 для забора воздуха через выпускные отверстия 42.
Воздушный поток, отбираемый в модуле 20 для забора воздуха, может составлять, например, между 20 и 100 литров/минуту (л/мин). Предпочтительно, он составляет 50 л/мин.
После завершения стадии задерживания/концентрации микроорганизмов в картридже, последний извлекают из модуля для забора воздуха, за счет отсоединения верхнего 22 и нижнего 24 элементов от указанного средства, либо разбирая на части, либо развинчивая.
На этой стадии имеется возможность инкубирования картриджа в термостате при 37°С, если есть необходимость вынесения культуры микроорганизмов, сконцентрированных в указанном картридже. Как уже объяснялось выше, указанное инкубирование продолжается, в общем, от нескольких десятков минут до нескольких часов с тем, чтобы чрезмерно не удлинять время анализа. Однако если нет срочности в получении результата анализа, может быть предусмотрено инкубирование картриджа на протяжении более долгого периода, более соответствующего требованиям размножения бактерий, т.е. приблизительно двадцать четыре часа.
Аналогичным образом, также может быть предусмотрено сохранение картриджа в окружающих условиях, которые подходят для указанного хранения, таких как холодное помещение, если есть необходимость отложить анализ.
Согласно одному варианту осуществления изобретения, картридж 10 может поставляться установленным непосредственно в модуле для забора воздуха. Данный тип предоставления имеет то преимущество, что пользователю не нужно устанавливать картридж в модуле для забора воздуха, уменьшая за счет этого риск заражения во время данной стадии. Это особенно предпочтительно в том случае, если модуль для забора воздуха изготовлен из такого же материала, что и картридж, а именно из полипропилена, поликарбоната или ПММА. Тогда изготовление посредством инжекционного формования является особенно подходящим.
Когда отбор микроорганизмов и, возможно, инкубирование завершено, картридж 10 соединяют с ротором 50 для того, чтобы составить устройство для лизиса микроорганизмов, которое показано на Фиг.6. С данной целью, ротор 50 вставляют в картридж 10 на свободном конце последнего через вертикальное поступательное движение.
Ротор 50, показанный на Фиг.6 в продольном сечении, имеет корпус в целом цилиндрической формы с круглым поперечным сечением. Корпус имеет на верхней части его наружной стенки фланец 52, функцией которого является обеспечение того, чтобы узел картридж 10 - ротор 50 был непроницаемым для жидкостей, когда ротор полностью вставляют в картридж 10, с прекращением движения на верхнем конце вертикальной стенки картриджа 10.
Для усиления герметичности на картридже 10 может быть прикреплена крышка 54 с помощью любого подходящего средства для того, чтобы удерживать ротор 50 в виде единого целого с картриджем. Например, крышка 54 может быть прикреплена за счет взаимной подгонки или за счет прикручивания. Крышка имеет ориентировочно круглую форму и будет накручиваться сверху на ротор, образуя глухой проход 56, предоставленный в роторе. На верхнем конце данного глухого прохода, в стенке сделаны два диаметрально противоположных желобка 57. Данные желобки выполняют функцию приема конца трансмиссионного вала 90 средства 92 вращения указанного ротора, как показано на Фигурах 8А и 8В. Таким образом, конец данного вала имеет форму, комплементарную с данными желобками, в виде ребра, которое будет вставляться в данные желобки. Приводным валом может быть вал электрического двигателя. В качестве альтернативы, он может являться частью устройства для вращения вручную.
Как показано на Фиг.6, ротор 50 обладает в своей нижней части внешними формами, которые полностью комплементарны с внутренними формами картриджа 10. В результате, ротор 50 будет полностью помещаться внутри картриджа 10, при этом проход 12 выполняет роль направляющей за счет введения в полость 58, предусмотренную в основании ротора 50. Данная полость 58 имеет ориентировочно цилиндрическую форму с круглым поперечным сечением, а ее верхний конец имеет приблизительно коническую форму. Ротор 50 устанавливают до тех пор, пока его нижняя стенка 59 не будет опираться на узел, состоящий из шариков 18 и желированного материала 19.
Ротор 50 и крышка 54 преимущественно изготовлены из того же самого полимерного материала, что и картридж, а именно из полипропилена, поликарбоната или ПММА. Предпочтительно, данные детали изготавливают посредством инжекционного формования прозрачного поликарбоната (Makrolon®2858, Bayer).
Узел картридж 10 - ротор 50 - крышка 54, вследствие этого, составляет устройство для лизиса микроорганизмов 60 согласно изобретению и будет далее в данной работе называться «устройство для лизиса».
После того как устройство для лизиса выполнено, его помещают на 4-ходовой клапан, который показан на Фиг.7. Данный клапан 70 имеет первый ход 701, предназначенный для приема устройства 60 для лизиса. Указанное устройство соединено с клапаном с помощью основания прохода 12 картриджа 10. Второй ход имеет соединительное отверстие 702, предназначенное для соединения с первым средством аспирации-выталкивания, частью системы для лизиса микроорганизмов и очистки нуклеиновых кислот, согласно изобретению. Преимущественно, данное средство аспирации-выталкивания представляет собой насос, также соединенный с контейнером, заключающим в себе раствор элюирующего буфера. Указанный насос схематично показан на Фигурах 8А и 8В. Его действие будет объяснено ниже. Третий ход имеет соединительное отверстие 703, на котором закреплен съемный конус 72. В заключение, четвертый ход состоит из второго средства аспирации-выталкивания 704. Данное второе средство представляет собой шприц, который является единым целым с клапаном. Данный шприц 704 предназначен для взаимодействия со средством поступательного приведения в движение, образующего часть системы для лизиса микроорганизмов и очистки нуклеиновых кислот согласно изобретению и предназначенного для перемещения поршня указанного шприца. В итоге, клапан 70 имеет центральный вал 74, обладающий двумя жидкостными каналами. Как показано на Фиг.7, данные два канала обеспечивают соединение соответственно, с одной стороны, между устройством 60 для лизиса и соединительным отверстием 702, а с другой стороны, между шприцом 704 и соединительным отверстием 703, на котором закреплен съемный конус 72. Вал 74 можно поворачивать в четверть оборота, так чтобы изменять жидкостные соединения. Затем соединительное отверстие 702 соединяют с соединительным отверстием 703, а устройство 60 для лизиса затем соединяют со шприцом 704.
Узел, состоящий из устройства 60 для лизиса и клапана 70, составляет расходную часть. Затем его помещают на систему для лизиса микроорганизмов и очистки нуклеиновых кислот. Он представляет собой автоматическую систему, имеющую три отдельные основные функции: функцию лизиса, функцию переноса жидкости и функцию очистки. Данные функции описаны ниже.
Узел устройство 60 для лизиса - клапан 70 устанавливают в системе для лизиса микроорганизмов и очистки нуклеиновых кислот следующим образом. Во-первых, имеется специализированное местоположение для подгонки данного узла. Данное местоположение характеризуется тем, что оно имеет средство крепления клапана 70. Данное средство может, например, состоять из рычагов или кулачков, между которыми с усилием вставляют клапан.
После того как узел устройство 60 для лизиса - клапан 70 находится в своем положении, для клапана создают различные соединения. Это схематично показано на фигурах 8А и 8В. Таким образом, первое соединение создают посредством соединительного отверстия 702 клапана 70. Оно представляет собой заключительное соединение для средства аспирации-выталкивания 80, которое постоянно находится на автоматической системе, соединенной с соединительным отверстием 702. Как объяснялось выше, данное средство аспирации-выталкивания 80 предпочтительно находится в виде неподвижного насоса, встроенной части автоматической системы, не показанной полностью на фигурах 8А и 8В. Более точно, насос 80 в действительности соединен с клапаном 82, также установленным постоянно на автоматической системе. Более того, данный неподвижный клапан 82 находится в жидкостном соединении, с одной стороны, с клапаном 70 через соединительное отверстие 702, а с другой стороны, с резервуаром 84, заключающим в себе так называемый элюирующий буфер. Таким образом, неподвижный клапан 82 предоставляет возможность соединения неподвижного насоса 80 либо с клапаном 70, либо с резервуаром 84, в зависимости от его положения.
Узел устройство для лизиса - клапан также соединен с трансмиссионным валом 90 средства 92 вращения ротора устройства для лизиса. Необходимо заметить, что после того как данное соединение создано, трансмиссионный вал 90 прикладывает давление на ротор вдоль вертикальной составляющей согласно стрелке А на Фиг.8А, так чтобы данное давление передавалось от ротора на узел, состоящий из шариков 18 и желированного материала 19.
Третье соединение между узлом устройство для лизиса - клапан и автоматической системой состоит из соединения между шприцом 704 клапана 70 и средством 94 приведения в действие указанного шприца. Данное средство приведения в действие представляет собой средство приведения в поступательное движение, как, например, узел, состоящий из шагового двигателя и бесконечного винта, и предоставляет возможность либо тянуть, либо толкать поршень шприца 704 и, таким образом, либо аспирировать жидкость в шприц, либо выталкивать жидкость, заключенную в шприце.
В заключение, четвертое соединение между узлом устройство для лизиса - клапан и автоматической системой относится к средству вращательного приведения в действие вала 74 клапана 70. Данное средство не показано на Фигурах 8А и 8В. Оно представляет собой двигатель, который способен вызывать вращение трансмиссионного вала, при этом указанный трансмиссионный вал соединен с валом 74 клапана 70.
В процессе осуществления протокола лизиса микроорганизмов, отобранных в картридже 10, клапан 70 конфигурируют таким образом, чтобы устройство 60 для лизиса находилось в жидкостном соединении с узлом, состоящим из насоса 80 и неподвижного клапана 82. Тогда шприц 704 находится в жидкостном соединении с соединительным отверстием 703, на котором закреплен съемный конус. Неподвижный клапан 82 изначально конфигурируют таким образом, чтобы насос 80 находился в жидкостном соединении с резервуаром 84 для элюирующего буфера. Затем насос 80 аспирирует предварительно заданное количество элюирующего буфера. Затем конфигурацию неподвижного клапана 82 изменяют таким образом, чтобы насос 80 вошел в жидкостное соединение с устройством 60 для лизиса через клапан 70. Затем насос 80 выталкивает принятый объем элюирующего буфера, который поступает в устройство 60 для лизиса, а более конкретно в промежуточное пространство между внутренней стенкой картриджа 10 и наружной стенкой ротора 50 (см. Фиг.6). Затем элюирующий буфер увлажняет желированный материал 19 и шарики 18. Затем желированный материал 19 растворяется за счет объединенного действия элюирующего буфера и медленного вращения ротора 50. Затем шарики находятся в суспензии в последнем. Данное действие суспензии в соединении с действием давления, прикладываемого на ротор, и вращением последнего приводит к перемещению части шариков 18 в промежуточное пространство между внутренней стенкой картриджа 10 и наружной стенкой ротора 50. Необходимо заметить, что данное промежуточное пространство предпочтительно имеет ширину между 600 и 800 мкм. Данная ширина непосредственно связана с диаметром используемых шариков 18. В действительности, шарики должны быть способны одновременно легко циркулировать в данном пространстве и быть в состоянии вращаться посредством вращения ротора 50. С этой целью вертикальная наружная стенка ротора может иметь грубую поверхность, которая облегчает вращение шариков.
После того как шарики распределились в зоне задерживания картриджа и вдоль вертикальной стенки ротора, последний может быть полностью введен в картридж.
Конечно, микроорганизмы, задержавшиеся как на желированном материале, так и на шариках, переносятся в промежуточное пространство таким же образом, как и шарики 18, за счет струи элюирующего буфера.
После того как шарики 18 распределились вдоль вертикальной стенки ротора 50, начинается собственно стадия лизиса. Тогда за счет вращения средства вращения/двигателя 92 и посредством трансмиссионного вала 90 вызывается вращение ротора 50. Тем не менее, можно предусмотреть вращение ротора вручную, в упрощенном протоколе без использования системы для лизиса микроорганизмов и очистки нуклеиновых кислот.
В качестве примера, значения скорости вращения могут находиться между 200 и 3000 об/мин. Предпочтительно, изначально ротор вращается с низкой скоростью, составляющей 200 об/мин с целью распределения и обеспечения однородности шариков и элюирующего буфера в промежуточном пространстве. Данное медленное вращение продолжается приблизительно 15 секунд.
Затем скорость вращения увеличивается, достигая значения между 1000 и 3000 об/мин на протяжении периода времени между 1 и 5 минутами. Именно в течение данного периода происходит лизис микроорганизмов, отобранных из воздуха.
Вполне понятно, что выбор скорости и времени вращения ротора зависит от типа микроорганизмов, которые подлежат лизированию.
В процессе данной стадии, шарики 18 вращаются вокруг своей оси симметрии за счет трения о вертикальную внешнюю поверхность ротора и вертикальную внутреннюю поверхность картриджа. Такое двойное вращение приводит к механическому лизису микроорганизмов, захваченных между шариками 18 и соответствующими поверхностями ротора или картриджа. Результатом этого является высвобождение нуклеиновых кислот в элюирующий буфер.
После того как стадия лизиса завершена и были высвобождены нуклеиновые кислоты, необходимо всосать элюирующий буфер, заключающий в себе нуклеиновые кислоты. Затем за счет вращения его вала 74 изменяется конфигурация клапана 70, так чтобы устройство 60 для лизиса и шприц 704 снова находились в жидкостном сообщении, как показано на Фиг.8В. Затем поршень шприца 704 поступательно перемещается средством 94 приведения в действие, для того чтобы всосать элюирующий буфер, заключающий в себе нуклеиновые кислоты, в указанный шприц 704. Данная стадия аспирации происходит в то время, как ротор 50 все еще вращается, но с низкой скоростью (приблизительно 200 об/мин).
Затем клапан 70 возвращается назад к своей исходной конфигурации, которая показана на Фиг.8А, таким образом, чтобы шприц 704 находился в жидкостном сообщении с соединительным отверстием 703. Затем элюирующий буфер, заключающий в себе нуклеиновые кислоты, готов к перенесению в пробирку через конус 72 с целью очистки указанных нуклеиновых кислот. В действительности, лизат, заключенный в элюирующем буфере, заключает в себе нуклеиновые кислоты, а также все продукты распада клеток.
Чтобы это осуществить, пробирку 96 для анализа переносят вплотную к конусу 72. Предпочтительно, автоматическая система имеет держатель для приема указанной пробирки. В данном случае, указанный держатель может быть соединен с рычагом, который можно перемещать между нижним положением или положением покоя, в котором пробирку можно вставлять в держатель, и верхним положением или рабочим положением, в котором пробирка находится около конуса 72 (как показано на Фигурах 8А и 8В). Конечно, предпочтительно, чтобы конус 72 входил в пробирку 96. Пробирка 96 имеет так называемый лизирующий буфер и магнитные частицы диоксида кремния, требующиеся для очистки нуклеиновых кислот. Данные частицы имеют диаметр между 1 и 3 мкм. Более того, на отверстие пробирки 96 помещена предварительно проколотая диафрагма для того, чтобы избежать заражения пробирки. По мере поднятия пробирки 96, конус 72 проходит через диафрагму через предварительно проколотое отверстие. Затем элюирующий буфер с лизатом переносят в пробирку для анализа. На этой стадии предпочтительно использовать шприц 704 для выполнения нескольких аспираций/выталкиваний, для того чтобы гомогенизировать лизат с лизирующим буфером и магнитными частицами. Функция лизирующего буфера заключается в стабилизации нуклеиновых кислот (защите от нуклеазы) и в регулировании рН до оптимального значения для фазы улавливания.
Если смесь гомогенизирована правильно, то пробирку можно оставить в покое с целью предоставить возможность пассивного улавливания нуклеиновых кислот магнитными частицами. Время покоя может составлять, например, 2 минуты. В случае когда гомогенизация проведена неправильно, или в отсутствие гомогенизации, улавливание нуклеиновых кислот будет осуществляться активно. В действительности, пробирка и магнитные частицы, которые она заключает в себе, будут подвергаться действию магнитных полей различных ориентаций. Для этого пробирку помещают в нижнее положение, а затем вводят в контакт с магнитами через несущий ее рычаг. Данные магниты могут быть расположены на двух параллельных пластинах, представляющих единое целое с рычагом, несущим пробирку. Данные две пластины являются подвижными за счет горизонтального поступательного движения посредством специализированного средства перемещения и, в связи с этим, смещаются таким образом, чтобы пробирка в результате находилась между указанными пластинами. Количество магнитов на каждой пластине может колебаться. Предпочтительно, чтобы магниты находились на пластинах на различных высотах. Более того, важно, чтобы магниты на одной пластине не были расположены напротив магнитов на другой пластине, но были смещены относительно направления смещения пробирки в соответствии с определенной последовательностью. Таким образом, в процессе смещения пластин пробирка постепенно подвергается действию либо магнитного поля магнита на первой пластине, либо магнитному полю магнита на второй пластине. Данные поля могут быть расположены на другой высоте по отношению к траектории пластин. В результате, магнитные частицы, притягиваемые данными магнитами, образуют кластер, причем данный кластер вынужден перемещаться в пробирке, в виде функции притягивания, вызываемой магнитами и, главным образом, их положением по отношению к пробирке. Необходимо заметить, что данное относительное расположение магнитов относительно пробирки для анализа также может быть достигнуто за счет смещения пробирки вдоль вертикальной оси; причем в этом случае все магниты устанавливают на одной и той же высоте и согласно определенной последовательности. В случае активного улавливания нуклеиновых кислот, время, предназначенное для указанного улавливания, будет более продолжительным (между 4 и 6 минутами).
После того как было произведено улавливание нуклеиновых кислот, осуществляют одну или более последовательных стадий промывания. С этой целью пробирку помещают напротив магнита в верхнем положении для того, чтобы аккумулировать магнитные частицы, несущие нуклеиновые кислоты, в верхней части пробирки напротив вертикальной стенки. Затем пробирку передвигают в верхнее положение таким образом, чтобы конус 72 вошел в контакт с жидкостью, заключенной внутри пробирки. Затем жидкость, заключенная в пробирке, аспирируется в шприц 704 посредством приведения в действие поршня. Тогда шприц 704 служит в качестве контейнера для хранения жидких отходов, закачанных в пробирку. Для того чтобы начать промывку нуклеиновых кислот, клапан 74 помещают в конфигурацию, в которой соединительное отверстие 702 и, вследствие этого, насос 80 находятся в жидкостном сообщении с соединительным отверстием 703. Клапан 82 помещают в положение, позволяющее аспирацию элюирующего буфера насосом 80. Объем всасываемого элюирующего буфера составляет, например, 300 мкл. Затем положение клапана 82 изменяется, чтобы обеспечить перенос элюирующего буфера насосом 80 в пробирку 96. С целью обеспечения оптимального промывания пробирку возвращают в нижнее положение, а пластины, несущие магниты, снова перемещают для того, чтобы оптимизировать обмен между частицами и элюирующим буфером. Пластины способны совершать несколько возвратно-поступательных движений с различной скоростью в зависимости от требований. Затем элюирующий буфер, заключенный в пробирке, аспирируется посредством шприца 704, как описано выше. Необязательно, идентичным образом можно осуществить новые стадии промывания. Необходимо заметить, что на стадиях поршень шприца 704 приводится в действие таким образом, чтобы шприц 704 постепенно наполнялся жидкостью, всасываемой в пробирку для анализа, будь то это лизирующий буфер или элюирующий буфер, используемый для промываний. После того как нуклеиновые кислоты были перемещены в пробирку для анализа, шприц 704 предназначается только для роли хранилища жидких отходов, что представляет значительное преимущество. Более того, необходимо заметить, что насос 80 служит только для переноса элюирующего буфера и никогда не находится в контакте с «зараженным» веществом. Данный аспект также является особенно важным, поскольку насос 80 и клапан 82 постоянно остаются на автоматической системе в отличие от шприца 704, который представляет собой составную часть клапана 74, предназначенного для однократного использования.
После того как были произведены промывания нуклеиновых кислот, последняя аспирация элюирующего буфера в пробирке 72 является только частичной. В действительности, определенный объем элюирующего буфера остается в пробирке и составляет элюирующий объем, в котором нуклеиновые кислоты будут элюированы, т.е. диссоциированы от магнитных частиц. Элюирующий объем может колебаться между 5 и 150 мкл и предпочтительно составляет 25 или 40 мкл. Для данной заключительной аспирации, на дне пробирки образуется кластер магнитных частиц за счет расположения пробирки напротив магнита в нижнем положении. В виде отличия, аспирация производится с поверхности жидкости с целью избежания какой-либо аспирации частиц.
Затем в остающемся объеме производится элюирование нуклеиновых кислот. Для этого пробирку нагревают до 75°С посредством модуля нагревания, представляющего собой единое целое с держателем пробирки, до тех пор, пока температура жидкости, равная 65°С, не будет достигнута на протяжении приблизительно 5 мин. Одновременно со стадией нагревания пробирку подвергают действию магнитов, расположенных в нижнем положении, с целью содействовать элюированию.
После того как нуклеиновые кислоты были очищены и элюированы в элюирующем объеме, их можно амплифицировать с целью анализа. Для этого некоторую часть или весь элюирующий объем необходимо ввести в контакт с так называемым кондиционирующим буфером для амплификации (40 мМ Трис HCl, pH 8,5, 12 мМ MgCl2, 70 мМ KCl2, 5 мМ дитиотреитол, 15% о/о диметилсульфоксид, 1 мМ dNTP, 2 мМ каждого NTP, 0,2 мкМ праймеров, 0,1 мкМ молекулярных маяков). Такое введение в контакт может быть осуществлено в соответствии с двумя различными протоколами в зависимости от функциональных возможностей, доступных на автоматической системе.
Согласно первому протоколу, элюирование и кондиционирование для амплификации проводится в двух различных пробирках. В этом случае из пробирки для анализа необходимо взять предварительно заданную часть элюирующего объема, заключающего в себе очищенные нуклеиновые кислоты. Затем данную часть переносят во вторую пробирку, в которой будет проводиться кондиционирование для амплификации и которая уже содержит в себе требуемое количество буфера для кондиционирования с целью амплификации. Затем данную пробирку перемещают в приспособление, в котором будет проходить амплификация нуклеиновых кислот. Часть реакционного объема затем забирают посредством неподвижного насоса 80. В этом случае, клапаны 70 и 82 будут сконфигурированы для того, чтобы обеспечить жидкостное сообщение между насосом 80 соединительным отверстием 703. Пробирку для анализа помещают в верхнее положение таким образом, чтобы конус был погружен в элюирующий объем. Затем часть всасывают насосом 80. Необходимо напомнить, что данный насос 80, а в более общем смысле, жидкостной контур, заимствованный частью взятого элюирующего объема, находится в контакте только с элюирующим буфером в течение всего времени протокола для лизиса и очистки. Вследствие этого отсутствует возможность заражения фракции, которая будет использована для амплификации нуклеиновых кислот. После того как данная фракция была взята, пробирку для анализа можно заменить пробиркой для кондиционирования с целью амплификации. С этой целью пробирку для анализа опускают в нижнее положение таким образом, чтобы ее можно было вытащить из держателя, а пробирку для кондиционирования с целью амплификации можно было установить на свое место. Затем данную пробирку поднимают в верхнее положение так, чтобы конус вошел в пробирку, а часть элюирующего объема затем была перенесена с помощью насоса 80.
В качестве альтернативы, автоматическая система может быть снабжена специфичным модулем для управления и перемещения пробирки для кондиционирования с целью амплификации.
Данный первый протокол предлагает то преимущество, что предотвращается контакт между частицами диоксида кремния и буфером для кондиционирования с целью амплификации. В действительности известно, что подобные частицы могут ингибировать реакции амплификации нуклеиновых кислот.
Согласно второму протоколу, буфер для кондиционирования с целью амплификации и элюирующий объем вводят в контакт непосредственно в пробирке для анализа и в данном случае буфер для кондиционирования с целью амплификации добавляют в пробирку для анализа. Указанное добавление можно выполнять вручную или автоматически. В данном случае автоматическая система должна быть постоянно оборудована второй дозирующей системой, а именно контейнером, заключающим в себе буфер для кондиционирования с целью амплификации, шприцом для аспирации и выталкивания указанного буфера, клапаном, эквивалентным клапану 82, и иглой или конусом, который может проходить сквозь диафрагму, установленную на пробирке для анализа.
Независимо от использованного протокола, может являться предпочтительным выведение кластера частиц диоксида кремния за пределы либо только элюирующего объема, либо смеси элюирующего объема и буфера для кондиционирования с целью амплификации, заключенного в пробирке для анализа, перед взятием фракции, которая в итоге будет служить для амплификации. Это может быть сделано посредством подвергания пробирки намагничиванию магнитом, расположенным в верхнем положении.
Кроме того, все системы и устройства согласно изобретению, описанные выше, подходят для обеспечения возможности полного отслеживания на протяжении протоколов для лизиса микроорганизмов и очистки нуклеиновых кислот. В действительности, во-первых, все расходные материалы (картридж, ротор, многоходовый клапан, пробирки) идентифицируются специализированным средством идентификации (1D или 2D штрихкодами, радиометками и т.д.). Более того, в случае когда микроорганизмы отобраны с помощью средства для аспирации воздуха, последнее должно быть способно иметь средство беспроводного сообщения, обеспечивающее его сообщение с системой для лизиса микроорганизмов и очистки нуклеиновых кислот. Указанное средство беспроводного сообщения представляет собой, например, системы WiFi (стандарт 802.11b), Bluetooth (стандарт 802.15) или ZigBee (стандарт 802.15.4). Данные, которые можно передавать через эти системы беспроводной связи, могут относиться, например, к местам (помещение/точка отбора), условиям отбора образцов (время, скорость потока, гигрометрия, температура, атмосферное давление), идентификации оператора и, конечно, к элементам, идентифицирующим расходные материалы.
Устройство и системы согласно изобретению также целиком подходят для анализа клинических проб, таких как пробы цельной крови или биопсии тканей. В данном случае, картридж используют без модуля отбора воздуха. В случае пробы жидкости, такой как цельная кровь, последнюю помещают в картридж, а затем картридж соединяют с ротором в крышке для составления устройства для лизиса микроорганизмов. Затем последнее помещают в автоматическую систему для лизиса микроорганизмов и выделения нуклеиновых кислот. В случае биопсии тканей, последнюю, во-первых, нарезают тонкими слоями по несколько миллиметров, а затем помещают в картридж, который после этого объединяют с ротором в крышке для составления устройства для лизиса микроорганизмов. Последнее затем помещают в автоматическую систему для лизиса клеток и выделения нуклеиновых кислот.
ПРИМЕРЫ
Пример 1: Исходный протокол:
- Подготовка расходных материалов:
Подготовка картриджа:
Картридж наполняют предварительно заданным количеством стеклянных шариков и агарозного геля:
- 0,3-0,45 г стеклянных шариков (диаметр: 420-600 мкм)
- Состав геля: 1% агарозы - 1% глицерола
Объем элюирующего буфера, используемого для осуществления лизиса микроорганизмов составляет 300 мкл.
Подготовка пробирки для анализа:
Пробирку для анализа, помещенную в автоматическую систему и предназначенную для выделения лизата, наполняют 30 мкл магнитных частиц диоксида кремния и 200 мкл лизирующего буфера (гуанидин тиоцианат).
- Параметры лизиса:
Время лизиса: 4 минуты
Скорость вращения ротора: 200 об/мин (нижняя скорость); 2000 об/мин (верхняя скорость)
- Параметры лизиса:
Аспирация лизата из картриджа в шприц многоходового клапана:
Объем аспирации шприца = 1000 мкл
Скорость аспирации шприца = 70 ммс-1
Время вращения ротора в процессе аспирации = 9 с
Скорость вращения ротора в процессе аспирации = 200 об/мин
Перенос лизата из шприца многоходового клапана в пробирку для анализа:
Объем аспирации из шприца многоходового клапана = 1000 мкл
Скорость аспирации шприца = 70 ммс-1
- Параметры очистки нуклеиновых кислот:
Очистка включает 3 стадии:
- изоляции нуклеиновых кислот
- промывки элюирующим буфером (3 раза)
- элюирования в элюирующем буфере (рН 8,5)
После перемещения лизата в пробирку для анализа (0,5 мл), последняя заключает в себе 30 мкл кремниевых шариков, 200 мкл лизирующего буфера и 120-150 мкл лизата.
С помощью магнитов осуществляют два типа колебаний кремниевых частиц:
• Высокие колебания, которые возникают между магнитами в верхнем положении
• Низкие колебания, которые возникают между магнитами в нижнем положении
Высокие колебания используют для осуществления улавливания нуклеиновых кислот магнитными частицами, но также для стадий промывания (удаления супернатанта). Низкие колебания используют для стадии элюирования и объединяют с нагреванием пробирки.
Параметры улавливания нуклеиновых кислот:
Скорость колебания = 5 ммс-1
Количество колебаний = 112
Амплитуда колебаний = 27 ммс-1
Параметры промывания
Скорость колебания = 5 ммс-1
Количество колебаний = 10
Амплитуда колебаний = 27 ммс-1
Параметры удаления супернатанта:
Аспирация шприцом многоходового клапана = 600 мкл
Скорость насоса = 100 ммс-1
Параметры распределения элюирующего буфера насосом, закрепленным в пробирке для анализа:
Объем распределения = 400 мкл
Скорость насоса = 100 ммс-1
Параметры для элюирования:
Скорость колебания = 5 ммс-1
Амплитуда колебаний = 9 ммс-1
Намеченная температура = 75°С
Время нагрева = 300 с
Объем элюирующего буфера = 45 мкл
Пример 2: Механический лизис тканей
Стадию осуществляли для оценки эффективности механического лизиса в устройстве для лизиса согласно изобретению с целью разрушения стенок живых клеток микроорганизмов для высвобождения тРНК. Данные испытания проводили на пробах солидных опухолей.
Детально разработанный и прошедший испытания протокол:
• Реактивы и оборудование:
- Опухоли рака молочной железы, предварительно обезжиренные и стабилизированные с помощью оборудования RNAlater®, продаваемого Qiagen,
- Чашки Петри,
- Стерильные пробирки 2мл,
- Пластмассовые пинцеты и скальпели одноразового применения,
- Устройства для лизиса согласно изобретению (картридж и ротор), обеззараженные Актрилом,
- Стеклянные шарики 400-600 мкм,
- Набор RNeasy Plus, продаваемый Qiagen + автоматическая система выделения Qiacube
• Подготовка:
- Очистка лабораторного стола и пипеток RNaze Zap перед началом выделения,
- Выдержка опухолей, замороженных при -80°C для оттаивания,
- Помещение опухоли в чашку Петри, избегая взятия RNAlater®,
- Промывание дважды 300 мкл буфера RTL (Qiagen) для удаления остатка RNAlater.
• Измельчение опухолей:
- Тонкая нарезка опухоли (диаметр приблизительно 4 мм) скальпелем,
- Выделение частей опухоли, используя пластмассовые пинцеты, и перемещение в 2 мл пробирку, содержащую в себе 300 мкл RLT (+3 мкЛ β-меркаптоэтанол),
- Измельчение частей опухоли с помощью:
• Qiagen Tissue Ruptor: 2 скорость в течение 2 минут или
• устройства для лизиса микроорганизмов согласно изобретению: 0,4-0,5 г стеклянных шариков (400-600 мкм), 2000 об/мин, 2×20 секунд.
- Выделение пробы и регулирование объема буфером RTL для получения объема, равного 300 мкл перед очисткой.
• Очистка тРНК с помощью набора Qiagen RNeasy Plus:
1. Помещение 300 мкл буфера RTL, выделенного после измельчения без оставления остатка опухоли в 2 мл пробирку,
2. Подготовка 2 типов колонн для очистки и фиксации РНК: колонна Элиминатора гДНК и быстрого вращения РНК,
3. Подготовка буферов, шаттлов выделения Qiagen и пробирок для элюирования,
4. Подготовка тестера Quicube после команд для автоматического устройства и запуск работы,
5. Выделение 80 мкл элюата и замораживание очищенной тРНК при -80°С,
6. Дозировка: 1 мкл неразведенного элюата на Nanodrop,
7. Измерение качества выделенной тРНК: анализ качества выполняют согласно протоколу RNA 6000 Nano на биоанализаторе Agilent.
Как и в общепризнанном электрофорезе, распределение транскриптов рРНК наблюдалось с двумя основными пиками на 18 с и 28 с.
Результаты:
Для данного исследования использовали две биопсии, полученные и хранившиеся идентичным образом. Данные биопсии являются круглыми с диаметром, составляющим приблизительно 4 мм, и толщиной, составляющей 1,5 мм. Их массу оценили приблизительно как 10 мг. Данные биопсии просто разделили на две для того, чтобы параллельно провести два типа механического лизиса (стандартный лизис Tissue Ruptor и PPM). Однако необходимо заметить, что количество использованной ткани не является идентичным от одного теста к другому, так как цель состоит в том, чтобы обеспечить правильное проведение теста, а не сравнение эффективности между стандартной методикой и протоколом согласно изобретению.
Анализ чистоты основан на соотношении между значениями поглощения с различными длинами волн: 260 нм для нуклеиновых кислот, 230 нм для солей и 280 нм для белков. Значение соотношения, близкое к 2, отражает хорошую чистоту нуклеиновых кислот.
В случае биопсии 1 можно видеть, что количество выделенной тРНК является очень небольшим. Это можно объяснить тем фактом, что биопсия подверглась разрушению, ведущему к потере материала.
В случае биопсии 2 можно видеть, что значительное количество тРНК было выделено с помощью обеих методик. Более того, можно видеть, что чистота хорошая.
Таким образом, из данных экспериментов понятно, что устройство согласно изобретению предлагает хорошую эффективность для отбора бактерий, содержащихся в пробе воздуха, лизирования их и обеспечения выделения нуклеиновых кислот из указанных бактерий с целью анализа. Для этого использованное устройство будет состоять, во-первых, из картриджа, вставленного в модуль для отбора воздуха, а во-вторых, из картриджа, заключающего в себе отобранные бактерии, в соединении со средством для выделения нуклеиновых кислот.
| название | год | авторы | номер документа |
|---|---|---|---|
| СМЕННЫЙ МИКРОФЛЮИДНЫЙ МОДУЛЬ ДЛЯ АВТОМАТИЗИРОВАННОГО ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ ИЗ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ И СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ С ЕГО ИСПОЛЬЗОВАНИЕМ | 2008 |
|
RU2380418C1 |
| АВТОМАТИЗИРОВАННЫЙ ПРИБОР ДЛЯ ВЫДЕЛЕНИЯ, ОЧИСТКИ И АНАЛИЗА НУКЛЕИНОВЫХ КИСЛОТ МЕТОДОМ ПЦР-РВ | 2020 |
|
RU2784821C2 |
| СПОСОБ АВТОМАТИЗИРОВАННОГО ВЫДЕЛЕНИЯ С ОДНОВРЕМЕННОЙ ОЧИСТКОЙ НУКЛЕИНОВЫХ КИСЛОТ ИЗ НЕСКОЛЬКИХ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ | 2014 |
|
RU2595374C2 |
| Универсальный способ выделения ДНК и лизирующая смесь для его осуществления | 2022 |
|
RU2807254C1 |
| СИСТЕМА И СПОСОБ СБОРА ОБРАЗЦА НУКЛЕИНОВОЙ КИСЛОТЫ | 2015 |
|
RU2729113C2 |
| СИСТЕМА ОЧИСТКИ НУКЛЕИНОВОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ ОДНОГО БУФЕРНОГО РАСТВОРА ДЛЯ ПРОМЫВАНИЯ И ЭЛЮИРОВАНИЯ | 2016 |
|
RU2766005C2 |
| УСТРОЙСТВО ДЛЯ АВТОМАТИЧЕСКОГО ВЫДЕЛЕНИЯ, ОЧИСТКИ И АМПЛИФИКАЦИИ УЧАСТКОВ ДНК Mycobacterium tuberculosis С РЕГИСТРАЦИЕЙ РЕЗУЛЬТАТОВ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2024 |
|
RU2837310C1 |
| УСТРОЙСТВО И СПОСОБ ЭКСТРАКЦИИ НУКЛЕИНОВЫХ КИСЛОТ | 2000 |
|
RU2244559C2 |
| Способ выделения РНК и ДНК из сухих биологических образцов, хранившихся на бумажном носителе, и набор для его осуществления | 2016 |
|
RU2628695C1 |
| СПОСОБЫ РАЗДЕЛЕНИЯ, ХАРАКТЕРИСТИКИ И(ИЛИ) ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ С ПОМОЩЬЮ МАСС-СПЕКТРОМЕТРИИ | 2009 |
|
RU2519650C2 |
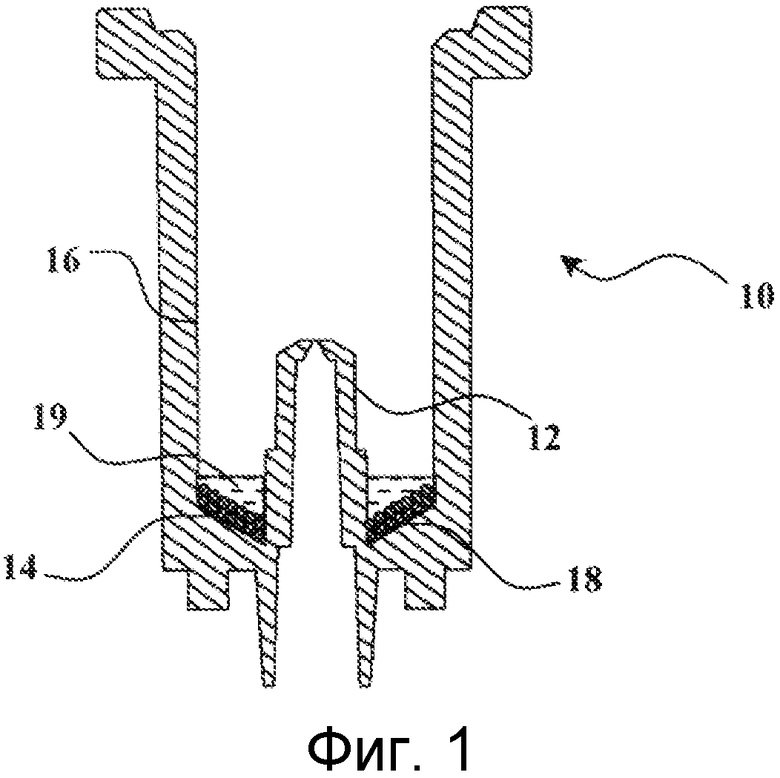
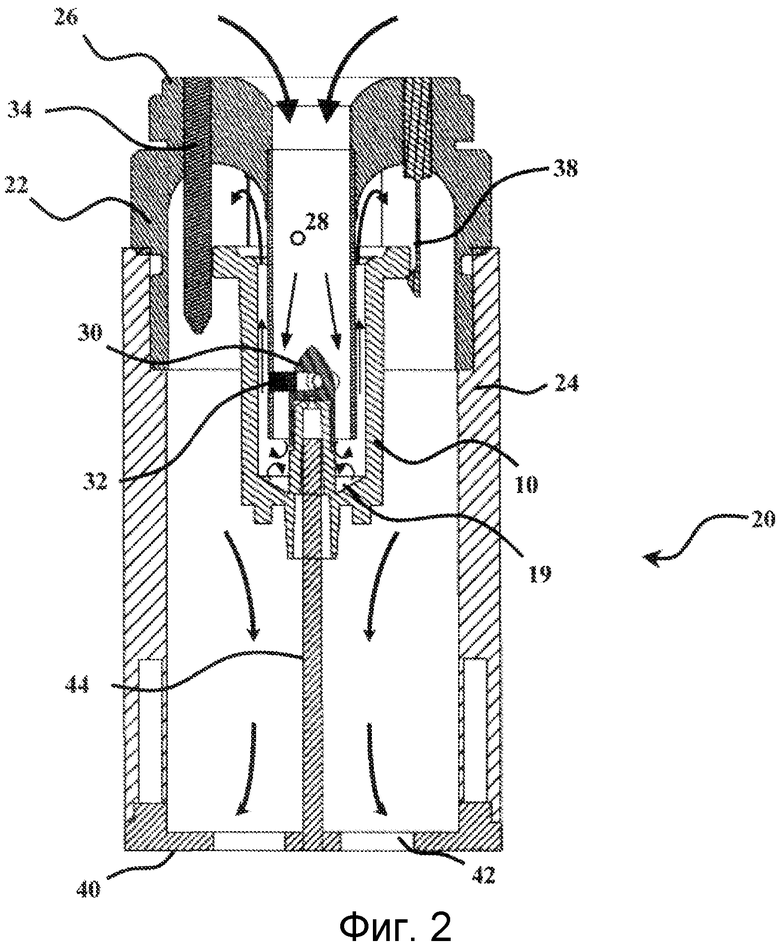
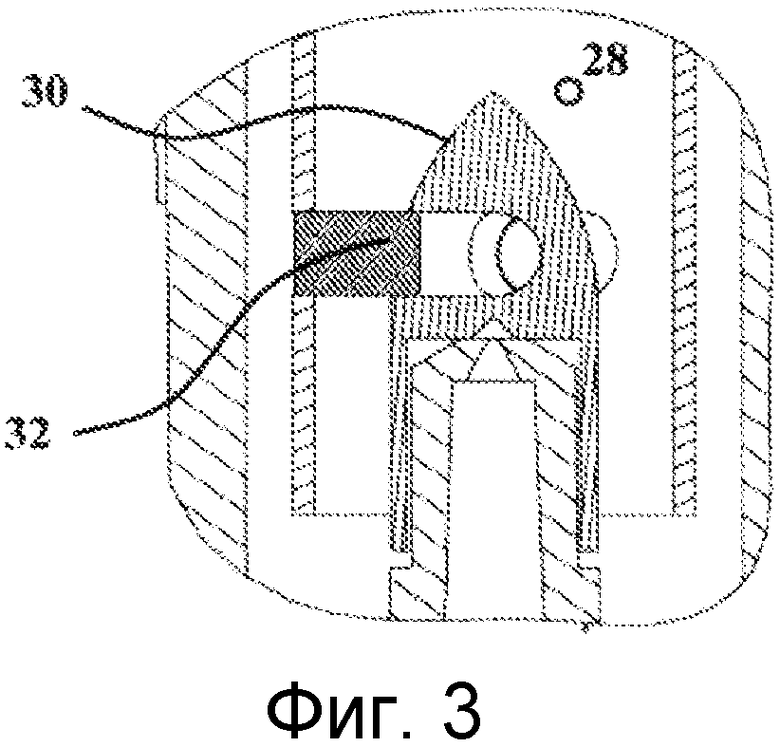
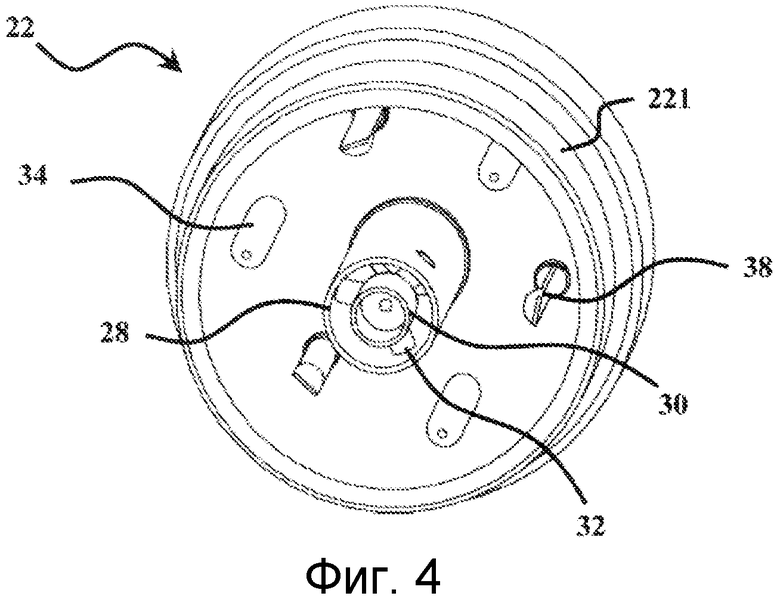
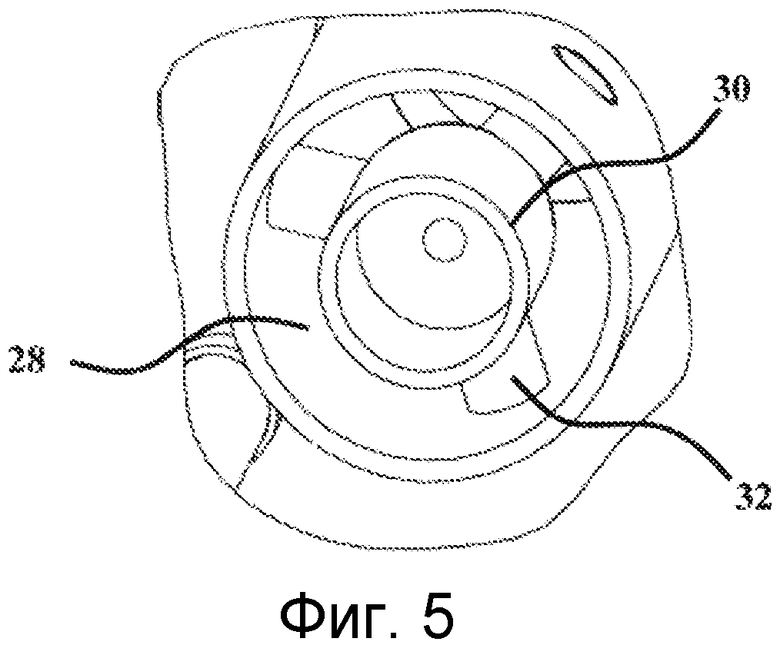
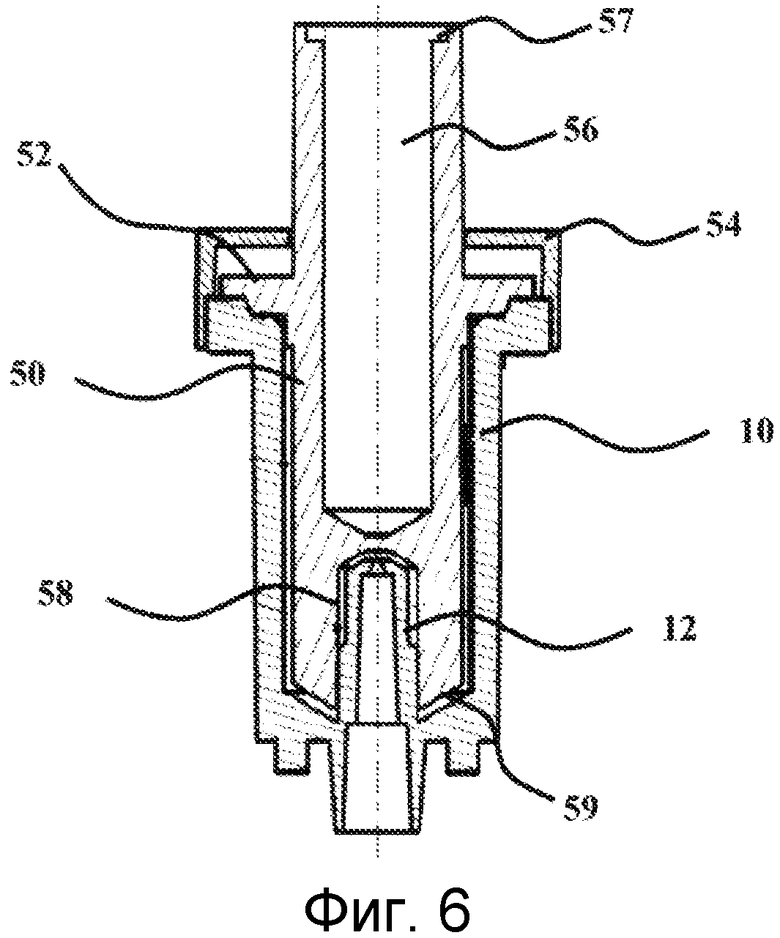
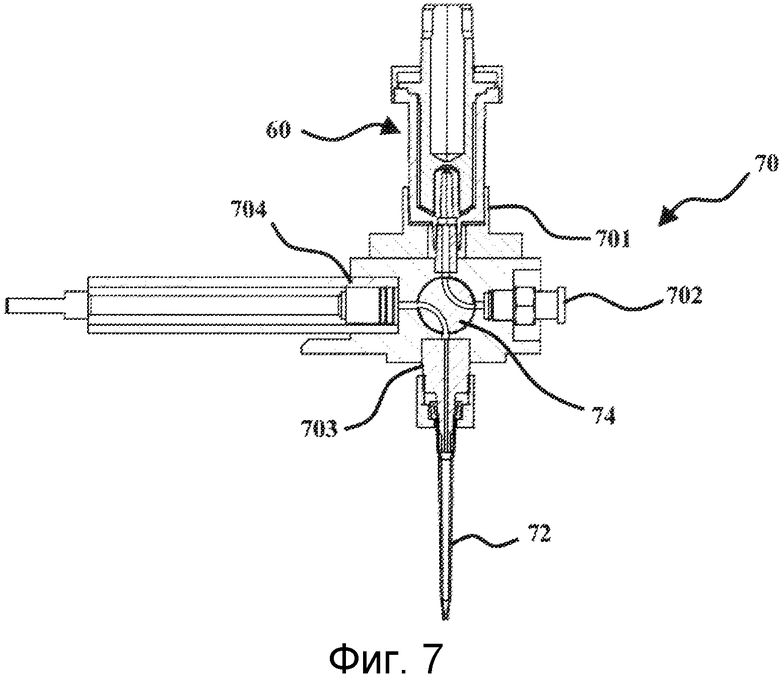
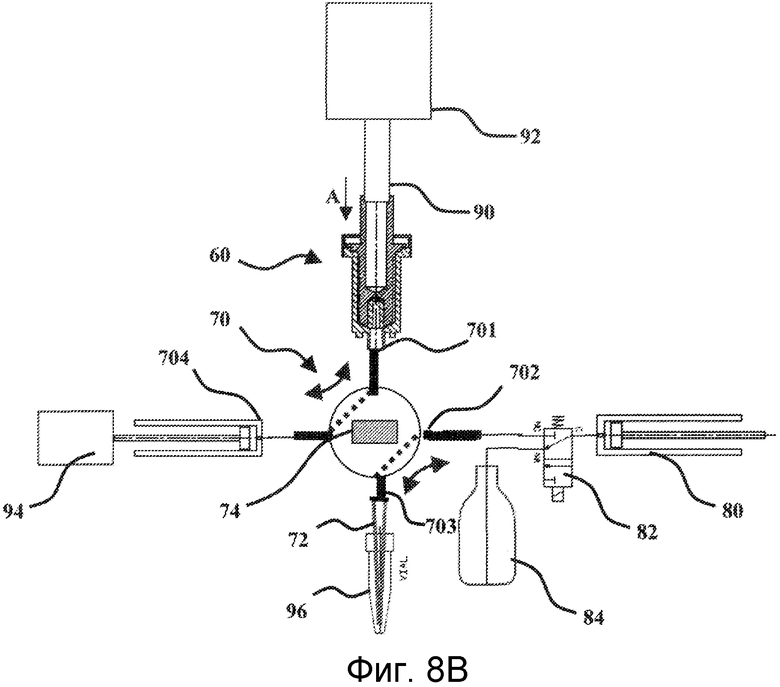
Способы лизиса микроорганизмов и выделения из них нуклеиновых кислот предусматривают использование системы для лизиса микроорганизмов и очистки нуклеиновых кислот указанных микроорганизмов. Указанная система включает установленное на средстве позиционирования устройство для лизиса микроорганизмов, содержащее картридж, имеющий зону задерживания микроорганизмов со средством для их лизиса, установленный в картридже ротор со средством его вращения, крышку, контейнер для приема нуклеиновых кислот и средство для аспирации/выпускания жидкости. Каждый из способов предусматривает механический лизис микроорганизмов посредством вращения ротора, который вызывает вращение лизирующего средства, содержащегося в картридже. Изобретение обеспечивает эффективный отбор бактерий, содержащихся в пробе воздуха, пробе жидкости и пробе клеточной ткани, лизирование их и выделение нуклеиновых кислот из указанных бактерий с целью анализа. 9 н. и 6 з.п. ф-лы, 9 ил., 1 табл., 2 пр.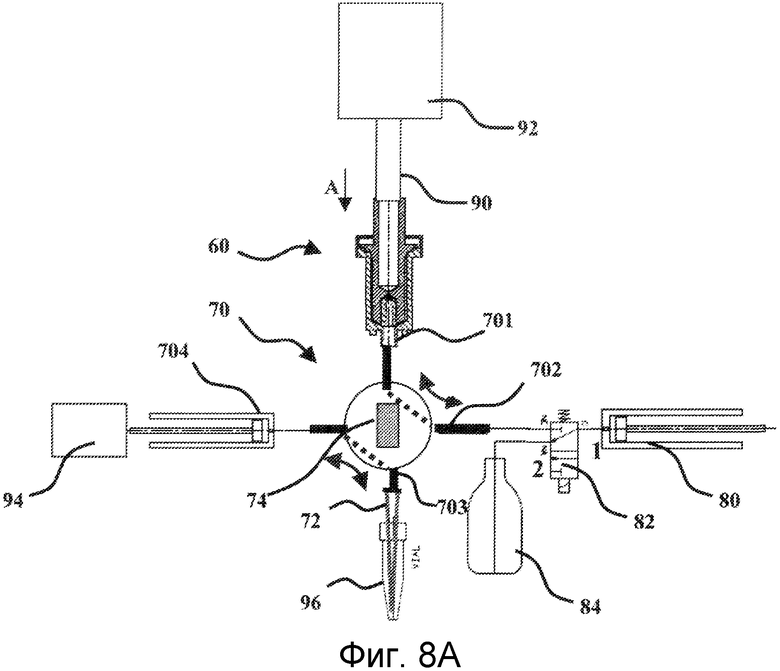
1. Устройство для лизиса микроорганизмов, где указанное устройство имеет:
- картридж ориентировочно цилиндрической формы, имеющий зону задерживания микроорганизмов, причем указанная зона задерживания имеет средство для лизиса указанных микроорганизмов и материал, который способен задерживать указанные микроорганизмы, удерживать на месте средство для лизиса и растворяться в присутствии жидкости, причем указанный картридж выполняет роль статора;
- ротор, установленный в картридже, причем указанный ротор имеет средство вращения; и
- крышку, предназначенную для удерживания ротора в виде единого целого с картриджем;
в котором внутренний диаметр картриджа больше, чем наружный диаметр ротора, так что, когда ротор вставляют в картридж, расстояние от внутренней стенки картриджа до наружной стенки ротора является достаточно большим, чтобы предоставить возможность расположения лизирующего средства в данном промежуточном пространстве, и достаточно маленьким для того, чтобы лизирующее средство находилось в контакте с одной или другой из указанных стенок.
2. Устройство по п.1, в котором средство вращения состоит из диаметрально противоположных желобков, сделанных в стенке глухого прохода, образованного в роторе, причем указанные желобки предназначены для приема конца трансмиссионного вала средства вращения указанного ротора.
3. Система для лизиса микроорганизмов и очистки нуклеиновых кислот указанных микроорганизмов, имеющая:
- средство позиционирования устройства для лизиса микроорганизмов по п. 1 или 2;
- средство вращения ротора, когда указанное устройство для лизиса устанавливают на средство позиционирования;
- по меньшей мере один контейнер для приема нуклеиновых кислот;
- по меньшей мере одно средство для аспирации/выпускания жидкости;
- многоходовой клапан, в жидкостном сообщении с устройством для лизиса микроорганизмов, контейнером для приема очищенных нуклеиновых кислот и средством для аспирации/выпускания жидкости.
4. Система для лизиса по п.3, имеющая в дополнение средство намагничивания.
5. Система для лизиса по п.3 или 4, имеющая в дополнение нагревающее средство.
6. Система для лизиса по пп.3 -5, в которой многоходовой клапан включает средство для аспирации/выпускания.
7. Способ лизиса микроорганизмов, где указанный способ имеет стадии, состоящие из:
а) обеспечения картриджа, в котором микроорганизмы сконцентрированы в зоне задерживания указанного картриджа,
b) установки ротора в картридже для того, чтобы получить устройство для лизиса микроорганизмов по п.1 или 2,
с) введения элюирующей жидкости в картридж для суспендирования лизирующего средства, расположенного в зоне задерживания микроорганизмов картриджа, и
d) механического лизиса микроорганизмов посредством вращения ротора внутри картриджа, причем указанный ротор вызывает вращение лизирующего средства микроорганизмов.
8. Способ выделения нуклеиновых кислот из микроорганизмов, где указанный способ имеет стадии, состоящие из:
а) обеспечения картриджа, в котором микроорганизмы сконцентрированы в зоне задерживания указанного картриджа,
b) установки ротора в картридже для того, чтобы получить устройство для лизиса микроорганизмов по п.1 или 2,
с) введения элюирующей жидкости в картридж для суспендирования лизирующего средства, расположенного в зоне задерживания микроорганизмов картриджа, и
d) механического лизиса микроорганизмов посредством вращения ротора внутри картриджа, причем указанный ротор вызывает вращение лизирующего микроорганизмы средства, и
е) аспирации элюирующей жидкости, содержащей нуклеиновые кислоты указанных микроорганизмов, высвобожденные в процессе лизиса, и
f) переноса элюирующей жидкости в контейнер для приема и очистки нуклеиновых кислот.
9. Способ по п.8, включающий дополнительную стадию для отмывания и очистки нуклеиновых кислот.
10. Способ лизиса микроорганизмов, содержащихся в пробе жидкости, где указанный способ имеет стадии, состоящие из:
а) введения пробы жидкости, содержащей указанные микроорганизмы, в картридж, поблизости от зоны задерживания, таким образом, чтобы указанная проба жидкости приводила к суспендированию лизирующего средства, расположенного в указанной зоне задерживания микроорганизмов картриджа,
b) установки ротора в картридже для того, чтобы получить устройство для лизиса микроорганизмов по п.1 или 2,
с) механического лизиса микроорганизмов посредством вращения ротора внутри картриджа, причем указанный ротор вызывает вращение лизирующего средства, на котором задерживаются микроорганизмы.
11. Способ выделения нуклеиновых кислот из микроорганизмов, содержащихся в пробе жидкости, где указанный способ имеет стадии, состоящие из:
а) введения пробы жидкости, содержащей указанные микроорганизмы, в картридж, поблизости от зоны задерживания, таким образом, чтобы указанная проба жидкости приводила к суспендированию лизирующего средства, расположенного в указанной зоне задерживания микроорганизмов картриджа,
b) установки ротора в картридже для того, чтобы получить устройство для лизиса микроорганизмов по п.1 или 2,
с) механического лизиса микроорганизмов посредством вращения ротора внутри картриджа, причем указанный ротор вызывает вращение лизирующего средства,
d) аспирации пробы жидкости, содержащей нуклеиновые кислоты указанных микроорганизмов, высвобожденные в процессе лизиса, и
е) переноса пробы жидкости в контейнер для приема и очистки нуклеиновых кислот.
12. Способ выделения нуклеиновых кислот из пробы клеточной ткани, где указанный способ имеет стадии, состоящие из:
а) введения пробы клеточной ткани в картридж в присутствии элюирующей жидкости,
b) установки ротора в картридже для того, чтобы получить устройство для лизиса микроорганизмов по п.1 или 2,
с) механического лизиса клеток клеточной ткани посредством вращения ротора внутри картриджа, причем указанный ротор вызывает вращение лизирующего средства, содержащегося в картридже,
d) аспирации элюирующей жидкости, содержащей нуклеиновые кислоты, из указанных клеток, высвобожденные в процессе лизиса, и
е) переноса элюирующей жидкости в контейнер для приема и очистки нуклеиновых кислот.
13. Способ по п.11 или 12, включающий дополнительную стадию отмывания и очистки нуклеиновых кислот.
14. Применение устройства для лизиса микроорганизмов по п.1 или 2 для лизиса клеток пробы клеточной ткани.
15. Применение системы для лизиса микроорганизмов и очистки нуклеиновых кислот из указанных микроорганизмов по одному из пп.3-6 для лизиса клеток из пробы клеточной ткани.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| УСТРОЙСТВО ДЛЯ нА.^\отки нити | 0 |
|
SU303791A1 |
| Устройство для улавливания микроорганизмов из воздуха | 1983 |
|
SU1217876A1 |
| Установка для дезинтеграции клеток микроорганизмов | 1981 |
|
SU1116054A1 |
Авторы
Даты
2015-07-20—Публикация
2009-12-09—Подача